1.本发明属于生物技术领域,具体涉及一种基于对蛋白酶切的肽谱识别特征指纹的抗体配对筛选方法。
背景技术:
2.配对抗体是指能同时结合在一个抗原分子上的两个抗体。通常情况下,一个抗原分子拥有多个抗原决定簇,将抗原注射入动物体内进行免疫,针对不同的抗原决定簇会产生不同的抗体。产生的抗体具有特异性与专一性,即一个抗体分子只会特异性地结合一个抗原决定簇。两个针对不同抗原决定簇的抗体,有可能同时结合到抗原分子上。如果两个抗体同时结合到同一个抗原分子上,那么这两个抗体就是配对抗体。
3.配对抗体目前主要运用于elisa试剂盒的制作,配对抗体筛选的方法有双抗体夹心elisa法、双抗体夹心胶体金免疫层析法等等。目前,最常用的配对抗体筛选的方法为双抗夹心elisa法,其具体操作步骤是将两种可能配对的抗体,一种作为捕获抗体,另一种作为检测抗体;首先将捕获抗体包被在酶标板上,后加入抗原,再加入检测抗体,若能得到阳性信号并且与抗原含量正相关,说明捕获抗体和检测抗体能同时与抗原特异性结合,该捕获抗体与检测抗体为一对配对抗体。该方法能准确筛选用于双抗体夹心elisa法的配对抗体,但其具有复杂的酶标、包被和加样过程,操作步骤繁琐,反应时间长,通常只能用穷举法测试任意两个候选抗体的组合,当候选抗体数量较多时工作量极大。
4.有鉴于此,有必要开发一种基于对蛋白酶切的肽谱识别特征指纹的抗体配对筛选方法,减少工作量,节省成本。
技术实现要素:
5.本发明的目的在于克服现有技术的不足,提供一种基于对蛋白酶切的肽谱识别特征指纹的抗体配对筛选方法。解决现有的基于elisa法进行配对抗体筛选时,具有复杂的酶标、包被和加样过程,操作步骤繁琐,反应时间长,通常只能用穷举法测试任意两个候选抗体的组合,当候选抗体数量较多时工作量极大等问题。
6.为解决现有技术中的上述问题,本发明是通过如下技术方案来实现的:一种基于对蛋白酶切的肽谱识别特征指纹的抗体配对筛选方法,包括如下步骤:s1、使用消化酶对目标蛋白进行酶切反应,得到蛋白的酶切片段;s2、以步骤s1中得到的蛋白的酶切片段作为检测样本,候选抗体作为一抗,进行western blot检测,获得蛋白酶切片段的肽谱识别特征指纹;s3、找出步骤s2中得到的蛋白酶切片段的肽谱识别特征指纹图谱中具有差异的泳道,所述泳道对应的候选抗体即为可能存在两两配对的配对抗体。
7.进一步地,所述基于对蛋白酶切的肽谱识别特征指纹的抗体配对筛选方法还包括采用双抗体夹心elisa法对步骤s3中得到的可能存在两两配对的配对抗体进行确认复核的步骤。
8.进一步地,步骤s1中,所述消化酶选自胰蛋白酶、胰凝乳蛋白酶或胃蛋白酶中的一种。
9.进一步地,步骤s1中,所述消化酶的浓度为0.2~0.5%,所述酶切反应的温度为25~40℃,酶切反应的时间为0.5~8h。
10.进一步地,步骤s1中,所述酶切反应体系中的缓冲液为tris-hcl缓冲液,ph为8.0。
11.进一步地,步骤s2中,所述western blot检测的具体方法为:将所述蛋白酶切片段和蛋白上样缓冲液混匀后,煮沸5~10min,经sds-page分离;之后置于转移槽中进行转膜,将蛋白酶切片段转移至pvdf膜上;室温5%脱脂奶粉封闭2~4h,用封闭液稀释一抗,在温度为4℃的条件下,一抗封闭过夜;用tbst溶液洗涤3次,每次8mim,室温孵育二抗2h;用tbst溶液洗涤3次,每次9min,ecl试剂显影,获得蛋白酶切片段的肽谱识别特征指纹。
12.本发明还提供了上述任一项所述的基于对蛋白酶切的肽谱识别特征指纹的抗体配对筛选方法在大样本配对抗体筛选领域中的应用。
13.本发明的技术原理如下:若两个抗体所对应的蛋白酶切片段的肽谱识别特征指纹图谱存在差异,即代表这两个抗体识别不同的表位,故可通过特征指纹的差异度对配对抗体进行初步筛选。
14.与现有技术相比,本发明具有如下优点:本发明所述的基于对蛋白酶切的肽谱识别特征指纹的抗体配对筛选方法能快速进行初步筛选出识别不同表位的抗体,尤其是候选抗体数量较多时,可有效缩小候选抗体数量,进而减少elisa配对工作量,具有操作简单、成本低廉等优点,因此,在配对抗体筛选领域具有良好的应用情景。
附图说明
15.为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单的介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
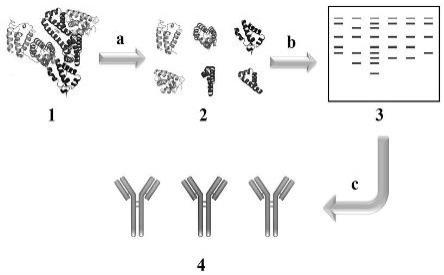
16.图1为本发明基于对蛋白酶切的肽谱识别特征指纹的抗体配对筛选方法流程图,其中附图标记为:1:抗原;2:酶切后的抗原片段;3:western blot;4:已筛选的配对抗体;a:胰蛋白酶酶解;b:待筛选的目标抗体;c:根据特征指纹的差异度进行抗体配对筛选;图2为蛋白酶切的人血清白蛋白肽谱被待筛选抗体识别的特征指纹结果,其中附图标记为:1:t5d2 (0.1 μg/ml);2:t4h9 (0.1 μg/ml);3:t5e6(0.002 μg/ml);4:t4a1 (0.002 μg/ml);5:t4a6 (0.01 μg/ml);6:t2c9(0.1 μg/ml);图3为蛋白酶切的白介素-6肽谱被待筛选抗体识别的特征指纹结果,其中左图为曝光30秒的图片,右边为曝光10秒的图片;附图标记为:1:k1e9b8b4;2:k4g3e6e2;3:k6e3e2g10;4:k6d1e5c12;5:k6c4b7g8;6:k6c12c4a2;7:k6b1a5g6;8:k5g2a6a5;9:k4d8e7g3;10:k4d12g2a6;11:k4c7g2a2;12:k3e12e5e7;13:k3b4a1e9;14:k2g11c7b2;15:k2f12e7a5;16:k2b9b12c9;17:k1a5g5c5;18:k1a4e9a1,其浓度均为0.1 μg/ml;图4为蛋白酶切的flt3 ligand蛋白肽谱被待筛选抗体识别的特征指纹结果,其中左图为曝光0.5秒的图片,右边为曝光0.1秒的图片;附图标记为:1:v4e5a6e1;2:
v4e10e9a8;3:v4d3a5h5;4:v4c7c6b1;5:v4c4g8e7;6:v3e1a3e2;7:v3c9c7h8;8:v3c3g4c3;9:v3a7c7d7;10:v3a5a8a1;11:v2e12e6g1;12:v2d9e1a8;13:v2d4d1g3;14:v2c5c4h2;15:v2b10g5c6;16:v1g12c4g11;17:v1d8e8d11;18:v1c1h5e3,其浓度均为0.1 μg/ml。
具体实施方式
17.下面将结合本发明实施例中的附图对本发明实施例中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例,基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
18.本发明实施例中使用的人血清白蛋白(alb,albumin)、白介素-6(il-6,interleukin 6)、flt3 ligand三种蛋白及对应的候选抗体都由武汉三鹰生物技术有限公司自主生产得到。
19.本发明实施例中使用的二抗为hrp标记山羊抗小鼠igg(h l),购自美国jackson immunoresearch 公司。
20.本发明所使用的其他常规试剂和设备,如无特殊说明,均可市售获得。
21.本发明的技术原理如下:若两个抗体所对应的蛋白酶切片段的肽谱识别特征指纹图谱存在差异,即代表这两个抗体识别不同的表位,故可通过特征指纹的差异度对配对抗体进行初步筛选,具体快速筛选方法见图1。
22.实施例1 人血清白蛋白配对抗体的筛选对株号为t5d2、t4h9、t5e6、t4a1、t4a6和t2c9的6株抗人alb鼠单克隆抗体进行抗体配对的筛选,具体方法如下:首先使用480 μl 浓度为0.25%的胰蛋白酶对800 μg alb进行酶切,所述酶切反应的温度为30℃,酶切反应的时间为6h;所述酶切反应体系中的缓冲液为tris-hcl缓冲液,ph为8.0;然后将所述蛋白酶切片段和蛋白上样缓冲液混匀后,煮沸5~10min,经sds-page分离;之后置于转移槽中进行转膜,将蛋白酶切片段转移至pvdf膜上;室温5%脱脂奶粉封闭2~4h,用封闭液稀释一抗(6株不同的抗alb抗体),在温度为4℃的条件下,一抗封闭过夜;用tbst溶液洗涤3次,每次8mim,室温孵育二抗(hrp标记山羊抗小鼠igg(h l))2h;用tbst溶液洗涤3次,每次9min,ecl试剂显影,获得蛋白酶切片段的肽谱识别特征指纹;找出上述蛋白酶切片段的肽谱识别特征指纹图谱中具有差异的泳道,所述泳道对应的候选抗体即为可能存在两两配对的配对抗体;最后采用双抗体夹心elisa法对上述得到的可能存在两两配对的配对抗体进行确认复核。
23.western blot检测结果如图2所示,由结果图可知,泳道1、2、3、5所对应的特征指纹是一致的,即所对应抗体识别的抗原决定簇是一样的或空间位置非常接近,所以上述泳道对应的抗体无法配对;泳道4和6所对应的特征指纹也是一致的,但和泳道1、2、3、5存在显著性差异。因此,只有泳道4、6和1、2、3、5之间具有配对的可能性,即配对由原来的(6
×
5)/2=15种组合缩小到2
×
4=8 种组合,分别为t4a1配t5d2、t4h9、t5e6或t4a6,和t2c9配t5d2、t4h9、t5e6或t4a6。
24.进一步地,本实施例对t5d2、t4h9、t5e6、t4a1、t4a6和t2c9的6株抗alb抗体进行hrp标记,采取两两配对,进行双抗体夹心elisa验证,结果如表1-3所示。
25.表1.1 配对抗体的elisa验证-:elisa结果阴性; :elisa结果阳性由表1.1的结果可知,仅有t5e6和t4a1两株抗体互相配对,并在wb筛选到可能存在配对的8对配对抗体中,即本发明提供的方法可以在elisa配对工作中显著缩小候选抗体的数量,并能准确得到有效的配对抗体,适用于样本量较大的抗体配对工作。
26.表1.2 配对抗体的elisa原始测试数据
由表1.2的结果可知,除t5e6和t4a1外,t4h9与t5e6或t5d2也有一定的配对反应,但显色结果并不随稀释倍数而显著性降低,故又对t4h9和t5e6或t5d2进行结合验证,且结果(具体见表1.3)显示抗体t4h9能直接和t5e6或t5d2进行结合,故t4h9与t5e6或t5d2的配对阳性结果是由t4h9能和t5e6或t5d2直接结合造成的假阳性,而该假阳性可以通过本发明的抗体配对筛选方法结果进行排除。即本发明除了能有效缩小候选抗体数量,减少elisa配对工作量外,还在一定程度上可以排除由抗体之间的直接结合作用照成的配对假阳性。
27.表1.3 抗体t4h9和t5e6或t5d2之间的直接结合验证
实施例2 人白介素-6配对抗体的筛选对株号为k1e9b8b4、k4g3e6e2、k6e3e2g10、k6d1e5c12、k6c4b7g8、k6c12c4a2、k6b1a5g6、k5g2a6a5、k4d8e7g3、k4d12g2a6、k4c7g2a2、k3e12e5e7、k3b4a1e9、k2g11c7b2、k2f12e7a5、k2b9b12c9、k1a5g5c5、k1a4e9a1的18株抗人白介素6(il-6)鼠单克隆抗体进行抗体配对的筛选,具体方法如下:首先使用6 μl 浓度为0.25%的胰蛋白酶对10 μg il-6进行酶切,所述酶切反应的温度为35℃,酶切反应的时间为0.5h;所述酶切反应体系中的缓冲液为tris-hcl缓冲液,ph为8.0;然后将所述蛋白酶切片段和蛋白上样缓冲液混匀后,煮沸5~10min,经sds-page分离;之后置于转移槽中进行转膜,将蛋白酶切片段转移至pvdf膜上;室温5%脱脂奶粉封闭2~4h,用封闭液稀释一抗(18株不同的抗il-6抗体),在温度为4℃的条件下,一抗封闭过夜;用tbst溶液洗涤3次,每次8mim,室温孵育二抗(hrp标记山羊抗小鼠igg(h l))2h;用tbst溶液洗涤3次,每次9min,ecl试剂显影,获得蛋白酶切片段的肽谱识别特征指纹;找出上述蛋白酶切片段的肽谱识别特征指纹图谱中具有差异的泳道,所述泳道对应的候选抗体即为可能存在两两配对的配对抗体;最后采用双抗体夹心elisa法对上述得到的可能存在两两配对的配对抗体进行确认复核。
28.western blot的结果如图3所示,由结果可知,泳道15所对应的特征指纹和其它泳道均不同,泳道8所对应的特征指纹和其它多数泳道均不同,推测15号抗体可能与其它17株抗体配对,8号抗体可能与其它多数抗体配对,即(18
×
17)/2 =153种组合缩小到2
×
17=34种组合。
29.进一步地,本实施例对k2f12e7a5和k5g2a6a5两株抗il-6抗体进行hrp标记,并和其它抗体配对,进行双抗体夹心elisa验证,结果如表2.1-2.3。
30.表2.1 配对抗体的elisa验证-:elisa结果阴性; :elisa结果阳性; /:未检测由表2.1-2.3的结果可知,15号抗体k2f12e7a5和其它17株抗体均能配对,8号抗体k5g2a6a5除抗体k6e3e2g10(3号)、抗体k6b1a5g6(7号)、k2g11c7b2(13号)和k2b9b12c9(14号)外,可与其它13株抗体进行配对,即本发明提供的方法可以在elisa配对工作中显著缩小候选抗体的数量,并能准确得到有效的配对抗体,适用于样本量较大的抗体配对工作。
31.表2.2 和k2f12e7a5抗体配对的elisa原始数据
表2.3 和k5g2a6a5抗体配对的elisa原始数据
实施例3 人flt3 ligand蛋白配对抗体的筛选对株号为v4e5a6e1、v4e10e9a8、v4d3a5h5、v4c7c6b1、v4c4g8e7、v3e1a3e2、v3c9c7h8、v3c3g4c3、v3a7c7d7、v3a5a8a1、v2e12e6g1、v2d9e1a8、v2d4d1g3、v2c5c4h2、v2b10g5c6、v1g12c4g11、v1d8e8d11、v1c1h5e3的18株抗人flt3 ligand鼠单克隆抗体进行抗体配对的筛选,具体方法如下:首先使用6 μl 浓度为0.25%的胰蛋白酶对10 μg flt3 ligand蛋白进行酶切,所述酶切反应的温度为30℃,酶切反应的时间为8h;所述酶切反应体系中的缓冲液为tris-hcl缓冲液,ph为8.0;然后将所述蛋白酶切片段和蛋白上样缓冲液混匀后,煮沸5~10min,经sds-page分离;之后置于转移槽中进行转膜,将蛋白酶切片段转移至pvdf膜上;室温5%脱脂奶粉封
闭2~4h,用封闭液稀释一抗(18株不同的抗flt3 ligand抗体),在温度为4℃的条件下,一抗封闭过夜;用tbst溶液洗涤3次,每次8mim,室温孵育二抗(hrp标记山羊抗小鼠igg(h l))2h;用tbst溶液洗涤3次,每次9min,ecl试剂显影,获得蛋白酶切片段的肽谱识别特征指纹;找出上述蛋白酶切片段的肽谱识别特征指纹图谱中具有差异的泳道,所述泳道对应的候选抗体即为可能存在两两配对的配对抗体;最后采用双抗体夹心elisa法对上述得到的可能存在两两配对的配对抗体进行确认复核。
32.western blot的结果如图4所示,由结果可知,泳道7和13所对应的特征指纹是一致的,与其它泳道均不同,推测7和13号抗体可能与其它16株抗体配对,另外有10株抗体没有显示条带,表明这些抗体可能只能识别完整全长或只能识别特定构象的形式,这里可能存在它们都识别同一表位或者识别不同表位的情况。若都识别同一表位,组合情况由(18
×
17)/2=153种缩小到2
×
16 10
×
6=92种;若识别的表位均不一样,组合缩小到2
×
16 10
×
6 (10
×
9)/2=137种。本实验中选取western blot结果有信号来探讨可能的配对情况,即2
×
16=32种组合。
33.本实施例对v3c9c7h8和v2d4d1g3两株抗flt3 ligand抗体进行hrp标记,并和其它抗体配对,进行双抗体夹心elisa验证,结果如表3.1-3.3所示。
34.表3.1 配对抗体的elisa验证-:elisa结果阴性; :elisa结果阳性; /:未检测由3.1-3.3的结果可知,7号抗体v3c9c7h8和13号抗体v2d4d1g3都能和抗体v3e1a3e2(6号)、v3a5a8a1(10号)、v2e12e6g1(11号)进行配对,即本发明提供的方法可以在elisa配对工作中显著缩小候选抗体的数量,并能准确得到有效的配对抗体,适用于样本量较大的抗体配对工作。
35.表3.2 和v3c9c7h8抗体配对的elisa原始数据
表3.3 和v2d4d1g3抗体配对的elisa原始数据
综上所述,实施例1中对6株抗人alb鼠单克隆抗体进行抗体配对的筛选,经肽谱识别分析后,配对由原来的15种组合缩小到8种组合,最后经wb验证后,成功找到1对配对抗体;实施例2中对18株抗人白介素6(il-6)鼠单克隆抗体进行抗体配对的筛选,经肽谱识别分析后,配对由原来的153种组合缩小到34种组合,最后经wb验证后,34种组合中只有4种不能进行配对,结果发现,本发明的筛选方法能显著缩小候选抗体的数量组合,并能准确得到有效的配对抗体;实施例3中对18株抗人flt3 ligand鼠单克隆抗体进行抗体配对的筛选,经肽谱识别分析后,其中有10株抗体没有显示条带,表明这些抗体可能只能识别完整全长或只能识别特定构象的形式,若都识别同一表位,配对由原来的153种组合缩小到92种组合,若识别的表位均不一样,配对由原来的153种组合缩小到137种组合,以有信号的32种组合,经wb验证后,筛选出6种配对抗体结果发现,本发明的筛选方法能显著缩小候选抗体的数量组合,并能准确得到有效的配对抗体。
36.本发明中,实施例1有6株候选抗体,实施例2有18种候选抗体,实施例3有18种候选抗体,实施例1~3中均能筛选到存在配对的抗体,尤其是对于大样本配对抗体的筛选,本发明的方法能进行快速筛选,显著缩小候选抗体的数量,虽然,实施例3中有部分抗体可能只
能识别完整全长或只能识别特定构象的形式,但由结果可以看出,采用本发明的筛选方法,依然能找到配对抗体,结果表明,本发明的配对抗体筛选方法适用于大样本配对抗体的筛选,显著缩小候选抗体的数量,并能准确得到有效的配对抗体,因此,在大样本配对抗体的快速筛选领域有良好的应用前景。
37.以上实施例,仅为本发明的具体实施方式,用以说明本发明的技术方案,而非对其限制,本发明的保护范围并不局限于此,尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,其依然可以对前述实施例所记载的技术方案进行修改或可轻易想到变化,或者对其中部分技术特征进行等同替换;而这些修改、变化或者替换,并不使相应技术方案的本质脱离本发明实施例技术方案的精神和范围,都应涵盖在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。