1.本发明涉及增殖性肝类器官、代谢活化肝类器官和它们的使用。2.本技术基于2019年12月16日在日本提出申请的日本特愿2019-226717号而要求优先权,并将其内容援引于本说明书中。
背景技术:
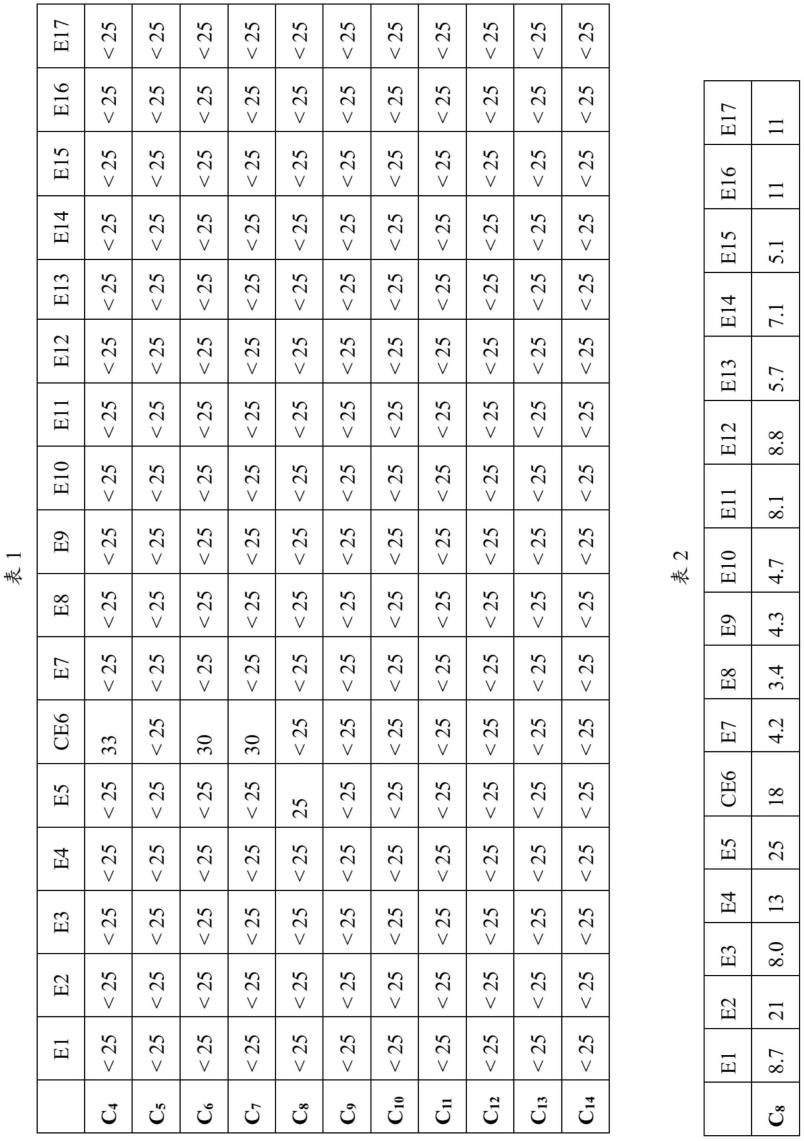
::3.在医药品开发的药代动力学试验中,进行了使用啮齿动物的体内试验、使用来自啮齿动物的原代(冷冻)肝细胞(肝实质细胞)的体外试验。然而,由于存在种差,因此,难以预测人特异性产生的毒性。另一方面,对于人原代(冷冻)肝细胞,由于数量有限,因此,难以稳定地获得优质的肝细胞。4.在药代动力学试验中,特别着眼于肝细胞中大量存在的细胞色素p450(cyp),推进了药物的研究开发。cyp是代谢人体中存在的异型生物质的主要的酶之一。在对基于cyp的药物的代谢进行解析时,可以使用heparg(注册商标,以下,省略“注册商标”的记载)这样的法国国立卫生医学研究所(inserm)开发的来自人肝肿瘤的细胞株。heparg细胞被认为对cyp具有人肝细胞的平均活性。然而,对于heparg细胞,为了恢复cyp的活性,需要培养时间,进而,由于购入而耗费成本。另外,hepg2细胞等来自人的肝癌细胞株的cyp的活性低,无法评价与基于cyp的代谢相关的毒性。另外,从确保稳定的细胞数的观点出发,也研究了使用人ips细胞(inducedpluripotentstemcell)等来自多能干细胞的肝细胞。然而,来自人ips细胞的肝细胞与来自人的肝癌细胞株同样,cyp的活性低,进而,细胞的成熟度也比原代(冷冻)肝细胞差。由此,需要能够更稳定地使用的通过体外制造的来自人的肝细胞(肝类器官)。5.在2013年,由hansclevers等人建立了由来自小鼠的肝细胞培养肝类器官的方法,其后,在2015年,由同一团体建立了由来自人的肝干细胞得到肝类器官。进而,在2018年,由同一团体建立了由与前面出现的肝类器官不同的细胞起源的肝干细胞得到肝类器官,作为肝细胞的新的供给源而受到期待(参照专利文献1和非专利文献1~非专利文献2)。6.现有技术文献7.专利文献8.专利文献1:日本特表2013-535201号公报9.非专利文献10.非专利文献1:huchmetal.,“long-termcultureofgenome-stablebipotentstemcellsfromadulthumanliver.”,cell,vol.160,issue1,p299-312,2015.11.非专利文献2:huhetal,“long-termexpansionoffunctionalmouseandhumanhepatocytesas3dorganoids.”,cell,vol.175,issue6,p1591-1606,2018.技术实现要素:12.本发明是鉴于上述情况而完成的,提供增殖性优异的增殖性肝类器官和其制造方法、以及从上述增殖性肝类器官分化的代谢活性优异的代谢活化肝类器官和其制造方法。13.即,本发明包含以下的实施方式。14.(1)一种制造方法,是增殖性肝类器官的制造方法,包括:15.在增殖用培养基中培养肝干细胞或包含肝干细胞的组织片,得到增殖性肝类器官;16.上述增殖用培养基包含白细胞介素-6家族细胞因子。17.(2)根据上述(1)所述的制造方法,其中,上述白细胞介素-6家族细胞因子为选自白细胞介素-6、白细胞介素-11、制瘤素m、白血病抑制因子、心肌营养素心肌营养素-1和睫状神经营养因子中的至少1种。18.(3)根据上述(1)或(2)所述的制造方法,其中,上述增殖用培养基实质上不含烟酰胺。19.(4)根据上述(1)~(3)中任一项所述的制造方法,其中,上述增殖用培养基进一步包含生长因子。20.(5)根据上述(4)所述的制造方法,其中,上述生长因子为选自上皮生长因子、成纤维细胞增殖因子、肝细胞增殖因子、双调蛋白和肝素结合egf样生长因子中的至少1种。21.(6)根据上述(1)~(5)中任一项所述的制造方法,其中,上述增殖用培养基进一步包含wnt激动剂。22.(7)根据上述(6)所述的制造方法,其中,上述wnt激动剂为选自wnt家族成员、r-脊椎蛋白(spondin)1、r-脊椎蛋白2、r-脊椎蛋白3、r-脊椎蛋白4、norrin和糖原合成酶抑制剂中的至少1种。23.(8)根据上述(1)~(7)中任一项所述的制造方法,其中,上述增殖用培养基进一步包含rho激酶抑制剂。24.(9)根据上述(8)所述的制造方法,其中,上述rho激酶抑制剂为选自y-27632、法舒地尔、y39983、wf-536、slx-2119、氮杂苯并咪唑-氨基呋咱、de-104、h-1152p、rho激酶α抑制剂、xd-4000、hmn-1152、4-(1-氨基烷基)-n-(4-吡啶基)环己烷-甲酰胺、rho他汀、ba-210、ba-207、ki-23095和vas-012中的至少1种。25.(10)根据上述(1)~(9)中任一项所述的制造方法,其中,上述增殖用培养基进一步包含转化生长因子-β抑制剂。26.(11)根据上述(10)所述的制造方法,其中,上述转化生长因子-β抑制剂为选自a83-01、sb-431542、sb-505124、sb-525334、ly364947、sd-208和sjn2511中的至少1种。27.(12)根据上述(1)~(11)中任一项所述的制造方法,其中,上述增殖用培养基进一步包含骨形成蛋白抑制剂。28.(13)根据上述(12)所述的制造方法,其中,上述骨形成蛋白抑制剂为选自noggin、神经母细胞瘤中差异筛选选择的基因异常(differentialscreening-selectedgeneaberrativeinneuroblastoma)、cerberus和gremlin中的至少1种。29.(14)根据上述(1)~(13)中任一项所述的制造方法,其中,上述增殖用培养基进一步包含毛喉素。30.(15)根据上述(1)~(14)中任一项所述的制造方法,其中,上述增殖用培养基进一步包含选自胃泌素、神经系统补充剂和n-乙酰半胱氨酸中的至少1种。31.(16)根据上述(1)~(15)中任一项所述的制造方法,其中,在上述增殖用培养基中的培养中,使上述肝干细胞或包含上述肝干细胞的组织片与细胞外基质接触而进行培养。32.(17)根据上述(16)所述的制造方法,其中,在上述增殖用培养基中的培养中,上述细胞外基质为胶原蛋白和基质胶的混合物。33.(18)根据上述(1)~(17)中任一项所述的制造方法,其中,在上述增殖用培养基中的培养中,至少进行2周培养。34.(19)一种制造方法,是代谢活化肝类器官的制造方法,包括:35.在分化用培养基中培养通过上述(1)~(18)中任一项所述的制造方法而制造的增殖性肝类器官,得到代谢活化肝类器官;36.上述分化用培养基实质上不含白细胞介素-6家族细胞因子。37.(20)根据上述(19)所述的制造方法,其中,上述分化用培养基实质上不含烟酰胺。38.(21)根据上述(19)或(20)所述的制造方法,其中,上述分化用培养基进一步包含生长因子。39.(22)根据上述(21)所述的制造方法,其中,上述生长因子为选自上皮生长因子、成纤维细胞增殖因子和肝细胞增殖因子中的至少1种。40.(23)根据上述(19)~(22)中任一项所述的制造方法,其中,上述分化用培养基进一步包含wnt激动剂。41.(24)根据上述(23)所述的制造方法,其中,上述wnt激动剂为选自wnt家族成员、r-脊椎蛋白1、r-脊椎蛋白2、r-脊椎蛋白3、r-脊椎蛋白4、norrin和糖原合成酶抑制剂中的至少1种。42.(25)根据上述(19)~(24)中任一项所述的制造方法,其中,上述分化用培养基进一步包含rho激酶抑制剂。43.(26)根据上述(25)所述的制造方法,其中,上述rho激酶抑制剂为选自y-27632、法舒地尔、y39983、wf-536、slx-2119、氮杂苯并咪唑-氨基呋咱、de-104、h-1152p、rho激酶α抑制剂、xd-4000、hmn-1152、4-(1-氨基烷基)-n-(4-吡啶基)环己烷-甲酰胺、rho他汀、ba-210、ba-207、ki-23095和vas-012中的至少1种。44.(27)根据上述(19)~(26)中任一项所述的制造方法,其中,上述分化用培养基进一步包含转化生长因子-β抑制剂。45.(28)根据上述(27)所述的制造方法,其中,上述转化生长因子-β抑制剂为选自a83-01、sb-431542、sb-505124、sb-525334、ly364947、sd-208和sjn2511中的至少1种。46.(29)根据上述(19)~(28)中任一项所述的制造方法,其中,上述分化用培养基进一步包含骨形成蛋白抑制剂。47.(30)根据上述(29)所述的制造方法,其中,上述骨形成蛋白抑制剂为选自noggin、神经母细胞瘤中差异筛选选择的基因异常、cerberus和gremlin中的至少1种。48.(31)根据上述(19)~(30)中任一项所述的制造方法,其中,上述分化用培养基进一步包含毛喉素。49.(32)根据上述(19)~(31)中任一项所述的制造方法,其中,上述分化用培养基进一步包含选自胃泌素、神经系统补充剂和n-乙酰半胱氨酸中的至少1种。50.(33)根据上述(19)~(32)中任一项所述的制造方法,其中,上述分化用培养基进一步包含维生素d。51.(34)根据上述(19)~(33)中任一项所述的制造方法,其中,上述分化用培养基进一步包含notch抑制剂。52.(35)一种诱导方法,是将代谢活化肝类器官诱导为增殖性肝类器官的方法,包括:53.在诱导用培养基中培养通过上述(19)~(34)中任一项所述的制造方法而制造的代谢活化肝类器官,将上述代谢活化肝类器官诱导为增殖性肝类器官;54.上述诱导用培养基包含白细胞介素-6家族细胞因子。55.(36)一种增殖性肝类器官,是通过上述(1)~(18)中任一项所述的制造方法而制造的。56.(37)一种代谢活化肝类器官,是通过上述(19)~(34)中任一项所述的制造方法而制造的。57.(38)一种用于培养增殖性肝类器官的增殖用培养基,包含白细胞介素-6家族细胞因子。58.(39)一种受试物质的评价方法,包括:使上述(37)所述的代谢活化肝类器官与受试物质接触,以及59.对上述代谢活化肝类器官的反应进行评价。60.根据上述方式的增殖性肝类器官的制造方法,能够提供增殖性优异的增殖性肝类器官。根据上述方式的代谢活化肝类器官的制造方法,能够提供从上述增殖性肝类器官分化的代谢活性优异的代谢活化肝类器官。附图说明61.图1为实验例1中的增殖性肝类器官的显微镜图像。比例尺为100μm。62.图2为实验例2中的肝类器官的显微镜图像。比例尺为100μm。63.图3为实验例5中的代谢活化肝类器官的显微镜图像。64.图4a为表示使用基质胶、胶原蛋白和基质胶的混合物、以及胶原蛋白作为实验例13中的细胞外基体时的传代次数的比较的图表。图4a中,p表示传代次数。65.图4b为使用胶原蛋白和基质胶的混合物作为实验例13中的细胞外基体时的14次传代后且培养190天后的增殖性肝类器官的显微镜图像。66.图4c为图4b的放大图像。比例尺为100μm。67.图4d为表示使用基质胶、胶原蛋白和基质胶的混合物、以及胶原蛋白作为实验例13中的细胞外基体时的增殖能力的比较的图表。具体实施方式68.以下,示出实施方式对本发明进行进一步的详细说明,但本发明并不受以下的实施方式任何限定。69.本说明书中例示的各成分,例如增殖用培养基中或分化用培养基中的各成分只要没有特别说明,则可以分别单独含有1种,或者组合含有2种以上。70.在本说明书中,表示“a~b”等数值范围的表述与“a以上且b以下”含义相同,该数值范围包含a和b。71.<增殖性肝类器官的制造方法>72.在一个实施方式中,本发明提供一种制造方法,是增殖性肝类器官的制造方法,包括:在增殖用培养基中培养肝干细胞或包含肝干细胞的组织片,得到增殖性肝类器官(以下也称为“工序a”);上述增殖用培养基包含白细胞介素-6(il-6)家族细胞因子。73.根据本实施方式的增殖性肝类器官的制造方法,可得到增殖性优异的增殖性肝类器官。74.对于现有的人原代(冷冻)肝细胞中,由于数量有限,因此,难以稳定地获得优质的肝细胞。75.与此相对,本实施方式的增殖性肝类器官的制造方法能够由人原代(冷冻)肝细胞等肝干细胞或包含肝干细胞的组织片得到具有增殖能力的增殖性肝类器官。因此,能够稳定地供给药代动力学试验所需要的优质的肝细胞。76.另外,通过使利用本实施方式的增殖性肝类器官的制造方法制造的增殖性肝类器官分化,能够得到代谢活性优异的代谢活化肝类器官。77.本说明书中的“代谢活化肝类器官”是指具有与构成活体的肝脏组织的肝细胞相类似的特性的细胞群体。作为代谢活化肝类器官,例如可举出:相对于人原代冷冻悬浮肝细胞中的表达量,白蛋白的表达量为50%以上、cyp2e1的表达量为300%以上、ugt1a1的表达量为300%以上、nrp2的表达量为500%以上的肝类器官。78.另外,本说明书中,“分化”、“分化诱导”是指以至少发生复杂化和异构化中的任一者的方式发挥作用。后述的本实施方式的代谢活化肝类器官的制造方法中,将增殖性肝类器官分化诱导为代谢活化肝类器官。79.应予说明,有时将利用本实施方式的制造方法制造的“增殖性肝类器官”和利用后述的本实施方式的代谢活化肝类器官的制造方法从上述增殖性肝类器官分化而制造的“代谢活化肝类器官”统称为“肝细胞块”。80.[工序a][0081]工序a中,在增殖用培养基中培养肝干细胞或包含肝干细胞的组织片,得到增殖性肝类器官。[0082]肝脏由承担肝功能的本质的肝实质细胞和支持该肝实质细胞的增殖、存活的肝非实质细胞群构成。肝实质细胞也被称为肝细胞。肝非实质细胞群由肝星状细胞、窦状内皮细胞、枯否细胞、胆管上皮细胞等构成。[0083]肝干细胞是保持分化为肝细胞和胆管上皮细胞的两能性的细胞,既存在于肝脏内的肝细胞,也存在于肝非实质细胞,是在组织损伤时承担肝脏再生的干细胞群体。包含肝干细胞的组织片为肝细胞的组织片。[0084]在工序a中,优选使肝干细胞或包含肝干细胞的组织片与细胞外基质(ecm)接触而进行培养。[0085]作为使ecm与肝干细胞或包含肝干细胞的组织片接触而培养的方法,例如,可以将肝干细胞或包含肝干细胞的组织片与细胞外基质前体混合,使细胞外基质前体凝胶化而形成ecm,接下来,将ecm浸渍于增殖用培养基进行培养。[0086]作为工序a中使用的ecm,优选包含至少2种特异性的糖蛋白的ecm。例如,可以为包含2种不同类型的胶原蛋白的ecm,也可以为例如包含胶原蛋白和层粘连蛋白的ecm。ecm可以为合成水凝胶细胞外基质,也可以为天然ecm。作为ecm,优选使用包含层粘连蛋白、巢蛋白和胶原蛋白iv的基质胶(注册商标)(bdbiosciences公司)。另外,可以使用胶原蛋白i和基质胶的混合物,此时,混合比优选以体积比计为1:1。细胞外基质可以为涂布在细胞培养容器上的状态,也可以为溶解状态。[0087]作为工序a中的培养条件,可以为在动物细胞的培养中一般采用的条件。例如,可以在30℃~40℃左右(优选为37℃左右)的温度、5%体积分率(1大气压)左右的co2浓度环境下进行。[0088]培养时间可以根据细胞数、细胞的状态等而适当地调整。从培养开始起1周~2周左右的期间后,能够形成增殖性肝类器官。其中,从增殖性肝类器官的增殖和类器官的形成的观点出发,优选至少进行2周培养。[0089][增殖用培养基][0090]增殖用培养基是用于培养增殖性肝类器官的培养基,包含il-6家族细胞因子。[0091]作为增殖用培养基,优选实质上不含烟酰胺。另外,优选除il-6家族细胞因子之外,还进一步包含生长因子、wnt激动剂和tgf-β抑制剂,更优选进一步包含rock抑制剂、bmp抑制剂和毛喉素。[0092]增殖用培养基通常可以在基本培养基中添加各成分来制备。作为基本培养基,例如可举出:dulbecco改良eagle培养基(dmem)、基础培养基(mem)、knockout-dmem(ko-dmem)、glasgow基本培养基(g-mem)、eagle基础培养基(bme)、dmem/ham’sf12、advanceddmem/ham’sf12(advanceddmem/f12)、iscov改良dulbecco培养基、ham’sf-10、ham’sf-12、199培养基、rpmi1640培养基。[0093]这些之中,优选添加了hepes、谷氨酰胺和青霉素/链霉素的dmem/f12和rpmi1640。另外,优选最适于无血清培养的包含glutamax(gibco公司制、l-丙氨酰-l-谷氨酰胺)代替谷氨酰胺的advanceddmem/f12或advancedrpmi。优选在advanceddmem/f12或advancedrpmi培养基中添加谷氨酰胺和青霉素/链霉素。[0094]发明人等着眼于参与细胞周期的从g0期向g1期转变的细胞因子、生长因子等各种因子中的作为炎症性细胞因子的il-6家族细胞因子,发现通过使用包含il-6家族细胞因子的增殖用培养基,能够得到可以一边维持高增殖能力一边长时间培养的增殖性肝类器官。[0095](1)il-6家族细胞因子[0096]作为il-6家族细胞因子,例如可举出:白细胞介素-6(il-6)、白细胞介素-11(il-11)、制瘤素m(osm)、白血病抑制因子(lif)、心肌营养素-1(ct-1)和睫状神经营养因子(cntf),其中,优选为il-6。[0097]il-6家族细胞因子的来源没有特别限定,可以使用来自各种生物的细胞因子。其中,优选为来自哺乳动物的细胞因子。作为哺乳动物,可举出人、小鼠、大鼠、牛、猪、兔等,其中,优选人。[0098]以主要的哺乳动物的il-6家族细胞因子为代表的增殖用培养基中所含的各种成分的氨基酸序列和编码该氨基酸序列的基因的碱基序列例如可以从基因库等公知的数据库获取。例如,在基因库中,人il-6的氨基酸序列以登录号xp_011513692、xp_005249802注册。[0099]增殖用培养基中所含的il-6家族细胞因子的浓度通常为10ng/ml~1.0μg/ml,优选为50ng/ml~500ng/ml,更优选为80ng/ml~200ng/ml。[0100](2)烟酰胺[0101]从提高和维持长期培养时的细胞增殖能力的观点出发,增殖用培养基优选实质上不含烟酰胺。这里所谓的“实质上不含烟酰胺”是指增殖用培养基完全不含烟酰胺(相对于增殖用培养基的总容量为0mm)、或者仅包含不会妨碍长期培养时的细胞增殖能力的提高和维持的程度的极微量,例如9mm以下,优选5mm以下,更优选1mm以下的浓度。[0102](3)生长因子[0103]从提高细胞增殖性的观点出发,增殖用培养基优选进一步包含生长因子。生长因子是指刺激细胞的生长、分化、存活、炎症和组织修复的扩散性信号转导蛋白。[0104]作为生长因子,可举出上皮生长因子(egf)、成纤维细胞增殖因子(fgf)、肝细胞增殖因子(hgf)、双调蛋白(amphiregulin)、肝素结合egf样生长因子(hb-egf)等。[0105]egf为egf家族之一,是使上皮生长因子受体(egfr或erbb1)活化的生长因子。活化的egfr主要使mapk信号转导通路活化,另外,使pi3k信号转导通路、jak/stat信号转导通路活化。[0106]增殖用培养基中所含的egf的浓度通常为10ng/ml~1000ng/ml,优选为50ng/ml~500ng/ml,更优选为80ng/ml~200ng/ml。[0107]hgf为使met受体活化的生长因子,活化的met受体使hgf-met信号转导通路活化。hgf-met信号转导通路的活化促进β连环蛋白通路的活化,促进血管形成、金属蛋白酶产生。[0108]增殖用培养基中所含的hgf的浓度通常为10ng/ml~1000ng/ml,优选为50ng/ml~500ng/ml,更优选为80ng/ml~200ng/ml。[0109]作为fgf,优选能够与fgf受体2(fgfr2)或fgf受体4(fgfr4)结合,优选为fgf2、fgf4、fgf7或fgf10,特别优选为fgf10。[0110]增殖用培养基中所含的fgf的浓度通常为20ng/ml~500ng/ml,优选为50ng/ml~300ng/ml,更优选为80ng/ml~150ng/ml。[0111]双调蛋白和hb-egf为egf家族之一,与egf相同,使egfr活化,使mapk信号转导通路、pi3k信号转导通路或jak/stat信号转导通路活化。[0112]增殖用培养基中所含的双调蛋白的浓度通常为10ng/ml~1000ng/ml,优选为50ng/ml~500ng/ml,更优选为80ng/ml~200ng/ml。[0113]增殖用培养基中所含的hb-egf的最终浓度通常为10ng/ml~1000ng/ml,优选为50ng/ml~500ng/ml,更优选为80ng/ml~200ng/ml。[0114](4)wnt激动剂[0115]从维持肝干细胞和提高细胞增殖性的观点出发,增殖用培养基优选进一步包含wnt激动剂。wnt激动剂是活化wnt信号转导通路的激动剂。[0116]作为wnt激动剂,例如可举出wnt家族成员、r-脊椎蛋白家族、norrin(ノリン)和糖原合成酶(gsk)抑制剂。[0117]作为wnt家族成员,例如可举出wnt1、wnt2、wnt2b、wnt3、wnt3a、wnt4、wnt5a、wnt5b、wnt6、wnt7a、wnt7b、wnt8a、wnt8b、wnt9a、wnt9b、wnt10a、wnt10b、wnt11和wnt16,其中,优选wnt3a。[0118]已知阿法明(afamin)有助于wnt家族成员的稳定化和可溶化,因此,作为wnt激动剂,更优选使用wnt家族成员与阿法明的复合体。wnt家族成员与afamin的复合体可以以包含wnt家族成员的浓度为18ng/ml~900ng/ml的该复合体的熟化培养液(条件培养基)的形式使用。[0119]阿法明是指属于白蛋白家族的糖蛋白。[0120]在基因库中,人阿法明的氨基酸序列以aaa21612注册,牛阿法明的氨基酸序列以daa28569注册。[0121]作为wnt家族成员,在使用wnt家族成员的浓度为上述范围的条件培养基的情况下,增殖用培养基中所含的条件培养基的含量相对于增殖用培养基的总容量通常为1容量(v/v)%~50容量(v/v)%,优选为10容量(v/v)%~30容量(v/v)%、15容量(v/v)%~25容量(v/v)%。[0122]作为r-脊椎蛋白家族,例如可举出r-脊椎蛋白1、r-脊椎蛋白2、r-脊椎蛋白3和r-脊椎蛋白4,其中,优选r-脊椎蛋白1。r-脊椎蛋白家族如果在细胞膜中与lgr5结合,则由于自泛素化而从细胞膜中被除去,其结果,诱导wnt信号转导通路的活化的frezzled在细胞膜中稳定化或使β连环蛋白通路活化。r-脊椎蛋白家族成员可以以包含浓度为0.13μg/ml~6.5μg/ml的该复合体的熟化培养液的形式使用。[0123]作为r-脊椎蛋白家族成员,在使用r-脊椎蛋白家族成员的浓度为上述范围的条件培养基的情况下,增殖用培养基中所含的条件培养基的含量相对于增殖用培养基的总容量通常为1容量(v/v)%~50容量(v/v)%,优选为5容量(v/v)%~25容量(v/v)%、8容量(v/v)%~20容量(v/v)%。[0124]gsk抑制剂表示糖原合成酶3β(gsk3β)的抑制剂。gsk3β将β-连环蛋白磷酸化,促进其分解反应,gsk抑制剂作为wnt激动剂发挥作用。[0125]作为gsk抑制剂,例如可举出chir99021(cas号:252917-06-9)、sb216763(cas号:280744-09-4)、sb415286(cas号:264218-23-7)、chir98014(cas号:252935-94-7)、azd1080(cas号:612487-72-6)、ly2090314(cas号:603288-22-8),其中,优选chir99021。[0126]作为wnt激动剂,优选将wnt家族成员和r-脊椎蛋白家族组合使用,更优选将wnt3a和r-脊椎蛋白1组合使用,进一步优选将wnt3a与afamin的复合体和r-脊椎蛋白1组合使用。[0127](5)rho激酶抑制剂[0128]从抑制细胞凋亡的观点出发,增殖用培养基优选进一步包含rho激酶(rock)抑制剂。rock抑制剂作为igf-1信号转导的拮抗剂而发挥作用。[0129]作为rock抑制剂,例如可举出:y-27632(cas号:146986-50-7)、法舒地尔(fasudil)(cas号:105628-07-7)、y39983(cas号:203911-26-6)、wf-536(cas号:539857-64-2)、slx-2119(cas号:911417-87-3)、氮杂苯并咪唑-氨基呋咱(azabenzimidazole-aminofurazans)(cas号:850664-21-0)、de-104、h-1152p(cas号:872543-07-6)、rho激酶α抑制剂(rokαinhibitor)、xd-4000、hmn-1152、4-(1-氨基烷基)-n-(4-吡啶基)环己烷-甲酰胺(4-(1-aminoalkyl)-n-(4-pyridyl)cyclohexane-carboxamides)、rho他汀(rhostain)、ba-210、ba-207、ki-23095和vas-012。这些之中,优选y-27632。[0130]增殖用培养基中所含的rock抑制剂的浓度通常为1μm~20μm,优选为5μm~15μm,表示增殖用培养基1升中的分子量(mol/l)的1/1000000000的浓度,以下也表示同样的浓度。[0147]b27补充剂为包含生物素、胆固醇、亚油酸、亚麻酸、黄体酮、腐胺、视黄醇、视黄醇乙酸酯、亚硒酸钠、三碘甲腺原氨酸(t3)、dl-α-生育酚(维生素e)、白蛋白、胰岛素和转铁蛋白等的组合物,作为50倍液体浓缩液而市售。[0148]n2补充剂为包含500μg/ml的人转铁蛋白、500μg/ml的牛胰岛素、0.63μg/ml的黄体酮、161μg/ml的腐胺和0.52μg/ml的亚硒酸钠等的组合物,作为100倍液体浓缩液而市售。[0149]增殖用培养基中所含的n-乙酰半胱氨酸的浓度通常为150ng/ml~250ng/ml。[0150]<代谢活化肝类器官的制造方法>[0151]在一个实施方式中,本发明提供一种制造方法,包括:在分化用培养基中培养通过上述增殖性肝类器官的制造方法而制造的增殖性肝类器官,得到代谢活化肝类器官(以下称为“工序b”);上述分化用培养基实质上不含il-6家族细胞因子。[0152]根据本实施方式的代谢活化肝类器官的制造方法,可得到从利用上述增殖性肝类器官的制造方法制造的增殖性肝类器官分化的代谢活性优异的代谢活化肝类器官。该代谢活化肝类器官如后述的实施例所示,各种代谢酶的表达提高到能够在药代动力学试验中使用的程度。[0153][工序b][0154]在工序b中,在分化用培养基中使通过上述制造方法而制造的增殖性肝类器官分化为代谢活化肝类器官。[0155]作为工序b中使用的增殖性肝类器官,从增殖性肝类器官的增殖和类器官的形成的观点出发,优选在工序a中进行2周以上的培养的增殖性肝类器官。[0156]工序b中的培养期间通常为5天~15天,优选为7天~12天。[0157]工序b中,优选使增殖性肝类器官与细胞外基质(ecm)接触而进行培养。例如,如后述的实施例所示,在聚合的ecm层积增殖用培养基并培养而得的增殖性肝类器官中,可以根据需要以包含适当的个数的增殖性肝类器官的方式进行物理解离后,层积分化用培养基代替增殖用培养基进行培养。[0158]作为工序b中使用的ecm,可举出与上述工序a中使用的ecm同样的ecm。[0159]作为工序b中的培养条件,可举出与工序a中的培养条件同样的条件。[0160]本实施方式的代谢活化肝类器官的制造方法中,增殖性肝类器官分化为代谢活化肝类器官的情况可以将肝细胞标志物的表达、药物代谢活性等作为指标来进行判定或评价。作为肝细胞标志物,例如可举出白蛋白(alb)、α-胎儿蛋白(afp)、酪氨酸-氨基转移酶(tat)、孕烷x受体(pxr)等。肝细胞标志物的表达量的测定可以以基因水平进行,也可以以蛋白质水平进行。[0161]作为由包含代谢活化肝类器官的细胞群体得到仅由代谢活化肝类器官构成的细胞的方法,例如可举出以上述肝细胞标志物的存在为指标,对代谢活化肝类器官进行筛选和分取的方法。[0162]药物代谢活性可以通过药物代谢酶的表达的检测或药物代谢测试来评价。作为药物代谢酶,例如可举出细胞色素p4501a2(cyp1a2)、细胞色素p4502b(cyp2b)、细胞色素p4502c9(cyp2c9)、细胞色素p4502c19(cyp2c19)、细胞色素p4502d6(cyp2d6)、细胞色素p4502e1(cyp2e1)、细胞色素p4503a4(cyp3a4)、细胞色素p4503a7(cyp3a7)、尿苷二磷酸-葡萄糖醛酸转移酶(ugt)和硫酸转移酶(sult)。[0163][分化用培养基][0164]分化用培养基实质上不含il-6家族细胞因子。由此,能够从增殖性肝类器官向肝细胞分化。[0165]作为分化用培养基,优选实质上不含烟酰胺,优选包含生长因子、wnt激动剂和tgf-β抑制剂,除它们以外,还优选包含rock抑制剂、bmp抑制剂和毛喉素。[0166]分化用培养基通常可以在基本培养基中添加各成分来制备。作为基本培养基,可举出与增殖用培养基同样的基础培养基。[0167](1)il-6家族细胞因子[0168]分化用培养基实质上不含il-6家族细胞因子。“实质上不含il-6家族细胞因子”是指分化用培养基中所含的il-6家族细胞因子的浓度为0ng/ml或极微量,具体而言,是指分化用培养基中所含的il-6家族细胞因子的浓度小于10ng/ml,优选为1ng/ml以下。作为il-6家族细胞因子,可举出与上述增殖用培养基中例示的细胞因子同样的细胞因子。[0169](2)烟酰胺[0170]从提高和维持长期培养时的细胞增殖能力的观点出发,分化用培养基优选实质上不含烟酰胺。“实质上不含烟酰胺”是指分化用培养基中所含的烟酰胺的浓度为0mm或极微量,具体而言,是指分化用培养基中所含的烟酰胺的浓度为9mm以下,优选为5mm以下,更优选为1mm以下。[0171](3)生长因子[0172]从提高细胞增殖性的观点出发,分化用培养基优选进一步包含生长因子。生长因子的种类和分化用培养基中所含的生长因子的浓度与上述增殖用培养基同样。[0173](4)wnt激动剂[0174]从维持肝干细胞和提高细胞增殖性的观点出发,分化用培养基进一步包含wnt激动剂。wnt激动剂的种类和分化用培养基中所含的wnt激动剂的浓度与上述增殖用培养基同样。[0175](5)rock抑制剂[0176]从抑制细胞凋亡的观点出发,分化用培养基优选进一步包含rock抑制剂。rock抑制剂的种类和分化用培养基中所含的rock抑制剂的浓度与上述增殖用培养基同样。[0177](6)tgf-β抑制剂[0178]从维持肝干细胞的观点出发,分化用培养基优选进一步包含tgf-β抑制剂。tgf-β抑制剂的种类和分化用培养基中所含的tgf-β抑制剂的浓度与上述增殖用培养基同样。[0179](7)bmp抑制剂[0180]从调节类器官中所含的肝干细胞量的观点出发,分化用培养基优选进一步包含bmp抑制剂。bmp抑制剂的种类和分化用培养基中所含的bmp抑制剂的浓度与上述增殖用培养基同样。[0181](8)毛喉素[0182]从提高细胞增殖性的观点出发,分化用培养基优选进一步包含毛喉素。分化用培养基中所含的毛喉素的浓度与上述增殖用培养基同样。[0183](9)notch信号转导抑制剂[0184]分化用培养基可以进一步包含notch信号转导抑制剂,能够使代谢活化肝类器官的cyp3a4的表达量增大。notch信号承担细胞间的信息转导,是控制细胞的分化的信号。[0185]作为notch信号转导抑制剂,例如可举出:l-685458(cas号:292632-98-5)、dapt(cas号:208255-80-5)、dbz(cas号:209984-56-5)、mrk560(cas号:677772-84-8)、3,5-双(4-硝基苯氧基)苯甲酸、mrk003(cas号:623165-93-5)、mk0752(cas号:471905-41-6)、氟比洛芬和jlk6(cas号:62252-26-0)等γ-分泌酶抑制剂。[0186]分化用培养基中所含的notch信号转导抑制剂的浓度通常为10ng/ml~1000ng/ml,优选为20ng/ml~500ng/ml,更优选为30ng/ml~300ng/ml。[0187](10)维生素d[0188]分化用培养基可以进一步包含维生素d,能够使代谢活化肝类器官的白蛋白的产生量增大。维生素d受体的活化诱导p21和p27蛋白质的表达,停止细胞周期中的g0/g1期。[0189]维生素d在生物体内进行合成、代谢。因此,作为维生素d,包含维生素d前体、维生素d代谢产物和维生素d窦体。[0190]作为维生素d,可举出维生素d2(麦角钙化醇)、维生素d3(胆钙化醇)、7-脱氢胆固醇等维生素d前体、骨化二醇和骨化三醇等维生素d代谢产物、以及钙泊三醇、24,25-二羟基维生素d3、zk191784和zk2032788等维生素d窦体。[0191]分化用培养基中所含的维生素d的浓度通常为10nm~1000nm,优选为50nm~800nm,更优选为100nm~500nm。[0192](11)dna去甲基化剂[0193]分化用培养基可以进一步包含dna去甲基化剂,能够使代谢活化肝类器官的cyp3a4的表达量增大。[0194]作为dna去甲基化剂,5-氮杂-2-脱氧胞苷、5-氮杂胞苷(阿扎胞苷)、泽布拉林(zebularine)、假异胞嘧啶(pseudoisocytidine)、5-氟-2-脱氧胞苷、5,6-二氢-5-氮杂胞苷、2’‑脱氧-5,6-二氢-5-氮杂胞苷、6-氮杂胞苷、2’,2’‑二氟-脱氧胞苷和胞嘧啶-β-d-阿拉伯呋喃糖苷等胞苷类似物。[0195]分化用培养基中所含的dna去甲基化剂的浓度通常为0.1μm~100μm,优选为1μm~50μm,更优选为5μm~15μm。[0196](12)其它添加剂[0197]分化用培养基除上述成分之外,还可以含有胃泌素、b27补充剂(thermofisherscientific公司)、n2补充剂(thermofisherscientific公司)或n-乙酰半胱氨酸。分化用培养基中,作为胃泌素、b27补充剂(thermofisherscientific公司)、n2补充剂(thermofisherscientific公司)和n-乙酰半胱氨酸,可以以同样的浓度使用与上述增殖用培养基中的这些物质同样的物质。[0198]<将代谢活化肝类器官诱导为增殖性肝类器官的方法>[0199]在一个实施方式中,本发明提供一种诱导方法,包括:在诱导用培养基中培养通过上述代谢活化肝类器官的制造方法而制造的代谢活化肝类器官,将代谢活化肝类器官诱导为增殖性肝类器官(以下称为“工序c”);上述诱导用培养基包含il-6家族细胞因子。[0200]根据本实施方式的诱导方法,能够使代谢活化肝类器官返回到增殖性肝类器官,能够使细胞的增殖能力恢复。[0201]工序c中的培养条件为与上述增殖性肝类器官的制造方法中的工序a的培养条件同样的条件。另外,使用的诱导用培养基为与上述增殖性肝类器官的制造方法中记载的增殖用培养基同样的组成。[0202]<受试物质的评价方法>[0203]在一个实施方式中,本发明提供上述受试物质的评价方法,包括:使利用代谢活化肝类器官的制造方法制造的代谢活化肝类器官与受试物质接触,以及对代谢活化肝类器官的反应进行评价。[0204]通过本实施方式的评价方法,能够在体外评价受试物质的代谢、药物相互作用、肝毒性、转运子活性等,得到与体内的评价相近的结果。[0205]作为受试物质,例如可举出:天然化合物库、合成化合物库、现有药库和代谢物库。受试物质可以使用各种各样的分子尺寸的有机化合物或无机化合物。作为有机化合物的例子,可举出核酸、肽、蛋白质、脂质(单纯脂质、复合脂质(磷酸甘油酯、鞘脂、糖基甘油酯、脑苷脂等)、前列腺素、类异戊二烯、萜烯、类固醇、多酚、儿茶素、维生素(b1、b2、b3、b5、b6、b7、b9、b12、c、a、d、e等)等。[0206]医药、营养食品等现有成分或候补成分也是受试物质之一。也可以使用植物提取液、细胞提取液和培养上清液等作为受试物质。另外,通过同时添加2种以上的受试物质,也能够调查受试物质间的相互作用、协同作用等。[0207]使受试物质与代谢活化肝类器官接触的期间通常为10分钟~3天,优选为1小时~1天。受试物质与代谢活化肝类器官的接触可以分成多次进行。[0208]代谢活化肝类器官的反应的评价例如可根据所产生的代谢产物,通过质谱分析、液相色谱或免疫学方法来进行。作为免疫学方法,例如可举出荧光免疫测定法(fia法)和酶免疫测定法(eia法)。[0209]也可以将代谢活化肝类器官中的药物代谢酶(例如、细胞色素、ugt等)的表达作为指标来测定受试物质的代谢。药物代谢酶的表达可举出mrna水平或蛋白质水平。[0210]本实施方式的评价方法也可以检验受试物质的毒性。例如,调查接触受试物质后的代谢活化肝类器官的状态,评价受试物质的毒性。作为代谢活化肝类器官的状态,可举出存活率、细胞形态和培养液中的肝损伤标志物(例如、got、gpt等)的存在量等。[0211]<其它实施方式>[0212]在一个实施方式中,本发明提供通过上述增殖性肝类器官的制造方法而制造的增殖性肝类器官和通过代谢活性肝类器官的制造方法而制造的代谢活化肝类器官。本实施方式的代谢活化肝类器官能够适用于受试物质的代谢、药物相互作用、肝毒性和转运子活性等的体外评价。[0213]增殖性肝类器官和代谢活化肝类器官与例如生物体内天然存在的肝细胞有可能基因表达模式等存在差异。然而,是否存在这样的差异尚不确定,另外,为了确定这样的差异并通过基因表达模式等确定本实施方式的细胞,需要反复进行非常多的重复试验,实质上是不可能的。因此,可以说本实施方式的细胞通过利用上述制造方法制造来确定是较为实际的。[0214]在一个实施方式中,本发明提供增殖用培养基和分化用培养基。增殖用培养基和分化用培养基分别如增殖性肝类器官的制造方法中记载的增殖用培养基和代谢活性肝类器官的制造方法中记载的分化用培养基中记载所示。[0215]实施例[0216]以下,利用实验例对本发明进行说明,但本发明并不限定于以下的实验例。另外,所有实验基于庆应义塾大学医学部伦理委员会批准的伦理研究计划进行。[0217][实验例1]人增殖性肝类器官的制造[0218]将人原代冷冻悬浮肝细胞(bioprridic、hep187-s)在37℃的水浴中融化,悬浮于加入了无血清培养基的50ml管进行离心。应予说明,无血清培养基是在advanceddmem/f12中加入了hepes、glutamax、青霉素/链霉素的培养基。离心后,除去上清液,其后,在无血清培养基中悬浮,制备肝细胞悬浮液。从该悬浮液中将40000个肝细胞与50μl的基质胶(bdbiosciences公司)混合,接种于24孔组织培养板,在37℃孵育5分钟~10分钟直到基质胶完全聚合为止。接下来,在基质胶聚合后,层积表1所示的增殖用培养基,培养12周,制造实验例1的增殖性肝类器官。[0219]应予说明,r-脊椎蛋白1以包含r-脊椎蛋白1的条件培养基的形态使用,相对于条件培养基的总容量,r-脊椎蛋白1的浓度为1.3μg/ml。[0220]对于wnt3a,也与r-脊椎蛋白1同样地,以包含wnt3a与阿法明的复合体的条件培养基的形态使用,相对于条件培养基的总容量,wnt3a的浓度为360ng/ml。[0221]以目视来判定来自原代冷冻悬浮肝细胞的增殖性肝类器官(从培养开始起2周后)的增殖率。将结果示于表1。判定基准从增殖率高的情况起依次为( 、 、 、-)。[0222]利用荧光显微镜(keyence公司制、装置名“bz-x710”)观察从培养开始起2周后的增殖性肝类器官的形态,对形态进行观察。将类器官的内部为空洞的情况判定为“空心”,将细胞塞满至内部的情况判定为“实心”。将结果示于表1。另外,将显微镜图像示于图1。[0223]判定增殖性肝类器官可否进行维持传代培养。判定是在传代后根据显微镜图像来判断细胞的增殖性。将结果示于表1。[0224]对于从培养开始起2周后的增殖性肝类器官,使用市售的试剂盒(商品名“fastlanecellcdnakit”、qiagen公司),从细胞提取总核糖核酸(rna),合成cdna,利用实时定量pcr测定白蛋白、代谢酶和转运子基因的mrna的表达量。实时定量pcr使用市售的试剂盒(商品名“sybr(注册商标)premixextaq(perfectrealtime)”、takarabio公司)进行。另外,作为内源性对照,使用甘油醛3磷酸脱氢酶(gapdh)校正测定结果。将结果示于表3。应予说明,表3中,数值以将人原代冷冻悬浮肝细胞(bioprridic、hep187-s)的表达量设为100时的相对值表示。[0225][实验例2~实验例4]肝类器官的制造[0226]除了使用表1所示的各组成的增殖用培养基以外,使用与实验例1同样的方法制造肝类器官。对于增殖率、细胞的形态、维持扩大培养、以及基因水平下的代谢酶、转运子和白蛋白表达量的测定,也使用与实验例1同样的方法进行。将结果示于表1和表3。另外,将实验例2的肝类器官的显微镜图像示于图2。[0227][实验例5]代谢活化肝类器官的制造[0228]使用实验例1的方法,将在增殖用培养基中培养了2周的人增殖性肝类器官通过机械解离进行稀释,进行传代。此时,将培养基从增殖用培养基更换为分化用培养基,进行1周培养,从而制造代谢活化肝类器官。作为分化用培养基,使用表2所示的组成的不含il-6的无血清培养基。对于细胞的形态、维持扩大培养、以及基因水平下的代谢酶、转运子和白蛋白表达量的测定,使用与实验例1同样的方法进行。将结果示于表2和3。另外,将得到的肝类器官的显微镜图像示于图3。[0229][参考例1]人肝类器官的制造[0230]使用非专利文献2中记载的方法制造人肝类器官。对于基因水平下的代谢酶、转运子和白蛋白表达量的测定,使用与实验例1同样的方法进行。结果示于表3。[0231][表1][0232][0233][表2][0234][0235][表3][0236][0237]根据表1可知,使用包含il-6的增殖用培养基而得到的增殖性肝类器官(实验例1)的细胞的形态是空心的,增殖率高,能够维持扩大培养。另外,从图1的显微镜图像观察到在类器官内部包含红色的成分。[0238]与此相对,使用不含il-6的增殖用培养基而得到的肝类器官(实验例2)的细胞的形态是实心的,增殖率高,但无法维持扩大培养。另外,使用不含il-6但包含烟酰胺的增殖用培养基而得到的肝类器官(实验例3和实验例4)的细胞的形态是实心的,增殖率低,无法维持扩大培养。[0239]根据表2和表3可知,使用不含il-6的分化用培养基而从实验例1的增殖性肝类器官分化的实验例5的代谢活化肝类器官的细胞的形态是空心的,虽然无法维持扩大培养,但基因水平下的代谢酶、转运子和白蛋白表达量普遍提高,是能够用于药代动力学试验的程度。另外,从图3的显微镜图像观察到在类器官内部包含推测为胆红素的黄色的成分。[0240][实验例6~实验例7]增殖性肝类器官的制造[0241]除了使用表4所示的增殖用培养基以外,使用与实验例1同样的方法制造增殖性肝类器官。对于增殖率和维持扩大培养的测定,也使用与实验例1同样的方法进行。将结果示于表4。[0242][表4][0243][0244][实验例8~实验例12]代谢活性肝类器官的制造[0245]除了使用表4所示的分化用培养基以外,使用与实验例5同样的方法制造代谢活性肝类器官。对于白蛋白表达量和cyp3a4表达量的测定,也使用与实验例5同样的方法进行。将结果示于表5。[0246][表5][0247][0248][实验例13]胶原蛋白-基质胶上的人增殖性肝类器官的制造[0249]将人原代冷冻悬浮肝细胞(bioprridic、hep187-s)在37℃的水浴中融化,在加入了无血清培养基的50ml管中悬浮并离心。应予说明,无血清培养基是在advanceddmem/f12中加入了hepes、glutamax、青霉素/链霉素的培养基。离心后,除去上清液,其后,在无血清培养基中悬浮,制备肝细胞悬浮液。从该悬浮液中将50000个的肝细胞与12.5μl的基质胶(bdbiosciences公司)和12.5μl的胶原蛋白i(新田明胶株式会社)混合,接种于48孔组织培养板,在37℃孵育5分钟~10分钟直到基质胶和胶原蛋白完全聚合为止。作为对照,准备仅使用基质胶或仅使用胶原蛋白的对照组。接下来,在基质胶和胶原蛋白i聚合后,层积上述表1所示的增殖用培养基进行培养,制造实验例13的增殖性肝类器官。[0250]如图4a~图4d所示,在使用将胶原蛋白和基质胶混合而成的ecm的情况下,可以以更多的传代次数进行培养,可见增殖性的增强。[0251]产业上的可利用性[0252]根据本实施方式的增殖性肝类器官的制造方法,可得到增殖性优异的增殖性肝类器官。根据本实施方式的代谢活化肝类器官的制造方法,可得到从上述增殖性肝类器官分化的代谢活性优异的代谢活化肝类器官。当前第1页12当前第1页12
背景技术:
::3.在医药品开发的药代动力学试验中,进行了使用啮齿动物的体内试验、使用来自啮齿动物的原代(冷冻)肝细胞(肝实质细胞)的体外试验。然而,由于存在种差,因此,难以预测人特异性产生的毒性。另一方面,对于人原代(冷冻)肝细胞,由于数量有限,因此,难以稳定地获得优质的肝细胞。4.在药代动力学试验中,特别着眼于肝细胞中大量存在的细胞色素p450(cyp),推进了药物的研究开发。cyp是代谢人体中存在的异型生物质的主要的酶之一。在对基于cyp的药物的代谢进行解析时,可以使用heparg(注册商标,以下,省略“注册商标”的记载)这样的法国国立卫生医学研究所(inserm)开发的来自人肝肿瘤的细胞株。heparg细胞被认为对cyp具有人肝细胞的平均活性。然而,对于heparg细胞,为了恢复cyp的活性,需要培养时间,进而,由于购入而耗费成本。另外,hepg2细胞等来自人的肝癌细胞株的cyp的活性低,无法评价与基于cyp的代谢相关的毒性。另外,从确保稳定的细胞数的观点出发,也研究了使用人ips细胞(inducedpluripotentstemcell)等来自多能干细胞的肝细胞。然而,来自人ips细胞的肝细胞与来自人的肝癌细胞株同样,cyp的活性低,进而,细胞的成熟度也比原代(冷冻)肝细胞差。由此,需要能够更稳定地使用的通过体外制造的来自人的肝细胞(肝类器官)。5.在2013年,由hansclevers等人建立了由来自小鼠的肝细胞培养肝类器官的方法,其后,在2015年,由同一团体建立了由来自人的肝干细胞得到肝类器官。进而,在2018年,由同一团体建立了由与前面出现的肝类器官不同的细胞起源的肝干细胞得到肝类器官,作为肝细胞的新的供给源而受到期待(参照专利文献1和非专利文献1~非专利文献2)。6.现有技术文献7.专利文献8.专利文献1:日本特表2013-535201号公报9.非专利文献10.非专利文献1:huchmetal.,“long-termcultureofgenome-stablebipotentstemcellsfromadulthumanliver.”,cell,vol.160,issue1,p299-312,2015.11.非专利文献2:huhetal,“long-termexpansionoffunctionalmouseandhumanhepatocytesas3dorganoids.”,cell,vol.175,issue6,p1591-1606,2018.技术实现要素:12.本发明是鉴于上述情况而完成的,提供增殖性优异的增殖性肝类器官和其制造方法、以及从上述增殖性肝类器官分化的代谢活性优异的代谢活化肝类器官和其制造方法。13.即,本发明包含以下的实施方式。14.(1)一种制造方法,是增殖性肝类器官的制造方法,包括:15.在增殖用培养基中培养肝干细胞或包含肝干细胞的组织片,得到增殖性肝类器官;16.上述增殖用培养基包含白细胞介素-6家族细胞因子。17.(2)根据上述(1)所述的制造方法,其中,上述白细胞介素-6家族细胞因子为选自白细胞介素-6、白细胞介素-11、制瘤素m、白血病抑制因子、心肌营养素心肌营养素-1和睫状神经营养因子中的至少1种。18.(3)根据上述(1)或(2)所述的制造方法,其中,上述增殖用培养基实质上不含烟酰胺。19.(4)根据上述(1)~(3)中任一项所述的制造方法,其中,上述增殖用培养基进一步包含生长因子。20.(5)根据上述(4)所述的制造方法,其中,上述生长因子为选自上皮生长因子、成纤维细胞增殖因子、肝细胞增殖因子、双调蛋白和肝素结合egf样生长因子中的至少1种。21.(6)根据上述(1)~(5)中任一项所述的制造方法,其中,上述增殖用培养基进一步包含wnt激动剂。22.(7)根据上述(6)所述的制造方法,其中,上述wnt激动剂为选自wnt家族成员、r-脊椎蛋白(spondin)1、r-脊椎蛋白2、r-脊椎蛋白3、r-脊椎蛋白4、norrin和糖原合成酶抑制剂中的至少1种。23.(8)根据上述(1)~(7)中任一项所述的制造方法,其中,上述增殖用培养基进一步包含rho激酶抑制剂。24.(9)根据上述(8)所述的制造方法,其中,上述rho激酶抑制剂为选自y-27632、法舒地尔、y39983、wf-536、slx-2119、氮杂苯并咪唑-氨基呋咱、de-104、h-1152p、rho激酶α抑制剂、xd-4000、hmn-1152、4-(1-氨基烷基)-n-(4-吡啶基)环己烷-甲酰胺、rho他汀、ba-210、ba-207、ki-23095和vas-012中的至少1种。25.(10)根据上述(1)~(9)中任一项所述的制造方法,其中,上述增殖用培养基进一步包含转化生长因子-β抑制剂。26.(11)根据上述(10)所述的制造方法,其中,上述转化生长因子-β抑制剂为选自a83-01、sb-431542、sb-505124、sb-525334、ly364947、sd-208和sjn2511中的至少1种。27.(12)根据上述(1)~(11)中任一项所述的制造方法,其中,上述增殖用培养基进一步包含骨形成蛋白抑制剂。28.(13)根据上述(12)所述的制造方法,其中,上述骨形成蛋白抑制剂为选自noggin、神经母细胞瘤中差异筛选选择的基因异常(differentialscreening-selectedgeneaberrativeinneuroblastoma)、cerberus和gremlin中的至少1种。29.(14)根据上述(1)~(13)中任一项所述的制造方法,其中,上述增殖用培养基进一步包含毛喉素。30.(15)根据上述(1)~(14)中任一项所述的制造方法,其中,上述增殖用培养基进一步包含选自胃泌素、神经系统补充剂和n-乙酰半胱氨酸中的至少1种。31.(16)根据上述(1)~(15)中任一项所述的制造方法,其中,在上述增殖用培养基中的培养中,使上述肝干细胞或包含上述肝干细胞的组织片与细胞外基质接触而进行培养。32.(17)根据上述(16)所述的制造方法,其中,在上述增殖用培养基中的培养中,上述细胞外基质为胶原蛋白和基质胶的混合物。33.(18)根据上述(1)~(17)中任一项所述的制造方法,其中,在上述增殖用培养基中的培养中,至少进行2周培养。34.(19)一种制造方法,是代谢活化肝类器官的制造方法,包括:35.在分化用培养基中培养通过上述(1)~(18)中任一项所述的制造方法而制造的增殖性肝类器官,得到代谢活化肝类器官;36.上述分化用培养基实质上不含白细胞介素-6家族细胞因子。37.(20)根据上述(19)所述的制造方法,其中,上述分化用培养基实质上不含烟酰胺。38.(21)根据上述(19)或(20)所述的制造方法,其中,上述分化用培养基进一步包含生长因子。39.(22)根据上述(21)所述的制造方法,其中,上述生长因子为选自上皮生长因子、成纤维细胞增殖因子和肝细胞增殖因子中的至少1种。40.(23)根据上述(19)~(22)中任一项所述的制造方法,其中,上述分化用培养基进一步包含wnt激动剂。41.(24)根据上述(23)所述的制造方法,其中,上述wnt激动剂为选自wnt家族成员、r-脊椎蛋白1、r-脊椎蛋白2、r-脊椎蛋白3、r-脊椎蛋白4、norrin和糖原合成酶抑制剂中的至少1种。42.(25)根据上述(19)~(24)中任一项所述的制造方法,其中,上述分化用培养基进一步包含rho激酶抑制剂。43.(26)根据上述(25)所述的制造方法,其中,上述rho激酶抑制剂为选自y-27632、法舒地尔、y39983、wf-536、slx-2119、氮杂苯并咪唑-氨基呋咱、de-104、h-1152p、rho激酶α抑制剂、xd-4000、hmn-1152、4-(1-氨基烷基)-n-(4-吡啶基)环己烷-甲酰胺、rho他汀、ba-210、ba-207、ki-23095和vas-012中的至少1种。44.(27)根据上述(19)~(26)中任一项所述的制造方法,其中,上述分化用培养基进一步包含转化生长因子-β抑制剂。45.(28)根据上述(27)所述的制造方法,其中,上述转化生长因子-β抑制剂为选自a83-01、sb-431542、sb-505124、sb-525334、ly364947、sd-208和sjn2511中的至少1种。46.(29)根据上述(19)~(28)中任一项所述的制造方法,其中,上述分化用培养基进一步包含骨形成蛋白抑制剂。47.(30)根据上述(29)所述的制造方法,其中,上述骨形成蛋白抑制剂为选自noggin、神经母细胞瘤中差异筛选选择的基因异常、cerberus和gremlin中的至少1种。48.(31)根据上述(19)~(30)中任一项所述的制造方法,其中,上述分化用培养基进一步包含毛喉素。49.(32)根据上述(19)~(31)中任一项所述的制造方法,其中,上述分化用培养基进一步包含选自胃泌素、神经系统补充剂和n-乙酰半胱氨酸中的至少1种。50.(33)根据上述(19)~(32)中任一项所述的制造方法,其中,上述分化用培养基进一步包含维生素d。51.(34)根据上述(19)~(33)中任一项所述的制造方法,其中,上述分化用培养基进一步包含notch抑制剂。52.(35)一种诱导方法,是将代谢活化肝类器官诱导为增殖性肝类器官的方法,包括:53.在诱导用培养基中培养通过上述(19)~(34)中任一项所述的制造方法而制造的代谢活化肝类器官,将上述代谢活化肝类器官诱导为增殖性肝类器官;54.上述诱导用培养基包含白细胞介素-6家族细胞因子。55.(36)一种增殖性肝类器官,是通过上述(1)~(18)中任一项所述的制造方法而制造的。56.(37)一种代谢活化肝类器官,是通过上述(19)~(34)中任一项所述的制造方法而制造的。57.(38)一种用于培养增殖性肝类器官的增殖用培养基,包含白细胞介素-6家族细胞因子。58.(39)一种受试物质的评价方法,包括:使上述(37)所述的代谢活化肝类器官与受试物质接触,以及59.对上述代谢活化肝类器官的反应进行评价。60.根据上述方式的增殖性肝类器官的制造方法,能够提供增殖性优异的增殖性肝类器官。根据上述方式的代谢活化肝类器官的制造方法,能够提供从上述增殖性肝类器官分化的代谢活性优异的代谢活化肝类器官。附图说明61.图1为实验例1中的增殖性肝类器官的显微镜图像。比例尺为100μm。62.图2为实验例2中的肝类器官的显微镜图像。比例尺为100μm。63.图3为实验例5中的代谢活化肝类器官的显微镜图像。64.图4a为表示使用基质胶、胶原蛋白和基质胶的混合物、以及胶原蛋白作为实验例13中的细胞外基体时的传代次数的比较的图表。图4a中,p表示传代次数。65.图4b为使用胶原蛋白和基质胶的混合物作为实验例13中的细胞外基体时的14次传代后且培养190天后的增殖性肝类器官的显微镜图像。66.图4c为图4b的放大图像。比例尺为100μm。67.图4d为表示使用基质胶、胶原蛋白和基质胶的混合物、以及胶原蛋白作为实验例13中的细胞外基体时的增殖能力的比较的图表。具体实施方式68.以下,示出实施方式对本发明进行进一步的详细说明,但本发明并不受以下的实施方式任何限定。69.本说明书中例示的各成分,例如增殖用培养基中或分化用培养基中的各成分只要没有特别说明,则可以分别单独含有1种,或者组合含有2种以上。70.在本说明书中,表示“a~b”等数值范围的表述与“a以上且b以下”含义相同,该数值范围包含a和b。71.<增殖性肝类器官的制造方法>72.在一个实施方式中,本发明提供一种制造方法,是增殖性肝类器官的制造方法,包括:在增殖用培养基中培养肝干细胞或包含肝干细胞的组织片,得到增殖性肝类器官(以下也称为“工序a”);上述增殖用培养基包含白细胞介素-6(il-6)家族细胞因子。73.根据本实施方式的增殖性肝类器官的制造方法,可得到增殖性优异的增殖性肝类器官。74.对于现有的人原代(冷冻)肝细胞中,由于数量有限,因此,难以稳定地获得优质的肝细胞。75.与此相对,本实施方式的增殖性肝类器官的制造方法能够由人原代(冷冻)肝细胞等肝干细胞或包含肝干细胞的组织片得到具有增殖能力的增殖性肝类器官。因此,能够稳定地供给药代动力学试验所需要的优质的肝细胞。76.另外,通过使利用本实施方式的增殖性肝类器官的制造方法制造的增殖性肝类器官分化,能够得到代谢活性优异的代谢活化肝类器官。77.本说明书中的“代谢活化肝类器官”是指具有与构成活体的肝脏组织的肝细胞相类似的特性的细胞群体。作为代谢活化肝类器官,例如可举出:相对于人原代冷冻悬浮肝细胞中的表达量,白蛋白的表达量为50%以上、cyp2e1的表达量为300%以上、ugt1a1的表达量为300%以上、nrp2的表达量为500%以上的肝类器官。78.另外,本说明书中,“分化”、“分化诱导”是指以至少发生复杂化和异构化中的任一者的方式发挥作用。后述的本实施方式的代谢活化肝类器官的制造方法中,将增殖性肝类器官分化诱导为代谢活化肝类器官。79.应予说明,有时将利用本实施方式的制造方法制造的“增殖性肝类器官”和利用后述的本实施方式的代谢活化肝类器官的制造方法从上述增殖性肝类器官分化而制造的“代谢活化肝类器官”统称为“肝细胞块”。80.[工序a][0081]工序a中,在增殖用培养基中培养肝干细胞或包含肝干细胞的组织片,得到增殖性肝类器官。[0082]肝脏由承担肝功能的本质的肝实质细胞和支持该肝实质细胞的增殖、存活的肝非实质细胞群构成。肝实质细胞也被称为肝细胞。肝非实质细胞群由肝星状细胞、窦状内皮细胞、枯否细胞、胆管上皮细胞等构成。[0083]肝干细胞是保持分化为肝细胞和胆管上皮细胞的两能性的细胞,既存在于肝脏内的肝细胞,也存在于肝非实质细胞,是在组织损伤时承担肝脏再生的干细胞群体。包含肝干细胞的组织片为肝细胞的组织片。[0084]在工序a中,优选使肝干细胞或包含肝干细胞的组织片与细胞外基质(ecm)接触而进行培养。[0085]作为使ecm与肝干细胞或包含肝干细胞的组织片接触而培养的方法,例如,可以将肝干细胞或包含肝干细胞的组织片与细胞外基质前体混合,使细胞外基质前体凝胶化而形成ecm,接下来,将ecm浸渍于增殖用培养基进行培养。[0086]作为工序a中使用的ecm,优选包含至少2种特异性的糖蛋白的ecm。例如,可以为包含2种不同类型的胶原蛋白的ecm,也可以为例如包含胶原蛋白和层粘连蛋白的ecm。ecm可以为合成水凝胶细胞外基质,也可以为天然ecm。作为ecm,优选使用包含层粘连蛋白、巢蛋白和胶原蛋白iv的基质胶(注册商标)(bdbiosciences公司)。另外,可以使用胶原蛋白i和基质胶的混合物,此时,混合比优选以体积比计为1:1。细胞外基质可以为涂布在细胞培养容器上的状态,也可以为溶解状态。[0087]作为工序a中的培养条件,可以为在动物细胞的培养中一般采用的条件。例如,可以在30℃~40℃左右(优选为37℃左右)的温度、5%体积分率(1大气压)左右的co2浓度环境下进行。[0088]培养时间可以根据细胞数、细胞的状态等而适当地调整。从培养开始起1周~2周左右的期间后,能够形成增殖性肝类器官。其中,从增殖性肝类器官的增殖和类器官的形成的观点出发,优选至少进行2周培养。[0089][增殖用培养基][0090]增殖用培养基是用于培养增殖性肝类器官的培养基,包含il-6家族细胞因子。[0091]作为增殖用培养基,优选实质上不含烟酰胺。另外,优选除il-6家族细胞因子之外,还进一步包含生长因子、wnt激动剂和tgf-β抑制剂,更优选进一步包含rock抑制剂、bmp抑制剂和毛喉素。[0092]增殖用培养基通常可以在基本培养基中添加各成分来制备。作为基本培养基,例如可举出:dulbecco改良eagle培养基(dmem)、基础培养基(mem)、knockout-dmem(ko-dmem)、glasgow基本培养基(g-mem)、eagle基础培养基(bme)、dmem/ham’sf12、advanceddmem/ham’sf12(advanceddmem/f12)、iscov改良dulbecco培养基、ham’sf-10、ham’sf-12、199培养基、rpmi1640培养基。[0093]这些之中,优选添加了hepes、谷氨酰胺和青霉素/链霉素的dmem/f12和rpmi1640。另外,优选最适于无血清培养的包含glutamax(gibco公司制、l-丙氨酰-l-谷氨酰胺)代替谷氨酰胺的advanceddmem/f12或advancedrpmi。优选在advanceddmem/f12或advancedrpmi培养基中添加谷氨酰胺和青霉素/链霉素。[0094]发明人等着眼于参与细胞周期的从g0期向g1期转变的细胞因子、生长因子等各种因子中的作为炎症性细胞因子的il-6家族细胞因子,发现通过使用包含il-6家族细胞因子的增殖用培养基,能够得到可以一边维持高增殖能力一边长时间培养的增殖性肝类器官。[0095](1)il-6家族细胞因子[0096]作为il-6家族细胞因子,例如可举出:白细胞介素-6(il-6)、白细胞介素-11(il-11)、制瘤素m(osm)、白血病抑制因子(lif)、心肌营养素-1(ct-1)和睫状神经营养因子(cntf),其中,优选为il-6。[0097]il-6家族细胞因子的来源没有特别限定,可以使用来自各种生物的细胞因子。其中,优选为来自哺乳动物的细胞因子。作为哺乳动物,可举出人、小鼠、大鼠、牛、猪、兔等,其中,优选人。[0098]以主要的哺乳动物的il-6家族细胞因子为代表的增殖用培养基中所含的各种成分的氨基酸序列和编码该氨基酸序列的基因的碱基序列例如可以从基因库等公知的数据库获取。例如,在基因库中,人il-6的氨基酸序列以登录号xp_011513692、xp_005249802注册。[0099]增殖用培养基中所含的il-6家族细胞因子的浓度通常为10ng/ml~1.0μg/ml,优选为50ng/ml~500ng/ml,更优选为80ng/ml~200ng/ml。[0100](2)烟酰胺[0101]从提高和维持长期培养时的细胞增殖能力的观点出发,增殖用培养基优选实质上不含烟酰胺。这里所谓的“实质上不含烟酰胺”是指增殖用培养基完全不含烟酰胺(相对于增殖用培养基的总容量为0mm)、或者仅包含不会妨碍长期培养时的细胞增殖能力的提高和维持的程度的极微量,例如9mm以下,优选5mm以下,更优选1mm以下的浓度。[0102](3)生长因子[0103]从提高细胞增殖性的观点出发,增殖用培养基优选进一步包含生长因子。生长因子是指刺激细胞的生长、分化、存活、炎症和组织修复的扩散性信号转导蛋白。[0104]作为生长因子,可举出上皮生长因子(egf)、成纤维细胞增殖因子(fgf)、肝细胞增殖因子(hgf)、双调蛋白(amphiregulin)、肝素结合egf样生长因子(hb-egf)等。[0105]egf为egf家族之一,是使上皮生长因子受体(egfr或erbb1)活化的生长因子。活化的egfr主要使mapk信号转导通路活化,另外,使pi3k信号转导通路、jak/stat信号转导通路活化。[0106]增殖用培养基中所含的egf的浓度通常为10ng/ml~1000ng/ml,优选为50ng/ml~500ng/ml,更优选为80ng/ml~200ng/ml。[0107]hgf为使met受体活化的生长因子,活化的met受体使hgf-met信号转导通路活化。hgf-met信号转导通路的活化促进β连环蛋白通路的活化,促进血管形成、金属蛋白酶产生。[0108]增殖用培养基中所含的hgf的浓度通常为10ng/ml~1000ng/ml,优选为50ng/ml~500ng/ml,更优选为80ng/ml~200ng/ml。[0109]作为fgf,优选能够与fgf受体2(fgfr2)或fgf受体4(fgfr4)结合,优选为fgf2、fgf4、fgf7或fgf10,特别优选为fgf10。[0110]增殖用培养基中所含的fgf的浓度通常为20ng/ml~500ng/ml,优选为50ng/ml~300ng/ml,更优选为80ng/ml~150ng/ml。[0111]双调蛋白和hb-egf为egf家族之一,与egf相同,使egfr活化,使mapk信号转导通路、pi3k信号转导通路或jak/stat信号转导通路活化。[0112]增殖用培养基中所含的双调蛋白的浓度通常为10ng/ml~1000ng/ml,优选为50ng/ml~500ng/ml,更优选为80ng/ml~200ng/ml。[0113]增殖用培养基中所含的hb-egf的最终浓度通常为10ng/ml~1000ng/ml,优选为50ng/ml~500ng/ml,更优选为80ng/ml~200ng/ml。[0114](4)wnt激动剂[0115]从维持肝干细胞和提高细胞增殖性的观点出发,增殖用培养基优选进一步包含wnt激动剂。wnt激动剂是活化wnt信号转导通路的激动剂。[0116]作为wnt激动剂,例如可举出wnt家族成员、r-脊椎蛋白家族、norrin(ノリン)和糖原合成酶(gsk)抑制剂。[0117]作为wnt家族成员,例如可举出wnt1、wnt2、wnt2b、wnt3、wnt3a、wnt4、wnt5a、wnt5b、wnt6、wnt7a、wnt7b、wnt8a、wnt8b、wnt9a、wnt9b、wnt10a、wnt10b、wnt11和wnt16,其中,优选wnt3a。[0118]已知阿法明(afamin)有助于wnt家族成员的稳定化和可溶化,因此,作为wnt激动剂,更优选使用wnt家族成员与阿法明的复合体。wnt家族成员与afamin的复合体可以以包含wnt家族成员的浓度为18ng/ml~900ng/ml的该复合体的熟化培养液(条件培养基)的形式使用。[0119]阿法明是指属于白蛋白家族的糖蛋白。[0120]在基因库中,人阿法明的氨基酸序列以aaa21612注册,牛阿法明的氨基酸序列以daa28569注册。[0121]作为wnt家族成员,在使用wnt家族成员的浓度为上述范围的条件培养基的情况下,增殖用培养基中所含的条件培养基的含量相对于增殖用培养基的总容量通常为1容量(v/v)%~50容量(v/v)%,优选为10容量(v/v)%~30容量(v/v)%、15容量(v/v)%~25容量(v/v)%。[0122]作为r-脊椎蛋白家族,例如可举出r-脊椎蛋白1、r-脊椎蛋白2、r-脊椎蛋白3和r-脊椎蛋白4,其中,优选r-脊椎蛋白1。r-脊椎蛋白家族如果在细胞膜中与lgr5结合,则由于自泛素化而从细胞膜中被除去,其结果,诱导wnt信号转导通路的活化的frezzled在细胞膜中稳定化或使β连环蛋白通路活化。r-脊椎蛋白家族成员可以以包含浓度为0.13μg/ml~6.5μg/ml的该复合体的熟化培养液的形式使用。[0123]作为r-脊椎蛋白家族成员,在使用r-脊椎蛋白家族成员的浓度为上述范围的条件培养基的情况下,增殖用培养基中所含的条件培养基的含量相对于增殖用培养基的总容量通常为1容量(v/v)%~50容量(v/v)%,优选为5容量(v/v)%~25容量(v/v)%、8容量(v/v)%~20容量(v/v)%。[0124]gsk抑制剂表示糖原合成酶3β(gsk3β)的抑制剂。gsk3β将β-连环蛋白磷酸化,促进其分解反应,gsk抑制剂作为wnt激动剂发挥作用。[0125]作为gsk抑制剂,例如可举出chir99021(cas号:252917-06-9)、sb216763(cas号:280744-09-4)、sb415286(cas号:264218-23-7)、chir98014(cas号:252935-94-7)、azd1080(cas号:612487-72-6)、ly2090314(cas号:603288-22-8),其中,优选chir99021。[0126]作为wnt激动剂,优选将wnt家族成员和r-脊椎蛋白家族组合使用,更优选将wnt3a和r-脊椎蛋白1组合使用,进一步优选将wnt3a与afamin的复合体和r-脊椎蛋白1组合使用。[0127](5)rho激酶抑制剂[0128]从抑制细胞凋亡的观点出发,增殖用培养基优选进一步包含rho激酶(rock)抑制剂。rock抑制剂作为igf-1信号转导的拮抗剂而发挥作用。[0129]作为rock抑制剂,例如可举出:y-27632(cas号:146986-50-7)、法舒地尔(fasudil)(cas号:105628-07-7)、y39983(cas号:203911-26-6)、wf-536(cas号:539857-64-2)、slx-2119(cas号:911417-87-3)、氮杂苯并咪唑-氨基呋咱(azabenzimidazole-aminofurazans)(cas号:850664-21-0)、de-104、h-1152p(cas号:872543-07-6)、rho激酶α抑制剂(rokαinhibitor)、xd-4000、hmn-1152、4-(1-氨基烷基)-n-(4-吡啶基)环己烷-甲酰胺(4-(1-aminoalkyl)-n-(4-pyridyl)cyclohexane-carboxamides)、rho他汀(rhostain)、ba-210、ba-207、ki-23095和vas-012。这些之中,优选y-27632。[0130]增殖用培养基中所含的rock抑制剂的浓度通常为1μm~20μm,优选为5μm~15μm,表示增殖用培养基1升中的分子量(mol/l)的1/1000000000的浓度,以下也表示同样的浓度。[0147]b27补充剂为包含生物素、胆固醇、亚油酸、亚麻酸、黄体酮、腐胺、视黄醇、视黄醇乙酸酯、亚硒酸钠、三碘甲腺原氨酸(t3)、dl-α-生育酚(维生素e)、白蛋白、胰岛素和转铁蛋白等的组合物,作为50倍液体浓缩液而市售。[0148]n2补充剂为包含500μg/ml的人转铁蛋白、500μg/ml的牛胰岛素、0.63μg/ml的黄体酮、161μg/ml的腐胺和0.52μg/ml的亚硒酸钠等的组合物,作为100倍液体浓缩液而市售。[0149]增殖用培养基中所含的n-乙酰半胱氨酸的浓度通常为150ng/ml~250ng/ml。[0150]<代谢活化肝类器官的制造方法>[0151]在一个实施方式中,本发明提供一种制造方法,包括:在分化用培养基中培养通过上述增殖性肝类器官的制造方法而制造的增殖性肝类器官,得到代谢活化肝类器官(以下称为“工序b”);上述分化用培养基实质上不含il-6家族细胞因子。[0152]根据本实施方式的代谢活化肝类器官的制造方法,可得到从利用上述增殖性肝类器官的制造方法制造的增殖性肝类器官分化的代谢活性优异的代谢活化肝类器官。该代谢活化肝类器官如后述的实施例所示,各种代谢酶的表达提高到能够在药代动力学试验中使用的程度。[0153][工序b][0154]在工序b中,在分化用培养基中使通过上述制造方法而制造的增殖性肝类器官分化为代谢活化肝类器官。[0155]作为工序b中使用的增殖性肝类器官,从增殖性肝类器官的增殖和类器官的形成的观点出发,优选在工序a中进行2周以上的培养的增殖性肝类器官。[0156]工序b中的培养期间通常为5天~15天,优选为7天~12天。[0157]工序b中,优选使增殖性肝类器官与细胞外基质(ecm)接触而进行培养。例如,如后述的实施例所示,在聚合的ecm层积增殖用培养基并培养而得的增殖性肝类器官中,可以根据需要以包含适当的个数的增殖性肝类器官的方式进行物理解离后,层积分化用培养基代替增殖用培养基进行培养。[0158]作为工序b中使用的ecm,可举出与上述工序a中使用的ecm同样的ecm。[0159]作为工序b中的培养条件,可举出与工序a中的培养条件同样的条件。[0160]本实施方式的代谢活化肝类器官的制造方法中,增殖性肝类器官分化为代谢活化肝类器官的情况可以将肝细胞标志物的表达、药物代谢活性等作为指标来进行判定或评价。作为肝细胞标志物,例如可举出白蛋白(alb)、α-胎儿蛋白(afp)、酪氨酸-氨基转移酶(tat)、孕烷x受体(pxr)等。肝细胞标志物的表达量的测定可以以基因水平进行,也可以以蛋白质水平进行。[0161]作为由包含代谢活化肝类器官的细胞群体得到仅由代谢活化肝类器官构成的细胞的方法,例如可举出以上述肝细胞标志物的存在为指标,对代谢活化肝类器官进行筛选和分取的方法。[0162]药物代谢活性可以通过药物代谢酶的表达的检测或药物代谢测试来评价。作为药物代谢酶,例如可举出细胞色素p4501a2(cyp1a2)、细胞色素p4502b(cyp2b)、细胞色素p4502c9(cyp2c9)、细胞色素p4502c19(cyp2c19)、细胞色素p4502d6(cyp2d6)、细胞色素p4502e1(cyp2e1)、细胞色素p4503a4(cyp3a4)、细胞色素p4503a7(cyp3a7)、尿苷二磷酸-葡萄糖醛酸转移酶(ugt)和硫酸转移酶(sult)。[0163][分化用培养基][0164]分化用培养基实质上不含il-6家族细胞因子。由此,能够从增殖性肝类器官向肝细胞分化。[0165]作为分化用培养基,优选实质上不含烟酰胺,优选包含生长因子、wnt激动剂和tgf-β抑制剂,除它们以外,还优选包含rock抑制剂、bmp抑制剂和毛喉素。[0166]分化用培养基通常可以在基本培养基中添加各成分来制备。作为基本培养基,可举出与增殖用培养基同样的基础培养基。[0167](1)il-6家族细胞因子[0168]分化用培养基实质上不含il-6家族细胞因子。“实质上不含il-6家族细胞因子”是指分化用培养基中所含的il-6家族细胞因子的浓度为0ng/ml或极微量,具体而言,是指分化用培养基中所含的il-6家族细胞因子的浓度小于10ng/ml,优选为1ng/ml以下。作为il-6家族细胞因子,可举出与上述增殖用培养基中例示的细胞因子同样的细胞因子。[0169](2)烟酰胺[0170]从提高和维持长期培养时的细胞增殖能力的观点出发,分化用培养基优选实质上不含烟酰胺。“实质上不含烟酰胺”是指分化用培养基中所含的烟酰胺的浓度为0mm或极微量,具体而言,是指分化用培养基中所含的烟酰胺的浓度为9mm以下,优选为5mm以下,更优选为1mm以下。[0171](3)生长因子[0172]从提高细胞增殖性的观点出发,分化用培养基优选进一步包含生长因子。生长因子的种类和分化用培养基中所含的生长因子的浓度与上述增殖用培养基同样。[0173](4)wnt激动剂[0174]从维持肝干细胞和提高细胞增殖性的观点出发,分化用培养基进一步包含wnt激动剂。wnt激动剂的种类和分化用培养基中所含的wnt激动剂的浓度与上述增殖用培养基同样。[0175](5)rock抑制剂[0176]从抑制细胞凋亡的观点出发,分化用培养基优选进一步包含rock抑制剂。rock抑制剂的种类和分化用培养基中所含的rock抑制剂的浓度与上述增殖用培养基同样。[0177](6)tgf-β抑制剂[0178]从维持肝干细胞的观点出发,分化用培养基优选进一步包含tgf-β抑制剂。tgf-β抑制剂的种类和分化用培养基中所含的tgf-β抑制剂的浓度与上述增殖用培养基同样。[0179](7)bmp抑制剂[0180]从调节类器官中所含的肝干细胞量的观点出发,分化用培养基优选进一步包含bmp抑制剂。bmp抑制剂的种类和分化用培养基中所含的bmp抑制剂的浓度与上述增殖用培养基同样。[0181](8)毛喉素[0182]从提高细胞增殖性的观点出发,分化用培养基优选进一步包含毛喉素。分化用培养基中所含的毛喉素的浓度与上述增殖用培养基同样。[0183](9)notch信号转导抑制剂[0184]分化用培养基可以进一步包含notch信号转导抑制剂,能够使代谢活化肝类器官的cyp3a4的表达量增大。notch信号承担细胞间的信息转导,是控制细胞的分化的信号。[0185]作为notch信号转导抑制剂,例如可举出:l-685458(cas号:292632-98-5)、dapt(cas号:208255-80-5)、dbz(cas号:209984-56-5)、mrk560(cas号:677772-84-8)、3,5-双(4-硝基苯氧基)苯甲酸、mrk003(cas号:623165-93-5)、mk0752(cas号:471905-41-6)、氟比洛芬和jlk6(cas号:62252-26-0)等γ-分泌酶抑制剂。[0186]分化用培养基中所含的notch信号转导抑制剂的浓度通常为10ng/ml~1000ng/ml,优选为20ng/ml~500ng/ml,更优选为30ng/ml~300ng/ml。[0187](10)维生素d[0188]分化用培养基可以进一步包含维生素d,能够使代谢活化肝类器官的白蛋白的产生量增大。维生素d受体的活化诱导p21和p27蛋白质的表达,停止细胞周期中的g0/g1期。[0189]维生素d在生物体内进行合成、代谢。因此,作为维生素d,包含维生素d前体、维生素d代谢产物和维生素d窦体。[0190]作为维生素d,可举出维生素d2(麦角钙化醇)、维生素d3(胆钙化醇)、7-脱氢胆固醇等维生素d前体、骨化二醇和骨化三醇等维生素d代谢产物、以及钙泊三醇、24,25-二羟基维生素d3、zk191784和zk2032788等维生素d窦体。[0191]分化用培养基中所含的维生素d的浓度通常为10nm~1000nm,优选为50nm~800nm,更优选为100nm~500nm。[0192](11)dna去甲基化剂[0193]分化用培养基可以进一步包含dna去甲基化剂,能够使代谢活化肝类器官的cyp3a4的表达量增大。[0194]作为dna去甲基化剂,5-氮杂-2-脱氧胞苷、5-氮杂胞苷(阿扎胞苷)、泽布拉林(zebularine)、假异胞嘧啶(pseudoisocytidine)、5-氟-2-脱氧胞苷、5,6-二氢-5-氮杂胞苷、2’‑脱氧-5,6-二氢-5-氮杂胞苷、6-氮杂胞苷、2’,2’‑二氟-脱氧胞苷和胞嘧啶-β-d-阿拉伯呋喃糖苷等胞苷类似物。[0195]分化用培养基中所含的dna去甲基化剂的浓度通常为0.1μm~100μm,优选为1μm~50μm,更优选为5μm~15μm。[0196](12)其它添加剂[0197]分化用培养基除上述成分之外,还可以含有胃泌素、b27补充剂(thermofisherscientific公司)、n2补充剂(thermofisherscientific公司)或n-乙酰半胱氨酸。分化用培养基中,作为胃泌素、b27补充剂(thermofisherscientific公司)、n2补充剂(thermofisherscientific公司)和n-乙酰半胱氨酸,可以以同样的浓度使用与上述增殖用培养基中的这些物质同样的物质。[0198]<将代谢活化肝类器官诱导为增殖性肝类器官的方法>[0199]在一个实施方式中,本发明提供一种诱导方法,包括:在诱导用培养基中培养通过上述代谢活化肝类器官的制造方法而制造的代谢活化肝类器官,将代谢活化肝类器官诱导为增殖性肝类器官(以下称为“工序c”);上述诱导用培养基包含il-6家族细胞因子。[0200]根据本实施方式的诱导方法,能够使代谢活化肝类器官返回到增殖性肝类器官,能够使细胞的增殖能力恢复。[0201]工序c中的培养条件为与上述增殖性肝类器官的制造方法中的工序a的培养条件同样的条件。另外,使用的诱导用培养基为与上述增殖性肝类器官的制造方法中记载的增殖用培养基同样的组成。[0202]<受试物质的评价方法>[0203]在一个实施方式中,本发明提供上述受试物质的评价方法,包括:使利用代谢活化肝类器官的制造方法制造的代谢活化肝类器官与受试物质接触,以及对代谢活化肝类器官的反应进行评价。[0204]通过本实施方式的评价方法,能够在体外评价受试物质的代谢、药物相互作用、肝毒性、转运子活性等,得到与体内的评价相近的结果。[0205]作为受试物质,例如可举出:天然化合物库、合成化合物库、现有药库和代谢物库。受试物质可以使用各种各样的分子尺寸的有机化合物或无机化合物。作为有机化合物的例子,可举出核酸、肽、蛋白质、脂质(单纯脂质、复合脂质(磷酸甘油酯、鞘脂、糖基甘油酯、脑苷脂等)、前列腺素、类异戊二烯、萜烯、类固醇、多酚、儿茶素、维生素(b1、b2、b3、b5、b6、b7、b9、b12、c、a、d、e等)等。[0206]医药、营养食品等现有成分或候补成分也是受试物质之一。也可以使用植物提取液、细胞提取液和培养上清液等作为受试物质。另外,通过同时添加2种以上的受试物质,也能够调查受试物质间的相互作用、协同作用等。[0207]使受试物质与代谢活化肝类器官接触的期间通常为10分钟~3天,优选为1小时~1天。受试物质与代谢活化肝类器官的接触可以分成多次进行。[0208]代谢活化肝类器官的反应的评价例如可根据所产生的代谢产物,通过质谱分析、液相色谱或免疫学方法来进行。作为免疫学方法,例如可举出荧光免疫测定法(fia法)和酶免疫测定法(eia法)。[0209]也可以将代谢活化肝类器官中的药物代谢酶(例如、细胞色素、ugt等)的表达作为指标来测定受试物质的代谢。药物代谢酶的表达可举出mrna水平或蛋白质水平。[0210]本实施方式的评价方法也可以检验受试物质的毒性。例如,调查接触受试物质后的代谢活化肝类器官的状态,评价受试物质的毒性。作为代谢活化肝类器官的状态,可举出存活率、细胞形态和培养液中的肝损伤标志物(例如、got、gpt等)的存在量等。[0211]<其它实施方式>[0212]在一个实施方式中,本发明提供通过上述增殖性肝类器官的制造方法而制造的增殖性肝类器官和通过代谢活性肝类器官的制造方法而制造的代谢活化肝类器官。本实施方式的代谢活化肝类器官能够适用于受试物质的代谢、药物相互作用、肝毒性和转运子活性等的体外评价。[0213]增殖性肝类器官和代谢活化肝类器官与例如生物体内天然存在的肝细胞有可能基因表达模式等存在差异。然而,是否存在这样的差异尚不确定,另外,为了确定这样的差异并通过基因表达模式等确定本实施方式的细胞,需要反复进行非常多的重复试验,实质上是不可能的。因此,可以说本实施方式的细胞通过利用上述制造方法制造来确定是较为实际的。[0214]在一个实施方式中,本发明提供增殖用培养基和分化用培养基。增殖用培养基和分化用培养基分别如增殖性肝类器官的制造方法中记载的增殖用培养基和代谢活性肝类器官的制造方法中记载的分化用培养基中记载所示。[0215]实施例[0216]以下,利用实验例对本发明进行说明,但本发明并不限定于以下的实验例。另外,所有实验基于庆应义塾大学医学部伦理委员会批准的伦理研究计划进行。[0217][实验例1]人增殖性肝类器官的制造[0218]将人原代冷冻悬浮肝细胞(bioprridic、hep187-s)在37℃的水浴中融化,悬浮于加入了无血清培养基的50ml管进行离心。应予说明,无血清培养基是在advanceddmem/f12中加入了hepes、glutamax、青霉素/链霉素的培养基。离心后,除去上清液,其后,在无血清培养基中悬浮,制备肝细胞悬浮液。从该悬浮液中将40000个肝细胞与50μl的基质胶(bdbiosciences公司)混合,接种于24孔组织培养板,在37℃孵育5分钟~10分钟直到基质胶完全聚合为止。接下来,在基质胶聚合后,层积表1所示的增殖用培养基,培养12周,制造实验例1的增殖性肝类器官。[0219]应予说明,r-脊椎蛋白1以包含r-脊椎蛋白1的条件培养基的形态使用,相对于条件培养基的总容量,r-脊椎蛋白1的浓度为1.3μg/ml。[0220]对于wnt3a,也与r-脊椎蛋白1同样地,以包含wnt3a与阿法明的复合体的条件培养基的形态使用,相对于条件培养基的总容量,wnt3a的浓度为360ng/ml。[0221]以目视来判定来自原代冷冻悬浮肝细胞的增殖性肝类器官(从培养开始起2周后)的增殖率。将结果示于表1。判定基准从增殖率高的情况起依次为( 、 、 、-)。[0222]利用荧光显微镜(keyence公司制、装置名“bz-x710”)观察从培养开始起2周后的增殖性肝类器官的形态,对形态进行观察。将类器官的内部为空洞的情况判定为“空心”,将细胞塞满至内部的情况判定为“实心”。将结果示于表1。另外,将显微镜图像示于图1。[0223]判定增殖性肝类器官可否进行维持传代培养。判定是在传代后根据显微镜图像来判断细胞的增殖性。将结果示于表1。[0224]对于从培养开始起2周后的增殖性肝类器官,使用市售的试剂盒(商品名“fastlanecellcdnakit”、qiagen公司),从细胞提取总核糖核酸(rna),合成cdna,利用实时定量pcr测定白蛋白、代谢酶和转运子基因的mrna的表达量。实时定量pcr使用市售的试剂盒(商品名“sybr(注册商标)premixextaq(perfectrealtime)”、takarabio公司)进行。另外,作为内源性对照,使用甘油醛3磷酸脱氢酶(gapdh)校正测定结果。将结果示于表3。应予说明,表3中,数值以将人原代冷冻悬浮肝细胞(bioprridic、hep187-s)的表达量设为100时的相对值表示。[0225][实验例2~实验例4]肝类器官的制造[0226]除了使用表1所示的各组成的增殖用培养基以外,使用与实验例1同样的方法制造肝类器官。对于增殖率、细胞的形态、维持扩大培养、以及基因水平下的代谢酶、转运子和白蛋白表达量的测定,也使用与实验例1同样的方法进行。将结果示于表1和表3。另外,将实验例2的肝类器官的显微镜图像示于图2。[0227][实验例5]代谢活化肝类器官的制造[0228]使用实验例1的方法,将在增殖用培养基中培养了2周的人增殖性肝类器官通过机械解离进行稀释,进行传代。此时,将培养基从增殖用培养基更换为分化用培养基,进行1周培养,从而制造代谢活化肝类器官。作为分化用培养基,使用表2所示的组成的不含il-6的无血清培养基。对于细胞的形态、维持扩大培养、以及基因水平下的代谢酶、转运子和白蛋白表达量的测定,使用与实验例1同样的方法进行。将结果示于表2和3。另外,将得到的肝类器官的显微镜图像示于图3。[0229][参考例1]人肝类器官的制造[0230]使用非专利文献2中记载的方法制造人肝类器官。对于基因水平下的代谢酶、转运子和白蛋白表达量的测定,使用与实验例1同样的方法进行。结果示于表3。[0231][表1][0232][0233][表2][0234][0235][表3][0236][0237]根据表1可知,使用包含il-6的增殖用培养基而得到的增殖性肝类器官(实验例1)的细胞的形态是空心的,增殖率高,能够维持扩大培养。另外,从图1的显微镜图像观察到在类器官内部包含红色的成分。[0238]与此相对,使用不含il-6的增殖用培养基而得到的肝类器官(实验例2)的细胞的形态是实心的,增殖率高,但无法维持扩大培养。另外,使用不含il-6但包含烟酰胺的增殖用培养基而得到的肝类器官(实验例3和实验例4)的细胞的形态是实心的,增殖率低,无法维持扩大培养。[0239]根据表2和表3可知,使用不含il-6的分化用培养基而从实验例1的增殖性肝类器官分化的实验例5的代谢活化肝类器官的细胞的形态是空心的,虽然无法维持扩大培养,但基因水平下的代谢酶、转运子和白蛋白表达量普遍提高,是能够用于药代动力学试验的程度。另外,从图3的显微镜图像观察到在类器官内部包含推测为胆红素的黄色的成分。[0240][实验例6~实验例7]增殖性肝类器官的制造[0241]除了使用表4所示的增殖用培养基以外,使用与实验例1同样的方法制造增殖性肝类器官。对于增殖率和维持扩大培养的测定,也使用与实验例1同样的方法进行。将结果示于表4。[0242][表4][0243][0244][实验例8~实验例12]代谢活性肝类器官的制造[0245]除了使用表4所示的分化用培养基以外,使用与实验例5同样的方法制造代谢活性肝类器官。对于白蛋白表达量和cyp3a4表达量的测定,也使用与实验例5同样的方法进行。将结果示于表5。[0246][表5][0247][0248][实验例13]胶原蛋白-基质胶上的人增殖性肝类器官的制造[0249]将人原代冷冻悬浮肝细胞(bioprridic、hep187-s)在37℃的水浴中融化,在加入了无血清培养基的50ml管中悬浮并离心。应予说明,无血清培养基是在advanceddmem/f12中加入了hepes、glutamax、青霉素/链霉素的培养基。离心后,除去上清液,其后,在无血清培养基中悬浮,制备肝细胞悬浮液。从该悬浮液中将50000个的肝细胞与12.5μl的基质胶(bdbiosciences公司)和12.5μl的胶原蛋白i(新田明胶株式会社)混合,接种于48孔组织培养板,在37℃孵育5分钟~10分钟直到基质胶和胶原蛋白完全聚合为止。作为对照,准备仅使用基质胶或仅使用胶原蛋白的对照组。接下来,在基质胶和胶原蛋白i聚合后,层积上述表1所示的增殖用培养基进行培养,制造实验例13的增殖性肝类器官。[0250]如图4a~图4d所示,在使用将胶原蛋白和基质胶混合而成的ecm的情况下,可以以更多的传代次数进行培养,可见增殖性的增强。[0251]产业上的可利用性[0252]根据本实施方式的增殖性肝类器官的制造方法,可得到增殖性优异的增殖性肝类器官。根据本实施方式的代谢活化肝类器官的制造方法,可得到从上述增殖性肝类器官分化的代谢活性优异的代谢活化肝类器官。当前第1页12当前第1页12
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。