实体肿瘤治疗方法
1.相关申请的交叉引用
2.本技术是申请日为2017年4月3日、申请号为201780027094.3、标题为“实体肿瘤治疗方法”的中国发明专利申请的分案申请。
背景技术:
3.每年全世界有数百万患者被诊断患有癌症,并且每年还有数百万死于癌症或癌症相关的并发症。癌症的风险随年龄显著增加,许多癌症在发达国家更常见,并且随着发达世界的预期寿命增加,患癌率也在增加。目前的疗法包括全身治疗,例如静脉内(iv)输注注射化疗剂。然而,由于全身毒性,这些疗法通常对患者有明显的不需要的副作用。已经尝试过将化疗剂直接注射到肿瘤中,然而,化疗剂倾向于“渗漏”出肿瘤,尤其是当化疗剂溶解时。因此,需要用于治疗癌症患者的改进方法。
技术实现要素:
4.在本发明的一个方面,公开了一种治疗实体肿瘤的方法,所述方法包括给患有实体肿瘤的对象施用有效量的包含化疗剂粒子的组合物以治疗肿瘤,其中所述组合物被直接注射到肿瘤中。
5.在本发明的另一个方面,公开了一种抑制肿瘤转移的方法,所述方法包括给患有肿瘤的对象施用有效量的包含化疗剂粒子的组合物以抑制肿瘤转移。
6.在本发明的另一个方面,公开了一种混悬液,其包含化疗剂粒子、药学上可接受的载体和聚山梨醇酯。
7.在本发明的另一个方面,公开了一种药剂盒,其包含含有化疗剂粒子的第一小瓶;含有聚山梨醇酯的第二小瓶;和在施用于患者之前将所述化疗剂粒子重构成混悬液并用稀释溶液稀释所述混悬液的说明书。
8.在本发明的上下文中还公开了以下实施方式1至77:
9.实施方式1是一种治疗实体肿瘤的方法,所述方法包括给患有实体肿瘤的对象施用有效量的包含化疗剂粒子的组合物以治疗肿瘤,其中所述组合物被直接注射到肿瘤、例如恶性肿瘤中。
10.实施方式2是实施方式1的方法,其中所述组合物由化疗剂粒子和药学上可接受的载体、例如液体载体组成。
11.实施方式3是实施方式1-2中任一项的方法,其中所述施用导致化疗剂迁移到对象的淋巴系统中。
12.实施方式4是抑制肿瘤转移的方法,所述方法包括向患有恶性肿瘤的对象施用有效量的包含化疗剂粒子的组合物以抑制肿瘤转移。
13.实施方式5是实施方式4的方法,其中将所述组合物直接注射到肿瘤中,或者进行瘤周注射。
14.实施方式6是实施方式4-5中任一项的方法,其中所述组合物由化疗剂粒子和载体
(例如液体、半固体或固体载体)组成。
15.实施方式7是实施方式1-3和6中任一项的方法,其中所述载体是含水液体载体。
16.实施方式8是实施方式7的方法,其中所述含水液体载体是盐水,例如生理盐水。
17.实施方式9是实施方式1-8中任一项的方法,其中所述组合物是混悬液。
18.实施方式10是实施方式1-9中任一项的方法,其中所述粒子是(i)未包衣的;(ii)未包埋、包含、包封或囊封在固体赋形剂内;和(iii)不是含有化疗剂和赋形剂的微球、脂质体或微囊。
19.实施方式11是实施方式1-10中任一项的方法,其中所述化疗剂选自由下列组成的组:紫杉醇;紫杉醇、多西紫杉醇、卡巴他赛、紫杉烷的衍生物;埃坡西龙,长春花生物碱,例如长春碱、长春新碱、长春地辛、长春瑞滨;喜树碱类似物;表鬼臼毒素,例如顺铂、卡铂、奥沙利铂、依托泊苷和替尼泊苷;阿霉素、蒽环类药物、5-氟尿嘧啶、托泊替康、吉西他滨、过氧化物酶体增殖物激活受体(ppar)配体和抗血管生成剂,或其药学上可接受的盐。
20.实施方式12是实施方式1-11中任一项的方法,其中所述化疗剂是紫杉烷或其药学上可接受的盐。
21.实施方式13是实施方式1-12中任一项的方法,其中所述化疗剂是紫杉醇或其药学上可接受的盐。
22.实施方式14是实施方式1-13中任一项的方法,其中所述肿瘤选自由下列组成的组:肉瘤,癌瘤,和淋巴瘤,乳腺肿瘤,前列腺肿瘤,头颈肿瘤,胶质母细胞瘤,膀胱肿瘤,胰腺肿瘤,肝肿瘤,卵巢肿瘤,结直肠肿瘤,皮肤、淋巴和胃肠道肿瘤。
23.实施方式15是实施方式13的方法,其中所述肿瘤选自由卵巢、膀胱、乳腺、前列腺、肺、胰腺、皮肤、淋巴和胃肠道肿瘤组成的组。
24.实施方式16是实施方式13的方法,其中所述肿瘤选自由卵巢和膀胱肿瘤组成的组。
25.实施方式17是实施方式1-12中任一项的方法,其中所述化疗剂是多西紫杉醇或其药学上可接受的盐。
26.实施方式18是实施方式17的方法,其中所述肿瘤选自由卵巢、膀胱、乳腺和前列腺肿瘤组成的组。
27.实施方式19是实施方式17的方法,其中所述肿瘤选自由乳腺和前列腺肿瘤组成的组。
28.实施方式20是实施方式1-19中任一项的方法,其中所述化疗剂粒子包含至少95%的化疗剂,并且其中所述粒子的比表面积(ssa)为至少10m2/g,或至少12m2/g、14m2/g、16m2/g、18m2/g、20m2/g、25m2/g、30m2/g、32m2/g、34m2/g或35m2/g。
29.实施方式21是实施方式20的方法,其中所述化疗剂粒子的ssa在约10m2/g和50m2/g之间。
30.实施方式22是实施方式20-21中任一项的方法,其中所述化疗剂粒子的ssa为:
31.(a)16m2/g和31m2/g之间或32m2/g和50m2/g之间;
32.(b)16m2/g和30m2/g之间或32m2/g和50m2/g之间;
33.(c)16m2/g和29m2/g之间或32m2/g和50m2/g之间;
34.(d)17m2/g和31m2/g之间或32m2/g和50m2/g之间;
35.(e)17m2/g和30m2/g之间或32m2/g和50m2/g之间;
36.(f)17m2/g和29m2/g之间或32m2/g和50m2/g之间;
37.(g)16m2/g和31m2/g之间或33m2/g和50m2/g之间;
38.(h)16m2/g和30m2/g之间或33m2/g和50m2/g之间;
39.(i)16m2/g和29m2/g之间或33m2/g和50m2/g之间;
40.(j)17m2/g和31m2/g之间或33m2/g和50m2/g之间;
41.(k)17m2/g和30m2/g之间或33m2/g和50m2/g之间;
42.(l)17m2/g和29m2/g之间或33m2/g和50m2/g之间;
43.(m)16m2/g和31m2/g之间,或≥32m2/g;
44.(h)17m2/g和31m2/g之间,或≥32m2/g;
45.(i)16m2/g和30m2/g之间,或≥32m2/g;
46.(j)17m2/g和30m2/g之间,或≥32m2/g;
47.(k)16m2/g和29m2/g之间,或≥32m2/g;
48.(l)17m2/g和29m2/g之间,或≥32m2/g;
49.(m)16m2/g和31m2/g之间,或≥33m2/g;
50.(n)17m2/g和31m2/g之间,或≥33m2/g;
51.(o)16m2/g和30m2/g之间,或≥33m2/g;
52.(p)17m2/g和30m2/g之间,或≥33m2/g;
53.(q)16m2/g和29m2/g之间,或≥33m2/g;或
54.(r)17m2/g和29m2/g之间,或≥33m2/g。
55.实施方式23是实施方式20-22中任一项的方法,其中所述化疗剂是紫杉醇或其药学上可接受的盐。
56.实施方式24是实施方式20-22中任一项的方法,其中所述化疗剂是多西紫杉醇或其药学上可接受的盐。
57.实施方式25是实施方式1-24中任一项的方法,其中所述化疗剂粒子包含至少95重量%的紫杉烷或其药学上可接受的盐,其中所述粒子具有一种或两种以下特征:
58.(i)平均堆积密度在约0.050g/cm3和约0.15g/cm3之间,和/或
59.(ii)比表面积(ssa)为至少18m2/g、20m2/g、25m2/g、30m2/g、32m2/g、34m2/g或35m2/g。
60.实施方式26是实施方式25的方法,其中所述紫杉烷选自由紫杉醇、多西紫杉醇、卡巴他赛、紫杉二烯、巴卡丁iii、taxchinin a、brevifoliol和taxuspine d、或其药学上可接受的盐组成的组。
61.实施方式27是实施方式25的方法,其中所述紫杉烷选自由紫杉醇、多西紫杉醇和卡巴他赛、或其药学上可接受的盐组成的组。
62.实施方式28是实施方式27的方法,其中所述紫杉烷是紫杉醇或其药学上可接受的盐,并且其中所述粒子的平均堆积密度在约0.050g/cm3和约0.12g/cm3之间,或约0.060g/cm3和约0.11g/cm3之间。
63.实施方式29是实施方式27或28的方法,其中所述紫杉烷是紫杉醇或其药学上可接受的盐,并且其中所述紫杉醇粒子的比表面积(ssa)为至少18m2/g、20m2/g、25m2/g、30m2/g、
32m2/g、34m2/g或35m2/g。
64.实施方式30是实施方式27-29中任一项的方法,其中所述紫杉烷是紫杉醇或其药学上可接受的盐,并且其中所述紫杉醇粒子的ssa在约22m2/g和约40m2/g、25m2/g和约40m2/g、30m2/g和约40m2/g之间,或约35m2/g和约40m2/g之间。
65.实施方式31是实施方式28-30中任一项的方法,其中所述紫杉醇粒子的堆积密度在约0.060g/cm3和约0.11g/cm3之间并且ssa在约22m2/g和约40m2/g之间。
66.实施方式32是实施方式28-31中任一项的方法,其中在以75rpm运行的usp ii桨叶设备中,在37℃和ph 7.0下,至少40%(w/w)的紫杉醇在30分钟或更短时间内溶解在50%甲醇/50%水(v/v)的溶液中。
67.实施方式33是实施方式27的方法,其中所述紫杉烷是多西紫杉醇或其药学上可接受的盐,并且其中所述粒子的平均堆积密度在约0.050g/cm3和约0.12g/cm3之间或约0.06g/cm3和约0.1g/cm3之间。
68.实施方式34是实施方式27或33的方法,其中所述紫杉烷是多西紫杉醇或其药学上可接受的盐,并且其中所述多西紫杉醇粒子的ssa为至少18m2/g、20m2/g、25m2/g、30m2/g、35m2/g、40m2/g或42m2/g。
69.实施方式35是实施方式27或33-34的方法,其中所述紫杉烷是多西紫杉醇或其药学上可接受的盐,并且其中所述多西紫杉醇粒子的ssa在约40m2/g和约50m2/g之间、或约43m2/g和约46m2/g之间。
70.实施方式36是实施方式33-35中任一项的方法,其中所述多西紫杉醇粒子的堆积密度在约0.06g/cm3和约0.1g/cm3之间并且ssa在约40m2/g和约50m2/g之间。
71.实施方式37是实施方式33-36中任一项的方法,其中在以75rpm运行的usp ii桨叶设备中,在37℃和ph 7.0下,至少20%(w/w)的多西紫杉醇在30分钟或更短时间内溶解在15%甲醇/85%水(v/v)的溶液中。
72.实施方式38是实施方式1-22中任一项的方法,其中所述化疗剂粒子包含至少95重量%的紫杉醇或其药学上可接受的盐,其中所述粒子的比表面积(ssa)为至少12m2/g。
73.实施方式39是实施方式38的方法,其中所述紫杉醇粒子的ssa为至少12m2/g、15m2/g、20m2/g、25m2/g、30m2/g、32m2/g、34m2/g或35m2/g。
74.实施方式40是实施方式38-39中任一项的方法,其中在以75rpm运行的usp ii桨叶设备中,在37℃和ph 7.0下,至少40%(w/w)的紫杉醇在30分钟或更短时间内溶解在50%甲醇/50%水(v/v)的溶液中。
75.实施方式41是实施方式1-22中任一项的方法,其中所述化疗剂粒子包含至少95重量%的紫杉醇,其中在以75rpm运行的usp ii桨叶设备中,在37℃和ph 7.0下,至少40%(w/w)的紫杉醇在30分钟或更短时间内溶解在50%甲醇/50%水(v/v)的溶液中。
76.实施方式42是实施方式1-22中任一项的方法,其中所述化疗剂粒子包含至少95重量%的多西紫杉醇,其中在以75rpm运行的usp ii桨叶设备中,在37℃和ph 7.0下,至少20%(w/w)的紫杉醇在30分钟或更短时间内溶解在15%甲醇/85%水(v/v)的溶液中。
77.实施方式43是实施方式1-42中任一项的方法,其中所述粒子的平均粒径数在约0.4μm和约1.2μm之间,或约0.6μm和约1.0μm之间。
78.实施方式44是实施方式1-43中任一项的方法,其中所述粒子是未包衣的,并且所
述组合物不包含聚合物、蛋白质、聚乙氧基化蓖麻油、和/或由甘油单、二和三酯与聚乙二醇单和二酯构成的聚乙二醇甘油酯。
79.实施方式45是实施方式1-42中任一项的方法,其中所述化疗剂粒子存在于混悬液中,所述混悬液还包含药学上可接受的含水载体。
80.实施方式46是实施方式1-45中任一项的方法,其中所述粒子包含至少96%、97%、98%、99%或100%的所述化合物。
81.实施方式47是实施方式1-46中任一项的方法,其中所述化疗剂粒子存在于混悬液中,所述混悬液还包含聚山梨醇酯,例如聚山梨醇酯80,其中所述聚山梨醇酯存在于所述混悬液中的浓度在约0.01%v/v和约1.5%v/v之间,或约0.01%v/v和约1%v/v、约0.01%v/v和约0.5%v/v、约0.01%v/v和约0.4%v/v、约0.01%v/v和约0.25%v/v、约0.05%v/v和约0.5%v/v、约0.05%v/v和约0.25%v/v、约0.1%v/v和约0.5%v/v、约0.1%v/v和约0.25%v/v之间,约0.1%v/v,约0.16v/v,或约0.25%v/v。
82.实施方式48是实施方式47的方法,其中所述化疗剂存在于所述混悬液中的浓度在约1mg/ml和约40mg/ml、或约6mg/ml和约20mg/ml之间。
83.实施方式49是实施方式48的方法,其中所述化疗剂粒子包含紫杉醇或其药学上可接受的盐,其中紫杉醇存在于所述混悬液中的浓度在约1mg/ml和约40mg/ml、或约6mg/ml和约20mg/ml之间。
84.实施方式50是实施方式48的方法,其中所述化疗剂粒子包含多西紫杉醇或其药学上可接受的盐,其中所述多西紫杉醇存在于所述混悬液中的浓度在约1mg/ml和约40mg/ml、或约6mg/ml和约20mg/ml之间。
85.实施方式51是混悬液,其包含:
86.(a)化疗剂粒子;
87.(b)药学上可接受的载体;和
88.(c)聚山梨醇酯,其中所述聚山梨醇酯存在于所述混悬液中的浓度在约0.01%v/v和约1.5%v/v之间,或约0.01%v/v和约1%v/v、约0.01%v/v和约0.5%v/v、约0.01%v/v和约0.4%v/v、约0.01%v/v和约0.25%v/v、约0.05%v/v和约0.5%v/v、约0.05%v/v和约0.25%v/v、约0.1%v/v和约0.5%v/v、约0.1%v/v和约0.25%v/v之间,约0.1%v/v,约0.16v/v,或约0.25%v/v。
89.实施方式52是药剂盒,其包含:
90.(a)含有化疗剂粒子的第一小瓶;
91.(b)含有聚山梨醇酯和药学上可接受的载体的第二小瓶;
92.(c)在施用于患者之前通过合并第一小瓶和第二小瓶的内容物将所述化疗剂粒子重构成混悬液以及用稀释溶液例如0.9%盐水溶液稀释所述混悬液的说明书。
93.实施方式53是实施方式51的混悬液或实施方式52的药剂盒,其中所述化疗剂粒子选自由下列组成的组:紫杉醇;紫杉醇、多西紫杉醇、卡巴他赛、紫杉烷的衍生物;埃坡西龙,长春花生物碱,例如长春碱、长春新碱、长春地辛、长春瑞滨;喜树碱类似物;表鬼臼毒素,例如顺铂、卡铂、奥沙利铂、依托泊苷和替尼泊苷;阿霉素、蒽环类药物、5-氟尿嘧啶、托泊替康、吉西他滨、过氧化物酶体增殖物激活受体(ppar)配体和抗血管生成剂,或其药学上可接受的盐。
94.实施方式54是实施方式51-53中任一项的混悬液或药剂盒,其中所述化疗剂是紫杉烷或其药学上可接受的盐。
95.实施方式55是实施方式51-54中任一项的混悬液或药剂盒,其中所述化疗剂是紫杉醇或其药学上可接受的盐。
96.实施方式56是实施方式51-54中任一项的混悬液或药剂盒,其中所述化疗剂是多西紫杉醇或其药学上可接受的盐。
97.实施方式57是实施方式51和53-56中任一项的方法,其中所述化疗剂存在于所述混悬液中的浓度在约1mg/ml和约40mg/ml、或约6mg/ml和约20mg/ml之间。
98.实施方式58是实施方式51-57中任一项的混悬液或药剂盒,其中所述化疗剂粒子包含至少95%的化疗剂,并且其中所述粒子的比表面积(ssa)为至少10m2/g,或至少12m2/g、14m2/g、16m2/g、18m2/g、20m2/g、25m2/g、30m2/g、32m2/g、34m2/g、或35m2/g。
99.实施方式59是实施方式51-58中任一项的混悬液或药剂盒,其中所述化疗剂粒子的ssa在约10m2/g和50m2/g之间。
100.实施方式60是实施方式51-59中任一项的混悬液或药剂盒,其中所述化疗剂粒子的ssa为:
101.(a)16m2/g和31m2/g之间或32m2/g和50m2/g之间;
102.(b)16m2/g和30m2/g之间或32m2/g和50m2/g之间;
103.(c)16m2/g和29m2/g之间或32m2/g和50m2/g之间;
104.(d)17m2/g和31m2/g之间或32m2/g和50m2/g之间;
105.(e)17m2/g和30m2/g之间或32m2/g和50m2/g之间;
106.(f)17m2/g和29m2/g之间或32m2/g和50m2/g之间;
107.(g)16m2/g和31m2/g之间或33m2/g和50m2/g之间;
108.(h)16m2/g和30m2/g之间或33m2/g和50m2/g之间;
109.(i)16m2/g和29m2/g之间或33m2/g和50m2/g之间;
110.(j)17m2/g和31m2/g之间或33m2/g和50m2/g之间;
111.(k)17m2/g和30m2/g之间或33m2/g和50m2/g之间;
112.(l)17m2/g和29m2/g之间或33m2/g和50m2/g之间;
113.(m)16m2/g和31m2/g之间,或≥32m2/g;
114.(h)17m2/g和31m2/g之间,或≥32m2/g;
115.(i)16m2/g和30m2/g之间,或≥32m2/g;
116.(j)17m2/g和30m2/g之间,或≥32m2/g;
117.(k)16m2/g和29m2/g之间,或≥32m2/g;
118.(l)17m2/g和29m2/g之间,或≥32m2/g;
119.(m)16m2/g和31m2/g之间,或≥33m2/g;
120.(n)17m2/g和31m2/g之间,或≥33m2/g;
121.(o)16m2/g和30m2/g之间,或≥33m2/g;
122.(p)17m2/g和30m2/g之间,或≥33m2/g;
123.(q)16m2/g和29m2/g之间,或≥33m2/g;或
124.(r)17m2/g和29m2/g之间,或≥33m2/g。
125.实施方式61是实施方式51-60中任一项的混悬液或药剂盒,其中所述化疗剂粒子包含至少95重量%的紫杉烷或其药学上可接受的盐,其中所述粒子具有一种或两种以下特征:
126.(i)平均堆积密度在约0.050g/cm3和约0.15g/cm3之间,和/或
127.(ii)比表面积(ssa)为至少18m2/g、20m2/g、25m2/g、30m2/g、32m2/g、34m2/g或35m2/g。
128.实施方式62是实施方式51-55和57-61中任一项的混悬液或药剂盒,其中所述紫杉烷是紫杉醇或其药学上可接受的盐,并且其中所述粒子的平均堆积密度在约0.050g/cm3和约0.12g/cm3之间,或约0.060g/cm3和约0.11g/cm3之间。
129.实施方式63是实施方式51-55和57-62中任一项的混悬液或药剂盒,其中所述紫杉烷是紫杉醇或其药学上可接受的盐,并且其中所述紫杉醇粒子的比表面积(ssa)为至少12m2/g、18m2/g、20m2/g、25m2/g、30m2/g、32m2/g、34m2/g、或35m2/g。
130.实施方式64是实施方式51-55和57-63中任一项的混悬液或药剂盒,其中所述紫杉烷是紫杉醇或其药学上可接受的盐,并且其中所述紫杉醇粒子的ssa在约22m2/g和约40m2/g、25m2/g和约40m2/g、30m2/g和约40m2/g之间,或约35m2/g和约40m2/g之间。
131.实施方式65是实施方式51-55和57-64中任一项的混悬液或药剂盒,其中所述紫杉醇粒子的堆积密度在约0.060g/cm3和约0.11g/cm3之间并且ssa在约22m2/g和约40m2/g之间。
132.实施方式66是实施方式51-55和57-65中任一项的混悬液或药剂盒,其中在以75rpm运行的usp ii桨叶设备中,在37℃和ph 7.0下,至少40%(w/w)的紫杉醇在30分钟或更短时间内溶解在50%甲醇/50%水(v/v)的溶液中。
133.实施方式67是实施方式51-54和56-61中任一项的混悬液或药剂盒,其中所述紫杉烷是多西紫杉醇或其药学上可接受的盐,并且其中所述粒子的平均堆积密度在约0.050g/cm3和约0.12g/cm3之间或约0.06g/cm3和约0.1g/cm3之间。
134.实施方式68是实施方式51-54、56-61和67中任一项的混悬液或药剂盒,其中所述紫杉烷是多西紫杉醇或其药学上可接受的盐,并且其中所述多西紫杉醇粒子的ssa为至少18m2/g、20m2/g、25m2/g、30m2/g、35m2/g、40m2/g或42m2/g。
135.实施方式69是实施方式51-54、56-61和67-68中任一项的混悬液或药剂盒,其中所述紫杉烷是多西紫杉醇或其药学上可接受的盐,并且其中所述多西紫杉醇粒子的ssa在约40m2/g和约50m2/g之间、或约43m2/g和约46m2/g之间。
136.实施方式70是实施方式51-54、56-61和67-69中任一项的混悬液或药剂盒,其中所述多西紫杉醇粒子的堆积密度在约0.06g/cm3和约0.1g/cm3之间并且ssa在约40m2/g和约50m2/g之间。
137.实施方式71是实施方式51-54、56-61和67-70中任一项的混悬液或药剂盒,其中在以75rpm运行的usp ii桨叶设备中,在37℃和ph 7.0下,至少20%(w/w)的多西紫杉醇在30分钟或更短时间内溶解在15%甲醇/85%水(v/v)的溶液中。
138.实施方式72是实施方式51-71中任一项的混悬液或药剂盒,其中所述粒子的平均粒径数在约0.4μm和约1.2μm之间,或约0.6μm和约1.0μm之间。
139.实施方式73是实施方式51-72中任一项的混悬液或药剂盒,其中所述粒子是未包
衣的,并且所述混悬液或药剂盒不包含聚合物、蛋白质、聚乙氧基化蓖麻油、和/或由甘油单、二和三酯与聚乙二醇单和二酯构成的聚乙二醇甘油酯。
140.实施方式74是实施方式51-73中任一项的混悬液或药剂盒,其中所述药学上可接受的载体是盐水,例如0.9%氯化钠溶液。
141.实施方式75是实施方式51-74中任一项的混悬液或药剂盒,其中所述聚山梨醇酯是聚山梨醇酯80。
142.实施方式76是实施方式52-75中任一项的药剂盒,其中所述第一小瓶和第二小瓶的内容物是无菌的。
143.实施方式77是实施方式1-76中任一项的方法、混悬液或药剂盒,其中所述化疗剂粒子是非团聚的单个粒子。
附图说明
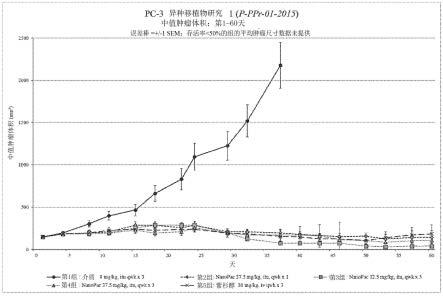
144.图1.在用介质和紫杉醇粒子直接肿瘤注射(itu)处理的小鼠中pc3人前列腺癌的中位肿瘤体积(研究p-ppr-01-2015)。
145.图2.用介质、nanodoce
tm
、nanopac
tm it处理和用多西紫杉醇iv处理的小鼠pc-3前列腺肿瘤异种移植物的中位肿瘤体积(研究pd-ppr-02-2016)。
146.图3.用介质、nanodoce
tm
、nanopac
tm it处理和用多西紫杉醇或紫杉醇iv处理的小鼠mda-mb-231异种移植物的中位肿瘤体积(研究pd-pb-04-2016)。
147.图4.用介质、nanodoce
tm
、nanopac
tm it处理和用多西紫杉醇或紫杉醇iv处理的小鼠mx-1异种移植物的中位肿瘤体积(研究p-pb-03-2016)。
具体实施方式
148.用在本文中时,除非上下文另有明确规定,否则不带数量指示的指称物也包括多个指称物。除非另有明确说明,否则“和”用于本文中时可与“或”互换使用。
149.用于本文中时,“约”是指所叙述的测量单位的 /-百分之五(5%)。
150.除非上下文另有明确规定,否则本发明的任何方面的所有实施方式均可组合使用。
151.除非上下文另有明确要求,否则在整个说明和权利要求书中,单词
‘
包含’等应以包括性意义而不是排他或穷举的意义解释;就是说,以“包括但不限于”的意义。采用单数或复数的单词也分别包括复数和单数。另外,当在本技术中使用时,单词“在本文中”、“上文”和“下文”以及类似含义的单词应该是指作为整体上的本技术而不是本技术的任何特定部分。组合物及其使用方法可以“包含”在整个说明书中公开的任何成分或步骤、“基本上由其组成”或“由其组成”。关于短语“基本上由...组成”,本发明组合物的基本和新颖性质是它们能够通过直接注射未包衣(纯粹)化疗剂粒子来治疗实性肿瘤。这可以在不使用包衣材料、囊封材料和其他药物递送助剂下实现。
152.本公开实施方式的描述不意欲穷举或将本公开限制到所公开的精确形式。虽然本文中出于说明性目的描述了本公开的具体实施方式和实施例,但是如相关领域的技术人员将认识到的,在本公开的范围内可能有各种等效修改。
153.在一个方面,本发明提供了治疗实体肿瘤的方法,所述方法包括给患有实体肿瘤
的对象施用有效量的包含化疗剂粒子的组合物以治疗肿瘤,其中所述组合物被直接注射到肿瘤中。本发明人意外地发现,根据本发明的方法施用的化疗剂粒子可以在肿瘤中以很高的水平蓄积很长一段时间,而所述化疗剂粒子几乎不会渗漏到不需要的位置。如本领域技术人员将理解的,直接施用到肿瘤中的游离药物不会充分保留在肿瘤中以进入肿瘤细胞来获得最佳治疗效益。因此,本发明的方法提供了超越现有技术方法的明显改进。所述化疗剂粒子与通过典型程序制备的化疗剂粒子相比,表现出高得多的表面积。这使得注射到肿瘤中的所述粒子太大而不能被体循环带走,可是比传统粒子快得多地释放化疗剂。
154.用于本文中时,“化疗剂粒子”是基本上由直径在0.1μm和5μm之间的化疗剂组成(即,至少95%、96%、97%、98%、99%或100%化疗剂)的粒子。化疗剂粒子不同于“含有化疗剂的粒子”,后者是含有化疗剂和至少一种添加的赋形剂的粒子。本发明的化疗剂粒子是未包衣的,并且没有包埋、包含、包封或囊封在固体赋形剂内。然而,本发明的化疗剂粒子可以含有通常在制备所述化疗剂期间发现的杂质和副产物。即便如此,化疗剂粒子仍包含至少95%、至少96%、至少97%、至少98%、至少99%或100%的化疗剂,意味着化疗剂粒子由基本上纯的化疗剂组成或基本由其组成。
155.在其他实施方式中,化疗剂粒子的直径大于0.2μm或0.3μm。在另一个实施方式中,化疗剂粒子的直径为至少0.4μm。在进一步的实施方式中,化疗剂粒子的直径在0.4μm和2μm之间,或直径在0.5μm和1.5μm之间,或直径在0.2μm和1μm之间,或直径在0.2μm至小于1μm之间。在进一步的实施方式中,化疗剂粒子的平均粒径数可在以下范围之间:约0.4μm至约5μm,约0.4μm至约3μm,约0.5μm至约1.4μm,约0.4μm至约0.8μm,约0.4μm至约0.7μm,或约0.5μm至约0.7μm。在一个进一步的实施方式中,化疗剂或紫杉醇粒子的平均粒径数在约0.4μm和约1.2μm之间,或约0.6μm和约1.0μm之间。在另一个实施方式中,化疗剂或紫杉醇粒子的平均粒径数为0.6μm和0.861μm之间,或约0.5μm至约0.7μm之间,或约0.2μm至约1μm之间,或约0.2μm至小于1μm之间,或约0.3μm至约1μm之间,或约0.3μm至小于1μm之间,或约0.4μm至约1μm之间,或约0.4μm至小于1μm之间。
156.用于制造粒径小至0.1至5μm的化合物的各种方法在美国专利no.5,833,891、6,113,795、8,221,779和wo2016/197091中公开,这些文献通过引用以其整体并入本文。
157.用于本文中时,“实体肿瘤”是一种通常不含囊肿或液体区域的异常组织块。实体肿瘤可以是良性的(不是癌症)或恶性的(癌症)。不同类型的实体肿瘤以形成它们的细胞类型命名。实体肿瘤的例子是肉瘤、癌瘤和淋巴瘤。在一个特定的实施方式中,实体肿瘤是恶性实体肿瘤。
158.用于本文中时,“直接注射到肿瘤中”是指将所述组合物、例如混悬液的一些或全部注射到肿瘤块中。如本领域技术人员将理解的,这样的直接注射可包括注射所述组合物、例如混悬液的一些部分,例如在实体肿瘤的周围(“瘤周”)用药,比如如果组合物或其混悬液的量太大而不能全部直接注射到实体肿瘤块中的话。在一个实施方式中,将所述组合物或其混悬液整体注射到实体肿瘤块中。用于本文中时,肿瘤包括肿瘤块和肿瘤转移瘤二者,包括但不限于骨和软组织转移瘤。
159.用于本文中时,“治疗”是指实现以下一或多项:(a)降低肿瘤尺寸;(b)降低肿瘤生长;(c)降低或限制转移瘤的发展和/或扩散;(d)降低或限制化疗治疗的一种或多种副作用的发展。
160.化疗治疗的副作用包括但不限于贫血、中性粒细胞减少、血小板减少、神经毒性、食欲减退、便秘、腹泻、脱发、疲劳、恶心/呕吐、和疼痛。
161.在一个实施方式中,治疗肿瘤包括抑制肿瘤转移。“抑制”肿瘤细胞转移可包括与未治疗相比的任何抑制量。在各种非限制性实施方式中,所述方法可包括与对照(例如未治疗)相比,抑制肿瘤细胞转移的发展、或将现有肿瘤转移瘤减少5%、10%、25%、50%;100%或更多。
162.在另一个方面,本发明提供抑制肿瘤转移的方法,所述方法包括给患有肿瘤的对象施用有效量的包含化疗剂粒子的组合物以抑制肿瘤转移。
163.本发明人意外地发现,给对象施用的本文所述的化疗剂给迁移到对象的淋巴系统中并保留在淋巴系统内。如本领域技术人员将理解的,肿瘤的循环血液非常丰富,并且直接施用到肿瘤中的游离药物未充分保留在肿瘤内以进入肿瘤细胞中来获得最佳治疗效益。在被称为转移的过程中,肿瘤内的恶性细胞通过血液系统、淋巴系统扩散到淋巴结,通过腹膜腔液体内的癌细胞迁移,并到达远处部位。因此,本发明的方法可用于抑制转移。在这方面,所述化疗剂粒子可以经由直接注射、腹膜内注射、瘤周注射或其他合适的给药途径施用。
[0164]“抑制”肿瘤细胞转移可包括与未治疗相比的任何抑制量。在各种非限制性实施方式中,所述方法可包括与对照(例如未治疗)相比,抑制肿瘤细胞转移的发展、或将现有肿瘤转移瘤减少5%、10%、25%、50%;100%或更多。
[0165]
在各种实施方式中,化疗剂选自由下列组成的组:紫杉烷(紫杉醇,紫杉醇、多西紫杉醇、卡巴他赛等的衍生物),埃坡西龙,长春花生物碱例如长春碱、长春新碱、长春地辛、长春瑞滨;喜树碱类似物;表鬼臼毒素,例如顺铂、卡铂、奥沙利铂、依托泊苷和替尼泊苷;阿霉素,蒽环类药物,5-氟尿嘧啶,托泊替康,吉西他滨,过氧化物酶体增殖物激活受体(ppar)配体,和抗血管生成剂。
[0166]
在各种实施方式中,实体肿瘤选自下列组成的组:肉瘤,癌瘤,和淋巴瘤,乳腺肿瘤,前列腺肿瘤,头颈肿瘤,胶质母细胞瘤,膀胱肿瘤,胰腺肿瘤,肝肿瘤,卵巢肿瘤,结直肠肿瘤,肺、皮肤、淋巴和胃肠道肿瘤。在一个具体实施方式中,实体肿瘤是前列腺肿瘤并且化疗剂粒子是紫杉醇或多西紫杉醇粒子。在另一个具体实施方式中,实体肿瘤是卵巢肿瘤并且化疗剂粒子是紫杉醇或多西紫杉醇粒子。在另一个具体实施方式中,实体肿瘤是乳腺肿瘤并且化疗剂粒子是多西紫杉醇粒子。在另一个具体实施方式中,实体肿瘤是胰腺肿瘤并且化疗剂粒子是紫杉醇或多西紫杉醇粒子。在任何这些实施方式中,肿瘤可以是,例如,腺癌。
[0167]
使用如下所述用于制造化疗剂粒子的新方法,本发明人出乎意料地能够制造平均堆积密度在约0.050g/cm3和约0.15g/cm3之间和比表面积(ssa)为至少18m2/g的所述粒子,例如紫杉烷粒子。如后文的实施例所示,与原始紫杉烷和用于比较的磨制紫杉烷产品相比,所述紫杉烷粒子的比表面积增加和堆积密度降低导致溶解速率显著增加。溶解仅在固/液界面处发生。因此,由于与溶解介质接触的粒子的表面上分子数量较多,所以比表面积增加将增加溶解速率。堆积密度要考虑粉末的宏观结构和粒子间空间。对堆积密度有贡献的参数包括粒径分布、粒子形状和粒子彼此的亲和力(即,附聚)。粉末堆积密度越低产生溶解速率越快。这是由于溶解介质更容易穿透间隙或粒子间空间并且与粒子表面更大接触的能力。因此,与未加工的或原始的材料以及用于比较的磨制紫杉烷产品相比,比表面积增加和
堆积密度降低中的每一个都导致本发明的紫杉烷粒子溶解速率显著增加。这为本发明的紫杉烷粒子在例如肿瘤治疗中应用提供了显著的改进。
[0168]
因此,在另一个实施方式中,所述化疗剂粒子的比表面积(ssa)为至少10m2/g、或至少12m2/g、14m2/g、16m2/g、18m2/g、20m2/g、25m2/g、30m2/g、32m2/g、34m2/g、或35m2/g。在一个实施方式中,所述化疗剂粒子的ssa在约10m2/g和约50m2/g之间。
[0169]
在这些实施方式中,优选所述化疗剂粒子是紫杉烷粒子。紫杉烷是一类含有紫杉二烯核的二萜类,它们的水溶性很差。本发明的紫杉烷粒子可以是任何合适的紫杉烷,包括但不限于紫杉醇、多西紫杉醇、卡巴他赛、紫杉二烯、巴卡丁iii、taxchinin a、brevifoliol和taxuspine d、其组合、或其药学上可接受的盐。在一个实施方式中,紫杉烷选自由紫杉醇、多西紫杉醇和卡巴他赛、或其药学上可接受的盐组成的组。在本发明的各种实施方式中,紫杉烷粒子是未包衣的(纯粹的)单个粒子;紫杉烷粒子未与任何物质结合或缀合;没有物质被吸收或吸附在紫杉烷粒子的表面上;紫杉烷粒子未囊封在任何物质中;紫杉烷粒子未被任何物质包被;紫杉烷粒子不是紫杉烷的微状液、纳米乳液、微球或脂质体;和/或紫杉烷粒子未被单体、聚合物(或生物相容性聚合物)、蛋白质、表面活性剂或白蛋白结合、附着、囊封或包被。在一些实施方式中,紫杉烷粒子的表面上未吸收或吸附单体、聚合物(或生物相容性聚合物)、共聚物、蛋白质、表面活性剂或白蛋白。在一些实施方式中,所述组合物没有/不包含或含有聚合物/共聚物或生物相容性聚合物/共聚物。在一些实施方式中,所述组合物没有/不包含或含有蛋白质。在本发明的一些方面中,所述组合物没有/不包含或含有白蛋白。在本发明的一些方面中,所述组合物没有/不包含或含有透明质酸。在本发明的一些方面中,所述组合物没有/不包含或含有透明质酸和紫杉烷的缀合物。在本发明的一些方面中,所述组合物没有/不包含或含有透明质酸和紫杉醇的缀合物。在本发明的一些方面中,所述组合物没有/不包含或含有泊洛沙姆、聚阴离子、聚阳离子、改性聚阴离子、改性聚阳离子、壳聚糖、壳聚糖衍生物、金属离子、纳米载体、聚γ-谷氨酸(pga)、聚丙烯酸(paa)、藻酸(alg)、维生素e-tpgs、二甲基异山梨糖醇(dmi)、甲氧基peg 350、柠檬酸、抗vegf抗体、乙基纤维素、聚苯乙烯、聚酸酐、多羟基酸、聚磷腈、聚原酸酯、聚酯、聚酰胺、多糖、多蛋白、苯乙烯-异丁烯-苯乙烯(sibs)、聚酸酐共聚物、聚己内酯、聚乙二醇(peg)、聚(双(对羧基苯氧基)丙烷-癸二酸、聚(d,l-乳酸)(pla)、聚(d.l-乳酸-共-羟基乙酸)(plaga)、和/或聚(d,l乳酸-共-羟基乙酸)(plga)。
[0170]
在一个这样的实施方式中,所述化疗剂粒子包含至少95重量%的紫杉烷或其药学上可接受的盐,其中所述粒子具有一种或两种以下特征:
[0171]
(i)平均堆积密度在约0.050g/cm3和约0.15g/cm3之间,和/或
[0172]
(ii)比表面积(ssa)为至少18m2/g、20m2/g、25m2/g、30m2/g、32m2/g、34m2/g或35m2/g。
[0173]
用于本文中时,“比表面积”是通过brunauer-emmett-teller(“bet”)等温线(即:bet ssa)测量的每单位紫杉烷质量的紫杉烷粒子的总表面积。如本领域技术人员将理解的,“紫杉烷粒子”可以包括附聚的紫杉烷粒子和非附聚的紫杉烷粒子;由于ssa是以每克为基准测定的,因此它考虑了组合物中附聚和非附聚这两种紫杉烷粒子。bet比表面积测试程序是在美国药典和欧洲药典二者中包含的药典方法。
[0174]
用于本文中时,紫杉烷粒子的堆积密度是所述组合物中粒子总量的质量除以它们
在倒入量筒中、但不轻敲量筒时占据的总体积。所述总体积包括粒子体积、粒子间空隙体积和内部孔隙体积。
[0175]
在一个实施方式中,紫杉烷是紫杉醇或其药学上可接受的盐,并且粒子的平均堆积密度在约0.050g/cm3和约0.12g/cm3之间。在另一个实施方式中,紫杉烷粒子的平均堆积密度在约0.060g/cm3和约0.11g/cm3之间。在一些实施方式中,化疗剂和紫杉烷粒子是非附聚的单个粒子,而不是多个化疗剂粒子的簇。
[0176]
在一个进一步的实施方式中,紫杉烷是紫杉醇或其药学上可接受的盐,并且紫杉醇粒子的比表面积(ssa)为至少12m2/g。在各种实施方式中,紫杉醇粒子的ssa为至少12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、或至少40m2/g。在各种进一步的实施方式中,紫杉醇粒子的ssa在约12m2/g和约40m2/g之间,约14m2/g和约40m2/g之间,约15m2/g和约40m2/g之间,约16m2/g和约40m2/g之间,约17m2/g和约40m2/g之间,约18m2/g和约40m2/g之间,约19m2/g和约40m2/g之间,约20m2/g和约40m2/g之间,约22m2/g和约40m2/g之间,约25m2/g和约40m2/g之间,约26m2/g和约40m2/g之间,约30m2/g和约40m2/g之间,约35m2/g和约40m2/g之间,约20m2/g和约29m2/g之间,约20m2/g和约28m2/g之间,约20m2/g和约26.2m2/g之间,约22m2/g和约29m2/g之间,约22m2/g和约28m2/g之间,约22m2/g和约26.2m2/g之间,约32m2/g和约40m2/g之间,约32m2/g和约38m2/g,或约32m2/g和约36m2/g之间。
[0177]
在一个优选的实施方式中,紫杉醇粒子的平均堆积密度在约0.050g/cm3和约0.12g/cm3之间并且ssa为至少30m2/g。在另一个优选的实施方式中,紫杉醇粒子的平均堆积密度在约0.050g/cm3和约0.12g/cm3之间并且ssa为至少35m2/g。在一个实施方式中,紫杉醇粒子的平均堆积密度在约0.050g/cm3和约0.12g/cm3之间并且ssa在约30m2/g和约40m2/g之间。在另一个优选实施方式中,紫杉醇粒子的平均堆积密度在约0.060g/cm3和约0.11g/cm3之间并且ssa在约30m2/g和约40m2/g之间。在另一个优选的实施方式中,紫杉醇粒子的平均堆积密度在约0.060g/cm3和约0.11g/cm3之间并且ssa为至少30m2/g。在一个进一步的实施方式中,紫杉醇粒子的平均堆积密度在约0.060g/cm3和约0.11g/cm3之间并且ssa为至少35m2/g。这些各种实施方式在后面的实施例中举例说明。
[0178]
在任何这些各种实施方式中,紫杉醇粒子可以包含每紫杉醇粒子至少4.16x10-13
克紫杉醇或其药学上可接受的盐。
[0179]
在另一个实施方式中,在以75rpm运行的usp ii桨叶设备中,所述组合物的紫杉醇粒子中至少40%(w/w)的紫杉醇在30分钟或更短时间内溶解在50%甲醇/50%水(v/v)的溶液中。使用ph 7,紫杉烷的溶解度不受ph影响。在另一个实施方式中,所述溶解研究在37℃下进行。
[0180]
在另一个实施方式中,紫杉烷是多西紫杉醇或其药学上可接受的盐,并且多西紫杉醇粒子的平均堆积密度在约0.050g/cm3和约0.12g/cm3之间。在一个进一步的实施方式中,多西紫杉醇粒子的平均堆积密度在约0.06g/cm3和约0.1g/cm3之间。
[0181]
在另一个实施方式中,紫杉烷是多西紫杉醇或其药学上可接受的盐,并且其中多西紫杉醇粒子的ssa为至少18m2/g。在各种进一步的实施方式中,多西紫杉醇粒子的ssa为至少20m2/g、25m2/g、30m2/g、35m2/g、40m2/g、或42m2/g。在一个进一步的实施方式中,多西紫杉醇粒子的ssa在约40m2/g和约50m2/g之间。在另一个实施方式中,多西紫杉醇粒子的ssa在
约43m2/g和约46m2/g之间。
[0182]
在一个优选的实施方式中,多西紫杉醇粒子的平均堆积密度在约0.050g/cm3和约0.12g/cm3之间并且ssa为至少30m2/g。在另一个优选的实施方式中,多西紫杉醇粒子的平均堆积密度在约0.050g/cm3和约0.12g/cm3之间并且ssa为至少35m2/g。在一个进一步的优选实施方式中,多西紫杉醇粒子的平均堆积密度在约0.050g/cm3和约0.12g/cm3之间并且ssa为至少40m2/g。在一个优选实施方式中,多西紫杉醇粒子的平均堆积密度在约0.050g/cm3和约0.12g/cm3之间并且ssa在约40m2/g和约50m2/g之间。在另一个优选的实施方式中,多西紫杉醇粒子的平均堆积密度在约0.060g/cm3和约0.1g/cm3之间并且ssa在约40m2/g和约50m2/g之间。这些各种实施方式在后面的实施例中举例说明。
[0183]
在任何这些各种实施方式中,多西紫杉醇粒子可以包含每多西紫杉醇粒子至少4.16x10-13
克多西紫杉醇或其药学上可接受的盐。
[0184]
在另一个实施方式中,在以75rpm运行的usp ii桨叶设备中,至少20%(w/w)的多西紫杉醇在30分钟或更短时间内溶解在15%甲醇/85%水(v/v)的溶液中。使用中性ph 7,在此情况下紫杉烷的溶解度不受ph影响。在另一个实施方式中,所述溶解研究在37℃下进行。
[0185]
在一个进一步的实施方式中,所述化疗剂粒子包含至少95重量%的紫杉醇或其药学上可接受的盐,其中所述粒子具有下列的比表面积(ssa):
[0186]
(a)16m2/g和31m2/g之间或32m2/g和40m2/g之间;
[0187]
(b)16m2/g和30m2/g之间或32m2/g和40m2/g之间;
[0188]
(c)16m2/g和29m2/g之间或32m2/g和40m2/g之间;
[0189]
(d)17m2/g和31m2/g之间或32m2/g和40m2/g之间;
[0190]
(e)17m2/g和30m2/g之间或32m2/g和40m2/g之间;
[0191]
(f)17m2/g和29m2/g之间或32m2/g和40m2/g之间;
[0192]
(g)16m2/g和31m2/g之间或33m2/g和40m2/g之间;
[0193]
(h)16m2/g和30m2/g之间或33m2/g和40m2/g之间;
[0194]
(i)16m2/g和29m2/g之间或33m2/g和40m2/g之间;
[0195]
(j)17m2/g和31m2/g之间或33m2/g和40m2/g之间;
[0196]
(k)17m2/g和30m2/g之间或33m2/g和40m2/g之间;
[0197]
(l)17m2/g和29m2/g之间或33m2/g和40m2/g之间;
[0198]
(m)16m2/g和31m2/g之间,或≥32m2/g;
[0199]
(h)17m2/g和31m2/g之间,或≥32m2/g;
[0200]
(i)16m2/g和30m2/g之间,或≥32m2/g;
[0201]
(j)17m2/g和30m2/g之间,或≥32m2/g;
[0202]
(k)16m2/g和29m2/g之间,或≥32m2/g;
[0203]
(l)17m2/g和29m2/g之间,或≥32m2/g;
[0204]
(m)16m2/g和31m2/g之间,或≥33m2/g;
[0205]
(n)17m2/g和31m2/g之间,或≥33m2/g;
[0206]
(o)16m2/g和30m2/g之间,或≥33m2/g;
[0207]
(p)17m2/g和30m2/g之间,或≥33m2/g;
10ml,100ul-7.5ml 100ul-5ml,100ul-5ml,100ul-4ml,100ul-3ml,500ul-40ml,500ul-35ml,500ul-30ml,500ul-25ml,500ul-20ml,500ul-15ml,500ul-10ml,500ul-7.5ml,500ul-5ml,500ul-4ml,500ul-3ml,1ml-40ml,1ml-35ml,1ml-30ml,1ml-25ml,1ml-20ml,1ml-15ml,1ml-10ml,1ml-7.5ml 1ml-5ml,1ml-4ml,或1ml-3ml)。因此,在另一个方面,本发明提供包含化疗剂粒子和药学上可接受的载体的药物组合物,其中所述组合物的总体积在1ml和40ml、1ml和35ml、1ml和30ml、1ml和25ml、1ml和20ml、1ml和15ml、1ml和10ml、1ml和7.5ml、1ml和5ml、1ml和4ml、或1ml和3ml之间。在一个实施方式中,所述组合物由化疗剂粒子和药学上可接受的载体例如液体、半固体或固体载体组成。
[0215]
在一个实施方式中,所述组合物包含化疗剂粒子和液体载体或由其组成。可以使用任何合适的液体载体,例如含水液体载体。可以使用任何合适的含水液体载体,包括但不限于0.9%盐水溶液(生理盐水),例如usp的0.9%注射用氯化钠。在另一个实施方式中,所述组合物包含混悬液。在一些实施方式中,所述混悬液包含含水载体。所述载体可在水中包含缓冲剂、渗透盐和/或表面活性剂,以及用于调节ph、等渗性和粘度的其它作用剂。在使用含水载体的一个实施方式中,表面活性剂的浓度以w/w或w/v为基准小于1%;在其它实施方式中,小于0.5%、小于0.25%、或约0.1%。在其他实施方式中,所述含水载体可以不包括表面活性剂(由甘油单、二和三酯以及聚乙二醇的单和二酯构成的聚乙二醇甘油酯)和/或(聚乙氧基化蓖麻油)。在一些实施方式中,所述组合物或混悬液不包括聚合物、蛋白质(例如白蛋白)、聚乙氧基化蓖麻油、和/或由甘油单、二和三酯以及聚乙二醇的单和二酯构成的聚乙二醇甘油酯。
[0216]
所述混悬液可以原样施用,或者可以在施用之前用稀释剂、例如用盐水(0.9%盐水溶液)任选包含缓冲剂和一种或多种其它赋形剂来稀释。所述稀释剂可以是适于通过注射施用于患者的任何液体。例如,混悬液与稀释剂的体积比可以在1:1-1:100v/v的范围内或其他合适的比率。
[0217]
在一些实施方式中,所述混悬液可包含水和任选的一种或多种赋形剂,所述赋形剂选自缓冲剂、张度调节剂、防腐剂、缓和剂、粘度调节剂、渗透剂、表面活性剂、抗氧化剂、碱化剂、酸化剂、消泡剂、和着色剂。例如,所述混悬液可包含化疗剂粒子、水、缓冲剂和盐。它任选还包含表面活性剂。在一些实施方式中,所述混悬液基本上由水、悬浮在水中的紫杉醇粒子和缓冲剂组成或由它们组成。所述混悬液还含有渗透盐。
[0218]
所述混悬液可包含一种或多种表面活性剂。合适的表面活性剂包括例如但不限于聚山梨醇酯、月桂基硫酸盐、乙酰化甘油单酯、二乙酰化甘油单酯和泊洛沙姆。聚山梨醇酯是聚氧乙烯脱水山梨糖醇脂肪酸酯,它是山梨糖醇及其酸酐与每摩尔山梨糖醇及其酸酐约20、5或4摩尔环氧乙烷共聚的部分脂肪酸酯系列。聚山梨醇酯的非限制性例子是聚山梨醇酯20、聚山梨醇酯21、聚山梨醇酯40、聚山梨醇酯60、聚山梨醇酯61、聚山梨醇酯65、聚山梨醇酯80、聚山梨醇酯81、聚山梨醇酯85、和聚山梨醇酯120。含有约20摩尔环氧乙烷的聚山梨醇酯是亲水性非离子表面活性剂。含有约20摩尔环氧乙烷的聚山梨醇酯的例子包括聚山梨醇酯20、聚山梨醇酯40、聚山梨醇酯60、聚山梨醇酯65、聚山梨醇酯80、聚山梨醇酯85、和聚山梨醇酯120。聚山梨醇酯可以从croda以商品名tween
tm
商购。聚山梨醇酯的数字标号对应于tween的标号,例如,聚山梨醇酯20是tween 20,聚山梨醇酯40是tween 40,聚山梨醇酯60是tween 60,聚山梨醇酯80是tween 80,等等。usp/nf级的聚山梨醇酯包括聚山梨醇酯
20nf、聚山梨醇酯40nf、聚山梨醇酯60nf和聚山梨酯80nf。聚山梨醇酯也有pheur等级(欧洲药典)、bp等级和jp等级。术语“聚山梨醇酯”是非专有名称。聚山梨醇酯20的化学名称是聚氧乙烯20脱水山梨糖醇单月桂酸酯。聚山梨醇酯40的化学名称是聚氧乙烯20脱水山梨糖醇单棕榈酸酯。聚山梨醇酯60的化学名称是聚氧乙烯20脱水山梨糖醇单硬脂酸酯。聚山梨醇酯80的化学名称是聚氧乙烯20脱水山梨糖醇单油酸酯。在一些实施方式中,所述混悬液可包含聚山梨醇酯的混合物。在一些实施方式中,所述混悬液包含聚山梨醇酯20、聚山梨醇酯40、聚山梨醇酯60、聚山梨醇酯65、聚山梨醇酯80、聚山梨醇酯85、和/或聚山梨醇酯120。在其它实施方式中、所述混悬液包含聚山梨醇酯20、聚山梨醇酯40、聚山梨醇酯60、和/或聚山梨醇酯80。在一种实施方式中、所述混悬液包含聚山梨醇酯80。
[0219]
所述混悬液可包含一种或多种涨度调节剂。合适的涨度调节剂包括例如但不限于,一种或多种无机盐,电解质,氯化钠,氯化钾,磷酸钠,磷酸钾,硫酸钠,硫酸钾,碳酸氢钠和碳酸氢钾,以及碱土金属盐,例如碱土金属无机盐,例如钙盐和镁盐,甘露糖醇,右旋糖,甘油,丙二醇,及其混合物。
[0220]
所述混悬液可包含一种或多种缓冲剂。合适的缓冲剂包括,例如但不限于,磷酸氢二钠,磷酸二氢钠,柠檬酸,柠檬酸钠盐酸,氢氧化钠,三(羟甲基)氨基甲烷,双(2-羟基乙基)亚氨基三(羟甲基)甲烷,和碳酸氢钠,以及本领域普通技术人员已知的那些。缓冲剂通常用于将ph调节至腹膜内应用的理想范围。通常约5至9、5至8、6至7.4、6.5至7.5、或6.9至7.4的ph是可取的。
[0221]
所述混悬液可包含一种或多种缓和剂。缓和剂是在粘膜、例如衬在腹膜和其中器官里的膜上形成平滑膜的作用剂。缓和剂可缓解轻微疼痛和炎症,有时被称为粘膜保护剂。合适的缓和剂包括范围约0.2至约2.5%的纤维素衍生物,例如羧甲基纤维素钠、羟乙基纤维素、羟丙基甲基纤维素和甲基纤维素;约0.01%的明胶;约0.05至约1%的多元醇,还包括约0.05至约1%,例如甘油、聚乙二醇300、聚乙二醇400和丙二醇;约0.1至约4%的聚乙烯醇;约0.1至约2%的聚维酮;和当与另一种本文中描述的聚合缓和剂一起使用时从约0.1%起的葡聚糖70。
[0222]
所述混悬液可包含一种或多种碱化剂以调节ph。用于本文中时,术语“碱化剂”旨在表示用于提供碱性介质的化合物。这样的化合物包括,例如但不限于,氨溶液、碳酸铵、氢氧化钾、碳酸钠、碳酸氢钠和氢氧化钠以及本领域普通技术人员已知的其它化合物。
[0223]
所述混悬液可包含一种或多种酸化剂以调节ph。用于本文中时,术语“酸化剂”旨在表示用于提供酸性介质的化合物。这样的化合物包括,例如但不限于,乙酸、氨基酸、柠檬酸、硝酸、富马酸和其它α-羟基酸、盐酸、抗坏血酸和硝酸以及本领域普通技术人员已知的其它化合物。
[0224]
所述混悬液可包含一种或多种消泡剂。用于本文中时,术语“消泡剂”旨在表示防止或减少在所述填充组合物表面上形成的发泡量的一种化合物或多种化合物。合适的消泡剂包括例如但不限于,二甲基硅油、simethicone、辛基酚聚醚和本领域普通技术人员已知的其它消泡剂。
[0225]
所述混悬液可包含一种或多种粘度调节剂,其增加或降低混悬液的粘度。合适的粘度调节剂包括甲基纤维素、羟丙基甲基纤维素、甘露糖醇和聚乙烯吡咯烷酮。
[0226]
在一些实施方式中,化疗剂粒子存在于还包含聚山梨醇酯的混悬液中。在一个具
体实施方式中,化疗剂粒子存在于还包含聚山梨醇酯的混悬液中,其中聚山梨醇酯是聚山梨醇酯80。在其它实施方式中,聚山梨醇酯或聚山梨醇酯80以约0.01%v/v至约1.5%v/v的浓度存在于所述混悬液中。本发明人意外地发现,所列举的非常少量的聚山梨醇酯80降低了化疗剂粒子与混悬液中的含水载体(例如盐水)界面处的表面张力。这些实施方式通常在接近所述组合物的使用时间时配制。在这些实施方式中,粒子未用聚山梨醇酯或聚山梨醇酯80包衣。在各种其他实施方式中,聚山梨醇酯或聚山梨醇酯80存在于混悬液中的浓度在约0.01%v/v和约1%v/v、约0.01%v/v和约0.5%v/v、约0.01%v/v和约0.4%v/v、约0.01%v/v和约0.25%v/v、约0.05%v/v和约0.5%v/v、约0.05%v/v和约0.25%v/v、约0.1%v/v和约0.5%v/v、约0.1%v/v和约0.25%v/v、约0.1%v/v、约0.16v/v、或约0.25%v/v之间。在进一步的实施方式中,化疗剂,如紫杉醇,存在于混悬液中的浓度在约1mg/ml和约40mg/ml、或约6mg/ml和约20mg/ml之间。在各种进一步的实施方式中,化疗剂存在于混悬液中的浓度在约6mg/ml和约15mg/ml之间,约6mg/ml和约10mg/ml、约10mg/ml和约20mg/ml、约10mg/ml和约15mg/ml之间,约6mg/ml,约10mg/ml,或约15mg/ml。在各种进一步的实施方式中,所述组合物中的含水载体可以是盐水,例如约0.9%的氯化钠。
[0227]
因此,本发明还提供一种混悬液,其包含:
[0228]
(a)化疗剂粒子;
[0229]
(b)药学上可接受的载体;和
[0230]
(c)聚山梨醇酯,其中聚山梨醇酯存在于混悬液中的浓度在约0.01%v/v和约1.5%v/v之间,或约0.01%v/v和约1%v/v、约0.01%v/v和约0.5%v/v、约0.01%v/v和约0.4%v/v、约0.01%v/v和约0.25%v/v、约0.05%v/v和约0.5%v/v、约0.05%v/v和约0.25%v/v、约0.1%v/v和约0.5%v/v、约0.1%v/v和约0.25%v/v之间,约0.1%v/v,约0.16v/v,或约0.25%v/v。
[0231]
在一个实施方式中,聚山梨醇酯是聚山梨醇酯80。在一个实施方式中,药学上可接受的载体是0.9%盐水溶液。在另一个实施方式中,化疗剂粒子是紫杉烷粒子。
[0232]
因此,本发明还提供药剂盒,其包含:
[0233]
(a)含有化疗剂粒子的第一小瓶;
[0234]
(b)含有聚山梨醇酯和药学上可接受的载体的第二小瓶;
[0235]
(c)在施用于患者之前通过合并第一小瓶和第二小瓶的内容物将所述化疗剂粒子重构成混悬液以及用稀释溶液例如0.9%盐水溶液稀释所述混悬液的说明书。
[0236]
在一个实施方式中,聚山梨醇酯是聚山梨醇酯80。在一个实施方式中,药学上可接受的载体是0.9%盐水溶液。在一个实施方式中,第一和第二小瓶的内容物是无菌的。当用稀释溶液稀释化疗剂粒子和聚山梨醇酯的混悬液时,防止化疗剂粒子的过度溶解。
[0237]
本发明这个方面的组合物、混悬液和药剂盒可包含本文所述化疗剂粒子的任何实施方式或实施方式组合,以及本文所述的聚山梨醇酯或聚山梨醇酯80浓度的任何实施方式。在各种进一步的实施方式中,所述组合物中的含水载体可以是盐水,例如约0.9%的氯化钠。所述组合物、混悬液和药剂盒可以不包括聚合物、蛋白质(例如白蛋白)、聚乙氧基化蓖麻油、和/或由甘油单、二和三酯以及聚乙二醇的单和二酯构成的聚乙二醇甘油酯。
[0238]
所述组合物和药剂盒还可以包含适合于给定化疗剂粒子的其他组分。在一个实施方式中,多西紫杉醇粒子还可包含乙醇作为溶剂;可使用任何合适量的乙醇,例如约0.13%
至3.2%之间的无水酒精(乙醇),200标准度,未变性的,usp。
[0239]
对象可以是可受益于该治疗的任何合适的对象,包括但不限于哺乳动物(例如人类和其他灵长类动物、狗、猫、马、牛、猪、绵羊、山羊等)。
[0240]
所述化疗剂粒子的“有效量”可由主治医师基于所有相关因素确定。化疗剂粒子可以是所施用的唯一化疗剂,或者可以考虑到所有情况与主治医师认为适当的其他治疗剂一起施用。在一个实施方式中,所述方法还包括用所治疗肿瘤的标准治疗例如静脉内化疗、放射疗法放疗、手术切除等来治疗对象。例如,治疗前列腺癌的方法可以与挽救前列腺切除术、局灶性或全腺近距离放射治疗、冷冻疗法、高强度聚焦超声(hifu)和立体定向放射疗法(sbrt)中的一种或多种组合。
[0241]
将所述化疗剂粒子直接注射到肿瘤中可以通过任何合适的方法来实现。在非限制性实施方式中,注射可以通过磁共振成像-经直肠超声融合(mr-trus)引导(例如用于注射前列腺肿瘤)、或通过超声内镜引导的细针注射(eus-fni)来进行。
[0242]
实施例1.紫杉醇和多西紫杉醇粒子的制造
[0243]
材料和方法
[0244]
原始紫杉醇和多西紫杉醇分别购自phyton biotech(british columbia,加拿大),批号fp2-15004和dt7-14025。两者都以其原始形式表征。使用deco-pbm-v-0.41磨机(deco)完成两种药物的研磨。两种化合物的研磨条件如下:
[0245]
磨球尺寸=5mm
[0246]
rpm=600
[0247]
处理时间=60min
[0248]
室温。
[0249]
紫杉醇粒子的制备
[0250]
在丙酮中制备65mg/ml紫杉醇溶液。将bete 喷雾嘴(bete fog nozzle,inc)和声波探头(qsonica,型号q700)定位在结晶室中,相隔约8mm。将有约100nm个孔的不锈钢网式过滤器附接到结晶室以收集沉淀的紫杉醇纳米粒子。将超临界二氧化碳放入所述制造设备的结晶室中,并在约38℃和24kg/h的流速下达到约1200psi。将声波探头调节到在20khz频率下总输出功率的60%。将所述含有紫杉醇的丙酮溶液以4.5ml/min的流速泵送通过所述喷嘴约36小时。产生的紫杉醇纳米粒子具有0.81μm的平均数量加权平均尺寸,在三次单独运行中平均标准偏差为0.74μm。
[0251]
多西紫杉醇粒子的制备
[0252]
在乙醇中制备79.32mg/ml多西紫杉醇溶液。将所述喷嘴和声波探头定位在可加压室中,相隔约9mm。将有约100nm个孔的不锈钢网式过滤器附接到可加压室以收集沉淀的多西紫杉醇纳米粒子。将超临界二氧化碳放入所述制造设备的可加压室中,并在约3℃8和68slpm的流速下达到约1200psi。将声波探头调节到在20khz频率下总输出功率的60%。将所述含有多西紫杉醇的乙醇溶液以2ml/min的流速泵送通过所述喷嘴约95分钟。然后在混合物泵送通过所述不锈钢网式过滤器时,从超临界二氧化碳中收集沉淀的多西紫杉醇附聚物和粒子。打开含有多西紫杉醇纳米粒子的过滤器,从该过滤器收集所生成的产物。
[0253]
产生的多西紫杉醇纳米粒子具有0.82μm的平均数量加权平均尺寸,在三次单独的乙醇运行中平均标准偏差为0.66μm。
[0254]
粒径分析
[0255]
通过光阻和激光衍射两种方法分析粒径。particle sizing systems accusizer780sis系统用于光阻法,shimadzu sald-7101用于激光衍射法。紫杉醇纳米粒子利用含有0.10%(w/v)十二烷基硫酸钠(sds)的水作为分散剂分析。多西紫杉醇纳米粒子利用isopar g作为分散剂分析。
[0256]
将约7ml过滤的分散剂添加到含有约4mg紫杉醇粒子的玻璃小瓶中来制备紫杉醇混悬液。将小瓶涡旋约10秒,然后在声波浴中超声处理约1分钟。如果样品已经悬浮,则制备紫杉醇混悬液与0.1%sds溶液的1:1溶液,涡旋10秒,并在声波浴中超声处理1分钟。
[0257]
将约7ml过滤的分散剂添加到含有约4mg多西紫杉醇粒子的塑料小瓶中来制备多西紫杉醇混悬液。将小瓶涡旋约10秒,然后在声波浴中超声处理约2分钟。该混悬液用于激光衍射分析。将未使用的混悬液倒入125ml无粒子的塑料瓶中,然后用过滤的分散剂填充至约100ml。将所述混悬液涡旋约10秒,然后在声波浴中超声处理约2分钟。将该稀释的混悬液用于光阻分析。
[0258]
在accusizer 780 sis上分析粒子之前,首先进行背景测试。利用蠕动泵,将空白混悬液从储液器泵送通过0.22μm millipore过滤器并泵入新的无粒子塑料瓶中,来填充瓶子。运行背景分析以确保粒子/ml计数低于100个粒子/ml。取决于溶液浓度,将少量紫杉醇混悬液,5-100μl,移液到所述来自背景测试的塑料瓶中的位置,并用~100ml分散剂填充并开始分析。监测计数并添加紫杉醇溶液以在整个分析期间达到和/或维持6000-8000个粒子计数/ml。一旦分析完成,就去除背景数据,并去除少于四个计数的任何测量值。
[0259]
为了在sald-7101上使用批量池(batch cell)分析粒子,通过选择手动测量开始分析。折射率设定为1.5至1.7。所述批量池用过滤的分散剂填充至刚好过蚀刻线。空运行白测量。取决于低至100μl的溶液浓度,根据需要移取少量api(紫杉醇或多西紫杉醇)混悬液,通常《1ml,进入批量池,以达到0.15-0.2吸光度单位之间的可接受的吸光度。执行测量,选择具有最高置信水平的所得图;自动计算背景。
[0260]
bet分析
[0261]
将在200至300mg分析物之间的已知质量添加到30ml样品管中。然后将装载的管安装到porous materials inc.bet-202a型。然后使用软件包进行自动化测试,并随后计算各样品的表面积。
[0262]
堆积密度分析物
[0263]
在室温下通过塑料称重漏斗将紫杉醇或多西紫杉醇粒子制剂添加到10ml除皮重的量筒中。测量药物质量精确到0.1mg,测定体积精确到0.1ml,并计算密度。
[0264]
溶解研究
[0265]
紫杉醇
[0266]
通过将约50mg材料(即:原始紫杉醇、研磨紫杉醇或紫杉醇粒子)和约1.5克的1mm玻璃珠在小瓶中翻滚约1小时,将所述材料包被在所述珠粒上。将珠粒转移到不锈钢网式容器中,并放入含有37℃、ph7的甲醇/水50/50(v/v)介质和以75rpm运行的usp设备ii(桨叶)的溶解浴中。在10、20、30、60和90分钟时,取出5ml等分试样,通过0.22μm过滤器过滤,并在u(v/v)is分光光度计上在227nm处分析。样品的吸光度值与在溶解介质中制备的标准溶液的吸光度值进行比较,以确定溶解的材料量。
[0267]
多西紫杉醇
[0268]
将约50mg材料(即:原始多西紫杉醇、研磨多西紫杉醇或多西紫杉醇粒子)直接放入含有37℃、ph7的甲醇/水15/85(v/v)介质和以75rpm运行的usp设备ii(桨叶)的溶解浴中。在5、15、30、60、120和225分钟时,取出5ml等分试样,通过0.22μm过滤器过滤,并在uv/vis分光光度计上在232nm处分析。样品的吸光度值与在溶解介质中制备的标准溶液的吸光度值进行比较,以确定溶解的材料量。
[0269]
结果
[0270]
使用上述方案及其变体(即:变更喷嘴、过滤器、声能来源、流速等)产生的颗粒的bet表面积范围在22和39m2/g之间。相比之下,测得原始紫杉醇的bet表面积在7.25m2/g(图2),而根据美国专利5833891和5874029的方法制备的紫杉醇粒子则范围从11.3至15.58m2/g。使用本发明方法制备的示例性粒径示于表1中。
[0271]
表1
[0272][0273]
对原始药物、研磨药物粒子和通过本发明方法制备的药物粒子的堆积密度、ssa和溶解速率(如上所述进行)的比较研究提供在下面表2和3中。紫杉醇和多西紫杉醇材料的完全溶解时间过程分别在表4和5中提供。
[0274]
表2
[0275][0276]
表3
[0277][0278]
表4:紫杉醇溶解时间过程
[0279][0280]
表5:多西紫杉醇溶解时间过程
[0281][0282]
实施例2.小鼠腹膜内注射后紫杉醇粒子的药代动力学和组织分布
[0283]
目的:进行该研究以确定在腹膜内递送紫杉醇颗粒混悬液后紫杉醇从腹膜腔吸收到体循环中的水平。还评估了腹膜内施用后来自紫杉醇粒子混悬液的紫杉醇的组织分布。
[0284]
实验细节:用id8卵巢癌细胞接种雌性c57bl6小鼠,并让肿瘤生长45天。这些小鼠经由腹膜内施用总量为4ml的在0.9%盐水中的紫杉醇粒子混悬液(36mg/kg)处理。在零时间(给药前)、1、6、24和48小时收集血浆和腹膜液样品(每个时间点至少4只小鼠),并通过lcmsms测量血浆和腹膜液中的紫杉醇。另外,在腹膜内施用紫杉醇粒子后的零时间(给药前)、1、6、24和48小时收集组织样品。通过lc/ms/ms分析来自施用紫杉醇粒子的小鼠的腹股沟淋巴结、腹膜壁、卵巢、肝脏、心脏、肾脏、肺、脑和肿瘤组织样品。
[0285]
结果和意义:血浆、腹膜液和器官组织样品中紫杉醇水平的结果显示在下表中。血浆紫杉醇在48小时期间内保持在非常低的水平。腹膜液中的紫杉醇水平要高得多,并且表现出可观量的变化。紫杉醇分析方法的定量限为0.01μg/gm。如通过卵巢肿瘤、卵巢、腹股沟淋巴结和腹膜的结果所证明,腹膜腔内组织中紫杉醇的水平一直高。相反,腹膜腔外组织中的紫杉醇水平始一直低,如肝脏、心脏、肺和脑组织所示。这些结果示于表6中。
[0286]
因为在与腹膜液接触的组织中(卵巢肿瘤,卵巢,腹股沟淋巴结和腹膜)紫杉醇的出乎意料的高水平,和在不与腹膜液接触的组织中紫杉醇很少,该数据是有意义的。基于这些和其他研究,紫杉醇从紫杉醇粒子中的释放持续数周,并且预计将会提供持续的大量紫杉醇,这将意味着如果直接注射到肿瘤中,紫杉醇将以很高的水平蓄积。
[0287]
表6.在化疗剂粒子处理的小鼠组织、血浆和腹膜液中的紫杉醇水平总结(值以μg/g计)(4只动物)
[0288]
[0289][0290]
实施例3.胶质母细胞瘤研究
[0291]
在这项研究中,我们评估了紫杉醇粒子对胶质母细胞瘤(gb)的疗效。裸鼠大脑注射gb细胞以建立原发性肿瘤,其在两周后用紫杉醇粒子注射。我们相对于仅接受盐水注射的对照组和接受taxol
tm
(在聚氧乙烯蓖麻油(cremophor)中配制)注射的对照组来监测存活率效益。我们通过直接注射向生长中的肿瘤递送100mg/m2的剂量。下表显示了四种不同肿瘤尺寸和本发明的紫杉醇粒子的相应剂量,假设肿瘤呈球形。作为对照实验,使用在聚氧乙烯蓖麻油中配制并在盐水中稀释至正确浓度的taxol
tm
。
[0292]
表7.
[0293]
[0294]
*在100mg/m2的剂量下
ꢀꢀ
**5μl注射;nanotax储用溶液:3,150ng/μl
[0295]
在每次注射5μg紫杉醇的最高剂量下,未观察到毒性。注射的小鼠保持存活8至9天,之后没有观察到神经病学症状。9天后处死小鼠并收获脑;沿注射路径解剖脑并分析。紫杉醇粒子组和taxol
tm
组均未显示坏死或病变。脑切片无需进一步制备即可以用于以三种不同的成像技术进行分析,从而创建合成图像(数据未显示):
[0296]
(a)二次谐波发生(shg):图像以蓝色显现,主要是胶原蛋白和血管以及紫杉醇粒子。
[0297]
(b)双光子激发荧光(tpef):图像以绿色显现,主要是反应性细胞、小胶质细胞、巨噬细胞、一些神经元体。
[0298]
(c)相干反斯托克斯拉曼散射(coherent anti-stokes raman scattering)(cars):图像以红色显现,针对-ch2振动进行调谐来观察脂质-主要是cns中的髓磷脂,而且被称为泡沫细胞的含有脂滴的细胞将产生阳性信号。具有脂质空泡的退化细胞和巨噬细胞也将显现。
[0299]
由于紫杉醇粒子晶体的非线性光学性质,所述晶体可以用二次谐波发生成像技术直接看到。注射5μg紫杉醇粒子小鼠在注射后9天在注射部位可清楚地看到紫杉醇粒子簇(即:在肿瘤内蓄积),并且未显示神经病学症状(数据未显示)。
[0300]
实施例4.前列腺癌研究
[0301]
进行两项体内非临床药理学研究以确定在裸鼠实体瘤pc-3人前列腺癌裸鼠异种移植物中瘤内(itu)递送紫杉醇粒子的效果。在研究编号p-ppr-01-2015中,给小鼠施用紫杉醇粒子(也称为nanopac
tm
)37.5mg/kg,qwk x 1(即:单剂);12.5mg/kg,qwk x 3(即:单剂,每周三次);或37.5mg/kg,qwk x 3;紫杉醇(30mg/kg,qwk x 3),或介质(含0.1%w/v聚山梨醇酯80的盐水,qwk x 3)。用紫杉醇粒子和介质处理是通过itu注射。在研究的d1进行细胞植入后35天,将个体肿瘤体积为108至196mm3的动物分成五组(n=10),组平均肿瘤体积范围为150-153mm3。所有处理均在研究的d1开始。紫杉醇按iv输注施用。所有实验处理以10只小鼠为组测试。每周两次测量肿瘤。部分治疗结果基于肿瘤生长抑制百分比(%tgi),定义为处理小鼠和介质对照小鼠的第32天中值肿瘤体积之间的百分比差异。实验结束是肿瘤体积为2000mm3或60天,以先到者为准。
[0302]
紫杉醇粒子在pc-3前列腺癌模型中有显著活性(图1)。与介质处理的对照动物相比,用单剂或每周三剂的紫杉醇粒子治疗动物导致相同的存活延长和研究存活者/消退数量增加。没有剂量依赖性反应,因为以12.5或37.5mg/kg qwk x3给予紫杉醇粒子产生了研究中可得到的最大存活延长。所有紫杉醇粒子处理动物的结果都远高于指示潜在治疗活性的60%tgi阈值。iv-施用的紫杉醇在该研究中产生显著的tgi和显著改善的存活延长。所有处理均耐受良好。
[0303]
研究编号pd-ppr-02-2016包括如上所述制备的多西紫杉醇粒子(也称为nanodocetm),以及紫杉醇粒子。有pc-3前列腺癌肿瘤异种移植物的小鼠通过itu注射施用多西紫杉醇粒子100mg/kg,qwk x 1;37.5mg/kg,qwk x 3;或100mg/kg,qwk x 3;紫杉醇粒子37.5mg/kg,qwk x 3;或经由it注射施用介质(含0.1%w/v聚山梨醇酯80的盐水,qwk x 3);或静脉内施用多西紫杉醇(30mg/kg,qwk x 3)。在研究的d1进行细胞植入后26天,将个体肿瘤体积为108至172mm3的动物分成五组(n=10),组平均肿瘤体积范围为136-141mm3。所
有处理均在研究的d1开始。所有实验处理以10只小鼠为组测试。每周两次测量肿瘤。实验结束是肿瘤体积为2000mm3或60天,以先到者为准。该研究中最大可能的肿瘤生长延迟(tgd)被确定为41%。
[0304]
紫杉醇粒子和多西紫杉醇粒子在pc-3前列腺癌模型中具有高活性。所有方案,无论剂量/计划如何,均产生显著的存活延长,在所有情况下都实现了研究中可允许的最大可能tgd。用紫杉醇粒子、多西紫杉醇粒子和多西紫杉醇处理的动物的结果证明了相似的疗效水平。所有治疗方案都耐受良好。图2显示了用介质、nanodoce、nanopac it处理和用多西紫杉醇iv处理的小鼠pc-3前列腺肿瘤异种移植物的平均肿瘤体积。
[0305]
实施例5.mda-mb-231乳腺癌研究
[0306]
该研究的目的是确定皮下(sc)植入的mda-mb-231人乳腺癌异种移植物对用紫杉醇粒子(“nanopac
tm”)和多西紫杉醇粒子(“nanodoce
tm”)处理的反应。
[0307]
试验品如表8所示
[0308]
表8
[0309][0310]
*基于25g小鼠
[0311]
剂量制剂
[0312]
nanopac
tm
:将0.75ml的1%聚山梨醇酯80(“t80”)重构溶液加入到nanopac
tm
的小瓶(306mg/小瓶)中。制备重构溶液,在制备当天通过0.22微米过滤器无菌过滤,并冷藏(2至8℃)不超过7天。将小瓶剧烈地用手摇动倒转1分钟。摇动后立即将6.9ml的0.9%注射用氯化钠usp加入到小瓶中以制备40mg/ml混悬液(7.65ml)并再用手摇动小瓶1分钟。混合后,让混悬液静置5分钟以减少夹带的空气和泡沫。
[0313]
操作:室温。
[0314]
稳定性:将剂量制剂保持在室温下并认为稳定达8小时。
[0315]
nanodoce
tm
:将1.33ml的含1%t80/10%乙醇的0.9%盐水重构溶液加入到nanodoce粒子的小瓶(200mg/小瓶)中。制备重构溶液,在制备当天通过0.22微米过滤器无菌过滤,并冷藏(2至8℃)不超过7天。将小瓶剧烈地用手摇动倒转1分钟。摇动后立即添加2ml的0.9%注射用氯化钠usp并再用手摇动小瓶1分钟。将另外1.67ml的0.9%注射用氯化钠usp添加到小瓶中并继续手动倒转混合1分钟。最终体积为5ml的40mg/ml混悬液。混合后,让混悬液静置至少5分钟以减少夹带的空气和泡沫。
[0316]
操作:室温。
[0317]
稳定性:将剂量制剂保持在室温下并认为稳定达8小时。
[0318]
紫杉醇:将散粒紫杉醇添加到紫杉醇的临床制剂(6mg/ml,在50%乙醇:50%聚氧乙烯蓖麻油el中)中以制备12mg/ml溶液并根据需要涡旋。添加注射用氯化钠usp(0.9%)以制备3mg/ml紫杉醇溶液并涡旋混合。
[0319]
操作:温水。
[0320]
稳定性:在制剂的20分钟内注射。
[0321]
多西紫杉醇:添加注射用氯化钠usp(0.9%)以制备3mg/ml多西紫杉醇溶液(20mg/ml,在50%乙醇:50%t80中)并涡旋混合。
[0322]
操作:室温。
[0323]
稳定性:将剂量制剂保持在室温下并认为稳定达8小时。
[0324]
试验体系:
[0325]
物种&种系:小鼠;ncr-nu/nu
[0326]
供应商:charles river laboratories
[0327]
研究编号:females
–
50
[0328]
研究设计:总共88只雌性ncr-nu/nu小鼠在右侧胁皮下(sc)植入来自体内传代的mda-mb-231乳腺肿瘤碎片。肿瘤细胞植入日(2016年8月4日)被指定为第0天。在肿瘤细胞植入后第13天(2016年8月17日),50只动物的个体肿瘤生长至100-221mg重量(100-221mm3尺寸),治疗开始日/阶段日(sd)。将50只动物分配到第1-5组,使得第13天所有五个组中的平均肿瘤重量为147.4-149.6mg(中值肿瘤重量为135-149mg)。
[0329]
表9
[0330][0331]
*it=瘤内
[0332]
**总剂量基于25g小鼠。
[0333]
nanopac
tm
和nanodoce
tm
是混悬液。在填充每个注射器之前和每只动物的注射之间,温和地旋涡/倒转试验品。所述试验材料的瘤内施用需要每个肿瘤使用六个针道(27g1/2英寸针头)。将剂量体积的六分之一在每道中缓慢推注注射,在缓慢移除针头之前暂停~15秒,并且移动到在肿瘤表面上间隔开的下一个注射部位。每天一次观察动物的死亡和濒死。从处理的第一天开始每周两次称重小鼠并进行肿瘤测量。测量每个肿瘤的长度和宽度。使用椭球体的公式确定肿瘤体积:
[0334]
长度x宽度2/2=体积(mm3)
[0335]
假设密度一致(1mm3=1mg),该公式也用于计算肿瘤重量。肿瘤检测限为32mg(4x 4mm)。从肿瘤植入当天起,实验持续61天。在研究终止之前,对体重从处理第一天的体重减少超过30%或其肿瘤达到4,000mg重量、溃烂或脱落的动物实施安乐死。在施用试验品多西
紫杉醇和nanodocetm后以及在紫杉醇和nanopactm之间的平均肿瘤体积之间的比较在图3中显示。在第21天,1-2组中超过50%的动物由于肿瘤溃烂、死亡或大肿瘤尺寸而损失,因此未显示这些组的平均数据。
[0336]
结果
[0337]
介质处理对照组(第1组)中的人mda-mb-231乳腺癌异种移植物第29天时在所有10只小鼠中生长至1,929mg的平均肿瘤重量(n=9;在最后一个处理日后第一次测量,1只动物由于溃烂在第22天除去)。没有动物死亡或平均体重减轻。肿瘤抑制仅在第33天时与对照进行比较,当时对照组中有6只动物。
[0338]
用nanopac
tm
以100mg/kg的剂量三次it处理(每周一次)(第2组)有三只动物死亡(第20天和第27天),并且没有平均体重减轻。动物死亡发生在it注射日。重复的nanopac
tm
处理没有显著抑制mda-mb-231乳腺癌异种移植物的生长[第29天时平均肿瘤重量为1,031mg(n=7),对应相对于介质处理对照的%差异为-46.6%(p》0.05)]。响应的最低点发生在第26天,%差异为-51.8%,这与介质处理对照组有显著差异(p《0.05);第19天也与介质对照组有显著差异(p《0.05)。有两只完全肿瘤消退,在研究结束时仍然没有肿瘤。
[0339]
用nanodoce
tm
以100mg/kg的剂量三次it处理(每周一次)(第3组)有两只动物死亡(第20天和第27天),并且没有平均体重减轻。动物死亡发生在it注射日。重复的nanodoce
tm
处理显著抑制mda-mb-231乳腺癌异种移植物的生长[第29天时平均肿瘤重量为143mg(n=8),对应相对于介质处理对照的%差异为-92.6%(p《0.05)]。肿瘤生长抑制在第33天进展至最低点,%差异为-94.2%(p《0.05);平均肿瘤体积在第40天减少至0。从第19天开始,%差异显著,直到不可能比较。在第61天研究结束时,8只存活的动物保持无肿瘤。
[0340]
在多西紫杉醇以30mg/kg的剂量三次iv处理(每周一次)(第4组)后,没有动物死亡,平均体重减轻19.6%(4.78g,第33天)。重复的多西紫杉醇处理显著抑制mda-mb-231乳腺癌异种移植物的生长[第29天时平均肿瘤重量为16mg(n=10),对应相对于介质处理对照的%差异为-99.2%(p《0.001)]。肿瘤生长抑制在第33天进展至最低点,%差异为-99.8%(p《0.05);平均肿瘤体积在第40天减少至0。从第19天开始,%差异显著,直到不可能比较。在第40天观察到完全的肿瘤抑制,当时所有10只动物完全肿瘤消退,它们在研究结束时保持无肿瘤。多西紫杉醇处理的动物的肿瘤生长抑制仅在第22-33天与nanodoce
tm
处理动物有显著差异。
[0341]
用紫杉醇以30mg/kg的剂量三次iv处理(每周一次)(组5)是耐受的,没有动物死亡并且没有平均体重减轻。所述紫杉醇处理显著抑制mda-mb-231乳腺癌异种移植物的生长[第29天时平均肿瘤重量为118mg(n=10),对应相对于介质处理对照的%差异为-93.9%(p《0.05)]。反应的最低点出现在第33天,%差异为-97.4%。平均肿瘤体积在第40天减少至0。从第19天开始,%差异显著,直到不可能比较。有六只完全肿瘤消退,在研究结束时有三只无肿瘤动物。紫杉醇处理动物的肿瘤生长抑制与nanopac
tm
处理动物的第15天和第22-36天有显著差异。
[0342]
讨论
[0343]
在分别用nanopac
tm
或nanodoce
tm it处理的组中有三或两只动物死亡。动物死亡发生在早期,不认为是处理相关的。对照组和用紫杉醇或多西紫杉醇处理是耐受的,没有动物死亡。用nanodoce
tm
处理显著抑制了人mda-mb-231乳腺癌异种移植物的生长,有8只无肿
瘤存活的动物。用多西紫杉醇处理抑制了人mda-mb-231乳腺癌异种移植物的生长,有10只无肿瘤存活的动物并且在第22-33天与nanodoce
tm
处理有显著差异。用nanopac
tm
处理在评价日没有显著抑制人mda-mb-231乳腺癌异种移植物的生长,但在第19和21天有显著差异。另外,到第49天有两只无肿瘤的动物(数据未显示)。用紫杉醇处理显著抑制了人mda-mb-231乳腺癌异种移植物的生长,在第15和22-36天比nanopac
tm
处理更有效。在第49天,在iv紫杉醇处理组中有三只无肿瘤动物,在it nanopac
tm
处理组中有两只无肿瘤动物。用多西紫杉醇和nanodoce
tm
处理抑制了人mda-mb-231乳腺癌异种移植物的生长。在第49天,在iv多西紫杉醇处理组中有十只无肿瘤动物,在it nanodoce
tm
处理组中有八只无肿瘤动物。
[0344]
实施例6.mx-1人乳腺癌异种移植物研究
[0345]
该研究的目的是确定皮下(sc)植入的mx-1人乳腺癌异种移植物对用紫杉醇粒子(被称为nanopac
tm
)和多西紫杉醇粒子(被称为nanodoce
tm
)处理的反应。试验品如表10所示:
[0346]
表10
[0347][0348]
*基于25g小鼠
[0349]
**由于计算错误,nanodoce的介质制剂在方案(附录a)中被不正确地描述为0.267%t80/2.67%乙醇/23.71%pbs/73.33%盐水(0.9%)
[0350]
剂量制剂:
[0351]
nanopac
tm
:1)将0.75ml的1%t80重构溶液加入到nanopac的小瓶(306mg/小瓶)中。用手剧烈摇动倒转1分钟。3)摇动后立即将6.9ml的0.9%注射用氯化钠usp添加到小瓶中以制备40mg/ml混悬液(7.65ml)并再用手摇动小瓶1分钟。混合后,让混悬液静置5分钟以减少夹带的空气和泡沫。
[0352]
操作:室温。
[0353]
稳定性:将剂量制剂保持在室温下并认为稳定达8小时。
[0354]
nanodoce
tm
:1)将1.0ml的1%t80/10%乙醇/89%pbs重构溶液加入到nanodoce粒子的小瓶(200mg/小瓶)中。2)用手剧烈摇动倒转1分钟3)摇动后立即将2ml的0.9%注射用氯化钠usp(0.9%)添加到小瓶中并再用手摇动小瓶1分钟。4)将另外2ml的注射用氯化钠usp(0.9%)添加到小瓶中并继续用手倒转混合1分钟。40mg/ml nanodoce混悬液的最终体积为5ml。混合后,让混悬液静置至少5分钟以减少夹带的空气和泡沫。
[0355]
操作:室温。
[0356]
稳定性:剂量制剂将保持在室温下并认为稳定达8小时。
[0357]
紫杉醇:1)将散粒紫杉醇添加到紫杉醇的临床制剂(6mg/ml,在50%乙醇:50%聚氧乙烯蓖麻油el中)中以制备12mg/ml溶液。根据需要涡旋。2)添加注射用氯化钠usp(0.9%)以制备3mg/ml紫杉醇溶液。涡旋混合。
[0358]
操作:温水。
[0359]
稳定性:在制剂的20分钟内注射。
[0360]
多西紫杉醇:1)添加注射用氯化钠usp(0.9%)以制备3mg/ml多西紫杉醇溶液(20mg/ml,在50%乙醇:50%t80中)。涡旋混合。
[0361]
试验体系:
[0362]
物种&种系:小鼠;ncr-nu/nu
[0363]
供应商:charles river laboratories
[0364]
研究编号:females
–
50
[0365]
肿瘤模型:总共88只雌性ncr-nu/nu小鼠在右侧胁腹皮下(sc)植入来自体内传代的mx-1乳腺肿瘤碎片。肿瘤细胞植入日被指定为第0天。在肿瘤细胞植入后第10天,50只动物的个体肿瘤生长至100-198mg重量(100-198mm3尺寸),治疗开始日/阶段日(sd)。将50只动物分配到第1-5组,使得第10天所有五个组中的平均肿瘤重量为139.9至141.9mg(中值肿瘤重量为135或144mg)。
[0366]
表11
[0367][0368]
*it=瘤内:每肿瘤使用六个针道(27g1/2英寸针头),体积的六分之一在每道中按缓慢推注注射,等待~15秒,然后缓慢移除针头,针道在肿瘤表面上间隔开。
[0369]
nanopac
tm
和nanodoce
tm
是混悬液。在填充每个注射器之前和每只动物的注射之间,温和地旋涡/倒转试验品。每天一次观察动物的死亡和濒死。不良体征仅以异常记录。从sd开始每周两次收集体重。使用数字卡尺从sd开始每周两次进行肿瘤测量。测量每个肿瘤的长度和宽度。肿瘤体积利用椭球体的公式确定:长度x宽度2/2=体积(mm3)。假设密度一致(1mm3=1mg).,该公式也用于计算肿瘤重量。肿瘤检测限为32mg(4x4mm)。从肿瘤植入当天起,实验持续63天。在研究终止之前,对体重从处理第一天的体重减少超过30%或其肿瘤达到4,000mg重量、溃烂或脱落的动物实施安乐死。各处理的平均肿瘤体积示于图4中。在第26天时,1-2组中超过50%的动物由于肿瘤溃烂、死亡或大肿瘤尺寸而损失,因此未显示这些组的平均数据。
[0370]
结果
[0371]
介质处理对照组(第1组)中的人mx-1乳腺癌异种移植物第24天时在所有10只小鼠中生长至1,153mg的平均肿瘤重量(n=9;最后一个处理日)。有一只死亡(第21天)和一只濒死的动物被安乐死(第25天),平均体重减轻1.06%(0.26克,第14天)。肿瘤抑制仅在直到第38天比较,当时对照组中有6只动物。
[0372]
用nanopac
tm
以100mg/kg的剂量三次it处理(每周一次)(即第2组)有两只动物死亡(第17天和第28天),以及《1%的平均体重减轻。第17天的动物死亡发生在it注射后。重复的nanopac
tm
处理没有显著抑制mx-1乳腺癌异种移植物的生长[第24天时平均肿瘤重量为1,096mg(n=9),对应相对于介质处理对照的%差异为-4.9%(p》0.05)]。响应的最低点发生在第38天,%差异为-14.1%,这与介质处理对照组没有显著差异(p》0.05)。
[0373]
用nanodoce
tm
以100mg/kg的剂量三次it处理(每周一次)(即第3组)期间有两只动物死亡(第17天和第24天),并且没有平均体重减轻。第17和24天的动物死亡发生在it注射后。重复的nanodoce
tm
处理显著抑制mx-1乳腺癌异种移植物的生长[第24天时平均肿瘤重量为449mg(n=9),对应相对于介质处理对照的%差异为-61.0%(p《0.01)]。肿瘤生长抑制在第38天进展至最低点,%差异为-90.1%(p《0.001);平均肿瘤体积持续降低直至第56天。有四只完全肿瘤消退,在研究结束时所述动物保持无肿瘤。
[0374]
在多西紫杉醇以30mg/kg的剂量三次iv处理(每周一次)(即,第4组)后,有两只体重减轻》30%的动物被安乐死(第24和31天),而平均体重减轻为24.9%(5.90g,第31天)。重复的多西紫杉醇处理显著抑制mx-1乳腺癌异种移植物的生长[第28天时平均肿瘤重量为0.9mg(n=9),对应相对于介质处理对照的%差异为-99.9%(p《0.001)]。从第19天开始,%差异显著,直到不可能比较。在第31天观察到完全肿瘤抑制,当时所有九只动物的肿瘤完全消退。在第63天研究结束时,8只存活的动物保持无肿瘤。多西紫杉醇处理的动物的肿瘤生长抑制在第14-52天与nanodoce
tm
处理动物有显著差异,但在第56-63天没有。
[0375]
用紫杉醇以30mg/kg的剂量三次iv处理(每周一次)(组5)是耐受的,没有动物死亡并且平均体重减轻为2.44%(0.59g,第14天)。所述紫杉醇处理显著抑制mx-1乳腺癌异种移植物的生长[第24天时平均肿瘤重量为309mg(n=10),对应相对于介质处理对照的%差异为-73.2%(p《0.001)]。反应的最低点出现在第31天,%差异为-86.0%。从第14天开始,%差异显著,直到不可能比较。紫杉醇处理动物的肿瘤生长抑制与nanopac
tm
处理动物在第14-38天有显著差异(最后一天留在nanopac
tm
处理组中的任何动物)。
[0376]
讨论:
[0377]
除紫杉醇处理外,各组中有两只动物死亡、濒死、或因体重减轻被安乐死。用紫杉醇处理是耐受的,没有动物死亡。用nanodoce
tm it处理显著抑制了人mx-1乳腺癌异种移植物的生长,有四只无肿瘤存活的动物。用多西紫杉醇处理抑制了人mx-1乳腺癌异种移植物的生长,有八只无肿瘤存活的动物并且除了研究结束时(第56-63天),与nanodoce
tm
处理有显著差异。用nanopac
tm
处理没有显著抑制人mx-1乳腺癌异种移植物的生长。用紫杉醇处理显著抑制了人mx-1乳腺癌异种移植物的生长,比nanopac
tm
处理更有效。
[0378]
实施例7.jimt-1人类乳腺癌异种移植物研究
[0379]
本研究的目的是确定皮下(sc)植入的jimt-1人乳腺癌异种移植物对用紫杉醇粒子(被称为nanotax
tm
)处理的反应。试验品如下:
[0380]
程序:
[0381]
·
100只cr雌性cb.17scid小鼠在侧胁中皮下注射含1x10
7 jimt-1肿瘤细胞的50%matrigel。
[0382]
·
细胞注射体积为0.1ml/小鼠。
[0383]
·
开始日期时的年龄:8至12周龄。
[0384]
·
当肿瘤达到平均尺寸为100-150mm3时,进行配对,并开始处理。试验品如表12所示:
[0385]
表12
[0386][0387]
#对照组
[0388]
紫杉醇=在含5%乙醇:5%聚氧乙烯蓖麻油el的d5w中的紫杉醇
[0389]
nanotax=在含0.1%w/v聚山梨醇酯80的生理盐水中的nanotax
[0390]
介质=含0.1%w/v聚山梨醇酯80的生理盐水
[0391]
给药体积=2.5ml/kg(0.050ml/20g小鼠)。对应体重调节体积。对于组5,iv紫杉醇,给药体积是10ml/kg(0.20ml/20g小鼠)。
[0392]
·
体重:5/2(测量5天,休息2天)然后每周两次至结束
[0393]
·
将单次观察到体重减轻》30%或连续三次测量体重减轻》25%的个体动物安乐死。
[0394]
·
终点tgd。个别监测动物。实验的终点是肿瘤体积为1000mm3或60天,以先到者为准。当到达终点时,将动物安乐死。
[0395]
在d29(接受5次施用的动物的给药最后一天、g1、3、4)以1000mm3评价肿瘤生长抑制,并且对于总体存活率分析,研究在d50结束,修正的肿瘤体积终点为600mm3。
[0396]
然后在第50天从各组中的3个最佳反应者收集肿瘤用于分析以确定肿瘤组织中的紫杉醇浓度。各组相对于药物施用最后一天的分析时间安排如下:
[0397]
第1、3和4组最后一次给药后21天;
[0398]
第1组49天;和
[0399]
第5组35天。
[0400]
这些研究表明,nanotax(nanopac)在jimt-1乳腺癌模型中没显著的活性。与介质处理的对照动物相比,用五剂nanotax(nanopac)处理动物导致小幅存活延长和研究存活者数量增加。所有nanotax(nanopac)处理的动物的结果远低于指示潜在治疗活性的60%tgi阈值。紫杉醇在该研究中产生显著的tgi和显著改善的存活延长。所有处理均耐受良好。
[0401]
组织加工如下进行:
[0402]
1.称重对照肿瘤组织和肿瘤组织样品,并向每个样品添加三倍体积的水,以得到稀释因子为4的样品。
[0403]
2.用均化器-24使用4.0m/sec的速度将肿瘤组织匀化100秒。
[0404][0405]
4.向对照肿瘤组织匀浆添加50μl用于std和qc样品的适当溶液(添加50μl用于空
白的稀释剂)
[0406]
5.对于肿瘤组织匀浆研究样品,将50μl的每个样品添加到96孔板的不同孔中,并向每个组织样品添加50μl等分试样的稀释剂。
[0407]
6.向所有样品添加200μl在acnin的内标(200ng/ml华法林)溶液。
[0408]
7.在15℃下,将板剧烈涡旋10分钟,然后以4000rpm离心10分钟(sorvall legend x1r离心机,thermo scientific)。
[0409]
8.离心后,将100μl等分试样的上清液转移到每孔中含有100μl水的新96孔板中。
[0410][0411][0412]
bql:below the quantitation limit of 1ng/g before the dilution factor was applied.
[0413]
group 1:vehicle(it,qwk x 3)
[0414]
group 2:nanotax(37.5mg/kg,it,qwk x 1)
[0415]
group 3:nanotax(12.5mg/kg,it,qwk x 3)
[0416]
group 4:nanotax(37.5mg/kg,it,qwk x 3)
[0417]
group 5:paclitaxel(30mg/kg,iv,qwk x 3)
[0418]
该数据令人惊讶地地证明紫杉醇粒子(第2、3和4组)在肿瘤中持续很长时间。
[0419]
实施例8
[0420]
给右侧胁植入mda-mb-231乳腺肿瘤异种移植物的雌性裸鼠(ncr-nu/nu)(pd-pb-04-2016;参见上文)在肿瘤植入后第13、20和27天以瘤内注射施用100mg/kg剂量的在肿瘤植入后第61天,对4只第3组动物(100mg/kg nanodoce it qwk x 3)进行尸体剖检,并获得肿瘤植入部位的皮肤和下层组织。将组织在水中匀浆。用乙腈提取匀浆的等分试样,并通过lc/uv/ms分析提取物。使用多西紫杉醇的合成标准与组织样品中存
在的未知化合物比较保留时间(tr)、uv和裂解图型。肿瘤部位组织提取物的分析表明多西紫杉醇存在于所检查的四种组织的两个样品(动物3-7和3-8)中。lc/uv/ms分析显示,从组织提取物中获得的m/z 807.7-808.7的提取离子色谱图(xic)内的色谱峰的保留时间(tr=16.6min)和ms2谱与多西紫杉醇的可靠标准样品(tr=16.16min)相似。
[0421]
总之,基于保留时间和质谱数据与可靠参考标准的相似性,证实了在瘤内施用的四种小鼠乳腺肿瘤(mda-mb-231)异种移植模型的两种中,从肿瘤植入部位组织样品中分离的化合物是多西紫杉醇。
[0422]
实施例9.在接受根治性前列腺切除术的受试者中紫杉醇粒子(nanopac
tm
)局灶性治疗前列腺癌的iia期剂量递增试验
[0423]
方案概要
[0424]
在这项开放标签、剂量上升、扩大群组的iia期试验中,在如本文所述确定具有最佳耐受性和安全性轮廓的紫杉醇粒子剂量下,预定前列腺切除术的前列腺癌患者将在前列腺切除术之前四周在图像引导下将紫杉醇粒子直接注射到有主要病变的前列腺叶中。该研究将包括剂量递增期和剂量确认期。
[0425]
在剂量递增期中,将在三个群组中研究6、10和15mg/ml的紫杉醇粒子浓度,注射体积最多为含有主要病变的前列腺叶的20%,所述群组从最低浓度开始依次入选。在数据安全监测委员会(dsmb)审查群组数据之后,可以开始入选下一群组,在当前剂量下可以再入选三人,或者如果第一剂量未提供足够的安全性和耐受性,研究可以停止。被确定为最适合进一步评估的剂量,其被定义为具有由dsmb判定的合格的安全性和耐受性情况的最高剂量,将招募额外的受试者以提供该剂量水平的12名受试者的群组。
[0426]
在紫杉醇粒子注射之前将测定肿瘤体积和血清前列腺特异性抗原(psa)。在注射和前列腺切除术之间的时间间隔内将收集药代动力学样品、psa和射精。在紫杉醇粒子(也称为nanopac
tm
)注射之前和前列腺切除术之前两至三周将进行用多参数mri(mpmri)成像。将评价在前列腺切除术中切除的前列腺和盆腔淋巴结。
[0427]
终点:
[0428]
主要终点:安全性和耐受性,这通过不良事件(ae)以及实验室评估、体检结果和生命体征中的变化证明。
[0429]
次要终点:
[0430]
·
注射之后和前列腺切除术之前体循环中紫杉醇的浓度;
[0431]
·
在前列腺切除术期间切除的前列腺、前列腺的同侧叶、前列腺的对侧叶和盆腔淋巴结内肿瘤中存在紫杉醇;
[0432]
·
肿瘤反应(mpmri图像体积的变化;经由活检的组织学评价);
[0433]
·
在前列腺切除术期间切除的前列腺、前列腺的同侧叶、前列腺的对侧叶和盆腔淋巴结内肿瘤中存在肿瘤细胞。
[0434]
群体:直至最多30名男性在单个部位有预定根治性前列腺切除术的前列腺腺癌。
[0435]
研究药剂说明:混悬液用nanopac
tm
(无菌紫杉醇粒子)粉末(“nanopac”),所述混悬液用于以6、10、15mg/ml的浓度直接注射到含有主要病变的前列腺叶中,注射体积最多为含有主要病变的前列腺叶的20%。
[0436]
研究药剂的名称和说明:
[0437]
颗粒紫杉醇制剂,被确认为混悬液用nanopac
tm
(无菌颗粒紫杉醇)粉末,使用压缩反溶剂沉淀(pca)技术制造,该技术使用超临界二氧化碳和丙酮产生在充分表征的粒径分布内的紫杉醇纳米粒子。在pca之后,将紫杉醇粒子装填到60ml1型usp透明玻璃小瓶(306mg/小瓶)中,每个小瓶用溴化丁基橡胶塞和铝压接密封封闭,并通过γ辐射灭菌。在医院/诊所中施用之前,紫杉醇粒子将用含1%聚山梨醇酯80nf的0.9%注射用氯化钠(盐水)usp重构,以形成混悬液。混悬液将进一步用0.9%注射用氯化钠usp进行稀释,以获得最终的临床制剂。这种重构和稀释将在临床地点的药房发生。最终临床制剂中的nanopac浓度将是6mg/ml、10mg/ml或15mg/ml。聚山梨醇酯80的终浓度为在6mg/ml混悬液中0.1%、在10mg/ml混悬液中0.16%、和在15mg/ml混悬液中0.25%。
[0438]
研究的重要性:
[0439]
前列腺癌是男性中第二最常见的癌症,仅次于非黑素瘤皮肤癌。尽管该疾病发病率高,但它是一个不断进展的医学领域,对于患者和保健提供者存在艰难的决定。目前,前列腺癌的治疗主要由两种选项组成:主动监测或根治性全腺治疗。然而,这种二分法未能反映前列腺癌的异质性和细微差别的患者体验。部分由于普遍采用psa作为筛查工具,更多的男性被诊断出患有低风险、低等级的癌症。对于这些男性中的一些人来说,主动监测可能是一个合适的选择,因为根治性全腺治疗有导致改变生活的后果、例如阳痿和尿失禁的风险。这得到了接受根治性前列腺切除术的男性中有49%被发现只有不明显或进展缓慢的癌症的统计数字的支持。尽管如此,前列腺癌仍具有所有癌症中第四高的死亡率,并且最初入选主动监测并最终接受前列腺切除术的患者中有73%被发现患有明显的癌症。因此,主动监测不仅有疾病进展的风险,而且可能对患者造成心理上的痛苦。
[0440]
理论根据:
[0441]
该iia期研究将包括预定接受前列腺切除术的前列腺腺癌患者。该研究设计允许将紫杉醇粒子在前列腺切除术前直接注射到包含主要病变的前列腺叶中作为局灶性治疗的安全性评价。我们假设将紫杉醇粒子直接注射到前列腺中将导致紫杉醇的全身暴露有限,即使有的话,并因此应该仅导致低级别和短暂的ae。
[0442]
与静脉内(iv)施用相反,紫杉醇粒子的直接注射将允许更高浓度的药物靶向局部疾病,同时全身性毒性降低。由于延长的前列腺内停留和溶解,预期前列腺内紫杉醇粒子比iv紫杉醇更有效,导致肿瘤部位中持续和更高的紫杉醇浓度。受试者将在磁共振成像-经直肠超声融合(mr-trus)引导下将nanopac
tm
直接注射到含有主要病变的前列腺叶中。注射nanopac
tm
后四周,患者将接受根治性前列腺切除术。
[0443]
在进入研究之前,受试者将接受超声引导的前列腺活检以诊断并分级前列腺癌。该活检将用于鉴别主要病变,其被定义为具有最高gleason评分的病变。在该活检期间进行的超声还将用于计算整个前列腺的体积。含有主要病变的前列腺叶的体积将通过计算在研究前活检时通过超声确定的总前列腺体积的50%来确定。
[0444]
该研究将包括剂量递增期和剂量确认期。
[0445]
·
剂量递增:将研究nanopactm浓度为6、10和15mg/ml,注射体积最多为包含主要病变的前列腺叶的20%。群组将从最低浓度开始依次入选。每个群组将有计划最少三个受试者。来自群组中前三个受试者的数据将由dsmb审查和评价。结果将是确定是否a)递增至下一剂量;b)对当前剂量添加三个另外的受试者;或c)将前一剂量扩大三个受试者。
[0446]
·
剂量确认期:一旦确定适合于扩大和进一步评价的剂量,将入选受试者到该剂量以提供总共12个以该水平给药的受试者。如果两个剂量相似,将入选受试者到每个剂量;但是,治疗的受试者总数将保持12。
[0447]
护理研究程序标准
[0448]
入选本研究的受试者将接受预定的前列腺切除术。手术前的例行检查和手术本身被认为是标准护理。手术的后续事项将按照标准护理进行。在紫杉醇粒子注射之前以及在紫杉醇粒子注射和前列腺切除术之间的时间间隔期间每周一次测定血清psa。
[0449]
超声和mpmri成像将在参与研究之前进行,作为腺癌例行评价和确认的一部分。这些结果将用作紫杉醇粒子注射之前的治疗前(或基线)数据;然后在前列腺切除术前的三天内进行另一个研究特异性mpmri,并将进行超声波作为前列腺切除术程序的一部分。
[0450]
在紫杉醇粒子注射和前列腺切除术之间的时间间隔中,在注射后一周开始,将以每周一次为基准收集射精并评价以确定紫杉醇浓度。
[0451]
在前列腺切除术当天,在施用麻醉后,将进行活检。在活检后立即,在相同的麻醉下,受试者将进行预定的前列腺切除术,并且在手术后,将从切除的组织(前列腺和淋巴结)取样品以评价紫杉醇浓度和肿瘤细胞评估,如前所述。
[0452]
实施例10.评价在局部晚期胰腺癌患者中瘤内注射紫杉醇粒子的安全性的iia期试验
[0453]
在这项开放标签的iia期试验中,患有位于胰尾或胰体内的局部晚期胰腺癌的受试者将完成至少一个化疗疗程,作为标准护理(soc)的一部分。一旦有足够的血液学恢复,受试者将经由内窥镜超声引导的直接注射接受itu紫杉醇粒子(即,nanopac
tm
)。将跟踪受试者的总体存活率(os)、无进展存活率(pfs)、ca-19-9水平、癌胚抗原(cea)水平、疼痛减轻和肿瘤对治疗的反应(通过成像显示)。
[0454]
受试者将入选以6、10或15mg/ml浓度依次递增的紫杉醇粒子群组,所述紫杉醇粒子以最多20%肿瘤体积(施用于任何受试者的最大体积为5ml)直接注射到胰腺内的肿瘤中。该研究将包括剂量递增期和剂量确认期。
[0455]
基于这些肿瘤体积计算,可以将等于肿瘤体积的20%、在任何受试者中不超过5ml的紫杉醇粒子量注射到肿瘤中。
[0456]
用于该研究的紫杉醇粒子(称为nanopactm)由crititech,inc.(lawrence,kansas)利用压缩反溶剂沉淀(pca)技术制造,该技术使用超临界二氧化碳和丙酮以产生在充分表征的粒径分布内的紫杉醇纳米粒子。在医院/诊所中施用之前,将小瓶中的紫杉醇粒子粉末用无菌重构溶液(含1%聚山梨醇酯80nf的0.9%注射用氯化钠usp)悬浮,然后用0.9%注射用氯化钠usp进一步稀释,产生6、10或15mg/ml nanopac
tm
混悬液。
[0457]
将所述颗粒紫杉醇混悬液引入恶性肿瘤部位假设在受患区域(在这种情况下为胰腺肿瘤)内建立紫杉醇储库,将紫杉醇从粒子中缓慢释放到肿瘤空间,并因此导致在恶性肿瘤部位处延长的紫杉醇暴露。从胰腺的清除减少应导致紫杉醇的全身水平较低,进一步限制全身毒性。
[0458]
该iia期研究将在多达30名患者中进行以评价紫杉醇粒子安全性和耐受性,这些患者将接受对位于胰尾或胰体内的局部晚期胰腺癌的化疗治疗。在该临床试验中,紫杉醇粒子将经由内窥镜超声引导的细针注射(eus-fni)直接施用于胰腺中。
[0459]
所述药品作为颗粒紫杉醇的粉末填充物包含在透明的60ml 1型usp透明玻璃小瓶(306mg/小瓶)中,所述小瓶用丁基橡胶塞和铝压接密封封闭,并通过γ辐射灭菌。为了临床给药,将小瓶中的紫杉醇粒子粉末用无菌重构溶液(含1%聚山梨醇酯80nf的0.9%注射用氯化钠usp)悬浮,然后用不同体积的0.9%注射用氯化钠usp进一步稀释。结果是分别在在0.9%注射用氯化钠usp中含有0.1、0.16或0.25%聚山梨醇酯80nf的6、10或15mg/ml nanopac混悬液。
[0460][0461]
终点:主要终点:安全性和耐受性,这通过不良事件(ae)以及实验室评估、体检结果和生命体征中的变化证明。
[0462]
次要终点:
[0463]
·
注射后体循环中紫杉醇的浓度(通过pk分析确定);
[0464]
·
肿瘤反应(根据eisenhauer等人2009年的recist);
[0465]
·
减轻疼痛(通过视觉模拟量表[vas]测量);
[0466]
·
肿瘤标志物ca19-9的变化;
[0467]
·
肿瘤标志物cea的变化。
[0468]
群体:多达30名有位于胰尾或胰体内局部晚期胰腺癌的受试者。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。