1.本发明涉及一种用于在对患有癌症的受试者进行强子疗法治疗期间监测强子束的系统和方法。特别地,本发明涉及一种用于监测强子束与受试者的组织之间的相互作用区域的系统和方法,并因此间接地监测相对于待治疗的肿瘤块的递送剂量,该肿瘤块已经用放射性药物产品进行了标记,该放射性药物产品具有以准符合方式(quasi-coincidence)发射正电子和去激发伽马射线的放射性同位素。
背景技术:
2.强子疗法是一种使用质子颗粒或碳离子束的高效癌症疗法。这种创新技术已被证明对使用常规放射疗法难以治疗的肿瘤有效,因为这些肿瘤是抗辐射的,或者位于深的位置或接近重要器官。强子束的使用能够在纵向和横向上非常精确地沉积剂量。实际上,与其中能量沉积从进入患者体内的第一厘米开始最大,并随着深度而减少的光子束不同,带电离子在其路径的端部沉积其能量最大值(布拉格峰),同时保持最小的输入沉积剂量。此外,质子的横向半影比用光子束获得的横向半影要弱。然而,强子疗法的高发射的精度使这种技术对任何与治疗计划相关的偏差源敏感:该偏差源包括患者体位不佳、器官运动或部位之间的解剖变化或肿瘤消退、体重减轻、治疗的疗程之间的解剖腔填充。
3.为了利用高发射的精度的优势,需要对辐射递送的剂量位置进行彻底检查。当初级射束在患者体内停止时,能够通过来自体内的强子的核反应的次级辐射,特别是伽马射线,对强子的路径进行实时监测。
4.一些成像方案似乎有希望获得与强子束的轮廓相关的信息,例如离子诱导超声、次级电子轫致辐射测量或磁共振成像(mri),这些成像方案在实时mri的情况下具有与磁场中的强子束偏转相关联的特定问题。然而,这些技术可能难以实施。目前,已经提出了“束内”正电子发射断层扫描(pet)系统,该系统使用511kev的重合伽马射线,该伽马射线来自在组织中强子相互作用产生的放射性同位素的贝塔衰变期间发射的正电子的湮灭。然而,由于经历贝塔衰变的同位素数量少,并且考虑到贝塔衰变的观察相对于衰变被放射性同位素的寿命持续时间延迟,因此需要相对长的数据采集时间。因此,使用束内pet的实时束成像仅提供与治疗后递送的剂量位置相关的信息。此外,与常规的pet系统不同,束内pet系统具有减小的覆盖角度,以能够定位“台架”等中心旋转头,这减小了系统的敏感体积。
5.在这种背景下,frandes等人(frandes,mirela等人“a tracking compton-scattering imaging system for hadron therapy monitoring.”ieee transactions on nuclear science 57.1(2010):144-150.)通过数字模拟证明了基于康普顿望远镜(compton telescope)和成对相机组合的医学成像系统的可行性。对强子疗法中典型的不同射束能量的系统进行模拟,使得frandes等人能够证明这种成像系统在康普顿相互作用的能量范围特征中探测伽马射线的能力,从而重建递送剂量的位置。然而,这种以探测来自湮灭的伽马射线为目标的系统具有与束内pet相同的缺点。
6.此外,患者的内部解剖结构在一个疗程与下一个疗程之间或者在同一个疗程期间
会有所不同。因此,能够实时监测患者体内沉积的剂量位置和数量不足以确保目标肿瘤体积被全部照射,同时尽可能地最小化递送到周围健康组织的剂量。实际上,肿瘤体积相对于用于使患者相对于射束对准的外部解剖标记的偏差可能具有严重的后果,因为剂量将不会根据治疗计划被递送,因此健康组织将被照射。
7.本发明尤其旨在通过提出一种系统来弥补这些缺点,该系统能够在强子疗法治疗期间实时监测患者体内的位置和肿瘤块以及由射束递送的剂量的位置,从而能够根据治疗计划进行剂量沉积。
技术实现要素:
8.本发明涉及一种用于在对受试者进行强子疗法治疗期间监测强子束的方法,该受试者包括用放射性药物产品标记的肿瘤细胞,该放射性药物产品具有以准符合方式发射正电子和去激发伽马射线的放射性同位素,其中,强子疗法治疗根据包括作为时间的函数的预定参数的治疗计划来实施,以便在强子疗法治疗期间定义强子束随时间的至少一个特征,其中强子束包括由加速设备以预定频率发射的多个离散强子“爆发”,该方法包括以下步骤:
[0009]-当“爆发”撞击到受试者时:
[0010]
·
通过液态氙康普顿望远镜探测由“爆发”的强子与受试者的组织的相互作用产生的“瞬发伽马射线”;
[0011]
·
使用探测到的“瞬发伽马射线”来重建相互作用体积的图像,在相互作用体积内,“爆发”的强子与受试者的组织相互作用。
[0012]-当没有“爆发”撞击到受试者时:
[0013]
·
通过液态氙康普顿望远镜同时探测去激发伽马射线和由正电子产生的两个湮灭伽马射线,以提取用放射性药物产品标记的肿瘤细胞的位置;
[0014]
·
重建在强子疗法治疗期间要由强子束治疗的总肿瘤体积的图像;
[0015]-比较相互作用体积的图像和总肿瘤体积的图像,以便相对于测量的总肿瘤体积定位测量的相互作用体积;
[0016]-每当所测量的相互作用体积至少部分地包括在所测量的总肿瘤体积中时,计算一方面所测量的相互作用体积在所测量的总肿瘤体积中的位置与另一方面相互作用体积在治疗计划中定义的总肿瘤体积中的预定位置之间的偏差。
[0017]
根据本发明,由于相互作用体积的图像和总肿瘤体积的图像的重建和比较,有可能实时监测强子疗法治疗过程,并有效评价是否已经根据治疗计划实施了治疗。
[0018]
在一个实施例中,对于撞击到受试者的每个“爆发”获得相互作用体积的图像。这使得实时监测受试者中射束的位置成为可能。
[0019]
在一个实施例中,该方法还包括将相互作用体积的预定位置和所测量的相互作用体积相对于所测量的总肿瘤体积的位置之间的偏差与预定阈值进行比较的步骤。有利地,该实施例使得可以实时检查由射束在受试者体内递送的剂量分布是否在临床角度的可接受误差范围内与治疗计划一致。
[0020]
在一个实施例中,每当偏差大于预定阈值时,该方法包括计算强子束的至少一个新参数以便校正强子束的至少一个特征的步骤。放射治疗计划通常基于通过将hounsfield
单位(hus)转换成质子阻止能力以能够计算剂量分布的“ct扫描”计算机轴向断层摄影获得的受试者的三维图像来定义。然而,ct扫描仅仅是受试者在治疗前给定位置和给定时间的静态图像。然而,在强子疗法中,器官运动,例如排便、呼吸、心跳或由于膀胱充盈或体重变化引起的内部解剖结构的变化,也会引起密度的变化,并因此沿射束轨迹改变放射路径的长度。其在质子疗法中的影响会导致目标临床体积的严重剂量不足以及处于危险的器官和远离目标的正常组织的剂量过量。该实施例使得能够考虑任何几何变化并实时校正强子束的参数,从而使得能够在治疗计划中的目标肿瘤体积中递送剂量。
[0021]
在一个实施例中,受试者被定位在机动化的机械支撑件上,该机械支撑件被配置为在强子疗法治疗期间相对于射束移动受试者。在该实施例中,治疗计划的预定参数中的至少一个对应于机动化的机械支撑件的空间位置。
[0022]
在一个实施例中,每当偏差大于预定阈值时,该方法包括计算对应于机动化的机械支撑件的新空间位置的治疗计划的参数以便校正强子束的至少一个特征的步骤。这使得可以将射束源置于固定位置并避免使用“台架(gantry)”。
[0023]
在一个实施例中,强子束的新参数被发送到加速设备,该加速设备修改强子束的至少一个特征,以便修改相互作用体积相对于所测量的总肿瘤体积的位置。这产生了反馈回路,使得能够根据治疗计划实时调整射束。
[0024]
在一个实施例中,每当偏差大于预定阈值时,该方法包括停止强子束。有利地,该实施例使得可以停止治疗以防止处于危险中的器官的过量给药。
[0025]
在一个实施例中,该方法还包括重建三维图像序列的步骤,该三维图像序列是通过将相互作用体积的三维图像与具有相同康普顿相机参照物中的总肿瘤体积的三维图像融合而得到的。
[0026]
本发明还涉及一种用于在对受试者进行强子疗法治疗期间监测强子束的系统,该受试者包括用放射性药物产品标记的肿瘤细胞,该放射性药物产品具有以准符合方式发射正电子和去激发伽马射线的放射性同位素,其中,强子疗法治疗根据包括作为时间的函数的预定参数的治疗计划来实施,以便在强子疗法治疗期间定义强子束随时间的至少一个特征,其中强子束包括由加速设备以预定频率发射的多个离散强子“爆发”,该系统包括:
[0027]-射束成像模块,该射束成像模块被配置为当“爆发”撞击到受试者时接收从液态氙康普顿望远镜获取的数据,并且被配置为分析这些数据,以确定由“爆发”与受试者的组织的相互作用产生的“瞬发伽马射线”的发射点,从该发射点来重建相互作用体积的图像,在该体积内“爆发”的强子与组织相互作用;
[0028]-肿瘤成像模块,该肿瘤成像模块被配置为当没有“爆发”撞击到受试者时接收由液态氙康普顿望远镜采集的数据,并且被配置为分析这些数据,以通过同时探测去激发伽马射线和由正电子产生的两个湮灭伽马射线来提取用放射性药物产品标记的肿瘤细胞的位置,并且使用肿瘤细胞的位置来重建在强子疗法治疗期间将由强子束治疗的总肿瘤体积的图像;
[0029]-评估模块,该评估模块被配置为比较相互作用体积的图像和总肿瘤体积的图像,以相对于所测量的总肿瘤体积来定位所测量的相互作用体积,并且每当所测量的相互作用体积至少部分地包括在所测量的总肿瘤体积中时,计算一方面所测量的相互作用体积相对于所测量的总肿瘤体积的位置与另一方面相互作用体积在治疗计划中定义的总肿瘤体积
中的预定位置之间的偏差。
[0030]
实施根据本发明的方法的系统有利地使得可以根据相互作用体积的图像和总肿瘤体积的图像的重建而实时监测在受试者中递送的剂量,并检查其是否符合治疗计划中提供的剂量分布。
[0031]
在一个实施例中,在评估模块中,对于撞击在受试者上的每个爆发获得相互作用体积的图像。
[0032]
在一个实施例中,评估模块还被配置为将相互作用体积的预定位置和所测量的相互作用体积相对于所测量的总肿瘤体积的位置之间的偏差与预定阈值进行比较。
[0033]
在一个实施例中,受试者被定位在机动化的机械支撑件上,该机械支撑件被配置为在强子疗法治疗期间相对于射束移动受试者,并且其中治疗计划的预定参数中的至少一个对应于机动化的机械支撑件的空间位置。
[0034]
根据一个实施例,该系统还包括校正模块,该校正模块被配置为每当偏差大于预定阈值时计算强子束的至少一个新参数,以便校正强子束的至少一个特征。
[0035]
根据一个有利特征,校正模块还被配置为将强子束的新参数发送到加速设备,该加速设备修改强子束的至少一个特征,以便修改相互作用体积相对于所测量的总肿瘤体积的位置。
[0036]
根据一个实施例,该系统还包括安全模块,该安全模块被配置为每当偏差大于预定阈值时,向加速设备发送停止强子束的指令。
[0037]
根据一个实施例,该系统还包括图像重建模块,该图像重建模块被配置为重建三维图像序列,该三维图像序列是通过将相互作用体积的三维图像与具有根据相同康普顿相机参照物的总肿瘤体积的三维图像合融合而得到的。
[0038]
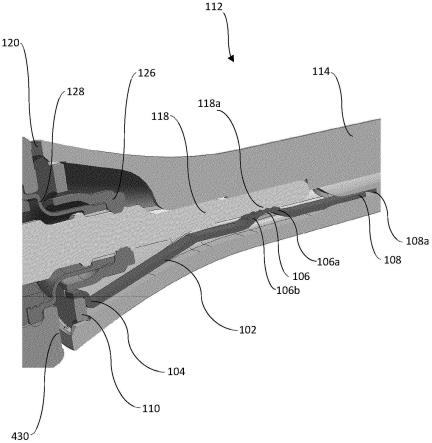
根据一个实施例,该系统包括康普顿望远镜,该康普顿望远镜是液态氙康普顿望远镜。
[0039]
根据一个实施例,该系统包括加速设备和/或机动化的机械支撑件。
[0040]
根据一个实施例,用于监测强子束的方法是计算机实施的方法。
[0041]
本发明还涉及一种包括指令的计算机程序,当该程序由计算机运行时,该指令导致计算机实施上述用于监测强子束的方法。
[0042]
本发明还涉及一种包括指令的计算机可读记录介质,当该介质由计算机运行时,导致计算机实施上述用于监测强子束的方法。
[0043]
定义
[0044]
在本发明中,以下术语定义如下:
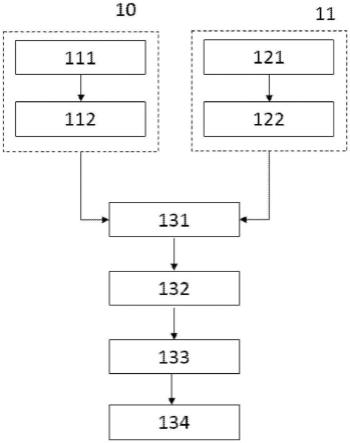
[0045]
‑“
爆发”是指具有相同加速相位的强子束。
[0046]
‑“
瞬发伽马射线”是指在强子与受试者的组织发生核反应后自然发射的高速和高能伽马射线。
[0047]
‑“
处于危险中的器官(oar)”是指医生设置剂量限制不得超过的器官,以尽可能防止与辐射相关的副作用
[0048]
‑“
ptv(或计划目标体积)”是指一个体积,该体积包括在影像学检查中可见的肿瘤(gtv或“总肿瘤体积”),通过增加由治疗过程的不精确性(关于路径、定位的不确定性、治疗机器的固有不确定性等)所定义的余量(margins),由医生根据所治疗的疾病类型定义治疗
余量(ctv或“临床目标体积”)来扩展。
[0049]
‑“
受试者”是指哺乳动物,优选人。根据本发明,受试者能够是患者,即在医学监督下、正在经历或已经经历医学治疗,或经历疾病发展的随访的人。
具体实施方式
[0050]
本发明的特征和优点将在以下对根据本发明的系统和方法的几个实施例的描述中显现出来,这些描述仅通过非限制性示例并参考附图给出,其中:
[0051]
图1是根据本发明第一实施例的治疗台和开放式配置的康普顿望远镜的示意性透视图;
[0052]
图2是表示根据本发明第一实施例的方法步骤的流程图;
[0053]
图3是根据本发明第二实施例的治疗台和开放式配置的康普顿望远镜的示意性透视图;
[0054]
图4是根据本发明第三实施例的治疗台和封闭式配置的康普顿望远镜的示意性透视图。
[0055]
本发明涉及一种在对患有肿瘤的受试者进行强子疗法治疗期间监测强子束的方法。
[0056]
通常,在强子疗法中心,强子在70至250mev之间的治疗能量下被加速,通常使用回旋加速器或同步加速器加速,并且强子被输送到治疗室,在该治疗室强子进入治疗喷嘴。薄的初始强子束横向和纵向分布,并被适当地格式化以实现治疗。使用的强子通常是质子或碳离子。能够使用机电装置来进行射束的散射和格式化,以用于以被动散射强子疗法(psht)治疗患者。这种技术特别适用于质子。第二种模式被称为均匀扫描,包括在宽视野上扫描粗略射束,然后通过为患者解剖结构定制的附件对该射束进行准直和深度补偿。这使得用更深的路径处理更广泛的领域成为可能。另一种方法包括以初始能量序列对强子的微射束进行磁扫描。强子在三个方向(x,y,z)上非常精细和精确地扫描肿瘤,以便在不使用定制附件的情况下照射肿瘤。这项技术能够用于利用强度调制强子疗法治疗患者。
[0057]
所述强子疗法根据治疗计划进行,该治疗计划包括作为时间的函数的预定参数,以便在强子疗法治疗期间定义强子束随时间的至少一个特征。
[0058]
根据一个实施例,定义射束的至少一个特征的预定参数根据所使用的强子疗法技术而变化。
[0059]
对于被动散射方法,由于使用了路径调制轮和由高z材料制成的一个或两个散射体以在感兴趣的区域中产生平坦的宽射束,所以获得了射束的横向和纵向散射。调制轮被配置为在强子旋转期间在强子的路径上插入不同厚度材料的叶片,以扩展布拉格峰并将其调整到目标体积的深度。因此,布拉格峰的调制是离散的。叶片厚度和宽度被设计成使得所得到的单个布拉格峰的总和给出了均匀且同质深度的剂量分布、sobp或“展开的布拉格峰”。为了使剂量分布横向适应目标体积的形状(加上适当的余量),使用了通常由足够厚度(2cm至8cm)的黄铜块组成的孔,以吸收最高能量的入射强子。最后,为了根据目标的远端形状创建剂量分布,使用距离补偿器将被动散射束的布拉格峰扩展得更远。
[0060]
根据一个实施例,强子疗法使用被动散射技术。在该实施例中,预定参数至少包括射束能量和强子路径调制(即,sobp)。实际上,吸收器和补偿器是为患者定制的附件,并且
其位置在治疗期间不会改变。
[0061]
对于均匀扫描,使用主动扫描系统,该系统通过多次微照射,在肿瘤中构建布拉格峰调制。通过一层接一层的横向扫描来照射目标体积。专用调制轮用于逐步平移布拉格峰。为了更好地定义调制的布拉格峰,由于散射体的吸收板和调制轮的叶片的关联,中间深度层被照射。一旦被调制,质子束就被第一位置的垂直磁体分别在y和x方向上广泛扫描,然后被随后的水平磁体扫描。
[0062]
根据一个实施例,强子疗法使用均匀扫描技术。在该实施例中,预定参数至少包括射束能量、强子路径调制以及射束的x和y位置。
[0063]
主动微束扫描包括使用磁体在水平和垂直方面上精确扫描基本离子束,同时改变质子的初始能量,以便逐层扫描整个肿瘤体积,而无需使用为患者定制的附件。由于能量选择系统,深度(z)由质子束能量调制来管理。细射束在平面(x,y)中的位置通过与下文所述相同的扫描磁体进行控制。因此产生了一组光点,并分布在整个目标体积上。由于位于扫描磁体之前的四极,所以在等中心点处的光点尺寸是合适的。其主要优点是减少了产生的中子数量和输出损失,这两者都是由于被动射束格式化附件造成的。
[0064]
根据一个实施例,强子疗法使用主动微束扫描技术。在该实施例中,预定参数至少包括x、y和z坐标(即射束能量)以及每个光点的强度。
[0065]
实施磁束扫描的技术可以配置为使得射束偏转成为可能,从而覆盖能够达到30cm
×
40cm的治疗区域。
[0066]
在强子疗法治疗室中,受试者通常以相对于治疗喷嘴的预定位置坐在椅子上或斜靠在治疗台上,射束从该治疗喷嘴射出以撞击到受试者。
[0067]
在一个实施例中,治疗喷嘴位于距受试者预定距离的固定位置。治疗喷嘴能够相对于受试者定位,使得射束f的入射方向垂直于受试者的矢状面进入受试者。在优选实施例中,治疗喷嘴面向受试者定位,使得射束的进入点在受试者的前部。这使得射束能够通过穿过最小可能厚度的健康组织和/或处于危险中的器官而穿透受试者直到目标体积,从而减少它们接收的剂量。
[0068]
在治疗喷嘴处于固定位置的情况下,仅使用磁扫描就能够改变射束f的入射方向,因此也可以改变其在组织中的进入点,这使得能够实现射束的小范围偏离。
[0069]
为了能够在超过180度的弧上改变射束的入射角,在一个实施例中,治疗台t被配置为相对于射束的入射点移动受试者,特别是在强子疗法治疗期间。在图1所示的第一实施例中,治疗台t能够围绕三个轴线a1、a2和a3在两个旋转方向上旋转,并且能够沿着轴线a1、a2和a3在每个轴线的两个相反方向上平移。
[0070]
在该第一实施例中,康普顿望远镜tc包括呈两个中空半圆柱体形式的两个康普顿半探测器,这两个探测器相对于轴线a1对称,并且沿着方向a2彼此分开,从而使得到达受试者上方的射束f能够通过。这两个半圆柱体是互补的,如果连接在一起,能够形成完整的中空圆柱体。特别地,每个半探测器形成一个角度为180
°
的圆弧。在该实施例中,每个康普顿半探测器能够沿轴线a1、a2和a3在两个方向上平移,并绕轴线a3旋转。
[0071]
在图3所示的第二实施例中,治疗台t还能够围绕三个轴线a1、a2和a3在两个旋转方向上旋转,并且能够沿着轴线a1、a2和a3在每个轴线的两个相反方向上平移。康普顿望远镜tc包括呈两个中空半圆柱体形式的两个康普顿半探测器,这两个探测器相对于轴线a1对
称,并且沿着方向a3彼此分开,从而使得到达受试者侧方的射束f能够通过。
[0072]
第一和第二实施例中的康普顿望远镜的配置在本说明书中被称为“开放式配置的康普顿望远镜”。在第一和第二实施例中,每个康普顿半探测器能够彼此独立地移动,以更好地适应射束f在受试者上的入射位置和方向,同时保持康普顿望远镜tc在受试者上尽可能封闭的配置。事实上,当两个半探测器最接近受试者时,康普顿望远镜具有更高的空间分辨率,使得能够探测更多数量的事件(即瞬发伽马射线、去激发伽马射线或湮没伽马射线)。
[0073]
在图4所示的第三实施例中,康普顿望远镜包括单个探测体积,该单个探测体积具有中空圆柱体的形式,并包括横向狭缝,该狭缝的尺寸能够允许到达受试者侧方的射束f通过。康普顿望远镜的这种配置在本说明书中被称为“封闭式配置的康普顿望远镜”。治疗台t沿着轴线a1对齐,轴线a1也是中空圆柱体的纵向轴线。治疗台t能够在封闭式配置的康普顿望远镜内移动,特别是能够围绕三个轴线a1、a2和a3在两个旋转方向上旋转,并且能够沿着轴线a1、a2和a3在每个轴线的两个相反方向上平移。在该实施例中,康普顿望远镜安装在机械支撑件上,该支撑件是机动化的,以便能够沿着轴线a1、a2和a3平移并且绕轴线a3枢转。
[0074]
在第一、第二和第三实施例中,受试者所在的治疗台t牢固地安装在机动化的机械支撑件(未示出)上,该机械支撑件使得治疗台能够以下文所述的自由度移动。机动化的机械支撑件特别能够使治疗台t以2至15度的间隔进行旋转运动,并以0.5cm至5cm的间隔进行平移运动。
[0075]
在一个实施例中,机动化的支撑件是机器人定位臂,其被配置为具有0.1cm至1cm的灵敏度。
[0076]
在包括机动化的机械支撑件上的治疗台t的实施例中,治疗计划的预定参数中的至少一个对应于治疗台t的空间位置,因此对应于机动化的机械支撑件的空间位置。这个特别有利的实施例使得有可能避免使用巨大的等中心旋转头(“台架”),该旋转头被配置为以超过180
°
的可变角度递送射束。与机动化的治疗床相比,装有治疗喷嘴的“台架”具有极高的生产成本。因此,避免使用“台架”可以降低强子治疗基础设施的构造成本,使这项技术更容易实现。
[0077]
在康普顿望远镜能够被移动的实施例中,治疗计划的预定参数中的至少一个对应于封闭式配置的康普顿望远镜的空间位置,或对应于开放式配置的康普顿望远镜的每个康普顿半探测器的空间位置。
[0078]
根据本发明的方法中使用的加速设备产生强子束,该强子束包括由加速设备以预定频率发射的多个离散强子“爆发”。
[0079]
在一个实施例中,产生所用强子束的加速设备是同步加速器或线性加速器。同步加速器以所需的能量以射束(脉冲)的形式加速强子。一旦射束达到所需的能量,它就被提取出来,并经由“射束线”发送到治疗室。然而,不管加速器的类型如何,提取的窄的单能射束通过射束线被磁性引导到治疗喷嘴。
[0080]
在一个实施例中,加速设备是包括感应单元的“数字”同步加速器,其中由于外部射束控制装置和能够控制它们的机载计算机(开关和fpga),磁体暴露于其操作的快速变化。
[0081]
除了带电颗粒的自激活和发射之外,“爆发”的相互作用还在材料中产生被称为“瞬发伽马射线”的高能伽马射线的快速发射。“瞬发伽马射线”生成轮廓与强子路径有很好
的关联。因此,对“瞬发伽马射线”的探测能够有效地用于监测射束和受试者体内剂量沉积的相互作用点。
[0082]
图2示出了包括几个数据采集和计算步骤的方法的实施例。
[0083]
根据本发明的方法被配置为能够通过获得相互作用体积和总肿瘤体积的图像序列来实时监测强子疗法治疗,在相互作用体积内“爆发”的强子与受试者的组织相互作用。只有当“爆发”撞击到受试者时,才能获得相互作用体积的图像。
[0084]
因此,该方法包括第一阶段,当“爆发”撞击到受试者时10,该第一阶段包括以下步骤:
[0085]-通过康普顿望远镜探测111由“爆发”的强子与受试者的组织的相互作用产生的“瞬发伽马射线”;
[0086]-使用探测到的“瞬发伽马射线”来重建112相互作用体积的图像,在相互作用体积内,“爆发”的强子与受试者的组织相互作用。
[0087]
在优选实施例中,康普顿望远镜是液态氙康普顿望远镜。液态氙的基本物理性质,例如其高密度和高原子序数,赋予电离辐射很高的阻止能力,这使得液态氙成为能量范围为几十kev至几十mev的伽马射线探测器的理想材料。液态氙既是用于探测电离辐射的极好的活性介质,也是极好的闪烁体,其优点是能够用均匀的敏感介质构造大型探测器。康普顿望远镜利用入射光子在相互作用体积中的连续相互作用(两个或多于两个)。基于相互作用点和在每次相互作用中沉积的能量,经由康普顿运动学的应用,入射光子的方向能够减少到锥体。光子源的位置能够通过不同康普顿锥体的相交来确定,这从来自相同源的光子的后续相互作用来推断。因此,这种类型的探测器非常适合于探测几mev的相应能量范围内的“瞬发伽马射线”,其中康普顿散射是主要过程。
[0088]
所测量的相互作用体积的图像能够是三维图像。
[0089]
在一个实施例中,对于撞击到受试者的每个“爆发”,获得相互作用体积的图像。在该实施例中,图像采集频率取决于加速设备中的“爆发”产生频率。因此,每秒采集的图像数量能够在5至30变化。
[0090]
在一个实施例中,康普顿望远镜被配置为对于“爆发”的每个图像具有约1mm的空间分辨率。
[0091]
在本发明中,受试者的肿瘤细胞用放射性药物产品标记,该放射性药物产品包含以准符合方式发射正电子和去激发伽马射线的放射性同位素。由于使用了三光子成像原理,这使得能够识别无线电标记的位置。事实上,正电子在组织中沿着短路径(大约1mm)行进,然后湮灭成以相反方向移动的511kev的两个光子(“背对背伽马射线”)。
[0092]
三光子成像基于康普顿望远镜和放射性药物的组合使用,该放射性药物具有以准符合方式发射正电子和去激发伽马射线的放射性同位素。
[0093]
对这两个湮灭光子的同时探测使得绘制响应线(lor)成为可能,即连接康普顿望远镜中湮灭光子的两个相互作用点并穿过组织中正电子湮灭点的线。因此,放射性同位素的位置通过lor与康普顿锥体之间的相交来获得,该康普顿锥体是基于去激发伽马射线与康普顿望远镜的相互作用来定义的。康普顿锥体的表面包括去激发伽马射线的入射方向,并且能够从康普顿运动学直接推断。康普顿锥体的孔径角θ由康普顿散射公式定义,其中康普顿锥体的轴线使用进入望远镜的去激发伽马射线的两个相互作用点中的第一个来确定。
[0094]
这种技术有利地减少了获取图像所需的衰变次数,从而减少了采集时间和/或每位患者接种的物质的量。
[0095]
当没有“爆发”撞击到受试者时11,该方法的第一阶段包括以下步骤:
[0096]-如上所述,通过利用康普顿望远镜同时探测去激发伽马射线和由正电子产生的两个湮灭伽马射线,以提取121用放射性药物产品标记的肿瘤细胞的位置;
[0097]-基于肿瘤细胞的位置,重建122将在强子疗法治疗期间由强子束治疗的总肿瘤体积的图像。
[0098]
在一个优选实施例中,放射性药物中使用的放射性同位素是
44
sc,其在空间和时间准符合中发射能量为1.157mev的正电子和光子。
[0099]
总肿瘤体积的图像是在两次连续“爆发”之间采集的,以防止图像被“瞬发伽马射线”产生的信号污染。
[0100]
在一个示例中,康普顿望远镜的结构是这样的,对于10s的采集,总肿瘤体积的图像的空间分辨率约为1mm。所获得的分辨率是由于探测器的物理限制和注入受试者的同位素的活性。
[0101]
在一个实施例中,总肿瘤体积的图像是三维图像。
[0102]
该方法还包括第二阶段,该第二阶段包括以下阶段:
[0103]-比较131相互作用体积的图像和总肿瘤体积的图像,以便相对于测量的总肿瘤体积定位测量的相互作用体积;
[0104]-每当所测量的相互作用体积至少部分地包括在所测量的总肿瘤体积中时,计算132一方面所测量的相互作用体积在所测量的总肿瘤体积中的位置与另一方面相互作用体积在治疗计划中定义的总肿瘤体积中的预定位置之间的偏差。
[0105]
能够通过叠加图像来计算偏差。一旦所测量的相互作用体积的图像和所测量的总肿瘤体积的图像由相同的探测器采集,并且因此相对于相同的参照物进行重建,这是容易获得的。
[0106]
比较阶段使得可以将布拉格峰的实际位置相对于用于生成治疗计划的计算软件中计算的位置进行比较。
[0107]
在一个实施例中,该方法还包括步骤133,其中将相互作用体积的预定位置和所测量的相互作用体积相对于所测量的总肿瘤体积的位置之间的偏差与预定阈值进行比较。预定阈值能够对应于目标体积(ptv)周围1mm至5mm的余量。阈值也能够根据目标体积周围处于危险中的器官的放射敏感性来定义。例如,预定阈值对应于对高度放射敏感性的淋巴结0.5mm的余量和较低放射敏感性的肺方向的1mm的余量。
[0108]
在一个实施例中,每当偏差大于预定阈值时,该方法包括计算134强子束的至少一个新参数以便校正强子束的至少一个特征的步骤。
[0109]
在一个实施例中,每当偏差大于预定阈值时,该方法包括计算对应于机动化支撑件的新空间位置的治疗计划的参数以便校正强子束的至少一个特征的步骤。
[0110]
在一个实施例中,强子束的新参数被发送到加速设备,该加速设备修改强子束的至少一个特征,以便修改相互作用体积相对于所测量的总肿瘤体积的位置。
[0111]
在一个实施例中,每当偏差大于预定阈值时,该方法包括停止强子束。这使得有可能采取安全措施来避免与治疗计划不一致的任何照射。
[0112]
在一个实施例中,该方法还包括重建三维图像序列的步骤,该三维图像序列是通过将相互作用体积的三维图像与具有相同康普顿相机参照物中的总肿瘤体积的三维图像融合而得到的。由于屏幕为医疗专业人员提供了视觉信息,因此能够实时查看这样的图像序列。
[0113]
本发明还涉及一种用于在对受试进行强子疗法治疗期间监测强子束的系统。该系统被配置为在根据包括作为时间的函数的预定参数的治疗计划实施的强子疗法治疗期间,监测强子束,该强子束包括由加速设备以预定频率发射的多个离散强子“爆发”,以便定义强子疗法治疗期间强子束随时间的至少一个特征。
[0114]
现在将详细描述用于监测强子束的系统。在下文中,模块应该被理解为功能实体,而不是物理上分离的硬件部件。因此,它们能够组合在同一个具体的硬件部件中,也能够分布在几个这样的部件中。此外,这些模块中的每一个可选地又在至少两个物理部件之间共享。此外,模块以硬件、软件、微程序或其任何其他组合形式来实现。
[0115]
该系统包括射束成像模块,该射束成像模块被配置为当“爆发”撞击到受试者时接收从康普顿望远镜获取的数据。在一个实施例中,数据采集是在线且连续进行的。在对应于向受试者发出“爆发”的时间窗口期间采集的数据被发送到射束成像模块。该模块还被配置为分析这些数据,以便确定由“爆发”与受试者组织的相互作用产生的“瞬发伽马射线”的发射点。因此,该模块使用“瞬发伽马射线”的发射点来重建相互作用体积的图像,在该体积内“爆发”的强子与组织相互作用。
[0116]
在一个实施例中,射束成像模块还被配置为识别和拒绝与事件相对应的任何数据,这些事件不是基于康普顿望远镜的敏感体积中的“瞬发伽马射线”的相互作用。
[0117]
该系统还包括肿瘤成像模块,该肿瘤成像模块被配置为当没有“爆发”撞击到受试者时接收由康普顿望远镜采集的数据。在一个实施例中,数据采集是在线且连续进行的,并且只有在两个连续的受试者“爆发”之间采集的数据被发送到肿瘤成像模块。这使得仅从肿瘤细胞捕获的放射性同位素的贝塔衰变中选择数据成为可能。此外,该模块被配置为分析这些数据,以便通过同时探测去激发伽马射线和由正电子产生的两个湮灭伽马射线来提取用放射性药物产品标记的肿瘤细胞的位置,并且使用肿瘤细胞的位置来重建在强子疗法治疗期间将由强子束治疗的总肿瘤体积的图像。
[0118]
在一个实施例中,康普顿望远镜是液态氙康普顿望远镜。
[0119]
该系统还包括评估模块,其被配置为比较相互作用体积的图像和总肿瘤体积的图像,以便相对于所测量的总肿瘤体积来定位所测量的相互作用体积,并且每当所测量的相互作用体积至少部分地包括在所测量的总肿瘤体积中时,计算一方面所测量的相互作用体积相对于所测量的总肿瘤体积的位置与另一方面相互作用体积在治疗计划中定义的总肿瘤体积中的预定位置之间的偏差。
[0120]
在一个实施例中,该评估模块还被配置为将相互作用体积的预定位置和所测量的相互作用体积相对于所测量的总肿瘤体积的位置之间的偏差与预定阈值进行比较。
[0121]
在一个实施例中,该系统还包括校正模块,该校正模块被配置为每当偏差大于预定阈值时计算强子束的至少一个新参数,以便校正强子束的至少一个特征。
[0122]
如说明书的第一部分中所解释的,定义强子束特征的预定参数根据强子疗法治疗的类型而变化。基于能够由治疗喷嘴输送的治疗类型,在一个疗程期间能够被动态影响的
预定参数包括射束能量、强子路径调制(即sobp)、强子路径调制和/或射束的x和y位置。
[0123]
在一个实施例中,校正模块还被配置为将强子束的新参数发送到加速设备,该加速设备修改强子束的至少一个特征,以便修改相互作用体积相对于所测量的总肿瘤体积的位置。
[0124]
在一个实施例中,加速设备包括设置在治疗室内相对于治疗台固定位置的治疗喷嘴。
[0125]
在一个实施例中,治疗台t被配置为相对于射束的入射点移动受试者,特别是在强子疗法治疗期间。在图1所示的第一实施例中,治疗台t能够围绕三个轴线a1、a2和a3在两个旋转方向上旋转,并且能够沿着轴线a1、a2和a3在每个轴线的两个相反方向上平移。
[0126]
在该第一实施例中,康普顿望远镜tc包括呈两个中空半圆柱体形式的两个康普顿半探测器,这两个探测器相对于轴线a1对称,并且沿着方向a2彼此分开,从而使得到达受试者上方的射束f能够通过。这两个半圆柱体是互补的,如果连接在一起,能够形成完整的中空圆柱体。特别地,每个半探测器形成一个角度为180
°
的圆弧。在该实施例中,每个康普顿半探测器能够沿轴线a1、a2和a3在两个方向上平移,并绕轴线a3旋转。
[0127]
在图3所示的第二实施例中,治疗台t还能够围绕三个轴线a1、a2和a3在两个旋转方向上旋转,并且能够沿着轴线a1、a2和a3在每个轴线的两个相反方向上平移。康普顿望远镜tc包括呈两个中空半圆柱体形式的两个康普顿半探测器,这两个探测器相对于轴线a1对称,并且沿着方向a3彼此分开,从而使得到达受试者侧方的射束f能够通过。
[0128]
第一和第二实施例中的康普顿望远镜的配置在本说明书中被称为“开放式配置的康普顿望远镜”。在第一和第二实施例中,每个康普顿半探测器能够彼此独立地移动,以更好地适应射束f在受试者上的入射位置和方向,同时保持康普顿望远镜tc在受试者上尽可能封闭的配置。事实上,当两个半探测器最接近受试者时,康普顿望远镜具有更高的空间分辨率,使得能够探测更多数量的事件(即瞬发伽马射线、去激发伽马射线或湮没伽马射线)。
[0129]
在图4所示的第三实施例中,康普顿望远镜包括单个探测体积,该单个探测体积具有中空圆柱体的形式,并包括横向狭缝,该狭缝的尺寸能够允许到达受试者侧方的射束f通过。康普顿望远镜的这种配置在本说明书中被称为“封闭式配置的康普顿望远镜”。治疗台t沿着轴线a1对齐,轴线a1也是中空圆柱体的纵向轴线。治疗台t能够在封闭式配置的康普顿望远镜内移动,特别是能够围绕三个轴线a1、a2和a3在两个旋转方向上旋转,并且能够沿着轴线a1、a2和a3在每个轴线的两个相反方向上平移。在该实施例中,康普顿望远镜安装在机械支撑件上,该支撑件是机动化的,以便能够沿着轴线a1、a2和a3平移并且绕轴线a3枢转。
[0130]
在第一、第二和第三实施例中,受试者所在的治疗台t牢固地安装在机动化的机械支撑件(未示出)上,该机械支撑件使得治疗台能够以下文所述的自由度移动。机动化的机械支撑件特别能够使治疗台t以2至15度的间隔进行旋转运动,并以0.5cm至5cm的间隔进行平移运动。
[0131]
在一个实施例中,机动化的支撑件是机器人定位臂,其被配置为具有0.1cm至1cm的灵敏度。
[0132]
在包括机动化的机械支撑件上的治疗台t的实施例中,治疗计划的预定参数中的至少一个对应于机动化的机械支撑件的空间位置,特别是治疗台t的空间位置。校正模块还被配置为计算对应于机动化的机械支撑件的新空间位置的治疗计划的新参数,以便校正强
子束的至少一个特征,特别是对应于射束的入射方向和入射点。
[0133]
在康普顿望远镜能够被移动的实施例中,治疗计划的预定参数中的至少一个对应于封闭式配置的康普顿望远镜的空间位置,或对应于开放式配置的康普顿望远镜的每个康普顿半探测器的空间位置。校正模块还被配置为计算对应于封闭式配置的康普顿望远镜或开放式配置的康普顿望远镜的每个康普顿半探测器的新空间位置的治疗计划的新参数。
[0134]
在一个实施例中,校正模块还被配置为将与机动化的机械支撑件的新位置相关的强子束的新参数发送到机动化的机械支撑件本身,以便修改射束的入射方向和/或入射点,并因此修改相互作用体积相对于所测量的总肿瘤体积的位置。
[0135]
在一个实施例中,该系统包括图像重建模块,该图像重建模块被配置为重建三维图像序列,该三维图像序列是通过将相互作用体积的三维图像与具有根据相同康普顿相机参照物的总肿瘤体积的三维图像融合而得到的。这使得获得治疗疗程的影像成为可能。
[0136]
在一个实施例中,系统的模块包括至少一个处理器和至少一个处理器可读记录介质。
[0137]
术语“处理器”不应被解释为限于能够运行软件的“硬件”,而是泛指处理设备,例如能够包括计算机、微处理器、集成电路或可编程逻辑控制器(pld)。处理器还能够包括一个或更多个图形处理单元(gpu),无论它们是用于信息图和图像处理还是用于其他功能。此外,用于执行相关联和/或所得功能的指令和/或数据能够存储在处理器可读的任何介质上,例如集成电路、硬盘驱动器、cd(光盘)、诸如dvd(数字多功能盘)的光盘、ram(随机存取存储器)或rom(只读存储器)。指令尤其能够存储在硬件、软件、微程序或其任意组合中。
[0138]
本发明还涉及一种包括指令的计算机程序,当该程序由计算机运行时,使得计算机实施上述用于监测强子束的方法。
[0139]
本发明还涉及一种包括指令的计算机可读记录介质,当该介质由计算机运行时,使得计算机实施上述用于监测强子束的方法。
[0140]
在一个实施例中,计算机可读记录介质是非瞬态的。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。