1.本发明涉及医用材料领域,特别是涉及一种涂层材料及其制备方法和用途。
背景技术:
2.植入类医疗器械在植入过程中会与组织产生摩擦,这可能导致炎症以及血栓等一系列的问题,亲水润滑涂层可以很好的解决这些问题,同时提升患者的舒适度。
3.植入类医疗器械与生物环境接触时都是以外源性物质的状态存在,会引起不同程度的凝血现象,影响血液的流动性,从而严重影响患者的健康,甚至会危及生命,提高材料的抗凝血性能是解决这一问题的关键,而材料的表面改性又是提高材料抗凝血性能的最常用方案。
4.目前的涂层技术往往是单一功能的,如抗凝血涂层、抗菌涂层、亲水涂层,无法完全解决医疗器械使用过程中的其他问题。而且涂层加工方法也存在着一定的局限性,例如dsm的亲水涂层通过紫外光固化技术赋予材料良好的润滑性能,但对一些结构复杂的医疗器械来说,很难使器械各个面附上均匀且牢固的涂层。美敦力公司的第三代pipeline密网支架,采用了磷酰胆碱聚合物涂层技术,有效降低了支架的致栓性,但其润滑性却不如常用的亲水涂层。同时大多涂层对不同的基底材料也有着不同的粘附性,因此并不适用于所有材料,与部分基底材料结合后会导致涂层稳定性差、易脱落的问题。其它的一些常见的处理方法,如酸碱腐蚀处理、等离子体处理等往往也会对基材的表面结构造成一定程度的破坏,可能会对材料的结构性能等造成一定的破坏,同时也更易导致血栓等一系列的问题。
技术实现要素:
5.鉴于以上所述现有技术的缺点,本发明的目的在于提供一种涂层材料及其制备方法和用途,用于解决现有技术中的问题。
6.为实现上述目的及其他相关目的,本发明提供一种涂层材料的制备方法,所述制备方法包括如下步骤:
7.1)将形成有氨基保护层的基底材料置于双官能团修饰的聚乙二醇溶液中,使所述基底材料上接枝双官能团修饰的聚乙二醇;
8.2)将步骤1)得到的产物置于伯胺类化合物溶液中,使伯胺类化合物偶联至步骤1)得到的产物上;
9.3)将步骤2)得到的产物置于mpc溶液中,使mpc通过迈克尔加成反应接枝于步骤2)获得的产物上,即获得所述涂层材料。
10.本发明还提供所述的制备方法获得的涂层材料。
11.本发明还提供所述的涂层材料在医疗器械表面修饰改性中的用途。
12.本发明还提供一种医疗器械表面修饰改性的方法,所述方法包括以医疗器械为基底材料,在基底材料上按照所述涂层材料的制备方法对基底材料进行表面修饰改性。
13.如上所述,本发明的涂层材料及其制备方法和用途,具有以下有益效果:具有优异
的润滑性、抗凝血性能和牢固度。良好的润滑性可解决器械使用时与组织的摩擦问题,更容易通过体内弯曲的血管,易于输送及释放,改善患者的舒适度,有效减小感染和血栓的发生。优异的抗凝血性抑制血栓产生,减少不良反应的发生。优异的牢固度能在体内复杂的血液环境中长时间使用。涂层材料几乎适用于任何基底材料,具有普适性,同时对基底材料无任何破坏,能维持材料的结构性能。
具体实施方式
14.本发明提供一种涂层材料的制备方法,所述制备方法包括如下步骤:
15.1)将形成有氨基保护层的基底材料置于双官能团修饰的聚乙二醇溶液中,使所述基底材料上接枝双官能团修饰的聚乙二醇;
16.2)将步骤1)得到的产物置于伯胺类化合物溶液中,使伯胺类化合物偶联至步骤1)得到的产物上;
17.3)将步骤2)得到的产物置于mpc溶液中,使mpc通过迈克尔加成反应接枝于步骤2)获得的产物上,即获得所述涂层材料。
18.基底材料是指待用涂层材料修饰改性的材料,或称为待修饰改性的材料。
19.在一种实施方式中,所述基底材料进行修饰改性前进行抛光、清洗干燥。
20.在一种实施方式中,所述基底材料选自金属材料或高分子材料。
21.在一种实施方式中,所述金属材料选自不锈钢、钴基合金、钛及其合金、镁及其合金或纯铁中的一种或多种。
22.在一种实施方式中,所述高分子材料选自聚酰胺、聚四氟乙烯、膨体聚四氟乙烯、聚丙交酯、聚酯、聚醚、聚氨酯、聚烯烃、聚对苯二甲酸乙二醇酯或相关的嵌段共聚物中的一种或多种。
23.所述制备方法中,“置于”是指基底材料或前一步骤的产物被溶液浸没的状态,并不限定各反应物的加入顺序。
24.在一种实施方式中,步骤1)中所述形成有氨基保护层的基底材料通过下述方法制备:
25.a)将基底材料置于邻苯二酚衍生物溶液中反应,使基底材料表面形成醌基保护层;
26.b)将形成有醌基保护层的基底材料置于伯胺类化合物溶液中发生席夫碱反应,使基底材料表面形成氨基保护层。
27.在一种实施方式中,步骤a)中,基底材料置于邻苯二酚衍生物溶液中反应1-24小时。在一较佳实施方式中,反应时间为2-10小时。所述反应时间例如为2-3小时、3-6小时或6-10小时。
28.在一种实施方式中,步骤a)在室温下静置、振荡或超声反应。
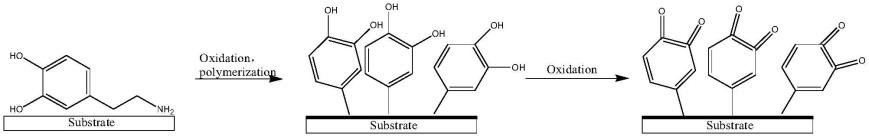
29.在一种实施方式中,步骤a)中,所述邻苯二酚衍生物选自多巴胺、去甲基肾上腺素。
30.在一较佳实施方式中,所述邻苯二酚衍生物溶液中邻苯二酚衍生物的浓度为0.5-25mg/ml。优选的,所述邻苯二酚衍生物溶液的浓度为1-20mg/ml。所述邻苯二酚衍生物溶液的浓度例如为1-5mg/ml、5-10mg/ml、10-15mg/ml或15-20mg/ml。邻苯二酚衍生物几乎能与
任何基底材料共价结合,具有普适性,同时对基底材料无任何破坏,能维持材料的结构性能。
31.在一更佳实施方式中,所述邻苯二酚衍生物溶液的ph为6-12,和/或,溶剂为500-2000mm的tris-hcl。优选的,所述tris-hcl的浓度为1000-1500mm。
32.具体的,邻苯二酚衍生物通过氧化聚合在基底材料上形成富含醌基的聚邻苯二酚衍生物层(或称为醌基保护层)。以多巴胺为例,反应路线如下(反应式中,substrate指基底材料):
33.在一种实施方式中,步骤a)反应结束后用超纯水反复润洗表面并用氮气吹干再进行步骤b)。
34.在一种实施方式中,步骤b)中使用的为伯胺类化合物的水溶液。具体的,在一种实施方式中,所述伯胺类化合物水溶液的质量分数为0.1-50%,和/或,ph为6-12。
35.在一种实施方式中,步骤b)在室温下反应。本发明中所指的室温是指15-30℃。在一种实施方式中,步骤b)的反应时间为0.5-26h。在一较佳实施方式中,步骤b)的反应时间为1-24h。
36.在一种实施方式中,所述伯胺类化合物选自聚烯丙胺、乙二胺、己六胺和/或聚乙烯亚胺。通过聚烯丙胺、乙二胺、己六胺或聚乙烯亚胺的氨基与醌基保护层中的醌基发生schiff碱反应,从而将聚烯丙胺、乙二胺、己六胺或聚乙烯亚胺固定在基底材料表面。步骤b)中通过共价结合伯胺类化合物从而提供更多的氨基结合位点,为后续共价结合更多的聚乙二醇二羧酸和mpc提供基础,从而可赋予涂层材料更加优异的润滑性和抗凝血性能。步骤b)具体的反应路线如下:
[0037][0038]
其中,h2n-r-nh2表示聚烯丙胺、乙二胺、己六胺或聚乙烯亚胺。
[0039]
在一种实施方式中,在步骤b)完成后,用去离子水冲洗、氮气干燥后再进行下一步反应。
[0040]
在一种实施方式中,步骤1)中的双官能团修饰的聚乙二醇选自同双官能团修饰的聚乙二醇,所述同双官能团修饰的聚乙二醇例如为聚乙二醇二羧酸(即peg二羧酸,cooh-peg-cooh)。
[0041]
所述双官能团修饰的聚乙二醇中聚乙二醇的分子量为400-20000。
[0042]
在一种实施方式中,所述聚乙二醇二羧酸溶液中聚乙二醇二羧酸的质量分数为0.05%-10%。在一较佳实施方式中,所述聚乙二醇二羧酸溶液中聚乙二醇二羧酸的质量分数为0.1%-5%。所述聚乙二醇二羧酸溶液中聚乙二醇二羧酸的质量分数例如为0.1%-1%、1%-3%或3%-5%。
[0043]
在一种实施方式中,步骤1)中通过氨基和羧基偶联剂的偶联作用将聚乙二醇中的羧基与氨基保护层上的氨基共价结合。
[0044]
在一种实施方式中,所述氨基和羧基偶联剂选自edc和nhs。
[0045]
在一种实施方式中,步骤1)具体为将形成有氨基保护层的基底材料浸没到peg二羧酸溶液中,加入edc
·
hcl与nhs,反应1-25小时。优选的,反应时间为2-20小时。
[0046]
在一种实施方式中,所述peg二羧酸溶液的溶剂为水。
[0047]
在一种实施方式中,所述edc
·
hcl和nhs的质量分数为0.1%-5%。
[0048]
在一种实施方式中,在振荡下反应2-20小时。具体的反应路线如下:
[0049][0050]
在一种实施方式中,在步骤1)完成后,用去离子水冲洗、氮气干燥后再进行下一步反应。
[0051]
步骤2)中通过nhs的偶联作用将伯胺类化合物共价结合至双官能团修饰的聚乙二醇上。
[0052]
在一种实施方式中,步骤2)中使用的为伯胺类化合物的水溶液。具体的,在一种实施方式中,所述伯胺类化合物的水溶液的质量分数为0.1-50%,和/或,ph为6-12。
[0053]
在一种实施方式中,步骤2)的反应时间为2-10h。具体的,反应路线如下:
[0054]
[0055]
其中,h2n-r-nh2表示聚烯丙胺、乙二胺、己六胺或聚乙烯亚胺。
[0056]
获得的产物可以简单表示为如下:
[0057][0058]
在一种实施方式中,在步骤2)完成后,用去离子水冲洗、氮气干燥后再进行下一步反应。
[0059]
步骤3)中的mpc指聚(2-甲基丙烯酰氧乙基磷酰胆碱)。
[0060]
在一种实施方式中,步骤3)中mpc溶液的浓度为10-150mg/ml。在一较佳实施例中,步骤3)中mpc溶液的浓度为20-100mg/ml。mpc溶液的浓度例如为20-40mg/ml、40-50mg/ml、50-70mg/ml或70-100mg/ml。
[0061]
在一种实施方式中,步骤3)中使用的是mpc的甲醇溶液。
[0062]
在一种实施方式中,步骤3)中加入mpc后室温下震荡反应2-48小时。例如反应2-12小时或12-48小时。
[0063]
步骤3)通过mpc分子中的双键与步骤2)中获得的产物上的伯氨基之间发生迈克尔加成反应,将mpc分子共价接枝于步骤2)获得的产物上,从而在基底材料表面获得所述涂层材料,具体的,反应路线如下:
[0064][0065]
在一种实施方式中,在步骤3)完成后,还可以用去离子水冲洗、氮气干燥。即在步骤1)至步骤3)每一步反应完成后,均用去离子水冲洗、氮气干燥。
[0066]
涂层材料中的mpc赋予涂层材料优异的抗凝血性,可以使涂层材料抑制血栓产生,减少不良反应的发生。
[0067]
所述涂层材料的制备过程中采用全共价接枝peg二羧酸和mpc,使制备的涂层材料具有优异的牢固度,能在体内复杂的血液环境中长时间使用。
[0068]
本发明还提供所述制备方法获得的涂层材料。
[0069]
本发明还提供所述涂层材料在医疗器械表面修饰改性中的用途。
[0070]
本发明还提供一种医疗器械表面修饰改性的方法,所述方法包括以医疗器械为基底材料,在基底材料上按照所述涂层材料的制备方法对基底材料进行表面修饰改性。
[0071]
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
[0072]
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。
[0073]
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
[0074]
实施例1
[0075]
利用以下制备方法制备含有牢固抗凝、超润滑涂层材料的医用不锈钢片,具体包括以下步骤:
[0076]
1)对待修饰改性的医用不锈钢片进行清洗干燥;
[0077]
2)用ph为8的500mm tris-hcl配制浓度为10mg/ml的多巴胺溶液,将步骤1)清洗干燥后的医用不锈钢片浸没于其中,室温下静置反应6小时。用超纯水反复润洗聚多巴胺改性表面并用氮气吹干。
[0078]
3)聚多巴胺改性后的基底材料于室温下浸入乙二胺溶液(水溶液,m/m=1/10,ph=8)中反应12h。
[0079]
4)用去离子水冲洗3次,每次3分钟,然后氮气干燥。
[0080]
5)配置peg二羧酸溶液(水溶液,1%,m/m)100ml。将氨基改性后的基底材料浸没到peg二羧酸溶液中,加入0.5g的edc
·
hcl与0.5g的nhs,振荡反应10小时后取出。
[0081]
6)用去离子水冲洗3次,每次3分钟,然后氮气干燥。
[0082]
7)将接枝peg二羧酸的基底材料浸没到乙二胺溶液中(水溶液,m/m=1/10,ph=8),继续反应6小时。
[0083]
8)用去离子水冲洗3次,每次3分钟,然后氮气干燥。
[0084]
9)配置mpc的甲醇溶液(100mg/ml),将基底材料浸没到配置好的溶液中,室温下震荡反应24小时。
[0085]
10)用去离子水冲洗3次,每次3分钟,然后氮气干燥,即得含有牢固抗凝超润滑涂层材料的医用不锈钢片。
[0086]
实施例2
[0087]
利用以下制备方法制备含有牢固抗凝、超润滑涂层材料的医用聚四氟乙烯,具体包括以下步骤:
[0088]
1)对待修饰改性的医用聚四氟乙烯进行清洗干燥;
[0089]
2)用ph为6的1500mm tris-hcl配制浓度为1mg/ml的多巴胺溶液,将步骤1)清洗干
燥后的基底材料浸没于其中,室温下静置反应10小时。用超纯水反复润洗聚多巴胺改性表面并用氮气吹干。
[0090]
3)聚多巴胺改性后的基底材料于室温下浸入聚乙烯亚胺溶液(水溶液,m/m=1/10,ph=12)中24h。
[0091]
4)用去离子水冲洗3次,每次3分钟,然后氮气干燥。
[0092]
5)配置peg二羧酸溶液(水溶液,1%,m/m)100ml。将氨基改性后的基底材料浸没到peg二羧酸溶液中,加入1g的edc
·
hcl与1g的nhs,振荡反应10小时后取出。
[0093]
6)用去离子水冲洗3次,每次3分钟,然后氮气干燥。
[0094]
7)将接枝peg二羧酸的基底材料浸没到聚乙烯亚胺溶液中(水溶液,m/m=1/10,ph=8),继续反应6小时。
[0095]
8)用去离子水冲洗3次,每次3分钟,然后氮气干燥。
[0096]
9)配置mpc的甲醇溶液(50mg/ml),将基底材料浸没到配置好的溶液中,室温下震荡反应24小时。
[0097]
10)用去离子水冲洗3次,每次3分钟,然后氮气干燥,即得含有牢固抗凝超润滑的涂层材料的医用聚四氟乙烯。
[0098]
实施例3
[0099]
利用以下制备方法制备含有牢固抗凝、超润滑涂层材料的医用镍钛合金,具体包括以下步骤:
[0100]
1)对待修饰改性的医用镍钛合金进行清洗干燥;
[0101]
2)用ph为8的2000mm tris-hcl配制浓度为5mg/ml的去甲基肾上腺素溶液,将步骤1)清洗干燥后的基底材料浸没于其中,室温下静置反应6小时。用超纯水反复润洗聚去甲基肾上腺素改性表面并用氮气吹干。
[0102]
3)聚去甲基肾上腺素改性后的基底材料于室温下浸入聚烯丙胺溶液(水溶液,m/m=3/10,ph=10)中12h。
[0103]
4)用去离子水冲洗3次,每次3分钟,然后氮气干燥。
[0104]
5)配置peg二羧酸溶液(水溶液,0.1%,m/m)100ml。将氨基改性后的基底材料浸没到peg二羧酸溶液中,加入5g的edc
·
hcl与5g的nhs,振荡反应2小时后取出。
[0105]
6)用去离子水冲洗3次,每次3分钟,然后氮气干燥。
[0106]
7)将接枝peg二羧酸的基底材料浸没到聚烯丙胺溶液中(水溶液,m/m=3/10,ph=8),继续反应6小时。
[0107]
8)用去离子水冲洗3次,每次3分钟,然后氮气干燥。
[0108]
9)配置mpc的甲醇溶液(50mg/ml),将基底材料浸没到配置好的溶液中,室温下震荡反应24小时。
[0109]
10)用去离子水冲洗3次,每次3分钟,然后氮气干燥,即得含有牢固抗凝超润滑的涂层材料的医用镍钛合金。
[0110]
实施例4
[0111]
利用以下制备方法制备含有牢固抗凝、超润滑涂层材料的医用聚氨酯,具体包括以下步骤:
[0112]
1)对待修饰改性的医用聚氨酯进行清洗干燥;
[0113]
2)用ph为10的1000mm tris-hcl配制浓度为10mg/ml的去甲基肾上腺素溶液,将步骤1)清洗干燥后的基底材料浸没于其中,室温下静置反应3小时。用超纯水反复润洗聚去甲基肾上腺素改性表面并用氮气吹干。
[0114]
3)聚去甲基肾上腺素改性后的基底材料于室温下浸入己六胺溶液(水溶液,m/m=1/2,ph=8)中6h。
[0115]
4)用去离子水冲洗3次,每次3分钟,然后氮气干燥。
[0116]
5)配置peg二羧酸溶液(水溶液,5%,m/m)100ml。将氨基改性后的基底材料浸没到peg二羧酸溶液中,加入0.1g的edc
·
hcl与0.1g的nhs,振荡反应15小时后取出。
[0117]
6)用去离子水冲洗3次,每次3分钟,然后氮气干燥。
[0118]
7)将接枝peg二羧酸的基底材料浸没到己六胺溶液中(水溶液,m/m=1/2,ph=12),继续反应2小时。
[0119]
8)用去离子水冲洗3次,每次3分钟,然后氮气干燥。
[0120]
9)配置mpc的甲醇溶液(20mg/ml),将基底材料浸没到配置好的溶液中,室温下震荡反应2小时。
[0121]
10)用去离子水冲洗3次,每次3分钟,然后氮气干燥,即得含有牢固抗凝超润滑的涂层材料的医用聚氨酯。
[0122]
实施例5
[0123]
利用以下制备方法制备含有牢固抗凝、超润滑涂层材料的医用pet,具体包括以下步骤:
[0124]
1)对待修饰改性的医用pet进行清洗干燥;
[0125]
2)用ph为12的800mm tris-hcl配制浓度为20mg/ml的多巴胺溶液,将步骤1)清洗干燥后的基底材料浸没于其中,室温下静置反应2小时。用超纯水反复润洗聚多巴胺改性表面并用氮气吹干。
[0126]
3)聚多巴胺改性后的基底材料于室温下浸入聚烯丙胺溶液(水溶液,m/m=0.1/10,ph=6)中1h。
[0127]
4)用去离子水冲洗3次,每次3分钟,然后氮气干燥。
[0128]
5)配置peg二羧酸溶液(水溶液,1%,m/m)100ml。将氨基改性后的基底材料浸没到peg二羧酸溶液中,加入0.5g的edc
·
hcl与0.5g的nhs,振荡反应20小时后取出。
[0129]
6)用去离子水冲洗3次,每次3分钟,然后氮气干燥。
[0130]
7)将接枝peg二羧酸的基底材料浸没到聚乙烯亚胺溶液中(水溶液,m/m=0.1/10,ph=6),继续反应10小时。
[0131]
8)用去离子水冲洗3次,每次3分钟,然后氮气干燥。
[0132]
9)配置mpc的甲醇溶液(100mg/ml),将基底材料浸没到配置好的溶液中,室温下震荡反应48小时。
[0133]
10)用去离子水冲洗3次,每次3分钟,然后氮气干燥,即得含有牢固抗凝超润滑涂层材料的医用pet。
[0134]
亲水性测试
[0135]
利用jc2000d1接触角测量仪测试实施例1-5中的材料的水静态接触角,结果如表1所示,当接枝本发明的涂层材料后接触角都出现了大幅度下降,说明此涂层材料具有良好
的亲水性。
[0136]
表1
[0137] 实施例1实施例2实施例3实施例4实施例5接触角(处理前)93
°
120
°
88
°
85
°
76
°
接触角(处理后)12
°
17
°
1818
°
21
°
[0138]
抗凝血性测试
[0139]
使用现有技术中用于体外检测人血浆中的活化部分凝血活酶时间的试剂盒,如英诺华aptt检测试剂盒来评价实施例1-5中获得的涂层样品的抗凝血性,具体步骤如下:采集新鲜兔血与枸橼酸钠按9:1体积比混合均匀,将涂层样品与未涂层样品(即基底材料)分别同2ml新鲜枸橼酸钠抗凝血液一起37℃恒温水浴培养30分钟,取出涂层样品,将所得血液及未经材料处理的新鲜兔血(作为对照样)在低温离心机上3000r/min离心15分钟,取上层贫血小板血浆(ppp)按试剂盒说明书进行以下测试:
[0140]
将上述步骤制得的血浆50μl同部分aptt试剂50μl混合均匀后37℃恒温培养3分钟,再加入预热的0.03mol/lcacl2溶液50ul,立即混匀,记录血浆凝固时间。结果如下表2所示,空白血液与不同基底材料的aptt时间都在20几秒,接枝本发明的涂层材料后aptt时间大幅增加至最长80s,表明抗凝血性能优异。
[0141]
表2
[0142][0143]
涂层牢固度测试
[0144]
将实施例1至实施例5所得的涂层样品浸泡在ph为7.4的pbs缓冲溶液中,30天后取出用去离子水冲洗后冷风吹干,然后通过接触角测量仪测试其亲水性,通过aptt试剂测试其抗凝血性,如下表3所示,浸泡前后涂层样品接触角与活化部分凝血酶时间(aptt)并未发生明显变化,证明涂层结合牢固。
[0145]
表3
[0146][0147]
[0148]
以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此外,本文所列出的各种修改以及发明中方法的变化,在不脱离本发明的范围和精神的前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上,各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。