一种能同时测定猪组织中杆菌肽b2、b3含量的方法
技术领域
1.本发明涉及杆菌肽检测技术领域,更具体地说是涉及一种能同时测定猪组织中杆菌肽b2、b3含量的方法。
背景技术:
2.杆菌肽(bacitracin)是一种重要的多肽类抗生素,主要由地衣芽孢杆菌和枯草芽孢杆菌等产生,其可通过抑制脂质载体的去磷酸化来干扰细胞壁的合成,对葡萄球菌、链球菌等均有效,因此被广泛应用在畜牧养殖领域。杆菌肽为多组分化合物,含a、b、c、d、e等多种成分。目前,商业化的杆菌肽制剂中杆菌肽a为主要活性成分,其次是杆菌肽b,而杆菌肽b包含了b1、b2、b3等组分。
3.针对杆菌肽使用产生的药物残留风险,国内外制定了一系列杆菌肽最大残留限量(mrl)进行监控,如我国标准gb31650-2019中规定了牛、猪和家禽可食组织中杆菌肽mrl为500μg/kg,其中规定的杆菌肽残留标志物为杆菌肽a、b、c三种组分,但目前现行国家标准中均仅对杆菌肽a进行了测定,或有部分文献对杆菌肽b进行了测定,目前尚无残留分析方法对其中的杆菌肽b2和b3分别进行准确定量,由于杆菌肽b2和b3存在一定的毒理学差异,因此分别对其进行定量分析将更有利于杆菌肽残留风险的科学评估。故而有必要建立一种能够同时分别测定猪组织中杆菌肽b2、b3的残留含量的分析方法。
4.因此,如何提供一种测定猪组织中杆菌肽b2、b3含量的方法是本领域技术人员亟需解决的问题。
技术实现要素:
5.有鉴于此,本发明提供了一种能同时测定猪组织中杆菌肽b2、b3含量的方法,利于对猪组织中杆菌肽b2、b3的含量进行综合评估。
6.为了实现上述目的,本发明采用如下技术方案:
7.一种能同时测定猪组织中杆菌肽b2、b3含量的方法,以液相色谱串联质谱法对提取得到的杆菌肽b2、b3进行分析,分析时,色谱条件为:流动相为色谱纯乙腈和0.1%甲酸溶液;流动相比例为:0min~0.2min为20%色谱纯乙腈,0.2min~6.0min由20%色谱纯乙腈变至30%色谱纯乙腈,6.0min~6.1min由30%色谱纯乙腈变至80%色谱纯乙腈,6.1min~7.0min为80%色谱纯乙腈,7.0min~7.1min由80%色谱纯乙腈变至20%色谱纯乙腈,7.1min~9.0min为20%色谱纯乙腈;流动相流速:0.300ml/min;进样量:10.0μl。
8.该洗脱条件的优势在于能够在很短的分析时间内将杆菌肽b2、b3分离开,且分离度良好,b2和b3是相同的检测离子对,所以良好的分离度是后续能够对其准确定量的先决条件。
9.作为上述技术方案优选的技术方案,色谱柱为c18柱,柱温为35℃。
10.作为上述技术方案优选的技术方案,分析时,质谱条件为:采用电喷雾离子源正源模式,电压1.5kv,脱溶剂气流速800l/h,雾化气温度600℃;锥孔气流速20l/h;离子源温度
150℃;离子扫描模式为多重反应监测模式;检测离子对为705/199.3和705/110.2。
11.作为上述技术方案优选的技术方案,提取猪组织中杆菌肽b2、b3含量的方法包括下述步骤:
12.1)称取猪组织样品,加入提取溶剂,10000r/min高速匀浆分散提取1min,9500r/min离心2min,分层,得到上清液a,剩余残渣按前述步骤重复提取1次,得到上清液b,合并两次上清液,得到溶液c;提取溶剂为1%甲酸甲醇,作用是将样品中残留的杆菌肽b2、b3提取出来,该步骤具有较好的提取效率方能保证整个前处理方法符合残留分析的要求(即最终回收率满足70%~110%)。
13.2)向步骤1)得到的溶液c中加入正己烷,震荡1min,9500r/min离心2min,分层,弃去上层后得到溶液d;正己烷主要作用是除脂,去除样品中的脂类杂质,降低其对后续检测的不利影响。该步骤为初步净化,去除一部分杂质,减少杂质干扰。
14.3)取步骤2)得到的溶液d与psa、c18混匀,震荡净化1min后,9500r/min离心2min,分层,得到溶液e;该步骤为第二步净化,去除酸性和极性较大的杂质,进一步减少杂质干扰,降低基质效应,提高灵敏度。
15.4)取步骤3)得到的溶液e,过0.22μm滤膜,得到待测杆菌肽b2、b3。该步骤可过滤掉较大的颗粒杂质,防止进入检测系统,损坏仪器。
16.作为上述技术方案优选的技术方案,步骤1)中,猪组织样品和提取溶剂的质量体积比为0.2~0.4g/ml。
17.作为上述技术方案优选的技术方案,步骤2)中,溶液c和正己烷的体积比为1:1~2。
18.作为上述技术方案优选的技术方案,步骤3)中,溶液d、psa、c18的体积质量比为1ml:50mg:50mg。
19.经由上述的技术方案可知,根据公开的文献资料,目前在残留分析领域内有对杆菌肽a或者b总量进行分析的,但没有对b2、b3进行分析的,而本发明针对这一点进行改进,残留分析文献中都没有实现杆菌肽b2和b3的良好分离,尤其是在短短的9min仪器分析时间内。有些国外文献为了分析杆菌肽的组成成分,通过增大仪器分析时间(60min左右)而实现b2和b3的分离,但这牺牲了高效性,对于残留分析来说需要处理大批量的样品检测,基本是不可能的,所以,总体来说,本发明的方法优势为分析效率更高、更简单、灵敏度也高,与现有技术相比,本发明采用uplc-msms对猪组织中杆菌肽b2、b3同时、分别进行定性定量分析,且分析时间短、灵敏高;而且前处理过程更加简单,且结果可靠,极大提高分析效率。
附图说明
20.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
21.图1附图是杆菌肽b2(上)、b3(下)的化学结构式;
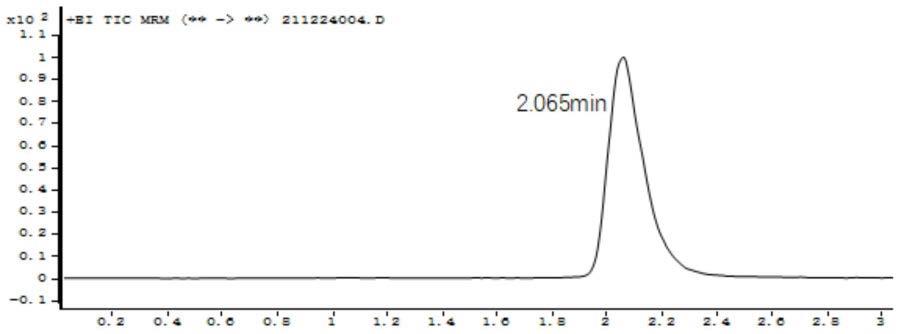
22.图2附图是杆菌肽b2、b3定量离子色谱图;
23.图3附图是杆菌肽b2、b3定性离子色谱图;
24.图4附图是实施例1中杆菌肽b2标准曲线图;
25.图5附图是实施例1中杆菌肽b3标准曲线图;
26.图6附图是对比例1中杆菌肽b2、b3定性离子色谱图。
具体实施方式
27.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
28.所有示例中使用的原料、设备等均为已知产品,并可通过购买市售产品获得,主要如下:
29.uplc-ms/ms(waters acquity uplc-xevo tq-s micro,美国waters);匀浆机(t25,德国ika);高速离心机(3k15,德国sigma);旋涡混合器(genius3,德国ika);电子天平(quintix124,瑞士mettler toledo);十万分之一电子天平(xpe205,瑞士mettler toledo);
30.乙腈(色谱纯,德国merk);甲醇(色谱纯,德国merk);甲酸(色谱纯,德国sigma);氯化钠(分析纯,国药集团化学试剂有限公司);n-丙基乙二胺(psa)和十八烷基硅烷键合硅胶(c18)(天津博纳艾杰尔科技有限公司);纯水(娃哈哈集团有限公司);杆菌肽b2标准品(纯度为92.80%,日本toku-e公司)、杆菌肽b3标准品(纯度为99.72%,日本toku-e公司)。
31.为了衡量本发明分析方法的正确度和精密度,利用添加回收方法来进行试验,分别向空白样品中添加杆菌肽b2、b3混合标准溶液,添加浓度分别为0.01mg/kg、0.1mg/kg、1mg/kg,每个浓度重复5次。具体实施如下:
32.实施例1:
33.(1)前处理方法
34.a、准确称取均质后的猪肉样品2.00g,加入10ml提取溶剂(1%甲酸甲醇),10000r/min高速匀浆分散提取1min,9500r/min离心2min,分层,得到上清液a,剩余残渣按前述步骤重复提取1次,得到上清液b。合并两次上清液,得到溶液c;
35.b、向步骤a得到的溶液c中加入10ml正己烷,震荡1min,9500r/min离心2min,分层,弃去上层后得到溶液d;
36.c、取2ml步骤b得到的溶液d与100mgn-丙基乙二胺(psa)、100mg十八烷基键合硅胶(c
18
)混匀,震荡净化1min后,9500r/min离心2min,分层,得到溶液e;
37.d、取1.0ml步骤c得到的溶液e,过0.22μm滤膜,得到待测样品。
38.(2)标准溶液配制
39.a、标准储备液的配制:称取10.78mg纯度为92.80%的杆菌肽b2标准品,用乙腈定容至10ml,得到浓度为1000mg/l的杆菌肽b2标准储备液;另称取10.03mg纯度为99.72%的杆菌肽b3标准品,用乙腈定容至10ml,得到浓度为997mg/l的杆菌肽b3标准储备液;各准确移取1ml上述杆菌肽b2和杆菌肽b3标准储备液,用乙腈定容至10ml,得到浓度为100mg/l的杆菌肽b2和杆菌肽b3混合标准储备液。
40.b、基质标准工作液的配制:准确移取上述杆菌肽b2和杆菌肽b3混合标准储备液,
用猪组织空白样品定容溶液逐级稀释,得到浓度为0.0005mg/l、0.001mg/l、0.01mg/l、0.1mg/l、0.2mg/l的系列基质标准工作液,待uplc-msms检测。
41.(3)检测条件
42.液相条件:色谱柱为waters acquitybeh c18(2.1
×
100mm,1.7μm);色谱柱柱温为35℃;进样量为10.0μl;流动相为色谱纯乙腈(a)和0.1%甲酸溶液(b),采用梯度洗脱(如表1所示);流动相流速为0.30ml/min。
43.表1液相梯度洗脱条件
[0044][0045][0046]
质谱条件:离子源为电喷雾离子源正源模式(esi
);毛细管电压为1.5kv;脱溶剂气流速为800℃;雾化气温度为600℃;锥孔气流速为20l/h;离子源温度为150℃;离子扫描模式为多重反应监测模式(mrm)如表2所示。
[0047]
表2多重反应监测条件
[0048][0049]
(4)定性定量分析
[0050]
将上述系列基质标准工作液进样检测,结果表明进样浓度与峰面积之间线性关系良好,可用于杆菌肽b2、b3的准确定量。线性回归方程和相关系数r如表3。
[0051]
当猪肉中杆菌肽b2、b3添加浓度范围为0.01~1mg/kg时,结果表明(表4),杆菌肽b2、b3的平均回收率为81.9%~93.9%,表明准确度良好;其相对标准偏差为1.8%~4.1%,表明方法精密度良好;方法符合残留分析要求。
[0052]
表3杆菌肽b2、b3猪肉基质标准溶液线性关系
[0053]
分析组分线性回归方程相关系数r杆菌肽b2y=3027897.0x 1422.20.9999杆菌肽b3y=2202175.1x 1211.50.9999
[0054]
表4猪肉中添加回收试验的准确度和精密度
[0055][0056][0057]
实施例2:
[0058]
(1)前处理方法
[0059]
a、准确称取均质后的猪肝样品2.00g,加入10ml提取溶剂(1%甲酸甲醇),10000r/min高速匀浆分散提取1min,9500r/min离心2min,分层,得到上清液a,剩余残渣按前述步骤重复提取1次,得到上清液b。合并两次上清液,得到溶液c;
[0060]
b、向步骤a得到的溶液c中加入10ml正己烷,震荡1min,9500r/min离心2min,分层,弃去上层后得到溶液d;
[0061]
c、取2ml步骤b得到的溶液d与100mg n-丙基乙二胺(psa)、100mg十八烷基键合硅胶(c
18
)混匀,震荡净化1min后,9500r/min离心2min,分层,得到溶液e;
[0062]
d、取1.0ml步骤c得到的溶液e,过0.22μm滤膜,得到待测样品。
[0063]
(2)标准溶液配制
[0064]
同实施例1。
[0065]
(3)检测条件
[0066]
同实施例1。
[0067]
(4)定性定量分析
[0068]
将上述系列基质标准工作液进样检测,结果表明进样浓度与峰面积之间线性关系良好,可用于杆菌肽b2、b3的准确定量。线性回归方程和相关系数r如表5。
[0069]
当猪肝中杆菌肽b2、b3添加浓度范围为0.01~1mg/kg时,结果表明(表6),杆菌肽b2、b3的平均回收率为78.9%~92.7%,表明准确度良好;其相对标准偏差为1.9%~4.2%,表明方法精密度良好;方法符合残留分析要求。
[0070]
表5杆菌肽b2、b3猪肝基质标准溶液线性关系
[0071]
分析组分线性回归方程相关系数r杆菌肽b2y=3344757.0x 2287.90.9999
杆菌肽b3y=2160775.6x 611.71.0000
[0072]
表6猪肝中添加回收试验的准确度和精密度
[0073][0074]
实施例3:
[0075]
(1)前处理方法
[0076]
a、准确称取均质后的猪肾样品2.00g,加入10ml提取溶剂(1%甲酸甲醇),10000r/min高速匀浆分散提取1min,9500r/min离心2min,分层,得到上清液a,剩余残渣按前述步骤重复提取1次,得到上清液b。合并两次上清液,得到溶液c;
[0077]
b、向步骤a得到的溶液c中加入10ml正己烷,震荡1min,9500r/min离心2min,分层,弃去上层后得到溶液d;
[0078]
c、取2ml步骤b得到的溶液d与100mg n-丙基乙二胺(psa)、100mg十八烷基键合硅胶(c
18
)混匀,震荡净化1min后,9500r/min离心2min,分层,得到溶液e;
[0079]
d、取1.0ml步骤c得到的溶液e,过0.22μm滤膜,得到待测样品。
[0080]
(2)标准溶液配制
[0081]
同实施例1。
[0082]
(3)检测条件
[0083]
同实施例1。
[0084]
(4)定性定量分析
[0085]
将上述系列基质标准工作液进样检测,结果表明进样浓度与峰面积之间线性关系良好,可用于杆菌肽b2、b3的准确定量。线性回归方程和相关系数r如表7。
[0086]
当猪组织中杆菌肽b2、b3添加浓度范围为0.01~1mg/kg时,结果表明(表8),杆菌肽b2、b3的平均回收率为84.0%~94.3%,表明准确度良好;其相对标准偏差为2.2%~6.5%,表明方法精密度良好;方法符合残留分析要求。
[0087]
表7杆菌肽b2、b3猪肾基质标准溶液线性关系
[0088]
分析组分线性回归方程相关系数r杆菌肽b2y=3193026.1x 970.50.9999杆菌肽b3y=2133412.7x 101.21.0000
[0089]
表8猪肾中添加回收试验的准确度和精密度
[0090][0091]
实施例1提取到的杆菌肽b2、b3的化学结构式如图1所示,其定量和定性离子对分别如图2、图3所示,杆菌肽b2的标准曲线如图4所示,实施例杆菌肽b3的标准曲线如图5所示。
[0092]
对比例1(现有的洗脱条件)
[0093]
(1)标准溶液配制
[0094]
a、标准储备液的配制:称取10.78mg纯度为92.80%的杆菌肽b2标准品,用乙腈定容至10ml,得到浓度为1000mg/l的杆菌肽b2标准储备液;另称取10.03mg纯度为99.72%的杆菌肽b3标准品,用乙腈定容至10ml,得到浓度为997mg/l的杆菌肽b3标准储备液;各准确移取1ml上述杆菌肽b2和杆菌肽b3标准储备液,用乙腈定容至10ml,得到浓度为100mg/l的杆菌肽b2和杆菌肽b3混合标准储备液。
[0095]
b、基质标准工作液的配制:准确移取上述杆菌肽b2和杆菌肽b3混合标准储备液,用猪组织空白样品定容溶液逐级稀释,得到浓度为0.0005mg/l、0.001mg/l、0.01mg/l、0.1mg/l、0.2mg/l的系列基质标准工作液,待uplc-msms检测。
[0096]
(2)检测条件
[0097]
液相条件:色谱柱为waters acquity beh c18(2.1
×
100mm,1.7μm);色谱柱柱温为35℃;进样量为10.0μl;流动相为色谱纯乙腈(a)和0.1%甲酸溶液(b),采用梯度洗脱(如表9所示);流动相流速为0.30ml/min。
[0098]
表9液相梯度洗脱条件
[0099]
时间/mina比例/%b比例/%0.0020.080.00.5020.080.01.0080.020.06.0080.020.06.5020.080.09.0020.080.0
[0100]
质谱条件:离子源为电喷雾离子源正源模式(esi
);毛细管电压为1.5kv;脱溶剂气流速为800℃;雾化气温度为600℃;锥孔气流速为20l/h;离子源温度为150℃;离子扫描模式为多重反应监测模式(mrm)如表10所示。
[0101]
表10多重反应监测条件
[0102][0103][0104]
对比例2:
[0105]
(1)前处理方法
[0106]
a、准确称取均质后的猪肉样品2.00g,加入2ml提取溶剂(1%甲酸甲醇),5000r/min高速匀浆分散提取1min,9500r/min离心2min,分层,得到上清液a,剩余残渣按前述步骤重复提取1次,得到上清液b。合并两次上清液,得到溶液c;
[0107]
b、向步骤a得到的溶液c中加入10ml正己烷,震荡1min,9500r/min离心2min,分层,弃去上层后得到溶液d;
[0108]
c、取1ml步骤b得到的溶液d与100mgn-丙基乙二胺(psa)、100mg十八烷基键合硅胶(c
18
)混匀,震荡净化1min后,9500r/min离心2min,分层,得到溶液e;
[0109]
d、取1.0ml步骤c得到的溶液e,过0.22μm滤膜,得到待测样品。
[0110]
(2)标准溶液配制
[0111]
同对比例1。
[0112]
(3)检测条件
[0113]
液相条件:色谱柱为waters acquitybeh c18(2.1
×
100mm,1.7μm);色谱柱柱温为35℃;进样量为10.0μl;流动相为色谱纯乙腈(a)和0.1%甲酸溶液(b),采用梯度洗脱(如表11所示);流动相流速为0.30ml/min。
[0114]
表11液相梯度洗脱条件
[0115]
时间/mina比例/%b比例/%0.0020.080.00.2020.080.06.0030.070.06.1080.020.07.0080.020.07.1020.080.09.0020.080.0
[0116]
质谱条件:同对比例1。
[0117]
(4)定性定量分析
[0118]
将上述系列基质标准工作液进样检测,结果表明在0.001~0.2mg/l浓度范围内,进样浓度与峰面积之间线性关系良好。线性回归方程和相关系数r如表12。
[0119]
向空白猪肉中添加杆菌肽b2、b3混合标准溶液进行添加回收试验,每个浓度重复2次。当添加浓度范围为0.01~1mg/kg时,结果表明(表13),杆菌肽b2、b3的平均回收率为36.8%~57.5%,其相对标准偏差为1.4%~12.1%。
[0120]
表12杆菌肽b2、b3猪肉基质标准溶液线性关系
[0121]
分析组分线性回归方程相关系数r杆菌肽b2y=1,522,760.4x 2,423.10.9990杆菌肽b3y=1,033,330.5x 3,037.30.9963
[0122]
表13猪肉中添加回收试验的准确度和精密度
[0123][0124]
对比例1定性定量离子色谱图如图6所示。
[0125]
对实验结果分析如下:
[0126]
(1)从对比例1结合图6可以看出,在一般仪器检测条件下,杆菌肽b2、b3无法实现有效分离,故无法对其进行准确的定性定量分析。
[0127]
(2)从对比例2可以看出,不同于本发明方法条件下,由于存在更为明显的基质效应等情况,杆菌肽b2、b3的线性范围最低点变高,表明检测灵敏度变差,同时添加回收率也无法满足残留分析的要求。
[0128]
(3)从图2、图3可以看出,色谱图背景干净,杂质干扰少,且杆菌肽b2、b3在本方法色谱条件下能够实现良好的分离,因此二者定性定量更准确。同时灵敏度相对较高。
[0129]
(4)与现有相关公开文献相比,本方法前处理过程极大简化,减少了spe净化过程,且杂质干扰程度小,整体而言,时间成本节约60%以上。
[0130]
(5)从表3、5、7结合图3、4中可以看出,不同猪组织基质标准溶液在0.0005~0.2mg/l范围内进样浓度与响应值之间的线性关系良好,相关系数r均在0.999以上,表明可以用于准确定量。
[0131]
(6)从表4、6、8可以看出,不同猪组织中杆菌肽b2、b3添加浓度在0.01~1mg/kg范围内时,平均添加回收率在78.9%~94.3%之间,rsd在1.8%~6.5%之间,说明该分析方法准确度和精密度均良好,满足残留分析的相关要求。
[0132]
综上所述,本发明采用uplc-msms检测同时分别测定猪组织中的杆菌肽b2和杆菌肽b3残留,前处理过程安全、高效,仪器检测灵敏度高,分析方法的准确度和精密度等亦均符合残留分析要求,对猪组织中杆菌肽残留的科学评估提供一定的技术支撑。
[0133]
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。
[0134]
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。