1.本发明涉及组织工程及器官芯片技术领域,特别涉及一种人血脑脊液屏障模型及其制备方法与应用。
背景技术:
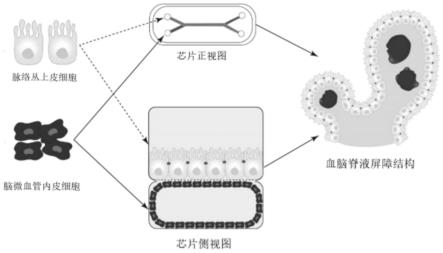
2.bcsfb位于侧脑室、第三脑室及第四脑室,由彼此紧密连接、具有极性的脉络丛上皮细胞(choroid plexus epithelial cells,cpecs),与带有窗孔结构的脑微血管内皮细胞(brain microvascular endothelial cells,bmecs)组成。除了物理屏障功能之外,脉络丛上皮细胞是脑脊液分泌与重吸收的主要位点,可分泌多种细胞因子以维持神经系统稳定。研究发现,在使用人脑脊液与神经发生、胶质细胞发生、突触形成、神经突外生等神经发育过程有密切关系,说明脉络丛上皮细胞对维持神经系统的正常功能至关重要。此外,脉络丛上皮细胞表达细胞间黏附分子-1(intercellular adhesion molecule-1,icam-1)、ccl20等趋化因子,使淋巴细胞可通过此途径对脑脊液和大脑进行持续免疫监视。以上研究结果均提示,bcsfb是神经-免疫-内分泌轴在中枢神经系统内的重要界面,具有显著临床意义及研究价值。此外,越来越多的证据表明,脉络丛上皮细胞的形态或分子图谱改变与阿尔兹海默症、帕金森病、多发性硬化症等多种神经系统疾病相关。深入研究bcsfb需要可靠的模型支持,但现有模型存在诸多局限性。
3.目前bcsfb模型主要包括动物模型与体外模型。由于动物模型和人类真实生理情况之间存在较大差异,同时由于bcsfb解剖位置位于大脑深部难以进行观察,其临床前实验研究受到限制;而体外模型主要使用二维细胞进行构建,模型结构过于简单,难以重现bcsfb的生理功能。
4.因此,为了克服上述传统模型存在的问题,急需开发一种仿生程度高、易于检测的人血脑脊液屏障模型及其构建方法和应用,适用于共聚焦显微镜等光学成像仪器,为深入研究bcsfb的调控机制和相关疾病的临床治疗提供新的技术支撑。
技术实现要素:
5.本发明目的是提供一种人血脑脊液屏障模型及其制备方法与应用,本发明获得的屏障模型是三层结构,这与以往血脑脊液屏障模型的结构相比更接近生理实际情况;由于稳定的单向流体刺激,屏障模型上皮部分可见形成了定向的细胞排布,血管内皮部分则形成了紧密连接,仿生程度高、易于检测,适用于共聚焦显微镜等光学成像仪器。
6.为了实现上述目的,本发明采用如下技术方案:
7.在本发明的第一方面,提供了一种人血脑脊液屏障模型的制备方法,所述方法包括:
8.将生物相容性材料通过倒模法制备获得微流控芯片,所述微流控芯片内含有相邻设置的上通道和下通道;
9.于所述微流控芯片的所述上通道和所述下通道之间设置多孔薄膜,并使用夹具对
微流控芯片进行固定,获得培养装置;
10.将所述培养装置置于基质材料中,以使所述基质材料对所述上通道和所述下通道的外周进行包被;将人脉络丛上皮细胞悬液注入所述上通道内,将人脑微血管内皮细胞悬液注入所述下通道内,待细胞贴附后,对所述上通道和所述下通道内施加流体刺激并培养,获得人血脑脊液屏障模型。
11.进一步地,所述生物相容性材料包括聚对苯二甲酸乙二醇酯pdms预聚物;或者i型胶原、matrigel、gelma、海藻酸钠、fibrinogen、hama、ha-ca、丝素蛋白、壳聚糖和明胶中的至少一种。
12.进一步地,所述将生物相容性材料通过倒模法制备获得微流控芯片,包括:
13.获得具有相邻设置的上通道和下通道的阳模;
14.将生物相容性材料倒入所述阳模上,真空干燥和固化,后剥离,获得阴膜;
15.将阴膜切割为适于后续组装的形状及大小,获得所述含有上通道和下通道的微流控芯片。
16.进一步地,所述上通道和所述下通道的长度、宽度、高度分别为9000~11000μm、800~1200μm、20~200μm。
17.进一步地,所述多孔薄膜的材料选择聚对苯二甲酸乙二醇酯,所述多孔薄膜的孔隙率设置为1
×
105~1
×
107个/cm2。
18.进一步地,所述基质材料包括基质胶matrigel、层粘连蛋白和纤连蛋白中的一种。
19.进一步地,所述人脉络丛上皮细胞悬液和所述人脑微血管内皮细胞悬液的细胞密度均为(5~10)
×
106cells/ml。
20.进一步地,所述流体刺激中,流体的流速为10~200μl/h。
21.在本发明的第二方面,提供了所述方法制备得到的人血脑脊液屏障模型。
22.在本发明的第三方面,提供了所述的人血脑脊液屏障模型在免疫学、药效学、生理病理学分析上的应用。
23.本发明实施例中的一个或多个技术方案,至少具有如下技术效果或优点:
24.本发明提供的一种人血脑脊液屏障模型及其制备方法与应用中,利用反向工程构建策略,将人血脑脊液屏障简化为脉络丛上皮与具有孔窗结构内皮的共培养体系,中间使用生物相容性材料提供支撑从而形成三明治结构,从而仿生构建人血脑脊液屏障界面。利用器官芯片技术,构建与实际人体生理状况相符的上皮及内皮双通道,并使用多孔薄膜对上下层通道进行分隔。利用微流控技术控制该模型内部流场,通过模拟生理实际流体特征,促进细胞自组织,形成体外人血脑脊液屏障模型;该模型具有以下优点:
25.(1)该模型具有稳定的流体刺激,可为内皮细胞和脉络丛上皮细胞提供稳定的支撑,可以形成完整的人血脑脊液屏障,在体外形成与生理水平相似的屏障功能。与传统动物实验和二维细胞培养模型相比具有显著优势;
26.(2)本发明所述微流控芯片具有成熟的大批量标准化生产工艺,易于进行后续商业化生产。本发明涉及芯片结构及尺寸可根据具体需求进行设计定制,可将其与孔板系统进行结合,通过更改通道内流体灌流方式,可以较为方便的转变为高通量体系;
27.(3)本发明中的人血脑脊液屏障模型,可以直接从芯片中取出并进行后续染色及成像,不会破坏其生理结构,对现有的用于药物开发领域的生物分析和成像仪器(如高内涵
系统)均有良好的兼容性;
28.(4)涉及到的技术方法操作简单、可重复性高,可为组织工程生理和病理模型构建领域提供有益参考。本发明在异质性的组织/器官模型的构建方面显示了极大的发展潜力和应用前景,将来有望运用于体外药物筛选和疾病形成机制研究中,为人类研究和治疗神经系统疾病带来曙光。
附图说明
29.为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作一简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其它的附图。
30.图1为本发明实施例提供的人血脑脊液屏障模型的构建流程图及实物图;
31.图2为本发明实施例提供的人血脑脊液屏障模型的培养及表征;其中图2a为屏障模型培养流程图;图2b为芯片内部流体分布情况;图2c为屏障模型明场图;图2d为屏障上下细胞类群免疫荧光鉴定结果;
32.图3为本发明实施例提供人血脑脊液屏障模型的病理学评价及表征结果;其中,图3a为两通道流速情况,图3b为两通道剪切力情况;
33.图4为实验例2中的免疫荧光结果;期中图4a为芯片构建后zo-1表达情况,图4b为使用炎症因子tnf-α处理后芯片zo-1变化情况,图4c为炎症因子处理前后芯片对标准品igg的透过能力变化;图4d为炎症因子处理前后芯片对标准品dextran的透过能力变化。
具体实施方式
34.下文将结合具体实施方式和实施例,具体阐述本发明,本发明的优点和各种效果将由此更加清楚地呈现。本领域技术人员应理解,这些具体实施方式和实施例是用于说明本发明,而非限制本发明。
35.在整个说明书中,除非另有特别说明,本文使用的术语应理解为如本领域中通常所使用的含义。因此,除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域技术人员的一般理解相同的含义。若存在矛盾,本说明书优先。
36.此外,在本技术的描述中,多个”、“若干个”的含义是两个或两个以上,除非另有明确具体的限定。
37.本技术的技术方案总体思路如下:
38.根据本发明的一种典型的实施方式,提供一种人血脑脊液屏障模型的制备方法,所述方法包括:
39.步骤s1、将生物相容性材料通过倒模法制备获得微流控芯片,所述微流控芯片内含有相邻设置的上通道和下通道;
40.所述生物相容性材料包括聚对苯二甲酸乙二醇酯pdms预聚物;或者i型胶原、matrigel、gelma、海藻酸钠、fibrinogen、hama、ha-ca、丝素蛋白、壳聚糖和明胶中的至少一种。
41.所述步骤s1,具体包括:
42.步骤s101、获得具有相邻设置的上通道和下通道的阳模;
43.所述上通道和所述下通道的长度、宽度、高度分别为9000~11000μm、800~1200μm、20~200μm。
44.若通道高度小于20μm,存在内部水利阻抗过大,上样过程困难,上样过程容易破坏屏障结构;若高度大于200μm,存在上样细胞损失过大等缺点;
45.步骤s102、将生物相容性材料倒入所述阳模上,真空干燥和固化,后剥离,获得阴膜;
46.作为一种具体的实施方式,采用真空干燥器保证pdms与模具间无空气,置入烘箱中80℃固化1h;将固化后的pdms从阳模上剥离,获得阴膜。
47.步骤s103、将阴膜切割为适于后续组装的形状及大小,获得所述含有上通道和下通道的微流控芯片。
48.作为一种具体的实施方式,若将其与孔板系统进行结合,即将阴膜切割为适合孔板系统的尺寸。
49.步骤s2、于所述微流控芯片的所述上通道和所述下通道之间设置多孔薄膜,并使用夹具对微流控芯片进行固定,获得培养装置;
50.所述步骤s2中,
51.所述多孔薄膜的材料选择聚对苯二甲酸乙二醇酯pet,所述多孔薄膜的孔隙率设置为1
×
105~1
×
107个/cm2。
52.若所述多孔薄膜孔隙率小于1
×
105个/cm2,存在屏障功能受多孔薄膜限制,与生理状况不符;若所述多孔薄膜孔隙率大于1
×
107个/cm2,存在细胞贴附困难等缺点;本发明的多孔薄膜的孔隙率是指孔隙的体积占膜的表观体积的比值;
53.所述培养装置整体组装,可以使用夹具等形式进行物理组装,也可以使用plasm等方式进行化学组装;既可以进行可逆组装,也可以进行不可逆组装。
54.步骤s3、将所述培养装置置于基质材料中,以使所述基质材料对所述上通道和所述下通道的外周进行包被;将人脉络丛上皮细胞悬液注入所述上通道内,将人脑微血管内皮细胞悬液注入所述下通道内,待细胞贴附后,对所述上通道和所述下通道内施加流体刺激并培养,获得人血脑脊液屏障模型。
55.所述基质胶包被可以使用各种胶进行单一或混合包被,可以对上下通道进行同时或分别包被。可以只对其中一个通道进行修饰,或者对两通道进行差异修饰以适应不同的研究情况。
56.上通道使用matrigel 80μg/ml进行包被,下通道使用laminin(层粘连蛋白)50μg/ml及fibronectin(纤连蛋白)80mg/ml进行包被,所述基质材料包括基质胶matrigel、层粘连蛋白和纤连蛋白中的一种。
57.所述人脉络丛上皮细胞悬液和所述人脑微血管内皮细胞悬液的细胞密度均为(5~10)
×
106cells/ml。若细胞接种密度低,则难以在薄膜界面处完全附着形成一层屏障,若细胞接种密度高,则屏障形成过程中会出现细胞堆积,影响观察成像及屏障功能;
58.所述流体刺激中,流体的流速为10~200μl/h。
59.若持续流体刺激流速小于10μl/h,存在刺激不足,难以促进屏障结构的形成;若持续流体刺激流速大于200μl/h,存在剪切力过大,屏障结构被破环。
60.根据本发明另一种典型实施方式,提供了所述方法制备得到的人血脑脊液屏障模型。
61.本发明获得的屏障模型是三层结构,这与以往血脑脊液屏障模型的结构相比更接近生理实际情况;由于稳定的单向流体刺激,屏障模型上皮部分可见形成了定向的细胞排布,血管内皮部分则形成了紧密连接。
62.所述人血脑脊液屏障模型除生物部分外,还可以与微流控通道作为工程化整体,以实现该屏障结构的生理功能,其三层结构的上下通道部分均可用于流体的灌注与收集,并对流体在整个模型内部的作用进行分析。
63.根据本发明另一种典型实施方式,提供了所述的人血脑脊液屏障模型在免疫学、药效学、生理病理学分析中的应用。
64.所述人血脑脊液屏障(bcsfb)模型及其构建方法与应用。通过反向工程的构建策略,将人血脑脊液屏障简化为脉络丛上皮细胞与带有穿孔结构的内皮细胞结合的三明治结构。利用器官芯片技术,构建与实际人体生理状况相符的上皮及内皮双通道,并使用多孔薄膜对上下层通道进行分隔。该模型可以形成完整的人血脑脊液屏障,该屏障具有与人生理近似的屏障功能。本发明涉及到的技术方法操作简单、可重复性高,可用于神经药物开发以及临床前神经毒性评估,具有广阔的商业应用前景。
65.下面将结合附图对本技术的一种人血脑脊液屏障模型及其制备方法与应用进行详细说明。
66.实施例1、一种人血脑脊液屏障模型及其制备方法
67.(1)采用标准软光刻倒模法制作微流控芯片。首先,通过软光刻制造刻蚀有微流道结构的硅母板模具。其次,使用pdms以倒模法制作芯片上下层结构。随后,将芯片用3m胶带彻底除尘,在体视显微镜下于上下层通道之间平整放置一片多孔聚对苯二甲酸乙二醇酯(pet)薄膜(膜厚度7μm,孔直径0.4μm,孔密度4
×
106/cm2),对齐上下通道,以聚甲基丙烯酸甲酯(poly-methyl methacrylate,pmma)制作的夹具进行固定组装。最后,将组装好的芯片充分消毒备用;
68.(2)芯片上层通道使用matrigel 80μg/ml进行包被,下层通道使用laminin(层粘连蛋白)50μg/ml及fibronectin(纤连蛋白)80mg/ml进行包被,放入培养箱中静置过夜。在接种细胞前用pbs和培养基冲洗通道。以5~10
×
106cells/ml密度将bmecs悬液用10μl枪头轻柔注入下层通道,并迅速翻转芯片,以倒置位置于培养箱中,使bmecs贴壁于pet膜上、下层通道顶端。1h后,将芯片恢复为正置位,使未贴壁的bmecs贴附于通道另外三面,形成管状结构。3h后,以5~10
×
106cells/ml密度将cpecs悬液轻用10μl枪头轻柔注入上层通道,放入培养箱内静置过夜。第二天对上下层通道进行灌注培养。
69.(3)将模型置于培养箱中,使用微量注射泵以100μl/h流速对芯片两通道进行长期稳定流体刺激。
70.实施例2
71.本发明实施例中,将芯片通道长度增长20000μm,其他结构和步骤均同实施例1。
72.实施例3
73.本发明实施例中,将培养装置组装方式改为化学改性键合,其他结构和步骤均同实施例1。
74.对比例1
75.该对比例中,将持续灌流速度改为8μl/h,其他结构和步骤均通实施例1。
76.对比例2
77.该对比例中,将持续灌流速度改为210μl/h,其他结构和步骤均通实施例1。
78.对比例3
79.该对比例中,将细胞接种密度改为1
×
106cells/ml,其他结构和步骤均通实施例1。
80.对比例4
81.该对比例中,将细胞接种密度改为100
×
106cells/ml,其他结构和步骤均通实施例1。
82.对比例5
83.该对比例中,不使用基质材料对芯片进行包被,其他结构和步骤均通实施例1。
84.对比例6
85.该对比例中,将多孔薄膜改为孔隙率0,其他结构和步骤均通实施例1。
86.对比例7
87.该对比例中,将多孔薄膜改为孔隙率100,其他结构和步骤均通实施例1。
88.实验例1
89.对上述实施例1-3和对比例1-7的模型构建结果进行统计分析,明场下观察形成屏障结构,如表1所示;
90.表1
91.组别接种密度多孔薄膜属性灌流速度通道包被备注实施例110
×
106cells/ml4
×
106/cm2100μl/h包被屏障结构实施例220
×
106cells/ml4
×
106/cm2100μl/h包被屏障结构实施例310
×
106cells/ml4
×
106/cm2100μl/h包被屏障结构对比例110
×
106cells/ml4
×
106/cm210μl/h包被无屏障结构对比例210
×
106cells/ml4
×
106/cm2200μl/h包被无屏障结构对比例31
×
106cells/ml4
×
106/cm2100μl/h包被无屏障结构对比例4100
×
106cells/ml4
×
106/cm2100μl/h包被结构形态差对比例510
×
106cells/ml4
×
106/cm2100μl/h不包被结构形态差对比例610
×
106cells/ml0100μl/h包被无屏障结构对比例710
×
106cells/ml/100μl/h包被无屏障结构
92.由表1的数据可知:
93.对比例1中,流体的流速为8μl/h,小于本发明实施例10~200μl/h的范围,无法形成屏障结构,由于流体刺激不足,模型中细胞状态与传统二维培养情况类似;
94.对比例2中,流体的流速为220μl/h,大于本发明实施例10~200μl/h的范围,无法形成屏障结构,灌流速度高,通道中细胞受剪切力影响,尤其通道壁附近细胞随流体被冲出流道;
95.对比例3中,将细胞接种密度改为1
×
106cells/ml,小于本发明实施例(5~10)
×
106cells/ml的范围,细胞接种密度低,则难以在薄膜界面处完全附着形成一层屏障;
96.对比例4中,将细胞接种密度改为1
×
106cells/ml,小于本发明实施例(5~10)
×
106cells/ml的范围,细胞接种密度高,则屏障形成过程中会出现细胞堆积,影响观察成像及屏障功能;
97.对比例5中,不使用基质材料对芯片进行包被,可见明场下屏障形成效果与包被后结果相差较多;
98.对比例6中,多孔薄膜改为孔隙率0,存在屏障功能受多孔薄膜限制,与生理状况不符;
99.对比例7中,多孔薄膜改为孔隙率100%,存在细胞贴附困难等缺点;
100.本发明实施例1-实施例3中,明场观察均可见形成屏障结构。与传统的动物模型和二维细胞培养模型相比,本发明提供了一种仿生性高、高均一性、便于成像的人血脑脊液屏障模型,为相关研究提供了一个创新研究工具。
101.实验例2、人血脑脊液模型构建情况表征
102.1、构建工程化血脑脊液屏障模型流程如图1所示,将脉络丛上皮细胞及脑微血管内皮细胞分别接种于上下两层芯片通道中,以形成生理中类似结构。
103.2、实施例1血脑脊液屏障模型构建表征:使用流体刺激后对比与静态培养的屏障形成情况,对相关标志物zo-1及cld-5进行了检测,结果如图2,使用有限元模拟确定了芯片内部流场变化情况,结果如图3。表面本发明实施例成功构建了人血脑脊液屏障模型。
104.3、将实施例1构建的人血脑脊液屏障模型使用tnf-α处理,并检测屏障功能受损情况,免疫荧光结果显示屏障结构被破坏,屏障功能与对照组相比也产生了显著丧失,结果如图4所示,表明本发明可用于临床及药理等方面研究。
105.最后,还需要说明的是,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
106.尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
107.显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。