1.本发明涉及植物中天然有效成分的提取、分离和富集技术领域,具体涉及一种从植物中提取花青素的方法。
背景技术:
2.花青素是一类广泛存在于植物体内的水溶性天然色素,20世纪末,国际卫生组织和国际粮农组织联合禁止人工合成色素作食用色素后,花青素逐渐被推广和应用。紫苏是我国卫生部首批颁布的药食两用植物之一,紫苏花青素安全、无毒、资源丰富,具有抗氧化、抗突变、预防心脑血管疾病、保护肝脏、抑制肿瘤细胞发生等多种生理功能,在食品、化妆、医药等方面有着巨大的应用潜力。然而紫苏花青素当前面临的主要问题是如何从紫苏中高效提取、分离和富集花青素。
3.近年来,从紫苏中分离花青素的代表方法有:
①
唐翔(申请号:cn201610563919.0)采用微切助互作技术辅助提取紫苏花青素,具体步骤为对预处理的紫苏采用微切助互作技术进行混合研磨、超声提取、树脂层析、洗脱干燥,即得紫苏花青素;
②
陈幸培等(申请号:cn201810650497.x)基于截留分子量为150~300道尔顿且最高耐受90%乙醇浓度的耐溶剂纳滤膜、开发了一种紫苏花青素提取液的浓缩系统及方法,包括依次串联的原液箱、预处理单元、一级、二级和三级过滤单元。尽管上述专利中实现了紫苏花青素的高效提取、分离和浓缩,但从产业化角度而言,上述方法不同程度地存在过程复杂、效率低、成本高等缺点。可见开发一种高效、简单、低成本的提取、分离和富集方法至关重要。
4.泡沫分离技术具有设备简单、无污染、能耗低等显著的工程优势、已成为同时分离和富集植物有效成分的主要手段,在降低分离成本、简化分离过程和保证分离效率方面有着巨大潜力,并成功用于分离三七单体皂苷(申请号:cn202120584092.8)、罗汉果甜苷类化合物(申请号:cn202111046454.9)和油茶饼粕中茶皂素(申请号:cn201811402547.9)。然而,目前尚没有将其用于紫苏花青素的分离过程。
技术实现要素:
5.本发明的第一方面,提供了一种从植物中提取花青素的方法,所述的方法包括向植物的花青素浸提液中加入植物蛋白获得原液,通气使得形成气泡并携带花青素从原液中溢出,溢出液即为花青素粗产品。
6.所述的植物为被子植物,优选为唇形科植物,例如迷迭香、薄荷、丹参、紫苏、鼠尾草、夏枯草、肾茶、冬凌草、蜜蜂花、荔枝草、溪黄草、牛至、泽兰、筋骨草、赶黄草、草珊瑚、青兰或薰衣草植物。
7.提取的部位可以为根、茎、叶、籽等。
8.在本发明的一个具体实施方式中,所述的植物为紫苏(perilla frutescens l.)或其变种,提取部位优选为茎、叶和/或籽等。其中,所述的籽可以为脱脂籽。
9.所述的植物或其部位(例如根、茎、叶、籽)可以为种植获得或者购买获得。
10.所述的花青素浸提液为植物或其部位醇提获得。优选还包括超声后离心取上清的步骤。进一步优选所述花青素浸提液的制备方法包括将植物或其部位进行粉碎、过筛,获得紫苏粉,然后醇提后超声,离心取上清,再去除醇后即为花青素浸提液。
11.优选的,所述的植物或其部位为紫苏或其部位(例如叶、茎和/或籽(例如脱脂籽))。其中,部位可以为单一部位或混合部位,例如叶与茎、叶与籽、茎与籽或者紫苏植物与任一、二或三部位的混合等等。
12.优选的,所述的醇提包括按照质量体积比为1:30~1:50的料液比向紫苏粉中加入醇,所述的醇优选为乙醇,进一步优选为乙醇水溶液(例如乙醇体积分数为20~40%或20-30%)。
13.优选的,所述的超声温度为25~45℃,进一步优选为30~40℃。
14.优选的,所述的超声时间为10~30min。
15.优选的,所述的离心温度为20~40℃,优选为室温。
16.优选的,所述的离心时间为10~30min。
17.优选的,所述的离心在4000r/min转速下进行。
18.优选的,所述的去除醇为采用旋转蒸发的方式。
19.优选的,所述的旋转蒸发的时间为0.5~1.5h,进一步优选0.8~1.2h。
20.优选的,所述的旋转蒸发的转速为10~40r/min。
21.优选的,所述的旋转蒸发的温度为50~70℃。
22.在本发明的一个具体实施方式中,所述的花青素浸提液的制备方法包括将紫苏或其部位(例如叶、茎和/或籽(例如脱脂籽))进行粉碎、过筛(例如80目筛),获得紫苏粉,然后按照质量体积比为1:30~1:50的料液比向紫苏粉中加入醇,25~45℃下超声提取10~30min,20~40℃、4000r/min离心10~30min,取上清,再在50~70℃、转速10~40r/min下旋转蒸发0.5~1.5h(优选0.8~1.2h)去除醇,即为花青素浸提液。
23.所述的植物蛋白可以为被子植物蛋白,优选为唇形科植物蛋白,例如紫苏蛋白。
24.所述的植物蛋白可以为单一植物的蛋白或者混合的植物的蛋白,例如紫苏蛋白与其他唇形科植物混合后提取的蛋白。
25.优选的,所述的植物蛋白为紫苏茎蛋白、紫苏叶蛋白和/或紫苏籽蛋白。其中,所述的紫苏籽蛋白可以为脱脂籽蛋白。
26.所述的植物蛋白可以为提取获得或者直接购买获得。
27.所述的紫苏蛋白的制备方法包括:将紫苏或其部位进行粉碎、过筛(例如500目筛),获得紫苏粉,然后碱提酸沉后离心取沉淀。
28.优选的,所述的紫苏或其部位为紫苏或其叶、茎和/或籽(例如脱脂籽)。其中,部位可以为单一部位或混合部位,例如叶与茎、叶与籽、茎与籽或者紫苏植物与任一、二或三部位的混合等等。
29.优选的,所述的碱提的ph值为7.0~11.0(优选8.0~11.0,进一步优选9.0-10.0)。
30.优选的,所述的酸沉的ph值为3.5~4.5。即碱提后在ph值为3.5~4.5下酸沉蛋白。
31.优选的,所述的离心温度为在25~45℃,进一步优选为室温。
32.优选的,所述的离心时间为10~15min。
33.优选的,所述的离心转速4000~6000r/min。
34.优选的,所述的方法包括向获得的紫苏粉中加入水,然后进行碱提酸沉,优选的,按照质量体积比为1:100~1:1000(优选1:100~1:600,进一步优选1:200~1:600,更进一步优选1:300~1:500)的料液比向紫苏粉中加入水。
35.在本发明的一个具体实施方式中,所述的紫苏蛋白的制备方法包括:将紫苏或其部位(例如叶、茎和/或籽(例如脱脂籽))进行粉碎、过筛(例如500目筛),获得紫苏粉,然后按照质量体积比为1:100~1:1000(优选1:100~1:600,进一步优选1:200~1:600,更进一步优选1:300~1:500)的料液比向紫苏粉中加入水,调节ph值为7.0~11.0(优选8.0~11.0,进一步优选9.0-10.0),于25~45℃、200~600rpm转速下搅拌提取5~20min,然后在ph值为3.5~4.5下酸沉蛋白,20~40℃、4000~6000r/min离心10~15min,取沉淀,即为紫苏蛋白。
36.优选还包括将紫苏蛋白溶于水,并调节ph供后续使用的步骤。
37.优选的,按照100~600mg/l(优选100~500mg/l,进一步优选200~400mg/l)向花青素浸提液中加入植物蛋白获得原液。
38.优选的,所述的方法包括将原液调节ph为2.0~7.0,优选3.0~6.0,进一步优选4.0~5.0,然后进行通气。
39.优选的,所述通气的气速为0.1~0.8l/min,进一步优选为0.2~0.4l/min,更进一步优选为0.3l/min。
40.通气可以采用现有技术中任何常规的方式,例如加入气体分布器等等。通入的气体可以为现有技术中任何气体,只要该气体不影响花青素的活性及植物提取的过程即可。
41.在本发明的一个具体实施方式中,所述的方法包括按照100~600mg/l(优选100~500mg/l,进一步优选200~400mg/l)向花青素浸提液中加入紫苏蛋白获得原液,调节ph为2.0~7.0(优选3.0~6.0,进一步优选4.0~5.0),然后以0.1~0.8l/min(优选0.2~0.4l/min,进一步优选0.3l/min)进行通气,形成气泡并携带花青素从原液中溢出,溢出液即为花青素粗产品。
42.优选的,所述的从植物中提取花青素的方法还包括从溢出液中进一步纯化花青素的步骤。
43.优选的,所述的从植物中提取花青素的方法还包括从溢出液中分离植物蛋白,分离的植物蛋白加入至花青素浸提液中获得原液。
44.优选的,所述的进一步纯化与从溢出液中分离植物蛋白均可以为调节溢出液的ph值(优选为3.5~4.5),离心(优选为4000~6000r/min,10~20min)的步骤。进一步优选的,所述的纯化还包括重复调节的ph值(优选为3.5~4.5),离心(优选为4000~6000r/min,10~20min)的步骤。
45.在本发明的一个具体实施方式中,所述的进一步纯化包括调节溢出液的ph值(优选为3.5~4.5),离心(优选为4000~6000r/min,10~20min),取沉淀溶解后再进行调节ph值(优选为3.5~4.5),离心(优选为4000~6000r/min,10~20min)。
46.离心后取上清即为花青素产品,沉淀为植物蛋白。
47.即溢出液中包含植物蛋白和花青素,从溢出液中分离的植物蛋白可以作为下一轮提取花青素的方法中加入花青素浸提液中的植物蛋白。
48.在本发明的一个具体实施方式中,所述的从植物中提取花青素的方法包括:
49.第一步:制备花青素浸提液,包括将紫苏或其部位(例如叶、茎和/或籽(例如脱脂籽))进行粉碎、过筛,然后醇提后超声,离心取上清,再去除醇后即为花青素浸提液;
50.第二步:制备植物蛋白,优选制备紫苏蛋白,包括将紫苏或其部位(例如叶、茎和/或籽)进行粉碎、过筛,然后ph为7.0~11.0(优选8.0~11.0,进一步优选9.0~10.0)碱提后在ph值为3.5~4.5下酸沉蛋白,室温下4000~6000r/min下离心10~15min取沉淀;
51.第三步:分离、富集,包括按照100~600mg/l(优选100~500mg/l,进一步优选200~400mg/l)向花青素浸提液中加入紫苏蛋白获得原液,调节ph为2.0-7.0(优选3.0~6.0,进一步优选4.0~5.0)后,以气速0.1~0.8l/min(优选为0.2~0.4l/min,进一步优选0.3l/min)进行通气,形成气泡并携带花青素从原液中溢出,溢出液即为花青素粗产品;
52.第四步:纯化,包括调节第三步获得的溢出液的ph值为3.5~4.5,离心,上清液即为花青素产品,沉淀为紫苏蛋白。
53.在本发明的一个具体实施方式中,所述的从植物中提取花青素的方法包括:
54.第一步:制备花青素浸提液,包括将紫苏或其部位(例如叶、茎和/或籽(例如脱脂籽))进行粉碎、过筛(例如80目筛),获得紫苏粉,然后按照质量体积比为1:30~1:50的料液比向紫苏粉中加入醇,25~45℃下超声提取10~30min,20~40℃、4000r/min离心10~30min,取上清,再在50~70℃、转速10~40r/min下旋转蒸发0.5~1.5h(优选0.8~1.2h)去除醇,即为花青素浸提液。
55.第二步:制备紫苏蛋白,包括:将紫苏或其部位(例如叶、茎和/或籽(例如脱脂籽))进行粉碎、过筛(例如500目筛),获得紫苏粉,然后按照质量体积比为1:100~1:1000(优选1:100~1:600,进一步优选1:200~1:600,更进一步优选1:300~1:500)的料液比向紫苏粉中加入水,调节ph值为7.0~11.0(优选8.0~11.0,进一步优选9.0-10.0),于25~45℃、200~600rpm转速下搅拌提取5~20min,然后在ph值为3.5~4.5下酸沉蛋白,20~40℃、4000~6000r/min离心10~15min,取沉淀,即为紫苏蛋白。
56.第三步:分离、富集,包括按照100~600mg/l(优选100~500mg/l,进一步优选200~400mg/l)向花青素浸提液中加入紫苏蛋白获得原液,调节ph为2.0-7.0(优选3.0~6.0,进一步优选4.0~5.0)后以气速0.1~0.8l/min(优选0.2-0.4l/min,进一步优选为0.3l/min)进行通气,形成气泡并携带花青素从原液中溢出,溢出液即为花青素粗产品;
57.第四步:纯化,包括调节第三步获得的溢出液的ph值为3.5~4.5,离心,上清液即为花青素产品,沉淀为紫苏蛋白。
58.优选的,所述的方法还包括将第四步获得的紫苏蛋白单独或与第二步获得的紫苏蛋白混合加至花青素浸提液中获得原液,再进行第三步的分离、富集。
59.优选的,所述的第三步分离、富集采用泡沫分离塔进行,优选的,所述的泡沫分离塔为中空柱状体(例如棱柱、圆柱、梯柱或不规则柱状体等任何现有技术中可以进行泡沫分离的装置),其中,中空柱状体内部承载原液,从下底面(塔底)进行通气,从上底面(塔顶)收集溢出液。
60.优选的,所述的泡沫分离塔在高度方向上可以是相同的内径或者不同的内径,所述的柱高、内径可以根据常规使用进行调节。所述的泡沫分离塔中还可以加入构件,例如强化泡沫排液的装置、稳定泡沫的装置等等。
61.在本发明的一个具体实施方式中,所述的泡沫分离塔为中空圆柱体,其高径比为
20:1~30:1(优选为25:1)。
62.在本发明的一个具体实施方式中,所述的从植物中提取花青素的方法包括:
63.第一步,制备花青素浸提液,包括:
64.1)将干燥紫苏叶粉碎、过80目筛,获得紫苏叶粉;
65.2)按照质量体积比为1:30~1:50的料液比将紫苏叶粉溶入包含20~30%乙醇的乙醇水溶液,在ph值为4.0~6.0、温度为25~45℃、时间为10~30min(优选10-20min)条件下超声提取,获得紫苏叶初提液;
66.3)将紫苏叶初提液在室温下、4000r/min离心10~30min(优选10-15min),取上清,在温度为50~70℃(优选60-70℃)、转速为10~40r/min(优选30-40r/min)、时间为0.8~1.2h条件下旋转蒸发去除乙醇,即为紫苏叶的花青素浸提液;优选的,提取后还包括冷却至室温的步骤。其中,花青素浸提液中花青素的浓度为1.5~2.5mg/g(30~50mg/l)。
67.第二步,制备紫苏蛋白,优选脱脂紫苏籽蛋白,包括:
68.1)将脱脂紫苏籽粉碎、过500目筛,获得脱脂紫苏籽粉;
69.2)按照质量体积比为1:100~1:1000((优选1:100~1:600,进一步优选1:200~1:600,更进一步优选1:300~1:500))的料液比将脱脂紫苏籽粉溶入水溶液,在ph值为7.0~11.0(优选8.0~11.0,进一步优选9.0~10.0)、温度为25~45℃、时间为5~20min(优选5-10min)、转速为200~600rpm(优选400~500rpm)下进行碱提,获得脱脂紫苏籽浸提液;其中,紫苏籽蛋白浓度为0.8~1.0g/l;
70.3)碱提后在ph值为3.5~4.5下酸沉蛋白,在室温下4000~6000r/min(优选5000r/min)离心10~15min,取沉淀,用水将沉淀物洗出溶解,再调整溶液ph至6.5~7.5,在温度为-55℃、时间为24h下冷冻干燥和/或喷雾干燥获得脱脂紫苏籽蛋白;其中,脱脂紫苏籽蛋白纯度达到90%~99%;
71.第三步,泡沫分离技术分离、富集,包括:
72.1)将100~600mg/l(优选100~500mg/l,进一步优选200~400mg/l)脱脂紫苏籽蛋白与花青素浸提液混合获得原液,调节ph为2.0~7.0(优选3.0~6.0,进一步优选4.0-5.0)后作为进料液;
73.2)室温下以气速为0.1~0.8l/min(优选为0.2~0.4l/min,进一步优选为0.3l/min)、泡沫层高度为泡沫分离塔高的2/5~4/5(优选3/5)进行泡沫分离,对流出塔顶的泡沫进行收集并消泡,即为消泡液,待泡沫不能从泡沫分离塔顶流出时停止通气,优选操作时间为40-60min;
74.优选的,所述的消泡可以为采用本领域技术人员熟知的任何消泡方式,优选不影响产品质量及二次进行泡沫分离的方法,例如机械法消泡或加入常规消泡剂。
75.其中,所述的泡沫分离优选为间歇式泡沫分离。且可以独立控制气速、温度、泡沫层高度等操作条件。
76.泡沫分离后消泡液体积为进料液体积的2.5~8.5%,花青素浓度为600~1800mg/l。
77.泡沫分离后排放的残液中花青素浓度为0.2~9.0mg/l,可作为提取紫苏油、迷迭香酸和其他有效成分原料。
78.第四步:纯化,包括:
79.将消泡液调节ph值为3.5~4.5(优选4.0~4.5,优选4~4.3)以沉淀脱脂紫苏籽蛋白,在室温下6000r/min下离心10~15min取上清液,将上清液在温度-55℃下冷冻干燥36h,也可以为喷雾干燥,获得紫苏花青素产品。优选还包括将上清液调节ph值为中性(例如6.5~7.5)的步骤。
80.本发明的第二方面,提供了一种上述方法获得的花青素产品。
81.本发明的第三方面,提供了一种上述方法获得的花青素产品在制备化妆品、食品或者医药中的应用。
82.本发明的第四方面,提供了紫苏蛋白作为起泡剂和/或捕获剂在提取紫苏中花青素的应用。
83.优选的,所述的紫苏蛋白为紫苏茎蛋白、紫苏叶蛋白和/或紫苏籽蛋白。其中,所述的紫苏籽蛋白可以为脱脂籽蛋白。
84.所述的紫苏蛋白可以为提取获得或者直接购买获得。
85.所述的紫苏蛋白的制备方法包括:将紫苏或其部位进行粉碎、过筛(例如500目筛),获得紫苏粉,然后碱提酸沉后离心取沉淀。
86.优选的,所述的提取为泡沫分离提取。
87.本发明的第五方面,提供了一种上述泡沫分离获得的残液在作为提取紫苏油、迷迭香酸和其他有效成分原料中的应用。
88.本发明所述的“和/或”包含该术语所连接的项目的所有组合,应视为各个组合已经单独地在本文列出。例如,“a和/或b”包含了“a”、“a和b”以及“b”。又例如,“a、b和/或c”包含了“a”、“b”、“c”、“a和b”、“a和c”、“b和c”以及“a和b和c”。
89.本发明所述的“操作时间”,是指从向泡沫分离塔通气开始至停止通气为止,其中停止通气的时间可以为泡沫不能从泡沫分离塔顶端流出或者很少量流出。
90.本发明所述的“间歇操作”是指每次泡沫分离操作之初向泡沫分离塔内注入一批进料液,经过泡沫分离过程后,收集全部泡沫,排出全部残液,再重新投料。
91.本发明的有益效果为:
92.1.本发明开发一种基于泡沫分离技术的新型提取、分离和富集植物花青素的方法,并将其应用于分离制备紫苏中的花青素。本发明所述的提取花青素的方法具备投资少、耗能小、无污染和步骤简单等优点,大大降低了花青素的富集难度和分离成本。
93.2.本发明开发了一种针对无表面活性花青素泡沫分离的起泡剂和捕收剂——同源植物蛋白质,其作为紫苏籽脱脂后的副产物具有天然、低成本、高起泡性和高捕收能力的特色和优点,能够稳定上升泡沫性能和促进花青素的界面吸附,实现了花青素的绿色分离,更重要的是不会影响花青素的结构和性能。
94.3.本发明通过调控紫苏蛋白浓度、气速、泡沫高度等操作条件充分强化了泡沫排液,同时实现了紫苏花青素的有效回收(80.0%~99.7%)和高度富集(12.0~35.0),显著推进了花青素的产品化进程。
95.4.本发明通过调节消泡液ph值进一步纯化了紫苏花青素,获得的紫苏花青素浓缩液(浓度最高为1.8g/l)经一步纯化后可直接作为紫苏花青素产品的生产原料;残液可作为提取紫苏油、迷迭香酸和其他有效成分的原料进行处理,进一步提高经济效益。
附图说明
96.以下,结合附图来详细说明本发明的实施例,其中:
97.图1:提取、分离和富集紫苏叶中花青素的工艺流程图。
98.图2:泡沫分离塔装置的示意图,其中,1-空气泵,2-缓冲瓶,3-空气加湿瓶,4-流量计,5-止水夹,6-气体分布器,7-消泡液,8-进料泵,9-残液,10-泡沫层。
99.图3:添加不同浓度的脱脂紫苏籽蛋白对花青素泡沫分离效果的影响结果。
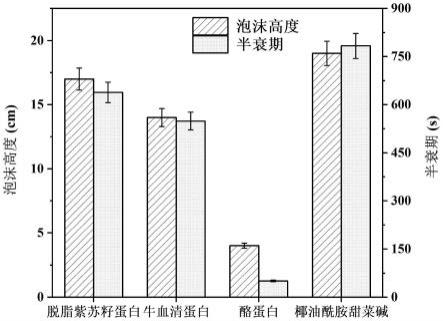
100.图4:脱脂紫苏籽蛋白、牛血清蛋白、酪蛋白和椰油酰胺甜菜碱的泡沫性能测试结果。
101.图5:不同ph值对花青素泡沫分离效果的影响结果。
具体实施方式
102.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明的部分实施例,而不是全部。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
103.本实施例使用的“紫苏”种植于山西省中北大学晋中产业技术研究院试验田,收叶和收籽后于无阳光直射且通风处阴干至恒重备用,脱脂紫苏籽为紫苏籽脱油后的产物。
104.本实施例中紫苏花青素浓度根据宋德群等研究者在《沈阳农业大学学报》2013年44卷第231页至第233页上发表的“蓝莓花色苷的ph示差法测定”中给出的测定方法进行测定。
105.本实施例中脱脂紫苏籽蛋白浓度根据吴存兵等研究者在《安徽农业大学学报》2017年44卷4期第574页至第579页上发表的“响应面优化泡沫法提取紫苏饼粕蛋白的工艺”中给出的测定方法进行测定。
106.本实施例中泡沫性能测试参照kanokkarn等研究者在《colloids and surfaces a physicochemical and engineering aspects》2017年524卷第135至第142页上发表的“equilibrium and dynamic surface tension in relation to diffusivity and foaming properties:effects of surfactant type and structure”中给出的测定方法,使用内径为45mm和柱高为500mm的透明有机玻璃柱进行,将200ml的溶液加入柱中,调节气速200ml/min,记录60s内产生的泡沫高度以及泡沫相下降到一半高度所需的时间,前者为泡沫高度、代表起泡性,后者为泡沫半衰期、代表泡沫稳定性。
107.本实施例中所述的“回收率”计算公式如下:
[0108][0109]
本实施例中所述的“富集比”计算公式如下:
[0110][0111]
本实施例中采用的提取、分离和富集紫苏叶中花青素的工艺流程如图1所示,泡沫分离塔装置如图2所示,第一步:紫苏叶经粉碎、过筛,于乙醇/水溶液中超声浸提,离心取上清液,经旋蒸后得到紫苏叶浸提液。第二步:脱脂紫苏籽经粉碎、过筛,碱提酸沉后离心取沉
淀,冷冻干燥后得到脱脂紫苏籽蛋白。第三步,紫苏叶浸提液和脱脂紫苏籽蛋白混合后注入进料液调节池中,通过调节操作条件强化泡沫排液,减小消泡液体积,有效分离和富集紫苏花青素;残液注入残液储池,可作为提取紫苏油、迷迭香酸和其他有效成分的原料;消泡液注入消泡液储池。第四步:消泡液经过酸沉去除蛋白进行一步纯化,离心后上清液注入二次酸沉上清液储池,冷冻干燥后获得紫苏花青素产品。
[0112]
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明的部分实施例,而不是全部。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0113]
实施例1:紫苏花青素的提取、分离和富集
[0114]
第一步,紫苏属花青素浸提液的获取
[0115]
将干燥紫苏叶经高速粉碎机粉碎后过80目筛子,得到紫苏叶粉;分别按照1:40(g/ml)的料液比向紫苏叶粉中加入体积分数为30%的乙醇水溶液,调节ph值为5.0,于35℃下超声提取20min;冷却至室温后于4000r/min下离心15min,取上清液,在温度60℃和转速30r/min下采用旋转蒸发仪提取1.0h,即得紫苏叶花青素浸提液,置于调节池中,其中紫苏花青素浓度为2.0mg/g。
[0116]
第二步,紫苏蛋白的制备
[0117]
将干燥后的脱脂紫苏籽经高速粉碎机粉碎后过500目筛子,获得脱脂紫苏籽粉;按照1:100、1:200、1:300、1:400、1:500、1:600(g/ml)的料液比向脱脂紫苏籽粉中加入水溶液,调节ph值为10.0,于35℃和400rpm转速下搅拌提取10min;即得脱脂紫苏籽浸提液,其中脱脂紫苏籽蛋白浓度分别为670.2、738.7、794.8、824.3、859.8、864.3mg/l;冷却至室温后调节ph值为4.3进行酸沉,于5000r/min下离心12min,取沉淀,用水将沉淀物洗出溶解,再用碱液调整溶液ph至7.0,于-55℃下冷冻干燥24h后获得脱脂紫苏籽蛋白,该蛋白纯度分别达到83、88、90、93、95、96%。
[0118]
第三步,基于泡沫分离技术分离和富集紫苏花青素
[0119]
分别将100、200、300、400、500、600mg/l脱脂紫苏籽蛋白(第二步获得的纯度96%的紫苏蛋白)与紫苏叶花青素浸提液混合,调节ph值为4.0,作为进料液,之后进料液注入泡沫分离塔中;该塔(如图2所示)的内径为50mm、高为1.3m,在室温下进行泡沫分离,操作方式为间歇操作,气速为0.3l/min,泡沫层高度为0.8m,待泡沫不能从泡沫分离塔顶流出时停止通气,操作时间为45~60min;流出塔顶的泡沫进行收集并机械消泡,即为消泡液,注入消泡液储池,其体积分别是紫苏浸提液体积的2.8、4.2、5.0、6.6、8.2、10.3%,紫苏叶花青素浓度分别为662.9、772.1、1001.2、760.6、594.6、464.8mg/l;泡沫分离塔底排放的残液注入残液储池,其中紫苏叶花青素浓度分别为11.4、7.7、1.4、1.1、0.8、0.6mg/l。
[0120]
通过泡沫分离工艺,紫苏叶花青素的回收率和富集比见图3。可见,较低浓度的紫苏蛋白尽管能够实现花青素的较高富集,但是不利于花青素的高效回收;与此相反,较高浓度的紫苏蛋白尽管能够实现花青素的高效回收,但是不利于花青素的高度富集。
[0121]
第四步,纯化及冷冻干燥
[0122]
将第三步中300mg/l脱脂紫苏籽蛋白与紫苏叶花青素浸提液混合,调节ph值为4.0,作为进料液,进行泡沫分离后的消泡液调节ph至4.3,在室温下6000r/min下离心15min,取上清液将ph调整为7.0,注入二次酸沉上清液储池;在温度-55℃下冷冻干燥36h即
得紫苏花青素产品。
[0123]
实施例2:紫苏花青素的提取、分离和富集
[0124]
第一步,紫苏属花青素浸提液的获取
[0125]
同实施例1。
[0126]
第二步,基于泡沫分离技术分离和富集紫苏花青素
[0127]
将300mg/l牛血清蛋白质与紫苏叶花青素浸提液混合,调节ph值为4.0,作为进料液,之后进料液注入泡沫分离塔中;该塔(如图2所示)的内径为50mm、高为1.3m,在室温下进行泡沫分离,操作方式为间歇操作,气速为0.3l/min,泡沫层高度为0.8m,待泡沫不能从泡沫分离塔顶流出时停止通气,操作时间为55min;流出塔顶的泡沫进行收集并机械消泡,即为消泡液,注入消泡液储池,其体积是紫苏浸提液体积的11.0%,紫苏叶花青素浓度为433.8mg/l;泡沫分离塔底排放的残液注入残液储池,其中紫苏叶花青素浓度为6.6mg/l。
[0128]
通过泡沫分离工艺,紫苏叶花青素的回收率为88.3%,富集比为10.8。由图4可以看出牛血清蛋白的起泡性和泡沫稳定性均不如脱脂紫苏籽蛋白,因此与添加脱脂紫苏籽蛋白在其他条件一致进行实验时相比,回收率和富集比分别降低了10.3%和132.4%。
[0129]
第三步,纯化,冷冻干燥
[0130]
将泡沫分离后消泡液调节ph至4.3,在室温下6000r/min下离心15min,取上清液将ph调整为7.0,注入二次酸沉上清液储池;在温度-55℃下冷冻干燥36h即得紫苏花青素产品。
[0131]
实施例3:紫苏花青素的提取、分离和富集
[0132]
第一步,紫苏属花青素浸提液的获取
[0133]
同实施例1。
[0134]
第二步,基于泡沫分离技术分离和富集紫苏花青素
[0135]
将300mg/l酪蛋白与紫苏叶花青素浸提液混合,调节ph值为4.0,作为进料液,之后进料液注入泡沫分离塔中;该塔(如图2所示)的内径为50mm、高为1.3m,在室温下进行泡沫分离,操作方式为间歇操作,气速为0.3l/min,泡沫层高度为0.8m,待泡沫不能从泡沫分离塔顶流出时停止通气,操作时间为55min;流出塔顶的泡沫进行收集并机械消泡,即为消泡液,注入消泡液储池,其体积是紫苏浸提液体积的2.6%,紫苏叶花青素浓度为933.5mg/l;泡沫分离塔底排放的残液注入残液储池,其中紫苏叶花青素浓度为15.4mg/l。
[0136]
通过泡沫分离工艺,紫苏叶花青素的回收率为70.0%,富集比为23.3。由图4可以看出酪蛋白的起泡性和泡沫稳定性明显差于脱脂紫苏籽蛋白,因此与添加脱脂紫苏籽蛋白在其他条件一致进行实验时相比,回收率和富集比分别降低了39.1%和7.7%。
[0137]
第三步,纯化及冷冻干燥
[0138]
将泡沫分离后消泡液调节ph至4.3,在室温下6000r/min下离心15min,取上清液将ph调整为7.0,注入二次酸沉上清液储池;在温度-55℃下冷冻干燥36h即得紫苏花青素产品。
[0139]
实施例4:紫苏花青素的提取、分离和富集
[0140]
第一步,紫苏属花青素浸提液的获取
[0141]
同实施例1。
[0142]
第二步,基于泡沫分离技术分离和富集紫苏花青素
[0143]
将300mg/l椰油酰胺丙基甜菜碱与紫苏叶花青素浸提液混合,调节ph值为4.0,作为进料液,之后进料液注入泡沫分离塔中;该塔(如图2所示)的内径为50mm、高为1.3m,在室温下进行泡沫分离,操作方式为间歇操作,气速为0.3l/min,泡沫层高度为0.8m,待泡沫不能从泡沫分离塔顶流出时停止通气,操作时间为55min;流出塔顶的泡沫进行收集并机械消泡,即为消泡液,注入消泡液储池,其体积是紫苏浸提液体积的36.1%,紫苏叶花青素浓度为136.8mg/l;泡沫分离塔底排放的残液注入残液储池,其中紫苏叶花青素浓度为11.1mg/l。
[0144]
通过泡沫分离工艺,紫苏叶花青素的回收率为82.3%,富集比为2.8,由图4可以看出椰油酰胺丙基甜菜碱的起泡性和泡沫稳定性略优于脱脂紫苏籽蛋白,但是其对花青素的捕收能力较差,与添加脱脂紫苏籽蛋白在其他条件一致进行实验时相比,回收率和富集比分别降低了18.3%和796.4%。
[0145]
第三步,纯化、冷冻干燥
[0146]
将泡沫分离后消泡液调节ph至4.3,在室温下6000r/min下离心15min,取上清液将ph调整为7.0,注入二次酸沉上清液储池;在温度-55℃下冷冻干燥36h即得紫苏花青素产品。
[0147]
实施例5:紫苏花青素的提取、分离和富集
[0148]
第一步,紫苏属花青素浸提液的获取
[0149]
同实施例1。
[0150]
第二步,紫苏蛋白的制备
[0151]
将干燥后的脱脂紫苏籽经高速粉碎机粉碎后过500目筛子,获得脱脂紫苏籽粉;按照1:500(g/ml)的料液比向脱脂紫苏籽粉中加入水溶液,分别调节ph值7.0、8.0、9.0、10.0、11.0,于35℃和400rpm转速下搅拌提取15min;即得脱脂紫苏籽浸提液,其中脱脂紫苏籽蛋白浓度分别为592.6、782.6、880.8、823.2、731.6mg/l;冷却至室温后调节ph至4.3进行酸沉,于5000r/min下离心12min,取沉淀,用水将沉淀物洗出溶解,再用碱液调整溶液ph至7.0,于-55℃下冷冻干燥24h后获得脱脂紫苏籽蛋白,该蛋白纯度分别达到88、90、98、96、93%。
[0152]
第三步,基于泡沫分离技术分离和富集紫苏花青素
[0153]
将300mg/l脱脂紫苏籽蛋白(第二步获得的纯度98%的紫苏蛋白)与紫苏叶花青素浸提液混合,调节ph值为2.0、3.0、4.0、4.4、5.0、6.0、7.0,作为进料液,之后进料液注入泡沫分离塔中;该塔(如图2所示)的内径为50mm、高为1.3m,在室温下进行泡沫分离,操作方式为间歇操作,气速为0.3l/min,泡沫层高度为0.8m,待泡沫不能从泡沫分离塔顶流出时停止通气,操作时间为35~50min;流出塔顶的泡沫进行收集并机械消泡,即为消泡液,注入消泡液储池,其体积分别是紫苏浸提液体积的6.5、5.8、5.0、4.1、4.8、6.3、7.2%,紫苏叶花青素浓度分别为788.8、866.1、1001.2、1659.5、1226.9、902.4、770.6、581.6mg/l;泡沫分离塔底排放的残液注入残液储池,其中紫苏叶花青素浓度分别为8.3、5.9、1.4、0.2、4.7、7.8、9.5mg/l。
[0154]
通过泡沫分离工艺,紫苏叶花青素的回收率和富集比见图5。可见,无论是较低还是较高的ph值均不利于花青素的富集和回收。
[0155]
第四步,纯化、冷冻干燥
[0156]
将进料液ph值为4.4的泡沫分离后消泡液调节ph至4.3,在室温下6000r/min下离心15min,取上清液将ph调整为7.0,注入二次酸沉上清液储池;在温度-55℃下冷冻干燥36h即得紫苏花青素产品。
[0157]
由以上实施例可以看出,本技术的方法是在乙醇/水超声提取的基础上,根据泡沫分离的界面吸附原理、通过加入同源蛋白质实现花青素的同时分离和富集,同时工艺流程具备步骤简单、绿色化、能耗低和投资少等优点。
[0158]
本发明未尽事宜为公知技术。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。