1.本发明涉及生物医学工程技术领域,尤其涉及一种基于图像分析的单细胞捕获系统。
背景技术:
2.单细胞测序技术是指对单个细胞基因组、转录组等信息进行测序定量,从而揭示细胞群体差异和细胞进化关系。高通量测序技术即二代测序技术(next generation sequencing,ngs),能对一个物种的基因组和转录组等进行全面、细致的分析,其能一次并行对几十万到几百万条dna分子进行序列测定、读长较短等为标志,通过读取多个短dna片段,拼接成完整的序列信息;在处理大规模样品时具有显著的优势,是目前组学研究中的核心技术。
3.1964年,美国康奈尔大学教授罗伯特
·
霍利(robert holley)发明了最早的测序技术。此后,分子克隆、凝胶电泳和放射自显影技术的发展使dna序列直读法应运而生;1971年美国康奈尔大学的华人生物学家吴瑞将引物延伸法用于dna测序,为日后的sanger测序法提供了技术基础;1975年,英国生物化学家弗雷德里克
·
桑格(frederick sanger),在吴瑞测序方法的基础上发明了生命科学领域划时代的测序技术sanger测序法,并于1977年,利用此技术成功测序出φx174噬菌体的基因组序列——这是人类解读的第一个完整的生物体基因组全序列。第一代测序技术的主要特点是测序读长可达1000bp,准确性高达99.999%,但其测序成本高,通量低等方面的缺点,严重影响了其真正大规模的应用。
4.随着1985年人类基因组计划(human genome project,hgp)的提出,测序向着更大样本量、更多数据量、更多物种的方向迅速发展,第一代测序技术无法成为理想的测序方法。经过不断的技术开发和改进,以roche公司的454、illumina公司的solexa、hiseq技术和abi公司的solid技术为标记的高通量测序技术诞生了,其大大降低测序成本的同时,还大幅提高了测序速度、保持高准确性,但在序列读长方面比第一代测序技术要短很多。
5.随着高通量测序技术的迅猛发展,其被广泛应用于各类生物学问题。在基因组水平上对还没有参考序列的物种进行从头测序(de novo sequencing),获得该物种的参考序列,为后续研究和分子育种奠定基础;对有参考序列的物种,进行全基因组重测序(resequencing),在全基因组水平上扫描并检测突变位点,发现个体差异的分子基础;还可以在宏基因组水平进行微生物多样性及功能鉴定等。在转录组水平上进行全转录组测序(whole transcriptome resequencing),从而开展可变剪接、编码序列单核苷酸多态性(csnp)等研究;或进行小分子rna测序(small rna sequencing),通过分离特定大小的rna分子进行测序,从而发现新的microrna分子等。在表观组水平上,与染色质免疫共沉淀(chip)和甲基化dna免疫共沉淀(medip)技术相结合,从而检测出与特定转录因子结合的dna区域和基因组上的甲基化位点等。在蛋白组水平上,用于鉴定蛋白质、表征蛋白质翻译后修饰、分析蛋白质一级结构与功能的关系等。在代谢组水平上,对生物体内代谢物进行定量分析,寻找代谢物与生理病理变化的相对关系等。此外,还有基于高通量测序结合微阵列
技术而衍生出来目标序列捕获测序技术(targeted resequencing),如全外显子组捕获测序等。随着技术的发展,测序技术也进一步推进到单细胞水平上,更方便于探究早期胚胎发育、细胞异质性、分析谱系路径等。此外,基因表达具有时间特异性和空间特异性,新的测序技术可更进一步解析时间、空间维度上细胞类型和基因表达模式。
6.单细胞测序技术是指对单个细胞基因组、转录组等信息进行测序定量,从而揭示细胞群体差异和细胞进化关系。近年来,随着高通量测序技术的迅猛发展,对单个细胞进行组学测序的技术也日益成熟,单细胞测序的成本也日趋下降。随着研究不断深入,已有多种单细胞测序技术被开发出来,国内外最新的研究成果已经实现了在单细胞水平上对全基因组、转录组、表观遗传组以及蛋白质组学等进行全方位的测序与探索。目前,单细胞技术已广泛应用于基础和临床研究,基于单细胞的组学测序已成为诸如肿瘤学、微生物学、神经生物学学、生殖医学、免疫学等诸多学科进行科研探索的必要手段之一。
7.单细胞测序技术的兴起最早可追溯至2006年的。利用多重置换扩增法,科研人员将飞克级别的dna 扩增放大到微克级,从而达到被机器捕获并测序的阈值,为单细胞级组学的检测打开了大门。在随后很短的时间里,各类测序技术如雨后春笋般出现。2009年,汤富酬等人便在扩增单细胞基因组方法的基础上,首次建立了单细胞转录组测序的方法,为后续单细胞转录组的研究奠定了基础。之后的几年时间里,单细胞转录组测序技术不断改进,如strt-seq、smart-seq、smart-seq2等方法陆续发表在了顶级期刊上。除了转录组外,表观遗传学的测序技术也得到了长足的发展。2012年至2013年间,pbat以及scbs-seq方法的出现,填补了单细胞甲基化测序的空白。2015年,利用dnase i可切割消化未被核小体包被染色体的特性,首个对对单细胞染色体开放状态进行测序的方法在《nature》上发表,这也标志着首个对表观遗传学的研究进入了全新的阶段。在日益增长的科研需求下,仅仅对单一组学测序的方案已无法完成许多科研探索。在2015年,桑格研究所的研究人员就率先通过磁珠将dna与rna分离,从而实现了同时对转录组以及基因组的检测。剑桥大学wolf reik团队开发的scm&t-seq技术,通过通过结合smart-seq2和scbs-seq提供了同时检测单细胞转录组以及dna甲基化的可靠方案。而17年问世的scnome-seq可同时对单细胞水平的染色体开放状态以及dna甲基化进行测定。由satiji实验室开发的cite-seq以及eccite-seq技术,通过将特定碱基标签与抗体偶联的方法,实现了对单个细胞的部分细胞表面蛋白以及转录组同时测定。另外,由北大汤富酬教授团队开发的诸如sctrio-seq、sccool-seq等技术可同时对单细胞基因组、dna甲基化、转录组/染色体开放状态进行检测。为了对细胞在空间上的联系进行探索,诸如slide-seq等可对空间范围内的转录组测序方案也陆续问世。
8.目前主流的单细胞捕获技术包括以下两种:
9.1.10x genomics公司基于微流控的液滴捕获技术:利用微流控技术分选单个细胞,beads在压力的作用下逐个通过管道,而细胞和酶在另一个垂直管道,将1个细胞打到1个bead上,然后混入油相。通过油滴包裹单个细胞和bead,形成油包水的结构,创造1个bead吸附1个细胞内的mrna的微环境。进而达到捕获单细胞并进行后续文库构建的微环境。
10.2.bd rhapsody单细胞捕获系统:bd rhapsody利用微孔进行单细胞分离,属于microwell-seq。20万个微孔的尺寸被设计成一个微孔恰好可以容纳一个bead(磁珠),bead上连接逆转录引物。捕获时单细胞悬液被稀释到适当浓度,微孔随机捕获单细胞,单细胞捕获率为80%,捕获1k个细胞出现的多细胞比率约为0.2%,捕获10k个细胞多细胞比率约为
2.4%。rhapsody建议检测通量为100-10000。
11.单细胞测序技术发展至今,全球范围内已开发出数十种不同应用场景的单细胞测序技术,但总体而言,单细胞测序技术分三个环节:单细胞捕获、文库构建以及高通量二代测序。目前根据应用场景有不同的文库构建方法,高通量的二代测序也是非常成熟的平台,最关键的单细胞捕获技术是限制其应用的核心。目前主流的单细胞捕获技术平台包括基于微流体技术的相关产品,利用微流体装置,可以将带有条形码的微珠、细胞以及反应所需的酶、引物等一起装入微小的液滴,在数百上千个微滴中进行反应,从而在短时间内获得数以千计的单细胞转录组文库,代表性的方法包括上述10x genomics公司的基于drop-seq等技术。另外一个单细胞捕获技术平台是上述通过自然沉降捕获高通量细胞的micorowell技术,通过让单细胞沉降入只能容纳一个细胞的微孔内,进而形成一个微量反应体系进行文库的构建。目前这些主流的单细胞捕获技术仍面临较多限制,例如:
12.1)基于微流控的单细胞技术对细胞大小有明确限制,10x genomics公司的微流控芯片一般要求细胞直径小于40um,单细胞样本上机前必须使用网筛对细胞进行过滤,以去除直径大于40um的细胞,因此会造成样本偏好性以及损失样本信息等问题。同时又难以捕获过小的细胞或者类细胞,如细胞器等,限制了技术的应用范围;
13.2)由于目前主流方法采用油包水液滴的形式形成一个微量反应体系进行核酸扩增,因此该方法对细胞类型存在一定偏好性,如脂肪细胞在形成油包水液滴过程中效率较低进而影响建库和扩增效率等。
14.3)目前主流的微流控和microwell技术体系均采用在液滴或微孔中直接裂解细胞,之后利用液滴或微孔内一个耦联了引物序列条形码的微珠捕获mrna信息。由于无法实现单细胞的核质分离,因此无法实现单细胞多组学建库和测序;
15.4)目前主流的微流控和microwell技术体系由于捕获技术限制以及测序深度有限等,最终获得的平均单细胞可检测到的基因数量较少,因此可能损失部分样本信息以及不利于后期进行深度的数据挖掘分析工作。
16.5)目前主流的微流控和microwell技术体系由于对细胞进行无差别的捕获,为了提高活细胞的捕获效率产出较高质量测序数据,因此目前的捕获技术体系均要求上样的单细胞悬液先进行细胞活率检测,悬液中细胞活率须达到一定标准,如需细胞活率在85%以上,之后进行无差别的捕获,对于捕获的凋亡细胞,后续只能通过生物信息学算法进行过滤。
17.6)目前主流的微流控和microwell技术体系由于采用捕获后细胞混合整体建库的策略,由于受捕获效率限制,其要求上样的细胞数量较多,至少需要数百个细胞以上,一般需要数万个细胞,因此不适用于稀少细胞的样本,如单胚胎的单细胞样本等。
技术实现要素:
18.针对上述技术问题,本发明提供一种基于图像分析的单细胞捕获系统。本发明提供的单细胞捕获系统的捕获原理不同于目前主流的单细胞捕获系统,基于图像分析化,将单细胞或单细胞类似物分布、活性或其他特征进行图像分析和并将其二维位置信息传递,然后对目标区域内的靶标单细胞或单细胞类似物进行逐个吸取,吸取的单细胞或单细胞类似物可通过采样管进行转移并收集,后续用于多种不同用途的建库操作。
19.为实现上述目的,本发明采取的技术方案为:
20.一方面,本发明提供一种基于图像分析的单细胞捕获系统,包括储液单元、光学成像单元、图像分析单元、采样单元和分别连接所述采样单元和所述图像分析单元的控制单元;
21.所述光学成像单元用于获取所述储液单元内的图像信息,包括光源和图像采集元件;
22.所述采样单元包括连通的采样吸头和采样管道;所述采样吸头从所述储液单元处吸取目标物,通过与其连通的采样管道将所述目标物转移;
23.所述图像分析单元与所述图像采集元件相连进行图像信息的接受与输出;
24.所述控制单元包括用于控制所述采样吸头的第一位移控制模块;所述第一位移控制模块与所述图像分析单元相连;所述第一位移控制模块根据所述图像分析单元反馈的信息控制所述采样吸头的位移。
25.优选地,所述采样单元包括多组孤立连通的采样吸头和采样管道;所述采样吸头可拆卸地与所述采样管道连通。
26.优选地,所述储液单元上设置有定位标记,所述定位标记将储液单元划分为多个储液区域,所述多组孤立连通的采样吸头和采样管道与所述多个储液区域一一对应。
27.优选地,所述光源和所述图像采集元件分别设置于所述储液单元的上下两侧。
28.优选地,还包括与所述储液单元相连的进样单元,所述进样单元包括进样管和与其连通的铺样器;所述铺样器包括样品仓和样品出口;所述样品出口设置于所述样品仓的下端;所述样品仓的截面从上端至所述样品出口呈收敛状;所述进样管的一端开设有进样口,另一端与所述样品仓连通。
29.优选地,还包括与所述采样管道和所述控制单元相连的收集单元;所述收集单元包括多孔培养板和出样针管;所述控制单元还包括第二位移控制模块;所述出样针管与所述第二位移控制模块相连;所述出样针管与所述采样管道连通;所述第二位移控制模块通过控制所述出样针管在所述多孔培养板上的位移将其定位至多孔培养板的目标区域。
30.优选地,所述样品仓和样品出口的宽度与储液单元的宽度一致。
31.又一方面,本发明提供上述单细胞捕获系统在捕获单细胞及单细胞类似物中的用途。
32.在本发明的技术方案中,所述单细胞类似物包括细胞核、细胞器等。
33.上述技术方案具有如下优点或者有益效果:
34.1.本发明提供的单细胞捕获系统对上机单细胞样本的活率无限制,本发明对细胞进行图像分析定位和识别后,用吸头逐个吸取以捕获,结合台盼蓝染色等相关技术,在图像识别后可仅吸取目标区域内的活细胞,因此对上机细胞样本的活率无限制和要求;
35.2.本发明提供的单细胞捕获系统对细胞大小无偏好性,对细胞类型无偏好性;本发明提供的单细胞捕获系统对单细胞采取单个逐一吸取的方式,因此对细胞大小没有特殊要求,可实现大细胞到极小细胞甚至细胞器的捕获;同时,由于吸取的单细胞通过可以直接分样的收集单元进行收集,无需通过油包水液滴,因此对细胞类型无偏好性;
36.3.本发明提供的单细胞捕获系统可以对单个细胞或细胞类似物逐一图像识别并捕获,因此理论上对于上机样本的细胞数量没有下限,只要图像可识别即能够进行捕获,因
此可用于极少量细胞样本的单细胞捕获;
37.4.现有技术中,捕获单细胞后采用单细胞样本与beads混合的样品标签技术捕获mrna的poly a尾,一次性对成千上万的细胞进行整体建库和测序,文库构建的通量较高,但受测序数据量限制,测序深度较低,单个细胞可测的基因数偏低;而本发明提供的单细胞捕获系统,捕获的单细胞可以逐一单独收集并进行后续建库处理,便于实现核质分离进行单细胞多组学建库;同时由于对单个细胞进行单独建库和测序,因此测序深度较高,获得的数据中单细胞可测得的基因数理论上较主流技术的单细胞平均测得基因数高出2-8倍,可实现多组学高深度的单细胞测序;
38.5.本发明提供的单细胞捕获系统中,光学成像单元中的光源用激光发射器替换后,可用于特定荧光信号标记细胞的捕获;
39.6.本发明提供的单细胞捕获系统,通过更换不同内径规格的吸头以及提高图像分析单元的分辨率,能够提高捕获精度,不仅可用于单细胞的捕获,也可以实现更小的细胞核、亚细胞器等单细胞类似物的捕获。
附图说明
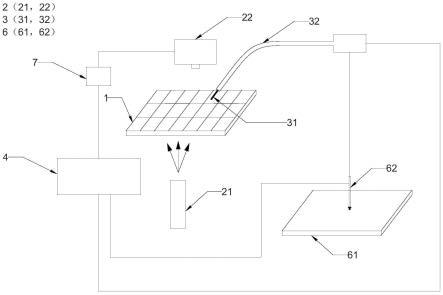
40.通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明及其特征、外形和优点将会变得更加明显。在全部附图中相同的标记指示相同的部分。并未刻意按照比例绘制附图,重点在于示出本发明的主旨。
41.图1是本发明实施例1中的单细胞捕获系统的结构示意图。
42.图2是本发明实施例1中的单细胞捕获系统的进样单元的结构示意图。
43.图3是本发明实施例1中的单细胞捕获系统的进样单元的结构示意图。
具体实施方式
44.下面结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整的说明,显然所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。因此,以下对附图中提供的本发明实施例中的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明的实施例,本领域技术人员在没有作出创造性劳动的前提下所获得的所有其他实施例,都属于本发明的保护范围。
45.在本发明的描述中,需要说明的是,如出现术语“中心”、“上”、“下”、“左”、“右”、“竖直”、“水平”、“内”、“外”等,其所指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。
46.在本发明的描述中,需要说明的是,除非另有明确的规定和限定,如出现术语“安装”、“相连”、“连接”应做广义理解,例如,可以是固定连接,也可以是可拆卸连接,或一体地连接;可以是机械连接,可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通。对于本领域的普通技术人员而言,可以具体情况理解上述术语在本发明中的具体含义。
47.在本发明中,若非特指,所有的设备和原料等均可从市场购得或是本行业常用的。下述实施例中的方法,如无特别说明,均为本领域的常规方法。
48.实施例1:
49.本实施例1提供一种基于图像分析的单细胞捕获系统,如图1所示,包括储液单元1、光学成像单元2、图像分析单元7、采样单元3和分别连接采样单元3和图像分析单元7的控制单元4;
50.光学成像单元2用于获取储液单元1内的图像信息,包括光源21和图像采集元件22;
51.采样单元3包括连通的采样吸头31和采样管道32;采样吸头31从储液单元1处吸取目标物,通过与其连通的采样管道32将目标物转移;
52.图像分析单元7与图像采集元件22相连进行图像信息的接受与输出;
53.控制单元4包括用于控制采样吸头31的第一位移控制模块;第一位移控制模块与图像分析单元7相连;第一位移控制模块根据图像分析单元7反馈的信息控制采样吸头31在储液单元1上的位移。
54.本实施例提供的单细胞捕获系统在使用过程中,储液单元1用于承载解离的单细胞或单细胞类似物(如细胞核、细胞器等)悬液(以下简称为细胞悬液);光学成像单元2获取储液单元1承载的细胞悬液的图像信息后传递给图像分析单元7;图像分析单元7对接收到的图像信息进行分析并反馈给控制单元4,并通过第一位移模块控制采样吸头31的位移,将其定位至储液单元1的目标区域,从储液单元1内吸取目标单细胞或单细胞类似物,并通过采样管道32将其转移。
55.为了进一步提高单细胞捕获系统的操作便捷性,采样单元3包括多组孤立连通的采样吸头31和采样管道32;采样吸头31可拆卸地与采样管道32连通。设置多组孤立连通的采样吸头31和采样管道32,可以实现多个吸头同步工作吸取目标单细胞或单细胞类似物,第一位移模块独立控制每个采样吸头的位移,将多个采样吸头移动到储液单元1的不同区域,同步进行吸取,进一步提高了采样效率;而采样吸头31可拆卸地与采样管道32连通,可以实现吸头的便捷更换,不仅可以更换新吸头,也可以更换不同内径规格的吸头,进一步提高了单细胞捕获系统的操作便捷性。
56.为了进一步提高单细胞捕获系统的实用性,储液单元1上设置有定位标记,定位标记将储液单元1划分为多个储液区域,多组孤立连通的采样吸头31和采样管道32与多个储液区域一一对应。在储液单元1上用定位标记将其划分为多个区域对应不用的采样吸头,可以清楚显示不同采样吸头的工作区域,光学成像单元2所获取的图像信息更为精准,从而能够提高单细胞捕获系统的准确性和通量。其中定位标记可以采用定位线和定位凹槽等。
57.为了进一步提高单细胞捕获系统的实用性,光源21和图像采集元件22分别设置于储液单元1的上下两侧。本实施例中,储液单元1的上下侧相对于储液单元承载细胞悬液的表面而言,光源21和图像采集元件22并无固定的方位,光源21在上时,图像采集元件22在下,光源21在下时,图像采集元件22在上。本发明提供的单细胞捕获系统,光源21发出的光线照射储液单元1,生成光学图像信息;图像采集元件22观测和收集储液单元1多个储液区域内的光学图像信息。
58.为了进一步提高单细胞捕获系统的操作性,单细胞捕获系统还包括与储液单元1相连的进样单元5,如图2所示,进样单元5包括进样管51和与其连通的铺样器52;铺样器52包括样品仓和样品出口;样品出口设置于样品仓的下端;样品仓的截面从上端至样品出口
呈收敛状;进样管的一端开设有进样口,另一端与样品仓连通。本发明提供的单细胞捕获系统通过进样单元5将细胞悬液铺载于储液单元1上,使用过程中,细胞悬液通过进样管51流入样品仓内,铺样器52在储液单元1上平移,在重力或压力作用下细胞悬液通过样品仓下端设置的样品出口流到储液单元1上,样品仓的截面设置为收敛状,可以使细胞悬液均匀滴下,保证储液单元1上细胞悬液的均匀性。铺样器52在储液单元1上的移动方向可随意设置,与细胞悬液流入进样管51的方向无关。
59.为了进一步提高单细胞捕获系统的实用性,单细胞捕获系统还包括与采样管道32和控制单元4相连的收集单元6;收集单元6包括多孔培养板61和出样针管62;控制单元4还包括第二位移控制模块;出样针管62与第二位移控制模块相连;出样针管62与采样管道32连通;第二位移控制模块通过控制出样针管62在多孔培养板61上的位移将其定位至多孔培养板61的目标区域。本发明提供的单细胞捕获系统,在使用过程中,采样吸头31吸取的单细胞或单细胞类似物通过采样管道32流入出样针管62中,第二位移控制模块控制出样针管62的位移,将其移动至多孔培养板61目标位置,并释放出样针管62内的单细胞或单细胞类似物。本发明中,采样单元3设置多组孤立连通的采样吸头31和采样管道32时,每一个采样管道孤立连通一个出样针管,第二位移控制模块独立控制多个出样针管的位移,同时实现多个出样针管的同步出样,提高出样效率。
60.为了进一步提高储液单元上细胞悬液的均匀性,样品仓和样品出口的宽度与储液单元1的宽度一致。如图3所示,本实施例中,铺样器5在储液单元1上的运动方向如箭头所示,储液单元1的宽度为其铺载细胞悬液的平面上垂直于箭头方向的长度,样品仓和样品出口的宽度即垂直于上述箭头的长度与该长度一致。本发明提供的铺样器,铺样过程中,随着铺样器的移动,细胞悬液从样品出口滴落,设置样品出口的宽度与储液单元1的宽度一致,可以实现细胞悬液成排滴下,铺样器的移动速率保持在合理的范围内时,当铺样器从储液单元的一端平移至另一端的过程中,细胞悬液即均匀完整地铺载于储液单元上,无需重复移动操作,保证了储液单元上细胞悬液分布的均匀性。
61.以上所述仅是本发明的优选实施方式,应当指出:对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。