用于难治性遗传性肾病奥尔波特综合征的根治性疗法的药剂
1.相关申请的交叉引用
2.本国际申请主张基于2019年9月11日向日本专利局申请的日本专利申请第2019-165583号的优先权,并通过参考将日本专利申请第2019-165583号的全部内容引用至本国际申请。
技术领域
3.本发明涉及一种胶原三聚物形成促进剂,特别涉及奥尔波特综合征的治疗领域。
背景技术:
4.奥尔波特综合征(as)是一种由构成肾脏的肾小球的基底膜的任意一种iv型胶原基因(col4a3、col4a4、col4a5)的突变所导致的遗传性疾病。奥尔波特综合征(as)是一种严重疾病,其大多从儿童期起发病,并在10-20多岁发展至终末期肾功能衰竭。目前,as的治疗与其它慢性肾病一样利用肾素-血管紧张素(ras)抑制剂进行对症治疗,但患者最终都会向终末期肾功能衰竭发展而不得不进行人工透析或者肾移植。
5.环孢菌素a(csa)是由11个氨基酸构成的疏水性环状多肽。csa通过抑制钙调神经磷酸酶来抑制细胞因子的产生,因此被用作抑制移植时的排斥反应等的免疫抑制剂。1992年callis等人报道了投予csa可以延迟as的发病,证明了as治疗的可能性(非专利文献1)。然后,尝试阐明其机理,并报道了对于肾小球的血流动力学的作用等(非专利文献2及3)。2008年faul等人报道,在足细胞中csa通过抑制钙调神经磷酸酶来保持突触足蛋白(synaptopodin)的磷酸化,从而保护作为肌动蛋白相互作用蛋白质的突触足蛋白不被组织蛋白酶l分解(非专利文献4)。基于该报道,目前一直认为csa的作用机理在于稳定足细胞中的肌动蛋白骨架(非专利文献5及6)。
6.但是,另一方面,报道称csa也存在伴随抑制钙调神经磷酸酶-nf-at路径而产生的肾毒性等副作用(非专利文献7)。
7.阿拉泊韦(alisporivir)是作为环孢菌素衍生物而报道的化合物(专利文献1),其被开发用作丙型肝炎病毒治疗药物。
8.另外,作为广泛使用的as模型,具有col4a3缺失(col4a3 ko)小鼠(非专利文献8)及col4a5无意义突变(col4a5-g5x)小鼠(非专利文献9),但它们均是缺失了作为病因的蛋白质α3(iv)、α5(iv)的表达自身的模型。col4a5 g5x突变小鼠是美国明尼苏达大学的dr.michelle rhea ult等人基于6岁起表现出肾脏病理的少年的突变型所制作的。该小鼠是外显子1的第五个密码子从甘氨酸转换为终止密码子的突变,很可能也会伴有无意义突变依赖性mrna分解机理等,因此几乎不表达α5(iv)突变体,肾小球基底膜(gbm)上的α345(iv)缺失(非专利文献9)。该小鼠是通过持续蛋白尿漏出而表现出炎症性细胞的浸润及局灶节段性肾小球硬化(fsgs)、间质纤维化等的模型,可以说很好地反映了as的进行性的临床病理。本发明人等也使用该模型小鼠探索病理调控因子及评价治疗药物的药效,并鉴定出多个治疗靶点及候选治疗药物,但它们均仅靶向与病理学进展相关的因子,肾脏病理的
改善效果有限。因此认识到,对于导致as的α345(iv),需要一种更准确地反映病理的模型动物。
9.现有技术文献
10.专利文献
11.专利文献1:wo2000/001715
12.非专利文献
13.非专利文献1:l.callis等,pediatric nephrology(1992)6:140-144
14.非专利文献2:l.callis等,kidney international(1999)55:1051-1056
15.非专利文献3:dilys chen等,j.am.soc.nephrol(2003)14:690-698
16.非专利文献4:christian faul等,nat.med.(2008)14(9):931-938
17.非专利文献5:massela.l等,pediatric nephrology(2010)25(7):1269-1275
18.非专利文献6:sugimoto.k等,clin.exp.nephrol.(2014)18:492-498
19.非专利文献7:charbit.m等,pediatric nephrology(2007)22:57-63
20.非专利文献8:miner jh等,j.cell biol.(1996)135:1403-1413.
21.非专利文献9:rheault mn等,j.am.soc.nephrol.(2004)15:1466-1474.
技术实现要素:
22.发明要解决的问题
23.本发明的目的在于提供一种更加安全且直接作用于疾病的发病机理的as治疗法。
24.解决问题的方法
25.本发明的发明人们一直以来着眼于as肾组织中降低的病因蛋白质col4a3/a4/a5的三聚物的形成、及胞外分泌降低,探讨了通过改善以上情况来根治as的可能性,并成功构建了能够对它们进行高通量评价的系统(利用split nanoluc的评价体系)(omachi k.等,cell chem.biol.(2018)25:634)。使用所构建的系统对独立采集的微生物提取物库进行筛选,结果表明,具有以下结构的csa会促进作为as的病因蛋白质的iv型胶原的三聚物的胞外分泌。
[0026][0027]
目前认为,csa对于as的奏效性是由csa的钙调神经磷酸酶抑制活性所带来的。因
而,针对虽然是csa的衍生物,但不会抑制钙调神经磷酸酶,也不具有免疫抑制作用的psc-833进行了试验,但没有确认到促进突变胶原三聚物分泌的作用。由此,即使csa对于as有效,也不能推断其衍生物也具有相同的效果。
[0028][0029]
本发明的发明人们进一步针对csa的衍生物对于as的作用进行了研究,结果意外发现,与psc833一样不会抑制钙调神经磷酸酶,且不具有免疫抑制作用的阿拉泊韦(alisporivir)具有促进as突变胶原三聚物分泌的作用。
[0030][0031]
并且,本发明的发明人们对其它化合物也进行了考察,结果发现,不会抑制钙调神经磷酸酶,且不具有免疫抑制作用的nim258也具有促进as突变胶原三聚物分泌的作用。
[0032]
本发明的发明人们由此发现,csa、阿拉泊韦及nim258基于完全不同于钙调神经磷酸酶路径的另一新机理引起iv型胶原的三聚物形成及胞外分泌,从而能够根治as,特别是,阿拉泊韦及nim258所具有的除钙调神经磷酸酶路径以外的活性通过促进iv型胶原三聚物
形成/分泌而带来as治疗效果。
[0033]
目前认为,由于csa伴随着其钙调神经磷酸酶抑制活性而具有肾毒性,因此难以直接作为as治疗药物临床应用。已经通过临床试验确认不具有肾毒性的阿拉泊韦(s.zeuzem等,aliment pharmacol.ther.(2015)42:829-844;m.buti等,j.of viral hepatitis(2015)22:596-606)、及同样不具有免疫抑制作用的nim258具有促进iv型胶原分泌的作用,并起到as治疗效果,这说明它们可以解决限制csa临床应用的肾毒性的问题,由此,本发明的发明人首次成功提供了肾毒性低的根治as的药物。
[0034]
并且,本发明的发明人们进一步研究了csa及阿拉泊韦促进iv型胶原的三聚物的形成及分泌的机理,结果发现,其机理源于亲环素d的参与。具体而言,在缺失了亲环素d的细胞中csa及阿拉泊韦不会充分发挥促进iv型胶原的三聚物形成及分泌的作用,因此发现,csa及阿拉泊韦是通过作用于亲环素d来促进iv型胶原的三聚物的形成及分泌。另外,本发明的发明人们考察了亲环素d在iv型胶原的三聚物的形成及分泌中的作用,发现敲低亲环素d会促进iv型胶原的三聚物的形成及分泌。
[0035]
综上所述,本发明的发明人们发现,阿拉泊韦促进因as而变得异常的iv型胶原三聚物的胞外分泌,从而用作根治as的药物;csa及阿拉泊韦促进iv型胶原的三聚物的形成及分泌的机理是基于亲环素d的抑制,亲环素d成为促进iv型胶原的三聚物的形成及分泌的新靶点。
[0036]
另一方面,本发明的发明人们也针对iv型胶原的突变进行了分析,其通过抑制亲环素d来促进三聚物形成能够起到效果。结果发现,对于col4a5上的外显子41的区域内或其周围的氨基酸突变所导致的iv型胶原的三聚物的形成及分泌障碍特别有效。
[0037]
发明的效果
[0038]
本发明促进iv型胶原的三聚物的形成及胞外分泌,因此可以有助于以as为代表的由iv型胶原的三聚物的形成及分泌障碍所导致的疾病的根治及预防。本发明对于col4a5上的外显子41的区域内或其周围的突变所引起iv型胶原的三聚物的形成及分泌障碍导致的疾病特别有效。
附图说明
[0039]
图1是示出csa处理时包含col4a5(g1244d)在内的胶原三聚物的分泌量的图表。图表中,横轴的数值表示csa的浓度(μm),纵轴用与对照(二甲基亚砜(dmso)处理组)的比(%of control)来表示胶原三聚物的分泌量。横轴中的“dmso”表示dmso处理组。胶原三聚物的分泌量以csa浓度依赖性的方式增加。
[0040]
图2是示出psc-833处理时包含col4a5(g1244d)在内的胶原三聚物的分泌量的图表。图表中,横轴的数值表示psc-833的浓度(μm),纵轴用与对照(dmso处理组)的比来表示胶原三聚物的分泌量。横轴上的“dmso”表示dmso处理组,“csa”表示环孢菌素a处理组(1μm)(阳性对照)。即使使psc-833的添加量增加至10μm,胶原三聚物的分泌量也不会增加。
[0041]
图3是示出阿拉泊韦处理时包含col4a5(g1244d)在内的胶原三聚物的分泌量的图表。图表中,横轴的数值表示阿拉泊韦的浓度,纵轴用与对照(dmso处理组)的比(%of control)来表示胶原三聚物的分泌量。横轴上的“dmso”表示dmso处理组,“csa”表示csa处理组(阳性对照)。胶原三聚物的分泌量以阿拉泊韦给药量依赖性的方式增加。
[0042]
图4是示出在更高浓度的csa(5、10μm)和阿拉泊韦(5、10μm)的处理条件下进行图1和图3的实验而得到的结果的图表。图表中,横轴表示环孢菌素a(csa)和阿拉泊韦(alv)浓度,纵轴用与对照(dmso处理组)的比(%of control)表示胶原三聚物的分泌量。横轴上的“dmso”表示dmso处理组,“alv”表示阿拉泊韦处理组,“csa”表示csa处理组(阳性对照)。在高浓度下,可见与csa相比,阿拉泊韦的胶原三聚物的分泌量较多的倾向。
[0043]
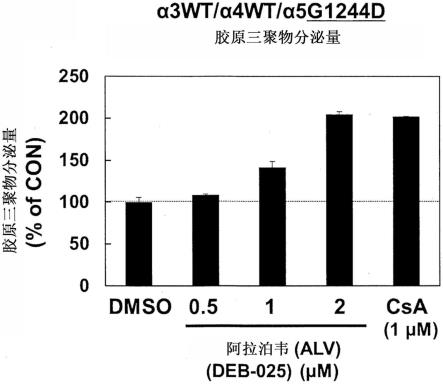
图5是示出对野生型(α3wt/α4wt/α5wt:上图)和col4a5上具有g1241v的氨基酸突变的细胞系(α3和α4为野生型)(α3wt/α4wt/α5g1241v:下图)分别进行阿拉泊韦处理时胶原三聚物的分泌量的图表。图表中,横轴表示阿拉泊韦的浓度(μm),纵轴用与对照(dmso处理组)的比(%of control)表示胶原三聚物的分泌量。横轴上的“dmso”表示dmso处理组,“alv”表示阿拉泊韦处理组,“csa”表示csa处理组(阳性对照)。可见与野生型相比突变型中csa和阿拉泊韦促进三聚物的形成和分泌的效果更高。
[0044]
图6是示出对col4a5上具有g1241v的氨基酸突变的细胞系(α3和α4为野生型)(α3wt/α4wt/α5g1241v:下图)进行nim258处理时胶原三聚物的分泌量的图表。图表中,横轴表示nim258的浓度(μm),纵轴用与对照(dmso处理组)的比(%of control)表示胶原三聚物的分泌量。横轴上的“dmso”表示dmso处理组,“nim258”表示nim258处理组。显示出nim258促进三聚物的形成和分泌的效果。
[0045]
图7是示出针对具有临床报告的广泛的as突变体(col4a5的g227s、g594d、g624d、g869r、s916g、g1030s、g1107r、g1140v、g1220d、g1241c、g1241v、g1244d、p1517t、及r1569q)、和外显子41(col4a5的第1202~1263个氨基酸)缺失(d外显子41))突变体的细胞测定csa及阿拉泊韦促进三聚物形成及分泌的能力而得到的结果的图表。纵轴用与各细胞的对照(dmso处理组)的比(%of control)表示胶原三聚物的分泌量。α5wt表示野生型col4a5。横轴的“con”表示对照(dmso处理组),“csa”表示csa处理组(阳性对照),“alv”表示阿拉泊韦处理组。可见特别是在g1030s、g1107r、g1220d、g1241c、g1241v、g1244d、及外显子41缺失的细胞中csa和阿拉泊韦促进三聚物的形成和分泌的效果较高。
[0046]
图8是示出为了阐明csa和阿拉泊韦促进胶原三聚物形成的机理而向用sirna敲低了亲环素类(ppia(亲环素a)、ppib、ppic、ppid、ppie、ppif(亲环素d)、ppig、ppih、ppil1、nktr、ppwd1)的g1244d突变导入hek293t细胞中添加csa和阿拉泊韦,并考察促进胶原三聚物形成的效果而得到的结果的图表。纵轴用与各细胞的对照(dmso处理组)的比(%of control)来表示胶原三聚物的分泌量。横轴的“con”表示对照(dmso处理组),“csa”表示csa处理组(阳性对照),“alv”表示阿拉泊韦处理组。特别是在ppif(亲环素d)敲低细胞中,抑制了csa和阿拉泊韦促进胶原三聚物的形成和分泌的能力。
[0047]
图9是示出使用g1244d突变导入hek293t细胞考察用sirna敲低了各种亲环素类(ppia(亲环素a)、ppib、ppic、ppid、ppie、ppif(亲环素d)、ppig、ppih、ppil1、nktr、ppwd1)而得到的细胞中的胶原三聚物形成能力而得到的结果的图表。纵轴用与对照(sigl2处理组)的比(%of control)表示胶原三聚物的分泌量。横轴表示所使用的sirna的种类。特别是在用sippif处理后的细胞中,确认促进了胶原三聚物的形成和分泌。
[0048]
图10是示出制作col4a5g1244d小鼠和col4a5δ外显子41小鼠时所使用的核酸的示意图。
[0049]
图11是表示δ外显子41小鼠中的层粘连蛋白(laminin)的表达的照片、和细胞/基
底膜溶胞产物(lysate)的蛋白质印迹(wb)照片(方框内)。
[0050]
图12是表示δ外显子41小鼠的尿中蛋白质量的图表。纵轴表示尿中蛋白质量(mg/mg cre),横轴表示周龄(week-old)。黑圈表示野生型小鼠,黑方块表示δ外显子41小鼠。
[0051]
图13是示出δ外显子41小鼠的血清肌酐值的图表。纵轴表示血清肌酐值(mg/dl)。横轴的con表示野生型小鼠,δ外显子41表示δ外显子41小鼠。
[0052]
图14表示向δ外显子41小鼠投予csa后的尿中蛋白质的变化的图表。纵轴表示尿中蛋白质量(mg/mg cre),横轴表示周龄(week-old)。通过投予csa抑制了尿中蛋白质的升高。
[0053]
发明的具体实施方式
[0054]
在一个方式中,本发明涉及含有亲环素d抑制剂作为有效成分的、用于促进具备具有突变的iv型胶原基因的细胞中胶原三聚物的形成和/或分泌的组合物、或者促进胶原三聚物的形成和/或分泌的促进剂。
[0055]
作为亲环素d抑制剂,除阿拉泊韦之外,还可列举例如:wo2009/018179;wo2012/103520;us9、132、138b;wo2014/093632;jp2016-124821a;jp2017-513490a;wo2015/200725;us9、738、615b;wo2016/112321;us10、179、161b;wo2019/173382中记载的化合物。亲环素d抑制剂可以为在这些文献中记作亲环素d选择性抑制剂的物质。
[0056]
亲环素d抑制剂优选为以上物质中不显示钙调神经磷酸酶抑制作用的物质。例如,由于钙调神经磷酸酶通过将活化t细胞核内因子(nf-at)脱磷酸化而使其移动到核内,因此,能够使用在nfat结合部位的下游插入有报告基因的系统来考察候选物质是否不显示钙调神经磷酸酶抑制作用(参见blood(2000)96(2):459-466.)。在报告基因的表达在候选分子存在下不减少的情况下,则能够判断该候选分子不显示钙调神经磷酸酶抑制作用。在本说明书中,不显示钙调神经磷酸酶抑制作用可以表示完全不具有钙调神经磷酸酶抑制作用,但通常表示,钙调神经磷酸酶抑制的程度在本发明的目的下使用时充分低且不会产生毒性等问题。举例而言,不显示钙调神经磷酸酶抑制作用可以表示钙调神经磷酸酶抑制作用比csa更低。另外,由于钙调神经磷酸酶抑制作为生物活性被表示为免疫抑制活性,因此,亲环素d抑制剂也可以为不显示免疫抑制活性的物质。
[0057]
例如,作为亲环素d抑制剂,能够使用下述式子表示的环孢菌素衍生物、或其盐、或者它们的水合物或溶剂化物:
[0058][0059]
式中,r1表示被羟基取代的c1~10烷基或c2~10烯基;或者下述式子表示的基团,
[0060][0061]
x表示o或nr
11
,
[0062]r11
表示h或c1~6烷基,
[0063]
y表示cr
12r13
、cr
14
或》c=o,
[0064]r12
表示h、c1~6烷基或oh基,
[0065]r13
表示h、c1~6烷基或oh基,
[0066]r14
表示h或c1~6烷基,
[0067]
z为(ch2)m、cr
15
、nr
16
或o,
[0068]r15
表示h或c1~6烷基,
[0069]r16
表示h或c1~6烷基,
[0070]
m为1~3的整数,
[0071]
n表示0或1,
[0072]
由实线和虚线表示的y-z之间的键表示单键或双键,在y-z之间的键为单键的情况下,y为cr
12r13
或c=o,且z为(ch2)m、nr
16
或o;在y-z之间的键为双键的情况下,y为cr
14
,且z为cr
15
,
[0073]
r2表示任选被羟基取代的c1~4烷基,
[0074]
r3表示氢原子;任选被羟基和/或卤素原子取代的c1~6烷基、c1~6烷氧基或c1~6烷基硫基;或者
[0075]
选自以下的式子的基团,
[0076][0077]
r4表示c1~4烷基,
[0078]
r5表示任选被羟基和/或c1~6烷氧基取代的c1~6烷基、或以下表示的基团,
[0079][0080]
r6表示正丙基或异丙基,
[0081]
r7表示c1~4烷基,
[0082]
r8表示任选被羟基取代的c1~4烷基,
[0083]
r9表示支链状的c3~4烷基,
[0084]
波浪线表示的键表示所键合的手性碳原子的立体结构为r体、s体或它们的混合物。
[0085]
以上,“c1~10烷基”表示碳原子数1~10个的直链或支链状的饱和烃基,“c1~6烷基”表示碳原子数1~6个的直链或支链状饱和烃基,“c1~4烷基”表示碳原子数1~4个的直链或支链状饱和烃基。作为烷基,可列举例如:甲基、乙基、正丙基、异丙基、异丁基、仲丁基、叔丁基、异丁基、戊基、异戊基、2,3-二甲基丙基、己基、2-甲基戊基、庚基、2-甲基己基、辛基、2-甲基庚基、壬基、2-甲基辛基、癸基、和2-甲基壬基等。另外,“支链状的c3~4烷基”表示异丙基、异丁基、仲丁基或叔丁基。
[0086]“c2~10烯基”表示从具有一个以上碳-碳间的双键的直链或支链状的不饱和烃的任意碳原子中去掉一个氢原子而成的碳原子数2~10个的一价基团。作为c2~10烯基,可列
举例如:乙烯基、丙烯基、异丙烯基、1-丁烯基、2-丁烯基、3-丁烯基、1-甲基-1-丙烯基、2-甲基-1-丙烯基、1-甲基-2-丙烯基、2-甲基-2-丙烯基、1-亚甲基-1-丙烷基、1-戊烯基、1-戊烯基、3-戊烯基、4-戊烯基、1-甲基-1-丁烯基、1-甲基-2-丁烯基、1-甲基-3-丁烯基、1-亚甲基丁基、2-甲基-1-丁烯基、2-甲基-2-丁烯基、2-甲基-3-丁烯基、2-亚甲基丁基、3-甲基-1-丁烯基、3-甲基-2-丁烯基、3-甲基-3-丁烯基、1-乙基-1-丙烯基、1-乙基-2-丙烯基、1-己烯基、2-己烯基、3-己烯基、4-己烯基、5-己烯基、1-甲基-1-戊烯基、1-甲基-2-戊烯基、1-甲基-3-戊烯基、1-甲基-4-戊烯基、1-亚甲基戊基、2-甲基-1-戊烯基、2-甲基-2-戊烯基、2-甲基-3-戊烯基、2-甲基-4-戊烯基、2-亚甲基戊基、3-甲基-1-戊烯基、3-甲基-2-戊烯基、3-甲基-3-戊烯基、3-甲基-4-戊烯基、3-亚甲基戊基、4-甲基-1-戊烯基、4-甲基-2-戊烯基、4-甲基-3-戊烯基、4-甲基-4-戊烯基、1-乙基-1-丁烯基、1-乙基-2-丁烯基、1-乙基-3-丁烯基、2-乙基-1-丁烯基、2-乙基-2-丁烯基、2-乙基-3-丁烯基、1-(1-甲基乙基)-1-丙烯基、1-(1-甲基乙基)-2-丙烯基、1-乙基-2-甲基-1-丙烯基、1-乙基-2-甲基-2-丙烯基、4-己烯基、2-甲基-4-戊烯基、4-庚烯基、2-甲基-4-己烯基、4-辛烯基、2-甲基-4-庚烯基、4-壬烯基、2-甲基-4-辛烯基、4-癸烯基、和2-甲基-4-壬烯基等。
[0087]“c1~6烷氧基”是指经由氧原子与上述c1~6烷基键合的基团((c1~6烷基)-o-基),该烷基部分可以为直链状,也可以为支链状。c1~6烷氧基表示该烷基部分的碳原子数为1~6个。作为烷氧基,可列举例如:甲氧基、乙氧基、1-丙氧基、2-丙氧基、2-甲基-1-丙氧基、2-甲基-2-丙氧基、2,2-二甲基-1-丙氧基、1-丁基氧基、2-丁基氧基、2-甲基-1-丁基氧基、3-甲基-1-丁基氧基、2-甲基-2-丁基氧基、3-甲基-2-丁基氧基、1-戊氧基、2-戊氧基、3-戊氧基、2-甲基-1-戊氧基、3-甲基-1-戊氧基、2-甲基-2-戊氧基、3-甲基-2-戊氧基、1-己基氧基、2-己基氧基、3-己基氧基等。c1~6烷氧基优选为c1~5烷氧基,更优选为甲氧基、乙氧基、正丙氧基、异丙氧基、异丁基氧基、仲丁基氧基、叔丁基氧基、异丁基氧基、戊氧基、异戊氧基、和2,3-二甲基丙氧基,进一步优选为c1~3烷氧基(甲氧基、乙氧基、和丙氧基),更进一步优选为甲氧基或乙氧基。
[0088]“c1~6烷基硫基”是指通过硫原子与上述c1~6烷基键合的基团((c1~6烷基)-s-基),该烷基部分可以为直链状,也可以为支链状。c1~6烷基硫基表示该烷基部分的碳原子数为1~6个。作为烷基硫基,可列举例如:甲基硫基、乙基硫基、1-丙基硫基、2-丙基硫基、2-甲基-1-丙基硫基、2-甲基-2-丙基硫基、2,2-二甲基-1-丙基硫基、1-丁基硫基、2-丁基硫基、2-甲基-1-丁基硫基、3-甲基-1-丁基硫基、2-甲基-2-丁基硫基、3-甲基-2-丁基硫基、1-戊基硫基、2-戊基硫基、3-戊基硫基、2-甲基-1-戊基硫基、3-甲基-1-戊基硫基、2-甲基-2-戊基硫基、3-甲基-2-戊基硫基、1-己基硫基、2-己基硫基、3-己基硫基等。c1~6烷基硫基优选为c1~5烷基硫基,更优选为甲基硫基、乙基硫基、正丙基硫基、异丙基硫基、异丁基硫基、仲丁基硫基、叔丁基硫基、异丁基硫基、戊基硫基、异戊基硫基、及2,3-二甲基丙基硫基,进一步优选为c1~3烷基硫基(甲基硫基、乙基硫基及丙基硫基),更进一步优选为甲基硫基或乙基硫基。
[0089]
作为上述式子的r1,优选为1-羟基-2-甲基-己基、1-羟基-2-甲基-4-己烯基或下述式子表示的基团:
[0090][0091]
式中,x表示o或nr
11
,
[0092]r11
表示h或c1~6烷基,
[0093]
y表示cr
12r13
、cr
14
或》c=o,
[0094]r12
表示h、c1~6烷基或oh基,
[0095]r13
表示h、c1~6烷基或oh基,
[0096]r14
表示h或c1~6烷基,
[0097]
z为(ch2)m、cr
15
、nr
16
或o,
[0098]r15
表示h或c1~6烷基,
[0099]r16
表示h或c1~6烷基,
[0100]
m为1~3的整数,
[0101]
n表示0或1,
[0102]
由实线和虚线表示的y-z之间的键表示单键或双键,在y-z之间的键为单键的情况下,y为cr
12r13
或c=o,且z为(ch2)m、nr
16
或o;在y-z之间的键为双键的情况下,y为cr
14
,且z为cr
15
。
[0103]
r1可以为例如1-羟基-2-甲基-己基或1-羟基-2-甲基-4-己烯基。
[0104]
r2优选为任选被羟基取代的c1~3烷基,例如可以为甲基、乙基、1-羟基乙基、异丙基或正丙基。
[0105]
r3优选为氢原子,或者任选被羟基和/或卤素原子取代的c1~4烷基,例如可以为氢原子或甲基。
[0106]
r4优选为甲基。
[0107]
r5优选为c3~4支链烷基,例如为异丁基或仲丁基。
[0108]
r6优选为c3烷基,例如为异丙基。
[0109]
r7优选为c4烷基,例如为异丁基。
[0110]
r8优选为甲基或羟基甲基,更优选为甲基。
[0111]
r9优选为c3~4支链烷基,例如为异丁基或异丙基。
[0112]
更具体而言,作为亲环素d抑制剂,能够列举:环孢菌素a、环孢菌素d、nim258、nim811、阿拉泊韦、pkf220-384、scy-635、mtcsa1、mtcsa2、mtcsa3、环孢菌素c、环孢菌素g、环孢菌素m、环孢菌素h、二氢环孢菌素d、[(d)ser]8-环孢菌素、[meile]8-环孢菌素、[meala]6-环孢菌素、[(d)pro]3-环孢菌素、及scy-641。优选为其中不显示钙调神经磷酸酶抑制/免疫抑制活性的物质,具体为nim258(j.fu等,j med chem(2014)57:8503?16.);nim811(r.traber等,antiviral chemistry&chemotherapy(1994)5:331-9);阿拉泊韦(j.paeshuyse等,hepatology(2006)43:761-70.);pkf220-384(molecular pharmacology 62(1):22-9);scy-635(s.hopkins等,antimicrob agents chemother(2010)54:660-72.);mtcsa1、mtcsa2、mtcsa3(以上出自biochem j.2012;441(pt3):901-7.);环孢菌素h(j immunol 1991;147:1940-1946)、及[meile]8-环孢菌素(scifinder),更优选为阿拉泊韦和
具有其骨架的衍生物化合物(nim258、nim811、scy-635)(jiping fu等,j.med.chem.(2014)57:8503-8516),最优选为阿拉泊韦和nim258。
[0113]
在一个方式中,本发明也可以为一种组合物,其含有亲环素d抑制剂作为有效成分,用于促进具备具有突变的iv型胶原基因的细胞中胶原三聚物的分泌。
[0114]
另外,作为亲环素d抑制剂,也可以使用针对亲环素d的sirna、shrna、mirna、抗亲环素抗体、针对亲环素d的适配子、或针对亲环素d的反义核酸分子。另外,亲环素d抑制剂可以为具有以下序列的肽:
[0115]
efggvmcvesvnremsplvd(序列号53)
[0116]
remsplvdnialwmteylnr(序列号54)
[0117]
mcvesvnremsplvdnialw(序列号55)
[0118]
llslalvgacitlgaylghk(序列号56)
[0119]
作为sirna及反义等核酸分子,可列举例如具有以下序列的核酸分子(左侧表示5’端,右侧表示3’端):
[0120]
ggcagaugucgucccaaag(序列号27)
[0121]
cuuugggacgacaucugcc(序列号28)
[0122]
gtcctcccactcttagagcc(序列号57)
[0123]
gtcctcccactcttagagcc(序列号58)
[0124]
cttcccgcctgtgccattgt(序列号59)
[0125]
gatgtcctcccactcttaga(序列号60)
[0126]
tgtcctcccactcttagagcc(序列号61)
[0127]
ggaggacauccaagaagauugucat(序列号62)
[0128]
augacaaucuucuuggauguccuccca(序列号63)
[0129]
cccaaagacagcugagaacuucaga(序列号64)
[0130]
ucugaaguucucagcugucuuugggac(序列号65)
[0131]
gcuccaccuuccacagggugauccc(序列号66)
[0132]
gggaucacccuguggaagguggagccu(序列号67)
[0133]
cagacugguuggauggcaagcaug(序列号68)
[0134]
acaugcuugccauccaaccagucuguc(序列号69)
[0135]
ggcuaaugcugguccuaacaccaac(序列号70)
[0136]
guugguguuaggaccagcauuagccau(序列号71)
[0137]
这些亲环素d抑制剂能够通过例如wo2009/018179;wo2012/103520;us9、132、138b;wo2014/093632;jp2016-124821a;jp2017-513490a;wo2015/200725;us9、738、615b;wo2016/112321;us10、179、161b;wo2019/173382中记载的方法来获得。
[0138]
亲环素d抑制剂是上述式子表示的化合物等。在本说明书中,亲环素d抑制剂根据需要可以为药理学上可接受的盐和/或水合物或溶剂化物的形式。在本说明书中,“药理学上可接受的盐”是指本发明的化合物与无机或有机的酸结合而形成的盐,允许该盐作为药物投予于体内。这样的盐记载于例如berge等,j.pharm.sci.66:1-19(1977)等。作为盐,可列举:与盐酸、氢溴酸、硫酸、硝酸、磷酸等矿物酸的盐;与甲磺酸、苯磺酸、对甲苯磺酸、醋酸、丙酸盐、酒石酸、富马酸、马来酸、苹果酸、草酸、琥珀酸、柠檬酸、苯甲酸、扁桃酸、肉桂
酸、乳酸、乙醇酸、葡萄糖醛酸、抗坏血酸、烟酸、水杨酸等有机酸的盐;或与天冬氨酸、谷氨酸等酸性氨基酸的盐等。需要指出,亲环素d抑制剂的水合物或溶剂化物、及亲环素d抑制剂的药理学上可接受的盐的水合物或溶剂化物也包括在亲环素d抑制剂之内。另外,在本说明书中,即使在未明确说明的情况下,“亲环素d抑制剂”也包括亲环素d抑制剂的药理学上可接受的盐、水合物及溶剂化物、以及亲环素d抑制剂的药理学上可接受的盐的水合物或溶剂化物,除非其明显不适用。
[0139]
iv型胶原是基底膜的主要构成成分,存在6种(α1、2、3、4、5及6)(分别为序列号2、4、6、8、10及12),分别由对应的基因(col4a1、2、3、4、5及6)(分别为序列号1、3、5、7、9及11)编码。胶原的3条α链缔合而形成三螺旋结构。在肾脏的肾小球基底膜(gbm)中主要表达α3、α4、α5,一般认为这些上的突变特别是多参与as的发病。在本说明书中,“胶原”可以表示iv型胶原。并且,在本说明书中,“iv型胶原”也可以表示具有突变的iv型胶原。在本说明书中,作为具有突变的iv型胶原基因,优选iv型胶原基因(col4a3、col4a4或col4a5),最优选为col4a5。
[0140]
在本说明书中,只要这样解释没有矛盾,则“突变”表示由氨基酸的取代、缺失和/或插入导致的突变,优选为取代。举例而言,胶原的“突变”为降低胶原三聚物的分泌量的突变、或引起as的突变。
[0141]
iv型胶原基因上的突变只要为有助于胶原的三聚物的形成及分泌的突变,则不受特别限定,优选为降低胶原三聚物的分泌的突变,可列举例如:选自col4a5上的g129e、g227s、g230c、g325r、g426r、g475s、g521d、g573d、g594d、g594s、g624d、g650d、l664n、g675s、g796r、g869r、g911e、s916g、g953v、g1030s、g1107r、g1140v、g1143d、g1220d、g1241c、g1241v、g1244d、g1448r、p1517t、c1567r、r1569q、m1607i、l1649r、及r1683q中的突变(优选为g1241v和/或g1244d)、或者外显子41上的氨基酸突变。另外,在本说明书中,as优选为具有这样的突变的as。
[0142]“促进胶原三聚物的分泌”表示最终使胶原三聚物的胞外分泌量与未投予该药剂时相比增加,可以包括:促进胶原三聚物的分泌本身;使胶原基因的产生量增加;及促进胶原三聚物形成中的任意一种、两种或三种作用。本发明的组合物可以通过促进胶原三聚物的分泌来根治胶原三聚物的分泌量不足为根本原因的as。
[0143]
本发明的组合物能够制成以as为代表的由胶原三聚物的形成和/或分泌障碍导致的疾病或状态的治疗药物或预防药物。在本说明书中,as可以适当替换为由胶原三聚物的形成和/或分泌障碍导致的疾病或状态。as典型地为遗传性疾病,作为其代表性的临床症状,可列举:肾小球肾炎、慢性肾炎、血尿(特别是持续性血尿)、蛋白尿、肾小球基底膜不规则增厚及致密层网状变化等肾脏病变;耳聋、特别是感音性(神经性)耳聋、高频范围内的听力下降和渐进性恶化等耳部病变;前圆锥形晶状体、后囊下白内障、后部多形性角膜变性、盲点视网膜(blind spot retina)等眼部病变;弥漫性平滑肌瘤(diffuse leiomyomatosis)并发症等。
[0144]
本发明的治疗药物或预防药物待治疗/预防的患者可以具有col4a5上的g1030s、g1107r或外显子41的区域内的氨基酸突变,在此,外显子41的区域内的突变可以为g1220d、g1241c、g1241v或g1244d。
[0145]
由此,在其它方式中,本发明涉及作为as的治疗药物、预防药物或改善剂的上述组
合物(医疗用组合物)。本发明的医疗用组合物能够制成口服或非口服给药用医疗用组合物,例如,能够制成片剂、散剂、颗粒剂、胶囊剂、口服液、糖浆剂、软膏、洗剂、或注射剂(例如,静脉注射用注射剂、皮下给药用注射剂、肌肉注射用注射剂、点滴)。在本说明书中,医疗用组合物能够通过常规方法来制备。
[0146]
医疗用组合物可以含有药理学上可接受的载体(制剂用添加物)。用于制造医疗用组合物的制剂用添加物的种类、制剂用添加物相对于有效成分的比例、或医疗用组合物的制造方法可以根据组合物的形式由本领域技术人员适当选择。作为制剂用添加物,能够使用无机或有机物质、或者固体或液体的物质,一般而言,相对于有效成分重量可以按照1重量%~90重量%配合。
[0147]
医疗用组合物可以进一步与其它药剂一同给药。其它药剂和本发明的医疗用组合物可以包含于单一制剂,也可以作为单独的制剂一并给药。作为这样的其它药剂,可列举:不会抑制亲环素d抑制剂对as的治疗效果,而是已知对as具有治疗效果的药剂;或者增强亲环素d抑制剂的治疗效果的药剂。例如,作为增强亲环素d抑制剂的治疗效果的药剂,可列举:肾素-血管紧张素-醛固酮系抑制剂:血管紧张素转换酶抑制剂(例如,依拉普利、雷米普利、贝那普利等)、血管紧张素ii受体拮抗剂(例如,缬沙坦、氯沙坦、坎地沙坦等);他汀类(例如,氟伐他汀等);醛固酮拮抗剂(例如,螺内酯等);或者活性维生素d2类似物(例如,帕立骨化醇等)等。
[0148]
本发明涉及一种as的治疗方法、预防方法或改善方法,其包括向需要的患者投予有效量的亲环素d抑制剂。本发明涉及一种包括向需要的患者投予有效量的亲环素d抑制剂的、改善患者的胶原三聚物的形成和/或分泌障碍的方法或者胶原三聚物的形成和/或分泌促进剂。“需要的患者”具体是指罹患有as的患者。患者优选为具有col4a5上的g1030s、g1107r或外显子41的区域内的氨基酸突变的患者,在此,外显子41的区域内的突变可以为g1220d、g1241c、g1241v或g1244d。例如,本发明的治疗方法或预防方法可以包括调查想要进行治疗或预防的患者是否具有这样的突变的步骤。具体而言,本发明可以为as的治疗方法或预防方法,包括:调查患者的col4a5上的基因突变的步骤;和在上述基因突变为g1030s、g1107r、或外显子41的区域内的氨基酸突变的情况下,向该患者投予有效量的本发明的组合物的步骤。在该方法中,外显子41的区域内的氨基酸突变可以为g1220d、g1241c、g1241v或g1244d。“有效量”表示可以改善想要治疗、预防或改善的症状或状态的量。作为想要治疗、预防或改善的症状或状态,可列举例如:基底膜上的α5(iv)表达消失;α2(iv)在gbm中广泛表达;层粘连蛋白的异位表达增加;蛋白尿;尿白蛋白漏出;血清肌酐值升高;其它进行性的肾脏病理。
[0149]
在本说明书中,待治疗、预防或改善的患者包括人、牛、马、犬、猫、猪、绵羊等哺乳动物,优选为人。
[0150]
本发明的医疗用组合物的给药可以在体内、离体或体外进行。
[0151]
并且,本发明涉及亲环素d抑制剂用于制造as的治疗药物、预防药物或改善药物的用途。本发明涉及亲环素d抑制剂用于制造改善胶原三聚物的形成和/或分泌障碍的药剂的用途。本发明涉及亲环素d抑制剂用于制造胶原三聚物的形成和/或分泌促进剂的用途。另外,本发明涉及用于治疗、预防或改善as的亲环素d抑制剂。本发明涉及用于改善胶原三聚物的形成和/或分泌障碍的亲环素d抑制剂。本发明涉及用于促进胶原三聚物的形成和/或
分泌障碍的亲环素d抑制剂。例如,在为了治疗、预防或改善的目的而使用亲环素d抑制剂的情况下,能够以口服给药形式或注射剂、点滴剂等非口服给药形式投予含有亲环素d抑制剂作为有效成分的医疗用组合物。在向哺乳动物等投予亲环素d抑制剂的情况下,可以将上述的制剂口服给药,或者也可以作为注射剂、点滴剂非口服给药。给药量根据症状、年齢、性别、体重、给药形式等而不同,但在例如对成人口服给药的情况下,通常每日剂量为0.1-1000mg。
[0152]
在另一方式中,本发明涉及在col4a5基因上具有g1220d突变的非人模型动物、或col4a5基因上的外显子41缺失或被破坏的非人模型动物。外显子41的缺失不一定是整个区域,只要表现出由胶原三聚物的形成和/或分泌障碍导致的症状,则外显子41也可以为部分缺失。或者也可以破坏外显子41上的基因。例如,与相应的野生型的动物相比,非人模型动物可以通过具有选自以下的一个或多个以下表型来表征:基底膜上的α5(iv)表达消失;α2(iv)在gbm中广泛表达;层粘连蛋白的异位表达增加;蛋白尿;尿白蛋白漏出;血清肌酐值升高;其它进行性的肾脏病理。由胶原三聚物的形成和/或分泌障碍导致的症状可以为以上所列举的表型。
[0153]
或者,在另一方式中,本发明可以为外显子41缺失或被破坏的核酸构建体。该构建体能够作为用于制作本发明的模型动物的核酸构建体或者本发明的模型动物制作剂。
[0154]
非人模型动物无需为成体,也可以为其的细胞、组织或胚胎。另外,非人模型动物可以为小鼠、大鼠、豚鼠、仓鼠、兔子、犬、猪、绵羊、牛、猴子,优选为小鼠。
[0155]
本发明包括使用上述非人模型动物评价药剂对as的治疗效果的方法或筛选方法。具体而言,本方法可以包括:向上述非人模型动物投予测试药剂的步骤;观察或测定上述非人模型动物中由胶原三聚物的形成和/或分泌障碍导致的症状或状态或者作为其指标的水平(基底膜上的α5(iv)表达消失;α2(iv)在gbm上广泛表达;层粘连蛋白的异位表达增加;蛋白尿;尿白蛋白漏出;血清肌酐值升高;其它进行性的肾脏病理)的步骤;和在通过投予测试药剂改善了上述非人模型动物中由胶原三聚物的形成和/或分泌障碍导致的症状或状态或者作为其指标的水平的情况下,判定该测试药剂具有as治疗效果的步骤。“改善了由胶原三聚物的形成和/或分泌障碍导致的症状或状态或者作为其指标的水平”是指与该模型动物的状态相比更接近野生型的状态,也可以并不表示该症状或状态完全消失。
[0156]
以下,使用实施例对本发明进行更详细说明,但其并不限定本发明的范围。需要指出,本技术说明书通篇所引用的文献全文通过参照并入本技术说明书。
实施例
[0157]
(实施例1)nim258的合成
[0158]
(1)叔丁基(呋喃-2-基(甲苯磺酰基)甲基)氨基甲酸酯(4)的合成
[0159][0160]
由氨基甲酸酯(2)(8.13g,69.4mmol)和亚磺酸3(35.2g,140mmol,2.0eq)、以及甲醇和水的混合溶剂(2/1,168ml)制备悬浮液,向该悬浮液中加入醛1(8.65ml,104.1mmol,
1.5eq)及甲酸(3.4ml,90.2mmol,1.3eq)。在室温下搅拌52小时之后,过滤取得所析出的白色固体。使用水和二乙基醚清洗固体,然后使其在减压下加热干燥,从而得到氨基甲酸酯(4)(10.2g,42%收率)。
[0161]
(2)叔丁基叔丁基((1s,2s)-1-(呋喃-2-基)-2-甲基-3-氧代丙基)氨基甲酸酯(7)的合成
[0162][0163]
在双口烧瓶中量取无水硫酸钠(53.0g)和碳酸钙(15.4g),减压下使用加热枪干燥。冷却至室温后加入无水thf(100ml)得到悬浮液,向该悬浮液中加入氨基甲酸酯4(6.6g,18.6mmol)并加热回流15小时。冷却至室温后,使悬浮液通过硅藻土以除去固体,对滤液进行减压蒸馏除去,由此得到作为黄色液体的亚胺5(3.9g)。得到的产物不进一步纯化而直接用于下一工序。
[0164]
在氩气气氛及室温下,向亚胺5(3.6g,18.6mmol)中加入水(11ml),然后加入醛6(2.16g,37.2mmol,2.0eq)及(2s,4r)-4-((叔丁基二苯基甲硅烷基)氧基)吡咯烷-2-羧酸(689.7mg,1.86mmol,10mol%),搅拌反应溶液8小时。向反应溶液中加入水稀释后,用乙酸乙酯(30ml)提取水层三次。用饱和盐水清洗合并的有机层后,用无水硫酸钠干燥。减压蒸馏除去溶剂后,通过硅胶柱色谱法(己烷/乙酸乙酯=12/1)对得到的粗产物进行纯化,得到作为非对映体混合物的目标醛7(3.07g,65%收率,dr68/32)。
[0165]
(3)叔丁基((1s,2s)-1-(呋喃-2-基)-3-羟基-2-甲基丙基)氨基甲酸酯(8)的合成
[0166][0167]
冰冷下向醛7(3.07g,12.1mmol)的甲醇溶液(40ml)中缓慢加入硼氢化钠(1.38g,36.4mmol,3.0eq)。搅拌1小时后,加入饱和氯化铵水溶液以停止反应。用乙酸乙酯提取反应溶液三次后,用饱和盐水清洗合并的有机层,并用无水硫酸钠干燥。蒸馏除去溶剂得到的粗产物,用硅胶柱色谱法(己烷/乙酸乙酯=7/1)对得到的粗产物纯化,从而得到醇8(2.96g,95%收率)。
[0168]
(4)叔丁基((1s,2s)-3-((叔丁基二苯基甲硅烷基)氧基)-1-(呋喃-2-基)-2-甲基丙基)氨基甲酸酯(9)的合成
[0169][0170]
在氩气气氛及室温下,向溶解有醇8(2.96g,11.6mmol)的n,n-二甲基甲酰胺溶液(45ml)中依次加入叔丁基二苯基氯硅烷(4.7ml,17.1mmo l,1.5eq)、咪唑(1.75g,
25.5mmol,2.2eq),并在室温下搅拌5小时。冰冷反应溶液并缓慢加入1n盐酸水溶液(15ml),停止反应。升温至室温再搅拌30分钟,然后,用乙酸乙酯/己烷混合溶液(2/3,30ml)提取三次。用饱和碳酸氢钠水、饱和盐水依次清洗所合并的有机层,然后用无水硫酸钠干燥,并减压蒸馏除去溶剂。用硅胶柱色谱法(己烷/乙酸乙酯=19/1)纯化得到的粗产物,得到作为非对映体混合物的氨基甲酸酯9(5.11g 89%收率)。
[0171]
(5)叔丁基((1s,2s)-3-((叔丁基二苯基甲硅烷基)氧基)-1-(呋喃-2-基)-2-甲基丙基)(甲基)氨基甲酸酯(10)的合成
[0172][0173]
氩气气氛下,向200ml烧瓶中依次加入无水thf(30ml)、氢化钠(60%,1.24g,31.0mmol)。冷却至0℃后,通过导管向反应液中添加氨基甲酸酯9(5.11g,10.3mmol)的thf溶液(10ml)。在0℃下搅拌15分钟后,依次添加碘甲烷(2.13ml,34.2mmol,3.3eq)及n,n-二甲基甲酰胺(4.33ml,55.9mmol,5.4eq)。使反应溶液恢复室温并搅拌13小时。加入饱和氯化铵水溶液停止反应后,用乙酸乙酯(20ml)提取水层三次。用饱和盐水清洗所合并的有机层,使用无水硫酸钠使其干燥后,减压蒸馏除去溶剂,得到粗产物。使用硅胶柱色谱法(己烷/醚=12/1)将其纯化,得到氨基甲酸酯10(3.53g,67%收率)。
[0174]
(6)(1s,2s)-3-((叔丁基二苯基甲硅烷基)氧基)-1-(呋喃-2-基)-n,2-二甲基丙烷-1-胺(11)的合成
[0175][0176]
在氩气气氛、0℃下,向氨基甲酸酯10(2.91g,5.73mmol)的二氯甲烷溶液(20ml)中加入氯化氢/二噁烷溶液(4.0m,20ml),搅拌45小时。加入饱和碳酸氢钠水(20ml)停止反应后,用二氯甲烷(15ml)提取水层6次。用饱和盐水清洗所合并的有机层,使用无水硫酸钠使其干燥后,减压蒸馏除去溶剂,由此得到粗产物。用硅胶柱色谱法(己烷/乙酸乙酯=5/1~4/1)将其纯化,得到胺11(1.33g,57%收率)。
[0177]
(7)叔丁基(r)-1-((((1s,2s)-3-((叔丁基二苯基甲硅烷基)氧基)-1-(呋喃-2-基)-2-甲基丙基)(甲基)氨基)-1-氧代丙烷-2-基)(甲基)氨基甲酸酯(13)的合成
[0178][0179]
在氩气气氛下,将胺11(781mg,1.92mmol)及羧酸12(469mg,2.30mmol)溶解于无水二氯甲烷(18ml)。冷却至0℃后,加入hatu(1.75g,4.60mmol)、n,n-二异丙基乙基胺(1.0ml,5.75mmol)。升温至室温后,再搅拌1小时。加入乙酸乙酯(20ml)和水(5ml)稀释溶液后,加入
1n盐酸(10ml)停止反应。用乙酸乙酯(15ml)提取水层三次后,用饱和碳酸氢钠水及饱和盐水清洗所合并的有机层,用无水硫酸钠干燥。将溶剂减压蒸馏除去,得到粗产物,用硅胶柱色谱法(己烷/乙酸乙酯=9/1~8/1)纯化粗产物,得到酰胺13(1.09g,96%收率)。
[0180]
(8)(2s,3s)-2-((r)-2-((叔丁氧基羰基)(甲基)氨基)-n-甲基丙酰胺)-4-((叔丁基二苯基甲硅烷基)氧基)-3-甲基丁酸(14)的合成
[0181][0182]
一边剧烈搅拌一边向高碘酸钠(3.50g,16.4mmol,9.0eq)的乙腈/四氯化碳/水悬浮液(22ml/10ml/22ml)中加入氯化钌(iii)(113.5mg,0.55mmol),再搅拌15分钟。通过导管向反应液中加入酰胺13(1.08g,1.82mmol)的四氯化碳溶液(5ml)。搅拌30分钟后,加入水和10%硫代硫酸钠水溶液停止反应。用乙酸乙酯(30ml)提取水层四次,用饱和盐水清洗所合并的有机层后,用无水硫酸钠干燥。蒸馏除去溶剂得到粗产物,用硅胶柱色谱法(己烷/乙酸乙酯)纯化该粗产物,得到羧酸14(533.4mg,纯度90%)。得到的目标物不进一步进行纯化而直接用于后续的工序。
[0183]
(9)苄基(2s,3s)-2-((r)-2-((叔丁氧基羰基)(甲基)氨基)-n-甲基丙酰胺)-4-((叔丁基二苯基甲硅烷基)氧基)-3-甲基丁酸酯(15)的合成
[0184][0185]
在氩气气氛、-10℃下,向羧酸14(528.9mg,90%纯度,0.93mmol)的n,n-二甲基甲酰胺溶液(10ml)中缓慢加入碳酸钾(141.1mg,1.02mmol)、苄基溴(0.12ml,1.02mmol)。7小时后,加入水停止反应,用乙酸乙酯(20ml)提取水层三次。用饱和盐水清洗所合并的有机层,用无水硫酸钠干燥后,蒸馏除去溶剂。用硅胶柱色谱法(己烷/二氯甲烷=1/2)纯化得到的粗产物,得到苄基酯15(442.1mg,72%收率)。
[0186]
(10)苄基(2s,3s)-2-((r)-2-((叔丁氧基羰基)(甲基)氨基)-n-甲基丙酰胺)-4-羟基-3-甲基丁酸酯(16)的合成
[0187][0188]
在氩气气氛、0℃下,向酯15(304.8mg,0.46mmol)的thf溶液(25ml)中加入醋酸(0.53ml,9.2mmol,20eq)。向该溶液中加入四丁基氟化铵(5.5ml,1.0m在thf中,12eq)并搅拌4天。用乙酸乙酯及饱和盐水稀释后,用乙酸乙酯(15ml)提取水层四次。用饱和盐水清洗
所合并的有机层,使用无水硫酸钠干燥后,减压蒸馏除去溶剂,由此得到粗产物。用硅胶柱色谱法(己烷/乙酸乙酯=5/1~1/1)纯化得到的化合物,得到醇16(48.5mg,纯度50%包含内酯17,13%收率)。
[0189]
(11)苄基(2s,3s)-2-((r)-2-((叔丁氧基羰基)(甲基)氨基)-n-甲基丙酰胺)-3-甲基-4-氧代丁酸的合成(18)。
[0190][0191]
在氩气气氛、0℃下,向醇16(48.5mg,50%纯度,0.115mmol)的二氯甲烷溶液(10ml)中加入dess-martin试剂(1.01g,2.3mmol)并搅拌22小时。加入10%硫代硫酸钠水溶液(8ml)和饱和碳酸氢钠水(8ml)并停止反应后,用乙酸乙酯(20ml)稀释。搅拌20分钟后,用乙酸乙酯(10ml)提取水层三次,用饱和盐水清洗所合并的有机层。用无水硫酸钠干燥,并蒸馏除去溶剂,得到粗产物,用硅胶柱色谱法(己烷/乙酸乙酯=4/1)纯化该粗产物,得到醛18(23.3mg,96%收率)。
[0192]
(12)苄基(2s,3r)-2-((r)-2-((叔丁氧基羰基)(甲基)氨基)-n-甲基丙酰胺)-4-(4-(2-甲氧基乙基)哌嗪-1-基)-3-甲基丁酸酯(19)的合成
[0193][0194]
在氩气气氛、-20℃下,向醛18(23.6mg,0.056mmol)的二氯甲烷溶液(2ml)中依次加入醋酸(3.5mg,0.056mmol)、1-(2-甲氧基乙基)哌嗪(11.4mg,0.079mmol)。向该溶液中缓慢加入三乙酰氧基硼氢化钠(29.9mg,0.14mmol)后,在-10℃下搅拌41小时。使用饱和氯化铵水溶液停止反应,用乙酸乙酯(10ml)提取水层五次。用饱和盐水清洗所合并的有机层,用无水硫酸钠干燥后,减压蒸馏除去溶剂,由此得到粗产物。用硅胶柱色谱法(2~7%甲醇/二氯甲烷)纯化该粗产物,得到胺19(24.0mg,78%收率)。
[0195]
(13)(2s,3r)-2-((r)-2-((叔丁氧基羰基)(甲基)氨基)-n-甲基丙酰胺)-4-(4-(2-甲氧基乙基)哌嗪-1-基)-3-甲基丁酸的合成
[0196][0197]
向胺19(30.8mg,0.056mmol)的乙酸乙酯溶液(5ml)中加入氢氧化钯(10wt%,1.3mg)后,在1个大气压的氢气气氛下搅拌2小时。使反应溶液通过硅藻土,过滤固体成分
后,减压蒸馏除去溶剂,得到粗产物。使用硅胶柱色谱法(7~10%甲醇/二氯甲烷)纯化该粗产物,得到羧酸20(21.4mg,83%收率)。
[0198]
(14)乙酰基-csa(22)的合成
[0199][0200]
在氩气气氛下,将环孢菌素a(21)(4.0g,3.33mmol)溶解于二氯甲烷(24ml)后,在0℃下依次加入醋酸酐(3.2ml,33.3mmol)及吡啶(4.0ml,50.0mmol)、dmap(40.6mg,0.33mmol,10mol%)。升温至室温再搅拌一周。缓慢向反应溶液中注入饱和碳酸氢钠水(100ml),搅拌1小时后,用二氯甲烷(20ml)提取水层三次。将合并的有机层用1n氯化氢水溶液(48ml)清洗两次,再用饱和碳酸氢钠水(48ml)及饱和盐水清洗,然后使用无水硫酸钠干燥。减压蒸馏除去溶剂,得到粗产物(4.1g)。得到的产物不进一步进行纯化而直接用于后续的工序。
[0201]
(15)化合物23的合成
[0202][0203]
氩气气氛下,向乙酰基化体22(2.16g,1.74mmol)的二氯甲烷溶液(4ml)中加入三氧鎓四氟硼酸盐(642.6mg,4.34mmol)并在室温下搅拌20小时。向该反应溶液中加入乙腈(4ml)、水(13.5ml),再搅拌48小时后,提取有机层并用无水硫酸钠干燥,然后减压蒸馏除去溶剂,由此得到粗产物。通过硅胶快速柱色谱法(1~9%甲醇/二氯甲烷)纯化得到的化合物,得到开环体23(1.75g,74%收率)。
[0204]
(16)化合物24的合成
[0205][0206]
在室温下向开环体23(1.74g,1.28mmol)的甲苯(4.2ml)和水(2.5ml)的混合液中加入碳酸钠(243mg,2.3mmol)。加入2-甲基四氢呋喃(20ml)使固体完全溶解并搅拌2小时后,分离有机层并进行减压蒸馏除去。将得到的残渣溶解于甲苯(4.2ml),在室温下加入异硫氰酸苯酯(224mg,1.66mmol)。搅拌24小时后,加入甲醇(2.4ml),然后接着加入50%四氟硼酸(0.8ml),再搅拌1小时。添加水(2.4ml)后,通过分液回收有机层,将其用水和饱和盐水清洗。经过用无水硫酸钠干燥、减压蒸馏除去,得到粗产物,通过快速柱色谱法纯化粗产物,得到胺24(580.6mg,40%收率)。
[0207]
(17)化合物25的合成
[0208][0209]
在氩气气氛下,向胺24(486mg,0.39mmol)中加入甲苯(2.8ml)和水(1.5ml),制备悬浮液。在室温下缓慢加入碳酸钠(210mg,1.96mmol)、fmoc-琥珀酰亚胺(174mg,0.51mmol)。搅拌1小时后,加入甲醇(0.2ml),在50℃下再搅拌1小时。分离有机层,减压蒸馏除去溶剂,得到粗产物。用硅胶柱色谱法(3%甲醇/二氯甲烷)纯化得到的化合物,得到氨基甲酸酯25(508mg,94%收率)。
[0210]
(18)化合物26的合成
[0211][0212]
在氩气气氛下,由异丙基醇(10ml)和甲醇(1.1ml)制备氨基甲酸酯25(477.1mg,0.35mmol)的溶液,在0℃向其中加入硼氢化钠(202.3mg,5.22mmol)。升温至室温后再搅拌5小时,然后加入水(5ml)停止反应。用二氯甲烷(10ml)提取水层五次,用饱和碳酸氢钠水及
饱和盐水清洗所合并的有机层后,用无水硫酸钠干燥。减压蒸馏除去溶剂,得到的粗产物,用硅胶柱色谱法(3%甲醇/二氯甲烷)纯化粗产物,得到醇26(383.7mg,82%收率)。
[0213]
(19)化合物27的合成
[0214][0215]
在氩气气氛下,将醇26(320.9mg,0.24mmol)溶解于异丙基醇(15ml),在50℃下添加甲磺酸(0.16ml,2.39mmol),搅拌48小时。将反应溶液冷却至室温后,依次加入醋酸酐(0.11ml,1.19mmol)、吡啶(0.48ml,5.97mmol)。搅拌1小时后,加入饱和碳酸氢钠水(3ml)停止反应。用二氯甲烷(10ml)提取水层四次,用5%盐酸水溶液(10ml)清洗所合并的有机层两次,并用饱和碳酸氢钠水(10ml)、饱和盐水分别清洗一次。通过用无水硫酸钠干燥及蒸馏除去,得到粗产物,用硅胶柱色谱法(1~4%甲醇/二氯甲烷)纯化该粗产物,得到化合物27(179.5mg,54%收率)。
[0216]
(20)化合物28的合成
[0217][0218]
在氩气气氛及室温下,向化合物27(72.6mg,0.052mmol)的甲苯溶液(3ml)中加入三(2-氨基乙基)胺(0.078ml,0.52mmol),搅拌1小时。加入水(5ml)停止反应后,用二氯甲烷(10ml)提取水层三次,然后,用饱和盐水清洗所合并的有机层。用无水硫酸钠干燥并减压蒸馏除去溶剂,由此得到粗产物,用硅胶柱色谱法(5~7%甲醇/二氯甲烷)纯化粗产物,得到胺28(51.0mg,84%收率)。
[0219]
(21)化合物29的合成
[0220][0221]
在氩气气氛下,将胺28(26.8mg,0.023mmol)和羧酸20(10.6mg,0.023mmol)溶解于二氯甲烷(3ml),在0℃下加入n-甲基吗啉(0.92mm,0.1ml)的二氯甲烷溶液。将该溶液冷却
至-15℃后,加入hatu(0.28mm,0.1ml)的dmf溶液,用-15℃搅拌24小时。加入饱和氯化铵(3ml)停止反应后,用二氯甲烷(10ml)提取水层三次。用饱和盐水清洗所合并的有机层后,用无水硫酸钠干燥。减压蒸馏除去溶剂,得到粗产物,用硅胶柱色谱法(5~10%甲醇/二氯甲烷)纯化粗产物,得到目标化合物29(27.6mg,75%收率)。
[0222]
(22)nim258的合成
[0223][0224]
在氩气气氛下,将化合物29(27.6mg,0.017mmol)溶解于甲醇(3ml)和甲苯(1.5ml),在室温下加入硫酸(1.7mm,0.2ml)的甲醇溶液。将该反应溶液在50℃下搅拌18小时,然后,冷却至15度。加入苄基三甲基氢氧化铵(6.7mm,0.1ml)的甲醇溶液并再搅拌24小时。加入水(3ml)停止反应后搅拌4小时,然后,用二氯甲烷(10ml)提取水层五次,然后,用水和饱和盐水依次清洗所合并的有机层。用无水硫酸钠干燥,并减压蒸馏除去溶剂。得到的粗产物不进一步进行纯化而直接用于后续的工序。
[0225]
在氩气气氛下,将粗产物(24.8mg)溶解于二氯甲烷(180ml)。室温下向该反应溶液中加入hatu(19.8mg,0.052mmol)及n-甲基吗啉(0.23mm,0.3ml)的二氯甲烷溶液并搅拌27小时。然后,加入饱和氯化铵水溶液(3ml)停止反应,用二氯甲烷(10ml)提取水层四次。用饱和盐水清洗所合并的有机层后,用无水硫酸钠干燥。减压蒸馏除去溶剂,得到粗纯化物,用硅胶柱色谱法(3~10%甲醇/二氯甲烷)纯化该粗纯化物,得到目标nim258(11.8mg,51%收率)。
[0226]
(实施例2)csa、psc-833、及阿拉泊韦促进胶原三聚物分泌
[0227]
(1)制作分割纳米荧光素酶(split nano luciferase)融合α345稳定表达细胞系
[0228]
从理化学研究所细胞库获得hek293t细胞(人胚肾293),然后,按照col4a4-3flag(puro)、col4a3-smbit(hyg)、col4a5-lgbit(bsd)(omachi k.等,cell chemical biology 2018,25,634-643)的顺序添加病毒浓缩液、更换具有抗性的培养基、进行存活细胞的传代及保存,反复进行上述操作,从而制作α345(iv)的三聚物稳定表达细胞系。以plvsin ef1αbsd col4a5-lgbit为模板,使用quikchange(注册商标)ii定点诱变试剂盒(stratagene(注册商标))制作col4a5突变体g1244d。需要指出,所使用的引物如下所述。利用每种引物进行pcr反应(95℃、1分钟、1个循环;95℃、50秒,60℃、50秒,68℃、90秒/1kb 18个循环;68℃、7
秒)。需要指出,dna的碱基序列使用循环测序(cycle sequence)法(sigma-aldrich japan)确认。
[0229]
[g1244d突变引物]
[0230]
正义引物:5
’‑
ccctcctggttctccggatccagctctggaaggacc-3’(序列号13)
[0231]
反义引物:5
’‑
ggtccttccagagctggatccggagaaccaggaggg-3’(序列号14)
[0232]
[g1241v突变引物]
[0233]
正义引物:5
’‑
gtcccccaggccctcctgtttctccgggtccagctctg-3’(序列号15)
[0234]
反义引物:5
’‑
cagagctggacccggagaaacaggagggcctgggggac-3’(序列号16)
[0235]
(2)纳米荧光素酶促使iv型胶原α345三聚物发光
[0236]
将α345稳定表达细胞系接种于luminuc 96孔白板(thermo),该α345稳定表达细胞系融合有测定nanolucα345三聚物所需的分割纳米荧光素酶。24小时后使用包含2-磷酸抗坏血酸酯(200μm)且不含酚红的dmem完全培养基进行培养,分别按照nanoglo活细胞检测(promega)试剂的标准法向培养上清和细胞中添加底物,并用光度计(luminometer)glomax navigator(promega)确认发光。
[0237]
(3)利用纳米荧光素酶测定iv型胶原α345三聚物
[0238]
剥离α345稳定表达细胞系(col4a5-g1244d),按照2
×
104cells/well的密度接种于luminunc 96孔白板(thermo)。并且,接种24小时后更换为包含2-磷酸抗坏血酸酯(200μm)及各浓度的环孢菌素a(csa)(0.1、0.5、1、2、5、10μm)或各浓度的psc-833(0.5、1、2、5、10μm)或各浓度的阿拉泊韦(0.1、0.5、5、10μm)的不含酚红的dmem完全培养基并进行培养,24小时后按照nanoglo活细胞检测(promega)试剂的标准法向培养上清中添加底物,并用光度计glomax navigator(promega)测定发光(三聚物分泌的指标)。对照溶剂(con)使用二甲基亚砜(dmso)。
[0239]
(4)结果
[0240]
将结果示于图1~图4。计算药物处理组与dmso处理组(对照:con)相比的发光(三聚物分泌量)的比例,并用%表示。需要指出,图2、图3中的阳性对照使用csa。其结果,csa虽然促进了胶原三聚物分泌,但psc-833并未对胶原三聚物分泌及细胞内表达量产生影响。另一方面,阿拉泊韦显示出促进胶原三聚物分泌的作用。另外,在浓度5μm及10μm的处理条件下,阿拉泊韦显示出比csa更强大的促进胶原三聚物分泌的作用。
[0241]
(实施例3)胶原突变与药剂促进分泌量之间的关系
[0242]
报道称多种不同基因突变参与了as。报道称虽然col4a5/g1241v与g1244d相同保持在胞内大量形成,但三聚物分泌降低。另一方面,as没有发病的健康人的col4a5/wt的胞内形成及三聚物分泌均正常。因而,通过利用稳定表达细胞系的评价体系考察了csa及阿拉泊韦对于含有col4a5/wt、col4a5/g1241v的胶原三聚物分泌的影响。
[0243]
结果csa及阿拉泊韦对col4a5/wt不产生影响。另一方面,对于col4a5/g1241v,与g1244d相同地,csa及阿拉泊韦促进其胶原三聚物的胞外分泌。由此显示,csa及阿拉泊韦对正常的细胞没有作用,但具有促进含突变col4a5的胶原三聚物分泌的效果。
[0244]
(实施例4)投予nim258时胶原三聚物的分泌
[0245]
通过与实施例1及实施例2相同的方法测定投予5μm或10μm nim258时胶原三聚物的胞外分泌。其结果,与作为对照的dmso投予组相比,nim258投予组中促进了胶原三聚物的
胞外分泌(图6)。由此显示,与csa及阿拉泊韦相同地,nim258具有促进含突变col4a5的胶原三聚物分泌的效果。
[0246]
(实施例5)col4a5上的各种胶原突变与csa及阿拉泊韦的奏效性之间的关系
[0247]
针对有临床报道的广泛的as突变体(col4a5的g227s、g594d、g624d、g869r、s916g、g1030s、g1107r、g1140v、g1220d、g1241c、g1241v、g1244d、p1517t、及r1569q)、及外显子41(col4a5的第1202~1263个氨基酸)缺失突变体,通过与实施例1相同的方法测定csa及阿拉泊韦促进三聚物形成的能力。使用野生型col4a5作为对照。
[0248]
其结果,由csa及阿拉泊韦所带来的胶原三聚物的形成在g1030s、g1107r、g1220d、g1241c、g1241v、g1244d、及外显子41缺失的突变体中起到显著的效果(图7)。特别是关于外显子41缺失本身及外显子41内存在的突变,均可以认为,由于csa及阿拉泊韦促进三聚物形成,因此,csa及阿拉泊韦促进三聚物形成的效果对于外显子41内及其周围存在的突变所导致的胶原异常增生特别有效。
[0249]
(实施例6)阐明csa及阿拉泊韦促进胶原三聚物形成的机理
[0250]
为了阐明csa及阿拉泊韦促进胶原三聚物形成的机理,制作用sirna全面敲低了csa及阿拉泊韦可结合的亲环素类的细胞,并考察csa及阿拉泊韦在该细胞中促进胶原三聚物形成的效果。
[0251]
作为细胞,使用以往实验中已确认csa及阿拉泊韦有效的g1244d突变导入hek293t细胞。
[0252]
将融合有测定nanolucα345三聚物所需的分割纳米荧光素酶的α345稳定表达细胞系按照3
×
105cells/well接种于6孔板(corning),亚融合(subconfluent)时通过脂质体转染导入表1中记载的sirna。靶基因均为亲环素,表1中的简称表示以下的物质:
[0253]
ppia:肽基脯氨酰异构酶a(亲环素a)
[0254]
ppib:肽基脯氨酰异构酶b
[0255]
ppic:肽基脯氨酰异构酶c
[0256]
ppid:肽基脯氨酰异构酶d
[0257]
ppie:肽基脯氨酰异构酶e
[0258]
ppif:肽基脯氨酰异构酶f(亲环素d)
[0259]
ppig:肽基脯氨酰异构酶g
[0260]
ppih:肽基脯氨酰异构酶h
[0261]
ppil1:肽基脯氨酰异构酶样1(peptidylprolyl isomerase like 1)
[0262]
nktr:自然杀伤细胞触发受体(natural killer cell triggering receptor)(肽基脯氨酰顺反异构酶nktr)
[0263]
ppwd1:含肽基脯氨酰异构酶结构域和wd重复序列1(peptidylprolyl isomerase domain and wd repeat containing 1)
[0264]
sirna的转染中使用脂质体(lipofectamine)rnai max,并进行调节使最终sirna浓度达到15nm,按照标准流程进行转染。导入sirna24小时后剥离细胞,并按照4
×
104cells/well重新接种于luminuc 96孔白板(thermo)。再于重新接种24小时后更换为包含2-磷酸抗坏血酸酯(200μm)及环孢菌素a(csa)(1μm)或阿拉泊韦(2μm)且不含酚红的dmem完全培养基并进行培养,24小时后,分别按照nanoglo活细胞检测(promega)试剂的标准法
向培养上清和细胞中添加底物,并用光度计glomax navigator(promega)测定发光(三聚物分泌的指标)。对照溶剂(con)使用dmso。
[0265]
【表1】
[0266][0267]
其结果,仅在敲低了ppif(亲环素d)的细胞中发现csa与阿拉泊韦促进胶原三聚物形成的效果降低(图8)。由此表明,csa和阿拉泊韦通过结合于亲环素d来促进胶原三聚物形成。
[0268]
(实施例7)亲环素d对胶原三聚物形成的影响
[0269]
在上述实施例4的实验中,确认csa和阿拉泊韦通过亲环素d促进胶原三聚物形成,因此接着考察了亲环素d对胶原三聚物形成的影响。
[0270]
与实施例5相同地,使用g1244d突变导入hek293t细胞,调查用sirna全面敲低了各种亲环素类的细胞中的胶原三聚物形成能力。
[0271]
其结果,在亲环素d敲低细胞中确认到显著形成胶原三聚物(图9)。由此确认,通过抑制亲环素d来促进胶原三聚物形成。
[0272]
(实施例8)as模型小鼠的制作及评价
[0273]
现有的as的模型动物缺失了胶原蛋白质自身的基因,因此不能够基于胶原蛋白质的功能异常进行病理评价。本发明的发明人们的研究成果表明,as的重要的基因突变存在于col4a5的外显子41,因此,作为典型的col4a5的错义突变(甘氨酸取代)制作g1244d或外显子41缺失突变小鼠,以尝试确认是否能够制作可以基于胶原蛋白质的功能异常来评价病理的模型小鼠。
[0274]
另外,在典型的奥尔波特综合征患者、及现有的模型小鼠(col4a3 ko、col4a5-g5x)中,gbm上的α345(iv)消失。另外,出生后未实现向α345(iv)转变,因此,胎儿期脆弱的α112(iv)持续存在于gbm。并且,报道称作为基底膜分子的层粘连蛋白会向gbm异位积累(kashtan ce等,j am soc nephrol 2001;12:252-260.;cosgrove d等,am j pathol 2000;157:1649-1659.)。因而,评价了所制作的g1244d小鼠及δ外显子41小鼠的肾脏中α5
(iv)、α2(iv)及层粘连蛋白的表达。
[0275]
kick-in法是由熊本大学生命资源研究支持中心的荒木喜美教授等人开发的方法,该方法中,制作接受者es细胞,该接受者es细胞用loxp序列夹持插入突变的靶外显子,然后使用cre-loxp的系统与具有目标突变的靶外显子进行高概率重组(tomonoh y等,plos one 2014;9:e88549.)。为了制作g1244d突变小鼠,制作分别插入了由loxp夹持的外显子41、药剂选择盒、外显子41前后的同源序列的靶载体,并利用crispr/cas9进行同源重组,由此构建具有靶向序列的等位基因的es细胞(接受者es细胞)。接着,制作具有g1244d突变的外显子41和药剂选择盒、其两端具有loxkmr3、lox2272的载体,并利用cre重组酶进行重组,由此将接受者es细胞和loxp间序列交换。loxkmr3通过取代loxp3’侧的3个碱基来防止重组后重新断开,lox2272通过取代loxp的间隔序列能够规定所插入的序列的方向性以仅在lox2272彼此之间进行重组。最终在具有g1244d突变的es细胞中除去药剂选择盒,从而构建col4a5-g1244d小鼠(图10)。从所制作的小鼠的肾脏中提取mrna,并解析rt-pcr产物的序列,确认在g1244d小鼠中插入了目标突变(g》a)(未图示)。
[0276]
通过kick-in法制作的接受者es细胞具有用loxp夹持外显子41的两端而成的序列。因而,针对接受者es细胞,通过cre重组酶使外显子41缺失,除去耐药盒,从而构建col4a5-外显子41缺失(δ外显子41)小鼠(图10)。从所制作的小鼠的肾脏中提取mrna,对rt-pcr产物进行电泳,在δ外显子41小鼠中确认到外显子41的186bp的短条带(无图示)。并且,在序列分析中确认形成了外显子41脱离而使外显子40与外显子42连续的转录产物(无图示)。另外还表明,即使使eon41缺失,仍保持胶原结构域的甘氨酸-x-y的重复序列,保持α5(iv)突变体的部分三聚物形成能力。以下,对具体的实验方法进行叙述。
[0277]
(1)制作靶载体
[0278]
将c57bl/6小鼠(charles river,000664,black6)的肾脏切碎,使用dneasy血液和组织试剂盒(qiagen,69504)纯化基因组dna,制得模板。以包含靶外显子41的0.9kb(arm2)为中心,在5’侧设置1.9kb(arm1)的短臂,在3’侧设置1.7kb(arm3)的短臂。需要指出,将用于插入双链断裂(double-strand break,dsb)的3’侧缺失区域(147bp)设于arm2和arm3之间。在pbluescript ii sk( )loxp载体(tomonoh y等,plos one 2014;9:e88549)的loxp的两端插入arm1和arm2(载体1)。在p03载体(tomonoh等,2014,上述)的frt-pgk-neo-lox2272-pa-frt区域的下游插入arm3(载体2)。将载体1的arm1-loxp-arm2序列插入载体2的frt前,从而制得靶载体。
[0279]
(2)制作突变载体
[0280]
在pk-teps-2272载体(tomonoh等,2014,上述)的loxkmr3的下游插入arm2之后,插入g1244d突变。各lox的序列如下所述。
[0281]
loxp:ataacttcgtatagcatacattatacgaagttat(序列号39)
[0282]
loxkmr3:ataacttcgtatagcatacattataccttgttat(序列号40)
[0283]
lox2272:ataacttcgtataggatactttatacgaagttat(序列号41)
[0284]
(3)向es细胞导入基因
[0285]
通过苯酚/氯仿提取来纯化所制作的靶载体,并用70%乙醇清洗,用100%乙醇脱水,溶解于灭菌te后使用。一次电穿孔使用40μg载体。将在用于培养的10cm培养皿中培养至融合状态的es细胞(6nk)用pbs清洗后,用胰蛋白酶剥离细胞,并用培养基悬浮。将细胞溶液
离心(4℃,800rpm)后,除去上清,将团块重新悬浮于冷的pbs中。向细胞液中混合靶载体和cas9载体,通过电穿孔进行转染。然后在室温下孵育10分钟,悬浮于培养基并接种于用于培养的10cm培养皿,在5%co2、37℃的条件下静置培养。24小时后,更换为包含g418(nacalai,16548)(200μg/ml)的培养基,大概用时一周来进行药剂选择。选取集落并使其增殖,通过pcr及southern印迹确认插入序列。对已确认目标序列的克隆同样地进行突变载体和cre表达载体的电穿孔,并用包含嘌呤霉素(nacalai,14861-84)(2mg/ml)的培养基大致用时一周来进行药剂选择。选取集落并增殖后,通过pcr来确认序列。
[0286]
(4)制作突变小鼠
[0287]
由具有各目标序列的es细胞克隆来制作小鼠。将icr品系的小鼠2细胞期细胞浸渍于es细胞悬浮液,孵育一晚后,将嵌合胚胎移植至假孕雌性的子宫。使得到的同胎仔嵌合体与c57bl/6j小鼠交配,得到f1小鼠。再通过flp重组酶除去frt的耐药性盒,从而构建小鼠。
[0288]
(5)基因分型
[0289]
收集小鼠的尾巴,用70%乙醇清洗。风干后,加入50mm naoh并切碎,蒸煮10分钟后,用1m-tris-hci中和。离心(15,000rpm,4℃,10min)后,提取上清,作为dna样本。进行各样本的pcr反应(94℃-2min:1个循环,98℃-10sec-68℃-1min/kb:20个循环,在4℃保持),通过琼脂糖凝胶电泳确认条带。用于各小鼠基因分型的引物的序列示于表2。
[0290]
(6)提取rna
[0291]
向1.5ml管中加入1ml rnaisoplus(takara,9109)并切碎肾组织后均质化。然后,加入氯仿0.2ml充分搅拌,室温下静置2分钟。离心(12,000rpm,4℃,15min),将水层转移至新的1.5ml管,加入等量的氯仿并搅拌后,重新离心分离(12,000rpm,4℃,15min)。再将水层转移至新的1.5ml管,加入等量的异丙醇并搅拌后,离心(12,000rpm,4℃,30min)。将得到的团块用70%乙醇清洗两次,风干后,溶解于depc处理水。使用epoch微孔板分光光度计(biotek)测定得到的总rna的收量及纯度。od260/od280比为2.0以上,确认其为高纯度的rna,并将其用于各种实验。
[0292]
(7)semi-rt-pcr法
[0293]
将从肾脏中提取的总rna作为模板,使用prime script(注册商标)rt试剂盒(takara,rr036a)进行逆转录反应(37℃-30min,85℃-10sec)。然后,使用kod plus(takara)进行pcr反应(94℃-2min:1个循环,98℃-10sec-68℃-1min/kb:20个循环,在4℃保持),通过琼脂糖凝胶电泳确认条带。需要指出,pcr产物的碱基序列使用循环测序法确认(sigma-aldrich japan)。将用于pcr反应的引物的序列示于表2。
[0294]
【表2】
[0295]
用于基因分型的引物及semi-rt-prc
[0296][0297]
(8)制作肾组织的冷冻切片
[0298]
将解剖摘出后的新鲜的小鼠肾脏切成两半,在冷冻切片包埋模具cryomold内浸渍于oct化合物(sakura finetek),通过液氮急速冷冻,得到小鼠肾冷冻块。使用冷冻切片机(cryostat,leica)将肾冷冻块切成5μm厚的薄片,将其作为冷冻切片。使所制作的切片干燥,染色之前在-80℃下保存。
[0299]
(9)免疫荧光染色
[0300]
肾冷冻切片在冰冷的丙酮溶液中在-20℃下浸渍5分钟来固定。然后,在湿润箱内通过无血清蛋白封闭液(dako,x0909)在室温下封闭1小时。通过pbs清洗后,将用抗体稀释液(dako,s0809)按照1:100稀释后的一抗在室温下反应1小时。作为一抗,使用抗层粘连蛋白多克隆抗体(sigma,l9393)、抗人alpha5(iv)抗体、克隆h53(chondrex,7078)、或抗人alpha2(iv)抗体、克隆h22(chondrex,7071)。然后,用pbs清洗三次,将用抗体稀释液(dako)
稀释至1:500的荧光标记二抗(alexa fluor抗体)在室温下反应1小时。用pbs清洗三次,用vector shield(vector,h-1000)封入,使用bz-x700(keyence)进行拍摄及解析。
[0301]
(10)收集尿液
[0302]
通过使用小鼠代谢笼(as one)蓄尿24小时来回收尿液。将回收后的尿液离心(12,000rpm,4℃,5min)以除去杂物,收集上清后,在-80℃下保存。
[0303]
(11)测定蛋白尿评分
[0304]
蛋白尿评分通过尿中总蛋白浓度/尿肌酐浓度的比而算得。尿中总蛋白浓度使用bradford法测定。尿肌酐值使用肌酐测定试剂盒(wako)按照操作说明测定。
[0305]
(12)cbb染色
[0306]
尿液样本由还原用5
×
sample buffer(0.25m tris-hcl(ph 6.8)、10%sds、4.1mβ-巯基乙醇、50%甘油、bpb)制备,并使用12%聚丙烯酰胺凝胶进行sds-page后,使用cbb(考马斯亮蓝,coomassie brilliantblue)进行染色以检测条带。
[0307]
(13)结果
[0308]
g1244d小鼠显示出与对照小鼠相同的基底膜上的α5(iv)表达模式,α2(iv)及层粘连蛋白在肾小球膜底物中的表达也未见变化(无图示)。另外,进行肾功能评价,g1244d小鼠即使是在现有的col4a5-g5x小鼠中可见显著病理的18周龄以后也未发现蛋白尿,而且35周龄时也未发现尿白蛋白的漏出有变(无图示)。
[0309]
另一方面,在δ外显子41小鼠中,基底膜上的α5(iv)表达消失,而α2(iv)却在gbm中广泛表达。另外还表明,正常肾小球中主要作为系膜基质存在的层粘连蛋白在δ外显子41小鼠的gbm中显示出异位表达增加,这与此前的报道一致(图11)。并进行肾功能评价,结果δ外显子41小鼠呈现出进行性蛋白尿(图12),10周龄时已经可见显著尿白蛋白等的漏出(无图示)。另外,血清肌酐值也升高(图13)。因此,δ外显子41小鼠中,由于α5(iv)突变体的三聚物形成异常,所以不会正常形成gbm,呈现出进行性的肾脏病理,如白蛋白及蛋白质向尿液中漏出等,由此表明δ外显子41小鼠为反映as的功能异常的模型小鼠。
[0310]
(实施例9)向奥尔波特综合征模型小鼠投予环孢菌素a
[0311]
确认实施例7中制作的δ外显子41小鼠中as样病理是否通过投予环孢菌素a而改善。
[0312]
(1)投予环孢菌素a
[0313]
量取粉末环孢菌素a并用乙醇溶解,然后,使用0.5%甲基纤维素分别调节至15、30、45mg/kg/day。测定体重后,将调节后的环孢菌素a向小鼠的腹腔内给药,每天一次。向0.5%甲基纤维素中加入乙醇以最终达到4%,然后投予对照组。
[0314]
(2)收集尿液
[0315]
使小鼠自由摄取食物及水,使用可以行动的代谢笼(as one)从6周龄时起收集尿液,每两周一次。使用24小时所积累的尿液充分悬浮,将1ml回收于1.5ml管。为了除去所回收的尿液中的杂质,进行离心分离(4℃,12,000rpm,5分钟),将其上清作为尿样本,在-80℃下保存。
[0316]
(3)计算蛋白尿评分
[0317]
蛋白尿评分按照尿中总蛋白浓度/尿肌酐浓度的比算得。尿中总蛋白浓度使用bradford法测定。另外,尿肌酐浓度使用肌酐测定试剂盒根据操作说明测定。
[0318]
结果显示,δ外显子41小鼠中的蛋白尿通过投予45mg/kg/day的环孢菌素a得以改善(图14)。由此表明,本模型小鼠可以用于评价亲环素d介导的as治疗效果。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。