用于组织再生的方法和组合物
1.相关申请的交叉引用
2.本技术要求2019年9月16日提交的国际专利申请第pct/cn2019/105890号的优先权权益,该国际专利申请的内容通过引用整体并入本文。
技术领域
3.本技术涉及脂肪酸氧化活化剂用于增强组织(例如,肌肉)再生的用途。
4.ascii文本文件形式的序列表的提交
5.以下以ascii文本文件形式提交的内容通过引用整体并入本文:计算机可读形式(crf)的序列表(文件名:182452000341seqlist.txt,记录日期:2020年9月14日,大小:5kb)。
背景技术:
6.已知底物和氧气的可用性以及生物能量需求决定使用哪种代谢途径来生成atp。在缺氧条件下,主要通过使用葡萄糖或果糖的糖酵解来生成atp。然而,在有氧条件下,主要通过氧化磷酸化(oxphos)来产生atp。线粒体oxphos需要克雷布斯(krebs)循环和电子传递链(etc),克雷布斯循环使用衍生自糖、氨基酸或脂肪酸的羧酸来产生nadh和fadh2,电子传递链氧化nadh和fadh2以生成质子梯度来驱动atp合成。与oxphos相比,糖酵解是一种根据碳产生atp的效率较低的方法。然而,糖酵解为增殖细胞(包括癌细胞和干细胞/祖细胞)提供了许多重要优势,例如能够快速生成必要的糖酵解中间体,以生物合成对细胞增殖至关重要的新大分子(lunt和vander heiden,2011;shyh-chang等人,2013;ryall和sartorelli,2015;shyh-chang和ng,2017)。
7.虽然人们在发现加快细胞增殖的代谢途径方面付出了很多努力,但对抑制增殖和促进细胞分化的代谢途径知之甚少。细胞增殖和分化对于组织再生都是必要的。骨骼肌是这些过程的成熟模型系统(comai和tajbakhsh,2014;lepper等人,2011;murphy等人,2011)。作为对损伤的反应,静止的肌肉干细胞活化进入高度增殖状态(g
ü
nther等人,2013;lepper等人,2009;relaix等人,2006;sambasivan等人,2011;seale等人,2000;von maltzahn等人,2013;gayraud-morel等人,2012)。这种活化的肌肉干细胞或祖细胞被称为成肌细胞,由肌肉特异性转录因子myod(myod1)标记和调节。在进行分化程序后,成肌细胞然后表达成肌素(myog)并分化成非增殖性肌细胞。这些myog 肌细胞具有融合能力,随后融合成多核肌管,这些多核肌管表达高水平的肌球蛋白重链(mhc)和肌节α-辅肌动蛋白以形成高度特化的横纹肌细胞骨架,从而修复受损的肌肉并再生新的肌肉纤维。由于在从细胞增殖到分化的转变过程中在成肌细胞中发生的分子变化的复杂性,这些细胞状态的代谢需求也可能发生巨大变化。然而,大多数以前关于成肌细胞分化的研究往往集中于将多核肌管作为终点,而往往忽略了非增殖、稳定定型、单核肌细胞的中间终点。许多研究还利用了永生化的c2c12细胞系而不是原代肌肉细胞,具有不同的结果。因此,在原代成肌细胞分化的最早阶段引发细胞命运转变的真正因果事件可能仍不清楚。
8.本文提及的所有出版物、专利、专利申请和公布的专利申请的公开内容都据此通过引用整体并入本文。
9.简述
10.本技术提供了使用脂肪酸氧化(“fao”)活化剂进行组织(例如,肌肉)再生和治疗的组合物和方法。
11.本技术的一个方面提供了一种促进组织(例如,肌肉组织)再生的方法,该方法包括使组织与一种或多种fao活化剂接触。在一些实施方案中,使组织与一种或多种fao活化剂接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,接触是体外、离体或体内的。在一些实施方案中,组织选自由肌肉组织、肝脏组织、心脏组织、皮肤组织和毛囊组成的组。在一些实施方案中,组织是肌肉组织。
12.本技术的一个方面提供了一种促进组织(例如,肌肉组织)生长的方法,该方法包括使组织与一种或多种fao活化剂接触。在一些实施方案中,使组织与一种或多种fao活化剂接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,接触是体外、离体或体内的。在一些实施方案中,组织选自由肌肉组织、肝脏组织、心脏组织、皮肤组织和毛囊组成的组。在一些实施方案中,组织是肌肉组织。
13.本技术的一个方面提供了一种诱导组织(例如,肌肉组织)中的组织形成细胞(例如,生肌细胞)分化的方法,该方法包括使组织与一种或多种fao活化剂接触。本技术的一个方面提供了一种诱导组织(例如,肌肉组织)中的组织形成细胞(例如,生肌细胞)成熟的方法,该方法包括使组织与一种或多种fao活化剂接触。在一些实施方案中,组织选自由肌肉组织、肝脏组织、心脏组织、皮肤组织和毛囊组成的组。在一些实施方案中,组织是肌肉组织。在一些实施方案中,组织形成细胞是生肌细胞。在一些实施方案中,生肌细胞是成肌细胞和/或肌细胞。在一些实施方案中,使组织(例如,肌肉组织)与一种或多种fao活化剂接触不超过约72小时、不超过约48小时或不超过约24小时。
14.本技术的一个方面提供了一种诱导组织(例如,肌肉组织)中的干细胞或组织形成细胞增值的方法,该方法包括使组织与一种或多种fao活化剂接触。在一些实施方案中,组织已被损伤。在一些实施方案中,组织未经历损伤。在一些实施方案中,使组织与一种或多种fao活化剂接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,接触是体外、离体或体内的。在一些实施方案中,组织选自由肌肉组织、肝脏组织、心脏组织、皮肤组织和毛囊组成的组。在一些实施方案中,组织是肌肉组织。在一些实施方案中,组织形成细胞是生肌细胞。在一些实施方案中,生肌细胞是成肌细胞和/或肌细胞。
15.在根据上述方法中任一种的一些实施方案中,组织来自老年个体,例如至少约50、60、70、80岁或更大年龄中任一种的人类个体。
16.在根据上述方法中任一种的一些实施方案中,组织是损伤组织。在一些实施方案中,组织未经历损伤。
17.本技术的一个方面提供了一种治疗个体中与组织(例如,肌肉组织)相关的疾病或病症的方法,该方法包括向个体的组织施用有效量的包含组织形成细胞(例如,生肌细胞)的药物组合物,其中在施用药物组合物之前使组织形成细胞与一种或多种fao活化剂接触。在一些实施方案中,该方法包括在施用药物组合物之前使组织形成细胞与一种或多种fao活化剂接触。在一些实施方案中,使组织形成细胞与一种或多种fao活化剂接触不超过约72
小时、不超过约48小时或不超过约24小时。在一些实施方案中,组织形成细胞是自体的。在一些实施方案中,组织形成细胞是同种异体的。在一些实施方案中,组织选自由肌肉组织、肝脏组织、心脏组织、皮肤组织和毛囊组成的组。在一些实施方案中,组织是肌肉组织。在一些实施方案中,组织形成细胞是生肌细胞。在一些实施方案中,生肌细胞是成肌细胞和/或肌细胞。在一些实施方案中,肌内施用药物组合物。在一些实施方案中,皮下施用药物组合物。
18.本技术的一个方面提供了一种治疗个体中与组织(例如,肌肉组织)相关的疾病或病症的方法,该方法包括向个体施用有效量的包含一种或多种fao活化剂的药物组合物。在一些实施方案中,每24小时、每48小时或每72小时向个体施用一次药物组合物。在一些实施方案中,向个体的组织(例如,肌肉组织)施用药物组合物。在一些实施方案中,向个体全身(诸如口服)施用药物组合物。在一些实施方案中,组织选自由肌肉组织、肝脏组织、心脏组织、皮肤组织和毛囊组成的组。在一些实施方案中,组织是肌肉组织。在一些实施方案中,肌内施用药物组合物。在一些实施方案中,皮下施用药物组合物。
19.在根据上述治疗方法中任一种的一些实施方案中,疾病或病症是组织损伤。在一些实施方案中,疾病或病症是肌肉损伤。在一些实施方案中,在组织损伤后不超过约72小时、不超过约48小时或不超过约24小时向个体施用药物组合物。
20.在根据上述治疗方法中任一种的一些实施方案中,疾病或病症是组织变性。在一些实施方案中,疾病或病症是肌肉变性。
21.在根据上述治疗方法中任一种的一些实施方案中,疾病或病症是组织纤维化。在一些实施方案中,疾病或病症是肌肉纤维化。
22.在根据上述治疗方法中任一种的一些实施方案中,疾病或病症是衰老。
23.在根据上述治疗方法中任一种的一些实施方案中,疾病或病症选自由以下项组成的组:肌肉减少症、恶病质、废用性萎缩、炎性肌病、肌营养不良、心肌病、皮肤起皱、顽固性皮肤溃疡、皮肤创伤、大疱病、脱发、瘢痕疙瘩、皮炎、黄斑变性、结肠炎、肝脂肪变性、脂肪性肝炎、肝纤维化、肝硬化、胰腺炎、2型糖尿病(t2d)、脂肪营养不良、慢性阻塞性肺病(copd)、肺纤维化、急性呼吸窘迫综合征(ards)、类风湿性关节炎、骨关节炎、骨质疏松症、神经变性疾病、脑梗塞、心肌梗塞、肺梗塞、骨折、胃溃疡、肠炎、慢性肾病、肾纤维化以及其他导致组织/器官/身体部分结构和功能丧失或萎缩的遗传决定的、环境决定的或特发性疾病过程。
24.本技术的一个方面提供了一种向个体的组织(例如,肌肉组织)提供一种或多种锻炼和/或营养益处的方法,该方法包括向个体施用有效量的包含一种或多种fao活化剂的药物组合物。在一些实施方案中,每24小时、每48小时或每72小时向个体施用一次药物组合物。在一些实施方案中,组织选自由肌肉组织、肝脏组织、心脏组织、皮肤组织和毛囊组成的组。在一些实施方案中,组织是肌肉组织。在一些实施方案中,向个体的组织(例如,肌肉组织)施用药物组合物。在一些实施方案中,肌内施用药物组合物。在一些实施方案中,皮下施用药物组合物。在一些实施方案中,向个体全身(诸如口服)施用药物组合物。在一些实施方案中,组织是损伤组织。在一些实施方案中,组织未经历损伤。
25.在根据上述治疗方法中任一种的一些实施方案中,个体是老年个体,例如至少约50、60、70、80岁或更大年龄中任一种的人类个体。
26.在根据上述方法中任一种的一些实施方案中,一种或多种fao活化剂增加生肌细
胞中的线粒体fao。在一些实施方案中,一种或多种fao活化剂增加生肌细胞中的线粒体fao。在一些实施方案中,一种或多种fao活化剂增加生肌细胞中的线粒体氧气消耗。在一些实施方案中,一种或多种fao活化剂不影响生肌细胞中的线粒体生物发生。在一些实施方案中,一种或多种fao活化剂不影响生肌细胞的膜电位。在一些实施方案中,一种或多种fao活化剂增加生肌细胞中pax7、myod(例如,myod1)、ki67、myog、myh3、pparγ、pparα,和/或h3k9ac的水平。
27.在根据上述方法中任一种的一些实施方案中,一种或多种fao活化剂是单一fao活化剂。在一些实施方案中,一种或多种fao活化剂是两种或更多种(例如,2种)fao活化剂的组合。
28.在根据上述方法中任一种的一些实施方案中,一种或多种fao活化剂包括fao途径或脂质代谢途径中的基因的活化剂。在一些实施方案中,一种或多种fao活化剂包括选自由以下项组成的组的基因的活化剂:脂质代谢的转录调节因子、脂肪酸转运蛋白、脂肪酶、肉毒碱棕榈酰转移酶、肉毒碱乙酰化酶、酰基辅酶a脱氢酶、羟酰基辅酶a脱氢酶和线粒体电子转移黄素蛋白。在一些实施方案中,一种或多种fao活化剂包括选自由以下项组成的组的基因的活化剂:pparα、pparδ、pparγ、rxrb、rxrg、ncoa1、ncoa2、fabp3、fabp4、cd36、scarb1、fatp1、fatp2、fatp3、fatp4、fatp5、fatp6、lpl、cpt1a、cpt1b、cpt1c、cpt2、crat、acad1、acad2、acad3、acad4、acad5、acad6、acad7、acad8、acad9、acad10、acad11、mcad、lcad、vlcad、hadha、hadhb、etfa和etfb。在一些实施方案中,一种或多种fao活化剂包括一种或多种pparγ.活化剂。
29.本技术的一个方面提供了一种增加组织形成细胞(例如,生肌细胞)中的fao的方法,该方法包括使组织形成细胞与一种或多种pparγ活化剂接触不超过约72小时(诸如不超过约48小时或不超过约24小时)。在一些实施方案中,组织形成细胞是生肌细胞。在一些实施方案中,生肌细胞是成肌细胞。在一些实施方案中,生肌细胞是肌细胞。在一些实施方案中,接触是体外、离体或体内的。
30.本技术的一个方面提供了一种活化组织形成细胞中的pparγ的方法,该方法包括使组织形成细胞与选自由前列腺素i2(pgi2)、前列腺素d2(pgd2)、它们的类似物以及它们的盐、溶剂化物、互变异构体和立体异构体组成的组的前列腺素接触。在一些实施方案中,组织形成细胞是生肌细胞。在一些实施方案中,生肌细胞是成肌细胞。在一些实施方案中,生肌细胞是肌细胞。在一些实施方案中,接触是体外、离体或体内的。在一些实施方案中,前列腺素是pgi2或其盐、溶剂化物、互变异构体或立体异构体。在一些实施方案中,前列腺素是曲前列环素或其盐、溶剂化物、互变异构体或立体异构体。在一些实施方案中,前列腺素是pgd2或其盐、溶剂化物、互变异构体或立体异构体。
31.在根据上述方法中任一种的一些实施方案中,一种或多种fao活化剂或pparγ活化剂包含pparγ激动剂。在一些实施方案中,pparγ激动剂是噻唑烷二酮或其衍生物或其盐、溶剂化物、互变异构体或立体异构体。在一些实施方案中,pparγ激动剂是式(i)的化合物:
[0032][0033]
或其盐、溶剂化物、互变异构体或立体异构体,其中r选自由氢、未取代和取代的c
1-6
烷基、未取代和取代的c
2-6
烯基、未取代和取代的c
2-6
炔基、未取代和取代的芳基、未取代和取代的杂芳基以及未取代和取代的杂环基组成的组。在一些实施方案中,pparγ激动剂是式(ii)的化合物:
[0034][0035]
或其盐、溶剂化物、互变异构体或立体异构体,其中r1和r4中的每一者独立地选自由氢、卤基、未取代的烷基、被1-3个卤基取代的烷基、未取代的烷氧基和被1-3个卤基取代的烷氧基组成的组;其中r2选自由卤基、羟基、未取代和取代的烷基组成的组;其中r
′2为氢,或者r2和r
′2一起形成氧代;其中r3为h;并且其中环a为苯基。在一些实施方案中,pparγ激动剂是罗格列酮或其盐、溶剂化物、互变异构体或立体异构体。
[0036]
在根据上述方法中任一种的一些实施方案中,一种或多种fao活化剂或pparγ活化剂包括选自由pgi2、pgd2、它们的类似物以及它们的盐、溶剂化物、互变异构体和立体异构体组成的组的前列腺素。在一些实施方案中,前列腺素是pgi2或其盐、溶剂化物、互变异构体或立体异构体。在一些实施方案中,一种或多种fao活化剂或pparγ活化剂是罗格列酮和pgi2。在一些实施方案中,前列腺素是曲前列环素或其盐、溶剂化物、互变异构体或立体异构体。在一些实施方案中,一种或多种fao活化剂包括曲前列环素或其盐、溶剂化物、互变异构体或立体异构体。在一些实施方案中,一种或多种fao活化剂或pparγ活化剂是罗格列酮和曲前列环素。
[0037]
还提供了用于上述方法中任一种的药物组合物、试剂盒和制品。在一些实施方案中,提供了用于上述方法中任一种的一种或多种fao活化剂(例如,pparγ激动剂诸如罗格列酮,以及/或者pgi2、pgd2或它们的类似物)。在一些实施方案中,提供了一种或多种fao活化剂(例如,pparγ激动剂诸如罗格列酮,以及/或者pgi2、pgd2或它们的类似物)在制备用于上述方法中任一种的药物中的用途。
[0038]
在一些实施方案中,提供了一种包含组织形成细胞(例如,生肌细胞)的药物组合物,其中使组织形成细胞与一种或多种fao活化剂接触不超过约72小时。
[0039]
在一些实施方案中,提供了一种试剂盒,其包括包含一种或多种fao活化剂的药物组合物。在一些实施方案中,试剂盒包括罗格列酮和pgi2。在一些实施方案中,试剂盒包括
罗格列酮和曲前列环素。
[0040]
本发明的这些以及其他方面和优势将根据随后具体实施方式和随附权利要求而变得显而易知。应当理解,本文所述的各种实施方案的一种、一些或所有特性可组合以形成本发明的其他实施方案。
附图说明
[0041]
图1a-1g示出了人类肌细胞中脂肪酸代谢的瞬时诱导。
[0042]
图1a示出了相对于未分化的增殖成肌细胞在分化48小时后有丝分裂后单核人类肌细胞中细胞内代谢物的聚类图热图。结果表明,肌细胞在代谢上与增殖性成肌细胞有很大不同。
[0043]
图1b示出了作为成肌分化、环amp、肌酸和磷酸肌酸的标志的代谢物的相对丰度。
[0044]
图1c示出了在2-碳(c2)乙酰基肉毒碱到6-碳(c6)己酰基肉毒碱范围内的短链酰基肉毒碱的相对丰度。
[0045]
图1d示出了关键的糖酵解中间体葡萄糖-6-磷酸盐(g6p)或果糖-6-磷酸盐(f6p)、丙酮酸盐和乳酸盐的相对丰度。
[0046]
图1e示出了调节氧化还原平衡的代谢物(包括谷胱甘肽和nad
的氧化和还原形式)的相对丰度。
[0047]
图1f示出了在人类成肌细胞分化的336小时时间进程中脂肪酸代谢的上游调节因子的相对mrna表达水平。结果表明,脂肪酸代谢基因的几乎所有上游调节因子都在48小时内瞬时升高。
[0048]
图1g示出了在人类成肌细胞分化的336小时时间进程中脂肪酸代谢的下游效应子的相对mrna表达水平。结果表明,几乎所有脂肪酸代谢基因都在48小时内瞬时升高。
[0049]
图2a-2f示出了人肌细胞中线粒体fao的瞬时诱导。
[0050]
图2a示出了相对于未分化的增殖成肌细胞在分化48小时后通过用mitotracker red荧光染色对有丝分裂后单核人类肌细胞中线粒体体积的追踪。结果表明,肌细胞的线粒体体积高于增殖性成肌细胞。
[0051]
图2b示出了相对于未分化的增殖成肌细胞在分化48小时后通过用mitotracker red荧光染色对有丝分裂后单核人类肌细胞中每个细胞的线粒体体积的量化。
[0052]
图2c示出了相对于未分化的增殖成肌细胞在分化48小时后通过用jc1染料荧光染色对有丝分裂后单核人类肌细胞中线粒体膜电位的追踪。
[0053]
图2d示出了相对于未分化的增殖成肌细胞在分化48小时后通过测量jc1的红色:绿色荧光比率对有丝分裂后单核人类肌细胞中每个细胞的线粒体膜电位的量化。
[0054]
图2e示出了通过每12小时测量补充有脂肪酸的分化培养基中的基础氧气消耗率(持续84小时)来对成肌分化过程中肌细胞的基础呼吸率的量化。
[0055]
图2f示出了通过在用质子梯度解偶联剂fccp处理后每12小时测量补充有脂肪酸的分化培养基中的最大氧气消耗率(持续84小时)来对成肌分化过程中肌细胞的最大呼吸率的量化。
[0056]
图3a-3g示出了pparγ驱动线粒体fao的瞬时诱导。
[0057]
图3a示出了在人类成肌细胞分化84小时的过程中成肌分化标志物的相对mrna表
达水平。
[0058]
图3b示出了在人类成肌细胞分化84小时的过程中myod1的相对mrna表达水平。
[0059]
图3c示出了相对于加扰的对照sirna在sirna敲低myod1(simyod1)后分化48小时后肌细胞中的最大呼吸率。
[0060]
图3d示出了在人类成肌细胞分化84小时的过程中各种let-7microrna的相对表达水平。
[0061]
图3e示出了相对于用cy5标记的加扰对照寡核苷酸或未转染对照在用let-7安塔哥米尔(antagomir)寡核苷酸(let-7kd)敲低或用双链体寡核苷酸(let-7oe)过度表达let-7后分化48小时后肌细胞中的基础呼吸率。
[0062]
图3f示出了在人类成肌细胞分化84小时的过程中pparα(点线)、pparδ(虚线)和pparγ(实线)的相对mrna表达水平。pparγ从12小时到72小时瞬时上升,而pparα在12小时后稳定上升。
[0063]
图3g示出了在成肌分化的不同时间窗期间在用pparα和pparγ抑制剂(ipparα/γ)或pparδ抑制剂(ipparδ)抑制后肌细胞中的基础呼吸率。
[0064]
图4a-4e示出了瞬时线粒体fao诱导对于正常肌细胞分化是必要的。
[0065]
图4a示出了在成肌分化的不同时间窗期间在用cpt1抑制剂乙莫克舍处理肌细胞后的相对细胞数。
[0066]
图4b示出了在成肌分化的不同时间窗期间在用cpt1抑制剂乙莫克舍处理后肌细胞中分化标志物成肌素(myog)和肌球蛋白重链(mhc)的蛋白质印迹。
[0067]
图4c示出了在成肌分化的不同时间窗期间在用cpt1抑制剂乙莫克舍处理后肌细胞中肌球蛋白重链(mhc)蛋白水平的量化。
[0068]
图4d示出了在成肌分化的不同时间窗期间在用cpt1抑制剂乙莫克舍处理后肌细胞中成肌素(myog)蛋白水平的量化。
[0069]
图4e示出了在成肌分化的不同时间窗期间在用cpt1抑制剂乙莫克舍处理后肌细胞中的成肌素(myog)蛋白水平的量化。
[0070]
图5a-5i示出了早期pparγ诱导足以促进肌细胞分化。
[0071]
图5a示出了在低密度条件下成肌分化的不同时间窗期间在用pparγ激动剂罗格列酮处理后成肌素(myog)的相对mrna表达水平。
[0072]
图5b示出了在低密度条件下成肌分化的不同时间窗期间在用pparγ激动剂罗格列酮处理后成年慢缩肌球蛋白重链(myh7)的相对mrna表达水平。
[0073]
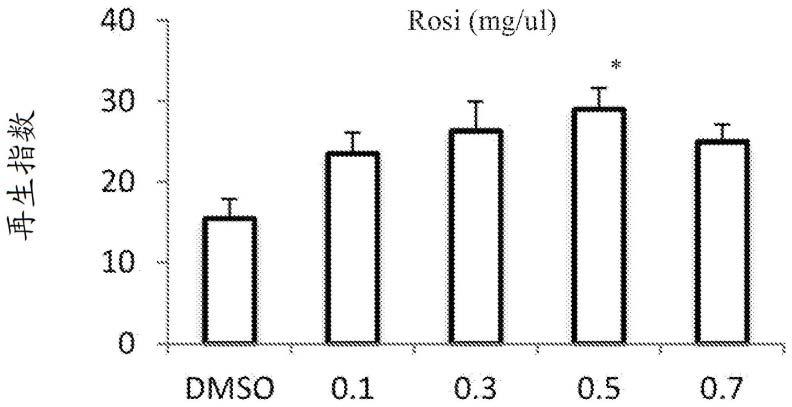
图5c示出了在低密度条件下成肌分化的不同时间窗期间在用pparγ激动剂罗格列酮处理后围产期肌球蛋白重链(myh8)的相对mrna表达水平。
[0074]
图5d示出了在低密度条件下成肌分化的不同时间窗期间在用pparγ激动剂罗格列酮(rosi)处理后分化标志物肌球蛋白重链蛋白(mhc;紫色)、α-辅肌动蛋白(红色)和核成肌素蛋白(绿色)的免疫荧光染色。结果表明,罗格列酮诱导的肌细胞和肌管更大,mhc和α-辅肌动蛋白表达水平更高。
[0075]
图5e示出了在低密度条件下成肌分化的不同时间窗期间在用pparγ激动剂罗格列酮(rosi)处理后肌球蛋白重链(mhc)蛋白表达的量化。
[0076]
图5f示出了在低密度条件下成肌分化的早期0-24小时时间窗在pparγ激动剂罗
格列酮(rosi)处理后分化标志物肌球蛋白重链蛋白(mhc;紫色)、α-辅肌动蛋白(红色)和核成肌素蛋白(绿色)的免疫荧光染色。结果表明,罗格列酮诱导的肌纤维直径更宽,mhc和α-辅肌动蛋白表达更高。
[0077]
图5g示出了在高密度条件下成肌分化的早期0-24小时时间窗在用pparγ激动剂罗格列酮(rosi)处理后成肌素(myog)和肌球蛋白重链(mhc)蛋白表达的蛋白质印迹。
[0078]
图5h示出了在高密度条件下成肌分化的早期0-24小时时间窗在用pparγ激动剂罗格列酮(rosi)处理后成肌素(myog)蛋白表达的量化。
[0079]
图5i示出了在高密度条件下成肌分化的早期0-24小时时间窗在用pparγ激动剂罗格列酮(rosi)处理后肌球蛋白重链(mhc)蛋白表达的量化。
[0080]
图6a-6j示出了早期线粒体fao诱导促进体内骨骼肌再生。
[0081]
图6a示出了小鼠胫骨前肌(ta)被冷冻损伤随后在损伤后0、24或48小时肌内注射单次推注pparγ激动剂罗格列酮(rosi)的示意图。损伤后4天收获ta肌肉进行分析。
[0082]
图6b示出了在损伤后0、24或48小时注射单次推注pparγ激动剂罗格列酮(rosi)后相对于pbs媒介物对照(ctr)ta肌肉(损伤后4天)中小鼠分化标志物myod、myog、mhc和α-辅肌动蛋白的蛋白质印迹。
[0083]
图6c示出了相对于pbs媒介物对照(ctr),在损伤后0、24或48小时注射单次推注αpparγ激动剂罗格列酮(rosi)后ta肌肉(损伤后4天)中分化标志物1.myod、2.mhc和3.辅肌动蛋白的量化。
[0084]
图6d示出了在损伤后0、24或48小时注射单次推注pparγ激动剂罗格列酮(rosi)后ta肌肉(损伤后4天)中剩余坏死面积的量化。
[0085]
图6e示出了小鼠胫骨前肌(ta)被冷冻损伤随后在损伤后24小时肌内注射用pparγ激动剂罗格列酮(rosi)或dmso媒介物处理的单次推注gfp 人类肌细胞的示意图。损伤后4天收获ta肌肉进行分析。
[0086]
图6f示出了在损伤后4天移入冷冻损伤的ta肌肉中的gfp 人类肌细胞中分化的mhc 细胞的量化。
[0087]
图6g示出了在损伤后4天移入冷冻损伤的ta肌肉中的用pparγ激动剂罗格列酮(rosi)或dmso媒介物对照处理的gfp 人类肌细胞中mhc 细胞(紫色)的代表性图像。
[0088]
图6h示出了在0-24小时分化窗用pparγ激动剂罗格列酮(rosi)或罗格列酮和乙莫克舍(rosi eto)相对于用dmso媒介物对照处理的人类肌细胞中分化84小时后成肌素(myog)和肌球蛋白重链(mhc)蛋白的蛋白质印迹。
[0089]
图6i示出了在0-24小时分化窗用pparγ激动剂罗格列酮(rosi)或罗格列酮和乙莫克舍(rosi eto)相对于用dmso媒介物对照处理的人类肌细胞中分化84小时后1.成肌素(myog)和2.肌球蛋白重链(mhc)蛋白的量化。
[0090]
图6j示出了总结pparγ-fao活性对肌生成的不同阶段的影响的模型。
[0091]
图7示出了在成肌分化的不同时间窗期间在用cpt1抑制剂乙莫克舍处理后肌细胞中jc1红色和jc1绿色信号的量化。
[0092]
图8示出了在成肌分化的不同时间窗期间在用cpt1抑制剂乙莫克舍处理后肌细胞中的线粒体dna拷贝数的量化。
[0093]
图9示出了相对于加扰的对照sirna在sirna敲低myod1(simyod1)后分化48小时后
肌细胞中的基础o2消耗率。
[0094]
图10示出了相对于用cy5标记的加扰对照寡核苷酸或未转染对照在用let-7安塔哥米尔寡核苷酸(let-7kd)敲低或用双链体寡核苷酸(let-7oe)过度表达let-7后分化48小时后肌细胞中的最大基础o2消耗率。
[0095]
图11示出了在成肌分化的不同时间窗期间在用ppara和pparγ抑制剂(ipparα/γ)或pparδ抑制剂(ipparδ)抑制后肌细胞中的最大o2消耗率。
[0096]
图12a-12b示出了pparγ蛋白在肌细胞分化的早期阶段瞬时升高。
[0097]
图12a示出了通过蛋白质印迹和光密度法对0-96小时成肌分化窗期间人类肌细胞中的肌球蛋白重链(mhc)蛋白的量化。
[0098]
图12b示出了通过蛋白质印迹光密度法对0-96小时分化窗期间人类肌细胞中的pparγ(pparg)和gapdh蛋白的量化。pparg蛋白在24-72小时分化窗期间瞬时升高。
[0099]
图13a-13c示出了使用针对pparg的多西环素抑制性的tetoff-shrna(tetoff-shpparg)瞬时敲低pparγ(pparg)导致分化效率降低,即pparg对于正常成肌分化是必需的。
[0100]
图13a示出了当戒断多西环素(-dox)时,tetoff-shpparg被活化,从而减少pparg和分化的成肌标志物mhc i、mhc iia和mhc iix蛋白,如通过蛋白质印迹光密度法所量化的。
[0101]
图13b示出了当戒断多西环素(-dox)时,tetoff-shpparg被活化,从而减少分化的成肌标志物acta1、myog、myh7和myh8 mrna,如通过qrt-pcr所量化的(*p《0.05)。
[0102]
图14a-14b示出了pax7 肌肉干细胞在小鼠骨骼肌衰老过程中积累,表明衰老肌肉中的再生缺陷不是由于干细胞增殖缺陷而是由于干细胞分化缺陷。
[0103]
图14a通过免疫荧光显微镜图像示出了与年轻的6周龄小鼠相比,用dapi(蓝色核)复染的pax7 肌肉干细胞(绿色)在年老和肌少的2岁小鼠的骨骼肌(ta)中更频繁。箭头指向pax7 肌肉干细胞的示例性核。
[0104]
图14b示出了与年轻的6周龄小鼠相比,老年和肌少的2岁小鼠的骨骼肌(ta)中的pax7 肌肉干细胞的量化(*p《0.05)。
[0105]
图15a-15d示出了pparγ的早期活化因此线粒体fao在年老动物体内衰老后促进骨骼肌再生并减少肌肉纤维化。
[0106]
图15a示出了小鼠胫骨前肌(ta)被冷冻损伤随后在损伤后0、24或48小时肌内注射单次推注pparγ激动剂罗格列酮(rosi)的示意图。损伤后6天对ta肌肉进行针刺活检,并在损伤后27天收获ta肌肉以进行分析。
[0107]
图15b示出了相对于在6周的年轻小鼠和2岁的年老小鼠中注射dmso媒介物对照,在老年和肌少的2岁小鼠胫骨前肌(ta)被冷冻损伤后,随后在损伤后0、24或48小时肌内注射单次推注pparγ激动剂罗格列酮(rosi),ta肌肉的代表性masson三色染色图像。
[0108]
图15c示出了相对于在6周的年轻小鼠和2岁的年老小鼠中注射dmso媒介物对照,在损伤后0、24或48小时注射单次推注pparγ激动剂罗格列酮(rosi)后ta肌肉(损伤后27天)中纤维化面积的量化。结果表明,与年轻小鼠相比,老年小鼠显示出肌肉纤维化增加(***p《0.001),并且如果在损伤后0小时早期注射pparγ激动剂罗格列酮,则可以逆转衰老肌肉纤维化(
###
p《0.001)。
[0109]
图15d示出了相对于在6周的年轻小鼠和2岁的年老小鼠中注射dmso媒介物对照,在损伤后0、24或48小时注射单次推注pparγ激动剂(rosi)后ta肌肉(损伤后6天)中再生指数的量化(胚胎mhc阳性肌纤维的核分数)。结果表明,与年轻小鼠相比,老年小鼠显示出肌肉再生减少(***p《0.001),并且如果在损伤后0小时早期注射pparγ激动剂罗格列酮,则可以恢复衰老肌肉再生(
##
p《0.01)。
[0110]
图15e示出了相对于在6周的年轻小鼠和2岁的年老小鼠中注射dmso媒介物对照,在损伤后0、24或48小时注射单次推注pparγ激动剂(rosi)后握力(损伤后27天)的量化。结果表明,与年轻小鼠相比,老年小鼠显示出握力下降(**p《0.01),并且如果在损伤后0小时早期注射pparγ激动剂罗格列酮,则可以部分恢复握力(
#
p《0.05)。
[0111]
图16a-16b示出了单次肌内推注pparγ激动剂罗格列酮(rosi)在年老动物体内肌肉再生期间诱导线粒体fao,而对衰老诱导的肥胖和全身胰岛素敏感性没有显著影响。
[0112]
图16a示出了肌内注射单次推注pparγ激动剂罗格列酮(rosi)后27天,相对于dmso或未处理对照,老年和肌少的2岁小鼠的体重或衰老诱导的肥胖没有显著变化。
[0113]
图16b示出了相对于在2岁的老年小鼠和6周的年轻小鼠中注射dmso媒介物对照,在2岁的老年小鼠损伤后0小时肌肉注射单次推注pparγ激动剂罗格列酮(rosi)导致在第6天诱导各种称为酰基肉毒碱的fao中间体,如通过lc-ms/ms(waters xevo-g2xs)所测量的。
[0114]
图17a-17d示出了只有前列腺素pgi2和pgd2可以促进组织再生。
[0115]
图17a示出了相对于dmso媒介物对照(con),在注射单次推注前列腺素pgi2后ta肌肉(损伤后6.5天)中再生指数的量化(胚胎mhc阳性肌纤维的核分数)。结果表明,pgi2可以显著增加肌肉再生(p《0.001)。
[0116]
图17b示出了相对于dmso媒介物(con),在注射单次推注前列腺素pgf1a后ta肌肉(损伤后6.5天)中再生指数的量化(胚胎mhc阳性肌纤维的核分数)。结果表明,pgf1a可以显著减少肌肉再生(p《0.05)。
[0117]
图17c示出了相对于dmso媒介物(con),在注射单次推注前列腺素pgd2后ta肌肉(损伤后6.5天)中再生指数的量化(胚胎mhc阳性肌纤维的核分数)。结果表明,pgd2可以略微但显著增加肌肉再生(p《0.01)。
[0118]
图17d示出了相对于dmso媒介物(con),在注射单次推注前列腺素pgg1后ta肌肉(损伤后6.5天)中再生指数的量化(胚胎mhc阳性肌纤维的核分数)。结果表明,pgg1对肌肉再生没有显著影响(p》0.05)。
[0119]
图18a-18h示出了pgi2可以增加pparγ(pparg)阳性细胞,并在体内肌肉再生期间和体外培养的纯成肌细胞中促进成肌细胞分化的中间阶段。
[0120]
图18a示出了相对于dmso媒介物对照,在注射单次推注前列腺素pgi2后6天,在体内肌肉再生期间损伤区域(ir)或非损伤区域(nr)内的骨骼肌细胞子集中环磷酸腺苷(camp)的丰度,如通过对冷冻损伤后的ta肌肉进行基质辅助激光解吸电离质谱成像(maldi-msi,bruker daltonics)所量化的。虽然gpcr驱动的camp产生通常被认为是pgi2信号传导的下游机制(narumiya等人,1999,doi:10.1152/physrev.1999.79.4.1193),但结果表明,注射pgi2后camp显著降低(***p《0.001),因此排除了pgi2可能通过camp将信号传导至蛋白激酶a(pka)而发挥其促再生作用的可能性,并通过其他靶标进一步支持pgi2的机制。
[0121]
图18b示出了相对于dmso媒介物对照,在冷冻损伤(fi)后1-2天注射单次推注前列腺素pgi2后ta肌肉中pparg阳性细胞的百分比分数的量化(通过免疫荧光)。结果表明,pgi2可以在肌肉再生期间显著增加pparg阳性细胞(*p《0.05,***p《0.001)。
[0122]
图18c示出了相对于dmso媒介物对照,在注射单次推注前列腺素pgi2后损伤的ta肌肉中ppara、ppard和pparg mrna表达的量化(通过qrt-pcr)。结果表明,pgi2可以在肌肉再生期间显著增加pparg mrna表达(**p《0.01)。
[0123]
图18d示出了相对于dmso媒介物对照,在注射单次推注前列腺素pgi2后损伤的ta肌肉中pax7、myod、myog、myh3 mrna表达的量化(通过qrt-pcr)。结果表明,pgi2可以在肌肉再生期间显著增加肌肉干细胞标志物pax7和myod以及肌细胞分化标志物myog和myh3(**p《0.01)。
[0124]
图18e示出了相对于dmso媒介物对照(ctr),在用前列腺素pgi2、pgi2类似物曲前列环素和pparg激动剂罗格列酮(rosig)处理后纯人类成肌细胞中pparg、h3k9ac(乙酰化组蛋白h3赖氨酸9)和myod蛋白表达的量化(通过蛋白质印迹和光密度法)。结果表明,pgi2信号传导增加pparg蛋白,因此增加组蛋白h3乙酰化和myod蛋白以活化干细胞进入成肌细胞。
[0125]
图18f示出了相对于dmso媒介物对照(ctr),在用前列腺素pgi2处理后纯人类成肌细胞中多种肌生成标志物的量化(通过qrt-pcr)。结果表明,pgi2足以促进增殖性成肌细胞进行分化(**p《0.01,***p《0.001)。
[0126]
图18g示出了相对于dmso媒介物对照(ctr),在用前列腺素pgi2处理后在分化开始后24小时纯人类成肌细胞中多种肌生成标志物的量化(通过qrt-pcr)。结果表明,pgi2足以阻断定型肌细胞进行终末分化(*p《0.05,**p《0.01,***p《0.001)。
[0127]
图18h示出了相对于dmso媒介物对照,在冷冻损伤后6天注射单次推注前列腺素pgi2后,ta肌肉的非损伤区域(nr)和损伤区域(ir)中ppara、ppard、pparg、乙酰化组蛋白h3赖氨酸9(h3k9ac)、pax7、myod、myog和胚胎mhc(myh3)蛋白表达的量化(通过蛋白质印迹和光密度法)。结果表明,在ir和nr中,pgi2可以在肌肉再生期间增加ppara、ppard、pparg、h3k9ac以及所有成肌标志物,包括pax7、myod、myog和myh3蛋白表达。
[0128]
图18i示出了相对于dmso媒介物对照,在冷冻损伤后1-2天注射单次推注前列腺素pgi2后,ta肌肉中ppara、ppard、pparg和h3k9ac(乙酰化组蛋白h3赖氨酸9)蛋白表达的量化(通过蛋白质印迹和光密度法)。结果表明,ppara、ppard和pparg蛋白在肌肉再生期间瞬时增加(dmso d1-2),但pgi2加速了pparg的增加,抑制了ppara的增加,并且对ppard几乎没有影响(pgi2 d1-2)。pgi2诱导pparg和线粒体fao也增加了蛋白质乙酰化,尤其是组蛋白乙酰化,如h3k9ac水平(作为促进成肌细胞分化的中间阶段的机制之一)所示。
[0129]
图19a-19e示出了pgi2和pgi2类似物可以与pparg激动剂协同作用以促进体内肌肉再生。
[0130]
图19a示出了相对于dmso媒介物对照,在损伤后6天内注射单次推注前列腺素pgi2后ta肌肉中定型成肌细胞的百分比分数的量化(通过免疫荧光得到的myog阳性ki67阳性细胞和myog阳性细胞)。结果表明,pgi2可以在肌肉再生期间显著增加定型成肌细胞(**p《0.01)。
[0131]
图19b示出了相对于单独的罗格列酮(rosi),在以不同浓度注射单次推注前列腺素pgi2后ta肌肉(损伤后6.5天)中再生指数的量化(胚胎mhc阳性肌纤维的核分数)。结果表
明,6.5-13mm pgi2是肌肉再生的最佳浓度。
[0132]
图19c示出了在以不同浓度注射单次推注罗格列酮(rosi)后ta肌肉(损伤后6.5天)中再生指数的量化(胚胎mhc阳性肌纤维的核分数)。结果表明,0.5mg/ul罗格列酮是肌肉再生的最佳浓度。
[0133]
图19d示出了相对于dmso媒介物对照,在冷冻损伤后6天在第0天注射单次推注前列腺素pgi2类似物曲前列环素(tp),随后在第1天注射单次推注pparg激动剂罗格列酮(rog)后ta肌肉中成肌标志物pax7、myod、myog和胚胎mhc myh3蛋白表达的半量化(通过蛋白质印迹光密度法)。结果表明,单独的pgi2信号传导可以在肌肉再生期间显著增加pax7、myod、myog和myh3蛋白表达,但是pgi2类似物与罗格列酮联合更能增强肌生成标志物。
[0134]
图19e示出了相对于在第0天注射dmso媒介物,在0天注射单次推注前列腺素pgi2后,随后相对于在第1天注射dmso媒介物,在1天注射单次推注pparg激动剂罗格列酮(rosi)后,ta肌肉(损伤后6.5天)中再生指数的量化(胚胎mhc阳性肌纤维的核分数)。结果表明,单独的pgi2和单独的罗格列酮均可以显著增加肌肉再生(***p《0.001,*p《0.05),但pgi2与罗格列酮联合更能协同增强肌肉再生(***p《0.001,
##
p《0.01,
###
p《0.001)。
[0135]
图19f示出了相对于在第0天注射dmso媒介物,在0天注射单次推注前列腺素pgi2类似物曲前列环素(tp)后,随后相对于在第1天注射dmso媒介物,在1天注射单次推注pparg激动剂罗格列酮(rosi)后,ta肌肉(损伤后6.5天)中再生指数的量化(胚胎mhc阳性肌纤维的核分数)。结果表明,单独的罗格列酮、单独的tp、单独的pgi2均可以显著增加肌肉再生(***p《0.001),但tp联合罗格列酮更能协同增强肌肉再生(***p《0.001)。
[0136]
图19g示出了对于损伤区域(ir)和非损伤区域(nr),相对于在第0天注射dmso媒介物,在0天注射单次推注前列腺素pgi2后,随后相对于在第1天注射dmso媒介物,在1天注射单次推注pparg激动剂罗格列酮(rosi)后,ta肌肉(损伤后6.5天)中肌纤维横截面feret直径的相对分布。每种处理类别的肌纤维横截面积分布的显著差异的kruskal-wallis检验p值如下示出。结果表明,单独的pgi2或单独的罗格列酮可以增加肥大生长,但pgi2与罗格列酮联合更能协同增加肥大生长。
[0137]
图19h示出了相对于在第0天注射dmso媒介物,在0天注射单次推注pgi2类似物曲前列环素(tp)后,随后相对于在第1天注射dmso媒介物,在1天注射单次推注pparg激动剂罗格列酮(rosi)后,ta肌肉(损伤后6.5天)中肌纤维横截面feret直径的相对分布。每种处理类别的肌纤维横截面积分布的显著差异的kruskal-wallis检验p值在图例旁示出。结果表明,单独的pgi2类似物(tp)或单独的罗格列酮可以增加肥大生长,但pgi2类似物(tp)与罗格列酮联合更能协同增加肥大生长。
[0138]
图19i示出了相对于未损伤小鼠,在冷冻损伤后的6周龄小鼠中,在损伤后0小时注射单次推注前列腺素pgi2或pgi2类似物曲前列环素(tp)或dmso媒介物对照,随后在损伤后24小时注射单次推注pparg激动剂(rosi)或dmso媒介物对照后握力(损伤后14天)的量化。结果表明,虽然与未损伤小鼠相比,损伤小鼠显示出握力减小,但单独的pparg激动剂罗格列酮(rosi)、前列腺素pgi2或pgi2类似物曲前列环素(tp)均可部分恢复握力(
*
p《0.05)。结果进一步表明,pgi2或曲前列环素(tp)联合罗格列酮(rosi)可以进一步协同增强握力的损伤后恢复(**p《0.01)。
[0139]
图20a-20b示出了pgi2信号传导促进体外培养的纯原代人类成肌细胞的细胞增
殖。
[0140]
图20a示出了在早期传代的原代人类成肌细胞(第12代)中,用pgi2处理显著增加增殖(***p《0.001)。
[0141]
图20b示出了在晚期传代的原代人类成肌细胞(第18代)中,用pgi2处理显著增加增殖(***p《0.001)。
[0142]
图21a-21e示出了pgi2信号传导甚至在没有损伤的情况下活化多种肌肉组织中的肌肉干细胞和祖细胞增殖,活化无伤口再生和逆转衰老期间的纤维化。
[0143]
图21a示出了在腹膜内注射单次推注pgi2类似物曲前列环素(tp)后2天,腓肠肌中增殖性肌肉干细胞的分数(通过免疫荧光得到的pax7阳性ki67阳性细胞)、肌肉干细胞的总和(通过免疫荧光得到的pax7阳性细胞)、增殖细胞的总和(通过免疫荧光得到的ki67阳性细胞)甚至在没有损伤的情况下均显著增加(p《0.05)。
[0144]
图21b示出了在腹膜内注射单次推注pgi2类似物曲前列环素(tp)后2天,股四头肌中增殖性肌肉干细胞的分数(通过免疫荧光得到的pax7阳性ki67阳性细胞)、肌肉干细胞的总和(通过免疫荧光得到的pax7阳性细胞)、增殖细胞的总和(通过免疫荧光得到的ki67阳性细胞)甚至在没有损伤的情况下均显著增加(p《0.05)。
[0145]
图21c示出了在肌内注射单次推注pgi2或pgi2类似物曲前列环素(tp)后2天,ta肌肉中增殖性肌肉干细胞(通过免疫荧光得到的pax7阳性ki67阳性细胞)的分数甚至在没有损伤的情况下显著增加(***p《0.001)。
[0146]
图21d示出了相对于在2岁的小鼠中注射dmso媒介物对照,在每天注射pparγ激动剂罗格列酮(rosi)、pgi2、pgi2类似物曲前列环素(tp)、pgi2和rosi或者tp和rosi后,ta肌肉(注射后7天)中%纤维化面积(masson三色染色)的相对变化的量化。结果表明,虽然老年小鼠显示出肌肉纤维化增加,但pparγ激动剂罗格列酮、pgi2和曲前列环素均可以部分逆转衰老肌肉纤维化。此外,pgi2或曲前列环素与罗格列酮的组合更能协同作用以逆转衰老肌肉纤维化(
*
p《0.05,
**
p《0.01)。
[0147]
图21e示出了相对于在2岁的小鼠中注射dmso媒介物对照,在每天注射pparγ激动剂罗格列酮(rosi)、pgi2、pgi2类似物曲前列环素(tp)、pgi2和rosi或者tp和rosi后,ta肌肉(注射后7天)中纤维化前体(通过免疫荧光得到的pgdfra阳性和ki67阳性)的百分比分数的相对变化的量化。结果表明,虽然老年小鼠显示出肌肉纤维化前体增加,但pparγ激动剂罗格列酮、pgi2和曲前列环素均可以部分抑制衰老肌肉纤维化前体。此外,pgi2或曲前列环素与罗格列酮的组合更能协同作用以抑制衰老肌肉纤维化前体(
*
p《0.05)。
[0148]
图22a-22d示出了pgi2信号传导甚至在没有损伤的情况下活化多种非骨骼肌组织中的干细胞和祖细胞增殖,从而活化无伤口再生。
[0149]
图22a示出了在腹膜内注射单次推注pgi2类似物曲前列环素(tp)后2天,内胚层来源的肝组织中增殖性祖细胞的总数(通过免疫荧光得到的ki67阳性细胞)甚至在没有损伤的情况下显著增加(**p《0.01)。
[0150]
图22b示出了在腹膜内注射单次推注pgi2类似物曲前列环素(tp)后2天,中胚层来源的心脏和心肌组织中增殖性祖细胞的总数(通过免疫荧光得到的ki67阳性细胞)甚至在没有损伤的情况下显著增加(**p《0.01)。
[0151]
图22c示出了在腹膜内注射单次推注pgi2类似物曲前列环素(tp)后2天,神经外胚
层来源的皮肤组织中增殖性祖细胞的总数(通过免疫荧光得到的ki67阳性细胞)甚至在没有损伤的情况下显著增加(***p《0.01)。
[0152]
图22d示出了在腹膜内注射单次推注pgi2类似物曲前列环素(tp)后2天,皮肤组织的休止期毛囊中增殖性祖细胞的总数(通过免疫荧光得到的ki67阳性细胞)甚至在没有损伤的情况下显著增加(**p《0.001)。
[0153]
图23a-c示出了pgi2信号传导与pparg信号传导协同以抑制衰老期间多种非骨骼肌组织中的纤维化前体。
[0154]
图23a示出了相对于在2岁的小鼠中注射dmso媒介物对照,在每天注射pparγ激动剂罗格列酮(rosi)、pgi2、pgi2类似物曲前列环素(tp)、pgi2和rosi或者tp和rosi后,内胚层来源的肝脏组织(注射后7天)中纤维化前体(通过免疫荧光得到的pgdfra阳性和ki67阳性)的百分比分数的相对变化的量化。结果表明,虽然老年小鼠显示出肝脏纤维化前体增加,但pparγ激动剂罗格列酮、pgi2和曲前列环素均可以部分抑制衰老肝脏纤维化前体。此外,pgi2或曲前列环素与罗格列酮的组合更能协同作用以抑制衰老肝脏纤维化前体(
*
p《0.05)。
[0155]
图23b示出了相对于在2岁的小鼠中注射dmso媒介物对照,在每天注射pparγ激动剂罗格列酮(rosi)、pgi2、pgi2类似物曲前列环素(tp)、pgi2和rosi或者tp和rosi后,神经外胚层来源的皮肤组织(注射后7天)中纤维化前体(通过免疫荧光得到的pgdfra阳性和ki67阳性)的百分比分数的相对变化的量化。结果表明,虽然老年小鼠显示出皮肤纤维化前体增加,但pparγ激动剂罗格列酮、pgi2和曲前列环素均可以部分抑制衰老皮肤纤维化前体。此外,pgi2或曲前列环素与罗格列酮的组合更能协同作用以抑制衰老皮肤纤维化前体(
**
p《0.01)。
[0156]
图23c示出了相对于在2岁的小鼠中注射dmso媒介物对照,在每天注射pparγ激动剂罗格列酮(rosi)、pgi2、pgi2类似物曲前列环素(tp)、pgi2和rosi或者tp和rosi后,中胚层来源的心脏组织(注射后7天)中纤维化前体(通过免疫荧光得到的pgdfra阳性和ki67阳性)的百分比分数的相对变化的量化。结果表明,虽然老年小鼠显示出心脏纤维化前体增加,但pparγ激动剂罗格列酮、pgi2和曲前列环素均可以部分抑制衰老心脏纤维化前体。此外,pgi2或曲前列环素与罗格列酮的组合更能协同作用以抑制衰老心脏纤维化前体(
**
p《0.01)。
[0157]
图24a-c示出了pgi2信号传导与pparg信号传导协同以抑制衰老期间多种非骨骼肌组织中的纤维化。
[0158]
图24a示出了相对于在2岁的小鼠中注射dmso媒介物对照,在每天注射pparγ激动剂罗格列酮(rosi)、pgi2、pgi2类似物曲前列环素(tp)、pgi2和rosi或者tp和rosi后,内胚层来源的肝脏组织(注射后7天)中%纤维化面积(masson三色染色)的相对变化的量化。结果表明,虽然老年小鼠显示出肝脏纤维化增加,但pparγ激动剂罗格列酮、pgi2和曲前列环素均可以部分逆转衰老肝脏纤维化。此外,pgi2或曲前列环素与罗格列酮的组合更能协同作用以逆转衰老肝脏纤维化(
*
p《0.05,
**
p《0.01)。
[0159]
图24b示出了相对于在2岁的小鼠中注射dmso媒介物对照,在每天注射pparγ激动剂罗格列酮(rosi)、pgi2、pgi2类似物曲前列环素(tp)、pgi2和rosi或者tp和rosi后,神经外胚层来源的皮肤组织(注射后7天)中%纤维化面积(masson三色染色)的相对变化的量
化。结果表明,虽然老年小鼠显示出皮肤纤维化增加,但pparγ激动剂罗格列酮、pgi2和曲前列环素均可以部分逆转衰老皮肤纤维化。此外,pgi2或曲前列环素与罗格列酮的组合更能协同作用以逆转衰老皮肤纤维化(
**
p《0.01)。
[0160]
图24c示出了相对于在2岁的小鼠中注射dmso媒介物对照,在每天注射pparγ激动剂罗格列酮(rosi)、pgi2、pgi2类似物曲前列环素(tp)、pgi2和rosi或者tp和rosi后,中胚层来源的心脏组织(注射后7天)中%纤维化面积(masson三色染色)的相对变化的量化。结果表明,虽然老年小鼠显示出心脏纤维化增加,但pparγ激动剂罗格列酮、pgi2和曲前列环素均可以部分逆转衰老心脏纤维化。此外,pgi2或曲前列环素与罗格列酮的组合更能协同作用以逆转衰老心脏纤维化(
*
p《0.05,
**
p《0.01)。
[0161]
图25a-25b示出了尝试将pgi2和pgi2类似物与肝细胞生长因子(hgf)组合以在没有损伤的情况下活化肌肉再生的结果。
[0162]
图25a示出了在具有或没有肝细胞生长因子(hgf)的情况下,相对于dmso媒介物对照,在肌内注射单次推注前列腺素pgi2后2天,ta肌肉中增殖性成肌细胞(通过免疫荧光得到的myod阳性ki67阳性细胞)的百分比分数的量化。hgf先前已被证明甚至在没有损伤的情况下也能活化肌肉干细胞增殖(tatsumi等人,1998,doi:10.1006/dbio.1997.8803)。这些结果表明,pgi2在具有或没有hgf的情况下显著降低了增殖性成肌细胞(*p《0.05,**p《0.01),而单独的hgf和曲前列环素(tp)略微增加了增殖性成肌细胞,因此排除了hgf与pgi2信号传导之间的协同作用。
[0163]
图25b示出了在具有或没有肝细胞生长因子(hgf)的情况下,相对于dmso媒介物对照,在肌内注射单次推注前列腺素pgi2后2天,ta肌肉中增殖性肌肉干细胞(通过免疫荧光得到的pax7阳性ki67阳性细胞)的百分比分数的量化。hgf先前已被证明甚至在没有损伤的情况下也能活化肌肉干细胞增殖(tatsumi等人,1998;doi:10.1006/dbio.1997.8803)。我们的结果表明,单独的pgi2、单独的hgf和单独的pgi2类似物曲前列环素(tp)显著增加了增殖性肌肉干细胞(***p《0.001),而hgf与pgi2联合未能增加增殖性肌肉干细胞,因此排除了hgf与pgi2信号传导之间的协同作用。
[0164]
图26a-26b示出了尝试将pgi2和pgi2类似物与ppard药物组合以在没有损伤的情况下活化肌肉再生的结果。
[0165]
图26a示出了相对于dmso媒介物对照和ppard激动剂gw0742(gw),在具有或没有ppard抑制剂gsk3787(gsk)的情况下,在肌肉内注射单次推注前列腺素pgi2类似物曲前列环素(tp)后2天,腓肠肌中增殖性肌肉干细胞(通过免疫荧光得到的pax7阳性ki67阳性细胞)的百分比分数的量化。ppard已被证明是血管细胞中pgi2的靶标(he等人,2008,doi:10.1161/circresaha.108.176057;li等人,2011,doi:10.1165/rcmb.2010-0428oc)。我们的结果表明,单独的pgi2类似物(tp)显著增加了增殖性肌肉干细胞(*p《0.05),而ppard激动剂gw0742出人意料地减少了增殖性肌肉干细胞(**p《0.01)。单独的ppard抑制剂gsk3787没有作用,但在共同处理时特异性地消除了tp的刺激作用,这表明ppard是部分必要的,但不足以驱动pgi2及其类似物的干细胞活化作用。
[0166]
图26b示出了相对于dmso媒介物对照和ppard激动剂gw0742(gw),在具有或没有ppard抑制剂gsk3787(gsk)的情况下,在肌肉内注射单次推注前列腺素pgi2类似物曲前列环素(tp)后2天,腓肠肌中增殖性成肌细胞(通过免疫荧光得到的myod阳性ki67阳性细胞)
的百分比分数的量化。ppard激动剂先前已被证明是运动模拟药物(narkar等人,2008;doi:10.1016/j.cell.2008.06.051)。我们的结果出人意料地表明,单独的pgi2类似物(tp)在具有或没有gsk3787的ppard抑制的情况下略微增加了增殖性成肌细胞。单独的ppard激动剂gw0742没有作用,但单独的ppard抑制剂gsk3787略微增加了增殖性成肌细胞,这表明ppard既不必要也不足以驱动pgi2及其类似物的干细胞活化作用,但如果受到抑制,则会产生复杂的反馈作用。
[0167]
图27a示出了相对于dmso媒介物对照注射,在肌内注射单次推注ppard激动剂gw0742或ppard抑制剂gsk3787后胫骨前肌(ta)中胚胎mhc(myh3)的代表性免疫染色图像(冷冻损伤后6.5天)。
[0168]
图27b示出了相对于dmso媒介物(con),在注射单次推注ppard激动剂gw0742或ppard抑制剂gsk3787后ta肌肉(损伤后6.5天)中再生指数的量化(胚胎mhc阳性肌纤维的核分数)。结果表明,gw0742可以显著降低肌肉再生(p《0.05),而gsk3787则不能,这表明ppard不能驱动骨骼肌再生。
[0169]
图28a-28b示出了pgi2类似物曲前列环素与pparg而不是ppara协同作用以活化干细胞增殖。
[0170]
图28a示出了相对于dmso对照,在具有或没有ppara激动剂非诺贝特(ff)或ppara/g激动剂wy-14643(wy)的情况下,在腹膜内注射单次推注前列腺素pgi2类似物曲前列环素(tp)后2天,腓肠肌中增殖性成肌细胞(通过免疫荧光得到的myod阳性ki67阳性细胞)的百分比分数的量化。我们的结果表明,单独的pgi2类似物(tp)和单独的wy-14643显著增加了(**p《0.01)增殖性成肌细胞。单独的ppara激动剂非诺贝特(ff)没有作用,但在共同处理时特异性消除了tp的刺激作用,这表明ppara下调是必要的,但不足以驱动pgi2及其类似物的干细胞活化作用。相比之下,曲前列环素(tp)与wy-14643(wy)的联合处理甚至进一步协同增加了增殖性成肌细胞(*p《0.05),这表明pgi2信号传导与pparg而不是ppara协同以活化干细胞增殖。
[0171]
图28b示出了相对于dmso对照,在具有或没有ppara激动剂非诺贝特(ff)或ppara/g激动剂wy-14643(wy)的情况下,在腹膜内注射单次推注前列腺素pgi2类似物曲前列环素(tp)后2天,腓肠肌中成肌细胞(通过免疫荧光得到的myod阳性细胞)的百分比分数的量化。我们的结果表明,单独的pgi2类似物(tp)和单独的wy-14643显著增加了成肌细胞(**p《0.01,*p《0.05)。单独的ppara激动剂非诺贝特(ff)没有作用,但在共同处理时特异性消除了tp的刺激作用,这表明ppara下调是必要的,但不足以驱动pgi2及其类似物的干细胞活化作用。相比之下,曲前列环素(tp)与wy-14643(wy)的联合处理甚至进一步协同增加了增殖性成肌细胞,这表明pgi2信号传导与pparg而不是ppara协同以活化干细胞。
具体实施方式
[0172]
本技术提供了使用脂肪酸氧化(“fao”)的活化剂在体外或体内促进组织(例如,肌肉)再生的组合物和方法。本技术至少部分基于发明人惊奇地发现在原代人类成肌细胞分化72小时内,fao在早期阶段发生瞬时爆发。此外,本技术证明了例如通过pparγ激动剂(诸如罗格列酮)和/或前列腺素(诸如前列腺素i2(pgi2)、前列腺素d2(pgd2)或它们的类似物)活化fao会诱导细胞培养物中生肌细胞(例如,成肌细胞或肌细胞)的分化并增强肌肉损伤
动物模型中的肌生成。值得注意的是,pparγ激动剂罗格列酮可以增强老年动物(例如,年龄等于人类60岁的小鼠)中的肌肉再生。此外,pgi2及其类似物在pparγ上游起作用,并且可以与pparγ激动剂协同作用以增强损伤后的肌肉再生。即使在没有损伤的情况下,pgi2和类似物也可以活化多个肌肉组织和其他器官(例如,皮肤,肝脏,心脏等)中的干细胞和再生。本文所述的方法和组合物可以用于诱导组织形成细胞(例如,生肌细胞)的分化和/或成熟,促进组织生长(例如,肌肉生长),以及治疗与组织(例如,肌肉)相关的疾病或病症,诸如组织损伤、变性或衰老。
[0173]
因此,在一些实施方案中,提供了一种促进组织再生和/或生长和/或诱导干细胞增殖和/或诱导组织中的组织形成细胞的分化和/或成熟的方法,该方法包括使组织与一种或多种fao活化剂(例如,pparγ激动剂诸如罗格列酮,以及/或者pgi2、pgd2或它们的类似物)接触。在一些实施方案中,使组织与一种或多种fao活化剂接触不超过约72小时(例如,不超过约48小时或不超过约24小时)。在一些实施方案中,组织是肌肉组织。在一些实施方案中,组织形成细胞是生肌细胞。
[0174]
在一些实施方案中,提供了一种治疗个体中与组织相关的疾病或病症的方法,该方法包括向个体的组织施用有效量的包含组织形成细胞的药物组合物,其中在施用药物组合物之前使组织形成细胞与一种或多种fao活化剂(例如,pparγ激动剂诸如罗格列酮,以及/或者pgi2、pgd2或它们的类似物)接触。在一些实施方案中,使组织形成细胞与一种或多种fao活化剂接触不超过约72小时(例如,不超过约48小时或不超过约24小时)。在一些实施方案中,组织是肌肉组织。在一些实施方案中,组织形成细胞是生肌细胞。在一些实施方案中,疾病或病症是组织损伤、组织再生、组织纤维化或衰老。
[0175]
在一些实施方案中,提供了一种治疗个体中与组织相关的疾病或病症的方法,该方法包括向个体的组织施用有效量的包含一种或多种fao活化剂(例如,pparγ激动剂诸如罗格列酮,以及/或者pgi2、pgd2或它们的类似物)的药物组合物。在一些实施方案中,约每24小时、48小时或72小时施用一次药物组合物。在一些实施方案中,疾病或病症是组织损伤。在一些实施方案中,在组织损伤后不超过约72小时、不超过约48小时或不超过约24小时向个体施用药物组合物。在一些实施方案中,组织是肌肉组织。
[0176]
i.定义
[0177]
除非下文另有定义,否则本文使用的术语与本领域中通常使用的术语相同。
[0178]
术语“脂肪酸氧化”和“fao”在本文中可互换使用,是指将脂肪酸分解成乙酰辅酶a单元的生化过程。在一些实施方案中,fao在细胞的线粒体中。在一些实施方案中,fao在细胞的过氧化物酶体中。
[0179]
如本文所用,“组织形成细胞”是指可以增殖和/或分化为特化的成熟细胞类型并再生组织的细胞。示例性组织形成细胞包括但不限于干细胞、祖细胞、前体细胞以及它们的组合。如本文所用,“生肌细胞”是指可以增殖和/或分化以产生肌肉组织的细胞。生肌细胞包括但不限于肌肉干细胞、成肌细胞、肌细胞、肌管和肌纤维。本文所考虑的生肌细胞可产生骨骼肌、平滑肌和/或心肌。
[0180]
如本文所用,“干细胞”是未分化的细胞,其特征在于能够通过有丝分裂细胞分裂进行自我更新以及有潜力分化为后代细胞,包括自我更新的祖细胞、非更新的祖细胞和终末分化的细胞。“肌肉干细胞”是指在成年肌肉组织中发现的干细胞,包括例如卫星细胞。
[0181]
如本文所用,“祖细胞”是指具有在组织中分化为特化细胞类型的潜力的未分化细胞。肌肉祖细胞包括但不限于肌肉干细胞和成肌细胞。原代成年肌肉祖细胞的增殖能力有限,它们在增殖之后便进入衰老状态并失去增殖和分化能力。相比之下,胚胎和胎儿肌肉祖细胞尽管经历了多轮有丝分裂,但增殖能力增强,并且在损伤和移植时表现出强烈的再生反应。
[0182]
如本文所用,“成肌细胞”是指可以分化以产生肌肉细胞的单核肌肉祖细胞。
[0183]
如本文所用,“肌细胞”是指由肌肉祖细胞分化产生的单核肌肉细胞。
[0184]
如本文所用,“肌管”是指由肌细胞融合产生的多核肌肉细胞。
[0185]
如本文所用,“肌纤维”是指从肌管发育的终末分化、多核和横纹的肌肉细胞。
[0186]
如本文所用,“活化剂”是指增加靶标的活性、表达和/或量的药剂。药剂可以是任何分子实体,包括但不限于小分子、肽、蛋白质、核酸(例如,rna、dna、microrna、化学修饰的核酸等)以及它们的组合。活化剂的靶标可以是基因、小分子(例如,代谢物)、蛋白质、分子途径或它们的任何组合。在一些实施方案中,活化剂使靶标的活性、表达和/或量增加至少约10%、20%、50%、2倍、5倍、10倍、100倍或1000倍或更多中的任一种,包括这些值之间的任何值或范围。靶标的活化剂可直接与靶标相互作用(例如,与其结合),或者在靶标上游的信号传导途径中起作用以调节靶标的活性、表达和/或量。
[0187]
如本文所用,“pparγ激动剂”是指通过结合并活化pparγ或其复合物来增加pparγ的活性、表达和/或量的药剂。pparγ激动剂可以是任何合适的分子实体,包括小分子、肽、蛋白质、核酸以及它们的组合。在一些实施方案中,pparγ激动剂模拟pparγ的天然配体。
[0188]
如本文所用,“pparγ,”、“pparg”、“pparg”或“ppar-γ”是指过氧化物酶体增殖物活化受体γ,包括其所有同种型pparγ1-3)。在一些实施方案中,pparγ是pparγ1.。在一些实施方案中,pparγ是pparγ2.。在一些实施方案中,pparγ与类视黄醇x受体(rxr)形成复合物,该复合物结合靶基因的dna上的特定区域。
[0189]
如本文所用,“治疗”是获得有益或期望的结果(包括临床结果)的方法。出于本发明的目的,有益或期望的临床结果包括但不限于以下项中的一项或多项:减少由疾病引起的一种或多种症状、减轻疾病的程度、稳定疾病或病症(例如,预防或延缓疾病或病症的恶化)、预防或延缓疾病或病症的传播、预防或延缓疾病或病症的发生或复发、延缓或减缓疾病或病症的进展、改善疾病状态、提供疾病或病症的缓解(部分或全部)、减少治疗疾病或病症所需的一种或多种其他药物的剂量、延缓疾病或病症的进展、提高生活质量以及/或者延长生存期。“治疗”还包括减少疾病或病症的病理后果。本技术的方法考虑治疗的这些方面中的任何一个或多个。
[0190]
术语“个体”、“受试者”和“患者”在本文中可互换地用于描述哺乳动物,包括人类。个体包括但不限于人、牛、羊、猪、马、猫、犬、啮齿动物或灵长类动物。在一些实施方案中,个体是人。在一些实施方案中,个体患有疾病或病症。在一些实施方案中,个体需要治疗。在一些实施方案中,个体是老年个体,例如至少约50、55、60、65、70、75、80、85岁或更大年龄中任一种的人类个体。
[0191]
如本领域所理解,“有效量”是指足以产生期望的治疗结果的组合物(例如,一种或多种fao活化剂或生肌细胞)的量。对于治疗用途,有益或期望的结果包括例如减少由疾病
或病症引起的一种或多种症状(生化、组织学和/或行为),包括其并发症和在疾病或病症发展期间呈现的中间病理表型;提高患有疾病或病症的个体的生活质量;减少治疗疾病或病症所需的其他药物的剂量;增强另一种药物的效果;延缓疾病或病症的进展;以及/或者延长患者的生存期。
[0192]
如本文所用,术语“细胞”和“细胞培养物”可互换使用,并且所有此类名称包括后代。应当理解,由于有意或无意的突变,所有后代的dna含量可能并不完全相同。包括与原始细胞具有相同功能或生物学活性的变体后代。
[0193]“烷基”是指具有1至10个碳原子且优选1至6个碳原子的一价饱和脂族烃基基团。举例来说,该术语包括直链和支链烃基基团,诸如甲基(ch
3-)、乙基(ch3ch
2-)、正丙基(ch3ch2ch
2-)、异丙基((ch3)2ch-)、正丁基(ch3ch2ch2ch
2-)、异丁基((ch3)2chch
2-)、仲丁基((ch3)(ch3ch2)ch-)、叔丁基((ch3)3c-)、正戊基(ch3ch2ch2ch2ch
2-)、新戊基((ch3)3cch
2-)和正己基(ch3(ch2)
5-)。
[0194]“亚烷基”是指优选地具有1至10个且更优选1至3个碳原子的直链或支链二价脂族亚烃基基团。举例来说,该术语包括例如亚甲基(-ch
2-)、乙烯(-ch2ch
2-)、正丙烯(-ch2ch2ch
2-)、异丙烯(-ch2ch(ch3)-)、(-c(ch3)2ch2ch
2-)、(-c(ch3)2ch2c(o)-)、(-c(ch3)2ch2c(o)nh-)、(-ch(ch3)ch
2-)等。
[0195]“烯基”是指具有2至10个碳原子且优选2至4个碳原子并且具有至少1个且优选1至2个双键不饱和位点的直链或支链烃基基团。举例来说,该术语包括二乙烯基、烯丙基和丁-3-烯-1-基。该术语包括顺式和反式异构体或这些异构体的混合物。
[0196]“亚烯基”是指具有2至10个碳原子且优选2至4个碳原子并且具有至少1个且优选1至2个双键不饱和位点的直链或支链亚烃基基团。亚烯基的示例包括但不限于亚乙烯基(-ch=ch-)、亚丙基(-ch2c=c-)和丁-3-烯-1-亚基(-ch2ch2c=ch-)。该术语包括顺式和反式异构体或这些异构体的混合物。
[0197]“炔基”是指具有2至6个碳原子且优选2至3个碳原子并且具有至少1个且优选1至2个三键不饱和位点的直链或支链烃基基团。此类炔基基团的示例包括乙炔基(-c≡ch)和炔丙基(-ch2c≡ch)。
[0198]“亚炔基”是指具有2至6个碳原子且优选2至3个碳原子并且具有至少1个且优选1至2个三键不饱和位点的直链或支链亚烃基基团。亚炔基的示例包括但不限于乙炔基(-c≡c-)和炔丙基(-ch2c≡c-)。
[0199]“氨基”是指基团
–
nh2。
[0200]“取代的氨基”是指基团-nrr,其中每个r独立地选自由以下项组成的组:氢、烷基、取代的烷基、环烷基、取代的环烷基、烯基、取代的烯基、环烯基、取代的环烯基、炔基、取代的炔基、芳基、杂芳基和杂环基,条件是至少一个r不为氢。
[0201]“芳基”是指具有单环(诸如存在于苯基基团中)或具有多个稠环的环系(此类芳族环系的示例包括萘基、蒽基和茚满基)的6至18个碳原子的单价芳族碳环基团,这些稠环可以是也可以不是芳族的,条件是附接点穿过芳族环的原子。举例来说,该术语包括苯基和萘基。除非芳基取代基的定义另有限制,否则此类芳基基团可以任选地被1至5个取代基或1至3个取代基取代,这些取代基选自酰氧基、羟基、硫醇、酰基、烷基、烷氧基、烯基、炔基、环烷基、环烯基、取代的烷基、取代的烷氧基、取代的烯基、取代的炔基、取代的环烷基、取代的环
烯基、氨基、取代的氨基、氨酰基、酰氨基、烷芳基、芳基、芳氧基、叠氮基、羧基、羧基酯、氰基、卤素、硝基、杂芳基、杂芳氧基、杂环基、杂环氧基、氨基酰氧基、氧酰氨基、硫代烷氧基、取代的硫代烷氧基、硫代芳氧基、硫代杂芳氧基、磺酰基氨基、-so-烷基、-so-取代的烷基、-so-芳基、-so-杂芳基、-so
2-烷基、-so
2-取代的烷基、-so
2-芳基、-so
2-杂芳基和三卤甲基。
[0202]“环烷基”是指具有单个或多个环(包括稠环系、桥环系和螺环系)的3至10个碳原子的环状烷基基团。合适的环烷基基团的示例包括例如金刚烷基、环丙基、环丁基、环戊基、环辛基等。举例来说,此类环烷基基团包括单环结构(诸如环丙基、环丁基、环戊基、环辛基等)或多环结构(诸如金刚烷基等)。
[0203]“杂芳基”是指在环内具有1至15个碳原子(诸如1至10个碳原子)和1至10个选自由氧、氮和硫组成的组的杂原子的芳族基团。此类杂芳基基团可以具有单环(诸如吡啶基、咪唑基或呋喃基)或环系中(例如,诸如中氮茚基、喹啉基、苯并呋喃基、苯并咪唑基或苯并噻吩基的基团中)的多个稠环,其中环系内的至少一个环是芳族的,并且环系内的至少一个环是芳族的,条件是附接点穿过芳族环的原子。在某些实施方案中,杂芳基基团的氮和/或硫环原子任选地被氧化以提供n-氧化物(n
→
o)、亚磺酰基或磺酰基部分。举例来说,该术语包括吡啶基、吡咯基、吲哚基、噻吩基和呋喃基。除非杂芳基取代基的定义另有限制,否则此类杂芳基基团可以任选地被1至5个取代基或1至3个取代基取代,这些取代基选自酰氧基、羟基、硫醇、酰基、烷基、烷氧基、烯基、炔基、环烷基、环烯基、取代的烷基、取代的烷氧基、取代的烯基、取代的炔基、取代的环烷基、取代的环烯基、氨基、取代的氨基、氨酰基、酰氨基、烷芳基、芳基、芳氧基、叠氮基、羧基、羧基酯、氰基、卤素、硝基、杂芳基、杂芳氧基、杂环基、杂环氧基、氨基酰氧基、氧酰氨基、硫代烷氧基、取代的硫代烷氧基、硫代芳氧基、硫代杂芳氧基、磺酰基氨基、-so-烷基、-so-取代的烷基、-so-芳基、-so-杂芳基、-so
2-烷基、-so
2-取代的烷基、-so
2-芳基和-so
2-杂芳基和三卤甲基。
[0204]
杂芳基基团的示例包括但不限于吡咯、咪唑、吡唑、吡啶、吡嗪、嘧啶、哒嗪、吲哚嗪、异吲哚、吲哚、嘌呤、异喹啉、喹啉、酞嗪、萘啶、喹喔啉、喹唑啉、噌啉、蝶啶、咔唑、咔啉、菲啶、吖啶、菲咯啉、异噻唑、吩嗪、异噁唑、吩噁嗪、吩噻嗪、哌啶、哌嗪、邻苯二甲酰亚胺、4,5,6,7-四氢苯并[b]噻吩、噻唑、噻吩、苯并[b]噻吩等。
[0205]“杂环”、“杂环状”、“杂环烷基”或“杂环基”是指具有单环或多个稠环(包括稠环系、桥环系或螺环系)并且具有3至20个环原子(包括1至10个杂原子)的饱和或部分不饱和基团。这些环原子选自由碳、氮、硫或氧组成的组,其中,在稠环系中,环中的一个或多个可以为环烷基、芳基或杂芳基,条件是附接点穿过非芳族环。在某些实施方案中,杂环基团的氮和/或硫原子任选地被氧化以提供n-氧化物、-s(o)-或
–
so
2-部分。
[0206]
杂环的示例包括但不限于氮杂环丁烷、二氢吲哚、吲唑、喹嗪、咪唑烷、咪唑啉、哌啶、哌嗪、吲哚啉、1,2,3,4-四氢异喹啉、噻唑烷、吗啉基、硫代吗啉基(也称为噻吗啉基)、1,1-二氧代硫代吗啉基、哌啶基、吡咯烷、四氢呋喃基等。
[0207]
当杂芳基或杂环基团被“取代”时,除非杂芳基或杂环取代基的定义另有限制,否则此类杂芳基或杂环基团可以被1至5个或1至3个取代基取代,这些取代基选自烷基、取代的烷基、烷氧基、取代的烷氧基、环烷基、取代的环烷基、环烯基、取代的环烯基、酰基、酰氨基、酰氧基、氨基、取代的氨基、氨酰基、氨基酰氧基、叠氮基、氰基、卤素、羟基、氧代、硫代酮、羧基、羧基酯、硫代芳氧基、硫代杂芳氧基、硫代杂环氧基、硫醇、硫代烷氧基、取代的硫
代烷氧基、芳基、芳氧基、杂芳基、杂芳氧基、杂环基、杂环氧基、羟基氨基、烷氧基氨基、硝基、磺酰基氨基、-so-烷基、-so-取代的烷基、-so-芳基、-so-杂芳基、-so-杂环基、-so
2-烷基、-so
2-取代的烷基、-so
2-芳基、―so2―杂芳基和-so
2-杂环基。
[0208]“聚亚烷基二醇”是指直链或支链聚亚烷基二醇聚合物,诸如聚乙二醇、聚丙二醇和聚丁二醇。聚亚烷基二醇亚基是单个聚亚烷基二醇单元。例如,聚乙二醇亚基的示例是在链终止点用氢封端的乙二醇-o-ch
2-ch
2-o-或丙二醇―o―ch2―ch2―ch2―o―。聚(亚烷基二醇)的其他示例包括但不限于peg、peg衍生物,诸如甲氧基聚(乙二醇)(mpeg)、聚(环氧乙烷)、ppg、聚(四亚甲基二醇)、聚(环氧乙烷-共-环氧丙烷)或它们的共聚物和组合。
[0209]“多胺”是指在单体单元中具有胺官能团或者结合到主链中(如在聚亚烷基亚胺中)或侧基中(如在聚乙烯胺中)的胺官能团的聚合物。
[0210]
除了本文的公开内容之外,术语“取代的”在用于修饰指定基团或自由基时,还可以表示指定基团或自由基的一个或多个氢原子各自彼此独立地被如下定义的相同或不同取代基替换。
[0211]
除非另有说明,否则除了关于本文的各个术语公开的基团外,用于取代指定基团或自由基中的饱和碳原子上的一个或多个氢(单个碳上的任何两个氢都可以被=o、=nr
70
、=n-or
70
、=n2或=s替换)的取代基团为-r
60
、卤基、=o、-or
70
、-sr
70
、-nr
80r80
、三卤甲基、-cn、-ocn、-scn、-no、-no2、=n2、-n3、-s(o)r
70
、-s(o)2r
70
、-so3–m
、-s(o)2or
70
、-os(o)2r
70
、-oso3–m
、-os(o)2or
70
、-po
32
–
(m
)2、-p(o)(or
70
)o
–m
、-p(o)(or
70
)2、-c(o)r
70
、-c(s)r
70
、-c(nr
70
)r
70
、-c(o)o
–m
、-c(o)or
70
、-c(s)or
70
、-c(o)nr
80r80
、-c(nr
70
)nr
80r80
、-oc(o)r
70
、-oc(s)r
70
、-oc(o)o-m
、-oc(o)or
70
、-oc(s)or
70
、-nr
70
c(o)r
70
、-nr
70
c(s)r
70
、-nr
70
co2–m
、-nr
70
co2r
70
、-nr
70
c(s)or
70
、-nr
70
c(o)nr
80r80
、-nr
70
c(nr
70
)r
70
和-nr
70
c(nr
70
)nr
80r80
,其中r
60
选自由任选取代的烷基、环烷基、杂环烷基、杂环烷基烷基、环烷基烷基、芳基、芳基烷基、杂芳基和杂芳基烷基组成的组,每个r
70
独立地为氢或r
60
;每个r
80
独立地为r
70
,或者另选地两个r
80
'与它们所键合的氮原子一起形成3、4、5、6或7元杂环烷基,该杂环烷基可任选地包括1至4个相同或不同的另外的选自由o、n和s组成的组的杂原子,其中n可具有
–
h、c
1-c4烷基、-c(o)c
1-4
烷基、-co2c
1-4
烷基或-s(o)2c
1-4
烷基取代;并且每个m
为具有净单正电荷的抗衡离子。每个m
可独立地为例如碱离子,诸如k
、na
、li
;铵离子,诸如
n(r
60
)4;或者碱土金属离子,诸如[ca
2
]
0.5
、[mg
2
]
0.5
或[ba
2
]
0.5
("下标0.5表示此类二价碱土金属离子的抗衡离子中的一种可以是实施方案的化合物的电离形式和另一种典型的抗衡离子诸如氯离子,或者本文所公开的两种电离化合物可以用作此类二价碱土金属离子的抗衡离子,或者实施方案的双电离化合物可以用作此类二价碱土金属离子的抗衡离子)。
[0212]
除非另有说明,否则除了本文的公开内容外,“取代的”烯烃、炔烃、芳基和杂芳基基团中的不饱和碳原子上的氢的取代基团为-r
60
、卤基、-o
–m
、-or
70
、-sr
70
、-s
–m
、-nr
80r80
、三卤甲基、-cf3、―cn、-ocn、-scn、-no、-no2、-n3、-s(o)r
70
、-s(o)2r
70
、-so3–m
、-so3r
70
、-os(o)2r
70
、-oso3–m
、-oso3r
70
、-po
32
–
(m
)2、-p(o)(or
70
)o
–m
、-p(o)(or
70
)2、-c(o)r
70
、-c(s)r
70
、-c(nr
70
)r
70
、-co2–m
、-co2r
70
、-c(s)or
70
、-c(o)nr
80r80
、-c(nr
70
)nr
80r80
、-oc(o)r
70
、-oc(s)r
70
、-oco2–m
、-oco2r
70
、-oc(s)or
70
、-nr
70
c(o)r
70
、-nr
70
c(s)r
70
、-nr
70
co2–m
、-nr
70
co2r
70
、-nr
70
c(s)or
70
、-nr
70
c(o)nr
80r80
、-nr
70
c(nr
70
)r
70
和-nr
70
c(nr
70
)nr
80r80
,其中r
60
、r
70
、r
80
和m
如前定义,条件是在取代的烯烃或炔烃的情况下,取代基不为-o
–m
、-or
70
,-sr
70
或-s
–m
。
[0213]
除非另有说明,否则除了关于本文的各个术语公开的取代基团外,“取代的”杂环烷基和环烷基基团中的氮原子上的氢的取代基为-r
60
、-o
–m
、-or
70
、-sr
70
、-s
–m
、-nr
80r80
、三卤甲基、-cf3、-cn、-no、-no2、-s(o)r
70
、-s(o)2r
70
、-s(o)2o
–m
、-s(o)2or
70
、-os(o)2r
70
、-os(o)2o
–m
、-os(o)2or
70
、-po
32
–
(m
)2、-p(o)(or
70
)o
–m
、-p(o)(or
70
)(or
70
)、-c(o)r
70
、-c(s)r
70
、-c(nr
70
)r
70
、-c(o)or
70
、-c(s)or
70
、-c(o)nr
80r80
、-c(nr
70
)nr
80r80
、-oc(o)r
70
、-oc(s)r
70
、-oc(o)or
70
、-oc(s)or
70
、-nr
70
c(o)r
70
、-nr
70
c(s)r
70
、-nr
70
c(o)or
70
、-nr
70
c(s)or
70
、-nr
70
c(o)nr
80r80
、-nr
70
c(nr
70
)r
70
和-nr
70
c(nr
70
)nr
80r80
,其中r
60
、r
70
、r
80
和m
如前定义。
[0214]
除了本文的公开内容外,在某些实施方案中,被取代的基团具有1、2、3或4个取代基,1、2或3个取代基,1或2个取代基,或者1个取代基。
[0215]
据了解,在以上定义的所有取代的基团中,通过定义具有针对本身的其他取代基的取代基(例如,具有本身被取代的芳基取代的取代的芳基作为取代基的取代的芳基,其进一步被取代的芳基取代等)得到的聚合物不意图包括在本文中。在此类情况下,此类取代的最大数量为三。例如,本文特别考虑的取代的芳基基团的连续取代限于取代的芳基-(取代的芳基)-取代的芳基。
[0216]
除非另外指明,否则本文未明确定义的取代基的命名是通过命名官能团的末端部分然后命名靠近附接点的相邻官能团来获得的。例如,取代基“芳基烷基氧基羰基”是指基团(芳基)-(烷基)-o-c(o)-。
[0217]
对于本文所公开的含有一个或多个取代基的任何基团,当然应当理解,此类基团不含有空间上不切实际和/或合成上不可行的任何取代或取代模式。另外,主题化合物包括由这些化合物的取代产生的所有立体化学异构体。
[0218]
术语“药学上可接受的盐”是指对于向患者(诸如哺乳动物)施用可接受的盐(对于给定剂量方案具有可接受的哺乳动物安全性的具有抗衡离子的盐)。此类盐可以衍生自药学上可接受的无机或有机碱和药学上可接受的无机或有机酸。“药学上可接受的盐”是指化合物的药学上可接受的盐,这些盐衍生自本领域公知的多种有机和无机抗衡离子,举例来说包括钠、钾、钙、镁、铵、四烷基铵等;并且当分子含有碱性官能团时,包括有机或无机酸的盐,诸如盐酸盐、氢溴酸盐、甲酸盐、酒石酸盐、苯磺酸盐、甲磺酸盐、乙酸盐、马来酸盐、草酸盐等。
[0219]
术语“其盐”是指当酸的质子被阳离子诸如金属阳离子或有机阳离子等替换时形成的化合物。在适用情况下,盐是药学上可接受的盐,尽管这对于不旨在向患者施用的中间体化合物的盐来说不是必需的。举例来说,本发明化合物的盐包括其中化合物被无机或有机酸质子化以形成阳离子的盐,该无机或有机酸的共轭碱作为盐的阴离子组分。
[0220]“溶剂化物”是指溶剂分子与溶质的分子或离子结合形成的复合物。溶剂可以是有机化合物、无机化合物或两者的混合物。溶剂的一些示例包括但不限于甲醇、n,n-二甲基甲酰胺、四氢呋喃、二甲亚砜和水。当溶剂是水时,形成的溶剂化物是水合物。
[0221]“立体异构体”是指原子连接性相同但在空间中原子排列不同的化合物。立体异构体包括顺反异构体、e和z异构体、对映异构体和非对映异构体。
[0222]“互变异构体”是指仅在原子的电子键合和/或质子的位置上不同的分子的替代形式(诸如烯醇-酮和亚胺-烯胺互变异构体),或含有-n=c(h)-nh-环原子排列的杂芳基基团
的互变异构形式(诸如吡唑、咪唑、苯并咪唑、三唑和四唑)。本领域普通技术人员将认识到,其他互变异构环原子排列是可能的。
[0223]
应当理解,术语“或其盐或溶剂化物或互变异构体或立体异构体”旨在包括盐、溶剂化物、互变异构体和立体异构体的所有排列,诸如主题化合物的立体异构体的互变异构体的药学上可接受的盐的溶剂化物。
[0224]
应当理解,本文所述的本发明的方面和实施方案包括“由方面和实施方案组成”和/或“基本上由方面和实施方案组成”。
[0225]
本文提及“约”某一值或参数包括(并且描述)针对该值或参数本身的变化。例如,提及“约x”的描述包括对“x”的描述。
[0226]
本文所用的术语“约x-y”与“约x至约y”具有相同含义。
[0227]
如本文所用,提及“不为”某一值或参数通常意指并且描述某一值或参数“以外”。举例来说,该方法不用于治疗x类型的癌症意指该方法用于治疗x以外的类型的癌症。
[0228]
除非上下文另有明确规定,否则如本文和所附权利要求中所用,单数形式“一个”、“一种”和“该”包括复数指示物。
[0229]
应当理解,为了清楚起见而在单独的实施方案的上下文中描述的本发明的某些特征还可在单个实施方案中组合提供。相反,为了简洁起见而在单个实施方案的上下文中描述的本发明的各种特征也可单独或以任何合适的子组合提供。与fao活化剂及其使用方法有关的实施方案的所有组合都特别包含在本技术中并在本文中公开,就好像每个和每种组合在本文中单独且明确地公开一样。
[0230]
ii.组织再生的方法
[0231]
本技术提供了在体外或体内使用一种或多种脂肪酸氧化活化剂(“fao活化剂”)进行组织(例如,肌肉)再生的方法。本文所述的方法可以促进损伤后和无损伤的组织再生(即无创伤组织再生)。
[0232]
在一些实施方案中,提供了一种促进组织(例如,肌肉组织)再生的方法,该方法包括使组织与fao活化剂接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使组织与fao活化剂接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,fao活化剂是fao途径或脂质代谢途径中的基因的活化剂。在一些实施方案中,fao活化剂是选自由以下项组成的组的基因的活化剂:pparα、pparδ、pparγ、rxrb、rxrg、ncoa1、ncoa2、fabp3、fabp4、cd36、scarb1、fatp1、fatp2、fatp3、fatp4、fatp5、fatp6、lpl、cpt1a、cpt1b、cpt1c、cpt2、crat、acad(例如,acad1、acad2、acad3、acad4、acad5、acad6、acad7、acad8、acad9、acad10、acad11、mcad、lcad、vlcad)、hadh(例如,hadha、hadhb)、etfa和etfb。在一些实施方案中,该方法包括使组织与两种或更多种fao活化剂接触。在一些实施方案中,组织来自老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,组织是损伤组织。在一些实施方案中,组织未经历损伤。
[0233]
在一些实施方案中,提供了一种促进组织(例如,肌肉组织)再生的方法,该方法包括使组织与pparγ激动剂接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使组织与pparγ激动剂接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,pparγ激
动剂是罗格列酮或其盐、溶剂化物、互变异构体或立体异构体。在一些实施方案中,组织来自老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,组织是损伤组织。在一些实施方案中,组织未经历损伤。
[0234]
在一些实施方案中,提供了一种促进组织(例如,肌肉组织)再生的方法,该方法包括使组织与选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组的前列腺素接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使组织与前列腺素接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,组织来自老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,组织是损伤组织。在一些实施方案中,组织未经历损伤。
[0235]
在一些实施方案中,提供了一种促进组织(例如,肌肉组织)再生的方法,该方法包括使组织与pparγ激动剂(例如,罗格列酮)和选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组的前列腺素接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使组织与pparγ激动剂和前列腺素接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,组织来自老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,组织是损伤组织。在一些实施方案中,组织未经历损伤。
[0236]
在一些实施方案中,提供了一种促进肌肉组织再生的方法,该方法包括使肌肉组织与一种或多种fao活化剂接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使肌肉组织与fao活化剂接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,一种或多种fao活化剂包括fao途径或脂质代谢途径中的基因的活化剂。在一些实施方案中,一种或多种fao活化剂包括一种或多种pparγ.活化剂。在一些实施方案中,一种或多种pparγ活化剂包括pparγ激动剂,诸如罗格列酮。在一些实施方案中,一种或多种pparγ活化剂包括选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组的前列腺素。在一些实施方案中,一种或多种pparγ活化剂包括罗格列酮和pgi2或罗格列酮和曲前列环素。在一些实施方案中,肌肉组织来自老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,肌肉组织是损伤组织。在一些实施方案中,肌肉组织未经历损伤。
[0237]
在一些实施方案中,提供了一种促进组织(例如,肌肉组织)生长的方法,该方法包括使组织与fao活化剂接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使组织与fao活化剂接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,fao活化剂是fao途径或脂质代谢途径中的基因的活化剂。在一些实施方案中,fao活化剂是选自由以下项组成的组的基因的活化剂:pparα、pparδ、pparγ、rxrb、rxrg、ncoa1、ncoa2、fabp3、fabp4、cd36、scarb1、fatp1、fatp2、fatp3、fatp4、fatp5、fatp6、lpl、cpt1a、cpt1b、cpt1c、cpt2、crat、acad(例如,acad1、acad2、acad3、acad4、acad5、acad6、acad7、acad8、acad9、acad10、acad11、mcad、lcad、vlcad)、hadh(例如,hadha、hadhb)、etfa和etfb。在一些实施方案中,该方法包括使组织与两种或更多种fao活化剂接触。在一些实施方案中,肌肉组织来自老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,组织是损伤组织。在一些实施方案中,组织未经历损伤。
[0238]
在一些实施方案中,提供了一种促进组织(例如,肌肉组织)生长的方法,该方法包括使组织与pparγ激动剂接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使组织与pparγ激动剂接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,pparγ激动剂是罗格列酮或其盐、溶剂化物、互变异构体或立体异构体。在一些实施方案中,组织来自老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,组织是损伤组织。在一些实施方案中,组织未经历损伤。
[0239]
在一些实施方案中,提供了一种促进组织(例如,肌肉组织)生长的方法,该方法包括使组织与选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组的前列腺素接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使组织与前列腺素接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,组织来自老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,组织是损伤组织。在一些实施方案中,组织未经历损伤。
[0240]
在一些实施方案中,提供了一种促进组织(例如,肌肉组织)生长的方法,该方法包括使组织与pparγ激动剂(例如,罗格列酮)和选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组的前列腺素接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使组织与pparγ激动剂和前列腺素接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,组织来自老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,组织是损伤组织。在一些实施方案中,组织未经历损伤。
[0241]
在一些实施方案中,提供了一种促进肌肉组织生长的方法,该方法包括使肌肉组织与一种或多种fao活化剂接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使肌肉组织与fao活化剂接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,一种或多种fao活化剂包括fao途径或脂质代谢途径中的基因的活化剂。在一些实施方案中,一种或多种fao活化剂包括一种或多种pparγ.活化剂。在一些实施方案中,一种或多种pparγ活化剂包括pparγ激动剂,诸如罗格列酮。在一些实施方案中,一种或多种pparγ活化剂包括选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组的前列腺素。在一些实施方案中,一种或多种pparγ活化剂包括罗格列酮和pgi2或罗格列酮和曲前列环素。在一些实施方案中,肌肉组织来自老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,肌肉组织是损伤组织。在一些实施方案中,肌肉组织未经历损伤。
[0242]
在一些实施方案中,提供了一种增加组织形成细胞(例如,生肌细胞,诸如成肌细胞或肌细胞)中的h3k9ac、ki67、myod、myog、myh7和/或myh8表达的方法,该方法包括使组织形成细胞与fao活化剂接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使组织形成细胞与fao活化剂接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,fao活化剂是fao途径或脂质代谢途径中的基因的活化剂。在一些实施方案中,fao活化剂是选自由以下项组成的组的基因的活化剂:pparα、pparδ、pparγ、rxrb、rxrg、ncoa1、ncoa2、fabp3、fabp4、cd36、scarb1、fatp1、fatp2、fatp3、fatp4、fatp5、fatp6、lpl、cpt1a、cpt1b、crat、
cpt1c、cpt2、acad(例如,acad1、acad2、acad3、acad4、acad5、acad6、acad7、acad8、acad9、acad10、acad11、mcad、lcad、vlcad)、hadh(例如,hadha、hadhb)、etfa和etfb。在一些实施方案中,该方法包括使组织形成细胞与两种或更多种fao活化剂接触。
[0243]
在一些实施方案中,提供了一种增加组织形成细胞(例如,生肌细胞,诸如成肌细胞或肌细胞)中的h3k9ac、ki67、myod、myog、myh7和/或myh8表达的方法,该方法包括使组织形成细胞与pparγ激动剂接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使组织形成细胞与pparγ激动剂接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,pparγ激动剂是罗格列酮或其盐、溶剂化物、互变异构体或立体异构体。
[0244]
在一些实施方案中,提供了一种增加组织形成细胞(例如,生肌细胞,诸如成肌细胞或肌细胞)中的h3k9ac、ki67、myod、myog、myh7和/或myh8表达的方法,该方法包括使组织形成细胞与选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组的前列腺素接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使组织形成细胞与前列腺素接触不超过约72小时、不超过约48小时或不超过约24小时。
[0245]
在一些实施方案中,提供了一种增加组织形成细胞(例如,生肌细胞,诸如成肌细胞或肌细胞)中的h3k9ac、ki67、myod、myog、myh7和/或myh8表达的方法,该方法包括使组织形成细胞与pparγ激动剂(例如,罗格列酮)和选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组的前列腺素接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使组织形成细胞与pparγ激动剂和前列腺素接触不超过约72小时、不超过约48小时或不超过约24小时。
[0246]
在一些实施方案中,提供了一种促进肌肉组织中的肌生成的方法,该方法包括使肌肉组织与fao活化剂接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使肌肉组织与fao活化剂接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,fao活化剂是fao途径或脂质代谢途径中的基因的活化剂。在一些实施方案中,fao活化剂是选自由以下项组成的组的基因的活化剂:pparα、pparδ、pparγ、rxrb、rxrg、ncoa1、ncoa2、fabp3、fabp4、cd36、scarb1、fatp1、fatp2、fatp3、fatp4、fatp5、fatp6、lpl、cpt1a、cpt1b、cpt1c、cpt2、crat、acad(例如,acad1、acad2、acad3、acad4、acad5、acad6、acad7、acad8、acad9、acad10、acad11、mcad、lcad、vlcad)、hadh(例如,hadha、hadhb)、etfa和etfb。在一些实施方案中,该方法包括使肌肉组织与两种或更多种fao活化剂接触。在一些实施方案中,肌肉组织来自老年个体(例如,至少约50岁的人类个体)。
[0247]
在一些实施方案中,提供了一种促进组织肌肉组织中的肌生成的方法,该方法包括使肌肉组织与pparγ激动剂接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使肌肉组织与pparγ激动剂接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,pparγ激动剂是罗格列酮或其盐、溶剂化物、互变异构体或立体异构体。在一些实施方案中,肌肉组织来自老年个体(例如,至少约50岁的人类个体)。
[0248]
在一些实施方案中,提供了一种促进肌肉组织中的肌生成的方法,该方法包括使
肌肉组织与选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组的前列腺素接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使肌肉组织与前列腺素接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,肌肉组织来自老年个体(例如,至少约50岁的人类个体)。
[0249]
在一些实施方案中,提供了一种促进肌肉组织中的肌生成的方法,该方法包括使肌肉组织与选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组的前列腺素接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使肌肉组织与pparγ激动剂和前列腺素接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,肌肉组织来自老年个体(例如,至少约50岁的人类个体)。
[0250]
在一些实施方案中,提供了一种诱导组织(例如,肌肉组织)中的组织形成细胞(例如,生肌细胞,诸如成肌细胞和/或肌细胞)分化和/或成熟的方法,该方法包括使组织与fao活化剂接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使组织与fao活化剂接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,fao活化剂是fao途径或脂质代谢途径中的基因的活化剂。在一些实施方案中,fao活化剂是选自由以下项组成的组的基因的活化剂:pparα、pparδ、pparγ、rxrb、rxrg、ncoa1、ncoa2、fabp3、fabp4、cd36、scarb1、fatp1、fatp2、fatp3、fatp4、fatp5、fatp6、lpl、cpt1a、cpt1b、cpt1c、cpt2、crat、acad(例如,acad1、acad2、acad3、acad4、acad5、acad6、acad7、acad8、acad9、acad10、acad11、mcad、lcad、vlcad)、hadh(例如,hadha、hadhb)、etfa和etfb。在一些实施方案中,该方法包括使组织与两种或更多种fao活化剂接触。在一些实施方案中,组织来自老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,组织是损伤组织。在一些实施方案中,组织未经历损伤。
[0251]
在一些实施方案中,提供了一种诱导组织(例如,肌肉组织)中的组织形成细胞(例如,生肌细胞,诸如成肌细胞和/或肌细胞)分化和/或成熟的方法,该方法包括使组织与pparγ激动剂接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使组织与pparγ激动剂接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,pparγ激动剂是罗格列酮或其盐、溶剂化物、互变异构体或立体异构体。在一些实施方案中,组织来自老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,组织是损伤组织。在一些实施方案中,组织未经历损伤。
[0252]
在一些实施方案中,提供了一种诱导组织(例如,肌肉组织)中的组织形成细胞(例如,生肌细胞,诸如成肌细胞和/或肌细胞)分化和/或成熟的方法,该方法包括使组织与选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组的前列腺素接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使组织与前列腺素接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,组织来自老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,组织是损伤组织。在一些实施方案中,组织未经历损伤。
[0253]
在一些实施方案中,提供了一种诱导组织(例如,肌肉组织)中的组织形成细胞(例如,生肌细胞,诸如成肌细胞和/或肌细胞)分化和/或成熟的方法,该方法包括使组织与pparγ激动剂(例如,罗格列酮)和选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)的前列腺素接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使组织与pparγ激动剂和前列腺素接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,组织来自老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,组织是损伤组织。在一些实施方案中,组织未经历损伤。
[0254]
在一些实施方案中,提供了一种诱导肌肉组织中的生肌细胞(例如,成肌细胞或肌细胞)分化和/或成熟的方法,该方法包括使肌肉组织与一种或多种fao活化剂接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使肌肉组织与fao活化剂接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,一种或多种fao活化剂包括fao途径或脂质代谢途径中的基因的活化剂。在一些实施方案中,一种或多种fao活化剂包括一种或多种pparγ.活化剂。在一些实施方案中,一种或多种pparγ活化剂包括pparγ激动剂,诸如罗格列酮。在一些实施方案中,一种或多种pparγ活化剂包括选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组的前列腺素。在一些实施方案中,一种或多种pparγ活化剂包括罗格列酮和pgi2或罗格列酮和曲前列环素。在一些实施方案中,肌肉组织来自老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,肌肉组织是损伤组织。在一些实施方案中,肌肉组织未经历损伤。
[0255]
在一些实施方案中,提供了一种诱导组织(例如,肌肉组织)中的干细胞(例如,肌肉干细胞)或组织形成细胞(例如,肌肉祖细胞)增殖的方法,该方法包括使组织与fao活化剂接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使组织与fao活化剂接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,fao活化剂是fao途径或脂质代谢途径中的基因的活化剂。在一些实施方案中,fao活化剂是选自由以下项组成的组的基因的活化剂:pparα、pparδ、pparγ、rxrb、rxrg、ncoa1、ncoa2、fabp3、fabp4、cd36、scarb1、fatp1、fatp2、fatp3、fatp4、fatp5、fatp6、lpl、cpt1a、cpt1b、cpt1c、cpt2、crat、acad(例如,acad1、acad2、acad3、acad4、acad5、acad6、acad7、acad8、acad9、acad10、acad11、mcad、lcad、vlcad)、hadh(例如,hadha、hadhb)、etfa和etfb。在一些实施方案中,该方法包括使组织与两种或更多种fao活化剂接触。在一些实施方案中,组织来自老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,组织是损伤组织。在一些实施方案中,组织未经历损伤。
[0256]
在一些实施方案中,提供了一种诱导组织(例如,肌肉组织)中的干细胞(例如,肌肉干细胞)或组织形成细胞(例如,肌肉祖细胞)增殖的方法,该方法包括使组织与pparγ激动剂接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使组织与pparγ激动剂接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,pparγ激动剂是罗格列酮或其盐、溶剂化物、互变异构体或立体异构体。在一些实施方案中,组织来自老年个体(例如,至
少约50岁的人类个体)。在一些实施方案中,组织是损伤组织。在一些实施方案中,组织未经历损伤。
[0257]
在一些实施方案中,提供了一种诱导组织(例如,肌肉组织)中的干细胞(例如,肌肉干细胞)或组织形成细胞(例如,肌肉祖细胞)增殖的方法,该方法包括使组织与选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组的前列腺素接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使组织与前列腺素接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,组织来自老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,组织是损伤组织。在一些实施方案中,组织未经历损伤。
[0258]
在一些实施方案中,提供了一种诱导组织(例如,肌肉组织)中的干细胞(例如,肌肉干细胞)或组织形成细胞(例如,肌肉祖细胞)增殖的方法,该方法包括使组织与pparγ激动剂(例如,罗格列酮)和选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组的前列腺素接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使组织与pparγ激动剂和前列腺素接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,组织来自老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,组织是损伤组织。在一些实施方案中,组织未经历损伤。
[0259]
在一些实施方案中,提供了一种诱导肌肉组织中的肌肉干细胞或生肌细胞(例如,肌肉祖细胞)增殖的方法,该方法包括使肌肉组织与一种或多种fao活化剂接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使肌肉组织与fao活化剂接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,一种或多种fao活化剂包括fao途径或脂质代谢途径中的基因的活化剂。在一些实施方案中,一种或多种fao活化剂包括一种或多种pparγ.活化剂。在一些实施方案中,一种或多种pparγ活化剂包括pparγ激动剂,诸如罗格列酮。在一些实施方案中,一种或多种pparγ活化剂包括选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组的前列腺素。在一些实施方案中,一种或多种pparγ活化剂包括罗格列酮和pgi2或罗格列酮和曲前列环素。在一些实施方案中,肌肉组织来自老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,肌肉组织是损伤组织。在一些实施方案中,肌肉组织未经历损伤。
[0260]
可使用本领域已知的方法评估组织再生、组织生长、干细胞和组织形成细胞的增殖以及组织形成细胞的分化和成熟。例如,可通过使用显微镜检查评估细胞形态(例如,肌管厚度)或通过评估成肌标志物(诸如pax7,myod(myod1)、成肌素(myog)、myf5(myf5)、mrf4(myf6)、α肌动蛋白1(acta1)、α辅肌动蛋白2(actn2)、成年i型肌球蛋白重链(myh7)、成年iia型肌球蛋白重链(myh2)、成年iib型肌球蛋白重链(myh4)、成年iix型肌球蛋白重链(myh1)、胚胎肌球蛋白重链(myh3)、围产期肌球蛋白重链(myh8)、泛肌球蛋白重链(mhc)、肌球蛋白轻链(mlc)和肌钙蛋白)的表达水平(例如,mrna和/或蛋白质水平)或通过评估增殖标志物(诸如ki67)的表达水平来评估肌肉再生、肌肉生长、肌生成、肌肉干细胞的增殖以及生肌细胞的分化和成熟。可通过免疫染色或蛋白质印迹来确定蛋白质表达水平。可通过定量逆转录pcr、微阵列或下一代测序来确定mrna表达水平。
[0261]
在一些实施方案中,提供了一种增加组织形成细胞(诸如生肌细胞,例如成肌细胞或肌细胞)中的线粒体氧气消耗的方法,该方法包括使组织形成细胞(诸如生肌细胞,例如成肌细胞或肌细胞)与pparγ活化剂接触不超过约72小时。在一些实施方案中,pparγ活化剂是pparγ激动剂。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使组织形成细胞与pparγ激动剂接触不超过约48小时。在一些实施方案中,使组织形成细胞与pparγ激动剂接触不超过约24小时。在一些实施方案中,pparγ激动剂是罗格列酮或其盐、溶剂化物、互变异构体或立体异构体。在一些实施方案中,pparγ活化剂是选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组的前列腺素。在一些实施方案中,该方法包括使生肌细胞与pparγ的两种或更多种活化剂(pparγ激动剂(例如,罗格列酮)和选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组的前列腺素)接触。
[0262]
可使用本领域已知的任何方法(例如,通过seahorse分析)来确定线粒体氧气消耗。在一些实施方案中,该方法增加了最大线粒体氧气消耗。在一些实施方案中,该方法增加了基础线粒体氧气消耗。在一些实施方案中,该方法增加了最大线粒体氧气消耗和基础线粒体氧气消耗。在一些实施方案中,线粒体氧气消耗增加10%、20%、50%、2倍、3倍、5倍、10倍或更多中的任一种,包括这些值之间的任何值或范围。
[0263]
在一些实施方案中,提供了一种增加组织形成细胞(诸如生肌细胞,例如成肌细胞或肌细胞)中的fao的方法,该方法包括使组织形成细胞(诸如生肌细胞,例如成肌细胞或肌细胞)与pparγ活化剂接触不超过约72小时。在一些实施方案中,pparγ活化剂是pparγ激动剂。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使组织形成细胞与pparγ激动剂接触不超过约48小时。在一些实施方案中,使组织形成细胞与pparγ激动剂接触不超过约24小时。在一些实施方案中,pparγ激动剂是罗格列酮或其盐、溶剂化物、互变异构体或立体异构体。在一些实施方案中,pparγ活化剂是选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组的前列腺素。在一些实施方案中,该方法包括使生肌细胞与pparγ的两种或更多种活化剂(pparγ激动剂(例如,罗格列酮)和选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组的前列腺素)接触。
[0264]
可使用本领域已知的任何方法(例如,通过使用质谱的代谢组学和脂质组学分析)来确定fao的水平。在一些实施方案中,fao的水平增加10%、20%、50%、2倍、3倍、5倍、10倍或更多中的任一种,包括这些值之间的任何值或范围。
[0265]
本文所述的方法中所用的fao活化剂(包括pparγ活化剂,诸如pparγ激动剂和前列腺素)可具有下文在章节iv“脂肪酸氧化活化剂”中描述的特征中的任何特征或这些特征的组合。
[0266]
在一些实施方案中,组织(例如,肌肉组织)或组织形成细胞(例如,生肌细胞)与一种或多种fao活化剂(包括pparγ活化剂,诸如pparγ激动剂和前列腺素)的接触是瞬时的。本文所用的“瞬时”不超过72小时,诸如不超过约60小时、48小时、36小时、24小时、12小时或6小时中的任一种,包括这些值之间的任何值或范围。在一些实施方案中,使组织(例如,肌肉组织)或组织形成细胞(例如,生肌细胞)与一种或多种fao活化剂接触不超过约24小时。在一些实施方案中,使组织(例如,肌肉组织)或组织形成细胞(例如,生肌细胞)与一种或多
种fao活化剂接触不超过约48小时。
[0267]
在一些实施方案中,在使组织(例如,肌肉组织)或组织形成细胞(例如,生肌细胞)经受诱导组织再生(例如,肌生成,诸如诱导生肌细胞的分化和/或成熟)的条件之后,在约0、1、2、4、6、12、18、24、36、48、60或72小时中的任一种(包括这些值之间的任何值或范围)使组织(例如,肌肉组织)或组织形成细胞(例如,生肌细胞)与一种或多种fao活化剂接触。在一些实施方案中,在使组织(例如,肌肉组织)或组织形成细胞(例如,生肌细胞)经受诱导组织再生(例如,肌生成,诸如诱导生肌细胞的分化和/或成熟)的条件之后,在约0小时与24小时之间使组织(例如,肌肉组织)或组织形成细胞(例如,生肌细胞)与一种或多种fao活化剂接触。在一些实施方案中,在使组织(例如,肌肉组织)或组织形成细胞(例如,生肌细胞)经受诱导组织再生(例如,肌生成,诸如诱导生肌细胞的分化和/或成熟)的条件之后,在约0小时与48小时之间使组织(例如,肌肉组织)或组织形成细胞(例如,生肌细胞)与一种或多种fao活化剂接触。在一些实施方案中,在使组织(例如,肌肉组织)或组织形成细胞(例如,生肌细胞)经受诱导组织再生(例如,肌生成,诸如诱导生肌细胞的分化和/或成熟)的条件之后,在约24小时与48小时之间使组织(例如,肌肉组织)或组织形成细胞(例如,生肌细胞)与一种或多种fao活化剂接触。
[0268]
诱导组织再生(诸如肌生成)的示例性条件包括例如在分化培养基中(诸如在补充有约2%敲除血清替代物或约2%马血清和1%l-谷氨酰胺的dmem/f12或dmem培养基中)培养。
[0269]
在一些实施方案中,提供了一种增加线粒体脂肪酸氧化的活性以促进人肌细胞早期细胞分化的方法。
[0270]
在一些实施方案中,提供了一种增加线粒体氧气消耗以促进人肌细胞早期细胞分化的方法。
[0271]
在一些实施方案中,提供了一种增加pparγ活性以促进人肌细胞早期细胞分化的方法。
[0272]
在一些实施方案中,瞬时增加线粒体脂肪酸氧化增加成肌分化。在一些实施方案中,瞬时增加myod1促进成肌分化。在一些实施方案中,瞬时活化pparγ通过瞬时增加线粒体脂肪酸氧化来促进成肌分化。
[0273]
例如,在示例性细胞培养条件下在0-24小时时间窗内对肌细胞进行罗格列酮处理独特地上调了成肌素(myog)、成年i型肌球蛋白重链(myh7)和围产期肌球蛋白重链(myh8)的mrna水平,而在其他时间窗处理在96小时结束时没有显著影响。在示例性培养条件下在0-24小时和24-48小时时间窗内对肌细胞进行罗格列酮处理可以显著增强肌生成。然而,罗格列酮在相同条件下在其他时间窗内会抑制肌生成。
[0274]
在一些实施方案中,与没有罗格列酮的相同培养条件相比,以高密度接种的人肌细胞与罗格列酮接触产生更成熟和肥大的人肌管。
[0275]
在一些实施方案中,提供了一种活化组织形成细胞(例如,生肌细胞)中的pparγ的方法,该方法包括使组织形成细胞与选自由前列腺素i2(pgi2)、前列腺素d2(pgd2)、它们的类似物以及它们的盐、溶剂化物、互变异构体和立体异构体组成的组的前列腺素接触。在一些实施方案中,接触是体外的。在一些实施方案中,接触是离体的。在一些实施方案中,接触是体内的。在一些实施方案中,使组织形成细胞与前列腺素接触不超过约72小时、不超过
约48小时或不超过约24小时。在一些实施方案中,该方法还包括使组织形成细胞与pparγ激动剂(例如,罗格列酮)接触。在一些实施方案中,前列腺素使pparγ表达和/或活性增加10%、20%、50%、2倍、3倍、5倍、10倍或更多中的任一种,包括这些值之间的任何值或范围。
[0276]
本文所述的方法适用于来自各种生物体(诸如人、非人灵长类动物(例如,食蟹猴、恒河猴等)、小鼠、大鼠、猫、狗、仓鼠、兔、猪、牛、山羊、绵羊、马、驴、鹿、哺乳动物、鸟类、爬行动物、两栖动物、鱼类、节肢动物、软体动物、棘皮动物、刺胞动物、线虫、环节动物、扁形动物等)的组织(例如,肌肉组织)和组织形成细胞(例如,生肌细胞)。
[0277]
在一些实施方案中,组织(例如,肌肉组织)来自个体。在一些实施方案中,组织(例如,肌肉组织)通过体外细胞培养获得。在一些实施方案中,组织(例如,肌肉组织)是损伤组织。在一些实施方案中,组织(例如,肌肉组织)未经历损伤。在一些实施方案中,组织(例如,肌肉组织)来自老年个体,诸如至少1岁、1.5岁、2岁或更大年龄的啮齿动物,或至少约50、55、60、65、70、75、80、85岁或更大年龄中任一种的人类。
[0278]
本文所述的方法适用于多种组织,包括但不限于源自内胚层、中胚层或神经外胚层的组织。在一些实施方案中,组织是结缔组织(例如,疏松结缔组织、致密结缔组织、弹性组织、网状结缔组织和脂肪组织)、肌肉组织(例如,骨骼肌、平滑肌和心肌)、泌尿生殖组织、胃肠组织、肺组织、骨组织、神经组织和上皮组织(例如,单层上皮和复层上皮)。在一些实施方案中,组织是选自由心脏、肝脏、肾脏、肺、胃、肠、膀胱和脑组成的组的器官。在一些实施方案中,组织是肝脏组织。在一些实施方案中,组织是心脏组织。在一些实施方案中,组织是皮肤组织。在一些实施方案中,组织是毛囊。在一些实施方案中,人造组织是肌肉组织。
[0279]
在一些实施方案中,组织是骨骼肌组织。在一些实施方案中,组织是非骨骼肌组织。在一些实施方案中,非骨骼肌组织是中胚层组织。在一些实施方案中,非骨骼肌组织是心脏和心肌组织。在一些实施方案中,非骨骼肌组织是内胚层组织。在一些实施方案中,非骨骼肌组织是肝脏组织。在一些实施方案中,非骨骼肌组织是神经外胚层组织。在一些实施方案中,非骨骼肌组织是皮肤组织。在一些实施方案中,非骨骼肌组织是毛囊。
[0280]
在一些实施方案中,肌肉组织包括生肌细胞,诸如成肌细胞和/或肌细胞。在一些实施方案中,肌肉组织包括至少约0.1%、0.5%、1%、2%、5%、10%、20%、30%或更多中的任一种(包括这些值之间的任何值或范围)的生肌细胞。
[0281]
在一些实施方案中,生肌细胞是成肌细胞。在一些实施方案中,生肌细胞是pax7-pax3
myod
成肌素-和/或pax7
pax3-myod
成肌素-细胞。在一些实施方案中,生肌细胞是肌细胞。在一些实施方案中,肌细胞是pax3-pax7-myod
成肌素
细胞。在一些实施方案中,生肌细胞是原代细胞。在一些实施方案中,生肌细胞来源于细胞系。在一些实施方案中,生肌细胞不是来源于细胞系。在一些实施方案中,生肌细胞不是来源于永生细胞系。
[0282]
iii.治疗方法
[0283]
本技术还提供了使用一种或多种fao活化剂治疗与组织相关的疾病或病症(例如,肌肉疾病或病症)的方法。上文在章节ii“组织再生的方法”中描述的组织再生的方法中的任一种可用于治疗与组织相关的疾病或病症。本文所用的一种或多种fao活化剂(包括pparγ活化剂,诸如pparγ激动剂和前列腺素)可具有下文在章节iv“脂肪酸氧化活化剂”中描述的特征中的任何特征或这些特征的组合。合适的疾病或病症包括但不限于肌肉减少症、恶病质、废用性萎缩、炎性肌病、肌营养不良、心肌病、皮肤起皱、顽固性皮肤溃疡、皮肤创
伤、大疱病、脱发、瘢痕疙瘩、皮炎、黄斑变性、结肠炎、肝脂肪变性、脂肪性肝炎、肝纤维化、肝硬化、胰腺炎、2型糖尿病(t2d)、脂肪营养不良、慢性阻塞性肺病(copd)、肺纤维化、急性呼吸窘迫综合征(ards)、类风湿性关节炎、骨关节炎、骨质疏松症、神经变性疾病、脑梗塞、心肌梗塞、肺梗塞、骨折、胃溃疡、肠炎、慢性肾病、肾纤维化以及其他导致组织/器官/身体部分结构和功能丧失或萎缩的遗传决定的、环境决定的或特发性疾病过程。
[0284]
fao活化剂的施用
[0285]
在一些实施方案中,提供了一种治疗个体中与组织相关的疾病或病症(例如,肌肉疾病或病症)的方法,该方法包括向个体施用有效量的包含fao活化剂的药物组合物。在一些实施方案中,疾病或病症是组织损伤。在一些实施方案中,疾病或病症是组织变性。在一些实施方案中,疾病或病症是组织纤维化。在一些实施方案中,疾病或病症是衰老。在一些实施方案中,组织选自由肌肉组织、肝脏组织、心脏组织、皮肤组织和毛囊组成的组。在一些实施方案中,每24小时、每48小时或每72小时向个体施用一次药物组合物。在一些实施方案中,向个体的组织施用药物组合物。在一些实施方案中,向个体全身(例如,口服)施用药物组合物。在一些实施方案中,fao活化剂是fao途径或脂质代谢途径中的基因的活化剂。在一些实施方案中,fao活化剂是选自由以下项组成的组的基因的活化剂:pparα、pparδ、pparγ、rxrb、rxrg、ncoa1、ncoa2、fabp3、fabp4、cd36、scarb1、fatp1、fatp2、fatp3、fatp4、fatp5、fatp6、lpl、cpt1a、cpt1b、cpt1c、cpt2、crat、acad(例如,acad1、acad2、acad3、acad4、acad5、acad6、acad7、acad8、acad9、acad10、acad11、mcad、lcad、vlcad)、hadh(例如,hadha、hadhb)、etfa和etfb。在一些实施方案中,药物组合物包含两种或更多种fao活化剂。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。在根据上述治疗方法中任一种的一些实施方案中,疾病或病症选自由以下项组成的组:肌肉减少症、恶病质、废用性萎缩、炎性肌病、肌营养不良、心肌病、皮肤起皱、顽固性皮肤溃疡、皮肤创伤、大疱病、脱发、瘢痕疙瘩、皮炎、黄斑变性、结肠炎、肝脂肪变性、脂肪性肝炎、肝纤维化、肝硬化、胰腺炎、2型糖尿病(t2d)、脂肪营养不良、慢性阻塞性肺病(copd)、肺纤维化、急性呼吸窘迫综合征(ards)、类风湿性关节炎、骨关节炎、骨质疏松症、神经变性疾病、脑梗塞、心肌梗塞、肺梗塞、骨折、胃溃疡、肠炎、慢性肾病、肾纤维化以及其他导致组织/器官/身体部分结构和功能丧失或萎缩的遗传决定的、环境决定的或特发性疾病过程。
[0286]
在一些实施方案中,提供了一种治疗个体中与组织相关的疾病或病症(例如,肌肉疾病或病症)的方法,该方法包括向个体施用有效量的包含pparγ激动剂的药物组合物。在一些实施方案中,疾病或病症是组织损伤。在一些实施方案中,疾病或病症是组织变性。在一些实施方案中,疾病或病症是组织纤维化。在一些实施方案中,疾病或病症是衰老。在一些实施方案中,组织选自由肌肉组织、肝脏组织、心脏组织、皮肤组织和毛囊组成的组。在一些实施方案中,每24小时、每48小时或每72小时向个体施用一次药物组合物。在一些实施方案中,向个体的组织施用药物组合物。在一些实施方案中,向个体全身(例如,口服)施用药物组合物。在一些实施方案中,pparγ激动剂是罗格列酮或其盐、溶剂化物、互变异构体或立体异构体。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。在根据上述治疗方法中任一种的一些实施方案中,疾病或病症选自由以下项组成的组:肌肉减少症、恶病质、废用性萎缩、炎性肌病、肌营养不良、心肌病、皮肤起皱、顽固性皮肤溃疡、皮肤创伤、大疱病、脱发、瘢痕疙瘩、皮炎、黄斑变性、结肠炎、肝脂肪变性、脂肪性肝炎、肝纤维
化、肝硬化、胰腺炎、2型糖尿病(t2d)、脂肪营养不良、慢性阻塞性肺病(copd)、肺纤维化、急性呼吸窘迫综合征(ards)、类风湿性关节炎、骨关节炎、骨质疏松症、神经变性疾病、脑梗塞、心肌梗塞、肺梗塞、骨折、胃溃疡、肠炎、慢性肾病、肾纤维化以及其他导致组织/器官/身体部分结构和功能丧失或萎缩的遗传决定的、环境决定的或特发性疾病过程。
[0287]
在一些实施方案中,提供了一种治疗个体中与组织相关的疾病或病症(例如,肌肉疾病或病症)的方法,该方法包括向个体施用有效量的包含前列腺素的药物组合物,其中前列腺素选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组。在一些实施方案中,疾病或病症是组织损伤。在一些实施方案中,疾病或病症是组织变性。在一些实施方案中,疾病或病症是组织纤维化。在一些实施方案中,疾病或病症是衰老。在一些实施方案中,组织选自由肌肉组织、肝脏组织、心脏组织、皮肤组织和毛囊组成的组。在一些实施方案中,每24小时、每48小时或每72小时向个体施用一次药物组合物。在一些实施方案中,向个体的组织施用药物组合物。在一些实施方案中,向个体全身(例如,口服)施用药物组合物。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。在根据上述治疗方法中任一种的一些实施方案中,疾病或病症选自由以下项组成的组:肌肉减少症、恶病质、废用性萎缩、炎性肌病、肌营养不良、心肌病、皮肤起皱、顽固性皮肤溃疡、皮肤创伤、大疱病、脱发、瘢痕疙瘩、皮炎、黄斑变性、结肠炎、肝脂肪变性、脂肪性肝炎、肝纤维化、肝硬化、胰腺炎、2型糖尿病(t2d)、脂肪营养不良、慢性阻塞性肺病(copd)、肺纤维化、急性呼吸窘迫综合征(ards)、类风湿性关节炎、骨关节炎、骨质疏松症、神经变性疾病、脑梗塞、心肌梗塞、肺梗塞、骨折、胃溃疡、肠炎、慢性肾病、肾纤维化以及其他导致组织/器官/身体部分结构和功能丧失或萎缩的遗传决定的、环境决定的或特发性疾病过程。
[0288]
在一些实施方案中,提供了一种治疗个体中与组织相关的疾病或病症(例如,肌肉疾病或病症)的方法,该方法包括向个体施用有效量的包含pparγ激动剂(例如,罗格列酮)和前列腺素的药物组合物,其中前列腺素选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组。在一些实施方案中,疾病或病症是组织损伤。在一些实施方案中,疾病或病症是组织变性。在一些实施方案中,疾病或病症是组织纤维化。在一些实施方案中,疾病或病症是衰老。在一些实施方案中,组织选自由肌肉组织、肝脏组织、心脏组织、皮肤组织和毛囊组成的组。在一些实施方案中,每24小时、每48小时或每72小时向个体施用一次药物组合物。在一些实施方案中,向个体的组织施用药物组合物。在一些实施方案中,向个体全身(例如,口服)施用药物组合物。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,药物组合物包含罗格列酮和pgi2。在一些实施方案中,药物组合物包含罗格列酮和曲前列环素。在根据上述治疗方法中任一种的一些实施方案中,疾病或病症选自由以下项组成的组:肌肉减少症、恶病质、废用性萎缩、炎性肌病、肌营养不良、心肌病、皮肤起皱、顽固性皮肤溃疡、皮肤创伤、大疱病、脱发、瘢痕疙瘩、皮炎、黄斑变性、结肠炎、肝脂肪变性、脂肪性肝炎、肝纤维化、肝硬化、胰腺炎、2型糖尿病(t2d)、脂肪营养不良、慢性阻塞性肺病(copd)、肺纤维化、急性呼吸窘迫综合征(ards)、类风湿性关节炎、骨关节炎、骨质疏松症、神经变性疾病、脑梗塞、心肌梗塞、肺梗塞、骨折、胃溃疡、肠炎、慢性肾病、肾纤维化以及其他导致组织/器官/身体部分结构和功能丧失或萎缩的遗传决定的、环境决定的或特发性疾病过程。
[0289]
在一些实施方案中,提供了一种治疗个体中的肌肉疾病或病症的方法,该方法包
括向个体施用有效量的包含一种或多种fao活化剂的药物组合物。在一些实施方案中,肌肉疾病或病症是肌肉损伤。在一些实施方案中,肌肉疾病或病症是肌肉变性。在一些实施方案中,肌肉疾病或病症是肌肉纤维化。在一些实施方案中,肌肉疾病或病症是衰老。在一些实施方案中,每24小时、每48小时或每72小时向个体施用一次药物组合物。在一些实施方案中,向个体的肌肉组织(例如,肌内或皮下)施用药物组合物。在一些实施方案中,向个体全身(例如,口服)施用药物组合物。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,一种或多种fao活化剂包括fao途径或脂质代谢途径中的基因的活化剂。在一些实施方案中,一种或多种fao活化剂包括一种或多种pparγ.活化剂。在一些实施方案中,一种或多种pparγ活化剂包括pparγ激动剂,诸如罗格列酮。在一些实施方案中,一种或多种pparγ活化剂包括选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组的前列腺素。在一些实施方案中,一种或多种pparγ活化剂包括罗格列酮和pgi2或罗格列酮和曲前列环素。
[0290]
在一些实施方案中,提供了一种治疗个体的组织(例如,肌肉组织)损伤的方法,该方法包括向个体施用有效量的包含fao活化剂的药物组合物。在一些实施方案中,组织选自由肌肉组织、肝脏组织、心脏组织、皮肤组织和毛囊组成的组。在一些实施方案中,在组织损伤后不超过约72小时、不超过约48小时或不超过约24小时向个体施用药物组合物。在一些实施方案中,在损伤后不超过约24小时向个体施用药物组合物。在一些实施方案中,向个体的组织施用药物组合物。在一些实施方案中,向个体全身(例如,口服)施用药物组合物。在一些实施方案中,fao活化剂是fao途径或脂质代谢途径中的基因的活化剂。在一些实施方案中,fao活化剂是选自由以下项组成的组的基因的活化剂:pparα、pparδ、pparγ、rxrb、rxrg、ncoa1、ncoa2、fabp3、fabp4、cd36、scarb1、fatp1、fatp2、fatp3、fatp4、fatp5、fatp6、lpl、cpt1a、cpt1b、cpt1c、cpt2、crat、acad(例如,acad1、acad2、acad3、acad4、acad5、acad6、acad7、acad8、acad9、acad10、acad11、mcad、lcad、vlcad)、hadh(例如,hadha、hadhb)、etfa和etfb。在一些实施方案中,药物组合物包含两种或更多种fao活化剂。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。
[0291]
在一些实施方案中,提供了一种治疗个体的组织(例如,肌肉组织)损伤的方法,该方法包括向个体施用有效量的包含pparγ激动剂的药物组合物。在一些实施方案中,组织选自由肌肉组织、肝脏组织、心脏组织、皮肤组织和毛囊组成的组。在一些实施方案中,在组织损伤后不超过约72小时、不超过约48小时或不超过约24小时向个体施用药物组合物。在一些实施方案中,在损伤后不超过约24小时向个体施用药物组合物。在一些实施方案中,向个体的组织施用药物组合物。在一些实施方案中,向个体全身(例如,口服)施用药物组合物。在一些实施方案中,pparγ激动剂是罗格列酮或其盐、溶剂化物、互变异构体或立体异构体。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。
[0292]
在一些实施方案中,提供了一种治疗个体的组织(例如,肌肉组织)损伤的方法,该方法包括向个体施用有效量的包含前列腺素的药物组合物,其中前列腺素选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组。在一些实施方案中,组织选自由肌肉组织、肝脏组织、心脏组织、皮肤组织和毛囊组成的组。在一些实施方案中,在组织损伤后不超过约72小时、不超过约48小时或不超过约24小时向个体施用药物组合物。在一些实施方案中,在损伤后不超过约24小时向个体施用药物组合物。在一些实施方案中,向个体的组织
施用药物组合物。在一些实施方案中,向个体全身(例如,口服)施用药物组合物。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。
[0293]
在一些实施方案中,提供了一种治疗个体的组织(例如,肌肉组织)损伤的方法,该方法包括向个体施用有效量的包含pparγ激动剂(例如,罗格列酮)和前列腺素的药物组合物,其中前列腺素选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组。在一些实施方案中,组织选自由肌肉组织、肝脏组织、心脏组织、皮肤组织和毛囊组成的组。在一些实施方案中,在组织损伤后不超过约72小时、不超过约48小时或不超过约24小时向个体施用药物组合物。在一些实施方案中,在损伤后不超过约24小时向个体施用药物组合物。在一些实施方案中,向个体的组织施用药物组合物。在一些实施方案中,向个体全身(例如,口服)施用药物组合物。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,药物组合物包含罗格列酮和pgi2。在一些实施方案中,药物组合物包含罗格列酮和曲前列环素。
[0294]
在一些实施方案中,提供了一种治疗个体的肌肉组织损伤的方法,该方法包括向个体施用有效量的包含一种或多种fao活化剂的药物组合物。在一些实施方案中,在肌肉损伤后不超过约72小时、不超过约48小时或不超过约24小时向个体施用药物组合物。在一些实施方案中,向个体的肌肉组织(例如,肌内或皮下)施用药物组合物。在一些实施方案中,向个体全身(例如,口服)施用药物组合物。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,一种或多种fao活化剂包括fao途径或脂质代谢途径中的基因的活化剂。在一些实施方案中,一种或多种fao活化剂包括一种或多种pparγ.活化剂。在一些实施方案中,一种或多种pparγ活化剂包括pparγ激动剂,诸如罗格列酮。在一些实施方案中,一种或多种pparγ活化剂包括选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组的前列腺素。在一些实施方案中,一种或多种pparγ活化剂包括罗格列酮和pgi2或罗格列酮和曲前列环素。
[0295]
在一些实施方案中,提供了一种治疗个体中与衰老相关的疾病或病症的方法,该方法包括向个体施用有效量的包含fao活化剂的药物组合物。在一些实施方案中,向个体的组织施用药物组合物。在一些实施方案中,组织选自由肌肉组织、肝脏组织、心脏组织、皮肤组织和毛囊组成的组。在一些实施方案中,向个体全身(例如,口服)施用药物组合物。在一些实施方案中,fao活化剂是fao途径或脂质代谢途径中的基因的活化剂。在一些实施方案中,fao活化剂是选自由以下项组成的组的基因的活化剂:pparα、pparδ、pparγ、rxrb、rxrg、ncoa1、ncoa2、fabp3、fabp4、cd36、scarb1、fatp1、fatp2、fatp3、fatp4、fatp5、fatp6、lpl、cpt1a、cpt1b、cpt1c、cpt2、crat、acad(例如,acad1、acad2、acad3、acad4、acad5、acad6、acad7、acad8、acad9、acad10、acad11、mcad、lcad、vlcad)、hadh(例如,hadha、hadhb)、etfa和etfb。在一些实施方案中,药物组合物包含两种或更多种fao活化剂。在一些实施方案中,个体是至少约50岁的人类个体。
[0296]
在一些实施方案中,提供了一种治疗个体中与衰老相关的疾病或病症的方法,该方法包括向个体施用有效量的包含pparγ激动剂的药物组合物。在一些实施方案中,向个体的组织施用药物组合物。在一些实施方案中,组织选自由肌肉组织、肝脏组织、心脏组织、皮肤组织和毛囊组成的组。在一些实施方案中,向个体全身(例如,口服)施用药物组合物。在一些实施方案中,pparγ激动剂是罗格列酮或其盐、溶剂化物、互变异构体或立体异构
体。在一些实施方案中,个体是至少约50岁的人类个体。
[0297]
在一些实施方案中,提供了一种治疗个体中与衰老相关的疾病或病症的方法,该方法包括向个体施用有效量的包含前列腺素的药物组合物,其中前列腺素选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组。在一些实施方案中,向个体的组织施用药物组合物。在一些实施方案中,组织选自由肌肉组织、肝脏组织、心脏组织、皮肤组织和毛囊组成的组。在一些实施方案中,向个体全身(例如,口服)施用药物组合物。在一些实施方案中,个体是至少约50岁的人类个体。
[0298]
在一些实施方案中,提供了一种治疗个体中与衰老相关的疾病或病症的方法,该方法包括向个体施用有效量的包含pparγ激动剂(例如,罗格列酮)和前列腺素的药物组合物,其中前列腺素选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组。在一些实施方案中,向个体的组织施用药物组合物。在一些实施方案中,组织选自由肌肉组织、肝脏组织、心脏组织、皮肤组织和毛囊组成的组。在一些实施方案中,向个体全身(例如,口服)施用药物组合物。在一些实施方案中,个体是至少约50岁的人类个体。在一些实施方案中,药物组合物包含罗格列酮和pgi2。在一些实施方案中,药物组合物包含罗格列酮和曲前列环素。
[0299]
同样在本技术的范围内的是使用脂肪酸氧化活化来模拟运动和营养的益处以在体内影响组织(例如,肌肉)再生和变性的方法。
[0300]
在一些实施方案中,提供了一种向个体的组织(例如,肌肉组织)提供一种或多种锻炼和/或营养益处的方法,该方法包括向个体施用有效量的包含fao活化剂的药物组合物。在一些实施方案中,组织(例如,肌肉组织)损伤。在一些实施方案中,组织(例如,肌肉组织)变性。在一些实施方案中,每24小时、每48小时或每72小时向个体施用一次药物组合物。在一些实施方案中,向个体的组织(例如,肌肉组织)(例如,肌内或皮下)施用药物组合物。在一些实施方案中,向个体全身(例如,口服)施用药物组合物。在一些实施方案中,fao活化剂是fao途径或脂质代谢途径中的基因的活化剂。在一些实施方案中,fao活化剂是选自由以下项组成的组的基因的活化剂:pparα、pparδ、pparγ、rxrb、rxrg、ncoa1、ncoa2、fabp3、fabp4、cd36、scarb1、fatp1、fatp2、fatp3、fatp4、fatp5、fatp6、lpl、cpt1a、cpt1b、cpt1c、cpt2、crat、acad(例如,acad1、acad2、acad3、acad4、acad5、acad6、acad7、acad8、acad9、acad10、acad11、mcad、lcad、vlcad)、hadh(例如,hadha、hadhb)、etfa和etfb。在一些实施方案中,药物组合物包含两种或更多种fao活化剂。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。
[0301]
在一些实施方案中,提供了一种向个体的组织(例如,肌肉组织)提供一种或多种锻炼和/或营养益处的方法,该方法包括向个体施用有效量的包含pparγ激动剂的药物组合物。在一些实施方案中,组织(例如,肌肉组织)损伤。在一些实施方案中,组织(例如,肌肉组织)变性。在一些实施方案中,每24小时、每48小时或每72小时向个体施用一次药物组合物。在一些实施方案中,向个体的组织(例如,肌肉组织)(例如,肌内或皮下)施用药物组合物。在一些实施方案中,向个体全身(例如,口服)施用药物组合物。在一些实施方案中,pparγ激动剂是罗格列酮或其盐、溶剂化物、互变异构体或立体异构体。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。
[0302]
在一些实施方案中,提供了一种向个体的组织(例如,肌肉组织)提供一种或多种
锻炼和/或营养益处的方法,该方法包括向个体施用有效量的包含前列腺素的药物组合物,其中前列腺素选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组。在一些实施方案中,组织(例如,肌肉组织)损伤。在一些实施方案中,组织(例如,肌肉组织)变性。在一些实施方案中,每24小时、每48小时或每72小时向个体施用一次药物组合物。在一些实施方案中,向个体的组织(例如,肌肉组织)(例如,肌内或皮下)施用药物组合物。在一些实施方案中,向个体全身(例如,口服)施用药物组合物。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。
[0303]
在一些实施方案中,提供了一种向个体的组织(例如,肌肉组织)提供一种或多种锻炼和/或营养益处的方法,该方法包括向个体施用有效量的包含pparγ激动剂(例如,罗格列酮)和前列腺素的药物组合物,其中前列腺素选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组。在一些实施方案中,组织(例如,肌肉组织)损伤。在一些实施方案中,组织(例如,肌肉组织)变性。在一些实施方案中,每24小时、每48小时或每72小时向个体施用一次药物组合物。在一些实施方案中,向个体的组织(例如,肌肉组织)(例如,肌内或皮下)施用药物组合物。在一些实施方案中,向个体全身(例如,口服)施用药物组合物。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,药物组合物包含罗格列酮和pgi2。在一些实施方案中,药物组合物包含罗格列酮和曲前列环素。
[0304]
在一些实施方案中,一种或多种锻炼和/或营养益处包括肌生成增加、肌肉再生增加、肌肉变性减少、组织再生增加、组织变性减少、肌肉体积增加、肌肉质量增加、肌肉葡萄糖和脂肪代谢增加、肌肉胰岛素敏感性增加、肌肉耐力增加和/或肌肉力量增加。
[0305]
还提供了包含本文所述的任何一种或多种fao活化剂(包括pparγ活化剂诸如pparγ激动剂,以及/或者pgi2、pgd2或它们的类似物)的组合物(诸如药物组合物),其用于本文所述的任何一种方法中。
[0306]
通常,包含一种或多种fao活化剂的药物组合物的剂量、时间表和施用途径可根据个体的大小和状况并根据标准药学实践来确定。示例性施用途径包括口服、直肠、经鼻、局部(包括颊部和舌下)、经皮、阴道或胃肠外(包括肌内、皮下和静脉内)。在一些实施方案中,向个体的肌肉组织局部施用药物组合物。在一些实施方案中,皮下施用药物组合物。在一些实施方案中,肌内施用药物组合物。在一些实施方案中,通过注射施用药物组合物。在一些实施方案中,向个体全身施用药物组合物。在一些实施方案中,向个体口服施用药物组合物。
[0307]
向个体施用的一种或多种fao活化剂的剂量可根据例如所施用的fao活化剂的特定类型、施用途径和所治疗的肌肉疾病或病症的特定类型而变化。该量应当足以产生所需的反应,例如对疾病或病症的治疗反应,但没有严重的毒性或不良事件。在一些实施方案中,以治疗有效量施用一种或多种fao活化剂。
[0308]
在一些实施方案中,向个体施用药物组合物一次。在一些实施方案中,向个体施用药物组合物超过一次,诸如2、3、4、5、6次或更多次中的任一种。在一些实施方案中,药物组合物可方便地以每日一次或以适当间隔施用的分剂量(例如,以每24、48或72小时一次剂量)提供。在一些实施方案中,每24小时一次、每36小时一次、每48小时一次、每60小时一次或每72小时一次(包括这些值之间的任何值或范围)施用药物组合物。
[0309]
在一些实施方案中,在距肌肉损伤约72小时内(诸如在距肌肉损伤约60小时、48小
时、36小时、24小时、12小时、6小时或更短时间内中的任一种,包括这些值之间的任何值或范围)向个体施用药物组合物。在一些实施方案中,在肌肉组织损伤后24和48小时时间点向个体施用罗格列酮改善了体内骨骼肌再生。
[0310]
组织形成细胞的施用
[0311]
在一些实施方案中,提供了一种治疗个体中与组织相关的疾病或病症(例如,肌肉疾病或病症)的方法,该方法包括向个体的组织(例如,肌肉组织)施用有效量的包含组织形成细胞(诸如生肌细胞,例如成肌细胞和/或肌细胞)的药物组合物,其中在施用药物组合物之前使组织形成细胞与fao活化剂接触。在一些实施方案中,疾病或病症是组织损伤(例如,肌肉损伤)。在一些实施方案中,疾病或病症是组织变性(例如,肌肉变性)。在一些实施方案中,疾病或病症是组织纤维化(例如,肌肉纤维化)。在一些实施方案中,疾病或病症是衰老。在一些实施方案中,组织选自由肌肉组织、肝脏组织、心脏组织、皮肤组织和毛囊组成的组。在一些实施方案中,使组织形成细胞(例如,生肌细胞)与fao活化剂接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,fao活化剂是fao途径或脂质代谢途径中的基因的活化剂。在一些实施方案中,fao活化剂是选自由以下项组成的组的基因的活化剂:pparα、pparδ、pparγ、rxrb、rxrg、ncoa1、ncoa2、fabp3、fabp4、cd36、scarb1、fatp1、fatp2、fatp3、fatp4、fatp5、fatp6、lpl、cpt1a、cpt1b、cpt1c、cpt2、crat、acad(例如,acad1、acad2、acad3、acad4、acad5、acad6、acad7、acad8、acad9、acad10、acad11、mcad、lcad、vlcad)、hadh(例如,hadha、hadhb)、etfa和etfb。在一些实施方案中,使组织形成细胞(例如,生肌细胞)与两种或更多种fao活化剂接触。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,该方法还包括在施用药物组合物之前使组织形成细胞与fao活化剂接触。
[0312]
在一些实施方案中,提供了一种治疗个体中与组织相关的疾病或病症(例如,肌肉疾病或病症)的方法,该方法包括向个体的组织(例如,肌肉组织)施用有效量的包含组织形成细胞(诸如生肌细胞,例如成肌细胞和/或肌细胞)的药物组合物,其中在施用药物组合物之前使组织形成细胞与pparγ激动剂接触。在一些实施方案中,疾病或病症是组织损伤(例如,肌肉损伤)。在一些实施方案中,疾病或病症是组织变性(例如,肌肉变性)。在一些实施方案中,疾病或病症是组织纤维化(例如,肌肉纤维化)。在一些实施方案中,疾病或病症是衰老。在一些实施方案中,组织选自由肌肉组织、肝脏组织、心脏组织、皮肤组织和毛囊组成的组。在一些实施方案中,使组织形成细胞(例如,生肌细胞)与pparγ激动剂接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,pparγ激动剂是罗格列酮或其盐、溶剂化物、互变异构体或立体异构体。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,该方法还包括在施用药物组合物之前使组织形成细胞与pparγ激动剂接触。
[0313]
在一些实施方案中,提供了一种治疗个体中与组织相关的疾病或病症(例如,肌肉疾病或病症)的方法,该方法包括向个体的组织(例如,肌肉组织)施用有效量的包含组织形成细胞(诸如生肌细胞,例如成肌细胞和/或肌细胞)的药物组合物,其中在施用药物组合物之前使组织形成细胞与前列腺素接触,并且其中前列腺素选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组。在一些实施方案中,疾病或病症是组织损伤(例如,肌肉损伤)。在一些实施方案中,疾病或病症是组织变性(例如,肌肉变性)。在一些实施方案中,
疾病或病症是组织纤维化(例如,肌肉纤维化)。在一些实施方案中,疾病或病症是衰老。在一些实施方案中,组织选自由肌肉组织、肝脏组织、心脏组织、皮肤组织和毛囊组成的组。在一些实施方案中,使组织形成细胞(例如,生肌细胞)与前列腺素接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,该方法还包括在施用药物组合物之前使组织形成细胞与前列腺素接触。
[0314]
在一些实施方案中,提供了一种治疗个体中与组织相关的疾病或病症(例如,肌肉疾病或病症)的方法,该方法包括向个体的组织(例如,肌肉组织)施用有效量的包含组织形成细胞(诸如生肌细胞,例如成肌细胞和/或肌细胞)的药物组合物,其中在施用药物组合物之前使组织形成细胞与pparγ激动剂(例如,罗格列酮)和前列腺素接触,并且其中前列腺素选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组。在一些实施方案中,疾病或病症是组织损伤(例如,肌肉损伤)。在一些实施方案中,疾病或病症是组织变性(例如,肌肉变性)。在一些实施方案中,疾病或病症是组织纤维化(例如,肌肉纤维化)。在一些实施方案中,疾病或病症是衰老。在一些实施方案中,组织选自由肌肉组织、肝脏组织、心脏组织、皮肤组织和毛囊组成的组。在一些实施方案中,使组织形成细胞(例如,生肌细胞)与pparγ激动剂和前列腺素接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,pparγ激动剂是罗格列酮,并且前列腺素是pgi2。在一些实施方案中,pparγ激动剂是罗格列酮,并且前列腺素是曲前列环素。在一些实施方案中,该方法还包括在施用药物组合物之前使组织形成细胞与pparγ激动剂和前列腺素接触。
[0315]
在一些实施方案中,提供了一种治疗个体的肌肉疾病或病症的方法,该方法包括:(1)使生肌细胞(例如,成肌细胞或肌细胞)与fao活化剂接触以提供包含生肌细胞或其分化细胞的药物组合物;以及(2)向个体的肌肉组织施用有效量的药物组合物。在一些实施方案中,肌肉疾病或病症是肌肉损伤。在一些实施方案中,肌肉疾病或病症是肌肉变性。在一些实施方案中,该方法包括使生肌细胞与fao活化剂接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,fao活化剂是fao途径或脂质代谢途径中的基因的活化剂。在一些实施方案中,fao活化剂是选自由以下项组成的组的基因的活化剂:pparα、pparδ、pparγ、rxrb、rxrg、ncoa1、ncoa2、fabp3、fabp4、cd36、scarb1、fatp1、fatp2、fatp3、fatp4、fatp5、fatp6、lpl、cpt1a、cpt1b、cpt1c、cpt2、crat、acad(例如,acad1、acad2、acad3、acad4、acad5、acad6、acad7、acad8、acad9、acad10、acad11、mcad、lcad、vlcad)、hadh(例如,hadha、hadhb)、etfa和etfb。在一些实施方案中,该方法包括使生肌细胞与两种或更多种fao活化剂接触。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。
[0316]
在一些实施方案中,提供了一种治疗个体的肌肉疾病或病症的方法,该方法包括:(1)使生肌细胞(例如,成肌细胞或肌细胞)与pparγ激动剂接触以提供包含生肌细胞或其分化细胞的药物组合物;以及(2)向个体的肌肉组织施用有效量的药物组合物。在一些实施方案中,肌肉疾病或病症是肌肉损伤。在一些实施方案中,肌肉疾病或病症是肌肉变性。在一些实施方案中,该方法包括使生肌细胞与pparγ激动剂接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,pparγ激动剂是罗格列酮或其盐、溶剂化物、互变异构体或立体异构体。在一些实施方案中,个体是老年个体(例如,至少约50岁的人
类个体)。
[0317]
在一些实施方案中,提供了一种治疗个体的肌肉疾病或病症的方法,该方法包括:(1)使生肌细胞(例如,成肌细胞或肌细胞)与前列腺素接触以提供包含生肌细胞或其分化细胞的药物组合物,其中前列腺素选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组;以及(2)向个体的肌肉组织施用有效量的药物组合物。在一些实施方案中,肌肉疾病或病症是肌肉损伤。在一些实施方案中,肌肉疾病或病症是肌肉变性。在一些实施方案中,该方法包括使生肌细胞与前列腺素接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。
[0318]
在一些实施方案中,提供了一种治疗个体的肌肉疾病或病症的方法,该方法包括:(1)使生肌细胞(例如,成肌细胞或肌细胞)与pparγ激动剂(例如,罗格列酮)和前列腺素接触以提供包含生肌细胞或其分化细胞的药物组合物,其中前列腺素选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组;以及(2)向个体的肌肉组织施用有效量的药物组合物。在一些实施方案中,肌肉疾病或病症是肌肉损伤。在一些实施方案中,肌肉疾病或病症是肌肉变性。在一些实施方案中,该方法包括使生肌细胞与pparγ激动剂和前列腺素接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,pparγ激动剂是罗格列酮,并且前列腺素是pgi2。在一些实施方案中,pparγ激动剂是罗格列酮,并且前列腺素是曲前列环素。
[0319]
在一些实施方案中,提供了一种治疗个体的肌肉组织损伤的方法,该方法包括向个体的肌肉组织施用有效量的包含生肌细胞的药物组合物,其中在施用药物组合物之前使生肌细胞与fao活化剂接触。在一些实施方案中,在肌肉损伤后不超过约72小时、不超过约48小时或不超过约24小时向个体施用药物组合物。在一些实施方案中,使生肌细胞与fao活化剂接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,fao活化剂是fao途径或脂质代谢途径中的基因的活化剂。在一些实施方案中,fao活化剂是选自由以下项组成的组的基因的活化剂:pparα、pparδ、pparγ、rxrb、rxrg、ncoa1、ncoa2、fabp3、fabp4、cd36、scarb1、fatp1、fatp2、fatp3、fatp4、fatp5、fatp6、lpl、cpt1a、cpt1b、cpt1c、cpt2、crat、acad(例如,acad1、acad2、acad3、acad4、acad5、acad6、acad7、acad8、acad9、acad10、acad11、mcad、lcad、vlcad)、hadh(例如,hadha、hadhb)、etfa和etfb。在一些实施方案中,使生肌细胞与两种或更多种fao活化剂接触。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。
[0320]
在一些实施方案中,提供了一种治疗个体的肌肉组织损伤的方法,该方法包括向个体的肌肉组织施用有效量的包含生肌细胞的药物组合物,其中在施用药物组合物之前使生肌细胞与pparγ激动剂接触。在一些实施方案中,在肌肉损伤后不超过约72小时、不超过约48小时或不超过约24小时向个体施用药物组合物。在一些实施方案中,使生肌细胞与pparγ激动剂接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,pparγ激动剂是罗格列酮或其盐、溶剂化物、互变异构体或立体异构体。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。
[0321]
在一些实施方案中,提供了一种治疗个体的肌肉组织损伤的方法,该方法包括向个体的肌肉组织施用有效量的包含生肌细胞(例如,成肌细胞或肌细胞)的药物组合物,其
中在施用药物组合物之前使生肌细胞与前列腺素接触,其中前列腺素选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组。在一些实施方案中,肌肉疾病或病症是肌肉损伤。在一些实施方案中,肌肉疾病或病症是肌肉变性。在一些实施方案中,使生肌细胞与pgi2或其类似物接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。
[0322]
在一些实施方案中,提供了一种治疗个体的肌肉组织损伤的方法,该方法包括向个体的肌肉组织施用有效量的包含生肌细胞(例如,成肌细胞或肌细胞)的药物组合物,其中在施用药物组合物之前使生肌细胞与pparγ激动剂(例如,罗格列酮)和前列腺素接触,其中前列腺素选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组。在一些实施方案中,肌肉疾病或病症是肌肉损伤。在一些实施方案中,肌肉疾病或病症是肌肉变性。在一些实施方案中,使生肌细胞与pparγ激动剂和前列腺素接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,pparγ激动剂是罗格列酮,并且前列腺素是pgi2。在一些实施方案中,pparγ激动剂是罗格列酮,并且前列腺素是曲前列环素。
[0323]
在一些实施方案中,提供了一种治疗个体的肌肉组织损伤的方法,该方法包括:(1)使生肌细胞与fao活化剂接触以提供包含生肌细胞或其分化细胞的药物组合物;以及(2)向个体的肌肉组织施用有效量的药物组合物。在一些实施方案中,在肌肉损伤后不超过约72小时、不超过约48小时或不超过约24小时向个体施用药物组合物。在一些实施方案中,该方法包括使生肌细胞与fao活化剂接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,fao活化剂是fao途径或脂质代谢途径中的基因的活化剂。在一些实施方案中,fao活化剂是选自由以下项组成的组的基因的活化剂:pparα、pparδ、pparγ、rxrb、rxrg、ncoa1、ncoa2、fabp3、fabp4、cd36、scarb1、fatp1、fatp2、fatp3、fatp4、fatp5、fatp6、lpl、cpt1a、cpt1b、cpt1c、cpt2、crat、acad(例如,acad1、acad2、acad3、acad4、acad5、acad6、acad7、acad8、acad9、acad10、acad11、mcad、lcad、vlcad)、hadh(例如,hadha、hadhb)、etfa和etfb。在一些实施方案中,该方法包括使生肌细胞与两种或更多种fao活化剂接触。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。
[0324]
在一些实施方案中,提供了一种治疗个体的肌肉组织损伤的方法,该方法包括:(1)使生肌细胞与pparγ激动剂接触以提供包含生肌细胞或其分化细胞的药物组合物;以及(2)向个体的肌肉组织施用有效量的药物组合物。在一些实施方案中,在肌肉损伤后不超过约72小时、不超过约48小时或不超过约24小时向个体施用药物组合物。在一些实施方案中,该方法包括使生肌细胞与pparγ激动剂接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,pparγ激动剂是罗格列酮或其盐、溶剂化物、互变异构体或立体异构体。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。
[0325]
在一些实施方案中,提供了一种治疗个体的肌肉组织损伤的方法,该方法包括:(1)使生肌细胞(例如,成肌细胞或肌细胞)与前列腺素接触以提供包含生肌细胞或其分化细胞的药物组合物,其中前列腺素选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组;以及(2)向个体的肌肉组织施用有效量的药物组合物。在一些实施方案中,肌肉疾病或病症是肌肉损伤。在一些实施方案中,肌肉疾病或病症是肌肉变性。在一些实施方案中,该方法包括使生肌细胞与pgi2或其类似物接触不超过约72小时、不超过约48小时或不
超过约24小时。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。
[0326]
在一些实施方案中,提供了一种治疗个体的肌肉组织损伤的方法,该方法包括:(1)使生肌细胞(例如,成肌细胞或肌细胞)与pparγ激动剂(例如,罗格列酮)和前列腺素接触以提供包含生肌细胞或其分化细胞的药物组合物,其中前列腺素选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)组成的组;以及(2)向个体的肌肉组织施用有效量的药物组合物。在一些实施方案中,肌肉疾病或病症是肌肉损伤。在一些实施方案中,肌肉疾病或病症是肌肉变性。在一些实施方案中,该方法包括使生肌细胞与pparγ激动剂和前列腺素接触不超过约72小时、不超过约48小时或不超过约24小时。在一些实施方案中,个体是老年个体(例如,至少约50岁的人类个体)。在一些实施方案中,pparγ激动剂是罗格列酮,并且前列腺素是pgi2。在一些实施方案中,pparγ激动剂是罗格列酮,并且前列腺素是曲前列环素。
[0327]
合适的组织形成细胞包括但不限于干细胞、祖细胞、esc和ipsc、重编程细胞、转分化细胞,或者由此类干细胞、前体细胞产生的分化细胞,或者它们的组合。合适的生肌细胞包括但不限于肌肉干细胞(例如,卫星细胞)、胚胎和胎儿成肌细胞、由esc或ipsc产生的成肌细胞、重编程生肌细胞(例如,再生和/或去分化生肌细胞)或转分化生肌细胞,或者由此类肌肉干细胞、成肌细胞或重编程生肌细胞产生的分化细胞。
[0328]
组织形成细胞(例如,生肌细胞)可从各种来源获得。在一些实施方案中,组织形成细胞(例如,生肌细胞)是自体的。在一些实施方案中,组织形成细胞(例如,生肌细胞)是同种异体的。在一些实施方案中,组织形成细胞(例如,生肌细胞)对个体是非免疫原性的。在一些实施方案中,组织形成细胞(例如,生肌细胞)是由细胞系产生的。在一些实施方案中,组织形成细胞(例如,生肌细胞)不是从永生细胞系产生的。在一些实施方案中,组织形成细胞(例如,生肌细胞)是由从个体获得的原代细胞产生的。在一些实施方案中,组织形成细胞(例如,生肌细胞)是由从供体获得的原代细胞产生的。
[0329]
可使用本领域已知的方法获得肌肉干细胞。参见例如通过培养来自年轻个体的分离的肌肉干细胞并通过差异粘附培养肌肉干细胞(例如,skuk,2010)、通过对成年肌肉干细胞进行facs分选(例如,conboy,2010),以及通过从esc或ipsc制备肌肉干细胞(例如,darabi,2008;borchin,2013;shelton,2016),这些文献通过引用整体并入本文。
[0330]
可使用本领域已知的方法从esc或ipsc产生成肌细胞。参见例如darabi,2008;borchin,2013;shelton,2016,这些文献通过引用整体并入本文。可使用pct/cn2019/088977和pct/cn2020/092615中所述的方法来产生重编程(例如,再生和/或去分化)成肌细胞。另外,可通过使用成肌转录因子和/或小分子药物对成年体细胞进行直接重编程(例如,通过联合gsk3β抑制剂(例如,chir99021)、tgf-β抑制剂(例如,repsox)和/或camp激动剂(例如,forskolin)瞬时表达myod来转分化小鼠成纤维细胞)来产生肌肉祖细胞(诸如肌肉干细胞和成肌细胞)。参见bar-nur,2018,该文献的内容通过引用整体并入本文。通过在合适的条件下(例如,在包含dmem和约20%fbs的增殖培养基中)培养成肌细胞可在不分化的情况下使成肌细胞增殖,并且每次在约80%汇合度之前使其传代。
[0331]
通过在合适的条件下培养成肌细胞,可从成肌细胞产生肌细胞。例如,可使成肌细胞达到100%汇合度并将其在分化培养基中培养约2天,该分化培养基包含补充有约2%敲除血清替代物或约2%马血清和约1%l谷氨酰胺的dmem/f12或dmem培养基。
[0332]
在一些实施方案中,该方法还包括向个体施用有效量的免疫抑制剂,以最小化对组织形成细胞(例如,生肌细胞)的排斥。免疫抑制剂的示例包括但不限于甲氨蝶呤、环磷酰胺、环孢霉素a、氯喹、羟氯喹、柳氮磺胺吡啶(sulphasalazopyrine)、金盐、d-青霉胺、来氟米特、硫唑嘌呤、阿那白滞素、英夫利昔单抗(remicade)、依那西普、tnf-α、阻断剂、靶向炎性细胞因子的生物制剂以及非甾体抗炎药(nsaid)。
[0333]
本文所述的任何方法还可包括用于体外产生组织形成细胞(例如,生肌细胞)的一个或多个步骤。可使用用于体外增殖和/或分化组织形成细胞(例如,生肌细胞)的任何合适方法。参见例如chua等人,2019;以及fukawa等人,2016。在一些实施方案中,该方法包括从个体或供体获得组织形成细胞(诸如生肌细胞,例如肌肉干细胞、成肌细胞和/或肌细胞)。在一些实施方案中,该方法包括从成年生肌细胞或成年体细胞(例如,成纤维细胞)产生重编程生肌细胞的方法中的任一种。在一些实施方案中,该方法包括在允许组织形成细胞的增殖的条件下体外培养组织形成细胞(例如,生肌细胞)。在一些实施方案中,该方法包括在允许生肌细胞(例如,成肌细胞和/或肌细胞)增殖而不分化的条件下体外培养成肌细胞。在一些实施方案中,在包含具有约20%fbs和约1%l-谷氨酰胺的dmem/f12的增殖培养基中培养成肌细胞。在一些实施方案中,该方法包括在允许组织形成细胞的分化的条件下体外培养组织形成细胞(诸如生肌细胞,例如肌肉干细胞、成肌细胞和/或肌细胞)。在一些实施方案中,在包含具有约2%敲除血清替代物或约2%马血清和1%l-谷氨酰胺的dmem/f12或dmem的分化培养基中培养成肌细胞。在一些实施方案中,该方法包括在存在一种或多种fao活化剂诸如pparγ激动剂和/或pgi2或其类似物的情况下在分化培养基中培养组织形成细胞(例如,生肌细胞)。在一些实施方案中,在向个体施用之前,体外培养组织形成细胞(例如,生肌细胞)不超过约72小时、60小时、48小时、36小时、24小时、12小时或6小时中的任一种。在一些实施方案中,以高密度(例如,以至少约80%汇合度)接种组织形成细胞(例如,生肌细胞)。在一些实施方案中,以低密度(例如,以低于约80%汇合度)接种组织形成细胞(例如,生肌细胞)。
[0334]
本文所述的包含生肌细胞的药物组合物可包含组织形成细胞(例如,生肌细胞)、它们的后代以及从组织形成细胞(例如,生肌细胞)分化的细胞。药物组合物可以是细胞的悬浮液或组织构建体(例如,肌肉构建体)。在一些实施方案中,药物组合物是适于注射的溶液。在一些实施方案中,药物组合物是适于手术植入的水凝胶。在一些实施方案中,药物组合物包含药学上可接受的载体。在一些实施方案中,药物组合物包含细胞粘附分子,诸如纤维蛋白。在一些实施方案中,组织形成细胞(例如,生肌细胞)与载体混合。在一些实施方案中,药物组合物包含细胞外基质分子。在一些实施方案中,药物组合物包含
[0335]
在一些实施方案中,该方法包括将组织构建体植入个体中。在一些实施方案中,该方法包括将肌肉构建体植入在个体的肌肉组织处。本文所述的任何方法还可包括用于制备肌肉构建体的一个或多个步骤。可使用用于制备肌肉构建体的任何合适方法。参见例如velcro锚定的纤维蛋白构建体(例如,hinds等人,2011)和缝合线锚定的纤维蛋白构建体(例如,khodabukus和baar,2009)、诸如通过同轴印刷对肌肉构建体进行三维生物印刷(例如,testa,2018)和使用组织来源的生物油墨(例如,choi,2019),以及在三维印刷模具上培养肌肉祖细胞(例如,capel,2019)。在一些实施方案中,该方法包括在水凝胶载体(诸如包含和纤维蛋白的载体)中培养生肌细胞(例如,成肌细胞)以产生肌肉构建
体。在一些实施方案中,在水凝胶(诸如用缝合线锚定的纤维蛋白)的表面上培养生肌细胞(例如,成肌细胞),以产生肌肉构建体。在一些实施方案中,在三维(“3d”)实体模具内培养生肌细胞,以产生预成形的肌肉构建体。在一些实施方案中,用墨水对生肌细胞进行3d打印,以产生限定的3d肌肉构建体。
[0336]
本技术还提供了包含组织形成细胞(诸如生肌细胞,例如成肌细胞和/或肌细胞)或其分化细胞的组合物(诸如药物组合物),其可以用于本文所述的治疗方法中的任一种。还提供了包含组织形成细胞(诸如生肌细胞,例如成肌细胞和/或肌细胞)或其分化细胞的组织构建体(例如,肌肉构建体)。
[0337]
通常,包含组织形成细胞(例如,生肌细胞)的药物组合物的剂量、时间表和施用途径可根据个体的大小和状况并根据标准药学实践来确定。示例性施用途径包括静脉内、动脉内、腹膜内、肌内、皮下或经皮。在一些实施方案中,皮下施用药物组合物。在一些实施方案中,肌内施用药物组合物。在一些实施方案中,通过注射施用药物组合物。在一些实施方案中,通过手术植入施用药物组合物。
[0338]
向个体施用的细胞的剂量可根据例如所施用的细胞的特定类型、施用途径和所治疗的疾病或病症(例如,肌肉疾病或病症)的特定类型而变化。该量应当足以产生所需的反应,例如对疾病或病症的治疗反应,但没有严重的毒性或不良事件。在一些实施方案中,以治疗有效量施用生肌细胞或其分化细胞。在一些实施方案中,药物组合物包含103、104、105、106、107或更多个细胞中的任一种,包括这些值之间的任何值或范围。
[0339]
在一些实施方案中,向个体施用药物组合物一次。在一些实施方案中,向个体施用药物组合物超过一次,诸如2、3、4、5、6次或更多次中的任一种。在一些实施方案中,每24小时一次、每36小时一次、每48小时一次、每60小时一次或每72小时一次(包括这些值之间的任何值或范围)施用药物组合物。在一些实施方案中,在距组织损伤(例如,肌肉损伤)约72小时内(诸如在距组织损伤(例如,肌肉损伤)约60小时、48小时、36小时、24小时、12小时、6小时或更短时间内中的任一种,包括这些值之间的任何值或范围)向个体施用药物组合物。
[0340]
药物组合物
[0341]
本技术提供了可用于本文所述的治疗方法中任一种的组合物,诸如药物组合物。
[0342]
药物组合物可包含一种或多种药学上可接受的载体。如本文所用,所谓“药学上可接受的”或“药理学上相容的”是指在生物学上或其他方面不是不希望的材料,例如,该材料可被掺入向个体施用的药物组合物中,而不会引起任何明显的不希望的生物效应或者以有害的方式与包含其的组合物的任何其他组分相互作用。药学上可接受的载体或赋形剂优选满足毒理学和生产测试的所要求的标准并且/或者包含在美国食品和药物管理局编制的非活性成分指南中。药物的配制和施用技术可在"remington's pharmaceutical sciences,"mack publishing co.,easton,pa,最新版本中找到,该文献通过引用并入本文。
[0343]
本文所述的药物组合物可包括其他药剂、赋形剂或稳定剂以改善组合物的性质。药学上可接受的赋形剂的示例包括稳定剂、润滑剂、表面活性剂、稀释剂、抗氧化剂、粘结剂、着色剂、填充剂、乳化剂或调味剂。在优选的实施方案中,根据实施方案的药物组合物是无菌组合物。可使用本领域技术人员已知或可获得的配混技术来制备药物组合物。最终形式可以是无菌的,并且还能够容易地通过注射装置诸如空心针。可通过适当选择溶剂或赋形剂来实现和保持适当的粘度。在一些实施方案中,药物组合物适于向人类施用。
[0344]
本文所述的药物组合物和化合物可被配制成溶液、乳液、悬浮液、分散体或包合复合物,诸如合适的药物溶剂或载体中的环糊精,或者被配制成丸剂、片剂、锭剂、栓剂、小袋、糖衣丸、颗粒剂、粉末、重构粉末或根据本领域已知的用于制备各种剂型的常规方法与固体载体一起的胶囊。
[0345]
在适当的情况下,制剂可方便地以离散的剂量单位存在,并且可通过药学领域公知的任何方法制备。所有方法都包括将活性成分与一种或多种药学上可接受的载体(如液体载体或细分的固体载体或两者)结合然后(如果需要)将产品成型为所需的制剂的步骤。
[0346]
在一些实施方案中,提供了一种药物组合物,其包含一种或多种fao活化剂及其药学上可接受的盐。在一些实施方案中,一种或多种fao活化剂是pparγ激动剂。在一些实施方案中,pparγ激动剂是罗格列酮或其盐、溶剂化物、互变异构体或立体异构体。在一些实施方案中,一种或多种fao活化剂是选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)以及它们的盐、溶剂化物、互变异构体和立体异构体组成的组的前列腺素。在一些实施方案中,一种或多种fao活化剂是pgi2或其盐、溶剂化物、互变异构体或立体异构体。在一些实施方案中,一种或多种fao活化剂是曲前列环素或其盐、溶剂化物、互变异构体或立体异构体。在一些实施方案中,一种或多种fao活化剂是罗格列酮和pgi2。在一些实施方案中,一种或多种fao活化剂是罗格列酮和曲前列环素。药物组合物可被配制用于以液体或固体形式或者以适于通过吸入或吹入进行施用的形式进行口服、直肠、经鼻、局部(包括颊部和舌下)、经皮、阴道或胃肠外(包括肌内、皮下和静脉内)施用。在一些实施方案中,药物组合物被配制用于肌内或皮下施用。在一些实施方案中,药物组合物被配制用于口服施用。
[0347]
对于口服施用,一种或多种fao活化剂(例如,pparγ激动剂和/或pgd2、pgi2或它们的类似物)可以固体形式或者以溶液、乳液或悬浮液形式提供。例如,药物组合物可被配制成片剂、颗粒剂、细粒剂、粉末、胶囊、囊片、软胶囊、丸剂、口服溶液、糖浆、干糖浆、咀嚼片、锭剂、泡腾片、滴剂、悬浮液、速溶片、口服速散片等的形式。
[0348]
适于口服施用的药物组合物可方便地以如下形式存在:离散单元,诸如胶囊,包括软明胶胶囊、扁囊剂或片剂,每种都含有预定量的活性成分;粉末或颗粒剂;溶液、悬浮液或乳液,例如糖浆、酏剂或自乳化递送系统(sedds)。活性成分也可以大丸剂、冲服剂或糊剂存在。用于口服施用的片剂和胶囊可含有常规赋形剂,诸如粘结剂、填充剂、润滑剂、崩解剂或润湿剂。可根据本领域公知的方法对片剂进行包衣。口服液体制剂可以是例如水性或油性悬浮液、溶液、乳剂、糖浆或酏剂的形式,或者可以干燥产品存在,以在使用前与水或其他合适的媒介物重构。此类液体制剂可含有常规添加剂,诸如悬浮剂、乳化剂、非水性媒介物(可包括食用油)或防腐剂。
[0349]
根据本技术的药物组合物还可被配制用于胃肠外施用(例如通过注射,例如推注或连续输注),并且可以单位剂量形式存在于安瓿、预装注射器、小体积输液或添加有防腐剂的多剂量容器中。组合物可采用诸如在油性或水性媒介物中的悬浮液、溶液或乳液的形式,并且可含有诸如悬浮剂、稳定剂和/或分散剂的配制剂。另选地,活性成分可以是粉末形式,通过对无菌固体进行无菌分离或通过从溶液进行低压冻干获得,以在使用前与合适的媒介物(例如,无菌无热原水)重构。
[0350]
适于直肠施用的药物组合物(其中载体是固体)最优选地以单位剂量栓剂存在。合适的载体包括可可脂和本领域常用的其他材料,并且可通过将活性化合物与软化或融化载
体混合然后在模具中冷却和成型来方便地形成栓剂。
[0351]
在一些实施方案中,提供了一种药物组合物,其包含组织形成细胞(诸如生肌细胞,例如成肌细胞和/或肌细胞),其中使组织形成细胞(例如,生肌细胞)与一种或多种fao活化剂接触不超过约72小时。在一些实施方案中,使组织形成细胞(例如,生肌细胞)与一种或多种fao活化剂接触不超过约48小时。在一些实施方案中,使组织形成细胞(例如,生肌细胞)与一种或多种fao活化剂接触不超过约24小时。在一些实施方案中,一种或多种fao活化剂包括fao途径或脂质代谢途径中的基因的活化剂。在一些实施方案中,一种或多种fao活化剂包括选自由以下项组成的组的基因的活化剂:pparα、pparδ、pparγ、rxrb、rxrg、ncoa1、ncoa2、fabp3、fabp4、cd36、scarb1、fatp1、fatp2、fatp3、fatp4、fatp5、fatp6、lpl、cpt1a、cpt1b、cpt1c、cpt2、crat、acad(例如,acad1、acad2、acad3、acad4、acad5、acad6、acad7、acad8、acad9、acad10、acad11、mcad、lcad、vlcad)、hadh(例如,hadha、hadhb)、etfa和etfb。在一些实施方案中,一种或多种fao活化剂包括pparγ激动剂。在一些实施方案中,pparγ激动剂是罗格列酮或其盐、溶剂化物、互变异构体或立体异构体。在一些实施方案中,一种或多种fao活化剂包括选自由pgi2、pgd2以及它们的类似物(例如,曲前列环素)以及它们的盐、溶剂化物、互变异构体和立体异构体组成的组的前列腺素。在一些实施方案中,一种或多种fao活化剂是罗格列酮和pgi2。在一些实施方案中,一种或多种fao活化剂是罗格列酮和曲前列环素。在一些实施方案中,药物组合物被配制用于肌内施用。在一些实施方案中,药物组合物被配制用于皮下施用。在一些实施方案中,药物组合物被配制用于手术植入。在一些实施方案中,药物组合物被配制用于注射。
[0352]
在一些实施方案中,提供了一种组合物,其包含增加fao和以下项的表达的任何一种或多种活化剂:脂质调节基因,诸如但不限于核激素受体ppara、ppard、pparg、rxrb、rxrg、ncoa1、ncoa2;上游脂肪酸转运蛋白fabp3、fabp4、cd36、scarb1、fatp1-6;多种脂肪酶,包括lpl;限速肉毒碱棕榈酰转移酶cpt1a和cpt1b;肉毒碱乙酰化酶crat;酰基辅酶a脱氢酶acad和羟酰基辅酶a脱氢酶hadh;以及线粒体电子转移黄素蛋白etfa和etfb,这些可以促进成肌分化。
[0353]
在一些实施方案中,提供了一种组合物,其包含任何一种或多种ppar激动剂、其溶剂化物、水合物或药学上可接受的盐,包括在章节iv中描述的ppar激动剂中的任何一种或多种。在一些实施方案中,组合物包含pgd2、pgi2、其类似物(例如,曲前列环素)或其盐、溶剂化物、互变异构体或立体异构体。在一些实施方案中,组合物活化脂肪酸氧化并增强组织(例如,肌肉)再生。本文提供的示例性ppar激动剂是噻唑烷二酮、其溶剂化物、水合物或药学上可接受的盐。
[0354]
在一些实施方案中,提供了一种组合物,其包含罗格列酮、其溶剂化物、水合物或药学上可接受的盐。在一些实施方案中,组合物还包含pgi2、pgd2或它们的类似物(例如,曲前列环素)。
[0355]
iv.脂肪酸氧化活化剂
[0356]
本文所述的方法和组合物使用一种或多种(例如,1、2、3种或更多种)fao活化剂。在一些实施方案中,一种或多种fao活化剂具有以下性质中的一种或多种:(i)增加组织形成细胞(例如,生肌细胞)中的线粒体fao;(ii)增加组织形成细胞(例如,生肌细胞)中的线粒体氧气消耗;(iii)不影响组织形成细胞(例如,生肌细胞)中的线粒体生物发生;(v)不影
响组织形成细胞(例如,生肌细胞)中的膜电位;(vi)增加组织形成细胞(例如,生肌细胞)中myod(例如,myod1)的表达和/或活性;(vii)增加组织形成细胞(例如,生肌细胞)中pparγ的表达和/或活性;(viii)瞬时增加组织形成细胞(例如,生肌细胞)中pparα的表达和/或活性;(ix)增加组织形成细胞(例如,生肌细胞)中pax7的表达和/或活性;(x)增加组织形成细胞(例如,生肌细胞)中myog的表达和/或活性;(xi)增加组织形成细胞(例如,生肌细胞)中myh3的表达和/或活性;(xii)增加组织形成细胞(例如,生肌细胞)中h3k9ac的水平;以及(xiii)增加组织形成细胞(例如,生肌细胞)中ki67的表达和/或活性。
[0357]
在一些实施方案中,一种或多种fao活化剂增加组织形成细胞(例如,生肌细胞,诸如成肌细胞或肌细胞)中的线粒体fao。在一些实施方案中,一种或多种fao活化剂在约12小时、约24小时、约36小时、约48小时、约60小时或约72小时(包括这些值之间的任何值或范围)内增加组织形成细胞(例如,生肌细胞)中的线粒体fao。在一些实施方案中,一种或多种fao活化剂在约72小时、约84小时、约96小时或更长时间(包括这些值之间的任何值或范围)后不增加组织形成细胞(例如,生肌细胞)中的线粒体fao。可使用本领域已知的任何方法(例如,通过使用质谱的代谢组学和脂质组学分析)来确定fao的水平。在一些实施方案中,线粒体fao的水平增加10%、20%、50%、2倍、3倍、5倍、10倍或更多中的任一种,包括这些值之间的任何值或范围。
[0358]
在一些实施方案中,一种或多种fao活化剂增加组织形成细胞(例如,生肌细胞,诸如成肌细胞或肌细胞)中的线粒体氧气消耗。在一些实施方案中,一种或多种fao活化剂在约12小时、约24小时、约36小时、约48小时、约60小时或约72小时(包括这些值之间的任何值或范围)内增加组织形成细胞(例如,生肌细胞)中的线粒体氧气消耗。在一些实施方案中,一种或多种fao活化剂在约72小时、约84小时、约96小时或更长时间(包括这些值之间的任何值或范围)后不增加组织形成细胞(例如,生肌细胞)中的线粒体氧气消耗。可使用本领域已知的任何方法(例如,通过seahorse分析)来确定线粒体氧气消耗。在一些实施方案中,该方法增加了最大线粒体氧气消耗。在一些实施方案中,该方法增加了基础线粒体氧气消耗。在一些实施方案中,该方法增加了最大线粒体氧气消耗和基础线粒体氧气消耗。在一些实施方案中,线粒体氧气消耗增加10%、20%、50%、2倍、3倍、5倍、10倍或更多中的任一种,包括这些值之间的任何值或范围。
[0359]
在一些实施方案中,一种或多种fao活化剂不影响组织形成细胞(例如,生肌细胞,诸如成肌细胞或肌细胞)中的线粒体生物发生。可使用本领域已知的任何方法来确定线粒体生物发生,例如通过免疫染色或mitotracker染色确定线粒体体积,或者通过定量pcr确定线粒体dna拷贝数。在一些实施方案中,一种或多种fao活化剂不会使组织形成细胞(例如,生肌细胞)中的线粒体生物改变超过50%、40%、30%、20%、10%或更少,包括这些值之间的任何值或范围。
[0360]
在一些实施方案中,一种或多种fao活化剂不影响组织形成细胞(例如,生肌细胞,诸如成肌细胞或肌细胞)的膜电位。可使用本领域已知的任何方法来确定膜电位,例如通过使用jc1染料进行荧光染色。在一些实施方案中,一种或多种fao活化剂不会使组织形成细胞(例如,生肌细胞)的膜电位改变超过50%、40%、30%、20%、10%或更少,包括这些值之间的任何值或范围。
[0361]
在一些实施方案中,一种或多种fao活化剂增加组织形成细胞(例如,生肌细胞,例
如成肌细胞或肌细胞)中pax7的表达和/或活性。在一些实施方案中,一种或多种fao活化剂在约12小时、约24小时、约36小时、约48小时、约60小时或约72小时(包括这些值之间的任何值或范围)内增加组织形成细胞(例如,生肌细胞)中pax7的表达和/或活性。在一些实施方案中,一种或多种fao活化剂在约72小时、约84小时、约96小时或更长时间(包括这些值之间的任何值或范围)后不增加组织形成细胞(例如,生肌细胞)中pax7的表达和/或活性。在一些实施方案中,pax7的表达和/或活性的水平增加10%、20%、50%、2倍、3倍、5倍、10倍或更多中的任一种,包括这些值之间的任何值或范围。
[0362]
在一些实施方案中,一种或多种fao活化剂增加组织形成细胞(例如,生肌细胞,例如成肌细胞或肌细胞)中myod(例如,myod1)的表达和/或活性。在一些实施方案中,一种或多种fao活化剂在约12小时、约24小时、约36小时、约48小时、约60小时或约72小时(包括这些值之间的任何值或范围)内增加组织形成细胞(例如,生肌细胞)中myod的表达和/或活性。在一些实施方案中,一种或多种fao活化剂在约72小时、约84小时、约96小时或更长时间(包括这些值之间的任何值或范围)后不增加组织形成细胞(例如,生肌细胞)中myod的表达和/或活性。在一些实施方案中,myod的表达和/或活性的水平增加10%、20%、50%、2倍、3倍、5倍、10倍或更多中的任一种,包括这些值之间的任何值或范围。
[0363]
在一些实施方案中,一种或多种fao活化剂增加组织形成细胞(例如,生肌细胞,例如成肌细胞或肌细胞)中myog的表达和/或活性。在一些实施方案中,一种或多种fao活化剂在约12小时、约24小时、约36小时、约48小时、约60小时或约72小时(包括这些值之间的任何值或范围)内增加组织形成细胞(例如,生肌细胞)中myog的表达和/或活性。在一些实施方案中,一种或多种fao活化剂在约72小时、约84小时、约96小时或更长时间(包括这些值之间的任何值或范围)后不增加组织形成细胞(例如,生肌细胞)中myog的表达和/或活性。在一些实施方案中,myog的表达和/或活性的水平增加10%、20%、50%、2倍、3倍、5倍、10倍或更多中的任一种,包括这些值之间的任何值或范围。
[0364]
在一些实施方案中,一种或多种fao活化剂增加组织形成细胞(例如,生肌细胞,诸如成肌细胞或肌细胞)中myh3的表达和/或活性。在一些实施方案中,一种或多种fao活化剂在约12小时、约24小时、约36小时、约48小时、约60小时或约72小时(包括这些值之间的任何值或范围)内增加组织形成细胞(例如,生肌细胞)中myh3的表达和/或活性。在一些实施方案中,一种或多种fao活化剂在约72小时、约84小时、约96小时或更长时间(包括这些值之间的任何值或范围)后不增加组织形成细胞(例如,生肌细胞)中myh3的表达和/或活性。在一些实施方案中,myh3的表达和/或活性的水平增加10%、20%、50%、2倍、3倍、5倍、10倍或更多中的任一种,包括这些值之间的任何值或范围。
[0365]
在一些实施方案中,一种或多种fao活化剂增加组织形成细胞(例如,生肌细胞,诸如成肌细胞或肌细胞)中pparγ的表达和/或活性。在一些实施方案中,一种或多种fao活化剂在约12小时、约24小时、约36小时、约48小时、约60小时或约72小时(包括这些值之间的任何值或范围)内增加组织形成细胞(例如,生肌细胞)中pparγ的表达和/或活性。在一些实施方案中,一种或多种fao活化剂在约72小时、约84小时、约96小时或更长时间(包括这些值之间的任何值或范围)后不增加组织形成细胞(例如,生肌细胞)中pparγ的表达和/或活性。在一些实施方案中,pparγ的表达和/或活性的水平增加10%、20%、50%、2倍、3倍、5倍、10倍或更多中的任一种,包括这些值之间的任何值或范围。
[0366]
在一些实施方案中,一种或多种fao活化剂增加组织形成细胞(例如,生肌细胞,诸如成肌细胞或肌细胞)中pparα 的表达和/或活性。在一些实施方案中,一种或多种fao活化剂在约12小时、约24小时、约36小时、约48小时、约60小时或约72小时(包括这些值之间的任何值或范围)内增加组织形成细胞(例如,生肌细胞)中pparα的表达和/或活性。在一些实施方案中,一种或多种fao活化剂在约72小时、约84小时、约96小时或更长时间(包括这些值之间的任何值或范围)后不增加组织形成细胞(例如,生肌细胞)中pparα的表达和/或活性。在一些实施方案中,pparα的表达和/或活性的水平增加10%、20%、50%、2倍、3倍、5倍、10倍或更多中的任一种,包括这些值之间的任何值或范围。
[0367]
在一些实施方案中,一种或多种fao活化剂增加组织形成细胞(例如,生肌细胞,诸如成肌细胞或肌细胞)中h3k9ac(乙酰化组蛋白h3赖氨酸9)的水平。在一些实施方案中,一种或多种fao活化剂在约12小时、约24小时、约36小时、约48小时、约60小时或约72小时(包括这些值之间的任何值或范围)内增加组织形成细胞(例如,生肌细胞)中h3k9ac的水平。在一些实施方案中,一种或多种fao活化剂在约72小时、约84小时、约96小时或更长时间(包括这些值之间的任何值或范围)后不增加组织形成细胞(例如,生肌细胞)中h3k9ac的水平。在一些实施方案中,h3k9ac的水平增加10%、20%、50%、2倍、3倍、5倍、10倍或更多中的任一种,包括这些值之间的任何值或范围。
[0368]
在一些实施方案中,一种或多种fao活化剂增加组织形成细胞(例如,生肌细胞,诸如成肌细胞或肌细胞)中ki67的表达和/或活性。在一些实施方案中,一种或多种fao活化剂在约12小时、约24小时、约36小时、约48小时、约60小时或约72小时(包括这些值之间的任何值或范围)内增加组织形成细胞(例如,生肌细胞)中ki67的表达和/或活性。在一些实施方案中,一种或多种fao活化剂在约72小时、约84小时、约96小时或更长时间(包括这些值之间的任何值或范围)后不增加组织形成细胞(例如,生肌细胞)中ki67的表达和/或活性。在一些实施方案中,ki67的表达和/或活性的水平增加10%、20%、50%、2倍、3倍、5倍、10倍或更多中的任一种,包括这些值之间的任何值或范围。
[0369]
在一些实施方案中,一种或多种fao活化剂上调组织形成细胞(例如,生肌细胞,诸如成肌细胞或肌细胞)中fao和/或脂质代谢途径中的一种或多种基因。在一些实施方案中,一种或多种fao活化剂在约12小时、约24小时、约36小时、约48小时、约60小时或约72小时(包括这些值之间的任何值或范围)内上调组织形成细胞(例如,生肌细胞)中fao和/或脂质代谢途径中的一种或多种基因。在一些实施方案中,一种或多种fao活化剂在约72小时、约84小时、约96小时或更长时间(包括这些值之间的任何值或范围)后不上调组织形成细胞(例如,生肌细胞)中fao和/或脂质代谢途径中的一种或多种基因。在一些实施方案中,fao和/或脂质代谢途径中的一种或多种基因的表达和/或活性的水平增加10%、20%、50%、2倍、3倍、5倍、10倍或更多中的任一种,包括这些值之间的任何值或范围。在一些实施方案中,一种或多种fao活化剂上调一种或多种fao和脂质代谢基因,包括但不限于核激素受体ppara、ppard、pparg、rxrb、rxrg、ncoa1、ncoa2;上游脂肪酸转运蛋白fabp3、fabp4、cd36、scarb1、fatp1-6;多种脂肪酶,包括lpl;限速肉毒碱棕榈酰转移酶cpt1a和cpt1b;肉毒碱乙酰化酶crat;酰基辅酶a脱氢酶acad和羟酰基辅酶a脱氢酶hadh;以及线粒体电子转移黄素蛋白etfa和etfb,这些可以促进成肌分化。
[0370]
可以使用本领域已知的任何方法来确定pax7、myod、myog、myh3、pparγ,、pparα,、
h3k9ac以及fao和脂质代谢途径中的基因的表达和/或活性,例如通过定量逆转录pcr、免疫染色、微阵列、rna测序、蛋白质印迹以及代谢组学和脂质组学分析。
[0371]
在一些实施方案中,一种或多种fao活化剂包括选自由以下项组成的组的基因的活化剂:脂质代谢的转录调节因子、脂肪酸转运蛋白、脂肪酶、肉毒碱棕榈酰转移酶、肉毒碱乙酰化酶、酰基辅酶a脱氢酶、羟酰基辅酶a脱氢酶和线粒体电子转移黄素蛋白。
[0372]
在一些实施方案中,一种或多种fao活化剂包括选自由以下项组成的组的基因的活化剂:pparα、pparδ、pparγ、rxrb、rxrg、ncoa1、ncoa2、fabp3、fabp4、cd36、scarb1、fatp1、fatp2、fatp3、fatp4、fatp5、fatp6、lpl、cpt1a、cpt1b、cpt1c、cpt2、crat、acad(例如,acad1、acad2、acad3、acad4、acad5、acad6、acad7、acad8、acad9、acad10、acad11、mcad、lcad、vlcad)、hadh(例如,hadha、hadhb)、etfa和etfb。
[0373]
在一些实施方案中,一种或多种fao活化剂((诸如pparγ激动剂,例如罗格列酮,以及/或者前列腺素,例如pgi2、pgd2或它们的类似物)在药物组合物中。药物组合物可被配制用于合适的递送途径,诸如口服、胃肠外、直肠、经鼻、局部或通过吸入。优选地,组合物被配制用于肌内、皮下或口服施用。
[0374]
在一些实施方案中,一种或多种fao活化剂包括一种或多种ppar活化剂。在一些实施方案中,一种或多种fao活化剂包括一种或多种pparγ活化剂。在一些实施方案中,一种或多种fao活化剂是ppar活化剂。在一些实施方案中,一种或多种fao活化剂是pparγ活化剂。
[0375]
任何合适的pparγ活化剂可用于本文所述的方法中。在一些实施方案中,一种或多种pparγ活化剂增加pparγ的表达。在一些实施方案中,一种或多种pparγ活化剂增加pparγ的活性。在一些实施方案中,pparγ活化剂是编码pparγ的核酸(例如,mrna)。在一些实施方案中,pparγ活化剂是增加pparγ的表达的mirna。在一些实施方案中,pparγ活化剂是pparγ激动剂。在一些实施方案中,pparγ活化剂是选自由pgi2、pgd2、它们的类似物以及它们的盐、溶剂化物、互变异构体和立体异构体组成的组的前列腺素。
[0376]
在一些实施方案中,一种或多种fao活化剂包括pparγ激动剂以及选自由pgi2、pgd2以及它们的类似物组成的组的前列腺素。在一些实施方案中,一种或多种fao活化剂是pparγ激动剂和pgi2的组合。在一些实施方案中,一种或多种fao活化剂是pparγ激动剂和pgi2的类似物的组合。在一些实施方案中,一种或多种fao活化剂是pparγ激动剂和pgd2的组合。
[0377]
pparγ激动剂
[0378]
pparγ激动剂是本领域已知的。可用于本文所述的方法的pparγ激动剂的合适示例包括称为噻唑烷二酮的噻唑烷(“tzd”)衍生物。示例性噻唑烷二酮包括但不限于罗格列酮、吡格列酮、普格列酮、曲格列酮、c1-991(parke-davis)、brl 49653、西格列酮、恩格列酮以及它们的化学衍生物。这些化合物通常已知用于治疗糖尿病。参见例如美国专利号4,812,570;4,775,687;4,725,610;4,582,839;以及4,572,912,了解此类化合物的示例性来源。美国专利号5,521,201和欧洲专利申请0008203、0139421、0155845、0177353、0193256、0207581和0208420以及chem.pharm.bull 30(10)3580-3600涉及噻唑烷二酮衍生物并且描述了各种tzd和tzd样类似物的商业来源/合成方案,这些可用于实施本技术的方法。另一种示例性ppar激动剂是格列扎类化合物,诸如阿格列扎、莫格列扎、替格列扎、拉格列扎和沙
罗格列扎。非噻唑烷二酮pparγ激动剂(诸如gw2570、elafibranor、wy-14643(匹立尼酸)、双酚a二缩水甘油醚(badge)、l-796,449、gw1929、t33、int131、fk614、2-(2-(4-苯氧基-2-丙基苯氧基)乙基)吲哚-5-乙酸、依法他酮、15d-pgj2、9-和13-羟基十八烷酸)、pgi2(前列环素)和前列环素类似物(诸如曲前列环素、卡巴环素、异卡环素、伊洛前列素(西洛前列素)、西卡前列素、西沙前列素、贝前列素和依前列醇)也可用于本文所述的方法中。本文所考虑的pparγ激动剂包括药学上可接受的盐、溶剂化物、互变异构体、立体异构体、前药和本领域已知的合适pparγ激动剂化合物的组合。
[0379]
在一些实施方案中,pparγ激动剂是式(i)的化合物:
[0380][0381]
或其盐、溶剂化物、互变异构体或立体异构体,其中r选自由氢、未取代和取代的c
1-6
烷基、未取代和取代的c
2-6
烯基、未取代和取代的c
2-6
炔基、未取代和取代的芳基、未取代和取代的杂芳基以及未取代和取代的杂环基组成的组。
[0382]
在一些实施方案中,pparγ激动剂是式(ii)的化合物:
[0383][0384]
或其盐、溶剂化物、互变异构体或立体异构体,其中r1和r4中的每一者独立地选自由氢、卤基、未取代的烷基、被1-3个卤基取代的烷基、未取代的烷氧基和被1-3个卤基取代的烷氧基组成的组;其中r2选自由卤基、羟基、未取代和取代的烷基组成的组;其中r
′2为氢,或者r2和r
′2一起形成氧代;其中r3为h;并且其中环a为苯基。
[0385]
在一些实施方案中,pparγ激动剂是罗格列酮或其盐、溶剂化物、互变异构体或立体异构体。
[0386]
在一些实施方案中,pparγ激动剂是式(iii)的化合物:
[0387][0388]
或其盐、溶剂化物、互变异构体或立体异构体。
[0389]
前列腺素
[0390]
在一些实施方案中,一种或多种fao活化剂包含活化pparγ的前列腺素,包括天然存在的前列腺素、其类似物、其盐、溶剂合物、互变异构体和立体异构体。活化pparγ的示例性前列腺素包括但不限于pgi2和pgd2。
[0391]
pgi2也称为前列环素。它是脂质分子类花生酸家族的前列腺素成员。当用作药物时,pgi2被称为依前列醇,用于治疗肺动脉高压。
[0392]
在一些实施方案中,一种或多种fao活化剂包括(或是)式(iv)的化合物:
[0393][0394]
或其盐、溶剂化物、互变异构体或立体异构体。
[0395]
在一些实施方案中,一种或多种fao活化剂包括pgi2的类似物。pgi2类似物是本领域已知的,包括但不限于伊洛前列素和曲前列环素。在一些实施方案中,pgi2类似物是曲前列环素或其盐、溶剂化物、互变异构体或立体异构体。在一些实施方案中,pgi2类似物是曲前列环素钠。
[0396]
在一些实施方案中,一种或多种fao活化剂包括(或是)式(v)的化合物:
[0397][0398]
或其盐、溶剂化物、互变异构体或立体异构体。
[0399]
pgd2是一种与受体ptgdr(dp1)以及crth2(dp2)结合的前列腺素。在一些实施方案中,一种或多种fao活化剂包括(或是)式(vi)的化合物:
[0400]
或其盐、溶剂化物、互变异构体或立体异构体。
[0401]
在一些实施方案中,一种或多种fao活化剂包括pgd2的类似物。在一些实施方案中,pdg2的类似物是式(vii)的化合物:
[0402]
或其盐、溶剂化物、互变异构体或立体异构体,其中r1和r2中的每一者选自由卤基、羟基、未取代和取代的烷基组成的组。
[0403]
在一些实施方案中,一种或多种fao活化剂是罗格列酮和pgi2的组合。在一些实施方案中,一种或多种fao活化剂是罗格列酮和曲前列环素的组合。在一些实施方案中,一种或多种fao活化剂是罗格列酮和pgd2的组合。
[0404]
在一些实施方案中,一种或多种fao活化剂是匹立尼酸(wy-14643)和pgi2的组合。在一些实施方案中,一种或多种fao活化剂是匹立尼酸(wy-14643)和pgd2的组合。在一些实施方案中,一种或多种fao活化剂是匹立尼酸(wy-14643)和曲前列环素的组合。
[0405]
v.试剂盒和制品
[0406]
本技术还提供了用于体外或体内肌肉再生方法中的任一种以及本文所述的治疗方法中的试剂盒、制剂、单位剂量和制品。
[0407]
在一些实施方案中,提供了一种用于促进组织形成细胞(例如,生肌细胞,诸如成肌细胞或肌细胞)肌生成和/或诱导其分化和/或成熟的试剂盒,该试剂盒包括一种或多种fao活化剂,诸如pparγ激动剂(例如,罗格列酮)和/或pgi2或其类似物(例如,曲前列环素)。在一些实施方案中,试剂盒可用于体外细胞培养。在一些实施方案中,试剂盒可用于离体培养组织形成细胞(例如,生肌细胞)。在一些实施方案中,试剂盒可用于体内应用。
[0408]
在一些实施方案中,提供了一种用于治疗个体的肌肉疾病或病症(例如,肌肉损伤或肌肉变性)的试剂盒,该试剂盒包括包含一种或多种fao活化剂诸如pparγ激动剂(例如,罗格列酮)和/或pgi2或其类似物(例如,曲前列环素)的药物组合物。在一些实施方案中,试剂盒还包括组织形成细胞(例如,生肌细胞,诸如成肌细胞和/或肌细胞)。
[0409]
试剂盒可含有另外的组分,诸如容器、试剂、培养基、缓冲剂等,以促进执行这些方法的任何实施方案。例如,在一些实施方案中,试剂盒还包括细胞收集和储存装置,其可以用于收集个体的组织形成细胞(例如,生肌细胞,诸如成肌细胞)。在一些实施方案中,试剂盒还包括用于增殖和/或分化组织形成细胞(例如,生肌细胞)的培养基或容器(例如,培养皿和培养板)。在一些实施方案中,试剂盒还包括用于评估组织形成细胞(例如,生肌细胞)
的生物标志物的免疫染色或组织学试剂。
[0410]
本技术的试剂盒在合适的包装中。合适的包装包括但不限于小瓶、瓶、罐、柔性包装(例如,mylar或塑料袋)等。试剂盒可任选地提供另外的组分,诸如解释性信息。因此,本技术还提供了制品,该制品包括小瓶(诸如密封小瓶)、瓶、罐、柔性包装等。
[0411]
试剂盒还可包括与一种或多种fao活化剂在本文所述的任何一种方法中的使用有关的说明书。在一些实施方案中,试剂盒还包括指导手册,诸如描述根据本文所述的肌肉再生方法或治疗方法中的任一种的方案的手册。说明书还可包括关于使用试剂盒用于预期治疗的一种或多种fao活化剂或组织形成细胞(例如,生肌细胞)的剂量、给药时间表和施用途径的信息。
[0412]
还提供了包含本文所述的一种或多种fao活化剂和制剂的单位剂型。这些单位剂型可以单一或多个单位剂量储存在适合包装中,并且还可被进一步灭菌和密封。在一些实施方案中,组合物(诸如药物组合物)容纳在单次使用的小瓶(诸如单次使用的密封小瓶)中。在一些实施方案中,组合物(诸如药物组合物)容纳在多次使用的小瓶中。在一些实施方案中,组合物(诸如药物组合物)散装地容纳在容器中。
[0413]
实施例
[0414]
下文的实施例旨在纯粹是本技术的示例,因此不应视为以任何方式限制本发明。以下实施例和详细描述是通过说明而非限制的方式提供的。
[0415]
实施例1:ppar驱动的脂肪酸氧化的早期瞬时爆发增强了组织再生
[0416]
通过仔细绘制原代人类成肌细胞分化早期阶段期间的代谢组学特征,我们发现在从增殖性原代成肌细胞向非增殖性肌细胞转变过程中线粒体脂肪酸氧化(fao)和氧化还原应激瞬时爆发。另外,我们记录了fao的这种爆发是特定于分化的早期阶段的,它与线粒体氧气消耗的瞬时增加有关,而线粒体生物发生或膜电位没有显著变化。从机制上讲,线粒体fao的早期爆发受myod、pparγ和pparα的瞬时上升调节,以促进人类肌细胞的早期细胞分化程序。我们发现pparγ-fao轴仅在分化的早期阶段具有促成肌性,而在分化的后期阶段具有抗成肌性。在体内,我们发现抗糖尿病pparγ激动剂罗格列酮进行早期瞬时治疗可以通过瞬时增加fao通量来增强小鼠骨骼肌再生,这对我们理解如何调节运动和营养以影响肌肉再生和变性具有重要意义。
[0417]
材料和方法
[0418]
基因表达综合数据库挖掘
[0419]
我们在基因表达综合(geo)数据库中挖掘了有关人类成肌细胞分化的转录组学数据(gse55034),并使用r bioconductor软件包对其进行了分析。
[0420]
代谢组学和脂质组学分析
[0421]
根据先前公开的方案(chong等人,2012)进行液相色谱-串联质谱(lc-ms/ms)代谢组学和脂质组学分析。
[0422]
maldi-ms成像分析
[0423]
所有msi实验均使用maldi-ft-icr仪器(solarix 9.4t,bruker daltonics)进行,该仪器配备有智能光束激光器(bruker daltonics),其质量范围m/z为100-1000,正离子模式,频率为1000hz,使用200次激光发射和100μm的空间分辨率。使用fleximaging 3.0软件(bruker daltonics)处理所有数据。
[0424]
细胞培养和药物治疗
[0425]
在明胶溶液(0.1%,merck-millipore)包被的平板上培养原代人类骨骼肌(hskm)祖细胞(gibco),并在加湿气氛(5%co2和37℃)中将其与由dmem/f-12(gibco)组成的生长培养基一起孵育,该生长培养基补充有胎牛血清(fbs)(20%,ge healthcare)、l-谷氨酰胺(1%,gibco)和青霉素-链霉素(1%,gibco)。通过用包含dmem/f-12、敲除血清替代物(2%,gibco)、l-谷氨酰胺(1%,gibco)和青霉素-链霉素(1%,gibco)的分化培养基替换生长培养基来诱导汇合的hskm祖细胞分化。对于药物处理(全部来自cayman chemical),将细胞与乙莫克舍(10um)、罗格列酮(10μm)、gw6471(0.1μm)、gsk3787(1um)、pgi2(10ng/ml)、曲前列环素(1nm)和gw9662(0.1μm)一起孵育。根据制造商的说明进行mitotracker red(200nm,thermo fisher)和jc1(2um,thermo fisher)染色,并利用zeiss荧光显微镜对染色细胞进行成像。
[0426]
使用聚乙烯亚胺转染hskm祖细胞
[0427]
将hskm祖细胞接种到明胶包被的平板上,并在生长培养基中培养。接种后一天,使用聚乙烯亚胺(pei)/rna的混合物转染hskm细胞。为了制备混合物,将pei连同以下rna与无血清dmem、hsa-let-7 mircury lna microrna power family抑制剂(yfi0450006,qiagen)混合:mirvana mirna模拟物hsa-let-7a-5p(4464066、测定id:mc10050,thermo fisher)和mirvana mirna模拟物hsa-let-7b-5p(4464066,测定id:mc11050,thermo fisher)的组合、myod1 sirna(4392420,sirna id:s9231,thermo fisher)、mlycd sirna trifecta dsirna试剂盒(设计id:hs.ri.mlycd.13,idt)或cy5-缀合的加扰rnai对照。将pei/rna转染混合物在室温下孵育20分钟,然后添加到hskm细胞中。24小时后,用生长培养基替换转染培养基。
[0428]
定量pcr
[0429]
使用trizol(thermo fisher)提取rna,并根据制造商的说明,利用superscript iii(thermo fisher)将其逆转录为cdna。将合成的cdna在h2o中稀释5倍,然后根据制造商的说明,利用kapa sybr fast(merck)在abi prism 7900ht(applied biosystems)实时pcr系统上进行qpcr。引物序列在表1中提供。
[0430]
表1:
[0431]
[0432]
mirna定量pcr
[0433]
诱导hskm祖细胞分化后,每12小时收集hskm细胞,持续84小时。将冷trizol(thermo fisher)试剂添加到hskm细胞上,并将细胞裂解物储存在-30c,直到所有样品均可用于rna分离。根据制造商的说明,通过miscript rt kit(qiagen)逆转录和扩增分离的rna样品。根据制造商的说明,使用miscript sybr green pcr试剂盒(qiagen)在abi prism 7900ht(applied biosystems)实时pcr系统上进行mirna定量pcr。使用以下miscript引物测定(qiagen):hs_let-7a_2(ms00031220)、hs_let-7b_1(ms00003122)、hs_let-7e_3(ms00031227)和hs_let-7g_2(ms00008337)。
[0434]
线粒体dna拷贝数测量
[0435]
诱导hskm祖细胞分化后,每12小时收集hskm细胞,持续84小时。根据制造商的说明,使用dneasy血液和组织试剂盒(qiagen)从hskm细胞中分离基因组dna。简而言之,将hskm细胞用磷酸盐缓冲盐水(pbs)(thermo fisher)洗涤,在37℃下胰蛋白酶化(0.25%,thermo fisher)3分钟,并以1300rpm离心3分钟。随后将收获的细胞团块储存在-80℃,直到所有样品都可用于dna分离。对于线粒体dna拷贝数测量,根据制造商的说明,使用kapa sybr fast(merck)在abi prism 7900ht(applied biosystems)实时pcr系统上进行基于qpcr的线粒体定量。引物序列在表2中提供。
[0436]
表2:
[0437][0438]
氧气消耗分析
[0439]
将hskm祖细胞接种到用明胶(0.1%,merck-millipore)预包被的seahorse xf96细胞培养微孔板(agilent)上的生长培养基中,每孔10,000个细胞。接种后2天,通过用分化培养基替换生长培养基来诱导hskm祖细胞分化。在进行seahorse xf细胞mito压力测试测定之前,用测定培养基(seahorse xf dmem培养基,ph 7.4,2mm丙酮酸,2mm谷氨酰胺)(agilent)替换细胞培养基,并在37℃的无co2培养箱中孵育1小时以平衡每个孔的温度和ph。在测定期间,依次注射寡霉素(2um,agilent)、fccp(0.5um,agilent)以及抗霉素a和鱼藤酮(0.5um,agilent)的混合物,并根据制造商的说明进行测量。使用wave软件分析数据。
[0440]
蛋白质印迹
[0441]
用补充有蛋白酶抑制剂混合物i和ii(merck)以及磷酸酶抑制剂混合物iii(merck)的ripa缓冲液(thermo fisher)提取蛋白质。用pierce bca蛋白测定试剂盒(thermo fisher)对蛋白质进行定量,并用sunrise tecan读板器进行分析。在sds-page和电转移到pvdf膜(ge healthcare)上后,用以下一抗进行蛋白质印迹:myod(1:50,sc-760,santa cruz biotechnology)、myog(1:200,sc-576,santa cruz biotechnology)、肌球蛋白重链mhc efluor 660(1:20,50-6503-82,thermo fisher)、α-辅肌动蛋白(sarcomeric)
(1:500,a7811,merck)、ppara(1:1000,cst)、ppard(1:1000,cst)、pparg(1:1000,2443s,cst)、h3k9ac(1:1000,cst)和gapdh(1:1000,sc-25778,santa cruz biotechnology)。随后,用二抗抗兔igg hrp缀合物(1:2500,w401b,promega)和抗小鼠igg hrp缀合物(1:2500,w402b,promega)对印迹进行染色。使用ecl prime蛋白质印迹检测试剂盒(ge healthcare)检测蛋白质水平。
[0442]
免疫荧光
[0443]
用pbs(thermo fisher)洗涤细胞,并用多聚甲醛(pfa)(4%,electron microscopy sciences)在室温下固定10分钟。用一抗肌球蛋白重链efluor 660(1:20,50-6503-82,thermo fisher)在4c下对细胞染色过夜。根据制造商的建议,将dapi(merck)用作核复染剂。利用zeiss荧光显微镜对染色细胞进行成像。
[0444]
肌肉冷冻损伤
[0445]
通过腹膜内注射用氯胺酮和甲苯噻嗪(分别为120mg/kg和8mg/kg)的混合物麻醉八周龄的nod scid gamma(nsg)或c57bl/6小鼠。成功麻醉后,通过用70%乙醇擦拭对胫骨前肌(ta)或腓肠肌或股四头肌上的皮肤进行消毒,并在ta肌肉上切开一个3mm的切口。将干冰冷却的4mm金属探针直接施加到暴露的骨骼肌上,持续五秒,进行三个循环,以诱导冷冻损伤。此后,立即使用外科缝合器缝合切口。在加热灯下恢复2小时后,将小鼠随机分配到每个治疗组。使用胰岛素注射器(bd)将所有药物(罗格列酮(20mg/kg)、乙莫克舍(20mg/kg)、gw0742(1mg/kg)、gsk3787(5mg/kg)、非诺贝特(30mg/kg)、wy-14643(30mg/kg)、pgi2(3.2mm)、pgf1a(3.2mm)、pgd2(3.2mm)、pgg1(3.2mm)、曲前列环素(1mm)、hgf(4ng/ul)和dmso媒介物(全部来自cayman chemical))肌内注射到ta肌肉中。在实验结束时,使用握力计(bioseb)测量肌肉力量。冷冻损伤后七天至二十七天,对ta肌肉进行活检或收获ta肌肉用于组织学和蛋白质印迹。对于组织学样品,将ta肌肉在4%pfa溶液中孵育过夜并包埋在石蜡中。将样品连续切片直至耗尽,并在每12个5um厚的组织切片上进行苏木素和曙红(h&e)染色。显微镜成像后,使用imagej对冷冻损伤的肌纤维面积进行定量。对于蛋白质印迹样品,将ta肌肉在液氮中速冻,并使用tissuelyser ii(qiagen)在补充有蛋白酶抑制剂混合物i和ii(merck)以及磷酸酶抑制剂混合物iii(merck)的ripa缓冲液(thermo fisher)中进行均质化。
[0446]
gfp阳性hskm细胞的肌内注射
[0447]
将慢病毒egfp表达载体plenti cmv gfp blast(659-1)(addgene#17445)包装成慢病毒颗粒。为了获得gfp阳性hskm祖细胞,然后将细胞用病毒颗粒转导,并用含有杀稻瘟素(25ug/ml,invivogen)的生长培养基选择5-7天。如上所述对八周龄的nsg小鼠进行冷冻损伤,随后将小鼠随机分配为2组进行hskm移植,即罗格列酮处理的gfp阳性hskm和dmso处理的gfp阳性hskm。将gfp阳性hskm用含有罗格列酮或dmso对照的生长培养基处理24小时,并进行胰蛋白酶化用于细胞移植。将200万个hskm细胞重悬于100ul含有matrigel hesc-qualified matrix(1:1,corning)的生长培养基中。使用23号针头,将细胞悬液注射到ta肌肉中。冷冻损伤后7天,将ta肌肉收获在4%pfa中过夜并包埋在石蜡中。
[0448]
免疫组织化学
[0449]
使用切片机对包埋在石蜡中的胫骨前肌(ta)组织样品进行切片,并将其转移到leica microsystems plus载玻片上。将一些组织快速冷冻用于冷冻切片。将石蜡包埋的切
片在二甲苯(merck)中脱蜡2次(10分钟),然后在室温下依次转移到100%etoh(merck)、100%etoh、95%etoh和70%etoh(2分钟)中。然后将切片在去离子水中再水化(3分钟)。使用柠檬酸钠缓冲液(merck,ph 6.2,30分钟)中的2100retriever进行抗原修复。然后将载玻片在冷pbs中冷却(15分钟)并在室温下在封闭缓冲液中封闭(30分钟)。用以下抗体在4℃下在封闭缓冲液中过夜进行一抗染色:gfp(1:500,sc-9996,santa cruz)、pax7(5ug/ml,o42349,dshb)、myod(5ug/ml,sc-377460,santa cruz)、ki67(1:100,14-5698-82,thermo fisher)、胚胎mhc(myh3;1:100,sc-53091,santa cruz)、pdgfra(5ug/ml,af1062,r&d)、f4/80(1:100,ab6640,abcam)、pparg(1:1000,2443s,cst)和肌球蛋白重链efluor 660(1:20,50-6503-82,ebioscience)。在将载玻片在pbs中洗涤三次(10分钟)并用dapi复染后,用山羊抗小鼠igg二抗alexa fluor 488(1:500,a11001,thermo fisher)在室温下在封闭缓冲液中进行gfp的二抗染色(1小时)。
[0450]
结果
[0451]
早期原代人类成肌细胞分化的代谢组学分析
[0452]
为了全面地调查在成肌细胞分化初期阶段诱导的代谢变化,我们对原代人类成肌细胞和肌细胞进行了lc-ms/ms代谢组学分析。将原代人类成肌细胞置于血清戒断条件下48小时,以阻止增殖并诱导细胞分化产生原代人类肌细胞。血清戒断诱导原代人类成肌细胞的代谢组发生重大变化,因为它们经历了相变以分化成非增殖性肌细胞(图1a)。正如预期的处于成肌分化早期阶段的肌细胞,当它们活化pka信号传导和肌肉肌酸激酶时(naro等人,2003),我们观察到环amp、肌酸和磷酸肌酸显著增加(图1b)。与这些肌细胞特异性代谢变化同时,我们观察到短链酰基肉毒碱和己酰基肉毒碱(它们是线粒体β-氧化或脂肪酸氧化(fao)的中间体)显著增加(图1c)。相比之下,在成肌分化的该早期阶段,尚未观察到糖酵解中间体(包括乳酸盐产生)显著下降(图1d)。
[0453]
与氧化还原相关的代谢物随着fao中间体(包括氧化型谷胱甘肽、谷胱甘肽和nadh)的增加同时增加(图1e)。比较氧化型谷胱甘肽/还原型谷胱甘肽比率和nadh/nad
比率,我们的结果表明氧化应激和还原能力均有所增加。这与成肌细胞分化初期线粒体fao通量的增加是一致的,因为众所周知,线粒体fao可以有效地增加nadh和活性氧(ros)的产生。
[0454]
为了检查转录或转录后变化是否支持早期成肌分化中的fao增加,我们在geo数据库(gse55034)中挖掘了有关原代人类成肌细胞分化的转录组数据。我们发现,在原代人类成肌细胞分化开始后的第2天,多种脂质代谢和fao相关基因确实瞬时上调。其中包括脂质代谢的上游转录主调节因子,核激素受体ppara、pparg、rxrb、rxrg、ncoa1、ncoa2;上游脂肪酸转运蛋白fabp3、fabp4、cd36、scarb1、fatp1-6;以及多种脂肪酶,包括lpl(图1f)。此外,到第2天,我们还观察到fao相关基因的瞬时上调,包括限速肉毒碱棕榈酰转移酶cpt1a和cpt1b、肉毒碱乙酰化酶crat、各种酰基辅酶a脱氢酶acad和羟酰基辅酶a脱氢酶hadh以及线粒体电子转移黄素蛋白etfa和etfb(它们都对线粒体fao至关重要)(图1g)。应当注意,这些现象在原代人类成肌细胞分化的第7-14天消失,强烈表明线粒体fao仅在原代成肌细胞分化的早期阶段转录上调。
[0455]
人类成肌细胞早期分化期间的线粒体代谢
[0456]
为了测试线粒体氧化是否确实在成肌细胞分化的早期阶段功能性增加,我们用mitotracker red和jc1染料对增殖性原代人类成肌细胞和非增殖性肌细胞进行了染色,以
检查它们的线粒体体积和膜电位。我们发现,在血清戒断后仅48小时,人类肌细胞表现出线粒体体积显著增加(图2a和2b)。相比之下,我们没有观察到线粒体膜电位δψm有显著变化(图2c和2d),但jc1红色和jc1绿色信号都有所增加(图7),这与线粒体体积的整体增加一致。为了验证线粒体生物发生是否增加,我们检查了线粒体dna拷贝数,但在成肌分化的该早期阶段没有发现显著变化(图8),这表明线粒体体积的早期增加不是由于线粒体复制的增加。
[0457]
为了检查线粒体体积的早期增加是否转化为活性的增加,我们转向seahorse分析仪来测量基础和最大o2消耗率,并评估响应于线粒体酶扰动的线粒体etc流量和atp合成率。我们的分析表明,基础和最大o2消耗率最初在血清戒断12小时下降,但随着分化的进展随时间迅速上升(图2e和2f)。当非增殖性肌细胞刚形成时,o2消耗率在血清戒断约48小时达到峰值。然而,o2消耗率在血清戒断48小时后显著下降,并继续下降直到84小时(图2e和2f),此时多核肌管正在形成。因此,为了支持我们早期对fao代谢的发现,我们的seahorse分析仪结果表明,线粒体氧化在成肌分化早期从12-48小时瞬时上升,而在成肌融合和分化中期阶段从48-84小时下降,即使在整个过程中未检测到总核数和总生物量的显著变化。
[0458]
myod和ppar调节fao的瞬时爆发
[0459]
为了剖析细胞分化早期阶段线粒体fao瞬时增加的机制基础,我们对成肌分化的时间进程中的各种成肌和分化调节因子进行了rna分析。我们的结果表明,大多数成肌调节因子在血清戒断后单调地增加或减少,因此消除了它们作为驱动线粒体fao瞬时增加的候选者(图3a),myod1除外。只有myod1违抗单调趋势,并在成肌细胞分化12-36小时之间显示出瞬时增加(图3b)。有趣的是,一项研究还发现myod反式活化许多线粒体氧化基因以协调肌生成(shintaku等人,2016)。与这一观察结果一致,当我们用sirna敲低人类myod1时,我们可以显著降低人类肌细胞中的最大o2消耗率(图3c)。然而,myod sirna未能降低基础o2消耗率(图9),其在人类肌细胞中也显著增加,这表明其他调节因子可能参与促进成肌细胞分化期间线粒体fao的早期瞬时爆发。
[0460]
另一类代谢调节因子是let-7 mirna(zhu等人,2011;shyh-chang等人,2013;jun-hao等人,2016),已知这些调节因子通常在多种细胞类型中随着分化而积累。具体地,还已知let-7 mirna可以调节肌肉细胞中的胰岛素信号传导,并通过抑制pi3k-mtor信号传导上调线粒体fao。在原代人类成肌细胞分化期间,我们发现let-7e mirna在成肌细胞分化12-24小时之间确实表现出瞬时增加(图3d)。然而,当我们用lna安塔哥米尔敲低let-7 mirna时,基础o2消耗率保持不变(图3e)。当我们通过人工转染过表达let-7时,基础o2消耗率略有增加,但不显著(图3e)。此外,在let-7过表达或敲低后,最大基础o2消耗率略有下降(图10)。因此,我们得出结论,let-7 mirna上调不是肌细胞中线粒体fao早期瞬时爆发的重要原因。
[0461]
最后,我们转向fao的主要调节因子过氧化物酶体增殖物活化受体(ppar)。我们对人类成肌细胞分化时间进程的分析表明,pparγmrna从肌生成0-36小时经历了瞬时增加,到84小时下降回到接近基础水平(图3f)。通过蛋白质印迹在蛋白质水平上证实了这一点(图12)。当pparγ在0-36小时瞬时增加时,pparα也迅速上升,但此后保持稳定直到84小时。相比之下,pparδ在人类成肌细胞分化期间没有显著变化(图3f)。通过在一系列时间窗中仔细施用ppar抑制剂,我们试图测试ppar在调节fao早期瞬时爆发中的机制。我们的结果表
明,pparα/γ/δ都是维持人类肌细胞中增加的基础和最大o2消耗率所必需的(图3g和11)。具体地,我们发现pparα/γ抑制从0-72小时可以显著降低肌细胞的基础和最大呼吸,但之后从72小时-96小时则不会(图3g和11)。相比之下,pparδ抑制仅在0-24小时和48-72小时对基础呼吸产生显著影响,而在其他时间窗则没有(图3g)。有趣的是,当从0-96小时始终应用ppar抑制剂时,没有抑制剂可以降低呼吸,这表明当ppar被过度抑制时,补偿性应答被活化以维持人类肌细胞的更高基础呼吸。总而言之,我们的结果表明,ppar和myod在早期成肌细胞分化期间在调节线粒体fao方面发挥互补作用。
[0462]
通过在不同时间干扰fao来控制成肌细胞分化
[0463]
为了测试线粒体fao在成肌细胞分化中的重要性,我们在成肌细胞分化的不同时间窗中应用了低浓度的线粒体cpt1特异性抑制剂乙莫克舍,这避免了它们对辅酶a代谢的脱靶效应。我们发现线粒体fao抑制在成肌细胞分化0-24小时和24-48小时严重损害肌细胞存活(图4a),但在其他时间窗则没有,这表明cpt1介导的线粒体fao在0-48小时之间是瞬时但特异的需要。
[0464]
当通过蛋白质印迹分析剩余的贴壁肌细胞的肌细胞分化变化时,我们发现不同时间窗的线粒体fao抑制导致成肌标志物具有不同特征(图4b)。蛋白质印迹的定量结果使我们得出结论,0-24小时线粒体fao抑制产生mhc
低
;myog
低
表型(图4b-4d),这表明成肌分化被整体阻断。24h-48h线粒体fao抑制产生mhc
低
;myog
高
表型(图4b-4d),这表明myog 肌细胞现在被抑制融合和分化为mhc 肌管。48h-72h线粒体fao抑制产生mhc
高
;myog
低
表型(图4b-4d),这表明myog 肌细胞现在可以融合并分化为mhc 肌管,但是一些myog 肌细胞也被早熟耗尽。72h-96h线粒体fao抑制产生mhc
高
;myog
高
表型(图4b-4d),这表明晚期线粒体fao抑制实际上是增强成肌分化。这些结果进一步证明了线粒体fao在成肌细胞分化的早期阶段是特别需要的,并且fao在肌生成的后期阶段具有抑制性。
[0465]
当我们对人类肌细胞响应于线粒体fao抑制的o2消耗率进行seahorse分析时,我们发现只有乙莫克舍治疗的早期0-12小时和12-24小时时间窗可以降低o2消耗率(图4e),这进一步表明线粒体fao仅在早期成肌细胞分化期间是特别需要的。在乙莫克舍治疗的后期时间窗中,肌细胞和肌管似乎完全能够利用其他营养来源来促进线粒体氧化,而不损害生存或分化。
[0466]
确定了pparγ瞬时上升对线粒体fao的重要性,以及线粒体fao对早期成肌细胞分化的重要性之后,测试抗糖尿病pparγ激动剂是否可以增强早期成肌细胞分化是有意义的。我们以低密度在早期人类成肌细胞分化期间测试了公知的噻唑烷二酮avandia或罗格列酮。我们的测试表明,在0-24小时时间窗进行罗格列酮治疗独特地上调了成肌素(myog)、成年i型肌球蛋白重链(myh7)和围产期肌球蛋白重链(myh8)的mrna水平,而在其他时间窗处理在96小时结束时没有显著影响(图5a-5c)。当对罗格列酮处理的肌细胞进行免疫染色以分析肌生成标志物mhc蛋白和α-辅肌动蛋白时,很明显,0-24小时和24-48小时时间窗的罗格列酮处理显著增强了肌生成,但其他时间窗抑制了肌生成(图5d和5e)。我们对高密度接种的人类肌细胞重复了最佳的0-24小时罗格列酮处理,发现所得的人类肌管比对照人类肌管显著更加成熟和肥大(图5f)。通过蛋白质印迹对myog和mhc蛋白表达进行定量分析证实了这些观察结果(图5g-5i)。因此,在早期用pparγ激动剂处理可以特异性增强肌生成熟。相比之下,在原代人类成肌细胞分化的早期阶段(0-48小时)用特定shrna对pparγ
(pparg)进行tet抑制性敲低导致肌生成的几种标志物降低,包括肌球蛋白重链蛋白i、iia、和iix(图13a)以及acta1、myog、myh7和myh8的mrna(图13b)。因此,pparg对于成肌分化的早期阶段既是必要的又是足够的。
[0467]
通过pparγ-fao增强体内骨骼肌再生
[0468]
为了测试这些体外发现在体内环境中的效用,我们在不同时间点将一次推注pparγ激动剂罗格列酮直接注射到小鼠冷冻损伤的骨骼肌中(图6a)。我们将野生型小鼠的胫骨前肌(ta)冷冻损伤,然后在冷冻损伤后0小时、24小时或48小时将罗格列酮注射到损伤的ta肌肉中。初始冷冻损伤后4天,收集ta肌肉进行分析。蛋白质印迹分析表明,在冷冻损伤后24小时肌内注射罗格列酮引起myod和myog蛋白的表达最强(图6b和6c)。相对于dmso对照和0小时时间窗,在24小时和48小时注射罗格列酮使得几种mhc蛋白同种型和α-辅肌动蛋白水平的表达更强(图6b和6c)。对坏死面积进行定量证实,在24小时和48小时注射pparγ激动剂罗格列酮改善了体内骨骼肌再生(图6d)。
[0469]
为了评估这些发现是否在临床上与人类成肌细胞移植疗法(mtt;chua等人,2019)相关,并且为了测试罗格列酮对成肌细胞的影响是否是细胞自主的,我们在血清戒断条件下用dmso或罗格列酮预处理gfp 人类成肌细胞0-24小时时间窗,然后将人类成肌细胞原位注射到免疫缺陷nsg小鼠的冷冻损伤后24小时的ta肌肉中(图6e)。我们的免疫荧光分析结果表明,罗格列酮预处理显著增强了移入人类肌细胞中的mhc蛋白表达(图6f和6g),这表明用pparγ激动剂罗格列酮瞬时治疗可以增强人类成肌细胞移植介导的肌肉再生。
[0470]
为了证实这些体内效应依赖于pparγ-fao轴,我们相对于dmso对照测试了罗格列酮处理与罗格列酮 乙莫克舍处理。我们的结果表明,罗格列酮诱导的myog和mhc蛋白表达通过与乙莫克舍共同处理被废除(图6h和6i),这表明pparγ诱导肌生成依赖于线粒体fao。总而言之,我们的实验发现表明,pparγ-fao通路在肌细胞定型期间的肌生成早期阶段具有前所未有的促成肌性作用(0-48h;图6j)。
[0471]
为了证实这些发现与衰老骨骼肌中经常观察到的再生缺陷有关,我们首先检查了2岁老年小鼠(在生物学方面相当于60岁人类)的骨骼肌中的肌肉干细胞是否异常。免疫染色显示pax7 肌肉干细胞实际上在老年小鼠肌肉中增加(图14),这表明老年肌肉中的再生缺陷是由于肌肉干细胞分化异常下降,而不是肌肉干细胞增殖潜力异常下降。鉴于我们的发现,我们将pparγ激动剂罗格列酮应用于2岁老年小鼠。在》2岁老年小鼠的ta肌肉被冷冻损伤后,我们在不同时间点肌内注射单次推注pparγ激动剂,然后相对于年轻成年小鼠评估ta肌肉的再生和纤维化(图15a)。正如预期的,masson三色染色显示,与年轻成年小鼠相比,年老小鼠在肌肉再生后纤维化增加(图15b、15c)。与之前的dmso对照即24小时和48小时时间点相比,在早期0小时时间点进行肌内pparγ活化显著减少了纤维化(图15b、15c)。与这些结果一致,我们发现年老肌肉显示出比年轻成年小鼠低得多的胚胎mhc(emhc) 核再生指数(图15d)。我们发现,在早期0小时时间点,单次注射pparγ激动剂显著改善了年老肌肉的再生指数,甚至超过了年轻成年小鼠肌肉(图15d)。相比之下,在24小时和48小时时间点进行肌内pparγ活化并未显示出再生指数的强烈改善。尽管与年轻成年小鼠相比,老年小鼠的最佳时间点变化得更早,但这可能是由于年老肌肉中pax7 肌肉干细胞的过早或预先存在的活化水平较高(图14)。单次推注pparγ激动剂不足以影响总体重和肥胖(图16a),但确实会瞬时增加年老ta肌肉中的fao通量(图16b)。因此,这些结果证实了pparγ诱导肌生
成可以使衰老肌肉再生恢复活力,但只有在肌生成的早期阶段施用时。
[0472]
组织再生中前列腺素的功能测定
[0473]
为了测试其他脂质中介物(诸如前列腺素)是否确实在骨骼肌再生中发挥重要作用,我们将单次推注与青年相关的前列腺素pgi2注射到损伤后0小时的ta肌肉中。对emhc 核再生指数的评估显示,pgi2显著促进了肌肉再生,但仅到第6天(图17a)。注射前列腺素pgf1a略微减少了再生(图17b),前列腺素pgd2略微增加了再生(图17c),而前列腺素pgg1没有引起显著变化(图17d)。
[0474]
pgi2在调节pparg和活化干细胞成为定型祖细胞中的新作用
[0475]
虽然gpcr驱动的camp产生通常被认为是pgi2信号传导的下游机制(narumiya等人,1999,doi:10.1152/physrev.1999.79.4.1193),但结果表明,注射pgi2后camp显著降低(***p《0.001,图18a),因此排除了pgi2可能通过camp将信号传导至蛋白激酶a(pka)而发挥其促再生作用的可能性,并通过其他靶标支持pgi2的机制。以前的工作已表明,pgi2可以调节ppara和ppard(forman等人,1997,doi:10.1073/pnas.94.9.4312;he等人,2008,doi:10.1161/circresaha.108.176057;li等人,2011,doi:10.1165/rcmb.2010-0428oc),其在调节pparg中的作用尚不清楚。鉴于我们的上述发现,我们检查了pgi2施用是否可以上调pparg表达。免疫染色显示,单次推注pgi2确实可以在再生骨骼肌中显著增加pparg 细胞(图18b)和pparg(但不是ppara或ppard)mrna表达(图18c)。伴随pparg mrna的增加,多种成肌标志物mrna诸如pax7、myod、myog和myh3也显著增加(图18d)。为了验证pgi2直接作用于成肌细胞,我们用一系列pgi2相关药物处理纯原代人类成肌细胞。蛋白质印迹显示,pgi2、pgi2类似物曲前列环素和罗格列酮可以稳定和/或上调pparg蛋白水平(图18e)。同时,干细胞活化和祖细胞定型的一般标志物h3k9ac(乙酰化组蛋白h3赖氨酸9)以及干细胞活化的肌肉祖细胞特异性标志物myod也遵循与pparg相同的调节模式,表明pgi2-pparg驱动的fao和乙酰辅酶a合成促进了h3k9乙酰化,从而促进了成肌细胞定型。与此一致,用pgi2处理增殖性成肌细胞(分化前24小时)增加了成肌分化的多种mrna标志物,包括myhc、myh3、myh8和acta1(图18f),而用pgi2处理分化性成肌细胞(分化后24小时)降低了成肌分化的多种mrna标志物,包括myog、myhc、myh2、myh3、myh7、myh8、acta1,并增加了成肌细胞的一些mrna标志物,包括myod1和pax3(图18g)。这些结果表明,长期暴露于pgi2促进了定型成肌细胞的中间状态,并阻止它们进行终末分化。如果属实,早期将pgi2推注到损伤肌肉中应该会瞬时增加pgi2-pparg-fao-h3k9信号传导,以活化肌肉干细胞成为定型成肌细胞和肌细胞,从而促进肌肉再生。事实上,我们发现在损伤后0小时单次推注pgi2显著增加了所有肌生成标志物,包括到第6天显著增加了再生ta肌肉的损伤区域和非损伤区域中的胚胎mhc(myh3)蛋白表达(图18h)。详细的分析表明,早期推注pgi2抑制了ppara蛋白,增加了pparg蛋白,并且早在第1-2天增加了再生肌肉的损伤区域中的h3k9ac水平(图18i),这进一步支持了我们的假设。
[0476]
pgi2与pparg在促进组织再生中的新协同作用
[0477]
骨骼肌再生的进行分析证实,在损伤后0小时单次推注pgi2显著增加了肌肉再生早期阶段(第2-4天)myog ki67 定型成肌细胞的数量(图19a)。为了优化pgi2的浓度,我们进行了一系列滴定注射。我们的结果表明,再生指数不随pgi2浓度线性增加,而是饱和并在6.5-13mm左右达到峰值(图19b)。类似地,再生指数不随罗格列酮浓度线性增加,而是饱和
并在0.5mg/ul左右达到峰值(图19c)。单独地,我们发现pgi2类似物曲前列环素也可以到第6天增加再生肌肉中的pax7、myod、myog和myh3蛋白表达,表明pgi2类似物药物在肌肉中具有类似于pgi2的促再生作用(图19d)。因为pgi2信号传导在这些浓度的pgi2类似物下可能已经饱和,所以我们加入另一次pparg激动剂注射以试图增加再生。出人意料的是,在损伤后24小时额外注射pparg激动剂罗格列酮导致myod、myog和myh3蛋白表达急剧增加(图19d),表明pgi2与pparg激动剂协同以促进肌肉再生。单独或组合的pgi2和罗格列酮的最佳浓度的平行测试证实,最佳pgi2与最佳罗格列酮协同以进一步增强肌肉再生(p《0.001,图19e)。pgi2类似物曲前列环素在再生指数中显示出相似的协同作用结果(图19f)。损伤和未损伤区域中肌纤维横截面直径的量化证实,罗格列酮与pgi2或pgi2类似物曲前列环素组合可以协同促进损伤后肌肉肥大生长(图19g、19h)和握力(图19i)。
[0478]
pgi2-pparg信号传导促进干细胞活化并抑制组织纤维化
[0479]
pgi2信号传导除了促进肌肉干细胞在肌生成早期活化并进入定型成肌细胞的中间状态外,还促进成肌细胞的增殖能力。使用纯原代人类成肌细胞,我们发现长期的pgi2处理可以显著提高早期传代(图20a)和晚期传代成肌细胞(图20b)的增殖率。
[0480]
此外,我们发现在腹膜内注射单次推注pgi2类似物曲前列环素后2天,腓肠肌中pax7 ki67 增殖性肌肉干细胞的分数、pax7 肌肉干细胞的总数和ki67 增殖细胞的总数甚至在没有损伤的情况下均显著增加(p《0.05)(图21a)。对于pgi2和曲前列环素,对于股四头肌(图21b)和ta肌肉也是如此(图21c)。另外,每天将pgi2、pgi2类似物曲前列环素或pparg激动剂罗格列酮注射到老年和肌少的2岁小鼠体内显著逆转了ta肌肉中由衰老引起的纤维化。当罗格列酮与pgi2或pgi2类似物联合时,纤维化面积的减少甚至更大(图21d)。肌肉切片的免疫荧光进一步显示,pgi2类似物曲前列环素或pparg激动剂罗格列酮均可以抑制pdgfra ki67 纤维化前体的数量。当罗格列酮与pgi2或pgi2类似物曲前列环素联合时,与衰老相关的纤维化前体的减少甚至更大(图21e)。
[0481]
曲前列环素还可以甚至在没有伤害刺激或损伤的情况下增加内胚层来源的肝脏组织中ki67 祖细胞的总数(图22a),表明pgi2信号传导可以促进骨骼肌以外的身体多种组织中的无损伤或无伤口组织再生。事实上,除了内胚层来源的肝脏组织外,曲前列环素还可以甚至在没有损伤的情况下增加中胚层来源的心脏和心肌组织中ki67 祖细胞的总数(图22b),以及甚至在没有伤害刺激或损伤的情况下增加神经外胚层来源的皮肤组织(图22c)和毛囊(图22d)中的ki67 祖细胞的总数。
[0482]
另外,每天将pgi2、pgi2类似物曲前列环素或pparg激动剂罗格列酮注射到老年和肌少的2岁小鼠体内显著逆转了多种非骨骼肌组织(包括肝脏(图23a)、皮肤(图23b)和心脏(图23c))中由衰老引起的纤维化。当罗格列酮与pgi2或pgi2类似物联合时,纤维化面积的减少甚至更大(图23a-c)。多种组织的免疫荧光进一步显示,pgi2类似物曲前列环素或pparg激动剂罗格列酮均可以抑制多种非骨骼肌组织(包括肝脏(图24a)、皮肤(图24b)和心脏(图24c))中的pdgfra ki67 纤维化前体数量。当罗格列酮与pgi2或pgi2类似物曲前列环素联合时,与衰老相关的纤维化前体的减少甚至更大(图24a-c)。
[0483]
因此,调节pgi2-pparg-fao-h3k9ac轴的药物可以在多种变性疾病中用于促进一般组织再生和逆转纤维化,其中组织变性时有或甚至没有明显伤害。此类变性疾病可以包括肌肉减少症、恶病质、废用性萎缩、炎性肌病、肌营养不良、心肌病、皮肤起皱、顽固性皮肤
溃疡、皮肤创伤、大疱病、脱发、瘢痕疙瘩、皮炎、黄斑变性、结肠炎、肝脂肪变性、脂肪性肝炎、肝纤维化、肝硬化、胰腺炎、2型糖尿病(t2d)、脂肪营养不良、慢性阻塞性肺病(copd)、肺纤维化、急性呼吸窘迫综合征(ards)、类风湿性关节炎、骨关节炎、骨质疏松症、神经变性疾病、脑梗塞、心肌梗塞、肺梗塞、骨折、胃溃疡、肠炎、慢性肾病、肾纤维化或者任何其他导致组织/器官/身体部分结构和功能丧失或萎缩的遗传决定的、环境决定的或特发性疾病过程。总的来说,我们的结果表明,前列腺素(pgi2)-ppar-fao-h3乙酰化途径可能是模拟运动和损伤刺活化化组织形成干细胞和驱动来源于所有三个胚层(包括内胚层、中胚层和神经外胚层)的组织以及骨骼肌和非骨骼肌组织再生的作用的一般机制。
[0484]
pgi2信号传导与pparg协同促进无伤口再生
[0485]
肝细胞生长因子(hgf)先前已被证明活化肌肉干细胞增殖(tatsumi等人,1998,doi:10.1006/dbio.1997.8803)。为了测试hgf是否与pgi2协同作用,我们在具有或没有hgf的情况下将pgi2注射到腓肠肌中。我们的结果表明,pgi2与hgf联合未能增加,而单独的hgf和单独的曲前列环素(tp)可以增加增殖成肌细胞(图25a)和增殖肌肉干细胞(图25b),因此排除了hgf与pgi2信号传导之间在活化干细胞中具有协同作用。
[0486]
ppard已被证明是血管细胞中pgi2的靶标(he等人,2008,doi:10.1161/circresaha.108.176057;li等人,2011,doi:10.1165/rcmb.2010-0428oc)。ppard激动剂先前也已被证明是运动模拟药物(narkar等人,2008;doi:10.1016/j.cell.2008.06.051)。我们的结果表明,在注射到腓肠肌后2天,单独的pgi2类似物(tp)显著增加了pax7 ki67 增殖性肌肉干细胞,而ppard激动剂gw0742令人惊讶地减少了该增殖性肌肉干细胞(图26a)。单独的ppard抑制剂gsk3787没有作用,但在共同处理时特异性地消除了tp的刺激作用,这表明ppard是部分必要的,但不足以驱动pgi2及其类似物的干细胞活化作用。我们的结果还出人意料地表明,单独的pgi2类似物(tp)在具有或没有gsk3787的ppard抑制的情况下略微增加了myod ki67 增殖性成肌细胞(图26b)。单独的ppard激动剂gw0742没有作用,但单独的ppard抑制剂gsk3787略微增加了增殖性成肌细胞,这表明ppard既不必要也不足以驱动pgi2及其类似物的干细胞活化作用,但如果受到抑制,则会产生复杂的反馈作用。
[0487]
为了确定ppard是否在肌肉再生中起作用,我们将单次推注ppard激动剂gw0742或ppard抑制剂gsk3787注射到损伤的ta肌肉中。结果表明,gw0742可以显著降低肌肉再生(图27),而gsk3787则不能,这表明ppard不能驱动骨骼肌再生。
[0488]
ppara也被证明是pgi2的直接结合靶标(forman等人,1997,doi:10.1073/pnas.94.9.4312),并且非诺贝特是ppara的特异性激动剂,而wy-14643是ppara和pparg的激动剂(分别为ec50=0.63和32um)。我们的结果表明,单独的pgi2类似物(tp)和单独的wy-14643显著增加了增殖性成肌细胞(图28a、30b)。单独的ppara激动剂非诺贝特(ff)没有作用,但在共同处理时特异性消除了tp的刺激作用,这表明ppara下调是必要的,但不足以驱动pgi2及其类似物的干细胞活化作用。相比之下,曲前列环素(tp)与wy-14643(wy)的联合处理甚至进一步协同增加了增殖性成肌细胞(图28a、28b),这表明pgi2信号传导与pparg而不是ppara协同以活化干细胞增殖。
[0489]
讨论
[0490]
脂肪酸氧化正在成为调节细胞命运的重要代谢途径。fao的下游效应包括通过amp/atp比率、nad /nadh比率实现的生物能相关信号传导,通过mtros实现的氧化还原应激
信号传导,以及如本文所示通过乙酰辅酶a实现的蛋白质乙酰化调节(shyh-chang和ng,2017)。之前的研究表明,维持静止的肌肉干细胞(musc)、造血干细胞(hsc)和肠道干细胞(isc)需要低水平的fao(ryall等人,2015;pala和tajbakhsh等人,jcs 2018;ito等人,2012;mihaylova等人,2018)。相反,我们之前已证明,过多的线粒体fao可以诱导过多的mtros和p38 mapk信号传导在恶病质期间引起组织萎缩(fukawa等人,2016)。在干细胞被活化增殖然后分化后,已知线粒体氧化能力将在终末分化结束时升高(remels等人,2010;wagatsuma和sakuma 2013)。然而,中间体变化(即氧化动力学、上游调节剂、精确的营养来源以及最重要的是在组织形成的每个阶段营养氧化的因果作用)都还不清楚。
[0491]
此处,我们发现fao在组织形成分化过程中具有惊人的动态性。在正常情况下,线粒体氧化在成肌细胞分化的前24小时内下降,随后是fao瞬时爆发,这仅是早期分化(24-48小时)为非增殖性肌细胞特别需要的。从机制上讲,fao的这种早期爆发是由pparγ驱动的。随后,pparγ驱动的fao在分化为静止肌管的中间阶段被下调。我们的发现完善了最近的一项研究(yucel等,2019)所描绘的画面,该研究仅表明线粒体氧化在成肌分化的前24小时内可能由于线粒体自噬而瞬时下降(sin等人,2016)。我们的发现表明,在细胞分化期间有2波线粒体氧化,并且由pparγ-fao轴驱动的第一波可以被精细控制以调节干细胞命运和组织再生,特别是因为pparγ-fao轴代表几乎每个步骤中显著的可成药途径。线粒体氧化增加的第二波可能是由ppara驱动的(图3f;biswas等人,2016),这导致终末分化结束时线粒体质量和氧化显著增加。因为有氧运动是一种在骨骼肌和其他组织中瞬时诱导线粒体fao的成熟方法,所以我们的工作对于运动代谢如何促进骨骼肌和非骨骼肌在损伤后的再生具有明显的意义。
[0492]
ppar核激素受体是众所周知的脂质代谢的主要调节因子。传统上,pparα被认为是肝脏中fao的活化剂,pparβ/δ是许多组织中fao的普遍调节因子,而pparγ是各种脂质代谢组织中脂肪生成的活化剂(manickham和wahli 2017)。虽然总体上属实,但一些研究已经开始表明pparγ也可以在其他组织中上调fao(benton等人,2008;sikder等人,2018)。
[0493]
事实上,先前关于pparγ敲除和抑制的研究产生了关于pparγ或其缺乏在骨骼肌发育和肌肉胰岛素敏感性中的作用的相互矛盾的结论(hunter等人,2001;hevener等人,2003;norris等人,2003;singh等人,2007;dammone等人,int j mol sci.2018)。与我们关于pparγ的0-96小时扰动的发现一致,肌肉特异性pparγ
ko
小鼠在骨骼肌发育中没有显示明显的表型(hevener等人,2003;norris等人,2003),但肌细胞甘油三酯含量增加约50%(hevener等人,2003),表明pparγ促进肌细胞中的脂质分解代谢。此外,发现组成型pparγ
ko
在体外增加原代小鼠成肌细胞的有丝分裂活性,这表明pparγ对于阻断成肌细胞中的增殖状态是必需的(dammone等人,2018)。并且虽然一些研究表明pparγ活化是抗成肌性的(hunter等人,2001;singh等人,2007),但其他研究表明pparγ抑制也是抗成肌性的(singh等人,2007)。在这里,我们的时间窗实验通过表明过度抑制任何ppar亚型可以导致代偿性反应并且pparγ-fao仅在早期成肌细胞分化中具有促成肌性,而在晚期肌生成中变成抗成肌性,从而阐明了这些相互矛盾的发现。
[0494]
另一个混杂因子是永生化c2c12细胞系与原代肌细胞之间的差异(dressel等人,2003;hu等人,2012)。我们的生物信息学分析表明,永生化c2c12最初已经从高水平的pparγ开始,仅在成肌分化时下调pparγ。与永生化c2c12相反,原代成肌细胞仅在早期分化过
程中瞬时上调pparγ,这对我们对永生化c2c12数据的解释具有重要意义。无论如何,之前的研究表明,ppar可以调节myod,并与myod协作以反式活化一些肌生成基因,包括线粒体ucp3(hunter等人,2001;solanes等人,2003)。此外,已经表明,myod还可以与非经典nf-kb relb协作以在多核肌管中诱导pgc1β和多种氧化基因(包括fao基因)的转录(shintaku等人,2017)。与这些发现一致,myod-relb-pgc1β转录网络可能是myod通过上调最大ocr所需的下游线粒体氧化机制来促进肌细胞中最大ocr的方式。相反,pparγ诱导上游脂肪酸代谢酶可以为线粒体fao提供食物,并上调原代人类肌细胞中ocr的基础速率。
[0495]
参考文献
[0496]
anchelin,m.,et al.(2011).plos one 6,e16955.
[0497]
baker,d.j.,et al.(2011).nature 479,232-236.
[0498]
balzer,e.,et al.(2010).development 137,891-900.
[0499]
bar-nur,o.,et al.(2018).stem cell reports 10(5),1501-1521.
[0500]
beaus
é
jour,c.m.,et al.(2003).embo j.22,4212-4222.
[0501]
bernet,j.d.,et al.(2014).nat.med.20,265-271.
[0502]
bigot,a.,et al.(2008).biol.cell 100,189-199.
[0503]
blau,h.m.,et al.(1983).proc.natl.acad.sci.u.s.a.80,4856-4860.
[0504]
blau,h.m.,cosgrove,b.d.,and ho,a.t.v(2015).nat.med.21,854-862.
[0505]
borchin,b.,chen,j.,and barberi,t.(2013)stem cell rep.1(6),620-631.
[0506]
brack,a.s.,and rando,t.a.(2012).cell stem cell 10,504-514.
[0507]
briske-anderson,et al.(1997).proc.soc.exp.biol.med.214,248-257.
[0508]
buckingham,m.,and relaix,f.(2015).cell dev.biol.44,115-125.
[0509]
capel,a.j.,et al.(2019).front.bioeng.biotechnol.,7,20.
[0510]
de cecco,et al.(2019).nature 566,73-78.
[0511]
chandel,n.s.,et al.(1998).proc.natl.acad.sci.u.s.a.95,11715-11720.
[0512]
chandel,n.s.,et al.(2000).j.biol.chem.275,25130-25138.
[0513]
chang,j.,etal.(2016).nat.med.22,78-83.
[0514]
cheung,t.h.,and rando,t.a.(2013).nat.rev.mol.cell biol.14,329-340.
[0515]
choi,y.,et al.(2019).biomaterials 206:160-169.
[0516]
christy,b.,et al.(2015).p53 and rapamycin are additive.oncotarget 6.
[0517]
chua,m.-w.j.,et al.(2019).assessment of different strategies for scalable production and
[0518]
proliferation of human myoblasts.cell prolif.doi:10.1111/cpr.12602.
[0519]
chung,c.y.,et al.(1999).biochem.biophys.res.commun.265,246-251.
[0520]
coletti,d.,et al.(2002).embo j.21,631-642.
[0521]
conboy,i.m.,and rando,t.a.(2002).dev.cell 3,397-409.
[0522]
conboy,m.j.,et al.,(2010).protocols for adult stem cells,methods in molecular biology
tm
(methods and protocols),vol 621.humana press.
[0523]
copley,m.r.,et al.(2013).nat.cell biol.15,916-925.
[0524]
cosgrove,b.d.,et al.(2014).nat.med.20,255-264.
[0525]
darabi,r.,et al.(2008)nat.med.14,134-143.
[0526]
darwin,c.,darwin,f.,and darwin,f.(1887).the life and letters of charles darwin,including an autobiographical chapter.edited by his son,francis darwin.(london,:john murray,).
[0527]
decary,s.,mouly,v.,and butler-browne,g.s.(1996).hum.gene ther.7,1347-1350.
[0528]
decary,s.,et al.(1997).hum.gene ther.8,1429-1438.
[0529]
demaria,m.,et al.(2014).dev.cell 31,722-733.
[0530]
deuchar,e.(1976).j.embryol.exp.morphol.35,345-354.
[0531]
drummond,m.j.,et al.(2011).physiol.genomics 43,595-603.
[0532]
elsaeidi,f.,et al.(2018).j.neurosci.38,2246-2261.
[0533]
emerling,b.m.,et al.(2005).mol.cell.biol.25,4853-4862.
[0534]
emerling,b.m.,et al.(2008).proc.natl.acad.sci.105,2622-2627.
[0535]
engleka,k.a.,et al.(2005).dev.biol.280,396-406.
[0536]
esquenet,m.,et al.(1997).j.steroid biochem.mol.biol.62,391-399.
[0537]
farr,j.n.,et al.(2017).nat.med.23,1072-1079.
[0538]
flamini,v.,et al.(2018).stem cell reports 10,970-983.
[0539]
fukawa,t.,et al.(2016).nat.med.22,666-671.
[0540]
garc
í
a-prat,l.,et al.(2016).autophagy 12,612-513.
[0541]
groskreutz,d.j.,et al.(1994).j.biol.chem.269(8),6241-5.
[0542]
grounds,m.d.(2014).bioarchitecture 4,81-87.
[0543]
gussoni,e.,blau,h.m.,and kunkel,l.m.(1997).nat.med.3,970-977.
[0544]
gutscher,m.,et al.(2008).nat.methods 5,553-559.
[0545]
hanson,g.t.,et al.(2004).j.biol.chem.279,13044-13053.
[0546]
hinds,s.et al.(2011).biomaterials,32(14),3575-3583.
[0547]
huang,y.(2012).wiley interdiscip.rev.rna 3,483-494.
[0548]
hutcheson,d.a.,et al.(2009).genes dev.23,997-1013.
[0549]
jeon,o.h.,et al.(2017).nat.med.23,775-781.
[0550]
kastenhuber,e.r.,and lowe,s.w.(2017).cell 170,1062-1078.
[0551]
khodabukus,a.and baar,k.(2009).tissue engineering part c:methods 15(3).
[0552]
kudlow,b.a.,et al.(2008).mol.biol.cell 19,5238-5248.
[0553]
l’honor
é
,a.,et al.(2014).dev.cell 29,392-405.
[0554]
l’honor
é
,a.,et al.(2018).elife 7.
[0555]
lau,a.,et al.(2019).j.clin.invest.129,4-11.
[0556]
le,m.t.n.,et al.(2011).plos genet.7,e1002242.
[0557]
lee,s.j.,et al.(2012).proc.natl.acad.sci.109,e2353-e2360.
[0558]
li t.et al.(2018).nano research 11(10),5240-5257.
[0559]
li,z.,et al.(2012).dev.cell 23,1176-1188.
[0560]
liu,n.,etal.(2017).nat.cell biol.19,202-213.
[0561]
ma,x.,et al.(2014).nat.commun.5,5212.
[0562]
majmundar,a.j.,et al.(2010).mol.cell 40,294-309.
[0563]
malhotra,j.d.,and kaufman,r.j.(2007).antioxid.redox signal.9,2277-2294.
[0564]
mendell,j.r.(1995).ann.neurol.37,3-4.
[0565]
miwa,s.,and brand,m.d.(2003).biochem.soc.trans.31,1300-1301.
[0566]
mullarky,e.,and cantley,l.c.(2015).diverting glycolysis to combat oxidative stress.
[0567]
nakada,y.,et al.(2017).nature 541,222-227.
[0568]
o’driscoll,l.,et al.(2006).j.endocrinol.191,665-676.
[0569]
pajcini,k.v,et al.(2010).stem cell 7,198-213.
[0570]
park,t.j.,et al.(2017).science.356,307-311.
[0571]
pearson,rd.(1984).acta biotheor.33,51-59.
[0572]
poletto,m.,et al.(2017).nucleic acids res.45,10042-10055.
[0573]
porrello,e.r.,et al.(2011).science.331,1078-1080.
[0574]
price,f.d.,v etal.(2014).nat.med.20,1174-1181.
[0575]
pronsato,l.,et al.(2013a).biocell 37,1-9.
[0576]
pronsato,l.,boland,r.,and milanesi,l.(2013b).arch.biochem.biophys.530,13-22.
[0577]
quintana,e.,et al.(2008).nature 456,593-598.
[0578]
robinton,d.a.,et al.(2019).dev.cell 48,396-405.e3.
[0579]
rodier,f.,campisi,j.,and bhaumik,d.(2007).nucleic acids res.35,7475-7484.
[0580]
ron,d.,and walter,p.(2007).nat.rev.mol.cell biol.8,519-529.
[0581]
rowe,r.g.,etal.(2016).j.exp.med.213,1497-1512.
[0582]
ryall,j.g.,etal.(2015).cell stem cell 16,171-183.
[0583]
sadek,h.a.,et al.(2014).stem cell reports 3,1.
[0584]
schienda,j.,et al.(2006).proc.natl.acad.sci.103,945-950.
[0585]
schwarzkopf,m.,et al.(2006).genes dev.20,3440-3452.
[0586]
semenza,g.l.,et al.(1994).j.biol.chem.269,23757-23763.
[0587]
sena,l.a.,and chandel,n.s.(2012).mol.cell 48,158-167.
[0588]
shah,m.v.,namigai,e.k.o.,and suzuki,y.(2011).mech.dev.128,342-358.
[0589]
sharples,a.p.,et al.(2011).j.cell.biochem.112,3773-3785.
[0590]
shelton,m.,et al.(2016).methods 101,73-84.
[0591]
shinoda,g.,et al.(2013).stem cells 31,1563-1573.
[0592]
shyh-chang,n.,and daley,g.q.(2013).cell stem cell 12,395-406.
[0593]
shyh-chang,n.,et al.(2013a).cell 155,778-792.
[0594]
shyh-chang,n.,daley,g.q.,and cantley,l.c.(2013b).development 140,
2535-2547.
[0595]
skuk,d.,et al.(2010).mol.ther.18,1689-1697.
[0596]
smith-bolton,r.k.,et al.(2009).dev.cell 16,797-809.
[0597]
sousa-victor,p.,et al.(2014).nature 506,316.
[0598]
stockley,t.l.,et al.(2000).j.lab.clin.med.135(6):484-92.
[0599]
takashima,y.,et al.(2016).hepatology 64,245-260.
[0600]
testa,s.,et al.(2018).materialstoday communications 15:120-123.
[0601]
tierney,m.t.,et al.(2014).nat.med.20,1182-1186.
[0602]
tierney,m.t.,et al.(2016).cell rep.14,1940-1952.
[0603]
urbach,a.,et al.(2014).genes dev.28,971-982.
[0604]
van raamsdonk,j.m.,et al.(2002).j.lab.clin.med.139(1),35-42.
[0605]
xipell,e.,et al.(2016).neuro.oncol.18,1109-1119.
[0606]
xu,m.,et al.(2018).nat.med.24,1246-1256.
[0607]
yang,m.,et al.(2015).development 142,1616-1627.
[0608]
yao,k.,etal.(2016).cell rep.17,165-178.
[0609]
yermalovich,a.v.,et al.(2019).nat.commun.10,168.
[0610]
yin,h.,price,f.,and rudnicki,m.a.(2013).physiol.rev.93,23-67.
[0611]
yuan,j.,et al.(2012).science.335,1195-1200.
[0612]
yun,j.,and finkel,t.(2014).cell metab.19,757-766.
[0613]
zhang,j.,et al.(2016).cell stem cell 19,66-80.
[0614]
zhu,h.,et al.(2011).cell 147,81-94.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。