用于x连锁青少年型视网膜劈裂症疗法的crispr和aav策略
1.相关申请的交叉引用
2.本技术要求于2019年11月8日提交的美国申请第62/932,608号的权益,所述美国申请出于所有目的通过引用整体并入本文。
3.对通过efs web作为文本文件提交的序列表的引用
4.写入文件694232seqlist.txt中的序列表为1.22兆字节,创建于2020年11月6日,并且特此通过引用并入。
背景技术:
5.rs1基因编码涉及视网膜的细胞组织的高度保守的胞外蛋白。所述基因由光感受器和双极细胞组装并分泌为同源寡聚蛋白复合物。已在rs1中检测到超过200种突变,其中许多因无功能蛋白或不存在蛋白分泌而导致黄斑变性的早期发作。缺乏功能性rs1表达会引起视网膜层内的分裂,导致与x连锁青少年型视网膜劈裂症(xlrs)相关的早期和进行性视力丧失。尽管已经有针对xlrs的基因疗法临床试验,但所述试验并未达到其终点。治疗xlrs需要新的策略。
技术实现要素:
6.提供了允许将视网膜劈裂素编码序列插入到靶基因组基因座如内源性rs1基因座中和/或表达视网膜劈裂素编码序列的核酸构建体和组合物。所述核酸构建体和组合物可以在用于整合到靶基因组基因座和/或在细胞中表达的方法中,或在治疗x连锁青少年型视网膜劈裂症的方法中使用。
7.一方面,提供了用于整合到靶基因组基因座中的双向核酸构建体。一些此类核酸构建体包括:(a)第一区段,所述第一区段包括第一视网膜劈裂素蛋白或其片段的第一编码序列;以及(b)第二区段,所述第二区段包括第二视网膜劈裂素蛋白或其片段的第二编码序列的反向补体。在一些此类构建体中,所述第二区段定位于所述第一区段的3'端(即,下游)。
8.在一些此类构建体中,所述第一视网膜劈裂素蛋白或其片段是人视网膜劈裂素蛋白或其片段,所述第二视网膜劈裂素蛋白或其片段是人视网膜劈裂素蛋白或其片段,或者所述第一视网膜劈裂素蛋白或其片段和所述第二视网膜劈裂素蛋白或其片段两者均是人视网膜劈裂素蛋白或其片段。在一些此类构建体中,所述第一编码序列包括互补dna(cdna)、基本上由其组成或由其组成,所述第二编码序列包括cdna、基本上由其组成或由其组成,或者所述第一编码序列和所述第二编码序列两者均包括cdna、基本上由其组成或由其组成。在一些此类构建体中,所述第一编码序列包括人rs1或其简并变体的外显子2-6、基本上由其组成或由其组成,所述第二编码序列包括人rs1或其简并变体的外显子2-6、基本上由其组成或由其组成,或者所述第一编码序列和所述第二编码序列两者均包括人rs1或其简并变体的外显子2-6、基本上由其组成或由其组成。
9.在一些此类构建体中,所述第一区段包括定位于所述第一编码序列的5'(即,上
游)的人rs1的第一内含子的片段或部分,和/或所述第二区段包括定位于所述第二编码序列的所述反向补体的3'(即,下游)的人rs1的第二内含子的片段或部分的反向补体。
10.在一些此类构建体中,所述第一视网膜劈裂素蛋白或其片段与所述第二视网膜劈裂素蛋白或其片段相同。在一些此类构建体中,所述第二编码序列采用与所述第一编码序列的密码子使用不同的密码子使用。在一些此类构建体中,所述第二区段与所述第一区段具有至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约97%或至少约99%互补性。在一些此类构建体中,所述第二区段与所述第一区段具有小于约30%、小于约35%、小于约40%、小于约45%、小于约50%、小于约55%、小于约60%、小于约65%、小于约70%、小于约75%、小于约80%、小于约85%、小于约90%、小于约95%、小于约97%或小于约99%互补性。在一些此类构建体中,所述第二编码序列的所述反向补体:(a)与所述第一编码序列没有明显互补;(b)与所述第一编码序列的片段没有明显互补;(c)与所述第一编码序列高度互补;(d)与所述第一编码序列的所述片段高度互补;(e)与所述第一编码序列的所述反向补体至少约60%、至少约70%、至少约80%或至少约90%相同;(f)与所述第一编码序列的所述反向补体约50%到约80%相同;或者(g)与所述第一编码序列的所述反向补体约60%到约100%相同。
11.在一些此类构建体中,所述第一区段通过连接子与所述第二区段连接。任选地,所述连接子的长度为约5到约2000个核苷酸。
12.在一些此类构建体中,所述第一区段包括定位于所述第一编码序列的3'端的第一聚腺苷酸化信号序列,并且所述第二区段包括定位于所述第二编码序列的所述反向补体的5'端的第二聚腺苷酸化信号序列的反向补体。任选地,所述第一聚腺苷酸化信号序列不同于所述第二聚腺苷酸化信号序列。
13.在一些此类构建体中,所述核酸构建体不包括驱动所述第一视网膜劈裂素蛋白或其片段或所述第二视网膜劈裂素蛋白或其片段的表达的启动子。在一些此类构建体中,所述第一区段包括定位于所述第一编码序列的5'端的第一剪接受体位点,并且所述第二区段包括定位于所述第二编码序列的所述反向补体的3'端的第二剪接受体位点的反向补体。任选地,所述第一剪接受体位点来自rs1基因,所述第二剪接受体位点来自rs1基因,或者所述第一剪接受体位点和所述第二剪接受体位点两者均来自rs1基因。任选地,所述第一剪接受体位点来自人rs1的内含子1,所述第二剪接受体位点来自人rs1的内含子1,或者所述第一受体位点和所述第二剪接受体位点两者均来自人rs1的内含子1。
14.在一些此类构建体中,所述核酸构建体不包括同源臂。在一些此类构建体中,所述核酸构建体包括同源臂。在一些此类构建体中,所述核酸构建体是单链的。在一些此类构建体中,所述核酸构建体是双链的。在一些此类构建体中,所述核酸构建体包括dna。
15.在一些此类构建体中,所述第一编码序列被密码子优化以在宿主细胞中表达,所述第二编码序列被密码子优化以在所述宿主细胞中表达,或者所述第一编码序列和所述第二编码序列两者均被密码子优化以在所述宿主细胞中表达。在一些此类构建体中,所述核酸构建体包括以下末端结构中的一个或多个末端结构:发夹、环、反向末端重复序列(itr)或超环面。任选地,所述核酸构建体包括itr。
16.在一些此类构建体中,所述第一视网膜劈裂素蛋白或其片段和/或所述第二视网
膜劈裂素蛋白或其片段包括与seq id no:5至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%相同的序列、基本上由其组成或由其组成。在一些此类构建体中,所述第一编码序列和/或所述第二编码序列包括与seq id no:8或9至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%相同的序列、基本上由其组成或由其组成。在一些此类构建体中,所述第一编码序列包括与seq id no:8至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%相同的序列、基本上由其组成或由其组成,并且所述第二编码序列包括与seq id no:9至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%相同的序列、基本上由其组成或由其组成。在一些此类构建体中,所述核酸构建体包括与seq id no:46或47至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%相同的序列、基本上由其组成或由其组成。
17.在一些此类构建体中,所述第二区段定位于所述第一区段的3'端,所述第一视网膜劈裂素蛋白或其片段和所述第二视网膜劈裂素蛋白或其片段两者均是人视网膜劈裂素蛋白或其片段,所述第一视网膜劈裂素蛋白或其片段与所述第二视网膜劈裂素蛋白或其片段相同,所述第一编码序列和所述第二编码序列两者均包括互补dna(cdna),所述cdna包括人rs1或其简并变体的外显子2-6,所述第二编码序列采用与所述第一编码序列的密码子使用不同的密码子使用,其中所述第一区段包括定位于所述第一编码序列的3'端的第一聚腺苷酸化信号序列,并且所述第二区段包括定位于所述第二编码序列的所述反向补体的5'端的第二聚腺苷酸化信号序列的反向补体,所述第一区段包括定位于所述第一编码序列的5'端的第一剪接受体位点,并且所述第二区段包括定位于所述第二编码序列的所述反向补体的3'端的第二剪接受体位点的反向补体,所述核酸构建体不包括驱动所述第一视网膜劈裂素蛋白或其片段或所述第二视网膜劈裂素蛋白或其片段的表达的启动子,并且所述核酸构建体不包括同源臂。
18.另一方面,提供了包括任何上述双向核酸构建体的载体。一些此类载体是病毒载体。任选地,所述载体是腺相关病毒(aav)载体。任选地,所述aav包括单链基因组(ssaav)。任选地,所述aav包括自身互补型基因组(scaav)。任选地,所述aav选自由以下组成的组:aav2、aav5、aav8或aav7m8。
19.一些此类载体不包括驱动所述第一视网膜劈裂素蛋白或其片段或所述第二视网膜劈裂素蛋白或其片段的表达的启动子。一些此类载体不包括同源臂。一些此类载体确实包括同源臂。
20.另一方面,提供了包括任何上述双向核酸构建体的脂质纳米颗粒。
21.另一方面,提供了包括任何上述双向核酸构建体的细胞。一些此类细胞是体外的。一些此类细胞是体内的。一些此类细胞是哺乳动物细胞。一些此类细胞是人细胞。一些此类细胞是视网膜细胞。
22.一些此类细胞表达所述第一视网膜劈裂素蛋白或其片段或所述第二视网膜劈裂素蛋白或其片段。在一些此类细胞中,所述核酸构建体在基因组上整合在所述靶基因组基
因座处。在一些此类细胞中,所述靶基因组基因座是内源性rs1基因座。任选地,所述核酸构建体在基因组上整合在所述内源性rs1基因座的内含子1中。任选地,内源性rs1外显子1剪接至所述核酸构建体的所述第一编码序列或所述第二编码序列中。任选地,包括在基因组上整合的核酸构建体的经修饰的rs1基因座编码包括与seq id no:2或4至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%相同的序列、基本上由其组成或由其组成的蛋白质。
23.在一些此类细胞中,将所述核酸构建体整合到所述内源性rs1基因座中阻止整合位点下游的内源性rs1基因转录。任选地,所述将所述核酸构建体整合到所述内源性rs1基因座中减少或消除内源性视网膜劈裂素蛋白的表达,并且用由所述核酸构建体编码的所述视网膜劈裂素蛋白或其片段的表达替代所述内源性视网膜劈裂素蛋白的表达。任选地,所述内源性rs1基因座包括突变的rs1基因,所述突变的rs1基因包括引起x连锁青少年型视网膜劈裂症的突变,并且所述在基因组上整合的核酸构建体的表达降低或消除所述突变的rs1基因的表达。
24.另一方面,提供了用于同源非依赖性靶向整合到靶基因组基因座中的核酸构建体。一些此类核酸构建体包括视网膜劈裂素蛋白或其片段的在每一侧上侧接有核酸酶药剂的核酸酶靶序列的编码序列。还提供了用于与靶基因座同源重组的核酸构建体。一些此类核酸构建体包括视网膜劈裂素蛋白或其片段的在每一侧上侧接有同源臂的编码序列,任选地其中所述编码序列和所述同源臂在每一侧上进一步侧接有核酸酶药剂的靶序列。任选地,每个同源臂的长度介于约25个核苷酸与约2.5kb之间。
25.在一些用于同源非依赖性靶向整合的此类构建体中,所述核酸构建体中的所述核酸酶靶序列与用于整合到所述靶基因组基因座中的核酸酶靶序列相同,其中所述靶基因组基因座中的所述核酸酶靶序列在所述核酸构建体以正确朝向插入时被破坏,但在所述核酸构建体以相反朝向插入到所述靶基因组基因座中时被重整。
26.在一些此类构建体中,所述视网膜劈裂素蛋白或其片段是人视网膜劈裂素蛋白或其片段。在一些此类构建体中,所述视网膜劈裂素蛋白或其片段的所述编码序列包括互补dna(cdna)、基本上由其组成或由其组成。在一些此类构建体中,所述视网膜劈裂素蛋白或其片段的所述编码序列包括人rs1或其简并变体的外显子2-6、基本上由其组成或由其组成。
27.在一些此类构建体中,所述核酸构建体包括定位于所述编码序列的5'端的人rs1的第一内含子的片段或部分。在一些此类构建体中,所述核酸构建体不包括驱动所述视网膜劈裂素蛋白或其片段的表达的启动子。在一些此类构建体中,所述核酸构建体包括定位于所述编码序列的3'端的聚腺苷酸化信号序列。在一些此类构建体中,所述核酸构建体包括定位于所述编码序列的5'端的剪接受体位点。任选地,所述剪接受体位点来自rs1基因。任选地,所述剪接受体位点来自人rs1的内含子1。
28.一些此类构建体是单链的。一些此类构建体是双链的。一些此类构建体包括dna。在一些此类构建体中,所述编码序列被密码子优化以在宿主细胞中表达。
29.在一些此类构建体中,所述构建体包括以下末端结构中的一个或多个末端结构:发夹、环、反向末端重复序列(itr)或超环面。任选地,包括所述编码序列和所述核酸酶靶序列的所述核酸构建体侧接有itr。
30.在一些此类构建体中,所述核酸酶药剂为cas蛋白和向导rna,并且所述核酸酶靶序列为向导rna靶序列。任选地,所述向导rna靶序列为反向向导rna靶序列。任选地,所述cas蛋白是cas9。
31.在一些此类构建体中,所述视网膜劈裂素蛋白或其片段包括与seq id no:5至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%相同的序列、基本上由其组成或由其组成。在一些此类构建体中,所述视网膜劈裂素蛋白或其片段的所述编码序列包括与seq id no:8或9至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%相同的序列、基本上由其组成或由其组成。在一些此类构建体中,所述核酸构建体包括与seq id no:45至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%相同的序列、基本上由其组成或由其组成。
32.在一些此类构建体中,所述核酸构建体是所述用于同源非依赖性靶向整合到所述靶基因组基因座中的核酸构建体,所述视网膜劈裂素蛋白或其片段是人视网膜劈裂素蛋白或其片段,所述视网膜劈裂素蛋白或其片段的所述编码序列包括包含人rs1或其简并变体的外显子2-6的互补dna(cdna),所述核酸构建体不包括驱动所述视网膜劈裂素蛋白或其片段的表达的启动子,所述核酸构建体包括定位于所述编码序列的3'端的聚腺苷酸化信号序列,所述核酸构建体包括定位于所述编码序列的5'端的剪接受体位点,并且所述核酸构建体中的所述核酸酶靶序列与用于整合到所述靶基因组基因座中的核酸酶靶序列相同,其中所述靶基因组基因座中的所述核酸酶靶序列在所述核酸构建体以正确朝向插入时被破坏,但在所述核酸构建体以相反朝向插入到所述靶基因组基因座中时被重整。
33.在一些此类构建体中,所述核酸构建体是所述用于与所述靶基因组基因座同源重组的核酸构建体,所述视网膜劈裂素蛋白或其片段是人视网膜劈裂素蛋白或其片段,所述视网膜劈裂素蛋白或其片段的所述编码序列包括包含人rs1或其简并变体的外显子2-6的互补dna(cdna),所述核酸构建体不包括驱动所述视网膜劈裂素蛋白或其片段的表达的启动子,所述核酸构建体包括定位于所述编码序列的3'端的聚腺苷酸化信号序列,所述核酸构建体包括定位于所述编码序列的5'端的剪接受体位点,并且每个同源臂的长度介于约25个核苷酸与约2.5kb之间。
34.另一方面,提供了包括用于同源非依赖性靶向整合的任何上述核酸构建体的载体。一些此类载体是病毒载体。一些此类载体是腺相关病毒(aav)载体。任选地,所述aav包括单链基因组(ssaav)。任选地,所述aav包括自身互补型基因组(scaav)。任选地,所述aav选自由以下组成的组:aav2、aav5、aav8或aav7m8。
35.在一些此类载体中,所述载体不包括驱动所述视网膜劈裂素蛋白或其片段的表达的启动子。在一些此类载体中,所述载体不包括同源臂。
36.另一方面,提供了包括用于同源非依赖性靶向整合的任何上述核酸构建体的脂质纳米颗粒。
37.另一方面,提供了包括用于同源非依赖性靶向整合的任何上述核酸构建体的细胞。一些此类细胞是体外的。一些此类细胞是体内的。一些此类细胞是哺乳动物细胞。一些此类细胞是人细胞。一些此类细胞是视网膜细胞。
38.在一些此类细胞中,所述细胞表达所述视网膜劈裂素蛋白或其片段。在一些此类细胞中,所述核酸构建体在基因组上整合在所述靶基因组基因座处。任选地,所述靶基因组基因座是内源性rs1基因座。任选地,所述核酸构建体在基因组上整合在所述内源性rs1基因座的内含子1中。任选地,内源性rs1外显子1剪接至所述核酸构建体中的所述视网膜劈裂素蛋白或其片段的所述编码序列中。任选地,包括在基因组上整合的核酸构建体的经修饰的rs1基因座编码包括与seq id no:2或4至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%相同的序列、基本上由其组成或由其组成的蛋白质。
39.在一些此类细胞中,将所述核酸构建体整合到所述内源性rs1基因座中阻止整合位点下游的内源性rs1基因转录。任选地,所述将所述核酸构建体整合到所述内源性rs1基因座中减少或消除内源性视网膜劈裂素蛋白的表达,并且用由所述核酸构建体编码的所述视网膜劈裂素蛋白或其片段的表达替代所述内源性视网膜劈裂素蛋白的表达。任选地,所述内源性rs1基因座包括突变的rs1基因,所述突变的rs1基因包括引起x连锁青少年型视网膜劈裂症的突变,并且所述在基因组上整合的核酸构建体的表达降低或消除所述突变的rs1基因的表达。
40.另一方面,提供了用于在细胞中表达视网膜劈裂素或用于将视网膜劈裂素蛋白或其片段的编码序列整合到细胞中的靶基因组基因座中的组合物。一些此类组合物包含:(a)核酸构建体,所述核酸构建体包括用于整合到所述靶基因组基因座中的所述视网膜劈裂素蛋白或其片段的所述编码序列;以及(b)核酸酶药剂或编码所述核酸酶药剂的核酸,其中所述核酸酶药剂靶向所述靶基因组基因座中的核酸酶靶序列。
41.一些此类组合物包括:(a)用于同源非依赖性靶向整合的任何上述核酸构建体;以及(b)核酸酶药剂或编码所述核酸酶药剂的核酸,其中所述核酸酶药剂靶向所述靶基因组基因座中的核酸酶靶序列。任选地,所述靶基因组基因座中的所述核酸酶靶序列与所述核酸构建体中的所述核酸酶靶序列相同。任选地,所述靶基因组基因座中的所述核酸酶靶序列在所述核酸构建体以正确朝向插入时被破坏,但在所述核酸构建体以相反朝向插入到所述靶基因组基因座中时被重整。
42.一些此类组合物包括:(a)任何上述双向核酸构建体;以及(b)核酸酶药剂或编码所述核酸酶药剂的核酸,其中所述核酸酶药剂靶向所述靶基因组基因座中的核酸酶靶序列。
43.在一些此类组合物中,所述靶基因组基因座处于rs1基因中。任选地,所述靶基因组基因座中的所述核酸酶靶序列处于所述rs1基因中的第一内含子中。任选地,将所述核酸构建体整合到所述内源性rs1基因座中阻止整合位点下游的内源性rs1基因转录。任选地,所述将所述核酸构建体整合到所述细胞中的所述内源性rs1基因座中减少或消除内源性视网膜劈裂素蛋白的表达,并且用由所述核酸构建体编码的所述视网膜劈裂素蛋白或其片段的表达替代所述内源性视网膜劈裂素蛋白的表达。
44.在一些此类组合物中,所述核酸酶药剂为cas蛋白和向导rna,并且所述核酸酶靶序列为向导rna靶序列。任选地,所述cas蛋白是cas9。任选地,所述组合物包括所述向导rna和编码所述cas蛋白的信使rna。任选地,所述向导rna和所述编码所述cas蛋白的信使rna处于脂质纳米颗粒中。任选地,所述组合物包括编码所述cas蛋白的dna和编码所述向导rna的
dna。任选地,所述编码所述cas蛋白的dna和所述编码所述向导rna的dna处于一种或多种病毒载体中。任选地,所述一种或多种病毒载体是腺相关病毒(aav)病毒载体。任选地,所述编码所述cas蛋白的dna和所述编码所述向导rna的dna处于单个病毒载体(例如,单个aav载体)中。任选地,所述编码所述cas蛋白的dna和所述编码所述向导rna的dna处于单独的病毒载体(例如,单独的aav载体)中。
45.在一些此类组合物中,所述核酸构建体处于病毒载体中。任选地,所述病毒载体是腺相关病毒(aav)病毒载体。任选地,所述aav选自由以下组成的组:aav2、aav5、aav8或aav7m8。
46.还提供了组合物,其包括向导rna或编码所述向导rna的dna,其中所述向导rna包括靶向rs1基因中的向导rna靶序列的dna靶向区段,并且其中所述向导rna与cas蛋白结合,并且将所述cas蛋白靶向到所述rs1基因中的所述向导rna靶序列。
47.在一些此类组合物或使用的组合物中,所述组合物进一步包括所述cas蛋白或编码所述cas蛋白的核酸。任选地,所述cas蛋白是cas9蛋白。任选地,所述cas蛋白源自酿脓链球菌(streptococcus pyogenes)cas9蛋白。在一些此类组合物或使用的组合物中,所述组合物包括呈蛋白质形式的cas蛋白。
48.在一些此类组合物或使用的组合物中,所述组合物包括编码所述cas蛋白的所述核酸,其中所述核酸包括编码所述cas蛋白的dna,任选地其中所述组合物包括编码所述向导rna的所述dna。任选地,所述组合物包括编码所述cas蛋白的所述核酸,其中所述核酸包括编码所述cas蛋白的dna,其中所述组合物包括编码所述向导rna的所述dna,并且其中所述编码所述cas蛋白的dna和所述编码所述向导rna的dna处于一种或多种病毒载体中。任选地,所述一种或多种病毒载体是腺相关病毒(aav)病毒载体。任选地,所述编码所述cas蛋白的dna和所述编码所述向导rna的dna处于单个病毒载体(例如,单个aav载体)中。任选地,所述编码所述cas蛋白的dna和所述编码所述向导rna的dna处于单独的病毒载体(例如,单独的aav载体)中。任选地,所述aav选自由以下组成的组:aav2、aav5、aav8或aav7m8。
49.在一些此类组合物或使用的组合物中,所述组合物包括编码所述cas蛋白的所述核酸,其中所述核酸包括编码所述cas蛋白的信使rna,任选地其中所述组合物包括呈rna形式的所述向导rna。在一些此类组合物或使用的组合物中,所述组合物包括编码所述cas蛋白的所述核酸,其中所述核酸包括编码所述cas蛋白的信使rna,其中所述组合物包括呈rna形式的所述向导rna,并且其中所述向导rna和所述编码所述cas蛋白的信使rna处于脂质纳米颗粒中。
50.在一些此类组合物或使用的组合物中,所述编码所述cas蛋白的信使rna包括至少一种修饰。任选地,所述编码所述cas蛋白的信使rna被修饰以包括在一个或多个或所有尿苷位置处的经修饰的尿苷。任选地,所述经修饰的尿苷是假尿苷。任选地,所述编码所述cas蛋白的信使rna被假尿苷完全取代。在一些此类组合物或使用的组合物中,所述编码所述cas蛋白的信使rna包括5'帽。在一些此类组合物或使用的组合物中,所述编码所述cas蛋白的信使rna包括poly(a)尾部。在一些此类组合物或使用的组合物中,所述编码所述cas蛋白的信使rna包括seq id no:6243或6245中所示的序列。
51.在一些此类组合物或使用的组合物中,所述编码所述cas蛋白的核酸被密码子优化以在哺乳动物细胞或人细胞中表达。在一些此类组合物或使用的组合物中,所述cas蛋白
包括seq id no:27、6242或6246中所示的序列。
52.在一些此类组合物或使用的组合物中,所述向导rna靶序列处于所述rs1基因的内含子中。任选地,所述内含子是所述rs1基因的第一内含子。
53.在一些此类组合物或使用的组合物中,所述rs1基因是人rs1基因。
54.在一些此类组合物或使用的组合物中,所述dna靶向区段包括:(a)seq id no:3148-6241中的任一个中所示的序列的至少17、至少18、至少19或至少20个连续核苷酸;(b)seq id no:3148-4989中的任一个中所示的序列的至少17、至少18、至少19或至少20个连续核苷酸;(c)seq id no:3148-3151、3154-3186、3188-3247和3249-4351中的任一个中所示的序列的至少17、至少18、至少19或至少20个连续核苷酸;(d)seq id no:3150、3151、3159、3675、4297和4304中的任一个中所示的序列的至少17、至少18、至少19或至少20个连续核苷酸;或者(e)seq id no:4990-6241中的任一个中所示的序列的至少17、至少18、至少19或至少20个连续核苷酸。
55.在一些此类组合物或使用的组合物中,所述dna靶向区段:(a)与seq id no:3148-6241中的任一个中所示的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同;(b)与seq id no:3148-4989中的任一个中所示的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同;(c)与seq id no:3148-3151、3154-3186、3188-3247和3249-4351中的任一个中所示的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同;(d)与seq id no:3150、3151、3159、3675、4297和4304中的任一个中所示的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同;或者(e)与seq id no:4990-6241中的任一个中所示的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同。
56.在一些此类组合物或使用的组合物中,所述dna靶向区段包括以下中所示的序列、基本上由所述序列组成或由所述序列组成:(a)seq id no:3148-6241中的任一个;(b)seq id no:3148-4989中的任一个;(c)seq id no:3148-3151、3154-3186、3188-3247和3249-4351中的任一个;(d)seq id no:3150、3151、3159、3675、4297和4304中的任一个;或者(e)seq id no:4990-6241中的任一个。
57.在一些此类组合物或使用的组合物中,所述dna靶向区段包括seq id no:3150、3151、3159、3675、4297和4304中的任一个中所示的序列的至少17、至少18、至少19或至少20个连续核苷酸。
58.在一些此类组合物或使用的组合物中,所述dna靶向区段与seq id no:3150、3151、3159、3675、4297和4304中的任一个中所示的序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同。
59.在一些此类组合物或使用的组合物中,所述dna靶向区段包括seq id no:3150、3151、3159、3675、4297和4304中的任一个中所示的序列、基本上由其组成或由其组成。
60.在一些此类组合物或使用的组合物中,所述组合物包括呈rna形式的所述向导rna。在一些此类组合物或使用的组合物中,所述组合物包括编码所述向导rna的所述dna。
61.在一些此类组合物或使用的组合物中,所述向导rna包括至少一种修饰。在一些此
类组合物或使用的组合物中,所述至少一种修饰包括经2'-o-甲基修饰的核苷酸。在一些此类组合物或使用的组合物中,所述至少一种修饰包括核苷酸之间的硫代磷酸酯键。在一些此类组合物或使用的组合物中,所述至少一种修饰包括所述向导rna的5'端处的前五个核苷酸中的一个或多个核苷酸处的修饰。在一些此类组合物或使用的组合物中,所述至少一种修饰包括所述向导rna的3'端处的最后五个核苷酸中的一个或多个核苷酸处的修饰。在一些此类组合物或使用的组合物中,所述至少一种修饰包括所述向导rna的5'端处的前四个核苷酸之间的硫代磷酸酯键。在一些此类组合物或使用的组合物中,所述至少一种修饰包括所述向导rna的3'端处的最后四个核苷酸之间的硫代磷酸酯键。在一些此类组合物或使用的组合物中,所述至少一种修饰包括所述向导rna的5'端处的前三个核苷酸处的经2'-o-甲基修饰的核苷酸。在一些此类组合物或使用的组合物中,所述至少一种修饰包括所述向导rna的3'端处的最后三个核苷酸处的经2'-o-甲基修饰的核苷酸。在一些此类组合物或使用的组合物中,所述至少一种修饰包括:(i)所述向导rna的5'端处的前四个核苷酸之间的硫代磷酸酯键;(ii)所述向导rna的3'端处的最后四个核苷酸之间的硫代磷酸酯键;(iii)所述向导rna的5'端处的前三个核苷酸处的经2'-o-甲基修饰的核苷酸;以及(iv)所述向导rna的3'端处的最后三个核苷酸处的经2'-o-甲基修饰的核苷酸。在一些此类组合物或使用的组合物中,所述向导rna包括seq id no:44的经修饰的核苷酸。
62.在一些此类组合物或使用的组合物中,所述向导rna是单向导rna(sgrna)。任选地,所述向导rna包括seq id no:33-39和53中的任一个中所示的序列、基本上由其组成或由其组成。在一些此类组合物或使用的组合物中,所述向导rna是包括两个单独的rna分子的双向导rna(dgrna),所述rna分子包括crispr rna(crrna)和反式激活crrna(tracrrna)。任选地,所述crrna包括seq id no:29和52中的任一个中所示的序列。任选地,所述tracrrna包括seq id no:30-32中的任一个中所示的序列。
63.在一些此类组合物或使用的组合物中,所述组合物与脂质纳米颗粒缔合,任选地其中所述组合物包括所述向导rna。在一些此类组合物或使用的组合物中,所述编码所述向导rna的dna处于病毒载体中。在一些此类组合物或使用的组合物中,所述病毒载体是腺相关病毒(aav)病毒载体。任选地,所述编码所述cas蛋白的dna和所述编码所述向导rna的dna处于单个病毒载体(例如,单个aav载体)中。任选地,所述编码所述cas蛋白的dna和所述编码所述向导rna的dna处于单独的病毒载体(例如,单独的aav载体)中。任选地,所述aav选自由以下组成的组:aav2、aav5、aav8或aav7m8。
64.在一些此类组合物或使用的组合物中,所述组合物是包括药学上可接受的载体的药物组合物。
65.在一些此类组合物或使用的组合物中,所述组合物进一步包括第二向导rna或编码所述第二向导rna的dna,其中所述第二向导rna包括靶向所述rs1基因中的第二向导rna靶序列的dna靶向区段,并且其中所述第二向导rna与所述cas蛋白结合,并且将所述cas蛋白靶向到所述rs1基因中的所述第二向导rna靶序列。
66.还提供了包括任何上述组合物或使用的组合物的细胞。任选地,所述细胞在体外。任选地,所述细胞在体内。一些此类细胞是哺乳动物细胞。任选地,所述细胞是人细胞。任选地,所述细胞是视网膜细胞。
67.在一些此类细胞中,所述细胞表达所述第一视网膜劈裂素蛋白或其片段或所述第
二视网膜劈裂素蛋白或其片段。在一些此类细胞中,所述核酸构建体在基因组上整合在所述靶基因组基因座处。任选地,所述靶基因组基因座是内源性rs1基因座。任选地,所述核酸构建体在基因组上整合在所述内源性rs1基因座的内含子1中。任选地,内源性rs1外显子1剪接至所述核酸构建体的所述第一编码序列或所述第二编码序列中。任选地,包括在基因组上整合的核酸构建体的经修饰的rs1基因座编码包括与seq id no:2或4至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%相同的序列、基本上由其组成或由其组成的蛋白质。
68.在一些此类细胞中,将所述核酸构建体整合到所述内源性rs1基因座中阻止整合位点下游的内源性rs1基因转录。任选地,所述将所述核酸构建体整合到所述内源性rs1基因座中减少或消除内源性视网膜劈裂素蛋白的表达,并且用由所述核酸构建体编码的所述视网膜劈裂素蛋白或其片段的表达替代所述内源性视网膜劈裂素蛋白的表达。任选地,所述内源性rs1基因座包括突变的rs1基因,所述突变的rs1基因包括引起x连锁青少年型视网膜劈裂症的突变,并且所述在基因组上整合的核酸构建体的表达降低或消除所述突变的rs1基因的表达。
69.另一方面,提供了将视网膜劈裂素蛋白或其片段的编码序列整合到靶基因组基因座中并且在细胞中表达所述视网膜劈裂素蛋白或其片段的方法。一些此类方法包括向所述细胞施用任何上述核酸构建体、载体、脂质纳米颗粒或组合物,其中所述编码序列被整合到所述靶基因组基因座中,并且所述视网膜劈裂素蛋白或其片段在所述细胞中表达。任选地,所述细胞是哺乳动物细胞。任选地,所述细胞是人细胞。任选地,所述细胞是视网膜细胞。任选地,所述细胞在体外。任选地,所述细胞在体内。任选地,所述细胞是体内的视网膜细胞,并且所述施用包括视网膜下注射或玻璃体内注射。
70.在一些此类方法中,所述核酸构建体和所述核酸酶药剂或所述编码所述核酸酶药剂的核酸是同时施用的。在一些此类方法中,所述核酸构建体和所述核酸酶药剂或所述编码所述核酸酶药剂的核酸是以任何顺序依次施用的。任选地,在所述核酸酶药剂或所述编码所述核酸酶药剂的核酸之前施用所述核酸构建体。任选地,在所述核酸酶药剂或所述编码所述核酸酶药剂的核酸之后施用所述核酸构建体。任选地,连续施用之间的时间为约2小时到约48小时。在一些此类方法中,所述核酸构建体和所述核酸酶药剂或所述编码所述核酸酶药剂的核酸是在相同的递送媒剂中施用的。在一些此类方法中,所述核酸构建体和所述核酸酶药剂或所述编码所述核酸酶药剂的核酸是在不同的递送媒剂中施用的。
71.在一些此类组合物中,所述靶基因组基因座处于内源性rs1基因中。任选地,所述靶基因组基因座中的所述核酸酶靶序列处于所述内源性rs1基因中的第一内含子中。任选地,所述核酸构建体在基因组上整合在所述内源性rs1基因座的内含子1中,并且其中内源性rs1外显子1剪接至所述核酸构建体中的所述视网膜劈裂素蛋白或其片段的所述编码序列中。任选地,包括在基因组上整合的核酸构建体的经修饰的rs1基因座编码包括与seq id no:2或4至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%相同的序列、基本上由其组成或由其组成的蛋白质。在一些此类方法中,将所述核酸构建体整合到所述内源性rs1基因座中阻止整合位点下游的内源性rs1基因转录。任选地,所述将所述核酸构建体整合到所述内源性rs1基因座中减少或消除来自所述内源性rs1基因座的内源性视网膜劈裂素蛋白的表达,并
且用由所述核酸构建体编码的所述视网膜劈裂素蛋白或其片段的表达替代所述内源性视网膜劈裂素蛋白的表达。
72.另一方面,提供了治疗患有x连锁青少年型视网膜劈裂症的受试者的方法。一些此类方法可以包括向所述受试者施用任何上述核酸构建体、载体、脂质纳米颗粒或组合物,其中所述核酸构建体被整合到所述受试者的一个或多个视网膜细胞中的所述靶基因组基因座中并由所述靶基因组基因座表达,并且其中在所述受试者中实现了治疗有效水平的视网膜劈裂素表达。在一些此类方法中,所述受试者是人。在一些此类方法中,所述受试者具有内源性rs1基因,所述内源性rs1基因包括与x连锁青少年型视网膜劈裂症相关或引起x连锁青少年型视网膜劈裂症的至少一种突变。任选地,所述突变是r141c突变。在一些此类方法中,所述施用包括视网膜下注射或玻璃体内注射。在一些此类方法中,所述核酸构建体的整合引起视网膜结构恢复。
73.在一些此类方法中,所述核酸构建体和所述核酸酶药剂或所述编码所述核酸酶药剂的核酸是同时施用的。在一些此类方法中,所述核酸构建体和所述核酸酶药剂或所述编码所述核酸酶药剂的核酸是以任何顺序依次施用的。任选地,在所述核酸酶药剂或所述编码所述核酸酶药剂的核酸之前施用所述核酸构建体。任选地,在所述核酸酶药剂或所述编码所述核酸酶药剂的核酸之后施用所述核酸构建体。任选地,连续施用之间的时间为约2小时到约48小时。在一些此类方法中,所述核酸构建体和所述核酸酶药剂或所述编码所述核酸酶药剂的核酸是在相同的递送媒剂中施用的。在一些此类方法中,所述核酸构建体和所述核酸酶药剂或所述编码所述核酸酶药剂的核酸是在不同的递送媒剂中施用的。
74.在一些此类组合物中,所述靶基因组基因座处于内源性rs1基因中。任选地,所述靶基因组基因座中的所述核酸酶靶序列处于所述内源性rs1基因中的第一内含子中。任选地,所述核酸构建体在基因组上整合在所述内源性rs1基因座的内含子1中,并且其中内源性rs1外显子1剪接至所述核酸构建体中的所述视网膜劈裂素蛋白或其片段的所述编码序列中。任选地,包括在基因组上整合的核酸构建体的经修饰的rs1基因座编码包括与seq id no:2或4至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%相同的序列、基本上由其组成或由其组成的蛋白质。在一些此类方法中,将所述核酸构建体整合到所述内源性rs1基因座中阻止整合位点下游的内源性rs1基因转录。任选地,所述将所述核酸构建体整合到所述内源性rs1基因座中减少或消除来自所述内源性rs1基因座的内源性视网膜劈裂素蛋白的表达,并且用由所述核酸构建体编码的所述视网膜劈裂素蛋白或其片段的表达替代所述内源性视网膜劈裂素蛋白的表达。
75.另一方面,提供了修饰细胞中的rs1基因的方法。一些此类方法包括向所述细胞施用任何上述组合物,所述组合物包括所述向导rna或编码所述向导rna的所述dna和所述cas蛋白或编码所述cas蛋白的所述核酸,其中所述向导rna与所述cas蛋白结合,并且将所述cas蛋白靶向到所述rs1基因中的所述向导rna靶序列,并且所述cas蛋白切割所述向导rna靶序列。在一些此类方法中,所述细胞是哺乳动物细胞。任选地,所述细胞是人细胞。任选地,所述细胞是视网膜细胞。任选地,所述细胞在体外。任选地,所述细胞在体内。在一些此类方法中,所述细胞是视网膜细胞,并且所述施用包括视网膜下注射或玻璃体内注射。在一些此类方法中,所述向导rna靶序列处于所述rs1基因中的第一内含子中。
附图说明
76.图1(未按比例)示出了鼠类rs1基因座的示意图,所述基因座包含与x连锁青少年型视网膜劈裂症(xlrs)相关的r141c突变的位置和包括人rs1的外显子2-6的核酸构建体的插入位点。
77.图2示出了小鼠视网膜劈裂素、人视网膜劈裂素、具有r141c突变的人视网膜劈裂素、具有r141c突变的小鼠视网膜劈裂素和在将包括人rs1的外显子2-6的核酸构建体整合到小鼠rs1基因座的内含子1中时表达的小鼠/人视网膜劈裂素杂合体的比对。
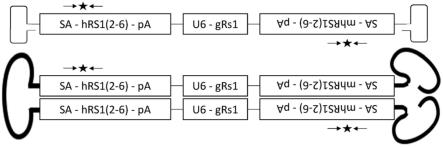
78.图3a(未按比例)示出了双向核酸构建体的示意图,所述双向核酸构建体包括包含剪接受体(a)、人rs1的外显子2-6和牛生长激素(bgh)polya的第一区段和包含sv40 polya的反向补体、人rs1的外显子2-6的反向补体和剪接受体的反向补体(a)的第二区段。双向构建体还包括u6启动子,所述启动子与编码靶向位于两个人rs1区段之间的鼠类rs1基因座的内含子1的向导rna的序列可操作地连接。侧接星形的水平箭头代表为ngs设计的下一代靶向重测序扩增子。双向ssaav结构在顶部处示出,并且双向scaav结构在底部处示出。
79.图3b(未按比例)示出了包括剪接受体(a)、人rs1的外显子2-6和polya序列的同源非依赖性靶向整合核酸构建体的示意图。构建体还包括u6启动子,所述启动子与编码靶向位于人rs1区段下游的鼠类rs1基因座的内含子1的向导rna的序列可操作地连接。侧接星形的水平箭头代表为ngs设计的下一代靶向重测序扩增子。
80.图4示出了来自注射有rs1病毒载体版本1、rs1病毒载体版本2或rs1病毒载体版本3的小鼠的眼睛的光学相干断层扫描(oct)扫描中示出的视网膜腔的评分。如果在至少一个单独的图像上有1-4个空腔,则分配的评分为1。如果在至少一个单独的图像上存在≥4个空腔,但空腔未融合,则分配的评分为2。如果在至少一个单独的图像上存在融合空腔,则分配的评分为3。如果在至少一个单独的图像上存在融合空腔并且视网膜被拉伸,则分配的评分为4。通过非参数克鲁斯卡尔-沃利斯(kruskal
–
wallis)单向方差分析和事后测试邓恩多重比较测试,将每个治疗组的平均评分与含有合并的未经治疗的眼睛的对照组进行比较。
81.图5示出了自注射有rs1病毒载体版本1(pssaav mhrs1-sgu)、rs1病毒载体版本2(pscaav rs1_tandem)或rs1病毒载体版本3(pssaav hrs1_hiti)的小鼠的眼睛中的小鼠视网膜样品的ngs结果。示出了四种预期的序列变体的读段计数:(1)wt小鼠,不含有r141c突变体的小鼠参考序列;(2)突变小鼠,含有r141c突变体的小鼠参考序列;(3)人源化转录物1,人参考序列;以及(4)人源化转录物2,小鼠密码子优化的人参考序列。下一代靶向重新测序扩增子是为图3中描绘的区设计的(水平箭头)。来自小鼠视网膜的mrna用于产生cdna,以充当下一代测序(ngs)扩增的模板。
82.图6a和6b示出了自注射有rs1病毒载体版本1(mhrs1-sgu)、rs1病毒载体版本2(pscaav_rs1_tandem)或rs1病毒载体版本3(hrs1_cdna hiti)的小鼠的眼睛中的小鼠视网膜样品的ngs结果。对于这些ngs结果,使用单独的扩增子来扩增rs1内含子1向导rna靶序列。对匹配小鼠参考序列或含有非同源末端接合的读段进行定量,以评估向导rna在不进行插入的情况下切割的频率。
83.图7a-7c示出了自注射有rs1病毒载体版本1(pssaav mhrs1-sgu;图7a)、rs1病毒载体版本2(pscaav rs1_tandem;图7b)或rs1病毒载体版本3(pssaav hrs1_hiti;图7c)的小鼠的眼睛中的小鼠视网膜样品的ngs结果。示出了四种预期的序列变体的读段计数:(1)wt小鼠,不含有r141c突变体的小鼠参考序列;(2)突变小鼠,含有r141c突变体的小鼠参考序列;(3)人源化转录物1,人参考序列;以及(4)人源化转录物2,小鼠密码子优化的人参考序列。下一代靶向重新测序扩增子是为图3中描绘的区设计的(水平箭头)。来自小鼠视网膜的mrna用于产生cdna,以充当下一代测序(ngs)扩增的模板。对匹配小鼠参考序列或含有非同源末端接合的读段进行定量,以评估向导rna在不进行插入的情况下切割的频率。
84.图8a和8b示出了在通过用cas9 mrna和靶向到人rs1内含子1的六种向导rna之一调配的脂质纳米颗粒进行处理之前,用rs1病毒载体版本1(pssaav mhrs1-sgu;图8a)或rs1病毒载体版本2(pscaav rs1_tandem;图8b)处理的人视网膜母细胞瘤细胞的rt-qpcr结果。示出了δct值(数字越小,表达越高)。“ho”是指人参考序列,并且“mo”是指针对小鼠表达进行密码子优化的人参考序列。
85.图9a和9b示出了在通过用cas9 mrna和靶向到人rs1内含子1的六种向导rna之一调配的脂质纳米颗粒进行处理之后,用rs1病毒载体版本1(pssaav mhrs1-sgu;图9a)或rs1病毒载体版本2(pscaav rs1_tandem;图9b)处理的人视网膜母细胞瘤细胞的rt-qpcr结果。示出了δct值(数字越小,表达越高)。“ho”是指人参考序列,并且“mo”是指针对小鼠表达进行密码子优化的人参考序列。
86.图10示出了用于同源重组的核酸构建体的示意图,所述核酸构建体包括剪接受体(a)、人rs1的外显子2-6和polya序列。构建体还包括u6启动子,所述启动子与编码靶向位于人rs1区段下游的鼠类rs1基因座的内含子1的向导rna的序列可操作地连接。所述构建体还包括上游和下游同源臂(ha)。侧接星形的水平箭头代表为ngs设计的下一代靶向重测序扩增子。
87.定义
88.本文可互换使用的术语“蛋白质”、“多肽”、和“肽”包含任何长度的聚合形式的氨基酸,包含编码氨基酸和非编码氨基酸以及以化学方式或生物化学方式修饰的氨基酸或以化学方式或生物化学方式衍生的氨基酸。这些术语还包含已经修饰的聚合物,如具有经修饰的肽骨架的多肽。术语“结构域”是指具有特定功能或结构的蛋白质或多肽的任何部分。
89.本文可互换使用的术语“核酸”和“多核苷酸”包含任何长度的聚合形式的核苷酸,包含核糖核苷酸、脱氧核糖核苷酸、或其类似物或经过修饰的版本。所述核苷酸包含单链、双链和多链dna或rna、基因组dna、cdna、dna-rna杂交体、和包括嘌呤碱基、嘧啶碱基或其它天然的、以化学方式修饰的、以生物化学方式修饰的、非天然的或衍生的核苷酸碱基的聚合物。
90.术语“基因组整合的”是指已被引入到细胞中使得核苷酸序列整合到细胞的基因组中的核酸。可以使用任何方案用于将核酸稳定地掺入到细胞的基因组中。
91.术语“表达载体”或“表达构建体”或“表达盒”是指含有期望编码序列的重组核酸,所述期望编码序列可操作地连接到在特定宿主细胞或生物体中表达可操作地连接的编码序列所必需的适当核酸序列。在原核生物中表达所必需的核酸序列通常包含启动子、操纵
子(任选的)和核糖体结合位点以及其它序列。众所周知,真核细胞利用启动子、增强子以及终止信号和多聚腺苷酸化信号,但是在不牺牲必要表达的情况下可以删除一些元素并添加其它元素。
92.术语“病毒载体”是指包含至少一种病毒来源元素并包含足以或允许包装成病毒载体颗粒的元素的重组核酸。载体和/或颗粒可以用于在离体或体内将dna、rna或其它核酸转移到细胞中的目的。许多形式的病毒载体是已知的。
93.关于蛋白质、核酸和细胞的术语“分离的”包含相对于通常可以原位存在的其它细胞或生物体组分相对纯化的蛋白质、核酸和细胞,直至并且包含蛋白质、核酸或细胞的基本上纯的制剂。术语“分离的”可以包含不具有天然存在的对应物的蛋白质和核酸,或者已经化学合成并且因此基本上未被其它蛋白质或核酸污染的蛋白质或核酸。术语“分离的”可以包含已经从与蛋白质、核酸或细胞天然伴随的大多数其它细胞组分或生物体组分(例如,但不限于其它细胞蛋白、核酸或细胞或胞外组分)中分离或纯化的蛋白质、核酸或细胞。
94.术语“野生型”包含具有如在正常(与突变、患病、改变等相比)状态或情况下发现的结构和/或活性的实体。野生型基因和多肽通常以多种不同形式(例如,等位基因)存在。
95.术语“内源性序列”是指天然存在于细胞或动物体内的核酸序列。例如,动物的内源性rs1序列是指天然存在于动物的rs1基因座处的天然rs1序列。
[0096]“外源性”分子或序列包含通常不以所述形式存在于细胞中的分子或序列。正常存在包含关于细胞的特定发育阶段和环境条件的存在。例如,外源性分子或序列可以包含细胞内对应的内源性序列的突变版本(如内源性序列的人源化版本),或者可以包含与细胞内的内源性序列相对应但形式不同(即,不在染色体内)的序列。相比之下,内源性分子或序列包含在特定环境条件下在特定发育阶段在特定细胞中通常以所述形式存在的分子或序列。
[0097]
当在核酸或蛋白质的上下文中使用时,术语“异源的”指示核酸或蛋白质包括在同一分子中并非天然地一起出现的至少两个区段。例如,当关于核酸的段或蛋白质的区段使用时,术语“异源的”指示核酸或蛋白质包括在自然界中未发现彼此处于相同关系(例如,连接在一起)的两个或更多个子序列。作为一个示例,核酸载体的“异源”区是在自然界中未发现与其它分子缔合的另一个核酸分子内或与其附着的核酸区段。例如,核酸载体的异源区可以包含侧接有在自然界中未发现与编码序列缔合的序列的编码序列。同样地,蛋白质的“异源”区是在自然界中未发现与其它肽分子缔合的另一个肽分子(例如,融合蛋白或具有标签的蛋白质)内或与其附着的氨基酸的区段。类似地,核酸或蛋白质可以包括异源标记或异源分泌或定位序列。
[0098]“密码子优化”利用密码子的简并性,如指定氨基酸的三碱基对密码子组合的多样性所展示的,并且通常包含通过用宿主细胞的基因中更频繁或最频繁使用的密码子置换天然序列的至少一个密码子同时维持天然氨基酸序列来修饰核酸序列以在特定宿主细胞中增强表达的过程。例如,与天然存在的核酸序列相比,可以修饰编码cas9蛋白的核酸以置换在给定的原核或真核细胞中具有更高使用频率的密码子,包含细菌细胞、酵母细胞、人细胞、非人细胞、哺乳动物细胞、啮齿动物细胞、小鼠细胞、大鼠细胞、仓鼠细胞或任何其它宿主细胞。密码子使用表例如在“密码子使用数据库”中很容易获得。这些表可以通过多种方式进行调整。参见nakamura等人(2000),《核酸研究(nucleic acids research)》28:292,所述文献出于所有目的通过引用整体并入本文。也可获得用于在特定宿主中表达的特定序列
的密码子优化的计算机算法(参见例如,《基因伪造(gene forge)》)。
[0099]
术语“基因座”是指基因(或显著序列)、dna序列、多肽编码序列或生物体的基因组的染色体上的位置的特异性定位。例如,rs1基因座可以指rs1基因、rs1 dna序列、视网膜劈裂素编码序列的特定位置或rs1在生物体的基因组的染色体上的定位,所述位置已被标识为此类序列所驻留的位置。“rs1基因座”可以包括rs1基因的调节元件,包含例如增强子、启动子、5'和/或3'非翻译区(utr)或其组合。
[0100]
术语“基因”是指染色体中的dna序列,所述染色体如果天然存在可以含有至少一个编码区和至少一个非编码区。染色体中编码产物(例如但不限于rna产物和/或多肽产物)的dna序列可以包含被非编码内含子中断的编码区和在5'和3'端两者上邻近编码区定位使得基因对应于全长mrna的序列(包含5'和3'非翻译序列)。另外,其它非编码序列,包含调节序列(例如但不限于启动子、增强子和转录因子结合位点)、聚腺苷酸化信号、内部核糖体进入位点、沉默子、绝缘序列和基质附着区可以存在于基因中。这些序列可以接近基因的编码区(例如但不限于在10kb内)或位于远处位点,并且这些序列会影响基因的转录和翻译水平或速率。
[0101]
术语“等位基因”是指基因的变体形式。一些基因具有多种不同的形式,所述基因定位于染色体上的相同位置或遗传基因座处。二倍体生物体在每个基因座处具有两个等位基因。每对等位基因表示特异性基因座的基因型。如果在特定基因座处有两个相同的等位基因,则基因型被描述为纯合的,如果两个等位基因不同,则基因型被描述为杂合的。
[0102]“启动子”是dna的调控区,其通常包括能够引导rna聚合酶ii在特定多核苷酸序列的适当转录起始位点处起始rna合成的tata盒。启动子可以另外包括影响转录起始速率的其它区。本文所公开的启动子序列调节可操作连接的多核苷酸的转录。启动子可以在本文所公开的细胞类型(例如,真核细胞、非人哺乳动物细胞、人细胞、啮齿动物细胞、多能细胞、单细胞期胚胎、分化细胞或其组合)中的一种或多种细胞类型中具有活性。启动子可以是例如组成型活性启动子、条件型启动子、诱导型启动子、时间受限启动子(例如,受发育调控的启动子)或空间受限启动子(例如,细胞特异性或组织特异性启动子)。启动子的实例可以例如在wo 2013/176772中找到,所述文献出于所有目的通过引用整体并入本文。
[0103]
组成型启动子是在所有发育阶段的所有组织或特定组织中都具有活性的启动子。组成型启动子的实例包含人巨细胞病毒即刻早期(hcmv)启动子、小鼠巨细胞病毒即刻早期(mcmv)启动子、人延伸因子1α(hef1α)启动子、小鼠延伸因子1α(mef1α)启动子、小鼠磷酸甘油酸激酶(pgk)启动子、鸡β肌动蛋白杂合(cag或cbh)启动子、sv40早期启动子和β2微管蛋白启动子。
[0104]
诱导型启动子的实例包含例如化学调节启动子和物理调节启动子。化学调节启动子包含例如醇调节启动子(例如,醇脱氢酶(alca)基因启动子)、四环素调节启动子(例如,四环素反应性启动子、四环素操纵子序列(teto)、tet-on启动子或tet-off启动子)、类固醇调节启动子(例如,大鼠糖皮质激素受体、雌激素受体启动子或蜕皮激素受体启动子)或金属调节启动子(例如,金属蛋白启动子)。物理调节启动子包含例如温度调节启动子(例如,热休克启动子)和光调节启动子(例如,光诱导型启动子或光抑制型启动子)。
[0105]
组织特异性启动子可以是例如神经元特异性启动子、神经胶质特异性启动子、肌肉细胞特异性启动子、心脏细胞特异性启动子、肾细胞特异性启动子、骨细胞特异性启动
656)或使用gap程序(威斯康星州麦迪逊大学研究园(university research park,madison wis.),遗传学计算机组,unix第8版,威斯康星序列分析包),所述程序使用默认设置,使用史密斯-沃特曼(smith and waterman)算法(《应用数学进展(adv.appl.math.)》,1981,2,482-489)。
[0112]
本文所提供的方法和组合物采用多种不同的组分。贯穿说明书的一些组分可以具有活性变体和片段。此类组分包含例如cas蛋白、crispr rna、tracrrna和向导rna。这些组分中的每个组分的生物活性在本文其它地方描述。术语“功能性”是指蛋白质或核酸(或其片段或变体)表现出生物活性或功能的先天能力。此类生物活性或功能可以包含例如cas蛋白结合向导rna和靶dna序列的能力。与原始分子相比,功能性片段或变体的生物学功能可以相同或实际上可以改变(例如,关于其特异性或选择性或功效)但保留分子的基本生物学功能。
[0113]
术语“变体”是指与群体中最普遍的序列不同的核苷酸序列(例如,相差一个核苷酸)或与群体中最普遍的序列不同的蛋白质序列(例如,相差一个氨基酸)。
[0114]
当提及蛋白质时,术语“片段”意指比全长蛋白质更短或具有更少氨基酸的蛋白质。当提及核酸时,术语“片段”意指比全长核酸更短或具有更少核苷酸的核酸。当提及蛋白质片段时,片段可以是例如n端片段(即,去除蛋白质的c端的一部分)、c端片段(即,去除蛋白质的n端的一部分)或内部片段(即,去除蛋白质的内部部分的一部分)。
[0115]
在两个多核苷酸或多肽序列的上下文中,“序列同一性”或“同一性”是指当在指定的比较窗口上针对最大对应性进行比对时两个序列中相同的残基。当提及蛋白质的序列同一性的百分比时,不相同的残基位置通常因保守性氨基酸取代而不同,其中氨基酸残基被具有相似化学性质(例如,电荷或疏水性)的其它氨基酸残基取代,因此不改变分子的功能性质。当序列的保守性取代不同时,可以将百分比序列同一性向上调整以校正取代的保守性质。因此类保守性取代而不同的序列被视为具有“序列相似性”或“相似性。”用于进行这种调整的方法是众所周知的。通常,这涉及将保守性取代计为部分错配而不是完全错配,从而增加百分比序列同一性。因此,例如,当相同氨基酸的所得得分为1,非保守性取代的所得得分为零时,保守性取代的所得得分介于零与1之间。例如,通过在项目pc/gene(加利福尼亚州山景城的intelligenetics公司(intelligenetics,mountain view,california))中的实施方式计算保守性取代的得分。
[0116]“序列同一性百分比”包含通过在比较窗口上比较两个最佳比对序列测定的值(完全匹配残基的最大数量),其中在比较窗口中的多核苷酸序列部分与参考序列(不包括添加物或缺失部分)相比可以包括添加物或缺失部分(即缺口),以实现两个序列的最佳比对。通过测定在两个序列中出现相同核酸碱基或氨基酸残基的位置数计算百分比来得到匹配位置数,用匹配位置数除以比较窗口中的位置总数,并将结果乘以100以得到序列同一性的百分比。除非另有说明(例如,较短的序列包含连接的异源序列),否则所述比较窗口为两个所比较序列中较短序列的全长。
[0117]
除非另有说明,否则序列同一性/相似性值包含使用以下参数使用第10版gap获得的值:使用gap权重50和长度权重3以及nwsgapdna.cmp评分矩阵的核苷酸序列的同一性百分比和相似性百分比;使用gap权重8和长度权重2以及blosum62评分矩阵的氨基酸序列的同一性百分比和相似性百分比;或其任何等效程序。“等效程序”包含当与第10版gap生成的
对应比对进行比较时针对所讨论的任何两个序列产生具有相同核苷酸或氨基酸残基匹配和相同百分比序列同一性的比对的任何序列比较程序。
[0118]
术语“保守性氨基酸取代”是指用具有相似大小、电荷或极性的不同氨基酸取代序列中正常存在的氨基酸。保守性取代的实例包含用非极性(疏水性)残基(如异亮氨酸、缬氨酸或亮氨酸)取代另一种非极性残基。同样地,保守性取代的实例包含用一种极性(亲水性)残基取代另一种极性残基,如精氨酸与赖氨酸之间的极性残基、谷氨酰胺与天冬酰胺之间的极性残基或甘氨酸与丝氨酸之间的极性残基。另外,用碱性残基(如赖氨酸、精氨酸或组氨酸)取代另一种碱性残基或者用一种酸性残基(如天冬氨酸或谷氨酸)取代另一种酸性残基是保守性取代另外的实例。非保守性取代的实例包含用如异亮氨酸、缬氨酸、亮氨酸、丙氨酸或甲硫氨酸等非极性(疏水性)氨基酸残基取代如半胱氨酸、谷氨酰胺、谷氨酸或赖氨酸等极性(亲水性)残基和/或用极性残基取代非极性残基。典型的氨基酸分类总结在下表1中。
[0119]
表1.氨基酸分类。
[0120][0121]“同源”序列(例如,核酸序列)包含与已知参考序列相同或基本上相似的序列,使得其例如与已知参考序列具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或100%同一性。同源序列可以包含例如直系同源序列和旁系同源序列。例如,同源基因通常通过物种形成事件(直系同源基因)或基因复制事件(旁系同源基因)从共同的祖先dna序列下降。“直系同源”基因包含不同物种中通过物种形成从共同祖先基因进化而来的基因。直系同源物通常在进化过程中保留相同的功能。“旁系同源”基因包含通过基因组内的复制相关的基因。旁系同源物可以在进化过程中进化出新的功能。
[0122]
术语“体外(in vitro)”包含人工环境以及在人工环境(例如,试管或分离的细胞或细胞系)内发生的过程或反应。术语“体内(in vivo)”包含自然环境(例如,细胞、生物体或身体)以及在自然环境内发生的过程或反应。术语“离体”包含已从个体体内取出的细胞
以及在此类细胞内发生的过程或反应。
[0123]
响应于双链断裂(dsb)的修复主要通过两个保守的dna修复途径发生:同源重组(hr)和非同源末端接合(nhej)。参见kasparek和humphrey(2011)《细胞与发育生物学研讨会(seminars in cell&dev.biol.)》22:886-897,所述文献出于所有目的通过引用整体并入本文。同样地,由外源性供体核酸介导的靶核酸修复可以包含两个多核苷酸之间基因信息交换的任何过程。
[0124]
术语“重组”包含所述两个多核苷酸之间基因信息交换的任何过程,并且可以通过任何机制发生。重组可以通过同源定向修复(hdr)或同源重组(hr)发生。hdr或hr包含可能需要核苷酸序列同源性的核酸修复形式,使用“供体”分子作为模板来修复“靶”分子(即经历双链断裂的分子),并且导致将基因信息从供体转移到靶标。不希望受任何特定理论的束缚,这种转移可以涉及在断裂的靶与供体之间形成的异源双链dna的错配校正和/或合成依赖性链退火(synthesis-dependent strand annealing),其中供体用于重新合成将成为靶的一部分的基因信息和/或相关过程。在一些情况下,供体多核苷酸、供体多核苷酸的一部分、供体多核苷酸的副本或者供体多核苷酸的副本的一部分被整合到靶dna中。参见wang等人(2013)《细胞(cell)》153:910-918;mandalos等人(2012)《公共科学图书馆
·
综合(plos one)》7:e45768:1-9;以及wang等人(2013)《自然生物技术(nat biotechnol.)》31:530-532,所述文献中的每个文献出于所有目的通过引用整体并入本文。
[0125]
非同源末端接合(nhej)包含在不需要同源模板的情况下通过将断裂端直接彼此连接或与外源序列连接来修复核酸中的双链断裂。通过nhej连接非连续序列通常会导致双链断裂位点附近的缺失、插入或易位。例如,nhej还可以通过断裂末端与外源性供体核酸的末端的直接连接(即,基于nhej的捕获)导致外源性供体核酸的靶向整合。当同源定向修复(hdr)途径不易使用时(例如,在非分裂细胞、原代细胞和执行基于同源性的dna修复不佳的细胞中),此类nhej介导的靶向整合可以优选用于插入外源性供体核酸。另外,与同源定向修复相反,不需要关于侧接切割位点的较大序列同一性区的知识,这在尝试靶向插入到具有基因组序列知识有限的基因组的生物体中时可能是有益的。整合可以通过连接外源性供体核酸与切割的基因组序列之间的平末端来进行,或者通过使用外源性供体核酸连接粘性末端(即,具有5'或3'突出端)来进行,所述外源性供体核酸侧接有与由切割的基因组序列中的核酸酶药剂产生的突出端相容的突出端。参见例如,us 2011/020722、wo 2014/033644、wo 2014/089290以及maresca等人(2013),《基因组研究》23(3):539-546,所述文献中的每个文献出于所有目的通过引用整体并入本文。如果连接平末端,则可能需要切除靶标和/或供体以产生片段连接所需的微同源性区,这可能会在靶序列中产生不想要的改变。
[0126]“包括”或“包含”一个或多个所列举的元件的组合物或方法可以包含其它未具体列举的元件。例如,“包括”或“包含”蛋白质的组合物可以单独含有蛋白质或与其它成分组合的蛋白质。过渡短语“基本上由
……
组成”意指权利要求的范围应被解释为涵盖权利要求中所列举的指定要素以及对要求保护的发明的基本和新颖特性没有实质性影响的那些要素。因此,当在本发明的权利要求中使用时,术语“基本上由
……
组成”不应被解释为等效于“包括”。
[0127]“任选的”或“任选地”意指随后描述的事件或情形可以发生也可以不发生,并且描述包含事件或情形发生的情况以及事件或情形不发生的情况。
[0128]
数值范围的指定包含所述范围内或定义所述范围的所有整数以及由所述范围内的整数定义的所有子范围。
[0129]
除非上下文另有说明,否则术语“约”涵盖所述值
±
5的值。
[0130]
术语“和/或”是指并且涵盖关联的所列项中的一个或多个所列项的任何和所有可能组合以及在以替代性方案(“或”)解释时组合的缺少。
[0131]
术语“或”是指特定列表中的任何一个成员,并且还包含所述列表成员的任何组合。
[0132]
除非上下文另外明确指明,否则本文中的单数形式“一个(a)”、“一种(an)”和“所述(the)”包含复数个提及物。例如,术语“蛋白质”或“至少一种蛋白质”可以包含多种蛋白质,包含其混合物。
[0133]
统计学上显著意指p≤0.05。
具体实施方式
[0134]
i.概述
[0135]
x连锁青少年型视网膜劈裂症(xlrs)是由视网膜劈裂素(rs1)突变引起的青少年型黄斑变性。rs1基因编码24kda含有网柄菌凝素结构域的蛋白质,所述蛋白质作为同源寡聚体复合物分泌。rs1的基因突变导致非功能性蛋白或不存在蛋白质分泌,这引起视网膜层内的劈裂或分裂,从而导致早期和进行性视力丧失。已知rs1基因中的超过200种不同的突变会引起xlrs。百分之四十的致病突变是预期会导致全长视网膜劈裂素蛋白缺失的无义突变或移码突变。百分之五十的致病突变是允许产生全长突变蛋白的错义突变。其中大部分位于网柄菌凝素结构域中,并且导致错误折叠的蛋白质保留在er中。
[0136]
由于xlrs是一种由视网膜劈裂素功能丧失引起的隐性疾病,基因替代疗法是此疾病的潜在治疗方法。此外,由于视网膜劈裂素用作胞外蛋白,因此有益的治疗不一定限于表达替代基因的转染细胞,而是由于分泌蛋白从表达位点扩散而可以涵盖更广泛的区。
[0137]
本文提供了允许将视网膜劈裂素编码序列插入到靶基因组基因座如内源性rs1基因座中和/或表达视网膜劈裂素编码序列的核酸构建体和组合物。所述核酸构建体和组合物可以在用于整合到靶基因组基因座和/或在细胞中表达的方法中,或在治疗x连锁青少年型视网膜劈裂症的方法中使用。还提供了核酸酶药剂(例如,靶向内源性rs1基因座)或编码核酸酶药剂的核酸,以促进核酸构建体整合到靶基因组基因座如内源rs1基因座中。
[0138]
将所述核酸构建体整合到内源性rs1基因座如rs1的内含子1中可以阻止整合位点下游的内源性rs1基因转录。所述将所述核酸构建体整合到所述内源性rs1基因座中可以减少或消除内源性视网膜劈裂素蛋白(例如,具有引起xlrs突变的内源性视网膜劈裂素蛋白)的表达,并且用由所述核酸构建体编码的所述视网膜劈裂素蛋白或其片段或变体(例如,没有引起xlrs的突变的视网膜劈裂素)的表达替代所述内源性视网膜劈裂素蛋白的表达。在一个实例中,将核酸构建体整合到内源性rs1基因座中会减少内源性视网膜劈裂素蛋白的表达。在另一个实例中,将核酸构建体整合到内源性rs1基因座中会消除内源性视网膜劈裂素蛋白的表达。以此方式,核酸构建体的整合可以同时敲除内源性rs1基因(例如,包括与xlrs相关的或引起xlrs的突变的一个或多个内源性rs1基因,如r141c)和敲入替代视网膜劈裂素编码序列(例如,不包括与xlrs相关的或引起xlrs的突变的替代视网膜劈裂素编码
序列)。
[0139]
ii.包括用于整合到靶基因组基因座中并从靶基因组基因座表达的视网膜劈裂素编码序列的核酸构建体
[0140]
本文提供了核酸构建体(即,外源性供体核酸),其包括用于整合到靶基因组基因座中并从靶基因组基因座表达的视网膜劈裂素编码序列(即,编码视网膜劈裂素蛋白或其片段或变体)。核酸构建体可以是分离的核酸构建体。
[0141]
视网膜劈裂素(x连锁青少年型视网膜劈裂蛋白)是视网膜的正常结构和功能所需的蛋白质。示例性人视网膜劈裂素蛋白被指定为uniprot登录号o15537,并且具有seq id no:2中所示的序列。其它物种的直系同源物也是已知的。例如,示例性小鼠视网膜劈裂素蛋白被指定为uniprot登录号q9z1l4,并且具有seq id no:1中所示的序列。视网膜劈裂素由rs1基因(也被称为xlrs1)编码。人rs1基因含有由五个内含子间隔的六个独立外显子。人rs1基因被指定为ncbi geneid 6247。小鼠rs1基因被指定为ncbi geneid 20147。人rs1的示例性编码序列被指定为ccds id ccds14187.1,并且在seq id no:6中示出。视网膜劈裂素突变引起x连锁青少年型视网膜劈裂症(xlrs),这是一种以黄斑病变和视网膜浅层分裂为特征的玻璃体视网膜营养不良。如本文别处更详细描述的,本文所公开的核酸构建体可以用于治疗xlrs的方法。
[0142]
rs1的功能结构域是信号肽(sp)、rs1和网柄菌凝素结构域。信号序列引导新生rs1从内质网(合成位点)易位到质膜的外部小叶,在此期间信号序列被信号肽酶切割以产生具有特征性rs1和高度保守的网柄菌凝素结构域的成熟蛋白。rs1信号序列的不同亚结构域是介导易位的氨基末端处的带正电荷的n区、靶向和膜插入所需的疏水核(h)以及确定信号肽酶识别和切割的位点的极性“c”区。rs1主要由视网膜感光细胞和双极细胞表达,并且也在松果体中。
[0143]
包含在本文所公开的核酸构建体中的视网膜劈裂素编码序列可以是全长视网膜劈裂素蛋白或其片段或变体的编码序列。在一个实例中,包含在核酸构建体中的视网膜劈裂素编码序列不包含rs1的第一外显子。例如,核酸构建体中包含的视网膜劈裂素编码序列可以包含rs1基因或其变体或简并变体的外显子2-6。作为一个实例,包括rs1基因的外显子2-6的cdna片段可以包括seq id no:8中所示的序列。尽管64个密码子中的每个密码子仅对一个氨基酸或终止信号具有特异性,但遗传密码是简并的(即,冗余的),因为单个氨基酸可以由超过一个密码子编码。基因的简并变体编码相同的蛋白质,但使用至少一个不同的密码子。核酸构建体中的视网膜劈裂素编码序列可以包括不具有插入内含子的互补dna(cdna),或者核酸构建体可以包括将视网膜劈裂素编码序列中的外显子分开的一个或多个内含子。例如,核酸构建体可以包括与具有外显子和内含子两者的rs1基因组基因座相对应的序列。
[0144]
视网膜劈裂素编码序列可以来自任何生物体。例如,视网膜劈裂素编码序列可以是哺乳动物、非人哺乳动物、啮齿动物、小鼠、大鼠或人或其变体。可替代地,视网膜劈裂素编码序列可以是嵌合的(例如,部分小鼠和部分人)。在具体的实例中,视网膜劈裂素编码序列是人视网膜劈裂素编码序列。
[0145]
可以对视网膜劈裂素编码序列进行密码子优化,以在特定细胞或生物体中有效翻译成视网膜劈裂素。作为一个实例,人rs1的外显子2-6的密码子优化版本如seq id no:9中
所示。例如,可以修饰核酸以取代在人细胞、非人细胞、哺乳动物细胞、啮齿动物细胞、小鼠细胞、大鼠细胞或任何其它所关注的宿主细胞中具有更高使用频率的密码子。
[0146]
视网膜劈裂素编码序列可以编码野生型视网膜劈裂素蛋白或其片段或变体。同样地,视网膜劈裂素编码序列可以是野生型编码序列或其变体。在一个实例中,视网膜劈裂素编码序列不包括与x连锁青少年型视网膜劈裂症相关的或引起x连锁青少年型视网膜劈裂症的任何突变。可替代地,视网膜劈裂素编码序列可以包括与x连锁青少年型视网膜劈裂症相关的或引起x连锁青少年型视网膜劈裂症的一种或多种突变(例如,r141c)。
[0147]
核酸构建体可以进一步包括一个或多个rs1内含子或其片段或变体(例如,一个或多个人rs1内含子或其片段或变体)。例如,核酸构建体可以包括rs1内含子1或其片段或变体。rs1内含子或其片段或变体可以包括剪接受体位点或其片段。rs1内含子1的片段的实例在seq id no:15和16中示出。在一个具体实例中,核酸构建体可以包括定位于rs1的外显子2-6的5'端的rs1内含子1或其片段或变体(例如,包括rs1的外显子2-6、基本上由其组成或由其组成的cdna序列的上游)。
[0148]
核酸构建体可以进一步包括一个或多个剪接受体位点。包括剪接受体位点的序列(例如,内含子序列)和其反向补体的实例在seq id no:15-21中示出。例如,核酸构建体可以包括定位于视网膜劈裂素编码序列的5'端的剪接受体位点。在具体实例中,视网膜劈裂素编码序列包括rs1的外显子2-6(例如,人rs1的外显子2-6)、基本上由其组成或由其组成,并且剪接受体位点是来自rs1(例如,人rs1)的内含子1的剪接受体位点,用于将rs1外显子1剪接至rs1外显子2。术语剪接受体位点是指3'内含子/外显子边界处可以被识别并通过剪接机制结合的核酸序列。
[0149]
本文所公开的核酸构建体还可以包括转录后调节元件,如土拨鼠肝炎病毒转录后调节元件。
[0150]
核酸构建体可以进一步包括一种或多种聚腺苷酸化信号序列。聚腺苷酸化信号序列或包括聚腺苷酸化信号序列的序列或其反向补体的实例在seq id no:22-25中示出。例如,核酸构建体可以包括定位于视网膜劈裂素编码序列的3'端的聚腺苷酸化信号序列。可以使用任何合适的聚腺苷酸化信号序列。术语聚腺苷酸化信号序列是指指导转录终止和向mrna转录物添加poly-a尾部的任何序列。在真核生物中,转录终止子被蛋白质因子识别,并且聚腺苷酸化在终止之后,所述聚腺苷酸化是在poly(a)聚合酶存在的情况下向mrna转录物添加poly(a)尾部的过程。哺乳动物poly(a)信号通常由约45个核苷酸长的核心序列组成,所述核心序列可以侧接有用于增强切割和聚腺苷酸化效率的不同辅助序列。核心序列由以下组成:mrna中高度保守的上游元件(aataaa或aauaaa),所述上游元件被称为poly a识别基序或poly a识别序列,由切割和聚腺苷酸化特异性因子(cpsf)识别;以及受切割刺激因子(cstf)约束的定义不清的下游区(在us或gs和us中富集)。可以使用的转录终止子的实例包含例如人生长激素(hgh)聚腺苷酸化信号、猿猴病毒40(sv40)晚期聚腺苷酸化信号、兔β-珠蛋白聚腺苷酸化信号、牛生长激素(bgh)聚腺苷酸化信号、磷酸甘油酸激酶(pgk)聚腺苷酸化信号、aox1转录终止序列、cyc1转录终止序列或已知适合于调节真核细胞中基因表达的任何转录终止序列。
[0151]
核酸构建体还可以包括位于视网膜劈裂素编码序列上游的聚腺苷酸化信号序列。视网膜劈裂素编码序列上游的聚腺苷酸化信号序列可以侧接有由位点特异性重组酶识别
的重组酶识别位点。在一些构建体,重组酶识别位点还侧接包括例如耐药蛋白的编码序列的选择盒。在其它构建体中,重组酶识别位点不侧接选择盒。聚腺苷酸化信号序列阻止由编码序列编码的蛋白质或rna的转录和表达。然而,在暴露于位点特异性重组酶后,聚腺苷酸化信号序列将被切除,并且可以表达蛋白质或rna。
[0152]
如果聚腺苷酸化信号序列以组织特异性或发育阶段特异性方式被切除,则此类构型可以在包括视网膜劈裂素编码序列的动物中实现组织特异性表达或发育阶段特异性表达。如果包括核酸构建体的动物进一步包括可操作地连接到组织特异性或发育阶段特异性启动子的位点特异性重组酶的编码序列,则可以实现以组织特异性或发育阶段特异性方式切除聚腺苷酸化信号序列。然后,聚腺苷酸化信号序列将仅在那些组织中或在那些发育阶段被切除,从而实现组织特异性表达或发育阶段特异性表达。在一个实施例中,由核酸构建体编码的视网膜劈裂素或其片段或变体可以以眼特异性或视网膜细胞特异性方式表达。
[0153]
位点特异性重组酶包含可以促进重组酶识别位点之间重组的酶,其中两个重组位点在单个核酸内或在单独的核酸上物理分离。重组酶的实例包含cre、flp和dre重组酶。cre重组酶基因的一个实例是crei,其中编码cre重组酶的两个外显子被内含子隔开,以阻止其在原核细胞中表达。此类重组酶可以进一步包括用于促进定位到核(例如,nls-crei)的核定位信号。重组酶识别位点包含由位点特异性重组酶识别并且可以用作重组事件的底物的核苷酸序列。重组酶识别位点的实例包含frt、frt11、frt71、attp、att、rox和lox位点,如loxp、lox511、lox2272、lox66、lox71、loxm2和lox5171。
[0154]
核酸构建体可以进一步包括与视网膜劈裂素编码序列可操作地连接的启动子。核酸构建体中的视网膜劈裂素编码序列可以与任何合适的启动子可操作地连接,以在动物体内或在分离的细胞内体外表达。启动子可以是组成型活性启动子(例如,cag启动子或u6启动子)、条件型启动子、诱导型启动子、时间受限启动子(例如,发育调节启动子)或空间受限启动子(例如,细胞特异性或组织特异性启动子)。此类启动子是众所周知的并且在本文别处讨论。可以在表达构建体中使用的启动子包含例如在真核细胞、人细胞、非人细胞、哺乳动物细胞、非人哺乳动物细胞、啮齿动物细胞、小鼠细胞、大鼠细胞、仓鼠细胞、兔细胞、多能细胞、眼细胞、视网膜细胞、胚胎干(es)细胞或受精卵中的一个或多个中具有活性的启动子。在具体实例中,启动子在眼细胞或视网膜细胞中是有活性的。
[0155]
可替代地,一些核酸构建体不包括与视网膜劈裂素编码序列可操作地连接的启动子(例如,一些核酸构建体是无启动子的构建体)。此类核酸构建体可以被设计为,例如,在整合到靶基因组基因座中时与靶基因组基因座处的内源性启动子(例如,内源性rs1基因座处的内源性rs1启动子)可操作地连接。
[0156]
可以使用任何能够表达基因的靶基因组基因座,如安全港基因座(安全港基因)或内源性rs1基因座。整合的外源dna与宿主基因组之间的相互作用会限制整合的可靠性和安全性,并且可能导致明显的表型效应,所述表型效应不是由于靶向基因修饰而是由于整合对周围内源性基因的非预期效应。例如,随机插入的转基因可能受到位置效应和沉默的影响,从而使其表达不可靠和不可预测。同样地,将外源dna整合到染色体基因座中会影响周围的内源性基因和染色质,由此改变细胞行为和表型。安全港基因座包含染色体基因座,在所述染色体基因座中,转基因或其它外源核酸插入物可以在所有所关注的组织中稳定且可靠地表达,而不会明显改变细胞行为或表型(即,对宿主细胞没有任何有害影响)。参见例如
sadelain等人(2012)《癌症自然评论(nat.rev.cancer)》12:51-58,所述文献出于所有目的通过引用整体并入本文。例如,安全港基因座可以是插入基因序列的表达不受来自相邻基因的任何通读表达干扰的基因座。例如,安全港基因座可以包含染色体基因座,在所述染色体基因座中,外源dna可以以可预测的方式整合和发挥作用,而不会对内源性基因结构或表达产生不利影响。安全港基因座可以包含基因外区或基因内区,例如非必需、可有可无或能够在没有明显表型结果的情况下破裂的基因内的基因座。
[0157]
此类安全港基因座可以在所有组织中提供开放的染色质构型,并且可以在胚胎发育期间和成人中普遍表达。参见例如zambrowicz等人(1997)《美国国家科学院院刊(proc.natl.acad.sci.u.s.a.)》94:3789-3794,所述文献出于所有目的通过引用整体并入本文。另外,安全港基因座可以被高效地靶向,并且安全港基因座可以在没有明显表型的情况下破裂。安全港基因座的实例包含白蛋白、ccr5、hprt、aavs1和rosa26。参见例如,美国专利第7,888,121号;第7,972,854号;第7,914,796号;第7,951,925号;第8,110,379号;第8,409,861号;第8,586,526号;以及美国专利公开第2003/0232410号;第2005/0208489号;第2005/0026157号;第2006/0063231号;第2008/0159996号;第2010/00218264号;第2012/0017290号;第2011/0265198号;第2013/0137104号;第2013/0122591号;第2013/0177983号;第2013/0177960号;以及第2013/0122591号,所述文献中的每个文献出于所有目的通过引用整体并入本文。
[0158]
靶基因组基因座也可以是内源性rs1基因座,如包括与xlrs相关的或引起xlrs的一种或多种突变(例如,经编码的视网膜劈裂素蛋白中的r141c突变)的内源性rs1基因座。在一些情况下,将所述核酸构建体整合到所述内源性rs1基因座中可以阻止整合位点下游的内源性rs1基因转录。所述将所述核酸构建体整合到所述内源性rs1基因座中可以减少或消除内源性视网膜劈裂素蛋白的表达,并且用由所述核酸构建体编码的所述视网膜劈裂素蛋白或其片段或变体的表达替代所述内源性视网膜劈裂素蛋白的表达。在一个实例中,将核酸构建体整合到内源性rs1基因座中会减少内源性视网膜劈裂素蛋白的表达。在另一个实例中,将核酸构建体整合到内源性rs1基因座中会消除内源性视网膜劈裂素蛋白的表达。以此方式,核酸构建体的整合可以同时敲除内源性rs1基因(例如,包括与xlrs相关的或引起xlrs的突变的一个或多个内源性rs1基因)和敲入替代视网膜劈裂素编码序列(例如,不包括与xlrs相关的或引起xlrs的突变的替代视网膜劈裂素编码序列)。
[0159]
核酸构建体可以整合到靶基因组基因座的任何部分中。例如,核酸构建体可以插入到靶基因组基因座的内含子或外显子中,或者可以替代靶基因组基因座的一个或多个内含子和/或外显子。在具体实例中,核酸构建体可以整合到靶基因组基因座的内含子中,如靶基因组基因座的第一内含子(例如,rs1内含子1)。整合到靶基因组基因座中的表达盒可以可操作地连接到靶基因组基因座处的内源启动子(例如,内源性rs1启动子),或者可以可操作地连接到与靶基因组基因座异源的外源启动子(例如,cmv启动子)。
[0160]
核酸构建体可以包括脱氧核糖核酸(dna)或核糖核酸(rna),其可以是单链或双链,并且可以是线性或环状形式。例如,核酸构建体可以是单链寡脱氧核苷酸(ssodn)。参见例如yoshimi等人(2016)《自然通讯》7:10431,所述文献出于所有目的通过引用整体并入本文。核酸构建体可以是裸核酸或可以通过载体如aav载体递送。在具体实例中,核酸构建体可以通过aav递送并且能够通过非同源末端接合插入到内源性rs1基因座中(例如,核酸构
建体可以是不包括同源臂的核酸构建体)。如果以线性形式引入,可以通过众所周知的方法保护核酸构建体(例如,供体序列)的末端(例如,免于核酸外切降解)。例如,可以将一或多个双脱氧核苷酸残基添加到线性分子的3'端和/或可以将自互补寡核苷酸连接到一或两个末端。参见例如,chang等人,(1987)《美国国家科学院院刊》84:4959-4963和nehls等人,(1996)《科学》272:886-889,所述文献中的每个文献出于所有目的通过引用整体并入本文。用于保护外源多核苷酸免于降解的另外的方法包含但不限于添加末端氨基以及使用经过修饰的核苷酸间键,例如硫代磷酸酯、氨基磷酸酯和o-甲基核糖或脱氧核糖残基。
[0161]
示例性核酸构建体的长度在约50个核苷酸到约5kb之间或约50个核苷酸到约3kb之间。可替代地,核酸构建体的长度可以在约1kb到约1.5kb、约1.5kb到约2kb、约2kb到约2.5kb、约2.5kb到约3kb、约3kb到约3.5kb、约3.5kb到约4kb、约4kb到约4.5kb或约4.5kb到约5kb之间。可替代地,核酸构建体的长度可以为例如不超过5kb、4.5kb、4kb、3.5kb、3kb或2.5kb。
[0162]
核酸构建体在靶基因组基因座处的整合会导致所关注的核酸序列到靶基因组基因座的添加或所关注核酸序列在靶基因组基因座处的替代(即,缺失和插入)。一些核酸构建体被设计成在靶基因组基因座处插入核酸构建体而在靶基因组基因座处没有任何对应的缺失。其它核酸构建体被设计成在靶基因组基因座处删除所关注的核酸序列并用核酸构建体将其替代。
[0163]
被缺失和/或替代的靶基因组基因座处的核酸构建体或对应的核酸可以具有各种长度。被缺失和/或替代的靶基因组基因座处的示例性核酸构建体或对应的核酸的长度在约1个核苷酸到约5kb之间或在约1个核苷酸到约3kb核苷酸之间。例如,被缺失和/或替代的靶基因组基因座处的核酸构建体或对应的核酸的长度可以在约1个到约100个、约100个到约200个、约200个到约300个、约300个到约400个、约400个到约500个、约500个到约600个、约600个到约700个、约700个到约800个、约800个到约900个或约900个到约1,000个核苷酸之间。同样地,被缺失和/或替代的靶基因组基因座处的核酸构建体或对应的核酸的长度可以在约1kb到约1.5kb、约1.5kb到约2kb、约2kb到约2.5kb、约2.5kb到约3kb、约3kb到约3.5kb、约3.5kb到约4kb、约4kb到约4.5kb、约4.5kb到约5kb之间或更长。
[0164]
被缺失和/或替代的靶基因组基因座处的核酸构建体或对应的核酸可以是如外显子等编码区、如内含子等非编码区、非翻译区或调节区(例如,启动子、增强子或转录抑制子结合元件)或其任何组合。
[0165]
在一些情况下,核酸构建体可以包括以下末端结构中的一个或多个末端结构:发夹、环、反向末端重复序列(itr)或超环面。例如,核酸构建体可以包括itr。
[0166]
一些此类核酸构建体可以在用核酸酶药剂如cas蛋白切割靶基因组基因座或使靶基因组基因座有切口后修饰靶基因组基因座(例如但不限于内源性rs1基因座)。核酸构建体可以被设计为通过非同源末端接合(nhej)介导的连接或同源定向修复来修复切割或切口基因座。任选地,用核酸构建体进行修复构建体去除或破坏了核酸酶靶序列,使得已经靶向的等位基因不能被核酸酶药剂重新靶向。
[0167]
一些核酸构建体包括同源臂。同源臂可以是对称的(例如,长度为各自40个核苷酸或各自60个核苷酸),或者其可以是不对称的(例如,一个同源臂或互补区的长度为36个核苷酸,并且一个同源臂或互补区的长度为91个核苷酸)。其它核酸构建体不包括同源臂。
[0168]
本文所公开的一些核酸构建体包括同源臂。同源臂可以侧接有视网膜劈裂素编码序列。为了便于参考,同源臂在本文中被称为5'和3'(即,上游和下游)同源臂。此术语涉及同源臂与核酸构建体内的核酸插入物(例如,视网膜劈裂素编码序列)的相对位置。5'和3'同源臂对应于靶基因组基因座内的区,所述区在本文中分别被称为“5'靶序列”和“3'靶序列”。
[0169]
当同源臂和靶序列彼此共享足够水平的序列同一性时,则这两个区彼此“对应(correspond或corresponding)”以充当同源重组反应的底物。术语“同源性”包含与对应序列相同或共享序列同一性的dna序列。给定靶序列与在核酸构建体中发现的对应的同源臂之间的序列同一性可以是允许同源重组发生的任何程度的序列同一性。例如,核酸构建体(或其片段)的同源臂与靶序列(或其片段)共享的序列同一性的量可以是至少50%、55%、60%、65%、70%、75%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性,使得序列经历同源重组。此外,同源臂与对应的靶序列之间对应的同源区可以具有足以促进同源重组的任何长度。示例性同源臂的长度在约25个核苷酸到约2.5kb之间、约25个核苷酸到约1.5kb之间或约25个到约500个核苷酸之间。例如,给定同源臂(或同源臂中的每个同源臂)和/或对应的靶序列可以包括具有以下长度的对应同源区:约25个到约30个、约30个到约40个、约40个到约50个、约50个到约60个、约60个到约70个、约70个到约80个、约80个到约90个、约90个到约100个、约100个到约150个、约150个到约200个、约200个到约250个、约250个到约300个、约300个到约350个、约350个到约400个、约400个到约450个或约450个到约500个核苷酸之间,使得同源臂具有足以与靶核酸内对应的靶序列经历同源重组的同源性。可替代地,给定同源臂(或每个同源臂)和/或对应的靶序列可以包括长度为以下的对应同源区:约0.5kb到约1kb、约1kb到约1.5kb、约1.5kb到约2kb或约2kb到约2.5kb之间。例如,同源臂各自的长度可以为约750个核苷酸。在另一个实例中,同源臂的长度可以各自为约150到约750、约200到约700、约250到约650、约300到约600、约350到约550、约400到约500、约150到约450、约200到约450、约250到约450、约300到约450、约350到约450、约400到约450、约450到约500、约450到约550、约450到约600、约450到约650、约450到约700、约450到约750或约450个核苷酸。在另一个实例中,同源臂的长度可以各自为约500到约1300、约550到约1250、约600到约1200、约650到约1150、约700到约1100、约750到约1050、约800到约1000、约850到约950、约500到约900、约550到约900、约600到约900、约650到约900、约700到约900、约750到约900、约800到约900、约850到约900、约900到约950、约900到约1000、约900到约1050、约900到约1100、约900到约1150、约900到约1200、约900到约1250、约900到约1300或约900个核苷酸。在另一个实例中,同源臂可以各自为约1500到约2100、约1550到约2050、约1600到约2000、约1650到约1950、约1700到约1900、约1750到约1850、约1500到约1800、约1550到约1800、约1600到约1800、约1650到约1800、约1700到约1800、约1750到约1800、约1800到约1850、约1800到约1900、约1800到约1950、约1800到约2000、约1800到约2050、约1800到约2100或约1800个核苷酸。在另一个实例中,每个同源臂不超过约450个核苷酸、不超过约900个核苷酸或不超过约1800个核苷酸。在另一个实例中,每个同源臂为至少约450个核苷酸、至少约900个核苷酸或至少约1800个核苷酸。同源臂可以是对称的(每个长度的大小大约相同),或者可以是不对称的(一个比另一个长)。
[0170]
当crispr/cas系统或其它核酸酶药剂与本文所描述的核酸构建体结合使用时,5'和3'靶序列可以定位在足够接近核酸酶切割位点的位置(例如,在足够接近向导rna靶序列的位置内),以在核酸酶切割位点或核酸酶切割位点处的单链断裂(切口)或双链断裂后促进靶序列与同源臂之间同源重组事件的发生。术语“核酸酶切割位点”包含由核酸酶药剂(例如,与向导rna复合的cas9蛋白)在其中产生切口或双链断裂的dna序列。靶基因座内对应于核酸构建体的5'和3'同源臂的靶序列“定位在足够接近”核酸酶切割位点的位置,如果这样的距离是为了在核酸酶切割位点处的单链断裂或双链断裂后促进5'和3'靶序列与同源臂之间同源重组事件的发生。因此,对应于核酸构建体的5'和/或3'同源臂的靶序列可以例如在给定核酸酶切割位点的至少1个核苷酸内,或在给定核酸酶切割位点的至少10个核苷酸到约1,000个核苷酸内。作为实例,核酸酶切割位点可以紧邻靶序列的至少一个或两个靶序列。
[0171]
对应于核酸构建体的同源臂和核酸酶切割位点的靶序列的空间关系可以变化。例如,靶序列可以定位到核酸酶切割位点的5',靶序列可以定位到核酸酶切割位点的3',或者靶序列可以侧接核酸酶切割位点。
[0172]
其它核酸构建体不包括任何同源臂。此类核酸构建体能够通过非同源末端接合插入。例如,此类核酸构建体可以在用核酸酶药剂切割后插入到平端双链断裂中。在具体实例中,核酸构建体可以通过aav递送并且能够通过非同源末端接合插入到靶基因组基因座中(例如,核酸构建体可以是不包括同源臂的核酸构建体)。
[0173]
在具体实例中,核酸构建体可以通过同源非依赖性靶向整合插入。例如,核酸构建体中的视网膜劈裂素编码序列可以在每一侧上侧接有用于核酸酶药剂的靶位点(例如,与靶基因组基因座中相同的靶位点,并且相同的核酸酶药剂用于切割靶基因组基因座中的靶位点)。核酸酶药剂然后可以切割侧接视网膜劈裂素编码序列的靶位点。在具体实例中,核酸构建体通过aav介导的递送进行递送,并且侧接视网膜劈裂素编码序列的靶位点的切割可以去除aav的反向末端重复序列(itr)。在一些方法中,靶基因组基因座中的靶位点(例如,包含侧接原型间隔子邻近基序的grna靶序列)在视网膜劈裂素编码序列以正确的朝向插入到靶基因组基因座中时不再存在,但在视网膜劈裂素编码序列以相反的朝向插入到靶基因组基因座中时被重整。这可以帮助视网膜劈裂素编码序列以正确的表达朝向插入。
[0174]
在用于同源非依赖性靶向整合到靶基因组基因座中的一个示例性核酸构建体,所述视网膜劈裂素蛋白或其片段是人视网膜劈裂素蛋白或其片段,所述视网膜劈裂素蛋白或其片段的所述编码序列包括包含人rs1或其简并变体的外显子2-6的互补dna(cdna),所述核酸构建体不包括驱动所述视网膜劈裂素蛋白或其片段的表达的启动子,所述核酸构建体包括定位于所述编码序列的3'端的聚腺苷酸化信号序列,所述核酸构建体包括定位于所述编码序列的5'端的剪接受体位点,并且所述核酸构建体中的所述核酸酶靶序列与用于整合到所述靶基因组基因座中的核酸酶靶序列相同,其中所述靶基因组基因座中的所述核酸酶靶序列在所述核酸构建体以正确朝向插入时被破坏,但在所述核酸构建体以相反朝向插入到所述靶基因组基因座中时被重整。
[0175]
在一种用于同源非依赖性靶向整合到靶基因组基因座中的示例性核酸构建体中,视网膜劈裂素蛋白或其片段包括与seq id no:2或5至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%
或100%相同的序列、基本上由其组成或由其组成。在用于同源非依赖性靶向整合到靶基因组基因座中的一种示例性核酸构建体中,所述视网膜劈裂素蛋白或其片段的所述编码序列包括与seq id no:6、8或9或其简并变体至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%相同的序列、基本上由其组成或由其组成。在一种用于同源非依赖性靶向整合到靶基因组基因座中的示例性核酸构建体中,所述核酸构建体包括与seq id no:45至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%相同的序列、基本上由其组成或由其组成。
[0176]
其它核酸构建体可以在5'端和/或3'端处具有与由核酸酶药剂介导的切割在靶基因组基因座处产生的一个或多个突出端互补的短单链区。例如,一些核酸构建体在5'端和/或3'端处具有与由核酸酶介导的切割在靶基因组基因座的5'和/或3'靶序列处产生的一个或多个突出端互补的短单链区。一些此类核酸构建体仅在5'端或仅在3'端处具有互补区。例如,一些此类核酸构建体仅在与靶基因组基因座的5'靶序列处产生的突出端互补的5'端处或者仅在与靶基因组基因座的3'靶序列处产生的突出端互补3'端处具有互补区。其它此类核酸构建体在5'和3'端两者处都有互补区。例如,其它此类核酸构建体在5'和3'端两者处都有由核酸酶介导的切割在靶基因组基因座处产生的互补区(例如,分别与第一突出端和第二突出端互补)。例如,如果核酸构建体是双链的,则单链互补区可以从核酸构建体的顶部链的5'端和供体核酸的底部链的5'端延伸,从而在每端产生5'突出端。可替代地,单链互补区可以从核酸构建体的顶部链的3'端和模板的底部链的3'端延伸,从而产生3'突出端。
[0177]
互补区可以具有足以促进核酸构建体与靶核酸之间的连接的任何长度。示例性互补区的长度在约1个到约5个核苷酸之间、在约1个到约25个核苷酸之间或在约5个到约150个核苷酸之间。例如,互补区的长度可以为至少约1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个或25个核苷酸。可替代地,互补区的长度可以为约5个到约10个、约10个到约20个、约20个到约30个、约30个到约40个、约40个到约50个、约50个到约60个、约60个到约70个、约70个到约80个、约80个到约90个、约90个到约100个、约100个到约110个、约110个到约120个、约120个到约130个、约130个到约140个、约140个到约150个核苷酸或更长。
[0178]
此类互补区可以与由两对切口酶产生的突出端互补。通过使用切割相反的dna链以产生第一双链断裂的第一切口酶和第二切口酶以及切割相反的dna链以产生第二双链断裂的第三切口酶和第四切口酶,可以产生具有交错端的两个双链断裂。例如,cas蛋白可以用于切割与第一、第二、第三和第四向导rna对应的第一、第二、第三和第四向导rna靶序列。第一和第二向导rna靶序列可以被定位成产生第一切割位点,使得第一和第二切口酶在第一和第二dna链上产生的切口产生双链断裂(即,第一切割位点包括第一和第二向导rna靶序列内的切口)。同样地,第三和第四向导rna靶序列可以被定位成产生第二切割位点,使得第三和第四切口酶在第一和第二dna链上产生的切口产生双链断裂(即,第二切割位点包括第三和第四向导rna靶序列内的切口)。第一和第二向导rna靶序列和/或第三和第四向导rna靶序列内的切口可以是产生突出端的偏移切口。偏移窗口可以为例如至少约5bp、10bp、20bp、30bp、40bp、50bp、60bp、70bp、80bp、90bp、100bp或更多。参见ran等人(2013),《细胞》
154:1380-1389;mali等人(2013)《自然生物技术》31:833-838;以及shen等人(2014)《自然方法(nat.methods)》11:399-404,所述文献中的每个文献出于所有目的通过引用整体并入本文。在这种情况下,双链核酸构建体可以被设计成具有单链互补区,所述单链互补区与由第一和第二向导rna靶序列内的切口以及第三和第四向导rna靶序列内的切口产生的突出端互补。然后可以通过非同源末端接合介导的连接插入此类核酸构建体。
[0179]
本文所公开的核酸构建体中的一些核酸构建体是双向构建体,其可以以任一朝向插入到靶基因组基因座中并从其表达。此类核酸构建体可以包括第一区段,所述第一区段包括第一视网膜劈裂素蛋白或其片段或变体的第一编码序列;以及第二区段,所述第二区段包括第二视网膜劈裂素蛋白或其片段或变体的第二编码序列的反向补体。例如,第二区段可以定位于核酸构建体中的第一区段的3'。
[0180]
第一区段和第二区段可以直接连接在一起,或者可以通过如肽连接子等连接子连接。肽连接子可以是任何合适的长度的。例如,连接子的长度可以介于约5到约2000个核苷酸之间。例如,连接子序列的长度可以为约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、150、200、250、300、500、1000、1500、2000或更多个核苷酸。
[0181]
在一些双向构建体中,所述第一视网膜劈裂素蛋白或其片段或变体与所述第二视网膜劈裂素蛋白或其片段或变体相同。在其它双向构建体中,所述第一视网膜劈裂素蛋白或其片段或变体不同于所述第二第一视网膜劈裂素蛋白或其片段或变体。
[0182]
在一些双向构建体中,第一编码序列中的密码子使用与第二编码序列中的密码子使用相同。在其它双向构建体中,第二编码序列采用不同于第一编码序列的密码子使用的密码子使用,以减少发夹形成。此类反向补体与第一区段中的编码序列的所有核苷酸相比形成碱基对,但它可以任选地编码相同的多肽。
[0183]
第二区段可以与第一区段具有任何百分比的互补性。例如,第二区段序列可以与第一区段具有至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约97%或至少约99%互补性。作为另一个实例,第二区段序列可以与第一区段具有小于约30%、小于约35%、小于约40%、小于约45%、小于约50%、小于约55%、小于约60%、小于约65%、小于约70%、小于约75%、小于约80%、小于约85%、小于约90%、小于约95%、小于约97%或小于约99%互补性。在一些核酸构建体中,第二编码序列的反向补体可以与第一编码序列没有明显互补(例如,不超过70%互补),与第一编码序列的片段没有明显互补,与第一编码序列高度互补(例如,至少90%互补),与第一编码序列的片段高度互补,与第一编码序列的反向补体约50%到约80%相同,或与第一编码序列的反向补体约60%到约100%相同。
[0184]
在一些情况下,双向构建体可以包括一个或多个(例如,两个)聚腺苷酸化信号序列。在一些双向构建体中,第一区段可以包括第一聚腺苷酸化信号序列。在一些双向构建体中,第一区段可以包括第二聚腺苷酸化信号序列。在一些双向构建体中,第一区段可以包括第一聚腺苷酸化信号序列,并且第二区段可以包括第二聚腺苷酸化信号序列(例如,聚腺苷酸化信号序列的反向补体)。在一些双向构建体中,第一区段可以包括定位于第一编码序列的3'端的第一聚腺苷酸化信号序列。在一些双向构建体中,第二区段可以包括定位于第二
编码序列的反向补体的5'端的第二聚腺苷酸化信号序列的反向补体。在一些双向构建体中,所述第一区段可以包括定位于所述第一编码序列的3'端的第一聚腺苷酸化信号序列,并且所述第二区段可以包括定位于所述第二编码序列的所述反向补体的5'端的第二聚腺苷酸化信号序列的反向补体。第一聚腺苷酸化信号序列和第二聚腺苷酸化信号序列可以相同或不同。在一个实例中,第一聚腺苷酸化信号和第二聚腺苷酸化信号是不同的。
[0185]
在一些情况下,双向构建体可以包括一个或多个(例如,两个)剪接受体位点。在一些双向构建体中,第一区段可以包括第一剪接受体位点。在一些双向构建体中,第一区段可以包括第二剪接受体位点。在一些双向构建体中,第一区段可以包括第一剪接受体位点,并且第二区段可以包括第二剪接受体位点(例如,剪接受体位点的反向补体)。在一些双向构建体中,第一区段包括定位于第一编码序列的5'端的第一剪接受体位点。在一些双向构建体中,第二区段包括定位于第二编码序列的反向补体的3'端的第二剪接受体位点的反向补体。在一些双向构建体中,所述第一区段包括定位于所述第一编码序列的5'端的第一剪接受体位点,并且所述第二区段包括定位于所述第二编码序列的所述反向补体的3'端的第二剪接受体位点的反向补体。第一剪接受体位点和第二剪接受体位点可以相同或不同。在一个实例中,第一剪接受体位点和第二剪接受体位点是不同的。第一剪接受体位点和/或第二剪接受体位点可以来自rs1基因(例如,来自rs1基因的内含子1),如人rs1基因。
[0186]
一些双向构建体可以包括驱动第一视网膜劈裂素蛋白或其片段或变体的表达的启动子和/或驱动第二视网膜劈裂素蛋白或其片段或变体的表达的启动子的反向补体。可替代地,双向构建体可以是不包括驱动第一视网膜劈裂素蛋白或其片段或变体或第二视网膜劈裂素蛋白或其片段或变体的表达的启动子的构建体(即,无启动子的构建体)。
[0187]
编码序列中的一者或两者可以被密码子优化以在宿主细胞中表达。在一些双向构建体中,仅编码序列之一是密码子优化的。在一些双向构建体中,第一编码序列是密码子优化的。在一些双向构建体中,第二编码序列是密码子优化的。在一些双向构建体中,两个编码序列均是密码子优化的。
[0188]
在示例性双向构建体中,所述第二区段定位于所述第一区段的3'端,所述第一视网膜劈裂素蛋白或其片段和所述第二视网膜劈裂素蛋白或其片段两者均是人视网膜劈裂素蛋白或其片段,所述第一视网膜劈裂素蛋白或其片段与所述第二视网膜劈裂素蛋白或其片段相同,所述第一编码序列和所述第二编码序列两者均包括互补dna(cdna),所述cdna包括人rs1或其简并变体的外显子2-6,所述第二编码序列采用与所述第一编码序列的密码子使用不同的密码子使用,其中所述第一区段包括定位于所述第一编码序列的3'端的第一聚腺苷酸化信号序列,并且所述第二区段包括定位于所述第二编码序列的所述反向补体的5'端的第二聚腺苷酸化信号序列的反向补体,所述第一区段包括定位于所述第一编码序列的5'端的第一剪接受体位点,并且所述第二区段包括定位于所述第二编码序列的所述反向补体的3'端的第二剪接受体位点的反向补体,所述核酸构建体不包括驱动所述第一视网膜劈裂素蛋白或其片段或所述第二视网膜劈裂素蛋白或其片段的表达的启动子,并且任选地所述核酸构建体不包括同源臂。
[0189]
在示例性双向构建体中,所述第一视网膜劈裂素蛋白或其片段和/或所述第二视网膜劈裂素蛋白或其片段包括与seq id no:2或5至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或
100%相同的序列、基本上由其组成或由其组成。在示例性双向构建体中,所述第一编码序列和/或所述第二编码序列包括与seq id no:6、8或9或其简并变体至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或约100%相同的序列、基本上由其组成或由其组成。在示例性双向构建体中,所述第一编码序列包括与seq id no:8至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%相同的序列、基本上由其组成或由其组成,并且所述第二编码序列包括与seq id no:9至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%相同的序列、基本上由其组成或由其组成。在示例性双向构建体中,所述核酸构建体包括与seq id no:46或47至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%相同的序列、基本上由其组成或由其组成。
[0190]
核酸构建体可以包含提供另外的期望特征的修饰或序列(例如,经修饰的或经调控的稳定性;用荧光标记跟踪或检测;蛋白质或蛋白质复合物的结合位点等)。核酸构建体可以包括一种或多种荧光标记、纯化标签、表位标签或其组合。例如,核酸构建体可以包括一个或多个荧光标记(例如,荧光蛋白或其它荧光团或染料),如至少1个、至少2个、至少3个、至少4个或至少5个荧光标记。示例性荧光标记包含荧光团,如荧光素(例如,6-羧基荧光素(6-fam))、德克萨斯红(texas red)、hex、cy3、cy5、cy5.5、太平洋蓝、5-(和-6)-羧基四甲基罗丹明(tamra)和cy7。多种荧光染料可商购获得,用于标记寡核苷酸(例如,来自整合dna技术公司(integrated dna technologies))。此类荧光标记(例如,内部荧光标记)可以用于例如检测已经直接整合到经切割的靶核酸中的核酸构建体,所述经切割的靶核酸具有与核酸构建体的端相容的突出端。标签或标记可以位于核酸构建体的5'端、3'端或内部。例如,核酸构建体可以在5'端与来自整合dna技术公司(5'700)的ir700荧光团缀合。
[0191]
核酸构建体还可以包括条件等位基因。条件等位基因可以是多功能等位基因,如us2011/0104799中所述,所述文献出于所有目的通过引用整体并入本文。例如,条件等位基因可以包括:(a)相对于基因转录在有义取向上的启动序列;(b)在有义或反义取向上的药物选择盒(dsc);(c)在反义取向上的所关注核苷酸序列(nsi);以及(d)在相反取向上的条件反转模块(coin,其利用外显子分裂内含子和可逆基因捕获样模块)。参见例如us 2011/0104799。条件等位基因可以进一步包括可重组单元,所述可重组单元在暴露于第一重组酶后重组以形成条件等位基因,所述条件等位基因(i)缺少启动序列和dsc;并且(ii)含有有义取向上的nsi和反义取向上的coin。参见例如us 2011/0104799。
[0192]
核酸构建体还可以包括编码选择标志物的多核苷酸。可替代地,核酸构建体可能缺少编码选择标志物的多核苷酸。选择标志物可以包含在选择盒中。任选地,选择盒可以是自缺失盒。参见例如us 8,697,851和us 2013/0312129,所述文献中的每个文献出于所有目的通过引用整体并入本文。作为实例,自缺失盒可以包括与小鼠prm1启动子可操作地连接的crei基因(包括编码cre重组酶的由内含子分开的两个外显子)和与人泛素启动子可操作地连接的新霉素抗性基因。通过采用prm1启动子,可以在f0动物的雄性生殖细胞中特异性地缺失自缺失盒。示例性选择标志物包含新霉素磷酸转移酶(neor)、潮霉素b磷酸转移酶(hygr)、嘌呤霉素-n-乙酰转移酶(puror)、杀稻瘟菌素-s脱氨酶(bsrr)、黄嘌呤/鸟嘌呤磷酸
核糖转移酶(gpt)或单纯疱疹病毒胸苷激酶(hsv-k)或其组合。编码选择标志物的多核苷酸可以可操作地连接到在被靶向的细胞中具有活性的启动子。启动子的实例在本文其它地方描述。
[0193]
核酸构建体还可以包括报告基因。示例性报告基因包含编码以下的基因:荧光素酶、β-半乳糖苷酶、绿色荧光蛋白(gfp)、增强型绿色荧光蛋白(egfp)、青色荧光蛋白(cfp)、黄色荧光蛋白(yfp)、增强型黄色荧光蛋白(eyfp)、蓝色荧光蛋白(bfp)、增强型蓝色荧光蛋白(ebfp)、dsred、zsgreen、mmgfp、mplum、mcherry、tdtomato、mstrawberry、j-red、morange、mko、mcitrine、venus、ypet、祖母绿、cypet、cerulean、t-天蓝色和碱性磷酸酶。此类报告基因可以可操作地连接到在被靶向的细胞中具有活性的启动子。启动子的实例在本文其它地方描述。
[0194]
核酸构建体还可以包括一种或多种表达盒或缺失盒。给定的盒可以包括所关注的核苷酸序列、编码选择标志物的多核苷酸和报告基因中的一种或多种,以及影响表达的各种调节组分。可以包含的可选择标志物和报告基因的实例在本文别处详细讨论。
[0195]
核酸构建体可以包括侧接有位点特异性重组靶序列的核酸。可替代地,核酸构建体可以包括一个或多个位点特异性重组靶序列。尽管整个核酸构建体可以侧接有此类位点特异性重组靶序列,但核酸构建体内的任何所关注的区或个体多核苷酸也可以侧接有此类位点。可以侧接核酸构建体或核酸构建体中的任何所关注的多核苷酸的位点特异性重组靶序列可以包含例如loxp、lox511、lox2272、lox66、lox71、loxm2、lox5171、frt、frt11、frt71、attp、att、frt、rox或其组合。在一个实例中,位点特异性重组位点侧接编码核酸构建体中包含的选择标志物和/或报告基因的多核苷酸。在靶向基因座处整合核酸构建体后,可以去除位点特异性重组位点之间的序列。
[0196]
核酸构建体还可以包括一个或多个限制性核酸内切酶(即,限制酶)的限制位点,所述限制性核酸内切酶包含i型、ii型、iii型和iv型核酸内切酶。i型和iii型限制性核酸内切酶识别具体的识别位点,但通常在离核酸酶结合位点可变的位置处进行切割,所述核酸酶结合位点可能与切割位点(识别位点)相距数百个碱基对。在ii型系统中,限制活性独立于任何甲基化酶活性,并且切割通常发生在结合位点内或附近的具体位点处。大多数ii型酶切断回文序列,然而iia型酶识别非回文识别位点并在识别位点外部进行切割,iib型酶用识别位点外部的两个位点切断序列两次,并且iis型酶识别不对称识别位点并在一侧上以及在距识别位点约1-20个核苷酸的限定距离处进行切割。iv型限制酶靶向甲基化dna。限制酶例如在rebase数据库中进一步描述和分类(rebase.neb.com网页;roberts等人,(2003)《核酸研究》31:418-420;roberts等人,(2003)《核酸研究》31:1805-1812;以及belfort等人(2002)《移动dna ii(mobile dna ii)》,第761-783页,craigie等人编辑(华盛顿特区asm出版社))。
[0197]
本文所公开的核酸构建体还可以包括另外的编码序列。例如,本文所公开的一些核酸构建体可以包括编码靶向靶基因组基因座(例如,靶向rs1,如rs1的内含子1)的向导rna的序列。编码向导rna的序列可以与启动子,如u6启动子可操作地连接。在一些核酸构建体中,向导rna表达盒定位于视网膜劈裂素编码序列的3'(下游)。在一些双向核酸构建体中,向导rna表达盒定位于第一区段与第二区段之间。
[0198]
iii.包括核酸构建体的载体
[0199]
本文还提供了包括核酸构建体(即,外源性供体核酸)的载体,所述核酸构建体包括用于整合到靶基因组基因座中并从靶基因组基因座表达的视网膜劈裂素编码序列(即,编码视网膜劈裂素蛋白或其片段或变体)。本文还提供了包括编码本文别处所公开的核酸酶药剂(例如,靶向内源性rs1基因座)的核酸的载体。本文还提供了包括本文别处所公开的核酸构建体和/或编码核酸酶药剂(例如,靶向内源rs1基因座)的核酸的载体(例如,包括核酸构建体和编码向导rna的dna的载体)。载体可以包括另外的序列,例如复制起点、启动子和编码抗生素抗性的基因。一些此类载体包括与靶基因组基因座中的靶位点相对应的同源臂。其它此类载体不包括任何同源臂。
[0200]
一些载体可以是圆形的。可替代地,所述载体可以是线性的。载体可以包装成通过脂质纳米颗粒、脂质体、非脂质纳米颗粒或病毒衣壳递送。非限制性示例性载体包含质粒、噬菌粒、粘粒、人工染色体、微型染色体、转座子、病毒载体和表达载体。
[0201]
载体可以是例如病毒载体,如腺相关病毒(aav)载体。aav可以是任何合适的血清型并且可以是单链aav(ssaav)或自身互补型aav(scaav)。其它示例性病毒/病毒性载体包含逆转录病毒、腺病毒、牛痘病毒、痘病毒和单纯疱疹病毒。病毒可以感染分裂细胞、非分裂细胞或分裂细胞和非分裂细胞两者。病毒可以整合到宿主基因组中,或者可替代地不整合到宿主基因组中。此类病毒还可以被工程化为具有降低的免疫力。病毒可能具有复制能力,也可能具有复制缺陷(例如,在另外轮次的病毒粒子复制和/或包装所必需的一个或多个基因中存在缺陷)。病毒可以引起瞬时表达、长期表达(例如,至少1周、2周、1个月、2个月或3个月)或永久表达(例如,cas9和/或grna)。示例性病毒滴度(例如,aav滴度)包含10
12
、10
13
、10
14
、10
15
和10
16
个载体基因组/ml。示例性病毒滴度(例如,aav滴度)包含约10
12
、约10
13
、约10
14
、约10
15
和约10
16
个载体基因组(vg)/ml,或介于约10
12
到约10
16
之间、介于约10
12
到约10
15
之间、介于约10
12
到约10
14
之间、介于约10
12
到约10
13
之间、介于约10
13
到约10
16
之间、介于约10
14
到约10
16
之间、介于约10
15
到约10
16
或介于约10
13
到约10
15
之间个vg/ml。其它示例性病毒滴度(例如,aav滴度)包含约1012、约1013、约1014、约1015和约1016个载体基因组(vg)/kg体重,或介于约10
12
到约10
16
之间、介于约10
12
到约10
15
之间、介于约10
12
到约10
14
之间、介于约10
12
到约10
13
之间、介于约10
13
到约10
16
之间、介于约10
14
到约10
16
之间、介于约10
15
到约10
16
或介于约10
13
到约10
15
之间个vg/kg体重。
[0202]
ssdna aav基因组由两个开放阅读框rep和cap组成,其侧接有允许合成互补dna链的两个反向末端重复序列。当构建aav转移质粒时,转基因放置在两个itr之间,并且rep和cap可以反式提供。除了rep和cap之外,aav还可能需要含有腺病毒基因的辅助质粒。这些基因(e4、e2a和va)介导aav复制。例如,转移质粒、rep/cap和辅助质粒可以转染到含有腺病毒基因e1 的hek293细胞中,以产生感染性aav颗粒。可替代地,将rep、cap和腺病毒辅助基因可以组合成单个质粒。相似的包装细胞和方法可以用于其它病毒,如逆转录病毒。
[0203]
已经鉴定了aav的多种血清型。这些血清型在其感染的细胞类型(即,其趋向性)方面不同,允许优先转导特定细胞类型。感光细胞的血清型包含aav2、aav5和aav8。视网膜色素上皮组织的血清型包含aav1、aav2、aav4、aav5和aav8。在具体实例中,包括核酸构建体的aav载体可以是aav2、aav5或aav8。
[0204]
趋向性可以通过假型进一步细化,所述假型即混合来自不同病毒血清型的衣壳和基因组。例如,aav2/5指示包装在来自血清型5的衣壳中的含有血清型2基因组的病毒。使用
假型病毒可以提高转导效率以及改变趋向性。源自不同血清型的杂交衣壳也可以用于改变病毒趋向性。例如,aav-dj含有来自八种血清型的杂交衣壳,并在广泛的体内细胞类型中表现出高感染性。aav-dj8是显示aav-dj性质的另一个实例,但具有增强的脑摄取。aav血清型还可以通过突变进行修饰。aav2突变修饰的实例包含y444f、y500f、y730f和s662v。aav3突变修饰的实例包含y705f、y731f和t492v。aav6突变修饰的实例包含s663v和t492v。其它假型的/经修饰的aav变体包含aav2/1、aav2/6、aav2/7、aav2/8、aav2/9、aav2.5、aav8.2和aav/sastg。在具体实例中,aav是aav7m8,是一种介导高效递送到所有视网膜层和感光器的aav变体。参见例如,dalkara等人,(2013)《科学转化医学(sci.transl.med.)》5:189ra76,所述文献出于所有目的通过引用整体并入本文。
[0205]
为了加速转基因表达,可以使用自身互补型aav(scaav)变体。由于aav依赖于细胞的dna复制机制来合成aav单链dna基因组的互补链,因此转基因表达可能会延迟。为了解决这种延迟问题,可以使用含有能够在感染后自发退火的互补序列的scaav,从而消除对宿主细胞dna合成的需要。然而,也可以使用单链aav(ssaav)载体。
[0206]
为了提高包装能力,可以将较长的转基因在两个aav转移质粒之间拆分,第一个具有3'剪接供体并且第二个具有5'剪接受体。在细胞共感染后,这些病毒形成多联体,拼接在一起,并且全长转基因可以被表达。虽然这允许更长的转基因表达,但表达效率较低。用于增加容量的相似方法利用同源重组。例如,转基因可以在两个转移质粒之间分开但是具大量的序列重叠,使得共表达诱导全长转基因的同源重组和表达。
[0207]
iv.包括核酸构建体的脂质纳米颗粒
[0208]
本文还提供了包括核酸构建体(即,外源性供体核酸)的脂质纳米颗粒,所述核酸构建体包括用于整合到靶基因组基因座中并从靶基因组基因座表达的视网膜劈裂素编码序列(即,编码视网膜劈裂素蛋白或其片段或变体)。本文还提供了本文别处所公开的包括编码核酸酶药剂(例如,靶向内源性rs1基因座)的核酸的脂质纳米颗粒。本文还提供了本文别处所公开的包括核酸构建体和编码核酸酶药剂(例如,靶向内源性rs1基因座)的核酸的脂质纳米颗粒。
[0209]
脂质调配物可以保护生物分子免于降解,同时改善其细胞摄取。脂质纳米颗粒是包括通过分子间力彼此物理相关的多个脂质分子的颗粒。这些颗粒包含微球体(包含单层和多层囊泡,例如,脂质体)、乳液中的分散相、胶束或悬浮液中的内相。此类脂质纳米颗粒可以用于封装一个或多个核酸或蛋白质以供递送。含有阳离子脂质的调配物可用于递送如核酸等聚阴离子。其它可以包含在内的脂质是中性脂质(即,不带电荷或两性离子脂质)、阴离子脂质、增强转染的辅助脂质和增加纳米颗粒可以在体内存在的时间长度的隐形脂质。合适的阳离子脂质、中性脂质、阴离子脂质、辅助脂质和隐形脂质的实例可以在wo 2016/010840 a1和wo 2017/173054a1中找到,所述文献出于所有目的通过引用整体并入本文。示例性脂质纳米颗粒可以包括阳离子脂质和一种或多种其它组分。在一个实例中,其它组分可以包括如胆固醇等辅助脂质。在另一个实例中,其它组分可以包括如胆固醇等辅助脂质和如dspc等中性脂质。在另一个实例中,其它组分可以包括如胆固醇等辅助脂质、如dspc等任选的中性脂质以及如s010、s024、s027、s031或s033等隐形脂质。
[0210]
lnp可以含有以下中的一种或多种或全部:(i)用于封装和用于内体逃逸的脂质;(ii)用于稳定的中性脂质;(iii)用于稳定的辅助脂质;(iv)隐形脂质。参见例如,finn等人
(2018)《细胞报告(cell rep.)》22(9):2227-2235和wo 2017/173054 a1,所述文献中的每个文献出于所有目的通过引用整体并入本文。在某些lnp中,负荷物可以进一步包括核酸酶药剂。在某些lnp中,负荷物可以进一步包括向导rna或编码向导rna的核酸。在某些lnp中,负荷物可以进一步包括编码如cas9等cas核酸酶的mrna以及向导rna或编码向导rna的核酸。在某些lnp中,负荷物可以包含编码如cas9等cas核酸酶的mrna、向导rna或编码向导rna的核酸以及核酸构建体。
[0211]
用于包封和内体逃逸的脂质可以是阳离子脂质。脂质还可以是生物可降解脂质,如生物可降解可电离脂质。合适的脂质的一个实例是脂质a或lp01,即(9z,12z)-3-((4,4-双(辛氧基)丁酰基)氧基)-2-((((3-(二乙氨基)丙氧基)羰基)氧基)甲基)丙基十八-9,12-二烯酸酯,也被称为3-((4,4-双(辛氧基)丁酰基)氧基)-2-((((3-(二乙氨基)丙氧基)羰基)氧基)甲基)丙基(9z,12z)-十八-9,12-二烯酸酯。参见例如,finn等人(2018)《细胞报告(cell rep.)》22(9):2227-2235和wo 2017/173054a1,所述文献中的每个文献出于所有目的通过引用整体并入本文。合适的脂质的另一个实例是脂质b,即((5-((二甲氨基)甲基)-1,3-亚苯基)双(氧))双(辛烷-8,1-二基)双(癸酸酯),也被称为((5-((二甲氨基)甲基)-1,3-亚苯基)双(氧基))双(辛烷-8,1-二基)双(癸酸酯)。合适的脂质的另一个实例是脂质c,即2-((4-(((3-(二甲氨基)丙氧基)羰基)氧基)十六酰基)氧基)丙烷-1,3-二基(9z,9'z,12z,12'z)-双(十八-9,12-二烯酸酯)。合适的脂质的另一个实例是脂质d,即3-(((3-(二甲氨基)丙氧基)羰基)氧基)-13-(辛酰氧基)十三烷基3-辛基十一烷酸酯。其它合适的脂质包含三十七-6,9,28,31-四烯-19-基4-(二甲氨基)丁酸酯(也被称为dlin-mc3-dma(mc3))。
[0212]
适用于本文所描述的lnp的一些此类脂质在体内是生物可降解的。例如,包括此类脂质的lnp包含在8小时、10小时、12小时、24小时或48小时或3天、4天、5天、6天、7天或10天内从血浆中清除脂质的至少75%的那些。作为另一个实例,lnp的至少50%在8小时、10小时、12小时、24小时或48小时或3天、4天、5天、6天、7天或10天内从血浆中清除。
[0213]
根据其所在的介质的ph值,此类脂质可以是可电离的。例如,在微酸性介质中,脂质可以被质子化并且因此带有正电荷。相反,在弱碱性介质中,例如在ph大约为7.35的血液中,脂质可能不会被质子化并且因此不带电荷。在一些实施例中,脂质可以在至少约9、9.5或10的ph下质子化。这种脂质带电荷的能力与其固有pka有关。例如,脂质的pka可以独立地处于约5.8到约6.2的范围内。
[0214]
中性脂质的作用是稳定和改善lnp的处理。合适的中性脂质的实例包含各种中性、不带电荷或两性离子脂质。适用于本公开的中性磷脂的实例包含但不限于5-十七烷基苯-1,3-二醇(间苯二酚)、二棕榈酰磷脂酰胆碱(dppc)、二硬脂酰磷脂酰胆碱(dspc)、磷酸胆碱(dopc)、二肉豆蔻酰磷脂酰胆碱(dmpc)、磷脂酰胆碱(plpc)、1,2-二硬脂酰-sn-甘油-3-磷酸胆碱(dapc)、磷脂酰乙醇胺(pe)、卵磷脂酰胆碱(epc)、二月桂酰磷脂酰胆碱(dlpc)、二肉豆蔻酰磷脂酰胆碱(dmpc)、1-肉豆蔻酰-2-棕榈酰磷脂酰胆碱(mppc)、1-棕榈酰-2-肉豆蔻酰磷脂酰胆碱(pmpc)、1-棕榈酰-2-硬脂酰磷脂酰胆碱(pspc)、1,2-二花生酰-sn-甘油-3-磷酸胆碱(dbpc)、1-硬脂酰-2-棕榈酰磷脂酰胆碱(sppc)、1,2-二二十碳烯酰-sn-甘油-3-磷酸胆碱(depc)、棕榈酰油酰磷脂酰胆碱(popc)、溶血磷脂酰胆碱、二油酰磷脂酰乙醇胺(dope)、二亚油酰磷脂酰胆碱二硬脂酰磷脂酰乙醇胺(dspe)、二肉豆蔻酰磷脂酰乙醇胺(dmpe)、二棕榈酰磷脂酰乙醇胺(dppe)、棕榈酰油酰磷脂酰乙醇胺(pope)、溶血磷脂酰乙醇
胺和其组合。例如,中性磷脂可以选自由二硬脂酰磷脂酰胆碱(dspc)和二肉豆蔻酰磷脂酰乙醇胺(dmpe)组成的组。
[0215]
辅助脂质包含增强转染的脂质。辅助脂质增强转染的机制可以包含增强颗粒稳定性。在某些情况下,辅助脂质可以增强膜融合性。辅助脂质包含类固醇、甾醇和烷基间苯二酚。合适的辅助脂质的实例包含胆固醇、5-十七烷基间苯二酚和胆固醇半琥珀酸酯。在一个实例中,辅助脂质可以是胆固醇或胆固醇半琥珀酸酯。
[0216]
隐形脂质包含改变纳米颗粒可以在体内存在的时间长度的脂质。隐形脂质可以通过例如减少颗粒聚集和控制粒度来帮助调配过程。隐形脂质可以调节lnp的药代动力学性质。合适的隐形脂质包含具有连接到脂质部分的亲水性头部基团的脂质。
[0217]
隐形脂质的亲水性头部基团可以包括例如选自基于peg(有时称为聚(环氧乙烷))、聚(噁唑啉)、聚(乙烯醇)、聚(甘油)、聚(n-乙烯基吡咯烷酮)、聚氨基酸和聚n-(2-羟丙基)甲基丙烯酰胺的聚合物的聚合物部分。术语peg意指任何聚乙二醇或其它聚亚烷基醚聚合物。在某些lnp调配物中,peg是peg-2k,也被称为peg 2000,其平均分子量为约2,000道尔顿。参见例如wo 2017/173054 a1,所述文献出于所有目的通过引用整体并入本文。
[0218]
隐形脂质的脂质部分可以衍生自例如二酰基甘油或二烷基甘酰胺,其包含包括二烷基甘油或二烷基甘酰胺基团的那些,所述二烷基甘油或二烷基甘酰胺基团具有独立地包括约c4到约c40个饱和或不饱和碳原子的烷基链长度,其中链可以包括一个或多个官能团,例如酰胺或酯。二酰基甘油或二烷基甘酰胺基团可以进一步包括一个或多个经取代的烷基。
[0219]
作为一个实例,隐形脂质可以选自peg-二月桂酸甘油酯、peg-二肉豆蔻酰甘油(peg-dmg)、peg-二棕榈酰甘油、peg-二硬脂酰甘油(peg-dspe)、peg-二月桂甘酰胺、peg-二肉豆蔻甘酰胺、peg-二棕榈酰甘酰胺和peg-二硬脂酰甘酰胺、peg-胆固醇(l-[8'-(胆甾-5-en-3[β]-氧基)甲酰胺基-3',6'-二氧杂辛基]氨甲酰基-[ω]-甲基-聚(乙二醇)、peg-dmb(3,4-二十四烷基苄基-[ω]-甲基-聚(乙二醇)醚)、1,2-二肉豆蔻酰-sn-甘油-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-2000](peg2k-dmg)、1,2-二硬脂酰-sn-甘油-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-2000](peg2k-dspe)、1,2-二硬脂酰-sn-甘油、甲氧基聚乙烯乙二醇(peg2k-dsg)、聚(乙二醇)-2000-二甲基丙烯酸酯(peg2k-dma)和1,2-二硬脂氧基丙基-3-胺-n-[甲氧基(聚乙二醇)-2000](peg2k-dsa)。在一个特定实例中,隐形脂质可以是peg2k-dmg。
[0220]
lnp可以包括调配物中相应摩尔比的组分脂质。ccd脂质的mol-%可以为例如约30mol-%到约60mol-%、约35mol-%到约55mol-%、约40mol-%到约50mol-%、约42mol-%到约47mol-%或约45%。辅助脂质的mol-%可以为例如约30mol-%到约60mol-%、约35mol-%到约55mol-%、约40mol-%到约50mol-%、约41mol-%到约46mol-%或约44mol-%。中性脂质的mol-%可以为例如约1mol-%到约20mol-%、约5mol-%到约15mol-%、约7mol-%到约12mol-%或约9mol-%。隐形脂质的mol-%可以为例如约1mol-%到约10mol-%、约1mol-%到约5mol-%、约1mol-%到约3mol-%、约2mol-%或约1mol-%。
[0221]
lnp在生物可降解脂质(n)的带正电荷的胺基团与待封装的核酸的带负电荷的磷酸基团(p)之间可以具有不同的比率。这可以由等式n/p在数学上表示。例如,n/p比率可以为约0.5到约100、约1到约50、约1到约25、约1到约10、约1到约7、约3到约5、约4到约5、约4、
约4.5或约5。
[0222]
在一些lnp中,负荷物可以包括cas mrna和grna。cas mrna和grna的比率可以不同。例如,lnp调配物的cas mrna与grna核酸的比率的范围可以为约25:1到约1:25、约10:1到约1:10、约5:1到约1:5或为约1:1。可替代地,lnp调配物的cas mrna与grna核酸的比率可以为约1:1到约1:5或约10:1。可替代地,lnp调配物的cas mrna与grna核酸的比率可以为约1:10、25:1、10:1、5:1、3:1、1:1、1:3、1:5、1:10或1:25。可替代地,lnp调配物的cas mrna与grna核酸的比率可以为约1:1到约1:2。在具体实例中,cas mrna与grna的比率可以为约1:1或约1:2。
[0223]
lnp的示例性剂量包含相对于总rna(cas9 mrna和grna)负荷物含量的约0.1、约0.25、约0.3、约0.5、约1、约2、约3、约4、约5、约6、约8或约10mg/kg体重(mpk),或约0.1到约10、约0.25到约10、约0.3到约10、约0.5到约10、约1到约10、约2到约10、约3到约10、约4到约10、约5到约10、约6到约10、约8到约10、约0.1到约8、约0.1到约6、约0.1到约5、约0.1到约4、约0.1到约3、约0.1到约2、约0.1到约1、约0.1到约0.5、约0.1到约0.3、约0.1到约0.25、约0.25到约8、约0.3到约6、约0.5到约5、约1到约5、或约2到约3mg/kg体重。此类lnp可以例如静脉内施用。在一个实例中,可以使用介于约0.01mg/kg与约10mg/kg之间、介于约0.1与约10mg/kg之间或介于约0.01与约0.3mg/kg之间的lnp剂量。例如,可以使用约0.01、约0.03、约0.1、约0.3、约1、约3或约10mg/kg的lnp剂量。lnp的另外的示例性剂量包含相对于总rna(cas9 mrna和grna)负荷物含量的约0.1、约0.25、约0.3、约0.5、约1、约2、约3、约4、约5、约6、约8或约10mg/kg(mpk)体重,或约0.1到约10、约0.25到约10、约0.3到约10、约0.5到约10、约1到约10、约2到约10、约3到约10、约4到约10、约5到约10、约6到约10、约8到约10、约0.1到约8、约0.1到约6、约0.1到约5、约0.1到约4、约0.1到约3、约0.1到约2、约0.1到约1、约0.1到约0.5、约0.1到约0.3、约0.1到约0.25、约0.25到约8、约0.3到约6、约0.5到约5、约1到约5、或约2到约3mg/kg体重。此类lnp可以例如静脉内施用。在一个实例中,可以使用介于约0.01mg/kg与约10mg/kg之间、介于约0.1与约10mg/kg之间或介于约0.01与约0.3mg/kg之间的lnp剂量。例如,可以使用约0.01、约0.03、约0.1、约0.3、约0.5、约1、约2、约3或约10mg/kg的lnp剂量。在另一个实例中,可以使用介于约0.5与约10之间、介于约0.5与约5之间、介于约0.5与约3之间、介于约1与约10之间、介于约1与约5之间、介于约1与约3之间或介于约1与约2mg/kg之间的lnp剂量。
[0224]
v.包括核酸构建体和/或核酸酶药剂或编码核酸酶药剂的核酸的组合物
[0225]
本文还提供了包括核酸构建体的组合物,所述核酸构建体包括用于整合到本文所公开的靶基因组基因座、载体或脂质纳米颗粒中并从其表达的视网膜劈裂素编码序列(即,编码视网膜劈裂素蛋白或其片段或变体)和核酸酶药剂或编码核酸酶药剂的核酸。本文还提供了包括核酸构建体的组合物,所述核酸构建体包括用于整合到本文所公开的靶基因组基因座、载体或脂质纳米颗粒中并从其表达的视网膜劈裂素编码序列(即,编码视网膜劈裂素蛋白或其片段或变体)。本文还提供了包括核酸酶药剂或编码核酸酶药剂的核酸(例如,其中核酸酶药剂靶向rs1基因或基因座)的组合物或包括核酸酶药剂或编码核酸酶药剂的核酸的载体或脂质纳米颗粒。此类组合物可以例如用于在细胞中表达视网膜劈裂素或用于将视网膜劈裂素蛋白或其片段或变体的编码序列整合到细胞中的靶基因组基因座中。例如,此类组合物还可以用于治疗患有x连锁青少年型视网膜劈裂症(xlrs)的受试者。此类组
合物可以包括核酸构建体,所述核酸构建体包括用于整合到靶基因组基因座中的视网膜劈裂素蛋白或其片段的编码序列(或包括核酸构建体的载体或脂质纳米颗粒)和核酸酶药剂或编码核酸酶药剂的核酸,其中所述核酸酶药剂靶向靶基因组基因座中的核酸酶靶序列。核酸酶药剂可以是crispr/cas系统(例如,cas蛋白和向导rna)或任何其它合适的核酸酶药剂。下面提供了合适的核酸酶药剂的实例。
[0226]
a.crispr/cas系统
[0227]
本文公开的方法和组合物可以利用成簇规律间隔短回文重复序列(crispr)/crispr相关(cas)系统或此类系统的组分来修饰细胞内的基因组(例如,rs1基因座)。crispr/cas系统包含转录物和涉及cas基因表达或引导其活性的其它元件。crispr/cas系统可以是例如i型、ii型、iii型系统或v型系统(例如,v-a亚型或v-b亚型)。本文公开的方法和组合物可以通过利用crispr复合物(包括与cas蛋白复合的向导rna(grna))用于核酸的定点结合或切割来采用crispr/cas系统。
[0228]
在本文公开的组合物和方法中使用的crispr/cas系统可以是非天然存在的。“非天然存在的”系统包含指示人参与的任何事物,如系统的一个或多个组分从其天然存在的状态改变或突变,至少基本上不含至少一种与其在自然界中天然相关的其它组分,或者与至少一种与其不天然相关的其它成分相关。例如,一些crispr/cas系统采用包括非天然一起存在的grna和cas蛋白的非天然存在的crispr复合物,采用非天然存在的cas蛋白,或者采用非天然存在的grna。
[0229]
1.cas蛋白
[0230]
cas蛋白通常包括可以与向导rna相互作用的至少一个rna识别或结合结构域。cas蛋白还可以包括核酸酶结构域(例如,dnase结构域或rnase结构域)、dna结合结构域、解旋酶结构域、蛋白质-蛋白质相互作用结构域、二聚化结构域和其它结构域。一些此类结构域(例如,dnase结构域)可以来自天然cas蛋白。可以添加其它此类结构域以制备经修饰的cas蛋白。核酸酶结构域对核酸切割具有催化活性,所述核酸切割包含核酸分子的共价键的断裂。切割可以产生平末端或交错末端,并且其可以是单链或双链的。例如,野生型cas9蛋白通常将产生钝性切割产物。可替代地,野生型cpf1蛋白(例如,fncpf1)可以产生具有5核苷酸5'突出端的切割产物,其中切割发生在来自非靶向链上的pam序列的第18个碱基对之后和基于靶向链的第23个碱基对之后。cas蛋白可以具有完整的切割活性以在靶基因组基因座处产生双链断裂(例如,具有平末端的双链断裂),或者其可以是在靶基因组基因座处产生单链断裂的切口酶。
[0231]
cas蛋白的实例包含cas1、cas1b、cas2、cas3、cas4、cas5、cas5e(casd)、cas6、cas6e、cas6f、cas7、cas8a1、cas8a2、cas8b、cas8c、cas9(csn1或csx12)、cas10、cas10d、casf、casg、cash、csy1、csy2、csy3、cse1(casa)、cse2(casb)、cse3(case)、cse4(casc)、csc1、csc2、csa5、csn2、csm2、csm3、csm4、csm5、csm6、cmr1、cmr3、cmr4、cmr5、cmr6、csb1、csb2、csb3、csx17、csx14、csx10、csx16、csax、csx3、csx1、csx15、csf1、csf2、csf3、csf4和cu1966及其同源物或经修饰的版本。
[0232]
示例性cas蛋白是cas9蛋白或源自cas9蛋白的蛋白。cas9蛋白来自ii型crispr/cas系统,并且通常共享具有保守结构的四个关键基序。基序1、2和4是ruvc样基序,并且基序3是hnh基序。示例性cas9蛋白来自酿脓链球菌(streptococcus pyogenes)、嗜热链球菌
(streptococcus thermophilus)、链球菌(streptococcus sp.)、金黄色葡萄球菌(staphylococcus aureus)、达松维尔拟诺卡氏菌(nocardiopsis dassonvillei)、始旋链霉菌(streptomyces pristinaespiralis)、绿产色链霉菌(streptomyces viridochromogenes)、绿产色链霉菌、链孢囊菌(streptosporangium roseum)、链孢囊菌、酸热脂环酸杆菌(alicyclobacillus acidocaldarius)、假蕈状芽孢杆菌(bacillus pseudomycoides)、硒化芽孢杆菌(bacillus selenitireducens)、西伯利亚微小杆菌(exiguobacterium sibiricum)、德氏乳酸杆菌(lactobacillus delbrueckii)、唾液乳杆菌(lactobacillus salivarius)、海洋微颤蓝细菌(microscilla marina)、伯克霍尔德氏菌(burkholderiales bacterium)、食萘极地单胞菌(polaromonas naphthalenivorans)、极地单胞菌(polaromonas sp.)、瓦氏鳄球藻(crocosphaera watsonii)、蓝丝菌(cyanothece sp.)、铜绿微囊藻(microcystis aeruginosa)、聚球藻(synechococcus sp.)、阿拉伯糖醋酸杆菌(acetohalobium arabaticum)、德根斯产氨菌(ammonifex degensii)、热解纤维素菌(caldicelulosiruptor becscii)、候选金矿菌(candidatus desulforudis)、肉毒杆菌(clostridium botulinum)、艰难梭菌(clostridium difficile)、大芬戈尔德菌(finegoldia magna)、嗜热厌氧钠杆菌(natranaerobius thermophilus)、丙酸降解菌(pelotomaculum thermopropionicum)、喜温嗜酸硫杆菌(acidithiobacillus caldus)、嗜酸氧化亚铁硫杆菌(acidithiobacillus ferrooxidans)、酒色异着色菌(allochromatium vinosum)、海杆菌(marinobacter sp.)、嗜盐亚硝化球菌(nitrosococcus halophilus)、瓦氏亚硝化球菌(nitrosococcus watsoni)、假交替单胞菌(pseudoalteromonas haloplanktis)、消旋纤线杆菌(ktedonobacter racemifer)、甲烷盐菌(methanohalobium evestigatum)、鱼腥藻(anabaena variabilis)、泡沫节球藻(nodularia spumigena)、念珠藻(nostoc sp.)、极大节旋藻(arthrospira maxima)、最大节螺藻(arthrospira platensis)、节旋藻(arthrospira sp.)、林氏藻(lyngbya sp.)、原型微鞘藻(microcoleus chthonoplastes)、颤藻(oscillatoria sp.)、移动石袍菌(petrotoga mobilis)、非洲栖热腔菌(thermosipho africanus)、深海阿卡罗虎尾草(acaryochloris marina)、脑膜炎奈瑟氏球菌(neisseria meningitidis)或空肠弯曲杆菌(campylobacter jejuni)。cas9家族成员的另外实例在wo 2014/131833中进行描述,所述文献出于所有目的通过引用整体并入本文。来自酿脓链球菌的cas9(spcas9)(例如,所分配的uniprot登录号为q99zw2)是示例性cas9蛋白。示例性spcas9蛋白序列在seq id no:27中示出(由seq id no:26中所示的dna序列编码)。示例性spcas9 cdna序列在seq id no:28中示出。较小的cas9蛋白(例如,当与向导rna编码序列和cas9和向导rna的调节元件组合时,其编码序列与最大aav包装能力相容的cas9蛋白,如sacas9和cjcas9以及nme2cas9)是其它示例性cas9蛋白。例如,来自金黄色葡萄球菌的cas9(sacas9)(所分配的uniprot登录号为j7rua5)是另一种示例性cas9蛋白。同样地,来自空肠弯曲杆菌的cas9(cjcas9)例如(所分配的uniprot登录号为q0p897)是另一种示例性cas9蛋白。参见例如,kim等人(2017),《自然通讯》8:14500,所述文献出于所有目的通过引用整体并入本文。sacas9小于spcas9,并且cjcas9小于sacas9和spcas9两者。来自脑膜炎奈瑟氏球菌的cas9(nme2cas9)是另一种示例性cas9蛋白。参见例如edraki等人(2019)《分子细胞(mol.cell)》73(4):714-726,所述文献出于所有目的通过引用整体并入本文。来自嗜热链
球菌的cas9蛋白(例如,由crispr1基因座编码的嗜热链球菌lmd-9cas9(st1cas9)或来自crispr3基因座的嗜热链球菌cas9(st3cas9))是其它例示性cas9蛋白。来自新凶手弗朗西丝氏菌(francisella novicida)的cas9(fncas9)或识别替代性pam(e1369r/e1449h/r1556a取代)的rha新凶手弗朗西丝氏菌cas9变体是其它示例性cas9蛋白。这些和其它示例性cas9蛋白例如在cebrian-serrano和davies(2017),《哺乳动物基因组(mamm.genome)》28(7):247-261中综述,所述文献出于所有目的通过引用整体并入本文。在wo 2013/176772、wo 2014/065596、wo 2016/106121和wo 2019/067910中提供了cas9编码序列、cas9 mrna和cas9蛋白序列的实例,所述文献中的每个文献出于所有目的通过引用整体并入本文。orf和cas9氨基酸序列的具体实例在wo 2019/067910的第[0449]段表30中提供,并且cas9 mrna和orf的具体实例在wo 2019/067910的第[0214]-[0234]段中提供。作为一个实例,cas9蛋白包括seq id no:6242中所示的序列、基本上由其组成或由其组成。此类cas9蛋白序列可以由包括以下、基本上由以下组成或由以下组成的mrna编码:seq id no:6243。作为另一个实例,cas9蛋白可以包括seq id no:6246中所示的序列、基本上由其组成或由其组成。此类cas9蛋白序列可以由包括以下、基本上由以下组成或由以下组成的mrna编码:seq id no:6245。
[0233]
cas蛋白的另一个实例是cpf1(来自普氏菌(prevotella)和弗朗西斯菌(francisella)1的crispr)蛋白。cpf1是大蛋白质(约1300个氨基酸),其含有与cas9的对应的结构域同源的ruvc样核酸酶结构域,以及与特征性富含精氨酸的cas9簇的对应物。然而,cpf1缺乏cas9蛋白中存在的hnh核酸酶结构域,并且ruvc样结构域在cpf1序列中是连续的,而cas9则相反,其含有包含hnh结构域的长插入物。参见例如,zetsche等人(2015)《细胞(cell)》163(3):759-771,所述文献出于所有目的通过引用整体并入本文。示例性cpf1蛋白来自土拉弗朗西斯菌1(francisella tularensis 1)、新凶手亚种土拉弗朗西丝菌(francisella tularensis subsp.novicida)、易北普氏菌(prevotella albensis)、毛螺菌科细菌(lachnospiraceae bacterium)mc2017 1、瘤胃产氢丁酸弧菌(butyrivibrio proteoclasticus)、异域菌门细菌(peregrinibacteria bacterium)gw2011_gwa2_33_10、俭菌超门细菌(parcubacteria bacterium)gw2011_gwc2_44_17、志贺氏杆菌(smithella sp.)scadc、氨基酸球菌(acidaminococcus sp.)bv3l6、毛螺科菌(lachnospiraceae bacterium)ma2020、候选白蚁甲烷菌(candidatus methanoplasma termitum)、挑剔真杆菌(eubacterium eligens)、牛眼莫拉氏菌(moraxella bovoculi)237、稻田氏钩端螺旋体(leptospira inadai)、毛螺菌科细菌(lachnospiraceae bacterium)nd2006、犬口腔卟啉单胞菌(porphyromonas crevioricanis)3、解糖胨普氏菌(prevotella disiens)和猕猴卟啉单胞菌(porphyromonas macacae)。来自新凶手弗朗西丝菌u112的cpf1(fncpf1;所分配的uniprot登录号为a0q7q2)是示例性cpf1蛋白。
[0234]
cas蛋白可以是野生型蛋白(即,自然界中存在的那些蛋白)、经修饰的cas蛋白(即,cas蛋白变体)或野生型或经修饰的cas蛋白的片段。就野生型或经修饰的cas蛋白的催化活性而言,cas蛋白也可以是活性变体或片段。就催化活性而言,活性变体或片段可以包括与野生型或经修饰的cas蛋白或其部分具有至少80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多的序列同一性,其中活性变体保留在期望的切割位点处切割的能力,并因此保留切口诱导或双链断裂诱导活性。对切口诱导或双链断裂诱
导活性的测定是已知的,并且通常测量cas蛋白对含有切割位点的dna底物的总体活性和特异性。
[0235]
可以修饰cas蛋白以增加或减少核酸结合亲和力、核酸结合特异性和酶活性中的一种或多种。也可以修饰cas蛋白以改变蛋白质的任何其它活性或性质,如稳定性。例如,cas蛋白的一个或多个核酸酶结构域可以是经修饰的、缺失的或失活的,或者可以截断cas蛋白以去除对蛋白质功能不必要的结构域或优化(例如,增强或减少)cas蛋白的活性或性质。
[0236]
经修饰的cas蛋白的一个实例是经修饰的spcas9-hf1蛋白,其是具有设计成减少非特异性dna接触的改变(n497a/r661a/q695a/q926a)的酿脓链球菌cas9的高保真变体。参见例如kleinstiver等人(2016)《自然(nature)》529(7587):490-495,所述文献出于所有目的通过引用整体并入本文。经修饰cas蛋白的另一个实例是被设计成减少脱靶效应的经修饰的espcas9变体(k848a/k1003a/r1060a)。参见例如,slaymaker等人(2016)《科学(science)》351(6268):84-88,所述文献出于所有目的通过引用整体并入本文。其它spcas9变体包含k855a和k810a/k1003a/r1060a。这些和其它经修饰的cas蛋白例如在cebrian-serrano和davies(2017)《哺乳动物基因组》28(7):247-261中综述,所述文献出于所有目的通过引用整体并入本文。另一种经修饰cas9蛋白的实例是xcas9,其是可以识别扩大范围的pam序列的spcas9变体。参见例如hu等人(2018),《自然》556:57-63,所述文献出于所有目的通过引用整体并入本文。
[0237]
cas蛋白可以包括至少一个核酸酶结构域,如dnase结构域。例如,野生型cpf1蛋白通常包括切割靶dna的两条链的ruvc样结构域,其可能呈二聚体构型。cas蛋白还可以包括至少两个核酸酶结构域,如dnase结构域。例如,野生型cas9蛋白通常包括ruvc样核酸酶结构域和hnh样核酸酶结构域。ruvc结构域和hnh结构域可以各自切割双链dna的不同的链以在dna中产生双链断裂。参见例如,jinek等人(2012),《科学》337:816-821,所述文献出于所有目的通过引用整体并入本文。
[0238]
核酸酶结构域中的一个或多个或所有核酸酶结构域可以缺失或突变,使得其不再具有功能或具有降低的核酸酶活性。例如,如果cas9蛋白中的核酸酶结构域之一进行缺失或突变,则所得cas9蛋白可以被称为切口酶,并且可以在双链靶dna内产生单链断裂,但不会产生双链断裂(即,其可以切割互补链或非互补链,但不能同时切割两者)。如果核酸酶结构域中的两者进行缺失或突变,则所得cas蛋白(例如,cas9)切割双链dna的两条链的能力将降低(例如,核酸酶无效或核酸酶失活cas蛋白,或催化死亡的cas蛋白(dcas))。如果cas9蛋白中没有任何核酸酶结构域被缺失或突变,则cas9蛋白将保留双链断裂诱导活性。将cas9转化为切口酶的突变的实例是来自酿脓链球菌的cas9的ruvc结构域中的d10a(在cas9的位置10处天冬氨酸转化为丙氨酸)突变。同样地,来自酿脓链球菌的cas9的hnh结构域中的h939a(在氨基酸位置839处组氨酸转化为丙氨酸)、h840a(在氨基酸位置840处组氨酸转化为丙氨酸)或n863a(在氨基酸位置n863处天冬酰胺转化为丙氨酸)可以将cas9转化为切口酶。将cas9转化为切口酶的突变的其它实例包含嗜热链球菌对cas9的对应突变。参见例如sapranauskas等人(2011)《核酸研究》39(21):9275-9282和wo 2013/141680,所述文献中的每个文献出于所有目的通过引用整体并入本文。可以使用如定点诱变、pcr介导的诱变或总基因合成等方法产生此类突变。产生切口酶的其它突变实例可以在例如wo2013/176772
和wo 2013/142578中找到,所述文献中的每个文献出于所有目的通过引用整体并入本文。如果cas蛋白中的全部核酸酶结构域都进行缺失或突变(例如,cas9蛋白中的两个核酸酶结构域都进行缺失或突变),则所得cas蛋白(例如,cas9)切割双链dna的两条链的能力将降低(例如,核酸酶无效或核酸酶失活cas蛋白)。一个具体实例是d10a/h840a酿脓链球菌cas9双突变体或当与酿脓链球菌cas9最佳比对时来自另一物种的cas9中的对应双突变体。另一个具体实例是d10a/n863a酿脓链球菌cas9双突变体或当与酿脓链球菌cas9最佳比对时来自另一物种的cas9中的对应双突变体。
[0239]
xcas9的催化结构域中的失活突变的实例与上述针对spcas9的突变相同。金黄色葡萄球菌cas9蛋白的催化结构域中的失活突变的实例也是已知的。例如,金黄色葡萄球菌cas9酶(sacas9)可以包括位置n580处的取代(例如,n580a取代)和位置d10处的取代(例如,d10a取代),用于产生核酸酶失活的cas蛋白。参见例如,wo 2016/106236,所述文献出于所有目的通过引用整体并入本文。nme2cas9的催化结构域中的失活突变的实例也是已知的(例如,d16a和h588a的组合)。st1cas9的催化结构域中的失活突变的实例也是已知的(例如,d9a、d598a、h599a和n622a的组合)。st3cas9的催化结构域中的失活突变的实例也是已知的(例如,d10a和n870a的组合)。cjcas9的催化结构域中的失活突变的实例也是已知的(例如,d8a和h559a的组合)。fncas9和rha fncas9的催化结构域中的失活突变的实例也是已知的(例如,n995a)。
[0240]
cpf1蛋白的催化结构域中的失活突变的实例也是已知的。关于来自新凶手弗朗西斯菌u112(fncpf1)的cpf1蛋白、氨基酸球菌bv3l6(ascpf1)、毛螺菌科细菌nd2006(lbcpf1)和牛眼莫拉氏菌237(mbcpf1 cpf1),此类突变可以包含在ascpf1的位置908、993或1263或cpf1直系同源物中的对应的位置,或lbcpf1的位置832、925、947或1180或cpf1直系同源物中的对应位置处的突变。此类突变可以包含例如ascpf1的突变d908a、e993a和d1263a或cpf1直系同源物中的对应突变或lbcpf1的d832a、e925a、d947a和d1180a或cpf1直系同源物中的对应突变中的一种或多种突变。参见例如,us 2016/0208243,所述文献出于所有目的通过引用整体并入本文。
[0241]
cas蛋白也可以作为融合蛋白与异源多肽可操作地连接。例如,cas蛋白可以与切割结构域或表观遗传修饰结构域融合。参见wo 2014/089290,所述文献出于所有目的通过引用整体并入本文。cas蛋白也可以与异源多肽融合,提供增加或减少的稳定性。融合结构域或异源多肽可以定位于n端、c端或cas蛋白内部。
[0242]
作为一个实例,cas蛋白可以与提供亚细胞定位的一种或多种异源多肽融合。此类异源多肽可以包含例如一种或多种核定位信号(nls),如用于靶向细胞核的单组分sv40 nls和/或双组分α-输入蛋白nls、用于靶向线粒体的线粒体定位信号、er保留信号等。参见例如lange等人(2007)《生物化学杂志(j.biol.chem.)》282(8):5101-5105,所述文献出于所有目的通过引用整体并入本文。此类亚细胞定位信号可以定位于n端、c端或cas蛋白内的任何位置。nls可以包括碱性氨基酸段并且可以是单分序列或二分序列。任选地,cas蛋白可以包括两个或更多个nls,包含n端处的nls(例如,α-输入蛋白nls或单分nls)和c端处的nls(例如,sv40 nls或双分nls)。cas蛋白还可以包括n端处的两个或更多个nls和/或c端处的两个或更多个nls。
[0243]
例如,cas蛋白可以与1-10个nls融合(例如,与1-5个nls融合或与一个nls融合)。
在使用一个nls的情况下,nls可以连接在cas蛋白序列的n端或c端。它也可以插入到cas蛋白序列中。可替代地,cas蛋白可以与超过一个nls融合。例如,cas蛋白可以与2、3、4或5个nls融合。在具体实例中,cas蛋白可以与两个nls融合。在某些情况下,所述两个nls可以是相同的(例如,两个sv40 nls)或不同的。例如,cas蛋白可以与两个连接在羧基末端处的sv40 nls序列融合。可替代地,cas蛋白可以与两个nls融合,一个连接在n端出,并且一个连接在c端出。在其它实例中,cas蛋白可以与3个nls融合或不与nls融合。nls可以是单分序列,例如sv40 nls、pkkkrkv(seq id no:49)或pkkkrrv(seq id no:50)。nls可以是二分序列,如核质蛋白的nls,krpaatkkagqakkkk(seq id no:51)。在具体实例中,单个pkkkrkv(seq id no:49)nls可以在cas蛋白的c端处连接。在融合位点处任选地包含一个或多个连接子。
[0244]
cas蛋白也可以与细胞穿透性结构域或蛋白质转导结构域可操作地连接。例如,细胞穿透性结构域可以源自hiv-1tat蛋白、来自人乙型肝炎病毒的tlm细胞穿透基序、mpg、pep-1、vp22、来自单纯疱疹病毒的细胞穿透性肽或聚精氨酸肽序列。参见例如wo2014/089290和wo 2013/176772,所述文献中的每个文献出于所有目的通过引用整体并入本文。细胞穿透性结构域可以定位于n端、c端或cas蛋白内的任何位置。
[0245]
cas蛋白也可以与异源多肽可操作地连接以便于进行追踪或纯化,如荧光蛋白、纯化标签或表位标签。荧光蛋白的实例包含绿色荧光蛋白(例如,gfp、gfp-2、taggfp、turbogfp、egfp、祖母绿、azami绿、单体azami绿、copgfp、acegfp、zsgreenl)、黄色荧光蛋白(例如,yfp、eyfp、柠檬黄、venus、ypet、phiyfp、zsyellowl)、蓝色荧光蛋白(例如,ebfp、ebfp2、石青、mkalamal、gfpuv、天蓝色、t-天蓝色(t-sapphire))、青色荧光蛋白(例如,ecfp、蔚蓝色(cerulean)、cypet、amcyanl、midoriishi-青色)、红色荧光蛋白(例如,mkate、mkate2、mplum、dsred单体、mcherry、mrfp1、dsred-表达、dsred2、dsred-单体、hcred-tandem、hcredl、asred2、eqfp611、mraspberry、mstrawberry、jred)、橙色荧光蛋白(例如,morange、mko、kusabira-橙色、单体kusabira-橙色、mtangerine、tdtomato)和任何其它合适的荧光蛋白。标签的实例包含谷胱甘肽-s-转移酶(gst)、几丁质结合蛋白(cbp)、麦芽糖结合蛋白、硫氧还蛋白(trx)、多(nanp)、串联亲和纯化(tap)标签、myc、acv5、au1、au5、e、ecs、e2、flag、血球凝集素(ha)、nus、softag 1、softag3、strep、sbp、glu-glu、hsv、kt3、s、s1、t7、v5、vsv-g、组氨酸(his)、生物素羧基载体蛋白(bccp)和钙调蛋白。
[0246]
cas蛋白还可以与标记的核酸或供体序列栓系。这种栓系(即,物理连接)可以通过共价相互作用或非共价相互作用来实现,并且栓系可以是直接的(例如,通过直接融合或化学缀合,这可以通过蛋白质上的半胱氨酸或赖氨酸残基的修饰或内含子修饰来实现),或者可以通过如链霉亲和素或适配子等一个或多个中间连接子或衔接子分子来实现。参见例如,pierce等人(2005),《药物化学短评(mini rev.med.chem.)》5(1):41-55;duckworth等人(2007),《德国应用化学会刊(angew.chem.int.ed.engl.)》46(46):8819-8822;schaeffer和dixon(2009),《澳大利亚化学杂志(australian j.chem.)》62(10):1328-1332;goodman等人(2009),《生物化学(chembiochem.)》10(9):1551-1557;以及khatwani等人(2012)《生物有机化学与医药化学(bioorg.med.chem.)》20(14):4532-4539,所述文献中的每个文献出于所有目的通过引用整体并入本文。用于合成蛋白质-核酸缀合物的非共价策略包含生物素-链霉亲和素和镍-组氨酸方法。可以通过使用多种化学反应连接适当功能
化的核酸和蛋白质来合成共价蛋白质-核酸缀合物。这些化学反应中的一些化学反应涉及将寡核苷酸直接附着到蛋白质表面上的氨基酸残基(例如,赖氨酸胺或半胱氨酸硫醇),而其它更复杂的方案需要蛋白质的翻译后修饰或者催化或反应蛋白结构域的参与。用于蛋白质与核酸共价连接的方法可以包含例如寡核苷酸与蛋白质赖氨酸或半胱氨酸残基的化学交联、表达的蛋白质连接、化学酶法和光适体的使用。标记的核酸或供体序列可以栓系到cas蛋白内的c端、n端或内部区。在一个实例中,标记的核酸或供体序列栓系到cas蛋白的c端或n端。同样地,cas蛋白可以栓系到标记的核酸或供体序列内的5'端、3'端或内部区。也就是说,标记的核酸或供体序列可以以任何取向和极性拴系。例如,cas蛋白可以栓系到标记的核酸或供体序列的5'端或3'端。
[0247]
cas蛋白可以以任何形式提供。例如,cas蛋白可以以蛋白质的形式提供,如与grna复合的cas蛋白。可替代地,可以以编码cas蛋白的核酸形式提供cas蛋白,如rna(例如,信使rna(mrna))或dna。任选地,可以对编码cas蛋白的核酸进行密码子优化以在特定细胞或生物体中有效翻译成蛋白质。例如,与天然存在的多核苷酸序列相比,可以修饰编码cas蛋白的核酸以取代在细菌细胞、酵母细胞、人细胞、非人细胞、哺乳动物细胞、啮齿动物细胞、小鼠细胞、大鼠细胞或任何其它所关注宿主细胞中具有更高使用频率的密码子。当编码cas蛋白的核酸被引入到细胞中时,cas蛋白可以在细胞中瞬时地、有条件地或组成性地表达。
[0248]
可以对作为mrna提供的cas蛋白进行修饰以提高稳定性和/或免疫原性性质。可以对mrna内的一种或多种核苷进行修饰。对mrna核碱基进行化学修饰的实例包含假尿苷、1-甲基-假尿苷和5-甲基-胞苷。例如,可以使用含有n1-甲基假尿苷的加帽和聚腺苷酸化cas mrna。同样地,cas mrna可以通过使用同义密码子对尿苷进行缺失来修饰。
[0249]
编码cas蛋白的核酸可以稳定地整合在细胞的基因组中,并且与在细胞中具有活性的启动子可操作地连接。可替代地,编码cas蛋白的核酸可以与表达构建体中的启动子可操作地连接。表达构建体包含能够指导基因或其它所关注核酸序列(例如,cas基因)的表达并且可以将此类所关注核酸序列转移到靶细胞的任何核酸构建体。例如,编码cas蛋白的核酸可以在包括编码grna的dna的载体中。可替代地,其可以在与包括编码grna的dna的载体分离的载体或质粒中。可以用于表达构建体的启动子包含在例如真核细胞、人细胞、非人细胞、哺乳动物细胞、非人哺乳动物细胞、啮齿动物细胞、小鼠细胞、大鼠细胞、多能细胞、胚胎干(es)细胞、成体干细胞、发育受限的祖细胞、诱导性多能干(ips)细胞或单细胞期胚胎中的一种或多种细胞中具有活性的启动子。此类启动子可以是例如条件型启动子、诱导型启动子、组成型启动子或组织特异性启动子。任选地,启动子可以是在一个方向上驱动cas蛋白的表达并且在另一个方向上驱动向导rna的表达的双向启动子。此类双向启动子可以由以下组成:(1)含有3个外部控制元件:远侧序列元件(dse)、近侧端序列元件(pse)和tata框的完整的、常规的、单向的pol iii启动子;(2)包含在相反取向上与dse的5'端融合pse和tata盒的第二基本pol iii启动子。例如,在h1启动子中,dse邻近pse和tata框,并且可以通过产生杂合启动子使启动子双向化,其中通过源自u6启动子的附加pse和tata盒来控制反向转录。参见例如us 2016/0074535,所述文献出于所有目的通过引用整体并入本文。使用双向启动子同时表达编码cas蛋白和向导rna的基因允许生成紧凑表达盒以促进递送。
[0250]
可以使用不同的启动子来驱动cas表达或cas9表达。在一些方法中,使用小启动子使得cas或cas9编码序列可以适应于aav构建体。例如,cas或cas9和一个或多个grna(例如,
1个grna或2个grna或3个grna或4个grna)可以通过lnp介导的递送(例如,以rna的形式)或腺相关病毒(aav)介导的递送(例如,aav2介导的递送、aav5介导的递送、aav8介导的递送或aav7m8介导的递送)进行递送。例如,核酸酶药剂可以是crispr/cas9,并且靶向内源型rs1基因座(例如,rs1的内含子1)的cas9 mrna和grna可以通过lnp介导的递送进行递送,或者编码cas9的dna和编码靶向内源性rs1基因座(例如,rs1的内含子1)的grna的dna可以通过aav介导的递送进行递送。cas或cas9和grna可以在单个aav中或通过两个单独的aav递送。例如,第一aav可以携带cas或cas9表达盒,并且第二aav可以携带grna表达盒。类似地,第一aav可以携带cas或cas9表达盒,并且第二aav可以携带两个或更多个grna表达盒。可替代地,单个aav可以携带cas或cas9表达盒(例如,与启动子可操作地连接的cas或cas9编码序列)和grna表达盒(例如,与启动子可操作地连接的grna编码序列)。类似地,单个aav可以携带cas或cas9表达盒(例如,与启动子可操作地连接的cas或cas9编码序列)和两个或更多个grna表达盒(例如,与启动子可操作地连接的grna编码序列)。可以使用不同的启动子来驱动grna的表达,如u6启动子或小trna gln。同样地,可以使用不同的启动子来驱动cas9表达。例如,使用小启动子以便cas9编码序列可以适应于aav构建体。类似地,小cas9蛋白(例如,sacas9或cjcas9用于最大化aav包装能力)。
[0251]
可以对作为mrna提供的cas蛋白进行修饰以提高稳定性和/或免疫原性性质。可以对mrna内的一种或多种核苷进行修饰。对mrna核碱基的化学修饰的实例包含假尿苷、1-甲基-假尿苷和5-甲基-胞苷。编码cas蛋白的mrna也可以加帽。例如,帽可以是帽1结构,其中 1核糖核苷酸在核糖的2'o位置处甲基化。例如,加帽可以在体内产生优异的活性(例如,通过模仿天然帽),可以产生减少对宿主的先天免疫系统的刺激的天然结构(例如,可以减少先天免疫系统中的模式识别受体的激活)。编码cas蛋白的mrna也可以被聚腺苷酸化(以包括poly(a)尾部)。也可以修饰编码cas蛋白的mrna,以包含假尿苷(例如,可以用假尿苷完全取代)。作为另一个实例,可以使用含有n1-甲基假尿苷的加帽和聚腺苷酸化cas mrna。作为另一个实例,可以使用被假尿苷完全取代的cas mrna(即,所有标准尿嘧啶残基都被假尿苷替代,所述假尿苷是尿嘧啶通过碳-碳键而不是氮-碳键连接的尿苷异构体)。同样地,cas mrna可以通过使用同义密码子对尿苷进行缺失来修饰。例如,可以使用被假尿苷完全取代的加帽和聚腺苷酸化cas mrna。
[0252]
cas mrna可以在至少一个、多个或所有尿苷位置包括经修饰的尿苷。经修饰的尿苷可以是在5位置处被修饰的尿苷(例如,用卤素、甲基或乙基修饰的尿苷)。经修饰的尿苷可以是在1位置处被修饰的假尿苷(例如,用卤素、甲基或乙基修饰的假尿苷)。经修饰的尿苷可以是例如假尿苷、n1-甲基假尿苷、5-甲氧基尿苷、5-碘尿苷或其组合。在一些实例中,经修饰的尿苷是5-甲氧基尿苷。在一些实例中,经修饰的尿苷是5-碘尿苷。在一些实例中,经修饰的尿苷是假尿苷。在一些实例中,经修饰的尿苷是n1-甲基假尿苷。在一些实例中,经修饰的尿苷是假尿苷和n1-甲基假尿苷的组合。在一些实例中,经修饰的尿苷是假尿苷和5-甲氧基尿苷的组合。在一些实例中,经修饰的尿苷是n1-甲基假尿苷和5-甲氧基尿苷的组合。在一些实例中,经修饰的尿苷是5-碘尿苷和n1-甲基假尿苷的组合。在一些实例中,经修饰的尿苷是假尿苷和5-碘尿苷的组合。在一些实例中,经修饰的尿苷是5-碘尿苷和5-甲氧基尿苷的组合。
[0253]
本文所公开的cas mrna还可以包括5'帽,如cap0、cap1或cap2。5'帽通常是通过
5'-三磷酸与mrna的5'到3'链的第一核苷酸(也就是说,第一帽近端核苷酸)的5'位置连接的7-甲基鸟嘌呤核糖核苷酸(其可以被进一步修饰,例如,关于arca)。在帽0中,mrna的第一帽近端核苷酸和第二帽近端核苷酸的核糖两者均包括2'-羟基。在帽1中,mrna的第一转录核苷酸和第二转录核苷酸的核糖分别包括2'-甲氧基和2'-羟基。在帽2中,mrna的第一帽近端核苷酸和第二帽近端核苷酸的核糖两者均包括2'-甲氧基。参见例如,katibah等人(2014)《美国国家科学院院刊》111(33):12025-30和abbas等人(2017)《美国国家科学院院刊》114(11):e2106-e2115,所述文献中的每个文献出于所有目的通过引用整体并入本文。大多数内源性高等真核mrna(包含哺乳动物mrna,如人mrna)包括帽1或帽2。帽0和其它不同于帽1和帽2的帽结构在如人等哺乳动物中可能是免疫原性的,因为先天免疫系统的组分(如ifit-1和ifit-5)将其识别为非自身,这可能导致包含i型干扰素的细胞因子水平升高。先天免疫系统的组分,如ifit-1和ifit-5还可以与eif4e竞争以与除了帽1或帽2之外的帽结合mrna,从而潜在地抑制mrna的翻译。
[0254]
可以共转录地包含帽。例如,arca(抗反向帽类似物;赛默飞世尔科技公司(thermo fisher scientific)目录号am8045)是包括与可以在开始时在体外掺入转录物中的鸟嘌呤核糖核苷酸的5'位置连接的7-甲基鸟嘌呤3'-甲氧基-5'-三磷酸的帽类似物。arca产生帽0帽,其中第一个帽近端核苷酸的2'位置是羟基。参见例如,stepinski等人(2001)rna 7:1486-1495,所述文献出于所有目的通过引用整体并入本文。
[0255]
cleancap
tm ag(m7g(5')ppp(5')(2'omea)pg;trilink生物技术有限公司目录号:n-7113或cleancap
tm gg(m7g(5')ppp(5')(2'omeg)pg;trilink生物技术有限公司目录号:n-7133)可以用于共转录地提供帽1结构。cleancap
tm ag和cleancap
tm gg的3'-o-甲基化型式还可以分别从trilink生物技术有限公司,目录号n-7413和n-7433获得。
[0256]
可替代地,可以在转录后向rna添加帽。例如,牛痘封端酶可商购(新英格兰生物实验室(new england biolabs),目录号:m2080s)并且具有由其d1亚基提供的rna三磷酸酶和尿苷转移酶活性及其d12亚基提供的鸟嘌呤甲基转移酶。如此,所述牛痘封端酶可以在存在s-腺苷甲硫氨酸和gtp的情况下向rna添加7-甲基鸟嘌呤,以提供帽0。参见例如,guo和moss,(1990)《美国国家科学院院刊》87:4023-4027以及mao和shuman,(1994)《生物化学杂志》269:24472-24479,所述文献中的每个文献出于所有目的通过引用整体并入本文。
[0257]
cas mrna可以进一步包括腺苷酸化(poly-a或poly(a)或poly-腺嘌呤)尾部。例如,poly-a尾部可以包括至少20个、至少30个、至少40个、至少50个、至少60个、至少70个、至少80个、至少90个或至少100个腺嘌呤,以及任选地至多300个腺嘌呤。例如,poly-a尾部可以包括95、96、97、98、99或100个腺嘌呤核苷酸。
[0258]
2.向导rna
[0259]“向导rna”或“grna”是与cas蛋白(例如,cas9蛋白)结合并将cas蛋白靶向靶dna内的特定位置的rna分子。向导rna可以包括两个区段:“dna靶向区段”(也被称为“向导序列”)和“蛋白质结合区段”。“区段”包含分子的一部分或区,如rna中的连续核苷酸段。一些grna,如cas9的那些,可以包括两个单独的rna分子:“激活因子rna”(例如,tracrrna)和“靶向因子rna”(例如,crispr rna或crrna)。其它grna是单个rna分子(单个rna多核苷酸),所述单个rna分子也可以被称为“单分子grna”、“单向导rna”或“sgrna”。参见例如wo 2013/176772、wo 2014/065596、wo 2014/089290、wo 2014/093622、wo 2014/099750、wo 2013/
142578和wo 2014/131833,所述文献中的每个文献出于所述目的通过引用整体并入本文。向导rna可以指crispr rna(crrna)或crrna和反式激活crispr rna(tracrrna)的组合。crrna和tracrrna可以作为单个rna分子(单向导rna或sgrna)或在两个单独的rna分子(双向导rna或dgrna)中缔合。例如,对于cas9,单向导rna可以包括(例如,通过连接子)与tracrrna融合的crrna。例如,对于cpf1,仅需要一个crrna来实现与靶序列的结合和/或切割。术语“向导rna”和“grna”包含双分子(即,模块化)grna和单分子grna两者。在本文所公开的一些方法和组合物中,grna是酿脓链球菌cas9 grna或其等效物。在本文所公开的一些方法和组合物中,grna是金黄色葡萄球菌cas9 grna或其等效物。
[0260]
示例性双分子grna包括crrna样(“crispr rna”或“靶向因子rna”或“crrna”或“crrna重复序列”)分子和对应的tracrrna样(“反式激活crispr rna”或“激活因子rna”或“tracrrna”)分子。crrna包括grna的dna靶向区段(单链)和形成grna的蛋白质结合段的dsrna双链体的一半的核苷酸段(即,crrna尾部)两者。定位在dna靶向区段下游(3')的crrna尾部的实例包括以下、基本上由以下组成或由以下组成:guuuuagagcuaugcu(seq id no:29)或guuuuagagcuaugcuguuuug(seq id no:52)。本文所公开的dna靶向区段中的任何区段可以与seq id no:29或52的5'端连接以形成crrna。
[0261]
对应的tracrrna(激活因子rna)包括形成grna的蛋白质结合区段的dsrna双链体的另一半的核苷酸段。crrna的核苷酸段与tracrrna的核苷酸段互补并且与其杂交,以形成grna的蛋白质结合结构域的dsrna双链体。因此,每个crrna可以被视为具有对应的tracrrna。示例性tracrrna序列包括以下、基本上由以下组成或由以下组成:agcauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuu(seq id no:30)、aaacagcauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuu(seq id no:31)或guuggaaccauucaaaacagcauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugc(seq id no:32)。
[0262]
在需要crrna和tracrrna两者的系统中,crrna和对应的tracrrna杂交以形成grna。在需要仅crrna的系统中,crrna可以是grna。crrna另外提供与靶dna的互补链杂交的单链dna靶向区段。如果用于细胞内的修饰,则给定的crrna或tracrrna分子的确切序列可以被设计成对将使用rna分子的物种具有特异性。参见例如mali等人,(2013)《科学》339(6121):823-826;jinek等人,(2012)《科学》337(6096):816-821;hwang等人,(2013)《自然生物技术》31(3):227-229;jiang等人,(2013)《自然生物技术》31(3):233-239;以及cong等人,(2013)《科学》339(6121):819-823,所述文献中的每个文献出于所有目的通过引用整体并入本文。
[0263]
给定grna的dna靶向区段(crrna)包括与靶dna的互补链上的序列互补的核苷酸序列,如下文更详细地描述的。grna的dna靶向区段通过杂交(即,碱基配对)以序列特异性方式与靶dna相互作用。因此,dna靶向区段的核苷酸序列可以不同,并且测定grna和靶dna将与其相互作用的靶dna内的定位。可以修饰主题grna的dna靶向区段以与靶dna内的任何期望序列杂交。天然存在的crrna因crispr/cas系统和生物体而不同,但通常含有长度为21到72个核苷酸之间的侧接有长度为21到46个核苷酸之间的两个直接重复序列(dr)的靶向区段(参见例如,wo 2014/131833,所述文献出于所有目的通过引用整体并入本文)。在酿脓链球菌的情况下,dr的长度为36个核苷酸,并且靶向区段的长度为30个核苷酸。定位于3'端的
dr与对应的tracrrna互补并杂交,后者进而与cas蛋白结合。
[0264]
dna靶向区段的长度可以例如为至少约12、至少约15、至少约17、至少约18、至少约19、至少约20、至少约25、至少约30、至少约35或至少约40个核苷酸。此类dna靶向区段的长度例如可以为约12个到约100个、约12个到约80个、约12个到约50个、约12个到约40个、约12个到约30个、约12个到约25个或约12个到约20个核苷酸。例如,dna靶向区段可以为约15个到约25个核苷酸(例如,约17个到约20个核苷酸或约17个、18个、19个或20个核苷酸)。参见例如,us 2016/0024523,所述文献出于所有目的通过引用整体并入本文。对于来自酿脓链球菌的cas9,典型的dna靶向区段的长度在16个与20个核苷酸之间或者17个与20个核苷酸之间。对于来自金黄色葡萄球菌的cas9,典型的dna靶向区段的长度在21个与23个核苷酸之间。对于cpf1,典型的dna靶向区段的长度为至少16个核苷酸或长度为至少18个核苷酸。
[0265]
在一个实例中,dna靶向区段的长度可以为约20个核苷酸。然而,更短和更长的序列也可以用于靶向区段(例如,长度为15-25个核苷酸,如长度为15、16、17、18、19、20、21、22、23、24或25个核苷酸)。dna靶向区段与对应的向导rna靶序列之间的同一性程度(或dna靶向区段与向导rna靶序列的另一条链之间的互补性程度)可以是例如约75%、约80%、约85%、约90%、约95%、约96%、约97%、约98%、约99%或约100%。dna靶向区段和对应的向导rna靶序列可以包括一个或多个错配。例如,向导rna的dna靶向区段和对应的向导rna靶序列可以含有1-4、1-3、1-2、1、2、3或4个错配(例如,其中向导rna靶序列的总长度为至少17个、至少18个、至少19个或至少20个或更多个核苷酸)。例如,向导rna的dna靶向区段和对应的向导rna靶序列可以含有1-4、1-3、1-2、1、2、3或4个错配,其中向导rna靶序列的总长度为20个核苷酸。
[0266]
作为一个实例,靶向rs1基因的向导rna可以包括dna靶向区段(即,向导序列),所述dna靶向区段包括seq id no:3148-6241中的任一个中所示的序列(dna靶向区段)、基本上由其组成或由其组成。可替代地,靶向rs1基因的向导rna可以包括dna靶向区段,所述dna靶向区段包括seq id no:3148-6241中的任一个中所示的序列(dna靶向区段)的至少17、至少18、至少19或至少20个连续核苷酸、基本上由其组成或由其组成。可替代地,靶向rs1基因的向导rna可以包括与seq id no:3148-6241中的任一个中所示的序列(dna靶向区段)至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的dna靶向区段。可替代地,靶向rs1基因的向导rna可以包括与seq id no:3148-6241中的任一个中所示的序列(dna靶向区段)至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的dna靶向区段。可替代地,靶向rs1基因的向导rna可以包括与seq id no:3148-6241中的任一个中所示的序列(dna靶向区段)的至少17、至少18、至少19或至少20个连续核苷酸至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的dna靶向区段。可替代地,靶向rs1基因的向导rna可以包括与seq id no:3148-6241中的任一个中所示的序列(dna靶向区段)的至少17、至少18、至少19或至少20个连续核苷酸至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的dna靶向区段。可替代地,靶向rs1基因的向导rna可以包括dna靶向区段,所述dna靶向区段包括与seq id no:3148-6241中的任一个中所示的序列(dna靶向区段)相差不超过3、不超过2或不
超过1个核苷酸的序列、基本上由其组成或由其组成。可替代地,靶向rs1基因的向导rna可以包括dna靶向区段,所述dna靶向区段包括与seq id no:3148-6241中的任一个中所示的序列(dna靶向区段)的至少17、至少18、至少19或至少20个连续核苷酸相差不超过3、不超过2或不超过1个核苷酸的序列、基本上由其组成或由其组成。此类向导序列的实例示出于表2和表3中。
[0267]
向导rna可以靶向人rs1基因。作为一个实例,靶向rs1基因的向导rna可以包括dna靶向区段(即,向导序列),所述dna靶向区段包括seq id no:3148-4989中的任一个中所示的序列(dna靶向区段)、基本上由其组成或由其组成。可替代地,靶向rs1基因的向导rna可以包括dna靶向区段,所述dna靶向区段包括seq id no:3148-4989中的任一个中所示的序列(dna靶向区段)的至少17、至少18、至少19或至少20个连续核苷酸、基本上由其组成或由其组成。可替代地,靶向rs1基因的向导rna可以包括与seq id no:3148-4989中的任一个中所示的序列(dna靶向区段)至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的dna靶向区段。可替代地,靶向rs1基因的向导rna可以包括与seq id no:3148-4989中的任一个中所示的序列(dna靶向区段)至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的dna靶向区段。可替代地,靶向rs1基因的向导rna可以包括与seq id no:3148-4989中的任一个中所示的序列(dna靶向区段)的至少17、至少18、至少19或至少20个连续核苷酸至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的dna靶向区段。可替代地,靶向rs1基因的向导rna可以包括与seq id no:3148-4989中的任一个中所示的序列(dna靶向区段)的至少17、至少18、至少19或至少20个连续核苷酸至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的dna靶向区段。可替代地,靶向rs1基因的向导rna可以包括dna靶向区段,所述dna靶向区段包括与seq id no:3148-4989中的任一个中所示的序列(dna靶向区段)相差不超过3、不超过2或不超过1个核苷酸的序列、基本上由其组成或由其组成。可替代地,靶向rs1基因的向导rna可以包括dna靶向区段,所述dna靶向区段包括与seq id no:3148-4989中的任一个中所示的序列(dna靶向区段)的至少17、至少18、至少19或至少20个连续核苷酸相差不超过3、不超过2或不超过1个核苷酸的序列、基本上由其组成或由其组成。
[0268]
向导rna可以靶向人rs1基因并被选择以避免脱靶效应。作为一个实例,靶向rs1基因的向导rna可以包括dna靶向区段(即,向导序列),所述dna靶向区段包括seq id no:3148-3151、3154-3186、3188-3247和3249-4351中的任一个中所示的序列(dna靶向区段)、基本上由其组成或由其组成。可替代地,靶向rs1基因的向导rna可以包括dna靶向区段,所述dna靶向区段包括seq id no:3148-3151、3154-3186、3188-3247和3249-4351中的任一个中所示的序列(dna靶向区段)的至少17、至少18、至少19或至少20个连续核苷酸、基本上由其组成或由其组成。可替代地,靶向rs1基因的向导rna可以包括与seq id no:3148-3151、3154-3186、3188-3247和3249-4351中的任一个中所示的序列(dna靶向区段)至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的dna靶向区段。可替代地,靶向rs1基因的向导
rna可以包括与seq id no:3148-3151、3154-3186、3188-3247和3249-4351中的任一个中所示的序列(dna靶向区段)至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的dna靶向区段。可替代地,靶向rs1基因的向导rna可以包括与seq id no:3148-3151、3154-3186、3188-3247和3249-4351中的任一个中所示的序列(dna靶向区段)的至少17、至少18、至少19或至少20个连续核苷酸至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的dna靶向区段。可替代地,靶向rs1基因的向导rna可以包括与seq id no:3148-3151、3154-3186、3188-3247和3249-4351中的任一个中所示的序列(dna靶向区段)的至少17、至少18、至少19或至少20个连续核苷酸至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的dna靶向区段。可替代地,靶向rs1基因的向导rna可以包括dna靶向区段,所述dna靶向区段包括与seq id no:3148-3151、3154-3186、3188-3247和3249-4351中的任一个中所示的序列(dna靶向区段)相差不超过3、不超过2或不超过1个核苷酸的序列、基本上由其组成或由其组成。可替代地,靶向rs1基因的向导rna可以包括dna靶向区段,所述dna靶向区段包括与seq id no:3148-3151、3154-3186、3188-3247和3249-4351中的任一个中所示的序列(dna靶向区段)的至少17、至少18、至少19或至少20个连续核苷酸相差不超过3、不超过2或不超过1个核苷酸的序列、基本上由其组成或由其组成。
[0269]
向导rna可以靶向人rs1基因。作为一个实例,靶向rs1基因的向导rna可以包括dna靶向区段(即,向导序列),所述dna靶向区段包括seq id no:3150、3151、3159、3675、4297和4304中的任一个中所示的序列(dna靶向区段)、基本上由其组成或由其组成。可替代地,靶向rs1基因的向导rna可以包括dna靶向区段,所述dna靶向区段包括seq id no:3150、3151、3159、3675、4297和4304中的任一个中所示的序列(dna靶向区段)的至少17、至少18、至少19或至少20个连续核苷酸、基本上由其组成或由其组成。可替代地,靶向rs1基因的向导rna可以包括与seq id no:3150、3151、3159、3675、4297和4304中的任一个中所示的序列(dna靶向区段)至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的dna靶向区段。可替代地,靶向rs1基因的向导rna可以包括与seq id no:3150、3151、3159、3675、4297和4304中的任一个中所示的序列(dna靶向区段)至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的dna靶向区段。可替代地,靶向rs1基因的向导rna可以包括与seq id no:3150、3151、3159、3675、4297和4304中的任一个中所示的序列(dna靶向区段)的至少17、至少18、至少19或至少20个连续核苷酸至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的dna靶向区段。可替代地,靶向rs1基因的向导rna可以包括与seq id no:3150、3151、3159、3675、4297和4304中的任一个中所示的序列(dna靶向区段)的至少17、至少18、至少19或至少20个连续核苷酸至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%相同的dna靶向区段。可替代地,靶向rs1基因的向导rna可以包括dna靶向区段,所述dna靶向区段包括与seq id no:3150、3151、3159、3675、4297和4304中的任一个中所示的序列(dna靶向区段)相差不超过3、不超过2或不超过1个核苷酸的序列、基本上由其组成或由其组成。可替代地,靶
8,697,359,所述文献出于所有目的通过引用整体并入本文。
[0272]
向导rna的dna靶向区段与靶dna的互补链之间的互补性百分比可以为至少60%(例如,至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少97%、至少98%、至少99%或100%)。dna靶向区段与靶dna的互补链之间的互补性百分比在约20个连续核苷酸上可以为至少60%。作为实例,dna靶向区段与靶dna的互补链之间的互补性百分比在靶dna的互补链的5'端处的14个连续核苷酸上可以为100%,并且在剩余部分上低至0%。在此类情况下,dna靶向区段可以被视为长度为14个核苷酸。作为另一个实例,dna靶向区段与靶dna的互补链之间的互补性百分比在靶dna的互补链的5'端处的七个连续核苷酸上可以为100%,并且在剩余部分上低至0%。在此类情况下,dna靶向区段可以被视为长度为7个核苷酸。在一些向导rna中,dna靶向区段内的至少17个核苷酸与靶dna的互补链互补。例如,dna靶向区段的长度可以是20个核苷酸并且可以包括与靶dna的互补链的1个、2个或3个失配。在一个实例中,失配不邻近对应于原间隔子相邻基序(pam)序列的互补链的区(即,pam序列的反向补体)(例如,失配位于向导rna的dna靶向区段的5'端,或失配距离对应于pam序列的互补链的区至少2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个或19个碱基对)。
[0273]
grna的蛋白质结合片段可以包括彼此互补的两个核苷酸段。蛋白质结合区段的互补核苷酸杂交形成双链rna双链体(dsrna)。主题grna的蛋白质结合片段与cas蛋白相互作用,并且grna通过dna靶向区段将结合的cas蛋白引导到靶dna内的特异性核苷酸序列。
[0274]
单向导rna可以包括dna靶向区段和支架序列(即,向导rna的蛋白质结合或cas结合序列)。例如,此类向导rna可以具有与3'支架序列连接的5'dna靶向区段。示例性支架序列包括以下、基本上由以下组成或由以下组成:guuuuagagcuagaaauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcu(版本1;seq id no:33);guuggaaccauucaaaacagcauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugc(版本2;seq id no:34);guuuuagagcuagaaauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugc(版本3;seq id no:35);guuuaagagcuaugcuggaaacagcauagcaaguuuaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugc(版本4;seq id no:36);guuuuagagcuagaaauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuuuuu(版本5;seq id no:37);guuuuagagcuagaaauagcaaguuaaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuu(版本6;seq id no:38);guuuaagagcuaugcuggaaacagcauagcaaguuuaaauaaggcuaguccguuaucaacuugaaaaaguggcaccgagucggugcuuuuuu(版本7;seq id no:39);或guuuuagagcuagaaauagcaaguuaaaauaaggcuaguccguuaucaacuuggcaccgagucggugc(版本8;seq id no:53)。在一些向导sgrna中,版本6的四个末端u残基不存在。在一些sgrna中,仅存在版本6的四个末端u残基中的1、2或3个。靶向本文所公开的向导rna靶序列中的任何序列的向导rna可以包含例如与向导rna的3'端上的示例性向导rna支架序列中的任何序列融合的向导rna的5'端上的dna靶向区段。即,本文所公开的dna靶向区段中的任何dna靶向区段可以与上述支架序列中的任何支架序列的5'端连接以形成单向导rna(嵌合向导rna)。
[0275]
向导rna可以包含提供另外的期望特征的修饰或序列(例如,经修饰或经调控的稳定性;亚细胞靶向;用荧光标记追踪;蛋白质或蛋白质复合物的结合位点;等等)。也就是说,向导rna可以包含一个或多个经修饰的核苷或核苷酸,或一个或多个非天然和/或天然存在
的用于代替或除了规范的a、g、c和u残基之外的组分或构型。此类修饰的实例包含例如5'封端(例如,7-甲基鸟苷酸封端(m7g));3'聚腺苷酸化尾部(即,3'poly(a)尾部);核糖开关序列(例如,以允许调控稳定性和/或调控蛋白质和/或蛋白质复合物的可及性);稳定性控制序列;形成dsrna双链体(即,发夹)的序列;将rna靶向亚细胞位置(例如,细胞核、线粒体、叶绿体等)的修饰或序列;提供用于追踪的修饰或序列(例如,与荧光分子直接缀合、与促进荧光检测的部分缀合、允许荧光检测的序列等);为蛋白质(例如,作用于dna的蛋白质,包含转录激活子、转录抑制子、dna甲基转移酶、dna去甲基化酶、组蛋白乙酰转移酶、组蛋白去乙酰化酶等)提供结合位点的修饰或序列;以及其组合。修饰的其它实例包含工程化茎环双链体结构、工程化凸起区、茎环双链体结构的工程化发夹3'或其任何组合。参见例如,us 2015/0376586,所述文献出于所有目的通过引用整体并入本文。凸起可以是由crrna样区和最小tracrrna样区构成的双链体内的核苷酸的未配对区。凸起在双链体的一侧可以包括未配对的5'-xxxy-3',其中x是任何嘌呤,并且y可以包括可以与相对链上的核苷酸形成摇摆对的核苷酸;并且在双链体的另一侧包括未配对核苷酸区。
[0276]
未经修饰的核酸可能易于降解。外源性核酸也可以诱导先天免疫应答。修饰可以有助于引入稳定性并降低免疫原性。向导rna可以包括经修饰的核苷和经修饰的核苷酸,包含例如以下中的一种或多种:(1)磷酸二酯骨架连接中的非连接磷酸氧中的一个或两个和/或连接磷酸氧中的一个或多个的改变或替代(示例性骨架修饰);(2)核糖糖的成分的改变或替代,如核糖糖上的2'羟基的改变或替代(示例性糖修饰);(3)用脱磷连接子替代(例如,大规模替代)磷酸部分(示例性骨架修饰);(4)天然存在的核碱基(包含用非规范的核碱基进行)的修饰或替代(示例性碱基修饰);(5)核糖磷酸骨架的替代或修饰(示例性骨架修饰);(6)寡核苷酸3'端或5'端的(例如,末端磷酸基的去除、修饰或替代或部分、帽或连接子的缀合(此类3'或5'帽修饰可以包括糖和/或骨架修饰);以及(7)糖的修饰或替代(示例性糖修饰)。其它可能的向导rna修饰包含尿嘧啶或聚尿嘧啶束的修饰或替代。参见例如wo2015/048577和us 2016/0237455,所述文献中的每个文献出于所有目的通过引用整体并入本文。可以对cas编码核酸,如cas mrna进行相似的修饰。例如,可以通过使用同义密码子耗尽尿苷来修饰cas mrna。
[0277]
化学修饰(如上文列出的那些化学修饰)可以组合以提供包括可以具有两种、三种、四种或更多种修饰的残基(核苷和核苷酸)的经修饰的grna和/或mrna。例如,经修饰的残基可以具有经修饰的糖和经修饰的核碱基。在一个实例中,修饰grna的每个碱基(例如所有碱基都具有经修饰的磷酸基,如硫代磷酸酯基)。例如,grna的所有或基本上所有的磷酸基都可以用硫代磷酸酯基替代。可替代地或另外地,经修饰的grna可以在5'端处或附近包括至少一个经修饰的残基。可替代地或另外地,经修饰的grna可以在3'端处或附近包括至少一个经修饰的残基。
[0278]
一些grna包括一个、两个、三个或更多个经修饰的残基。例如,经修饰的grna中的至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或100%的位置可以是经修饰的核苷或核苷酸。
[0279]
未经修饰的核酸可能易于降解。外源性核酸也可以诱导先天免疫应答。修饰可以有助于引入稳定性并降低免疫原性。本文所描述的一些grna可以包含一种或多种经修饰的
核苷或核苷酸以引入对细胞内或基于血清的核酸酶的稳定性。当引入到细胞群体中时,本文所描述的一些经修饰的grna可以表现出降低的先天免疫应答。
[0280]
本文所公开的grna可以包括骨架修饰,其中经修饰的残基的磷酸基可以通过用不同的取代基替代氧中的一个或多个氧来修饰。修饰可以包含用如本文所描述的经修饰的磷酸基大规模替代未经修饰的磷酸部分。磷酸骨架的骨架修饰还可以包含导致不带电荷的连接子或具有不对称电荷分布的带电荷的连接子的改变。
[0281]
经修饰的磷酸基的实例包含硫代磷酸酯、硒代磷酸酯、硼烷磷酸(borano phosphate)、硼烷磷酸酯(borano phosphate ester)、氢磷酸酯、磷酰胺酯、烷基或芳基膦酸酯和磷酸三酯。未经修饰的磷酸基中的磷原子是非手性的。然而,用上述原子或原子基团中的一个替代非桥氧中的一个可以使磷原子手性。立构磷原子可以具有“r”构型(rp)或“s”构型(sp)。骨架还可以通过用氮(桥接的磷酰胺酯)、硫(桥接的硫代磷酸酯)和碳(桥接的亚甲基膦酸酯)替代桥氧(也就是说,连接磷酸酯和核苷的氧)来修饰。替代可以发生在连接氧处或连接氧中的两个连接氧处。
[0282]
在某些骨架修饰中,磷酸基可以被不含磷的接头替代。在一些实施例中,带电荷的磷酸基可以被中性部分替代。可以替代磷酸基的部分的实例可以包含但不限于,例如甲基膦酸酯、羟氨基、硅氧烷、碳酸酯、羧甲基、氨基甲酸酯、酰胺、硫醚、环氧乙烷连接子、磺酸盐、磺酰胺、硫代甲缩醛化物、甲缩醛化物、肟、亚甲基亚氨基、亚甲基甲亚氨基、亚甲基亚肼基(methylenehydrazo)、亚甲基二甲亚肼基(methylenedimethylhydrazo)和亚甲基氧甲亚氨基。
[0283]
还可以构建模拟核酸的支架,其中磷酸连接子和核糖被耐核酸酶的核苷或核苷酸替代物替代。此类修饰可以包括骨架修饰和糖修饰。在一些实施例中,核碱基可以被替代骨架拴系。实例可以包含但不限于吗啉代、环丁基、吡咯烷和肽核酸(pna)核苷替代物。
[0284]
经修饰的核苷和经修饰的核苷酸可以包含对糖基的一种或多种修饰(糖修饰)。例如,2'羟基(oh)可以被修饰(例如,被许多不同的“氧”或“脱氧”取代基替代)。对2'羟基的修饰可以增强核酸的稳定性,因为羟基不再能去质子化以形成2'-醇盐离子。
[0285]
2'羟基修饰的实例可以包含:烷氧基或芳氧基(or,其中“r”可以是例如烷基、环烷基、芳基、芳烷基、杂芳基或糖);聚乙二醇(peg)、o(ch2ch2o)nch2ch2or,其中r可以是例如h或任选地经取代的烷基,并且n可以是0到20的整数(例如,0到4、0到8、0到10、0到16、1到4、1到8、1到10、1到16、1到20、2到4、2到8、2到10、2到16、2到20、4到8、4到10、4到16和4到20)。2'羟基修饰可以是2'-o-me。同样地,2'羟基修饰可以是2'-氟修饰,所述修饰用氟化物替代2'羟基。所述2'羟基修饰可以包含“锁”核酸(lna),其中2'羟基可以例如通过c
1-6
亚烷基或c
1-6
杂亚烷基桥连接到同一核糖的4'碳,其中示例性桥可以包含亚甲基桥、丙烯桥、醚桥或氨基桥;邻氨基(其中氨基可以是例如nh2;烷氨基、二烷基氨基、杂环基、芳基氨基、二芳基氨基、杂芳基氨基或二杂芳基氨基、乙二胺或聚氨基)和氨基烷氧基、o(ch2)
n-氨基(其中氨基可以是例如nh2;烷氨基、二烷基氨基、杂环基、芳基氨基、二芳基氨基、杂芳基氨基或二杂芳基氨基、乙二胺或聚氨基)。2'羟基修饰可以包含解锁核酸(una),其中核糖环缺少c2'-c3'键。2'羟基修饰可以包含甲氧基乙基(moe),(och2ch2och3,例如peg衍生物)。
[0286]
脱氧2'修饰可以包含氢(即,脱氧核糖,例如部分dsrna的突出部分);卤素(例如,溴、氯、氟或碘);氨基(其中氨基可以是例如nh2;烷基氨基、二烷基氨基、杂环基、芳基氨基、
二芳基氨基、杂芳基氨基、二杂芳基氨基或氨基酸);nh(ch2ch2nh)nch2ch
2-氨基(其中氨基可以是例如,如本文所描述的)、-nhc(o)r(其中r可以是例如,烷基、环烷基、芳基、芳烷基、杂芳基或糖),氰基;巯基;烷基-硫代-烷基;硫代烷氧基;以及烷基、环烷基、芳基、烯基和炔基,其可以任选地例如被如本文所描述的氨基取代。
[0287]
糖修饰可以包括还可以含有具有与核糖中对应碳的立体化学构型相反的立体化学构型的一个或多个碳的糖基。因此,经修饰的核酸可以包含含有例如阿拉伯糖作为糖的核苷酸。经修饰的核酸还可以包含无碱基糖。这些无碱基糖也可以进一步在组成糖原子中的一个或多个糖原子处修饰。经修饰的核酸还可以包含一种或多种呈l形式的糖(例如,l-核苷)。
[0288]
本文所描述的可以掺入经修饰的核酸中的经修饰的核苷和经修饰的核苷酸可以包含经修饰的碱基,也称为核碱基。核碱基的实例包含但不限于腺嘌呤(a)、鸟嘌呤(g)、胞嘧啶(c)和尿嘧啶(u)。这些核碱基可以被修饰或完全替代,以提供可以掺入经修饰的核酸中的经修饰的残基。核苷酸的核碱基可以独立地选自嘌呤、嘧啶、嘌呤类似物或嘧啶类似物。在一些实施例中,核碱基可以包含例如天然存在的和合成的碱基衍生物。
[0289]
在双向导rna中,crrna和tracrrna中的每一个都可以含有修饰。此类修饰可以在crrna和/或tracrrna的一端或两端处。在sgrna中,可以化学修饰sgrna的一端或两端处的一个或多个残基,和/或可以修饰内部核苷,和/或可以化学修饰整个sgrna。一些grna包括5'端修饰。一些grna包括3'端修饰。
[0290]
本文所公开的向导rna可以包括在wo 2018/107028 al中公开的修饰模式之一,所述文献出于所有目的通过引用整体并入本文。本文所公开的向导rna还可以包括在us2017/0114334中公开的结构/修饰模式之一,所述文献出于所有目的通过引用整体并入本文。本文所公开的向导rna还可以包括在wo 2017/136794、wo 2017/004279、us 2018/0187186或us 2019/0048338中公开的结构/修饰模式之一,所述文献中的每个文献出于所有目的通过引用整体并入本文。
[0291]
作为一个实例,向导rna的5'或3'端处的核苷酸可以包含硫代磷酸酯键(例如,碱基可以具有经修饰的磷酸酯基团,即硫代磷酸酯基团)。例如,向导rna可以包含向导rna的5'或3'端处的2、3或4个末端核苷酸之间的硫代磷酸酯键。作为另一个实例,向导rna的5'和/或3'端的核苷酸可以具有2'-o-甲基修饰。例如,向导rna可以包含向导rna的5'和/或3'端(例如,5'端)的2、3或4个端核苷酸处的2'-o-甲基修饰。参见例如wo 2017/173054a1 and finn等人,(2018)《细胞报告》22(9):2227-2235,所述文献中的每个文献出于所有目的通过引用整体并入本文。其它可能的修饰在本文其它地方进行更详细地描述。在一个具体实例中,向导rna在前三个5'和3'端rna残基处包含2'-o-甲基类似物和3'硫代磷酸酯核苷酸间键。在另一个具体实例中,向导rna被修饰使得所有不与cas9蛋白相互作用的2'oh基团被2'-o-甲基类似物置换,并且与cas9的相互作用最小的向导rna的尾部区用5'和3'硫代磷酸酯核苷酸间键修饰。另外,dna靶向区段在某些碱基上可以具有2'-氟修饰。参见例如,yin等人(2017),《自然生物技术》35(12):1179-1187,所述文献出于所有目的通过引用整体并入本文。经修饰的向导rna的其它实例在例如wo 2018/107028 a1中提供,所述文献出于所有目的通过引用整体并入本文。例如,此类化学修饰可以为向导rna提供更高的稳定性和免受核酸外切酶影响的保护性,使其在细胞内的存留时间比未经修饰的向导rna更长。例如,此
o-me、2'-f、反向无碱基核苷酸、硫代磷酸酯键或其它众所周知的增加稳定性和/或性能的核苷酸修饰。
[0298]
在另一个实例中,5'端处的前四个核苷酸和3'端处的最后四个核苷酸可以用硫代磷酸酯键连接。
[0299]
在另一个实例中,5'端处的前三个核苷酸以及3'端处的最后三个核苷酸可以包括经2'-o-甲基(2'-o-me)修饰的核苷酸。在另一个实例中,5'端处的前三个核苷酸和3'端处的最后三个核苷酸包括经2'-氟(2'-f)修饰的核苷酸。在另一个实例中,5'端处的前三个核苷酸和3'端处的最后三个核苷酸包括反向的无碱基核苷酸。
[0300]
可以以任何形式提供向导rna。例如,grna可以以rna的形式提供,作为两个分子(单独的crrna和tracrrna)或作为一个分子(sgrna),并且任选地以与cas蛋白的复合物的形式提供。grna也可以以编码grna的dna的形式提供。编码grna的dna可以编码单个rna分子(sgrna)或单独的rna分子(例如,单独的crrna和tracrrna)。在后一种情况下,编码grna的dna可以作为一个dna分子或作为分别编码crrna和tracrrna的单独dna分子提供。
[0301]
当grna以dna的形式提供时,grna可以在细胞中瞬时、有条件或组成型表达。编码grna的dna可以稳定地整合到细胞的基因组中,并且与在细胞中具有活性的启动子可操作地连接。可替代地,编码grna的dna可以与表达构建体中的启动子可操作地连接。例如,编码grna的dna可以处于包括异源核酸如编码cas蛋白的核酸的载体中。可替代地,编码grna的dna可以处于与包括编码cas蛋白的核酸的载体分开的载体或质粒中。可以用于此类表达构建体的启动子包含在例如真核细胞、人细胞、非人细胞、哺乳动物细胞、非人哺乳动物细胞、啮齿动物细胞、小鼠细胞、大鼠细胞、多能细胞、胚胎干(es)细胞、成体干细胞、发育受限的祖细胞、诱导性多能干(ips)细胞或单细胞期胚胎中的一种或多种细胞中具有活性的启动子。此类启动子可以是例如条件型启动子、诱导型启动子、组成型启动子或组织特异性启动子。此类启动子也可以是例如双向启动子。合适启动子的具体实例包含rna聚合酶iii启动子,如人u6启动子、大鼠u6聚合酶iii启动子或小鼠u6聚合酶iii启动子。在另一个实例中,小trna gln可以用于驱动向导rna的表达。
[0302]
可替代地,可以通过各种其它方法制备grna。例如,可以使用例如t7 rna聚合酶通过体外转录来制备grna(参见例如wo 2014/089290和wo 2014/065596,所述文献中的每个文献出于所有目的通过引用整体并入本文)。向导rna也可以是通过化学合成制备的合成产生的分子。例如,向导rna可以化学合成为包含前三个5'和3'端rna残基处的2'-o-甲基类似物和3'硫代磷酸酯核苷酸间键。
[0303]
向导rna(或编码向导rna的核酸)可以在包括一个或多个向导rna(例如,1个、2个、3个、4个或更多个向导rna)和增加向导rna稳定性(例如,延长在给定储存条件(例如,-20℃、4℃或环境温度)下降解产物保持在阈值以下的时间,如低于起始核酸或蛋白质重量的0.5%;或增加体内稳定性)的载体的组合物中。此类载体的非限制性实例包含聚(乳酸)(pla)微球、聚(d,l-乳酸-共乙醇酸)(plga)微球、质脂体、胶束、反胶束、脂质螺旋体和脂质微管。此类组合物可以进一步包括cas蛋白,如cas9蛋白,或编码cas蛋白的核酸。
[0304]
3.向导rna靶序列
[0305]
用于向导rna的靶dna包含存在于dna中的核酸序列,grna的dna靶向区段将与其结合,前提是存在足够的结合条件。合适的dna/rna结合条件包含细胞中通常存在的生理条
件。其它合适的dna/rna结合条件(例如,无细胞系统中的条件)是本领域已知的(参见例如,《分子克隆:实验室手册》,第3版(sambrook等人,海港实验室出版社(harbor laboratory press)2001),所述文献出于所有目的通过引用整体并入本文)。与grna互补并杂交的靶dna的链可以被称为“互补链”,并且与“互补链”互补(并且因此不与cas蛋白或grna互补)的靶dna的链可以称为“非互补链”或“模板链”。
[0306]
靶dna包含与向导rna杂交的互补链上的序列和非互补链上的对应序列(例如,与前间区序列邻近基序(pam)邻近)。除非另有说明,否则如本文所用,术语“向导rna靶序列”具体指与向导rna在互补链上杂交(即,反向补体)的序列对应的非互补链上的序列。也就是说,向导rna靶序列是指与pam邻近(例如,在cas9的情况下在pam的上游或5')的非互补链上的序列。向导rna靶序列等同于向导rna的dna靶向区段,但具有胸腺嘧啶而不是尿嘧啶。作为一个实例,spcas9酶的向导rna靶序列可以指非互补链上的5'-ngg-3'pam上游的序列。向导rna被设计成与靶dna的互补链互补,其中向导rna的dna靶向区段与靶dna的互补链之间的杂交促进了crispr复合物的形成。不一定需要完全互补,条件是存在足够的互补性来引起杂交并促进crispr复合物的形成。如果向导rna在本文中被称为靶向向导rna靶序列,则意味着向导rna与靶dna的互补链序列杂交,所述互补链序列是非互补链上的向导rna靶序列的反向补体。
[0307]
靶dna或向导rna靶序列可以包括任何多核苷酸,并且可以定位于例如细胞的细胞核或细胞质中或细胞的细胞器如线粒体或叶绿体内。靶dna或向导rna靶序列可以是细胞内源性或外源性的任何核酸序列。向导rna靶序列可以是编码基因产物(例如,蛋白质)的序列或非编码序列(例如,调节序列)或者可以包含两者。
[0308]
cas蛋白对靶dna的位点特异性结合和切割可以发生在由(i)向导rna与靶dna的互补链之间的碱基配对互补性和(ii)靶dna的非互补链中的短基序(被称为原型间隔子相邻基序(pam))两者测定的定位处。pam可以侧接向导rna靶序列。任选地,向导rna靶序列可以在3'端上侧接有pam(例如,对于cas9)。可替代地,向导rna靶序列可以在5'端上侧接有pam(例如,对于cpf1)。例如,cas蛋白的切割位点可以是pam序列上游或下游(例如,向导rna靶序列内)的约1到约10或约2到约5个碱基对(例如,3个碱基对)。在spcas9的情况下,pam序列(即,在非互补链上)可以是5'-n1gg-3',其中n1是任何dna核苷酸,并且其中pam是靶dna的非互补链上的向导rna靶序列的紧接着的3'。因此,对应于互补链上的pam的序列(即,反向补体)将是5'-ccn
2-3',其中n2是任何dna核苷酸并且紧接着向导rna的dna靶向区段在靶dna的互补链上与其杂交的序列的5'。在一些此类情况下,n1和n2可以是互补的,并且n
1-n2碱基对可以是任何碱基对(例如,n1=c并且n2=g;n1=g并且n2=c;n1=a并且n2=t;或n1=t,并且n2=a)。在来自金黄色葡萄球菌的cas9的情况下,pam可以是nngrrt或nngrr,其中n可以是a、g、c或t,并且r可以是g或a。在来自空肠弯曲菌的cas9的情况下,pam可以是例如nnnnacac或nnnnryac,其中n可以是a、g、c或t,并且r可以是g或a。在一些情况下(例如,对于fncpf1),pam序列可以位于5'端上游并且具有序列5'-ttn-3'。
[0309]
向导rna靶序列的实例是紧接在spcas9蛋白识别的ngg基序之前的20个核苷酸的dna序列。例如,向导rna靶序列加pam的两个实例是gn
19
ngg(seq id no:40)或n
20
ngg(seq id no:41)。参见例如,wo 2014/165825,所述文献出于所有目的通过引用整体并入本文。5'端处的鸟嘌呤可以促进细胞中rna聚合酶的转录。向导rna靶序列加pam的其它实例可以包
含5'端处的两个鸟嘌呤核苷酸(例如,ggn
20
ngg;seq id no:42)以促进体外t7聚合酶的高效转录。参见例如,wo 2014/065596,所述文献出于所有目的通过引用整体并入本文。其它向导rna靶序列加pam可以具有长度为介于4到22个核苷酸之间的seq id no:40-42,包含5'g或gg和3'gg或ngg。又其它向导rna靶序列加pam可以具有长度介于14与20个核苷酸之间的seq id no:40-42。
[0310]
靶向rs1基因的向导rna可以靶向rs1基因的第一内含子或与rs1基因的第一内含子邻近的序列(例如,在rs1基因的第一外显子或第二外显子中)。
[0311]
与靶dna杂交的crispr复合物的形成可以导致在对应于向导rna靶序列(即,靶dna的非互补链上的向导rna靶序列和互补链上的向导rna与其杂交的反向补体)的区内或附近的靶dna的一条或两条链的切割。例如,切割位点可以处于向导rna靶序列内(例如,处于相对于pam序列的所定义的定位处)。“切割位点”包含cas蛋白产生单链断裂或双链断裂的靶dna的位置。切割位点可以仅在双链dna的一条链上(例如,当使用切口酶时)或在两条链上。切割位点可以在两条链上的相同位置处(产生平端;例如,cas9))或可以在每条链上的不同位点处(产生交错末端(即,突出端);例如,cpf1)。例如,可以通过使用两种cas蛋白产生交错末端,其中每一种在不同链的不同切割位点处产生单链断裂,从而产生双链断裂。例如,第一切口酶可以在双链dna(dsdna)的第一条链上产生单链断裂,并且第二切口酶可以在dsdna的第二条链上产生单链断裂,使得产生突出序列。在一些情况下,第一链上的切口酶的向导rna靶序列或切割位点与第二链上的切口酶的向导rna靶序列或切割位点相隔至少2个、3个、4个、5个、6个、7个、8个、9个、10个、15个、20个、25个、30个、40个、50个、75个、100个、250个、500个或1,000个碱基对。
[0312]
靶向rs1基因如人rs1基因的向导rna可以靶向rs1基因中的任何期望的定位。靶向rs1基因的向导rna可以靶向rs1基因的第一内含子或与rs1基因的第一内含子邻近的序列(例如,在rs1基因的第一外显子或第二外显子中)。例如,向导rna靶序列可以包括rs1基因中的任何连续序列。术语rs1基因包含涵盖rs1调节启动子和增强子序列以及编码序列的基因组区。向导rna靶序列可以包括编码序列、非编码序列(例如,调节元件,如启动子或增强子区),或其组合。作为一个实例,向导rna靶序列可以包括任何rs1编码外显子中的连续编码序列。作为一个实例,向导rna靶序列可以位于rs1基因的外显子1中。作为另一个实例,向导rna靶序列可以位于rs1基因的外显子2中。作为另一个实例,向导rna靶序列可以位于rs1基因的外显子3中。作为另一个实例,向导rna靶序列可以位于rs1基因的外显子4中。作为另一个实例,向导rna靶序列可以位于rs1基因的外显子5中。作为另一个实例,向导rna靶序列可以位于rs1基因的外显子6中。向导rna靶序列也可以包括任何rs1内含子中的连续序列。作为一个实例,向导rna靶序列可以位于rs1基因的内含子1中。作为另一个实例,向导rna靶序列可以位于rs1基因的内含子2中。作为另一个实例,向导rna靶序列可以位于rs1基因的内含子3中。作为另一个实例,向导rna靶序列可以位于rs1基因的内含子4中。作为另一个实例,向导rna靶序列可以位于rs1基因的内含子5中。作为另一个实例,向导rna靶序列可以位于rs1基因的内含子6中。
[0313]
也可以选择向导rna靶序列以最小化脱靶修饰或避免脱靶效应(例如,通过避免与脱靶基因组序列发生两个或更少的错配)。
[0314]
作为一个实例,靶向rs1基因的向导rna可以靶向seq id no:54-3147中的任一个
中所示的向导rna靶序列。作为另一个实例,靶向rs1基因的向导rna可以靶向seq id no:54-3147中的任一个中所示的向导rna靶序列的至少17、至少18、至少19或至少20个连续核苷酸。此类向导rna靶序列的实例示出于表2和表3中。
[0315]
作为一个实例,靶向人rs1基因的向导rna可以靶向seq id no:54-1895中的任一个中所示的向导rna靶序列。作为另一个实例,靶向人rs1基因的向导rna可以靶向seq id no:54-1895中的任一个中所示的向导rna靶序列的至少17、至少18、至少19或至少20个连续核苷酸。
[0316]
作为一个实例,靶向人rs1基因的向导rna可以靶向seq id no:54-57、60-92、94-153和155-1257中的任一个中所示的向导rna靶序列。作为另一个实例,靶向人rs1基因的向导rna可以靶向seq id no:54-57、60-92、94-153和155-1257中的任一个中所示的向导rna靶序列的至少17、至少18、至少19或至少20个连续核苷酸。
[0317]
作为一个实例,靶向人rs1基因的向导rna可以靶向seq id no:56、57、65、581、1203和1210中的任一个中所示的向导rna靶序列。作为另一个实例,靶向人rs1基因的向导rna可以靶向seq id no:56、57、65、581、1203和1210中的任一个中所示的向导rna靶序列的至少17、至少18、至少19或至少20个连续核苷酸。
[0318]
作为一个实例,靶向小鼠rs1基因的向导rna可以靶向seq id no:1896-3147(例如,seq id no:2383或2887)中的任一个中所示的向导rna靶序列。作为另一个实例,靶向小鼠rs1基因的向导rna可以靶向seq id no:1896-3147(例如,seq id no:2383或2887)中的任一个中所示的向导rna靶序列的至少17、至少18、至少19或至少20个连续核苷酸。
[0319]
表2.人rs1内含子1向导rna靶序列和向导序列。
[0320]
[0321]
[0322]
[0323]
[0324]
[0325]
[0326]
[0327]
[0328]
[0329]
[0330]
[0331]
[0332]
[0333]
[0334]
[0335]
[0336]
[0337]
[0338]
[0339]
[0340]
[0341]
[0342]
[0343]
[0344]
[0345]
[0346]
[0347]
[0348]
[0349]
[0350]
[0351]
[0352]
[0353]
[0354]
[0355]
[0356]
[0357]
[0358]
[0359]
[0360]
[0361]
[0362][0363]
表3.小鼠rs1内含子1向导rna靶序列和向导序列。
[0364]
[0365]
[0366]
[0367]
[0368]
[0369]
[0370]
[0371]
[0372]
[0373]
[0374]
[0375]
[0376]
[0377]
[0378]
[0379]
[0380]
[0381]
[0382]
[0383]
[0384]
[0385]
[0386]
[0387]
[0388]
[0389]
[0390]
[0391]
[0392]
[0393][0394]
b.其它核酸酶药剂和核酸酶药剂的靶序列
[0395]
可以在本文所公开的方法和组合物中使用在期望靶序列处诱导切口或双链断裂的任何核酸酶药剂。可以采用天然存在的或自然的核酸酶药剂,只要所述核酸酶药剂在期望靶序列处诱导切口或双链断裂即可。可替代地,可以采用经修饰的或工程化的核酸酶药剂。“工程化核酸酶药剂”包含从其天然形式工程化(进行修饰或源自所述天然形式)以特异性地识别和诱导期望的靶序列中的切口或双链断裂的核酸酶。因此,工程化核酸酶药剂可以源自天然的、天然存在的核酸酶药剂,或者可以人工产生或合成。工程化核酸酶可以在例如靶序列中诱导切口或双链断裂,其中靶序列不是由天然(非工程化或未经修饰的)核酸酶药剂识别的序列。核酸酶药剂的修饰可以仅仅是蛋白质切割剂中的一个氨基酸或核酸切割剂中的一个核苷酸。在靶序列或其它dna处产生切口或双链断裂在本文中可以被称为“切断(cutting)”或“切割(cleaving)”靶序列或其它dna。
[0396]
还提供了示例性靶序列的活性变体和片段。此类活性变体可以包括与给定的靶序列具有至少65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多的序列同一性,其中活性变体保留生物活性并且因此能够以序列特异性方式被核酸酶药剂识别和切割。由核酸酶药剂测量靶序列双链断裂的测定是众所周知的。参见例如frendewey等人(2010),《酶学方法(methods in enzymology)》476:295-307,所述文献出于所有目的通过引用整体并入本文。
[0397]
核酸酶药剂的靶序列可以定位在靶基因座中或附近的任何位置。靶序列可以定位在基因的编码区内,或者在影响基因表达的调节区内。核酸酶药剂的靶序列可以定位在内含子、外显子、启动子、增强子、调控区或任何非蛋白质编码区中。
[0398]
一种类型的核酸酶药剂是转录激活因子样效应物核酸酶(talen)。tal效应物核酸酶是一类序列特异性核酸酶,其可以用于在原核或真核生物基因组中的具体靶序列处使双链断裂。通过将自然或工程化转录激活子样(tal)效应物或其功能部分与例如等核酸内切酶的催化结构域融合来产生tal效应物核酸酶。独特的模块化tal效应子dna结合结构域允许设计具有潜在任何给定dna识别特异性的蛋白质。因此,tal效应子核酸酶的dna结合结构域可以被工程化以识别特定的dna靶位点,并且因此用于在期望的靶序列处进行双链断裂。参见wo 2010/079430;morbitzer等人(2010)《美国国家科学院院刊》107(50):21617-21622;scholze和boch(2010)《毒力(virulence)》1:428-432;christian等人,《基因学
(genetics)》(2010)186:757-761;li等人(2010)《核酸研究》(2010)doi:10.1093/nar/gkq704;以及miller等人(2011)《自然生物技术》29:143-148,所述文献中的每个文献出于所有目的通过引用整体并入本文。
[0399]
合适的tal核酸酶的实例和用于制备合适的tal核酸酶的方法公开于例如us 2011/0239315 a1、us 2011/0269234 a1、us 2011/0145940 a1、us 2003/0232410 a1、us 2005/0208489 a1、us 2005/0026157 a1、us 2005/0064474 a1、us 2006/0188987 a1和us 2006/0063231 a1中,所述文献中的每个文献出于所有目的通过引用整体并入本文。在各个实施例中,tal效应核酸酶被工程化,其在例如所关注基因座或所关注基因组基因座中的靶核酸序列中或附近切割,其中靶核酸序列在将被靶向载体修饰的序列处或附近。适合与本文所提供的各种方法和组合物一起使用的tal核酸酶包含那些专门设计成在将由如本文所描述的靶向载体修饰的靶核酸序列处或附近结合的核酸酶。
[0400]
在一些talen中,talen的每个单体包括通过两个高变残基识别单个碱基对的33-35个tal重复序列。在一些talen中,核酸酶药剂是包括与如foki核酸内切酶等独立核酸酶可操作地连接的基于tal重复序列的dna结合结构域的嵌合蛋白。例如,核酸酶药剂可以包括第一基于tal重复序列的dna结合结构域和第二基于tal重复序列的dna结合结构域,其中第一和第二基于tal重复序列的dna结合结构域中的每一个与foki核酸酶可操作地连接,其中第一和第二基于tal重复序列的dna结合结构域识别由不同长度(12-20bp)的间隔子序列分开的靶dna序列的每条链中的两个连续靶dna序列,并且其中foki核酸酶亚基二聚化以产生使靶序列上的双链断裂的活性核酸酶。
[0401]
在本文所公开的各种方法和组合物中采用的核酸酶药剂可以进一步包括锌指核酸酶(zfn)。在一些zfn中,zfn的每个单体包括3个或更多个基于锌指的dna结合结构域,其中每个基于锌指的dna结合结构域与3bp亚位点结合。在其它zfn中,zfn是包括基于锌指的dna结合结构域的嵌合蛋白,所述结合结构域与如foki核酸内切酶等独立的核酸酶可操作地连接。例如,核酸酶药剂可以包括第一zfn和第二zfn,其中第一zfn和第二zfn中的每一个可操作地连接到foki核酸酶亚基,其中第一和第二zfn识别由约5-7bp间隔区隔开的靶dna序列的每条链中的两个连续靶dna序列,并且其中foki核酸酶亚基发生二聚化以产生使双链断裂的活性核酸酶。参见例如,us20060246567;us20080182332;us20020081614;us20030021776;wo/2002/057308a2;us20130123484;us20100291048;wo/2011/017293a2;以及gaj等人(2013)《生物技术趋势(trends biotechnol.)》31(7):397-405,所述文献中的每个文献出于所有目的通过引用整体并入本文。
[0402]
还提供了核酸酶药剂(即,工程化核酸酶药剂)的活性变体和片段。此类活性变体可以包括与天然核酸酶药剂具有至少65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多的序列同一性,其中活性变体保留在期望的靶序列处切割的能力并因此保留切口或双链断裂诱导活性。例如,本文所描述的核酸酶药剂中的任何核酸酶药剂都可以从天然核酸内切酶序列进行修饰,并被设计成在未被天然核酸酶药剂识别的靶序列处识别和诱导切口或双链断裂。因此,一些工程化核酸酶具有特异性以在不同于对应的天然核酸酶药剂靶序列的靶序列处诱导切口或双链断裂。对切口或双链断裂诱导活性的测定是已知的,并且通常测量内切核酸酶对含有靶序列的dna底物的总体活性和特异性。
[0403]
核酸酶药剂可以通过任何已知的方式引入到细胞或动物中。编码核酸酶药剂的多肽可以被直接引入到细胞或动物中。可替代地,编码核酸酶药剂的多核苷酸可以被引入到细胞或动物中。当引入编码核酸酶药剂的多核苷酸时,核酸酶药剂可以在细胞内瞬时地、有条件地或组成性地表达。编码核酸酶药剂的多核苷酸可以包含在表达盒中并且与条件型启动子、诱导型启动子、组成型启动子或组织特异性启动子可操作地连接。启动子的实例在本文其它地方进一步详细讨论。可替代地,核酸酶药剂可以作为编码核酸酶药剂的mrna被引入到细胞中。
[0404]
编码核酸酶药剂的多核苷酸可以稳定地整合在细胞的基因组中,并且与在细胞中有活性的启动子可操作地连接。可替代地,编码核酸酶药剂的多核苷酸可以在表达载体或靶向载体中。
[0405]
当通过引入编码核酸酶药剂的多核苷酸向细胞提供核酸酶药剂时,可以修饰这种编码核酸酶药剂的多核苷酸以取代与编码核酸酶药剂的天然存在的多核苷酸序列相比在所关注的细胞中具有更高使用频率的密码子。例如,与天然存在的多核苷酸序列相比,可以修饰编码核酸酶药剂的多核苷酸以取代在给定的所关注真核细胞中具有更高使用频率的密码子,包含人细胞、非人细胞、哺乳动物细胞、啮齿动物细胞、小鼠细胞、大鼠细胞或任何其它所关注的宿主细胞。
[0406]
术语“核酸酶药剂的靶序列”包含核酸酶药剂在其中诱导切口或双链断裂的dna序列。核酸酶药剂的靶序列可以是细胞内源的(或自然的),或者靶序列可以是细胞外源的。细胞外源性靶序列并非天然存在于细胞的基因组中。靶序列还可以对于期望定位在靶基因座处的所关注的多核苷酸是外源的。在一些情况下,靶序列在宿主细胞的基因组中仅存在一次。
[0407]
靶序列的长度可以变化,并且包含例如对于锌指核酸酶(zfn)对约30-36bp(即,对于每个zfn约15-18bp)、对于转录激活因子样效应物核酸酶(talen)约36bp或对于crispr/cas9向导rna约20bp的靶序列。
[0408]
vi.包括核酸构建体和/或核酸酶药剂或编码核酸酶药剂的核酸的细胞或动物或基因组
[0409]
还提供了通过本文所公开的方法产生的基因组、细胞和动物。同样地,还提供了包括如本文所描述的核酸构建体、载体、脂质纳米颗粒或组合物的基因组、细胞和动物,所述核酸构建体包括用于整合到靶基因组基因座中并从所述靶基因组基因座中表达的视网膜劈裂素编码序列(即,编码视网膜劈裂素蛋白或其片段或变体)。同样地,还提供了包括所描述的核酸酶药剂或编码核酸酶药剂的核酸(例如,靶向内源性rs1基因座),或如本文所描述的载体、脂质纳米颗粒或组合物的基因组、细胞和动物。所述基因组、细胞或动物可以包括在基因组上整合在靶基因组基因座(例如,在rs1基因座)处的核酸构建体,并且可以表达视网膜劈裂素蛋白或其片段或变体。在整合到靶基因组基因座中时,视网膜劈裂素编码序列可以与靶基因组基因座处的内源性启动子可操作地连接,或者其可以与核酸构建体中存在的外源性启动子可操作地连接。如果核酸构建体是本文所公开的双向核酸构建体,则基因组、细胞或动物可以表达第一视网膜劈裂素蛋白或其片段或变体,或可以表达第二视网膜劈裂素蛋白或其片段或变体。在一些基因组、细胞或动物中,所述靶基因组基因座是rs1基因座。例如,所述核酸构建体可以在基因组上整合在所述内源性rs1基因座的内含子1中。内
源性rs1外显子1然后可以剪接至所述核酸构建体中的所述视网膜劈裂素蛋白或其片段或变体的所述编码序列中。在具体实例中,包括在基因组上整合的核酸构建体的经修饰的rs1基因座编码包括与seq id no:2或4至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%相同的序列、基本上由其组成或由其组成的蛋白质。在具体实例中,包括在基因组上整合的核酸构建体的经修饰的rs1基因座包括rs1编码序列,所述rs1编码序列包括与seq id no:6、11或12至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%相同的序列、基本上由其组成或由其组成。
[0410]
在一些基因组、细胞或动物中,将所述核酸构建体整合到所述内源性rs1基因座中阻止整合位点下游的内源性rs1基因转录。例如,所述将所述核酸构建体整合到所述内源性rs1基因座中可以减少或消除内源性视网膜劈裂素蛋白的表达,并且用由所述核酸构建体编码的所述视网膜劈裂素蛋白或其片段或变体的表达替代所述内源性视网膜劈裂素蛋白的表达。在一个实例中,将核酸构建体整合到内源性rs1基因座中会减少内源性视网膜劈裂素蛋白的表达。在另一个实例中,将核酸构建体整合到内源性rs1基因座中会消除内源性视网膜劈裂素蛋白的表达。在具体实例中,所述内源性rs1基因座包括突变的rs1基因,所述突变的rs1基因包括引起x连锁青少年型视网膜劈裂症的突变,并且所述在基因组上整合的核酸构建体的表达降低或消除所述突变的rs1基因的表达。
[0411]
核酸构建体稳定地整合的靶基因组基因座可以是来自核酸构建体的视网膜劈裂素编码序列的杂合子或来自核酸构建体的视网膜劈裂素编码序列的纯合子。二倍体生物体在每个基因座处具有两个等位基因。每对等位基因表示特异性基因座的基因型。如果在特定基因座处有两个相同的等位基因,则基因型被描述为纯合的,如果两个等位基因不同,则基因型被描述为杂合的。包括如本文所描述的在基因组上整合的核酸构建体的动物可以在其种系的靶基因组基因座中包括核酸构建体。
[0412]
本文提供的基因组、细胞或动物可以是例如真核生物,包含例如动物、哺乳动物、非人哺乳动物和人。术语“动物”包含哺乳动物、鱼类和鸟类。哺乳动物可以是例如非人哺乳动物、人、啮齿动物、大鼠、小鼠或仓鼠。其它非人哺乳动物包含例如非人灵长类动物、猴子、猿、猫、狗、兔、马、公牛、鹿、野牛、家畜(例如,牛种,如奶牛、公牛等;绵羊种,如绵羊、山羊等;以及猪种,如猪和野猪)。鸟类包含例如鸡、火鸡、鸵鸟、鹅、鸭等。还包含家养动物和农业动物。术语“非人”不包含人。
[0413]
细胞可以是分离的细胞(例如,体外的)或可以是动物体内的。细胞也可以呈任何类型的未分化或分化状态。例如,细胞可以是全能细胞、多能细胞(例如,人多能细胞或非人多能细胞,如小鼠胚胎干(es)细胞或大鼠es细胞)或非多能细胞。全能细胞包含可以产生任何细胞类型的未分化细胞,并且多能细胞包含具有发育成超过一种分化细胞类型的能力的未分化细胞。
[0414]
本文所提供的细胞还可以是生殖细胞(例如,精子或卵母细胞)。细胞可以是有丝分裂感受态细胞或有丝分裂非活性细胞、减数分裂感受态细胞或减数分裂非活性细胞。相似地,细胞还可以是初生体细胞或不是初生体细胞的细胞。体细胞包含任何不是配子、生殖细胞、配子母细胞或未分化干细胞的细胞。例如,细胞可以是肝细胞、肾细胞、造血细胞、内
皮细胞、上皮细胞、成纤维细胞、间充质细胞、角质形成细胞、血细胞、黑素细胞、单核细胞、单个核细胞、单核细胞前体、b细胞、红细胞-巨核细胞、嗜酸性粒细胞、巨噬细胞、t细胞、胰岛β细胞、外分泌细胞、胰腺祖细胞、内分泌祖细胞、脂肪细胞、前脂肪细胞、神经元、神经胶质细胞、神经干细胞、神经元、成肝细胞、肝细胞、心肌细胞、骨骼肌细胞、平滑肌细胞、导管细胞、腺泡细胞、α细胞、β细胞、δ细胞、pp细胞、胆管细胞、白色或棕色脂肪细胞或眼细胞(例如,小梁网细胞、视网膜色素上皮细胞、视网膜微血管内皮细胞、视网膜周细胞、结膜上皮细胞、结膜成纤维细胞、虹膜色素上皮细胞、角膜细胞、晶状体上皮细胞、非色素睫状上皮细胞、眼脉络膜成纤维细胞、感光细胞、神经节细胞、双极细胞、水平细胞或无长突细胞)。例如,细胞可以是眼细胞,如视网膜细胞(例如,光感受器)。
[0415]
本文所提供的细胞可以是正常的、健康的细胞,或者可以是患病或携带突变体的细胞。例如,细胞可以包括与xlrs相关的或引起xlrs的一种或多种突变(例如,编码视网膜劈裂素蛋白中的r141c取代)。
[0416]
本文所提供的动物可以是人或非人动物。包括如本文所描述的核酸或表达盒的非人动物可以通过本文别处所述的方法制备。术语“动物”包含哺乳动物、鱼类和鸟类。哺乳动物包含例如人、非人灵长类动物、猴子、猿、猫、狗、马、公牛、鹿、野牛、绵羊、兔、啮齿动物(例如,小鼠、大鼠、仓鼠和豚鼠)和家畜(例如,牛种,如奶牛和公牛;绵羊种,如绵羊和山羊;以及猪种,如猪和野猪)。鸟类包含例如鸡、火鸡、鸵鸟、鹅和鸭。还包含家养动物和农业动物。术语“非人动物”不包含人。非人动物的特定实例包含啮齿动物,如小鼠和大鼠。
[0417]
非人动物可以来自任何遗传背景。例如,合适的小鼠可以来自129品系、c57bl/6品系、129和c57bl/6的混合、balb/c品系或swiss webster品系。129品系的实例包含129p1、129p2、129p3、129x1、129s1(例如,129s1/sv,129s1/svlm)、129s2、129s4、129s5、129s9/svevh、129s6(129/svevtac)、129s7、129s8、129t1和129t2。参见例如,festing等人(1999),《哺乳动物基因组(mammalian genome)》10:836,所述文献出于所有目的通过引用整体并入本文。c57bl品系的实例包含c57bl/a、c57bl/an、c57bl/grfa、c57bl/kal_wn、c57bl/6、c57bl/6j、c57bl/6byj、c57bl/6nj、c57bl/10、c57bl/10scsn、c57bl/10cr和c57bl/ola。合适的小鼠还可以来自上述129品系和上述c57bl/6品系的混合(例如,50%129和50%c57bl/6)。同样地,合适的小鼠可以来自上述129品系的混合或上述bl/6品系的混合(例如,129s6(129/svevtac)品系)。
[0418]
相似地,大鼠可以来自任何大鼠品系,包含例如aci大鼠品系、黑刺鼠(da)大鼠品系、威斯塔(wistar)大鼠品系、lea大鼠品系、斯泼累格多雷(sprague dawley,sd)大鼠品系或费舍尔(fischer)大鼠品系,如费舍尔f344或费舍尔f6。大鼠还可以从源自上述两种或更多种品系的混合品系中获得。例如,合适的大鼠可以来自da品系或aci品系。aci大鼠品系的特征在于具有腹部和足部呈白色的黑刺鼠以及单倍型。此类品系可从多种来源获得,包含哈兰实验室(harlan laboratories)。黑刺鼠(da)大鼠品系的特征在于具有刺鼠皮毛和单倍型。此类大鼠可从多种来源获得,包含查尔斯河和哈兰实验室(charles river and harlan laboratories)。在一些情况下,合适的大鼠可以来自近交大鼠品系。参见例如,us 2014/0235933,所述文献出于所有目的通过引用整体并入本文。
[0419]
vii.用于修饰靶基因组基因座、在细胞中表达视网膜劈裂素或治疗xlrs的方法
[0420]
本文还提供了用于修饰靶基因组基因座的方法或用于使用如本文所提供的核酸
构建体在细胞中表达视网膜劈裂素的方法,所述核酸构建体包括用于整合到靶基因组基因座中并从所述靶基因组基因座中表达的视网膜劈裂素编码序列(即,编码视网膜劈裂素蛋白或其片段或变体)。本文还提供了用于修饰靶基因组基因座的方法或用于使用本文所公开的核酸酶药剂(或编码所述核酸酶药剂的核酸)与如本文所提供的核酸构建体组合在细胞中表达视网膜劈裂素的方法,所述核酸构建体包括用于整合到靶基因组基因座中并从所述靶基因组基因座中表达的视网膜劈裂素编码序列(即,编码视网膜劈裂素蛋白或其片段或变体)。本文还提供了用于使用本文所公开的核酸酶药剂(或编码所述核酸酶药剂的核酸)修饰靶基因组基因座的方法。
[0421]
所述方法可以是例如修饰靶基因组基因座(例如,内源性rs1基因座)的方法。一些此类方法包括施用核酸酶药剂或编码核酸酶药剂的核酸,其中所述核酸酶药剂靶向靶基因组基因座中的核酸酶靶序列并且切割靶基因组基因座。
[0422]
所述方法可以是例如将视网膜劈裂素蛋白或其片段的编码序列整合到靶基因组基因座中并且在细胞中表达所述视网膜劈裂素蛋白或其片段的方法。一些此类方法包括将如本文别处所描述的核酸构建体、载体或脂质纳米颗粒施用于细胞。然后可以将编码序列整合到靶基因组基因座中,并且所述视网膜劈裂素蛋白或其片段在所述细胞中表达。在整合到靶基因组基因座中时,视网膜劈裂素编码序列可以与靶基因组基因座处的内源性启动子可操作地连接,或者其可以与核酸构建体中存在的外源性启动子可操作地连接。一些此类方法包括向细胞施用如本文别处所描述的核酸构建体、载体或脂质纳米颗粒以及核酸酶药剂或编码所述核酸酶药剂的核酸,其中所述核酸酶药剂靶向靶基因组基因座中的核酸酶靶序列。所述核酸酶药剂可以切割靶基因组基因座,并且来自核酸构建体的编码序列可以整合到靶基因组基因座中,使得视网膜劈裂素蛋白或其片段在细胞中表达。一些此类方法包括向细胞施用包括本文所公开的核酸构建体、载体或脂质纳米颗粒和核酸酶药剂或编码所述核酸酶药剂的核酸的组合物,其中所述核酸酶药剂靶向靶基因组基因座中的核酸酶靶序列。所述核酸酶药剂可以切割靶基因组基因座,并且来自核酸构建体的编码序列可以整合到靶基因组基因座中,使得视网膜劈裂素蛋白或其片段在细胞中表达。核酸酶药剂或编码核酸酶药剂的核酸可以例如在载体(例如,病毒载体如aav载体)或脂质纳米颗粒中施用。
[0423]
上述方法中的细胞可以是分离的细胞(例如,体外的)或可以是动物体内的。细胞也可以呈任何类型的未分化或分化状态。例如,细胞可以是全能细胞、多能细胞(例如,人多能细胞或非人多能细胞,如小鼠胚胎干(es)细胞或大鼠es细胞)或非多能细胞。全能细胞包含可以产生任何细胞类型的未分化细胞,并且多能细胞包含具有发育成超过一种分化细胞类型的能力的未分化细胞。
[0424]
细胞还可以是生殖细胞(例如,精子或卵母细胞)。细胞可以是有丝分裂感受态细胞或有丝分裂非活性细胞、减数分裂感受态细胞或减数分裂非活性细胞。相似地,细胞还可以是初生体细胞或不是初生体细胞的细胞。体细胞包含任何不是配子、生殖细胞、配子母细胞或未分化干细胞的细胞。例如,细胞可以是肝细胞、肾细胞、造血细胞、内皮细胞、上皮细胞、成纤维细胞、间充质细胞、角质形成细胞、血细胞、黑素细胞、单核细胞、单个核细胞、单核细胞前体、b细胞、红细胞-巨核细胞、嗜酸性粒细胞、巨噬细胞、t细胞、胰岛β细胞、外分泌细胞、胰腺祖细胞、内分泌祖细胞、脂肪细胞、前脂肪细胞、神经元、神经胶质细胞、神经干细胞、神经元、成肝细胞、肝细胞、心肌细胞、骨骼肌细胞、平滑肌细胞、导管细胞、腺泡细胞、α
细胞、β细胞、δ细胞、pp细胞、胆管细胞、白色或棕色脂肪细胞或眼细胞(例如,小梁网细胞、视网膜色素上皮细胞、视网膜微血管内皮细胞、视网膜周细胞、结膜上皮细胞、结膜成纤维细胞、虹膜色素上皮细胞、角膜细胞、晶状体上皮细胞、非色素睫状上皮细胞、眼脉络膜成纤维细胞、感光细胞、神经节细胞、双极细胞、水平细胞或无长突细胞)。例如,细胞可以是眼细胞,如视网膜细胞(例如,光感受器)。
[0425]
本文所提供的细胞可以是正常的、健康的细胞,或者可以是患病或携带突变体的细胞。例如,细胞可以包括与xlrs相关的或引起xlrs的一种或多种突变(例如,r141c)。
[0426]
细胞可以是例如真核细胞,包含例如动物、哺乳动物、非人哺乳动物和人。在具体实例中,细胞是人细胞。术语“动物”包含哺乳动物、鱼类和鸟类。哺乳动物可以是例如非人哺乳动物、人、啮齿动物、大鼠、小鼠或仓鼠。其它非人哺乳动物包含例如非人灵长类动物、猴子、猿、猫、狗、兔、马、公牛、鹿、野牛、家畜(例如,牛种,如奶牛、公牛等;绵羊种,如绵羊、山羊等;以及猪种,如猪和野猪)。鸟类包含例如鸡、火鸡、鸵鸟、鹅、鸭等。还包含家养动物和农业动物。术语“非人”不包含人。
[0427]
细胞可以在动物体内。所述动物可以是人或可以是非人动物。包括如本文所描述的核酸或表达盒的非人动物可以通过本文别处所述的方法制备。术语“动物”包含哺乳动物、鱼类和鸟类。哺乳动物包含例如人、非人灵长类动物、猴子、猿、猫、狗、马、公牛、鹿、野牛、绵羊、兔、啮齿动物(例如,小鼠、大鼠、仓鼠和豚鼠)和家畜(例如,牛种,如奶牛和公牛;绵羊种,如绵羊和山羊;以及猪种,如猪和野猪)。鸟类包含例如鸡、火鸡、鸵鸟、鹅和鸭。还包含家养动物和农业动物。术语“非人动物”不包含人。非人动物的特定实例包含啮齿动物,如小鼠和大鼠。
[0428]
非人动物可以来自任何遗传背景。例如,合适的小鼠可以来自129品系、c57bl/6品系、129和c57bl/6的混合、balb/c品系或swiss webster品系。129品系的实例包含129p1、129p2、129p3、129x1、129s1(例如,129s1/sv,129s1/svlm)、129s2、129s4、129s5、129s9/svevh、129s6(129/svevtac)、129s7、129s8、129t1和129t2。参见例如,festing等人(1999),《哺乳动物基因组(mammalian genome)》10:836,所述文献出于所有目的通过引用整体并入本文。c57bl品系的实例包含c57bl/a、c57bl/an、c57bl/grfa、c57bl/kal_wn、c57bl/6、c57bl/6j、c57bl/6byj、c57bl/6nj、c57bl/10、c57bl/10scsn、c57bl/10cr和c57bl/ola。合适的小鼠还可以来自上述129品系和上述c57bl/6品系的混合(例如,50%129和50%c57bl/6)。同样地,合适的小鼠可以来自上述129品系的混合或上述bl/6品系的混合(例如,129s6(129/svevtac)品系)。
[0429]
相似地,大鼠可以来自任何大鼠品系,包含例如aci大鼠品系、黑刺鼠(da)大鼠品系、威斯塔(wistar)大鼠品系、lea大鼠品系、斯泼累格多雷(sprague dawley,sd)大鼠品系或费舍尔(fischer)大鼠品系,如费舍尔f344或费舍尔f6。大鼠还可以从源自上述两种或更多种品系的混合品系中获得。例如,合适的大鼠可以来自da品系或aci品系。aci大鼠品系的特征在于具有腹部和足部呈白色的黑刺鼠以及单倍型。此类品系可从多种来源获得,包含哈兰实验室(harlan laboratories)。黑刺鼠(da)大鼠品系的特征在于具有刺鼠皮毛和单倍型。此类大鼠可从多种来源获得,包含查尔斯河和哈兰实验室(charles river and harlan laboratories)。在一些情况下,合适的大鼠可以来自近交大鼠品系。参见例如,us 2014/0235933,所述文献出于所有目的通过引用整体并入本文。
[0430]
还提供了治疗患有x连锁青少年型视网膜劈裂症(xlrs)的受试者的方法。此类方法可以包括将如本文别处所描述的核酸构建体、载体或脂质纳米颗粒施用于患有xlrs的受试者,其中所述核酸构建体被整合到所述受试者中的一个或多个视网膜细胞(例如,光感受器)中的靶基因组基因座中并由所述靶基因组基因座表达,并且在所述受试者中实现了治疗有效水平的视网膜劈裂素表达。所述受试者例如可以具有内源性rs1基因,所述内源性rs1基因包括与x连锁青少年型视网膜劈裂症相关或引起x连锁青少年型视网膜劈裂症的至少一种突变(例如,r141c)。在整合到靶基因组基因座中时,视网膜劈裂素编码序列可以与靶基因组基因座处的内源性启动子可操作地连接,或者其可以与核酸构建体中存在的外源性启动子可操作地连接。此类方法还可以包括向所述受试者施用如本文别处所描述的核酸构建体、载体或脂质纳米颗粒和核酸酶药剂或编码所述核酸酶药剂的核酸,其中所述核酸酶药剂靶向靶基因组基因座中的核酸酶靶序列,所述核酸构建体被整合到所述受试者中的一个或多个视网膜细胞(例如,光感受器)中的靶基因组基因座中并由所述靶基因组基因座表达,并且在所述受试者中实现了治疗有效水平的视网膜劈裂素表达。此类方法还可以包括向所述受试者施用包括本文所公开的核酸构建体、载体或脂质纳米颗粒和核酸酶药剂或编码所述核酸酶药剂的核酸的组合物,其中所述核酸酶药剂靶向靶基因组基因座中的核酸酶靶序列,所述核酸构建体被整合到所述受试者中的一个或多个视网膜细胞(例如,光感受器)中的靶基因组基因座中并由所述靶基因组基因座表达,并且在所述受试者中实现了治疗有效水平的视网膜劈裂素表达。
[0431]
xlrs是一种以黄斑病变和视网膜浅层分裂为特征的玻璃体视网膜营养不良。几乎所有病例都存在黄斑改变。在眼底,径向朝向的视网膜内黄斑囊肿呈辐轮构型,其中大多数情况下没有中央凹反射。另外,大约一半的病例在视网膜的颞下部分有双侧周围性视网膜劈裂。除了典型的眼底外观外,还可能存在斜视、眼球震颤、轴性远视、色觉缺陷和中央凹异位。最重要的并发症是玻璃体出血、视网膜脱离和新生血管性青光眼。“辐轮”型中央凹劈裂是眼底检查的特征性表现,几乎100%的病例中存在。至多50%的患者可能会发生外周劈裂。外周劈裂可能导致内叶出现孔洞和撕裂,并可能导致无支撑的交叉血管出血。另外的外周变化包含类似rp的色素沉着、视网膜纤维化和白色斑点。
[0432]
由于xlrs是一种由视网膜劈裂素功能丧失引起的隐性疾病,因此基因替代疗法被认为是此疾病的潜在治疗方法。此外,由于视网膜劈裂素用作胞外蛋白,因此有益的治疗不一定限于表达替代基因的转染细胞,而是由于分泌蛋白从表达位点扩散而可以涵盖更广泛的区。
[0433]
在一些方法中,核酸构建体的整合引起视网膜结构恢复(例如,至少部分视网膜结构恢复)。在一些方法中,核酸构建体的整合产生视网膜功能恢复(例如,至少部分视网膜功能恢复)。
[0434]
上述方法中患有xlrs的受试者可以是上文描述的任何类型的动物。在特定实例中,所述受试者是人。
[0435]
在靶向动物体内细胞的方法中,可以将核酸构建体插入动物中的特定类型的细胞中。用于将核酸酶药剂(或编码核酸酶药剂的核酸)和核酸构建体引入到动物中的方法和媒剂可以影响动物中的哪些类型的细胞被靶向。在一些方法中,例如,将核酸构建体插入到视网膜细胞如光感受器中的靶基因组基因座(例如,内源性rs1基因座)中。在本文别处更详细
地公开了用于将核酸酶药剂(或编码核酸酶药剂的核酸)和核酸构建体引入到动物中的方法和媒剂(包含靶向眼细胞或视网膜细胞(例如,光感受器)的方法和媒剂,如脂质纳米颗粒介导的递送和aav2介导的递送、aav5介导的递送、aav8介导的递送或aav7m8介导的递送和玻璃体内或视网膜下注射)。
[0436]
可以使用任何能够表达基因的靶基因组基因座,如安全港基因座(安全港基因)或内源性rs1基因座。此类基因座在本文别处更详细地描述。在具体实例中,靶基因组基因座可以是内源性rs1基因座,如包括与xlrs相关的或引起xlrs的一种或多种突变(例如,r141c)的内源性rs1基因座。例如,所述核酸构建体可以在基因组上整合在所述内源性rs1基因座的内含子1中。内源性rs1外显子1然后可以剪接至所述核酸构建体中的所述视网膜劈裂素蛋白或其片段或变体的所述编码序列中。在具体实例中,包括在基因组上整合的核酸构建体的经修饰的rs1基因座编码包括与seq id no:2或4至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%相同的序列、基本上由其组成或由其组成的蛋白质。在具体实例中,包括在基因组上整合的核酸构建体的经修饰的rs1基因座包括rs1编码序列,所述rs1编码序列包括与seq id no:6、11或12至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%相同的序列、基本上由其组成或由其组成。
[0437]
在一些情况下,将所述核酸构建体整合到所述内源性rs1基因座中可以阻止整合位点下游的内源性rs1基因转录。所述将所述核酸构建体整合到所述内源性rs1基因座中可以减少或消除内源性视网膜劈裂素蛋白的表达,并且用由所述核酸构建体编码的所述视网膜劈裂素蛋白或其片段或变体的表达替代所述内源性视网膜劈裂素蛋白的表达。在一个实例中,将核酸构建体整合到内源性rs1基因座中会减少内源性视网膜劈裂素蛋白的表达。在另一个实例中,将核酸构建体整合到内源性rs1基因座中会消除内源性视网膜劈裂素蛋白的表达。在体内靶向细胞的方法,如治疗患有xlrs的受试者的方法中,所述将所述核酸构建体整合到一个或多个细胞中的所述内源性rs1基因座中可以减少或消除那些细胞中的内源性视网膜劈裂素蛋白的表达,并且用由所述核酸构建体编码的所述视网膜劈裂素蛋白或其片段或变体的表达替代所述内源性视网膜劈裂素蛋白的表达。以此方式,核酸构建体的整合可以同时敲除内源性rs1基因(例如,包括与xlrs相关的或引起xlrs的突变的一个或多个内源性rs1基因,如r141c)和敲入替代视网膜劈裂素编码序列(例如,不包括与xlrs相关的或引起xlrs的突变的替代视网膜劈裂素编码序列)。然而,在其它方法中,可以首先使包括与xlrs相关的或引起xlrs的一种或多种突变的内源性rs1基因(例如,使用靶向并破坏内源性rs1基因的一种或多种核酸酶药剂)失活,并且随后可以将包括替代视网膜劈裂素编码序列(例如,不包括与xlrs相关的或引起xlrs的突变的替代视网膜劈裂素编码序列)的核酸构建体整合到靶基因组基因座中。在其它方法中,可以首先整合核酸构建体,并且然后可以使内源型rs1基因失活。
[0438]
将包括视网膜劈裂素编码序列的核酸构建体靶向插入靶基因组基因座,并且具体地内源rs1基因座中,提供了多种优势。这种方法导致稳定的修饰,以允许视网膜劈裂素编码序列的稳定、长期表达。对于rs1基因座,此类方法能够利用内源性rs1启动子和调节区来实现生理相关的表达(表达水平、表达时间和表达定位)。例如,核酸构建体中的视网膜劈裂
素编码序列可以包括无启动子基因,并且插入的核酸构建体可以与靶基因组基因座(例如,rs1基因座)中的内源性启动子可操作地连接。内源启动子的使用是有利的,因为其不需要在核酸构建体中包含启动子,从而允许(例如,在aav中)包装通常可能无法高效包装的较大转基因。可替代地,核酸构建体中的视网膜劈裂素编码序列可以与核酸构建体中的外源性启动子可操作地连接。可以使用的启动子类型的实例在本文别处公开。
[0439]
任选地,靶基因组基因座处的一些或所有内源性基因(例如,内源性rs1基因)可以在插入来自核酸构建体的视网膜劈裂素编码序列时表达。可替代地,在一些方法中,没有表达靶基因组基因座处的内源性基因。作为一个实例,整合核酸构建体之后的经修饰的靶基因组基因座(例如,经修饰的rs1基因座)可以编码包括内源性分泌信号或其片段的嵌合蛋白和由核酸构建体编码的视网膜劈裂素蛋白。在另一个实例中,可以靶向rs1基因座的第一内含子。rs1的分泌信号肽由rs1基因的外显子1和外显子2的一部分编码。在这种情况下,携带剪接受体和视网膜劈裂素编码序列的无启动子盒将支持视网膜劈裂素蛋白的表达和分泌。内源性rs1外显子1与整合的视网膜劈裂素编码序列之间的剪接产生了嵌合mrna和蛋白质,所述嵌合mrna和蛋白质包含由与由整合的核酸构建体编码的视网膜劈裂素蛋白序列可操作地连接的外显子1编码的内源性视网膜劈裂素序列。
[0440]
核酸构建体中的视网膜劈裂素编码序列可以通过任何方式插入到靶基因组基因座中,包含如本文别处所描述的同源重组(hr)和非同源末端接合(nhej)。
[0441]
在具体实例中,核酸构建体可以通过同源非依赖性靶向整合(例如,定向的同源非依赖性靶向整合)插入。例如,核酸构建体中的视网膜劈裂素编码序列可以在每一侧上侧接有用于核酸酶药剂的靶位点(例如,与靶基因组基因座中相同的靶位点,并且相同的核酸酶药剂用于切割靶基因组基因座中的靶位点)。核酸酶药剂然后可以切割侧接视网膜劈裂素编码序列的靶位点。在具体实例中,核酸构建体通过aav介导的递送进行递送,并且侧接视网膜劈裂素编码序列的靶位点的切割可以去除aav的反向末端重复序列(itr)。由于重复的序列,itr的存在会妨碍测序工作,因此去除itr可以更容易地评估成功的靶向。在一些方法中,如靶基因组基因座中的靶位点(例如,包含侧接原型间隔子邻近基序的grna靶序列)在视网膜劈裂素编码序列以正确的朝向插入到靶基因组基因座中时不再存在,但在视网膜劈裂素蛋白编码序列以相反的朝向插入到靶基因组基因座时被重整。这可以帮助视网膜劈裂素编码序列以正确的表达朝向插入。
[0442]
在其中核酸构建体(或载体或lnp)和核酸酶药剂或编码核酸酶药剂的核酸连同核酸构建体一起施用的方法中,所述核酸构建体和所述核酸酶药剂或所述编码所述核酸酶药剂的核酸可以同时施用。可替代地,所述核酸构建体和所述核酸酶药剂或所述编码所述核酸酶药剂的核酸可以以任何顺序依次施用。例如,核酸构建体可以在核酸酶药剂或编码核酸酶药剂的核酸之后施用,或者核酸酶药剂或编码核酸酶药剂的核酸可以在核酸构建体之后施用。例如,可以在施用核酸构建体之前或之后约1小时到约48小时、约1小时到约24小时、约1小时到约12小时、约1小时到约6小时、约1小时到约2小时、约2小时到约48小时、约2小时到约24小时、约2小时到约12小时、约2小时到约6小时、约3小时到约48小时、约6小时到约48小时、约12小时到约48小时或约24小时到约48小时施用核酸酶药剂或编码核酸酶药剂的核酸。
[0443]
核酸构建体和核酸酶药剂或编码核酸酶药剂的核酸可以在任何合适的递送媒剂
中施用。在一些方法中,核酸构建体和核酸酶药剂或编码核酸酶药剂的核酸可以在相同的递送媒剂(例如,相同的脂质纳米颗粒或载体)中施用。在其中核酸酶药剂包括cas蛋白或编码cas蛋白的核酸和向导rna或编码向导rna的dna的一些方法中,两种组分可以在相同的递送媒剂中施用,或者可替代地它们可以在单独的递送媒剂中递送。在其它方法中,核酸构建体和核酸酶药剂或编码核酸酶药剂的核酸可以在不同的递送媒剂中施用(例如,在第一载体或lnp中施用核酸酶药剂或编码核酸酶药剂的核酸,以及在第二载体(如aav载体)中施用核酸构建体)。
[0444]
核酸酶药剂(或编码核酸酶药剂的核酸)和核酸构建体可以以任何形式(例如,用于向导rna的dna或rna;用于cas蛋白的dna、rna或蛋白质)通过任何递送方法(例如,aav、lnp或hdd)和如本文别处所公开的任何施用途径(例如,玻璃体内注射或视网膜下注射)引入。作为一个实例,核酸构建体通过腺相关病毒(aav)介导的递送(例如,aav2介导的递送、aav5介导的递送、aav8介导的递送或aav7m8介导的递送)来递送。同样地,核酸酶药剂(或编码核酸酶药剂的核酸)可以通过脂质纳米颗粒(lnp)介导的递送或aav介导的递送来递送。例如,核酸酶药剂可以是crispr/cas9,并且靶向内源性rs1基因座(例如,rs1的内含子1)的cas9 mrna和grna可以通过lnp介导的递送或aav介导的递送来递送,并且核酸构建体(例如,双向构建体或同源性非依赖性靶向整合构建体)可以通过aav2介导的递送、aav5介导的递送、aav8介导的递送或aav7m8介导的递送来递送。在另一个具体实例中,编码核酸酶药剂的核酸和核酸构建体两者均通过aav介导的递送(例如,在单个aav中或通过两个单独的aav)来递送。例如,第一aav可以携带cas9表达盒,并且第二aav可以携带grna表达盒和核酸构建体。类似地,第一aav可以携带cas9表达盒,并且第二aav可以携带两个或更多个grna表达盒和核酸构建体。可替代地,第一aav可以携带cas9表达盒(例如,与启动子可操作地连接的cas9编码序列)和grna表达盒(例如,与启动子可操作地连接的grna编码序列),并且第二aav可以携带核酸构建体。类似地,第一aav可以携带cas9表达盒(例如,与启动子可操作地连接的cas9编码序列)和两个grna表达盒(例如,与启动子可操作地连接的grna编码序列),并且第二aav可以携带核酸构建体。可以使用不同的启动子来驱动grna的表达,如u6启动子或小trna gln。同样地,可以使用不同的启动子来驱动cas9表达。在一些方法中,使用小启动子使得cas9编码序列可以适应于aav构建体。在一些方法中,小cas9蛋白(例如,sacas9或cjcas9用于最大化aav包装能力)。
[0445]
本文所公开的方法包括向细胞或动物施用或引入核酸酶药剂(或编码核酸酶药剂的核酸)和核酸构建体(即,外源性供体核酸),所述核酸构建体包括用于整合到靶基因组基因座中并由所述靶基因组基因座表达的视网膜劈裂素编码序列(即,编码视网膜劈裂素蛋白或片段或其变体)。“引入”包含以核酸或蛋白质进入细胞内部或动物内的细胞内部的方式向细胞或动物呈递核酸或蛋白质。引入可以通过任何方式完成,并且可以以任何组合同时或顺序地将组分中的两种或更多种组分(例如,组分中的两种组分,或组分中的全部组分)引入到细胞或动物中。例如,可以在引入核酸构建体之前将核酸酶药剂引入到细胞或动物中。另外,可以通过相同的递送方法或不同的递送方法将组分中的两种或更多种组分引入到细胞或动物中。类似地,可以通过相同的施用途径或不同的施用途径将组分中的两种或更多种组分引入到动物中。
[0446]
可以将向导rna以rna的形式(例如,体外转录的rna)或编码向导rna的dna的形式
引入到细胞中。同样地,可以将如cas9蛋白、zfn或talen等蛋白质组分以dna、rna或蛋白质的形式引入到细胞中。例如,可以将向导rna和cas9蛋白两者以rna的形式引入。当以dna的形式引入时,编码向导rna的dna可以可操作地连接到在细胞中具有活性的启动子。例如,向导rna可以通过aav递送,并在u6启动子下在体内表达。此类dna可以在一种或多种表达构建体中。例如,此类表达构建体可以是单个核酸分子的组分。可替代地,其可以在两个或多个核酸分子之间以任何组合分离(即,编码一种或多种crispr rna的dna和编码一种或多种tracrrna的dna可以是单独的核酸分子的组分)。
[0447]
编码向导rna的核酸或核酸酶药剂可以与表达构建体中的启动子可操作地连接。表达构建体包含能够指导基因或其它所关注核酸序列的表达并且可以将此类所关注核酸序列转移到靶细胞的任何核酸构建体。可以在表达构建体中使用的合适的启动子包含例如在真核细胞、人细胞、非人细胞、哺乳动物细胞、非人哺乳动物细胞、啮齿动物细胞、小鼠细胞、大鼠细胞、仓鼠细胞、兔细胞、多能细胞、胚胎干(es)细胞、成体干细胞、发育受限的祖细胞、诱导多能干(ips)细胞或单细胞阶段胚胎中的一个或多个中具有活性的启动子。此类启动子可以是例如条件型启动子、诱导型启动子、组成型启动子或组织特异性启动子。任选地,启动子可以是在一个方向上驱动两个向导rna的表达并且在另一个方向上驱动另一组分的表达的双向启动子。此类双向启动子可以由以下组成:(1)含有3个外部控制元件:远侧序列元件(dse)、近侧端序列元件(pse)和tata框的完整的、常规的、单向的pol iii启动子;(2)包含在相反取向上与dse的5'端融合pse和tata盒的第二基本pol iii启动子。例如,在h1启动子中,dse邻近pse和tata框,并且可以通过产生杂合启动子使启动子双向化,其中通过源自u6启动子的附加pse和tata盒来控制反向转录。参见例如us 2016/0074535,所述文献出于所有目的通过引用整体并入本文。使用双向启动子同时表达编码向导rna和另一个组分的基因允许生成紧凑表达盒以促进递送。
[0448]
向导rna或编码向导rna(或其它组分)的核酸可以在包括增加向导rna稳定性(例如,延长在给定储存条件(例如,-20℃、4℃或环境温度)下降解产物保持在阈值以下的时间,如低于起始核酸或蛋白质重量的0.5%;或增加体内稳定性)的载体的组合物中提供。此类载体的非限制性实例包含聚乳酸(pla)微球体、聚(d,l-乳酸-乙醇酸共聚物)(plga)微球体、脂质体、胶束、反胶束、脂质螺旋体和脂质微管。
[0449]
本文提供的方法不依赖于用于将核酸或蛋白质引入到细胞中的特定方法,仅依赖于核酸或蛋白质进入至少一个细胞的内部。用于将核酸和蛋白质引入到各种细胞类型中的方法是本领域已知的,包含例如稳定转染方法、瞬时转染方法和病毒介导的方法。
[0450]
转染方案以及用于将核酸或蛋白质引入到细胞中的方案可以不同。非限制性转染方法包含使用以下各项的基于化学的转染方法:脂质体;纳米颗粒;磷酸钙(graham等人(1973),《病毒学(virology)》52(2):456
–
67;bacchetti等人(1977),《美国国家科学院院刊》74(4):1590-4;以及kriegler,m(1991),《转移和表达:实验室手册(transfer and expression:a laboratory manual.)》纽约:w.h.弗里曼出版社(w.h.freeman and company),第96-97页);树枝状聚合物;或阳离子聚合物,如deae葡聚糖或聚乙烯亚胺。非化学方法包含电穿孔、声穿孔和光转染。基于颗粒的转染包含使用基因枪或磁体辅助的转染(bertram(2006)《当今药物生物技术(current pharmaceutical biotechnology)》7,277-28)。病毒方法也可以用于转染。
[0451]
也可以通过电穿孔、胞质内注射、病毒感染、腺病毒、慢病毒、逆转录病毒、转染、脂质介导的转染或通过核转染来介导将核酸或蛋白质引入到细胞中。将核酸或蛋白质引入到细胞中也可以由腺相关病毒介导。核转染是使核酸底物不仅能够被递送到细胞质,而且能够通过核膜进入到细胞核中的改善的电穿孔技术。另外,在本文公开的方法中使用核转染通常需要比常规电穿孔少得多的细胞(例如,与常规电穿孔的700万相比,仅约200万)。在一个实例中,使用nucleofector
tm
系统进行核转染。
[0452]
也可以通过显微注射完成将核酸或蛋白质引入到细胞(例如,单细胞期胚胎)中。在单细胞期胚胎中,显微注射可以注入到母本和/或父本原核或细胞质中。如果显微注射仅注入到一个原核,则优选父本原核,因为其尺寸较大。优选地将mrna显微注射到细胞质中(例如,将mrna直接递送到翻译机器),而优选将cas蛋白或编码cas蛋白或rna的核酸显微注射到细胞核/原核中。可替代地,可以通过注射到细胞核/前核和细胞质两者中来进行显微注射:可以首先将针引入到细胞核/前核中并且注射第一量,并且在将针从单细胞期胚胎中去除时,可以将第二量注射到细胞质中。如果cas蛋白被注射到细胞质中,则cas蛋白优选地包括用于确保递送到细胞核/原核的核定位信号。用于进行显微注射的方法是众所周知的。参见例如,nagy等人(nagy a、gertsenstein m、vintersten k、behringer r.,2003,《操纵小鼠胚胎(manipulating the mouse embryo.)》纽约冷泉港:冷泉港实验室出版社);meyer等人(2010),《美国国家科学院院刊》107:15022-15026和meyer等人(2012),《美国国家科学院院刊》109:9354-9359。也可以通过电穿孔完成向单细胞期胚胎的引入。
[0453]
本文提供了允许将核酸或蛋白质引入到细胞或动物中的多种方法和组合物。用于将核酸或蛋白质引入到细胞或动物中的此类方法可以包含例如载体递送、颗粒介导的递送、外泌体介导的递送、脂质纳米颗粒(lnp)介导的递送、细胞穿透肽介导的递送或可植入装置介导的递送。作为具体实例,可以将核酸或蛋白质以如聚乳酸(pla)微球体、聚(d,l-乳酸-乙醇酸共聚物)(plga)微球体、脂质体、胶束、反胶束、脂质螺旋体或脂质微管等载体引入到细胞或动物中。向动物递送的一些具体实例包含流体动力学递送、病毒介导的递送(例如,腺相关病毒(aav)介导的递送,或通过腺病毒、慢病毒或逆转录病毒递送)和脂质纳米颗粒介导的递送。在一个具体实例中,核酸酶药剂和核酸构建体两者均可以通过lnp介导的递送来递送。在另一个具体实例中,核酸酶药剂和核酸构建体两者均可以通过aav介导的递送来递送。例如,核酸酶药剂和核酸构建体可以通过多种不同的aav载体(例如,两种不同的aav载体)递送。在核酸酶药剂是crispr/cas(例如,crispr/cas9)的具体实例中,第一aav载体可以递送cas(例如,cas9),并且第二aav载体可以递送grna和核酸构建体。例如,可以使用小启动子以便cas9编码序列可以适应于aav构建体。
[0454]
在另一个具体实例中,核酸酶药剂可以通过lnp介导的递送来递送,并且核酸构建体可以通过aav介导的递送来递送。在另一个具体实例中,核酸酶药剂可以通过aav介导的递送来递送,并且核酸构建体可以通过lnp介导的递送来递送。
[0455]
核酸的引入也可以通过病毒介导的递送来完成,如aav介导的递送或慢病毒介导的递送(例如,aav载体或慢病毒载体)。其它示例性病毒/病毒性载体包含逆转录病毒、腺病毒、牛痘病毒、痘病毒和单纯疱疹病毒。病毒可以感染分裂细胞、非分裂细胞或分裂细胞和非分裂细胞两者。病毒可以整合到宿主基因组中,或者可替代地不整合到宿主基因组中。此类病毒还可以被工程化为具有降低的免疫力。病毒可能具有复制能力,也可能具有复制缺
陷(例如,在另外轮次的病毒粒子复制和/或包装所必需的一个或多个基因中存在缺陷)。病毒可以引起瞬时表达、长期表达(例如,至少1周、2周、1个月、2个月或3个月)或永久表达(例如,cas9和/或grna)。示例性病毒滴度(例如,aav滴度)包含10
12
、10
13
、10
14
、10
15
和10
16
个载体基因组/ml。示例性病毒滴度(例如,aav滴度)包含约1012、约1013、约1014、约1015和约1016个载体基因组(vg)/ml,或介于约10
12
到约10
16
之间、介于约10
12
到约10
15
之间、介于约10
12
到约10
14
之间、介于约10
12
到约10
13
之间、介于约10
13
到约10
16
之间、介于约10
14
到约10
16
之间、介于约10
15
到约10
16
或介于约10
13
到约10
15
之间个vg/ml。其它示例性病毒滴度(例如,aav滴度)包含约1012、约1013、约1014、约1015和约1016个载体基因组(vg)/kg体重,或介于约10
12
到约10
16
之间、介于约10
12
到约10
15
之间、介于约10
12
到约10
14
之间、介于约10
12
到约10
13
之间、介于约10
13
到约10
16
之间、介于约10
14
到约10
16
之间、介于约10
15
到约10
16
或介于约10
13
到约10
15
之间个vg/kg体重。
[0456]
ssdna aav基因组由两个开放阅读框rep和cap组成,其侧接有允许合成互补dna链的两个反向末端重复序列。当构建aav转移质粒时,转基因放置在两个itr之间,并且rep和cap可以反式提供。除了rep和cap之外,aav还可能需要含有腺病毒基因的辅助质粒。这些基因(e4、e2a和va)介导aav复制。例如,转移质粒、rep/cap和辅助质粒可以转染到含有腺病毒基因e1 的hek293细胞中,以产生感染性aav颗粒。可替代地,将rep、cap和腺病毒辅助基因可以组合成单个质粒。相似的包装细胞和方法可以用于其它病毒,如逆转录病毒。
[0457]
已经鉴定了aav的多种血清型。这些血清型在其感染的细胞类型(即,其趋向性)方面不同,允许优先转导特定细胞类型。感光细胞的血清型包含aav2、aav5和aav8。视网膜色素上皮组织的血清型包含aav1、aav2、aav4、aav5和aav8。在具体实例中,包括核酸构建体的aav载体可以是aav2、aav5或aav8。
[0458]
趋向性可以通过假型进一步细化,所述假型即混合来自不同病毒血清型的衣壳和基因组。例如,aav2/5指示包装在来自血清型5的衣壳中的含有血清型2基因组的病毒。使用假型病毒可以提高转导效率以及改变趋向性。源自不同血清型的杂交衣壳也可以用于改变病毒趋向性。例如,aav-dj含有来自八种血清型的杂交衣壳,并在广泛的体内细胞类型中表现出高感染性。aav-dj8是显示aav-dj性质的另一个实例,但具有增强的脑摄取。aav血清型还可以通过突变进行修饰。aav2突变修饰的实例包含y444f、y500f、y730f和s662v。aav3突变修饰的实例包含y705f、y731f和t492v。aav6突变修饰的实例包含s663v和t492v。其它假型的/经修饰的aav变体包含aav2/1、aav2/6、aav2/7、aav2/8、aav2/9、aav2.5、aav8.2和aav/sastg。在具体实例中,aav是aav7m8,是一种介导高效递送到所有视网膜层和感光器的aav变体。参见例如,dalkara等人,(2013)《科学转化医学(sci.transl.med.)》5:189ra76,所述文献出于所有目的通过引用整体并入本文。
[0459]
为了加速转基因表达,可以使用自身互补型aav(scaav)变体。由于aav依赖于细胞的dna复制机制来合成aav单链dna基因组的互补链,因此转基因表达可能会延迟。为了解决这种延迟问题,可以使用含有能够在感染后自发退火的互补序列的scaav,从而消除对宿主细胞dna合成的需要。然而,也可以使用单链aav(ssaav)载体。
[0460]
为了提高包装能力,可以将较长的转基因在两个aav转移质粒之间拆分,第一个具有3'剪接供体并且第二个具有5'剪接受体。在细胞共感染后,这些病毒形成多联体,拼接在一起,并且全长转基因可以被表达。虽然这允许更长的转基因表达,但表达效率较低。用于
1,3-亚苯基)双(氧))双(辛烷-8,1-二基)双(癸酸酯),也被称为((5-((二甲氨基)甲基)-1,3-亚苯基)双(氧基))双(辛烷-8,1-二基)双(癸酸酯)。合适的脂质的另一个实例是脂质c,即2-((4-(((3-(二甲氨基)丙氧基)羰基)氧基)十六酰基)氧基)丙烷-1,3-二基(9z,9'z,12z,12'z)-双(十八-9,12-二烯酸酯)。合适的脂质的另一个实例是脂质d,即3-(((3-(二甲氨基)丙氧基)羰基)氧基)-13-(辛酰氧基)十三烷基3-辛基十一烷酸酯。其它合适的脂质包含三十七-6,9,28,31-四烯-19-基4-(二甲氨基)丁酸酯(也被称为dlin-mc3-dma(mc3))。
[0465]
适用于本文所描述的lnp的一些此类脂质在体内是生物可降解的。例如,包括此类脂质的lnp包含在8小时、10小时、12小时、24小时或48小时或3天、4天、5天、6天、7天或10天内从血浆中清除脂质的至少75%的那些。作为另一个实例,lnp的至少50%在8小时、10小时、12小时、24小时或48小时或3天、4天、5天、6天、7天或10天内从血浆中清除。
[0466]
根据其所在的介质的ph值,此类脂质可以是可电离的。例如,在微酸性介质中,脂质可以被质子化并且因此带有正电荷。相反,在弱碱性介质中,例如在ph大约为7.35的血液中,脂质可能不会被质子化并且因此不带电荷。在一些实施例中,脂质可以在至少约9、9.5或10的ph下质子化。这种脂质带电荷的能力与其固有pka有关。例如,脂质的pka可以独立地处于约5.8到约6.2的范围内。
[0467]
中性脂质的作用是稳定和改善lnp的处理。合适的中性脂质的实例包含各种中性、不带电荷或两性离子脂质。适用于本公开的中性磷脂的实例包含但不限于5-十七烷基苯-1,3-二醇(间苯二酚)、二棕榈酰磷脂酰胆碱(dppc)、二硬脂酰磷脂酰胆碱(dspc)、磷酸胆碱(dopc)、二肉豆蔻酰磷脂酰胆碱(dmpc)、磷脂酰胆碱(plpc)、1,2-二硬脂酰-sn-甘油-3-磷酸胆碱(dapc)、磷脂酰乙醇胺(pe)、卵磷脂酰胆碱(epc)、二月桂酰磷脂酰胆碱(dlpc)、二肉豆蔻酰磷脂酰胆碱(dmpc)、1-肉豆蔻酰-2-棕榈酰磷脂酰胆碱(mppc)、1-棕榈酰-2-肉豆蔻酰磷脂酰胆碱(pmpc)、1-棕榈酰-2-硬脂酰磷脂酰胆碱(pspc)、1,2-二花生酰-sn-甘油-3-磷酸胆碱(dbpc)、1-硬脂酰-2-棕榈酰磷脂酰胆碱(sppc)、1,2-二二十碳烯酰-sn-甘油-3-磷酸胆碱(depc)、棕榈酰油酰磷脂酰胆碱(popc)、溶血磷脂酰胆碱、二油酰磷脂酰乙醇胺(dope)、二亚油酰磷脂酰胆碱二硬脂酰磷脂酰乙醇胺(dspe)、二肉豆蔻酰磷脂酰乙醇胺(dmpe)、二棕榈酰磷脂酰乙醇胺(dppe)、棕榈酰油酰磷脂酰乙醇胺(pope)、溶血磷脂酰乙醇胺和其组合。例如,中性磷脂可以选自由二硬脂酰磷脂酰胆碱(dspc)和二肉豆蔻酰磷脂酰乙醇胺(dmpe)组成的组。
[0468]
辅助脂质包含增强转染的脂质。辅助脂质增强转染的机制可以包含增强颗粒稳定性。在某些情况下,辅助脂质可以增强膜融合性。辅助脂质包含类固醇、甾醇和烷基间苯二酚。合适的辅助脂质的实例包含胆固醇、5-十七烷基间苯二酚和胆固醇半琥珀酸酯。在一个实例中,辅助脂质可以是胆固醇或胆固醇半琥珀酸酯。
[0469]
隐形脂质包含改变纳米颗粒可以在体内存在的时间长度的脂质。隐形脂质可以通过例如减少颗粒聚集和控制粒度来帮助调配过程。隐形脂质可以调节lnp的药代动力学性质。合适的隐形脂质包含具有连接到脂质部分的亲水性头部基团的脂质。
[0470]
隐形脂质的亲水性头部基团可以包括例如选自基于peg(有时称为聚(环氧乙烷))、聚(噁唑啉)、聚(乙烯醇)、聚(甘油)、聚(n-乙烯基吡咯烷酮)、聚氨基酸和聚n-(2-羟丙基)甲基丙烯酰胺的聚合物的聚合物部分。术语peg意指任何聚乙二醇或其它聚亚烷基醚聚合物。在某些lnp调配物中,peg是peg-2k,也被称为peg 2000,其平均分子量为约2,000道
尔顿。参见例如wo 2017/173054 a1,所述文献出于所有目的通过引用整体并入本文。
[0471]
隐形脂质的脂质部分可以衍生自例如二酰基甘油或二烷基甘酰胺,其包含包括二烷基甘油或二烷基甘酰胺基团的那些,所述二烷基甘油或二烷基甘酰胺基团具有独立地包括约c4到约c40个饱和或不饱和碳原子的烷基链长度,其中链可以包括一个或多个官能团,例如酰胺或酯。二酰基甘油或二烷基甘酰胺基团可以进一步包括一个或多个经取代的烷基。
[0472]
作为一个实例,隐形脂质可以选自peg-二月桂酸甘油酯、peg-二肉豆蔻酰甘油(peg-dmg)、peg-二棕榈酰甘油、peg-二硬脂酰甘油(peg-dspe)、peg-二月桂甘酰胺、peg-二肉豆蔻甘酰胺、peg-二棕榈酰甘酰胺和peg-二硬脂酰甘酰胺、peg-胆固醇(l-[8'-(胆甾-5-en-3[β]-氧基)甲酰胺基-3',6'-二氧杂辛基]氨甲酰基-[ω]-甲基-聚(乙二醇)、peg-dmb(3,4-二十四烷基苄基-[ω]-甲基-聚(乙二醇)醚)、1,2-二肉豆蔻酰-sn-甘油-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-2000](peg2k-dmg)、1,2-二硬脂酰-sn-甘油-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-2000](peg2k-dspe)、1,2-二硬脂酰-sn-甘油、甲氧基聚乙烯乙二醇(peg2k-dsg)、聚(乙二醇)-2000-二甲基丙烯酸酯(peg2k-dma)和1,2-二硬脂氧基丙基-3-胺-n-[甲氧基(聚乙二醇)-2000](peg2k-dsa)。在一个特定实例中,隐形脂质可以是peg2k-dmg。
[0473]
lnp可以包括调配物中相应摩尔比的组分脂质。ccd脂质的mol-%可以为例如约30mol-%到约60mol-%、约35mol-%到约55mol-%、约40mol-%到约50mol-%、约42mol-%到约47mol-%或约45%。辅助脂质的mol-%可以为例如约30mol-%到约60mol-%、约35mol-%到约55mol-%、约40mol-%到约50mol-%、约41mol-%到约46mol-%或约44mol-%。中性脂质的mol-%可以为例如约1mol-%到约20mol-%、约5mol-%到约15mol-%、约7mol-%到约12mol-%或约9mol-%。隐形脂质的mol-%可以为例如约1mol-%到约10mol-%、约1mol-%到约5mol-%、约1mol-%到约3mol-%、约2mol-%或约1mol-%。
[0474]
lnp在生物可降解脂质(n)的带正电荷的胺基团与待封装的核酸的带负电荷的磷酸基团(p)之间可以具有不同的比率。这可以由等式n/p在数学上表示。例如,n/p比率可以为约0.5到约100、约1到约50、约1到约25、约1到约10、约1到约7、约3到约5、约4到约5、约4、约4.5或约5。
[0475]
在一些lnp中,负荷物可以包括cas mrna和grna。cas mrna和grna的比率可以不同。例如,lnp调配物的cas mrna与grna核酸的比率的范围可以为约25:1到约1:25、约10:1到约1:10、约5:1到约1:5或为约1:1。可替代地,lnp调配物的cas mrna与grna核酸的比率可以为约1:1到约1:5或约10:1。可替代地,lnp调配物的cas mrna与grna核酸的比率可以为约1:10、25:1、10:1、5:1、3:1、1:1、1:3、1:5、1:10或1:25。可替代地,lnp调配物的cas mrna与grna核酸的比率可以为约1:1到约1:2。在具体实例中,cas mrna与grna的比率可以为约1:1或约1:2。
[0476]
lnp的示例性剂量包含相对于总rna(cas9 mrna和grna)负荷物含量的约0.1、约0.25、约0.3、约0.5、约1、约2、约3、约4、约5、约6、约8或约10mg/kg体重(mpk),或约0.1到约10、约0.25到约10、约0.3到约10、约0.5到约10、约1到约10、约2到约10、约3到约10、约4到约10、约5到约10、约6到约10、约8到约10、约0.1到约8、约0.1到约6、约0.1到约5、约0.1到约4、约0.1到约3、约0.1到约2、约0.1到约1、约0.1到约0.5、约0.1到约0.3、约0.1到约0.25、约
0.25到约8、约0.3到约6、约0.5到约5、约1到约5、或约2到约3mg/kg体重。此类lnp可以例如静脉内施用。在一个实例中,可以使用介于约0.01mg/kg与约10mg/kg之间、介于约0.1与约10mg/kg之间或介于约0.01与约0.3mg/kg之间的lnp剂量。例如,可以使用约0.01、约0.03、约0.1、约0.3、约1、约3或约10mg/kg的lnp剂量。lnp的另外的示例性剂量包含相对于总rna(cas9 mrna和grna)负荷物含量的约0.1、约0.25、约0.3、约0.5、约1、约2、约3、约4、约5、约6、约8或约10mg/kg(mpk)体重,或约0.1到约10、约0.25到约10、约0.3到约10、约0.5到约10、约1到约10、约2到约10、约3到约10、约4到约10、约5到约10、约6到约10、约8到约10、约0.1到约8、约0.1到约6、约0.1到约5、约0.1到约4、约0.1到约3、约0.1到约2、约0.1到约1、约0.1到约0.5、约0.1到约0.3、约0.1到约0.25、约0.25到约8、约0.3到约6、约0.5到约5、约1到约5、或约2到约3mg/kg体重。此类lnp可以例如静脉内施用。在一个实例中,可以使用介于约0.01mg/kg与约10mg/kg之间、介于约0.1与约10mg/kg之间或介于约0.01与约0.3mg/kg之间的lnp剂量。例如,可以使用约0.01、约0.03、约0.1、约0.3、约0.5、约1、约2、约3或约10mg/kg的lnp剂量。在另一个实例中,可以使用介于约0.5与约10之间、介于约0.5与约5之间、介于约0.5与约3之间、介于约1与约10之间、介于约1与约5之间、介于约1与约3之间或介于约1与约2mg/kg之间的lnp剂量。
[0477]
可以选择降低免疫原性的递送方式。例如,可以通过不同的模式(例如,双模式递送)来递送不同的组分。这些不同的模式可以赋予主题递送分子不同的药效学或药代动力学性质。例如,不同的模式会导致不同的组织分布、不同的半衰期或不同的时间分布。一些递送模式(例如,通过自主复制或基因组整合来递送在细胞中持续存在的核酸载体)导致分子的表达和存在更持久,而其它递送模式是瞬时的且不太持久(例如,rna或蛋白质的递送)。以更瞬时的方式递送组分,例如作为rna,可以确保cas/grna复合物仅在短时间内存在和激活,并且可以降低免疫原性。此类瞬时递送还可以减少脱靶修饰的可能性。
[0478]
体内施用可以通过任何合适的途径,包含例如通过玻璃体内注射或视网膜下注射。与全身施用(例如,静脉内)相比,当局部施用(例如,视网膜下或玻璃体内)时,显著更少量的组分(与全身方法相比)可以发挥作用。局部施用方式还可以降低或消除当全身施用治疗有效量的组分时可能发生的潜在毒副作用的发生率。
[0479]
可以使用一种或多种生理学和药学上可接受的载体、稀释剂、赋形剂或助剂来调配包括核酸酶药剂(例如,cas9 mrna和向导rna或编码向导rna的核酸)和/或本文所公开的核酸构建体的组合物。调配物可以取决于所选择的施用途径。术语“药学上可接受的”意指载体、稀释剂、赋形剂或助剂与调配物的其它成分相容并且对其接受者基本上无害。
[0480]
施用频率和给药次数可以取决于核酸构建体或核酸酶试剂(或编码核酸酶药剂的核酸)的半衰期和施用途径以及其它因素。将核酸或蛋白质引入到细胞或动物中可以在一段时间内执行一次或多次。例如,引入可以按以下频率执行:一段时间内仅一次、一段时间内至少两次、一段时间内至少三次、一段时间内至少四次、一段时间内至少五次、一段时间内至少六次、一段时间内至少七次、一段时间内至少八次、一段时间内至少九次、一段时间内至少十次、至少十一次、一段时间内至少十二次、一段时间内至少十三次、一段时间内至少十四次、一段时间内至少十五次、一段时间内至少十六次、一段时间内至少十七次、一段时间内至少十八次、一段时间内至少十九次或一段时间内至少二十次。
[0481]
任选地,此类方法可以进一步包括评估插入的视网膜劈裂素编码序列或编码的视
网膜劈裂素蛋白在动物或细胞中的表达和/或活性。可以使用各种方法来鉴定具有靶向基因修饰的细胞。筛选可以包括用于评估亲本染色体的等位基因修饰(moa)的定量测定。例如,定量测定可以通过定量pcr进行,如实时pcr(qpcr)。实时pcr可以利用识别靶基因座的第一引物组和识别非靶向参考基因座的第二引物组。引物组可以包括识别扩增序列的荧光探针。合适的定量测定的其它实例包含荧光介导的原位杂交(fish)、比较基因组杂交、等温dna扩增、与固定化探针的定量杂交、探针、分子信标探针或eclipse
tm
探针技术(参见例如us 2005/0144655,所述文献出于所有目的通过引用整体并入本文)。
[0482]
下一代测序(ngs)也可以用于筛选。下一代测序也可以被称为“ngs”或“大规模平行测序”或“高通量测序”。除了moa测定外,ngs还可以用作筛选工具,用于定义靶向基因修饰的确切性质以及其是否在细胞类型或组织类型或器官类型上保持一致。
[0483]
评估对动物中的靶基因组基因座的修饰可以在来自任何组织或器官的任何细胞类型中进行。例如,评估可以在来自同一组织或器官(例如,眼睛)的多种细胞类型中进行,或者在来自组织或器官内的多个位置的细胞中进行。这可以提供关于靶向靶组织或器官内的哪些细胞类型或者核酸构建体到达组织或器官的哪些区段的信息。作为另一个实例,评估可以在多种类型的组织或多个器官中进行。在靶向特定组织、器官或细胞类型的方法中,这可以提供关于靶向所述组织或器官的有效性以及其它组织或器官中是否存在脱靶效应的信息。
[0484]
用于测量视网膜劈裂素蛋白的表达的方法可以包含,例如,测量蛋白质表达。此类方法是众所周知的。此类方法还可以包括评估由视网膜劈裂素编码序列编码的mrna的表达。这种测量可以在眼睛内或眼睛内的特定细胞类型或区(例如,视网膜细胞,如光感受器)内。
[0485]
可以使用的测定的一个实例是basescope
tm rna原位杂交(ish)测定,这是一种可以在完整的固定组织的情况下对细胞特异性编辑的转录物,包含单核苷酸变化进行定量的方法。basescope
tm rna ish测定可以在基因编辑的表征中补充ngs和qpcr。虽然ngs/qpcr可以提供野生型和编辑序列的定量平均值,但其不提供有关组织内经编辑的细胞的异质性或百分比的信息。basescope
tm ish测定可以提供整个组织的景观图并以单细胞分辨率对野生型与经编辑的转录物进行定量,其中可以定量靶组织中含有经编辑的mrna转录物的细胞的实际数量。basescope
tm
测定使用配对寡核苷酸(“zz”)探针在无非特异性背景的情况下放大信号,从而实现单分子rna检测。然而,basescope
tm
探针设计和信号放大系统利用1zz探针实现单分子rna检测,并且可以差异地检测完整固定组织中的单核苷酸编辑和突变。
[0486]
用于测量视网膜劈裂素蛋白的活性的测定可以包含,例如,光学相干断层扫描(oct)和视网膜电图(erg)测试。oct扫描可以用于对视网膜腔进行评分和/或测量视网膜光感受器厚度)。其它测定包含视动测试。此类方法是众所周知的。例如,如果被修饰的细胞或动物是具有与x连锁青少年型视网膜劈裂症相关的或引起x连锁青少年型视网膜劈裂症的突变(例如,r141c突变)的细胞,则此类功能测定可以用于评估疾病表型的挽救。光学相干断层扫描(oct)提供黄斑区的高分辨率横截面图像。在患有xlrs的个体中,oct显示主要位于视网膜内核层和外丛状层的囊性空间。这种功能测试还可以包含视网膜电图(erg)测试,这是一种测量视网膜中的神经和非神经元细胞响应光刺激而产生的电活动的诊断测试。
xlrs与erg中减少的明视和暗视b波振幅相关。
[0487]
出于所有目的,上文或下文引用的所有专利申请、网站、其它出版物、登录号等都通过引用整体并入,其程度如同每个单独的项目被单独并且具体地指出通过引用的方式并入。如果序列的不同版本与不同时间的登录号相关联,则意指在本技术的有效提交日期与登录号相关联的版本。有效提交日期是指实际提交日期或提及登记号的优先权申请的提交日期(在适用情况下)中较早的日期。同样地,如果出版物、网站等的不同版本在不同时间发布,除非另有说明,否则指在申请的有效提交日期最近发布的版本。除非另外具体说明,否则本发明的任何特征、步骤、元件、实施例或方面都可以与任何其它特征、步骤、元件、实施例或方面结合使用。尽管为了清楚和理解起见,已通过图解和实例方式详细地对本发明进行了描述,但显而易见的是,可以在所附权利要求的范围内进行某些改变和修改。
[0488]
序列简要说明
[0489]
使用核苷酸碱基的标准字母缩写和氨基酸的三字母代码示出随附序列表中列出的核苷酸和氨基酸序列。核苷酸序列遵循从序列的5'端开始并且向前(即,在每行中从左到右)到达3'端的标准惯例。每个核苷酸序列仅示出一条链,但任何提及的显示链均应理解为包含互补链。当提供编码氨基酸序列的核苷酸序列时,应当理解的是还提供了其编码相同氨基酸序列的密码子简并变体。氨基酸序列遵循从序列的氨基端开始并且向前(即,在每行中从左到右)到达羧基端的标准惯例。
[0490]
表4.序列描述。
[0491]
[0492][0493]
实例
[0494]
实例1.将rs1编码序列插入到xlrs小鼠模型中的小鼠rs1基因座中
[0495]
为了在体内模拟潜在的x连锁青少年型视网膜劈裂症疗法(xlrs)crispr治疗策略,产生了在所有组织中组成型表达cas9蛋白的小鼠品系(参见例如,us 2019/0032155和wo 2019/028032,所述文献中的每个文献出于所有目的通过引用整体并入本文),并将其与含有鼠类视网膜劈裂素(rs1)的突变拷贝的小鼠杂交以产生小鼠。具有rs1 r141c突变的小鼠会引起视网膜劈裂素在细胞内的滞留,以复制人病状的关键特征,包含视网膜劈裂、视网膜变性和erg b波降低。
[0496]
rs1基因是涉及视网膜的细胞组织的高度保守的胞外蛋白。所述基因由光感受器和双极细胞组装并分泌为同源寡聚蛋白复合物。已在rs1中检测到超过200种突变,其中许多因无功能蛋白或不存在蛋白分泌而导致黄斑变性的早期发作。缺乏功能性rs1表达会引起视网膜层内的分裂,导致与xlrs相关的早期和进行性视力丧失。迄今为止,没有出版物报告使用cas9技术进行xlrs治疗的临床前或临床研究。在这里,描述了一种用于将cas9与腺相关病毒(aav)组合使用来拯救小鼠中的rs1的非分泌型r141c变体的方法。这些构建体被设计为整合到视网膜中的内源性rs1基因座(例如,光感受器)中,其中杂交的小鼠-人rs1转录物将通过内源性rs1启动子表达。
[0497]
aav血清型7m8的视网膜下递送使得转基因成功表达(数据未示出)。虽然aav有可能异位持续一年或更长时间,但努力制定了一种用于永久拯救突变rs1表型的策略。为此,
设计了三种病毒载体,其编码wt人rs1外显子2-6(不具有启动子)以及靶向小鼠rs1内含子1的向导rna。向导rna的序列如seq id no:43中所示,并且小鼠rs1内含子1中的向导rna靶序列如seq id no:2383中所示。将这些病毒中的任何一种注射到rosacas9/ ;rs1r141c/y小鼠之后,预期向导rna表达会导致在rs1基因座处切割并整合含有人rs1cdna片段的病毒基因组。小鼠rs1基因座在图1中示出。小鼠外显子1会剪接至人外显子2-6cdna中(图2),并且杂交小鼠人蛋白的表达应该会阻止突变小鼠rs1的转录。
[0498]
通过双向插入单链aav(ssaav)载体产生病毒载体版本1(seq id no:47)。将两百个碱基的rs1人内含子1(含有外显子2剪接信号)置于编码人rs1转录物的外显子2-6的cdna前面,然后是牛生长激素(bgh)polya(th)。用小鼠密码子优化产生第二人cdna,并且以相反的朝向整合到载体中。此序列侧接有200bp,含有小鼠剪接信号和sv40 polya(t
mh
)。所述序列被设计得足够不同,以降低病毒转录物自我退火的可能性。进一步,在转录物之间添加了sgrna表达单元(图3a)。此策略的益处是病毒基因组可以以任一朝向插入,并且仍然形成用于等位基因拯救的可行阅读框。
[0499]
病毒载体版本2(seq id no:46)通过双向插入自身互补型aav(scaav)载体中产生。此版本与版本1一样配置,但有两个不同之处。首先,所述序列被整合到自身互补型aav载体中。其次,为了符合2100bp的最大自身互补型基因组大小,剪接信号区减少到60bp(图3a)。
[0500]
病毒载体版本3(seq id no:45)被设计用于同源非依赖性靶向整合(hiti)。hiti利用对cas9识别序列的需求来具有原型间隔子相邻基序(pam)。所述构建体被设计为表达th和靶向rs1内含子1的相同向导rna。然而,在版本1和2不含有向导rna靶序列的情况下,版本3在每一侧上侧接有反向向导rna靶序列(图3b)。一旦病毒基因组是双链的,它将表达一个向导rna序列,所述序列应该同时在小鼠rs1内含子1以及病毒基因组的两侧上引起双链断裂,从而有效地切断itr序列。释放的病毒基因组现在可以以任一朝向自由插入到小鼠基因组中。然而,如果cdna以相反朝向整合,则应该重组向导rna靶序列,并且可用于进一步的cas9切割。如果cdna以期望的朝向整合,向导rna靶序列将被破坏,并且序列锁定在适当的位置。
[0501]
虽然版本1和2的rs1序列几乎相同,但病毒骨架可以改变双链病毒产生的时间,并且因此影响基因插入效率。由于合成第二条链的机制不同,scaav将比ssaav更快地变成双链。ssaav中的两个itr都可以充当复制起点,并且含有切割新合成的链的单链核酸酶结构域。可以从任一itr启动复制,因此将产生 链和-链的混合物。一旦聚合酶到达另一个itr,合成的链就会被切割并释放。用于合成互补链的主要机制是使用宿主细胞机制。然而,在低水平下,病毒合成的 链和-链可以自发退火形成双链病毒。在scaav的情况下,两个itr序列之一被突变以去除核酸酶结构域。复制叉从活性itr开始,并且在没有被切割的情况下移动穿过突变的itr,并且合成在相反的链上继续。含有 和-链两者的单链合成自身互补以制造双链病毒。
[0502]
版本1-3各自能够介导cas9小鼠背景中的小鼠rs1基因座的基因插入。在试验性研究中,将少量病毒注射到每只小鼠的右眼中,并且左眼未被注射作为对照。两个视网膜都被采集并切成两半。每个视网膜的一半用于小鼠rs1基因座的内含子1处的非同源末端接合(nhej)表征。另一半用于产生cdna,用于对突变区进行ngs扩增子测序。由于pcr效率和偏
差,能够扩增每个转录物变体,但无法定量实际的表达谱。nhej表征提供了向导rna活性以及插入活性的线索。对nhej的检测意味着没有基因插入的等位基因可能会表达突变小鼠转录物。对任一经修饰的转录物的检测表明已发生基因插入。
[0503]
十三只小鼠的右眼被注射:版本1有三只,并且版本2和版本3各五只。如在光学相干断层扫描(oct)成像中所见,所有注射的眼睛都有改善的视网膜组织。参见图4。由三个独立的读者基于以下预设标准对来自每只眼睛的3个不同定位的oct扫描(每个含有61个图像)中示出的视网膜腔进行评分。如果在至少一个单独的图像上有1-4个空腔,则分配的评分为1。如果在至少一个单独的图像上存在≥4个空腔,但空腔未融合,则分配的评分为2。如果在至少一个单独的图像上存在融合空腔,则分配的评分为3。如果在至少一个单独的图像上存在融合空腔并且视网膜被拉伸,则分配的评分为4。通过非参数克鲁斯卡尔-沃利斯单向方差分析和事后测试邓恩多重比较测试,将每个治疗组的平均评分与含有合并的未经治疗的眼睛的对照组进行比较。
[0504]
下一代靶向重新测序扩增子是为图3(水平箭头)中描绘的区设计的,因为这些区在四种预期的序列变体中是不同的((1)wt小鼠,不含有r141c突变体的小鼠参考序列;(2)突变小鼠,含有r141c突变体的小鼠参考序列;(3)人源化转录物1,人参考序列;以及(4)人源化转录物2,小鼠密码子优化的人参考序列)。从研究小鼠中采集小鼠视网膜并从组织中提取总mrna。mrna用于产生cdna,以充当下一代测序(ngs)扩增的模板。带有用于序列鉴定的条形码的靶特异性寡核苷酸被用于扩增每个组织的所有四种变体。将来自每只小鼠的pcr产物归一化并合并到单个管中以供进一步制备。最终的文库被加载到miseq上,并使用2x300程序对样品进行测序。然后使用信息代码对样品进行去卷积并创建从头序列参考。对与每个变体匹配的读段数量进行定量,并且通过将变体读段计数除以总读段计数来获得百分比。如所预期的,wt小鼠序列仅在雌性小鼠中发现。四种预期的序列变体的ngs结果在图5中示出。没有考虑pcr偏差和效率。使用单独的扩增子来扩增rs1内含子1向导rna靶序列。对匹配小鼠参考序列或含有非同源末端接合的读段进行定量,以评估向导rna在不进行插入的情况下切割的频率。参见图6a和6b。示出了来自图5中的表格的一些数据的条形图分别在版本1-3的图7a-7c中示出。
[0505]
所有小鼠示出了不同水平的所有转录物,其中所有小鼠的th读段多于t
mh
读段。如所预期的,nhej速率非常高的小鼠存在的人转录物量较少。虽然版本1和2具有类似的序列图谱,但版本3具有更多的残留突变小鼠转录物存在。这可能是由于需要特定的插入朝向。虽然向导rna设计应该有助于将插入推动朝向期望的插入,但cas9切割可能会破坏识别序列,超出重新靶向的可能性。另外地,病毒基因组上的大量插入/缺失(indel)可能会破坏剪接信号并阻止正确表达。
[0506]
实例2.将rs1编码序列插入到人视网膜母细胞瘤细胞中的人rs1基因座
[0507]
接下来在体外测试了将rs1编码序列插入到weri-rb1人视网膜母细胞瘤细胞中的人rs1基因座中。weri-rb1细胞系(htb 169tm)源自人视网膜母细胞瘤。视网膜母细胞瘤细胞是光感受器的前体,并且是一种适当的体外感光细胞模型,因为感光细胞系不可用。通过icc和rt-pcr在内部用视网膜特异性细胞标志物对细胞进行了表征,这仅示出了锥体特异性mrna/蛋白质,但未发现其杆状对应物,这表明此赘生物属于锥细胞谱系。另外,据报道rs1由weri-rb1细胞表达和释放。还在mrna水平和蛋白质水平下检测到rs1表达(数据
未示出)。脂质纳米颗粒(lnp)与靶向人rs1的内含子1和cas9 mrna的六种向导rna之一一起调配(序列在seq id no:6245中示出)。
[0508]
表5.人rs1向导rna。
[0509]
grna向导rna靶序列(5'到3')方向seq id nohg1ctgtatcttcttagccagta 57hg2cccttttgtacgttttttaa 56hg3aaaaaaggacttgacatgca 65hg4agagctttggccgaggacga 1210hg5tctaggacttcttcgcatcg-1203hg6agtctgaggctggggcaact-581
[0510]
在第一实验中,用大约5e5 moi的aav供体(来自实例1的病毒载体版本1和2)转导悬浮液中的人视网膜母细胞瘤细胞,并且在感染后2小时施用crispr/cas9 lnp。所有lnp均以每孔500ng(48孔板)给药,“高”样品除外,其以1000ng lnp给药。然后通过rt-qpcr进行完整的基因表达分析。通过从样品中采集总rna并且用dnase处理它们以降解样品中含有的所有dna来进行rt-qpcr。接下来,使rna样品经历逆转录,以为样品中含有的所有mrna创建cdna。然后使用靶特异性taqman测定来定量细胞中表达的独特rs1序列。感染后72小时采集rna。通过采集总rna和如上处理的dna酶来完成无逆转录对照。对于对照,逆转录聚合酶用水替代,使得不应产生cdna。使用管家基因(drosha)运行逆转录和对照非逆转录的样品。病毒载体版本1(单链aav(ssaav)载体中的双向插入)的结果在图8a中示出。病毒载体版本1(自身互补型aav(scaav)载体中的双向插入)的结果在图8b中示出。这些结果示出为δct,以归一化rna数量和质量的差异。数字越小,靶序列的表达越高。这些结果表明所引入序列的稳健表达。taqman测定和病毒序列被优化以减少对内源性人rs1表达的交叉检测。在第二实验中,用大约5e5 moi的aav供体(来自实例1的病毒载体版本1和2)转导悬浮液中的人视网膜母细胞瘤细胞,并且在感染之前2小时施用crispr/cas9 lnp。所有lnp均以每孔500ng(48孔板)给药,“高”样品除外,其以1000ng lnp给药。然后通过rt-qpcr进行完整的基因表达分析。病毒载体版本1(单链aav(ssaav)载体中的双向插入)的结果在图9a中示出。病毒载体版本1(自身互补型aav(scaav)载体中的双向插入)的结果在图9b中示出。这些结果示出为δct,以归一化rna数量和质量的差异。数字越小,靶序列的表达越高。这些结果表明所引入序列的稳健表达。taqman测定和病毒序列被优化以减少对内源性人rs1表达的交叉检测。
[0511]
实例3.通过同源重组将rs1编码序列插入到xlrs小鼠模型中的小鼠rs1基因座中
[0512]
为了在体内模拟潜在的x连锁青少年型视网膜劈裂疗法(xlrs)crispr治疗策略,使用实施例1中描述的小鼠系,其中cas9蛋白在与含有鼠类视网膜劈裂素(rs1)的突变拷贝的小鼠杂交的所有组织中进行组成型表达(小鼠)。crispr/cas9与腺相关病毒(aav)组合使用以拯救小鼠中的rs1的非分泌型r141c变体的方法。这些构建体被设计为通过同源重组整合到视网膜中的内源性rs1基因座(例如,光感受器)中,其中杂交的小鼠-人rs1转录物将通过内源性rs1启动子表达。当视网膜仍在经历有丝分裂、细胞分化和成熟时,小鼠处于p14岁。注射是在视网膜有丝分裂期间进行的,并且在注射后2个月进行有丝分裂后的评估。
[0513]
设计了三个病毒载体,其编码wt人rs1外显子2-6(不具有启动子)以及靶向小鼠
rs1内含子1的向导rna(seq id no:2887中示出的向导rna靶序列),其中所有这些元件侧接有同源臂。参见图10。这些元件在每一侧上侧接有反向的向导rna靶序列。一旦病毒基因组是双链的,它将表达一个向导rna序列,所述序列同时在小鼠rs1内含子1以及病毒基因组的两侧上引起双链断裂,从而有效地切断itr序列。第一病毒载体中的同源臂各自为大约1800bp,第二病毒载体中的同源臂各自为大约900bp,并且第三病毒载体中的同源臂各自为大约450bp。三个载体的序列分别在seq id no:6247-6249中示出。在将这些病毒中的任何一种注射到rosacas9/ ;rs1r141c/y小鼠的眼睛之后,向导rna表达会导致在rs1基因座处切割并与含有人rs1 cdna片段的病毒基因组进行同源重组。小鼠rs1基因座在图1中示出。小鼠外显子1会剪接至人外显子2-6cdna中(图2),并且杂交小鼠人蛋白的表达会阻止突变小鼠rs1的转录。
[0514]
视网膜被采集并切成两半。每个视网膜的一半用于小鼠rs1基因座的内含子1处的非同源末端接合(nhej)表征。另一半用于产生cdna,用于对突变区进行ngs扩增子测序。nhej表征提供有关向导rna活性和插入活性的信息。对nhej的检测意味着没有基因插入的等位基因可能会表达突变小鼠转录物。对插入的转录物的检测表明已经发生基因插入。
[0515]
通过光学相干断层扫描(oct)成像评估视网膜组织。对oct扫描中的视网膜腔的评分由三个独立的读者基于以下预设标准进行。如果在至少一个单独的图像上有1-4个空腔,则分配的评分为1。如果在至少一个单独的图像上存在≥4个空腔,但空腔未融合,则分配的评分为2。如果在至少一个单独的图像上存在融合空腔,则分配的评分为3。如果在至少一个单独的图像上存在融合空腔并且视网膜被拉伸,则分配的评分为4。通过非参数克鲁斯卡尔-沃利斯单向方差分析和事后测试邓恩多重比较测试,将每个治疗组的平均评分与含有合并的未经治疗的眼睛的对照组进行比较。
[0516]
从研究小鼠中采集小鼠视网膜并从组织中提取总mrna。mrna用于产生cdna,以充当下一代测序(ngs)扩增的模板。带有用于序列鉴定的条形码的靶特异性寡核苷酸被用于扩增每个组织的所有变体。将来自每只小鼠的pcr产物归一化并合并到单个管中以供进一步制备。最终的文库被加载到miseq上,并使用2x300程序对样品进行测序。然后使用信息代码对样品进行去卷积并创建从头序列参考。对与每个变体匹配的读段数量进行定量,并且通过将变体读段计数除以总读段计数来获得百分比。
[0517]
实例4.通过同源重组将rs1编码序列插入到人视网膜母细胞瘤细胞中的人rs1基因座中
[0518]
接下来在体外测试了通过同源重组将rs1编码序列插入到人视网膜母细胞瘤细胞中的人rs1基因座中。脂质纳米颗粒(lnp)与靶向人rs1的内含子1和cas9 mrna的向导rna一起调配。在第一实验中,用大约5e5 moi的aav供体(来自实例3的病毒载体,但具有人rs1同源臂)转导悬浮液中的人视网膜母细胞瘤细胞,并且在感染后2小时施用crispr/cas9 lnp。所有lnp以每孔500ng或每孔1000ng给药。然后通过rt-qpcr进行完整的基因表达分析。在第二实验中,用大约5e5 moi的aav供体(来自实例3的病毒载体,但具有人rs1同源臂)转导悬浮液中的人视网膜母细胞瘤细胞,并且在感染之前2小时施用crispr/cas9 lnp。所有lnp以每孔500ng或每孔1000ng给药。然后通过rt-qpcr进行完整的基因表达分析。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。