用于神经学疾病的组合物和方法
1.相关申请的交叉引用
2.本技术要求2019年8月21日提交的美国临时专利申请系列号62/889,963的权益,其内容通过引用整体并入本文。
3.电子提交的文本文件的描述
4.与本技术相关的序列表以文本格式代替纸质副本提供,并特此通过引用并入说明书中。包含序列表的文本文件的名称是“swch02901wo-sequence_listing”。文本文件是200kb,创建于2020年8月21日,并正在通过efs-web以电子方式提交。
技术领域
5.本公开内容涉及经工程改造的受体以及经工程改造的受体和小分子配体用于调节细胞活性并治疗疾病的用途。
背景技术:
6.顽固性神经学疾病经常与异常地起作用的神经元相关联。与所述疾病相关联的易处理的靶蛋白的缺乏已经阻碍了开发用于治疗这些病症的疗法的尝试。例如,在美国和世界范围内,无法缓解的慢性疼痛是一个严重的健康问题。医学研究所(institute of medicine)的一份报告估计,1.16亿美国人遭受持续数周到数年的疼痛,导致每年超过5.6亿美元的费用。对于慢性疼痛患者,没有适当的长期疗法,这给社会和个人都带来了巨大的费用。疼痛经常会导致残疾,而且即使没有残疾,也会对生活质量产生深远影响。即使在诸如以下护理情况最佳时,疼痛治疗也常常失败:专心的、训练有素的医师;容易获得阿片样物质;使用辅助镇痛药;患者控制的镇痛的可获得性;以及如神经传导阻滞和it泵等程序的基于证据的使用。
7.关于慢性疼痛最常用的疗法是应用阿片样镇痛剂和非甾体类抗炎药,但这些药物可以导致成瘾并可能产生副作用,诸如药物依赖性、耐受性、呼吸抑制、镇静、认知失败、幻觉以及其它系统性副作用。尽管广泛使用药物,但其在缓解疼痛方面的成功率非常低。使用各种药物的大型随机研究发现,每两或三名患者中只有一名实现了至少至少50%的疼痛缓解(finnerup等人,2005)。使用最先进的药理学治疗的随访研究发现了相同的结果,表明用于疼痛的药物的效力没有改善(finnerup等人,pain,150(3):573-81,2010)。
8.用于治疗疼痛的更侵入性选择包括神经传导阻滞和电刺激。神经传导阻滞是通常在脊髓中的局部麻醉剂注射,以中断到大脑的疼痛信号,其作用仅持续数周到数月。在大多数情况下,神经传导阻滞不是推荐的治疗选择(mailis和taenzer,pain res manag.17(3):150-158,2012)。电刺激涉及提供电流以阻断疼痛信号。尽管作用可能比神经传导阻滞持续得更久,但电导线本身会引起并发症:脱位、感染、破裂或电池快要没电。一项综述发现,用电刺激治疗神经病的患者中的40%经历了装置的这些问题中的一个或多个问题(wolter,2014)。
9.用于管理疼痛的最侵入性的且最不优选的方法是引起疼痛的神经或其部分的完
全手术除去。仅当患者已用尽前者和其它更少侵入性的治疗并发现它们无效时,才推荐此选项。射频神经消融使用热来破坏有问题的神经并且提供比神经传导阻滞更长的疼痛缓解。但是,一项研究发现,在背根神经节(drg)因慢性腰骶神经根痛而有部分射频损伤方面,在对照组与治疗组之间没有差异(geurts等人,2003)。用于手术除去疼痛神经的其它手术方法具有类似的缺点并且具有长期的严重副作用(包括感觉或运动缺陷)或在其它地方引起疼痛。
10.用于治疗神经学障碍的方法应当是安全的、高效的和有成本效益的。基因疗法可以为多种神经学疾病提供非侵入性治疗选择,包括管理疼痛。但是,迄今为止,基因疗法尚未广泛用于治疗神经学疾病。本公开内容解决了这些需求。
附图说明
11.当结合附图阅读时,从以下详细描述最好地理解本公开内容。本专利或申请文件含有至少一幅彩色附图。具有彩图的该专利或专利申请公开文本的复制件将在请求并支付必要的费用后由专利局提供。应当强调的是,根据通常实践,附图的各个特征不是按比例绘制。相反,为了清楚起见,各个特征的尺寸被任意放大或缩小。在附图中包括以下图:
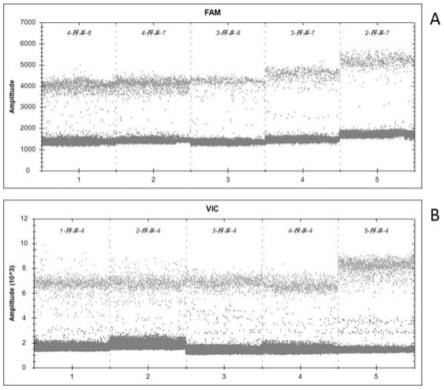
12.图1a-图1g显示了经工程改造的嵌合受体seq id no:33的突变体中yfp荧光猝灭百分比的热图,该突变体在不同剂量的乙酰胆碱或指示的非天然配体的刺激后包含指示的双氨基酸置换。配体剂量写在每个图表的顶部。框中的数字指示观察到的猝灭的绝对量。深蓝色=yfp报告物的80%最大猝灭。浅蓝色=30-80%的猝灭。白色=10-30%。橙色=0-10%猝灭。负值代表由于刺激伪像而具有负猝灭的无应答者。seq id no:29是用作阴性对照的无反应嵌合体。非天然配体名称的缩写:abt:abt-126;ach:乙酰胆碱;apn:apn-1125;azd:azd-0328;brd:tc-5619;fac:rg3487;tc6:tc-6987。
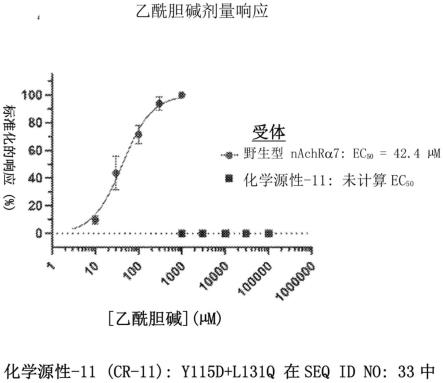
13.图2a-图2b显示了在hek 293细胞中表达的cr-11(化学成因(chemogenic)受体-11,一种经工程改造的受体,其包含具有在seq id no:33中的y115d和l131q的氨基酸置换的氨基酸序列)对乙酰胆碱以及对非天然配体rg-3487(sa-2,合成激动剂-2)的浓度-响应曲线。使用手动膜片箝电生理学评价应答。将电流标准化为统一以获得最大应答。穿过数据点的连续线是用hill方程式获得的最佳拟合,并且从浓度-响应曲线估计每种配体的ec
50
。图2a显示了野生型和cr-11受体对乙酰胆碱的浓度-响应曲线。图2b显示了野生型和cr-11受体对rg-3487(sa-2)的浓度-响应曲线。
14.图3显示了rg-3487(sa-2)在成年大鼠drg神经元中诱导的示例性氯离子电流,所述神经元被表达cr-11的慢病毒(化学成因(chemogenic)受体-11,一种经工程改造的受体,其包含具有在seq id no:33中的y115d和l131q的氨基酸置换的氨基酸序列)转导。
15.图4a显示了表达cr-11(经工程改造的受体,其包含具有在seq id no:33中的y115d和l131q的氨基酸置换的氨基酸序列)的转导的drg神经元或对照drg神经元(没有cr-11表达)在不同电流注射(50pa至700pa)下的诱发动作电位。上面的小图显示了对照dgf神经元的诱发动作电位。左下小图显示了在有3μm rg-3487(sa-2)存在下表达cr-11的转导的drg神经元的诱发动作电位。右下小图显示了在rg-3487(sa-2)被洗掉后,表达cr-11的转导的drg神经元的诱发动作电位。图4b显示了对照drg神经元和表达cr-11的转导的drg神经元在没有或有指定配体存在下的基本电流强度值(激发动作电位所需的电流)。
nachr)对非天然配体的效能大约相同。
22.在某些实施方案中,所述经工程改造的受体对非天然配体的效能高于人α7烟碱乙酰胆碱受体(α7-nachr)对非天然配体的效能。在某些实施方案中,所述经工程改造的受体对非天然配体的效能比人α7烟碱乙酰胆碱受体(α7-nachr)对非天然配体的效能高至少2倍。在某些实施方案中,确定所述效能包括确定ec50。
23.在某些实施方案中,在有非天然配体存在下所述经工程改造的受体的效力高于在有非天然配体存在下人α7烟碱乙酰胆碱受体(α7-nachr)的效力。在某些实施方案中,在有非天然配体存在下所述经工程改造的受体的效力比在有非天然配体存在下人α7烟碱乙酰胆碱受体(α7-nachr)的效力高至少2倍。在某些实施方案中,确定所述效力包括确定在有非天然配体存在下在体外穿过经工程改造的受体的电流的量。
24.在某些实施方案中,所述非天然配体选自由以下成员组成的集合:azd-0328、tc-6987、abt-126、apn-1125、tc-5619和facinicline/rg3487。在某些实施方案中,所述非天然配体选自由以下成员组成的集合:abt-126、rg3487和apn-1125。在某些实施方案中,所述非天然配体是tc-5619。
25.本公开内容提供了多核苷酸,其包含编码本文公开的经工程改造的受体中的任一种的核酸。在某些实施方案中,所述多核苷酸包含可操作地连接至编码经工程改造的受体的核酸的启动子。在某些实施方案中,所述启动子是可调节的启动子。在某些实施方案中,所述可调节的启动子在可兴奋细胞中是有活性的。在某些实施方案中,所述可兴奋细胞是神经元或肌细胞。在某些实施方案中,所述可兴奋细胞是神经元。
26.本公开内容提供了载体,其包含本文公开的多核苷酸中的任一种。在某些实施方案中,所述载体是质粒或病毒载体。在某些实施方案中,所述载体是选自由以下成员组成的集合的病毒载体:腺病毒载体、逆转录病毒载体、腺相关病毒(aav)载体和单纯疱疹-1病毒载体(hsv-1)。在某些实施方案中,所述病毒载体是avv载体,且其中所述aav载体是aav5或其变体、aav6或其变体或aav9或其变体。
27.本公开内容提供了组合物,其包含本文公开的经工程改造的受体中的任一种、本文公开的多核苷酸中的任一种或本文公开的载体中的任一种。本公开内容进一步提供了药物组合物,其包含本文公开的经工程改造的受体中的任一种、本文公开的多核苷酸中的任一种或本文公开的载体中的任一种;和药学上可接受的载体。
28.本公开内容提供了在神经元中产生经工程改造的受体的方法,该方法包括使所述神经元与本文公开的多核苷酸中的任一种、本文公开的载体中的任一种、本文公开的组合物中的任一种或本文公开的药物组合物中的任一种接触。在某些实施方案中,所述神经元是周围神经系统的神经元。在某些实施方案中,所述神经元是中枢神经系统的神经元。在某些实施方案中,所述神经元是感受伤害的神经元。在某些实施方案中,所述神经元是非感受伤害的神经元。在某些实施方案中,所述神经元是背根神经节(drg)神经元、三叉神经节(tg)神经元、运动神经元、兴奋性神经元、抑制性神经元或感觉神经元。在某些实施方案中,所述神经元是aδ传入纤维、c纤维或aβ传入纤维。在某些实施方案中,所述神经元是aβ传入纤维。在某些实施方案中,所述aβ传入纤维是受损伤的aβ传入纤维。在某些实施方案中,所述aβ传入纤维是未受损伤的aβ传入纤维。在某些实施方案中,其中所述神经元表达神经丝200(nf200)、piezo 2和tlr-5。在某些实施方案中,所述神经元不表达trpv1、前列腺酸性磷
酸酶、nav1.1。
29.在某些实施方案中,在体外、离体或在体内进行所述接触步骤。在某些实施方案中,在受试者中在体内进行所述接触步骤。在某些实施方案中,所述接触步骤包括将所述多核苷酸、所述载体、所述组合物或所述药物组合物施用给所述受试者。在某些实施方案中,在体外或离体进行所述接触步骤。在某些实施方案中,所述接触步骤包括脂质体转染、纳米颗粒递送、颗粒轰击、电穿孔、声处理或显微注射。在某些实施方案中,所述经工程改造的受体能够定位至所述神经元的细胞表面。
30.本公开内容提供了抑制神经元活性的方法,该方法包括(a)使所述神经元与本文公开的经工程改造的受体中的任一种、本文公开的多核苷酸中的任一种、本文公开的载体中的任一种、本文公开的组合物中的任一种或本文公开的药物组合物中的任一种接触,和(b)使所述神经元与所述经工程改造的受体的非天然配体接触。在某些实施方案中,所述神经元是周围神经系统的神经元。在某些实施方案中,所述神经元是中枢神经系统的神经元。在某些实施方案中,所述神经元是感受伤害的神经元。在某些实施方案中,所述神经元是非感受伤害的神经元。在某些实施方案中,所述神经元是背根神经节(drg)神经元、三叉神经节(tg)神经元、运动神经元、兴奋性神经元、抑制性神经元或感觉神经元。在某些实施方案中,所述神经元是aδ传入纤维、c纤维或aβ传入纤维。在某些实施方案中,所述神经元是aβ传入纤维。在某些实施方案中,所述aβ传入纤维是受损伤的aβ传入纤维。在某些实施方案中,所述aβ传入纤维是未受损伤的aβ传入纤维。在某些实施方案中,所述神经元表达神经丝200(nf200)、piezo 2和tlr-5。在某些实施方案中,所述神经元不表达trpv1、前列腺酸性磷酸酶、nav1.1。
31.在某些实施方案中,在体外、离体或在体内进行所述接触步骤(a)。在某些实施方案中,在体外、离体或在体内进行所述接触步骤(b)。在某些实施方案中,在受试者中在体内进行所述接触步骤(a)和/或(b)。在某些实施方案中,所述接触步骤(a)包括将所述经工程改造的受体、所述多核苷酸、所述载体或所述药物组合物施用给所述受试者;和/或所述接触步骤(b)包括将所述非天然配体施用给所述受试者。在某些实施方案中,所述接触步骤(a)和/或(b)包括脂质体转染、纳米颗粒递送、颗粒轰击、电穿孔、声处理或显微注射。在某些实施方案中,所述经工程改造的受体能够定位至所述神经元的细胞表面。
32.本公开内容提供了在有此需要的受试者中治疗神经学障碍和/或延迟神经学障碍的发作的方法,所述方法包括:给所述受试者施用治疗有效量的本文公开的经工程改造的受体中的任一种、本文公开的多核苷酸中的任一种、本文公开的载体中的任一种、本文公开的组合物中的任一种或本文公开的药物组合物中的任一种,和给所述受试者施用所述经工程改造的受体的非天然配体。在某些实施方案中,在步骤(a)之后给所述受试者施用所述非天然配体。在某些实施方案中,与步骤(a)并行地给所述受试者施用所述非天然配体。
33.在某些实施方案中,所述神经学障碍是癫痫发作障碍、运动障碍、进食障碍、脊髓损伤、神经源性膀胱障碍、痛觉超敏、痉挛状态障碍、瘙痒、阿尔茨海默氏病、帕金森病、创伤后应激障碍(ptsd)、胃食管反流疾病(gerd)、成瘾、焦虑、抑郁症、记忆丧失、痴呆、睡眠呼吸暂停、中风、发作性睡病、尿失禁、特发性震颤、三叉神经痛、口腔烧灼综合征或心房颤动。在某些实施方案中,所述神经学障碍是痛觉超敏。在某些实施方案中,所述非天然配体选自由以下成员组成的集合:azd-0328、abt-126、tc6987、apn-1125、tc-5619和facinicline/
rg3487。
34.在某些实施方案中,口服地、皮下地、局部地或静脉内地施用所述非天然配体。在某些实施方案中,口服地施用所述非天然配体。在某些实施方案中,皮下地、口服地、鞘内地、局部地、静脉内地、神经节内地、神经内地、颅内地、椎管内地或向小脑延髓池施用所述经工程改造的受体、所述多核苷酸、所述载体、所述组合物或所述药物组合物。在某些实施方案中,通过经椎间孔注射或鞘内地施用所述经工程改造的受体、所述多核苷酸、所述载体、所述组合物或所述药物组合物。在某些实施方案中,所述受试者遭受三叉神经痛,且其中将所述经工程改造的受体、所述多核苷酸、所述载体、所述组合物或所述药物组合物施用至所述受试者的三叉神经节(tg)。在某些实施方案中,所述受试者遭受神经性疼痛,且其中将所述经工程改造的受体、所述多核苷酸、所述载体、所述组合物或所述药物组合物施用至所述受试者的背根神经节(drg)。在某些实施方案中,所述受试者是人。
35.在某些实施方案中,所述治疗有效量减轻所述神经学障碍的征象和/或症状的严重程度。在某些实施方案中,所述治疗有效量延迟所述神经学障碍的征象和/或症状的发作。在某些实施方案中,所述治疗有效量消除所述神经学障碍的征象和/或症状。在某些实施方案中,所述神经学障碍的征象是神经损伤、神经萎缩和/或癫痫发作。在某些实施方案中,所述神经损伤是周围神经损伤。在某些实施方案中,所述神经学障碍的症状是疼痛。
36.本公开内容提供了在有此需要的受试者中治疗疼痛和/或延迟疼痛发作的方法,该方法包括:给所述受试者施用治疗有效量的本文公开的经工程改造的受体中的任一种、本文公开的多核苷酸中的任一种、本文公开的载体中的任一种、本文公开的组合物中的任一种或本文公开的药物组合物中的任一种,和给所述受试者施用所述经工程改造的受体的非天然配体。在某些实施方案中,在步骤(a)之后给所述受试者施用所述非天然配体。在某些实施方案中,与步骤(a)并行地给所述受试者施用所述非天然配体。在某些实施方案中,所述非天然配体选自由以下成员组成的集合:azd-0328、abt-126、tc6987、apn-1125、tc-5619和facinicline/rg3487。
37.在某些实施方案中,口服地、皮下地、局部地或静脉内地施用所述非天然配体。在某些实施方案中,口服地施用所述非天然配体。在某些实施方案中,皮下地、口服地、鞘内地、局部地、静脉内地、神经节内地、神经内地、颅内地、椎管内地或向小脑延髓池施用所述经工程改造的受体、所述多核苷酸、所述载体、所述组合物或所述药物组合物。在某些实施方案中,通过经椎间孔注射或鞘内地施用所述经工程改造的受体、所述多核苷酸、所述载体、所述组合物或所述药物组合物。
38.在某些实施方案中,所述受试者遭受三叉神经痛,且其中将所述经工程改造的受体、所述多核苷酸、所述载体、所述组合物或所述药物组合物施用至所述受试者的三叉神经节(tg)。在某些实施方案中,所述受试者遭受神经性疼痛,且其中将所述经工程改造的受体、所述多核苷酸、所述载体、所述组合物或所述药物组合物施用至所述受试者的背根神经节(drg)。
39.在某些实施方案中,所述受试者是人。在某些实施方案中,所述疼痛是神经性疼痛。在某些实施方案中,所述疼痛与化学疗法有关,由化学疗法造成,或起因于化学疗法。在某些实施方案中,所述疼痛与创伤有关,由创伤造成,或起因于创伤。在某些实施方案中,所述受试者遭受痛觉超敏。在某些实施方案中,所述疼痛在医学操作后出现。在某些实施方案
中,所述疼痛与分娩或剖腹产术有关,由分娩或剖腹产术造成,或起因于分娩或剖腹产术。在某些实施方案中,所述疼痛与偏头痛有关,由偏头痛造成,或起因于偏头痛。在某些实施方案中,所述治疗有效量暂时减轻所述受试者中的疼痛,永久地减轻所述受试者中的疼痛,预防所述受试者中的疼痛发作,和/或消除所述受试者中的疼痛。在某些实施方案中,在所述受试者中出现疼痛之前进行步骤(a)和(b)。
具体实施方式
40.a.概述
41.提供了用于调节细胞的活性的组合物和方法,其使用经工程改造的配体门控离子通道(lgic)受体、多核苷酸编码的经工程改造的lgic受体和包含编码经工程改造的lgic受体的多核苷酸的基因疗法载体。这些组合物和方法具体地用于调节神经元的活性,例如在疾病的治疗中或在神经元回路的研究中。另外,提供了用于实践主题方法的试剂、装置及其试剂盒。
42.具体地,本公开内容提供了经工程改造的受体,其结合已知的药物、配体和/或结合剂并响应于已知的药物、配体和/或结合剂而发信号。在某些实施方案中,本文描述的经工程改造的受体对已知的激动剂结合剂表现出增加的亲和力。在某些实施方案中,本文描述的经工程改造的受体对拮抗剂或调节剂结合剂表现出亲和力并对所述拮抗剂和/或调节剂做出应答,如同它们是激动剂。本公开内容进一步提供了在有此需要的受试者中治疗神经学疾病的方法。本公开内容通过利用以不同于野生型内源性受体的方式对已知药物做出应答的经工程改造的受体增加已知药物可以应用的临床适应症的数量。
43.在描述本发明的方法和组合物之前,应当理解,本公开内容不限于所描述的特定方法或组合物,因此当然可以改变。还应该理解,本文所使用的术语仅仅是为了描述具体实施方案的目的,且无意进行限制,因为本公开内容的范围将仅由所附权利要求书限制。
44.在提供值的范围的情况下,应当理解,也明确地公开了在该范围的上限和下限之间的每个插入值(至下限的单位的十分之一,除非上下文另外清楚地指明)。在所述范围内的任何所述值或插入值与所述范围内的任何其它所述值或插入值之间的每个更小范围被涵盖在本公开内容内。这些更小范围的上限和下限可以独立地在所述范围内包括或排除,并且每个范围(其中在所述更小范围内包括任一个限值、两个限值或不包含限值)也被涵盖在本公开内容内,具有在所述范围中的任何具体地排除的限制。在所述范围包括一个或两个限值的情况下,排除了那些被包含的限值中的任一个或两个的范围也被包括在本公开内容内。
45.除非另外定义,否则在本文中使用的所有技术和科学术语具有与本公开内容所属领域的普通技术人员通常所理解相同的含义。尽管与本文描述的那些类似或等同的任何方法和材料都可以用于实践或试验本公开内容,但是现在描述一些潜在的和优选的方法和材料。在本文中提及的所有出版物都通过引用并入本文,以公开和描述与所述出版物引用的对象有关的方法和/或材料。应当理解,在存在矛盾的情况下,本公开内容替代所并入的出版物的任何公开内容。
46.正如本领域技术人员在阅读本公开内容以后会明白的,本文描述和解释的每个单独实施方案具有离散的组分和特征,所述组分和特征可以在不偏离本公开内容的范围或精
神的情况下容易地与其它几个实施方案中的任一个的特征分离或组合。任何提及的方法可以按提及的事件的顺序进行,或按逻辑上可行的任意其它顺序进行。
47.在本文中讨论的出版物仅针对它们在本技术的提交日之前的公开内容而提供。本文中的任何内容均不应被解释为承认本公开内容由于先前出版物而丧失先于这样的出版物的资格。此外,提供的出版物的日期可能不同于实际的出版日期,后者可能需要独立地确认。
48.b.定义
49.在本说明书和所附权利要求中使用的单数形式“一个”、“一种”和“所述”包括复数所指,除非上下文另外清楚地指示。因而,例如,对“一个细胞”的提及包括多个这样的细胞,并且对“所述肽”的提及包括对本领域技术人员已知的一种或多种肽及其等同物(例如多肽)等的提及。
50.如在本说明书中所使用的,在本公开内容中使用术语“和/或”表示“和”或“或”,除非另外指出。
51.贯穿本说明书,除非上下文另外要求,否则词语“包含”或变体诸如“包括”或“含有”表示包括所述的要素或整数、或者多个要素或整数的集合,但不排除任何其它要素或整数、或者多个要素或整数的集合。进一步,贯穿本说明书对数值范围的陈述具体地包括在之间的所有整数和小数点。
52.贯穿本说明书,除非上下文另外要求,否则短语“基本上由
……
组成”表示所描述的组合物、方法或试剂盒的范围限于不会实质上影响本主题公开内容的基本和新颖特征的指定材料或步骤。例如,“基本上由所公开的序列组成”的配体结合结构域具有所公开的序列的氨基酸序列加上或减去在序列边界处的约5个氨基酸残基,例如比所列出的约束氨基酸残基少约5个残基、4个残基、3个残基、2个残基或约1个残基,或比所列出的约束氨基酸残基多约1个残基、2个残基、3个残基、4个残基或5个残基。
53.贯穿本说明书,除非上下文另外要求,否则短语“由
……
组成”表示从所述组合物、方法或试剂盒排除在权利要求中未指定的任何要素、步骤或成分。例如,“由所公开的序列组成”的配体结合结构域仅由所公开的氨基酸序列组成。
54.如在本技术中使用的,术语“约”和“大约”等同地使用。在本技术中使用的任何数字,不论有没有约/大约,都意在覆盖相关领域的普通技术人员所理解的任何正常波动。在某些实施方案中,术语“大约”或“约”表示在所述参考值的任一个方向(大于或更小)落在25%、20%、19%、18%、17%、16%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更小内的值的范围,除非另有说明或另外从上下文中显而易见(这样的数字会超过可能值的100%的情况除外)。
55.本文中使用的术语“分离的”是指实质上或基本上不含有在其天然状态下发现通常伴随它的组分的物质。在某些实施方案中,术语“得到”或“衍生”与分离同义地使用。
56.术语”受试者”、“个体”和“患者”在本文中互换地用于表示脊椎动物,诸如哺乳动物。哺乳动物可以是,例如,小鼠、大鼠、兔、猫、狗、猪、绵羊、马、非人灵长类动物(例如,食蟹猴、黑猩猩)或人。也涵盖在体内得到的或在体外培养的受试者的组织、细胞或其衍生物。人受试者可以是成年人、青少年、儿童(2岁至14岁)、婴儿(1个月至24个月)或新生儿(直到1个月)。在某些实施方案中,所述成年人是约65岁或更老或约60岁或更老的老年人。在某些实
施方案中,所述受试者是孕妇或意图怀孕的女性。
57.术语“样品”表示一定体积和/或质量的要进行分析的生物学材料。在某些实施方案中,样品包括组织样品、细胞样品、流体样品等。在某些实施方案中,样品取自受试者(例如,人受试者)或由其提供。在某些实施方案中,样品包括取自任何内部器官、癌性、癌前或非癌性肿瘤、脑、皮肤、毛发(包括根)、眼、肌肉、骨髓、软骨、白色脂肪组织和/或褐色脂肪组织的组织的一部分。在某些实施方案中,流体样品包括口腔拭子、血液、脐带血、唾液、精液、尿液、腹水液、胸膜液、脊髓液、肺灌洗液、泪液、汗液等。本领域普通技术人员会明白,在某些实施方案中,“样品”是“原始样品”,因为其直接从来源(例如,受试者)获得。在某些实施方案中,“样品”是原始样品的加工的结果,例如所述加工为了除去某些潜在污染组分、分离某些组分和/或纯化某些感兴趣的组分。在某些实施方案中,样品是细胞或细胞(例如,神经元细胞)的群体。细胞样品可以直接衍生自受试者(例如,原始样品)或者可以是细胞系。细胞系可以包括非哺乳动物细胞(例如,昆虫细胞、酵母细胞和/或细菌细胞)或哺乳动物细胞(例如,永生化的细胞系)。
58.本文中使用的“治疗”表示将组合物(例如,经工程改造的受体和/或结合剂)递送给受试者和/或细胞群体以影响生理学结果。在特定实施方案中,治疗导致一种或多种疾病症状的改善(例如,减少、减轻或修复)。所述改善可以是可观察的或可测量的改善,或者可以是受试者的健康状况的总体感受的改善。疾病的治疗可以表示疾病症状的严重程度的降低。在某些实施方案中,治疗可以表示将疾病症状的严重程度降低到与疾病发作之前的水平相当的水平。在某些实施方案中,治疗可以表示疾病症状的短期(例如,暂时或急性)和/或长期(例如,持续或慢性)减少。在某些实施方案中,治疗可以表示疾病症状的缓解。在某些实施方案中,治疗可以表示处于发生特定疾病的风险中的受试者的预防性治疗,以便预防疾病发展。预防疾病发展可以表示完全预防疾病症状,延迟疾病发作,减轻随后发展的疾病的症状的严重程度,或减少疾病发展的可能性。
59.本文中使用的“管理”或“控制”表示使用本文所涵盖的组合物或方法来改善患有特定疾病的个体的生活质量。在某些实施方案中,本文描述的组合物和方法为遭受疼痛的受试者提供镇痛。
[0060]“治疗有效量”是达到期望的治疗结果所需的组合物的量。治疗有效量可以根据诸如、但不限于疾病状态以及受试者的年龄、性别和体重等因素而变化。通常,治疗有效量也是其中治疗有益效果超过组合物的任何毒性或有害作用的量。“治疗有效量”包括有效治疗受试者的组合物的量。
[0061]“增加”表示与参考或对照水平相比至少5%的值的增加(例如,增加的结合亲和力、增加的生理学应答、增加的治疗效果等)。例如,增加可以包括5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、70%、80%、90%、100%、150%、200%、250%、500%、1000%或更多的增加。增加还意指比参考或对照水平高1.1、1.2、1.5、2、3、4、5、6、7、8、9、10、15、20、30倍或更多倍(例如,500倍、1000倍)的增加。
[0062]“减少”、“降低”、“减小”或其同义词表示与参考或对照水平相比至少5%的值的减少(例如,减少的结合亲和力、减少的生理学应答、减少的治疗效果、受试者中疼痛的减少等)。例如,减少可以包括5%、6%、7%、8%、9%、10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、70%、80%、90%、100%、150%、200%、250%、500%、1000%或更多的减
少。减少还意指比参考或对照水平低1.1、1.2、1.5、2、3、4、5、6、7、8、9、10、15、20、30倍或更多倍(例如,500倍、1000倍)的减少。
[0063]“维持”、“保留”、“保持”或“无变化”或“无实质性变化”或“无实质性减少”通常表示,与媒介物或对照分子/组合物引起的效果相当的生理学和/或治疗效果。相当的应答是与参考应答没有显著差异或可测量的差异的应答。
[0064]
术语“参考”或“对照”水平在本文中可互换地使用,并且表示在未用本文描述的组合物治疗的受试者或样品中或在已经用媒介物对照治疗的受试者或样品中的特定生理学和/或治疗效果的值。在某些实施方案中,参比水平表示在施用本文描述的组合物之前在受试者或样品中测量的特定生理学和/或治疗效果的值(例如,基线水平)。
[0065]
本文中使用的“配体”表示结合另一种较大分子的分子。在某些实施方案中,所述配体结合受体。在某些实施方案中,所述配体与所述受体的结合会改变所述受体的功能——以活化或抑制其功能。在某些实施方案中,所述配体与受体诸如配体门控离子通道(lgic)的结合会导致所述离子通道的打开或关闭。
[0066]“受体-配体结合”和“配体结合”在本文中可互换地使用,并且表示受体(例如,lgic)与配体之间的物理相互作用。本文中使用的术语“配体”可以表示内源性的或天然存在的配体。例如,在某些实施方案中,配体表示神经递质(例如,λ-氨基丁酸(gaba)、乙酰胆碱、血清素等)和信号传递中间体(例如,4,5-二磷酸磷脂酰肌醇(pip2)),氨基酸(例如,甘氨酸)或核苷酸(例如,atp)。在某些实施方案中,配体可以表示非天然的、即合成的或非天然存在的配体(例如,结合剂)。例如,在某些实施方案中,配体表示小分子。通过本领域已知的多种方法(例如,检测与放射性地标记的配体的缔合),可以测量配体结合。
[0067]“结合亲和力”通常表示受体的单个结合位点与配体之间的非共价相互作用的总和的强度。除非另外指出,否则本文中使用的“结合亲和力”表示反映结合对(例如,受体和配体)的成员之间的1:1相互作用的固有结合亲和力。分子x对它的配偶体y的亲和力通常可以由解离常数(kd)表示。通过本领域已知的常见方法(包括本文描述的那些),可以测量亲和力。
[0068]
术语“特异性结合亲和力”或“特异性结合”在本说明书和权利要求书中互换使用,并且表示在成对的分子物质(例如,受体和配体)之间发生的结合。当所述两种物质的相互作用产生非共价结合的复合物时,发生的结合通常是静电结合、氢键合的结合或亲脂相互作用的结果。在不同的实施方案中,一种或多种物质之间的特异性结合是直接的。在一个实施方案中,特异性结合的亲和力比背景结合(非特异性结合)大了约2倍、比背景结合大了约5倍、比背景结合大了约10倍、比背景结合大了约20倍、比背景结合大了约50倍、比背景结合大了约100倍或比背景结合大了约1000倍或更多。
[0069]“信号传递”表示由于配体与受体的结合(例如,由于结合剂与本文描述的经工程改造的受体的结合)而引起的生化或生理学应答。
[0070]
术语“野生型”或“天然的”是技术人员理解的本领域的术语,并且是指不同于突变体或变体形式的在自然界中发生的生物体、菌株、基因、蛋白或特征的典型形式。例如,野生型蛋白是在自然界中发生的该蛋白的典型形式。
[0071]
术语“非天然的”、“变体”和“突变体”在本说明书和权利要求书中互换使用以表示天然的或野生型组合物的突变体,例如与天然的或野生型序列具有小于100%序列同一性
的变体多肽。
[0072]
氨基酸修饰可以是氨基酸置换、氨基酸缺失和/或氨基酸插入。氨基酸置换可以是保守的氨基酸置换或非保守的氨基酸置换。保守替换(也称为保守突变、保守置换或保守变异)是这样的蛋白的氨基酸置换:其将给定的氨基酸变成具有类似生化性能(例如电荷、疏水性和大小)的不同氨基酸。本文中使用的“保守变异”表示将一个氨基酸残基用另一种生物学上类似的残基替换。保守变异的例子包括:一个疏水残基诸如异亮氨酸、缬氨酸、亮氨酸或甲硫氨酸置换另一个疏水残基;或一个极性残基置换另一个极性残基,诸如精氨酸置换赖氨酸、谷氨酸置换天冬氨酸、或谷氨酰胺置换天冬酰胺等。保守置换的其它示例性例子包括以下变化:丙氨酸变为丝氨酸;精氨酸变为赖氨酸;天冬酰胺变为谷氨酰胺或组氨酸;天冬氨酸盐变为谷氨酸盐;半胱氨酸变为丝氨酸;谷氨酰胺变为天冬酰胺;谷氨酸盐变为天冬氨酸盐;甘氨酸变为脯氨酸(praline);组氨酸变为天冬酰胺或谷氨酰胺;异亮氨酸变为亮氨酸或缬氨酸;亮氨酸变为缬氨酸或异亮氨酸;赖氨酸变为精氨酸,谷氨酰胺,或谷氨酸盐;甲硫氨酸变为亮氨酸或异亮氨酸;苯丙氨酸变为酪氨酸,亮氨酸或甲硫氨酸;丝氨酸变为苏氨酸;苏氨酸变为丝氨酸;色氨酸变为酪氨酸;酪氨酸变为色氨酸或苯丙氨酸;缬氨酸变为异亮氨酸或亮氨酸,等。
[0073]
术语“亲本”或“起始”在本说明书和权利要求书中互换使用以表示最初的组合物或蛋白,其被突变、修饰或衍生化,以建立具有新颖性能的经工程改造的组合物。在某些实施方案中,所述亲本蛋白是嵌合蛋白。
[0074]
术语“经工程改造的”在本说明书和权利要求书中用于表示非天然存在的组合物或蛋白,其具有与其来源亲本组合物或蛋白不同的性能。
[0075]
一般而言,“序列同一性”或“序列同源性”分别表示两个多核苷酸或多肽序列的核苷酸与核苷酸或氨基酸与氨基酸的对应关系。通常,用于确定序列同一性的技术包括:确定多核苷酸的核苷酸序列和/或确定由其编码的氨基酸序列,并将这些序列与第二个核苷酸或氨基酸序列进行对比。两个或多个序列(多核苷酸或氨基酸)可以通过确定其“同一性百分比”来进行对比。两个序列(无论是核酸序列还是氨基酸序列)的同一性百分比是两个比对序列之间的精确匹配数目除以较短序列的长度并且乘以100。例如,通过使用可从国立卫生研究院(national institutes of health)获得的高级blast计算机程序(包括版本2.2.9)对比序列信息,也可以确定同一性百分比。blast程序是基于karlin和altschul,proc.natl.acad.sci.usa 87:2264-2268(1990)的比对方法,并且如在以下文献中所讨论:altschul,等人,j.mol.biol.215:403-410(1990);karlin和altschul,proc.natl.acad.sci.usa 90:5873-5877(1993);和altschul等人,nucleic acids res.25:3389-3402(1997)。简而言之,blast程序将同一性定义为相同的比对符号(通常为核苷酸或氨基酸)的数目除以两个序列中的较短者中的符号的总数。该程序可以用于确定在所对比的蛋白的整个长度上的同一性百分比。提供默认参数以优化用短查询序列的搜索,例如用blastp程序。该程序还允许使用seg过滤器屏蔽查询序列的区段,如通过wootton和federhen,computers and chemistry 17:149-163(1993)的seg程序所确定的。期望的序列同一性程度的范围为大约80%到100%以及插入的整数值。通常,公开的序列与要求保护的序列之间的同一性百分比为至少80%、至少85%、至少90%、至少95%或至少98%。
[0076]
本文中使用的“基本上相同的”表示具有85%或更多、例如90%或更多、例如95%、
96%、97%、98%、99%、99.5%、99.9%或100%的序列同一性,其中所述组合物的活性不会被导致序列同一性差异的序列修饰改变。
[0077]
本文中使用的术语“启动子”表示指导可操作地连接的核酸的转录的一个或多个核酸控制序列。启动子可以包括在转录起始位点附近的核酸序列,诸如tata元件。启动子还可以包括可以被转录因子结合的顺式作用多核苷酸序列。“组成型”启动子是在大多数环境和发育条件下有活性的启动子。“诱导型”启动子是在环境或发育调节下有活性的启动子。术语“可操作地连接”表示在核酸表达控制序列(诸如启动子、或转录因子结合位点的阵列)和第二核酸序列之间的功能连接,其中所述表达控制序列指导与第二序列对应的核酸的转录。
[0078]
本文中使用的术语“病毒性载体”、“病毒载体”或“基因递送载体”表示作为核酸递送媒介物起作用的病毒颗粒,并且其包含被包装在病毒粒子内的核酸(例如,aav表达盒)。本公开内容的示例性病毒载体包括腺病毒载体、腺相关病毒载体(aav)、慢病毒载体和逆转录病毒载体。
[0079]
本文中使用的“神经元活性”、“神经元的活性”、“神经元点火”及其变体和同义词表示由神经元的刺激或激发引起的电活动性。在某些实施方案中,使用自动化的或手工的膜片箝技术测量神经元活性。在某些实施方案中,确定神经元活性包括确定兴奋性突触后电位(epsp)、抑制性突触后电位(ipsp)和/或神经元的动作电位。在某些实施方案中,神经元的活性水平依赖于兴奋性突触后电位(epsp)、抑制性突触后电位(ipsp)和/或动作电位,或者受兴奋性突触后电位(epsp)、抑制性突触后电位(ipsp)和/或动作电位影响。
[0080]
本文中使用的“神经学疾病”或“神经学障碍”表示神经系统的疾病或障碍。在某些实施方案中,所述神经学疾病与脑、脊髓、神经或神经系统的任何组分中的结构、生化和/或电异常有关,由所述异常造成,或起因于所述异常。
[0081]
本文中使用的疾病的“征象”表示被视为指示疾病状况的身体或心理特征。在某些实施方案中,征象是疾病的客观指征。在某些实施方案中,由患者以外的人(诸如医生)客观地评价、检查、观察或测量征象。
[0082]
本文中使用的疾病的“症状”表示被视为指示疾病状况的身体或心理特征,特别是患者显而易见的这样的特征。在某些实施方案中,所述症状由患者主观地评价。例如,在某些实施方案中,所述症状是疼痛。
[0083]
本文中使用的“效能”表示产生蛋白(诸如lgic)的特定活性水平所需的配体的量。在某些实施方案中,蛋白(诸如lgic)的活性表示离子通道的打开或关闭。在某些实施方案中,确定效能包括确定在特定条件下蛋白(诸如lgic)对配体的半数最大有效浓度(ec50)。ec50表示在特定暴露时间以后诱导基线和最大值之间的部分应答的配体的浓度。
[0084]
本文中使用的“效力”表示在有配体存在下蛋白(诸如lgic)的活性的量度。在某些实施方案中,效力表示在特定条件下,诸如在有特定浓度的配体存在下,穿过lgic的电流的量。在某些实施方案中,确定效力包括确定穿过受体的电流的量,和/或受体的基本电流强度。
[0085]
本文中使用的“应答性”表示在有配体存在下蛋白(诸如lgic)的总功能的量度。确定应答性可以包括确定和考虑一种或多种因素,诸如蛋白的效能、效力和亚细胞定位。
[0086]
c.经工程改造的受体
[0087]
本公开内容涉及经工程改造的受体、经工程改造的受体突变体及其使用方法。本文中使用的术语“受体”表示位于细胞的表面上并且可以介导向细胞和/或自细胞的信号传递的任何蛋白。术语“经工程改造的受体”在本文中用于表示已经经过实验改变使得其在物理上和/或在功能上不同于对应的亲本受体的受体。在某些实施方案中,所述亲本受体是野生型受体。术语“野生型受体”在本文中用于表示具有与在自然界中发现的蛋白的多肽序列相同的多肽序列的受体。野生型受体包括天然存在于人类中的受体以及天然存在于其它真核生物(例如原生生物、真菌、植物或动物,例如酵母、昆虫、线虫、海绵、哺乳动物、非哺乳动物脊椎动物)中的直系同源物。在某些实施方案中,所述亲本受体是非天然受体;也就是说,它是在自然界中不存在的受体,例如,从野生型受体工程改造而来的受体。例如,亲本受体可以是包含来自一种野生型受体的一个或多个亚基和来自第二种野生型受体的一个或多个亚基的经工程改造的受体。因此,所得的蛋白包含来自两种或更多种野生型受体的亚基。因此,在某些实施方案中,所述亲本受体是嵌合受体。本公开内容的经工程改造的受体包括例如亲本受体、亲本受体突变体和开关受体。
[0088]
在某些方面,本公开内容的经工程改造的受体包含相对于对应的亲本受体的至少一个氨基酸突变,例如,在野生型受体的一个或多个结构域中的一个或多个突变。“氨基酸突变”意指氨基酸序列相对于对应的亲本序列的任何差异,例如氨基酸置换、缺失和/或插入。在某些实施方案中,所述经工程改造的受体与对应的亲本受体共享约99%、约98%、约95%、约90%、约85%、约80%、约70%、约60%、约50%或更少的序列同一性,包括位于之间的所有值和子范围。在某些实施方案中,所述亲本受体突变体与对应的亲本受体具有85%或更多的序列同一性,例如,90%或更多或95%或更多,例如,与对应的亲本受体具有约96%、约97%、约98%或约99%同一性,包括位于之间的所有值和子范围。在某些实施方案中,通过易错pcr产生经工程改造的受体(例如,亲本受体突变体)。
[0089]
在某些实施方案中,所述氨基酸突变是相对于对应亲本受体的功能缺失氨基酸突变。“功能缺失”氨基酸突变表示这样的一个或多个突变:其相对于亲本受体降低、基本上减少或消除经工程改造的受体的功能,例如通过相对于内源性配体与亲本受体的结合降低内源性配体与经工程改造的受体的结合,或通过降低在经工程改造的受体下游的一个或多个信号传递途径的活性,所述信号传递途径通常响应于结合剂与对应的亲本受体的结合而活化。
[0090]
在某些实施方案中,所述氨基酸突变是相对于对应亲本受体的功能获得氨基酸突变。“功能获得”氨基酸突变表示这样的一个或多个突变:其相对于亲本受体改变经工程改造的受体的功能,例如通过相对于内源性配体与亲本受体的结合改变或增强经工程改造的受体对结合剂的亲和力,或通过相对于内源性配体与对应的亲本受体的结合改变或增强信号传递途径的活性,所述信号传递途径响应于结合剂与经工程改造的受体的结合而活化。在某些实施方案中,功能获得突变导致经工程改造的受体对结合剂的亲和力增加。在特定实施方案中,功能获得突变导致经工程改造的受体对激动剂结合剂的亲和力增加。在某些实施方案中,功能获得突变导致拮抗剂结合剂在与经工程改造的受体结合后充当激动剂结合剂(例如,导致激动剂信号传递途径而不是拮抗剂信号传递途径的活化)。在某些实施方案中,功能获得突变导致调节剂结合剂在与经工程改造的受体结合后充当激动剂结合剂。在某些实施方案中,本公开内容的主题经工程改造的受体包含相对于对应亲本受体的一个
或多个功能缺失氨基酸突变和一个或多个功能获得氨基酸突变。
[0091]
在某些实施方案中,功能缺失突变和功能获得突变处于相同残基处,即它们是相同突变。在其它实施方案中,功能缺失突变和功能获得突变是在不同氨基酸残基处的突变。在某些实施方案中,包含功能缺失突变和/或功能获得突变的主题经工程改造的受体与对应的亲本受体(例如野生型受体或非天然受体)共享约99%、约98%、约95%、约90%、约85%、约80%、约70%、约60%、约50%或更少的序列同一性。在某些实施方案中,所述主题经工程改造的受体与对应的亲本受体共享85%或更多的序列同一性,例如85%、90%或95%或更多的序列同一性,在某些情况下96%、97%、98%或更多的序列同一性,例如99%或99.5%或更多的序列同一性,包括位于之间的所有值和子范围。
[0092]
在某些方面,本公开内容的经工程改造的受体包括由一个或多个氨基酸序列的组合产生的受体,例如来自一种野生型受体的亚基与一个或多个氨基酸序列,例如来自第二种野生型受体的亚基。换而言之,经工程改造的受体包含彼此异源的氨基酸序列,其中“异源”意指不在自然界中一起出现。这样的受体在本文中被称作“嵌合受体”。在某些实施方案中,嵌合受体充当从其产生本公开内容的经工程改造的受体的亲本受体。
[0093]
在某些实施方案中,亲本受体突变体表现出增加的对激动剂结合剂的亲和力。在某些实施方案中,在与野生型受体结合时充当拮抗剂或调节剂的配体或结合剂在与亲本受体突变体结合时充当激动剂。
[0094]
在某些实施方案中,所述经工程改造的受体是“配体门控的离子通道”或lgic。lgic表示在被特异性配体(例如,化学剂或结合剂)活化后允许离子穿过的一大组跨膜蛋白。lgic由至少两个结构域组成:配体结合结构域和跨膜离子孔结构域。配体与lgic的结合会导致lgic的活化和离子孔的打开。配体结合会造成通道对一种或多种特定离子的渗透率的剧烈变化;当通道无活性或关闭时,基本上没有离子可以穿过通道,但是在配体结合后每秒多达107个离子可以穿过。在某些实施方案中,lgic对胞外配体(例如,神经递质)做出应答并促进离子向胞质溶胶中的流入。在某些实施方案中,lgic对胞内配体(例如,核苷酸诸如atp和信号传递中间体诸如pip2)做出应答并促进离子从胞质溶胶向胞外环境中的流出。重要的是,lgic的活化导致离子(例如,ca
2
、na
、k
、cl-等)跨细胞膜的运输,且不导致配体本身的运输。
[0095]
lgic受体包含多个亚基并且可以是同聚体受体或异聚体受体。同聚体受体包含全部是相同类型的亚基。异聚体受体包含这样的亚基:其中至少一个亚基不同于在受体内包含的至少一个其它亚基。例如,甘氨酸受体包含5个亚基,其中有两种类型:α-亚基,其中有四个异形体(α
1-α4);和β-亚基,其中有单个已知的异形体。一种示例性的同聚体glyr是包含5个α
1-glyr亚基的glyr。类似地,同聚体gabaa受体可以包含β
3-gabaa亚基,并且nachr受体可以包含α
7-nachr亚基。一种示例性的异聚体glyr可以包含一个或多个α-亚基和一个或多个β-亚基(例如,α1β-glyr)。在表1中示出了实施例lgic受体的亚基。
[0096]
表1:lgic受体和亚基
[0097]
[0098]
[0099][0100]
适合用在特定实施方案中的lgic家族的示例性例子包括、但不限于cys-环受体诸如甘氨酸受体(glyr)、血清素受体(例如,5-ht3受体)、λ-氨基丁酸a(gaba-a)受体和烟碱乙酰胆碱受体(nachr);以及酸感知(质子门控的)离子通道(asic)、上皮钠通道(enac)、离子型谷氨酸受体、ip3受体、p2x受体、兰尼碱受体和锌活化通道(zac)。
[0101]
适合用于与本文所述的方法一起使用的lgic的具体非限制性例子包括:htr3a;htr3b;htr3c;htr3d;htr3e;asic1;asic2;asic3;scnn1a;scnn1b;scnn1d;scnn1g;gabra1;gabra2;gabra3;gabra4;gabra5;gabra6;gabrb1;gabrb2;gabrb3;gabrg1;gabrg2;gabrg3;gabrd;gabre;gabrq;gabrp;gabrr1;gabrr2;gabrr3;glra1;glra2;glra3;glra4;glrb;gria1;gria2;gria3;gria4;grid1;grid2;grik1;grik2;grik3;grik4;grik5;grin1;grin2a;grin2b;grin2c;grin2d;grin3a;grin3b;itpr1;itpr2;itpr3;chrna1;chrna2;
chrna3;chrna4;chrna5;chrna6;chrna7;chrna9;chrna10;chrnb1;chrnb2;chrnb3;chrnb4;chrng;chrnd;chrne;p2rx1;p2rx2;p2rx3;p2rx4;p2rx5;p2rx6;p2rx7;ryr1;ryr2;ryr3;和zacn。
[0102]
trpv1、trpm8和p2x2是共享结构特征以及门控原理的大lgic家族的成员。例如,类似于trpv1的trpv4也是由热而不是由辣椒辣素触发;并且p2x3是由atp触发,但比p2x2更快脱敏。因此,trpv1、trpm8和p2x2是适合用于特定实施方案的lgic的非限制性例子。
[0103]
在一个实施方案中,所述经工程改造的受体是trpv1或trpm8受体或其突变蛋白。trpv1和trpm8是由周围神经系统的感受伤害的神经元表达的辣椒素和薄荷醇受体。认为两个通道作为非选择性的、钠和钙可渗透的同源四聚体起作用。另外,两个通道和它们的主要激动剂——分别是辣椒辣素和冷却化合物(诸如薄荷醇)——几乎不存在于中枢神经系统中。辣椒辣素和一些冷却化合物(包括薄荷醇和icilin)含有光不稳定的封闭基团的潜在受体位点。光不稳定的封闭基团与这样的受体的缔合将产生配体门控的离子通道,其中光通过释放活性配体而充当间接触发物。
[0104]
在一个实施方案中,所述经工程改造的受体是p2x2受体或其突变蛋白。p2x2是通过其慢脱敏速率来区分的atp-门控的非选择性阳离子通道。p2x2可以用作去极化电流的选择性可寻址源并且呈现用于产生完全缺乏天然激动剂的经工程改造的通道-配体组合的平台。
[0105]
可用于产生本公开内容的经工程改造的受体的野生型lgic受体的序列的非限制性例子包括以下。在序列中,信号肽是斜体,配体结合结构域是粗体,且离子孔结构域带下划线:
[0106]
在某些实施方案中,所述野生型lgic受体是人α1甘氨酸受体(glyrα1)(genbank登记号np_001139512.1,seq id no:2),其由glra1基因(genbank登记号nm_001146040.1(seq id no:1)编码:
[0107][0108][0109]
在某些实施方案中,所述野生型lgic受体是人烟碱胆碱能受体α7亚基(α7-nachr)(genbank登记号np_000737.1,seq id no:4),其由chrna7基因(genbank登记号nm_000746.5(seq id no:3)编码:
[0110][0111]
在某些实施方案中,所述野生型lgic受体是人5-羟基色胺受体3a(5ht3a,genbank登记号np_998786.2,seq id no:6),其由htr3a基因(genbank登记号nm_213621.3,seq id no:5)编码:
[0112][0113]
在某些实施方案中,所述野生型lgic受体是人5-羟基色胺受体3b(5ht3b genbank登记号np_006019.1,seq id no:57),其由htr3b基因(genbank登记号nm_006028.4,seq id no:56)编码:
[0114]
[0115]
在某些实施方案中,所述野生型lgic受体是人γ-氨基丁酸受体a(gaba-a)、亚基β-3(gaba-aβ3)(genbank登记号np_000805.1,seq id no:8),其由gabrb3基因(genbank登记号nm_000814.5,seq id no:7)编码:
[0116][0117]
在某些实施方案中,所述野生型lgic受体是人gaba-a,亚基rho1(ρ1)(gaba-aρ1)(genbank登记号np_002033.2,seq id no:10),其由gabrr1基因(genbank登记号nm_002042.4,seq id no:9)编码:
[0118][0119][0120]
在某些实施方案中,所述野生型lgic受体是人gaba-a,亚基rho2(ρ2)(gaba-aρ2)(genbank登记号np_002034.3,seq id no:12),其由gabrr2基因(genbank登记号nm_002043.4,seq id no:11)编码:
[0121][0122]
在某些实施方案中,所述野生型lgic受体是人gaba-a,亚基rho3(ρ3)(gaba-aρ3)(genbank登记号np_001099050.1,seq id no:14),其由gabrr3基因(genbank登记号nm_001105580.2,seq id no:13)编码:
[0123][0124]
在某些方面,主题经工程改造的受体是嵌合受体。在某些实施方案中,所述嵌合受体包含来自至少在第一lgic处的配体结合结构域序列以及离子孔传导结构域序列,或更简单地,来自至少第二lgic的“离子孔结构域序列”。在某些实施方案中,第一lgic和第二lgic是cys-环受体。cys-环受体的配体结合结构域序列和离子孔结构域序列是本领域众所周知的,并且可以通过使用公众可得到的软件(例如pubmed、genbank、uniprot等)从文献中容易地鉴别。在以上描述的序列中,配体结合结构域是粗体,且离子孔结构域带下划线。
[0125]
在某些实施方案中,所述嵌合受体的配体结合结构域包含人甘氨酸受体的配体结合结构域序列。在某些实施方案中,所述人甘氨酸受体是人glyrα1(seq id no:2)。在某些这样的实施方案中,所述配体结合结构域包含glyrα1的约氨基酸29-235,例如seq id no:2的氨基酸29-235、氨基酸29-240、氨基酸29-246、氨基酸29-248、氨基酸29-250或氨基酸29-252。在某些这样的实施方案中,所述配体结合结构域基本上由seq id no:2的氨基酸29-235组成,基本上由seq id no:2的氨基酸29-240组成,基本上由seq id no:2的氨基酸29-246组成,基本上由seq id no:2的氨基酸29-248组成,基本上由seq id no:2的氨基酸29-250组成,基本上由seq id no:2的氨基酸29-252组成。在某些实施方案中,所述离子孔结构域序列来自除人glyrα1以外的cys-环受体。
[0126]
在某些实施方案中,所述嵌合受体的配体结合结构域包含人烟碱胆碱能受体的配
体结合结构域序列。在某些实施方案中,所述人烟碱胆碱能受体是人α7-nachr。在某些这样的实施方案中,所述配体结合结构域包含α7-nachr(seq id no:4)的约氨基酸23-220,例如seq id no:4的氨基酸23-220、氨基酸23-226、氨基酸23-229、氨基酸23-230,在某些情况下氨基酸23-231。在某些这样的实施方案中,所述配体结合结构域基本上由seq id no:4的氨基酸23-220组成,基本上由seq id no:4的氨基酸23-226组成,基本上由seq id no:4的氨基酸23-229组成,基本上由seq id no:4的氨基酸23-230组成,或基本上由seq id no:4的氨基酸23-231组成。在某些实施方案中,所述离子孔结构域序列来自除人α7-nachr以外的cys-环受体。
[0127]
在某些实施方案中,所述嵌合受体的配体结合结构域包含人血清素受体的配体结合结构域序列。在某些实施方案中,所述人血清素受体是人5ht3a或5ht3b。在某些这样的实施方案中,所述配体结合结构域包含5ht3a(seq id no:6)的约氨基酸23-247,例如seq id no:6的氨基酸23-240、氨基酸30-245、氨基酸23-247、氨基酸23-250,在某些情况下氨基酸30-255。在某些实施方案中,所述配体结合结构域基本上由seq id no:6的氨基酸23-240组成,基本上由seq id no:6的氨基酸23-245组成,基本上由seq id no:6的氨基酸30-247组成,基本上由seq id no:6的氨基酸23-250组成,基本上由seq id no:6的氨基酸23-255组成。在某些这样的实施方案中,所述配体结合结构域包含5ht3b(seq id no:57)的约氨基酸21-239,例如seq id no:57的氨基酸21-232、氨基酸21-235、氨基酸21-240、氨基酸21-245,在某些情况下氨基酸21-247。在某些实施方案中,所述配体结合结构域基本上由seq id no:57的氨基酸21-239组成,基本上由seq id no:57的氨基酸21-232组成,基本上由seq id no:57的氨基酸21-235组成,基本上由seq id no:57的氨基酸21-240组成,基本上由seq id no:57的氨基酸21-245组成。在某些实施方案中,所述离子孔结构域序列来自除人5-羟基色胺受体3以外的cys-环受体。
[0128]
在某些实施方案中,所述嵌合受体的配体结合结构域包含人gaba受体的配体结合结构域序列。在某些实施方案中,所述人gaba受体是人gaba-aβ3。在某些这样的实施方案中,所述配体结合结构域包含gaba-aβ3(seq id no:8)的约氨基酸26-245,例如seq id no:8的氨基酸26-240、氨基酸26-245、氨基酸26-248、氨基酸26-250,在某些情况下氨基酸26-255。在某些这样的实施方案中,所述配体结合结构域基本上由seq id no:8的氨基酸26-240组成,基本上由seq id no:8的氨基酸26-245组成,基本上由seq id no:8的氨基酸26-248组成,基本上由seq id no:8的氨基酸26-250组成,或基本上由seq id no:8的氨基酸26-255组成。在某些实施方案中,所述离子孔结构域序列来自除人gaba-a受体以外的cys-环受体。
[0129]
在某些实施方案中,配体结合结构域与其融合的离子孔结构域传导阴离子,例如,它包含人甘氨酸受体或人血清素受体的离子孔结构域序列。在其它实施方案中,配体结合结构域与其融合的离子传导孔结构域传导阳离子,例如,它包含人乙酰胆碱受体或人γ-氨基丁酸受体a的离子孔结构域序列。
[0130]
在某些实施方案中,所述离子孔结构域包含人甘氨酸受体的离子孔结构域序列。在某些实施方案中,所述人甘氨酸受体是人glyrα1。在某些这样的实施方案中,所述离子孔结构域包含glyrα1(seq id no:2)的约氨基酸245-457,例如seq id no:2的氨基酸240-457、氨基酸245-457、氨基酸248-457、氨基酸249-457、氨基酸250-457、氨基酸255-457或氨
基酸260-457。在某些这样的实施方案中,所述离子孔结构域基本上由seq id no:2的氨基酸245-457组成,基本上由seq id no:2的氨基酸248-457组成,基本上由seq id no:2的氨基酸249-457组成,或基本上由seq id no:2的氨基酸250-457组成。
[0131]
在某些实施方案中,所述离子孔结构域包含人烟碱胆碱能受体的离子孔结构域序列。在某些实施方案中,所述人烟碱胆碱能受体是人α7-nachr。在某些这样的实施方案中,所述离子孔结构域包含α7-nachr(seq id no:4)的约氨基酸230-502,例如氨基酸227-502、氨基酸230-502、氨基酸231-502、氨基酸232-502或氨基酸235-502。在某些这样的实施方案中,所述离子孔结构域基本上由seq id no:4的氨基酸227-502组成,基本上由seq id no:4的氨基酸230-502组成,基本上由seq id no:4的氨基酸231-502组成,基本上由seq id no:4的氨基酸232-502组成,或基本上由seq id no:4的氨基酸235-502组成。
[0132]
在某些实施方案中,所述离子孔结构域包含人血清素受体的离子孔结构域序列。在某些实施方案中,所述人血清素受体是人5ht3a或5ht3b。在某些这样的实施方案中,所述离子孔结构域包含5ht3a(seq id no:6)的约氨基酸248-516,例如seq id no:6的氨基酸240-516、氨基酸245-516、氨基酸248-516、氨基酸250-516或氨基酸255-516。在某些这样的实施方案中,所述离子孔结构域基本上由seq id no:6的氨基酸240-516组成,基本上由seq id no:6的氨基酸245-516组成,基本上由seq id no:6的氨基酸248-516组成,基本上由seq id no:6的氨基酸250-516组成,或基本上由氨基酸253-516组成。在某些这样的实施方案中,所述离子孔结构域包含5ht3b(seq id no:57)的约氨基酸240-441,例如seq id no:57的氨基酸230-441、氨基酸235-441、氨基酸240-441、氨基酸245-441或氨基酸250-441。在某些这样的实施方案中,所述离子孔结构域基本上由seq id no:57的氨基酸230-441组成,基本上由seq id no:57的氨基酸235-441组成,基本上由seq id no:57的氨基酸240-441组成,基本上由seq id no:57的氨基酸245-441组成,或基本上由氨基酸250-441组成。
[0133]
在某些实施方案中,所述离子孔结构域包含人gaba受体的离子孔结构域序列。在某些实施方案中,所述人gaba受体是人gaba-aβ3。在某些这样的实施方案中,所述离子孔结构域包含gaba-aβ3(seq id no:8)的约氨基酸246-473,例如seq id no:8的氨基酸240-473、氨基酸245-473、氨基酸247-473、氨基酸250-473或氨基酸253-473。在某些这样的实施方案中,所述离子孔结构域基本上由seq id no:8的氨基酸240-473、seq id no:8的氨基酸245-473、seq id no:8的氨基酸247-473、seq id no:8的氨基酸250-473或seq id no:8的氨基酸253-473组成。
[0134]
在某些实施方案中,主题嵌合的配体门控的离子通道的离子孔结构域包含与离子孔结构域的m2-m3接头结构域异源的m2-m3接头结构域。“m2-m3接头结构域”或“m2-m3接头”是指在lgic的离子孔结构域内的序列,其在其氨基(n)端侧接受体的跨膜结构域2(m2)的c-端末端并且在其羧基(c)端侧接受体的跨膜结构域3(m3)的n-端末端。从本领域和/或通过使用任何公众可得到的蛋白分析工具,例如expasy、uniprot等,可以容易地确定lgic的m2-m3接头。通常,当嵌合受体的离子孔结构域包含异源m2-m3接头时,m2-m3接头衍生自与嵌合受体的配体结合结构域相同的受体。例如,当主题配体门控的离子通道包含来自achr的配体结合结构域和来自glyr的离子孔结构域时,主题配体门控的离子通道可以包含来自glyr的离子孔结构域序列,但是除了m2-m3接头以外,其替代性地衍生自achr。在某些实施方案中,所述离子孔结构域来自glyrα1,且m2-m3接头来自α7-nachr。在某些这样的实施方案中,
从glyrα1除去的m2-m3接头序列是glyrα1(seq id no:2)的约氨基酸293-311,例如氨基酸304-310、293-306、298-310、305-311等。在某些这样的实施方案中,插入的m2-m3接头是α7-nachr(seq id no:4)的约氨基酸281-295,例如氨基酸290-295、281-290、281-295、287-292等,或与α7-nachr的氨基酸281-295具有约95%同一性或更多的序列。
[0135]
在某些实施方案中,主题嵌合的配体门控的离子通道的配体结合结构域包含与配体结合结构域的cys-环序列异源的cys-环结构域序列。“cys-环结构域序列”或“cys-环序列”是指在cys-环lgic的配体结合结构域内的结构域,其形成在n-端和c-端侧接半胱氨酸的环结构。不希望受理论的约束,据信,在配体与配体结合结构域结合后,cys-环在结构上移动到与m2-m3环非常接近,此移动介导在胞外结构域中的配体结合向离子孔结构域中的信号转导的生物物理学翻译(如在miller和smart,trends in pharmacological sci 2009:31(4)中所综述的)。用异源cys-环序列对内源cys-环序列的置换可以使lgic的电导率增加1.5倍或更多,例如至少2倍、3倍或4倍,在某些情况下至少5倍或6倍,并且在某些剂量下至少7倍、8倍、9倍或10倍。从本领域和/或通过使用任何公众可得到的蛋白分析工具,例如expasy、uniprot等,可以容易地确定cys-环受体的cys-环结构域。通常,当嵌合受体的配体结合结构域包含异源cys-环序列时,cys-环序列衍生自与嵌合受体的离子孔结构域相同的受体。例如,当主题嵌合的配体门控的离子通道包含来自achr的配体结合结构域和来自glyr的离子孔结构域时,主题配体门控的离子通道可以包含来自achr的配体结合结构域序列,但是除了cys-环结构域的序列以外,后者替代性地衍生自glyr。在某些实施方案中,所述配体结合结构域来自α7-nachr且所述cys-环序列来自glyrα1。在某些这样的实施方案中,从α7-nachr除去的cys-环序列是α7-nachr(seq id no:4)的约氨基酸150-164,例如α7-nachr的氨基酸150-157。在某些这样的实施方案中,插入的cys环序列是glyrα1(seq id no:2)的约氨基酸166-180,例如glyrα1的氨基酸166-172,或与glyrα1的氨基酸166-180具有约95%或更多同一性的序列。
[0136]
在某些实施方案中,主题嵌合的配体门控的离子通道的配体结合结构域包含与配体结合结构域的β1-2环结构域序列异源的β1-2环结构域序列。“β1-2环结构域序列”或“β1-2环或β1-β2环”是指在cys-环lgic的配体结合结构域内的结构域,其在其n-端侧接β1折叠的c-端且在其c-端侧接β2折叠的n-端。不希望受理论的约束,据信,β1-2环有助于介导胞外结构域中的配体结合向离子孔结构域的生物物理学翻译和随后的信号转导(即,在glyr的情况下的氯离子流入)。据信,在配体结合后,β1-2环与cys-环一起非常接近m2-m3环,以介导胞外结构域中的配体结合向m2-m3环所在的离子孔结构域中的信号转导的生物物理学翻译(如在miller和smart,出处同上中所综述的)。用异源β1-2环序列对内源β1-2环序列的置换可以使lgic的电导率增加1.5倍或更多,例如至少2倍、3倍或4倍,在某些情况下至少5倍或6倍,并且在某些剂量下至少7倍、8倍、9倍或10倍。从本领域和/或通过使用任何公众可得到的蛋白分析工具,例如expasy、uniprot等,可以容易地确定cys-环受体的β1-2环。通常,当嵌合受体的配体结合结构域包含异源β1-2环序列时,β1-2环序列衍生自与嵌合受体的离子孔结构域相同的受体。例如,当主题嵌合的配体门控的离子通道包含来自achr的配体结合结构域和来自glyr的离子孔结构域时,主题配体门控的离子通道可以包含来自achr的配体结合结构域序列,但是除了β1-2环结构域的序列以外,后者替代性地衍生自glyr。在某些实施方案中,所述配体结合结构域来自α7-nachr且所述β1-2环序列来自glyrα1。在某些实
施方案中,从α7-nachr除去的β1-2环序列是α7-nachr(seq id no:4)的约氨基酸67-70,例如α7-nachr的氨基酸67-70、66-71或64-72。在某些实施方案中,插入的β1-2环序列是glyrα1(seq id no:2)的约氨基酸79-85,例如glyrα1的氨基酸81-84、79-85或81-84,或与glyrα1的氨基酸79-85具有约95%或更多同一性的序列。
[0137]
本公开内容的嵌合lgic受体的序列的非限制性例子包括在本文中公开为seq id no:15-seq id no:52的序列。在某些实施方案中,嵌合lgic受体或编码它的多核苷酸与本文的seq id no:15-seq id no:52中提供的序列具有85%或更多的序列同一性,例如,与在seq id no:15-seq id no:52中提供的序列具有90%或更多、93%或更多、或95%或更多(即约96%、约97%、约98%、约99%或约100%)的序列同一性。在序列中,信号肽是斜体,配体结合结构域是粗体,且离子孔结构域带下划线。
[0138]
在某些实施方案中,所述嵌合lgic受体是chrna7/glra1嵌合体(r229连接部),其包含人α7-nachr信号肽(斜体)和配体结合结构域(粗体),后者与人glyrα1离子孔结构域(带下划线)融合:
[0139][0140]
在某些实施方案中,所述嵌合lgic受体是chrna7/glra1(r228连接部)嵌合体,其包含人α7-nachr信号肽(斜体)和配体结合结构域(粗体),后者与人glyrα1离子孔结构域(带下划线)融合:
[0141][0142]
在某些实施方案中,所述嵌合lgic受体是chrna7/glra1(v224连接部)嵌合体,其包含人α7-nachr信号肽(斜体)和配体结合结构域(粗体),后者与人glyrα1离子孔结构域
(带下划线)融合:
[0143][0144][0145]
在某些实施方案中,所述嵌合lgic受体是chrna7/glra1(y233连接部)嵌合体,其包含人α7-nachr信号肽(斜体)和配体结合结构域(粗体),后者与人glyrα1离子孔结构域(带下划线)融合:
[0146][0147]
在某些实施方案中,所述嵌合lgic受体是chrna7/glra1嵌合体(r229连接部),其包含人α7-nachr信号肽(斜体)和配体结合结构域(粗体),后者与包含α7-nachr m2-m3接头(小写字母)的人glyrα1离子孔结构域(带下划线)融合:
[0148]
[0149][0150][0151][0152]
[0153][0153]
或者
[0154][0155]
在某些实施方案中,所述嵌合lgic受体是chrna7/glra1嵌合体,其包含人α7-nachr信号肽(斜体)和含有glyrα1cys-环序列(小写字母)的配体结合结构域(粗体);后者与人glyrα1离子孔结构域(带下划线)融合。在某些实施方案中,所述嵌合lgic受体包含与seq id no:33具有80%或更多、85%或更多、90%或更多、95%或更多、97%或更多、98%或更多、99%或更多或100%的序列同一性的氨基酸序列:
[0156]
[0157][0158][0159]
在某些实施方案中,所述嵌合lgic受体是chrna7/glra1嵌合体,其包含人α7-nachr信号肽(斜体)和含有glyrα1β1-2环序列(小写字母)的配体结合结构域(粗体);后者与人glyrα1离子孔结构域(带下划线)融合:
[0160][0161]
在某些实施方案中,所述嵌合lgic受体是chrna7/glra1嵌合体,其包含人α7-nachr信号肽(斜体)以及含有glyrα1β1-2环序列(小写字母)和cys-环序列(小写字母)的配体结合结构域(粗体);后者与人glyrα1离子孔结构域(带下划线)融合:
[0162]
[0163][0164][0165][0166][0167]
在某些实施方案中,所述嵌合lgic受体是chrna7/glra1嵌合体,其包含人α7-nachr信号肽(斜体)和含有glyrα1β1-2环序列(小写字母)的配体结合结构域(粗体);后者与包含人α7-nachr m2-m3接头(小写字母)的人glyrα1离子孔结构域(带下划线)融合:
[0168][0169][0170]
在某些实施方案中,所述嵌合lgic受体是chrna7/glra1嵌合体,其包含人α7-nachr信号肽(斜体)和含有glyrα1cys-环序列(小写字母)的配体结合结构域(粗体);后者与包含人α7-nachr m2-m3接头(小写字母)的人glyrα1离子孔结构域(带下划线)融合:
[0171][0172]
在某些实施方案中,所述嵌合lgic受体是htr3a/glra1嵌合体(r241连接部),其包含人5ht3a血清素受体信号肽(斜体)和配体结合结构域(粗体),后者与人glyrα1离子孔结构域(带下划线)融合:
[0173][0174]
在某些实施方案中,所述嵌合lgic受体是htr3a/glra1嵌合体(v236连接部),其包含人5ht3a血清素受体信号肽(斜体)和配体结合结构域(粗体),后者与人glyrα1离子孔结
构域(带下划线)融合:
[0175][0176][0177]
在某些实施方案中,所述嵌合lgic受体是gabrb3/glra1嵌合体(y245连接部),其包含人gaba-aβ3信号肽(斜体)和配体结合结构域(粗体),后者与人glyrα1离子孔结构域(带下划线)融合:
[0178][0179]
如以上所讨论的,在某些方面,主题经工程改造的受体包含至少一个氨基酸突变,相对于配体对未突变的亲本受体的效能,所述突变改变了配体对经工程改造的受体的效能。换而言之,一个或多个氨基酸突变,例如功能缺失突变或功能获得突变,使经工程改造的受体对配体的应答性相对于未突变的亲本受体的应答性发生转变。在某些这样的实施方案中,一个或多个突变是在经工程改造的受体的配体结合结构域中。在某些实施方案中,当经工程改造的受体的配体结合结构域是cys-环受体蛋白时,一个或多个氨基酸突变是在与α7-nachr(seq id no:4)的选自由以下成员组成的集合的残基相对应的残基处的置换:w77、y94、r101、w108、y115、t128、n129、v130、l131、q139、l141、y151、s170、w171、s172、s188、y190、y210、c212、c213和y217。在某些实施方案中,一个残基被置换。在某些实施方案中,2、3、4或5个或更多个残基被置换,例如6、7、8、9或10个残基被置换。在某些实施方案中,残基对应于α7-nachr(seq id no:4)的选自由以下成员组成的集合的残基:w77、r101、y115、n129、l131、s170、s172和s188。在某些实施方案中,一个或多个置换是在α7-nachr序列内。
[0180]
在某些实施方案中,一个或多个置换使经工程改造的受体对乙酰胆碱和非天然配
体的应答性降低例如2倍或更多、3倍或更多、4倍或更多、5倍或更多、10倍或更多、20倍或更多、30倍或更多、50倍或更多、或100倍。在某些实施方案中,一个或多个置换是与α7-nachr的r101i、r101s、r101d、y115l、y115m、y115d、y115t、t128m、t128r、t128i、n129i、n129v、n129p、n129w、n129t、n129d、n129e、l131e、l131p、l131t、l131d、l131s、l141s、l141r、w171f、w171h、s172f、s172y、s172r、s172d、c212a、c212l或c213p对应的置换。在其它情况下,一个或多个置换选择性地降低乙酰胆碱在经工程改造的受体上的效能。换而言之,一个或多个置换降低经工程改造的受体对乙酰胆碱的应答性,同时基本上维持对非天然配体的应答性,或相对于它降低经工程改造的受体对非天然配体的应答性,以其它方式使经工程改造的受体对乙酰胆碱的应答性降低2倍或更多,例如3倍、4倍、5倍或更多,在某些情况下10倍、20倍、50倍或100倍或更多。示例性的置换亦即与α7-nachr的l131e、l131s、l131t、l131d或s172d对应的置换。在其它实施方案中,一个或多个置换选择性地降低非天然配体在经工程改造的受体上的效能。换而言之,一个或多个置换降低经工程改造的受体对非天然配体的应答性,同时基本上维持对乙酰胆碱的应答性,或相对于它降低经工程改造的受体对乙酰胆碱的应答性,以其它方式使经工程改造的受体对非天然配体的应答性降低2倍或更多,例如3倍、5倍或更多,在某些情况下10倍、20倍或50倍或更多。示例性的置换包括与α7-nachr的w77m、y115w、s172t或s172c对应的置换。在某些实施方案中,一个或多个置换是在α7-nachr序列内。在某些实施方案中,所述非天然配体选自azd-0328、tc6987、abt-126和facinicline/rg3487。
[0181]
在其它实施方案中,一个或多个置换使经工程改造的受体对乙酰胆碱和/或非天然配体的应答性增加例如2倍或更多、3倍或更多、4倍或更多、5倍或更多、10倍或更多、20倍或更多、30倍或更多、50倍或更多或100倍。示例性的置换包括与l131n、l141w、s170g、s170a、s170l、s170i、s170v、s170p、s170f、s170m、s170t、s170c、s172t、s172c、s188i、s188v、s188f、s188m、s188q、s188t、s188p或s188w对应的置换。在某些情况下,一个或多个置换增加乙酰胆碱和非天然配体的效能,例如与α7-nachr的l131n、s170g、s170a、s170l、s170i、s170v、s170p、s170f、s170m、s170t、s170c、s172t、s188i、s188v、s188f、s188m、s188q和s188t对应的置换。在其它情况下,一个或多个置换选择性地增加乙酰胆碱在经工程改造的受体上的效能。换而言之,相对于它增加经工程改造的受体对非天然配体的应答性,一个或多个置换使经工程改造的受体对乙酰胆碱的应答性增加2倍或更多,例如3倍、4倍或5倍或更多,在某些情况下10倍、20倍、50倍或100倍,例如与α7-nachr的l141w、s172t、s172c、s188p或s188w对应的置换。在某些实施方案中,一个或多个置换是在α7-nachr序列内。在某些实施方案中,所述非天然配体选自azd-0328、tc6987、abt-126和facinicline/rg3487。在再其它情况下,一个或多个置换选择性地增加非天然配体在经工程改造的受体上的效能。换而言之,相对于它增加经工程改造的受体对乙酰胆碱的应答性,一个或多个置换使经工程改造的受体对非天然配体的应答性增加2倍或更多,例如3倍、5倍或更多,在某些情况下10倍、20倍或50倍或更多。
[0182]
在某些实施方案中,在主题经工程改造的受体中突变的氨基酸残基不是与野生型a7 nachr(seq id no:4)的r27、e41、q79、q139、l141、g175、y210、p216、y217或d219对应的氨基酸。在某些实施方案中,在主题经工程改造的受体中突变的氨基酸残基是与野生型a7 nachr(seq id no:4)的r27、e41、q79、q139、l141、g175、y210、p216、y217或d219对应的氨基
酸。在某些实施方案中,所述置换不是与野生型α7nachr中的w77f、w77y、w77m、q79a、q79q、q79s、q79g、y115f、l131a、l131g、l131m、l131n、l131q、l131v、l131f、q139g、q139l、g175k、g175a、g175f、g175h、g175m、g175r、g175s、g175v、y210f、p216i、y217f或d219a对应的置换。在某些实施方案中,所述置换是与野生型α7nachr中的w77f、w77y、w77m、q79a、q79q、q79s、q79g、y115f、l131a、l131g、l131m、l131n、l131q、l131v、l131f、q139g、q139l、g175k、g175a、g175f、g175h、g175m、g175r、g175s、g175v、y210f、p216i、y217f或d219a对应的置换。在某些实施方案中,当这样的置换存在于经工程改造的受体内时,它与本文描述的一个或多个氨基酸突变组合存在。
[0183]
例如,已经发现,α7-nachr(seq id no:4)的残基y94、y115、y151和y190介导天然配体乙酰胆碱的结合。在这些残基处的突变将减少乙酰胆碱的结合且因此是功能缺失突变。相反,α7-nachr的残基w77、y115、n129、v130、l131、q139、l141、s170、y210、c212、c213和y217介导非天然配体azd0328与该受体的结合,且这些残基的突变可能增加azd0328和/或其它配体对该受体的亲和力且因此是功能获得突变。在某些实施方案中,所述主题经工程改造的受体包含在α7-nachr(seq id no:4)的配体结合结构域区域或含有α7-nachr的配体结合结构域区域的嵌合受体的配体结合结构域的一个或多个氨基酸残基中的突变,其中所述一个或多个氨基酸残基选自由以下成员组成的集合:w77、y94、y115、n129、v130、l131、q139、l141、y151、s170、y190、y210、c212、c213和y217。在某些实施方案中,在α7-nachr(seq id no:4)的配体结合结构域区域或含有α7-nachr的配体结合结构域区域的嵌合受体的配体结合结构域的一个或多个氨基酸残基中的突变是在选自由以下成员组成的集合的一个或多个氨基酸残基处的置换:w77、y94、y115、n129、v130、l131、q139、l141、y151、s170、y190、y210、c212、c213和y217。
[0184]
作为另一个例子,已经发现,α7-nachr(seq id no:4)的残基y115、l131、l141、s170、w171、s172、c212和y217介导乙酰胆碱和/或烟碱的结合,且在这些残基中的一个或多个处的突变将减少乙酰胆碱和/或烟碱的结合。α7-nachr的r101、y115、l131、l141、w171、s172、s188、y210和y217介导非天然配体abt126的结合,且预期这些残基中的一个或多个的突变会增加abt126和/或其它配体对α7-nachr的亲和力。α7-nachr的r101、y115、t128、n129、l131、l141、w171、s172、y210、c212、c213和y217介导非天然配体tc6987的结合,且预期这些残基中的一个或多个的突变会增加tc6987和/或其它配体对α7-nachr的亲和力。α7-nachr的r101、n120、l131、l141、s170、w171、s172、y210和y217介导非天然配体facinicline/rg3487的结合,且预期这些残基中的一个或多个的突变会增加facinicline/rg3487和/或其它配体对α7-nachr的亲和力。在某些实施方案中,所述主题经工程改造的受体包含在α7-nachr的配体结合结构域区域或含有α7-nachr的配体结合结构域区域的嵌合受体的配体结合结构域的一个或多个氨基酸残基中的突变,其中所述一个或多个氨基酸残基选自由以下成员组成的集合:r101、y115、t128、n120、n129、l131、l141、s170、w171、s172、s188、y210、c212、c213和y217。在某些实施方案中,所述一个或多个氨基酸残基改变乙酰胆碱和/或烟碱与α7-nachr的结合,其中所述氨基酸选自由以下成员组成的集合:α7-nachr的y115、l131、l141、s170、w171、s172、c212和y217。在某些这样的实施方案中,所述氨基酸选自c212和s170。在某些实施方案中,所述一个或多个氨基酸残基中的突变改变abt126与α7-nachr的结合,其中一个或多个氨基酸残基选自由以下成员组成的集合:α7-nachr的r101、
y115、l131、l141、w171、s172、s188、y210和y217。在某些这样的实施方案中,所述氨基酸选自r101、s188和y210。在某些实施方案中,所述一个或多个氨基酸残基中的突变改变tc6987与α7-nachr的结合,其中一个或多个氨基酸残基选自由以下成员组成的集合:α7-nachr的r101、y115、t128、n129、l131、l141、w171、s172、y210、c212、c213和y217。在某些这样的实施方案中,所述氨基酸选自r101、t128、n129、y210和c213。在某些实施方案中,所述一个或多个氨基酸残基中的突变改变facinicline/rg3487与α7-nachr的结合,其中一个或多个氨基酸残基选自由以下成员组成的集合:α7-nachr的r101、n120、l131、l141、s170、w171、s172、y210和y217。在某些这样的实施方案中,所述氨基酸选自y210、r101和n129。
[0185]
作为另一个例子,已经发现,5ht3(seq id no:6)的残基w85、r87、y136、y138、g146、n147、y148、k149、s177、s178、l179、y228和y229介导血清素的结合,且在这些残基中的一个或多个处的突变将减少血清素与5ht3的结合。5ht3的d64、i66、w85、r87、y89、n123、g146、y148、t176、s177、s178、w190、r191、f221、e224、y228、y229和e231介导非天然配体西兰司琼的结合,且预期这些残基中的一个或多个的突变会增加西兰司琼和/或其它配体对5ht3的亲和力。在某些实施方案中,所述主题经工程改造的受体包含在配体结合结构域区域5ht3a或含有5ht3的配体结合结构域区域的嵌合受体的配体结合结构域的一个或多个氨基酸残基中的突变,其中所述一个或多个氨基酸残基选自由以下成员组成的集合:d64、i66、w85、r87、y89、n123、y136、y138、g146、n147、y148、k149、t176、s177、s178、l179、w190、r191、f221、e224、y228、y229和e231。在某些实施方案中,所述一个或多个氨基酸残基中的突变改变血清素与5ht3的结合,其中所述氨基酸选自由以下成员组成的集合:5ht3a的w85、r87、y136、y138、g146、n147、y148、k149、s177、s178、l179、y228和y229。在某些这样的实施方案中,所述氨基酸选自y136、y138、n147、k149和l179。在某些实施方案中,所述一个或多个氨基酸残基中的突变改变西兰司琼与5ht3的结合,其中一个或多个氨基酸残基选自由以下成员组成的集合:5ht3a的d64、i66、w85、r87、y89、n123、g146、y148、t176、s177、s178、w190、r191、f221、e224、y228、y229和e231。在某些这样的实施方案中,所述氨基酸选自d64、i66、y89、n123、t176、w190、r191、f221、e224和e231。
[0186]
在某些实施方案中,影响配体调节lgic的活性的能力的一个或多个突变位于lgic的离子孔结构域中。例如,血清素受体5ht3a的残基t279介导配体调节通道的活性的方式,使得此残基向例如丝氨酸的突变(t279s)将效果从拮抗性(即,降低lgic的活性)转换为激动性(即,促进通道的活性)。在某些实施方案中,主题配体门控离子通道包含在人5ht3a(seq id no:6)的离子孔结构域或含有5ht3a的离子孔结构域的嵌合lgic受体的离子孔结构域的一个或多个氨基酸残基中的突变,其中置换是在与seq id no:6的279相对应的氨基酸中。在某些实施方案中,置换是相对于seq id no:6的t279s置换。
[0187]
本公开内容提供了经工程改造的受体,其与亲本受体相比具有两个或更多个突变,诸如氨基酸置换。在某些实施方案中,所述亲本受体是嵌合受体。在某些实施方案中,所述亲本受体包含seq id no:33的氨基酸序列。在某些实施方案中,与包含seq id no:33的氨基酸序列的亲本受体相比,所述经工程改造的受体包含两个氨基酸置换。
[0188]
在某些实施方案中,所述两个氨基酸置换是在选自由以下成员组成的集合的一对氨基酸残基处:l131和s172,y115和s170,以及y115和l131。在某些实施方案中,所述配体结合结构域包含在选自由以下成员组成的集合的一对氨基酸残基处的两个氨基酸置换:l131
和s172,y115和s170,以及y115和l131。在某些实施方案中,所述配体结合结构域包含选自由以下成员组成的集合的一对氨基酸置换:l131s和s172d,l131t和s172d,l131d和s172d,y115d和s170t,y115d和l131q,以及y115d和l131e。在某些实施方案中,所述配体结合结构域包含l131e的氨基酸置换。
[0189]
在某些实施方案中,所述经工程改造的受体对乙酰胆碱的效能低于人α7烟碱乙酰胆碱受体(α7-nachr)对乙酰胆碱的效能。在某些实施方案中,所述经工程改造的受体对乙酰胆碱的效能比人α7烟碱乙酰胆碱受体(α7-nachr)对乙酰胆碱的效能低至少约1.5倍(例如,低约2倍、约3倍、约4倍、约5倍、约6倍、约7倍、约8倍、约9倍、约10倍、约12倍、约15倍、约20倍、约30倍、约40倍、约50倍、约60倍、约70倍、约80倍、约90倍或约100倍,包括位于之间的所有子范围和值)。
[0190]
在某些实施方案中,所述经工程改造的受体对非天然配体的效能与人α7烟碱乙酰胆碱受体(α7-nachr)对非天然配体的效能大约相同。在某些实施方案中,所述经工程改造的受体对非天然配体的效能高于人α7烟碱乙酰胆碱受体(α7-nachr)对非天然配体的效能。在某些实施方案中,所述经工程改造的受体对非天然配体的效能比人α7烟碱乙酰胆碱受体(α7-nachr)对非天然配体的效能高至少约1.5倍(例如,高约2倍、约3倍、约4倍、约5倍、约6倍、约7倍、约8倍、约9倍、约10倍、约12倍、约15倍、约20倍、约30倍、约40倍、约50倍、约60倍、约70倍、约80倍、约90倍或约100倍,包括位于之间的所有子范围和值)。在某些实施方案中,确定所述效能包括确定ec50。
[0191]
在某些实施方案中,在有非天然配体存在下所述经工程改造的受体的效力高于在有非天然配体存在下人α7烟碱乙酰胆碱受体(α7-nachr)的效力。在某些实施方案中,在有非天然配体存在下所述经工程改造的受体的效力比在有非天然配体存在下人α7烟碱乙酰胆碱受体(α7-nachr)的效力高至少约1.5倍(例如,高约2倍、约3倍、约4倍、约5倍、约6倍、约7倍、约8倍、约9倍、约10倍、约12倍、约15倍、约20倍、约30倍、约40倍、约50倍、约60倍、约70倍、约80倍、约90倍或约100倍,包括位于之间的所有子范围和值)。在某些实施方案中,确定所述效力包括确定在有非天然配体存在下在体外穿过经工程改造的受体的电流的量。
[0192]
在某些方面,主题配体门控的离子通道包含一个或多个非脱敏突变。当在配体门控的离子通道的上下文中使用时,“脱敏”表示在激动剂的长期存在下离子通量的逐渐减小。这导致神经元对配体的应答性的逐渐丧失。非脱敏突变意指阻止lgic对配体脱敏从而阻止神经元变得对配体低应答或无应答的氨基酸突变。通过将携带突变的lgic引入到神经元中并分析长期暴露于配体期间随时间推移的电流通量,可以容易地鉴定非脱敏突变。如果lgic不包含非脱敏突变,则在长期暴露期间电流将从峰值恢复到稳态,而如果lgic包含非脱敏突变,则在暴露于配体的持续时间内电流将保持在峰值通量。导致脱敏的示例性氨基酸突变包括人glyrα1中的v322l突变(在对前蛋白进行除去信号肽的处理后,v294l)和人gaba-a受体gabrb3中的l321v突变(在对前蛋白进行除去信号肽的处理后,l296v)。在某些实施方案中,所述脱敏突变是用脱敏序列替换在lgic的c-端处或附近的氨基酸残基,所述脱敏序列是例如与衍生自由gabar1编码的蛋白的c末端的idrlsriafpllfgifnlvywatylnrepql(seq id no:53)具有90%或更多同一性的序列,例如用idrlsriafpllfgifnlvywatylnrepql(seq id no:53)替换gabrr1中的残基455-479。lgic脱敏、用于测量lgic的脱敏的方法和非脱敏突变是本领域众所周知的;参见,例如gielen等
人.nat commun 2015年4月20日,6:6829,和keramidas等人.cell mol life sci.2013年4月;70(7):1241-53,它们的完整公开内容通过引用并入本文。
[0193]
在某些方面,主题配体门控的离子通道包含一个或多个转换突变。转换突变意指这样的突变:其改变了lgic的离子孔结构域的渗透性,使得它变成允许传导非天然离子,即,天然地不允许穿过的离子。在某些情况下,所述突变将渗透性从阳离子转换为阴离子,例如用肽序列pakiglgitvllslttfmsgvan(seq id no:55)替换人α7-nachr(chrna7)(ekislgitvllsltvfmllvae,seq id no:54)中的氨基酸残基260-281或另一种阳离子可渗透的lgic中的对应氨基酸。在某些情况下,所述突变将渗透性从阴离子转换为阳离子,例如,将glra1的氨基酸残基279或另一种阴离子可渗透的lgic中的对应氨基酸置换为谷氨酸(e)(这如glra1中的a293e置换那样,将lgic从允许阴离子转换为允许钙),或glra1的氨基酸残基278或另一种阴离子可渗透的lgic中的对应氨基酸的缺失,将glra1的氨基酸残基279或另一种阴离子可渗透的lgic中的对应氨基酸置换为谷氨酸(e),以及将glra1的氨基酸残基293或另一种阴离子可渗透的lgic中的对应氨基酸置换为缬氨酸(v)(这如glra1中的p278δ、a279e、t293v那样,将lgic从允许阴离子转换为允许阳离子)。
[0194]
通过体外筛选和验证方法,可以容易地鉴定除了本文描述的那些以外的另外的经工程改造的受体。在某些实施方案中,从有限数量的亲本受体产生亲本受体突变体的文库。使用本领域已知的方法,包括易错pcr,可以对亲本受体进行突变。在某些实施方案中,然后将亲本受体突变体的文库转染到酵母或哺乳动物细胞中,并且以高通量筛选以鉴定功能性受体(例如,以鉴定能够响应于结合剂或配体而进行信号传递的亲本受体突变体)。在某些实施方案中,然后将在此初步筛选中鉴定的功能性亲本受体突变体在哺乳动物细胞中表达,并且筛选对结合剂或配体的应答性,例如通过本文描述的平板读数器和/或电生理学测定。然后可以选择对激动剂结合剂显示出增加的结合亲和力或使得能够在二次筛选中使用拮抗剂或调节剂结合剂作为激动剂的亲本受体突变体,并且用于进一步的在体外和/或在体内验证和表征测定。这样的筛选测定是本领域已知的,例如armbruster,b.n.等人(2007)pnas,104,5163-5168;nichols,c.d.和roth,b.l.(2009)front.mol.neurosci.2,16;dong,s.等人(2010)nat.protoc.5,561-573;alexander,g.m.等人(2009)neuron 63,27-39;guettier,j.m.等人(2009)pnas 106,19197-19202;ellefson j.w.等人(2014)nat biotechnol.32(1):97-101;maranhao ac和ellington ad.(2017)acs synth biol.20;6(1):108-119;talwar s等人(2013)plos one;8(3):e58479;gilbert d.f.等人(2009)front mol neurosci.30;2:17;lynagh和lynch,(2010),biol chem.14:285(20),14890-14897;islam r.等人(2016)acs chem neurosci.21;7(12):1647-1657;和myers等人(2008)neuron.8:58(3):362-373。
[0195]
d.结合剂
[0196]
术语“结合剂”或“药剂”在本文中可互换地使用,并且表示对哺乳动物细胞具有已知的作用机理(例如,已知充当受体的激动剂、拮抗剂或调节剂)的外源药物或化合物。结合剂可以包括蛋白、脂质、核酸和/或小分子。在某些实施方案中,结合剂包括已被美国食品和药品管理局(fda)批准用于在临床应用中治疗特定疾病(例如,神经学疾病)的药物或化合物。在某些实施方案中,结合剂包括未经fda批准用于临床应用、但已在一项或多项临床试验中经过试验、当前正在一项或多项临床试验中进行试验和/或预期在一项或多项临床试
验中进行试验的药物或化合物。在某些实施方案中,结合剂包括未经fda批准用于临床应用、但常规地用在实验室研究中的药物或化合物。在某些实施方案中,结合剂是前述药剂之一的类似物。在特定实施方案中,结合剂选自表2-9中的药剂中的任一种。在某些实施方案中,所述结合剂选自由以下成员组成的集合:azd0328、abt-126、aqw-051、大麻二酚、西兰司琼、ph-399733、facinicline/rg3487/mem-3454、tc-6987、apn-1125和tc-5619/at-101。在某些实施方案中,所述结合剂选自由以下成员组成的集合:abt-126、azd-0328、apn-1125、rg3487、tc-6987和tc-5619。
[0197]
在特定实施方案中,所述结合剂是西兰司琼的类似物,例如由以下化合物式2-7之一所描述,处于其r或s对映异构体:
[0198][0199]
在某些实施方案中,所述结合剂充当激动剂。本文中使用的术语“激动剂”表示诱导信号传递应答的配体或结合剂。在某些实施方案中,所述结合剂充当拮抗剂。术语拮抗剂在本文中用于表示抑制信号传递应答的药剂。
[0200]
在某些实施方案中,所述结合剂是抗焦虑剂、抗惊厥剂、抗抑郁剂、抗精神病剂、止吐剂、益智剂、抗生素、抗真菌剂、抗病毒剂或抗寄生虫剂。
[0201]
表2:甘氨酸受体(glyr)的结合剂
[0202]
[0203][0204]
表3:λ-氨基丁酸a受体(gaba-a)的结合剂
[0205]
[0206]
[0207]
[0208]
[0209][0210]
表4:5-羟基色胺受体(5-ht3)的结合剂
[0211]
[0212][0213]
表5:烟碱乙酰胆碱受体(nachr)的结合剂
[0214]
[0215]
[0216]
[0217][0218]
表6:atp-门控的p2x受体阳离子通道(p2x)的结合剂
[0219]
[0220][0221]
表7:内向整流钾通道(kir)的结合剂
[0222]
[0223][0224]
表8:电位依赖性钾通道(kcnq/kv7)的结合剂
[0225]
激动剂调节剂/结合剂拮抗剂二氮嗪 阿齐利特氟吡汀 胺碘酮米诺地尔 溴苄胺尼可地尔 氯非铵吡那地尔 达伐吡啶瑞替加滨 多非利特
ꢀꢀ
e-4031
ꢀꢀ
伊布利特
ꢀꢀ
尼非卡兰
ꢀꢀ
司美利特
ꢀꢀ
索他洛尔
ꢀꢀ
磺酰脲类
ꢀꢀ
替地沙米
[0226]
表9:囊性纤维化跨膜传导调节因子(cftr)的结合剂
[0227]
[0228][0229]
e.多核苷酸
[0230]
在不同的示例性实施方案中,本公开内容部分地涵盖了多核苷酸、编码经工程改造的受体多肽(包括lgic、及其亚基和突变蛋白以及融合多肽)的多核苷酸、病毒载体多核苷酸和包含它们的组合物。
[0231]
本文中使用的术语“多核苷酸”、“核苷酸”、“核苷酸序列”或“核酸”互换使用。它们表示任何长度的核苷酸(脱氧核苷酸或核糖核苷酸或其类似物)的聚合形式。多核苷酸可以具有任何三维结构,并且可以执行任何已知或未知的功能。以下是多核苷酸的非限制性例子:基因或基因片段的编码或非编码区、由连锁分析定义的多个基因座(单个基因座)、外显子、内含子、信使rna(mrna)、转移rna(trna)、核糖体rna(rrna)、短干扰rna(sirna)、短发夹rna(shrna)、微-rna(mirna)、核酶、cdna、重组多核苷酸、支链多核苷酸、质粒、载体、任何序列的分离dna、任何序列的分离rna、核酸探针和引物。多核苷酸可以包含一个或多个经修饰的核苷酸,诸如甲基化的核苷酸和核苷酸类似物。如果存在的话,可以在聚合物的组装之前或之后赋予对核苷酸结构的修饰。核苷酸的序列可以被非核苷酸组分中断。聚合后可以进一步修饰多核苷酸,诸如通过与标记组分缀合。多核苷酸可以是脱氧核糖核酸(dna)、核糖核酸(rna)或dna/rna杂交体。多核苷酸可以是单链的或双链的。多核苷酸包括、但不限于:前信使rna(前-mrna)、信使rna(mrna)、rna、短干扰rna(sirna)、短发夹rna(shrna)、微rna(mirna)、核酶、合成的rna、基因组rna(grna)、正链rna(rna( ))、负链rna(rna(-))、合成的rna、基因组dna(gdna)、pcr扩增的dna、互补dna(cdna)、合成的dna或重组dna。多核苷酸表示长度为至少5个、至少10个、至少15个、至少20个、至少25个、至少30个、至少40个、至少50个、至少100个、至少200个、至少300个、至少400个、至少500个、至少1000个、至少5000个、至少10000个或至少15000个或更多个核苷酸(核糖核苷酸或脱氧核苷酸或者任一类型的核苷酸的经修饰形式)以及所有中间长度的核苷酸的聚合形式。将容易理解,在该背景下,“中间长度”是指在引用值之间的任何长度,诸如6、7、8、9等;101、102、103等;151、152、153等;201、202、203等。在特定实施方案中,多核苷酸或变体与本文描述的或本领域已知的参考序列具有至少或约50%、55%、60%、65%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性,通常其中所述变体维持参考序列的至少一种生物活性,除非另有说明。
[0232]
本文中使用的术语“基因”可以表示包含增强子、启动子、内含子、外显子等的多核苷酸序列。在特定实施方案中,术语“基因”表示编码多肽的多核苷酸序列,不论所述多核苷酸序列与编码多肽的基因组序列是否相同。
[0233]
本文中使用的“顺式作用序列、“顺式作用调节序列”或“顺式作用核苷酸序列”或等同术语表示与基因的表达(例如转录和/或翻译)相关联的多核苷酸序列。在一个实施方案中,顺式作用序列调节转录,因为它是抑制或减少转录的多肽的结合位点或与有助于转录抑制的转录因子结合位点相关联的多核苷酸序列。调节多核苷酸序列的表达并且可以与本公开内容的多核苷酸可操作地连接以调节主题经工程改造的受体的表达的顺式作用序列的例子是本领域众所周知的,并且包括诸如启动子序列(例如cag、cmv、syn、camkii、trpv1)、kozak序列、增强子、转录后调节元件、mirna结合元件和多腺苷酸化序列等元件。
[0234]
作为一个非限制性例子,启动子序列是能够结合细胞中的rna聚合酶并且引发下游(3'方向)编码序列的转录的dna调节区。为了限定本发明的目的,启动子序列在其3’末端处由转录起始位点结合,且向上游(5’方向)延伸以包括在背景以上可检测的水平起始转录所需的最小数目的碱基或元件。在启动子序列内将发现转录起始位点以及负责结合rna聚合酶的蛋白结合结构域。真核启动子通常但不一定含有“tata”框和“cat”框。各个启动子可以用于驱动本发明的各种载体。例如,启动子可以是组成活性的启动子,即在不存在外部施加的药剂的情况下有活性的启动子,例如,cmv ie1启动子、sv40启动子、gapdh启动子、肌动蛋白启动子。启动子可以是诱导型启动子,即在将药剂应用于细胞后其活性被调节的启动子,例如多西环素,tet-on或tet-off启动子、雌激素受体启动子等。启动子可以是组织特异性启动子,即对某些类型的细胞有活性的启动子。
[0235]
在某些实施方案中,所述启动子在可兴奋细胞中有活性。“可兴奋细胞”意指通过膜电位的变化而被活化的细胞,例如神经元或肌细胞,例如背根神经节神经元、运动神经元、兴奋性神经元、抑制性神经元或感觉神经元。在将可用于本发明的多核苷酸组合物中的可兴奋细胞中有活性的启动子将包括神经元启动子,例如,突触蛋白(syn)、trpv1、nav1.7、nav1.8、nav1.9、camkii、nse和advillin启动子;肌细胞启动子,例如结蛋白(des)、α-肌球蛋白重链(α-mhc)、肌球蛋白轻链2(mlc-2)和心肌肌钙蛋白c(ctnc)启动子;以及普遍存在的作用启动子,例如cag、cba、e1fa、ubc、cmv和sv40启动子。
[0236]
本文中使用的“用于诱导型表达的调节元件”表示这样的多核苷酸序列:其为可操作地连接至待表达的多核苷酸并且对结合所述元件的分子的存在或不存在做出应答以增加(开启)或减少(关闭)与其可操作地连接的多核苷酸的表达的启动子、增强子或其功能片段。用于诱导型表达的示例性调节元件包括、但不限于四环素应答性启动子、蜕皮激素应答性启动子、cumate应答性启动子、糖皮质激素应答性启动子、雌激素应答性启动子、ru-486应答性启动子、ppar-γ启动子和过氧化物诱导型启动子。
[0237]“用于瞬时表达的调节元件”表示可以用于简短或暂时表达多核苷酸核苷酸序列的多核苷酸序列。在特定实施方案中,用于瞬时表达的一种或多种调节元件可以用于限制多核苷酸的持续时间。在某些实施方案中,多核苷酸表达的优选持续时间是在数分钟、数小时或数天的量级。用于瞬时表达的示例性调节元件包括、但不限于核酸酶靶位点、重组酶识别位点和抑制性rna靶位点。另外,在某种程度上,在特定实施方案中,用于诱导型表达的调节元件还可以有助于控制多核苷酸表达的持续时间。
[0238]
本文中使用的术语“多核苷酸变体”和“变体”等表示表现出与参考多核苷酸序列的实质序列同一性的多核苷酸或在下文定义的严格条件下与参考序列杂交的多核苷酸。这些术语也涵盖通过添加、缺失、置换或修饰至少一个核苷酸而区别于参考多核苷酸的多核
苷酸。因此,术语“多核苷酸变体”和“变体”包括这样的多核苷酸:其中一个或多个核苷酸已经添加或缺失或修饰,或已经用不同的核苷酸替换。在这点上,在本领域中充分理解,可以对参考多核苷酸进行某些改变,包括突变、添加、缺失和置换,由此改变的多核苷酸保留参考多核苷酸的生物学功能或活性。在特定实施方案中,多核苷酸或变体与本文描述的或本领域已知的参考序列具有至少或约50%、55%、60%、65%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性,通常其中所述变体维持参考序列的至少一种生物活性,除非另有说明。
[0239]
在一个实施方案中,多核苷酸包含在严谨条件下与靶核酸序列杂交的核苷酸序列。在“严谨条件”下杂交描述了这样的杂交方案,其中彼此具有至少60%同一性的核苷酸序列保持杂交。通常,将严谨条件选择为在限定的离子强度和ph下比特定序列的热熔点(tm)低约5℃。tm是使50%的与靶序列互补的探针在平衡时与靶序列杂交时的温度(在确定的离子强度、ph和核酸浓度下)。由于靶序列通常过量存在,所以在tm,50%的探针在平衡时被占用。
[0240]
本文中使用的叙述“序列同一性”或例如包含“与
……
具有50%同一性的序列”表示,在对比窗口上在逐个核苷酸的基础上或在逐个氨基酸的基础上序列具有同一性的程度。因此,可以如下计算“序列同一性百分比”:在对比窗口上对比两个最佳比对的序列,确定相同的核酸碱基(例如,a、t、c、g、i)或相同的氨基酸残基(例如,ala、pro、ser、thr、gly、val、leu、ile、phe、tyr、trp、lys、arg、his、asp、glu、asn、gln、cys和met)在两个序列中出现的位置的数目以得到匹配位置的数目,将匹配位置的数目除以对比窗口中的位置总数(即,窗口大小),并将结果乘以100以产生序列同一性的百分比。用于描述两个或多个多核苷酸或多肽之间的序列关系的术语包括“参考序列”、“对比窗”、“序列同一性”、“序列同一性百分比”和“实质同一性”。“参考序列”的长度是至少12个、有时15至18个、且通常至少25个单体单元,包括核苷酸和氨基酸残基。因为两个多核苷酸可以各自包含:(1)在两个多核苷酸之间相似的序列(即,只是完整多核苷酸序列的一部分),和(2)两个多核苷酸之间不同的序列,通常通过在“对比窗口”内对比两个多核苷酸的序列来在两个(或多个)多核苷酸之间进行序列对比,以鉴定和对比序列相似性的局部区域。“对比窗口”表示这样的概念区段:其具有至少6个、通常约50至约100个、更通常约100至约150个邻接位置,其中在将两个序列最佳对齐后,将序列与相同数目的邻接位置的参考序列进行对比。对于两个序列的最佳比对,对比窗口可以包含与参考序列(其不包含添加或缺失)相比约20%或更少的添加或缺失(即,间隙)。用于对齐对比窗口的序列的最佳比对可以如下进行:通过算法的计算机化实现(gap、bestfit、fasta和tfasta,见wisconsin genetics software package release 7.0,genetics computer group,575 science drive madison,wi,usa)或通过目检和由选择的多种方法中的任一种产生的最佳比对(即导致在对比窗口内的最高百分比同源性)。还可以参考例如altschul等人,1997,nucl.acids res.25:3389公开的程序的blast家族。关于序列分析的详细讨论,可以参见:ausubel等人,current protocols in molecular biology的第19.3单元,john wiley&sons inc,1994-1998,第15章。
[0241]
本文中使用的“分离的多核苷酸”表示已经从它在天然存在状态侧接的序列纯化的多核苷酸,例如,已经从通常与该片段相邻的序列除去的dna片段。在特定实施方案中,“分离的多核苷酸”表示互补dna(cdna)、重组dna、或在自然界中不存在但已经通过人手制成的其它多核苷酸。
[0242]
描述多核苷酸方向的术语包括:5'(通常是多核苷酸的具有自由磷酸酯基团的一端)和3'(通常是多核苷酸的具有自由羟基(oh)基团的一端)。多核苷酸序列可以以5’至3’取向或3’至5’取向注解。对于dna和mrna,5’至3’链被命名为“有义”、“正”或“编码”链,因为其序列与前信使(前mrna)的序列相同[除了rna中的尿嘧啶(u)以外,在dna中替代为胸腺嘧啶(t)]。对于dna和mrna,作为被rna聚合酶转录的链的互补3’至5’链被命名为“模板”、“反义”、“负”或“非编码”链。本文中使用的术语“相反取向”表示以3’至5’取向书写的5’至3’序列或以5’至3’取向书写的3’至5’序列。
[0243]
术语“侧接”表示相对于所述序列在上游多核苷酸序列和/或下游多聚核苷酸序列(即,5’和/或3’)之间的多核苷酸序列。例如,“侧接”两个其它元件(例如,itr)的序列指示,一个元件位于所述序列的5'侧,并且另一个元件位于所述序列的3'侧;但是,之间可能存在插入序列。
[0244]
术语“互补的”和“互补性”表示通过碱基配对规则相关的多核苷酸(即,核苷酸序列)。例如,dna序列5’a g t c a t g 3’的互补链是3’t c a g t a c 5’。后一个序列经常被写作5'端在左侧并且3'端在右侧的反向补体5’c a t g a c t 3’。与其反向互补体相同的序列被称为回文序列。互补性可以是“部分的”,其中核酸的碱基中仅一些碱基根据碱基配对规则是匹配的。或者,在核酸之间可以存在“完全”或“全”互补性。
[0245]
本文中使用的术语“核酸盒”或“表达盒”表示在较大多核苷酸(诸如载体)内的多核苷酸序列,所述序列足以表达来自多核苷酸的一个或多个rna。表达的rna可以被翻译成蛋白,可以作为指导rna或抑制性rna起作用以靶向其它多核苷酸序列进行裂解和/或降解。在一个实施方案中,所述核酸盒含有一个或多个感兴趣的多核苷酸。在另一个实施方案中,所述核酸盒含有可操作地连接至一个或多个感兴趣的多核苷酸的一个或多个表达控制序列。多核苷酸包括感兴趣的多核苷酸。本文中使用的术语“感兴趣的多核苷酸”表示编码多肽或融合多肽的多核苷酸或充当抑制性多核苷酸的转录模板的多核苷酸,例如,lgic、及其亚基和突变蛋白,如本文所涵盖的。在一个特定实施方案中,感兴趣的多核苷酸编码具有一种或多种酶活性(诸如核酸酶活性)和/或染色质重塑或后天修饰活性的多肽或融合多肽。
[0246]
载体可以包含1、2、3、4、5、6、7、8、9或10个或更多个核酸盒。在本公开内容的一个优选的实施方案中,核酸盒包含一个或多个表达控制序列(例如,在神经元细胞中可操作的启动子或增强子),其可操作地连接至编码经工程改造的受体(例如,lgic、或其亚基或突变蛋白)的多核苷酸。所述盒可以作为单个单元从其它多核苷酸序列(例如,质粒或病毒载体)移除或插入到其它多核苷酸序列(例如,质粒或病毒载体)中。
[0247]
在一个实施方案中,本文涵盖的多核苷酸包含1、2、3、4、5、6、7、8、9个或更多个核酸盒,其任何数目或组合可以呈相同或相反的取向。
[0248]
此外,本领域普通技术人员将理解,由于遗传密码的简并性,许多核苷酸序列可以编码如本文所涵盖的多肽或其变体的片段。这些多核苷酸中的一些与任何天然基因的核苷酸序列具有最小的同源性。尽管如此,本公开内容具体地涵盖了由于密码子选择的差异而变化的多核苷酸,例如针对人和/或灵长类动物密码子选择而优化的多核苷酸。在一个实施方案中,提供了包含特定等位基因序列的多核苷酸。等位基因是由于一个或多个突变(诸如
核苷酸的缺失、添加和/或置换)而改变的内源性多核苷酸序列。
[0249]
f.载体
[0250]
在本公开内容的某些方面,将核酸分子(即,编码经工程改造的受体的多核苷酸)递送给受试者。在某些情况下,将编码经工程改造的受体的核酸分子通过载体递送给受试者。在不同的实施方案中,载体包含本文涵盖的一个或多个多核苷酸序列。术语“载体”在本文中用于表示能够转移或运输另一个核酸分子的核酸分子。被转移的多核苷酸通常连接至(例如,插入)载体核酸分子。载体可以包括指导在细胞中自主复制的序列,或可以包括足以允许整合到宿主细胞dna中的序列。载体可以将靶多核苷酸递送给生物体、细胞或细胞组分。在某些情况下,载体是表达载体。本文中使用的“表达载体”表示能够促进表达以及并入其中的多核苷酸的复制的载体,例如质粒。通常,待表达的核酸序列可操作地连接至顺式作用调节序列,例如启动子和/或增强子序列,并且受到启动子和/或增强子的转录调节控制。在特定情况下,载体用于将编码本公开内容的经工程改造的受体的核酸分子递送给受试者。
[0251]
在特定实施方案中,可以采用适合于将表达盒或编码经工程改造的受体的多核苷酸引入到神经元细胞中的任何载体。合适载体的示例性例子包括质粒(例如,dna质粒或rna质粒)、转座子、粘粒、细菌人工染色体和病毒载体。在某些情况下,载体是环状核酸,例如,质粒、bac、pac、yac、粘粒、f粘粒等。在某些情况下,可以利用环状核酸分子将编码经工程改造的受体的核酸分子递送给受试者。例如,可以将编码经工程改造的受体的质粒dna分子引入到受试者的细胞中,由此将编码经工程改造的受体的dna序列转录为mrna并且将mrna“消息”翻译为蛋白产物。环状核酸载体通常将包括调节靶蛋白的表达的调节元件。例如,环状核酸载体可以包括任何数目的启动子、增强子、终止子、剪接信号、复制起点、起始信号等。
[0252]
在某些情况下,所述载体可以包括复制子。复制子可以是能够自我复制的任何核酸分子。在某些情况下,复制子是衍生自病毒的rna复制子。可获得多种合适的病毒(例如,rna病毒),包括、但不限于甲病毒、小rna病毒、黄病毒、冠状病毒、瘟病毒、风疹病毒、杯状病毒和肝炎病毒。
[0253]
在某些实施方案中,所述载体是非病毒载体。“非病毒载体”是指不包含病毒衣壳或包膜的任何递送媒介物,例如脂质纳米颗粒(阴离子的(带负电荷的)、中性的或阳离子的(带正电荷的))、重金属纳米颗粒、基于聚合物的颗粒、质粒dna、微环dna、微载体dna、ccdna、合成的rna、外核体等。通过本领域中将充分理解的任何合适的方法,包括、例如纳米颗粒递送、颗粒轰击、电穿孔、声处理或显微注射,可以递送非病毒载体。参见,例如chen等人.mol.therapy,methods and clinical development.2016年1月;第3卷,第1期;和hardy,ce等人.genes(basel).2017年2月;8(2):65。
[0254]
在其它实施方案中,所述载体是病毒载体。“病毒载体”意指包含围绕编码感兴趣的rna或多肽的多核苷酸的病毒衣壳或包膜的递送媒介物。在某些情况下,病毒载体衍生自复制缺陷型病毒。适合于将本公开内容的核酸分子递送给受试者的病毒载体的非限制性例子包括衍生自腺病毒、逆转录病毒(例如,慢病毒)、腺相关病毒(aav)和单纯疱疹-1(hsv-1)的那些。合适的病毒载体的示例性例子包括、但不限于,逆转录病毒载体(例如,慢病毒载体)、基于疱疹病毒的载体和基于细小病毒的载体(例如,基于腺相关病毒(aav)的载体、aav-腺病毒嵌合载体和基于腺病毒的载体)。
[0255]
本文中使用的术语“细小病毒属”涵盖所有细小病毒,包括自主复制的细小病毒和依赖病毒。自主性细小病毒包括细小病毒属(parvovirus)、红细胞病毒属(erythrovirus)、浓核病毒属(densovirus)、艾特拉病毒属(iteravirus)和康特拉病毒属(contravirus)的成员。示例性自主性细小病毒包括、但不限于小鼠微小病毒、牛细小病毒、犬细小病毒、鸡细小病毒、猫泛白细胞减少病毒、猫细小病毒、鹅细小病毒和b19病毒。其它自主性细小病毒是本领域技术人员已知的。参见,例如,fields等人,1996virology,第2卷,第69章(第3版,lippincott-raven publishers)。
[0256]
依赖病毒属含有腺相关病毒(aav),包括、但不限于aav 1型、aav 2型、aav 3型、aav 4型、aav 5型、aav 6型、aav 7型、aav 8型、aav 9型、aav rh10型、禽aav、牛aav、犬aav、马aav和绵羊aav。
[0257]
在一个优选的实施方案中,所述载体是aav载体。在特定情况下,所述病毒载体是aav-6或aav-9载体。
[0258]
所有已知aav血清型的基因组组构是类似的。aav的基因组是小于约5,000个核苷酸(nt)长度的线性单链dna分子。反向末端重复(itr)侧接非结构复制(rep)蛋白和结构(vp)蛋白的独特编码核苷酸序列。vp蛋白(vpl、-2和-3)形成衣壳并且有助于病毒的向性。末端145nt itr是自互补的,并且被组织成使得形成t形发夹的能量上稳定的分子内双链体可以形成。这些发夹结构作为病毒dna复制的起点起作用,从而充当细胞dna聚合酶复合物的引物。在哺乳动物细胞中的野生型(wt)aav感染以后,rep基因被表达并且在病毒基因组的复制中起作用。
[0259]
在某些情况下,病毒载体的外部蛋白“衣壳”存在于自然界中,例如aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9或aav10。在特定情况下,衣壳被合成地工程改造(例如,通过定向进化或合理设计)以具有在自然界中不存在的某些独特特性,诸如改变的向性、增加的转导效率或免疫逃避。合理设计的衣壳的一个例子是在vp3病毒衣壳蛋白上一个或多个表面暴露的酪氨酸(y)、丝氨酸(s)、苏氨酸(t)和赖氨酸(k)残基的突变。其vp3衣壳蛋白已经合成地工程改造并且适合与本文提供的组合物和方法一起使用的病毒载体的非限制性例子包括:aav1(y705 731f t492v)、aav2(y444 500 730f t491v)、aav3(y705 731f)、aav5(y436 693 719f)、aav6(y705 731f t492v)、aav8(y733f)、aav9(y731f)和aav10(y733f)。已经通过定向进化进行工程改造并且适合与本文提供的组合物和方法一起使用的病毒载体的非限制性例子包括aav-7m8和aav-shh10。
[0260]“重组细小病毒或aav载体”(或“raav载体”)在本文中表示包含由一个或多个aav itr侧接的本文涵盖的一个或多个多核苷酸的载体。这样的多核苷酸被称为与itr“异源”,因为这样的组合通常在自然界中不存在。当存在于正在表达aav rep和cap基因产物(即,aav rep和cap蛋白)的昆虫宿主细胞中时,这样的raav载体可以复制并且包装成感染性病毒颗粒。当将raav载体并入较大核酸构建体中(例如,在染色体中或在另一种载体诸如用于克隆或转染的质粒或杆状病毒中)时,那么raav载体通常被称为前载体(pro-vector),其可以在aav包装功能和必要的辅助功能存在下通过复制和衣壳化来拯救”。
[0261]
在特定实施方案中,任何aav itr都可以用于aav载体中,包括来自aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、aav12、aav13、aav14、aav15和aav16的itr。在一个优选的实施方案中,本文涵盖的aav载体包含一个或多个aav2 itr。
[0262]
包含两个itr的raav载体具有约4.4kb的有效负载容量。自互补的raav载体含有第三itr并且包装载体的重组部分的两条链,从而对于本文涵盖的多核苷酸仅留下约2.1kb。在一个实施方案中,所述aav载体是scaav载体。
[0263]
使用双raav载体策略已经实现了大约是raav的包装容量的两倍的扩展包装容量(约9kb)。可用于产生本文涵盖的raav的双载体策略包括、但不限于剪接(反式剪接)、同源重组(重叠)或两者的组合(杂交)。在双aav反式剪接策略中,将剪接供体(sd)信号放置于5
′‑
半部分载体的3'端处,并且将剪接受体(sa)信号放置于3
′‑
半部分载体的5'端处。在双aav载体对同一细胞的共感染和反向末端重复(itr)介导的两个半部分的头接尾连环化后,反式剪接导致成熟的mrna和全尺寸蛋白的产生(yan等人,2000)。反式剪接已成功用于在肌肉和视网膜中表达大基因(reich等人,2003;lai等人,2005)。可替换地,在双aav载体中所含的大转基因表达盒的两个半部分可以含有同源重叠序列(在5
′‑
半部分载体的3'末端和在3
′‑
半部分载体的5'末端,双aav重叠),所述同源重叠序列将介导通过同源重组对单个大基因组的重构(duan等人,2001)。此策略取决于转基因重叠序列的引起重组的性能(ghosh等人,2006)。第三个双aav策略(杂交)是基于将来自外源基因(即,碱性磷酸酶;ghosh等人,2008,ghosh等人,2011))的高度引起重组的区域添加到反式剪接载体中。为了增加双aav之间的重组,将添加的区域放置在5
′‑
半部分载体中的sd信号的下游且在3
′‑
半部分载体中的sa信号的上游。
[0264]“杂交aav”或“杂交raav”表示用不同aav血清型(以及优选地,来自一个或多个aav itr的不同血清型)的衣壳包装的raav基因组,并且可以在其它方面被称为假型raav。例如,raav 1型、raav 2型、raav 3型、raav 4型、raav 5型、raav 6型、raav 7型、raav 8型、raav 9型、raav 10型、raav 11型、raav 12型、raav 13型、raav 14型、raav 15型或raav 16型基因组可以被衣壳化在aav 1型、aav 2型、aav 3型、aav 4型、aav 5型、aav 6型、aav 7型、aav 8型、aav 9型、aav 10型、aav 11型、aav 12型、aav 13型、aav 14型、aav 15型或aav 16型衣壳或其变体内,前提条件是,aav衣壳和基因组(以及优选地,一个或多个aav itr)属于不同的血清型。在某些实施方案中,假型raav颗粒可以称为属于“x/y”型,其中“x”指示itr的来源,并且“y”指示衣壳的血清型,例如2/5raav颗粒具有来自aav2的itr和来自aav6的衣壳。
[0265]“宿主细胞”包括用本公开内容的重组载体或多核苷酸在体内、离体或在体外转染、感染或转导的细胞。宿主细胞可以包括产生病毒的细胞和用病毒载体感染的细胞。在特定实施方案中,用本文涵盖的病毒载体在体内感染宿主细胞。在某些实施方案中,术语“靶细胞”与宿主细胞互换使用并且表示期望的细胞类型的受感染细胞。
[0266]
使用本领域已知的技术可以生产高滴度aav制品,例如,如以下文献中所描述的:美国专利号5,658,776;6,566,118;6,989,264;和6,995,006;美国2006/0188484;wo98/22607;wo2005/072364;和wo/1999/011764;以及viral vectors for gene therapy:methods and protocols,machida编,humana press,2003;samulski等人,(1989)j.virology 63,3822;xiao等人,(1998)j.virology 72,2224;lnoue等人,(1998)j.virol.72,7024。还已经报道了生产假型aav载体的方法(例如,wo 00/28004),以及aav载体的各种修饰或制剂,以在体内施用后降低其免疫原性(参见例如,wo 01/23001;wo 00/73316;wo 04/1 12727;wo 05/005610;wo 99/06562)。
[0267]
药物组合物
[0268]
还提供了药物制品,包括载体的药物制品和结合剂的药物制品。药物制品包括编码经工程改造的受体的主题多核苷酸(rna或dna)、携带编码主题经工程改造的受体的多核苷酸(rna或dna)的载体、或存在于药学上可接受的媒介物中的结合剂。“药学上可接受的媒介物”可以是这样的媒介物:其被联邦或州政府的管理机构批准,或在美国药典或用于哺乳动物(诸如人类)的其它普遍公认的药典中列出。术语“媒介物”表示本公开内容的化合物与其一起配制以施用给哺乳动物的稀释剂、佐剂、赋形剂或载体。这样的药物媒介物可以是液体,例如水和油,包括石油、动物、植物或合成来源的那些油,诸如花生油、大豆油、矿物油、芝麻油等。药物媒介物可以是盐水、金合欢树胶、明胶、淀粉糊剂、滑石粉、角蛋白、胶态二氧化硅、尿素等。另外,可以使用助剂、稳定剂、增稠剂、润滑剂和着色剂。当施用给哺乳动物时,本公开内容的化合物和组合物以及药学上可接受的媒介物、赋形剂或稀释剂可以是无菌的。在某些情况下,当将本公开内容的化合物静脉内地施用时,采用水性介质作为媒介物,诸如水、盐水溶液以及右旋糖水溶液和甘油水溶液。
[0269]
药物组合物可以采取胶囊剂、片剂、丸剂、小丸、锭剂、粉剂、颗粒剂、糖浆剂、酏剂、溶液剂、混悬液、乳剂、栓剂或其持续释放制剂的形式,或适合施用给哺乳动物的任何其它形式。在某些情况下,将药物组合物配制成用于根据常规程序施用,作为适于口服或静脉内施用给人类的药物组合物。合适的药物媒介物及其配制方法的例子描述在:remington:the science and practice of pharmacy,alfonso r.gennaro编,mack publishing co.easton,pa.,第19版,1995,第86、87、88、91和92章,通过引用并入本文。
[0270]
赋形剂的选择将部分地取决于特定载体以及用于施用组合物的特定方法。因此,存在本公开内容的药物组合物的多种合适制剂。
[0271]
例如,可以如下将载体配制成用于注射的制品:将它们溶解、悬浮或乳化于水性或非水性溶剂中,所述溶剂是例如植物油或其它类似的油、合成的脂肪族酸甘油酯、高级脂肪族酸的酯或丙二醇;和如果需要的话,用常规添加剂诸如增溶剂、等渗剂、助悬剂、乳化剂、稳定剂和防腐剂。
[0272]
作为另一个例子,可以将载体配制成适合于口服施用的制品,包括(a)液体溶液,诸如有效量的溶解在稀释剂(诸如水或盐水)中的化合物;(b)胶囊剂、药囊或片剂,每个含有预定量的活性成分,作为固体或颗粒;(c)在适当的液体中的混悬液;和(d)合适的乳剂。片剂形式可以包括下述的一种或多种:乳糖、甘露醇、玉米淀粉、马铃薯淀粉、微晶纤维素、阿拉伯胶、明胶、胶体二氧化硅、交联羧甲纤维素钠、滑石粉、硬脂酸镁、硬脂酸和其它赋形剂、着色剂、稀释剂、缓冲剂、润湿剂、防腐剂、矫味剂和药理学上相容的赋形剂。锭剂形式可以包括在调味剂(通常是蔗糖和阿拉伯胶或黄蓍胶)中的活性成分,以及包括在惰性基质(诸如明胶和甘油,或蔗糖和阿拉伯胶)中的活性成分的软锭剂,乳剂,凝胶,等,其除了活性成分之外还含有如本文描述的这样的赋形剂。
[0273]
作为另一个例子,可以将本公开内容的主题制剂制成气雾剂制剂以通过吸入施用。这些气雾剂制剂可以置于增压的可接受的推进剂(诸如二氯二氟甲烷、丙烷、氮等)中。还可以将它们配制为用于非压力制品的药物,诸如用于用在喷雾器或雾化器中。
[0274]
在某些实施方案中,适合用于胃肠外施用的制剂包括:水性的和非水性的、等渗的无菌注射溶液,其可以含有抗氧化剂、缓冲剂、抑菌剂、和使得所述制剂与预期接受者的血液等渗的溶质,以及水性的和非水性的无菌混悬液,其可以包括助悬剂、增溶剂、增稠剂、稳
定剂和防腐剂。所述制剂可以存在于单位剂量或多次剂量密闭容器(诸如安瓿和管形瓶)中,并且可以在冷冻干燥(低压冻干)条件下储存,仅需要在即将使用前添加无菌液体赋形剂(例如水)以进行注射。可以从前面所述种类的无菌粉剂、颗粒和片剂制备即时注射溶液和混悬液。
[0275]
适合于局部施用的制剂可以呈现为乳膏剂、凝胶、糊剂或泡沫,其除了活性成分外还含有适当的载体。在某些实施方案中,局部制剂含有一种或多种选自构造剂、增稠剂或胶凝剂以及软化剂或润滑剂的组分。经常采用的构造剂包括长链醇,诸如硬脂醇,以及甘油基醚或酯和寡(环氧乙烷)醚或其酯。增稠剂和胶凝剂包括,例如,丙烯酸或甲基丙烯酸的聚合物及其酯,聚丙烯酰胺,以及天然存在的增稠剂诸如琼脂、角叉菜胶、明胶和瓜尔胶。软化剂的例子包括甘油三酯、脂肪酸酯和酰胺,蜡类诸如蜂蜡、鲸蜡或巴西棕榈蜡,磷脂诸如卵磷脂,和固醇及其脂肪酸酯。局部制剂可以进一步包括其它组分,例如,收敛剂、芳香剂、颜料、皮肤穿透增强剂、防晒剂(即,遮光剂)等。
[0276]
可以将本公开内容的化合物配制成用于局部施用。用于局部应用的媒介物可以呈多种形式之一,例如洗剂、乳膏剂、凝胶、软膏剂、棒、喷雾剂或糊剂。它们可以含有不同类型的载体,包括、但不限于溶液、气雾剂、乳剂、凝胶和脂质体。载体可以配制为例如具有水包油或油包水基质的乳剂。在乳剂中采用的合适疏水性(油性)组分包括例如植物油、动物脂肪和油、合成烃及其酯和醇(包括聚酯)以及有机聚硅氧烷油。这样的乳剂还包括乳化剂和/或表面活性剂,例如非离子型表面活性剂,以将不连续相分散和悬浮在连续相内。
[0277]
还通过与多种基质(诸如乳化基质或水溶性基质)混合来提供栓剂制剂。适合用于阴道施用的制剂可以呈现为子宫托、卫生栓、乳膏剂、凝胶、糊剂、泡沫。
[0278]
可提供用于口服或直肠施用的单位剂型,如糖浆剂、酏剂和混悬液,其中每个剂量单位(例如,一茶匙、一汤匙、一个片剂或一个栓剂)含有预定量的组合物,所述组合物含有一种或多种抑制剂。类似地,用于注射或静脉内施用的单位剂型可以包括在组合物中的抑制剂,所述组合物作为在无菌水、生理盐水或另一种药学上可接受的载体中的溶液。
[0279]
本文中使用的术语“单位剂型”表示适合作为用于人类和动物受试者的单位剂量的物理离散单元,每个单元含有与药学上可接受的稀释剂、载体或媒介物联合的预定量的本公开内容的化合物,所述预定量计算为足可产生希望的作用的量。本公开内容的新颖单位剂型的规范取决于所采用的特定化合物和要达到的效果以及与宿主体内的每种化合物相关的药效动力学。
[0280]
剂量水平可以随具体的化合物、递送媒介物的性质等而变化。给定化合物的期望剂量可通过多种方式容易地确定。
[0281]
在本公开内容的上下文中施用给动物(特别是人类)的剂量应当足以在合理的时间范围内在动物中实现预防性或治疗性应答,例如,如在下面更详细地描述的。剂量将取决于多种因素,包括所采用的特定化合物的强度、动物的状况和动物的体重、以及疾病的严重程度和疾病的阶段。剂量的大小还将取决于可能伴随特定化合物的施用的任何不利副作用的存在、性质和程度。
[0282]
在药物剂型中,asc诱导物化合物可以以游离碱、它们的药学上可接受的盐的形式施用,或者它们也可以单独使用,或与其它药学活性化合物适当结合地以及联合地使用。
[0283]
g.临床应用和治疗方法
[0284]
本文公开的组合物和方法可以用于治疗神经学疾病或障碍。在本公开内容的某些方面,提供了治疗受试者中的神经学疾病或障碍的方法,所述方法包括:将经工程改造的受体引入神经元细胞和提供有效量的活化经工程改造的受体的配体以控制细胞的活性,从而减轻受试者的疼痛。在某些方面,将本文公开的载体或组合物用于制造药物,所述药物用于治疗神经学疾病或障碍。
[0285]
在某些情况下,将本公开内容的方法和组合物用于治疗癫痫。本文描述的组合物可以用于预防或控制癫痫发作。癫痫发作可以分类为强直性-阵挛性、强直性、阵挛性、肌阵挛性、失神性或无张力性癫痫发作。在某些情况下,本文的组合物和方法可以预防癫痫发作或使受试者经历的癫痫发作的数目减少约5%、约10%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%、约99%或100%。
[0286]
在某些情况下,将本公开内容的方法和组合物用于治疗进食障碍。进食障碍可能是由对受试者的身体或心理健康产生负面影响的异常进食行为限定的精神障碍。在某些情况下,进食障碍是神经性厌食。在其它情况下,进食障碍是神经性贪食。在某些情况下,进食障碍是异食癖、反刍性障碍、回避性/限制性食物摄入障碍、暴食症(bed)、其它指定的摄食和进食障碍(osfed)、强迫性暴食、糖尿病性食欲亢进、健康食品偏执症、选择性进食障碍、酗酒厌食症、孕期食欲亢进(pregorexia)或美食者综合征。在某些情况下,所述组合物包括增加或减少与进食障碍相关的一种或多种分子的产生的g-蛋白偶联受体。在某些情况下,所述组合物包括改变与进食障碍相关的一种或多种分子的产生的配体门控的离子通道。与进食障碍相关的一种或多种分子可以包括、但不限于下丘脑-垂体-肾上腺(hpa)轴的分子,包括加压素、促皮质素-释放激素(crh)、促肾上腺皮质激素(acth)、皮质醇、肾上腺素或去甲肾上腺素;以及血清素、多巴胺、神经肽y、瘦素或ghrelin。
[0287]
在某些情况下,所述组合物和方法用于治疗创伤后应激障碍(ptsd)、胃食管返流疾病(gerd)、成瘾(例如,酒精、药物)、焦虑症、抑郁症、记忆丧失、痴呆、睡眠呼吸暂停、中风、尿失禁、发作性睡病、特发性震颤、运动障碍、心房颤动、癌症(例如,脑瘤)、帕金森病或阿尔茨海默氏病。可以通过本文的组合物和方法治疗的神经学疾病或障碍的其它非限制性例子包括:丧志症、失写症、酒精中毒、失读症、动脉瘤、一过性黑矇、遗忘症、肌萎缩性侧索硬化(als)、angelman综合征、失语症、失用症、蛛网膜炎、阿诺德-基亚里畸形(arnold-chiari malformation)、阿斯佩格综合征、共济失调、运动失调性毛细血管扩张症、注意力缺陷伴多动障碍、言语听觉处理障碍、孤独症谱群、双相型障碍、贝尔麻痹、臂丛神经损伤、脑损伤、脑外伤、脑瘤、卡纳万病、卡普格拉妄想症、腕管综合征、灼性神经痛、中枢性疼痛综合征、脑桥中央髓鞘溶解、中央核肌病、头静脉障碍(cephalic disorder)、脑动脉瘤、脑动脉硬化、大脑萎缩、常染色体显性遗传性脑动脉病伴皮质下梗死和白质脑病(cadasil)、脑性巨人症、大脑性麻痹、脑血管炎、颈椎管狭窄症、腓骨肌萎缩症、小脑扁桃体下疝畸形、舞蹈病、慢性疲劳综合征、慢性炎性脱髓鞘多神经病(cidp)、慢性疼痛、科菲-劳里综合征(coffin-lowry syndrome)、昏迷、复杂性局部疼痛综合征、压迫性神经病、先天性双侧面瘫、皮质基底核退化症、颅动脉炎、颅缝早闭症、克雅二氏症(creutzfeldt-jakob disease)、积累性损伤错乱、库欣综合征、循环型情感障碍、巨细胞包涵体病(cibd)、巨细胞病毒感染、第四脑室孔闭塞综合征(dandy-walker syndrome)、道森病(dawson disease)、
莫西耶氏综合征(de morsier’s syndrome)、德热里纳-克隆普克麻痹(dejerine-klumpke palsy)、德雅兰-索塔斯病(dejerine-sottas disease)、睡眠时相延迟综合征、痴呆、皮肌炎、发育性共济障碍、糖尿病性神经病、弥漫性硬化、复视、唐氏综合征、dravet综合征、杜兴肌营养不良、构音困难、自主神经机能异常、计算困难、书写困难、运动障碍、诵读困难、张力失常、空蝶鞍综合征、脑炎、脑膨出、脑三叉神经血管瘤病、大便失禁、遗尿症、癫痫、女性癫痫智力障碍、欧勃氏麻痹、红斑性肢痛病、爆炸头综合征、法布里病、法尔氏综合征、昏厥、家族性痉挛性麻痹、高热惊厥、菲希尔综合征、弗里德赖希氏共济失调、纤维肌痛、福维哥氏综合征、胎儿酒精综合征、脆性x综合征、脆性x相关性震颤/共济失调综合征(fxtas)、高歇氏病、全身性癫痫伴热性惊厥附加症、格斯特曼氏综合征(gerstmann’s syndrome)、巨细胞动脉炎、巨细胞性包涵体病、球形细胞样脑白质病、灰质异位症、格-巴二氏综合征、广泛性焦虑障碍、htlv-1相关脊髓病、蛋白球色素退变综合征、头部伤害、头痛、半面痉挛、遗传性痉挛性截瘫、多神经炎型遗传性共济失调、耳带状疱疹、带状疱疹、平山氏综合征(hirayama syndrome)、希什斯普隆氏病(hirschsprung’s disease)、霍-艾二氏综合征(holmes-adie syndrome)、前脑无裂畸形、亨廷顿病、积水性无脑、脑积水、皮质醇增多症、低氧、免疫介导的脑脊髓炎、包涵体肌炎、色素失调症、婴儿雷夫叙姆病、婴儿痉挛症、炎性肌病、颅内囊肿、颅内压增高、具同形双着丝粒15、朱伯特综合征、karak综合征、卡恩斯-塞尔综合征、金斯布林纳综合征、克-列二氏综合征、klippel feil综合征、克拉伯病、拉福拉病、lambert-eaton肌无力综合征、landau-kleffner综合征、延髓外侧(瓦伦伯格(wallenberg))综合征、学习障碍、利氏病(leigh's disease)、lennox-gastaut综合征、lesch-nyhan综合征、脑白质营养不良、白质消融性白质脑病、路易体痴呆、无脑回畸形、闭锁综合征、椎间盘疾病、腰椎椎管狭窄、莱姆病-神经后遗症、machado-joseph病(脊髓小脑性共济失调3型)、巨脑、视物显大症、mal de debarquement、巨脑性白质脑病伴皮质下囊肿、巨脑症、迈-罗二氏综合征(melkersson-rosenthal syndrome)、梅尼埃病、脑膜炎、门克斯病、异染性脑白质营养不良、小头畸形、视物显小症、偏头痛、miller fisher综合征、小中风(短暂性脑缺血发作)、恐音症、线粒体肌病、mobius综合征、单肢肌萎缩、运动技能障碍、烟雾病、粘多糖累积病、多发梗塞性痴呆、多病灶运动神经病、多发性硬化、多系统萎缩、肌营养不良、肌痛性脑脊髓炎、重症肌无力、髓鞘碎裂性弥漫性硬化(myelinoclastic diffuse sclerosis)、婴儿肌阵挛性脑病、肌阵挛、肌病、肌管性肌病、先天性肌强直、发作性睡病、神经-贝赫切特病(neuro-disease)、神经纤维瘤病、神经传导阻滞剂恶性综合征、aids的神经表现、狼疮的神经后遗症、神经性肌强直、神经元蜡样脂褐质沉积症、神经元移位症、神经病、神经机能病、niemann-pick病、非-24-小时睡眠-觉醒障碍、非语言学习障碍、o’sullivan-mcleod综合征、枕神经痛、隐匿性脊柱神经管闭合不全序列症(occult spinal dysraphism sequence)、ohtahara综合征、橄榄体脑桥小脑萎缩、眼球阵挛肌阵挛综合征、视神经炎、直立性低血压、耳硬化症、过度使用综合征、视像存留、感觉异常、帕金森病、先天性副肌强直、副肿瘤疾病、阵发性发作、parry-romberg综合征、pandas、佩-梅二氏病、周期性麻痹、周围神经病、全身性发育迟缓、旋光性喷嚏反射、植烷酸贮积病、皮克病、神经受压、垂体肿瘤、pmg、多神经病、脊髓灰质炎、多小脑回、多肌炎、脑穿通畸形、脊髓灰质炎后综合征、带状疱疹后遗神经痛(phn)、直立性低血压、帕-魏二氏综合征、原发性侧索硬化、朊病毒病、进行性面部偏侧萎缩、进行性多灶性白质脑病、进行性核上性麻痹、面部失认、假脑瘤、象限盲、四
肢瘫痪、狂犬病、神经根病、拉姆齐
·
亨特综合征i型、拉姆齐
·
亨特综合征ii型、拉姆齐
·
亨特综合征iii型、rasmussen脑炎、反射性神经血管营养不良、雷夫叙姆病、rem睡眠行为障碍、重复性应力损伤、不宁腿综合征、逆转录病毒-相关的脊髓病、瑞特综合征、瑞氏综合征、节律性运动障碍、龙贝里综合征、saint vitus舞蹈病(saint vitus dance)、桑德霍夫病、谢耳德病、脑裂畸形、感觉处理障碍、视-隔发育不良、惊吓婴儿综合征、带状疱疹、夏伊-德雷格综合征、舍格伦综合征、睡眠呼吸暂停、非洲锥虫病、snatiation、sotos综合征、痉挛状态、脊柱裂、脊髓损伤、脊髓肿瘤、脊髓性肌萎缩、脊髓延髓肌肉萎缩症、脊髓小脑性共济失调、脑裂、斯-里-奥三氏综合征(steele-richardson-olszewski syndrome)、僵人综合征、中风、斯德奇-韦伯综合征、口吃、亚急性硬化性全脑炎、皮层下动脉硬化性脑病、浅表铁尘肺、西登哈姆舞蹈病、晕厥、牵连感觉、脊髓空洞症、跗管综合征、迟发性运动障碍、迟发性精神障碍、tarlov囊肿、泰-萨克斯病、颞动脉炎、颞叶癫痫、破伤风、脊髓栓系综合征、肌强直性白内障、胸廓出口综合征、三叉神经痛、托德麻痹、多动秽语综合征、中毒性脑病、短暂性脑缺血发作、传播性海绵状脑病、横贯性脊髓炎、创伤性脑损伤、震颤、拔毛癖、三叉神经痛、热带痉挛性轻截瘫、锥虫病、结节性硬化症、unverricht-lundborg病、希-林二氏病(vhl)、viliuisk脑脊髓炎(ve)、瓦伦伯格氏综合征、韦斯特综合征、颈椎加速伸展性损伤、威廉斯综合征、威尔森氏病或脑肝肾综合征。
[0288]
在某些情况下,本文公开的组合物和方法可以用于治疗脑癌或脑肿瘤。可以适于用本文描述的载体和组合物治疗的脑癌或肿瘤的非限制性例子包括:神经胶质瘤,包括间变性星形细胞瘤(iii级神经胶质瘤)、星形细胞瘤(ii级神经胶质瘤)、脑干神经胶质瘤、室管膜瘤、神经节神经胶质瘤、神经节瘤、胶质母细胞瘤(iv级神经胶质瘤)、神经胶质瘤、青少年毛细胞性星形细胞瘤(jpa)、低级星形细胞瘤(lga)、髓质母细胞瘤、混合性神经胶质瘤、少突神经胶质瘤、视神经神经胶质瘤、毛细胞性星形细胞瘤(i级神经胶质瘤)和原始性神经外胚层(pnet);颅底肿瘤,包括听神经瘤(前庭神经鞘瘤)、肢端肥大症、腺瘤、软骨肉瘤、脊索瘤、颅咽管瘤、表皮样肿瘤、颈静脉球瘤、幕下脑膜瘤、脑膜瘤、垂体腺瘤、垂体瘤、rathke氏裂囊肿(rathke’s cleft cyst);转移性癌症,包括脑转移、转移性脑肿瘤;其它脑肿瘤,包括脑囊肿、脉络丛乳头状瘤、cns淋巴瘤、胶质囊肿、囊性肿瘤、皮样瘤、生殖细胞瘤、淋巴瘤、鼻癌、鼻咽肿瘤、松果体肿瘤、松果体母细胞瘤、松果体细胞瘤、幕上脑膜瘤和血管肿瘤;脊髓肿瘤,包括星形细胞瘤、室管膜瘤、脑膜瘤和许旺细胞瘤。
[0289]
本公开内容部分地涵盖了用于控制、管理、预防或治疗受试者的疼痛的组合物和方法。“疼痛”表示受试者身体的不舒服感受和/或不愉快感觉。疼痛的感觉可以在从轻度和偶发到严重和持续的范围内。疼痛可以分类为急性疼痛或慢性疼痛。疼痛可以是伤害性疼痛(即,由组织损伤造成的疼痛)、神经性疼痛或心理性疼痛。在某些情况下,疼痛是由疾病(例如,癌症、关节炎、糖尿病)造成或与其相关。在其它情况下,疼痛是由损伤(例如,运动损伤、创伤)造成。适于用本文的组合物和方法治疗的疼痛的非限制性例子包括:神经性疼痛,包括周围神经病、糖尿病性神经病、疱疹后神经痛、三叉神经痛、背痛、与癌症相关的神经病、与hiv/aids相关的神经病、幻肢痛、腕管综合征、中枢性中风后疼痛、与慢性酒精中毒相关的疼痛、甲状腺功能减退、尿毒症、与多发性硬化相关的疼痛、与脊髓损伤相关的疼痛、与帕金森病相关的疼痛、癫痫、骨关节炎疼痛、风湿样关节炎疼痛、内脏痛以及与维生素缺乏症相关的疼痛;以及伤害性疼痛,包括与中枢神经系统创伤、劳损/扭伤和烧伤相关的疼痛;
心肌梗塞、急性胰腺炎、手术后疼痛、创伤后疼痛、肾绞痛、与癌症相关的疼痛、与纤维肌痛相关的疼痛、与腕管综合征相关的疼痛以及背痛。
[0290]
本文的组合物和方法可以用于减轻受试者的疼痛水平。在某些情况下,受试者的疼痛水平减轻了至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少99%或约100%。可以通过多种方法来评估受试者的疼痛水平。在某些情况下,通过自我报告(即,人受试者表达他/她正在经历的疼痛水平的言语报告)来评估疼痛水平。在某些情况下,通过疼痛的行为指标来评估疼痛水平,例如,面部表情、肢体活动、发声、躁动和防卫。例如,当受试者不能自我报告(例如,婴儿、无意识的受试者、非人受试者)时,这些类型的评估可以是有用的。与用所述组合物治疗之前受试者正在经历的疼痛水平相比,可以在用本公开内容的组合物治疗之后评估疼痛水平。
[0291]
在不同的实施方案中,用于控制、管理、预防或治疗受试者的疼痛的方法包括给所述受试者施用有效量的本文涵盖的经工程改造的受体。不希望受任何特定理论约束,本公开内容涵盖了使用本文公开的载体来调节神经元活性以减轻受试者的疼痛。
[0292]
在不同的实施方案中,将编码经工程改造的受体(其活化或除极化神经元细胞)的载体施用给(或引入)减少痛觉的一个或多个神经元细胞,例如,抑制性中间神经元。在有配体存在下,表达经工程改造的受体的神经元细胞被活化并且减少对疼痛的敏感性,从而增强刺激这些神经元细胞的镇痛作用。
[0293]
在不同的实施方案中,将编码经工程改造的受体(其灭活或超极化神经元细胞)的载体施用给(或引入)增加痛觉或对疼痛的敏感性的一个或多个神经元细胞,例如,伤害感受器、周围感觉神经元、c-纤维、aδ纤维、aβ纤维、drg神经元、tgg神经元等。在有配体存在下,表达经工程改造的受体的神经元细胞被灭活并且减少对疼痛的敏感性,并且增强镇痛作用。
[0294]
将经工程改造的受体的表达靶向伤害感受器的亚群可以通过以下中的一种或多种实现:选择载体(例如,aav1、aav1(y705 731f t492v)、aav2(y444 500 730f t491v)、aav3(y705 731f)、aav5、aav5(y436 693 719f)、aav6、aav6(vp3变体y705f/y731f/t492v)、aav-7m8、aav8、aav8(y733f)、aav9、aav9(vp3变体y731f)、aav10(y733f)和aav-shh10);选择启动子;和递送装置。
[0295]
在特定实施方案中,本文涵盖的组合物和方法有效减轻疼痛。适于用本文涵盖的载体、组合物和方法治疗的疼痛的示例性例子包括、但不限于急性疼痛、慢性疼痛、神经性疼痛、伤害性疼痛、痛觉超敏、炎症性疼痛、炎症性痛觉过敏、神经病、神经痛、糖尿病性神经病、人免疫缺陷病毒相关的神经病、神经损伤、风湿样关节炎疼痛、骨关节炎疼痛、烧伤、背痛、眼痛、内脏痛、癌症痛(例如,骨癌症痛)、牙痛、头痛、偏头痛、腕管综合征、纤维肌痛、神经炎、坐骨神经痛、骨盆超敏反应、骨盆痛、疱疹后神经痛、手术后疼痛、中风后疼痛和月经痛。
[0296]
疼痛可以分类为急性或慢性。“急性疼痛”表示突然开始并且通常在品质上尖锐的疼痛。急性疼痛可能是轻度的并且仅持续片刻,或者可能是严重的并且持续数周或数月。在大多数情况下,急性疼痛不会持续超过三个月,并且当疼痛的根本原因已经得到治疗或已
经治愈时,它会消失。但是,未缓解的急性疼痛可能导致慢性疼痛。“慢性疼痛”表示进行中的或复发的疼痛、持续超过急性疾病或损伤的常见病程或持续超过三至六个月,并且其不利地影响个体的健康状况。在特定实施方案中,术语“慢性疼痛”表示在它不应该继续时继续的疼痛。慢性疼痛可以是伤害性疼痛或神经性疼痛。
[0297]
在某些实施方案中,预料或预期疼痛与损伤、感染或医学干预关联地或作为损伤、感染或医学干预的结果而发生。在某些实施方案中,所述感染造成神经损伤。在某些实施方案中,所述医学干预是手术,诸如对身体的中央轴的手术。在某些实施方案中,所述医学干预是除去体内的一个或多个组织、肿瘤或器官的部分或全部的手术。在某些实施方案中,所述医学干预是截肢术。在特定实施方案中,本文涵盖的组合物和方法有效减轻急性疼痛。在特定实施方案中,本文涵盖的组合物和方法有效减轻慢性疼痛。
[0298]
当在患者的症状中出现不适和异常敏感性特征时,会存在临床疼痛。个体可以呈现各种疼痛症状。这样的症状包括:1)自发性疼痛,其可以是钝痛、灼痛或刺痛;2)对有害刺激的过度疼痛应答(痛觉过敏);以及3)由通常无害的刺激产生的疼痛(痛觉超敏-meyer等人,1994,textbook of pain,13-44)。尽管遭受各种形式的急性和慢性疼痛的患者可能具有类似的症状,但是根本机制可能不同,并且因此可能需要不同的治疗策略。因此,还可以根据不同的病理生理学将疼痛分成许多不同的亚型,包括伤害性疼痛、炎症性疼痛和神经性疼痛。
[0299]
在特定实施方案中,本文涵盖的组合物和方法有效减轻伤害性疼痛。在特定实施方案中,本文涵盖的组合物和方法有效减轻炎症性疼痛。在特定实施方案中,本文涵盖的组合物和方法有效减轻神经性疼痛。
[0300]
伤害性疼痛是由组织损伤或由可能引起损伤的强烈刺激诱导的。中度至重度急性伤害性疼痛是来自中枢神经系统创伤、劳损/扭伤、烧伤、心肌梗塞和急性胰腺炎、手术后疼痛(任何类型的外科手术后的疼痛)、创伤后疼痛、肾绞痛、癌症痛和背痛的疼痛的突出特征。癌症痛可以是慢性疼痛诸如肿瘤相关的疼痛(例如,骨痛、头痛、面部疼痛或内脏痛)或与癌症疗法相关的疼痛(例如,化学疗法后综合征、慢性手术后疼痛综合征或辐射后综合征)。癌症痛还可以响应于化学疗法、免疫疗法、激素疗法或放射疗法而发生。背痛可能是由于椎间盘突出或破裂或腰椎小平面关节、骶髂关节、脊柱旁肌肉或后纵韧带的异常所致。背痛可以自然消退,但在某些患者中,在背痛持续超过12周的情况下,背痛变成可能使人特别虚弱的慢性病症。
[0301]
神经性疼痛可以定义为由神经系统中的原发性病变或功能障碍引发或造成的疼痛。神经性疼痛的病因包括,例如,周围神经病、糖尿病性神经病、疱疹后神经痛、三叉神经痛、背痛、癌症神经病、hiv神经病、幻肢痛、腕管综合征、中枢性中风后疼痛以及与慢性酒精中毒、甲状腺功能减退、尿毒症、多发性硬化、脊髓损伤、帕金森病、癫痫和维生素缺乏相关的疼痛。
[0302]
神经性疼痛可以与疼痛障碍有关,术语疼痛障碍表示与疼痛相关或由疼痛造成的疾病、障碍或病症。疼痛障碍的示例性例子包括关节炎、痛觉超敏、典型三叉神经痛、三叉神经痛、躯体病样障碍、感觉减退、痛觉过敏(hypealgesia)、神经痛、神经炎、神经源性疼痛、痛觉缺失、痛性感觉缺失、灼痛(causlagia)、坐骨神经疼痛障碍、退化性关节障碍、纤维肌痛、内脏性疾病、慢性疼痛障碍、偏头痛/头痛、慢性疲劳综合症、复杂性局部疼痛综合征、神
经营养不良、足底筋膜炎或与癌症相关的疼痛。
[0303]
炎症性过程是复杂的一系列生化和细胞事件,它们响应于组织损伤或外来物质的存在而被活化,这导致了肿胀和疼痛。关节炎疼痛是常见的炎症性疼痛。
[0304]
适于用本文涵盖的载体、组合物和方法治疗的其它疼痛类型包括、但不限于由肌肉骨骼障碍引起的疼痛,包括肌痛、纤维肌痛、脊柱炎、血清阴性的(非风湿样的)关节病、非关节风湿病、抗肌萎缩蛋白病、肝糖分解、多肌炎和脓性肌炎;心脏和血管疼痛,包括由心绞痛、心肌梗塞、二尖瓣狭窄、心包炎、雷诺氏现象、硬肿病和骨骼肌缺血引起的疼痛;头痛,如偏头痛(包括有先兆的偏头痛和没有先兆的偏头痛)、丛集性头痛、紧张型头痛、混合性头痛和与血管障碍相关的头痛;以及口面部痛,包括牙痛、耳痛、口腔烧灼综合征和颞下颌肌盘膜痛。
[0305]
使用多种疼痛量表,可以确定本文涵盖的组合物和方法减少人受试者经历的疼痛量的有效量。患者自我报告可以用于评估疼痛是否减少;参见,例如,katz和melzack(1999)surg.clin.north am.79:231。可替换地,可以使用观察性疼痛量表。lanss疼痛量表可以用于评估疼痛是否减少;参见,例如,bennett(2001)pain 92:147。可以使用视觉模拟疼痛量表;参见,例如,schmader(2002)clin.j.pain 18:350。可以使用likert疼痛量表;例如,其中0为无痛、5为中度疼痛,并且10为可能的最严重疼痛。用于儿童的自我报告疼痛量表包括,例如,面部表情疼痛量表;wong-baker面部表情疼痛评级量表;以及彩色模拟量表。用于成年人的自我报告疼痛量表包括,例如,视觉模拟量表;言语数值评级量表;言语描述符量表;以及简易疼痛清单。疼痛测量量表包括,例如,alder hey分筛疼痛评分(stewart等人(2004)arch.dis.child.89:625);行为疼痛量表(payen等人(2001)critical care medicine 29:2258);简易疼痛清单(cleeland和ryan(1994)ann.acad.med.singapore 23:129);非言语疼痛指示符清单(feldt(2000)pain manag.nurs.1:13);病危护理疼痛观察工具(gelinas等人(2006)am.j.crit.care 15:420);comfort量表(ambuel等人(1992)j.pediatric psychol.17:95);dallas疼痛调查表(ozguler等人(2002)spine 27:1783);测痛计疼痛指数(hardy等人(1952)pain sensations and reactions baltimore:the williams&wilkins co.);面部表情疼痛量表-修订版(hicks等人(2001)pain 93:173);脸腿活动哭泣安抚量表;mcgill疼痛调查表(melzack(1975)pain 1:277);描述符差异量表(gracely和kwilosz(1988)pain 35:279);数值11点盒(jensen等人(1989)clin.j.pain 5:153);数值评级量表(hartrick等人(2003)pain pract.3:310);wong-baker面部表情疼痛评级量表;以及视觉模拟量表(huskisson(1982)j.rheumatol.9:768)。
[0306]
在特定实施方案中,提供了缓解受试者中的疼痛的方法,所述方法包括:将经工程改造的受体引入神经元细胞和通过提供有效量的活化所述经工程改造的受体的配体来控制所述细胞的活性,从而减轻受试者的疼痛。所述方法针对疼痛提供了显著的镇痛,而无脱靶效应,诸如一般的中枢神经系统抑制。在某些实施方案中,与未经治疗的受试者相比,所述方法使受试者中的神经性疼痛减少1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多。在某些实施方案中,所述方法包括在施用结合剂之前和之后测量受试者中的疼痛的步骤,其中受试者中的疼痛减少1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、
93%、94%、95%、96%、97%、98%、99%或更多。在这样的情况下,所述测量可以发生在施用结合剂以后4小时或更长时间,例如施用结合剂以后8小时、12小时、16小时、24小时、36小时、48小时、3天或4天或更长时间。
[0307]
在特定实施方案中,将本文涵盖的载体施用或引入到一个或多个神经元细胞。所述神经元细胞可以是相同类型的神经元细胞,或者不同类型的神经元细胞的混合群体。在一个实施方案中,所述神经元细胞是伤害感受器或周围感觉神经元。感觉神经元的示例性例子包括、但不限于,背根神经节(drg)神经元和三叉神经节(tgg)神经元。在一个实施方案中,所述神经元细胞是参与神经元疼痛回路的抑制性中间神经元。
[0308]
在某些情况下,将编码经工程改造的受体的载体施用给有此需要的受试者。施用方法的非限制性例子包括皮下施用、静脉内施用、肌肉内施用、真皮内施用、腹膜内施用、口服施用、输注、颅内施用、鞘内施用、鼻内施用、神经节内施用、椎管内施用、小脑延髓池施用和神经内施用。在某些情况下,施用可以涉及载体的液体制剂的注射。在其它情况下,施用可以涉及载体的固体制剂的口服递送。在某些情况下,口服制剂可以与食物一起施用。在特定实施方案中,胃肠外地、静脉内地、肌肉内地、腹膜内地、鞘内地、神经内地、神经节内地、椎管内地或心室内地将载体施用给受试者,以便将载体引入到一个或多个神经元细胞中。在不同的实施方案中,所述载体是raav。
[0309]
在一个实施方案中,通过鞘内(it)或神经节内(ig)施用将aav施用给感觉神经元或伤害感受器,例如,drg神经元、tgg神经元等。所述it途径将aav递送至脑脊液(csf)。该施用途径可以适合用于治疗例如慢性疼痛或其它周围神经系统(pns)或中枢神经系统(cns)适应症。在动物中,通过将it导管穿过小脑延髓池插入并将其尾端推进到腰椎水平,已经实现it施用。在人类中,通过腰椎穿刺术(lp),即一种具有优秀安全性谱的常规床边操作,可以容易地进行it递送。
[0310]
在特定情况下,通过神经节内施用可以将载体施用给受试者。神经节内施用可以涉及直接注射到一个或多个神经节中。ig途径可以将aav直接递送进drg或tgg实质中。在动物中,通过开放式神经外科手术进行向drg的ig施用,开放式神经外科手术在人类中是不希望的,因为它将需要复杂的且侵入性的操作。在人类中,可以使用微创ct成像引导的技术来安全地靶向drg。用于对流增强递送(ced)的定制针组合件可以用于将aav递送进drg实质中。在一个非限制性实施例中,可以将本公开内容的载体递送至一个或多个背根神经节和/或三叉神经节以用于治疗慢性疼痛。在另一个非限制性实施例中,可以将本公开内容的载体递送至结状神经节(迷走神经)以治疗癫痫。
[0311]
在又另一种特定情况下,可以通过颅内施用(即,直接施用到脑中)将载体施用给受试者。在颅内施用的非限制性例子中,可以将本公开内容的载体递送进脑皮质中以治疗例如癫痫发作病灶,递送进室旁下丘脑中以治疗例如饱感障碍,或递送进扁桃体中央核中以治疗例如饱感障碍。在另一种特定情况下,可以通过神经内注射(即,直接注射到神经中)将载体施用给受试者。可以基于待治疗的适应症来选择神经,例如,注射到坐骨神经中以治疗慢性疼痛,或注射到迷走神经中以治疗癫痫或饱感障碍。在又另一种特定情况下,可以通过皮下注射将载体施用给受试者,例如注射到感觉神经末梢中以治疗慢性疼痛。
[0312]
载体剂量可以表示为递送至受试者的载体基因组单位的数目。本文中使用的“载体基因组单位”表示在剂量中施用的单个载体基因组的数目。单个载体基因组的大小通常
取决于所用病毒载体的类型。本公开内容的载体基因组可以是从约1.0千碱基、1.5千碱基、2.0千碱基、2.5千碱基、3.0千碱基、3.5千碱基、4.0千碱基、4.5千碱基、5.0千碱基、5.5千碱基、6.0千碱基、6.5千碱基、7.0千碱基、7.5千碱基、8.0千碱基、8.5千碱基、9.0千碱基、9.5千碱基、10.0千碱基至超过10.0千碱基。因此,单个载体基因组可以包括多达或大于10,000个核苷酸碱基对。在某些情况下,载体剂量可以是约1x106、2x106、3x106、4x106、5x106、6x106、7x106、8x106、9x106、1x107、2x107、3x107、4x107、5x107、6x107、7x107、8x107、9x107、1x108、2x108、3x108、4x108、5x108、6x108、7x108、8x108、9x108、1x109、2x109、3x109、4x109、5x109、6x109、7x109、8x109、9x109、1x10
10
、2x10
10
、3x10
10
、4x10
10
、5x10
10
、6x10
10
、7x10
10
、8x10
10
、9x10
10
、1x10
11
、2x10
11
、3x10
11
、4x10
11
、5x10
11
、6x10
11
、7x10
11
、8x10
11
、9x10
11
、1x10
12
、2x10
12
、3x10
12
、4x10
12
、5x10
12
、6x10
12
、7x10
12
、8x10
12
、9x10
12
、1x10
13
、2x10
13
、3x10
13
、4x10
13
、5x10
13
、6x10
13
、7x10
13
、8x10
13
、9x10
13
、1x10
14
、2x10
14
、3x10
14
、4x10
14
、5x10
14
、6x10
14
、7x10
14
、8x10
14
、9x10
14
、1x10
15
、2x10
15
、3x10
15
、4x10
15
、5x10
15
、6x10
15
、7x10
15
、8x10
15
、9x10
15
、1x10
16
、2x10
16
、3x10
16
、4x10
16
、5x10
16
、6x10
16
、7x10
16
、8x10
16
、9x10
16
、1x10
17
、2x10
17
、3x10
17
、4x10
17
、5x10
17
、6x10
17
、7x10
17
、8x10
17
、9x10
17
、1x10
18
、2x10
18
、3x10
18
、4x10
18
、5x10
18
、6x10
18
、7x10
18
、8x10
18
、9x10
18
、1x10
19
、2x10
19
、3x10
19
、4x10
19
、5x10
19
、6x10
19
、7x10
19
、8x10
19
、9x10
19
、1x10
20
、2x10
20
、3x10
20
、4x10
20
、5x10
20
、6x10
20
、7x10
20
、8x10
20
、9x10
20
或更多个载体基因组单位。
[0313]
在特定实施方案中,将本文涵盖的载体以以下滴度施用给受试者:至少约1x109各基因组颗粒/ml,至少约1x10
10
各基因组颗粒/ml,至少约5x10
10
各基因组颗粒/ml,至少约1x10
11
各基因组颗粒/ml,至少约5x10
11
各基因组颗粒/ml,至少约1x10
12
各基因组颗粒/ml,至少约5x10
12
各基因组颗粒/ml,至少约6x10
12
各基因组颗粒/ml,至少约7x10
12
各基因组颗粒/ml,至少约8x10
12
各基因组颗粒/ml,至少约9x10
12
各基因组颗粒/ml,至少约10x10
12
各基因组颗粒/ml,至少约15x10
12
各基因组颗粒/ml,至少约20x10
12
各基因组颗粒/ml,至少约25x10
12
各基因组颗粒/ml,至少约50x10
12
各基因组颗粒/ml,或至少约100x10
12
各基因组颗粒/ml。参考病毒滴度使用的术语“基因组颗粒(gp)”或“基因组当量”或“基因组拷贝”(gc)表示含有重组aav dna基因组的病毒粒子的数目,不管感染性或功能性如何。通过本领域充分理解的方法,例如,基因组dna的定量pcr,或例如在以下文献中的方法,可以测量在特定载体制品中的基因组颗粒的数目:clark等人(1999)hum.gene ther.,10:1031-1039;veldwijk等人(2002)mol.ther.,6:272-278。
[0314]
可以在一定体积的流体中施用本公开内容的载体。在某些情况下,可以在约0.1ml、0.2ml、0.3ml、0.4ml、0.5ml、0.6ml、0.7ml、0.8ml、0.9ml、1.0ml、2.0ml、3.0ml、4.0ml、5.0ml、6.0ml、7.0ml、8.0ml、9.0ml、10.0ml、11.0ml、12.0ml、13.0ml、14.0ml、15.0ml、16.0ml、17.0ml、18.0ml、19.0ml、20.0ml或大于20.0ml的体积中施用载体。在某些情况下,载体剂量可以表示为施用给受试者的载体的浓度或滴度。在此情况下,载体剂量可以表示为单位体积中载体基因组单位的数目(即,基因组单位/体积)。
[0315]
在特定实施方案中,以至少约5x109个感染单位/ml、至少约6x109个感染单位/ml、至少约7x109个感染单位/ml、至少约8x109个感染单位/ml、至少约9x109个感染单位/ml、至少约1x10
10
个感染单位/ml、至少约1.5x10
10
个感染单位/ml、至少约2x10
10
个感染单位/ml、至少约2.5x10
10
个感染单位/ml、至少约5x10
10
个感染单位/ml、至少约1x10
11
个感染单位/ml、至少约2.5x10
11
个感染单位/ml、至少约5x10
11
个感染单位/ml、至少约1x10
12
个感染单
位/ml、至少约2.5x10
12
个感染单位/ml、至少约5x10
12
个感染单位/ml、至少约1x10
13
个感染单位/ml、至少约5x10
13
个感染单位/ml、至少约1x10
14
个感染单位/ml的滴度将本文涵盖的载体施用给受试者。参考病毒滴度使用的术语“感染单位(iu)”、“感染颗粒”或“复制单位”表示具有感染和复制能力的重组aav载体颗粒的数目,如通过例如在mclaughlin等人(1988)j.virol.,62:1963-1973中描述的感染中心测定(也称为复制中心测定)所测量的。
[0316]
在特定实施方案中,以至少约5x10
10
个转导单位/ml、至少约1x10
11
个转导单位/ml、至少约2.5x10
11
个转导单位/ml、至少约5x10
11
个转导单位/ml、至少约1x10
12
个转导单位/ml、至少约2.5x10
12
个转导单位/ml、至少约5x10
12
个转导单位/ml、至少约1x10
13
个转导单位/ml、至少约5x10
13
个转导单位/ml、至少约1x10
14
个转导单位/ml的滴度将本文涵盖的载体施用给受试者。参考病毒滴度使用的术语“转导单位”(tu)”表示导致功能性转基因产物产生的感染性重组aav载体颗粒的数目,如在例如以下文献中描述的功能测定中所测量的:xiao等人(1997)exp.neurobiol.,144:113-124;或fisher等人(1996)j.virol.,70:520-532(lfu测定)。
[0317]
载体剂量通常将由施用途径决定。在一个特定实施例中,神经节内注射可以包括在从约0.1ml至约1.0ml的体积中的从约1x109至约1x10
13
个载体基因组。在另一种特定情况下,鞘内注射可以包括在从约1.0ml至约12.0ml的体积中的从约1x10
10
至约1x10
15
个载体基因组。在另一种特定情况下,颅内注射可以包括在从约0.1ml至约1.0ml的体积中的从约1x109至约1x10
13
个载体基因组。在另一种特定情况下,神经内注射可以包括在从约0.1ml至约1.0ml的体积中的从约1x109至约1x10
13
个载体基因组。在另一个特定实施例中,椎管内注射可以包括在从约0.1ml至约1.0ml的体积中的从约1x109至约1x10
13
个载体基因组。在另一种特定情况下,小脑延髓池输注可以包括在从约0.5ml至约5.0ml的体积中的从约5x109至约5x10
13
个载体基因组。在另一种特定情况下,皮下注射可以包括在从约0.1ml至约1.0ml的体积中的从约1x109至约1x10
13
个载体基因组。
[0318]
在某些情况下,通过输注将载体递送至受试者。通过输注递送至受试者的载体剂量可以测量为载体输注速率。载体输注速率的非限制性例子包括:对于神经节内、椎管内、颅内或神经内施用,1-10μl/min;和对于鞘内或小脑延髓池施用,10-1000μl/min。在某些情况下,通过mri引导的对流增强递送(ced)将载体递送至受试者。此技术使得能够增加分布在脑部的整个大体积中的病毒扩散和转导以及减少载体沿针途径的回流。
[0319]
在不同的实施方案中,提供了一种方法,其包括将编码经工程改造的受体(其灭活或超极化神经元细胞)的载体施用给增加痛觉或对疼痛的敏感性的一个或多个神经元细胞,和将特异性地结合表达所述经工程改造的受体的神经元细胞的配体施用给受试者,从而灭活所述细胞、减少对疼痛的敏感性和增强镇痛作用。
[0320]
在不同的实施方案中,提供了一种方法,其包括将编码经工程改造的受体(其活化或极化神经元细胞)的载体施用给减少痛觉或对疼痛的敏感性的一个或多个神经元细胞,和将特异性地结合表达所述经工程改造的受体的神经元细胞的配体施用给受试者,从而活化所述细胞、减少对疼痛的敏感性和增强镇痛作用。
[0321]
可以通过各种途径将配体的制剂施用给受试者。施用方法的非限制性例子包括皮下施用、静脉内施用、肌肉内施用、透皮施用、真皮内施用、腹膜内施用、口服施用、输注、颅内施用、鞘内施用、鼻内施用、神经节内施用和神经内施用。在某些情况下,施用可以涉及配
体的液体制剂的注射。在其它情况下,施用可以涉及配体的固体制剂的口服递送。在特定情况下,通过口服施用(例如,丸剂、片剂、胶囊剂等)来施用配体。在某些情况下,口服组合物可以与食物一起施用。在另一种特定情况下,通过鞘内注射(即,注射到脊髓的蛛网膜下空间中)来施用配体以用于递送至受试者的脑脊液(csf)。在另一种特定情况下,局部地(例如,真皮贴剂、乳膏剂、洗剂、软膏剂等)施用配体。
[0322]
施用给受试者的配体的剂量不受绝对限制,但将取决于组合物及其活性成分的性质和它的不希望的副作用(例如,针对抗体的免疫应答)、所治疗的受试者和所治疗的病症的类型以及施用方式。通常,剂量将是治疗有效量,诸如足以实现期望的生物学效应的量,例如有效减少或减弱受试者所感受的疼痛水平的量。在特定实施方案中,剂量也可以是预防量或有效量。配体的治疗有效量可以取决于施用途径、所治疗的适应症和/或选择使用的配体。
[0323]
在一个实施方案中,在施用载体之前先将配体施用给受试者。可以在递送载体后的某个时间将治疗有效量的配体施用给受试者。通常,在递送载体后,受试者的一个或多个细胞需要一段时间来产生由所述载体编码的蛋白(即,经工程改造的受体)。在这段时间内,配体向受试者的施用可能对受试者无益。在此情况下,可能合适的是,在受试者的一个或多个细胞已经产生一定量的经工程改造的受体后施用配体。
[0324]
在一个实施方案中,在将载体施用给受试者的大约相同时间先将配体施用给受试者。
[0325]
在一个实施方案中,在将载体施用给受试者后1、2、3、4、5、6、7、8、9、11或12小时、数天、数周、数月或数年先施用配体。在某些情况下,可以在递送载体后至少一天、两天、三天、四天、五天、六天、七天、八天、九天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天、21天、22天、23天、24天、25天、26天、27天、28天、29天、30天或超过30天将治疗有效量的配体施用给受试者。在一个特定实施例中,在递送载体后至少一周将治疗有效量的配体施用给受试者。在另一个实施例中,每天将治疗有效量的配体施用给受试者,持续至少连续三天。
[0326]
本公开内容的配体的治疗有效量或剂量可以表示为mg或μg配体/千克受试者体重。在某些情况下,配体的治疗有效量可以是约0.001μg/kg、约0.005μg/kg、约0.01μg/kg、约0.05μg/kg、约0.1μg/kg、约0.5μg/kg、约1μg/kg、约2μg/kg、约3μg/kg、约4μg/kg、约5μg/kg、约6μg/kg、约7μg/kg、约8μg/kg、约9μg/kg、约10μg/kg、约20μg/kg、约30μg/kg、约40μg/kg、约50μg/kg、约60μg/kg、约70μg/kg、约80μg/kg、约90μg/kg、约100μg/kg、约120μg/kg、约140μg/kg、约160μg/kg、约180μg/kg、约200μg/kg、约220μg/kg、约240μg/kg、约260μg/kg、约280μg/kg、约300μg/kg、约320μg/kg、约340μg/kg、约360μg/kg、约380μg/kg、约400μg/kg、约420μg/kg、约440μg/kg、约460μg/kg、约480μg/kg、约500μg/kg、约520μg/kg、约540μg/kg、约560μg/kg、约580μg/kg、约600μg/kg、约620μg/kg、约640μg/kg、约660μg/kg、约680μg/kg、约700μg/kg、约720μg/kg、约740μg/kg、约760μg/kg、约780μg/kg、约800μg/kg、约820μg/kg、约840μg/kg、约860μg/kg、约880μg/kg、约900μg/kg、约920μg/kg、约940μg/kg、约960μg/kg、约980μg/kg、约1mg/kg、约2mg/kg、约3mg/kg、约4mg/kg、约5mg/kg、约6mg/kg、约7mg/kg、约8mg/kg、约9mg/kg、约10mg/kg或大于10mg/kg。
[0327]
在特定实施方案中,施用给受试者的配体的剂量是至少约0.001微克/千克(μg/
kg)、至少约0.005μg/kg、至少约0.01μg/kg、至少约0.05μg/kg、至少约0.1μg/kg、至少约0.5μg/kg、0.001毫克/千克(mg/kg)、至少约0.005mg/kg、至少约0.01mg/kg、至少约0.05mg/kg、至少约0.1mg/kg、至少约0.5mg/kg、至少约1mg/kg、至少约2mg/kg、至少约3mg/kg、至少约4mg/kg、至少约5mg/kg、至少约5mg/kg、至少约6mg/kg、至少约7mg/kg、至少约8mg/kg、至少约8mg/kg、至少约9mg/kg或至少约10或more mg/kg。
[0328]
在特定实施方案中,施用给受试者的配体的剂量是至少约0.001μg/kg至至少约10mg/kg、至少约0.01μg/kg至至少约10mg/kg、至少约0.1μg/kg至至少约10mg/kg、至少约1μg/kg至至少约10mg/kg、至少约0.01mg/kg至至少约10mg/kg、至少约0.1mg/kg至至少约10mg/kg、或至少约1mg/kg至至少约10mg/kg或其任何插入范围。
[0329]
在某些方面,配体的治疗有效量可以表示为摩尔浓度(即,m或mol/l)。在某些情况下,配体的治疗有效量可以是约1nm、2nm、3nm、4nm、5nm、6nm、7nm、8nm、9nm、10nm、20nm、30nm、40nm、50nm、60nm、70nm、80nm、90nm、100nm、200nm、300nm、400nm、500nm、600nm、700nm、800nm、900nm、1mm、2mm、3mm、4mm、5mm、6mm、7mm、8mm、9mm、10mm、20mm、30mm、40mm、50mm、60mm、70mm、80mm、90mm、100mm、200mm、300mm、400mm、500mm、600mm、700mm、800mm、900mm、1000mm或更大。
[0330]
可以每天施用治疗有效量的配体一次或超过一次。在某些情况下,根据需要(例如,当需要疼痛缓解时)施用治疗有效量的配体。可以连续地施用配体(例如,在治疗方案的持续时间内每天不间断地)。在某些情况下,治疗方案可以是小于一周、一周、两周、三周、一个月或大于一个月。在某些情况下,施用治疗有效量的配体一天、至少两个连续天、至少三个连续天、至少四个连续天、至少五个连续天、至少六个连续天、至少七个连续天、至少八个连续天、至少九个连续天、至少十个连续天或至少大于十个连续天。在特定情况下,施用治疗有效量的配体连续三天。在某些情况下,可以每周一次、每周两次、每周三次、每周四次、每周五次、每周六次、每周七次、每周八次、每周九次、每周10次、每周11次、每周12次、每周13次、每周14次、每周15次、每周16次、每周17次、每周18次、每周19次、每周20次、每周25次、每周30次、每周35次、每周40次、或每周大于40次施用治疗有效量的配体。在某些情况下,可以每天一次、每天两次、每天三次、每天四次、每天五次、每天六次、每天七次、每天八次、每天九次、每天10次或每天大于10次施用治疗有效量的配体。在某些情况下,至少每小时、至少每两小时、至少每三小时、至少每四小时、至少每五小时、至少每六小时、至少每七小时、至少每八小时、至少每九小时、至少每10小时、至少每11小时、至少每12小时、至少每13小时、至少每14小时、至少每15小时、至少每16小时、至少每17小时、至少每18小时、至少每19小时、至少每20小时、至少每21小时、至少每22小时、至少每23小时或至少每天施用治疗有效量的配体。可以如下将所述剂量的配体施用给受试者:连续地,或每天1次、2次、3次、4次或5次;每周1次、2次、3次、4次、5次、6次或7次,每月1次、2次、3次或4次,每2个月一次、每3个月一次、每4个月一次、每5个月一次或每6个月一次,或一年一次,或以甚至更长的间隔。治疗的持续时间可以持续一天、1、2或3周、1、2、3、4、5、7、8、9、10或11个月、1、2、3、4、5年或更多年或更长时间。
[0331]
通过本文公开的方法和组合物治疗的受试者可以是人类,或者可以是非人动物。本文所用的术语“治疗”及其语法等效词通常表示使用组合物或方法来减少、消除或预防疾病的症状,并且包括实现治疗益处和/或预防益处。治疗益处是指减慢所治疗的障碍或病症
的症状的进展、使其进展停止、逆转其进展或根除或减轻所述症状。治疗的预防益处包括降低病症的风险、延缓病症的进展、或减小病症发生的可能性。
[0332]
非人动物的非限制性例子包括非人灵长类动物、家畜动物、家养宠物和实验动物。例如,非人动物可以是猿(例如,黑猩猩、狒狒、大猩猩或猩猩)、旧大陆猴(例如,恒河猴)、新大陆猴、狗、猫、野牛、骆驼、牛、鹿、猪、驴、马、骡、美洲驼、绵羊、山羊、水牛、驯鹿、牦牛、小鼠、大鼠、兔或任何其它非人动物。如本文中所述的组合物和方法适于治疗兽医动物。兽医动物可以包括、但不限于狗、猫、马、牛、绵羊、小鼠、大鼠、豚鼠、仓鼠、兔、蛇、乌龟和蜥蜴。在某些方面,使组织或细胞群体与组合物接触包括将组合物施用给细胞群体或受试者。在某些实施方案中,施用在体外发生,例如通过将组合物添加到细胞培养系统中。在某些方面,施用在体内发生,例如通过经由特定途径施用。如果其中要施用超过一种组合物,所述组合物可以在相同时间(例如,在同一天)通过相同途径施用,或在不同的时间通过相同途径施用。可替换地,所述组合物可以在相同时间(例如,在同一天)通过不同的途径施用,或在不同的时间通过不同的途径施用。
[0333]
将组合物施用给有此需要的受试者的次数取决于医学专业人员的判断、障碍、障碍的严重程度以及受试者对制剂的应答。在某些方面,组合物的施用发生至少一次。在其它方面,施用在给定阶段内发生超过一次,例如2、3、4、5、6、7、8、9、10次或更多次。每次施用的剂量和/或施用的频率可以基于患者的病症和生理学应答根据需要进行调整。
[0334]
在某些实施方案中,可以施用组合物足够的次数以达到期望的生理学效果或受试者的病症的改善。在其中受试者的病症没有改善的情况下,根据医生的判断,可以长期地施用组合物,即在延长的时间段内,包括在受试者的生命的整个持续时间内,以改善或以其它方式控制或限制受试者的疾病或病症的症状。在其中受试者的状况确实有所改善的情况下,根据医生的判断,可以连续地施用组合物;可替换地,可以将所施用的药物的剂量暂时减少或暂时中止一定时间长度(即,“休药期”)。休药期的长度在2天至1年之间变化,仅作为示例包括2天、3天、4天、5天、6天、7天、10天、12天、15天、20天、28天、35天、50天、70天、100天、120天、150天、180天、200天、250天、280天、300天、320天、350天和365天。在休药期中的剂量减少可以为10%-100%,仅作为示例包括10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%和100%。
[0335]
当施用组合物超过一次时,每次施用可以由相同的操作人和/或在相同的地理位置进行。可替换地,每次施用可以由不同的操作人和/或在不同的地理位置进行。
[0336]
关于人和兽医治疗,所施用的特定药剂的量可以取决于多种因素,包括:正在治疗的病症和病症的严重程度;采用的具体药剂的活性;患者的年龄、体重、一般健康、性别和饮食;采用的具体药剂的施用时间、施用途径和排泄速率;治疗的持续时间;与采用的具体药剂组合或并用的药物;处方医师或兽医的判断;和医学和兽医学领域中已知的类似因素。类似地,给定组合物的有效浓度可以取决于多种因素,包括患者或受试者的年龄、性别、体重、遗传状况和总体健康。
[0337]
下面表2-8列出了各种剂量的乙酰胆碱或非天然配体对指示的经工程改造的受体刺激后yfp荧光的猝灭百分比。
[0338]
表2
[0339][0340][0341]
表3
[0342][0343]
表4
[0344][0345]
表5
[0346][0347]
表6
[0348][0349]
表7
[0350][0351][0352]
表8
[0353][0354]
下面表9-11列出了通过指出的不同技术计算的指示的经工程改造的受体的ec50。
[0355]
表9:从yfp淬灭板读取器实验测量的ec50值
[0356][0357][0358]
表10:从高通量电生理学实验测量的ec50值
[0359][0360]
表11:
[0361][0362][0363]
下面表a列出了本文公开的双突变体。
[0364]
表a:
[0365]
seq id no:序列seq id no:58l131d、s172d在seq id no:33中seq id no:59l131s、s172d在seq id no:33中seq id no:60l131t、s172d在seq id no:33中seq id no:61y115d、l131e在seq id no:33中seq id no:62y115d、l131q在seq id no:33中
seq id no:63y115d、s170t在seq id no:33中
[0366]
在本说明书中引用的所有论文、出版物和专利通过引用并入本文,如同明确地且单独地指出每篇单独的论文、出版物或专利通过引用并入,并且通过引用并入本文以公开和描述引用的出版物与其相关的方法和/或材料。但是,本文所引用的任何参考文献、文章、出版物、专利、专利公开和专利申请的提及不是且不应视为承认或任何形式的暗示:它们在世界上的任何国家构成有效的现有技术或形成普通一般知识的一部分。
[0367]
除非上下文另外指示,否则特别预期本文描述的各种特征可以以任意组合使用。
[0368]
除非另有定义,否则在本文中使用的所有技术和科学术语具有与本公开内容所属领域的普通技术人员通常所理解相同的含义。
[0369]
应当理解,上面的描述以及下面的实施例意图举例说明且不限制本发明的范围。在本发明范围内的其它方面、优点和修改是本发明所属领域的技术人员会明白的。
[0370]
实施例
[0371]
实施例1.包含在配体结合结构域中的突变的经工程改造的受体的发现
[0372]
为了产生在暴露于人α7-nachr的非天然小分子激动剂后传导阴离子电流的lgic,遗传工程改造嵌合的配体门控离子通道(lgic)受体,其包含从人α7烟碱乙酰胆碱受体(α7-nachr)衍生出的配体结合结构域和从人glyr1α衍生出的传导氯离子的离子孔结构域。鉴定了具有seq id no:33的氨基酸序列的经工程改造的受体,其对乙酰胆碱、abt-126和tc-6987与野生型α7-nachr大约一样敏感,其中tc-6987显示与野生型类似的对seq id no:33的部分激动剂活性。与野生型相比,seq id no:33对烟碱的敏感性低约2倍,且对azd-0328和facinicline/rg3487的敏感性分别高大约3倍和10倍。
[0373]
将氨基酸置换引入具有seq id no:33的氨基酸序列的经工程改造的受体的配体结合结构域。将α7-nachr中的每个配体的结合槽建模,并将形成结合槽的氨基酸残基绘图。然后产生单、双和三突变体嵌合lgic的文库,每个突变体嵌合lgic包含在seq id no:33的配体结合槽的一个或多个氨基酸中的置换。通过标准分子生物学技术,使用bamhi和ecori位点将亲本嵌合体受体(seq id no:33)克隆进pcdna3.1( )(invitrogen)中。通过定位诱变引入氨基酸置换。
[0374]
关于它们对其天然配体乙酰胆碱(ach)和非天然配体诸如azd-0328(adisinsight.springer.com/drugs/800018503)、tc-6987(drugbank.ca/drugs/db14854)、abt-126(medchemexpress.com/nelonicline.html)、apn-1125(clinicaltrials.gov/ct2/show/nct02724917)、tc-5619(en.wikipedia.org/wiki/bradanicline)和facinicline/rg3487(researchgate.net/figure/molecular-structure-of-rg3487_fig1_47499934)的效能,分析所有得到的经工程改造的受体。
[0375]
实施例2:使用高通量基于荧光的平板筛选表征经工程改造的受体
[0376]
为了筛选这些突变体lgic中对配体具有新颖应答特性的那些,开发了阴离子报告测定以高通量形式评估通道的功能。在该测定中,用编码目标通道的dna转染表达yfp报告物的细胞,所述yfp报告物的荧光在有阴离子存在下被猝灭。在暴露于配体后,被活化的通道将流出阴离子,从而导致在平板读数器上可以检测到的yfp的剂量依赖性猝灭。
[0377]
将lenti-x 293t细胞(lx293t,clontech)维持在含有10%fbs和1%青霉素/链霉素的dmem(invitrogen)中。关于平板读数器测定,将lx293t细胞用慢病毒感染以建立稳定
地表达突变体yfp(h148q/i152l)报告物的细胞,其显示出增强的对阴离子的敏感性。在测定前两天,将细胞以20,000个细胞/孔的密度分入用聚-d赖氨酸包被的96-孔组织培养板(thermo scientific)中。次日,使用标准的fugene方案(promega)将细胞用0.1μg的dna/孔瞬时转染。在测定当日,将细胞在1x细胞外溶液(1x ecs:140mm nacl,5mm kcl,1mm mgcl2,2mm cacl2,10mm hepes,10mm葡萄糖,ph 7.2,mosms 300)中洗涤2次。在最后一次洗涤以后,将100μl的1x ecs加入孔,并将平板在37℃温育30min。在温育平板的同时,将药物在1x ecs-nai(与1x ecs相同的组分,但是用140mm nai替换140mm nacl)中稀释至2x浓度。然后在flexstation3(molecular devices)上读出平板。如下使用flexstation3(molecular devices)读出平板的每个孔2min,每次8个孔:1)读基线yfp荧光17秒,2)加入100μl的配体,和3)然后在剩余时间中每1.3秒测量yfp荧光的变化。
[0378]
图1提供了用图中所示的各种剂量的乙酰胆碱或非天然配体刺激后yfp荧光的猝灭百分比的热图。如蓝色阴影格所示,阳性荧光信号指示,经工程改造的受体被该浓度的非天然配体活化。结果指示,经工程改造的受体对试验的非天然配体具有不同的效能。表12列出了指示的双突变体对乙酰胆碱(ach)和tc-5619的ec50值,如从yfp荧光平板读数器实验所确定的。
[0379]
表12:
[0380][0381]
实施例3:使用高通量电生理学表征经工程改造的受体
[0382]
为了证实通过平板读数器确定的ec
50
以及形成最大电流的更好理解,如下所述对经工程改造的受体进行高通量电生理学系统。对于hek293t研究,使用标准重组技术将编码离子通道的cdna克隆进pcdna3.1中。使用标准细胞培养方案,将来自clontech的hek293t细胞(lenti-x
tm
293t细胞系)在补充了10%fbs和1%青霉素/链霉素的dmem中培养至40-50%汇合,并且使用fugene 6用每个15cm培养皿18μg浓度的离子通道质粒转染,并且生长另外24小时。然后将细胞在电生理学系统(ionfluxht和/或mercury,fluxion biosciences)上测定,其中通过用于建立全细胞构型的基于微流体的平台可以评估剂量-响应关系。用细胞外缓冲液(140mm nacl,5mm kcl,2mm cacl2,1mm mgcl2,10mm hepes,和10mm葡萄糖,用naoh调至ph 7.2,mosm 310)、细胞内缓冲液(145mm cscl,2mm cacl2,2mm mgcl2,10mm hepes,和10mm egta,用csoh调至ph 7.2,mosm 305)(从lynagh和lynch改进)和在细胞外缓冲液中稀释的试验化合物(新鲜制备的储备液)对ensemble平板进行预处理(primed)。然后将细胞用accutase从平板释放,离心,重新悬浮于细胞外缓冲液中,并且装载进ensemble平板中。然后使细胞经受用于预处理、捕获、破碎和建立全细胞构型的标准方案,其中在整个记录中
将细胞保持在-60mv。记录基线后,使用ionflux软件应用渐进剂量的试验化合物以评估剂量响应关系。然后使用自定义python脚本离线分析数据,以将数据转换为.csv格式,重新绘制迹线,并且应用qc测量以排除不稳定的记录(即,基于访问阻力的阈值化和/或基线中的标准偏差,以及伪像排除)。然后计算峰值电流,并且使用如hill方程式所描述的4-参数逻辑方程拟合群体数据。在1秒添加药物后在自动化膜片箝系统(fluxion biosciences)上测量电流,并将计算的ec50值列在下面表13中。
[0383]
表13:
[0384][0385]
这些结果表明,与野生型nachra7相比,所有经工程改造的受体对乙酰胆碱具有降低的效能。例如,一些经工程改造的受体的ec50值比野生型nachra7的ec50高几个数量级。此外,结果表明,与野生型受体相比,一些经工程改造的受体对某些非天然配体具有增加的效能。例如,与野生型对照受体相比,包含在seq id no:33中的l131d、s172d的氨基酸序列的经工程改造的受体显示出对azd-0328和rg-3487增加至少10倍的效能。这些结果证实,经工程改造的受体可以用于降低对乙酰胆碱的效能,同时保持或增加对合成的小分子nachα7受体激动剂(其已经被公认为在人类中安全的和良好耐受的)的效能。
[0386]
来自电生理学方法的这些结果证实了来自平板读数器的ec50值,并进一步证实了本文公开的经工程改造的受体的乙酰胆碱和非天然配体应答的去偶联。
[0387]
实施例4:使用手工膜片箝电生理学表征经工程改造的受体
[0388]
在hek293细胞和大鼠drg神经元中使用全细胞手工膜片箝电生理学,测量了本文公开的各种经工程改造的受体对ach和非天然配体的ec50。还在大鼠drg神经元中测量了基本电流强度转换,其反映了受体的效力。为了计算基本电流强度,首先,确定了可以产生动作电位的电流的量。然后加入配体,随后使注射的电流逐步增加直到700pa。将添加配体后注射的电流除以为了得到动作电位注射的原始电流,以计算基本电流强度。用来自递增剂
量的配体的峰值电流测量结果,使用hill方程式计算ec50。
[0389]
将结果列在下面表14中。这些结果证实,本文公开的经工程改造的受体具有非常低的对ach的效能,但是对非天然配体诸如rg3487和tc5619更高的效能和效力。也参见,实施例6。
[0390]
表14:
[0391][0392]
实施例5:经工程改造的受体的定位
[0393]
使用两种方法评价了将本文公开的经工程改造的受体定位至细胞表面的效率。首先,在hek293t细胞中表达ha-标记的经工程改造的受体,并使用荧光地标记的ha抗体监测它们的表面表达。其次,使用荧光地标记的α-银环蛇毒素(其特异性地结合经工程改造的受体(chnra7)上的氨基酸)结合经工程改造的受体。这两种方法和随后流式细胞计量术的应用允许确证经工程改造的受体的表面定位。
[0394]
单克隆抗体抗-ha-pecy7(16b12)购自biolegend(san diego,ca)。在括弧中列出了单克隆抗体克隆名称。缀合至生物素alexa fluor 647的α-银环蛇毒素都购自thermo/fisher(waltham ma)。简而言之,将hek-293t以200,00个细胞/孔铺板,并在次日以1:3比例的dna:fugene用fugene 6转染。在转染后一天使用流式细胞计量术分析细胞。对于流式细胞计量术分析,使用0.05%胰蛋白酶和0.02%edta(thermo/fisher)使转染的hek293t细胞升起,洗涤,并在facs缓冲液(2%bsa,不含ca 和mg 的1x pbs,和1x青霉素链霉素)中与抗体(30min,1:100)或α-银环蛇毒素(1小时,1:1000)一起温育。然后将细胞在facs缓冲液中洗涤,并且然后在sony sh800 facs分选仪(san jose,ca)上分析。使用flowjo(san jose,ca)进行随后分析。将呈现的数据标准化至ha-标签荧光或α-银环蛇毒素染色为阳性的细胞的百分比;和包含seq id no:33的氨基酸序列的亲本嵌合受体的中值荧光强度。参见表1。
[0395]
图5和表1显示了表达经工程改造的受体的ha-标签阳性细胞的百分比,标准化为表达seq id no:33的氨基酸序列的对照细胞(“平均ha标签%”);和表达经工程改造的受体的α-银环蛇毒素阳性细胞的百分比,标准化为表达seq id no:33的氨基酸序列的对照细胞(“标准化的ab%”)。
[0396]
图5和表15也显示了表达经工程改造的受体的细胞的中值荧光强度(mfi),标准化为表达seq id no:33的氨基酸序列的对照细胞,如使用抗-ha抗体(“平均ha mfi”)或荧光地标记的缀合至alexa fluor 647的α-银环蛇毒素(“标准化的ab mfi”)所评价的。不同的
点突变可以影响通过流式细胞计量术对ha和α-银环蛇毒素的检测。
[0397]
表15:
[0398][0399][0400]
*缩写:mfi-平均荧光强度;ab-α-银环蛇毒素
[0401]
结果表明,在本文公开的经工程改造的受体中的突变影响向细胞表面的定位。尽管一些双突变体的定位与亲本嵌合体(seq id no:33)的定位相当,其它突变体具有比亲本嵌合体(seq id no:33)减少的细胞表面定位。例如,具有l131t、s172d突变的经工程改造的受体显示出与亲本嵌合体相当的定位,如通过ha标签所评价的。此外,具有y115d、l131e突变的经工程改造的受体通过两种技术(也就是说,如通过ha标签以及α-银环蛇毒素所评价的)显示出与亲本嵌合体相当的定位。
[0402]
实施例6:cr-11经工程改造的受体的表征
[0403]
高通量电生理学平台指示,包含具有在seq id no:33中的y115d和l131q氨基酸置换的氨基酸序列的经工程改造的受体对乙酰胆碱的效能与野生型受体相比降低了超过500倍,而其对rg-3487的效能增加了超过10倍。
[0404]
使用全细胞手工膜片箝电生理学,在hek293细胞和培养的大鼠背根神经节(drg)感觉神经元中,证实了包含具有在seq id no:33中的y115d和l131q氨基酸置换的氨基酸序列的经工程改造的受体对乙酰胆碱基本上不敏感,但是与野生型nachrα7受体相比对rg-3487更敏感。参见图2。
[0405]
在hek293细胞中,不可确定包含具有在seq id no:33中的y115d和l131q氨基酸置换的氨基酸序列的经工程改造的受体对ach的ec
50
,因为几乎没有电流可以产生,即使在最高达100mm的ach浓度。相反,野生型nachrα7受体对ach的ec
50
为42.4μm(图2a)。进一步证实了高通量数据,手工膜片箝电生理学结果也表明,与野生型nachα7受体(ec
50
=2.9μm)相比,包含具有在seq id no:33中的y115d和l131q氨基酸置换的氨基酸序列的经工程改造的受体对rg-3487(sa-2)更敏感(具有ec
50
=0.3μm)(图2b)。
[0406]
在培养的表达包含具有在seq id no:33中的y115d和l131q氨基酸置换的氨基酸序列的经工程改造的受体的成年大鼠drg神经元中,rg-3487(sa-2)的应用以剂量依赖性的方式产生了氯离子电流(图3),尽管这样的电流在非转导细胞中未观察到。
[0407]
另外,在转导的大鼠drg神经元中用3μm浓度的rg-3487(sa-2)对包含具有在seq id no:33中的y115d和l131q氨基酸置换的氨基酸序列的经工程改造的受体的活化可逆地抑制电流注射诱发的动作电位(图4a),引起动作电位所需的电流增加了约3倍(n=7)。3.0mm的乙酰胆碱对在转导的神经元中的诱发动作电位没有影响(n=4)(图4b)。这些结果表明,包含具有在seq id no:33中的y115d和l131q氨基酸置换的氨基酸序列的经工程改造的受体在drg神经元中的表达可以抑制诱发动作电位。
[0408]
实施例7.在ipsc-衍生的神经元中的经工程改造的受体的表征(预示性的)
[0409]
开发了产生ipsc-衍生的aβ神经元的分化方案。使用下述标志物将细胞定义为aβ神经元;表达神经丝200(nf200),其描绘有髓鞘的初级传入神经元(basbaum等人,2009);piezo 2,即低阈值机械感受器感觉神经元(ltmr)的标志物(ranade等人,2014);和tlr5,即据报道也标记aβ纤维的toll-样受体(xu等人,2015)。所述表征还将包括评价伤害感受器特异性标志物trpv1的缺失,该标志物在许多c和aβ纤维中表达(caterina等人,1997);前列腺酸性磷酸酶,其描绘非肽能的无髓鞘的传入物(zylka等人,2009);和nav1.1,即aβ感受伤害的神经元的标志物。将满足以上标准的ipsc-衍生的神经元进一步表征为在没有c-ret表达存在下快速地适应ltmr(基于c-ret和mafa/c-maf的表达)或缓慢地适应ltmr(基于trkb和shox2的表达)(koch等人,2018)。
[0410]
(1)证实满足aβ神经元的以上表达标志物标准的细胞具有非伤害感受性感觉神经元特有的电生理学性能。这些性能包括响应于配体的电流产生和直流电注射诱发动作电位。
[0411]
(2)证实用选择的化学源性受体(经工程改造的受体)转导的神经元中氯离子电流的存在。用慢病毒载体(其编码具有ires gfp的ha-标记的化学源性受体)转导细胞以通过gfp荧光鉴定转导的细胞。以电位箝模式检测响应于合成激动剂的氯离子电流,用nmgd 作为内部/外部流体阳离子。由于nmdg 是阳离子通道不可渗透的,它的包含消除了响应于研究的合成激动剂的任何内源性nachrα7阳离子电流。然后确定化学源性受体-合成激动剂对的ec50。读出后,使用针对ha标签的抗体在渗透化处理的和未渗透化处理的细胞中通过荧光显微术评价受体的表达和细胞表面定位。
[0412]
(3)评估抑制电流注射诱发的动作电位的能力。用慢病毒载体(其编码具有ires gfp的ha-标记的化学源性受体)转导细胞以通过gfp荧光鉴定转导的细胞。在电流箝模式中,通过电流的递增施加直到细胞膜除极化,确定在有和没有合成激动剂存在下的基本电流强度。将结果与仅用gfp转导的细胞进行对比。
[0413]
(4)评估对输入阻抗的影响。用慢病毒载体(其编码具有ires gfp的ha-标记的化学源性受体)转导细胞以通过gfp荧光鉴定细胞。在电流箝模式中,为了计算输入阻抗,注射低于阈值的电流并确定引起的膜电位的变化。将结果与仅用gfp转导的细胞进行对比。
[0414]
(5)在有和没有合成激动剂存在下评估对静止膜电位的影响。用慢病毒载体(其编码具有ires gfp的ha-标记的化学源性受体)转导细胞以通过gfp荧光鉴定转导的细胞。在电位箝模式,在有和没有合成激动剂存在下确定静止膜电位。将结果与仅用gfp转导的细胞
进行对比。
[0415]
将在ipsc-衍生的aβ神经元中的以上电生理学性能与在ipsc-衍生的c-纤维神经元以及成年大鼠drg神经元中的那些进行对比。另外,由于受损伤的aβ纤维传入物中的生化变化可以促进神经病状态中的自发性疼痛,在体外损伤后研究了ipsc衍生的aβ神经元的电生理学性能。为了产生体外损伤,将细胞收获并在培养物中已经伸出突起后重新铺板。重新铺板过程会切断突起,从而模仿轴突损伤。在损伤后的不同时间点,评价细胞的各种电生理学性能,包括:自发动作电位的产生,静止膜电位的变化,和基本电流强度的变化。还在受损伤的状态评价了化学源性受体的影响。
[0416]
实施例8.评估经工程改造的受体在动物模型中治疗疾病的效力
[0417]
关于它们在施用小分子配体后在神经性疼痛的大鼠模型中提供镇痛的能力,评估了本文公开的经工程改造的受体。使用标准的分子生物学技术,构建了含有人突触蛋白-1(hsyn)启动子的aav表达盒,所述启动子连接至编码野生型α7-nachr或本文公开的经工程改造的嵌合受体中的任一种的多核苷酸。
[0418]
将这些aav表达盒亚克隆进aav杆粒中,纯化,转染进sf9昆虫细胞中以产生重组杆状病毒,并且然后扩增。将sf9细胞用扩增的重组杆状病毒和另一种重组杆状病毒双重感染以产生重组aav载体,所述扩增的重组杆状病毒含有野生型α7-nachr或上述的经工程改造的嵌合受体盒中的任一种,所述另一种重组杆状病毒含有rep和aav6(y705 731f t492v)cap基因。将病毒载体纯化,使用qpcr确定病毒滴度,并且使用sds-page来验证aav载体的纯度。
[0419]
行为实验和疼痛模型:为了在模仿神经性疼痛病症的模型中产生机械超敏反应,使用了多余神经损伤(sni)模型(一种经过验证的机械痛觉超敏模型)(shields等人,2003,the journal of pain,4,465-470)。通过将腓总神经和腓肠神经切开并分离出胫骨分支而产生此模型。通过将大鼠放置在升高的金属丝网网格上并用von frey细丝刺激后爪的脚底表面来评估机械缩回阈值。
[0420]
aav注射到大鼠的脊髓中:在腰椎膨大水平处进行背侧半椎板切除术,以暴露腰椎脊髓的两个区段(约1.5-2mm),之后将硬膜切开并反射。将病毒溶液装入玻璃微量移液器(预装有矿物油)中。将微量移液器连接到安装在立体定位设备上的手动微型注射器。将病毒溶液靶向背侧角(左侧)。沿暴露的区域内的头尾轴,以等距线性方式进行6次注射,每次240nl。在每次注射后,观察1分钟的静止时间,并且然后缝合肌肉层,用缝钉闭合皮肤,并且在将动物放回其居住笼之前用加热的垫使动物恢复。在最后的行为试验后,对动物进行灌注以进行组织学分析。
[0421]
aav神经节内注射到大鼠的背根神经节(drg)中:用硼硅玻璃毛细管(0.78/1mm内部/外部直径)进行注射,所述硼硅玻璃毛细管被拉至细点,所述细点通过聚乙烯管道(0.4/0.8mm内部/外部直径)连接到安装在显微注射泵中的注射器上。将针头安装在向外摆动的立体定位框架的延长臂(仅用于固定和操纵针头)上。将管道、注射器和针头都充满水。将一微升空气吸入到针头中,然后吸入3μl的病毒载体溶液。对于每次注射,给针头分别装载此体积。在手术前将动物麻醉。沿背侧中线切开后,通过除去椎骨的外侧突而露出l4和l5 drg。打开位于drg之上的神经外膜,并且将玻璃针插入到神经节中到距离暴露的神经节的表面400μm的深度。延迟3分钟以允许密封在玻璃毛细管尖端周围的组织后,以0.2微升/分
钟的速率注射1.1μl病毒溶液。另外延迟2分钟后,取走针头。首先注射l4神经节,然后注射l5神经节。用5-0缝线将覆盖脊髓的肌肉松散地缝合到一起,并闭合伤口。使动物在37℃恢复并接受术后镇痛。
[0422]
aav鞘内注射进大鼠中:首先将大鼠麻醉,并且然后垂直放置,它们的头固定在立体定位框架中。在颈部的底部作出切口以露出颈脊的沟槽。在池膜中作出切口(1-2mm)至一定深度,使得脑脊液漏出。然后将4cm 32g鞘内导管沿腰椎脊髓的方向缓慢插入,并通过围绕导管的缝线来闭合皮肤。然后使大鼠恢复。然后将大鼠麻醉并施用载体(6μl)。用6μl的pbs冲洗导管并且然后将其取出,并且使大鼠恢复。
[0423]
施用的影响:通过将腓总神经和腓肠神经切开并分离出大鼠的胫骨分支而产生此sni模型。在将aav.hsyn-α7-nachr/glyrα1注射到脊髓、drg或鞘内空间中之前,使用chaplan和yaksh的上下法来确定机械阈值。在单侧载体注射后三周,再次对动物进行试验以验证其机械缩回阈值没有改变。还在注射之前和之后,使用最大速度为33rpm的加速旋转杆(stoelting,usa)试验运动协调性。记录大鼠花费在旋转杆上的持续时间,截止时间为300秒。每只大鼠经过三个训练试验并在两小时后进行试验。
[0424]
随后,对每个嵌合体组群中的一半大鼠施用azd-0328或facinicline的单次腹膜内注射,并在腹膜内注射后1、2、5、7和13天使用上下法试验机械阈值。在第三天,当阈值已经恢复到损伤后基线时,再次腹膜内注射azd-0328,并再次观察向非损伤基线阈值的恢复。跟踪这些动物48小时。然后对动物进行灌注以用于组织学分析。
[0425]
实施例9:遭受慢性疼痛的患者的治疗
[0426]
在一个非限制性实施例中,使用本文公开的组合物和方法治疗遭受慢性神经根痛的患者。在第一天,用在直接递送进一个或多个背根神经节(即,向腰、颈或胸drg中的神经节内对流增强的递送)中的1.0ml体积中的10
13
个aav.hsyn载体基因组(其可操作地连接至编码本文公开的经工程改造的受体中的任一种的多核苷酸)治疗患者。在该实施例中,所述aav载体在人突触蛋白-1(syn1)启动子的控制下编码本文公开的经工程改造的受体中的任一种以实现选择性神经元表达。注射后两周,患者返回诊所以接受azd-0328或另一种非天然配体的处方。患者根据需要(即,在疼痛发作期间)通过口服自我施用0.1mg/kg azd-0328或另一种非天然配体。
[0427]
实施例10.遭受慢性疼痛的患者的治疗
[0428]
在一个非限制性实施例中,使用本文公开的组合物和方法治疗遭受慢性颅面痛(例如,三叉神经痛或颞下颌关节功能障碍)的患者。在第一天,用在直接递送进三叉神经节(即,神经节内对流增强的递送)中的0.150ml体积中的10
13
个aav.hsyn载体基因组(其可操作地连接至编码本文公开的经工程改造的受体中的任一种的多核苷酸)治疗患者。在该实施例中,所述aav载体在人突触蛋白-1(syn1)启动子的控制下编码本文公开的经工程改造的受体中的任一种以实现选择性神经元表达。注射后两周,患者返回诊所以接受azd-0328或另一种非天然配体的处方。患者根据需要(即,在疼痛发作期间)通过口服自我施用0.1mg/kg azd-0328或另一种非天然配体。
[0429]
实施例11.遭受肥胖的患者的治疗
[0430]
在一个非限制性实施例中,使用本文公开的组合物和方法治疗遭受肥胖的患者。在第一天用在直接递送进迷走神经(即,神经内)的胃分支中的1.0ml体积中的10
13
个
aav.ghrelin载体基因组(其可操作地连接至编码本文公开的经工程改造的受体中的任一种的多核苷酸)治疗患者。在该实施例中,所述aav载体在人ghrelin启动子的控制下编码经工程改造的受体以实现选择性神经元表达。注射后两周,患者返回诊所以接受azd-0328或另一种非天然配体的处方。患者每天通过口服自我施用0.1mg/kg azd-0328或另一种非天然配体以实现过剩重量减轻(即为了食欲抑制)。
[0431]
实施例12.遭受肥胖的患者的治疗
[0432]
在一个非限制性实施例中,使用本文公开的组合物和方法治疗遭受肥胖的患者。在第一天用在直接递送进支配胰腺的背根神经节(即,神经节内)中的1.0ml体积中的10
13
个aav-trpv1载体基因组(其可操作地连接至编码本文公开的经工程改造的受体中的任一种的多核苷酸)治疗患者。在该实施例中,所述aav载体在人trpv1启动子的控制下编码经工程改造的受体以实现在伤害感受器中的选择性神经元表达。注射后两周,患者返回诊所以接受azd-0328或另一种非天然配体的处方。患者每天通过口服自我施用0.1mg/kg azd-0328或另一种非天然配体以实现过剩重量减轻。
[0433]
实施例13.遭受肥胖的患者的治疗
[0434]
在一个非限制性实施例中,使用本文公开的组合物和方法治疗遭受肥胖的患者。在第一天用在直接递送进下丘脑中的室旁核(pvh)(即,颅内的、对流增强的递送)中的1.0ml体积中的10
13
个aav-sim1载体基因组(其可操作地连接至编码本文公开的经工程改造的受体中的任一种的多核苷酸)治疗患者。在该实施例中,所述aav载体在人专心(single-minded)家族bhlh转录因子1(sim1)启动子的控制下编码经工程改造的通道以实现在阿黑皮素原(pomc)神经元中的选择性神经元表达并最终刺激减食欲途径。注射后两周,患者返回诊所以接受azd-0328或另一种非天然配体的处方。患者每天通过口服自我施用0.15mg/kg azd-0328或另一种非天然配体以实现过剩重量减轻(即为了食欲抑制)。
[0435]
实施例14.遭受ptsd的患者的治疗
[0436]
在一个非限制性实施例中,使用本文公开的组合物和方法治疗遭受创伤后应激障碍(ptsd)的患者。在第一天用在直接递送进c6星状神经节(即,神经节内)中的1.0ml体积中的10
13
个aav-hsyn1载体基因组(其可操作地连接至编码本文公开的经工程改造的受体中的任一种的多核苷酸)治疗患者。在该实施例中,所述aav载体在人突触蛋白-1(hsyn1)启动子的控制下编码经工程改造的受体以实现选择性神经元表达。注射后两周,患者返回诊所以接受azd-0328或另一种非天然配体的处方。患者因为ptsd症状(即因为焦虑)每天通过口服自我施用0.15mg/kg azd-0328或另一种非天然配体。
[0437]
实施例15.遭受抑郁症的患者的治疗
[0438]
在一个非限制性实施例中,使用本文公开的组合物和方法治疗遭受治疗抗性的抑郁症(trd)的患者。在第一天用在直接递送进迷走神经(即,神经内)中的1.0ml体积中的10
13
个aav-hsyn1载体基因组(其可操作地连接至编码本文公开的经工程改造的受体中的任一种的多核苷酸)治疗患者。在该实施例中,所述aav载体在人突触蛋白-1(hsyn1)启动子的控制下编码经工程改造的受体以实现选择性神经元表达。注射后两周,患者返回诊所以接受azd-0328或另一种非天然配体的处方。患者因为抑郁症症状每天通过口服自我施用0.1mg/kg azd-0328或另一种非天然配体。
[0439]
实施例16.遭受gerd的患者的治疗
[0440]
在一个非限制性实施例中,使用本文公开的组合物和方法治疗遭受胃食管反流疾病(gerd)的患者。在第一天用在分别直接递送进食管下端括约肌(les)迷走神经和肠肌丛(即,神经内)或平滑肌(肌肉内)中的1.0ml体积中的10
13
个aav-hsyn1(其可操作地连接至编码本文公开的经工程改造的受体中的任一种的多核苷酸)或aav-cag(其可操作地连接至编码本文公开的经工程改造的受体中的任一种的多核苷酸)载体基因组治疗患者。在该实施例中,所述aav载体在人突触蛋白-1(hsyn1)启动子(对于选择性神经元表达)或cag启动子(对于在les肌细胞中的表达)的控制下编码经工程改造的受体。注射后两周,患者返回诊所以接受azd-0328或另一种非天然配体的处方。患者因为gerd的症状(即酸回流)每天通过口服自我施用0.15mg/kg ad-0328或另一种非天然配体。
[0441]
实施例17.遭受癫痫的患者的治疗
[0442]
在一个非限制性实施例中,使用本文公开的组合物和方法治疗遭受与癫痫有关的癫痫发作的患者。在第一天用在直接递送进预定癫痫发作病灶诸如运动皮质(即,颅内)中的1.0ml体积中的10
13
个aav-camkiiα载体基因组(其可操作地连接至编码本文公开的经工程改造的受体中的任一种的多核苷酸)治疗患者。在该实施例中,所述aav载体在人钙/钙调蛋白依赖性蛋白激酶iiα(camkiiα)启动子的控制下编码经工程改造的受体以实现在兴奋性神经元中的选择性神经元表达。注射后两周,患者返回诊所以接受azd-0328的处方。患者因为癫痫症状(即癫痫发作)每天通过口服自我施用0.1mg/kg azd-0328。
[0443]
实施例18.遭受运动障碍的患者的治疗
[0444]
在一个非限制性实施例中,使用本文公开的组合物和方法治疗遭受运动障碍(例如帕金森病震颤)的患者。在第一天用在直接递送进底丘脑核(即,颅内的stn)中的1.0ml体积中的10
13
个aav-camkiiα载体基因组(其可操作地连接至编码本文公开的经工程改造的受体中的任一种的多核苷酸)治疗患者。在该实施例中,所述aav载体在人钙/钙调蛋白依赖性蛋白激酶iiα(camkiiα)启动子的控制下编码经工程改造的受体以实现在兴奋性神经元中的选择性神经元表达。注射后两周,患者返回诊所以接受azd-0328的处方。患者因为运动障碍症状(即震颤)每天通过口服自我施用0.1mg/kg azd-0328。
[0445]
其它编号的实施方案
[0446]
在下面的编号的实施方案中提供了本发明的其它实施方案:
[0447]
实施方案1.一种经工程改造的受体,其包含:
[0448]
从人α7烟碱乙酰胆碱受体(α7-nachr)衍生出的并且包含来自人甘氨酸受体α1亚基的cys-环结构域的配体结合结构域;和
[0449]
从人甘氨酸受体α1亚基衍生出的离子孔结构域,
[0450]
其中所述配体结合结构域包含:(i)在选自由以下成员组成的集合的一对氨基酸残基处的两个氨基酸置换:l131和s172,y115和s170,以及y115和l131;或(ii)l131e的氨基酸置换,其中所述氨基酸残基对应于α7-nachr的氨基酸残基,
[0451]
其中所述经工程改造的受体是嵌合的配体门控离子通道(lgic)受体。
[0452]
实施方案1.1实施方案1的经工程改造的受体,其中所述经工程改造的受体包含seq id no:33的氨基酸序列,其中所述氨基酸序列进一步包含在选自由以下成员组成的集合的一对氨基酸残基处的两个氨基酸置换:l131和s172,y115和s170,以及y115和l131;或l131e的氨基酸置换,其中所述氨基酸残基对应于α7-nachr的氨基酸残基。
[0453]
实施方案2.实施方案1或1.1的经工程改造的受体,其中所述配体结合结构域包含在选自由以下成员组成的集合的一对氨基酸残基处的两个氨基酸置换:l131和s172,y115和s170,以及y115和l131。
[0454]
实施方案3.实施方案1、1.1或2中的任一个的经工程改造的受体,其中所述配体结合结构域包含选自由以下成员组成的集合的一对氨基酸置换:l131s和s172d,l131t和s172d,l131d和s172d,y115d和s170t,y115d和l131q,以及y115d和l131e。
[0455]
实施方案3.1实施方案1-3中的任一个的经工程改造的受体,其中所述经工程改造的受体包含seq id no:33的氨基酸序列,其中所述氨基酸序列进一步包含选自由以下成员组成的集合的一对氨基酸置换:l131s和s172d,l131t和s172d,l131d和s172d,y115d和s170t,y115d和l131q,以及y115d和l131e。
[0456]
实施方案4.实施方案1或1.1的经工程改造的受体,其中所述配体结合结构域包含l131e的氨基酸置换。
[0457]
实施方案4.1权利要求1-4中的任一项所述的经工程改造的受体,其中所述经工程改造的受体包含seq id no:33的氨基酸序列,其中所述氨基酸序列进一步包含l131e的氨基酸置换。
[0458]
实施方案5.实施方案1-4.1中的任一个的经工程改造的受体,其中所述cys-环结构域包含seq id no:2的氨基酸166-172。
[0459]
实施方案6.实施方案1-4.1中的任一个的经工程改造的受体,其中所述cys-环结构域包含seq id no:2的氨基酸166-180。
[0460]
实施方案7.实施方案1-6中的任一个的经工程改造的受体,其中所述受体包含来自人甘氨酸受体α1亚基的β1-2环结构域。
[0461]
实施方案8.实施方案7的经工程改造的受体,其中所述β1-2环结构域包含seq id no:2的氨基酸81-84。
[0462]
实施方案8.1:实施方案1-8中的任一个的经工程改造的受体,其中所述经工程改造的受体包含选自由以下成员组成的集合的氨基酸序列:seq id no.58-63。
[0463]
实施方案9.实施方案1-8中的任一个的经工程改造的受体,其中所述经工程改造的受体对乙酰胆碱的效能低于人α7烟碱乙酰胆碱受体(α7-nachr)对乙酰胆碱的效能。
[0464]
实施方案10.实施方案9的经工程改造的受体,其中所述经工程改造的受体对乙酰胆碱的效能比人α7烟碱乙酰胆碱受体(α7-nachr)对乙酰胆碱的效能低至少2倍。
[0465]
实施方案11.实施方案1-10中的任一个的经工程改造的受体,其中所述经工程改造的受体对非天然配体的效能与人α7烟碱乙酰胆碱受体(α7-nachr)对非天然配体的效能大约相同。
[0466]
实施方案12.实施方案1-11中的任一个的经工程改造的受体,其中所述经工程改造的受体对非天然配体的效能高于人α7烟碱乙酰胆碱受体(α7-nachr)对非天然配体的效能。
[0467]
实施方案13.实施方案12的经工程改造的受体,其中所述经工程改造的受体对非天然配体的效能比人α7烟碱乙酰胆碱受体(α7-nachr)对非天然配体的效能高至少2倍。
[0468]
实施方案14.实施方案9-13中的任一个的经工程改造的受体,其中确定所述效能包括确定ec50。
[0469]
实施方案15.实施方案1-14中的任一个的经工程改造的受体,其中在有非天然配体存在下所述经工程改造的受体的效力高于在有非天然配体存在下人α7烟碱乙酰胆碱受体(α7-nachr)的效力。
[0470]
实施方案16.实施方案1-15中的任一个的经工程改造的受体,其中在有非天然配体存在下所述经工程改造的受体的效力比在有非天然配体存在下人α7烟碱乙酰胆碱受体(α7-nachr)的效力高至少2倍。
[0471]
实施方案17.实施方案15-16中的任一个的经工程改造的受体,其中确定所述效力包括确定在有非天然配体存在下在体外穿过经工程改造的受体的电流的量。
[0472]
实施方案18.实施方案11-17中的任一个的经工程改造的受体,其中所述非天然配体选自由以下成员组成的集合:azd-0328、tc-6987、abt-126、apn-1125、tc-5619和facinicline/rg3487。
[0473]
实施方案19.实施方案18的经工程改造的受体,其中所述非天然配体选自由以下成员组成的集合:abt-126、rg3487和apn-1125。
[0474]
实施方案20.实施方案18的经工程改造的受体,其中所述非天然配体是tc-5619。
[0475]
实施方案21.一种多核苷酸,其包含编码实施方案1-20中的任一个的经工程改造的受体的核酸。
[0476]
实施方案22.实施方案21的多核苷酸,其中所述多核苷酸包含可操作地连接至编码经工程改造的受体的核酸的启动子。
[0477]
实施方案23.实施方案22的多核苷酸,其中所述启动子是可调节的启动子。
[0478]
实施方案24.实施方案23的多核苷酸,其中所述可调节的启动子在可兴奋细胞中是有活性的。
[0479]
实施方案25.实施方案24的多核苷酸,其中所述可兴奋细胞是神经元或肌细胞。
[0480]
实施方案26.实施方案25的多核苷酸,其中所述可兴奋细胞是神经元。
[0481]
实施方案27.一种载体,其包含实施方案21-26中的任一个的多核苷酸。
[0482]
实施方案28.实施方案27的载体,其中所述载体是质粒或病毒载体。
[0483]
实施方案29.实施方案28的载体,其中所述载体是选自由以下成员组成的集合的病毒载体:腺病毒载体、逆转录病毒载体、腺相关病毒(aav)载体和单纯疱疹-1病毒载体(hsv-1)。
[0484]
实施方案30.实施方案29的载体,其中所述病毒载体是avv载体,且其中所述aav载体是aav5或其变体、aav6或其变体或aav9或其变体。
[0485]
实施方案31.一种组合物,其包含实施方案1-20中的任一个的经工程改造的受体、实施方案21-26中的任一个的多核苷酸或实施方案27-30中的任一个的载体。
[0486]
实施方案32.一种药物组合物,其包含实施方案1-20中的任一个的经工程改造的受体、实施方案21-26中的任一个的多核苷酸或实施方案27-30中的任一个的载体;和药学上可接受的载体。
[0487]
实施方案33.一种在神经元中产生经工程改造的受体的方法,所述方法包括使所述神经元与实施方案21-26中的任一个的多核苷酸、实施方案27-30中的任一个的载体、实施方案31的组合物或实施方案32的药物组合物接触。
[0488]
实施方案34.实施方案33的方法或实施方案26的多核苷酸,其中所述神经元是周
围神经系统的神经元。
[0489]
实施方案35.实施方案33或34的方法或实施方案26的多核苷酸,其中所述神经元是中枢神经系统的神经元。
[0490]
实施方案36.实施方案33-35中的任一个的方法或实施方案26的多核苷酸,其中所述神经元是感受伤害的神经元。
[0491]
实施方案37.实施方案33-36中的任一个的方法或实施方案26的多核苷酸,其中所述神经元是非感受伤害的神经元。
[0492]
实施方案38.实施方案33-37中的任一个的方法或实施方案26的多核苷酸,其中所述神经元是背根神经节(drg)神经元、三叉神经节(tg)神经元、运动神经元、兴奋性神经元、抑制性神经元或感觉神经元。
[0493]
实施方案39.实施方案33-38中的任一个的方法或实施方案26的多核苷酸,其中所述神经元是aδ传入纤维、c纤维或aβ传入纤维。
[0494]
实施方案40.实施方案39的方法或实施方案26的多核苷酸,其中所述神经元是aβ传入纤维。
[0495]
实施方案41.实施方案40的方法或实施方案26的多核苷酸,其中aβ传入纤维是受损伤的aβ传入纤维。
[0496]
实施方案42.实施方案40的方法或实施方案26的多核苷酸,其中aβ传入纤维是未受损伤的aβ传入纤维。
[0497]
实施方案43.实施方案33-42中的任一个的方法或实施方案26的多核苷酸,其中所述神经元表达神经丝200(nf200)、piezo 2和tlr-5。
[0498]
实施方案44.实施方案33-43中的任一个的方法或实施方案26的多核苷酸,其中所述神经元不表达trpv1、前列腺酸性磷酸酶、nav1.1。
[0499]
实施方案45.实施方案33-44中的任一个的方法,其中在体外、离体或在体内进行所述接触步骤。
[0500]
实施方案46.实施方案45的方法,其中在受试者中在体内进行所述接触步骤。
[0501]
实施方案47.实施方案46的方法,其中所述接触步骤包括将所述多核苷酸、所述载体、所述组合物或所述药物组合物施用给所述受试者。
[0502]
实施方案48.实施方案45的方法,其中在体外或离体进行所述接触步骤。
[0503]
实施方案49.实施方案48的方法,其中所述接触步骤包括脂质体转染、纳米颗粒递送、颗粒轰击、电穿孔、声处理或显微注射。
[0504]
实施方案50.实施方案33-49中的任一个的方法,其中所述经工程改造的受体能够定位至所述神经元的细胞表面。
[0505]
实施方案51.一种抑制神经元活性的方法,所述方法包括(a)使所述神经元与实施方案1-20中的任一个的经工程改造的受体、实施方案21-26中的任一个的多核苷酸、实施方案27-30中的任一个的载体、实施方案31的组合物或实施方案32的药物组合物接触,和(b)使所述神经元与所述经工程改造的受体的非天然配体接触。
[0506]
实施方案51.1实施方案51的方法,其中所述神经元是周围神经系统的神经元。
[0507]
实施方案51.2实施方案51的方法,其中所述神经元是中枢神经系统的神经元。
[0508]
实施方案52.实施方案51-51.2中的任一个的方法,其中所述神经元是感受伤害的
神经元。
[0509]
实施方案53.实施方案51-51.2中的任一个的方法,其中所述神经元是非感受伤害的神经元。
[0510]
实施方案54.实施方案51-53中的任一个的方法,其中所述神经元是背根神经节(drg)神经元、三叉神经节(tg)神经元、运动神经元、兴奋性神经元、抑制性神经元或感觉神经元。
[0511]
实施方案55.实施方案51-54中的任一个的方法,其中所述神经元是aδ传入纤维、c纤维或aβ传入纤维。
[0512]
实施方案56.实施方案55的方法,其中所述神经元是aβ传入纤维。
[0513]
实施方案57.实施方案56的方法,其中aβ传入纤维是受损伤的aβ传入纤维。
[0514]
实施方案58.实施方案56的方法,其中aβ传入纤维是未受损伤的aβ传入纤维。
[0515]
实施方案59.实施方案51-58中的任一个的方法,其中所述神经元表达神经丝200(nf200)、piezo 2和tlr-5。
[0516]
实施方案60.实施方案51-59中的任一个的方法,其中所述神经元不表达trpv1、前列腺酸性磷酸酶、nav1.1。
[0517]
实施方案61.实施方案51-60中的任一个的方法,其中在体外、离体或在体内进行所述接触步骤(a)。
[0518]
实施方案62.实施方案51-61中的任一个的方法,其中在体外、离体或在体内进行所述接触步骤(b)。
[0519]
实施方案63.实施方案51-62中的任一个的方法,其中在受试者中在体内进行所述接触步骤(a)和/或(b)。
[0520]
实施方案64.实施方案63的方法,其中所述接触步骤(a)包括将所述经工程改造的受体、所述多核苷酸、所述载体或所述药物组合物施用给所述受试者;和/或所述接触步骤(b)包括将所述非天然配体施用给所述受试者。
[0521]
实施方案65.实施方案51-64中的任一个的方法,其中所述接触步骤(a)和/或(b)包括脂质体转染、纳米颗粒递送、颗粒轰击、电穿孔、声处理或显微注射。
[0522]
实施方案66.实施方案51-65中的任一个的方法,其中所述经工程改造的受体能够定位至所述神经元的细胞表面。
[0523]
实施方案67.一种在有此需要的受试者中治疗神经学障碍和/或延迟神经学障碍的发作的方法,所述方法包括:
[0524]
给所述受试者施用治疗有效量的实施方案1-20中的任一个的经工程改造的受体、实施方案21-26中的任一个的多核苷酸、实施方案27-30中的任一个的载体、实施方案31的组合物或实施方案32的药物组合物,和
[0525]
给所述受试者施用所述经工程改造的受体的非天然配体。
[0526]
实施方案68.实施方案67的方法,其中在步骤(a)之后给所述受试者施用所述非天然配体。
[0527]
实施方案69.实施方案67的方法,其中与步骤(a)并行地给所述受试者施用所述非天然配体。
[0528]
实施方案70.实施方案67-69中的任一个的方法,其中所述神经学障碍是癫痫发作
障碍、运动障碍、进食障碍、脊髓损伤、神经源性膀胱障碍、痛觉超敏、痉挛状态障碍、瘙痒、阿尔茨海默氏病、帕金森病、创伤后应激障碍(ptsd)、胃食管反流疾病(gerd)、成瘾、焦虑、抑郁症、记忆丧失、痴呆、睡眠呼吸暂停、中风、发作性睡病、尿失禁、特发性震颤、三叉神经痛、口腔烧灼综合征或心房颤动。
[0529]
实施方案71.实施方案70的方法,其中所述神经学障碍是痛觉超敏。
[0530]
实施方案72.实施方案67-71中的任一个的方法,其中所述非天然配体选自由以下成员组成的集合:azd-0328、abt-126、tc6987、apn-1125、tc-5619和facinicline/rg3487。
[0531]
实施方案73.实施方案67-72中的任一个的方法,其中口服地、皮下地、局部地或静脉内地施用所述非天然配体。
[0532]
实施方案74.实施方案73的方法,其中口服地施用所述非天然配体。
[0533]
实施方案75.实施方案67-74中的任一个的方法,其中皮下地、口服地、鞘内地、局部地、静脉内地、神经节内地、神经内地、颅内地、椎管内地或向小脑延髓池施用所述经工程改造的受体、所述多核苷酸、所述载体、所述组合物或所述药物组合物。
[0534]
实施方案76.实施方案67-75中的任一个的方法,其中通过经椎间孔注射或鞘内地施用所述经工程改造的受体、所述多核苷酸、所述载体、所述组合物或所述药物组合物。
[0535]
实施方案77.实施方案67-76中的任一个的方法,其中所述受试者遭受三叉神经痛,且其中将所述经工程改造的受体、所述多核苷酸、所述载体、所述组合物或所述药物组合物施用至所述受试者的三叉神经节(tg)。
[0536]
实施方案78.实施方案67-76中的任一个的方法,其中所述受试者遭受神经性疼痛,且其中将所述经工程改造的受体、所述多核苷酸、所述载体、所述组合物或所述药物组合物施用至所述受试者的背根神经节(drg)。
[0537]
实施方案79.实施方案67-78中的任一个的方法,其中所述受试者是人。
[0538]
实施方案80.实施方案67-79中的任一个的方法,其中所述治疗有效量减轻所述神经学障碍的征象和/或症状的严重程度。
[0539]
实施方案81.实施方案67-80中的任一个的方法,其中所述治疗有效量延迟所述神经学障碍的征象和/或症状的发作。
[0540]
实施方案82.实施方案67-81中的任一个的方法,其中所述治疗有效量消除所述神经学障碍的征象和/或症状。
[0541]
实施方案83.实施方案80-82中的任一个的方法,其中所述神经学障碍的征象是神经损伤、神经萎缩和/或癫痫发作。
[0542]
实施方案84.实施方案83的方法,其中所述神经损伤是周围神经损伤。
[0543]
实施方案85.实施方案80-84中的任一个的方法,其中所述神经学障碍的症状是疼痛。
[0544]
实施方案86.一种在有此需要的受试者中治疗疼痛和/或延迟疼痛发作的方法,所述方法包括:
[0545]
给所述受试者施用治疗有效量的实施方案1-20中的任一个的经工程改造的受体、实施方案21-26中的任一个的多核苷酸、实施方案27-30中的任一个的载体、实施方案31的组合物或实施方案32的药物组合物,和
[0546]
给所述受试者施用所述经工程改造的受体的非天然配体。
[0547]
实施方案87.实施方案86的方法,其中在步骤(a)之后给所述受试者施用所述非天然配体。
[0548]
实施方案88.实施方案86的方法,其中与步骤(a)并行地给所述受试者施用所述非天然配体。
[0549]
实施方案89.实施方案86-88中的任一个的方法,其中所述非天然配体选自由以下成员组成的集合:azd-0328、abt-126、tc6987、apn-1125、tc-5619和facinicline/rg3487。
[0550]
实施方案90.实施方案86-89中的任一个的方法,其中口服地、皮下地、局部地或静脉内地施用所述非天然配体。
[0551]
实施方案91.实施方案90的方法,其中口服地施用所述非天然配体。
[0552]
实施方案92.实施方案86-91中的任一个的方法,其中皮下地、口服地、鞘内地、局部地、静脉内地、神经节内地、神经内地、颅内地、椎管内地或向小脑延髓池施用所述经工程改造的受体、所述多核苷酸、所述载体、所述组合物或所述药物组合物。
[0553]
实施方案93.实施方案86-92中的任一个的方法,其中通过经椎间孔注射或鞘内地施用所述经工程改造的受体、所述多核苷酸、所述载体、所述组合物或所述药物组合物。
[0554]
实施方案94.实施方案86-93中的任一个的方法,其中所述受试者遭受三叉神经痛,且其中将所述经工程改造的受体、所述多核苷酸、所述载体、所述组合物或所述药物组合物施用至所述受试者的三叉神经节(tg)。
[0555]
实施方案95.实施方案86-94中的任一个的方法,其中所述受试者遭受神经性疼痛,且其中将所述经工程改造的受体、所述多核苷酸、所述载体、所述组合物或所述药物组合物施用至所述受试者的背根神经节(drg)。
[0556]
实施方案96.实施方案86-95中的任一个的方法,其中所述受试者是人。
[0557]
实施方案97.实施方案85-96中的任一个的方法,其中所述疼痛是神经性疼痛。
[0558]
实施方案98.实施方案85-97中的任一个的方法,其中所述疼痛与化学疗法有关,由化学疗法造成,或起因于化学疗法。
[0559]
实施方案99.实施方案85-98中的任一个的方法,其中所述疼痛与创伤有关,由创伤造成,或起因于创伤。
[0560]
实施方案100.实施方案85-99中的任一个的方法,其中所述受试者遭受痛觉超敏。
[0561]
实施方案101.实施方案85-100中的任一个的方法,其中所述疼痛在医学操作后出现。
[0562]
实施方案102.实施方案85-101中的任一个的方法,其中所述疼痛与分娩或剖腹产术有关,由分娩或剖腹产术造成,或起因于分娩或剖腹产术。
[0563]
实施方案103.实施方案85-102中的任一个的方法,其中所述疼痛与偏头痛有关,由偏头痛造成,或起因于偏头痛。
[0564]
实施方案104.实施方案85-103中的任一个的方法,其中所述治疗有效量暂时减轻所述受试者中的疼痛,永久地减轻所述受试者中的疼痛,预防所述受试者中的疼痛发作,和/或消除所述受试者中的疼痛。
[0565]
实施方案105.实施方案85-104中的任一个的方法,其中在所述受试者中出现疼痛之前进行步骤(a)和(b)。
[0566]
前述内容仅仅解释了本公开内容的原理。应当理解,本领域技术人员将能够设计
各种布置,所述布置尽管没有在本文中明确地描述或示出,但体现本公开内容的原理并且被包括在其精神和范围内。此外,本文所叙述的所有实施例和条件性语言主要旨在帮助读者理解本公开内容的原理和发明人为改进现有技术所贡献的概念,并且不应被解释为没有限制地成为这样的特别叙述的实施例和条件。此外,本文中叙述本公开内容的原理、方面和实施方案及其具体实施例的所有陈述意图涵盖其结构等效物和功能等效物。另外,这样的等效物意图包括当前已知的等效物和在将来开发的等效物,即,不考虑结构而执行相同功能的所开发的任何元件。因此,本公开内容的范围无意限于本文中所示出和描述的示例性实施方案。相反,本公开内容的范围和精神由所附权利要求书体现。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。