1.本发明涉及中药提取制备技术领域,尤其涉及一种童康片的制备工艺。
背景技术:
2.童康片为纯中药制剂,处方来源于治疗表虚自汗“玉屏风散”经典名方,玉屏风散由防风、黄芪、白术三味中药组成,童康片在此基础上加山药、牡蛎、陈皮,由黄芪、白术、防风、山药、牡蛎和陈皮六味药材组成,具有补肺固表、健脾益胃、提高机体免疫的功效,适用于小儿反复呼吸道感染肺脾气虚证的患儿。
3.升麻素苷、毛蕊异黄酮葡萄糖苷、5-o-甲基维斯阿米醇苷、橙皮苷是童康制剂的主要指标成分,在高温条件下,稳定性降低。苍术酮具有保肝、抑制ccl4引起的脂质过氧化、细胞毒活性、、抗肿瘤、抗炎等药理作用,是白术的功效成分之一。苍术酮在室温下不稳定,极易自身氧化成白术内酯ⅰ,白术内酯ⅲ,在加热的条件下,降解速度加快。
4.童康片的现有制备工艺中,采用水蒸气蒸馏提取白术、防风中的挥发油,蒸馏时间达到6h以上,收集挥发油后药液过滤另行保存,药渣加水再煎煮一次;黄芪、牡蛎加水煎煮2次,过滤后合并所有煎煮液,减压浓缩成稠膏。该工艺在高温、长时间的提取制备过程中,指标成分和苍术酮易氧化降解,造成童康制剂产品中指标成分降低、苍术酮的含量极低,不利于产品的质量控制。经文献检索,目前,公开的研究基于单味药材中指标成分的提取及分析,尚未见有采用超临界co2流体技术用于童康片药材挥发油的提取制备和采用低温高压破碎提取技术用于童康片药材的提取制备,未考虑提取工艺对后续产品的影响。
技术实现要素:
5.为了降低温度对童康片制剂提取制备过程的影响、提高产品中指标成分和苍术酮的含量,本发明提供一种童康片的制备工艺。该工艺采用超临界co2萃取技术结合高压破碎提取技术改进药材的提取方式、降低提取温度、缩短提取时间来提高童康片中指标成分和苍术酮的含量,具体技术方案如下:
6.一种童康片的制备工艺,包括如下步骤:
7.(1)药材粉碎:将黄芪、山药、陈皮、白术、防风、牡蛎分别粉碎;
8.(2)挥发油超临界co2萃取:取粉碎好的白术、防风、陈皮置于超临界萃取釜中,对萃取装置分别进行升温、升压至萃取条件,开始循环萃取,保持恒温恒压至所需萃取时间,萃取完成后得到白术、防风、陈皮药材的挥发油及药渣;
9.(3)水溶性成分低温高压破碎提取:取步骤(2)中的药渣加入粉碎好的黄芪、山药、牡蛎,加水进行低温高压破碎提取,提取液过滤,得滤液,减压浓缩成稠膏;
10.(4)制粒、干燥:将步骤(2)提取的挥发油和步骤(3)所得的稠膏混合均匀,加入辅料制成颗粒、干燥、压片。
11.进一步地,步骤(1)中所述的药材的配方为按质量份计:黄芪300~350份、山药300~350份、陈皮20~30份、白术200~220份、防风100~115份、牡蛎300~350份。
12.进一步地,所述步骤(1)中,药材的粉碎粒度为60~100目。
13.进一步地,所述步骤(2)中,超临界co2萃取条件为:萃取压力15~30mpa,萃取温度40~60℃;解析釜i压力6~12mpa,解析釜i温度45~55℃;解析釜ii压力6~8mpa,解析釜ii温度45~50℃;循环萃取30~75min。
14.进一步地,所述步骤(2)中,挥发油收率》1.5%,苍术酮含量》1.4%。
15.进一步地,所述步骤(3)中,低温高压破碎提取的条件为:提取压力50~120mpa;提取温度4~24℃。
16.进一步地,所述步骤(3)中,水的添加量按每克混合药材加入体积为10~30ml计。
17.进一步地,所述步骤(3)中,稠膏收率》40%。
18.进一步地,所述步骤(4)中,以干品计算,颗粒中升麻素苷含量≥0.4769mg/2g、毛蕊异黄酮葡萄糖苷含量≥0.6384mg/2g、5-o-甲基维斯阿米醇苷含量≥0.7591mg/2g、橙皮苷含量≥4.1723mg/2g、苍术酮含量≥0.3205mg/2g。
19.本发明相对于现有技术具有如下的优点及效果:
20.本发明采用超临界co2萃取技术萃取药材的挥发性成分,萃取后的药渣与其他味药材一起进行低温高压破碎全提取,改进原工艺提取方式、缩短药材的提取过程,提高生产效率,且超临界co2萃取技术和低温高压破碎技术可以在较低的温度下提取指标成分,避免了原工艺产品制备过程中高温对指标成分的影响,减少降解,从而提高最终产品中指标成分的含量,提高产品的稳定性及疗效。
21.本发明操作简便无污染、温度低、周期短,可提高指标成分的含量,同时解决原工艺产品中苍术酮含量低的问题。
具体实施方式
22.为更好地理解本发明,下面通过以下实施例对本发明作进一步具体的阐述,但不可理解为对本发明的限定,对于本领域的技术人员根据上述发明内容所作的一些非本质的改进与调整,也视为落在本发明的保护范围内。
23.本发明实施例中涉及的成分检测分析方法:
24.(1)指标成分检测分析方法
25.色谱柱:色谱柱kromasil 100-5-c
18
(250mm
×
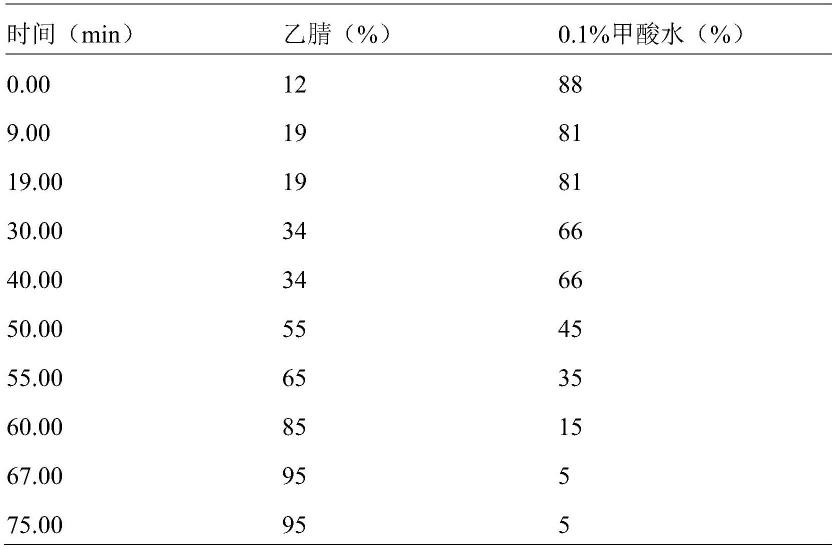
4.6mm,5μm)、流速1ml/min、柱温25℃、检测波长为升麻素苷、毛蕊异黄酮葡萄糖苷、5-o-甲基维斯阿米醇苷(260nm)、橙皮苷283nm、流动相为乙腈-0.1%甲酸水,按表1所示程序梯度洗脱。
26.表1指标成分梯度洗脱程序:
[0027][0028]
(2)苍术酮检测分析方法
[0029]
色谱条件:色谱柱kromasil 100-5-c
18
(250mm
×
4.6mm,5μm)、流速1ml/min、柱温35℃、检测波长220nm、流动相为乙腈-水,按表2所示程序梯度洗脱。
[0030]
表2苍术酮洗脱梯度
[0031][0032][0033]
(3)供试品溶液的配制
[0034]
挥发油供试品溶液的配制:取挥发油25mg,精密称定,加甲醇溶解并定容至10ml,摇匀,精密移取1ml,加甲醇稀释1倍,摇匀,即得挥发油供试品溶液。
[0035]
成品供试品溶液的配制:取成品2g,精密称定,置50ml具塞锥形瓶中,精密加入甲醇20ml,采用加热回流提取60min,放冷,再称定重量,用甲醇补足减失的重量,摇匀,用0.45μm微孔滤膜滤过,取续滤液作为成品供试品溶液。
[0036]
(4)对照品溶液的配制
[0037]
分别精密称取对照品升麻素苷、毛蕊异黄酮葡萄糖苷、5-o-甲基维斯阿米醇苷、橙皮苷、苍术酮适量,置2ml容量瓶中,加甲醇溶解并定容至刻度,配制成各含升麻素苷0.5309mg/ml、毛蕊异黄酮葡萄糖苷0.4852mg/ml、5-o-甲基维斯阿米醇苷0.49816mg/ml、橙皮苷0.4949mg/ml、苍术酮0.5194mg/ml的对照品母液。分别移取各对照品母液适量,稀释至不同浓度的对照品溶液。
[0038]
(5)线性关系及范围
[0039]
根据色谱条件,分别精密吸取对照品溶液与供试品溶液各10μl,注入液相色谱仪,记录色谱峰图。按外标法以峰面积计算,即得。结果如表3所示。
[0040]
表3线性关系
[0041][0042]
实施例1
[0043]
配方:白术210份、防风110份、陈皮25份、黄芪330份、山药325份、牡蛎320份,所述的份指质量份;
[0044]
将白术、防风、陈皮、黄芪、山药、牡蛎分别粉碎,粉碎度为60~100目。
[0045]
(1)超临界萃取
[0046]
取粉碎好的白术、防风、陈皮药材,按照处方量取样置于超临界萃取釜中,调节萃取压力至15~30mpa、萃取温度40~60℃;解析釜i压力6~12mpa、温度45~55℃;解析釜ii压力6~8mpa、温度45~50℃,循环萃取30~75min,萃取完成后得到白术、防风、陈皮药材的挥发油及药渣。结果如表4所示。
[0047]
表4挥发油提取结果
[0048][0049]
(2)高压差破碎提取
[0050]
取超临界所得的药渣,按照处方配比加入粉碎处理后的黄芪、山药、牡蛎,混合均匀,称取适量,每克药材加入10~30ml的纯化水,在温度4~24℃、压力为50~120mpa的条件下进行低温高压破碎提取1次,提取完成后过滤,滤液减压浓缩成稠膏。结果如表5所示。
[0051]
表5低温高压破碎提取结果
[0052][0053]
将超临界co2萃取的挥发油(样品b)和低温高压差破碎提取所得的稠膏(样品b)按照处方比例混合均匀,加入适量辅料制成颗粒、干燥。
[0054]
对比例1
[0055]
现有技术工艺步骤如下:
[0056]
(1)药材粉碎:将配方中的山药、陈皮分别粉碎成细粉;将白术、防风粉碎至5目;
[0057]
(2)脂溶性成分提取:取粉碎好的白术、防风药材,按照配方量取样置于圆底烧瓶中,煮沸,水蒸气蒸馏提取挥发油,收集挥发油,蒸馏后药液另行保存,药渣加水煎煮1次,过滤,合并2次药液;
[0058]
(3)水溶性成分提取:按照配方量称取黄芪、牡蛎,加水煎煮提取2次,提取液过滤,合并2次提取液,与步骤(2)药液合并后减压浓缩至稠膏;
[0059]
(4)制粒、干燥:取步骤(3)的稠膏,加入山药、陈皮细粉,混合混匀,将步骤(2)的脂溶性成分溶于体积分数95%乙醇溶液,脂溶性成分重量:乙醇溶液体积=1:5(g/ml),将其与适量辅料,混合均匀,制成颗粒、干燥、成片。
[0060]
分别对实施例1和对比例1中颗粒进行液相色谱检测,并根据高效液相色谱检测结果记录峰面积,对照标准品溶液中有效成分的峰面积与浓度的线性关系,计算出指标成分和苍术酮的含量。详情如下表6:
[0061]
表6颗粒成品指标成分和苍术酮含量检测结果表
[0062][0063]
相比之下,经过改进后工艺所得的产品中5个成分的含量均高于原工艺所得的样品,说明超临界co2萃取能显著提高成品中苍术酮的含量,低温高压破碎提取能提高指标成分的提取率,同时缩短药材提取、浓缩过程中的加热时间,减少了指标成分的降解,提高其在成品中的含量,突出了本发明提供的方法具有显著的进步性。
[0064]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受所述的实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。