1.本发明属于分子生物学技术领域,具体涉及一种受化学调控的蛋白酶工具及其配套底物。
背景技术:
2.通过合成生物学手段对细胞内信号通路进行人工干预,实现对细胞行为的人工控制具有重要的临床诊断治疗价值。蛋白酶具有通过水解肽键从而改变蛋白质底物状态的功能,包括使水解后的蛋白质底物失去原有活性和移除底物中原有的抑制性结构域而使蛋白质底物具有下游活性。因此蛋白酶可以在干预细胞内信号转导的过程中被应用为一种有效的分子工具。为了实现对蛋白酶的水解活性进行人为控制,对蛋白酶进行工程化改造是一种比较常用的技术手段。目前通用的策略是将完整的蛋白酶拆分裂为两个结构域,再将两个蛋白酶结构域分别与可诱导的异源二聚结构域以柔性方式连接。目前已经发表的六种分裂式可诱导蛋白酶分别由下列蛋白酶改造而来:烟草蚀纹病毒蛋白酶(tevp)、芜菁花叶病毒蛋白酶(tumvp)、烟草脉斑驳病毒蛋白酶(tvmvp)、向日葵轻度花叶病毒蛋白酶(summvp)、大豆花叶病毒蛋白酶(sbmvp)和李痘病毒蛋白酶(ppvp)。
3.人工信号输入细胞,诱导异源二聚结构域二聚,进而使分裂的蛋白酶结构域重新聚合成为有活性的完整蛋白酶结构,恢复蛋白酶的水解活性,从而开启下游的信号过程。上述的病毒蛋白酶均为内切酶,具有准确的氨基酸识别切割序列。在蛋白酶目标底物中引入相对应的蛋白酶识别切割序列构成人工蛋白酶底物,与其相对应的蛋白酶配套使用以实现特定的胞内信号控制效果。
4.现有可响应人工信号调控的蛋白酶工具都是基于“分裂蛋白”的技术路线实现的。这意味着这些可调控蛋白酶工具都必须以异源二聚的形式进行激活。在构建这样的蛋白酶工具的过程中,需要分别对分裂后的两部分蛋白酶结构域进行构建和优化,在后续的使用中,需要同时将异源的两部分蛋白酶元件同时转染进哺乳动物细胞中。因此现有的可调控蛋白酶技术手段具有一定局限性:一是分裂后的蛋白酶一定为异源二聚的形式限制了一些高效的同源二聚蛋白结构域被应用到蛋白酶工具的构建中;二是每构建一种蛋白酶工具都需要同时构建、优化以及转染两部分蛋白质结构域,增加了构建过程的工作量和在病毒转染载体上占据的有效包装容量。
5.基于这一情况,本发明使用基于突变天然同源二聚蛋白酶的技术路线开发了可受人工调控的同源二聚型蛋白酶工具,同时开发了一系列可与该新型蛋白酶配套使用的蛋白酶底物,以在细胞中实现不同的调控功能。
技术实现要素:
6.本发明的目的是克服现有可调控蛋白酶技术手段具有一定局限性的问题。
7.为此,本发明提供了一种受化学调控的蛋白酶工具,所述蛋白酶工具包括hiv-1蛋白酶突变体和dmrb结构域;所述dmrb结构域通过柔性肽段与所述hiv-1蛋白酶突变体进行
连接;所述hiv-1蛋白酶突变体通过对天然条件下介导hiv-1蛋白酶二聚的氨基酸位点进行突变获得。该蛋白酶受化学小分子ap20187诱导后二聚激活。
8.进一步的,为了在减弱天然hiv-1蛋白酶同源二聚活性的同时,又能保证突变体蛋白酶可以在所连接的化学诱导二聚结构域所介导的二聚下重新恢复催化活性,上述hiv-1蛋白酶突变体为t96a突变体或n98d突变体;其中,所述t96a突变体为将hiv-1蛋白酶第96位的苏氨酸突变为丙氨酸的突变体;所述n98d突变体为将hiv-1蛋白酶第98位的天冬酰胺突变为天冬氨酸的突变体。
9.进一步的,上述柔性肽段的氨基酸序列为sgggsgggsggg。
10.进一步的,上述dmrb结构域可以连接在hiv-1蛋白酶突变体的最n端,也可以连接在hiv-1蛋白酶突变体的最c端,两种连接方式可以产生不同强度的蛋白酶活性,dmrb结构域连接于hiv-1突变体n端时诱导后的蛋白酶活性较弱,同时在无诱导状态下背景活性低;连接在c端时诱导后的蛋白酶活性较强,但在无诱导状态下表现出较高的背景活性。dmrb结构域连接于hiv-1突变体n端时蛋白酶工具表现出较好的诱导前后蛋白酶活性强度变化比例。因此,在实际应用中可以根据对蛋白酶水解活性强度的需求选择dmrb结构域与hiv-1蛋白酶突变体的连接方向。
11.为了实现蛋白酶工具对细胞内信号过程的控制,本发明还提供了一种上述蛋白酶工具的配套底物,所述配套底物包括从n端到c端依次连接的ub(r)-dk降解标签、蛋白酶工具识别切割位点、目标效应蛋白、蛋白酶工具识别切割位点和4个串联的pest基序。
12.本发明还提供了一种上述蛋白酶工具的配套底物,所述配套底物包括底物蛋白,在所述底物蛋白的天然蛋白酶识别切割位点中插入蛋白酶工具识别切割位点;所述底物蛋白为天然受蛋白酶水解后激活的蛋白。
13.本发明还提供了一种上述蛋白酶工具的配套底物,所述配套底物包括从n端到c端依次连接的目标效应蛋白、蛋白酶工具识别切割位点和caax序列;其中所述caax序列为来自ras2蛋白c端末尾的caax氨基酸基序。
14.具体的,由于hiv-1蛋白酶具有多种不同的识别切割位点,为了实现蛋白酶对底物更高的水解效率,本发明中对底物构建过程中使用的hiv-1蛋白酶识别序列进行了优化测试,选用了最优的识别切割位点,上述蛋白酶工具识别切割位点的氨基酸序列为vsfnfpqitl。
15.具体的,上述目标效应蛋白为荧光蛋白、具有下游转录调控活性的转录因子或对细胞内源信号转导通路具有干扰作用的蛋白激酶中的一种。
16.具体的,上述底物蛋白为caspase3蛋白或gasdermin d蛋白。
17.与现有技术相比,本发明具有以下优点和有益效果:
18.本发明提供的这种受化学调控的蛋白酶工具将可受人工信号调控的蛋白酶工具由异源二聚形式改变为同源二聚形式,因此在进行细胞实验时所需转入细胞的蛋白酶工具元件数目由两个减少为一个,蛋白酶工具的氨基酸序列长度也有所缩短。以目前最常用的基于烟草蚀纹病毒蛋白酶(tevp)所开发的异源二聚蛋白酶工具作为比较,完整化学诱导型tevp蛋白酶工具由两部分构成,分别为与fkbp蛋白连接的n端部分tev蛋白酶和与frb蛋白连接的c端部分tev蛋白酶,这两部分蛋白的氨基酸数目分别为244个氨基酸和230个氨基酸,因此要完整使用tev蛋白酶工具一共需要转染两部分,共474个氨基酸大小的蛋白。而本
发明中所构建的同源二聚蛋白酶工具使用时仅需转染一个结构域,化学调控型蛋白酶工具的大小仅为222个氨基酸。更精简的结构和更小的蛋白质大小使该蛋白酶工具在被使用时占据更小的载体可用包装容量,在一些需要向细胞内转染多种蛋白元件的复杂人工信号通路构建工作中本发明提供的蛋白酶工具将更具优势。本发明提供的蛋白酶工具与其配套的多种不同特异性底物共同使用时,可以通过化学小分子ap20187调控细胞内荧光蛋白稳定性、荧光蛋白亚细胞定位变化、特定转录因子启动的下游目的基因表达、细胞凋亡以及细胞焦亡等多种不同的细胞内信号过程,实现人工信号输入对在哺乳动物细胞内信号通路的控制。
19.以下将结合附图对本发明做进一步详细说明。
附图说明
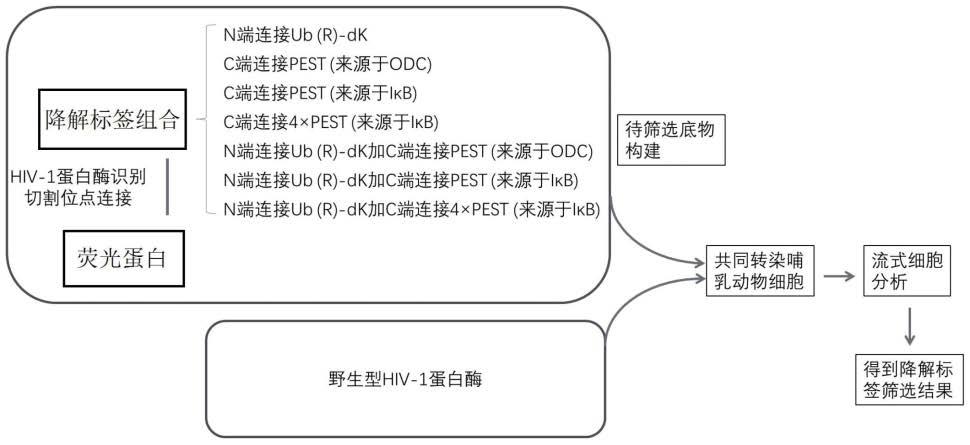
20.图1是本发明实施例1中不同降解因子组合的筛选流程图。
21.图2是本发明实施例1构建的荧光蛋白报告底物的蛋白序列构成示意图。
22.图3是本发明实施例1中hiv-1蛋白酶突变体筛选及受化学调控的蛋白酶工具构建流程图。
23.图4是本发明实施例1中受化学调控的蛋白酶工具的蛋白序列构成示意图;其中,a为dmrb结构域连接在hiv-1蛋白酶突变体n端时的示意图,b为dmrb结构域连接在hiv-1蛋白酶突变体c端时的示意图。
24.图5是本发明实施例1中基于天然受蛋白酶水解后激活的蛋白质设计的配套底物示意图。
25.图6是本发明实施例1中基于来自ras2蛋白c端末尾的caax氨基酸基序设计的配套底物示意图。
26.附图标记:1、ub(r)-dk降解标签;2、蛋白酶工具的识别切割位点;3、目标效应蛋白;4、pest基序;5、dmrb结构域;6柔性肽段;7、hiv-1蛋白酶突变体;8、caax氨基酸基序。
具体实施方式
27.下面将结合实施例对本发明中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。尽管已经详细描述了本发明的代表性实施例,但是本发明所属技术领域的普通技术人员将理解,在不脱离本发明范围的情况下可以对本发明进行各种修改和改变。因此,本发明的范围不应局限于实施方案,而应由所附权利要求及其等同物来限定。
28.本发明的技术方案具体包含了两大部分,分别为同源二聚型可受化学小分子ap20187诱导后二聚激活的化学调控蛋白酶工具和可被上述蛋白酶工具水解而产生状态变化的一系列配套蛋白酶底物。本发明中的底物具体有三类,分别为受蛋白酶水解后由易降解状态转变为稳定状态的底物、受蛋白酶水解后亚细胞定位由细胞质膜转变为细胞质基质的底物、受蛋白酶水解后激活而引发细胞凋亡或细胞焦亡的细胞命运控制底物。
29.下面通过具体实施例对本发明的受化学调控的蛋白酶工具及其配套底物的效果进行研究。
30.实施例1:
31.在诸多天然病毒蛋白酶中,来源于hiv-1(人类免疫缺陷病毒1型)的病毒蛋白酶(hiv-1蛋白酶)是一种同源二聚蛋白酶,由两个完全相同的亚基同源二聚后形成完整的催化中心产生水解活性,这样的天然结构契合构建同源二聚蛋白酶工具的需求,本实施例将基于hiv-1蛋白酶进行可受人工调控的蛋白酶分子工具开发。
32.一、构建可以用来反映hiv-1蛋白酶在细胞内活性的荧光蛋白报告底物
33.为了在后续的蛋白酶工具构建流程中反映哺乳动物细胞中水解活性的高低,首先需要构建一种可在哺乳动物细胞中表现hiv-1蛋白酶活性的报告性底物。以荧光蛋白为基础开发这类底物将方便使用流式细胞分析技术或荧光显微镜成像技术对活细胞产生的信号进行定量分析。因此本实施例中使用了连接降解标签的荧光蛋白设计,在荧光蛋白的n端或/和c端加上降解因子并以hiv-1蛋白酶切割位点相连接,当hiv-1蛋白酶无活性时,降解因子引导荧光蛋白被降解,而当hiv-1蛋白酶发挥活性时,可以将荧光蛋白底物两端降解因子切除,荧光蛋白得以在细胞内稳定存在。为了得到最佳的报告效果,本实施例对不同的降解因子组合进行了筛选,筛选流程如图1所示。
34.实验结果显示,n端ub(r)-dk降解标签加c端4个串联的来源于iκb的pest基序组合在hiv-1蛋白酶水解前后细胞荧光蛋白活性比例差异最大,因此选择该降解因子组合作为受蛋白酶工具水解后由易降解状态转变为稳定状态的底物设计基础,该荧光蛋白报告底物的蛋白序列构成如图2所示。
35.荧光蛋白报告底物是受蛋白酶工具水解后由易降解状态转变为稳定状态的底物,这类底物中的目标效应蛋白可以是上述起报告作用的荧光蛋白,也可以是具有下游转录调控活性的转录因子,如tet3g、gal4等,还可以是对细胞内源信号转导通路具有干扰作用的蛋白激酶。实际使用时可以根据需要实现的调控功能,基于本发明提供的底物设计原理替换所需的目标效应蛋白,实现通过蛋白酶工具控制细胞内目标效应蛋白从关闭状态转化为开启状态的过程。
36.二、连接hiv-1蛋白酶突变体与化学小分子诱导二聚结构域以进行hiv-1蛋白酶突变体筛选,构建受化学调控的蛋白酶工具
37.在完整的hiv-1蛋白酶结构中,两个亚基的n端和c端的氨基酸形成四个反向平行、相互交叉的β-折叠结构,构成了hiv-1蛋白酶的末端二聚平面,因此亚基的n端和c端是决定天然条件下hiv-1蛋白酶亚基自发二聚产生活性的关键区域。而为了构建可受人工信号输入调控的蛋白酶,需要在对天然条件下介导hiv-1蛋白酶二聚的关键氨基酸位点进行突变或组合突变,从而破坏hiv-1蛋白酶的天然二聚,破坏hiv-1蛋白酶的天然水解活性。为此,如表1所示,本实施例对12种hiv-1蛋白酶突变体进行了筛选。
38.表1蛋白酶工具构建中过程中筛选的12种hiv-1蛋白酶突变体
39.突变名称突变位置原氨基酸突变后氨基酸d25n25天冬氨酸(d)天冬酰胺(n)p1a1脯氨酸(p)丙氨酸(a)q2a2谷氨酰胺(q)丙氨酸(a)i3a3异亮氨酸(i)丙氨酸(a)t96a96苏氨酸(t)丙氨酸(a)l97a97亮氨酸(l)丙氨酸(a)
n98d98天冬酰胺(n)天冬氨酸(d)f99a99苯丙氨酸(f)丙氨酸(a)97&99a97和99亮氨酸和苯丙氨酸丙氨酸(a)δ9999苯丙氨酸(f)截去i3a&δ993和99异亮氨酸和苯丙氨酸第3位丙氨酸,第99位截去
40.如图3所示,将突变后的hiv-1蛋白酶突变体通过柔性肽段与受化学小分子ap20187诱导的同源二聚蛋白结构域dmrb相连接,构建得到待筛选的受化学调控的蛋白酶工具,柔性肽段连接的氨基酸序列为sgggsgggsggg。将待筛选的蛋白酶工具与上述荧光蛋白报告底物共同转染进人胚肾细胞系(hek-293t细胞系),通过流式细胞分析加入化学小分子诱导前后带有不同hiv-1蛋白酶突变体的工具对底物水解活性的变化。
41.为了在减弱天然hiv-1蛋白酶同源二聚活性的同时,又能保证突变体蛋白酶可以在所连接的化学诱导二聚结构域所介导的二聚下重新恢复催化活性。根据hiv-1蛋白酶突变体的筛选结果,确定了t96a突变体和n98d突变体为构建蛋白酶工具的最优hiv-1蛋白酶突变体。其中,t96a突变体为将hiv-1蛋白酶第96位的苏氨酸突变为丙氨酸的突变体,n98d突变体为将hiv-1蛋白酶第98位的天冬酰胺突变为天冬氨酸的突变体。
42.由于hiv-1蛋白酶二聚时,两个单体亚基的n端和c端在空间上的距离存在差异,因此两种dmrb结构域连接方向不同的化学诱导蛋白酶工具会存在水解活性上的差异。确定构建受化学调控的蛋白酶工具所用的hiv-1蛋白酶突变体后,对蛋白酶突变体和化学诱导同源二聚结构域dmrb之间的两种连接方向(dmrb结构域连接在hiv-1蛋白酶突变体的n端或者c端所构成的蛋白酶工具受化学小分子诱导前后的水解活性进行测试。
43.经实验验证,将dmrb连接在hiv-1蛋白酶突变体c端的蛋白酶工具在无化学小分子诱导的情况下有相对更高的背景水解活性,同时受化学小分子诱导后也表现出更高的诱导后水解活性。而将dmrb连接在hiv-1蛋白酶突变体n端的蛋白酶工具表现出很低的背景活性,受诱导后的水解活性也相对较低,化学小分子诱导前后水解活性比值整体高于dmrb连接于c端的蛋白酶工具。
44.受化学调控的蛋白酶工具的蛋白序列构成如图4所示。
45.三、受化学调控的蛋白酶工具的配套底物
46.除上述荧光蛋白报告底物外,本实施例还为受化学调控的蛋白酶工具开发了两种类型的配套底物。
47.1、基于天然受蛋白酶水解后激活的蛋白质
48.天然受蛋白酶水解后激活的蛋白质主要存在与细胞凋亡和细胞焦亡等信号过程中,一般情况下该类型蛋白具有起效应作用和起抑制作用的两个亚基,两个亚基间具有特异性的蛋白酶水解切割位点。当受到上游蛋白酶的水解后,抑制性的亚基与效应性亚基分离,抑制作用解除,该蛋白产生下游效应。
49.因此,将蛋白酶工具的识别切割位点(hiv-1蛋白酶切割位点)插入到底物蛋白天然的蛋白酶识别切割位点中,在破坏该底物天然的蛋白酶识别切割位点的同时,使该底物可以受人工设计的蛋白酶工具调控而激活。本实施例包含了两种该类型的配套底物,结构如图5所示。
50.2、基于来自于ras2蛋白c端末尾的“caax”氨基酸基序
51.在c端含有来自于ras2蛋白c端末尾的“caax”氨基酸基序的蛋白质在哺乳动物细胞中翻译后会被法尼基转移酶和香叶烯基转移酶识别,从对基序上的半胱氨酸位点产生异戊烯化修饰,异戊烯化修饰后的蛋白质会被锚定到质膜上。为了实现蛋白酶工具对细胞内目标蛋白质亚细胞定位的调控,这类配套底物的设计为:在特定的目标蛋白c端加上“caax”氨基酸基序,并在基序与原蛋白之间通过蛋白酶工具的识别切割位点(hiv-1蛋白酶切割位点)相连接。这样设计的蛋白底物在蛋白酶工具未被激活时会定位到细胞膜上,而通过人工控制蛋白酶工具的激活,可以实现目标底物从细胞膜上被释放到细胞质或细胞核(如果目标蛋白含有核定位序列)的亚细胞定位变化。这类底物的设计示意如图6所示。
52.四、蛋白酶工具的识别切割位点优化
53.由于hiv-1蛋白酶具有多种不同的识别切割位点,为了实现蛋白酶对底物更高的水解效率,本实施例对底物构建过程中使用的hiv-1蛋白酶识别序列进行了优化测试,选用了最优的识别切割位点,其氨基酸序列为vsfnfpqitl。
54.以上例举仅仅是对本发明的举例说明,并不构成对本发明的保护范围的限制,凡是与本发明相同或相似的设计均属于本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
