病毒样颗粒疫苗
1.相关申请的交叉引用
2.本技术要求2019年7月30日提交的美国临时申请号62/880547和2020年3月16日提交的美国临时申请号62/990318的权益,将所述申请通过引用以其整体并入本文。
3.序列表
4.本技术包含按ascii格式以电子方式提交并特此通过引用以其全文并入的序列表。所述ascii副本创建于2020年6月24日,名称为47750-705_601_sl.txt并且大小为143千字节。
背景技术:
5.感染引起的疾病是普遍的。许多感染性疾病难以预防或治疗。例如,冠状病毒感染、诸如冠状病毒疾病2019(covid-19)的数量正在上升,并且没有可用疗法。需要更好的疫苗来防治这些疾病。
技术实现要素:
6.在某些实施方案中,本文公开了病毒样颗粒(vlp),其包含:(a)合成或天然脂质双层;(b)嵌入在所述脂质双层中的锚定分子;以及(c)与所述锚定分子结合的抗原。在某些实施方案中,本文公开了vlp,其包含:(a)合成脂质双层;(b)嵌入在所述脂质双层中的锚定分子;以及(c)与所述锚定分子结合的抗原。在一些实施方案中,所述脂质双层包含第一脂质,诸如磷脂酰胆碱类。在一些实施方案中,所述脂质双层包含第二脂质诸如磷脂酰乙醇胺类。在一些实施方案中,所述第一脂质和/或所述第二脂质各自包含4个至18个碳原子的酰基链。在一些实施方案中,所述第一脂质和/或所述第二脂质各自包含四个或更少的不饱和键。在一些实施方案中,所述脂质双层的所述第一脂质和/或所述脂质双层的所述第二脂质是合成的。在一些实施方案中,所述脂质双层、所述脂质双层的所述第一脂质和/或所述脂质双层的所述第二脂质具有至少99%的纯度,或不含或基本上不含生物材料。在一些实施方案中,所述第一脂质包括l,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)。在一些实施方案中,所述第二脂质包括1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)。在一些实施方案中,所述脂质双层以在1:0.25与1:4之间的预定比率包含所述第一脂质和所述第二脂质。在一些实施方案中,所述脂质双层包含固醇或固醇衍生物。在一些实施方案中,所述固醇或固醇衍生物包括胆固醇或dc-胆固醇。在一些实施方案中,所述脂质双层以相对于所述第一脂质和/或所述第二脂质为0-30mol%的比率包含固醇或固醇衍生物。在一些实施方案中,所述抗原具有至少75.0%、80.0%、85.0%、90.0%、91.0%、92.0%、93.0%、94.0%、95.0%、96.0%、97.0%、97.5%、98.0%、98.5%、99.0%、99.5%、99.9%、100%或由前述百分比中的任两者定义的百分比范围的纯度。在一些实施方案中,所述抗原与所述锚定分子直接结合,或者其中所述抗原包含所述锚定分子。在一些实施方案中,所述抗原包含细菌抗原或其片段。在一些实施方案中,所述细菌抗原包括放线菌属(actinomyces)抗原、芽孢杆菌属(bacillus)抗原、例如来自炭疽芽孢杆菌的免疫原性抗原、拟杆菌属(bacteroides)抗原、
博代氏杆菌属(bordetella)抗原、巴尔通氏体属(bartonella)抗原、包柔氏螺旋体属(borrelia)抗原例如博氏疏螺旋体(b.burgdorferi)ospa、布鲁氏菌属(brucella)抗原、弯曲杆菌属(campylobacter)抗原、二氧化碳嗜纤维菌属(capnocytophaga)抗原、衣原体属抗原、梭菌属(clostridium)抗原、棒状杆菌属(corynebacterium)抗原、柯克斯氏体属(coxiella)抗原、嗜皮菌属(dermatophilus)抗原、肠球菌属(enterococcus)抗原、埃立克体属(ehrlichia)抗原、埃希氏菌属(escherichia)抗原、弗朗西斯氏菌属(francisella)抗原、梭杆菌属(fusobacterium)抗原、血巴通氏体属(haemobartonella)抗原、嗜血杆菌属(haemophilus)抗原、例如流感嗜血杆菌b型外膜蛋白、螺杆菌属(helicobacter)抗原、克雷伯氏菌属(klebsiella)抗原、l型细菌抗原、钩端螺旋体属(leptospira)抗原、李斯特氏菌属(listeria)抗原、分枝杆菌(mycobacteria)抗原、支原体属(mycoplasma)抗原、奈瑟氏球菌属(neisseria)抗原、新立克次氏体属(neorickettsia)抗原、诺卡氏菌属(nocardia)抗原、巴斯德氏菌属(pasteurella)抗原、消化球菌属(peptococcus)抗原、消化链球菌属(peptostreptococcus)抗原、肺炎球菌(pneumococcus)抗原、变形杆菌属(proteus)抗原、假单胞菌属(pseudomonas)抗原、立克次氏体属(rickettsia)抗原、罗沙利马体属(rochalimaea)抗原、沙门氏菌属(salmonella)抗原、志贺氏菌属(shigella)抗原、葡萄球菌属(staphylococcus)抗原、链球菌属(streptococcus)抗原、例如酿脓链球菌(s.pyogenes)m蛋白、密螺旋体属(treponema)抗原和耶尔森氏菌属(yersinia)抗原、例如鼠疫耶尔森氏菌属(y.pestis)f1和v抗原。在一些实施方案中,所述抗原包括真菌抗原或其片段。在一些实施方案中,所述真菌抗原包括结肠小袋纤毛虫(balantidium coli)抗原、溶组织内阿米巴(entamoeba histolytica)抗原、肝片形吸虫(fasciola hepatica)抗原、蓝氏贾第鞭毛虫(giardia lamblia)抗原、利什曼原虫属(leishmania)抗原和疟原虫属(plasmodium)抗原。在一些实施方案中,所述抗原包括癌症抗原或其片段。在一些实施方案中,所述癌症抗原包括肿瘤特异性免疫球蛋白可变区、gm2、tn、stn、thompson-friedenreich抗原(tf)、globo h、le(y)、muc1、muc2、muc3、muc4、muc5ac、muc5b、muc7、癌胚抗原、人绒毛膜促性腺素的β链(hcgβ)、c35、her2/neu、cd20、psma、egfrviii、ksa、psa、psca、gp100、mage 1、mage 2、trp 1、trp 2、酪氨酸酶、mart-1、pap、cea、bage、mage、rage。在一些实施方案中,所述抗原包括病毒抗原或其片段。在一些实施方案中,所述病毒抗原包括来自人免疫缺陷病毒(hiv)、流感病毒、登革热病毒、寨卡病毒、西尼罗河病毒、埃博拉病毒、马尔堡病毒、狂犬病病毒、中东呼吸综合征(mers)病毒、重度急性呼吸综合征(sars)病毒、呼吸道合胞体病毒病毒(rsv)、尼帕病毒、人乳头状瘤病毒(hpv)、疱疹病毒或肝炎病毒,诸如甲型肝炎(hepa)病毒、乙型肝炎(hepb)或丙型肝炎(hepc)病毒的抗原。在一些实施方案中,所述抗原包括流感蛋白或其片段。在一些实施方案中,所述流感蛋白包括ha、na、m1、m2、ns1、ns2、pa、pb1或pb2流感蛋白或其片段。在一些实施方案中,所述流感蛋白包含与seq id no:1-16中任一个75.0%、80.0%、85.0%、90.0%、91.0%、92.0%、93.0%、94.0%、95.0%、96.0%、97.0%、97.5%、98.0%、98.5%、99.0%、99.5%、99.9%、100%或由前述百分比中的任两者定义的百分比范围相同的氨基酸序列或其片段。在一些实施方案中,所述流感蛋白包含与seq id no:1-16中任一个相比具有不超过1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列或其片段。在一些实施方案中,所述流感蛋白由下述核酸编码,所述核酸具有与编码氨基酸
seq id no:1-16中任一个的核酸序列75.0%、80.0%、85.0%、90.0%、91.0%、92.0%、93.0%、94.0%、95.0%、96.0%、97.0%、97.5%、98.0%、98.5%、99.0%、99.5%、99.9%、100%或由前述百分比中的任两者定义的百分比范围相同的序列或其片段。在一些实施方案中,所述流感蛋白由下述核酸编码,所述核酸具有与编码氨基酸seq id no:1-16中任一个的核酸序列相比具有不超过1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的核酸取代、缺失和/或插入的序列或其片段。在一些实施方案中,所述抗原包括冠状病毒蛋白或其片段。在一些实施方案中,所述冠状病毒包括重度急性呼吸综合征冠状病毒2(sars-cov-2)。在一些实施方案中,所述冠状病毒蛋白包括刺突(s)蛋白、包膜(e)蛋白、膜蛋白(m)或核衣壳(n)蛋白。在一些实施方案中,所述冠状蛋白包括s1或s2。在一些实施方案中,所述冠状病毒蛋白包含与seq id no:20-29中任一个75.0%、80.0%、85.0%、90.0%、91.0%、92.0%、93.0%、94.0%、95.0%、96.0%、97.0%、97.5%、98.0%、98.5%、99.0%、99.5%、99.9%、100%或由前述百分比中的任两者定义的百分比范围相同的氨基酸序列或其片段。在一些实施方案中,所述冠状病毒蛋白包含与seq id no:20-29中任一个相比具有不超过1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列或其片段。在一些实施方案中,所述锚定分子包括跨膜蛋白、脂质锚定蛋白或其片段或结构域。在一些实施方案中,所述锚定分子包含疏水部分。在一些实施方案中,所述锚定分子包括异戊二烯化蛋白、脂肪酰化蛋白、糖基磷脂酰肌醇连接蛋白或其片段。在一些实施方案中,所述vlp进一步包含包括所述脂质双层的合成脂质囊泡。在一些实施方案中,所述脂质双层包括内表面和外表面。在一些实施方案中,所述抗原呈递在所述脂质囊泡的所述外表面上。在一些实施方案中,所述抗原呈递在所述脂质囊泡的所述内表面上。在一些实施方案中,所述vlp是sevlp并且所述脂质双层呈合成脂质囊泡的形式。在一些实施方案中,所述vlp呈包括纳米盘的合成膜病毒样颗粒(smvlp)的形式。在一些实施方案中,所述纳米盘具有在5-200nm之间的直径。在一些实施方案中,所述纳米盘包含两亲性聚甲基丙烯酸酯(pma)共聚物。在一些实施方案中,所述纳米盘包含苯乙烯-马来酸脂质颗粒(smalp)。在一些实施方案中,所述纳米盘包含二异丁烯马来酸(dibma)共聚物。在一些实施方案中,所述pma共聚物是环形的。在一些实施方案中,所述smalp是环形的。在一些实施方案中,所述dibma共聚物是环形的。在一些实施方案中,所述纳米盘包含两亲性环形聚甲基丙烯酸酯(pma)共聚物、smalp或dibma共聚物。
7.在某些实施方案中,本文公开了疫苗,其包含:如本文所述的vlp,以及药学上可接受的赋形剂、载体和/或佐剂。在一些实施方案中,所述赋形剂包括抗粘附剂、粘合剂、包衣、颜料或染料、崩解剂、调味剂、助流剂、润滑剂、防腐剂、吸附剂、甜味剂或媒介物。在一些实施方案中,所述疫苗包含所述佐剂。在一些实施方案中,所述佐剂包括诸如咪喹莫特的toll样受体(tlr)激动剂、flt3配体、单磷酰脂质a(mla)或诸如cpg寡核苷酸的免疫刺激性寡核苷酸。在一些实施方案中,所述佐剂包括咪喹莫特。在一些实施方案中,将所述疫苗配制在溶剂或诸如盐水溶液的液体中、配制为干粉或糖玻璃。在一些实施方案中,所述疫苗是冻干的。在一些实施方案中,将所述疫苗配制用于鼻内、皮内、肌肉内、局部、口服、皮下、腹膜内、静脉内或鞘内施用。在一些实施方案中,所述疫苗包含1pg、10pg、25pg、100pg、250pg、500pg、750pg、1ng、5ng、10ng、15ng、20ng、25ng、50ng、100ng、250ng、500ng、1μg、10μg、50μg、100μg、500μg、1mg、5mg、10mg、50mg、100mg、500mg或1g剂量或由前述剂量中的任两者定义的
剂量范围的所述sevlp。在一些实施方案中,所述疫苗包含25pl、50pl、100pl、250pl、500pl、750pl、1nl、5nl、10nl、15nl、20nl 25nl、50nl、100nl、250nl、500nl、1μl、10μl、50μl、100μl、500μl、1ml或5ml剂量或由前述剂量中的任两者定义的剂量范围的所述疫苗。在一些实施方案中,所述疫苗配制用于100pl-20nl剂量的微针施用。在一些实施方案中,所述剂量是在微针装置的每个微针上或每个微针中。在一些实施方案中,所述疫苗配制为海藻糖玻璃。
8.在某些实施方案中,本文公开了vlp,其包含:(a)合成脂质双层,所述合成脂质双层包含第一脂质和第二脂质;(b)嵌入在所述脂质双层中的锚定分子;以及(c)与所述锚定分子结合的sars-cov-2蛋白。在一些实施方案中,第一脂质包括磷脂酰胆碱类。在一些实施方案中,所述第一脂质包括dopc。在一些实施方案中,所述第二脂质包括磷脂酰乙醇胺类。在一些实施方案中,所述第二脂质包括dope。在一些实施方案中,所述脂质双层以1:0.25至1:4的预定比率包含所述第一脂质和所述第二脂质。在一些实施方案中,所述脂质双层进一步包含胆固醇或dc-胆固醇、或其衍生物。在一些实施方案中,所述脂质双层以相对于所述第一脂质或所述第二脂质为0-30mol%的比率包含所述胆固醇或dc-胆固醇、或其衍生物。在一些实施方案中,所述sars-cov-2蛋白与所述锚定分子直接结合,或者其中所述sars-cov-2蛋白包含所述锚定分子。在一些实施方案中,所述sars-cov-2蛋白包括刺突蛋白。在一些实施方案中,所述刺突蛋白包括s1或s2。在一些实施方案中,所述刺突蛋白包含与seq id no:25至少85%相同的氨基酸序列。在一些实施方案中,所述刺突蛋白包含与seq id no:25相比具有不超过10个氨基酸取代、缺失或插入的氨基酸序列。在一些实施方案中,所述刺突蛋白结合人血管紧张素转化酶2(ace2)。在某些实施方案中,本文公开了疫苗,其包含所述vlp,以及药学上可接受的赋形剂、载体或佐剂。在一些实施方案中,所述佐剂包括咪喹莫特。在一些实施方案中,所述疫苗配制用于通过微针的注射。在一些实施方案中,所述疫苗是冻干的。在一些实施方案中,将所述疫苗配制为糖玻璃。在某些实施方案中,本文公开了疫苗接种方法,其包括向有需要的受试者施用所述疫苗。
9.在某些实施方案中,本文公开了合成有包膜病毒样颗粒(sevlp),其包含:(a)包括脂质双层的合成脂质囊泡,所述脂质双层具有内表面和外表面;(b)嵌入在所述脂质双层中的锚定分子;以及(c)与所述锚定分子结合的sars-cov-2蛋白。在一些实施方案中,所述sars-cov-2蛋白呈递在所述脂质囊泡的所述外表面上。在一些实施方案中,所述sars-cov-2蛋白呈递在所述脂质囊泡的所述内表面上。在一些实施方案中,所述sars-cov-2蛋白包括s1或s2刺突蛋白。在一些实施方案中,所述sevlp配制为用于注射的糖玻璃。
10.在某些实施方案中,本文公开了smvlp,其包含:(a)包括脂质双层的合成纳米盘,所述脂质双层包括内表面和外表面;(b)嵌入在所述脂质双层中的锚定分子;以及(c)与所述锚定分子结合的sars-cov-2蛋白。在一些实施方案中,所述纳米盘具有5-200nm直径。在一些实施方案中,所述纳米盘包含两亲性环形聚甲基丙烯酸酯(pma)共聚物、smalp、dibma共聚物或apoa的α螺旋的非免疫原性模拟肽。在一些实施方案中,所述sars-cov-2蛋白包括s1或s2刺突蛋白。在一些实施方案中,所述smvlp配制为用于注射的糖玻璃。
11.在某些实施方案中,本文公开了微针装置,其加载有如本文所述的疫苗。在一些实施方案中,所述微针装置包括基底和从所述基底延伸的多个微针,所述基底包括片材。在一些实施方案中,将所述疫苗配制在糖玻璃中。在一些实施方案中,所述糖玻璃是海藻糖。在一些实施方案中,所述微针装置包括通过胶带紧固至支撑材料的金属扣施加器。
12.在某些实施方案中,本文公开了制备sevlp的方法,其包括:将(i)包含与锚定分子结合的抗原的水性溶液与(ii)包含第一脂质和第二脂质的乙醇溶液微流体组合,从而将所述水性溶液与所述乙醇溶液混合,以形成包含脂质双层和嵌入在所述脂质双层中的所述锚定分子的sevlp,所述脂质双层包含所述第一脂质和所述第二脂质。在一些实施方案中,将所述水性溶液与所述乙醇溶液微流体组合包括将所述水性溶液的流与所述乙醇溶液的流混合。
13.在某些实施方案中,本文公开了用于预防疾病、降低疾病的发生率或降低疾病的严重程度的方法,其包括:向受试者施用如本文所述的疫苗,其中所述施用预防所述疾病、降低所述疾病的发生率或降低所述疾病的严重程度。在一些实施方案中,所述疾病包括感染。在一些实施方案中,所述疾病包括细菌、真菌或病毒感染。在一些实施方案中,所述病毒感染包括流感感染。在一些实施方案中,所述毒感染是冠状病毒感染。在一些实施方案中,所述病毒感染是冠状病毒疾病2019(covid 19)。在一些实施方案中,所述受试者是哺乳动物或人受试者。在一些实施方案中,所述施用包括通过一个或多个针或微针的施用。在一些实施方案中,所述施用包括通过预成形液体注射器的施用。在一些实施方案中,所述施用包括鼻内、皮内、肌肉内、皮肤贴片、局部、口服、皮下、腹膜内、静脉内或鞘内施用。在一些实施方案中,所述施用包括施用1pg、10pg、25pg、100pg、250pg、500pg、750pg、1ng、5ng、10ng、15ng、20ng、25ng、50ng、100ng、250ng、500ng、1μg、10μg、50μg、100μg、500μg、1mg、5mg、10mg、50mg、100mg、500mg或1g剂量或由前述剂量中的任两者定义的剂量范围的所述sevlp或疫苗。在一些实施方案中,通过每个微针施用100pl-20nl的所述疫苗。在一些实施方案中,通过每个微针施用5-20nl的所述疫苗。在一些实施方案中,使用如本文所述的微针装置施用所述疫苗。
14.在某些实施方案中,本文公开了试剂盒,其包括加载有如所述的vlp或疫苗的微针;以及擦拭物、干燥剂和/或绷带。在一些实施方案中,所述试剂盒包括如本文所述的微针装置。在一些实施方案中,所述试剂盒含有咪喹莫特擦拭物。
15.在某些实施方案中,本文公开了用于确定疫苗的有效性的方法,其包括:获得从已经施用了疫苗的受试者获得的样品,所述样品包含存在的或一定量的病毒;提供包含能够结合病毒蛋白的ace2或其片段的基底;使所述基底与所述样品接触以使所述样品中的病毒或蛋白病毒结合所述ace2或其片段;检测与所述基底的所述ace2或其片段结合的病毒或蛋白病毒;以及基于所检测到的与所述基底的所述ace2或其片段结合的病毒或蛋白病毒确定所述样品中所述病毒的存在或量,从而确定所述疫苗的有效性。在一些实施方案中,所述样品来自受试者。在一些实施方案中,所述样品包括血液、血清或血浆。在一些实施方案中,所述病毒是冠状病毒。在一些实施方案中,所述病毒是sars-cov-2。在一些实施方案中,所述病毒蛋白是sars-cov-2刺突蛋白。在一些实施方案中,与向所述受试者施用所述疫苗之前从所述受试者获得的另一样品相比,所述样品中病毒的量减少。在一些实施方案中,与向所述受试者施用所述疫苗之前从所述受试者获得的另一样品相比,所述样品中病毒的量增加。一些实施方案进一步包括基于所述样品中所述病毒的量或所述疫苗的有效性来向所述受试者推荐或提供病毒治疗。在一些实施方案中,所述病毒治疗包括冠状病毒治疗、诸如covid-19治疗。在一些实施方案中,所述疫苗包含vlp。
16.在某些实施方案中,本文公开了用于确定疫苗的有效性的方法,其包括:获得从已
经施用了疫苗的受试者获得的样品,所述样品包含存在的或一定量的抗病毒抗体;提供包含能够结合所述抗病毒抗体的病毒蛋白或其片段的基底;使所述基底与所述样品接触以使所述样品中的抗病毒抗体结合所述病毒蛋白或其片段;检测与所述基底的所述病毒蛋白或其片段结合的抗病毒抗体;以及基于所检测到的与所述基底的所述病毒蛋白或其片段结合的抗病毒抗体确定所述样品中所述抗病毒抗体的存在或量,从而确定所述疫苗的有效性。在一些实施方案中,所述样品来自受试者。在一些实施方案中,所述样品包括血液、血清或血浆。在一些实施方案中,所述病毒是冠状病毒。在一些实施方案中,所述病毒是sars-cov-2。在一些实施方案中,所述病毒蛋白是sars-cov-2刺突蛋白。在一些实施方案中,与向所述受试者施用所述疫苗之前从所述受试者获得的另一样品相比,所述样品中抗病毒抗体的量减少。在一些实施方案中,与向所述受试者施用所述疫苗之前从所述受试者获得的另一样品相比,所述样品中抗病毒抗体的量增加。一些实施方案进一步包括基于所述样品中所述抗病毒抗体的量或所述疫苗的有效性来向所述受试者推荐或提供病毒治疗。在一些实施方案中,所述病毒治疗包括冠状病毒治疗、诸如covid-19治疗。在一些实施方案中,所述疫苗包含vlp。
17.在某些实施方案中,本文公开了病毒样颗粒vlp,其包含:合成脂质双层,所述合成脂质双层包含第一脂质和第二脂质;嵌入在所述脂质双层中的锚定分子;以及与所述锚定分子结合的sars-cov-2蛋白。在一些实施方案中,所述第一脂质包括磷脂酰胆碱类。在一些实施方案中,其中所述第一脂质包括dopc。在一些实施方案中,所述第二脂质包括磷脂酰乙醇胺类。在一些实施方案中,所述第二脂质包括dope。在一些实施方案中,所述脂质双层以1:0.25至1:4的预定比率包含所述第一脂质和所述第二脂质。在一些实施方案中,所述脂质双层进一步包含胆固醇或dc-胆固醇、或其衍生物。在一些实施方案中,所述脂质双层以相对于所述第一脂质或所述第二脂质为0-30mol%的比率包含所述胆固醇或dc-胆固醇、或其衍生物。在一些实施方案中,所述sars-cov-2蛋白与所述锚定分子直接结合,或者其中所述sars-cov-2蛋白包含所述锚定分子。在一些实施方案中,所述sars-cov-2蛋白包括刺突蛋白。在一些实施方案中,所述刺突蛋白包括s1或s2。在一些实施方案中,所述刺突蛋白包含与seq id no:25至少85%相同的氨基酸序列。在一些实施方案中,所述刺突蛋白包含与seq id no:25相比具有不超过10个氨基酸取代、缺失或插入的氨基酸序列。在一些实施方案中,所述刺突蛋白结合ace2。在一些实施方案中,疫苗,其包含所述vlp,以及药学上可接受的赋形剂、载体或佐剂。在一些实施方案中,所述佐剂包括咪喹莫特。在一些实施方案中,所述疫苗配制用于通过微针的注射。在一些实施方案中,所述疫苗是冻干的。在一些实施方案中,将所述疫苗配制为糖玻璃。一些实施方案包括疫苗接种方法,其包括向有需要的受试者施用所述疫苗。
18.在某些实施方案中,本文公开了sevlp,其包含:包括脂质双层的合成脂质囊泡,所述脂质双层具有内表面和外表面;嵌入在所述脂质双层中的锚定分子;以及与所述锚定分子结合的sars-cov-2蛋白。在一些实施方案中,所述sars-cov-2蛋白呈递在所述脂质囊泡的所述外表面上。在一些实施方案中,所述sars-cov-2蛋白呈递在所述脂质囊泡的所述内表面上。在一些实施方案中,所述sars-cov-2蛋白包括s1或s2刺突蛋白。在一些实施方案中,所述sevlp配制为用于注射的糖玻璃。
19.在某些实施方案中,本文公开了smvlp,其包含:包括脂质双层的合成纳米盘,所述
脂质双层包括内表面和外表面;嵌入在所述脂质双层中的锚定分子;以及与所述锚定分子结合的sars-cov-2蛋白。在一些实施方案中,所述纳米盘具有5-200nm直径。在一些实施方案中,所述纳米盘包含两亲性环形聚甲基丙烯酸酯(pma)共聚物、苯乙烯-马来酸脂质颗粒(smalp)、dibma共聚物或apoa的α螺旋的非免疫原性模拟肽。在一些实施方案中,所述sars-cov-2蛋白包括s1或s2刺突蛋白。在一些实施方案中,将所述smvlp配制为用于注射的糖玻璃。
附图说明
20.通过参考以下对说明性实施方案阐述的详细描述和附图,将会获得对本发明主题的特征和优点的更好的理解,在附图中:
21.图1是抗原的一些实例的图;
22.图2是说明用于制备抗原的方法的实例的流程图;
23.图3是说明与根据一些实施方案的抗原纯化相关的数据的图;
24.图4是示出了根据一些实施方案的洗脱抗原的蛋白质印迹图像;
25.图5说明一些脂质体的大小和体积的表和图;
26.图6包括示出与根据一些实施方案的脂质体制备相关的数据的图;
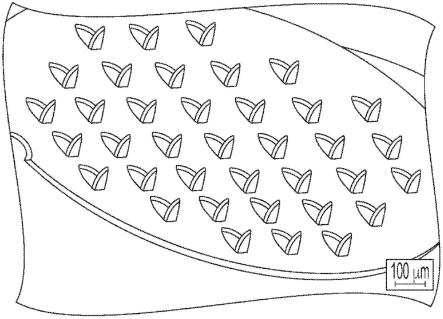
27.图7是一些微针的放大图像;
28.图8是说明根据一些实施方案的elisa数据的图;
29.图9包括微针装置的实例的图像;
30.图10是vaxipatch的实例的示意图;
31.图11是说明包括如本文所述的疫苗的试剂盒的实例的前面和后面的图像;
32.图12是示出在用于制备微针装置的示例性方法中将印刷阵列插入至弯曲夹具中的图像;
33.图13是示出在用于制备微针装置的示例性方法中附接至支撑材料的金属扣施加器的图像;
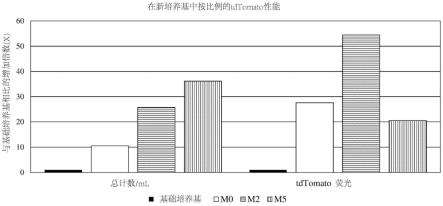
34.图14示出了用于解决定点照护型疫苗接种问题的示例性三方面方法;
35.图15a和15b示出微针阵列的示例性片材;
36.图16示出了疫苗加载的微阵列的实例;
37.图17示出了在人受试者中在五分钟内vaxipatch染料递送的实例;
38.图18示出了在大鼠中vaxipatch染料递送的实例;
39.图19示出了随着igg时程的vaxipatch大鼠elisa滴度;
40.图20示出了针对b/科罗拉多2017的vaxipatch elisa滴度;
41.图21示出了针对b/科罗拉多2017点图的血凝抑制滴度;
42.图22示出了hai数据的条形图表示;
43.图23示出了抗原研究的vaxipatch vmlp加速稳定性;
44.图24显示cogs低于行业平均值;
45.图25示出了关于有包膜糖蛋白亚单位疫苗的示例性图;
46.图26示出了疫苗流水线介绍;
47.图27示出了expicho中的示例性covid-s表达;
48.图28示出了示例性covid刺突蛋白质印迹,其确认重组covid-s蛋白的身份;
49.图29示出了全长刺突纯化,其具有covid-s的imac纯化的洗脱曲线;
50.图30示出了covid-19刺突慢病毒假型构建;
51.图31描绘了示例性考马斯染色sds-page凝胶,其示出来自纯化的样品;
52.图32描绘了ace-2样品中活性水平的实例;
53.图33描绘了对该实验的数据的示例性线性回归。
54.图34描绘了来自vrs01在四种不同浓度上结合250ng ace-2的能力测试的示例性标准曲线;
55.图35a描绘了来自在不同温度下测试vrs01的稳定性的示例性实验的结果;
56.图35b描绘了基于转换吸光度值确定的剩余的有效vrs01的量;
57.图36描绘了“印迹混合物”vmlp的示例性线性回归;
58.图37描绘了在显示的不同ph水平下的ace-2结合的图;
59.图38描绘了关于平均吸光度的图的条形图;
60.图39示出了vrs01构建体的汇总图;并且
61.图40示出了在sd大鼠中对vrs01的特异性igg应答。
具体实施方式
62.在某些实施方案中,本文公开了sevlp,其包含:(a)包括脂质双层的合成脂质囊泡,所述脂质双层包括内表面和外表面;(b)嵌入在所述脂质双层中的锚定分子;以及(c)与所述锚定分子结合的抗原。在某些实施方案中,本文还公开了smvlp,其包含:包括合成、半合成或天然脂质双层的纳米盘,所述脂质双层包括内表面和外表面;嵌入在所述脂质双层中的锚定分子;以及与所述锚定分子结合的抗原。在某些实施方案中,本文公开了包含sevlp或smvlp的疫苗及其使用和制造方法。
63.本文所述的一些疫苗的益处在于其是成本有效的并且比传统疫苗或市场上的疫苗相比更安全。市场上的一些预防性病毒疫苗是基于灭活或活的减毒病毒。福尔马林杀死或灭活的脊髓灰质炎(sanofi)和流感(flu)(seqiris;sanofi)疫苗是灭活病毒疫苗的实例,而活的减毒麻疹、腮腺炎和风疹(merck)疫苗是活的减毒病毒疫苗的实例。
64.i.概述
65.已经开发了本文所述的vlp以填补提供比传统疫苗更成本有效、更安全或更快的疫苗的需要。vlp是类似于其亲本病毒的非感染性颗粒。在一些实施方案中,vlp具有其亲本病毒的抗原或具有类似于其亲本病毒的抗原。在一些实施方案中,vlp的抗原蛋白在细菌、酵母、昆虫、植物或哺乳动物表达系统中通过重组dna方法产生。除了安全之外,一些vlp的另一个益处在于它们以结构阵列呈递抗原蛋白,所述抗原蛋白比其他疫苗更容易被病原体相关分子模式识别受体(pamp)、诸如tlr识别。这样,在一些实施方案中,vlp变为抗原蛋白的佐剂。因此,在一些实施方案中,vlp比构成它们的单独可溶性蛋白更具免疫原性。
66.一些无包膜vlp疫苗包括在酵母和hpv中产生的针对乙型肝炎的疫苗(gsk);分别在酵母和昆虫的中产生的9(merck)、(gsk),并且这些疫苗具有单一蛋白,即自发形成空二十面体衣壳壳体的乙型肝炎病毒的hbsag和hpv的l1。一些另外
的无包膜vlp疫苗包括在大肠杆菌中产生的戊型肝炎病毒(hev)(xiamen innovax biotech co.,中国)、在昆虫细胞中产生的malaria(gsk)和两种第二代乙型肝炎疫苗(vbi vaccines,inc.和dynavax)。
67.一些vlp是有包膜的(evlp)。evlp比无包膜vlp更复杂,因为它们含有来源于产生其的表达系统的脂质以及来自亲本病毒的一种或多种免疫原性蛋白。这些evlp使其脂质膜从其宿主细胞出芽。例如,此类evlp已经用于hiv、流感、基孔肯雅(chickungunya)、sars、尼帕、埃博拉、登革热、裂谷热和拉沙病毒。这些evlp在酵母、昆虫细胞、哺乳动物细胞和植物中产生。但这些evlp疫苗中没有一种达到商业生产。
68.问题禁止了evlp和其他疫苗的商业用途。例如,商业evlp疫苗是(一种流感疫苗)。为了产生inflexal,在鸡蛋中生长流感病毒。用洗涤剂八甘醇单(正十二烷基)醚溶解含有血凝素(ha)和神经氨酸酶(na)糖蛋白的病毒体,通过离心除去核衣壳,并且将所得的粗制未定义上清液混合物补充有10%另外的外部磷脂。通过混合和除去洗涤剂来产生这些evlp。inflexal在1997年在欧洲市场推出。商品的成本是inflexal的问题。在2012年,两个污染批次的inflexal从瑞士发货至意大利,因此结束了inflexal的生产。这些evlp含有蛋来源的蛋白质和脂质污染物、未定义比率的流感ha和na以及未知量的流感m2。产生evlp的混合过程和洗涤剂除去不好定义,导致结束生产的污染。
69.因此,现有的evlp具有限制其成功的问题。由于脂质膜,一些evlp与单一蛋白衣壳vlp相比不太稳定。一些evlp在表达系统中以较低的产量产生,因为它们通过从生产者细胞出芽而形成。一些evlp被宿主细胞蛋白污染,所述宿主细胞蛋白在从表达系统的细胞出芽的过程中包封在evlp中。在昆虫细胞系统中产生的一些evlp被近相同大小和形态的杆状病毒颗粒污染。一些evlp难以纯化,从而常常需要通过蔗糖梯度的超速离心。本文所述的疫苗的一些实施方案解决了这些问题中的一种或多种,并且为本领域中对安全、不含污染物和有效的改进疫苗的长期需要提供了解决方案。
70.先前疫苗没有包括清除掉来源于蛋的其他蛋白质或脂质的完全合成囊泡。制备合成有包膜vlp或疫苗解决了由细胞产生的当前vlp疫苗的未定义性质的问题。在一些实施方案中,本文提供的疫苗是快速开发或产生的,而例如先前流感疫苗花费过长开发时间或过于昂贵而不能在特定的流感季节期间完全有效。
71.甲型流感每年造成全球多达50万人死亡。尽管若干种亚型在通常在人中传播,但在一些实施方案中,新的亚型通过人畜共患感染而随时引入。在一些实施方案中,人畜共患感染包括h5n1或h7n9。即使每年更新季节性疫苗,但这些人畜共患传递是不可预测的,并且在疫苗中没有考虑。目前可用的疫苗是不充分的,因为(1)灭活疫苗不产生稳健的粘膜免疫应答,并且(2)活的减毒流感疫苗(laiv)是有问题的,因为它们过度减毒,具有限制性使用指导,并且由于与野生型病毒重配的风险,不能使用在季节性株系中不存在的具有ha和na亚型的laiv。目前可用的疫苗被设计为针对特定株系保护性的并且每年重新配制,并且不提供通用保护。针对禽流感病毒的特定大流行前疫苗(灭活的和laiv两者),病毒并不是非常有免疫原性的。旨在遏制人畜共患流感感染变为大流行病的通用疫苗可以补充目前的季节性疫苗,并且将有益于公共卫生。在一些实施例中,通用疫苗针对所有禽亚型,针对16种禽ha亚型(h1至h16)提供保护,或者在大流行病的情况下被快速制造。
72.在一些实施方案中,vlp包含各自含有单一甲型流感ha亚型(或单一na亚型)的流
感sevlp的多价混合物以避免ha相比于na的免疫显性的问题。在一些实施方案中,vlp是含有甲型流感na蛋白的sevlp或smvlp。在一些实施方案中,vlp包含两种或更多种不同的抗原,例如甲型流感na蛋白和甲型流感基质蛋白,诸如m1、m2或两者。这些多价vlp是非感染性、安全且易于制造和使用的。在一些实施方案中,使用这些多价vlp来提供广泛保护性“通用”大流行前疫苗和更广泛的反应性季节性疫苗。
73.在一些实施方案中,将疫苗鼻内、肌肉内、皮内、系统性或静脉内递送以引发对流感病毒ha头部和茎部上的保守表位以及对na表位的广泛反应性免疫并且因此针对宽范围的甲型流感病毒提供保护。在一些实施方案中,尽管ha是抗原多样的,但ha受体结合和茎部结构域中的保守表位允许产生交叉反应性疫苗。
74.在一些实施方案中,通过以下方式开发针对sars-cov-2的亚单位疫苗:将重组sars-cov-2刺突蛋白在哺乳动物细胞系中表达、纯化蛋白质并且将其配制为待与双重佐剂系统组合使用的膜结合颗粒(vmlp)。在一些实施方案中,开发亚单位疫苗的方面包括确定疫苗中使用的抗原的效力。为此,sars-cov-2的天然细胞受体靶标即血管紧张素转化酶2(ace-2)可以用于夹心酶联免疫吸附测定(elisa)中。可以通过该测定定量sars-cov-2-s结合ace-2的能力并且将其用作sars-cov-2-s效力的指标。在一些实施方案中,在不同储存条件下或不同配制品中随时间测量sars-cov-2-s的稳定性。
75.在一些实施方案中,夹心elisa的变型也可以用作亚单位疫苗是否已引发有效免疫应答的量度。本文中示出了抗体中和sars-cov-2-s与ace-2的结合的能力以与保护性免疫应答相关联。因此,本文所述的测定可用于筛选人们以知道他们是否具有sars-cov-2中和抗体(nab)。此外,可以测量nab的量并且将其与保护人们免受covid-19所需的nab水平相关联。目前,使用活sars-cov-2病毒(bsl3所需的和高变异系数(cv))或使用假型化病毒、诸如表达报道基因和sars-cov-2刺突糖蛋白的vsv(bsl2所需的和高cv)来生物测量nab。本文所述的改善将nab测试变成具有低cv的简单bls1定量免疫测定。预期了呈各种形式的商业免疫测定。
76.在一些实施方案中,为了开发夹心elisa,使用哺乳动物表达载体来产生对应于蛋白质(seq id no:18)的前740个氨基酸(seq id no:17)的ace-2胞外结构域。在一些实施方案中,使用离子交换色谱法纯化ace-2并且对其进行测试以使用荧光底物测定确定它是否保留其酶活性。在一些实施方案中,将高结合elisa板用ace-2包被过夜,用牛血清白蛋白封闭并且然后与不同浓度的sars-cov-2-s一起孵育以确定测定的线性范围。在一些实施方案中,将“内部(in-house)”sars-cov-2-s(vrs01)与可商购获得的sars-cov-2-s进行比较。在一些实施方案中,为了确保与ace-2的结合对于sars-cov-2-s具有特异性,将该结合与“内部”血凝素进行比较。在一些实施方案中,测试热应激、ph应激和针对sars-cov-2-s的s1结构域产生的可商购获得的多克隆抗体影响sars-cov-2-s/ace-2结合的能力。
77.在一些实施方案中,可以将用纯化的重组ace-2用于夹心elisa的捕获步骤,所述夹心elisa用于测试重组sars-cov-2-s作为疫苗抗原的效力。这些分子之间的结合相互作用在已经用ph或热激发sars-cov-2-s时被破坏,这表明该测定对于sars-cov-2-s的质量和构象的变化是敏感的。与ace-2的结合相互作用在大范围的sars-cov-2-s浓度上存在线性关系,并且当将重组sars-cov-2-s掺入膜结合颗粒中时,ace-2结合关系保持线性并且不受疫苗配制品的其他组分抑制。与ace-2的结合对于sars-cov-2-s具有特异性,因为当以相同
浓度测定时,来自流感的b/科罗拉多17株系的血凝素不结合ace-2。最终,针对sars-cov-2-s的s1亚单位产生的可商购获得的多克隆抗体可以抑制与ace-2的结合。因此,基于ace-2结合的夹心elisa在确定sars-cov-2-s效力和/或稳定性方面是强力工具,并且在确定来自疫苗接种个体的血清是否具有中和抗体方面具有效用。实施例12-16中包括一些此类实施方案的非限制性实例。
78.ii.定义
79.除非另外定义,否则本文使用的所有技术术语、符号和其他技术术语和科学术语或用词旨在具有与所要求保护的主题所属领域的普通技术人员通常所理解的相同意义。在一些情况下,为了清楚和/或为了便于参考而在本文中定义具有通常理解的含义的术语,并且本文中包含的此类定义不应被解释为表示与本领域通常理解的差异。
80.如本文所用,将疫苗“施用”至受试者包括将疫苗给予、应用至受试者或者使疫苗与受试者接触。在一些实施方案中,施用通过多种途径中的任一种实现。在一些实施方案中,施用通过局部、口服、皮下、肌肉内、腹腔内、静脉内、鞘内或皮内途径实现。
81.如本文所用,“抗体”在一些实施方案中是由具有特定氨基酸序列的b淋巴样细胞产生的免疫球蛋白分子。在一些实施方案中,本文所述的抗体包括抗体片段或由其组成。在一些实施方案中,抗体结合片段包括以下或由以下组成:fab、fab'、f(ab)'2、单链fv(scfv)、fv片段或fc序列。在一些实施方案中,抗体包括人igg。在一些实施方案中,抗体通过特异性抗原(免疫原,诸如ha和na)在人或其他动物中诱发。在一些实施方案中,抗体的特征在于以一些可论证方式与抗原特异性反应,抗体和抗原各自利用另一者来定义。在一些实施方案中,“引发抗体应答”是指抗原或其他分子诱导抗体的产生的能力。
82.在一些实施方案中,“抗原”或“免疫原”是指刺激动物中抗体或t细胞应答的产生的化合物、组合物或物质,包括注射至或吸收至动物中的组合物。在一些实施方案中,抗原与特定体液或细胞免疫的产物(包括由异源免疫原诱导的那些)反应。在所公开的组合物和方法的一些实施方案中,抗原是流感ha蛋白、流感na蛋白或两者。如本文所用,在一些实施方案中,“免疫原性组合物”是包含抗原(诸如具有不同流感ha蛋白的多种sevlp)的疫苗。
83.在一些实施方案中,“免疫应答”是指免疫系统的细胞(诸如b细胞、t细胞、巨噬细胞或多形核细胞)对刺激物、诸如抗原或疫苗(诸如甲型流感或乙型流感ha和/或na蛋白)的应答。在一些实施方案中,免疫应答包括参与宿主防御应答的身体的任何细胞,例如包括分泌干扰素或细胞因子的上皮细胞。免疫应答包括但不限于先天性免疫应答或炎症。如本文所用,保护性免疫应答是指保护受试者免受感染(预防感染或预防与感染相关的疾病的发生)的免疫应答。测量免疫应答的方法在本领域中是熟知的,并且包括例如测量淋巴细胞(诸如b或t细胞)的增殖和/或活性、细胞因子或趋化因子的分泌、炎症、抗体产生等。
84.在一些实施方案中,“分离的”生物组分(诸如核酸、蛋白质、vlp或病毒)已经基本上从其他生物组分(诸如细胞碎片或其他蛋白质或核酸)中分离或纯化。在一些实施方案中,已经“分离”的生物组分包括通过标准纯化方法纯化的那些组分。在一些实施方案中,所述术语还涵盖重组核酸、蛋白质、病毒和vlp,以及化学合成的核酸或肽。
85.在一些实施方案中,术语“纯化的”不需要绝对的纯净;更确切些,它旨在为相对性术语。在一些实施方案中,纯化的蛋白、病毒、vlp或其他化合物是全部或部分地与天然相关联的蛋白和其他污染物分离。在一些实施方案中,术语“基本上纯化的”是指已经从细胞、细
胞培养基或其他粗制剂中分离并且进行分级分离以除去初始制品中的多种组分(诸如蛋白、细胞碎片和其他组分)的蛋白、病毒、vlp或其他活性化合物。在一些实施方案中,分离的或纯化的生物组分、蛋白、病毒、vlp或其他化合物具有或包含1%、0.75%、0.5%、0.25%、0.1%、0.05%、0.01%、0.005%、0.001%、0.0005%、0.0001%、0.00005%、0.00001%、0.000005%或0.000001%或由前述百分比中的任两者定义的百分比范围的污染物。在一些实施方案中,分离的或纯化的生物组分、蛋白、病毒、vlp或其他化合物具有或包含少于1%、0.75%、0.5%、0.25%、0.1%、0.05%、0.01%、0.005%、0.001%、0.0005%、0.0001%、0.00005%、0.00001%、0.000005%或0.000001%的污染物。
86.在一些实施方案中,“脂质”包括天然存在的半合成和全合成脂质。用于产生vlp的脂质的一些实例包括dopc、dope、dspe(1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺)和dspe-peg(1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n-[氨基(聚乙二醇)-2000](铵盐))、胆固醇及其衍生物。一些实施方案包括混合物,诸如包含以10:4.25:3:1:3的比率混合的磷脂酰胆碱(50mg/ml)、胆固醇(20mg/ml)、磷脂酰乙醇胺(10mg/ml)、磷脂酰丝氨酸(10mg/ml)、鞘磷脂(20mg/ml)和磷脂酰肌醇(2.5mg/ml)。
[0087]
在一些实施方案中,当第一核酸序列被放置成与第二核酸序列有功能关系时,所述第一核酸序列与所述第二核酸序列“可操作地连接”。在一些实施方案中,如果启动子影响编码序列的转录或表达,则所述启动子与所述编码序列可操作地连接。在一些实施方案中,可操作地连接的dna序列是连续的,并且在需要接合两个蛋白质编码区域的情况下处于相同阅读框中。
[0088]
氨基酸或核酸序列之间的相似性在一些情况下以序列之间的相似性表示,或者被称为“序列同一性”。在一些实施方案中,序列同一性以同一性百分(或相似性或同源性)测量;例如百分比越高,两个序列越相似。在一些实施方案中,当使用标准方法比对时,给定基因或蛋白质的同源物或变体具有相对高度的序列同一性。
[0089]
在一些实施方案中,“治疗有效量”是指足以在用该药剂治疗的受试者中实现所需效果的指定药剂的量。在一些实施方案中,这是可用于在受试者中引发免疫应答和/或用于预防由流感病毒引起的感染或疾病的疫苗或vlp的量。在一些实施方案中,疫苗的治疗有效量是足以在受试者中增加对由流感病毒(诸如甲型流感、乙型流感或两者)引起的感染的抗性,预防、改善和/或治疗所述感染而不在受试者中引起显著细胞毒性作用的量。在一些实施方案中,可用于在受试者中增加对感染的抗性,预防、改善和/或治疗所述感染的疫苗的有效量将依赖于例如被治疗的受试者、治疗性组合物的施用方式和其他因素、诸如佐剂。
[0090]
在一些实施方案中,“疫苗”是指或包括能够刺激免疫应答的免疫原性物质的制剂,所述制剂用于预防、改善或治疗疾病、诸如感染性疾病。在一些实施方案中,免疫原性物质是本文所公开的vlp。在一些实施方案中,疫苗引发预防性(prophylactic)(预防性(preventative))应答和治疗性应答两者。在一些实施方案中,施用方法根据疫苗变化,或者包括接种、摄取、鼻内、皮内或其他形式的施用。在一些实施方案中,将疫苗与佐剂一起施用以增强免疫应答。
[0091]
在一些实施方案中,vlp是指或包括类似于病毒的有包膜结构,其由一种或多种病毒结构蛋白组成,但缺乏病毒基因组。在一些实施方案中,vlp缺乏病毒基因组并且是非感染性的。在一些实施方案中,将vlp分为无包膜的和evlp。在一些实施方案中,有包膜vlp包
括脂质膜。在一些实施方案中,vlp呈递正确折叠的功能性抗原。在一些实施方案中,vlp呈递结合上皮细胞或红细胞上的受体的ha。在一些实施方案中,vlp呈递na并且具有裂解唾液酸的酶活性。在一些实施方案中,vlp包括合成有包膜vlp(sevlp)。在一些实施方案中,sevlp呈递或包含ha或na蛋白,并且包括驱动颗粒从宿主细胞的出芽和释放的病毒核心蛋白(诸如流感m1、m2或两者)。在一些实施方案中,vlp包括smvlp。在一些实施方案中,smvlp包含纳米盘。在一些实施方案中,纳米盘包括合成、半合成或天然脂质双层,所述脂质双层包括第一侧面和第二侧面;嵌入在脂质双层中的锚定分子;以及与锚定分子结合的抗原。
[0092]
贯穿本技术,各种实施方案能以范围形式呈现。应当理解,范围形式的描述仅仅是为了方便以及简洁,不应该被理解为对本公开范围的不灵活的限制。因此,范围的描述应当被视为具有确切公开的所有可能的子范围以及该范围内的单独数值。例如,诸如从1至6的范围的描述应当被视为具有确切公开的子范围,诸如从1至3、从1至4、从1至5、从2至4、从2至6、从3至6等,以及该范围内的单独数字,例如1、2、3、4、5和6。无论范围的广度如何,这都适用。
[0093]
除非上下文另有明确指示,如说明书和权利要求中所用,单数形式“一个/种(a/an)”以及“所述(the)”包括复数指示物。在一些实施方案中,术语“一个/种样品”包括多个/种样品,包括其混合物。
[0094]
在一些实施方案中,“受试者”是含有表达的遗传物质的生物实体。在一些实施方案中,受试者是哺乳动物。在一些实施方案中,哺乳动物是人。
[0095]
如本文所用,术语“约”数字是指该数字加上或减去该数字的10%。术语“约”范围是指该范围减去其最低值的10%且加上其最大值的10%的范围。
[0096]
如本文所用,在一些实施方案中,术语“治疗(treatment/treating)”用于指用于在受者中获得有益或所需结果的药物方案。有益或所需结果包括但不限于治疗性益处和/或预防益处。在一些实施方案中,治疗性益处是指根除或改善被治疗的基本障碍或其症状。在一些实施方案中,治疗益处是通过根除或改善与基本障碍相关的一种或多种生理症状以使得在受试者中观察到改善而实现,尽管受试者仍可能被基本障碍困扰。在一些实施方案中,预防性效果包括延缓、防止或消除疾病或病症的出现,延缓或消除疾病或病症的症状发作,减缓、终止或逆转疾病或病症的进展,或其任何组合。在一些实施方案中,对于预防性益处,对有发生特定疾病风险的受试者或对报告疾病的一种或多种生理症状的受试者(即使可能还未作出疾病的诊断)进行治疗。在一些实施方案中,治疗性益处包括针对疾病的免疫。
[0097]
本文使用的章节标题只是出于组织的目的,而不应解释为限制所描述的主题。
[0098]
iii.sevlp和smvlp
[0099]
在某些实施方案中,本文公开了合成有包膜vlp(sevlp),其包含以下或由以下组成:(a)包括脂质双层的合成脂质囊泡,所述脂质双层包括内表面和外表面;(b)嵌入在脂质双层中的锚定分子;以及(c)与锚定分子结合的抗原。在某些实施方案中,本文还公开了smvlp,其包含包括合成、半合成或天然脂质双层的纳米盘,所述脂质双层包括第一侧面和第二侧面;嵌入在所述脂质双层中的锚定分子;以及与所述锚定分子结合的抗原。在一些实施方案中,vlp在室温下是稳定的。在一些实施方案中,脂质双层是合成的。在一些实施方案中,脂质双层是半合成的。在一些实施方案中,脂质双层是天然或非合成的。在一些实施方
案中,脂质双层包含合成脂质。在一些实施方案中,脂质双层是半合成的,并且包括天然或非合成脂质以及合成脂质。在一些实施方案中,脂质双层包含天然脂质。
[0100]
在一些实施方案中,使用纯化的重组蛋白制备抗原。在一些实施方案中,重组蛋白由培养细胞产生。在一些实施方案中,培养细胞包含编码抗原的核酸。
[0101]
在一些实施方案中,vlp(例如sevlp或smvlp)包含与所定义的脂质混合的所定义的纯化重组蛋白。在一些实施方案中,vlp包括化学定义的完全合成sevlp或由其组成。在一些实施方案中,sevlp含有嵌入在膜中的抗原蛋白。在一些实施方案中,sevlp含有包含如本文所述的锚定分子的抗原,所述锚定分子嵌入在膜中。在一些实施方案中,sevlp包含通过膜锚定结构域嵌入在膜中的抗原蛋白,同时将sevlp的表面用感兴趣抗原蛋白的亲水性结构域修饰。在一些实施方案中,疫苗配制品包含在单一sevlp中的抗原组合。在一些实施方案中,将不同的sevlp一起混合至单一疫苗中。
[0102]
在一些实施方案中,sevlp包含通过抗原的蛋白质亲脂性跨膜结构域锚定就位的抗原,而抗原的亲水性结构域显示在脂质膜的内表面和外表面两者上。在一些实施方案中,用于增强免疫应答和呈递抗原的膜的脂质是结构有序的阵列,也以此增强免疫应答。在一些实施方案中,抗原在sevlp或脂质体内保留其天然三维构象。
[0103]
在一些实施方案中,vlp包括smvlp或由其组成。在一些实施方案中,smvlp包括盘。在一些实施方案中,盘是纳米盘。在一些实施方案中,纳米盘包括膜。在一些实施方案中,纳米盘或膜包括合成、半合成或天然脂质双层。在一些实施方案中,脂质双层的脂质包含疏水性脂族侧链。在一些实施方案中,脂质双层的脂质包含亲水性头。在一些实施方案中,纳米盘包括第一侧面和第二侧面。在一些实施方案中,第一侧面和/或第二侧面中的每一者是平坦的。在一些实施方案中,第一侧面和/或第二侧面中的每一者包含嵌入在脂质双层中的抗原。在一些实施方案中,纳米盘包括边缘。在一些实施方案中,边缘是圆形的。在一些实施方案中,边缘包括周边。在一些实施方案中,纳米盘是环形的、盘状的或钱币形的。
[0104]
在一些实施方案中,纳米盘由以下制成或包含以下:聚甲基丙烯酸酯(pma)共聚物。在一些实施方案中,pma共聚物是两亲性的。在一些实施方案中,pma共聚物是环形的。在一些实施方案中,pma共聚物围绕纳米盘的周边或边缘缠绕。在一些实施方案中,pma共聚物围绕纳米盘的周边或边缘形成环形形状。在一些实施方案中,纳米盘由以下制成或包含以下:苯乙烯-马来酸脂质颗粒(smalp)。在一些实施方案中,所述smalp是环形的。在一些实施方案中,所述smalp是两亲性的。在一些实施方案中,smalp围绕纳米盘的周边或边缘缠绕。在一些实施方案中,smalp围绕纳米盘的周边或边缘形成环形形状。在一些实施方案中,smalp包括smalp 25010p、smalp 30010p和/或smalp 40005p(例如来自polyscience,赫仑,荷兰)。在一些实施方案中,纳米盘包含pma共聚物和smalp。在一些实施方案中,纳米盘不包含smalp。在一些实施方案中,纳米盘不包含pma共聚物。在一些实施方案中,纳米盘不包含膜支架蛋白(msps)或两亲性msps。在一些实施方案中,纳米盘不包含载脂蛋白a-1(apoa)。在一些实施方案中,纳米盘包含来源于apoa的重复α螺旋结构域的非免疫原性22个氨基酸模拟肽。在一些实施方案中,将纳米盘配制用于人用途。在一些实施方案中,pma共聚物提供了制备适于人用途的纳米盘的益处。在一些实施方案中,pma是无毒的。在一些实施方案中,smalp提供了制备适于人用途的纳米盘的益处。在一些实施方案中,smalp是无毒的。在一些实施方案中,纳米盘包含聚甲基丙烯酸酯共聚物(例如n-c4-52-6.9)。在一些实施方案中,
sma在低ph下或在二价金属离子的存在下是不稳定的。
[0105]
在一些实施方案中,纳米盘包含dibma。在一些实施方案中,纳米盘包含dibmaa共聚物。在一些实施方案中,所述dibma共聚物是环形的。在一些实施方案中,纳米盘包含两亲性的环形dibma共聚物。在一些实施方案中,smvlp是无苯乙烯的,或者包含无苯乙烯聚合物。在一些实施方案中,smvlp包含dibma或聚甲基丙烯酸酯共聚物(pma)。在一些实施方案中,dibma或pma形成纳米盘并且影响脂质酰基链或相比于sma对二价金属离子具有改善稳定性。
[0106]
在一些实施方案中,纳米盘膜包含一种或多种膜结合抗原蛋白质。在一些实施方案中,所述纳米盘具有5、10、25、50、75、100、125、150、175、200、225、250、300、400或500nm直径或由前述直径中的任两者定义的直径范围。在一些实施方案中,所述纳米盘具有5-200nm直径。在一些实施方案中,所述纳米盘具有50-200nm直径。在一些实施方案中,所述纳米盘具有小于5、10、25、50、75、100、125、150、175、200、225、250、300、400或500nm的直径。在一些实施方案中,所述纳米盘具有大于5、10、25、50、75、100、125、150、175、200、225、250、300、400或500nm的直径。在一些实施方案中,所述纳米盘具有小于50nm的直径。在一些实施方案中,所述纳米盘具有大于50nm的直径。在一些实施方案中,所述纳米盘具有50-100nm直径。在一些实施方案中,所述纳米盘具有100-150nm直径。在一些实施方案中,所述纳米盘具有150-200nm直径。在一些实施方案中,所述纳米盘具有75-125nm直径。在一些实施方案中,直径是vlp的脂质双层的直径。在一些实施方案中,直径是vlp的外部边缘上环形蛋白的直径。
[0107]
在一些实施方案中,纳米盘包括大于50nm的直径,其中抗原(例如流感ha抗原)嵌入在纳米盘的脂质膜中。在一些实施方案中,纳米盘不包括包膜或脂质包膜。在一些实施方案中,纳米盘包含单一抗原或锚定分子。在一些实施方案中,smvlp包括大的纳米盘。在一些实施方案中,纳米盘包含多种抗原和/或锚定分子。在一些实施方案中,纳米盘或大的纳米盘嵌入抗原阵列。在一些实施方案中,纳米盘是包含多种smvlp或多价smvlp的疫苗的组分。在一些实施方案中,脂质双层的第一侧面包含第一锚定分子和/或第一抗原,并且脂质双层的第二侧面包含第二锚定分子和/或第二抗原。
[0108]
在一些实施方案中,纳米盘包含嵌入在脂质双层中的锚定分子和与锚定分子结合的抗原。在一些实施方案中,抗原直接嵌入在脂质双层中。
[0109]
a.脂质囊泡
[0110]
在一些实施方案中,脂质囊泡包含第一脂质、诸如磷脂酰胆碱类。在一些实施方案中,脂质囊泡包含第二脂质、诸如磷脂酰乙醇胺类。在一些实施方案中,脂质囊泡以预定比率包含第一脂质和第二脂质。在一些实施方案中,预定比率在1:0.25与1:4之间。在一些实施方案中,脂质囊泡以在1:0.25与1:4之间的预定比率包含所述第一脂质和所述第二脂质。在一些实施方案中,脂质囊泡是如本文所述的sevlp的一部分。一些实施方案包括vlp,其具有如本文所述的第一脂质、第二脂质和/或第三脂质。在一些实施方案中,smvlp的一种或多种脂质不形成脂质囊泡。在一些实施方案中,smvlp不包含脂质囊泡。
[0111]
在一些实施方案中,第一脂质和/或第二脂质各自包含酰基链,所述酰基链包含1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或更多个碳原子或由前述数目中的任两者定义的碳原子范围。在一些实施方案中,所述第一脂质和/或所述第二脂质各自包含含有在4与18个之间的碳原子的酰基链。在一些实施方案中,所述第一脂质和/或所述第
二脂质各自包含四个或更少的不饱和键。在一些实施方案中,第一脂质包含1、2、3、4、5、6、7、8、9、10个或更少不饱和键或由前述数目中的任两个定义的不饱和键范围。在一些实施方案中,第二脂质包含1、2、3、4、5、6、7、8、9、10个或更少不饱和键或由前述数目中的任两个定义的不饱和键范围。
[0112]
在一些实施方案中,脂质囊泡的第一脂质和/或第二脂质包括纯化脂质或由其组成。在一些实施方案中,纯化脂质具有至少75.0%、80.0%、85.0%、90.0%、91.0%、92.0%、93.0%、94.0%、95.0%、96.0%、97.0%、97.5%、98.0%、98.5%、99.0%、99.5%、99.9%、100%或由前述百分比中的任两者定义的百分比范围的纯度。在一些实施方案中,纯化脂质具有至少99%的纯度。
[0113]
在一些实施方案中,所述第一脂质包括1,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)。在一些实施方案中,所述第二脂质包括1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)。在一些实施方案中,疫苗包含一种或多种脂质、诸如dopc或dope。在一些实施方案中,疫苗包含胆固醇。在一些实施方案中,疫苗包含dspe-peg2000(1,2-二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n[氨基(聚乙二醇)-2000](铵盐)或相关脂质。
[0114]
在一些实施方案中,脂质囊泡包含固醇或固醇衍生物。在一些实施方案中,所述固醇或固醇衍生物包括胆固醇或dc-胆固醇。在一些实施方案中,脂质囊泡以相对于第一脂质和/或第二脂质为0、5、10、15、20、25、30、35、40、45或50mol%的比率或由前述摩尔百分比中的任两者定义的范围包含固醇或固醇衍生物。在一些实施方案中,脂质囊泡以相对于第一脂质和/或第二脂质为0-30mol%的比率包含固醇或固醇衍生物。
[0115]
在一些实施方案中,脂质囊泡、脂质囊泡的第一脂质和/或脂质囊泡的第二脂质是合成的。在一些实施方案中,脂质囊泡、脂质囊泡的第一脂质和/或脂质囊泡的第二脂质是天然脂质。在一些实施方案中,脂质囊泡、脂质囊泡的第一脂质和/或脂质囊泡的第二脂质包括天然和合成脂质。在一些实施方案中,脂质囊泡、脂质囊泡的第一脂质和/或脂质囊泡的第二脂质不含或基本上不含生物材料。
[0116]
b.抗原
[0117]
在一些实施方案中,脂质囊泡包括向外表面,并且其中抗原呈递在脂质囊泡的向外表面上。在一些实施方案中,脂质囊泡包括向内表面,并且其中抗原呈递在脂质囊泡的向内表面上。
[0118]
在一些实施方案中,抗原在细菌、酵母、植物、昆虫细胞或哺乳动物细胞中产生。在一些实施方案中,抗原是纯化抗原、由纯化抗原组成或包括纯化抗原。在一些实施方案中,纯化抗原具有至少75.0%、80.0%、85.0%、90.0%、91.0%、92.0%、93.0%、94.0%、95.0%、96.0%、97.0%、97.5%、98.0%、98.5%、99.0%、99.5%、99.9%、100%或由前述百分比中的任两者定义的百分比范围的纯度。在一些实施方案中,纯化抗原具有至少99%的纯度。在一些实施方案中,抗原在与一种或多种脂质混合之前纯化。
[0119]
在一些实施方案中,抗原与如本文所述的膜锚定物直接结合。在一些实施方案中,抗原包含膜锚定物。
[0120]
在一些实施方案中,抗原包含标签、诸如六组氨酸标签或flag标签。
[0121]
在一些实施方案中,vlp(例如sevlp或smvlp)包含跨膜抗原诸如呼吸道合胞病毒、水痘、hiv、sars、埃博拉、尼帕、登革热、裂谷热、狂犬病、麻疹、腮腺炎、风疹、拉沙热和马尔
堡病毒。一些实施方案的合成性质将所定义的脂质与所定义的蛋白质组合,并且教导了在一些情况下扩展至感兴趣的任何抗原的技术。在一些实施方案中,vlp包含冠状病毒抗原,诸如本文所述的冠状病毒抗原。
[0122]
在一些实施方案中,抗原是病原体抗原。在一些实施方案中,抗原是病原体的蛋白质或组分。在一些实施方案中,病原体是病毒或寄生虫。在一些实施方案中,vlp靶向的病毒和寄生虫的类型的非限制性实例包括慢病毒、黄病毒、丝状病毒、冠状病毒、副粘病毒、hpv、疱疹病毒、丙型肝炎(hepc)病毒、疟原虫属寄生虫或锥体虫属寄生虫。
[0123]
在一些实施方案中,抗原是癌症相关肽或抗原或其片段。癌症相关抗原的实例包括但不限于肿瘤特异性免疫球蛋白可变区、gm2、tn、stn、tf、globo h、le(y)、muc1、muc2、muc3、muc4、muc5ac、muc5b、muc7、癌胚抗原、人绒毛膜促性腺素的β链(hcgβ)、c35、her2/neu、cd20、psma、egfrviii、ksa、psa、psca、gp100、mage 1、mage 2、trp 1、trp 2、酪氨酸酶、mart-1、pap、cea、bage、mage、rage和相关蛋白。
[0124]
在一些实施方案中,抗原是细菌肽或抗原或其片段。细菌抗原的实例包括但不限于放线菌属抗原、芽孢杆菌属抗原例如来自炭疽芽孢杆菌的免疫原性抗原、拟杆菌属抗原、博代氏杆菌属抗原、巴尔通氏体属抗原、包柔氏螺旋体属抗原例如博氏疏螺旋体ospa、布鲁氏菌属抗原、弯曲杆菌属抗原、二氧化碳嗜纤维菌属抗原、衣原体属抗原、梭菌属抗原、棒状杆菌属抗原、柯克斯氏体属抗原、嗜皮菌属抗原、肠球菌属抗原、埃立克体属抗原、埃希氏菌属抗原、弗朗西斯氏菌属抗原、梭杆菌属抗原、血巴通氏体属抗原、嗜血杆菌属抗原例如流感嗜血杆菌b型外膜蛋白、螺杆菌属抗原、克雷伯氏菌属抗原、l型细菌抗原、钩端螺旋体属抗原、李斯特氏菌属抗原、分枝杆菌抗原、支原体属抗原、奈瑟氏球菌属抗原、新立克次氏体属抗原、诺卡氏菌属抗原、巴斯德氏菌属抗原、消化球菌属抗原、消化链球菌属抗原、肺炎球菌抗原、变形杆菌属抗原、假单胞菌属抗原、立克次氏体属抗原、罗沙利马体属抗原、沙门氏菌属抗原、志贺氏菌属抗原、葡萄球菌属抗原、链球菌属抗原例如酿脓链球菌m蛋白、密螺旋体属抗原和耶尔森氏菌属抗原例如鼠疫耶尔森氏菌属f1和v抗原。
[0125]
在一些实施方案中,抗原是真菌肽或抗原或其片段。寄生虫抗原的实例包括但不限于结肠小袋纤毛虫抗原、溶组织内阿米巴抗原、肝片形吸虫抗原、蓝氏贾第鞭毛虫抗原、利什曼原虫属抗原和疟原虫属抗原(例如,恶性疟原虫抗原)。
[0126]
在一些实施方案中,抗原是寄生虫肽或抗原或其片段。寄生虫的实例包括但不限于结肠小袋虫抗原、溶组织内阿米巴抗原、肝片形吸虫抗原、蓝氏贾第鞭毛虫抗原、利什曼原虫属抗原和疟原虫属抗原(例如,恶性疟原虫抗原)。
[0127]
在一些实施方案中,抗原是病毒肽或抗原或其片段。病毒抗原和免疫原性抗原的实例包括但不限于腺病毒抗原、甲病毒抗原、杯状病毒抗原(例如,杯状病毒衣壳抗原)、冠状病毒抗原、瘟病毒抗原、埃博拉病毒抗原、肠病毒抗原、黄病毒抗原、肝炎病毒(a-e)抗原(例如,乙型肝炎核心或表面抗原)、疱疹病毒抗原(例如,单纯疱疹病毒或水痘带状疱疹病毒糖蛋白)、免疫缺陷病毒抗原(例如,人免疫缺陷病毒包膜或蛋白酶)、感染性腹膜炎病毒抗原、流感病毒抗原(例如,甲型流感血凝素、神经氨酸酶或核蛋白)、白血病病毒抗原、马尔堡病毒抗原、正粘病毒抗原、乳头状瘤病毒抗原、副流感病毒抗原(例如,血凝素/神经氨酸酶)、副粘病毒抗原、细小病毒抗原、瘟病毒抗原、小核糖核酸病毒抗原(例如,脊髓灰质炎病毒衣壳多肽)、痘病毒抗原(例如,痘苗病毒多肽)、狂犬病病毒抗原(例如,狂犬病病毒糖蛋
白g)、呼肠孤病毒抗原、逆转录病毒抗原和轮状病毒抗原。
[0128]
在慢病毒的情况下,在一些实施方案中,抗原是hiv抗原或蛋白。在黄病毒的情况下,在一些实施方案中,抗原是登革热病毒、寨卡病毒或西尼罗病毒抗原或蛋白。在丝状病毒的情况下,在一些实施方案中,抗原是埃博拉病毒、马尔堡病毒或狂犬病病毒抗原或蛋白。在冠状病毒的情况下,在一些实施方案中,抗原是mers病毒或sars病毒抗原或蛋白。在副粘病毒的情况下,在一些实施方案中,抗原是呼吸道合胞病毒(rsv)或尼帕病毒抗原或蛋白。在疟原虫属寄生虫的情况下,在一些实施方案中,抗原是疟疾寄生虫抗原或蛋白。在锥体虫属寄生虫的情况下,在一些实施方案中,抗原是查加斯病(chagas)寄生虫、昏睡病寄生虫或利什曼病寄生虫抗原或蛋白。
[0129]
合适抗原的一些非限制性实例包括糖蛋白、诸如有包膜病毒的表面蛋白和糖蛋白(gp),诸如hiv的gag和/或env;流感的ha和/或na和/或m2蛋白;基孔肯雅的c、e3、e2、6k和/或e1蛋白;sars的s、e、m和/或n蛋白;尼帕的m、g、f蛋白;埃博拉的v40、gp、np蛋白;登革热的prm和e蛋白;裂谷热病毒的gn、gc或np蛋白,或拉沙病毒的gpc、np或z蛋白。
[0130]
在一些实施方案中,抗原包括杂化蛋白,其含有或包含膜锚定物,诸如与非膜蛋白融合的膜锚定物,诸如与流感ha的膜锚定结构域融合的hpv的l2蛋白。在一些实施方案中,抗原是或包括任何数量的肿瘤相关抗原诸如muc、hpv e6和/或e7、mage-a3或cea。
[0131]
在一些实施方案中,抗原包括任何有包膜病毒的糖蛋白。在一些实施方案中,抗原粘附至形成如本文所述的sevlp的含脂质结构的外表面。在一些实施方案中,抗原粘附smvlp的侧面。
[0132]
在一些实施方案中,抗原包括蛋白融合体。在一些实施方案中,抗原与膜锚定结构域融合。
[0133]
在一些实施方案中,抗原包括化学附接至含有膜锚定物的载体蛋白的碳水化合物抗原。在一些实施方案中,抗原不具有膜锚定物。
[0134]
在一些实施方案中,抗原包括融合蛋白。在融合蛋白的一些实施方案中,将抗原与表面蛋白或表面糖蛋白的跨膜结构域融合。例如,在一些实施方案中使用hpv。hpv感染是一些子宫颈癌症的前体。一些hpv vlp是基于外衣壳蛋白免疫显性蛋白l1,但基于l1的hpv vlp是株系特异性的。gardasil(merck)由组装为无包膜vlp的九种不同的l1蛋白构成。相比之下,在一些实施方案中,l2蛋白是免疫原性差的,但是hpv株系的常见抗原。在一些实施方案中,为了制备基于hpv的l2蛋白的vlp,将l2与流感ha的跨膜结构域融合。在一些实施方案中,此处就是抗原在n末端并且ha跨膜结构域在蛋白的c末端。在一些实施方案中,vlp将产生hpv的通常免疫原性差的l2蛋白的结构化和图案化阵列。在一些实施方案中,基于l2的hpv vlp将预期针对其他hpv株系保护。在一些实施方案中,使用hpv的e6和e7蛋白的融合抗原来产生治疗患有子宫颈癌的患者的hpv。
[0135]
1.流感抗原
[0136]
在一些实施方案中,抗原是流感病毒抗原或其变体或片段。流感病毒是包括在正粘病毒科(orthomyxoviridae)中的区段化负链rna病毒。存在三种类型的流感病毒:甲型、乙型和丙型。甲型流感病毒(iav):负义、单链、区段化rna病毒,其具有编码11种蛋白的八个rna区段(pb2、pb1、pa、np、m、ns、ha和na),所述11种蛋白包括:rna指导的rna聚合酶蛋白(pb2、pb1和pa)、核蛋白(np)、神经氨酸酶(na)、血凝素(亚基ha1和ha2)、基质蛋白(m1和m2)
和非结构蛋白(ns1和ns2)。该病毒易于通过错误蛋白聚合酶和通过区段重配迅速进化。甲型流感的宿主范围是相当多样的,并且包括人、禽类(例如,鸡和水禽类)、马、海洋哺乳动物、猪、蝙蝠、小鼠、雪貂、猫、虎、豹和狗。在动物中,大多数甲型流感病毒引起呼吸道和肠道的轻度局部感染。在一些实施方案中,高致病性甲型流感株系(诸如h5n1)导致家禽中的全身性感染,其中死亡率达到100%。在一些实施方案中,用甲型流感感染的动物充当流感病毒的储库,并且某些亚型跨过物种屏障至人。
[0137]
在一些实施方案中,抗原是甲型流感病毒抗原或其变体或片段。甲型流感病毒基于编码表面糖蛋白(即,血凝素(ha)和神经氨酸酶(na))的两个基因的抗原区域中的等位基因变异而被分为亚型,所述表面糖蛋白是病毒附着和细胞释放所需的。目前有18种不同的甲型流感病毒ha抗原亚型(h1至h18)和11种不同的甲型流感病毒na抗原亚型(n1至n11)。在一些实施方案中,1-h16和n1-n9在野生禽类宿主中发现,并且可能对人构成大流行威胁。h17-h18和n10-n11已经在蝙蝠宿主中描述,并且目前尚未被认为对人构成大流行威胁。
[0138]
甲型流感的具体实例包括但不限于:h1n1(诸如1918h1n1)、h1n2、h1n7、h2n2(诸如1957h2n2)、h2n1、h3n1、h3n2、h3n8、h4n8、h5n1、h5n2、h5n8、h5n9、h6n1、h6n2、h6n5、h7n1、h7n2、h7n3、h7n4、h7n7、h7n9、h8n4、h9n2、h10n1、h10n7、h10n8、h11n1、h11n6、h12n5、h13n6和h14n5。在一个实例中。甲型流感包括已知在人类中循环的那些,诸如h1n1、h1n2、h3n2、h7n9和h5n1。
[0139]
在动物中,一些甲型流感病毒引起哺乳动物中的呼吸道和/或禽类中的消化道的自限性局部感染。在一些实施方案中,高致病性甲型流感株系(诸如h5n1)导致家禽中的全身性感染,其中死亡率达到100%。在2009年,h1n1流感是人流感的最常见原因。在2009年出现了一种猪源的h1n1新病毒株系,并且被世界卫生组织宣布为大流行。该病毒株被称为“猪流感”。h1n1甲型流感病毒还造成1918年的西班牙流感大流行、1976年的迪克斯堡(fort dix)爆发和1977-1978年的俄罗斯流感大流行。
[0140]
在一些实施方案中,抗原包括乙型流感病毒抗原或其变体或片段。乙型流感病毒(ibv)是负义单链rna病毒,其具有八个rna区段。ibv的衣壳是包膜的,而其病毒体包括包膜、基质蛋白、核蛋白复合物、核衣壳和聚合酶复合物。表面突出部由神经氨酸酶(na)和血凝素组成。该病毒与甲型流感相比较不易于进化,但其突变足以使得无法实现持久的免疫力。乙型流感的宿主范围比甲型流感更窄,并且仅知其感染人和海豹。乙型流感病毒不分为亚型,但被进一步细分为谱系和株系。乙型流感的具体实例包括但不限于:b/山形、b/维多利亚州、b/上海/361/2002和b/香港/330/2001。
[0141]
在一些实施方案中,抗原是流感病毒抗原或蛋白或其片段。在一些实施方案中,流感蛋白是ha、na、m1、m2、ns1、ns2、pa、pb1或pb2流感蛋白或其片段。
[0142]
在一些实施方案中,所述流感蛋白包含与seq id no:1-14中任一个75.0%、80.0%、85.0%、90.0%、91.0%、92.0%、93.0%、94.0%、95.0%、96.0%、97.0%、97.5%、98.0%、98.5%、99.0%、99.5%、99.9%、100%或由前述百分比中的任两者定义的百分比范围相同的氨基酸序列或其片段。在一些实施方案中,所述流感蛋白包含与seq id no:15或16 75.0%、80.0%、85.0%、90.0%、91.0%、92.0%、93.0%、94.0%、95.0%、96.0%、97.0%、97.5%、98.0%、98.5%、99.0%、99.5%、99.9%、100%或由前述百分比中的任两者定义的百分比范围相同的氨基酸序列或其片段。在一些实施方案中,所述流感蛋白包含
与seq id no:1-14中任一个相比具有不超过1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列或其片段。在一些实施方案中,所述流感蛋白包含与seq id no:15或16相比具有不超过1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列或其片段。在一些实施方案中,抗原包含根据seq id no:15的氨基酸序列或其变体。在一些实施方案中,抗原包含根据seq id no:16的氨基酸序列或其变体。
[0143]
在一些实施方案中,所述流感蛋白由下述核酸编码,所述核酸具有与编码氨基酸seq id no:1-14中任一个的核酸序列75.0%、80.0%、85.0%、90.0%、91.0%、92.0%、93.0%、94.0%、95.0%、96.0%、97.0%、97.5%、98.0%、98.5%、99.0%、99.5%、99.9%、100%或由前述百分比中的任两者定义的百分比范围相同的序列或其片段。在一些实施方案中,所述流感蛋白由下述核酸编码,所述核酸具有与编码氨基酸seq id no:15或16的核酸序列75.0%、80.0%、85.0%、90.0%、91.0%、92.0%、93.0%、94.0%、95.0%、96.0%、97.0%、97.5%、98.0%、98.5%、99.0%、99.5%、99.9%、100%或由前述百分比中的任两者定义的百分比范围相同的序列或其片段。在一些实施方案中,所述流感蛋白由下述核酸编码,所述核酸具有与编码氨基酸seq id no:1-14中任一个的核酸序列相比具有不超过1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的核酸取代、缺失和/或插入的序列或其片段。在一些实施方案中,所述流感蛋白由下述核酸编码,所述核酸具有与编码氨基酸seq id no:15或16的核酸序列相比具有不超过1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的核酸取代、缺失和/或插入的序列或其片段。
[0144]
在一些实施方案中,流感病毒是甲型、乙型、丙型或丁型。在一些实施方案中,如果病毒是甲型流感病毒,则其是h1n1、h1n2、h3n1、h3n2或h2n3。在一些实施方案中,流感病毒是h2n2、h5n1或h7n9。
[0145]
流感病毒株系的实例列出于表1中。一些vlp包含在受试者中激活针对表1中的至少80%的株系的免疫应答的一组抗原。在一些实施方案中,vlp包含在受试者中激活针对表1中的至少50%、55%、60%、65%、70%、75%、80%、85%、至少90%、至少95%、至少99%或至少100%的株系的免疫应答的一组抗原。
[0146]
在一些实施方案中,vlp包含表1中株系的抗原。一些vlp包括表1中株系的一种或多种抗原的一种或多种同源物。在一些情况下,这种同源物包含与表1中的抗原的至少90%序列同一性。在一些情况下,这种同源物包含与表1中的抗原的至少80%序列同一性。在一些情况下,这种同源物包含与表1中的抗原的至少85%序列同一性。在一些情况下,这种同源物包含与表1中的抗原的至少95%序列同一性。在一些情况下,这种同源物包含与表1中的抗原的至少99%序列同一性。
[0147]
表1:流感病毒株系的实例
[0148]
[0149]
[0150]
[0151]
[0152]
[0153][0154]
在一些实施方案中,vlp(例如sevlp或smvlp)包含h1n1、h1n2、h3n1、h3n2、h2n3、h2n2、h5n1或h7n9中的2种或更多种的抗原。在一些实施方案中,vlp包含h1n1、h1n2、h3n1、h3n2、h2n3、h2n2、h5n1或h7n9中的3种或更多种的抗原。在一些实施方案中,vlp包含h1n1、h1n2、h3n1、h3n2、h2n3、h2n2、h5n1或h7n9中的4种或更多种的抗原。在一些情况下,vlp是流感疫苗的一部分并且包含h1n1、h1n2、h3n1、h3n2、h2n3、h2n2、h5n1或h7n9中的5种或更多种的抗原。在一些实施方案中,vlp包含h1n1、h1n2、h3n1、h3n2、h2n3、h2n2、h5n1或h7n9中的6种或更多种的抗原。在一些实施方案中,vlp包含h1n1、h1n2、h3n1、h3n2、h2n3、h2n2、h5n1或h7n9中的7种或更多种的抗原。在一些实施方案中,vlp包含h1n1、h1n2、h3n1、h3n2、h2n3、h2n2、h5n1和h7n9的抗原。
[0155]
在一些实施方案中,抗原包括神经氨酸酶(na)蛋白或其变体或片段。na是流感病毒膜糖蛋白,并且在一些实施方案中通过将末端唾液酸残基从感染细胞表面上的碳水化合物部分裂解下来而参与病毒ha的细胞受体的破坏。在一些实施方案中,na还将唾液酸残基从病毒蛋白质裂解下来,从而防止病毒的聚集。na(与ha一起)是两个主要的流感病毒抗原决定簇之一。一些流感na蛋白的核苷酸和氨基酸序列是本领域已知的并且可公开获得的,诸如用genbank数据库贮藏的那些。
[0156]
在一些实施方案中,na包括同四聚体。在一些实施方案中,na包括已经在来自禽类的流感病毒中鉴定出的亚型(n1、n2、n3、n4、n5、n6、n7、n8或n9)。在一些实施方案中,na包括山形样和维多利亚州样抗原谱系。在一些实施方案中,na通过将末端神经氨酸(也称为唾液酸)残基从感染细胞表面上的碳水化合物部分裂解下来而参与病毒ha的细胞受体的破坏。在一些实施方案中,na还将唾液酸残基从病毒蛋白质裂解下来,从而防止病毒的聚集。在一些实施方案中,na通过以下方式而有利于病毒子代的释放:防止新形成的病毒颗粒沿着细胞膜聚积以及通过促进病毒转运通过粘膜表面上存在的粘液。
[0157]
可从genbank获得的非限制性示例性na序列(诸如存在于禽类中的iva na)包括n1 fj966084.1、acp41107.1、hm006761.1、add97097.1、af474048.1、aao33498.1、ay254145.1、aap21476.1、ay254139.1、aap21470.1、cy187031.1、ahz43937.1、cy020887.1、abo52063.1、ay207531.1、aao62045.1、ay207533.1、aao62047.1、ay207528.1、aao62042.1、n5、m24740.1、aaa43672.1、p03478.2、nmivaa、n6、ay207557.1、aao62071.1、ay207556.1、aao62070.1、ay207553.1、aao62067.1、n7、m38330.1、aaa43425.1、p18881.1、n8、l06575.1、aaa43404.1、ay531038.1、aat08005.1、cy020903.1、abo52085.1、n9、m17812.1、aaa43575.1、m17813.1、aaa43574.1、ab472040.1、bah69263.1、na、ab036870.1、bab32609.1、nc_002209.1、np_056663.1、d14855.1、baa03583.1、aj419110.1、act85965.1、aj784104.1、aga18957.1、aj419111.1和aao38872.1。na氨基酸序列的一些实例在本文中提供为seq id no:1-4。
[0158]
在一些实施方案中,抗原包括血凝素(ha)或其变体或片段。ha是流感病毒表面糖蛋白。ha介导病毒颗粒与宿主细胞的结合以及随后的病毒进入宿主细胞。在一些实施方案中,ha还引起红细胞凝集。多种流感ha蛋白的核苷酸和氨基酸序列是本领域已知的并且可公开获得的,诸如用genbank数据库贮藏的那些。ha(与na一起)是两个主要的流感病毒抗原决定簇之一。例如来自甲型流感的16种ha亚型的示例性ha序列和来自乙型流感的ha的实例可购自genbank数据库。ha氨基酸序列的一些实例在本文中提供为seq id no:5-8。
[0159]
在一些实施方案中,抗原包含ha和信号序列。在一些实施方案中,vlp中的ha肽不包括信号序列(即,加工前ha蛋白序列的例如约氨基酸1-15、1-16、1-17、1-18或1-19)。在一些实施方案中,ha或变体ha(例如当为vlp的一部分时)保留当施用至受试者(诸如哺乳动物或禽类)时诱导免疫应答的能力。
[0160]
在一些实施方案中,编码ha或本文所述的任何其他抗原的核酸分子经密码子优化以在哺乳动物或昆虫细胞中表达。在一些实施方案中,该核酸分子针对rna稳定性来优化。
[0161]
在一些实施方案中,抗原包括基质蛋白或流感病毒基质蛋白抗原或其变体或片段。甲型流感病毒具有两种基质蛋白m1和m2。m1是存在于病毒包膜内的结构蛋白。m1是介导rna-核蛋白核心包埋至膜包膜中的双功能膜/rna结合蛋白。m1由通过接头序列连接的两个结构域组成。m2蛋白是单跨膜蛋白,其形成具有h 离子通道活性的四聚体,并且当通过核内体中的低ph激活时,酸化病毒体的内部,从而有利于其脱壳。已经描述了乙型流感病毒m1和bm2中的同源蛋白。
[0162]
在一些实施方案中,本文所公开的vlp除了包含、具有或呈递ha亚型或na亚型之外还包括流感基质蛋白,诸如m1、m2或两者。在一些实施方案中,抗原包括基质蛋白。在一些实施方案中,流感基质蛋白来自与ha或ha相同的流感类型(例如,如果vlp中的ha或na来自甲型流感,则基质蛋白来自甲型流感,但如果vlp中的ha或na来自乙型流感,则基质蛋白来自乙型流感)。在一些实施方案中,本文提供的vlp中存在的基质肽序列是甲型流感m1、m2或m1和m2序列,诸如禽m1、m2或m1或m2序列或者乙型流感基质肽(诸如m1、bm2或m1和bm2两者)。在一些实施方案中,vlp包含甲型流感m1蛋白(例如如果vlp包含甲型流感na或ha蛋白)。在一些实施方案中,vlp包含甲型流感m1和甲型流感m2蛋白两者(例如如果vlp包含甲型流感na或ha蛋白)。在一些实施方案中,vlp包含乙型流感基质肽(例如如果vlp包含乙型流感na或ha蛋白)。在一些实施方案中,vlp包含乙型流感m1和乙型流感bm2蛋白(例如如果vlp包含乙型流感na或ha蛋白)两者。
[0163]
多种甲型流感m1和m2蛋白以及乙型流感基质蛋白的核苷酸和氨基酸序列是本领域已知的并且可公开获得的,诸如用genbank贮藏的那些。可获自genbank的示例性序列的一些示例性序列诸如ibv基质、m1和m2序列包括cy002697.1、aba12718.1、ab189064.1、aba12719.1、dq870897.1、af231361.1、abs52607.1、ay044171.1、aad49068.1、abq12378.1、ay504605.1、abs52606.1、abv53560.1、ab120274.1、aad49091.1、aak95902.1、af100382.1、dq508916.1、aat69429.1、bad29821.1、abf21318.1和ahw46771.1。基质或m2氨基酸序列的一些实例在本文中提供为seq id no:9-12。在一些实施方案中,基质序列是小m2膜蛋白,而不是较大的细胞质基质蛋白。在一些情况下,共表达较大的细胞质基质蛋白以驱动颗粒从传统vlp出芽,或者将小m2膜蛋白诸如seq id no:9-12中提供的那些用于本文提供的vlp。
[0164]
在一些实施方案中,抗原或流感抗原包括流感nb肽或其片段。nb肽序列的一些实
例在本文中提供为seq id no:13-14。在一些实施方案中,流感病毒、诸如乙型流感将两种小离子通道跨膜蛋白(nb和bm2)掺入至病毒体中,而不是甲型流感中的一种(m2)。在一些实施方案中,抗原或流感抗原包括nb或bm2。在一些实施方案中,nb由核酸、诸如rna编码,并且在与na相同的核酸区段上,但在不同的阅读框中。
[0165]
在一些实施方案中,本文所公开的流感ha、na、m1和m2蛋白及编码序列的变体的特征在于具有至少约80%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性,所述序列同一性使用设定为默认参数的ncbi blast 2.0、gapped blastp利用与氨基酸序列的全长比对来计数。对于大于约30个氨基酸的氨基酸序列的比对,在一些实施方案中,使用设定为默认参数(空位存在成本为11,且每个残基空位成本为1)的默认blosum62矩阵来采用blast 2序列函数。当比对短肽(少于约30个氨基酸)时,应使用采用设定为默认参数(开放空位9,延伸空位1罚分)的pam30矩阵来使用blast 2序列函数进行比对。通过该方法评估时,与参考序列具有更高相似性的蛋白质将显示出增加的同一性百分比,诸如至少95%、至少98%或至少99%序列同一性。在一些实施方案中,当比较小于完整序列的序列同一性时,同源物和变体将在一些实施方案中在10-20个氨基酸的短窗口上具有至少80%的序列同一性,并且在一些实施方案中根据其与参考序列的相似性而具有至少85%或至少90%或至少95%的序列同一性。用于确定在此类短窗口上的序列同一性的方法可在网上的ncbi网站处获得。本领域技术人员将理解,提供这些序列同一性范围仅用于指导;可以获得超出所提供范围的非常重要的同源物是完全有可能的。因此,在一些实施方案中,变体流感ha、na或基质蛋白(或编码序列)与本文提供的任何抗原或抗原序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性,并且在一些实施方案中用于本文提供的方法和组合物中。
[0166]
在一些实施方案中,vlp呈递或包含甲型流感ha或甲型流感na蛋白与甲型流感m1、甲型流感m2或甲型流感m1和甲型流感m2蛋白两者的组合。在本文的其他实施方案中,流感vlp呈递或包含乙型流感ha或乙型流感na蛋白与乙型流感基质蛋白m1或乙型流感m1和bm2蛋白两者的组合。
[0167]
2.冠状病毒抗原
[0168]
在一些实施方案中,本文公开了包含抗原的vlp。在一些实施方案中,抗原是冠状病毒抗原或其变体或片段。在一些实施方案中,片段是功能性片段。在一些实施方案中,抗原是冠状病毒抗原。在一些实施方案中,抗原是变体或冠状病毒抗原。在一些实施方案中,抗原是片段或冠状病毒抗原。
[0169]
冠状病毒抗原可以来自冠状病毒。冠状病毒的非限制性实例包括mhv、hcov-oc43、aibv、bcov、tgv、fipv、hcov-229e、mers病毒、重度急性呼吸综合征冠状病毒1(sars-cov-1)或sars-cov-2。在一些实施方案中,冠状病毒是mers病毒。在一些实施方案中,冠状病毒是sars冠状病毒。在一些实施方案中,冠状病毒是sars-cov-1。在一些实施方案中,冠状病毒是sars-cov-2。在一些实施方案中,冠状病毒包括sars-cov-2。
[0170]
在一些实施方案中,冠状病毒引起病毒感染。例如,sars冠状病毒可以引起sars感染。在一些实施方案中,sars-cov-2引起冠状病毒疾病2019。在一些实施方案中,所述毒感染是冠状病毒感染。在一些实施方案中,所述病毒感染是冠状病毒疾病2019(covid-19)。在一些实施方案中,受试者具有病毒感染。在一些实施方案中,受试者患有covid-19。
[0171]
在一些实施方案中,冠状病毒抗原是冠状病毒蛋白。在一些实施方案中,所述抗原包括冠状病毒蛋白或其片段。在一些实施方案中,抗原包括冠状病毒蛋白。在一些实施方案中,所述冠状病毒蛋白包括刺突(s)蛋白、包膜(e)蛋白、膜蛋白(m)或核衣壳(n)蛋白。在一些实施方案中,所述冠状病毒蛋白包括刺突(s)蛋白。在一些实施方案中,所述冠状病毒蛋白包括包膜(e)蛋白。在一些实施方案中,所述冠状病毒白蛋白包括膜蛋白(m)。在一些实施方案中,所述冠状病毒蛋白包括核衣壳(n)蛋白。在一些实施方案中,所述冠状蛋白包括s1或s2。在一些实施方案中,刺突蛋白裂解为s1和/或s2。在一些实施方案中,刺突蛋白包括s1。在一些实施方案中,刺突蛋白包括s2。在一些实施方案中,冠状病毒蛋白是重组的和/或非天然存在的。在一些实施方案中,刺突蛋白是功能性刺突蛋白或其功能性片段。在一些实施方案中,刺突蛋白结合受体。在一些实施方案中,刺突蛋白片段结合受体。在一些实施方案中,受体包括ace2。在一些实施方案中,受体是血管紧张素ace2。在一些实施方案中,刺突蛋白结合ace2。在一些实施方案中,刺突蛋白片段结合ace2。在一些实施方案中,受体是人蛋白。在一些实施方案中,受体是人ace2。在一些实施方案中,在与人受体结合时,刺突蛋白能够内化至细胞中。
[0172]
在一些实施方案中,冠状病毒蛋白包含与seq id no:20-29中任一个75.0%、80.0%、85.0%、90.0%、91.0%、92.0%、93.0%、94.0%、95.0%、96.0%、97.0%、97.5%、98.0%、98.5%、99.0%、99.5%、99.9%、100%或由前述百分比中的任两者定义的百分比范围相同的氨基酸序列或其片段。在一些实施方案中,冠状病毒蛋白包含与seq id no:20-29中任一个75.0%、80.0%、85.0%、90.0%、91.0%、92.0%、93.0%、94.0%、95.0%、96.0%、97.0%、97.5%、98.0%、98.5%、99.0%、99.5%、99.9%、100%或由前述百分比中的任两者定义的百分比范围相同的氨基酸序列。
[0173]
在一些实施方案中,冠状病毒蛋白包含与seq id no:20-29中任一个至少75.0%相同、至少80.0%相同、至少85.0%相同、至少90.0%相同、至少91.0%相同、至少92.0%相同、至少93.0%相同、至少94.0%相同、至少95.0%相同、至少96.0%相同、至少97.0%相同、至少97.5%相同、至少98.0%相同、至少98.5%相同、至少99.0%相同、至少99.5%相同、至少99.9%相同或100%相同的氨基酸序列。
[0174]
在一些实施方案中,冠状病毒蛋白包含与seq id no:20-29中任一个不超过75.0%相同、不超过80.0%相同、不超过85.0%相同、不超过90.0%相同、不超过91.0%相同、不超过92.0%相同、不超过93.0%相同、不超过94.0%相同、不超过95.0%相同、不超过96.0%相同、不超过97.0%相同、不超过97.5%相同、不超过98.0%相同、不超过98.5%相同、不超过99.0%相同、不超过99.5%相同、不超过99.9%相同或100%相同的氨基酸序列。
[0175]
在一些实施方案中,冠状病毒蛋白包含与seq id no:20 75.0%相同、80.0%相同、85.0%相同、90.0%相同、91.0%相同、92.0%相同、93.0%相同、94.0%相同、95.0%相同、96.0%相同、97.0%相同、97.5%相同、98.0%相同、98.5%相同、99.0%相同、99.5%相同、99.9%相同或100%相同的氨基酸序列或其片段,或包含相比于seq id no:20具有一定范围的同一性百分比的氨基酸序列或其片段。在一些实施方案中,冠状病毒蛋白包含seq id no:20的序列。在一些实施方案中,冠状病毒蛋白包含seq id no:20的片段的序列。
[0176]
在一些实施方案中,冠状病毒蛋白包含与seq id no:21 75.0%相同、80.0%相同、85.0%相同、90.0%相同、91.0%相同、92.0%相同、93.0%相同、94.0%相同、95.0%相
id no:27的序列。在一些实施方案中,冠状病毒蛋白包含seq id no:27的片段的序列。
[0183]
在一些实施方案中,冠状病毒蛋白包含与seq id no:28 75.0%相同、80.0%相同、85.0%相同、90.0%相同、91.0%相同、92.0%相同、93.0%相同、94.0%相同、95.0%相同、96.0%相同、97.0%相同、97.5%相同、98.0%相同、98.5%相同、99.0%相同、99.5%相同、99.9%相同或100%相同的氨基酸序列或其片段,或包含相比于seq id no:28具有一定范围的同一性百分比的氨基酸序列或其片段。在一些实施方案中,冠状病毒蛋白包含seq id no:28的序列。在一些实施方案中,冠状病毒蛋白包含seq id no:28的片段的序列。
[0184]
在一些实施方案中,冠状病毒蛋白包含与seq id no:29 75.0%相同、80.0%相同、85.0%相同、90.0%相同、91.0%相同、92.0%相同、93.0%相同、94.0%相同、95.0%相同、96.0%相同、97.0%相同、97.5%相同、98.0%相同、98.5%相同、99.0%相同、99.5%相同、99.9%相同或100%相同的氨基酸序列或其片段,或包含相比于seq id no:29具有一定范围的同一性百分比的氨基酸序列或其片段。在一些实施方案中,冠状病毒蛋白包含seq id no:29的序列。在一些实施方案中,冠状病毒蛋白包含seq id no:29的片段的序列。
[0185]
在一些实施方案中,冠状病毒蛋白包含与seq id no:20-29中任一个相比具有1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列或其片段。在一些实施方案中,冠状病毒蛋白包含与seq id no:20-29中任一个相比具有1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列。
[0186]
在一些实施方案中,冠状病毒蛋白包含与seq id no:20-29中任一个相比具有不超过1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列或其片段。在一些实施方案中,冠状病毒蛋白包含与seq id no:20-29中任一个相比具有不超过1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列。
[0187]
在一些实施方案中,冠状病毒蛋白包含与seq id no:20-29中任一个相比具有至少1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列或其片段。在一些实施方案中,冠状病毒蛋白包含与seq id no:20-29中任一个相比具有至少1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列。
[0188]
在一些实施方案中,冠状病毒蛋白包含与seq id no:20相比具有1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列或其片段。在一些实施方案中,冠状病毒蛋白包含与seq id no:20相比具有1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列。
[0189]
在一些实施方案中,冠状病毒蛋白包含与seq id no:21相比具有1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列或其片段。在一些实施方案中,冠状病毒蛋白包含与seq id no:21相比具有1、2、3、4、5、6、7、8、9、10、21、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列。
[0190]
在一些实施方案中,冠状病毒蛋白包含与seq id no:22相比具有1、2、3、4、5、6、7、
8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列或其片段。在一些实施方案中,冠状病毒蛋白包含与seq id no:22相比具有1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列。
[0191]
在一些实施方案中,冠状病毒蛋白包含与seq id no:23相比具有1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列或其片段。在一些实施方案中,冠状病毒蛋白包含与seq id no:23相比具有1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列。
[0192]
在一些实施方案中,冠状病毒蛋白包含与seq id no:24相比具有1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列或其片段。在一些实施方案中,冠状病毒蛋白包含与seq id no:24相比具有1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列。
[0193]
在一些实施方案中,冠状病毒蛋白包含与seq id no:25相比具有1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列或其片段。在一些实施方案中,冠状病毒蛋白包含与seq id no:25相比具有1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列。
[0194]
在一些实施方案中,冠状病毒蛋白包含与seq id no:26相比具有1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列或其片段。在一些实施方案中,冠状病毒蛋白包含与seq id no:26相比具有1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列。
[0195]
在一些实施方案中,冠状病毒蛋白包含与seq id no:27相比具有1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列或其片段。在一些实施方案中,冠状病毒蛋白包含与seq id no:27相比具有1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列。
[0196]
在一些实施方案中,冠状病毒蛋白包含与seq id no:28相比具有1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列或其片段。在一些实施方案中,冠状病毒蛋白包含与seq id no:28相比具有1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列。
[0197]
在一些实施方案中,冠状病毒蛋白包含与seq id no:29相比具有1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列或其片段。在一些实施方案中,冠状病毒蛋白包含与seq id no:29相比具有1、2、3、4、5、6、7、8、9、10、20、40个或由前述整数中的任意整数定义的范围的氨基酸取代、缺失和/或插入的氨基酸序列。
[0198]
3.多价性vlp
[0199]
本文提供了疫苗,其含有两种或更多种不同的vlp(例如sevlp或smvlp),诸如两种或更多种不同的vlp群体。此类疫苗被称为多价vlp(或含多价vlp疫苗)。在一些实施方案中,疫苗包含含有不同抗原的vlp。在一些实施方案中,疫苗包含含有不同的流感血凝素(ha)多肽的vlp,诸如含有或包含第一ha多肽的第一vlp和含有或包含第二ha多肽的第二vlp,其中第一和第二ha多肽是不同的亚型(或来自不同的流感病毒,诸如甲型流感和乙型流感)。在一些实施方案中,疫苗含有多种不同的vlp,每种vlp包含或含有不同的ha亚型或来自不同流感(例如甲型和乙型)的ha。在一些实施方案中,vlp包含其他试剂,诸如药学上可接受的载体和/或佐剂。
[0200]
在一些实施方案中,所公开的疫苗包含各自含有来自甲型或乙型流感的单一ha亚型的流感vlp的多价混合物。在一些实施方案中,疫苗进一步包含含有甲型或乙型流感na蛋白的vlp(例如,各自包含甲型流感na亚型或乙型流感na的另外vlp群体)。在一些实施方案中,vlp还含有甲型或乙型流感基质蛋白。在一些实施方案中,包含甲型流感na或ha的vlp包含甲型流感m1、m2或两者,而包含乙型流感na或ha的vlp包含乙型流感基质蛋白,诸如乙型流感m1、bm2或两者。在一些实施方案中,使用鼻内、皮内、全身性或静脉内递送或施用以诱导粘膜和全身性免疫。在一些实施方案中,单价或多价vlp是非感染性、安全且易于制造和使用的。在一些实施方案中,使用多价vlp(其在一些实施方案中包括包含甲型或乙型流感ha的vlp群体的混合物)来提供广泛反应性季节性疫苗。
[0201]
在一些实施方案中,疫苗包含至少两种不同的vlp,诸如vlp的至少两种不同的群体,每种vlp或vlp群体含有一种ha亚型(或含有来自一种流感病毒、诸如甲型和乙型流感的ha)。一些实施方案包括含有第一ha亚型(h-x)的第一vlp和含有不同的ha亚型(h-y)的第二vlp。在一些实施方案中,第一vlp含有来自乙型流感的第一ha(h-x)并且第二vlp含有来自乙型流感的第二但不同的ha(h-y),或者第一vlp含有来自甲型流感的第一ha(h-x)并且第二vlp含有来自甲型流感的第二但不同的ha(h-y)。在一些实施方案中,第一vlp含有来自甲型流感的第一ha(h-x)并且第二vlp含有来自乙型流感的第二ha(h-y)。在一些实施方案中,每种vlp含有多个vlp,每种群体含有不同的ha亚型(或来自不同流感病毒的ha)。
[0202]
在一些实施方案中,疫苗中包括多于两种不同的vlp或疫苗。在一些实施方案中,疫苗包含至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9、或至少10,诸如2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17或18种不同的vlp或vlp群体,每种vlp或vlp群体包含不同的抗原。在一些实施方案中,不同的抗原各自来自不同的流感ha亚型和/或来自不同的流感病毒,诸如2-8、2-6、5-6或4-6种不同的vlp或vlp群体(其中每种vlp或vlp群体具有不同的ha蛋白亚型和/或来自不同病毒的ha)。在一些实施方案中,第一vlp包含选自由以下组成的组的第一甲型流感ha多肽:ha亚型h1、h2、h3、h4、h5、h6、h7、h8、h9、h10、h11、h12、h13、h14、h15和h16;而第二vlp包含选自由以下组成的组的第二甲型流感ha多肽:ha亚型h1、h2、h3、h4、h5、h6、h7、h8、h9、h10、h11、h12、h13、h14、h15和h16;其中第一ha多肽和第二ha多肽是不同的亚型。因此,如果疫苗包含第三vlp,诸如第三vlp群体,则第三甲型流感ha多肽将选自由以下组成的组:ha亚型h1、h2、h3、h4、h5、h6、h7、h8、h9、h10、h11、h12、h13、h14、h15和h16,其中第三ha多肽亚型不同于第一ha多肽亚型和第二ha多肽亚型。
[0203]
在一些实施方案中,第一vlp包含选自由以下组成的组的第一甲型流感ha多肽:ha
亚型h1、h2、h3、h4、h5、h6、h7、h8、h9、h10、h11、h12、h13、h14、h15和h16;而第二vlp包含第一乙型流感ha多肽、诸如山形样或维多利亚州样抗原。如果疫苗包含第三vlp,诸如含有第二甲型流感ha多肽的第三vlp群体,则所述第二甲型流感ha多肽将选自由以下组成的组:ha亚型h1、h2、h3、h4、h5、h6、h7、h8、h9、h10、h11、h12、h13、h14、h15和h16,其中第二甲型流感ha多肽亚型不同于第一甲型流感ha多肽亚型。如果疫苗包含第三vlp,诸如含有第二乙型流感ha多肽的第三vlp群体,则第二乙型流感ha将不同于第一乙型流感ha。在具体实例中,疫苗包含至少两种、至少三种、至少四种、至少五种,诸如2、3、4、5、6、7、8、9或10种不同的vlp(或vlp群体),其中至少一种vlp群体包含甲型流感ha亚型,至少一种vlp群体包含乙型流感ha,并且任选地至少一种vlp群体包含甲型流感na亚型。
[0204]
在一些实施方案中,疫苗包含独立的vlp(或vlp群体)。在一些实施方案中,第一vlp群体包含甲型流感h1,第二vlp群体包含甲型流感h3,第三vlp群体包含甲型流感h5,第四vlp群体包含甲型流感h7,第五vlp群体包含甲型流感n1,第六vlp群体包含甲型流感n2,第七vlp群体包含乙型流感山形样或维多利亚州样抗原,并且任选地第八vlp群体包含乙型流感山形样或维多利亚州样抗原(不同于第七vlp群体)。在一些实施方案中,将疫苗用作季节性疫苗或大流行前疫苗。
[0205]
在一些实施方案中,存在两个主要组的甲型流感病毒ha:组1含有h1、h2、h5、h6、h8、h9、h11、h12、h13和h16,并且组2含有h3、h4、h7、h10、h14和h15亚型。在一些实施方案中,疫苗包含含有组1的至少一种ha多肽(例如,h1、h2、h5、h6、h8、h9、h11、h12、h13或h16)的第一vlp或第一vlp群体和含有组2的至少一种ha多肽(例如,h3、h4、h7、h10、h14或h15)的第二vlp或第二vlp群体。在另一个实例中,疫苗包含至少两种不同的vlp或不同的vlp群体,每种vlp或vlp群体包含组1的不同的ha多肽(例如h1、h2、h5、h6、h8、h9、h11、h12、h13或h16)。在另一个实例中,疫苗包含至少两种不同的vlp或不同的vlp群体,每种vlp或vlp群体包含组2的不同的ha多肽(例如h3、h4、h7、h10、h14或h15)。类似地,虽然乙型流感病毒ha不具有不同的亚型,但存在两种主要的抗原谱系,即维多利亚州样和山形样,其也在系统发育上不同。
[0206]
在一些实施方案中,疫苗包含至少两种、至少三种、至少四种、至少五种,诸如2、3、4、5、6、7、8、9或10种不同的vlp(或vlp群体),每种vlp(或vlp群体)含有组1的不同的甲型流感ha多肽(例如,h1、h2、h5、h6、h8、h9、h11、h12、h13或h16)。在具体实例中,疫苗包含至少两种、至少三种、至少四种、至少五种、至少六种,诸如2、3、4、5或6种不同的vlp(或vlp群体),每种vlp(或vlp群体)含有组2的不同的甲型流感ha多肽(例如,h3、h4、h7、h10、h14或h15)。
[0207]
在一些实施方案中,第一甲型流感ha多肽是ha亚型h1、h2或h5,并且第二甲型流感ha多肽是ha亚型h3、h7或h9。在另一个具体实例中,第一甲型流感ha多肽是ha亚型h1、h2、h3、h5、h7或h9并且第二甲型流感ha多肽是ha亚型h1、h2、h3、h5、h7或h9,其中第一ha多肽和第二ha多肽是不同的亚型。在一些实施方案中,(i)第一甲型流感ha多肽是ha亚型h2并且第二甲型流感ha多肽是ha亚型h5;(ii)第一甲型流感ha多肽是ha亚型h3并且第二甲型流感ha多肽是ha亚型h7;(iii)第一甲型流感ha多肽是ha亚型h1并且第二甲型流感ha多肽是ha亚型h3;(iv)第一甲型流感ha多肽是ha亚型h2并且第二甲型流感ha多肽是ha亚型h7;(v)第一甲型流感ha多肽是ha亚型h5并且第二甲型流感ha多肽是ha亚型h3;或(vi)第一甲型流感ha多肽是ha亚型h1并且第二甲型流感ha多肽是ha亚型h7。
[0208]
在一些实施方案中,疫苗包含至少四种不同的vlp群体,其中第一vlp群体包含甲
型流感ha亚型h1,第二vlp群体包含甲型流感ha亚型h3,第三vlp群体包含甲型流感ha亚型h5,并且第四vlp群体包含甲型流感ha亚型h7。在一些实施方案中,疫苗进一步包含含有甲型流感ha亚型h9的第五vlp群体。在一些实施方案中,疫苗进一步包含含有甲型流感na(诸如n1或n2)的第六vlp群体。在一些实施方案中,疫苗进一步包含含有甲型流感na n1(第七群体)和n2(第八群体)的第七和第八vlp群体。在一些实施方案中,此类vlp也包含m1和m2。
[0209]
在一些实施方案中,本公开的vlp除了具有ha蛋白之外还包含流感基质蛋白(例如,甲型流感m1、甲型流感m2或两种)。在一些实施方案中,疫苗106包含具有第一ha亚型h-x和基质蛋白m1的vlp或vlp群体和具有第二ha亚型h-y和基质蛋白m1的vlp或vlp群体。在一些实施方案中,m2存在于vlp和/或vlp群体中。在一些实施方案中,vlp或vlp群体含有来自甲型流感的第一ha(h-x)和甲型流感基质蛋白、诸如m1或m2,并且第二vlp或vlp群体含有来自乙型流感的第二ha(h-y)和乙型流感基质蛋白。
[0210]
一些实施方案除了包括含有ha的vlp之外还包括含有流感神经氨酸酶(na)多肽的vlp(或vlp群体)。在一些实施方案中,疫苗包含两种或更多种不同的vlp或vlp群体,每种vlp或vlp群体具有不同的流感na多肽。在一些实施方案中,疫苗包含含有第一流感na多肽的第一vlp、含有第二流感na多肽的第二vlp或两者,其中第一na多肽和第二na多肽是不同的亚型或来自不同的流感病毒。在一些实施方案中,疫苗包含各自具有不同的ha亚型(或来自不同的流感病毒的na)的vlp或vlp群体,并且进一步包含具有na亚型n-x的vlp或vlp群体。在一些实施方案中,vlp或疫苗包含流感基质蛋白(例如,m1、m2或两者)。
[0211]
在系统发育上,存在两组甲型流感病毒na,其形成以下两组:组1含有n1、n4、n5和n8,并且组2含有n2、n3、n6、n7和n9。因此,在一个实例中,含多价vlp疫苗进一步包含含有组1的至少一种na多肽(例如,n1、n4、n5或n8)的第一vlp或第一vlp群体和含有组2的至少一种na多肽(例如,n2、n3、n6、n7或n9)的第二vlp或第二vlp群体。在另一个实例中,含多价vlp疫苗进一步包含至少两种不同的vlp或不同的vlp群体,每种vlp或vlp群体含有组1的不同的na多肽(例如,n1、n4、n5或n8)。在另一个实例中,含多价vlp疫苗进一步包含至少两种不同的vlp或不同的vlp群体,每种vlp或vlp群体含有组2的不同的na多肽(例如,n2、n3、n6、n7或n9)。
[0212]
在一些实施方案中,含多价vlp疫苗进一步包含1、2、3或4种不同的vlp(或vlp群体),每种vlp(或vlp群体)含有组1的不同的na多肽(例如,n1、n4、n5和n8)。在具体实例中,疫苗包含1、2、3、4或5种不同的vlp(或vlp群体),每种vlp(或vlp群体)含有组2的不同的na多肽(例如,n2、n3、n6、n7或n9)。
[0213]
类似地,虽然乙型流感病毒na不具有不同的亚型,但存在两种主要的抗原谱系,即维多利亚州样和山形样,其也在系统发育上不同。在一些实施方案中,含多价vlp疫苗进一步包含含有至少一种乙型流感na多肽(例如,维多利亚州样)的第一vlp或第一vlp群体和含有至少一种乙型流感na多肽(例如,山形样)的第二vlp或第二vlp群体。
[0214]
在一些实施方案中,本公开的na-vlp除了具有na蛋白之外还包含流感基质蛋白(例如,甲型流感m1、甲型流感m2或两者;或乙型流感m1、乙型流感bm2或两者)。
[0215]
在一些实施方案中,疫苗包含含有甲型流感ha亚型h1的第一vlp群体、含有甲型流感ha亚型h3的第二vlp群体、含有甲型流感ha亚型h5的第三vlp群体和含有甲型流感ha亚型h7的第四vlp群体。在一些实施方案中,疫苗进一步或任选地包含含有甲型流感ha亚型h9的
第五vlp群体。在一些实施方案中,疫苗进一步包含含有甲型流感na(诸如n1或n2)的第六vlp群体。在一些实施方案中,疫苗进一步包含含有甲型流感na n1(第六群体)和n2(第七群体)的第六和第七vlp群体。在一些实施方案中,疫苗进一步包含含有乙型流感山形样或维多利亚州样抗原的第八vlp群体,并且任选地第九vlp群体包含乙型流感山形样或维多利亚州样抗原(不同于第八vlp群体)。在一些实施方案中,将这种疫苗用作季节性疫苗或大流行前疫苗。
[0216]
c.锚定分子
[0217]
在某些实施方案中,本文公开了sevlp,其包含以下或由以下组成:(a)包括脂质双层的合成脂质囊泡,所述脂质双层包括内表面和外表面;(b)嵌入在脂质双层中的锚定分子;以及(c)与锚定分子结合的抗原。在某些实施方案中,本文还公开了smvlp,其包含:合成、半合成或天然脂质双层,所述脂质双层包括第一侧面和第二侧面;嵌入在脂质双层中的锚定分子;以及与锚定分子结合的抗原。在一些实施方案中,vlp在室温下是稳定的。
[0218]
在一些实施方案中,所述锚定分子包括跨膜蛋白、脂质锚定蛋白或其片段或结构域。
[0219]
在一些实施方案中,所述锚定分子包含疏水部分。在一些实施方案中,所述锚定分子包括异戊二烯化蛋白、脂肪酰化蛋白、糖基磷脂酰肌醇连接蛋白或其片段。
[0220]
在一些实施方案中,所述锚定分子包含疏水性跨膜结构域、糖基磷脂酰肌醇附接或有助于将抗原定位至膜的另外结构特征,诸如蛋白质-蛋白质缔合结构域、脂质缔合结构域、糖脂质缔合结构域或蛋白聚糖缔合结构域,例如细胞表面结合结构域、细胞外基质结合结构域或脂质筏缔合结构域。
[0221]
在一些实施方案中,所述锚定分子包含跨膜肽结构域。在一些实施方案中,跨膜多肽结构域包括包含能够与形成质膜双层的内部的磷脂脂肪酰基尾在能量上有利地相互作用的疏水性区域的跨膜结构域(诸如[α]-螺旋结构域);或膜插入结构域多肽,其在一些实施方案中包括包含能够与形成质膜双层的内部的磷脂脂肪酰基尾在能量上有利地相互作用的疏水性区域但在一些实施方案中不跨越整个膜的膜插入结构域。具有一个或多个跨膜多肽结构域的跨膜蛋白的一些实例包括整联蛋白家族、cd44、血型糖蛋白、mhc i和il类糖蛋白、egf受体、g蛋白偶联受体(gpcr)家族、受体酪氨酸激酶(诸如胰岛素样生长因子1受体(igfr)和血小板来源生长因子受体(pdgfr))、孔蛋白家族和其他跨膜蛋白的成员。一些实施方案包括使用跨膜多肽结构域的一部分,诸如具有膜插入特征的截短型多肽。
[0222]
在一些实施方案中,锚定分子包含蛋白质-蛋白质缔合结构域,例如能够与细胞表面蛋白或糖蛋白的细胞外布置区域特异性缔合的蛋白质-蛋白质缔合结构域。在一些实施方案中,蛋白质-蛋白质缔合结构域导致细胞内引发的缔合,其例如伴随有合成、加工、折叠、组装、转运和/或输出至细胞表面蛋白的细胞表面。在一些实施方案中,已知蛋白质-蛋白质缔合结构域与另一细胞表面蛋白缔合,所述细胞表面蛋白是膜锚定的并且从外部布置在细胞表面上。此类结构域的非限制性实例包括含rgd多肽,包括能够整联蛋白的那些。
[0223]
在一些实施方案中,将编码锚定分子或跨膜结构域的序列包括在用于提供抗原或包含抗原和锚定分子的融合蛋白的表面表达的多核苷酸中。在一些实施方案中,将融合蛋白与选择性标记物同框克隆以允许选择生产性同框产物。
[0224]
iv.疫苗
[0225]
在某些实施方案中,本文公开了疫苗,其包含:(a)vlp(例如sevlp或smvlp),和(b)赋形剂、载体或佐剂。
[0226]
在一些实施方案中,疫苗含有至少一种赋形剂。在一些实施方案中,赋形剂是抗粘附剂、粘合剂、包衣、颜料或染料、崩解剂、调味剂、助流剂、润滑剂、防腐剂、吸附剂、甜味剂或媒介物。在一些实施方案中,赋形剂包括润湿剂或乳化剂、或ph缓冲剂。在一些实施方案中,赋形剂含有用于调整渗透压的药学上可接受的盐、缓冲剂、防腐剂等。
[0227]
在一些实施方案中,赋形剂包括藻酸钠。在一些实施方案中,赋形剂包括藻酸盐微球体。在一些实施方案中,赋形剂包括卡波普,例如与淀粉组合。在一些实施方案中,赋形剂包括壳聚糖壳聚糖是一种无毒的线性多糖,可以通过几丁质脱乙酰化产生。在一个实例中,壳聚糖呈壳聚糖纳米颗粒的形式,诸如基于n-三甲基壳聚糖(tmc)的纳米颗粒。
[0228]
在一些实施方案中,赋形剂包括润湿剂或乳化剂、或ph缓冲剂。在一些实施方案中,赋形剂包括细菌来源的一种或多种脂肽或其合成衍生物,诸如pam3cys(pam2cys,单/多链棕榈酸和脂氨基酸(laa)。在一些实施方案中,疫苗含有一种或多种佐剂,例如粘膜佐剂,诸如cpg寡脱氧核苷酸(cpg odn)、flt3配体和mla中的一种或多种。在一些实施方案中,佐剂包括临床级mla配制品,诸如mpl(3-o-脱酰基-4'-单磷酰脂质a)佐剂。在一些实施方案中,疫苗含有药学上可接受的载体和佐剂,诸如粘膜佐剂,例如作为cpg寡脱氧核苷酸、flt3配体和mla中的一种或多种。在一个实例中,佐剂包括mla,诸如临床级配制品,例如mpl(3-o-脱酰基-4'-单磷酰脂质a)佐剂。在一些实施方案中,疫苗含有一种或多种佐剂,诸如单磷酰脂质a(mpl)、flt3配体、免疫刺激性寡核苷酸(诸如cpg寡核苷酸)或其组合。在一些实施方案中,佐剂包括tlr激动剂诸如咪喹莫特、flt3配体、mla或免疫刺激性寡核苷酸诸如cpg寡核苷酸。在一些实施方案中,佐剂是咪喹莫特。
[0229]
在一些实施方案中,疫苗含有至少一种佐剂。如在此所用,“佐剂”是非特异性地增强对抗原(例如,流感ha和/或na)的免疫应答的物质或媒介物。在一些实施方案中,将佐剂与本文公开的vlp一起使用。在一些实施方案中,佐剂包含其上吸附了抗原的矿物(明矾、氢氧化铝或磷酸盐)的悬浮液;或其中抗原溶液在矿物油中乳化的油包水乳液(例如,弗氏不完全佐剂),有时包括杀死的分枝杆菌(弗氏完全佐剂)以进一步增强抗原性。在一些实施方案中,免疫刺激性寡核苷酸(诸如包含cpg基序的那些)可用作佐剂。佐剂的一些实例包括生物分子,诸如共刺激分子。示例性生物佐剂包括il-2、rantes、gm-csf、tnf-α、ifn-γ、g-csf、lfa-3、cd72、b7-1、b7-2、ox-40l和41bbl。在一些实施方案中,佐剂是一种或多种tlr激动剂,诸如以下的激动剂:tlr1/2(其在一些实施方案中是合成配体)(例如,pam3cys)、tlr2(例如,cfa、pam2cys)、tlr3(例如,polyi:c、poly a:u)、tlr4(例如,mpla、脂质a和lps)、tlr5(例如,鞭毛蛋白)、tlr7(例如,嘎德莫特(gardiquimod)、咪喹莫特、洛索立宾(loxoribine)、瑞喹莫德(resiquimod))、tlr7/8(例如,r848)、tlr8(例如,咪唑并喹啉、sspolyu、3m-012)、tlr9(例如,odn 1826(b型)、odn 2216(a型)、cpg寡核苷酸)和/或tlr11/12(例如,抑制蛋白)。在一些实施方案中,佐剂是脂质a,诸如来自肠沙门氏菌血清型minnesota re 595的单磷酰脂质a(mpl)。
[0230]
在一些实施方案中,疫苗含有至少一种药学上可接受的载体。在一些实施方案中,载体是盐水、缓冲盐水、右旋糖、水、甘油、芝麻油、乙醇及其组合。在一些实施方案中,药学上可接受的载体部分取决于所施用的特定疫苗和/或取决于用于施用疫苗的特定方法。药
学上可接受的载体包括但不限于盐水、缓冲盐水、右旋糖、水、甘油、芝蔴油、乙醇以及其组合。在一些实施方案中,载体是无菌的,并且配制品适于施用方式。在一些实施方案中,疫苗含有液体溶液、悬浮液、乳液、片剂、丸剂、胶囊、持续释放配制品或粉末。
[0231]
用于肠胃外施用的制剂包括无菌的水性或非水性溶液、悬浮液和乳液。非水性溶剂的实例是丙二醇、聚乙二醇、植物油诸如橄榄油、以及可注射的有机酯诸如油酸乙酯。水性载体包括水、醇性/水性溶液、乳液或悬浮液,包括盐水和缓冲介质。肠胃外媒介物包括氯化钠溶液、林格氏右旋糖、右旋糖和氯化钠、乳酸林格氏液或固定油。静脉内媒介物包括流体和营养补充剂、电解质补充剂(诸如基于林格氏右旋糖的那些)等。在一些实施方案中,防腐剂或其他添加剂存在于例如像抗微生物剂、抗氧化剂、螯合剂和惰性气体等中。
[0232]
在一些实施方案中,载体包括一种或多种生物可降解的、粘膜粘附的聚合物载体。在一些实施方案中,包括了聚合物诸如聚乳酸-共-乙交酯(plga)、壳聚糖(例如呈壳聚糖纳米颗粒的形式,诸如基于n-三甲基壳聚糖(tmc)的纳米颗粒)、藻酸盐(如藻酸钠)和卡波普。在一些实施方案中,赋形剂或载体包括一种或多种亲水性聚合物,诸如藻酸钠或卡波普。在一些实施方案中,疫苗包含卡波普,例如与淀粉组合。在一些实施方案中,将疫苗配制用于静脉内或全身性施用。在一些实施方案中,疫苗包含脂质体、免疫刺激复合物(iscom)和/或聚合物颗粒,诸如病毒体。
[0233]
在一些实施方案中,载体包括液体溶液、悬浮液、乳液、片剂、丸剂、胶囊、持续释放配制品或粉末。在一些实施方案中,疫苗包括液体或者冻干或冷冻干燥的粉末。在一些实施方案中,将疫苗与传统粘合剂和载体(诸如甘油三酯)一起配制为栓剂。在一些实施方案中,口服配制品包含一种或多种标准载体,诸如医药级甘露糖醇、乳糖、淀粉、硬脂酸镁、糖精钠、纤维素和碳酸镁。
[0234]
在一些实施方案中,载体包括一种或多种生物可降解的、粘膜粘附的聚合物载体。在一些实施方案中,包括聚合物诸如聚乳酸-共-乙交酯(plga)、壳聚糖、藻酸盐和卡波普。在一些实施方案中,亲水性聚合物(诸如藻酸盐和卡波普)通过形成氢键吸收至粘液,因此延长了鼻腔停留时间,并且在一些实施方案中被包括在所公开的疫苗中。
[0235]
在一些实施方案中,将疫苗配制为用于鼻腔施用的微粒递送系统或配制用于静脉内或全身性施用或递送。在一些实施方案中,疫苗包含脂质体、免疫刺激复合物(iscom)和/或聚合物颗粒,诸如病毒体。在一些实施方案中,脂质体是经表面修饰的(例如,乙二醇壳聚糖或寡甘露糖包被的)。在一些实施方案中,脂质体是融合性的(fusogenic)或阳离子融合性的。
[0236]
在一些实施方案中,所述疫苗是冻干的。在一些实施方案中,所公开的疫苗是冷冻干燥的。在一些实施方案中,将所述疫苗玻璃化在糖玻璃中。
[0237]
在一些实施方案中,将所述疫苗配制在溶剂或诸如盐水溶液的液体中、配制为干粉或糖玻璃。例如,在一些实施方案中,将vlp用作通过鼻内施用或者im或id注射的疫苗(配制在盐水中、配制为干粉或由海藻糖制成的糖玻璃),和/或与佐剂混合以增强对疫苗的免疫应答。在一些实施方案中,疫苗包含糖玻璃。在一些实施方案中,糖玻璃包括海藻糖。在一些实施方案中,疫苗包含嵌入在糖玻璃中的vlp和佐剂。在一些实施方案中,疫苗包含配制在盐缓冲的海藻糖溶液中的vlp或佐剂,所述盐缓冲海藻糖溶液被印刷和干燥。在一些实施方案中,干燥通过玻璃化来进行。在一些实施方案中,此举提供了室温稳定性的益处。
[0238]
在一些实施方案中,疫苗配制品含有海藻糖和咪喹莫特。在一些实施方案中,疫苗含有环糊精、诸如磺丁基-β-环糊精。在一些实施方案中,将疫苗抗原嵌入在脂质体配制品中,所述脂质体配制品包含dopc(1,2-二油酰基-sn-甘油-3-磷酸胆碱)、dope(1,2-二油酰基-sn-甘油-3-磷酸乙醇胺)、胆固醇和dspe-peg2000(1,2二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n[氨基(聚乙二醇)-2000](铵盐)。
[0239]
在一些实施方案中,将所述疫苗配制用于微针施用。在一些实施方案中,将所述疫苗配制用于鼻内、皮内、肌肉内、局部、口服、皮下、腹膜内、静脉内或鞘内施用。在一些实施方案中,将所公开的疫苗配制用于鼻内施用,例如用于粘膜免疫。
[0240]
在一些实施方案中,所述疫苗包含1pg、10pg、25pg、100pg、250pg、500pg、750pg、1ng、5ng、10ng、15ng、20ng、25ng、50ng、100ng、250ng、500ng、1μg、10μg、50μg、100μg、500μg、1mg、5mg、10mg、50mg、100mg、500mg或1g剂量或由前述剂量中的任两者定义的剂量范围的所述疫苗。在一些实施方案中,所述疫苗包含25pl、50pl、100pl、250pl、500pl、750pl、1nl、5nl、10nl、15nl、20nl 25nl、50nl、100nl、250nl、500nl、1μl、10μl、50μl、100μl、500μl、1ml或5ml剂量或由前述剂量中的任两者定义的剂量范围的所述疫苗。在一些实施方案中,所述剂量在本文所述的微针装置的每个微针上或之中。
[0241]
v.装置
[0242]
在某些实施方案中,本文公开了微针装置,其包括加载有如本文所述的疫苗的微针。在一些实施方案中,所述微针装置包括基底和从所述基底延伸的多个微针,所述基底包括片材。在一些实施方案中,所述微针中的每一个包括尖端。在一些实施方案中,所述微针中的每一个包括基部。在一些实施方案中,所述微针中的每一个包括基部处的铰合部,其将微针连接至片材。在一些实施方案中,所述微针中的每一个包括包含疫苗的孔。在一些实施方案中,疫苗是脱水的。在一些实施方案中,微针装置包括包含疫苗的糖玻璃。在一些实施方案中,糖玻璃包括海藻糖。在一些实施方案中,微针装置包括疫苗贴片、诸如vaxipatch。
[0243]
在一些实施方案中,微针包括微米级至毫米级的结构。在一些实施方案中,微针被设计来刺穿皮肤并且将疫苗递送至受试者表皮或真皮。相比于传统的皮下或肌肉内注射,微针提供一些优势。在一些实施方案中,微针用于将疫苗直接递送至皮肤中的免疫细胞,这对于免疫目的是有利的。与传统的皮下或肌肉内注射相比,微针施用所需的疫苗量更小并且可以降低生产成本和时间。在一些实施方案中,微针是自行施用的。在一些实施方案中,将疫苗干燥至微针上,这大大增加了疫苗在室温下的稳定性。微针施用是无痛的,从而使其成为更易耐受的施用形式。
[0244]
在一些实施方案中,微针是固体结构。在一些实施方案中,微针是中空结构。在一些实施方案中,疫苗通过中空结构释放(例如,将液体疫苗注射或输注至皮肤中)。在一些实施方案中,将疫苗包装至微针上(例如,在形成后涂覆至微针的表面上)。在一些实施方案中,将疫苗以干燥形式包装到微针上。在一些实施方案中,疫苗在包装至微针上后脱水。在一些实施方案中,将疫苗包装至微针中(例如,形成微针本身的一部分,诸如通过沉积至微针的内部,或通过包含在用于形成微针的混合物中)。在一些实施方案中,疫苗在皮肤隔层(skin compartment)中溶解。在一些实施方案中,将疫苗注射至皮肤中。在一些实施方案中,将微针形成为包括多个微针的阵列。在一些实施方案中,微针阵列是微针的5x5阵列。在一些实施方案中,微针阵列物理地或可操作地耦联至固体支撑物或基底。在一些实施方案
中,固体支撑物是贴片。在一些实施方案中,将微针阵列直接施加至皮肤以供皮内施用疫苗。
[0245]
微针阵列贴片可以是任何合适的形状或大小。在一些实施方案中,微针阵列贴片被成形为模仿面部特征,例如眉毛。在一些实施方案中,微针阵列贴片是允许递送选定量的生物活性剂的最小尺寸。
[0246]
微针的大小和形状随着需要而变化。在一些实施方案中,微针包括物理地或可操作地耦联至具有尖端的圆锥形部分的圆柱形部分。在一些实施方案中,微针具有整体金字塔形状或整体圆锥形状。在一些实施方案中,微针包括基部和尖端。在一些实施方案中,尖端具有小于或等于约1微米的半径。在一些实施方案中,微针具有足以穿透角质层并进入表皮或真皮的长度。在某些实施方案中,微针具有在约0.1微米与约5毫米之间,例如约5毫米或更小、4毫米或更小、在约1毫米与约4毫米之间、在约500微米与约1毫米之间、在约10微米与约500微米之间、在约30微米与约200微米之间或在约250微米至约1,500微米之间的(从其尖端到其基部的)长度。在一些实施方案中,微针具有在约400微米至约600微米的(从其尖端到其基部的)长度。
[0247]
在一些实施方案中,根据所需的靶向深度或针的强度要求来优化单独微针的大小,以避免在特定组织类型中断裂。在一些实施方案中,经皮微针的横截面尺寸在约10nm与1mm之间、或在约1微米与约200微米之间、或在约10微米与约100微米之间。在一些实施方案中,中空针的外径在约10微米与约100微米之间,并且中空针的内径在约3微米与约80微米之间。
[0248]
在一些实施方案中,微针以图案排列。在一些实施方案中,微针以均匀方式间隔开,诸如以矩形或正方形网格或以同心圆的方式间隔开。在一些实施方案中,微针在基底的周边上间隔开,诸如在矩形网格的周边上间隔开。在一些实施方案中,间距取决于许多因素,包括微针的高度和宽度、待施加至微针表面的膜的特征以及旨在移动通过微针的物质的量和类型。在一些实施方案中,微针的排列是微针之间的“尖端到尖端(tip-to-tip)”间隔,所述间隔为约50微米或更大、约100微米至约800微米或约200微米至约600微米。
[0249]
在一些实施方案中,微针包括任何合适材料或由其组成。示例性材料包括金属、陶瓷、半导体、有机物、聚合物和复合材料。在一些实施方案中,构造材料包括但不限于:医药级不锈钢、金、钛、镍、铁、金、锡、铬、铜、这些或其他金属的合金、硅、二氧化硅以及聚合物。在一些实施方案中,聚合物是可生物降解的聚合物或不可生物降解的聚合物。代表性的可生物降解的聚合物包括但不限于:羟基酸、诸如乳酸和乙醇酸的聚合物、聚丙交酯、聚乙交酯、丙交酯-乙交酯共聚物以及与peg的共聚物、聚酸酐、聚(原酸)酯(poly(ortho)esters)、聚氨酯、聚(丁酸)、聚(戊酸)和聚(丙交酯-共-己内酯)。代表性的不可生物降解的聚合物包括聚碳酸酯、聚甲基丙烯酸、乙烯-乙酸乙烯酯、聚四氟乙烯和聚酯。
[0250]
在一些实施方案中,微针是可溶解的、可生物溶解的、可生物降解的或其任何组合。“可生物降解的”用于指被细菌或其他活生物体分解的任何物质或物体。预期任何合适的可溶解的、可生物溶解的和/或可生物降解的微针以供与本文所公开的疫苗和方法一起使用。在一些实施方案中,可溶解的、可生物溶解的或可生物降解的微针由水溶性材料构成。在一些实施方案中,这些材料包括壳聚糖、胶原、明胶、麦芽糖、右旋糖、半乳糖、藻酸盐、琼脂糖、纤维素(诸如羧甲基纤维素或羟丙基纤维素)、淀粉、透明质酸或其任何组合。在一
些实施方案中,选择的材料具有足以允许穿透皮肤的弹性。在一些实施方案中,可溶解的微针在数秒内、诸如在约5、10、15、20、25、30、45、50、60、120、180秒或更多秒内溶解于皮肤中。在一些实施方案中,可溶解的微针在数分钟内、诸如在约1、2、3、4、5、6、7、8、9、10、15、20、30、60、120分钟或更多分钟内溶解于皮肤中。在一些实施方案中,可溶解的微针包括可溶解的部分(诸如微针的尖端)和不可溶解的部分(诸如微针的基部),使得微针结构的一部分溶解于皮肤中。在一些实施方案中,可溶解的微针涵盖整个微针,使得整个微针结构溶解于皮肤中。在一些实施方案中,在不可溶解的支撑结构上形成可溶解的涂层,使得仅有涂层溶解于皮肤中。在一些实施方案中,微针涂覆有可溶解的、可生物降解的、可生物溶解的或其任何组合的聚合物。
[0251]
在一些实施方案中,将疫苗直接涂覆在可溶解的、可生物降解的或可生物溶解的微针上。在一些实施方案中,疫苗包含在可溶解的、可生物降解的或可生物溶解的微针本身内(例如,通过形成可溶解的聚合物基质的一部分)。在一些实施方案中,在微针结构的模塑和聚合之前,将疫苗与聚合物基质混合。
[0252]
在一些实施方案中,微针阵列包括医用级不锈钢(ss)的薄片材。在一些实施方案中,使用光化学蚀刻来产生两个维度(x、y轴)的阵列。在一些实施方案中,形成每个单独尖端并且其通过预成形铰合部保持连接至ss片材。在一些实施方案中,微针形成有锋利的尖头和凿缘,并且各自具有被设计来随后接收适当的疫苗的预成形孔。在一些实施方案中,使用微流体分配仪器来将精确量的疫苗递送至每个预形成孔中。在一些实施方案中,微流体分配设备同时和/或精确地将流体施加至不锈钢片材上轮廓化的数百个孔中。在一些实施方案中,少量疫苗立即干燥并粘附至微针的孔。在一些实施方案中,微针阵列包括37个微针的1.2cm圆形微阵列。在一些实施方案中,微针包含光化学蚀刻的不锈钢。
[0253]
可获得用于制造微针的多种方法,并且考虑将用于制造微针或微针阵列的任何合适方法与本文所公开的疫苗和方法一起使用。在一些实施方案中,使用任何合适的方法制造微针,所述方法包括但不限于:模塑(例如,自模塑、微模塑、微压纹、微注塑等)、浇铸(例如,压铸)或蚀刻(例如,软微光刻技术)。在一些实施方案中,根据实施例10制备微针装置。在一些实施方案中,根据实施例10中所述的一个或多个步骤制备微针装置。
[0254]
vi.试剂盒
[0255]
在某些实施方案中,本文公开了试剂盒,其包括如本文所述的疫苗,并且包括加载有疫苗的微针,擦拭物,干燥剂和绷带。在某些实施方案中,试剂盒还含有第二佐剂,其含有其中佐剂是咪喹莫特的擦拭物。
[0256]
在一些实施方案中,试剂盒包括容器或小瓶。在一些实施方案中,容器或小瓶各自含有不同的vlp或疫苗。在一些实施方案中,容器包含悬浮液中的vlp,所述悬浮液诸如具有pbs或药学上可接受的载体。在一些实施方案中,疫苗或vlp呈干燥或粉末形式,诸如冻干或冷冻干燥的,其被配置为由最终用户重构(例如用pbs或其他药学上可接受的载体重构)。在一些实施方案中,疫苗或vlp在海藻糖糖玻璃中以供微针皮内施用。在一些实施方案中,试剂盒包括第一容器,其包含含有第一抗原(例如第一ha亚型或来自第一流感病毒的ha)的vlp。在一些实施方案中,试剂盒包括第二容器,其包含含有第二抗原(例如第二ha亚型或来自第二流感病毒的ha)的vlp。在一些实施方案中,试剂盒包括第三容器,其包含含有第三抗原(例如第一na亚型)的vlp。在一些实施方案中,容器包含本文提供的vlp的混合物。在一些
实施方案中,试剂盒中的容器包含佐剂。在一些实施方案中,佐剂是在试剂盒中的单独容器中。在一些实施方案中,容器包含药学上可接受的载体、诸如pbs。在一些实施方案中,药学上可接受的载体是在单独容器中(例如如果vlp是冷冻干燥或冻干的)。在一些实施方案中,试剂盒中的容器进一步包含一种或多种稳定剂。在一些实施方案中,试剂盒包括允许将vlp施用至受试者的装置。此类装置的实例包括vaxipatch中的微针或本文提供的其他装置。在一些实施方案中,所述试剂盒含有咪喹莫特擦拭物。
[0257]
vii.制造方法
[0258]
在某些实施方案中,本文公开了制备vlp(例如sevlp)的方法,其包括:将含有(i)包含如本文所述的抗原的第一溶液与(ii)包含一种或多种脂质、诸如第一脂质和第二脂质的第二溶液流体组合。在一些实施方案中,第一溶液和/或第二溶液包括水性溶液。在一些实施方案中,第一溶液和/或第二溶液包括乙醇溶液。在一些实施方案中,抗原与锚定分子结合。在一些实施方案中,将第一溶液和第二溶液组合将第一溶液和第二溶液混合以形成如本文所述的vlp。在一些实施方案中,vlp包含如本文所述的脂质囊泡。在一些实施方案中,vlp包含脂质双层。在一些实施方案中,脂质囊泡或脂质双层包含第一脂质和/或第二脂质和嵌入在脂质双层中的锚定分子。
[0259]
在一些实施方案中,所述方法包括:将(i)包含与锚定分子结合的抗原的水性溶液与(ii)包含第一脂质和第二脂质的乙醇溶液微流体组合,从而将水性溶液与乙醇溶液混合以形成vlp,所述vlp包含含有第一脂质和第二脂质的脂质双层和嵌入在脂质双层中的锚定分子。在一些实施方案中,将水性溶液与乙醇溶液微流体组合包括将水性溶液的流与乙醇溶液的流混合。
[0260]
在一些实施方案中,所述方法包括:提供包含含有抗原结构域和膜锚定结构域的肽的水性溶液;提供包含第一脂质和第二脂质的乙醇溶液;和/或将水性溶液与乙醇溶液组合以产生vlp,其中肽通过膜锚定结构域锚定至脂质囊泡,其中抗原结构域在脂质囊泡的外表面上。在一些实施方案中,将水性溶液与乙醇溶液组合包括将水性溶液的流与乙醇溶液的流微流体混合。
[0261]
在一些实施方案中,从使用重组dna方法产生的纯化蛋白产生抗原。在一些实施方案中,将所定义的纯化重组蛋白与所定义的脂质使用微流体混合器混合以形成化学定义的vlp(例如sevlp或smvlp)。微流体混合器的实例是nanoassmblr(precision nanosystems,inc.)。在一些实施方案中,vlp(例如sevlp)通过以下方式产生:(1)在任何基于重组dna的蛋白质表达系统中产生基本上纯的抗原蛋白质,(2)化学定义的脂质,(3)以及使用微流体混合器进行体外组装。
[0262]
在一些实施方案中,所述方法包括通过受控的微流体过程产生sevlp。在一些实施方案中,微流体以可扩展的商业量产生均匀大小的脂质体。在一些实施方案中,微流体使用保持抗原的天然特性的温和溶剂。在一些实施方案中,在不使用渗析或洗涤剂的情况下产生sevlp。在一些实施方案中,在使用渗析或洗涤剂的情况下产生sevlp。
[0263]
在一些实施方案中,使用洗涤剂、诸如本文所述的洗涤剂纯化抗原。在一些实施方案中,洗涤剂是不可裂解的。在一些实施方案中,使用洗涤剂纯化的抗原来制备vlp。在一些实施方案中,洗涤剂包括辛基葡糖苷(n-辛基-β-d-葡糖苷)。在一些实施方案中,可裂解洗涤剂减少了除去洗涤剂的制造时间(例如,从约5天至数分钟)。在一些实施方案中,洗涤剂
包括化学可裂解的洗涤剂(ccd)。在一些实施方案中,ccd通过二硫化物在洗涤剂、诸如正十二烷基-β-d-麦芽吡喃糖苷中掺入二硫键来衍生。在一些实施方案中,通过三(2-羧乙基)膦(tcep)裂解洗涤剂的二硫键。在一些实施方案中,在不裂解含有二硫键的天然蛋白中的二硫化物的条件下裂解洗涤剂的二硫键。一些实施方案包括辛基葡糖苷的可裂解二硫化物版。
[0264]
在一些实施方案中,vlp(例如sevlp)通过两个步骤制备。在第一步骤中,将抗原通过重组dna方法产生和/或纯化。第二,通过微流体将抗原与定义脂质混合。在一些实施方案中,在蛋白质表达系统中表达抗原。在一些实施方案中,抗原是ha、na或流感基质蛋白(诸如流感m1或m2)。在一些实施方案中,蛋白质表达系统是基于细菌、酵母、植物、昆虫细胞或哺乳动物细胞的。在一些实施方案中,将这些细胞在足以允许抗原在细胞中表达的条件下用(1)编码抗原的病毒或编码抗原的病毒,并且在一些实施方案中还用(2)编码抗原的病毒转染或感染。第二,在一些实施方案中,将抗原与dopc、dope和胆固醇在微流体仪、诸如nanoassemblr
tm benchtop(precision nanosystems,inc.,温哥华,加拿大)中混合。在一些实施方案中,sevlp通过挤出制备。在一些实施方案中,挤出包括使用挤出机装置,诸如来自avanti polar lipids的挤出机装置。
[0265]
在一些实施方案中,形成sevlp,其中其抗原在水性溶液中,并且脂质在乙醇溶液中。在混合器、诸如来自precision nanosystems的nanoassemblr
tm benchtop(precision nanosystems,inc.,温哥华,加拿大)中,通过微流体混合来组合各自含有水性溶液或乙醇溶液的两个流。在一些实施方案中,vlp包含脂质组分,所述脂质组分含有或包含摩尔比为3:1至1:3的至少一种合成或基本上纯的磷脂酰胆碱(pc)类和至少一种合成或基本上纯的磷脂酰乙醇胺(pe),其特征在于酰基链具有4至18个碳原子,酰基链中不饱和键的总数是四个或更少。在一些实施方案中,使用了合成l,2-二油酰基-sn-甘油-3-磷酸胆碱(dopc)和合成l,2-二油酰基-s7-甘油-3-磷酸乙醇胺(dope)。在一些实施方案中,使用(例如与纯化抗原混合)dspe-peg2000(1,2二硬脂酰基-sn-甘油-3-磷酸乙醇胺-n[氨基(聚乙二醇)-2000](铵盐)或相关脂质来制备vlp。在一些实施方案中,脂质组分补充有固醇(诸如胆固醇)或固醇衍生物,其比率为总添加磷脂的0-30mol%。在一些实施方案中,vlp用以下制备,并且包含以下或由以下组成:合成或基本纯的组分。一些实施方案包括定义质量、纯度和化学结构的外源添加的非病毒磷脂物质。一些实施方案包括合成或基本纯的pc和/或pe物质。在一些实施方案中,通过将dopc、dope、胆固醇和dspe-peg2000组合来制备vlp。
[0266]
在一些实施方案中,以4:1与0.5:1之间的dope与dopc比率产生vlp。在一些实施方案中,添加固醇或固醇衍生物以增加sevlp的储存稳定性。固醇衍生物的实例包括胆固醇、胆固醇半琥珀酸酯、植物甾醇诸如羊毛甾醇、麦角固醇以及维生素d和维生素d相关化合物。在一些实施方案中,胆固醇相对于组合的dopc和dope的量是约20mol%。
[0267]
一些实施方案包括抗原与脂质的预定比率。本公开的一些实施方案的区别性特征是在微流体混合期间将抗原插入至sevlp的膜中。为了制备sevlp,将nanoassemblr
tm benchtop(precision nanosystems,inc.,温哥华,加拿大)与300μm交错人字形微混合器一起使用。在一些实施方案中,将脂质以预定比率溶解于甲醇或乙醇中,并且将抗原溶解于含有0.1%-10%辛基葡糖苷(正辛基-β-d-葡糖苷)(og)洗涤剂的pbs,10mm,ph 7.4水性缓冲液中。另一种洗涤剂是1,2-二己酰基-sn-甘油-3-磷酸胆碱(dcpc)。在一些实施方案中,在
形成sevlp前将具有跨膜结构域的抗原保持在洗涤剂中。在一些实施方案中,og和dcpc的临界胶束浓度(c.m.c.)分别为25mm和14mm。在一些实施方案中,使用低于5mm的c.m.c.来通过渗析除去洗涤剂。作为实例,用nanoassemblr
tm benchtop将水性缓冲盐水中的流感rha蛋白和15-20mmdcpc与乙醇中的dope、dopc、胆固醇和2-5mm dcpc混合,使得洗脱液稍微低于dspc的14mm c.m.c.。在一些实施方案中,这种快速洗涤剂除去导致脂质-洗涤剂和脂质-蛋白质洗涤剂胶束的同时聚结,导致脂质和蛋白质的直接共同重构,从而形成均匀的sevlp。在一些实施方案中,在没有洗涤剂的情况下,抗原的跨膜结构域形成聚集体,其在流感ha的情况下导致瓣状体形成。在一些实施方案中,这种聚集是不可逆的。在一些实施方案中,sevlp每mg重组流感膜蛋白包含200-500nmol dopc、600-1000nmol dope和约200-300nmol胆固醇。水性流与溶剂流之间的流速比率在1:1与5:1(水性:醇)之间,其中优选3:1比率。总流速是1-10ml/min。使用750kd切向流(tff)柱渗析膜(生物技术ce管,spectrum laboratories,美国)纯化和浓缩sevlp。
[0268]
在一些实施方案中,vlp(例如sevlp)具有窄的大小分布。在一些实施方案中,脂质囊泡或vlp具有在40至200nm、50nm至150nm或70nm至130nm范围内的直径(颗粒大小)。在一些实施方案中,脂质囊泡或vlp具有均匀的大小分布,其中少于15%或10%的vlp具有大于150nm的颗粒大小,并且少于15%或10%小于50nm。在一些实施方案中,模态直径低于90nm。在一些实施方案中,胆固醇降低对dopc的需要并且稳定化sevlp。
[0269]
在一些实施方案中,使用了vlp的微流体制备。在一些实施方案中,未通过超声处理制备vlp,和/或未通过渗析进行洗涤剂除去。在一些实施方案中,与通过超声处理或经渗析的洗涤剂除去制备的vlp、诸如evlp相比,vlp的微流体制备将大小变化严加控制为更均匀的大小。
[0270]
在所述方法的一个或多个步骤中或在其所有步骤中,在不使用洗涤剂的情况下制备一些vlp。在一些实施方案中,用基于聚合物的纳米盘产生vlp(例如smvlp)。在一些实施方案中,通过包括使用聚甲基丙烯酸酯(pma)共聚物的方法来制备smvlp。在一些实施方案中,使甲基丙烯酸酯共聚物模拟形成脂质双层纳米盘的天然载脂蛋白的两亲性螺旋结构。在一些实施方案中,将两亲性α-螺旋肽用于形成纳米盘。在一些实施方案中,这些蛋白质和肽的两亲性结构有益于形成脂质纳米盘。在一些实施方案中,为了模拟此类蛋白质或肽的两亲性质,使用包含疏水性和亲水性侧链的两亲性聚甲基丙烯酸酯无规共聚物来产生纳米盘形成聚合物。在一些实施方案中,它们的单体序列是无规的,但两亲性聚甲基丙烯酸酯无规共聚物在其与脂质双层相互作用后提供两亲性结构。在一些实施方案中,所得聚合物的疏水性甲基丙烯酸丁酯和阳离子甲基丙烯酰基胆碱氯化物(methacroylcholine chloride)分别与疏水性酰基链和阴离子磷酸根首基相互作用,以形成由聚合物包围的脂质纳米盘形成。在一些实施方案中,使用由偶氮二(异丁腈)(aibn)引发的自由基聚合来合成共聚物。在一些实施方案中,通过改变用作链转移剂的3-巯基丙酸甲酯的量来调整聚合物的分子量。在一些实施方案中,疏水性/阳离子比率随两种单体的进料比而变化。在一些实施方案中,通过在乙醚中的再沉淀纯化所得聚合物,此举在一些实施方案中提供了完全除去未反应单体的益处。
[0271]
在一些实施方案中,通过在通过挤出方法(luv的直径为100nm)制备的dmpc(1,2-二肉豆蔻酰基-sn-甘油-3-磷酸胆碱)的大单层囊泡上进行浊度测量来检查每种合成聚合
物溶解脂质的能力。在一些实施方案中,向dmpc囊泡中添加聚合物导致溶液浊度在许多情况下降低,反映了聚合物诱导的囊泡片段化并导致脂质纳米盘形成。在一些实施方案中,两亲性平衡的优化有益于获得高效的纳米盘形成聚合物。
[0272]
在一些实施方案中,纳米盘包含苯乙烯马来酸(sma)聚合物或共聚物或使用其形成。在一些实施方案中,将sma添加至合成或生物脂质膜导致纳米盘的自发形成。在一些实施方案中,此类聚合物结合的纳米盘包括得以保存的掺入脂质分子的双层组构。在一些实施方案中,使用sma的优点是sma聚合物直接从天然细胞膜环境中提取蛋白质的能力。根据脂质材料的来源,在一些实施方案中,将术语smalp用于来源于合成脂质体的颗粒,并且在一些实施方案中,将合成天然纳米盘用于指来自生物膜的分离物。在一些实施方案中,smalp的使用包括用洗涤剂分离膜蛋白,将膜蛋白插入至脂质体中,并且然后通过添加sma形成纳米盘。在一些实施方案中,此举具有脂质在体外定义的优点。在一些实施方案中,天然纳米盘系统将类似于洗涤剂的溶解粉末与小颗粒大小的纳米盘组合,同时保持使蛋白质稳定的被最小化扰动的天然脂质环境。
[0273]
在一些实施方案中,smalp由聚(苯乙烯-共-马来酸)(sma)制成。在一些实施方案中,将sma掺入至膜中并且自发形成smalp。在一些实施方案中,苯乙烯马来酸酐共聚物试剂使用2:1的苯乙烯与马来酸比率。在一些实施方案中,获得酸酐聚合物粉末并且使用水解转化为酸。在一些实施方案中,将苯乙烯马来酸酐共聚物溶解于1m naoh中。在一些实施方案中,在加热和回流溶液的同时进行反应。在一些实施方案中,之后在室温下冷却。在一些实施方案中,通过将ph降低至低于5(通过添加浓缩hcl)来沉淀苯乙烯马来酸酐共聚物。在一些实施方案中,将沉淀物用水洗涤三次,之后使用离心分离。在一些实施方案中,在第三洗涤结束时,将沉淀物重悬于0.6m naoh中。在一些实施方案中,将溶液再次沉淀和洗涤,并且重悬于0.6m naoh中。在一些实施方案中,然后将ph调整至ph 8。在一些实施方案中,聚合物是冻干的。在一些实施方案中,将苯乙烯马来酸酐共聚物添加至脂质的悬浮液。在一些实施方案中,sma与脂质双层相互作用,从而自组装为smalp。
[0274]
在一些实施方案中,当用作将抗原呈递至免疫系统的vlp时,纳米盘技术提供了膜vlp(mvlp)的mvlp谱(从来源于细胞的天然mvlp到其中将外源性脂质补充至脂质混合物的半合成半合成mvlp,到其中所有脂质被定义并且在体外供应的完全smvlp。
[0275]
在一些实施方案中,dibma或sma提供了直接从天然细胞膜中提取膜蛋白的能力。在一些实施方案中,(例如当本文所述的vlp包含通过重组dna方法产生的流感ha、na或m2抗原时),这简化了疫苗纳米盘形成。在一些实施方案中,将dibma直接添加至细胞膜以提取嵌入蛋白质表达系统的膜中的通过重组方法产生的疫苗抗原。在一些实施方案中,dibma从anatace获得。在一些实施方案中,包含dibma的纳米盘的抗原在例如抗原的c末端包含his标签。在一些实施方案中,通过imac色谱法纯化抗原和/或dibma纳米盘。在一些实施方案中,纳米盘包含嵌入由dibma带限定的生产者细胞的平坦脂质膜中的抗原(例如ha)。在一些实施方案中,dibma补充有dmpc(1,2-二肉豆蔻酰基-sn-甘油-3-磷酸胆碱)。在一些实施方案中,这种补充提供了改善抗原从生产者细胞中的提取的益处。在一些实施方案中,vlp包含天然纳米盘。在一些实施方案中,纳米盘是合成或半合成的。
[0276]
在一些实施方案中,包括了载体,其包含编码抗原的核酸分子,所述抗原包括重组肽。在一些实施方案中,载体是用于表达重组多肽的任何合适的载体,诸如哺乳动物表达载
体。在一些实施方案中,载体是pcaggs表达载体或pfastbacl杆状病毒转移载体质粒。在一些实施方案中,使用用于转染或杆状病毒表达的任何表达载体。在一些实施方案中,载体包含与编码重组肽的核酸序列可操作地连接的启动子。在特定实例中,启动子是cmv或sv40启动子。
[0277]
a.哺乳动物细胞中的抗原产生
[0278]
用于与本文所述的疫苗和方法一起使用的抗原通过任何合适的方法制备。在一些实施方案中,将编码所需抗原(诸如ha蛋白或na蛋白)的核酸分子在一些实施方案中连同编码流感基质蛋白的核酸分子各自克隆至表达质粒(例如,pcaggs)中。在一些实施方案中,将抗原m1、m2、na和/或ha编码序列经密码子优化以在哺乳动物细胞中表达。在一些实施方案中,将所得载体连同含有基质蛋白的载体转染至细胞中。在一些实施方案中,从与ha或na相同的载体表达基质蛋白。在一些实施方案中,转染是瞬时转染。在一些实施方案中,细胞包括293细胞、vero细胞、a549细胞、cho细胞等。
[0279]
在一些实施方案中,将细胞在允许抗原被细胞表达的条件下孵育。在一些实施方案中,将哺乳动物细胞在37℃下孵育约72小时。在一些实施方案中,将蛋白质通过本领域技术人员熟知的标准技术纯化。
[0280]
在一些实施方案中,通过蛋白质印迹或其他定量免疫测定、bradford测定,并且在ha的情况下通过fda批准的效力测试单径向免疫测定(srid)测试来确定蛋白质的量。
[0281]
b.昆虫细胞中的抗原产生
[0282]
在一些实施方案中,抗原在昆虫细胞中产生。在一些实施方案中,核酸分子编码抗原。在一些实施方案中,连同编码流感基质蛋白的核酸分子各自克隆至杆状病毒转移载体质粒(例如,pfastbacl,invitrogen,卡尔斯巴德,加利福尼亚州)中。在一些实施方案中,从与ha或na相同的杆状表达转移载体表达基质蛋白。在一些实施方案中,抗原ha、na、m1和/或m2的表达在加洲苜蓿夜蛾核多角体病毒(autographa californica multiple nuclear polyhedrosis virus)(acmnpv)多角体蛋白启动子的转录控制下。在一些实施方案中,将抗原m1、m2、na和/或ha编码序列经密码子优化以在昆虫细胞中表达。在一些实施方案中,每种重组杆状病毒构建体是噬斑纯化的,并且制备母种子储备液,针对身份表征,并且用于制备工作病毒储备液。在一些实施方案中,通过使用快速滴度试剂盒(例如,bacpak杆状病毒快速滴度试剂盒;clontech,山景城,加利福尼亚州)来确定杆状病毒母储备液和工作储备液的滴度。
[0283]
在一些实施方案中,将昆虫细胞诸如草地粘虫(s.frugiperda)sf9昆虫细胞(atcc crl-1711)维持为在27
±
2℃下的在昆虫无血清培养基(例如,hyq-sfx hyclone,logan,utah)中的悬浮培养物。在一些实施方案中,重组杆状病毒储备液通过以下方式来制备:将细胞以《0.01噬斑形成单位(pfu)/细胞的低感染复数(moi)感染,并且在感染后68-72h(hpi)收获。
[0284]
在一些实施方案中,使用所得含有抗原杆状病毒载体来感染细胞。在一些实施方案中,连同含有基质蛋白的杆状病毒载体。在一些实施方案中,将约2-3x106个细胞/ml用含有抗原的杆状病毒载体感染。将所得感染细胞在连续搅拌下在27
±
2℃下孵育,并且约68-72hpi收获,例如通过离心(例如,4000xg,持续15分钟)。在一些实施方案中,通过本领域已知的标准方法纯化抗原。
[0285]
viii.使用方法
[0286]
在某些实施方案中,本文公开了预防疾病、降低疾病的发生率和/或降低疾病的严重程度的方法,其包括:向有需要的受试者施用如本文所述的疫苗。在某些实施方案中,本文公开了预防疾病的方法,其包括:向有需要的受试者施用如本文所述的疫苗。在某些实施方案中,本文公开了降低疾病的发生率的方法,其包括:向受试者施用如本文所述的疫苗。在某些实施方案中,本文公开了降低疾病的严重程度的方法,其包括:向受试者施用如本文所述的疫苗。
[0287]
在一些实施方案中,所述方法包括向受试者施用如本文所述的vlp(例如sevlp或smvlp)。在一些实施方案中,所述施用预防疾病的严重程度。在一些实施方案中,所述施用降低疾病的发生率。在一些实施方案中,所述施用降低疾病的严重程度。在一些实施方案中,所述施用预防疾病、降低疾病的发生率和/或降低疾病的严重程度。在一些实施方案中,所述方法包括预防疾病、降低疾病的发生率或降低疾病的严重程度。在一些实施方案中,所述方法包括向受试者施用如本文所述的疫苗,其中所述施用预防疾病、降低疾病的发生率或降低疾病的严重程度。
[0288]
在所述方法的一些实施方案中,所述疾病是感染。在一些实施方案中,所述疾病包括细菌、真菌或病毒感染。在一些实施方案中,所述病毒感染包括流感感染。在一些实施方案中,所述受试者是哺乳动物或人受试者。
[0289]
在某些实施方案中,本文公开了用于预防疾病、降低疾病的发生率或降低疾病的严重程度的方法,其包括:向受试者施用所述疫苗,其中所述施用预防所述疾病、降低所述疾病的发生率或降低所述疾病的严重程度。在一些实施方案中,所述疾病是感染。在一些实施方案中,所述疾病是细菌、真菌或病毒感染。在一些实施方案中,所述病毒感染是流感感染。在一些实施方案中,所述受试者是哺乳动物或人受试者。
[0290]
在一些实施方案中,所述施用包括通过一个或多个针或微针的施用。在一些实施方案中,所述施用包括通过预成形液体注射器的施用。在一些实施方案中,所述施用包括鼻内、皮内、肌肉内、皮肤贴片、局部、口服、皮下、腹膜内、静脉内或鞘内施用。在一些实施方案中,所述施用包括施用1pg、10pg、25pg、100pg、250pg、500pg、750pg、1ng、5ng、10ng、15ng、20ng、25ng、50ng、100ng、250ng、500ng、1μg、10μg、50μg、100μg、500μg、1mg、5mg、10mg、50mg、100mg、500mg或1g剂量或由前述剂量中的任两者定义的剂量范围的所述疫苗。在一些实施方案中,通过每个微针施用100pl-20nl的所述疫苗。在一些实施方案中,通过每个微针施用5-20nl的所述疫苗。在一些实施方案中,通过每个微针施用10-20nl的所述疫苗。
[0291]
a.施用方法
[0292]
通过合适的方法向受试者施用所公开的疫苗中的任一种。合适的施用方法包括但不限于皮内、肌肉内、腹膜内、肠胃外、静脉内、全身性、皮下、粘膜、阴道、直肠、鼻内、吸入或口服。在一些实施方案中,肠胃外施用诸如皮下、静脉内或肌肉内施用通过注射实现。在一些实施方案中,注射剂以常规形式制备,作为液体溶液或悬浮液、适于在注射前溶解或悬浮于液体中的固体形式、或作为乳液。在一些实施方案中,注射溶液和悬浮液由无菌粉末、颗粒、片剂等制备。在一些实施方案中,所述施用是全身性的。在一些实施方案中,所述施用是局部的。在一些实施方案中,将本文提供的疫苗配制用于粘膜疫苗接种,诸如用于口服、鼻内、肺部、直肠和阴道接种。在具体实例中,这是通过鼻内施用来实现。在一些实施方案中,
所述施用包括施用如本文所述的疫苗,所述疫苗包含糖玻璃。在一些实施方案中,糖玻璃包括海藻糖。
[0293]
在一些实施方案中,所述施用包括通过预成形液体注射器施用。在一些实施方案中,所述施用包括通过一个或多个针或微针施用。在一些实施方案中,通过每个微针施用100pl-20nl的所述疫苗。在一些实施方案中,所述施用包括鼻内、皮内、肌肉内、皮肤贴片、局部、口服、皮下、腹膜内、静脉内、全身性或鞘内施用。
[0294]
在一些实施方案中,所述施用包括在用针或微针注射疫苗前,用擦拭物在施用位点擦涂或擦拭受试者的皮肤。在一些实施方案中,擦拭物是清洁擦拭物。在一些实施方案中,擦拭物是咪喹莫特擦拭物。在一些实施方案中,将咪喹莫特擦拭物在受试者的施用位点擦涂至受试者的皮肤中,使得在用微针装置将疫苗注射至施用位点中之前将咪喹莫特擦涂至待疫苗接种的位点处的皮肤中。
[0295]
一些实施方案包括微针施用。一些实施方案包括皮肤贴片施用。一些实施方案包括微针皮肤贴片施用。在一些实施方案中,将微针放置于受试者的清洁皮肤上并压入皮肤中。在一些实施方案中,微针皮肤贴片包含液体分配步骤中加载在微针上或之中的疫苗剂量。在一些实施方案中,使用了10-20nl/微针的微流体分配。
[0296]
在一些实施方案中,疫苗在每个微针内部的孔中干燥。在一些实施方案中,这使微针足够尖锐以使得以低于10牛顿的轻力就能成功递送。在一些实施方案中,疫苗在每个微针外部干燥。在一些实施方案中,将微针阵列用于施用。
[0297]
在一些实施方案中,将疫苗包装至微针上。在一些实施方案中,将疫苗包装或嵌入至微针中。在一些实施方案中,疫苗在包装至微针中或微针上之后脱水。在一些实施方案中,微针以单位剂量的疫苗单独包装。在一些实施方案中,单位剂量在受试者中有效诱导对抗原的免疫应答。在一些实施方案中,单位剂量在室温下储存至少约一周(例如,约或多于约1、2、3、4、6、8、12周或更多周)后在受试者中有效诱导对抗原的免疫应答。在一些实施方案中,单位剂量在室温下储存至少约一个月(例如,约或多于约1、2、3、4、5、6、8、10、12个或更多个月)后在受试者中有效诱导对抗原的免疫应答。在一些实施方案中,疫苗以在受试者中有效诱导对抗原的免疫应答的量存在。在一些实施方案中,微针施用是无痛的。
[0298]
在一些实施方案中,疫苗抗原以每剂量的抗原量表示。在一些实施方案中,剂量具有100μg抗原或总蛋白(例如,1-100μg,诸如约1μg、5μg、10μg、25μg、50μg、75μg或100μg)。在一些实施方案中,在低得多的水平(例如,1μg/剂量、100ng/剂量、10ng/剂量或1ng/剂量)下观察到表达。
[0299]
在一些实施方案中,在疫苗接种之前用佐剂预治疗受试者。在一些实施方案中,佐剂是咪喹莫特。
[0300]
b.施用时间安排
[0301]
在一些实施方案中,所述方法包括如本文所述的疫苗的多次施用或剂量。在一些实施方案中,所公开的疫苗以单一剂量或多个剂量(例如,增强剂)施用。在一些实施方案中,第一次施用后进行第二次施用。在一些实施方案中,第二次施用使用与所施用的疫苗相同或不同的疫苗进行。在一些实施方案中,第二次施用使用与所施用的第一疫苗相同的疫苗进行。在一些实施方案中,第二次施用使用包含与所施用的第一疫苗不同的vlp(例如sevlp或smvlp)的疫苗。在一些实施方案中,如果第一疫苗包含第一ha亚型和第二ha亚型,
则第二疫苗包含第三ha亚型和第四ha亚型,其中所有四种亚型是不同的(诸如h1、h2、h3、h5、h7和h9中的四种)。
[0302]
在一些实施方案中,含有两种或更多种vlp的疫苗以多个剂量、诸如2、3、4、5、6、7、8、9或10个剂量(诸如2-3个剂量)施用。在一些实施方案中,剂量之间的时间安排是至少1周、至少2周、至少3周、至少4周、至少6周、至少8周、至少12周、至少2个月、至少3个月、至少4个月、至少5个月、至少6个月、至少1年、至少2年或至少5年,诸如1-4周、2-3周、1-6个月、2-4个月、1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、12周、1个月、2个月、3,个月、4,个月、5个月、6个月、1年、2年、5年或10年或其组合(诸如当有至少三次施用时,其中第一剂量和第二剂量以及第二剂量和第三剂量之间的时间安排在一些实施方案中相同或不同)。
[0303]
c.剂量
[0304]
在一些实施方案中,所述方法包括施用1pg、10pg、25pg、100pg、250pg、500pg、750pg、1ng、5ng、10ng、15ng、20ng、25ng、50ng、100ng、250ng、500ng、1μg、10μg、50μg、100μg、500μg、1mg、5mg、10mg、50mg、100mg、500mg或1g剂量或由前述剂量中的任两者定义的剂量范围的所述疫苗或vlp(例如sevlp或smvlp)。
[0305]
在一些实施方案中,向受试者施用(例如,静脉内或全身性)约1至约100μg的每种vlp,诸如约1μg至约50μg、1μg至约25μg、1μg至约5μg、约5μg至约20μg或约10μg至约15μg的每种vlp。在一些实施方案中,向受试者施用约15μg的每种vlp。在一些实施方案中,向受试者施用约10μg的每种vlp。在一些实施方案中,向受试者施用约20μg的每种vlp。在一些实施方案中,向受试者施用约1μg或2μg的每种vlp。
[0306]
在一些实施方案中,施用至受试者的剂量足以随时间诱导受试者中的有益的治疗性应答或足以抑制或预防感染。在一些实施方案中,剂量因受试者而不同,或者根据受试者的种类、年龄、体重和一般状况,待治疗的感染的严重程度和/或所用的特定疫苗及其施用方式来施用。
[0307]
d.测量免疫应答的方法
[0308]
一些实施方案包括测量免疫应答。一些实施方案包括用于确定本文所公开的疫苗是否引发或刺激免疫应答(诸如实现成功免疫)的方法。尽管在本文中提供了示例性测定,但本公开不限于使用特定测定。
[0309]
在一些实施方案中,在施用本文提供的疫苗后,进行一种或多种测定以评估所得的免疫应答。在一些实施方案中,还在施用疫苗前进行测定,和/或以充当基线或对照。在一些实施方案中,在施用疫苗后从受试者收集样品,诸如血液或血清样品。在一些实施方案中,样品在第一次疫苗施用之后至少1周、至少2周、至少3周、至少4周、至少5周、至少6周或至少8周(诸如1、2、3、4、5、6、7、8、9、10、11或12周)收集。在一些实施方案中,例如在后续疫苗施用后,也可以获得随后的样品。
[0310]
1.血凝滴度测定
[0311]
在一些实施方案中,在产生或纯化本文提供的疫苗后,进行血凝素滴度测定。在一些实施方案中,进行此类测定以测量或评价血凝单位(hau)。在一些实施方案中,将该测定用于评价vlp(例如sevlp或smvlp)呈递功能性ha三聚体,并且在一些实施方案中,用于定量vlp制剂中的ha蛋白。血凝素滴度也用于定量用作攻击病毒的流感病毒的量,或例如用于定量被攻击动物的肺或呼吸道中存在的病毒的量(滴定)。在一些实施方案中,疫苗接种受试
者与模拟疫苗接种受试者相比显示出病毒滴度降低。
[0312]
在一些实施方案中,将测定用于定量vlp的量或另外定量样品中病毒的量,所述样品诸如来自病毒攻击的受试者的肺样品,所述受试者预先施用了本文提供的疫苗。在一些实施方案中,将疫苗系列稀释(例如,2倍,从1:4至1:4096)并且然后添加至含有红细胞(rbc)的孔。在一些实施方案中,将rbc溶液(诸如0.75%至1%rbc)添加至孔。在一些实施方案中,然后将混合物在室温下孵育30min,这使得rbc沉降。在一些实施方案中,然后分析样品的所得凝集模式,例如通过检查其中放置了样品的微量滴定孔。例如,在放置在其边缘的微量滴定板中,rbc对照孔中的rbc将流成特征性泪珠形状(不存在流感病毒,因此无凝集)。在一些实施方案中,含有流感病毒的孔将rbc凝集至不同程度。在一些实施方案中,具有最大量病毒的孔将呈现浑浊,因为病毒交联了所有的红细胞,从而阻止其沉淀。在一些实施方案中,接下来的孔中较少量的病毒导致部分凝集,但沉淀物将不类似于rbc对照孔中的沉淀物那样流成泪珠形状。在一些实施方案中,将终点确定为导致rbc完全凝集的疫苗的最大稀释度。
[0313]
在一些实施方案中,确定待滴定样品中的血凝单位(hau)数。ha滴度是显示rbc完全凝集的系列中最后一个孔的稀释度的倒数(例如,如果最后一个稀释度是1:640,则样品的滴度是640ha单位/5μl样品)。
[0314]
2.血凝抑制(ha1)测定
[0315]
在一些实施方案中,在施用本文提供的疫苗后,进行血凝抑制(ha1)测定。在一些实施方案中,流感病毒凝集红细胞,这是一种称为血凝的过程。在一些实施方案中,在针对表面血凝素的特异性抗体的存在下,血凝被阻断。在一些实施方案中,该现象提供了ha1测定的基础,所述测定用于检测和定量血清中的特异性抗病毒抗体。因此,ha1测量了阻断ha受体结合的抗体的存在(如通过rbc的血凝所评估的)。
[0316]
在一些实施方案中,在37℃下用受体破坏酶(rde)处理待评价针对血凝素头部的抗体的存在的血清过夜。在一些实施方案中,次日,通过在56℃下孵育1小时将rde灭活。在一些实施方案中,所用的测定板是96孔无菌的未经组织培养处理的圆底微量滴定板。在一些实施方案中,从b行到g行沿着板向下对每个样品进行两倍连续稀释。将50μl的病毒抗原(设定的hau数)的工作稀释液添加至微量滴定板的所有孔,h行(rbc对照孔)和抗原对照孔除外。在一些实施方案中,将板在室温下孵育30min。将在pbs中的50μl 1%rbc悬浮液添加至所有孔,并且将板在室温下孵育30至45min。在一些实施方案中,分析微量滴定板以读取凝集模式。在一些实施方案中,阴性对照孔(那些含有无抗流感抗体的正常血清的孔)将呈现浑浊,因为流感病毒已完全凝集rbc。在一些实施方案中,只要有足够的抗流感抗体来抑制凝集,阳性对照孔(那些含有已知抗流感抗血清的孔)将具有外观类似于h行对照沉淀物的rbc沉淀物。在一些实施方案中,随着血清稀释度增加,抗体的量将减少使得rbc凝集量的增加将变得明显。在一些实施方案中,每个血清样品的血凝抑制(ha1)滴度是完全抑制rbc凝集的最大稀释度(即形成rbc沉淀物的稀释系列中的最后一个孔)的倒数。在一些实施方案中,每个样品的ha1滴度是其一式两份稀释系列的终点滴度的平均值。在一些实施方案中,如果一式两份的滴度相差超过两倍稀释,则可以对该样品重复进行ha1滴定。
[0317]
3.流感病毒中和测定
[0318]
在一些实施方案中,在施用本文提供的疫苗后,进行中和测定。在一些实施方案
中,将来自接受了本文提供的疫苗的受试者的血清样品稀释,添加流感病毒,并且确定阻止病毒生长所需的血清量。在一些实施方案中,中和评估了抑制病毒复制的抗体的存在。在一些实施方案中,针对ha茎部的抗体例如中和病毒复制,但不影响血凝,因为表位不在受体结合结构域的周围。在一些实施方案中,结合头部并抑制血凝的抗体通常是中和的。
[0319]
在一些实施方案中,将血清样品在组织培养基(诸如含有抗生素的dmem/5%fbs)中,例如在96孔圆底经组织培养处理的微量滴定板中孵育。在一些实施方案中,将血清样品系列稀释,例如在微孔板的一式两份相邻孔中系列稀释(例如最初以1:10稀释至1:640的样品稀释度)。在一些实施方案中,可以将先前滴定的流感病毒(任何亚型)稀释至含有1tcid
50/50
μl。在一些实施方案中,将等量的工作储备病毒(诸如约50tcid
50
)添加至每个血清样品(包括系列稀释液),并且在37℃下孵育1小时。在一些实施方案中,使用此方案,如果病毒的最终量在10至100tcid
50
之间,则获得相同的中和滴度。在一些实施方案中,在孵育后,将含有2.5x105个mdck细胞/ml(或其他细胞)的组织培养基(诸如具有抗生素的dmem/5%fbs)添加至血清样品(例如,添加至微量滴定板的所有孔)。在一些实施方案中,将其在加湿的37℃、5%co2培养箱中孵育过夜。在一些实施方案中,一些流感病毒在34
°
至35℃的温度下生长得更好,因此使用了这些温度。在一些实施方案中,除去培养基,并且更换为含有胰蛋白酶(诸如0.0002%)的组织培养基(诸如具有抗生素的dmem),并且将混合物在加湿的37℃、5%co2培养箱中孵育4天。在一些实施方案中,随后,添加无菌的0.5%rbc/pbs溶液,并且将混合物在4℃孵育1小时,并且检查孔中凝集的存在。在一些实施方案中,特定血清样品的病毒中和滴度定义为其中两个孔均不显示rbc凝集的血清最高稀释度的倒数。
[0320]
在一些实施方案中,含有足够浓度的流感病毒中和抗体的样品(例如,在微孔中)将阻止病毒感染细胞,因此不会发生病毒繁殖。在一些实施方案中,向这些孔中添加rbc将导致形成rbc沉淀物。相比之下,在一些实施方案中,没有抗流感抗体或具有低于中和浓度的抗流感抗体的样品(例如,在微孔中)在4天孵育结束时将存在流感病毒。在一些实施方案中,添加至这些样品的rbc将凝集。在一些实施方案中,流感病毒使红细胞交联,抑制了它们在微孔中的沉降,因此这些孔呈现浑浊。
[0321]
4.神经氨酸酶抑制(ni)抗体滴度测定
[0322]
在一些实施方案中,如果疫苗含有na蛋白,则确定神经氨酸酶抑制(ni)抗体滴度。在一些实施方案中,为了测量ni抗体滴度,产生含有适当的na的重配病毒,例如通过使用基于质粒的反向遗传学。在一些实施方案中,适当的na是施用至受试者的疫苗中存在的相同na。在一些实施方案中,使用胎球蛋白作为na底物进行ni测定。示例性方法在下文中提供。
[0323]
在一些实施方案中,ni滴度是提供了至少50%的na活性抑制的血清最大稀释度的倒数。在一些实施方案中,预期使用本文所公开的vlp将降低或者甚至消除接受vlp的受试者中的攻击病毒滴度。在一些实施方案中,与未接受vlp的受试者(例如,模拟疫苗接种的)相比,接受vlp的受试者预期在肺中具有少至少10倍、至少20倍、至少50倍或甚至100倍的病毒。
[0324]
在一些实施方案中,在使用过氧化物酶标记的花生凝集素(pna-po)结合脱唾液酸化胎球蛋白的酶联凝集素测定中确定ni抗体滴度。在一些实施方案中,通过在胎球蛋白包被的微量滴定板上孵育纯化的全长na的系列稀释液来确定na活性。在一些实施方案中,在室温下孵育30min后,洗涤板并且添加pna-po。在一些实施方案中,在室温下孵育1h后,再次
洗涤板,并且添加过氧化物酶底物3,3',5,5'-四甲基联苯胺,并且使显色进行10min。在一些实施方案中,停止显色,并且测量板的od450。在一些实施方案中,确定对应于95%na活性的稀释度。
[0325]
在一些实施方案中,可以从1:20的血清稀释度开始测量针对na亚型的ni滴度,之后在96孔u型底组织培养板中进行2倍系列稀释。在一些实施方案中,将对应于95%最大活性的na添加至稀释的血清中,并且在室温下孵育30min,然后将血清/na样品转移至胎球蛋白包被的微量滴定板中。在一些实施方案中,将板在37℃下孵育2h,洗涤并且添加pna-po。在一些实施方案中,将板在室温下再孵育1小时,洗涤并且添加过氧化物酶底物tmb。在一些实施方案中,10min后停止显色,并且测量板的od450。在一些实施方案中,ni滴度是抑制50%na活性时的倒数稀释度。在一些实施方案中,测定的定量下限是20;低于20的滴度被认为是阴性的,并且分配10的值。在一些实施方案中,良好或阳性应答产生》30的值,而不良应答或无应答产生《20的值。
[0326]
5.病毒肺滴度和病理
[0327]
在一些实施方案中,确定病毒的肺滴度和病理。在一些实施方案中,将组织样品(诸如肺样品(例如,充气的肺样品))固定(例如,在10%甲醛中固定24h),包埋(例如,在石蜡中),切片(例如,1至10μm,诸如5μm),并且安装。
[0328]
在一些实施方案中,通过使用适当抗体的免疫组织化学来评价流感病毒抗原分布。在一些实施方案中,抗体是对用于攻击受试者的病毒具有特异性的多克隆抗体或单克隆抗体,或者是对不同流感病毒株系具有交叉反应性的多克隆抗体或单克隆抗体。在一些实施方案中,预期使用本文所公开的疫苗将降低或者甚至消除接受疫苗的受试者中的病毒滴度。在一些实施方案中,与未接受疫苗的受试者(例如,模拟疫苗接种的)相比,接受疫苗的受试者预期在肺中具有少至少10倍、至少20倍、至少50倍或甚至100倍的病毒。在一些实施方案中,预期使用本文所公开的疫苗将在接受疫苗的受试者中减少或甚至消除流感感染的症状,诸如支气管炎、细支气管炎、肺泡炎和/或肺水肿。在一些实施方案中,与未接受疫苗的受试者(例如,模拟疫苗接种的)相比,接受疫苗的受试者预期具有少至少20%、至少50%、至少75%或至少90%的支气管炎、细支气管炎、肺泡炎和/或肺水肿(或这些症状严重程度的此类降低)。在一些实施方案中,vlp是多价的。
[0329]
6.其他示例性测定
[0330]
在一些实施方案中,评估受试者的呼吸道iga和/或全身性igg、t-细胞应答。在一些实施方案中,通过转录组学和细胞因子elisa或其他细胞因子免疫测定分析免疫应答。在一些实施方案中,通过微量中和分析免疫应答。在一些实施方案中,通过抗ha茎部测定分析免疫应答。
[0331]
e.评价疫苗的方法
[0332]
在某些实施方案中,本文公开了用于确定疫苗的有效性的方法。一些实施方案包括获得从已经施用了疫苗的受试者获得的样品,所述样品包含存在的或一定量的病毒。一些实施方案包括提供包含能够结合病毒蛋白的ace2或其片段的基底。一些实施方案包括使所述基底与所述样品接触以使所述样品中的病毒或蛋白病毒结合所述ace2或其片段。一些实施方案包括检测与所述基底的所述ace2或其片段结合的病毒或蛋白病毒。一些实施方案包括基于所检测到的与所述基底的所述ace2或其片段结合的病毒或蛋白病毒确定所述样
品中所述病毒的存在或量,从而确定所述疫苗的有效性。在一些实施方案中,所述样品来自受试者。在一些实施方案中,所述样品包括血液、血清或血浆。在一些实施方案中,所述病毒是冠状病毒。在一些实施方案中,所述病毒是sars-cov-2。在一些实施方案中,所述病毒蛋白是sars-cov-2刺突蛋白。在一些实施方案中,与向所述受试者施用所述疫苗之前从所述受试者获得的另一样品相比,所述样品中病毒的量减少。在一些实施方案中,与向所述受试者施用所述疫苗之前从所述受试者获得的另一样品相比,所述样品中病毒的量增加。一些实施方案进一步包括基于所述样品中所述病毒的量或所述疫苗的有效性来向所述受试者推荐或提供病毒治疗。在一些实施方案中,所述病毒治疗包括冠状病毒治疗、诸如covid-19治疗。在一些实施方案中,所述疫苗是本文所述的疫苗,诸如包含vlp的疫苗。
[0333]
在某些实施方案中,本文公开了用于确定疫苗的有效性的方法,其包括:获得从已经施用了疫苗的受试者获得的样品,所述样品包含存在的或一定量的抗病毒抗体。一些实施方案包括提供包含能够结合所述抗病毒抗体的病毒蛋白或其片段的基底。一些实施方案包括使所述基底与所述样品接触以使所述样品中的抗病毒抗体结合所述病毒蛋白或其片段。一些实施方案包括检测与所述基底的所述病毒蛋白或其片段结合的抗病毒抗体。一些实施方案包括基于所检测到的与所述基底的所述病毒蛋白或其片段结合的抗病毒抗体确定所述样品中所述抗病毒抗体的存在或量,从而确定所述疫苗的有效性。在一些实施方案中,所述样品来自受试者。在一些实施方案中,所述样品包括血液、血清或血浆。在一些实施方案中,所述病毒是冠状病毒。在一些实施方案中,所述病毒是sars-cov-2。在一些实施方案中,所述病毒蛋白是sars-cov-2刺突蛋白。在一些实施方案中,与向所述受试者施用所述疫苗之前从所述受试者获得的另一样品相比,所述样品中抗病毒抗体的量减少。在一些实施方案中,与向所述受试者施用所述疫苗之前从所述受试者获得的另一样品相比,所述样品中抗病毒抗体的量增加。一些实施方案进一步包括基于所述样品中所述抗病毒抗体的量或所述疫苗的有效性来向所述受试者推荐或提供病毒治疗。在一些实施方案中,所述病毒治疗包括冠状病毒治疗、诸如covid-19治疗。在一些实施方案中,所述疫苗是本文所述的疫苗,诸如包含vlp的疫苗。
[0334]
ix.实施例
[0335]
包括以下实施例仅出于说明目的,并不旨在限制本发明的范围。
[0336]
实施例1:vlp疫苗的使用
[0337]
在实验动物中选择最佳的广泛交叉反应性vlp(例如sevlp或smvlp)疫苗之后,将在人中用多价流感sevlp(例如,使用诸如来自paragon bioservice(巴尔的摩,马里兰州)的良好制造规范(gmp)生产)进行研究。在一些实施方案中,vlp还含有m1和m2。在一些实施方案中,多价vlp还含有mpl作为佐剂。
[0338]
将使用gmp方法产生包含单独呈递h1、h2、h3、h5、h7和h9的ha vlp和单独呈递n1和n2的na vlp的混合物的多价疫苗配制品,并且将其通过微注射施用至人。在一些实施方案中,测试了未在本文中描述的其他多价流感疫苗。
[0339]
简而言之,用包含海藻糖玻璃的vaxipatch微针阵列通过微针注射对人进行疫苗接种,所述海藻糖玻璃具有vlp(每种ha/na为10μg-20μg,诸如15μg)的多价混合物。在约3-12周后(诸如3、4、5、6、7、8、9、10、11或12周后),用相同混合物对人进行加强。对第二组人进行模拟疫苗接种(例如,用生理盐水)。在一些实施方案中,获得并储存血液样品。在研究过
程中监测患者的任何不良事件(ae)。由于vlp疫苗无感染性,因此预期它们具有优异的安全性概况。
[0340]
vlp在i期试验中显示为安全的,并且使用如在nih临床中心开发的人流感攻击模型进行ii期功效试验(例如,参见memoli等人,validation of a wild-type influenza a human challenge model:h1n1pdmist,an a(h1n1)pdm09 dose finding ind study)。对受试者进行健康状况筛选,并且通过ha1测定针对攻击2009年大流行h1n1病毒的低滴度(《1:10)进行筛选。通过如所述的微针注射对筛选出的参加本研究的患者用vlp的多价混合物进行疫苗接种(队列1)或者给予用生理盐水的模拟疫苗接种(队列2)。在三周时对他们进行加强,且然后在6周时通过ha1或其他测定来评估其血清学滴度,并且将受试者用在攻击前ha1滴度《1:10的》60%受试者中经验证诱导流感疾病并脱落的病毒剂量进行攻击。通过对疫苗接种的血清学应答的发展、症状减轻、病毒滴度降低和/或病毒脱落持续时间减少来评估疫苗效力。
[0341]
实施例2:针对流感的疫苗接种
[0342]
通过微针注射(以诱导全身性免疫)用单价ha sevlp或用单价ha smvlp疫苗接种的大鼠被保护而免受异源致命性流感攻击。另外,在tlr激动剂作为佐剂的情况下疫苗接种的大鼠与接受不包含佐剂的类似疫苗的那些相比表现出降低的发病率。在一些情况下,多价sevlp或smvlp混合物针对致命性甲型流感病毒、诸如1918h1n1、1957h2、2004h5n1和2013h7n9进行保护。
[0343]
实施例3:非限制性示例性方法
[0344]
克隆、表达和蛋白质纯化:合成抗原的基因序列并且将其克隆在ndel与bamh1限制性位点之间的表达载体pet-28a( )中。通过测序确认克隆。将构建体经密码子优化以在大肠杆菌中表达。
[0345]
蛋白质在大肠杆菌bl21(de3)细胞中过表达,并且将其从细胞培养裂解物的可溶性级分中纯化。将用包含编码感兴趣抗原的核酸的质粒转化的大肠杆菌bl21(de3)的单一菌落接种至50ml tartoff-hobbs hiveg.tm.培养基(himedia)中。将原代培养物在37℃下生长过夜。将2l tartoff-hobbs hiveg培养基(500ml x 4)(himedia)接种1%的原代接种物,并且在37℃下生长直至od
600
达到约0.6-0.8。然后用1mm异丙基-β-硫代半乳吡喃糖苷(iptg)诱导细胞,并且在20℃下再生长12-16小时。以5000g收获细胞并且并将其重悬于100ml的磷酸盐缓冲盐水(pbs,ph 7.4)中。将细胞悬浮液通过在冰上的超声处理进行裂解,且随后以14,000g离心。在4℃下在促进结合的轻度混合条件下将上清液与缓冲液平衡的ni-nta树脂(ge healthcare)一起孵育2小时。在重力流下使用咪唑梯度(在pbs,ph 7.4中)洗脱蛋白质。合并含有感兴趣蛋白质或抗原的级分,并且在含有1mm edta的pbs(ph 7.4)中渗析。将渗析的蛋白质在amicon(millipore)搅拌的细胞装置中浓缩至终浓度为约1mg/ml。通过sds-page评估蛋白质纯度并且通过esi-ms确认其身份。在一些实施方案中,使用表达系统特异性启动子或编码多肽或抗原的密码子优化的dna序列,在除了大肠杆菌的其他表达系统(诸如酵母、植物和动物)中产生多肽和抗原。
[0346]
免疫和攻击研究:使用了雌性sprague dawley大鼠(4-5周龄)。在第0天(初免)和/或第28天(加强),用20μg测试免疫原连同100μg cpg7909佐剂(trilink biotechnologies,圣地亚哥,加利福尼亚州)通过肌肉内对大鼠(10只/组)进行免疫。使用原初(仅缓冲液)大
鼠和/或佐剂治疗的大鼠用作对照。在初免后21天和/或在加强后14天,将从大鼠由尾静脉静脉穿刺获得的血清样品收集在microotainer血清分离管中(bd biosciences,富兰克林湖,新泽西州)。在初次和/或二次免疫后21天,将大鼠用氯胺酮/甲苯噻嗪麻醉,并且用ild
90
的在20μl pbs中的大鼠适应的病毒通过鼻内进行攻击。为了测试针对较高剂量的病毒的保护,用2ld
90
的同源病毒攻击用抗原初免和加强的一组大鼠。评价疫苗赋予保护的能力。每日监测被攻击大鼠的存活率和体重变化,持续检测攻击后的14天。在每个时间点,将组的存活大鼠一起称重,并且计算平均重量。平均重量的误差是从相同数量的健康大鼠的平均重量的三次重复测量估计的。
[0347]
血清抗体滴度的确定:通过elisa确定针对产生免疫原的抗体滴度。将测试免疫原以在50μl pbs中的4μg/ml在96孔板(thermo fisher scientific,罗彻斯特,纽约州)上在4℃下包被过夜。然后将板用含有0.05%tween-20(pbst)的pbs洗涤,并且在pbst中用3%脱脂乳封闭1h。将针对测试免疫原产生的100μl抗血清在乳pbst中以4倍系列稀释,并且添加至到每个孔。将板在室温下孵育2h,之后用pbst洗涤。将50μl的在乳pbst中的hrp缀合的山羊抗小鼠igg(h l)二抗以预定稀释度(1:5000)添加至每个孔,并且在室温下孵育1h。用pbst洗涤板,之后用100μl/孔的底物3,3',5,5'-四甲基联苯胺(tmb)溶液显色,并且在显色3-5min后用100μl/孔的针对tmb的终止溶液进行终止。测量450nm处的od,并且抗体滴度定义为最高稀释度的倒数,所述最高稀释度产生高于对照孔的平均值加上2标准偏差的od值。
[0348]
实施例4:b/科罗拉多州/06/2017rha构建体设计、表达和纯化
[0349]
将b/科罗拉多州/06/2017(b/co’17)重组ha(rha)设计为具有凝血酶裂解位点,从而在ha的c末端处产生6xhis标签。一旦裂解,b/co’17蛋白产物将仅包括附加至野生型序列的三个残余氨基酸(val-pro-arg)。合成构建体的氨基酸序列如下:
[0350]
mkaiivllmvvtssadrictgitssnsphvvktatqgevnvtgvipltttptkshfanlkgtetrgklcpkclnctdldvalgrpkctgkipsarvsilhevrpvtsgcfpimhdrtkirqlpnllrgyehvrlsthnvinaegapggpykigtsgscpnitngngffatmawavpdknktatnpltievpyvctegedqitvwgfhsdnetqmaklygdskpqkftssangvtthyvsqiggfpnqtedgglpqsgrivvdymvqksgktgtityqrgillpqkvwcasgrskvikgslpligeadclhekygglnkskpyytgehakaigncpiwvktplklangtkyrppakllkergffgaiagfleggwegmiagwhgytshgahgvavaadlkstqeainkitknlnslselevknlqrlsgamdelhneileldekvddlradtissqielavllsnegiinsedehllalerklkkmlgpsaveigngcfetkhkcnqtcldkiaagtfdagefslptfdslnitaaslnddgldnhtillyystaasslavtlmiaifvvymvsrdnvscsiclvprgshhhhhh(seq id no:15)。
[0351]
加下划线的序列表示合成凝血酶裂解位点,而最后六个氨基酸是c末端6xhis标签。图1中示出了天然流感ha0、来自sanofi的的ha0和verndari rha00023构建体的图。
[0352]
将atum bio作为合成供应商。使用了pd2600-v10质粒骨架。该载体被设计用于高水平的瞬时表达并且带有用于细菌选择的卡那霉素抗性基因。在针对cho细胞序列优化之后,dna序列与seq id no:16一致。
[0353]
将expicho-s细胞(fisher)从以p1冷冻的小瓶在传代p4时扩增至两个e250烧瓶。该扩增培养得到8.556x106的密度。将五个e125烧瓶制备有各自在25ml培养基中的150m细胞。还将一个e250烧瓶制备有在50ml培养基中的300m细胞。使用12.33ul的1ug/ml下的质粒
储备液进行转染。在转染后19小时,将增强子和供养试剂添加至转染培养物,并且通过台盼蓝排除进行初始密度和活力评价。此后每日使用0.4ml悬浮培养物进行这些评价。转染的细胞沉淀物保留绝大多数重组ha。用于纯化b/科罗拉多州/06/2017rha0的流程图示出于图2中。
[0354]
所使用的裂解缓冲液由20mm磷酸盐缓冲液(ph 7.4)、150mm nacl和2mm mgcl2(以支持benzonase活性)和2%ldao洗涤剂(正十二烷基-n,n-二甲胺-n-氧化物,anatrace)组成。将ldao洗涤剂交换至imac柱上的1%辛基葡糖苷洗涤剂。图3示出了imac柱中裂解物的加载、洗涤剂交换和rha的洗脱。
[0355]
图4中的蛋白质印迹示出了梯度为500mm咪唑的rha洗脱概况。将合并的rha浓缩并且缓冲液交换至含有1%的pbs。使用该rha来产生合成膜vlp。
[0356]
实施例5:脂质体的产生
[0357]
将咪喹莫特(imq)配制至脂质体中。使用nanoassemblr(precision nanosystems,温哥华,英属哥伦比亚)形成脂质体。水相是pbs。微阵列由乙醇中的25mg/ml脂质混合物和3.5mg/ml imq组成。流速是8ml/分钟。水性与有机的流速比是2.5。将脂质体立即用pbs稀释10倍。通过30kd amicon过滤柱和4000g离心除去乙醇和未掺入的imq。用pbs稀释amicon渗余物,并且重复amicon过滤。使用malvern zetasizer-ns,通过动态光散射(dls)测定脂质体的大小。如图5中所示,脂质体的大小平均为92nm。
[0358]
通过hplc定量脂质体中的imq。hplc含有waters alliance仪器,其具有xterra c18柱(ms c18 5um 4.6x150 mm柱)、2998光电二极管阵列检测器、2525二元梯度模块和uv级分管理器。流动相是15%乙腈和0.1%三氟乙酸。该系统产生60um-3mm imq的imq线性剂量应答曲线。
[0359]
图6示出了含imq脂质体的在242nm、245nm与254nm下的uv扫描。imq在9.78分钟时洗脱。将含有imq的脂质体用作配制于印刷在vaxipatch微阵列上、具有sevlp的15%海藻糖中的佐剂,并且用于动物实验中。
[0360]
实施例6:sevlp的产生
[0361]
将实施例4的b/科罗拉多州/06/2017的rha以两种方式用于制备sevlp。制备sevlp的第一种方式包括渗析:为了重构为sevlp,将2mg脂质(分别以10:4.25:3:1:3和0.5%的比率混合的磷脂酰胆碱(50mg/ml)、胆固醇(20mg/ml)、磷脂酰乙醇胺(10mg/ml)、磷脂酰丝氨酸(10mg/ml)、鞘磷脂(20mg/ml)和磷脂酰肌醇(2.5mg/ml))溶解于400μl 10%og中。然后将500ug b/科罗拉多州/06/2017rha添加至溶解脂质,并且将总体积定容至2ml,从而产生4%og的最终浓度。将2ml样品在4℃下在小体积(3ml)pbs的多种变化中渗析24小时。然后将样品经24小时在4x12ml pbs中渗析。然后将样品转移至2x2.5l,持续24小时,并且最终转移至5l pbs,持续48小时以除去og。如使用malvern zetasizer-ns通过动态光散射(dls)确定的,sevlp的大小是100-200nm。
[0362]
制备sevlp的第二种方式包括nanoassemblr。基于25mm下的og临界胶束浓度(c.m.c.),通过在与脂质混合的同时将og从30nm降低至20mm来形成sevlp。将水性缓冲盐水中的流感rha蛋白和30mm og与乙醇中的dope、dopc、胆固醇和dspe-peg(2000)胺混合。水性与有机体积比是2:1。流速是8ml/分钟。将sevlps收集至pbs中并且缓冲液交换至pbs,并且使用amicon 30kd柱浓缩。如使用malvern zetasizer-ns通过动态光散射(dls)确定的,
sevlp的大小是100-200nm。
[0363]
sevlp中rha b/科罗拉多州/06/2017的活性和效力通过血凝和srid确定。
[0364]
实施例7:将疫苗biodot印刷在vaxipatch微阵列上
[0365]
设计vaxipatch微阵列贴片(map)以利用biodot(欧文,加利福尼亚州)微流体分配装置。该分配以二维(x,y)进行。单独的vaxipatch map是圆形的,直径为1.2cm,各自具有37个单独微尖端。使用biodot微流体分配器使map加载有海藻糖中的疫苗。在手动模式下,在二维x,y平面中,对所有37个单独的微尖端以10秒内每尖端5至20nl进行加载。定制设计的分配装置的升级允许一次平行分配10个阵列,产生每分钟数百个阵列的操作量。一旦将微阵列被加载并干燥,就将阵列放置于夹心夹具中。夹具含有与阵列相对应的钉,使得当压缩夹心时,微尖端弯曲到z平面中。然后用模具冲压出单独map。在干燥剂的存在下实现室内稳定性。在pbs中的15%海藻糖中配制1ug rha和1ug佐剂。然后使用biodot ad1520将混合物印刷至vaxipatch微阵列上。在干燥和玻璃化后,形成糖玻璃。图7示出了加载有10nl含有蓝染料1号的疫苗的vaxipatch微针阵列的单一微针。图中的光反射示出了固体糖玻璃的表面。rha b/科罗拉多州/06/2017的效力通过srid示出。
[0366]
实施例8:动物研究
[0367]
将呈递来自b/科罗拉多州/06/2017的rha的sevlp合并并且使用具有30kd截止值膜的amicon ultra-0.5旋转渗滤柱浓缩。将疫苗材料(1.62ml)在预冷却的离心机转子以13k rpm中离心30min。然后将渗余物以13k rpm用1分钟旋转洗脱,然后配制。假设rha通过柱完全保留和释放,估计初始浓缩材料的rha蛋白为3.24mg/ml。用30%海藻糖(在具有或不具有4%bb染料的情况下)以1:1配制,这在以单一10nl滴印刷时等同于0.389ug rha/阵列。所得材料是用于可视化和递送评估的具有或不具有2%bb的15%海藻糖。对于较低剂量,对于每种rha蛋白,浓缩rha估计为2.32mg/ml。然后将该材料用无核酸酶的水稀释,并且配制15%海藻糖中的具有2%亮蓝色fcf染料的0.2ug/rha和0.04ug/rha印刷剂量。
[0368]
利用5分钟直接压力将先前除去毛发的sprague-dawley大鼠用这些阵列治疗;这是一种展示出能够从微阵列贴片大致90%释放疫苗材料的方法。所选的施加位点是背部的中线,并且在异氟醚下的同时治疗动物。对所有动物保持每周血液抽取以用于测定对sevlp b/科罗拉多州/06/2017疫苗的免疫应答。
[0369]
使另一对照组的三只动物接受0.2ug/sevlp b/科罗拉多州/06/2017(稀释于无菌磷酸盐缓冲盐水(pbs)中)的皮内注射。基于来自平行印刷的未施加阵列的染料洗脱与治疗后阵列上的保留染料的比较,对于所有染料配制的微阵列贴片治疗估计治疗递送效率超过90%。
[0370]
进行每周血液抽取至第4周,此时将动物人道地实施安乐死,并且通过心脏穿刺收集的终末期抽取。通过elisa测定分析来自这些“第4周”取血的血清的与b/科罗拉多州/06/2017rha的反应性。
[0371]
elisa测定:将板在4℃下用在100mm碳酸盐缓冲液中的0.5μg/ml的rha蛋白(b/科罗拉多州/06/2017)包被过夜。然后将板用tween-20(tbst)洗涤3次,并且用tbs中的5%bsa在室温下封闭1h。在洗涤之后,添加大鼠血清(1:100-1:12500)和阳性对照抗体(1:62,500-1:7,812,500;单克隆抗ha抗体,immunetech,在1%bsa/tbst中),并且将其在室温下孵育2小时,之后洗涤。使用了1:20,000下的山羊抗大鼠-hrp抗体(jackson labs,112-035-143)。
数据示出于图8中。在图8中,map=微阵列皮肤贴片;im=肌肉内注射;y轴是elisa测试中使用的血清稀释度。
[0372]
实施例9:用于人疫苗接种的vaxipatch试剂盒
[0373]
vaxipatch的实例示出于图9中,其包括vaxipatch的背面(左小图)、侧面(中间小图)和背面(右小图)的图像。在施用时将正面放置于受试者的皮肤上。右小图示出了疫苗负载的1.2cm直径map。
[0374]
疫苗施用:vaxipatch装置的层拉开,从而移除覆盖map的透明圆顶;将map放置于在腕部的尺骨结近侧大约1”的皮肤上。用食指以大约六牛顿的力按压verndari徽标(示出于图9的左小图中)的中心,此时装置发出可听见的咔哒声,这指示已经施加足够力。以高度可重复的方法将map推进至皮肤中。装置保持在皮肤上10分钟,通过3m医学粘合剂保持在位。在10分钟后,移除vaxipatch,放回袋中,用拉链锁密封件密封,并且作为医疗废物丢弃。
[0375]
皮肤中的水分使疫苗从map溶解掉,疫苗进入皮肤并且通过专职抗原递呈细胞(诸如树突状细胞和朗格汉斯细胞)处理。疫苗接种是无痛的,因为微针的长度为600μm,因此太短而无法到达神经。
[0376]
图9中所示的透明塑料圆顶(中间小图和右小图)为map上的疫苗提供初级无菌屏障并且保护微针。然而,圆顶不是气密性的。将vaxipatch装置连同皮肤擦拭物小毛巾和干燥剂包装在次级气密性屏障封套中。干燥剂和气密性屏障封套保持干燥的环境,这有助于保持疫苗糖玻璃的完整性,从而提供室温稳定性。图10示出了显示vaxipatch的实例的扩展视图的示意图。
[0377]
vaxipatch疫苗接种试剂盒的实例示出于图11中。示出了双面的可重复密封的4”x7”袋,其含有vaxipatch、皮肤擦拭物和干燥剂。试剂盒不包括传统针或注射器。袋是气密性的,具有箔前面和透明塑料背面。袋在其最厚点的宽度是1/4”。
[0378]
实施例10:vaxipatch组件
[0379]
该实施例中描述的程序的目的是展示制备、配制疫苗和将其印刷至微阵列贴片的指定半蚀刻孔的方式。
[0380]
设计该实施例中描述的程序被以在最终干燥和储存前将制备的vaxipatch与干燥剂一起有效地组装和包装至单独袋中。
[0381]
在组装vaxipatch的一些实施方案中使用的设备和材料的实例包括但不限于以下:
[0382]
·
无菌干燥托盘
[0383]
·
不锈钢镊子,pl-30型(fisherbrand 12-000-122)
[0384]
·
显微镜(celestron,型号:omax 40x-2500x)
[0385]
·
定制不锈钢阵列印刷托盘(verndari inc)
[0386]
·
定制不锈钢弯曲夹具(verndari inc)
[0387]
·
定制不锈钢扣施加器(verndari inc,由weichhart stamping co.制造)
[0388]
·
单独包装的3g干燥剂袋(目录号:60013t)
[0389]
·
gmp级热封机(accu-seal,型号:8000-gv)
[0390]
·
干燥氩压缩气体气缸(harris气体)
[0391]
·
foilpak袋5”x8
”‑
4.5ml:箔和聚丙烯三面密封屏障袋(ampac flexibles,项目
号:ksp-150-1mb)
[0392]
·
预组装的包装件#1(内部设计且由3m mbk tape制造)
[0393]
·
双面环形胶带(内部设计且由3m mbk tape制造)
[0394]
·
无菌透明圆顶(内部设计且由uc davis team lab制造)
[0395]
·
foilpak:薄金属袋
[0396]
非限制性示例性说明书如下:
[0397]
对于包装,准备无菌印刷阵列、定制不锈钢弯曲夹具、不锈钢镊子、预组装的包装件#1和双面环形胶带。在无菌平坦表面上聚集以下物品:双面环胶带;透明圆顶;扣施加器;预组装包装支撑材料;镊子;印刷阵列;弯曲夹具。
[0398]
将印刷阵列插入至弯曲夹具,如图12中所示。图12中的箭头指示待定位微阵列尖端的顶部的方向。将阵列面向印刷孔侧向下插入,其中尖端向上指向以匹配箭头。
[0399]
接下来,将弯曲夹具牢固地按压以使微阵列倾侧,从而以适当的皮肤适用形式发起微针。例如,在按下阵列之后并将其取出,阵列将包括从金属平面(微针从所述金属平面延伸)90度延伸的微针。使用无菌镊子将弯曲阵列搁置在无菌表面上。
[0400]
接下来,获得包括支撑材料和金属扣施用器的预组装包装套。在一些实施方案中,金属扣施加器处于“预致动”形式,这是即用型形式。
[0401]
翻转支撑材料以显示面朝上的白色圆形背衬。小心地移除不透明的白色圆形胶带背衬片以暴露圆形带。
[0402]
接下来,将圆形胶带和金属扣施加器(凸起形式面朝上)对齐,并且小心地按压金属扣施加器的边缘,以牢固地附接至支撑材料,如图13中所示。接下来,翻转组装件以使另一侧面朝上。
[0403]
移除最顶部透明胶带背衬以暴露小圆形粘合剂。小心地对齐所制备的90度弯曲阵列(微针面朝上),并且附接至支撑材料。使用无菌金属镊子轻轻敲击阵列的外边缘。
[0404]
接下来,使用带手套的手获得圆形环胶带并移除环形白色胶带背衬。获得透明圆顶并且适当地对齐并将透明圆顶附接至圆形胶带。轻轻敲击透明圆顶的边缘,以确保牢固附接。
[0405]
接下来,移除较大的背衬,以将透明圆顶 双面环粘合剂分离,并小心地将其放置在阵列的顶部上。需注意,由于透明3d圆顶应该具有保护微针弯曲阵列的功能,因此适当的对齐对该步骤来说是非常重要的。
[0406]
接下来,获得完成的组装vaxipatch件、3g干燥剂包装件和薄金属袋(例如foilpak)。首先将3g干燥剂包装件放置并且小心地将组装的vaxipatch件放置至金属袋中。
[0407]
打开热封机。打开氩气阀以提供热封机的精确压力。选择“方案1”。袋鳍的开放界面保持在两个密封垫圈之间。当将袋适当定位,并且将手指从密封区域安全地移出时,使用摇臂踏板发起热密封。将发出可听蜂鸣声以指示完成,并且密封表面将分离。然后可以移除密封袋。可能需要轻度压力来将其与下部密封垫圈分离。将袋在20℃下密封和储存。
[0408]
实施例11:定点照护型(point-of-care)疫苗
[0409]
该实施例中描述的程序的目的是展示提供为引起疾病、诸如流感、狂犬病、带状疱疹、covid19等的感染提供定点照护型疫苗的方式。一些实例包括疫苗接种试剂盒,其是室温稳定的(例如,用于邮寄分配),可以通过例如无痛的五分钟绷带自行施用,允许疫苗接种
的照片证据(例如,通过移动装置),可以例如在塑料储存袋中邮寄给供应商。
[0410]
图14示出了用于解决定点照护型疫苗接种问题的示例性三方面方法。该实施例示出了如何将rgp抗原、佐剂和递送物放在一起以提供完整的疫苗接种包装件。在一些实施方案中,rgp是来自病毒表面的重组糖蛋白。
[0411]
图15a和15b示出微针阵列的示例性片材。在一些实施方案中,这些片材包含医学级不锈钢。在一些实施方案中,微针阵列以二维(x,y)印刷疫苗。在一些实施方案中,夹具可以用于在z平面中使阵列中的微针倾侧。在一些实施方案中,可以采用中心点真空拾取来扩散和放置,以实现vaxipatch试剂盒的自动组装。
[0412]
图16示出了疫苗加载的微阵列的实例。所描绘的实例示出了10nl疫苗印刷混合物/微针的biodot印刷。
[0413]
图17示出了在人受试者中在五分钟内vaxipatch染料递送的实例。
[0414]
图18示出了在大鼠中vaxipatch染料递送的实例。所述实例包括0.3ug作为mlpvi的单价rha、0.5ug作为vas 1.0的qs-21 /-(0.3ug phad)、具有1号蓝色染料(w/v)的0.5%fd&c、flublo的1/150rha以及作为shingrix的1/100qs-21的剂量。将示例性vaxipatch阵列施加5分钟,其中每组n=6只(3只雄性,3只雌性)sprague-dawley大鼠,免疫前和每周取血,之后进行第28天的终末期取血。对皮肤发红/刺激的draize评估未显示出来自vaxipatch、剂量或配制品的刺激。
[0415]
图19示出了随着igg时程的vaxipatch大鼠elisa滴度。如所描绘的,在疫苗接种的sprague-dawley大鼠的血清中通过针对内部全长rha0蛋白(vrha0026)的elisa测定对来自b/科罗拉多州/06/2017的ha具有特异性的igg抗体水平。基于五倍稀释系列对每组6只动物(各自3只雄性和3只雌性)的n分配终点滴度。滴度是log10变换的,并且将平均值用于绘制的数据点。误差条表示每组6只的n的sem。将“5”的任意滴度分配至在初始1:100稀释下阴性的样品(假定为非应答者)。所示出的两种佐剂化配制品早在接种后14天表现出高水平的特异性igg,到第3-4周具有峰值水平。在超过第7天的所有时间点,佐剂化vaxipatch动物实现了比im注射比较器显著更高的终点滴度。
[0416]
图20示出了针对b/科罗拉多2017的vaxipatch elisa滴度。所述图示出了在最终的第28天时间点每个疫苗接种组内的个体变化,每只动物具有标记。较暗的阴影标记表示雌性动物。几何平均值由每个组的虚线表示。使肌内注射对照动物接受4.5微克的单剂量的抗原,而使vaxipatch动物接受0.3微克的蛋白质。需注意,选择flublok剂量以包括4.5微克的每种株系,因为它是四价产品(18微克总蛋白)。基于单因素方差分析和tukey的hoc后hsd检验,在图上方指示了组之间的统计学显著性。
[0417]
图21示出了针对b/科罗拉多2017点图的血凝抑制(hai)滴度。为了评估由sprague-dawley大鼠疫苗接种引发的免疫应答的质量,针对同源who标准抗原、bpl灭活的b/科罗拉多州/06/2017流感病毒体进行血凝抑制测定。对于人血清,认为1:40滴度在hai测定中是保护性的。将在疫苗接种后第28天收集的大鼠血清是经高岭土处理以除去凝集的非特异性抑制剂。将经处理的免疫后血清的两倍系列稀释液与bpl灭活抗原在室温下一起孵育45分钟以允许结合。添加人单一供体o 红细胞,并且评分免疫血清抑制凝集反应的能力。该点图示出了每组所有六只动物的得分,其中较暗的阴影标记表示雌性动物。y轴是log2标度以反映稀释度系列。用虚线指出每组的几何平均值。同样示出了组之间的统计学显著性,
technology corp.)。纯化的蛋白质对照是在左泳道中,标记为“it-rs”。抗兔二抗可视化材料在对于纯化的蛋白质对照的预期约175kd大小处。对于三种covid-19转染的细胞裂解物(ad3、bd3、dd3)存在相当大小的信号,但是所述信号在未接受covid-19表达构建体(cd3)的转染细胞裂解物中不存在。这为我们的重组covid-s抗原的身份提供了重要的二次指示。
[0425]
图29示出了全长刺突纯化,其具有covid-s的imac纯化的洗脱曲线。将来自大约30ml的高密度expicho细胞培养物的细胞提取物施加至histrap粗ff 1-ml柱(ge healthcare),所述柱用含有0.5%ldao的缓冲液预平衡。在洗涤剂交换为1%辛基葡糖苷之后,在恒定的1%辛基葡糖苷下施加咪唑的阶梯梯度,以释放松散结合的宿主细胞蛋白,之后释放his标记的重组蛋白。蓝色虚线迹线指示基于280nm处的吸光度的释放蛋白质的水平。154.5ml处的主峰含有重组蛋白产物。镍柱纯化允许对用于临床前测试的初始候选疫苗材料的快速且高度纯化,但可以被传统蛋白质色谱法代替,所述传统蛋白质色谱法不需要向重组抗原产物中添加异源表位标签。
[0426]
图30示出了covid-19刺突慢病毒假型构建。验证新颖疫苗的关键挑战是如何证明潜在功效。虽然igg elisa可以模型化特异性免疫应答的幅度,但它不会区分在功能上抑制病毒的抗体与可以结合靶蛋白的非必需(或结构封闭)表位的抗体。中和测定(其中测试免疫后血清在体外阻断病毒进入允许性细胞中的能力)可以是预测体内功效的强大工具。为了避免对于这种测定使用高度感染性sars-cov-2的需要,正在开发假型测定,其中使用covid-s蛋白包装复制缺陷型报告慢病毒。如果该假型病毒可以在体外转导允许性细胞,则应该可以将其用作中和测定中的真实sars-cov-2的替代物。选择的慢病毒载体包括组成型gfp报告物。该图示出了转染的expicho细胞中随时间的荧光,其指示了慢病毒载体质粒的活性。仅用covid-s构建体(没有慢病毒载体)转染的烧瓶b仅表现出荧光的背景水平,而用包装混合物转染的所有三种烧瓶到转染后第4天展示出强的gfp信号。
[0427]
实施例12:ace-2的产生
[0428]
在一些实施方案中,使用由atum bio要求的哺乳动物表达构建体产生ace-2,将所述表达构建体瞬时转染至expi293细胞中。在此类实施方案中,ace-2的胞外结构域分泌至细胞培养基中。在此类实施方案中,在转染后三天,收获细胞培养上清液并且使用pd-10柱(ge-health care,目录号17-0851-01)脱盐,并且在100mm nacl、20mm tris、ph 7.6中洗脱。在此类实施方案中,将洗脱液加载至平衡的hitrap ff deae离子交换柱上,洗涤,并且用200mm nacl、20mm tris、ph 7.6洗脱。
[0429]
图31描绘了考马斯染色sds-page凝胶,其示出来自纯化的样品。如所描绘的,第一泳道是来自sino biological(目录号10108h08h20)的商业ace-2。为了确定ace-2蛋白酶活性是否通过纯化保留,使用荧光底物(r&d systems,目录号es007)进行酶活性测定。将具有单一字母氨基酸序列yvadapk(seq id no:17)的小肽插入在高度荧光7-甲氧基香豆素(mca)基团与2,4-二硝基苯基(dnp)基团之间,从而通过共振能量转移高效地淬灭mca的荧光。ace-2裂解脯氨酸与赖氨酸之间的底物,使用荧光板读取器测量荧光的增加,其中激发波长为320nm并且发射为405nm。
[0430]
用于测定的基本方案如下:
[0431]
1.在测定缓冲液(1m nacl、75mm tris、ph 7.5)中将底物稀释至40um。
[0432]
2.将50ul底物添加至黑色96孔荧光测定板的待测定的每个孔中。
[0433]
3.添加在相同测定缓冲液中稀释的50ul样品。
[0434]
4.在荧光读取器上随时间测量荧光。
[0435]
对于使用荧光底物的ace-2活性测定,针对从sino biological可商购获得的ace-2测试纯化的“内部”ace-2。测试在40℃下在20%甘油中以及在供内部使用的1次冻融循环(在-200c下孵育2.5小时)之后,ace-2是否具有活性,以确定储存条件。所有四个样品显现为具有相似的活性水平,这表明用于ace-2的纯化方法对酶活性没有不利影响。这也表明ace-2可以储存在20%甘油中,并且进行至少1次冻融而不丧失显著量的活性。图32描绘了ace-2样品中的活性水平。
[0436]
实施例13:夹心elisa开发
[0437]
下文描述了用于sars-cov-2-s效力测定的一般方案。在一些实施方案中,将高结合的平底微量滴定板(corning 3206)在4℃下用在pbs中的2.5μg/ml的ace-2(内部纯化的ace-2)包被过夜。然后将板用含有0.05%tbst的tris缓冲盐水(tbs)洗涤3次,并且在室温下用在tbs中的5%牛血清白蛋白(bsa)封闭2-4h。在一次另外的tbst洗涤之后,添加1%bsa/tbst中的sars-cov-2-s蛋白,并且在室温下孵育2小时,之后用tbst进行四次另外的洗涤。然后在1%bsa/tbst中以1:5000添加小鼠抗sars-cov-2-s(genetex,目录号gtx632604),并且在室温下孵育1小时。在另外的四次洗涤之后,在1%bsa/tbst中以1:5,000添加山羊抗小鼠hrp抗体(jackson labs,715-035-150),并且在室温下孵育1小时。在四次最终洗涤之后,添加100ul的tmb底物,并且在室温下孵育30分钟。通过添加50ul 2n硫酸终止反应。然后在自动化微板读取器(accuskan fc,fisher scientific)上在450nm处读取所得吸收。
[0438]
实施例14:sars-cov-2-s效力测定
[0439]
进行效力测定以将vrs01的效力与从immune-tech(目录号it-002-032p)可商购获得的sars-cov-2-s进行比较。将来自内部产生的b/科罗拉多’17抗原的血凝素(ha)作为为阴性对照。商业(s com)与内部sars-cov-2-s(vrs01 0515)蛋白之间的结果是类似的,并且ha在所有测试浓度下具有接近零的结合。图33描绘了对从该实验获得的数据的线性回归。
[0440]
实施例15:热应激对sars-cov-2-s效力的影响
[0441]
测试vrs01在四种不同浓度(100、25、6.25和1.56ng)上结合250ng ace-2的能力以建立用于下面更详细描述的初步稳定性实验的标准曲线。图34描绘了标准曲线。
[0442]
在不同的温度(20、40和60摄氏度)下测试vrs01的稳定性,并且过夜孵育样品。将vrs01以0.5ng/ul的浓度稀释于tbst中的1%bsa中,因此当将100ul这些样品添加至ace2包被孔时,添加了50ng。还将95℃下的样品煮沸5分钟。图35a描绘了该实验中获得的数据。图35b描绘了基于使用图34中描绘的标准曲线的转换吸光度值确定的剩余的有效vrs01的量。
[0443]
针对每种条件的作为百分比的效力可以通过将有效vrs01除以添加至孔的vrs01的量并乘以100来计算。值计算为如表2中所示。
[0444]
表2:计算的效力值
[0445]
20℃o/n74.0%40℃o/n38.6%60℃o/n6.3%95℃5分钟9.8%
无刺突6.0%
[0446]
实施例16:配制有佐剂的vmlp结合的vrs01:
[0447]
通过将400、100、25或6.25ng的sars-cov-2-s添加至含有250ng ace-2的孔来测试已经配制为“印刷混合物”(例如用于印刷vaxipatch阵列的配制品)结合ace-2的能力。观察到vmlp的量与孔中测量的吸光度之间的线性关系。针对与ace-2结合的量观察到的值低于“游离”蛋白质。这可能是由于通过当将sars-cov-2-s掺入至vmlp中时的配制或结合动力学的差异导致的较低效力。图36描绘了“印刷混合物”vmlp的线性回归。
[0448]
表3:“印刷混合物”vmlp的线性回归
[0449]
吸光度vmlp(ng)1.2654000.32851000.129250.12256.25
[0450]
实施例17:ace-2/sars-cov-2-s结合的ph敏感性
[0451]
测试了ace-2/vrs01结合的ph敏感性。通过在2、5、7.5、9或12的ph水平下预孵育250ul 1ng/ul vrs01来进行实验。用naoh或hcl调整ph并且使用ph纸条测量。将100ul的每个样品一式两份地加载至包被有250ng ace-2的板上,并且在450nm处测量吸光度。ace-2结合的量显现为在5和9的ph下略微减少,而在2和12的ph下仅略高于背景。图37描绘了在不同ph下的ace-2结合的图。
[0452]
表4:在不同ph水平下的ace-2结合
[0453]
ph值吸光度ph 20.091ph 52.486ph 7.53.234ph 92.668ph 120.074
[0454]
实施例18:使用多克隆抗体抑制ace-2与sars-cov-2-s的s1亚基的结合:
[0455]
在对疫苗接种动物模型的血清进行分析的准备和预期中,对针对sars-cov-2-s的s1亚基的可商购获得的多克隆兔抗体抑制与ace-2的结合的能力进行测试。如上文设计中所述进行结合测定,不同的是在ace-2包被板在封闭溶液中的同时,将1ng/ul或0.25ng/ul内部sars-cov-2-s与商业抗体的多种稀释液一起孵育。在添加抗体之后,将样品在37摄氏度下孵育2小时。将样品一式两份地加载至包被有250ng ace-2的孔上,并且在450nm处确定吸光度。图38描绘了关于平均吸光度的图的条形图。
[0456]
当使用1:100或1:1000的稀释度时,多克隆抗体能够有效抑制sars-cov-2-s与ace-2的结合,并且在1:10,000的稀释度下存在对结合的部分抑制。该结果对于100和25ng sars-cov-2-s两种条件都符合。
[0457]
表5:汇总吸光度值
[0458]
抗体稀释度100 ng-抗s25ng-抗s
03.680.8621-1000.8310.2221-10000.9890.3241-100002.4470.6861-1000003.9601.537
[0459]
实施例19:重组sars-cov-2刺突蛋白纯化和vmlp配制
[0460]
将sars-cov-2(武汉’19)重组刺突(rs)设计为具有凝血酶裂解位点,从而在orf的c末端处产生6xhis标签,命名为vrs01。一旦通过凝血酶裂解,rs蛋白产物将仅包括附加至野生型序列的四个残余氨基酸(leu-val-pro-arg)。s蛋白的天然多元s1/s2裂解位点保持完整。合成构建体的氨基酸序列与seq id no:30一致。需注意:加下划线的序列表示合成凝血酶裂解位点,而最后六个氨基酸是c末端6xhis标签。
[0461]
图39示出了该构建体(vrs01)与单独的his标签化rbd(vrs12)和带有d614g及弗林位点突变(vrs14)的全长可分泌胞外结构域相比的概述图。将atum bio作为合成供应商。使用了pd2610-v10质粒骨架。该载体被设计用于高水平的瞬时表达并且带有用于细菌选择的卡那霉素抗性基因。在针对cho细胞序列优化之后,dna序列与seq id no:31一致(vrs01 dna序列,针对哺乳动物表达密码子优化)。
[0462]
将expicho-s细胞(fisher)从以p1冷冻的小瓶在传代p8时扩增至e1000烧瓶。该扩增培养得到8.66x106的密度。将一个e1000烧瓶制备有在200ml expicho表达培养基中的1200m细胞。通过expifectamine cho转染试剂盒(fisher),使用1ug/ml下的160ul的质粒储备液进行转染。在转染后24小时,将增强子和供养试剂添加至转染培养物,并且应用转变至32℃的温度。使用0.4ml悬浮培养物通过台盼蓝排除来进行每日密度和活力评价。在转染后第2天和第3天将沉淀的洗涤细胞进行储存,其中将第3天细胞沉淀物用于纯化vrs01以进行实验性免疫原性测试。
[0463]
将冷冻细胞沉淀物重悬于1x pbs中,并且以4,000x g进行20分钟离心以除去一些可溶性细胞蛋白。然后在50mm hepes缓冲液(ph 7.5)、500mm nacl和2mm mgcl2(以支持benzonase活性)以及2%ldao洗涤剂(正十二烷基-n,n-二甲胺-n-氧化物,anatrace)中进行带有vrs01的细胞沉淀物的裂解。在室温下应用benzonase处理(200u)10分钟,之后在4℃下温和旋转1小时。将两轮离心应用至不溶性细胞碎片的透明提取物;以4,000x g进行第一轮旋转持续20分钟,之后以10,000x g进行第二轮旋转持续40分钟。然后澄清化的提取物与预平衡的capto小扁豆凝集素树脂(cytiva)混合,并且在4℃下旋转4-6小时。用洗涤缓冲液(50mm hepes、500mm nacl、0.5%ldao;ph 7.5)洗涤结合的树脂,然后堆积至重力柱中以进行另外的洗涤。将柱上洗涤剂交换进行为1%辛基葡糖苷、50mm hepes、500mm nacl(ph 7.5),之后用300mmα-d甲基葡糖苷洗脱。然后将该洗脱液用咪唑补充至5mm,并且经由注射器泵施加至1-ml histrap ff粗柱。将洗脱液通过柱三次,然后用5mm咪唑、1%og溶液洗涤,并且最终在500mm咪唑中洗脱。将所得的og胶束化vrs01在amicon ultra-15 30k渗滤柱上浓缩,并且在vdb-og(10mm nap、140mm nacl、1%辛基葡糖苷;ph 7.2)中渗析以除去咪唑。然后通过bca测定(pierce)定量vrs01,并且通过sds-page分析确认纯度。
[0464]
通过实施例6中所述的相同方法用vrs01形成vmlp。为了重构为sevlp,将0.65mg脂质(比率为2:1的磷脂酰胆碱(50mg/ml)和植物胆固醇(20mg/ml))溶解于130μl 10%og中。
然后将200ug og胶束化vrs01添加至溶解脂质,并且将总体积定容至0.65ml,从而产生约4%og的最终浓度。将样品在4℃下在小体积(26ml)pbs的多种变化中渗析24小时。然后将样品经24小时在4x32ml pbs中渗析。然后将样品经48小时转移至4x2l,以除去og。将所有渗析步骤在4℃下在vdb(10mm nap、140mm nacl;ph 7.2)中进行。sevlp的平均直径为230-250nm,如使用malvern zetasizer-ns通过动态光散射(dls)确定的;相比之下,平行制备的空dopc/胆固醇脂质体(无vrs01掺入)具有190-200nm的平均直径。
[0465]
实施例20:vrs01 sevlp在sprague-dawley大鼠中的免疫原性
[0466]
如实施例7和8中所述从印刷混合物制备vaxipatch阵列,所述印刷混合物配制成含有100或500ng sevlp-vrs01,连同剂量为500ng qs-21和500ng 3d(6-酰基)-phad/贴片的脂质体佐剂以及用于可视化的0.5%(w/v)fd&c 1号蓝色染料。以与实施例8相同的方式将这些施加至8只sprague dawley大鼠(4只雄性,4只雌性)。简而言之,将先前除去毛发的sprague-dawley大鼠在异氟烷麻醉下的同时用阵列治疗,将5分钟直接压力用于背部中线。在治疗后2、3和4周通过隐静脉取血收集血清。在第5周,使来自两个组的动物通过相同的方法接受另外的vaxipatch加强,其由175ng sevlp-vrs01加上如上所述的佐剂(500ng qs-21、500ng 3d(6-酰基)-phad组成。在加强后2周再次抽取血清并且测试。
[0467]
在4℃下在具有0.5μg/ml的全长rs(immune tech,it-003-032p)的100mm碳酸盐缓冲液中包被过夜的板上,通过elisa测定评价血清中的特异性igg应答。使用针对用于检测的大鼠igg的hrp缀合的多克隆山羊抗体(jackson labs,112-035-143),测试从1:100至1:12,500的五倍连续稀释液。基于超过板的空白孔的两倍的信号分配阳性,并且将其用于分配终点滴度。
[0468]
图40汇总了在sd大鼠中对vrs01的特异性igg应答。左小图基于其分配的终点滴度的log10示出了vrs01治疗组的时程,其中箭头指示两种疫苗接种治疗的时间安排。误差条表示sem(n=8/组)。右小图比较了初始疫苗接种后4周和加强后2周时来自500ng治疗组内的单独动物的终点滴度。较暗的阴影中的标记表示雄性动物。虚线指示每个组的gmt滴度。
[0469]
尽管已经在本文中示出和描述了本发明的优选实施方案,但是对于本领域技术人员而言将显而易见的是,此类实施方案仅为通过举例方式提供。在不脱离本发明的情况下,本领域技术人员现将会想到众多变化、改变和替代。应当理解,本文所述的本发明的实施方案的各种替代方案可以用于实践本发明。所附权利要求旨在限定本发明的范围,并且由此涵盖这些权利要求及其等同物范围内的方法和结构。
[0470]
序列
[0471]
[0472]
[0473]
[0474]
[0475]
[0476]
[0477]
[0478]
[0479]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。