1.本发明涉及免疫测定,特别是用于检测和/或监测患者的心血管疾病的免疫测定,以及用于所述测定的单克隆抗体。心血管疾病尤其可以是心力衰竭,特别是射血分数保留的心力衰竭。免疫测定可用于评估心血管疾病的不良后果的可能性。
背景技术:
2.心力衰竭(hf)的负担在过去几年中急剧增加
1,2
。大约一半的hf继发于射血分数保留的hf(hfpef),随着人口老龄化,预计hfpef将占hf总负担的甚至更大的比例3。尽管在过去的几十年中进行了多项iii期随机对照试验,但被证明可以为该患者群体提供明显益处的药物干预仍有待确定。
3.hfpef综合征的异质性已被确定为证明候选药物干预的有效性的重要障碍。鉴于hfpef的异质性,来自各种病理生理过程的不同程度的贡献可对临床试验中测试的药物治疗的平均反应产生不利影响。因此,能够容易地识别相关潜在特定的由药物干预靶向的生物过程的简单、非侵入性生物标志物的可用性代表了一种增强我们对hfpef的临床和治疗方法的有前途的方法4。
4.hfpef的异质性对于个体患者的不同预后也具有重要意义。非常需要更有效地对hfpef患者进行风险分层(risk-stratify)的能力。新的风险分层标志物不仅可以提高我们在临床实践中预测hfpef患者的能力,而且对于告知未来试验中高风险个体的招募具有重要价值。
5.心肌纤维化被认为在hfpef的病理生理学中起作用
5,6
。纤维化增加是由相对于胶原蛋白的降解形成过多引起的,最终导致间质中的间质胶原蛋白沉积增加。hfpef的尸检标本和体内研究已证明心肌细胞外基质沉积增加
6-8
并且在该病症中已显示与lv被动硬化和舒张功能障碍相关
5,8
。心肌纤维化也可导致冠状动脉血流储备减少
6,9
、心室非同步化和心律失常倾向
10,11
。鉴于心肌纤维化在hfpef中的作用,反映纤维化进展或纤维化消退的潜在动态过程的简单纤维化生物标志物将非常有价值
10
。
6.据报道,细胞外体积分数(ecvf)是一种通过心脏磁共振成像测量的心肌纤维化指标,可预测hfpef患者
12,13
或处于hfpef风险
14
中的患者的不良结果。尽管mri可能在临床前研究、人类早期研究和某些临床环境中评估心肌纤维化方面发挥重要作用,但其成本和可用性可能会限制或排除其在全球iii期试验和临床实践中的使用。此外,由于幽闭恐惧症或晚期肾病,许多hfpef患者不适合进行ecvf测量。因此,寻找组织纤维化的循环中生物标志物仍然是一个非常有吸引力的领域。
7.然而,由于“纤维化不仅仅是纤维化”的概念,以及不同隔室和胶原蛋白类型的ecm重塑可能具有不同的生物学和预后意义,寻找hfpef的合适生物标志物变得复杂
15
。例如,已经报道了慢性乙型肝炎与丙型肝炎中胶原蛋白新表位片段和肝纤维化的差异关联。此外,尽管心肌纤维化被认为在hfpef中很重要,但心外纤维化也起重要作用。例如,在hfpef16中已经报道了骨骼肌的纤维脂肪浸润
16
。同样,纤维化也可能发生在动脉壁、肾和肝功能障碍
中,所有这些都可导致该人群出现不良后果。
8.xxviii型胶原蛋白在文献中的描述很少,但对其物理作用的研究正在缓慢出现。xxviii型胶原蛋白主要位于周围神经和背根神经节,但也存在于皮肤中
17,18
。xxviii型胶原蛋白是一种珠状胶原蛋白,其结构类似于vi型胶原蛋白,具有两个位于528个氨基酸的胶原蛋白结构域两侧的血管性血友病(von willebrand)因子a结构域
19
。xxviii型胶原蛋白在健康肺组织中的含量非常低,但在博莱霉素诱导的肺损伤中过度表达
20
,这可能表明表达xxviii型胶原蛋白的细胞参与了组织修复过程。xxviii型胶原蛋白先前也被认为在小鼠肝癌中上调
21
。
技术实现要素:
9.本发明人现已确定在hfpef中xxviii型胶原蛋白的形成上调,并已开发了一种新的竞争性elisa,其利用靶向xxviii型胶原蛋白c末端的单克隆抗体。
10.因此,在本发明的第一方面,提供了一种免疫测定方法,该方法包括:
11.(i)将来自患者的生物流体样品与特异性结合xxviii型胶原蛋白的c末端表位的单克隆抗体接触,和
12.(ii)检测和确定样品中所述单克隆抗体和肽之间的结合量。
13.所述方法可用于对生物流体样品中具有所述xviii型胶原蛋白的c末端表位的肽进行定量,例如以评估xxviii型胶原蛋白形成的水平。
14.在一种优选的实施方式中,该方法是用于检测和/或监测患者的心血管疾病和/或评估患者的心血管疾病的可能性或严重程度的免疫测定方法。在所述实施方式中,该方法包括:
15.(i)将来自患者的生物流体样品与特异性结合xxviii型胶原蛋白的c末端表位的单克隆抗体接触,
16.(ii)检测和确定样品中所述单克隆抗体与肽之间的结合量,和
17.(iii)将如步骤(ii)中确定的所述单克隆抗体的所述结合量和与正常健康受试者相关的值和/或与已知疾病严重程度相关的值和/或在先前时间点从所述患者获得的值和/或预定的截止值相关联。
18.免疫测定可以是但不限于竞争测定或夹心测定。例如,免疫测定可以是放射免疫测定或酶联免疫吸附测定(elisa)。这样的测定是本领域技术人员已知的技术。
19.在某些实施方式中,心血管疾病可以是心力衰竭。特别地,心血管疾病可以是射血分数保留的心力衰竭(hfpef)。
20.在某些实施方式中,该方法可以是用于评估患者心血管疾病的严重程度的方法,所述方法包括评估由于心血管疾病和/或不良心血管事件的复合而导致的患者死亡和/或住院的可能性。
21.在某些实施方式中,患者可以例如是正在接受心血管疾病治疗的患者,并且该方法可以包括监测患者的心血管疾病。
22.患者生物流体样品可以是但不限于血液、血清、血浆、尿液或来自细胞或组织培养物的上清液。优选地,生物流体是血清或血浆,最优选是血清。
23.如本文所用,术语“单克隆抗体”是指完整抗体及其保留完整抗体的结合特异性的
片段,例如fab片段、f(ab')2片段、单链fv片段或本领域技术人员已知的其他此类片段。众所周知,完整抗体通常具有两对相同多肽链的“y形”结构,每对由一条“轻”链和一条“重”链组成。每条轻链和重链的n末端区域包含可变区,而每条重链和轻链的c末端部分构成恒定区。可变区包含三个互补决定区(cdr),主要负责抗原识别。恒定区允许抗体募集免疫系统的细胞和分子。保留结合特异性的抗体片段至少包含cdr和剩余可变区的足以保留所述结合特异性的部分。
24.在本发明的方法中,可以使用包含本领域已知的任何恒定区的单克隆抗体。人恒定轻链分为κ和λ轻链。重恒定链分为μ、δ、γ、α或ε,并将抗体的同种型分别定义为igm、igd、igg、iga和ige。igg同种型具有若干亚类,包括但不限于igg1、igg2、igg3和igg4。单克隆抗体可优选为igg同种型,包括igg1、igg2、igg3或igg4中的任一种。
25.可以使用本领域已知的方法例如kabat等人描述的方法来确定抗体的cdr。如实施例中所述,可以从b细胞克隆产生抗体。抗体的同种型可以通过对人igm、igg或iga同种型或人igg1、igg2、igg3或igg4亚类特异的elisa确定。产生的抗体的氨基酸序列可以使用标准技术确定。例如,可以从细胞中分离rna,并用于通过逆转录产生cdna。然后使用扩增抗体重链和轻链的引物对cdna进行pcr。例如,对所有vh(可变重链)序列的前导序列特异的引物可以与结合位于先前已确定的同种型恒定区中的序列的引物一起使用。轻链可以使用结合κ或λ链的3'末端的引物以及与vκ或vλ前导序列退火的引物一起扩增。可以生成全长重链和轻链并对所述全长重链和轻链测序。
26.在根据本发明的第一方面的方法的一些实施方式中,将生物流体样品与特异性结合c端氨基酸序列qetciqg(seq id no:1)(本文也称为“pro-c28”)的单克隆抗体接触。优选地,所述单克隆抗体不识别或特异性结合所述c末端氨基酸序列的延长形式qetciqga(seq id no:2)。优选地,所述单克隆抗体不识别或特异性结合所述c末端氨基酸序列的截短形式qetciq(seq id no:3)。
27.优选地,所述抗体对c末端氨基酸序列qetciqg(seq id no:1)的亲和力与所述抗体对延长的c末端氨基酸序列qetciqga(seq id no:2)的亲和力之比为至少10比1,更优选地为至少50比1、至少100比1、至少500比1、至少1,000比1、至少10,000比1、至少100,000比1或至少1,000,000比1。
28.优选地,所述抗体对c末端氨基酸序列qetciqg(seq id no:1)的亲和力与所述抗体对截短的c末端氨基酸序列qetciq(seq id no:3)的亲和力之比为至少10比1,更优选地为至少50比1、至少100比1、至少500比1、至少1,000比1、至少10,000比1、至少100,000比1或至少1,000,000比1。
29.如本文所用,术语“c末端”是指在多肽的末端,即在多肽的c末端的c末端肽序列,并且不应被解释为在其一般方向上的含义。
30.可通过本领域已知的任何合适技术产生特异性结合c末端氨基酸序列qetciqg(seq id no:1)的单克隆抗体。例如,单克隆抗体可以针对具有氨基酸序列qetciqg(seq id no:1)的合成肽而产生,例如通过:用由序列qetciqg(seq id no:1)组成的合成肽免疫啮齿动物(或其他合适的哺乳动物),所述合成肽任选地可连接至免疫原性载体蛋白(例如钥孔血蓝蛋白),分离和克隆单个抗体产生细胞,并测定所得单克隆抗体以确保它们具有所需的特异性。下文描述了用于产生特异性结合c末端氨基酸序列qetciqg(seq id no:1)的单克
隆抗体的示例性方案。
31.在根据本发明的第一方面的方法的一些实施方式中,对xxviii型胶原蛋白的c末端表位具有特异性的单克隆抗体的结合量和与正常健康受试者相关的值和/或与已知疾病严重程度相关的值和/或在先前时间点从所述患者获得的值相关联。
32.如本文所用,术语“与正常健康受试者相关的值和/或与已知疾病严重程度相关的值”是指通过上述方法为被认为是健康即没有心血管疾病的受试者确定的标准化量,和/或通过上述方法为已知患有已知严重程度的心血管疾病的受试者确定的标准化量。
33.在根据第一方面的方法的一些实施方式中,对xxviii型胶原蛋白的c末端表位具有特异性的单克隆抗体的结合量与一个或多个预定截止值相关。
34.如本文所用,“截止值”是指经统计学确定以指示患者的心血管疾病或特定严重程度水平的心血管疾病的高可能性的结合量,其中患者样品中结合的生物标志物的测量值等于或高于以下统计截止值,该统计截止值对应于心血管疾病或该疾病的特定严重程度水平的存在或可能性的至少70%的概率、优选至少80%的概率、优选至少85%的概率、更优选至少90%的概率、最优选至少95%的概率。
35.对xxviii型胶原蛋白的c末端表位具有特异性的单克隆抗体的结合量的预定截止值优选为至少100ng/ml。对此,通过使用统计分析,已经发现对xxviii型胶原蛋白的c末端表位具有特异性的单克隆抗体的测量的结合量至少为100ng/ml或更高,可以是心血管疾病的决定因素。通过具有至少100ng/ml的统计截止值,可以利用本发明的方法以高置信水平给出心血管疾病的诊断。应用这样的统计截止值特别有利,因为它引起独立的诊断测定;即它消除了与健康个体和/或具有已知疾病严重程度的患者进行任何直接比较以得出诊断结论的需要。当使用该测定来评估已经具有通常指示心血管疾病的医学体征或症状的患者(例如,通过身体检查和/或咨询医疗专业人员确定)时,这也可能是特别有利的,因为它可以作为用于证实初始诊断的快速和确定性工具,从而可能消除对更具侵入性程序的需求,并加快开始合适的治疗方案。它还可以避免长时间住院治疗的需要。在心血管疾病的特定情况下,快速的结论性诊断可引起疾病在早期被检测到,这反过来提高总体生存机会,和/或降低住院风险。
36.在本发明的第二个方面,提供了一种免疫测定试剂盒,其包含特异性结合c末端氨基酸序列qetciqg(seq idno:1)的单克隆抗体,以及以下中的至少一个:
[0037]-链霉亲和素包被的孔板;
[0038]-生物素化肽生物素-l-qetciqg(seq id no:4),其中l是任选的接头;
[0039]-用于夹心免疫测定的二抗;
[0040]-包含序列qetciqg(seq id no:1)的校准肽;
[0041]-抗体生物素化试剂盒;
[0042]-抗体hrp标记试剂盒;
[0043]-抗体放射性标记试剂盒;和
[0044]-测定可视化试剂盒。
[0045]
该免疫测定试剂盒适用于实施根据第一方面的方法,因此第二方面的优选实施方式将从以上对第一方面的优选实施方式的讨论中显而易见。例如,该试剂盒优选用于检测和/或监测患者的心血管疾病和/或评估患者的心血管疾病的可能性或严重程度。特异性结
合c末端氨基酸序列qetciqg(seq id no:1)的单克隆抗体优选是针对具有氨基酸序列qetciqg(seq id no:1)的合成肽而产生的单克隆抗体。优选地,所述单克隆抗体不识别或特异性结合所述c末端氨基酸序列的延长形式qetciqga(seq id no:2)。优选地,所述单克隆抗体不识别或特异性结合所述c末端氨基酸序列的截短形式qetciq(seq id no:3)。
[0046]
在第三方面,本发明提供特异性结合c末端氨基酸序列qetciqg(seq id no:1)的单克隆抗体。第三方面的优选实施方式将从以上对第一方面的优选实施方式的讨论中再次显而易见。例如,单克隆抗体优选是已针对具有氨基酸序列qetciqg(seq id no:1)的合成肽而产生的单克隆抗体。优选地,单克隆抗体不识别或特异性结合所述c末端氨基酸序列的延长形式qetciqga(seq id no:2)。优选地,单克隆抗体不识别或特异性结合所述c末端氨基酸序列的截短形式qetciq(seq id no:3)。
附图说明
[0047]
图1:抗体特异性。使用标准肽(qetciqg)(seq id no:1)、延长肽(qetciqga)(seq id no:2)、无义肽(glrpgseytv)(seq id no:7)和无义包被物(non-sense coater)(glrpgseytv-k-生物素)(seq id no:8)。
[0048]
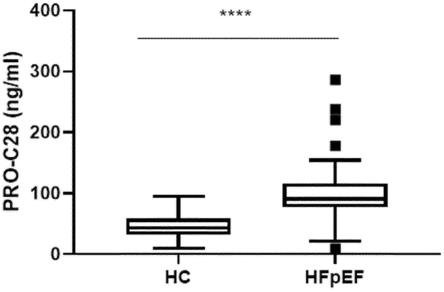
图2:健康对照(hc)和hfpef患者的血清中pro-c28的水平。
具体实施方式
[0049]
当前公开的实施方式在以下实施例中进行描述,列出这些实施方式旨在帮助理解本公开,并且不应被解释为以任何方式限制在随后的权利要求中定义的本公开的范围。提出以下实施例以向本领域普通技术人员提供完整的公开内容以及如何制作和使用所描述的实施方式的描述,并不旨在限制本公开的范围,也不旨在表示以下实验是全部或唯一进行的实验。已努力确保所用数字的准确性(例如数量、温度等),但应考虑一些实验误差和偏差。除非另有说明,否则份数是重量份数,分子量是重均分子量,温度是摄氏度,压力是大气压或接近大气压。
[0050]
在以下实施例中,采用以下材料和方法。
[0051]
材料和方法
[0052]
用于实验的所有试剂都是来自如sigma aldrich(st.louis,mo,usa)和merck(whitehouse station,nj,usa)等公司的高质量标准品。用于免疫和测定开发的合成肽购自genscript(new jersey,usa)。来自健康供体的人血清购自商业供应商(lee biosolutions,mo 63043,usa)。来自hfpef患者的人血清属于training-hf队列,是通过与西班牙巴伦西亚的incliva健康研究所(incliva health research institute in valencia,spain)的学术合作获得的。
[0053]
靶向pro-c28的单克隆抗体的产生
[0054]
通过针对在xxviii型胶原蛋白的c末端发现的7个氨基酸的序列qetciqg(seq id no:1)(“pro-c28”)而产生的抗体产生靶向xxviii型胶原蛋白c末端的单克隆抗体。选择这7个氨基酸的序列而不是更长的序列,例如10个氨基酸的c末端序列kecqetciqg(seq id no:5),以减少半胱氨酸残基的数量并因此避免在用于产生抗体的免疫原性肽中形成cys-cys桥。
[0055]
用于生成靶向pro-c28的单克隆抗体的方案如下。
[0056]
通过皮下注射包含100ug免疫原性肽(klh-cgg-qetciqg(seq id no:6)的200ul乳化抗原溶液开始对6-7周龄雌性balb/c小鼠(体重14-18g)进行免疫接种,其中
‘
khl’表示刺激免疫原性佐剂(stimune immunogenic adjuvant)(specol)(目录号7925000,invitrogen)中的钥孔血蓝蛋白,cgg是一个共轭接头。每两周重复免疫接种,直到达到稳定的血清抗体滴度水平。选择具有最高血清滴度和最佳抑制作用的小鼠进行融合,并在最后一次免疫接种后休息至少三周。随后,在分离脾用于细胞融合前三天,用在100ul 0.9%nacl溶液中的100ug免疫原性肽静脉内加强免疫小鼠。为了产生杂交瘤细胞,如gefter等人所述,将小鼠脾细胞与sp2/0骨髓瘤细胞融合。使用半固体培养基法在培养皿中克隆杂交瘤细胞。然后将克隆接种到96孔微量滴定板中以进一步生长,并应用有限稀释法促进单克隆生长。在链霉亲和素包被的板上进行的间接elisa用于筛选上清液反应性。生物素-qetciqg用作筛选肽,而标准肽(qetciqg(seq id no:1))、延长肽(qetciqga (seq id no:2))、无义肽(glrpgseytv(seq id no:7))和无义包被物(glrpgseytv-k-生物素(seq id no:8))用于进一步测试所述克隆的特异性。从杂交瘤细胞中收集上清液,并根据制造商的说明使用hitrap亲和柱(ge healthcare life science,little chalfront,buckinghamshire,uk)进行纯化。所有动物均按照动物福利指南(guidelines for animal welfare)进行治疗。
[0057]
克隆选择和表征
[0058]
在下文描述的竞争性elisa中,针对对标准肽(qetciqg(seq id no:1))的反应性筛选产生抗体的最佳杂交瘤,并选择表现出最高反应性的克隆用于产生靶向pro-c28的单克隆抗体。使用标准肽(qetciqg(seq id no:1))、延长肽(qetciqga (seq id no:2))、无义肽(glrpgseytv(seq id no:7))和无义包被物(glrpgseytv-k-生物素(seq id no:8))测试抗体特异性。使用克隆分型系统(clonotyping system)-hrp试剂盒,目录号5300-05(southern biotech,birmingham,al,usa)确定单克隆抗体的同种型。
[0059]
pro-c28 elisa
[0060]
将来自roche,目录号11940279的96孔链霉亲和素包被的elisa板用100μl/孔的溶解在测定缓冲液(25mm tbs-bte 2g/l nacl,ph8)中的生物素化肽生物素-qetciqg(seq id no:4)包被,20℃避光振荡孵育30分钟,随后在洗涤缓冲液(20mm tris,50mm nacl,ph7.2)中洗涤5次。此后,将20μl肽校准物或样品添加到合适的孔中,然后添加100μl纯化的抗体溶液(溶解在测定缓冲液中的对pro-c28特异的单克隆抗体),20℃振荡孵育1小时,然后在洗涤缓冲液中洗涤5次。接下来,将100μl二抗溶液(溶解在与用于对pro-c28特异的单克隆抗体相同的测定缓冲液中的辣根过氧化物酶(hrp)标记的抗小鼠抗体)添加到各个孔中,20℃振荡孵育1小时,然后在洗涤缓冲液中洗涤5次。最后,向各孔加入100μl四甲基联苯胺(tmb)(kem-en-tec目录号:438oh),将板在20℃下避光孵育15分钟,为了终止反应,添加100μl终止溶液(1%h2so4),然后在elisa读数器中以650nm作为参考(molecular devices,spectramax m,ca,usa),在450nm处分析板。使用4参数数学拟合模型绘制校准曲线。
[0061]
pro-c28 elisa技术评估
[0062]
使用人血清、人尿和edta、肝素或柠檬酸盐处理的人血浆样品(各类型样品四种)的两倍稀释液来评估线性度。线性度计算为未稀释样品的回收率的百分比。
[0063]
通过五个质量控制(qc)的10次独立运行和在两次测定中运行的两个试剂盒控制
来确定测定内和测定间变化。
[0064]
在添加标准肽的健康人血清样品中测量测定的准确性,并计算为血清在缓冲液中的回收率百分比。
[0065]
测量范围的下限(llmr)和测量范围的上限(ulmr)基于来自测定内和测定间变化的10条单独的标准曲线计算。
[0066]
pro-c28作为hfpef生物标志物的生物学验证
[0067]
使用上述pro-c28 elisa方案,在hfpef(射血分数保留的心力衰竭)患者队列和健康对照组队列的血清样品中测量pro-c28。患者人口统计数据如表1所示。
[0068]
表1:患者人口统计数据
[0069][0070]
*两组之间的年龄存在显著差异,但两组中任一组的年龄和pro-c28之间没有相关性。
[0071]
结果
[0072]
克隆选择和表征
[0073]
筛选产生抗体的最佳杂交瘤用于针对标准肽的反应性和选择性,并基于反应性,选择克隆nbh218#65 8c11-2f10-1h7并用于生产靶向pro-c28的单克隆抗体,用于pro-c28 elisa的技术和生物学评估。单克隆抗体为同种型:igg2b,k。未发现对延长肽、无义肽或无义包被物的反应性(图1)。
[0074]
pro-c28 elisa的技术评估
[0075]
进行了一系列技术验证以评估pro-c28 elisa测定。验证数据的总结如表2所示。
[0076]
表2:pro-c28竞争性elisa的技术特点
[0077][0078]
pro-c28作为hfpef生物标志物的生物学评估
[0079]
使用pro-c28 elisa,在射血分数保留的心力衰竭(hfpef)患者队列和健康对照(hc)队列的血清样品中测量pro-c28水平。然后使用mann-whitney检验(非参数数据)比较来自两个队列的血清样品中的生物标志物水平。结果如图2所示(其中结果显示为tukey的箱线图)。可以看出,与健康对照相比,hfpef患者血清中的pro-c28显著升高(p《0.0001)。
[0080]
此外,在研究过程中的三个不同时间点,测量了hfpef患者血清样品中的nt-probnp水平,然后使用spearman相关性将测得的nt-probnp浓度与测得的同一样品中的pro-c28(如上所述测量)浓度进行比较。如下所示,在表3中,发现hfpef队列中的pro-c28水平与nt-probnp显著相关,nt-probnp是用于诊断和监测hf的标准临床评估生物标志物。
[0081]
表3:pro-c28和nt-probnp之间的相关性
[0082][0083]
在本说明书中,除非另有明确说明,否则词语“或”的含义是以当满足任一或两个所述条件时返回真值的运算符的意义上使用的,而不是运算符“异或”,后者要求只满足其中一个条件。词语“包括”是在“包括”的意义上使用的,而不是“由
……
组成”的意思。上面承认的所有在先教导通过引用并入本文。对本文中任何先前发表的文件的承认不应被视为承认或表示其教导在本文日期为澳大利亚或其他地方的公知常识。
[0084]
参考文献
[0085]
1.lam cs,donal e,kraigher-krainer e,vasan rs,射血分数保留的心力衰竭的流行病学和临床病程(epidemiology and clinical course of heart failure with preserved ejection fraction),eur j heart fail 2011;13:18-28。
[0086]
2.lloyd-jones dm,hong y,labarthe d等,定义和设定促进心血管健康和减少疾病的国家目标:美国心脏协会到2020年及以后的战略影响目标(defining and setting national goals for cardiovascular health promotion and disease reduction:the american heart association's strategic impact goal through 2020and beyond),circulation 2010;121:586-613。
resonance in heart failure with preserved ejection fraction),j cardiovasc magn reson2018;20:55。
[0098]
14.schelbert eb,fridman y,wong tc等,射血分数保留的心肌纤维化和心力衰竭之间的时间关系:与基线疾病严重程度和随后的结果的关联(temporal relation between myocardial fibrosis and heart failure with preserved ejection fraction:association with baseline disease severity and subsequent outcome),jamacardiol 2017。
[0099]
15.nielsen mj,karsdal ma,kazankov k等,纤维化不仅仅是纤维化-乙型肝炎和丙型肝炎引起的损伤之间的基底膜建模和胶原蛋白代谢不同(fibrosis is not just fibrosis-basement membrane modelling and collagen metabolism differs between hepatitis b-and c-induced injury),aliment pharmacol ther2016;44:1242-1252。
[0100]
16.haykowsky mj,kouba ej,brubaker ph,nicklas bj,eggebeen j,kitzman dw,射血分数保留的老年心力衰竭患者的骨骼肌组成及其与运动不耐受的关系(skeletal muscle composition and its relation to exercise intolerance in older patients with heart failure and preserved ejection fraction),am j cardiol2014;113:1211-6。
[0101]
17.gebauer,j.m.,kobbe,b.,paulsson,m.&wagener,r,xxviii胶原蛋白的结构、进化和表达:斑马鱼的教训(structure,evolution and expression of collagen xxviii:lessons from the zebrafish),matrix biol.49,106
–
119(2016)。
[0102]
18.veit,g等,胶原蛋白xxviii,一种新的含有血管性血友病因子a结构域的蛋白质,在胶原蛋白结构域中有许多缺陷(collagen xxviii,a novel von willebrand factor a domain-containing protein with many imperfections in the collagenous domain),j.biol.chem.281,3494
–
3504(2006)。
[0103]
19.annis,d.s.,mosher,d.f.&roberts,d.d,nih public access.27,339
–
351(2009)。
[0104]
20.schiller,h.b等,肺损伤和修复中细胞外生态位的时间和隔室分辨蛋白质组分析(time-and compartment-resolved proteome profiling of the extracellular niche in lung injury and repair),mol.syst.biol.11,819
–
819(2015)。
[0105]
21.lai kky,shang s,lohia n,booth gc,masse dj,fausto n等,(2011)肝癌发生中的细胞外基质动力学:pdgfc转基因和pten无效小鼠模型的比较蛋白质组学研究(extracellular matrix dynamics in hepatocarcinogenesis:acomparative proteomics study of pdgfc transgenic and pten null mouse models),plos genet 7(6):e1002147.https://doi.org/10.1371/journal.pgen.1002147。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。