1.本发明涉及化学修饰的腺相关(aav)病毒及其在基因疗法中的用途。
背景技术:
2.基因疗法最初是为了校正造成遗传疾病的缺陷基因而开发的。如今,基因疗法被越来越多地用于治疗广范围的获得性疾病例如癌症。
3.基因疗法是基于将核酸治疗性递送到患者的细胞核中。所述核酸然后可能被插入到靶细胞的基因组中,或者可能保持游离。治疗性核酸向对象的靶细胞的递送可以通过各种不同方法来进行,包括使用合成载体和病毒载体。在众多可用的病毒载体(如反转录病毒、慢病毒、腺病毒等)中,重组腺相关病毒(aav)作为用于基因疗法的通用载体,尤其是在体内应用中越来越受欢迎。重组aav(raav)的主要优势在于其广泛的嗜性、高转导效率、持续的游离表达和高安全性,特别是因为野生型aav与任何人类疾病无关。
4.使用raav的人体临床试验证实了当靶向组织例如视网膜、肝脏或运动神经元时,可以在治疗水平上持久表达。使用raav作为基因载体治疗多种疾病的几项临床试验正在进行中。fda和ema最近已批准了voretigene neparvovec这是一种包含编码人视网膜色素上皮65kda蛋白(hrpe65)的cdna的腺相关病毒载体血清型2(aav2)衣壳,用于治疗由确认的双等位基因rpe65突变引起的遗传性视网膜营养不良导致的视力丧失。作为另一个实例,(onasemnogene abeparvovec-xioi)刚刚被fda批准用于治疗2岁以下患有脊髓性肌肉萎缩症(sma)的儿科患者。是一种aav9载体,能够将sma中的缺陷基因即smn1基因的功能性非突变拷贝递送到运动神经元中。
5.尽管取得了这些成功,但某些临床试验表明这些载体在治疗某些疾病方面存在一些限制。它们的第一个限制在于它们的免疫原性。由于它们的非整合本性,使用aav载体的系统性基因疗法,尤其是在儿科患者中,可能会受到组织增殖的限制,导致所述载体随时间而稀释。然而,载体的重新给药可能因病毒载体首次给药后触发的持久性中和抗体(nab)而被排除。此外,已进一步显示对某些aav血清型、尤其是血清型2的aav来说,预先存在的体液免疫在人类中非常普遍。抗aav中和抗体(nab)可以完全阻止在靶组织中的转导,导致缺乏疗效,尤其是当所述载体被直接给药到血流中时。因此,对aav-nab血清阳性的对象通常被排除在基因疗法试验之外。
6.aav的另一个限制在于它们的广泛嗜性,这可能导致转入基因在需要转入基因表达的组织之外的其他组织中表达。
7.作为基因载体的aav也可能遭受治疗指数降低的困扰。有时,需要给药高剂量的aav才能实现有效转导。例如,尽管aav2载体可以高效靶向肝脏,但由于所述载体的细胞内蛋白酶体介导的降解,转入基因表达可能仅限于非常少量的转染肝细胞,因此可能需要高剂量的aav-2才能达到追求的治疗效果。如此高的剂量不仅对载体生产构成挑战,而且提高了包括诱导nab在内的免疫应答的风险。
8.为了克服aav、特别是血清型2(aav2)的aav在基因疗法中的缺点,已提出了几种策
略。其中某些策略是基于载体的衣壳蛋白的修饰。
9.在这一方面,已显示aav2上暴露于表面的酪氨酸残基的突变能够避开磷酸化和随后的遍在蛋白化,从而避免蛋白酶体介导的降解。事实上,缺少衣壳遍在蛋白化据信可以改善病毒载体向细胞核的细胞内运输,从而在体外和体内提高肝细胞的转导效率(zhong等,pnas,2008,105,7827-7832;markusic等,molecular therapy,2010,18,2048-2056)。对于aav8来说,在视网膜细胞中的基因转移效率方面观察到类似的结果(petrs-silva,2009,molecular therapy,17:463-471)。
10.还提出了病毒衣壳的化学修饰,以便在衣壳上引入配体或掩盖某些暴露的氨基酸,从而改良aav的抗原性、嗜性或转导效率。作为第一种策略,几项研究探索了带有修饰的侧链的非天然氨基酸的遗传并入,所述侧链包含反应性基团例如炔基、叠氮基或氨基苯基,能够通过正交反应与配体进行后续的选择性偶联。例如在wo2015/062516中,通过遗传修饰将非天然氨基酸例如包含叠氮基的氨基酸插入到衣壳中,然后通过点击反应进行与配体的偶联步骤,以改变它对靶细胞的嗜性。
11.另一种策略在于病毒衣壳的直接化学修饰,而无需对衣壳蛋白进行任何初步的定点诱变。
12.在这一方面,lee等(biotechnol bioeng 2005,92:24-34)研究了将aav表面与活化的聚乙二醇链偶联,以保护所述载体免受中和抗体影响的潜力。horowitz等(bioconj chem,2011,22(4):529-532)描述了一种在使用甲基乙二醛糖化的基础上选择性掩蔽病毒衣壳上的精氨酸残基的化学方法。由此得到的化学修饰的aav保留了在小鼠大脑中感染神经元的能力,并在小鼠中系统性感染后从肝脏重定向到骨骼肌和心肌。此外,这些糖化的aav显示出改变的抗原性,这可能能够逃避抗体中和。最后,国际专利申请wo2017/212019提出了一种通过共价偶联带有异硫氰酸酯基团的配体对aav衣壳进行化学修饰的方法,所述异硫氰酸酯基团与氨基酸残基例如赖氨酸或精氨酸中存在的氨基反应。
13.然而,对于能够调节在基因疗法中用作基因递送载体时的aav的性质的新方法,仍存在着需求。
技术实现要素:
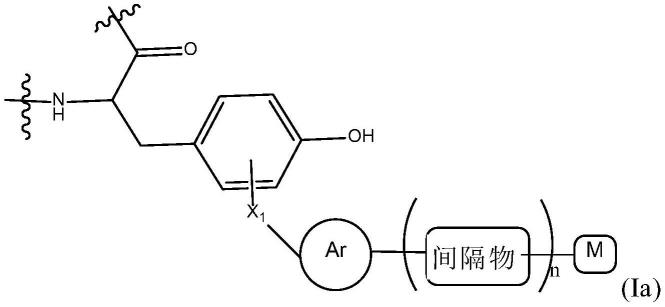
14.本发明涉及一种腺相关病毒(aav),其在衣壳中具有至少一个化学修饰的酪氨酸残基,其中所述化学修饰的酪氨酸残基为式(i)的结构:
[0015][0016]
其中:
[0017]-x1选自:
[0018]
并且
[0019]-ar是任选被取代的芳基或杂芳基组成部分。
[0020]
x1优选地在酚基的邻位处。
[0021]
在某些实施方式中,所述至少一个化学修饰的酪氨酸残基为式(ia)的结构:
[0022][0023]
其中
[0024]-x1和ar如上所定义,
[0025]-间隔物是用于将“ar”基团连接到功能性组成部分“m”的基团,所述间隔物优选地包含至多1000个碳原子,并且优选地采取任选地包含杂原子和/或环状组成部分的化学链的形式,
[0026]-n是0或1,并且
[0027]-m是包含选自空间屏蔽剂、标记剂、细胞类型特异性配体或药物组成部分及其组合的基团的功能性组成部分。
[0028]
在某些特定实施方式中,x1为式(a)的结构,和/或“ar”选自取代或未取代的苯基、吡啶基、萘基和蒽基。
[0029]
在某些其他实施方式中,所述aav的衣壳中的至少一个化学修饰的酪氨酸为式(1c)的结构:
[0030]
[0031]
其中:
[0032]-x2是-c(=o)-nh、-c(=o)-o、-c(=o)-o-c(=o)-、o-(c=o)-、nh-c(=o)-、nh-c(=o)-nh、-o-c=o-o-、o、nh、-nh(c=s)-或-(c=s)-nh-,优选为
–
(c=o)-nh-或
–
(c=o)-o-[0033]-x2在亚苯基的对位、间位或邻位处,优选地在对位处,
[0034]-间隔物、n和m如上所定义。
[0035]“间隔物”当存在时选自任选被取代的饱和或不饱和的直链或支链c
2-c
40
烃链、聚乙二醇、聚丙二醇、phpma、plga、烷基二胺的聚合物及其组合;和/或“m”可能包含细胞类型靶向配体或由细胞类型靶向配体组成,其优选地选自单糖或多糖、包括甾类激素在内的激素、肽例如rgd肽、肌肉靶向肽(mtp)或angiopep-2、蛋白质或其片段、膜受体或其片段、适体、包括重链抗体在内的抗体及其片段例如fab、fab’和vhh、scfv、spiegelmer、肽适体、维生素和药物例如cb1和/或cb2配体。
[0036]
在某些其他实施方式中,“间隔物”(当存在时)选自直链或支链c
2-c
20
烷基链、聚乙二醇、聚丙二醇、phpma、plga、烷基二胺的聚合物及其组合,所述聚合物具有2至20个单体;和/或“m”包含细胞类型特异性配体或由细胞类型特异性配体组成,所述配体源自于选自转铁蛋白、表皮生长因子(egf)和碱性成纤维细胞生长因子βfgf的蛋白质,包含一个或几个半乳糖、甘露糖、n-乙酰半乳糖胺残基、桥接galnac或甘露糖-6-磷酸的单糖或多糖,选自seq id no:1至seq id no:7的mtp,以及维生素例如叶酸。
[0037]
例如,m是特异性靶向肝细胞的细胞类型特异性配体,并包含至少一个式(iii)的组成部分:
[0038]
和/或
[0039]“间隔物”是包含2至10个单体的聚乙二醇链。
[0040]
作为另一个实例,所述aav在其衣壳中包含至少一个化学修饰的酪氨酸,其为式(ii)的结构:
[0041][0042]
在某些其他实施方式中,本发明的aav在衣壳中还具有至少一个另外的化学修饰的不同于酪氨酸残基的氨基酸残基,所述氨基酸残基优选地带有被式(v)的基团化学修饰的氨基:
[0043][0044]
其中:
[0045]-n*是氨基酸残基例如赖氨酸残基或精氨酸残基的氨基的氮,
[0046]-ar、间隔物、n和m具有与上文式(ii)中所定义的ar、间隔物、n和m相同的定义。
[0047]
本发明的aav可以是任何类型。例如,所述aav可以是重组aav,优选地选自具有野生型衣壳的aav、天然存在的血清型aav、变体aav、假型aav、具有杂合或突变的衣壳的aav和自身互补的aav。
[0048]
本发明还涉及一种对aav的衣壳进行化学修饰,更准确来说对aav的衣壳中的至少一个酪氨酸残基进行化学修饰的方法,所述方法包括将所述aav与带有选自芳基重氮盐和4-苯基-1,2,4-三唑-3,5-二酮(ptad)组成部分的反应性基团的化学试剂,在有利于所述反应性基团与所述aav的衣壳中存在的酪氨酸残基反应以便形成共价键的条件下温育。
[0049]
在某些实施方式中,本发明的方法包括将所述aav与式(vid)的化学试剂温育
[0050][0051]
以便在所述衣壳中获得至少一个式(ic)的化学修饰的酪氨酸残基:
[0052][0053]
其中:
[0054]-x2是-c(=o)-nh、-c(=o)-o、-c(=o)-o-c(=o)-、o-(c=o)-、nh-c(=o)-、nh-c(=o)-nh、-o-c=o-o-、o、nh、-c=s-nh或nh-c=s-,优选为
–
(c=o)-nh-或
–
(c=o)-o-,
[0055]-x2在苯基的对位、间位或邻位处,优选地在对位处,
[0056]-间隔物是包含2至400个碳原子的烃基,
[0057]-n是0或1,并且
[0058]-m是包含空间屏蔽剂、标记剂、细胞类型特异性配体或药物组成部分的化学组成部分。
[0059]
本发明还涉及一种aav,其可以通过或通过本发明的方法获得。
[0060]
本发明的另一个目的是一种药物组合物,其包含如上所定义的aav和至少一种可
药用赋形剂。所述aav或所述药物组合物可以用作诊断剂或药物,优选地用于基因疗法。
附图说明
[0061]
图1、图4c、图6c、图7c和图8c:通过sds-page和银染测量的aav衣壳蛋白完整性。向2、3、4、6、7或8(3e5或3e6当量)在tbs缓冲液(ph 9.3)中的溶液添加10
12
vg的aav2-luc-gfp、aav2-gfp和aav8-gfp载体,并在rt温育4h。将每种条件的10
10
vg通过sds-page和银染进行分析。vp1、vp2和vp3是构成aav衣壳的三种蛋白质。衣壳蛋白的分子量根据蛋白质梯标注在图像的右侧。aav2 2:与化合物2(发明例)温育的aav2;aav2 3:与化合物3(比较例)温育的aav2;aav2 4:与化合物4(比较例)温育的aav2;aav2 6:与化合物6(发明例)温育的aav2;aav2 7:与化合物7(发明例)温育的aav2;aav2 8:与化合物8(比较例)温育的aav2;aav8 4:与化合物4(比较例)温育的aav8;aav8 2:与化合物2(发明例)温育的aav2。
[0062]
图2、图5、图6、图7、图8和图9:斑点印迹分析。向化合物2、3、4、6、7、8、9、10、11和12(3e5或3e6当量)在tbs缓冲液(ph9.3)中的溶液添加10
12
vg的aav2-luc-gfp、aav2-gfp和aav8-gfp载体,并在rt温育4h。(a-b)使用识别组装的衣壳的a20或adk8抗体(a)或使用识别galnac和甘露糖的fitc-大豆凝集素或fitc-伴刀豆球蛋白a凝集素(b),将每种条件的109vg通过斑点印迹进行分析。
[0063]
图3、图4:western印迹。向化合物2、3或4(3e5或3e6当量)在tbs缓冲液(ph 9.3)中的溶液添加10
12
vg的aav2-luc-gfp或aav2-gfp载体,并在rt温育4h。使用针对衣壳蛋白的多克隆抗体以检测vp蛋白(a)或使用识别galnac糖的fitc-大豆凝集素(b-c),将10
12
vg的样品通过western印迹进行分析。vp1、vp2和vp3是构成aav衣壳的三种蛋白质。衣壳蛋白的分子量根据蛋白质梯标注在图像的右侧。b和c是来自于在显色期间使用短(b)和长(c)曝光时间的同一个印迹的图像。
[0064]
图10:通过facs分析确定的aav2-gfp和aav2 2:用化合物2(发明例)化学修饰的aav2(3e5和3e6当量)对hek细胞的感染力。
[0065]
图11:通过facs分析确定的aav2-gfp和aav2 2:用化合物2(发明例)化学修饰的aav2(3e5和3e6当量)对huh7细胞的感染力。
[0066]
图12a和12b:示出了根据本发明所述的“m”组成部分的实例。
具体实施方式
[0067]
据本发明人所知,现有技术中描述的用于化学修饰aav衣壳的方法靶向带有氨基的氨基酸残基例如精氨酸和赖氨酸。然而,还存在其他有兴趣进行化学修饰的其他氨基酸残基,例如暴露于表面的酪氨酸残基。事实上,暴露于表面的酪氨酸可能在免疫原性以及细胞中aav的蛋白酶体降解中发挥关键作用。
[0068]
本发明人设想了一种能够对aav衣壳表面上存在的酪氨酸残基进行化学修饰的新方法。这种方法依赖于芳基重氮基团或ptad基团与酪氨酸残基中的苯基产生共价偶联的特异性反应。
[0069]
本发明人制备了几种带有糖组成部分的ptad和重氮化物配体,用于化学修饰aav载体的衣壳上的酪氨酸残基。
[0070]
作为概念验证,本发明人显示,通过将aav粒子与带有n-乙酰半乳糖胺或甘露糖的
芳基重氮化物(化合物2、6、7和12)在碱性ph下的水性缓冲液中温育,可以将n-乙酰半乳糖胺和甘露糖组成部分共价固定在aav衣壳的表面上,正如通过使用大豆和伴刀豆球蛋白a凝集素检测的斑点印迹分析所证实的。
[0071]
本发明人还显示,所述共价偶联不改变aav2和aav8的衣壳蛋白亚单位vp1、vp2和vp3,表明aav的完整性得以维持,也正如分别通过使用a20抗体和adk8抗体的免疫染色所证实的。
[0072]
值得注意的是,本发明人进一步显示,用重氮化合物2化学修饰的aav2载体在非肝脏细胞系hek细胞中仍具有感染性,但与使用未化学修饰的载体观察到的相比显示出不太重要的转导效能(图10)。相反,在肝细胞系huh7(其表达低水平的aspgr)上,用重氮化合物2化学修饰的aav2载体显示出转入基因的表达提高,正如通过较高的荧光强度所证实的(图11)。因此,用带有糖的配体化学修饰衣壳的酪氨酸残基将导致aav的重新靶向及其体内嗜性的改变,从而可能降低脱靶效应。
[0073]
·
本发明的化学修饰的aav
[0074]
因此,本发明涉及一种在其衣壳中具有至少一个化学修饰的酪氨酸残基的腺相关病毒(aav)。
[0075]
当在本文中使用时,腺相关病毒(aav)是指一种具有约5kb长的单链线性dna基因组的依赖细小病毒科的小的无包膜病毒。野生型aav具有两个主要的开放阅读框(orf),其两侧带有两个反向末端重复序列(itr)。所述5’和3’orf分别编码复制和衣壳蛋白。所述itr含有145个核苷酸,并充当aav基因组复制原点和包装信号。在重组aav中,病毒的orf被外源基因表达盒代替,而复制和衣壳蛋白则以反式提供。
[0076]
因此,在本发明的情形中,重组aav是指已在病毒基因组中已经引入外源核酸序列的aav。所述外源核酸序列可以是任何类型,并且根据aav的目标用途进行选择。例如,所述核酸可以包含任何rna或dna序列。
[0077]
在优选实施方式中,本发明的aav是重组aav。通常,所述重组aav将作为基因载体用于体内或体外应用,这意味着本发明的aav是重组aav载体。关于aav作为基因疗法中的载体的综述,可以参考naso等,biodrugs,2017,31:317-334,其内容通过参考并入本文。
[0078]
仅作为说明,在基因疗法中用作载体的重组aav可以包含代替病毒orf并放置在两个itr之间的外源基因表达盒。所述表达盒可以包含启动子、感兴趣的基因和终止子。所述启动子和感兴趣的基因根据被靶向的组织/器官和所治疗的病症来选择。作为另一个实例,所述在基因疗法中使用的重组aav可以包含用于在细胞中进行同源重组的dna模板。这种重组aav可以与基因编辑工具相组合使用,用于体内、体外或离体促进靶细胞中的同源重组。所述基因编辑工具可以是任何类型,并包括但不限于crispr/cas9、锌指核酸酶、大范围核酸酶以及编码所述蛋白质的rna和dna。
[0079]
在本发明的情形中,术语“aav”包括所有类型的aav,包括野生型aav和重组或变体aav。aav变体包括但不限于具有突变或合成的衣壳的aav例如具有杂合衣壳的aav、假型aav以及自身互补的aav(scaav)。
[0080]
野生型aav的衣壳由被称为病毒蛋白1(vp1)、vp2和vp3的三种交叠的衣壳蛋白组成。衣壳的遗传工程改造是指所述衣壳蛋白的氨基酸替换,例如在它们的高变环中。
[0081]
当在本文中使用时,“具有遗传工程改造的衣壳的aav”或“具有突变衣壳的aav”是
pharmacol(2015),24,94-104中)而获得的血清型。
[0096]
在某些实施方式中,所述aav选自天然存在的血清型,优选地选自aav-2、aav-3b、aav-5、aav-8、aav-9和aavrh10,更优选为aav-2。例如,本发明的aav可以是血清型2的重组aav载体。
[0097]
所述aav可以靶向各种不同的细胞、组织和器官。被aav靶向的细胞的实例包括但不限于肝细胞;视网膜细胞,即感光细胞、视网膜色素上皮细胞(rpe);肌肉细胞,即成肌细胞、卫星细胞;中枢神经系统(cns)的细胞,即神经元、神经胶质;心脏细胞;外周神经系统(pns)的细胞;成骨细胞;肿瘤细胞;血液细胞,例如淋巴细胞、造血细胞包括造血干细胞、诱导多能干细胞(ips)等。可以被aav靶向的组织和器官的实例包括肝、肌肉、心肌、平滑肌、脑、骨骼、结缔组织、心、肾、肺、淋巴结、乳腺、髓鞘、前列腺、睾丸、胸腺、甲状腺、气管等。优选的细胞类型是肝细胞、视网膜细胞、肌肉细胞、cns的细胞、pns的细胞和造血细胞。优选的组织和器官是肝、肌肉、心、眼和脑。
[0098]
aav的嗜性可以随着它们的血清型而变。例如,aav-2可用于转导中枢神经系统(cns)、肾和感光细胞,而aav-8对转导cns、心、肝、感光细胞、视网膜色素上皮细胞(rpe)和骨骼肌有效。
[0099]
所述aav可以通过本领域中已知的任何方法来生产,例如在实施例部分中所描述的在感兴趣的细胞系例如hek293细胞中瞬时转染。在这一方面,人们可以参考naso等,biodrugs,2017,31:317-334,其提供了关于在基因疗法中作为载体的aav的综述,并描述了在工业规模上生产aav的常规方法。
[0100]
本发明的aav可能具有已被化学修饰的其他衣壳氨基酸。例如,所述aav可能包含已通过wo2017/212019中公开的方法修饰的一个或几个衣壳氨基,即通过将衣壳中的所述氨基与带有异硫氰酸酯反应性基团的配体反应。可选地或此外,本发明的aav可能具有通过糖化,例如通过如horowitz(同上)中所描述的与甲基乙二醛的反应修饰的一个或几个衣壳的精氨酸残基。
[0101]
通常,所述衣壳中的至少一个化学修饰的酪氨酸残基为式(i)的结构:
[0102][0103]
其中:
[0104]-x1选自:
[0105][0106]
并且
[0107]-ar是任选被取代的亚芳基或亚杂芳基组成部分。
[0108]
在优选实施方式中,本发明的aav在其衣壳中具有至少一个化学修饰的酪氨酸残基,其中所述至少一个化学修饰的酪氨酸残基为式(ia)的结构:
[0109][0110]
其中
[0111]-x1选自:
[0112][0113]-n是1或0。“n是1”意味着存在“间隔物”基团。“n是0”意味着不存在间隔物,
[0114]-ar是任选被取代的芳基或杂芳基组成部分,
[0115]-间隔物是将“ar”连接到“m”的化学基团,
[0116]-m是功能性组成部分,其本质取决于通过进行所述化学修饰所寻求的aav的功能改良。
[0117]
x1[0118]
x1为如上所述的式(a)或(b)的结构。优选地x1为式(a)的结构。
[0119]
x1可以在邻位、间位或对位处,优选在对位处。
[0120]
ar基团
[0121]
正如上文提到的,ar是取代或未取代的芳基或杂芳基组成部分。
[0122]
当在本文中使用时,“芳基”是指芳香环系统,其优选地具有6-14个原子,具有至少一个具有共轭π电子系统并且可以任选被取代的环。“芳基”可能含有超过一个芳香环,例如稠合环系统或被另一个芳基取代的芳基。芳基包括但不限于苯基、蒽基、萘基、茚基、二价联
苯基。
[0123]“杂芳基”是指杂芳基团。“杂芳基”是指一种化学基团,其优选地具有5-14个环原子,其中1至4个杂原子是所述芳香环中的环原子,并且其余的环原子是碳原子。适合的杂原子包括氧、硫、氮、磷和硒。适合的杂芳基包括呋喃基、噻吩基、吡啶基、吡咯基、n-烷基吡咯基、吡啶基-n-氧化物、嘧啶基、吡嗪基、咪唑基、苯并咪唑基、苯并呋喃基、苯并噻吩基、喹唑啉基和喹啉基。
[0124]
双环杂芳基的实例包括但不限于双环杂芳基团,可以提到的包括1h-吲唑基、苯并[l,2,3]噻二唑基、苯并[l,2,5]噻二唑基、苯并噻吩基、咪唑并[l,2-a]吡啶基、喹啉基、吲哚基和异喹啉基。
[0125]“取代”或“任选被取代”包括被一个或几个取代基,通常为1、2、3、4、5或6个取代基取代的基团。例如,所述取代基可以独立地选自c
1-c6烷基、芳基、c
3-c6环烷基、c
2-c6杂环烷基、c
1-c6烷氧基、c
1-c6烷基氨基、c
1-c6氨基烷基-、c
1-c6烷基氨基烷基-、-n3、-nh2、
–
f、-i、-br、-cl、-cn、c
1-c6烷酰基、c
1-c6羧基酯、c
1-c6酰基氨基、-cooh、-conh2、-no2、-so3h、c
1-c6氨基烷基、c
1-c6羟基烷基、c
1-c6卤代烷基、c
1-c6烷硫基、c
2-c
10
烷氧基烷基、c
2-c6烷氧基羰基氧基、-cn、-cf3和c
2-c6烷氧基烷基。
[0126]
优选的取代基是卤素、-oh、nh2、no2、c
1-c3烷基、c
1-c3烷氧基、c
1-c3羟基烷基和c
1-c3卤代烷基。
[0127]
在整个本技术中,短语“任选被取代”可以被短语“取代或未取代”代替。
[0128]
在某些实施方式中,“ar”选自包含5至14个环原子,例如6至10个环原子的芳基和杂芳基,所述芳基或杂芳基任选被取代。例如,所述芳基或杂芳基可以包含1、2或3个独立地选自卤素、-oh、nh2、no2、c
1-c3烷基、c
1-c3烷氧基、c
1-c3羟基烷基和c
1-c3卤代烷基的取代基。
[0129]
在某些特定实施方式中,“ar”选自取代或未取代的苯基、吡啶基、萘基和蒽基。所述芳香族化合物可以包含1至3个取代基,所述取代基优选独立地选自卤素、-oh、nh2、no2、c
1-c3烷基、c
1-c3烷氧基、c
1-c3羟基烷基和c
1-c3卤代烷基。
[0130]
间隔物基团
[0131]“间隔物”是任选的化学基团,因此其可以存在或不存在。
[0132]
当存在时,“间隔物”用于将“ar”基团连接到功能性组成部分“m”。“间隔物”可以是任何化学链,其可以包含杂原子以及环状组成部分例如环烷基或芳香族基团。“间隔物”可以包含多达1000个碳原子,并且甚至更多。所述间隔物的长度和化学本质可以根据打算与所述酪氨酸残基偶联的“m”组成部分和寻求的生物学效应进行优化。事实上,除了连接功能之外,“间隔物”可用于改善功能性组成部分“m”的性质。例如,“间隔物”可以降低“m”相对于衣壳的空间位阻,提高“m”与感兴趣的生物学实体结合的可及性,改进“m”与感兴趣的实体的结合和/或提高“m”的可溶性。
[0133]
在某些实施方式中,“间隔物”是包含2至1000个碳原子,优选地2至500个碳原子、2至300个碳原子,例如2至100个碳原子、2至40个碳原子、4至30个碳原子或4至20个碳原子的化学链基团。
[0134]
通常,“间隔物”选自包括均聚物、共聚物和嵌段聚合物在内的聚合物,肽,寡糖,以及任选地被一个或几个杂原子(例如s、o、se、p或nh)中断,任选地在其至少一个末端具有杂原子例如s、o和nh,和任选地被一个或几个取代基例如羟基、卤素、c
1-c3烷氧基、-cn、-cf3或c1-c3烷基取代的饱和或不饱和的烃链,及其组合。
[0135]
当在本文中使用时,“组合”意味着所述间隔物基团可以包含通过适合的基团连接的几个(例如2、3、4、5或6个)烃链、寡聚物链或聚合物链,所述适合的基团例如
–
o-、
–
s-、
–
nhc(o)-、-oc(o)-、-c(o)-o-c(o)-、-nh-、-nh-co-nh-、-o-co-nh-、nh-(cs)-nh-、nh-cs-、磷酸二酯或硫代磷酸酯基团。
[0136]
在某些实施方式中,所述间隔物可以选自聚醚例如聚乙二醇(peg)和聚丙二醇、聚乙烯醇(pva)、聚酯例如聚乳酸酯、聚丙烯酸酯、聚甲基丙烯酸酯、聚硅氧烷、聚酰胺例如聚己内酯和聚(n-(2-羟基丙基)甲基丙烯酰胺)(phpma)、聚(d,l-乳酸-共-乙醇酸)(plga)、烷基二胺的聚合物、在至少一个末端上具有杂原子例如o、nh和s的不饱和或饱和的支链或非支链烃链,及其组合。
[0137]
当在本文中使用时,烷基二胺是指nh
2-(ch2)
r-nh2,其中r是2至20的整数,例如2至10,例如2、3、4和5。烷基二胺的聚合物(也被称为聚胺)是指式nh
2-[(ch2)
r-nh]
t-h的化合物,其中r如上所定义,并且t是至少为2的整数,例如至少3、4、5、10或更大。感兴趣的烷基二胺的聚合物是例如亚精胺和精胺。
[0138]
例如,所述间隔物包含至少一个包含2至40个单体例如2至10或2至6个单体的聚乙二醇组成部分。仅供说明,所述间隔物可以包含通过连接物连接在一起的2至10个三乙二醇嵌段。作为另一个实例,所述间隔物可以是c
12
亲水性三乙二醇乙胺衍生物。或者,所述间隔物可以是饱和或不饱和的c
2-c
40
烃链,特别是c
10-c
20
烷基链或c
2-c
10
烷基链例如c6烷基链。所述烷基链可以在至少一个末端上具有例如nh、s或o的基团。
[0139]
作为进一步的实例,所述间隔物可以选自亚精胺、腐胺、精胺及其组合。
[0140]
在特定实施方式中,所述间隔物基团选自直链或支链c
2-c
20
烷基链、聚乙二醇、聚丙二醇、phpma、plga、二氨基烷基的聚合物及其组合。优选地,所述聚乙二醇、聚丙二醇、plga、phpma和烷基二胺的聚合物包含2至40个单体,优选地2至10或10至20个单体。
[0141]
例如,“间隔物”可以包含一个或几个(例如2、3、4或5个)三乙二醇嵌段。
[0142]“m”组成部分
[0143]
功能性组成部分“m”可以是任何类型。“m”通常根据在对aav的衣壳进行化学修饰时所寻求的生物学效应来选择。
[0144]
例如,“m”可以包含选自靶向剂、空间屏蔽剂、标记剂或药物的组成部分。“m”也可以是包括磁性(纳米)粒子在内的(纳米)粒子和量子点。例如,m可以是铁、染色剂、硅、金或碳(纳米)粒子。
[0145]
在某些实施方式中,“m”包含标记剂或由标记剂组成,所述标记剂例如荧光染料如荧光素、罗丹明、硼-二吡咯甲川(bodipy)染料和alexa fluor,或放射性核素。
[0146]
在其他实施方式中,“m”包含空间屏蔽剂或由空间屏蔽剂组成,所述空间屏蔽剂是例如能够屏蔽衣壳的某些表位,由此避免中和抗体结合的试剂。例如,“m”可以是聚乙二醇(peg)、phpma或多糖。
[0147]
在特定实施方式中,“m”包含能够屏蔽酪氨酸残基,由此避免aav在细胞中的蛋白酶体降解的空间屏蔽剂,或由所述空间屏蔽剂组成。
[0148]
在某些实施方式中,m包含细胞类型特异性配体、即能够靶向特定细胞类型的配体,或由所述配体组成。这种配体可能能够修改aav的嗜性,即它选择性感染和/或转导给定
细胞系、组织或器官的能力。
[0149]
例如,“m”可以是与靶细胞的膜生物学实体(例如膜受体)特异性结合的配体。所述配体可以是例如单糖或多糖、包括甾类激素在内的激素、肽例如rgd肽、angiopep-2、肌肉靶向肽、蛋白质或其片段、膜受体或其片段、cb1和cb2配体、适体、包括重链抗体在内的抗体及其片段例如fab、fab’和vhh、scfv、spiegelmer、肽适体、已知与靶生物学实体结合的小化学分子等。
[0150]
在某些实施方式中,“m”包含源自于蛋白质例如转铁蛋白、表皮生长因子(egf)和碱性成纤维细胞生长因子βfgf的细胞类型特异性配体,或由所述配体组成。
[0151]
在某些其他实施方式中,“m”包含源自于例如包含一个或几个半乳糖、甘露糖、甘露糖-6-磷酸、n-乙酰半乳糖胺(galnac)和桥接galnac的单糖或多糖的细胞类型特异性配体,或由所述配体组成。所述单糖或多糖可以是天然或合成的。
[0152]
在另一个实施方式中,“m”包含源自于维生素例如叶酸的细胞类型特异性配体,或由所述配体组成。
[0153]
根据一个实施方式,所述包含在“m”中的细胞类型特异性配体可以源自于或可以包含肌肉靶向肽(mtp)。所述配体可以包含选自下述的氨基酸序列:asslnia(seq id no:1);wdangkt(seq id no:2);getrapl(seq id no:3);cghhpvyac(seq id no:4);haiyprh(seq id no:5);环状cqlfplfrc(seq id no:6)或如下所示的seq id no:7的序列:
[0154]
r-x-r-r-b-r-r-x-r-f-q-i-l-y-r-x-r-b-r-x-r_b(seq id no:7)
[0155]
其中x是氨基己酸残基,并且b是β-丙氨酸残基。
[0156]
当在本文中使用时,seq id no:6的环状cqlfplfrc是指:
[0157][0158]
在某些实施方式中,“m”是癌细胞靶向肽,并包含肽例如rgd,包括环状rgd。
[0159]
当“m”包含肽组成部分例如肌肉靶向肽(mtp)时,所述肽组成部分可以在其n-端或c-端包含化学修饰。例如,所述肽组成部分的n-端可以被酰化或偶联到组成部分例如-c(=o)-(peg组成部分)-nh2。
[0160]
在另一个实施方式中,“m”包含源自于小分子或激素例如萘普生、布洛芬、胆甾醇、黄体酮或雌二醇的细胞类型特异性配体,或由所述配体组成。
[0161]
在另一个实施方式中,“m”包含cb1和/或cb2配体或由cb1和/或cb2配体组成,例
如:
[0162][0163]
被去唾液酸糖蛋白受体(aspgpr)识别的源自于半乳糖的配体可用于特异性靶向肝细胞。因此,在某些实施方式中,“m”是用于特异性靶向肝细胞的配体,并包含至少一个式(iiia)、(iiib)或(iiic)的组成部分:
[0164][0165]
在某些其他实施方式中,“m”是用于靶向肌肉细胞、特别是骨骼肌细胞的配体,并且包含至少一个甘露糖-6-磷酸组成部分:
[0166][0167]
在某些其他实施方式中,“m”是用于感光细胞或神经元细胞的配体,并包含至少一个式(iiif)的甘露糖组成部分:
[0168][0169]
在某些实施方式中,“m”是多价的,意味着它包含至少两个(例如2、3、4、5或6个)感兴趣的配体组成部分,例如上文所描述的细胞类型特异性配体。
[0170]
例如,m可以包含带有几个(例如至少2、3、4、5或6个)细胞类型配体的多功能连接物。所述细胞类型配体可以相同或不同。
[0171]
例如,“m”可以包含式(iv)的组成部分:
[0172][0173]
其中n是1至100、优选地1至20的整数。
[0174]
作为多价配体的另一个实例,“m”可以包含式(iv)的组成部分,其中galnac基团被甘露糖、磷酸-6-甘露糖、桥接galnac、cb1和/或cb2配体或肽代替。
[0175]
在某些特定实施方式中,“m”可以包含标记组成部分例如荧光标记物或放射性核素和细胞类型特异性配体两者。仅供说明,m可以是:
[0176]
即与k-fitc相连的seq id no:1的肌肉靶向肽。
[0177]
可用作“m”组成部分的化学组成部分的其他实例提供在图12a和图12b中。
[0178]
正如上文提到的,优选的化学修饰的aav是包含至少一个式(ia)或(i)的化学修饰的酪氨酸的aav,其中x1为式(a)的结构。
[0179]
在特定实施方式中,x1在所述酪氨酸的苯基的邻位处。因此,本发明涉及aav粒子,其包含存在于衣壳中的至少一个式(ib)的化学修饰的酪氨酸:
[0180][0181]
其中“ar”、“间隔物”、n和“m”如上对于式(i)所定义。
[0182]
在本发明的某些实施方式中,所述衣壳中存在的化学修饰的酪氨酸为式(ib)的结
构,并且由下述特点中的一个或几个进一步表征:
[0183]
‑“
ar”选自取代或未取代的苯基、吡啶基、萘基和蒽基。“ar”可以包含1至3个取代基,所述取代基优选独立地选自卤素、-oh、nh2、no2、c
1-c3烷基、c
1-c3烷氧基、c
1-c3羟基烷基和c
1-c3卤代烷基,和/或
[0184]
‑“
间隔物”当存在时选自任选被取代的饱和或不饱和的、直链或支链c
2-c
40
烃链、聚乙二醇、聚丙二醇、phpma、plga、烷基二胺的聚合物及其组合,所述聚合物优选地包含2至40个单体,和/或
‑“
m”包含细胞类型靶向配体或由细胞类型靶向配体组成,所述配体优选地选自单糖或多糖、包括甾类激素在内的激素、肽例如rgd肽、肌肉靶向肽(mtp)或angiopep-2、蛋白质或其片段、膜受体或其片段、适体、包括重链抗体在内的抗体及其片段例如fab、fab’和vhh、scfv、spiegelmer、肽适体、维生素和小化学分子例如药物如cb1和/或cb2配体。
[0185]
在另一个实施方式中,所述衣壳中存在的化学修饰的酪氨酸为式(ib)的结构,并且由下述特点中的一个或几个进一步表征:
[0186]
‑“
ar”选自任选被取代的苯基或吡啶基,和/或
[0187]
‑“
间隔物”(当存在时)选自直链或支链c
2-c
40
、优选地c
2-c
20
烷基链、聚乙二醇、聚丙二醇、phpma、plga、烷基二胺的聚合物及其组合,其中所述聚合物优选地包含2至40个单体,和/或
[0188]
‑“
m”包含细胞类型特异性配体或由细胞类型特异性配体组成,所述配体源自于蛋白质例如转铁蛋白、表皮生长因子(egf)和碱性成纤维细胞生长因子βfgf,如上所述的肌肉靶向肽,和例如包含一个或几个半乳糖、甘露糖、甘露糖-6-磷酸、n-乙酰半乳糖胺或桥接galnac的单糖或多糖,cb1和/或cb2配体,以及维生素例如叶酸。
[0189]
在特定实施方式中,“ar”是任选被取代的苯基。通常,所述苯基可以被一个或几个取代基取代,所述取代基选自卤素例如cl、br、i或f、c
1-c6烷基、c
1-c6羟基烷基、c
1-c6烷氧基、c
1-c6卤代烷基、-cn、-no2等。
[0190]
在某些实施方式中,“ar”是未取代的苯基,所述苯基通过x2连接物连接到间隔物基团(当n是1时)或m基团(当n是0时)。
[0191]
因此,本发明的另一个目的是一种包含至少一个化学修饰的酪氨酸的aav,所述化学修饰的酪氨酸为式(ic)的结构:
[0192][0193]
其中:
[0194]-x2是-c(=o)-nh、-c(=o)-o、-c(=o)-o-c(=o)-、o-(c=o)-、nh-c(=o)-、nh-c(=o)-nh、以及-o-c=o-o-、o、nh、nh(c=s)-、-(c=s)-nh-,优选为
–
(c=o)-nh-或
–
(c=o)-o-,并且
[0195]
‑“
间隔物”、n和m如上所描述,
[0196]-x2可以在苯基的对位、间位或邻位处,优选在对位处。
[0197]
在本发明的某些实施方式中,所述衣壳中存在的化学修饰的酪氨酸为式(ic)的结构,并且由下述特点中的一个或几个进一步表征:
[0198]
‑“
间隔物”当存在时选自任选被取代的饱和或不饱和的、直链或支链c
2-c
40
烃链、聚乙二醇、聚丙二醇、phpma、plga、烷基二胺的聚合物及其组合,所述聚合物优选地包含2至40个单体,和/或
‑“
m”包含细胞类型靶向配体或由细胞类型靶向配体组成,所述配体优选地选自单糖或多糖、包括甾类激素在内的激素、肽例如rgd肽、肌肉靶向肽(mtp)或angiopep-2、蛋白质或其片段、膜受体或其片段、适体、包括重链抗体在内的抗体及其片段例如fab、fab’和vhh、scfv、spiegelmer、肽适体、维生素和小化学分子例如药物如cb1和/或cb2配体。
[0199]
在另一个实施方式中,所述衣壳中存在的化学修饰的酪氨酸为式(ic)的结构,并且由下述特点中的一个或几个进一步表征:
[0200]
‑“
间隔物”(当存在时)选自直链或支链c
2-c
40
、优选地c
2-c
20
烷基链、聚乙二醇、聚丙二醇、phpma、plga、烷基二胺的聚合物及其组合,其中所述聚合物优选地包含2至40个单体,和/或
[0201]
‑“
m”包含细胞类型特异性配体或由细胞类型特异性配体组成,所述配体源自于蛋白质例如转铁蛋白、表皮生长因子(egf)和碱性成纤维细胞生长因子βfgf,如上所述的肌肉靶向肽,和例如包含一个或几个半乳糖、甘露糖、甘露糖-6-磷酸、n-乙酰半乳糖胺或桥接galnac的单糖或多糖,cb1和/或cb2配体,以及维生素例如叶酸。
[0202]
在某些实施方式中,x2是-c(=o)nh-并在对位处。因此,本发明还涉及一种aav,其包含存在于衣壳中的至少一个化学修饰的酪氨酸,所述化学修饰的酪氨酸为式(id)的结构:
[0203][0204]
其中n、m和间隔物如上所定义。
[0205]
在某些实施方式中,n是1。
[0206]
在某些另外的或其他实施方式中,所述存在于衣壳中的化学修饰的酪氨酸为式(id)的结构,并且由下述特点中的一个或几个进一步表征:
[0207]
‑“
间隔物”当存在时选自任选被取代的饱和或不饱和的、直链或支链c
2-c
40
烃链、聚乙二醇、聚丙二醇、phpma、plga、烷基二胺的聚合物及其组合,所述聚合物优选地包含2至40个单体,和/或
[0208]
‑“
m”包含细胞类型靶向配体或由细胞类型靶向配体组成,所述配体优选地选自单糖或多糖、包括甾类激素在内的激素、肽例如rgd肽、肌肉靶向肽(mtp)或angiopep-2、蛋白
质或其片段、膜受体或其片段、适体、包括重链抗体在内的抗体及其片段例如fab、fab’和vhh、scfv、spiegelmer、肽适体、维生素和小化学分子例如药物如cb1和/或cb2配体。
[0209]
在另一个实施方式中,所述存在于衣壳中的化学修饰的酪氨酸为式(id)的结构,并且由下述特点中的一个或几个进一步表征:
[0210]
‑“
间隔物”(当存在时)选自直链或支链c
2-c
40
、优选地c
2-c
20
烷基链、聚乙二醇、聚丙二醇、phpma、plga、烷基二胺的聚合物及其组合,其中所述聚合物优选地包含2至40个单体,和/或
[0211]
‑“
m”包含细胞类型特异性配体或由细胞类型特异性配体组成,所述配体源自于蛋白质例如转铁蛋白、表皮生长因子(egf)和碱性成纤维细胞生长因子βfgf,如上所述的肌肉靶向肽,和例如包含一个或几个半乳糖、甘露糖、甘露糖-6-磷酸、n-乙酰半乳糖胺或桥接galnac的单糖或多糖,cb1和/或cb2配体,以及维生素例如叶酸。
[0212]
在某些其他实施方式中,所述存在于衣壳中的化学修饰的酪氨酸为式(ia)的结构,其中x1为式(b)的结构,优选地在对位处,并且由下述特点中的一个或几个进一步表征:
[0213]
‑“
间隔物”当存在时选自任选被取代的饱和或不饱和的、直链或支链c
2-c
40
烃链、聚乙二醇、聚丙二醇、phpma、plga、烷基二胺的聚合物及其组合,所述聚合物优选地包含2至40个单体,和/或
[0214]
‑“
m”包含细胞类型靶向配体或由细胞类型靶向配体组成,所述配体优选地选自单糖或多糖、包括甾类激素在内的激素、肽例如rgd肽、肌肉靶向肽(mtp)或angiopep-2、蛋白质或其片段、膜受体或其片段、适体、包括重链抗体在内的抗体及其片段例如fab、fab’和vhh、scfv、spiegelmer、肽适体、维生素和小化学分子例如药物如cb1和/或cb2配体。
[0215]
在另一个实施方式中,所述存在于衣壳中的化学修饰的酪氨酸为式(ia)的结构,其中x1为式(b)的结构,优选地在对位处,并且由下述特点中的一个或几个进一步表征:
[0216]
‑“
间隔物”(当存在时)选自直链或支链c
2-c
40
、优选地c
2-c
20
烷基链、聚乙二醇、聚丙二醇、phpma、plga、烷基二胺的聚合物及其组合,其中所述聚合物优选地包含2至40个单体,和/或
[0217]
‑“
m”包含细胞类型特异性配体或由细胞类型特异性配体组成,所述配体源自于蛋白质例如转铁蛋白、表皮生长因子(egf)和碱性成纤维细胞生长因子βfgf,如上所述的肌肉靶向肽,和例如包含一个或几个半乳糖、甘露糖、甘露糖-6-磷酸、n-乙酰半乳糖胺或桥接galnac的单糖或多糖,cb1和/或cb2配体,以及维生素例如叶酸。
[0218]
仅供说明,本发明的aav可以在衣壳中包含至少一个式(iia)、(iib)、(iic)或(iid)的化学修饰的酪氨酸:
[0219][0220]
本发明的aav可以在衣壳中包含至少一个式(iie)、(iif)或(iig)的化学修饰的酪氨酸:
[0221]
[0222][0223]
在所有上述实施方式,特别是其中至少一个化学修饰的蛋白质为式(i)、(ia)、(ib)、(ic)(id)、(iia)、(iib)、(iic)(iid)、(iie)、(iif)和(iig)的结构的实施方式中,所述aav优选为重组avv,更优选为重组aav载体。
[0224]
正如上文提到的,所述aav可能具有“天然存在的”衣壳或遗传修饰的衣壳,即在至少一个衣壳蛋白即vp1、vp2和/或vp3中包含一个或几个突变。
[0225]
在某些另外的或可选实施方式中,所述aav可以具有选自aav-2、aav-3b、aav-5、aav-8、aav-9和aavrh10,更优选为aav-2的血清型。
[0226]
可选地,所述aav具有合成的血清型。
[0227]
在某些其他实施方式中,本发明的aav可能在衣壳中具有至少一个另外的化学修饰的不同于酪氨酸残基的氨基酸残基,例如精氨酸或赖氨酸残基。在某些实施方式中,所述氨基酸残基在其侧链中带有氨基,并被式(v)的基团化学修饰:
[0228][0229]
其中:
[0230]-n*是氨基酸残基例如赖氨酸残基的侧链的氨基的氮,
[0231]-ar、间隔物、n和m如式(ia)、(ib)、(ic)和(id)中所定义。自不用说,式(v)中的ar、间隔物、n和m可以与如上所述的至少一个化学修饰的酪氨酸中存在的相同或不同。
[0232]
所述氨基上的修饰可以如wo2017212019中所述引入,其内容通过参考并入本文。
[0233]
aav衣壳的化学修饰可能改变一种或几种生物学功能和/或性质。取决于共价结合在化学修饰的aav表面上的“m”的本质,所述化学修饰的aav与相同但未化学修饰的aav相比可能具有一种或几种改良的生物学性质,例如:
[0234]-改良的嗜性,例如aav对特定器官、组织或细胞(体内给药或转导培养物中的组织或细胞)的提高的选择性,或aav的选择性从一种组织/器官/细胞转移到另一种,和/或
[0235]-aav的改变的免疫反应性,例如aav的降低的免疫原性和/或降低的对中和抗体的亲和性,和/或所述aav在体内给药时引发改变的体液应答,例如不产生针对aav的中和抗体,
[0236]-aav粒子的感染效率提高,和/或
[0237]-aav对特定细胞、组织或器官的转导效率提高,
[0238]-当转导培养物中的细胞时细胞毒性降低,
[0239]-在癌细胞中诱导细胞靶向性死亡,
[0240]-在用aav粒子体内给药后或体外修饰细胞后可视化/监测这些aav粒子,
[0241]-治疗诊断应用,例如与治疗剂和诊断剂组合。
[0242]
在某些实施方式中,本发明的化学修饰的aav与未化学修饰的aav相比可能具有更高的转导效率,这可能是由于向细胞核的细胞内运输增加,蛋白酶体降解减少,更高效的核内脱衣壳,更快的载体基因组稳定化,和/或与中和抗体的相互作用降低,和/或抗体介导的体内aav清除减少。在某些其他实施方式中,所述aav与未化学修饰的aav相比在体内或体外可能具有更高的感染效率和/或对给定细胞、组织或器官提高的选择性。
[0243]
在某些其他实施方式中,当所述aav被用作药物例如基因载体时,此类改良的性质可能导致所述aav的治疗指数提高,这可能是由于为实现所寻求的治疗效果向患者给药的剂量的降低和/或所述aav的毒性降低。
[0244]
在特定实施方式中,本发明的化学修饰的aav对选自肝、心、脑、关节、视网膜和骨骼肌的器官或细胞显示出偏好的嗜性。在另一个或另外的实施方式中,本发明的化学修饰的aav对选自但不限于肝细胞、心肌细胞、肌细胞、神经元、运动神经元、视网膜色素细胞、感光细胞、软骨细胞、造血干细胞(hsc)或诱导多能干细胞(ips)的培养细胞显示出偏好的嗜性。
[0245]
·
制备本发明的化学修饰的aav的方法
[0246]
本发明还涉及一种对aav的衣壳进行化学修饰,更准确来说对aav的衣壳中的至少一个酪氨酸残基进行化学修饰的方法,所述方法包括将所述aav与带有选自芳基重氮盐和4-苯基-1,2,4-三唑-3,5-二酮(ptad)组成部分的反应性基团的化学试剂,在有利于所述反应性基团与所述aav的衣壳中存在的酪氨酸残基反应以便形成共价键的条件下温育。
[0247]
在特定实施方式中,本发明的方法用于获得在衣壳中包含至少一个化学修饰的酪氨酸残基的化学修饰的aav,其中所述化学修饰的酪氨酸残基为式(ia)的结构:
[0248][0249]
所述方法包括将所述aav与选自下述的化学试剂:
[0250][0251]
在有利于所述化学试剂与所述aav的衣壳中存在的酪氨酸残基反应以便形成共价键的条件下温育。
[0252]
自不用说:
[0253]-ar、间隔物和n如上对于式(ia)所定义,并且
[0254]-当x1为式(a)的结构时,所述化学试剂为式(via)的结构,而当x1为式(b)的结构时,所述化学试剂为式(vib)的结构。
[0255]
通常,将所述aav粒子与所述化学试剂在适合于促进酪氨酸残基的苯基与所述化学试剂之间形成共价键而不损害所述aav的结构完整性的条件下温育。
[0256]
所述温育可以在具有5至11、优选地7至10、例如8.5至10.5或9至10的ph的水性缓冲液中进行。
[0257]
所述缓冲液可以选自tris缓冲液、碳酸钠-碳酸氢钠缓冲液、磷酸盐缓冲液例如pbs或dulbecco磷酸盐缓冲盐水(dpbs)。
[0258]
当所述化学试剂为式(via)的结构时,所述水性缓冲液的ph可以是碱性的,例如高于7,例如8.5至10,例如9至10,例如9.0至9.6。这种碱性ph可能能够提高所述芳基重氮盐试剂对酪氨酸残基的苯基的反应性和/或选择性。例如,适合于进行所述aav与芳基重氮盐试剂的温育的缓冲液是tris缓冲液。
[0259]
所述温育可以持续几分钟至几小时,例如5min至6h,例如3至4小时。通常,所述温育在达到足够的偶联得率时结束。
[0260]
所述温育的温度通常为10℃至50℃。优选地,所述温育在室温,即18℃至30℃,例如20℃左右的温度下进行。
[0261]
所述温育可以在搅拌下进行。
[0262]
所述化学试剂与aav粒子的摩尔比可以为1.10至1.108,例如1.105至1.107,例如1.106至5.106。
[0263]
所述介质可以包含一种或几种另外的化合物。例如,当所述化学试剂为式(vic)的结构时,所述介质可能包含氧化剂或产生氧化剂的体系例如h2o2。
[0264]
所述芳基重氮盐试剂中存在的平衡阴离子可以是任何类型,优选为tso-、bf
4-、cl-、aco-、pf
6-、tfo-或cf3co
2-。
[0265]
在特定实施方式中,得到的aav包含至少一个式(ib)的化学修饰的酪氨酸。因此,所述化学试剂为式(via)的结构:
[0266][0267]
其中ar、间隔物、n和m如式(ib)中所定义。
[0268]
在某些其他实施方式中,得到的aav包含至少一个式(ic)的化学修饰的酪氨酸。因此,所述化学试剂为式(vid)的结构:
[0269][0270]
其中x2、间隔物、n和m如式(ic)中所定义。
[0271]
在另一个实施方式中,得到的aav包含至少一个式(id)的化学修饰的酪氨酸。因此,所述化学试剂为式(vie)的结构:
[0272][0273]
其中间隔物、n和m如式(id)中所定义。
[0274]
本发明的方法可以在如上所述的温育步骤之前或之后包括一个或几个另外的步骤。
[0275]
例如,本发明的方法可以包括提供或产生所述待化学修饰的aav粒子的步骤。
[0276]
本发明还可以包括提供或制备所述化学试剂的步骤。
[0277]
所述化学试剂可以通过合成路线来生产。例如,式(viia)的化学试剂可以如下制备:从硝基衍生物通过例如使用pd/c作为催化剂加氢,将-no2还原成-nh2,然后从苯胺衍生物通过例如与tbuono反应,形成芳基重氮基团。仅仅作为说明,人们可以参考在实施例部分中描述的式ii的化合物的合成。
[0278]
本发明的方法还可以在所述温育步骤后包括一个或几个另外的步骤,例如:
[0279]-在温育步骤结束时将未反应的化学试剂淬灭的步骤,和/或
[0280]-通过例如透析或切向流过滤除去所述未反应的试剂的步骤,和/或
[0281]-收集所述化学修饰的aav粒子的步骤,和/或
[0282]-纯化所述化学修饰的aav粒子的步骤,和/或
[0283]-回收所述化学修饰的aav粒子的步骤,和/或
[0284]-配制和/或包装所述化学修饰的aav的步骤。
[0285]
本发明的方法还可以包括对所述aav衣壳的酪氨酸残基之外的氨基酸残基进行化学修饰的步骤。例如,所述另外的化学修饰的氨基酸残基可以在其侧链中带有氨基。
[0286]
在特定实施方式中,本发明的方法可以包括将所述aav与式(vii)的化学试剂:
[0287][0288]
在有利于促进所述化学试剂与所述aav的衣壳中存在的氨基酸残基例如赖氨酸残基或精氨酸残基的氨基反应,以便形成共价键的条件下温育。这个步骤能够按照下式对所述衣壳的氨基酸残基中存在的氨基进行化学修饰:
[0289][0290]
其中:
[0291]-n*是氨基酸残基例如赖氨酸残基的氨基的氮,
[0292]-ar、间隔物、n和m如式(ia)、(ib)、(ic)和(id)中所定义。自不必说,式(v)中的ar、间隔物、n和m可以与如上所述的至少一个化学修饰的酪氨酸中的相同或不同。
[0293]
通常,这个步骤可以在水性缓冲液例如tris缓冲液中,在8至10的ph例如约9.3的ph和10℃至50℃的温度例如室温下进行。关于这个步骤的实施的更多详情可以在wo2017/212019中找到,其内容通过参考并入本文。
[0294]
这个步骤可以在如上所述对aav的衣壳中的至少一个酪氨酸残基进行化学修饰的步骤之前、同时或之后进行。
[0295]
本发明还涉及通过如上所述本发明的方法可以获得或获得的化学修饰的aav。
[0296]
另一方面,本发明还涉及一种用于改良aav、更准确来说是打算在基因疗法中用作基因载体的重组aav的一种或几种生物学性质的方法。事实上,取决于“m”组成部分的本性,如上所述用于对aav的衣壳进行化学修饰、更准确来说用于对aav衣壳中的至少一个酪氨酸残基进行化学修饰的方法可能能够:
[0297]-改良嗜性,例如提高aav对特定器官、组织或细胞(体内给药或转导培养物中的组织或细胞)的选择性,或将aav的选择性从一种组织/器官/细胞转移到另一种,和/或
[0298]-改变aav的免疫反应性,例如降低aav的免疫原性和/或降低对中和抗体的亲和性,和/或所述aav在体内给药时引发改变的体液应答,例如不产生针对aav的中和抗体,
[0299]-提高aav粒子的感染效率,和/或
[0300]-降低脱靶效应,即转导对于提供所述药物的益处来说非必需的并且可能甚至有害的细胞,
[0301]-提高aav对特定细胞、组织或器官的转导效率,
[0302]-当转导培养物中的细胞时降低细胞毒性,
[0303]-在癌细胞中诱导细胞靶向性死亡,
[0304]-能够在用aav粒子体内给药后或体外修饰细胞后可视化/监测这些aav粒子,
[0305]-将治疗剂和诊断剂合并在所述aav中。
[0306]
·
本发明的aav的用途
[0307]
本发明的化学修饰的aav可以用作研究工具或药物,例如作为用于递送治疗性核
酸例如dna或rna的载体,和/或作为诊断手段例如作为成像剂,或两者的组合,包括治疗诊断用途。
[0308]
在某些实施方式中,本发明的化学修饰的aav用于将核酸递送到细胞中,因此它是重组aav。
[0309]
所述重组aav可以被给药到体内、离体或体外细胞。所述细胞可以源自于任何哺乳动物,包括人类、灵长动物、奶牛、小鼠、绵羊、山羊、猪、大鼠等。所述细胞可以是任何类型,包括肝细胞、心肌细胞、肌细胞、神经元、运动神经元、视网膜色素细胞、感光细胞、软骨细胞、造血干细胞(hsc)或诱导多能干细胞(ips)。
[0310]
本发明的重组aav可用于将感兴趣的治疗性核酸递送到对象中。因此,本发明涉及一种将感兴趣的治疗性核酸递送到需要的对象中的方法,所述方法包括向需要的对象给药本发明的化学修饰的aav。本发明的重组aav可以通过任何适合的途径递送到所述对象。适合的给药途径包括但不限于吸入、局部、组织内(例如肌肉内、心脏内、肝内、肾内)、结膜(例如视网膜内、视网膜下)、粘膜(例如颊、鼻)、关节内、玻璃体内、颅内、血管内(例如静脉内)、心室内、脑池内、腹膜内和淋巴管内途径。通常,给药途径根据靶组织/器官,即根据试图在其中转导的组织/器官来选择。
[0311]
给药到所述对象的aav的剂量通常由专业技术人员根据所述对象的具体特点、所寻求的治疗效果和靶组织/器官来确定。为了实现所寻求的治疗效果,可能需要aav的单次给药或几次给药。本发明的aav通常以药物组合物的形式给药,即作为与一种或几种药用赋形剂的混合物。
[0312]
通过aav的给药治疗的病症可以是任何类型,并且包括遗传障碍以及获得性障碍。感兴趣的遗传障碍包括遗传性肌肉障碍例如杜氏肌营养不良症、脑白质营养不良症、脊髓性肌肉萎缩症(sma)、血友病、镰状细胞病和遗传性视网膜营养不良。所述化学修饰的aav也可用于治疗障碍例如癌症、关节炎、关节病、先天性和获得性心脏病、帕金森氏病、阿兹海默氏病以及传染病例如丙型肝炎。
[0313]
本发明的另一个目的是一种药物组合物,其包含本发明的化学修饰的aav和至少一种可药用赋形剂。所述药用赋形剂可以选自公知的赋形剂,例如载体、防腐剂、抗氧化剂、表面活性剂、缓冲剂、稳定剂等。
[0314]
本发明还涉及一种用于将感兴趣的核酸递送到细胞中的体内或离体方法,所述方法包括将本发明的化学修饰的aav与所述细胞接触。所述细胞可以来自于患者。在转导后,可以将所述细胞移植到需要的患者中。所述细胞可以是例如造血干细胞。所述感兴趣的核酸可以是任何类型,并根据所寻求的效果来选择。
[0315]
例如,所述aav可以包含外源基因表达盒。所述表达盒可以包含启动子、感兴趣的基因和终止子。作为另一个实例,本发明的aav可以包含用于在细胞中同源重组的dna模板。这种重组aav可以与基因编辑工具相组合,用于促进在靶细胞中的同源重组。所述基因编辑工具可以是任何类型,并且包括但不限于crispr/cas9、锌指核酸酶、大范围核酸酶以及编码所述蛋白质的rna和dna。
[0316]
本发明还涉及用本发明的化学修饰的aav转染的宿主细胞,所述宿主细胞可以是任何类型。
[0317]
例如,所述宿主细胞可以是肝细胞、心肌细胞、肌细胞、神经元、运动神经元、视网
膜色素细胞、感光细胞、软骨细胞、造血干细胞(hsc)或诱导多能干细胞(ips)。
[0318]
本发明的其他方面和优点公开在下面的实验部分中,所述实验部分应该被当作是说明性的,而不是限制本技术的范围。
[0319]
实施例
[0320]
制备了下述化合物:
[0321][0322]
化合物3、9和10的合成和在aav衣壳的氨基上偶联的程序已发表在chemical science,2020,11,1122-1131中。其他化合物的合成如下所述。
[0323]
1.化合物2(发明例)的合成
[0324][0325]
配体2如下制备:
[0326]
[0327]
将化合物a(1当量,1.12mmol)溶解在dcm中,添加dmap(5当量,5.6mmol)、4-硝基苯甲酰氯(3当量,3.3mmol)。将所述混合物在室温搅拌4小时。将有机溶液用hcl 1m、水和nahco3洗涤,在mgso4上干燥。在浓缩后,将橙色油状物通过快速层析进行纯化(sio2,acoet/meoh 85/15)。得到化合物b的微黄色固体。得率:51.7%。
[0328]
nmr 1
h(300mhz,meod):δ(ppm)8.34(d,j=8.98hz,2h),8.06(d,j=9hz,2h),5.32(d,j=3.13hz,1h),5.06(dd,j=3.3hz,j=11hz,1h),4.61(d,j=8.41hz,1h),4.12(m,3h),3.95(m,2h),3.65(m,12h),2.10(s,3h),2.02(s,3h),1.94(s,3h),1.92(s,3h)。nmr 13
c(75mhz,meod):δ(ppm)173.66,172.08,172.05,171.75,168.22,151.04,141.44,129.85x2c,124.66x2c,102.87,72.18,71.84,71.60,71.39,71.35,70.39,70.21,68.18,62.73,51.56,41.17,22.92,20.55x2c,20.51。hrms:tof(esi )m/z,对于c
27h37
n3o
14
na(m na)
的计算值为650.2173,实测值为650.2172。
[0329][0330]
将化合物b(1当量,0.6mmol)溶解在1:1h2o/meoh混合物中,并添加amberlist碱性树脂。将所述混合物搅拌2小时,直至起始原料消失。将树脂过滤,并将滤液在真空下浓缩,得到作为白色固体的相应产物c。得率:定量。
[0331]
nmr 1
h(400mhz,meod):δ(ppm)8.33(d,j=8.8hz,2h),8.05(d,j=9.2hz,2h),4.42(d,j=8.4hz,1h),3.93(m,2h),3.82-3.46(m,18h),1.96(s,3h)。nmr 13
c(100mhz,meod):δ(ppm)174.12,168.29,151.08,141.44,129.78,124.66,103.12,76.79,73.50,71.62,71.54,71.40,70.41,69.76,69.67,62.57,54.29,41.19,23.08。hrms:tof(esi )m/z,对于c
21h31
n3o
11
na(m na)
的计算值为524.1856,实测值为524.1852。
[0332][0333]
将化合物c(1当量,0.6mmol)溶解在meoh(15ml)中,添加碳载pd(10%w/w)。将所述混合物置于h2气氛下并在室温搅拌5小时。将混合物在硅藻土上过滤并将滤液在真空下浓缩,得到对应于化合物d的白色固体。得率:82.3%。
[0334]
nmr 1
h(400mhz,meod):δ(ppm)7.60(d,j=8.8hz,2h),6.67(d,j=8.8hz,2h),4.41(d,j=8.4hz,1h),3.76-3.46(m,20h),1.96(s,3h)。nmr 13
c(100mhz,meod):δ(ppm)174.16,170.47,153.15,129.97,123.20,114.76,103.12,76.72,73.49,71.57,71.34,70.79,69.74,69.70,62.56,54.29,40.68,23.09。hrms:tof(esi )m/z,对于c
21h33
n3o9na(m na)
的计算值为494.2114,实测值为494.2108。
[0335]
重氮盐衍生物2通过向氨基衍生物d添加在超纯水中的hbf4(1.1当量)和tbuono(1.1当量)来获得。在涡旋振荡后5分钟,使用2-羟基萘酚溶液确认重氮盐的形成。一滴每种溶液的混合物给出红色颜色,允许重氮盐的形成。
[0336]
2.化合物4(比较例)的合成
[0337][0338]
将化合物a(1当量,0.2mmol)溶解在dcm(15ml)中,添加dmap(5当量,1.1mmol)、苯甲酰氯(3当量,0.8mmol)。将所述混合物在室温搅拌4小时。将有机溶液用hcl 1m、水和nahco3洗涤,在mgso4上干燥。在浓缩后,将黄色油状物通过快速层析进行纯化(sio2,acoet/meoh 8/2)。得到化合物e的白色固体。得率:67%。
[0339]
nmr 1
h(400mhz,meod):δ(ppm)7.83(d,j=8.4hz,2h),7.48(m,3h),5.31(d,j=3.2hz,1h),5.06(dd,j=11.2hz,j=3.2hz,1h),4.61(d,j=8.4hz,1h),4.11(m,3h),3.92(m,2h),3.68-3.59(m,12h),2.12(s,3h),2.02(s,2h),1.94(s,3h),1.91(s,3h)。nmr 13
c(100mhz,meod):δ(ppm)173.59,172.07,172.06,171.76,170.31,135.72,132.66,129.56,128.34,102.77,72.23,71.84,71.65,71.46,71.36,70.58,70.10,68.23,62.75,51.65,40.88,22.90,20.56,20.54,20.52。hrms:tof(esi )m/z,对于c
27h39
n2o
12
(m h)
的计算值为583.2503,实测值为583.2504。
[0340][0341]
将化合物e(1当量,0.15mmol)溶解在1:1h2o/meoh混合物中,并添加amberlist碱性树脂。将混合物搅拌2小时,直至起始原料消失。将树脂过滤,并将滤液在真空下浓缩,得到作为无色油状物的相应产物。然后将所述油状物冷冻干燥,得到化合物4的白色固体。得率:定量。
[0342]
nmr 1
h(400mhz,meod):δ(ppm)7.83(m,2h),7,49(m,3h),4.42(d,j=8.4hz,1h),3.93(m,2h),3.81-3.56(m,16h),3.46(m,1h),1.96(s,3h)。nmr 13
c(100mhz,meod):δ(ppm)174.14,170.37,135.69,132.66,129.57,128.32,103.09,76.77,73.52,71.63,71.58,71.40,70.60,69.73,69.70,62.55,54.32,40.91,23.07。hrms:tof(esi )m/z,对于c
21h32
n2o9na(m na)
的计算值为479.2006,实测值为479.1997。
[0343]
3.化合物5(发明例)的合成
[0344][0345]
向a(160mg,0.246mmol)在无水dcm(5ml)中的溶液添加6-硝基-2-烟酰氯(91mg,
0.492mmol)和dmap(90ml,0.738mmol)。在20℃搅拌2h后,将反应混合物用dcm稀释,并用1m hcl和nahco3饱和水溶液洗涤。将合并的有机相用盐水洗涤,在mgso4上干燥,将混合物过滤并在减压下浓缩。将残留物通过快速层析进行纯化(sio2,acoet/meoh:90/10),得到作为白色固体的酰胺f(94mg,0.149mmol)。得率:61%。
[0346]1h nmr(300mhz,cdcl3):δ=1.92(s,3h,aco),1.97(s,3h,aco),2.01(s,3h,aco),2.13(s,3h,nhac),3.63-3.94(m,13h),4.06-4.21(m,3h,h-2,h-6a,h-6b),4.76(d,1h,j
1,2
=8.6hz,h-1),5.12(dd,1h,j
3,2
=11.3hz,j
3,4
=3.5hz,h-3),5.28(dd,1h,j
4,3
=3.4hz,j
4,5
=0.8hz,h-4),6.29(d,1h,j=9.1hz,nhac),8.22(d,1h,j=7.9hz,py),8.37(d,1h,j=8.1,j=0.9hz,py),8.55(d,1h,j=7.7,j=0.9hz,py)。
13
c nmr(100.6mhz,cdcl3):δ=20.6(2x ch3,2x aco),20.7(ch3,aco),20.69(ch3,aco),23.2(ch3,nhac),39.4(ch2),50.9(ch,c-5),61.5(ch2,c-6),66.8(ch,c-4),68.7(ch2),69.7(ch2),70.49(ch2),70.51(ch2)70.6(ch),70.7(ch,c-3),71.1(ch2),101.9(ch,c-1),120.1(ch,py),127.7(ch,py),141.6(ch,py),149.6(c,py),155.1(c,py),162.2(c,co),170.3(c,aco),170.4(c,aco),170.5(c,aco),170.6(c,nhac)。hrms(esi):m/z,对于c
26h37
n4o
14
[m h]
的计算值为629.2306,实测值为629.2307。
[0347][0348]
将化合物f(88mg,0.139mmol)溶解在无水meoh(2.8ml)中,并添加甲醇钠(42μl在meoh中的1m溶液,0.042mmol)。将混合物搅拌2h,并通过添加酸性树脂amberlite ir120(h)进行中和,过滤,并将溶剂蒸发至干。所述反应的粗产物不需进一步纯化用于下一步骤中。
[0349]
向去保护的糖(0.139mmol)在meoh(3ml)中的溶液添加pd/c(24mg,20%w)。将得到的悬液在h2气氛(1atm)下搅拌8h。通过经过滤除去pd/c,并将滤液在减压下蒸发。将所述反应的粗产物冷冻干燥,得到作为白色固体的苯胺g(54mg,0.114mmol)。得率:82%。
[0350]1h nmr(300mhz,cd3od):δ=1.97(s,3h,nhac),1.49(t,2h,j=5.9hz),3.57-3.80(m,13h),3.84(bd,1h,j=3.1hz),4.06(m,2h),4.43(d,1h,j
1,2
=8.5hz,h-1),6.69(dd,1h,j=8.4hz,j=0.8hz,py),7.30(dd,1h,j=7.3,j=0.7hz,py),7.53(dd,1h,j=8.2,j=7.3hz,py)。
13
c nmr(100.6mhz,cdcl3):δ=23.1(ch3,nhac),40.2(ch2),54.3(ch,c-5),62.6(ch2,c-6),69.7(ch),69.8(ch2),70.8(ch2),71.40(ch2),71.47(ch2),71.54(ch2),70.6(ch),73.4(ch,c-3),76.7(ch),103.2(ch,c-1),112.0(ch,py),113.1(ch,py),139.4(ch,py),148.9(c,py),160.2(c,py),167.5(c,co),174.2(c,nhac)。hrms(esi):m/z,对于c
20h32
n4o9[m na]
的计算值为495.206,实测值为495.2063。
[0351]
重氮盐衍生物5通过向氨基衍生物g添加超纯水中的hbf4(1.1当量)和tbuono(1.1当量)来获得。在涡旋振荡后5分钟,使用2-羟基萘酚溶液确认重氮盐的形成。一滴每种溶液的混合物给出红色颜色,允许重氮盐的形成。
[0352]
4.化合物6(发明例)的合成
[0353][0354]
在0℃下,向6-(((苯甲基氧基)羰基)氨基)-2-萘甲酸(210mg,0.644mmol)在无水dcm(4.3ml)和hobt(87mg,0.644mmol)中的溶液逐滴添加dic(90ml,0.738mmol)。在搅拌15min后,逐滴添加含有tea(88μl,0.644mmol)的a的溶液(280mg,0.429mmol)。在rt搅拌2h后,将反应混合物用dcm稀释,并用1m hcl和饱和nahco3水溶液洗涤。将合并的有机相用盐水洗涤,在mgso4上干燥,将混合物过滤并在减压下浓缩。将残留物通过快速层析进行纯化(sio2,acoet/meoh:95/5),得到作为白色固体的酰胺h(94mg,0.120mmol)。得率:28%。
[0355]1h nmr(300mhz,cd3od):δ=1.91(s,3h,aco),1.94(s,3h,aco),1.97(s,3h,aco),2.05(s,3h,nhac),3.53-3.91(m,13h),4.00(d,2h,j=4.0hz),4.07(dd,1h,j=11.3hz,j=8.5hz),4.42(s,2h,phch2),4.48(d,1h,j
1,2
=8.5hz,h-1),5.00(dd,1h,j
3,2
=11.3hz,j
3,4
=3.4hz,h-3),5.24(dd,1h,j
4,3
=3.4hz,j
4,5
=0.8hz,h-4),6.73(d,1h,j=2.3hz),7.06(d,1h,j=8.9hz,j=2.3hz),7.19-7.41(m,5h),7.53(d,1h,j=8.9hz),7.70(m,2h),8.18(d,1h,j=1.8hz)。
13
c nmr(100.6mhz,cd3od):δ=20.5(ch3,aco),20.6(2x ch3,2x aco),22.9(ch3,nhac),40.8(ch2),48.3(ch2),51.5(ch,c-2),61.7(ch2,c-6),68.1(ch,c-4),70.1(ch2),70.7(ch2),71.3(ch2),71.4(ch2),71.6(ch2),71.7(ch),72.2(ch,c-3),102.8(ch,c-1),104.3(ch,ar),120.1(ch,ar),125.2(ch,ar),126.9(ch,ar),127.3(c,ar),127.9(c,ar),128.0(ch,ar),128.4(2x ch,ar),128.9(ch,ar),129.5(2x ch,ar),130.9(ch,ar),138.7(c),140.8(c),149.7(c),170.6(c,aco),171.8(c,aco),172.0(2x c,aco,co),173.6(c,nhac)。hrms(esi):m/z,对于c
39h48
n3o
14
[m h]
的计算值为782.3136,实测值为782.3142。
[0356][0357]
将化合物h(86mg,0.109mmol)溶解在meoh(2.2ml)中,并添加碱性树脂((190mg)。将混合物搅拌2h,过滤,并将溶剂蒸发至干。所述反应的粗产物不需进一步纯化用于下一步骤中。
[0358]
向粗品去保护的糖(0.109mmol)在meoh(4ml)中的溶液添加pd/c(17mg,20%w)。将得到的悬液在h2气氛(1atm)下搅拌6h。通过经过滤除去pd/c,并将滤液在减压下蒸发。将反应的粗产物冷冻干燥,得到作为白色固体的苯胺i(51mg,0.098mmol)。得率:90%。
[0359]1h nmr(300mhz,cd3od):δ=1.95(s,3h,nhac),3.43(t,2h,j=5.4hz),3.48-3.84(m,21h),3.92(m,2h),4.38(d,1h,j
1,2
=8.5hz,h-1),6.97(d,1h,j=2.2hz),7.05(dd,1h,j=8.7hz,j=2.2hz),7.57(d,1h,j=8.7hz),7.73(m,2h),8.19(d,1h,j=1.8hz)。
13
c nmr(100.6mhz,cd3od):δ=23.1(ch3,nhac),40.9(ch2),54.3(ch,c-2),62.5(ch2,c-6),69.68
(ch,c-4),69.74(ch2),71.4(ch2),71.6(2x ch2),73.5(ch),76.7(ch,c-3),103.1(ch,c-1),108.3(ch,ar),120.4(ch,ar),125.1(ch,ar),127.7(c,ar),128.3(c,ar),128.9(ch,ar),131.2(ch,ar),138.4(c),149.2(c),170.7(c,nhac),174.1.0(c,co)。hrms(esi):m/z,对于c
25h35
n3o9[m na]
的计算值为544.2271,实测值为544.2270。
[0360]
重氮盐衍生物6通过向氨基衍生物i添加在超纯水中的hbf4(1.1当量)和tbuono(1.1当量)来获得。在涡旋振荡后5分钟,使用2-羟基萘酚溶液确认重氮盐的形成。一滴每种溶液的混合物给出红色颜色,允许重氮盐的形成。
[0361]
5.化合物7(发明例)的合成
[0362][0363]
将化合物j(1当量,1.38mmol,0.900g)溶解在dcm中,添加dmap(3当量,4.14mmol,0.506g)、4-硝基苯甲酰氯(3当量,4.14mmol,0.769g)。将混合物在rt搅拌4小时。将有机溶液用hcl 1m、水和nahco3洗涤,在mgso4上干燥。在浓缩后,将橙色油状物通过快速层析进行纯化(sio2,acoet/meoh:85/15),得到微黄色固体k(0.270g,0.43mmol)。得率:31.1%。
[0364]1h nmr(300mhz,cdcl3):δ(ppm)8.27(m,2h),7.99(m,2h),7.19(br s,1h),5.29(m,3h,h2,h3,h4),4.86(d,1h,j=1.6hz,h-1),4.25(m,1h,h-6),4.07(m,2h),3.87-3.66(m,13h,h-5,h-6,peg),2.15(s,3h,aco),2.09(s,3h,aco),2.03(s,3h,aco),1.98(s,3h,aco)。
13
c nmr(75mhz,cdcl3):δ(ppm)170.86(c,co),170.30(2x c,2x co),169.79(c,co),165.66(c,co),149.70(c),140.37(c),128.50(2x c,ch),123.83(2x c,ch),97.81(ch,c-1),70.78(ch2),70.43(ch2),70.14(ch2),69.81(ch),69.68(ch),68.71(ch2),67.48(ch2),66.23(ch),62.60(ch2),40.25(ch2),21.00(ch3,aco),20.88(ch3,aco),20.82(2x ch3,2x aco)。hrms:tof(esi )m/z,对于c
27h36
n2o
15
na的计算值为651.2013,实测值为651.2002。
[0365][0366]
将化合物k(1当量,0.99mmol,625mg)溶解在1:1h2o/meoh混合物中,并添加amberlist碱性树脂。将混合物搅拌2小时,直至起始原料消失。将树脂过滤,并将滤液在真空下浓缩,得到作为白色固体的产物l(475mg,1mmol,定量,不干)。
[0367]1h nmr(300mhz,meod):δ(ppm)8.32(m,2h),8.04(m,2h),4.72(d,1h,j=1.72hz),3.82(m,3h),3.72-3.54(m,16h)。
13
c nmr(75mhz,meod):δ(ppm)168.28(c,co),151.05(c),141.43(c),129.75(2x ch,ar),124.62(2x ch,ar),101.74(c-1),74.63,72.58,72.13,71.61,71.42,71.36,70.47,68.65,67.68,62.98,41.22(ch2)。hrms:tof(esi )m/z,对于c19h27
n2o
11
的计算值为459.1615,实测值为459.1611。
[0368][0369]
向l(90mg,0.197mmol)在meoh(3ml)中的溶液添加pd/c(25mg,20%w)。将得到的悬液在h2气氛(1atm)下搅拌4h。通过经过滤除去pd/c,并将滤液在减压下蒸发。将反应的粗产物冷冻干燥,得到作为白色固体的苯胺m(69mg,0.160mmol)。得率:81%。
[0370]1h nmr(400mhz,cd3od):δ=3.52-3.68(m,14h),3.69-3.74(2h,m),3.78-3.85(3h,m),6.67(d,1h,j=8.8hz,ar),7.71(d,1h,j=8.8hz,ar)。
13
c nmr(100.6mhz,cdcl3):δ=40.7(ch2),62.9(ch2,c-6),68.6(ch),70.8(ch2),71.28(ch2),71.32(ch2),71.37(ch2),71.5(ch),72.1(ch),72.6(ch),74.6(ch),101.7(ch,c-1),114.8(2x ch,ar),123.2(c,ar),129.9(2x ch,ar),153.1(c,ar),170.2(c,酰胺)。hrms(esi):m/z,对于c
19h30
n2o9na[m na]
的计算值为453.1849,实测值为453.1841。
[0371]
重氮盐衍生物7通过向氨基衍生物m添加在超纯水中的hbf4(1.1当量)和tbuono(1.1当量)来获得。在涡旋振荡后5分钟,使用2-羟基萘酚溶液确认重氮盐的形成。一滴每种溶液的混合物给出红色颜色,允许重氮盐的形成。
[0372]
6.化合物8(比较例)的合成
[0373][0374]
将化合物j(1当量,0.3mmol,0.230g)溶解在dcm中,添加dmap(3当量,0.9mmol,0.129g)、4-硝基苯甲酰氯(3当量,0.9mmol,0.167g)。将混合物在rt搅拌4小时。将有机溶液用hcl 1m、水和nahco3洗涤,在mgso4上干燥。在浓缩后,将橙色油状物通过快速层析进行纯化(sio2,acoet/meoh:85/15),得到微黄色固体n(70mg,0.1mmol)。得率:34%。
[0375]1h nmr(400mhz,cd3od):δ(ppm)7.82(m,2h),7.49(m,3h),5.26(m,3h,h2,h3,h4),4.87(d,j=1.36hz,1h),4.23(dd,j=5hz,j=12,3hz,1h,h6),4.10(m,2h,h5,h6),3.82(m,1h),3.71-3.58(m,12h),2.12(s,3h),2.05(s,3h),2.02(s,3h),1.95(s,3h)。
13
c nmr(100mhz,cd3od):δ(ppm)172.33(c,co),171.55(c,co),171.49(c,co),171.47(c,co),170.23(c,co),135.69(c),132.62(ch),129.53(2x ch),128.29(2x ch),98.95(c-1),71.59(ch2),71.33(ch2),71.18(ch2),70.74(ch),70.73(ch),70.63(ch),69.78(c-5),68.34(ch2),67.30(ch2),63.57(ch2,c-6),40.93(ch2),20.65(ch3,aco),20.62(ch3,aco),
20.61(ch3,aco),20.55(ch3,aco)。hrms:tof(esi )m/z,对于c
27h38
n0
13
的计算值为584.2343,实测值为584.2344。
[0376][0377]
将化合物n(1当量,0.1mmol,70mg)溶解在1:1h2o/meoh混合物中,并添加amberlist碱性树脂。将混合物搅拌2小时,直至起始原料消失。将树脂过滤,并将滤液在真空下浓缩,得到作为白色固体的相应产物8(50mg,0.1mmol,定量)。
[0378]1h nmr(400mhz,d2o):δ(ppm)7.84(m,2h),7.69(m,1h),7.60(m,2h),4.88(d,j=1.68hz,1h),3.97(m,1h),3.93-3.63(m,18h)。
13
c nmr(100mhz,d2o):δ(ppm)171.11(c,co),133.65(c),132.21(ch,ar),128.83(2ch,ar),127.10(2ch,ar),99.93(c-1),72.74,70.54,69.99,69.66,69.58,68.89,66.76,66.37,60.93,39.57。hrms:tof(esi )m/z,对于c
19h29
no9na的计算值为438.1740,实测值为438.1730。
[0379]
7.化合物11(比较例)的合成
[0380][0381]
将化合物o(550mg,0.917mmol)20%碳载pd(110mg)在乙酸乙酯(9.2ml)中的混合物在氢气气氛(1atm)和室温下搅拌2h。将反应混合物通过硅藻土垫过滤,并将溶剂在真空中蒸发,得到作为无定形黄色固体的加氢产物,其不需进一步纯化直接使用。
[0382]
向cdi(149mg,0.917mmol)在无水thf(9.2ml)中的溶液添加肼基甲酸乙酯(95mg,0.917mmol),并在室温和氮气下搅拌15min。然后逐滴添加粗产物(0.917mmol,溶解在4ml thf中),并继续搅拌过夜。将混合物用acoet稀释,并用0.5m hcl水溶液洗涤。将有机相干燥并在减压下浓缩。将残留物通过快速层析进行纯化(sio2,etoac
–
meoh,90:10),得到作为白色固体的p(311g,0.541mmol)。得率:59%。
[0383]1h nmr(300mhz,cdcl3):δ=1.25(t,3h,j=7.1hz,ch3ch2o),1.88(s,3h,aco),1.92(s,3h,aco),2.03(s,3h,aco),2.09(s,3h,nhac),3.59-4.10(m,16h),4.16(d,2h,j=7.1hz,ch3ch2o),4.73(d,1h,j=8.6hz,h-1),5.05(dd,1h,j
3,2
=11.2hz,j
3,4
=3.3hz,h-3),5.26(bd,1h,j
4,3
=3.3hz,h-4),6.78(d,3h,j=9.0hz,ph,nh),7.16(s,1h,nh),7.22(s,1h,nh),7.24(d,2h,j=9.0hz,ph),7.67(s,1h,nh)。
13
c nmr(100.6mhz,cdcl3):δ=14.4(ch3,ch3ch2o),20.7(3x ch3,3x aco),23.0(ch3,nhac),50.4(ch,c-5),61.6(ch2,c-6),62.3(ch2,ch3ch2o),66.7(ch,c-4),67.6(ch2),68.6(ch2),69.9(ch2),70.5(ch,ch2),70.83(ch),70.86(ch2),71.2(ch2),101.9(ch,c-1),114.9(2x ch,ph),121.7(2x ch,ph),131.5
(c,ph),154.8(c),156.4(c),157.5(c),170.4(c,aco),170.5(c,aco),170.7(c,aco),171.1(c,nhac)。hrms(esi):m/z,对于c
30h44
n4o
15
na[m na]
的计算值为723.2701,实测值为723.2700。
[0384][0385]
将化合物p(286mg,0.497mmol)溶解在无水meoh(10ml)中,并添加甲醇钠(149μl在meoh中的1m溶液,0.149mmol)。将混合物搅拌4h,添加k2co3(137mg,0.994mmol),并将得到的混合物在75℃搅拌1.5h(μw,50w)。将混合物用10ml h2o稀释,用amberlite ir120(h)中和,过滤,并将溶剂蒸发至干。将物质溶解在水中并进行冷冻干燥,得到作为棕色固体的11(226mg,0.427mmol)。得率:86%。
[0386]1h nmr(300mhz,meod):δ=1.97(s,3h,nhac),3.45(ddd,1h,j=6.5hz,j=5.3hz,j=1.0hz,h-5),3.53(dd,1h,j
3,2
=10.7hz,j
3,4
=3.3hz,h-3),3.62-3.79(m,10h),3.86-3.97(m,4h),4.19(m,2h),4.44(d,1h,j
1,2
=8.4hz,h-1),6.78(d,3h,j=9.0hz,ph,nh),7.24(d,1h,j=9.1hz,ph),7.35(d,1h,j=9.1hz,ph)。
13
c nmr(100.6mhz,cdcl3):δ=23.0(ch3,nhac),54.4(ch,c-5),62.6(ch2,c-6),68.9(ch2),69.7(ch),70.8(ch2),71.6(ch2),71.7(ch2),71.8(ch2),73.6(ch),76.7(ch),103.1(ch,c-1),116.2(2x ch,ph),125.6(c,ph),129.0(2x ch,ph),156.1(2x c,urazol),160.1(c,ph),174.2(c,nhac)。hrms(esi):m/z,对于c22h31n4o11[m-h] 的计算值为527.1989,实测值为527.1974。
[0387]
8.化合物12(发明例)的合成
[0388][0389]
化合物12在化合物11在乙腈中的1.1当量的海因存在下的氧化后获得。溶液的红色颜色证实ptad衍生物12的形成。
[0390]
3.化学修饰的aav的制备
[0391]-aav2和aav8的生产和纯化
[0392]
aav2载体从两种质粒产生:编码aav rep2-cap2和腺病毒辅助基因(e2a、va rna和e4)的辅助质粒pdp2-kana,和载体质粒ss-cag-luc-egfp或载体质粒ss-cag-egfp。aav8载体从两种质粒产生:编码aav rep2-cap8和腺病毒辅助基因(e2a、va rna和e4)的辅助质粒pdp8-kana,和载体质粒ss-cag-egfp。所有载体使用磷酸钙-hebs方法,通过hek293细胞的瞬时转染来生产。在转染后48小时收获载体生产细胞。对于aav2粒子的提取来说,将细胞首先用triton-1%和全能核酸酶(25u/ml)在37℃处理1小时。对于aav8载体来说,这个步骤被省略,但后续步骤相同。将整体以2000rpm离心20min并进行冻融循环,以释放载体粒子。通过以2500rpm离心15min除去细胞碎片。将细胞裂解液用peg沉淀过夜,并通过以4000rpm离心1小时进行澄清。然后将沉淀物与全能核酸酶在37℃温育30min,并在以10000g在4℃离心10min后收集。载体通过双重氯化铯(cscl)梯度超速离心进行纯化。然后将病毒悬液在
slide-a-lyzer盒(pierce)中,在轻微搅拌下,针对dpbs(含有ca
和mg
)进行连续4轮透析。
[0393]-偶联和纯化
[0394]
重氮盐衍生物2、5、6和7通过向相应的氨基化合物添加在超纯水中的hbf4(1.1当量)和tbuono(1.1当量)来获得。在涡旋振荡后5分钟,使用2-羟基萘酚溶液确认重氮盐的形成。一滴每种溶液的混合物给出红色颜色,允许重氮盐的形成。然后,向ph=9.3的含有2(发明例)、3(比较例)、4(比较例)、5(发明例)、6(发明例)、7(发明例)或8(比较例)的tris缓冲液溶液以3e5或3e6当量的摩尔比添加aav2-gfp-luc、aav2-gfp或aav8-gfp(1e12 vg,2.49nmol),并在20℃温育4h。然后将所述含有载体的溶液针对dpbs 0.001%pluronic透析,以除去未偶联到aav衣壳的游离分子。
[0395]
对于用化合物9和10修饰aav2衣壳的氨基来说,程序描述在chemical science,2020,11,1122-1131中。
[0396]
对于aav2-gfp的酪氨酸和氨基的双重修饰来说,首先使用2和酪氨酸修饰的程序进行偶联,并在5分钟后,使用氨基修饰的程序,使用摩尔比为3e5当量的化合物10进行偶联,并在20℃温育4h。然后将含有所述载体的溶液针对dpbs 0.001%pluronic透析,以除去未偶联到aav衣壳的游离分子。
[0397]
对于ptad衍生物12(发明例,3e6当量)和脲唑衍生物11(比较例,3e6当量)来说,向tbs缓冲液中的aav2-gfp以小份添加所述化合物。在添加后5分钟,将含有所述载体的溶液针对dpbs 0.001%pluronic透析,以除去未偶联到aav衣壳的游离分子。
[0398]
4.化学修饰的aav(发明例和比较例)的表征
[0399]
材料和方法
[0400]-病毒基因组提取
[0401]
将3μl aav2、aav8或化学修饰的aav2或aav8用20单位的dnase i(roche#04716728001)在37℃处理45min,以除去载体样品中的残留dna。在用dnase i处理后,添加20μl蛋白酶k 20mg/ml(macherey-nagel#740506),并在70℃温育20min。然后使用提取柱(rna virus)从纯化的aav载体提取dna。
[0402]-定量实时pcr分析
[0403]
定量实时pcr(qpcr)使用steponeplustm升级版实时pcr系统(life technologies)来进行。所有pcr在20μl终体积pcr中进行,其包含引物、探针、pcr主混合物(takara)和5μl模板dna(质粒标准品或样品dna)。qpcr如下进行:最初变性步骤是在95℃下20秒,然后是45个在95℃变性1秒和在56℃退火/延伸20秒的循环。质粒标准品使用用sca-i限制性酶线性化的质粒ptr-uf-11(mba-331
tm
)的7个连续稀释液(含有108至102个质粒拷贝)产生。
[0404]-western印迹
[0405]
将所有载体用laemmli样品缓冲液在100℃变性5min,并通过sds-page 10%tris-甘氨酸聚丙烯酰胺凝胶(life technologies)分离。使用precision plus蛋白质全蓝色标准品(biorad)作为分子量大小标志物。在trans-blot sd半干转移池(bio-rad)中使用转移缓冲液(25mm tris/192mm甘氨酸/0.1(w/v)sds/20%meoh)将蛋白质以150ma电流向硝酸纤维素膜转移1小时后,将所述膜用含有5%半脱脂奶的pbs-tween(0.1%)或用含有1%明胶、
0.1%igepal的pbs-tween(0.1%)在rt饱和2h。在饱和后,将所述膜用针对aav2和化学修饰的aav2的抗血清(多克隆或b1单克隆)、fitc-大豆凝集素或fitc-伴刀豆球蛋白a在4℃探测过夜。在每个阶段之间用pbs-tween(0.1%)在rt下进行三次15min的清洗,以除去未结合的试剂。条带使用碱性磷酸酶(ap)或辣根过氧化物酶(hrp)偶联的第二抗体通过化学发光进行可视化,并捕获在x-射线胶片上。
[0406]-免疫斑点印迹
[0407]
将非变性aav2或aav8和化学修饰的aav2或aav8沉积在简短浸泡在pbs中的硝酸纤维素纸上,然后组装斑点印迹多管吸印仪(bio-rad)。以与western印迹相同的方式处理硝酸纤维素膜。为了可视化组装的衣壳,将所述膜用针对aav2衣壳的抗血清(a20抗体)或针对aav8的抗血清(adk8抗体)进行探测。
[0408]-通过facs分析检测感染力
[0409]
将hek293和huh7细胞以大约2.5x105个细胞/孔的密度接种在24孔板中的2ml dmem生长培养基中。然后将细胞在37℃温育过夜,以在37℃和5%co2下达到50%合生。将细胞在培养基中以1e4和1e5的moi用aav2或化学修饰的aav2载体转导。所有aav载体均编码gfp。在转导后48h,通过facs测量gfp阳性细胞的百分率。将细胞用胰蛋白酶-edta(sigma-aldrich)解离,用4%聚甲醛固定,并在bd-lsrii流式细胞仪(bd bioscience)上分析。所有数据均通过flowjo(v10;flowjo llc,ashland,or)处理。
[0410]-结果
[0411]
结果示出在图1-11中。
[0412]
为了评估这些galnac-aav2和galnac-aav8的纯度和完整性,进行了不同样品的银染。如图1-a、图4-c、图6-c和图8-c中所示并且正如预期,在经历反应和后续的透析后,vp1:vp2:vp3的比率保持完好。为了评估man-aav2的纯度和完整性,进行了样品的银染。如图7-c中所示并且正如预期,在经历反应和后续的透析后,vp1:vp2:vp3的比率保持完好。对于galnac-aav2、galnac-aav8和man-aav2来说,随着配体2、6和7的偶联,每个vp的分子量增加。
[0413]
使用分别与galnac和甘露糖残基选择性结合的大豆凝集素和伴刀豆球蛋白a凝集素,通过斑点印迹进一步研究了糖在aav表面处的偶联反应。也使用识别组装的aav2衣壳的a20抗体和与组装的aav8衣壳结合的adk8抗体,分别进行了免疫染色。与a20抗体和adk8抗体的阳性斑点表明在使用化合物2、4、6、7、8、9、10、11和12的偶联程序和随后的透析后,aav2和aav8仍然完好(图2-a、图5-a、图6-a、图7-a、图8-a和图9-a)。
[0414]
使用大豆凝集素,仅在aav2与重氮盐化合物2和6和ptad衍生物12共温育时以及aav8与化合物2共温育时观察到阳性信号,揭示出在aav2和aav8衣壳上高效的酪氨酸点击反应(图2-b、图6-b、图8-b和图9-b)。事实上,使用缺少重氮基团的化合物4和缺少ptad基团的化合物11时没有观察到检测,证明了化合物2、6和12(发明例)被共价连接而不是物理吸附到aav2和aav8衣壳。
[0415]
使用与甘露糖结合的伴刀豆球蛋白a凝集素,在aav2与化合物7(发明例)共温育时观察到阳性信号,揭示出在aav2上高效的酪氨酸点击反应(图7-b)。事实上,使用缺少重氮基团的化合物8(比较例)时没有观察到检测,证明了化合物7被共价连接而不是物理吸附到aav2。
[0416]
对于aav2衣壳的酪氨酸和氨基的双重修饰来说,使用伴刀豆球蛋白a和大豆凝集素时与2和10的共温育顺序地显示出阳性斑点,揭示出aav2上高效的酪氨酸点击反应和氨基修饰(图5-b)。
[0417]
对于western印迹分析来说,衣壳特异性多克隆抗体的使用表明不论用于aav2-luc和aav2-gfp的化学过程如何,vp衣壳亚单位均保持完好(图3-a、图4-a)。重要的是,使用凝集素检测到的条带清楚显示,对于aav2-luc和aav2-gfp来说化合物2(发明例)被共价连接到vp(图3-b、c,图4-b)。
[0418]
相反,来自于以相同的比例与3和4(比较例)温育的aav2-luc和aav2-gfp的衣壳亚单位,在与特异性凝集素温育后没有产生阳性条带,表明在没有重氮官能团的情况下不发生偶联(图3-b、c,图4-b)。
[0419]
评估了与带有galnac组成部分的化合物2(发明例)的化学偶联对aav2-gfp载体的感染力的影响。
[0420]
感染力在hek293和huh7细胞上通过facs分析来评估。测量了表达gfp的细胞的%以及gfp的强度两者。如图10和图11中所示,galnac-aav2-gfp粒子在所述两种细胞系上感染。这些粒子的化学修饰对转导效率和去靶向性质具有重要影响。当使用肝细胞系huh7时,用化合物2化学修饰的病毒粒子与使用非肝细胞系hek293时获得的转导相比显示出更高的转导水平。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。