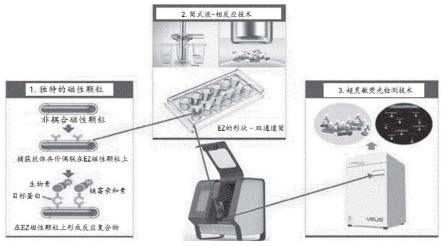
用于癌症的新型poct诊断系统
技术领域
1.本发明涉及一种用于癌症的新型poct诊断系统,更具体地涉及一种能够快速识别早期癌症、诊断癌症预后以增强抗癌剂等对癌症的治疗效果的癌症poct诊断系统,并能以高灵敏度准确地确定癌症。
背景技术:
2.体外诊断(ivd)是一种分析从人体采集的样本(例如血液、尿液和细胞)以诊断人体健康的技术。这种体外诊断方法包括免疫诊断、自我血糖监测和分子诊断。特别地,免疫诊断技术可用于通过基于抗原-抗体反应确定特定致病蛋白的存在或不存在来诊断和跟踪多种疾病。然而,目标蛋白的浓度高于检测极限是使用免疫诊断技术的先决条件。由于这个缺点,已经开发了各种技术来放大由低浓度蛋白质产生的信号。
3.特别地,随着合成化学和生物科学的最新进展,各种目标分析物已经出现在各个领域,包括新药开发和诊断。据报道,有几种高度敏感的方法可以使用磁性颗粒检测微量的目标,该磁性颗粒确保信号的产生(期刊regul.mech.biosyst.的2017年第9卷第2期第47-55页的modern magnetic immunoassay:biophysical and biochemical aspects)。
4.传统的免疫诊断技术使用经二氧化硅改性的纳米级磁性颗粒表面。然而,这种二氧化硅改性的磁性颗粒不能有效地从发生免疫反应的孔中被提取或释放。即,小尺寸磁性颗粒通常以悬浮形式存在于溶液中,因此难以分离。出于这个原因,小尺寸磁性颗粒用于定性分析而不是定量分析。此外,传统的分析方法需要较长的测试时间并且涉及复杂的测试程序,因为它们一次只能测试一个磁性颗粒。
5.癌症是指人类细胞无限增殖的恶性肿瘤。癌症也指一种肿瘤,其尺寸不断增加并侵入并转移到外周器官,而不像良性肿瘤具有有限的转移速率并且不会侵入或转移到外周器官。ct和mri被作为癌症的唯一诊断工具,但由于价格昂贵且需要专业的操作技能,因此难以用于中小型医院的诊断应用。此外,ct和mri难以区分小型肿瘤,可能会提供高度假阴性结果,该结果取决于仅使用扫描检测癌症的医务人员的技能,其无法为患者提供准确的结果。ct和mri诊断时间长,成本高,缺点是患者有暴露于辐射的风险,并且由于磁场导致体内金属成分异常。此外,ct和mri难以区分小肿瘤,可能会提供高度假阴性结果,这取决于仅使用扫描检测癌症的医务人员的技能,无法为患者提供准确的结果。ct和mri诊断时间长,成本高,并具有使患者有暴露于辐射的风险,由于磁场而导致体内金属成分异常的缺点。
6.因此,需要一种更准确、更安全的新型癌症诊断系统。癌症诊断应快速并准确,检测时间小于1小时,以适用于紧急情况并迅速告知患者结果,其应能够从少量样本中获得结果,并且需要一次以高灵敏度测试两种或更多种生物标志物。此外,癌症诊断需要简单的测试,该测试具有小尺寸系统,维护和管理成本低,适用于急诊室和中小型医院。
7.乳腺癌的诊断取决于它是hr(er、pr)阳性、her2阳性还是三阴性。由于抗癌剂对乳腺癌的疗效在个体中存在很大差异,因此有必要监测抗癌剂对个体的乳腺癌的治疗效果。因此,需要一种能够单独确定个体乳腺癌治疗效果的乳腺癌预后诊断系统。
8.颗粒蛋白前体(gp88)正在成为乳腺癌、肝癌、胆囊癌和肺癌的诊断标志物。特别地,据报道,颗粒蛋白前体(gp88)在监测个体抗癌治疗效果和诊断个体癌症预后方面非常有效(vanessa abellaet等人(2017)drug discovery today;tkaczuk,kr等人(2011)breast cancer;abdulrahman等人(2019)cancers;serrero1等人(2012)cancer research)。因此,使用颗粒蛋白前体(gp88)作为标志物开发用于个体伴随诊断和乳腺癌预后的poct诊断试剂盒有望增强抗癌剂对个体的治疗效果。
技术实现要素:
9.本发明待解决的问题
10.本发明是为了解决上述问题而完成的,其目的在于提供一种包含磁性颗粒的癌症poct诊断系统,其能够迅速识别早期癌症,诊断癌症的预后,提高抗癌剂对癌症的治疗效果等,并能够以高灵敏度准确判断癌症。
11.解决问题的手段
12.本发明的一个方面提供了一种磁性颗粒,其包括包含磁响应金属的核、围绕该核并具有均匀厚度的壳层,以及引入到该壳层上以捕获生物材料的捕获探针,其中每个捕获探针包含针对作为抗原的用于癌症诊断的生物标志物的抗体。
13.在一个实施例中,该癌症可以为乳腺癌、肺癌、肝癌、胆囊癌、卵巢癌、肾癌、白血病或胶质母细胞瘤。
14.在一个实施例中,该生物标志物可以包括gp88。
15.在一个实施例中,该磁性颗粒具有1ng/ml或更小的检测极限以及至少log3的动态范围。
16.在一个实施例中,该磁性颗粒可以具有两种或更多种不同的长度并且同时诊断两种或更多种类型的生物标志物。
17.在一个实施例中,壳表面的每单位面积(nm2)可以具有80个亲水性官能团。
18.在一个实施例中,该亲水性官能团可以是硅烷醇基或衍生自硅烷醇基的羧基、氨基、羟基、硫醇基或醛基。
19.在一个实施例中,该捕获探针与该壳层的表面的亲水性官能团连接。
20.在一个实施例中,该核占该磁性颗粒的总体积的60%或以上。
21.在一个实施例中,该壳层的平均表面粗糙度(ra)可以为15nm或更小。
22.在一个实施例中,该壳层可以具有1至100μm的厚度。
23.在一个实施例中,该磁性颗粒可以是通过切割玻璃镀膜的金属微线获得的。
24.在一个实施例中,该磁性颗粒可以具有尺寸和比重,使得它们不会悬浮在水中。
25.在一个实施例中,该磁性颗粒可以是微棒的形式。
26.在一个实施例中,该微棒可以具有10至1000μm的长度。
27.在一个实施例中,该所述微棒的纵横比可以至少为2。
28.在一个实施例中,该生物标志物可以是一种存在于源自活生物体的样本溶液中的生物标志物。
29.本发明的另一方面提供了一种制备磁性颗粒的方法,包括(i)制备由玻璃制成的壳和包含磁性材料的核组成的磁性微棒,(ii)用酸性溶液处理该磁性微棒的表面以形成硅
烷醇基,(iii)将表面处理过的该磁性微棒浸入硅烷基溶液中以将硅烷化合物与该硅烷醇基结合,(iv)将硅烷分子的末端基团转化为能够与探针结合的末端基团,以及(v)将探针附接到该硅烷分子的末端基团,其中每个探针包含针对作为抗原的用于癌症诊断的生物标志物的抗体。
30.在一个实施例中,步骤(iv)可以通过将该磁性微棒浸入硅烷基溶液中6至24小时来执行。
31.在一个实施例中,该酸性溶液可以是硫酸和过氧化氢的混合物。
32.本发明的另一方面提供了一种用于检测生物材料的方法,包括(1)将该磁性颗粒提供至第一孔,(2)使用磁力将该磁性颗粒从所述第一孔转移至第二孔,(3)向该第二孔提供检测探针,该检测探针能够与生物材料特异性结合并与响应于外部刺激而发光的发光材料缀合,以及允许该捕获探针、生物材料和检测探针相互反应以形成该磁性颗粒、生物材料和检测探针的复合物,以及(4)使用磁力将磁性颗粒-生物材料-检测探针复合物转移到第三孔中,并测量该复合物中存在的发光材料响应于外部刺激产生的发光信号以检测该生物材料。
33.在一个实施例中,该复合物的形成可以包括在外磁力存在下促进该反应。
34.在一个实施例中,该方法旨在可以使用两种或更多种磁性颗粒对两种或更多种生物材料进行多路检测。
35.在一个实施例中,该多路检测可以包括读取标记有长度、直径、厚度、形状、颜色或识别码的磁性颗粒,以便相互区分。
36.在一个实施例中,该方法进一步可以包括在该第二孔和该第三孔之间设置2-10个洗涤孔,依次将该磁性颗粒-生物材料-检测探针复合物浸入该洗涤孔中以洗涤该复合物。
37.在一个实施例中,可以利用外磁力将该磁性颗粒-生物材料-检测探针复合物浸没并转移以用于洗涤。
38.在一个实施例中,该方法可以设计用于在不到30分钟内进行诊断。
39.在一个实施例中,该方法可以通过poct过程进行。
40.本发明的效果
41.根据本发明的用于癌症诊断的磁性颗粒具有比现有磁性颗粒(尤其是磁珠)更高的磁性。因此,本发明的poct诊断系统可以高效地使用磁体混合或移动,并且能够以低成本制备,与使用磁性颗粒的现有诊断系统相比,能够以低成本进行相同的诊断。
42.此外,根据本发明的用于癌症诊断的磁性颗粒包括具有不同长度的捕获探针,其能够与各种生物标志物结合,从而能够同时诊断众生物标志物。因此,本发明的即时检验(poct,point-of-care test)诊断方法可用于在短时间内诊断目标疾病。
附图说明
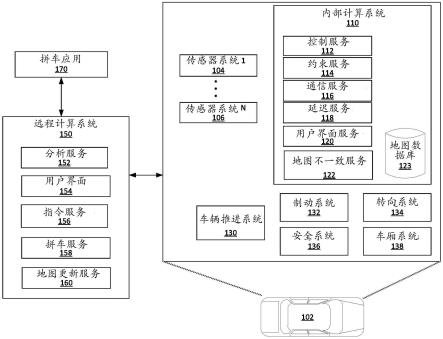
43.图1示出了根据本发明一个实施例的使用磁性颗粒的诊断系统和根据本发明一个实施例的诊断方法的流程图。
44.图2示出了根据本发明一个实施例的制备磁性微棒的方法。
45.图3示出了显示根据本发明一个实施例的磁性微棒的尺寸(括直径和长度)的显微镜图像。
46.图4示出了根据本发明一个实施例的用于处理磁性微棒的表面的化学过程。
47.图5示出了根据本发明一个实施例的表面处理前后磁性颗粒的荧光变化:(a)表面未使用酸性溶液处理的磁性颗粒的图像以及(b)表面使用酸性溶液处理的磁性颗粒的图像。
48.图6比较了根据本发明的一个实施例的磁性微棒的表面与常规磁珠的表面:(a)根据本发明的磁性微棒的表面,(b)根据本发明的磁性微棒的发光示意图,(c)常规磁珠的表面,以及(d)常规磁珠的发光示意图。
49.图7示出了根据本发明的一个实施例的磁性微棒的优化结果:(a)示出随硅烷化时间增加的发光变化的图像以及(b)示出在不同硅烷化时间获得的实验结果的图表。
50.图8示出了根据本发明示例性实施例的包括用于多路检测的磁性微棒的长度编码系统。
51.图9示意性地示出了根据本发明的一个实施例的磁性微棒和标志物(抗原)之间的抗原-抗体反应。
52.图10示出了使用磁棒和加热块来促进免疫反应的混合、加热和洗涤过程。
53.图11示出了根据本发明一个实施例的超灵敏荧光图像分析仪检测到的图像和荧光信号:(a)根据本发明一个实施例的磁性微棒图像,(b)根据本发明一个实施例的荧光图像,(c)由本发明的分析系统检测到的磁性微棒的荧光图像,以及(d)由现有分析系统拍摄的荧光图像。
54.图12示出了使用根据本发明的一个实施例的包括磁性微棒的长度编码系统检测的三种或更多种生物标志物的荧光图像,以及该生物标志物的多路测定的结果。
55.图13示出了显示根据本发明的一个实施例的在gp88浓度为0至60ng/ml下进行的实验结果的图像。
56.图14是显示根据本发明的一个实施例的在gp88浓度为0至60ng/ml下进行的实验结果的图表。
57.图15示出了根据本发明的一个实施例对gp88(在300μm的磁性颗粒上)和p53(在400μm的磁性颗粒上)的多路检测结果的图像(a)gp88的结果以及(b)p53的结果。
具体实施方式
58.现在将详细描述本发明的优选实施例。在本发明的描述中,当认为相关技术的详细解释可能不必要地模糊本发明的本质时,将它们省略。在整个说明书中,当某个部分“包含”或“包括”某个组件时,这表示不排除其他组件并且可以进一步包括其他组件,除非上下文另有明确要求。
59.由于本发明允许各种变化和众多实施例,特定实施例将在附图中示出并在书面描述中详细描述。然而,这并不旨在将本发明限制于特定的实施方式,并且应当理解,不脱离本发明的精神和技术范围的所有变化、等同物和替代物都包含在本发明中。
60.本发明不限于图示的实施例并且能够以各种不同的形式实施。相反,提供所公开的实施例以使得本公开将是彻底和完整的,并且将向本领域技术人员充分传达本发明的范围。在附图中,为清楚起见,元件的尺寸,例如宽度和厚度,可能被夸大。附图是从观察者的角度解释的。应当理解,当一个元件被称为在另一个元件“上”时,它可以直接在另一个元件
上,或者一个或多个中间元件也可以存在于它们之间。本领域的技术人员将理解,在不背离如所附权利要求限定的本发明的精神和范围的情况下,可以对形式和细节进行各种改变。在所有附图中,相同的附图标记基本上表示相同的元件。
61.本文所用术语仅用于描述特定实施例,并不用于限制本发明。如本文所用,单数形式“一”、“该”和“所述”旨在也包括复数形式,除非上下文另有明确指示。在本发明中,应当理解,诸如“包括”或“具有”等用语旨在表示说明书中公开的特征、数量、步骤、操作、动作、组件、部件或其组合的存在,并且不旨在排除可能存在或可能添加一个或多个其他特征、数量、步骤、操作、动作、组件、部件或其组合的可能性。
62.另一方面,此处使用的术语应理解为如下所述。尽管可以使用诸如“第一”和“第二”等术语来描述各种元素,但这些元素绝不限于上述术语。上述术语仅用于区分一种元素与另一种元素。例如,第一元素可以被称为第二元素,同样第二元素可以被称为第一元素。
63.如本文所用,单数形式“一”、“该”和“所述”旨在也包括复数形式,除非上下文另有明确指示。在本发明中,应当理解,诸如“包括”或“具有”等用语旨在表示说明书中公开的特征、数量、步骤、操作、动作、组件、部件或其组合的存在,并且不旨在排除可能存在或可能添加一个或多个其他特征、数量、步骤、操作、动作、组件、部件或其组合的可能性。本文描述的方法的各个步骤能够以与明确描述的顺序不同的顺序执行。换言之,各个步骤能够以与所述相同的顺序、基本上同时或以相反的顺序执行。
64.如本文所用,术语“和/或”涵盖所公开的多个相关项目的组合和所公开的多个相关项目中的任何项目的组合。在本说明书中,描述“a或b”是指“a”、“b”或“a和b”。
65.本发明涉及磁性颗粒,其包括包含磁响应金属的核、围绕该核并具有均匀厚度的壳层,以及引入到该壳层上以捕获生物材料的捕获探针,其中每个捕获探针包含针对作为抗原的用于癌症诊断的生物标志物的抗体。
66.该核可以包括磁响应金属,优选地磁性金属或与磁性金属合金的金属。磁性金属可以是与铁(fe)、镍(ni)、钴(co)或锰(mn)的合金。磁响应金属可以基本上包括至少一种过渡金属,例如铁、镍、钴或锰,并且可以任选地包括至少一种稀土金属,例如钆(gd)、铽(tb)或钐(sm)。磁响应金属可以任选地进一步包括一种或多种其他元素,例如硼(b)、硅(si)和碳(c)。磁响应金属通常是铁或钴合金。具体地,铁合金为fe
70b15
si
10
c5,钴合金为co
68
mn7si
10b15
。核可以包括磁性金属与铜(cu)、金(au)、银(ag)、铁(fe)或铂(pt)的混合物或合金。更优选地,核包括超顺磁性金属。核不直接具有磁性,但可能被靠近的磁体磁化,并与磁铁具有吸引力。因此,磁体的使用对于移动和混合磁性颗粒是有用的。在本发明中,优选使用顺磁性材料而不是铁磁性材料。将顺磁性材料使用于核,减少了在移除磁体时由磁性颗粒之间的磁吸引力引起的磁性颗粒聚集。铁磁性材料的使用导致磁性颗粒的聚集,使得难以单独观察荧光。因此,优选使用铁磁性材料作为核。优选地,磁性颗粒具有不悬浮在水中的尺寸和比重。由于这些物理特性,磁性颗粒可以通过外部磁体(例如永磁体或电磁体)被快速收集或分离。
67.核可以占磁性颗粒总体积的60%或更多。例如,核可以占磁性颗粒总体积的60%至99%,优选地75%至99%。优选地,磁性颗粒具有大约几十到几百微米(μm)的尺寸(例如,直径或长度)以及至少为5,例如5至30的比重。如果磁性颗粒是纳米颗粒,它们的尺寸小于1微米,尽管它们的比重很高(例如,铁纳米颗粒的比重为7.876),但它们可能会悬浮在水中。
在这种情况下,用于在外加磁场的影响下使用磁性颗粒检测孔中的生物材料的生物测定期间,生物材料难以分离,因为微粒的低磁力使得其难以控制磁性颗粒的磁性。当磁棒在孔中上下移动以促进免疫反应时,微粒会附接在磁棒上或从磁棒上分离。即使去除磁场后,附接在磁棒上的微粒也不会从孔底脱落,并且当检测到孔中存在生物材料时,由于其重量小,在磁棒上下运动过程中仍保持与磁棒的非特异性结合,导致定量分析的重现性差。
68.在本发明的磁性颗粒中,包含磁响应金属的核和围绕该核的壳层形成核-壳结构。该壳层可以由有机或无机材料形成,优选地为玻璃。
69.玻璃可以基本上由至少一种选自以下组的化合物组成,该组由钠钙、硼硅酸盐、铝硅酸盐、二氧化硅、碱金属硅酸盐、耐热玻璃和石英组成。优选地,该玻璃为硼硅酸盐玻璃,适用于需要耐热、耐酸、耐水的实验,可以最大限度地减少与抗体的非特异性结合。
70.壳表面可以包括亲水性官能团。
71.捕获探针可以结合到包括官能团的壳表面,这将在后面描述。官能团是亲水性官能团。亲水性官能团可以是硅烷醇基或衍生自硅烷醇基的羧基、氨基、羟基、硫醇基或醛基。亲水性官能团更优选地为硅烷醇基。
72.亲水性官能团可以直接与捕获探针结合。优选地,亲水性官能团经由连接键与捕获探针结合。连接键位于亲水性官能团和捕获探针之间,以促进捕获探针与壳层的连接。每个连接键优选地是硅烷化合物,更优选地是氨基硅烷,最优选地是3-氨基丙基三甲氧基硅烷(aptes)。
73.优选地,硅烷化合物具有由h2n-l-si(or)3表示的结构,其中l为c
1-c
12
亚烷基、c
6-c
20
亚芳基或亚烷基和亚芳基的任意组合,r为氢或c
1-c8烷基。l的主链可以被0至4个-nh-部分取代。
74.硅烷化合物优选为氨基硅烷。具体地,氨基硅烷可以选自由下述项构成的组,即,3-氨基丙基三乙氧基硅烷、氨基硅烷水解物、3-氨基丙基三甲氧基硅烷、2-氨基乙基-3-氨基丙基三甲氧基硅烷、2-氨基乙基-3-氨基丙基三乙氧基硅烷、2-氨基乙基-3-氨基丙基甲基二甲氧基硅烷、3-氨基丙基甲基二乙氧基硅烷、3-氨基丙基三甲氧基硅烷、n-2-氨基乙基-3-氨基丙基三乙氧基硅烷、三乙氧基甲硅烷基丙基二亚乙基三胺、双(三甲氧基甲硅烷基丙基)胺、双(三乙氧基甲硅烷基丙基)胺及其混合物。从经济角度来看,3-氨基丙基三甲氧基硅烷(aptes)是优选的。在一个实施例中,末端胺基可以被转化为羧基以便与捕获探针结合。
75.壳层可以基本上完全围绕磁性颗粒。或者,微粒的表面可以不被壳层完全覆盖,并且可以在微粒的生产过程中被部分暴露。
76.核-壳结构可以通过将液体壳组分施加到核金属或将核金属组分填充在中空框架中来形成。
77.壳层可以通过有机或无机涂层溶液的固化形成。更具体地,壳层可以通过在高温下熔融有机或无机壳组分以使壳组分可流动来形成。或者,可以通过将壳组分溶解在溶剂中以制备涂覆液并将涂覆液施加到核金属上来形成壳层。有机材料通常是聚合物,无机材料可以是金属或陶瓷材料,尤其是玻璃。例如,壳层可以通过将塑料材料溶解在溶剂或熔融玻璃中以获得涂层溶液并通过合适的涂层工艺(例如浸涂或喷涂)将涂层溶液施加到磁性颗粒上来形成。
78.引入壳层上的捕获探针用于捕获生物材料。每个捕获探针包括针对作为抗原的用于癌症诊断的生物标志物的抗体。
79.许多中小型医院没有用于癌症诊断的断层扫描系统,例如ct或mri。即使可用,它们也需要大量时间来读取结果,从而难以正确治疗癌症。因此,大多数中小型医院目前仅使用可以直观地立即读取结果的超声成像系统来测试是否存在肿瘤。由于有限的分辨率,断层扫描系统无法检测到小肿瘤。使用长波长超声波的超声成像系统也具有有限的分辨率。因此,诊断准确性取决于医生的经验。有经验的医生只能判断有无肿瘤,依靠活检结果进行准确诊断。然而,活检是一种侵入性操作,会给患者的身体带来很大的负担,并且需要大量的测试成本和时间,从而限制了其在即时测试中的使用。相比之下,由于本发明的poct诊断系统使用血液中存在的生物标志物来确定肿瘤的存在与否,它可以做得足够小以适用于中小型医院,并且需要低的劳动力和空间成本。另外,本发明的poct诊断系统平均需要20至30分钟的诊断时间,准确率高达98%左右。由于这些优点,本发明的poct诊断系统对于快速准确的癌症诊断非常有用。
80.图1示出了本发明的poct癌症诊断系统和使用该诊断系统的诊断方法的流程图。能够与癌症生物标志物特异性结合的第一抗体被固定在表面改性的磁性颗粒上。磁性颗粒是经过改进的非球形/不对称微粒,具有磁性金属被玻璃包覆的结构,并且可以通过它们的长度来区分。磁性颗粒的第一抗体与癌症生物标志物之间可能会发生免疫反应。由于不能直接观察到这种免疫反应的结合过程,因此可以使用能够产生可测量信号的标记。在本发明中,可以使用第二抗体-标志物缀合作为标记。第二抗体是能够与癌症生物标志物特异性结合的抗体,并且标志物通常可以包括荧光材料或酶。
81.癌症可以是乳腺癌、肺癌、肝癌、胆囊癌、卵巢癌、肾癌、白血病或胶质母细胞瘤。癌症可以通过常见的生物标志物来检测。
82.88kda糖蛋白pc细胞衍生生长因子(pcdgf)是一种自分泌生长因子,首先从高致瘤性小鼠畸胎瘤pc细胞中分离出来。pcdgf又称为gp88、颗粒蛋白-上皮素前体(gep)、颗粒蛋白前体、颗粒蛋白前体、上皮蛋白前体、上皮蛋白原(pepi)和顶粒蛋白(以下统称为gp88),其是富含半胱氨酸的多肽生长调节剂颗粒蛋白/上皮蛋白家族中最大的成员。据报道,gp88通过刺激map激酶、pi-3激酶和fak激酶途径刺激了几种间充质和上皮来源的细胞类型的增殖和存活。有趣的是,在几种癌细胞系和/或肿瘤组织(包括乳腺癌、卵巢癌、肾癌、几种白血病和胶质母细胞瘤)中发现了gp88的过表达。然而,已知gp88在良性肿瘤和正常乳腺上皮组织中不表达。因此,gp88作为生物标志物可用于制造高精度的癌症诊断试剂盒。
83.在癌细胞中,gp88已被证明在肿瘤发生中起关键作用。gp88过表达与雌激素非依赖性生长的的获得、他莫昔芬抗性和致瘤性呈正相关。在mda-mb-468细胞中通过反义cdna转染抑制gp88表达导致在裸鼠中完全抑制生长因子。此外,已证明gp88可阻止他莫昔芬在雌激素受体阳性乳腺癌细胞中的凋亡作用。乳腺癌活检的病理学研究表明,gp88在80%的浸润性导管癌中表达,与预后不良的标志物,例如肿瘤分级、p53表达和ki67指数相关,而良性病变大多为阴性。此外,卵巢肿瘤的病理学研究表明,与恶性潜能低的肿瘤相比,gp88在侵袭性上皮性卵巢肿瘤中高表达。这些研究表明,除了刺激肿瘤细胞的增殖外,gp88在侵袭中也起作用。
84.癌症可以是乳腺癌、肺癌、肝癌、胆囊癌、卵巢癌、肾癌、白血病或胶质母细胞瘤。癌
症优选地为乳腺癌。已知gp88通常在各种癌症类型中表达。特别是gp88与乳腺癌的发生和发展高度相关。因此,gp88可用作乳腺癌、肺癌、肝癌、胆囊癌、卵巢癌、肾癌、白血病或胶质母细胞瘤,尤其是乳腺癌的诊断生物标志物,其具有高准确度。此外,通过观察生物标志物是否增加或减少,可以快速监测目前市售的乳腺癌治疗剂对个体的治疗效果,从而为患者选择合适的治疗剂,诊断和监测预后。此外,该生物标志物可用于研究目前正在开发的乳腺癌治疗药物的有效性,从而有助于开发有效的乳腺癌治疗药物。
85.gp88的序列可以在韩国专利号为10-1690249的专利中找到。gp88及其重组体已保藏,它们的序列是公知的。用于与gp88结合的捕获探针或检测探针可以包括抗gp88抗体。此类抗gp88抗体可以从杂交瘤细胞系产生,包括但不限于,6b3杂交瘤细胞系(atcc登录号pta-5262)、6b2杂交瘤细胞系(atcc登录号pta-5261)、6c12杂交瘤细胞系(atcc登录号pta-5597)、5b4杂交瘤细胞系(atcc登录号pta5260)、5g6杂交瘤细胞系(atcc登录号pta-5595)、4d1杂交瘤细胞系(atcc登录号pta-5593)、3f8杂交瘤细胞系(atcc登录号pta-5591)、3f5杂交瘤细胞系(atcc登录号pta-5259)、3f4杂交瘤细胞系(atcc登录号pta-5590)、3g2杂交瘤细胞系(atcc登录号pta-5592)、2a5杂交瘤细胞系(atcc登录号pta-5589)以及4f10杂交瘤细胞系(atcc登录号pta-8763)。
86.本发明的磁性颗粒具有非常高的表面均匀性。用于生物测定的常规颗粒是通过在核颗粒表面上生长二氧化硅前体(例如teos)以形成壳层来制备的。在这种情况下,壳层的表面非常粗糙,因此,颗粒与目标材料的非特异性结合经常发生,造成不必要的背景噪声。
87.通过使用酸性材料,优选地使用强酸和过氧化氢的混合物进行表面处理,可以形成没有弯曲或突起的壳层。强酸和过氧化氢的混合物称为“食人鱼溶液”。传统的食人鱼溶液是硫酸和过氧化氢按3:1到7:1的比例混合而成。强酸/过氧化氢混合物是具有强氧化能力的溶液。强酸/过氧化氢混合物通过氧化去除存在于壳层上的异物,并通过蚀刻去除在壳层表面上形成的突起,结果,可以将壳层的表面粗糙度降至最低以防止粘附不需要的荧光材料。酸性材料可在壳层表面形成亲水性官能团。如上所述,连接键或捕获探针可以通过亲水性官能团容易地结合到壳层的表面。
88.每单位面积(nm2)可将1至80个亲水性官能团引入壳表面。
89.由于与壳层上的亲水性官能团结合的连接键或捕获探针附接在磁性颗粒上,因此结合的连接键或捕获探针的数量可以根据亲水性官能团的数量来确定。因此,磁性颗粒表面上的多个亲水性官能团的形成允许大量连接键或探针附接到磁性颗粒表面(图5)。如果亲水性官能团的密度小于1/nm2,可能会观察到低荧光,这很难测量。同时,如果亲水性官能团的密度超过80/nm2,由于与亲水性官能团结合的探针之间的干扰,可能观察不到荧光的进一步增加。
90.当捕获探针直接与硅烷醇基结合时,亲水性官能团的密度可以为1至80/nm2。如图4所示,连接键与三个硅烷醇分子结合。在这种情况下,当亲水性官能团经由过连接键与捕获探针结合时,它们的密度为1至30/nm2。
91.壳层的表面可以用酸性材料处理。当壳层由玻璃制成时,作为存在于玻璃表面上的亲水性官能团的硅烷醇基可以与探针结合。然而,在这种情况下,只有少量的捕获探针可以附接在壳层的表面,导致荧光强度低。在本发明中,优选使用硫酸和过氧化氢的混合物,称为“食人鱼溶液”作为酸性材料,在壳层表面形成亲水性官能团。由酸性材料形成的亲水
性官能团可以是硅烷醇基或衍生自硅烷醇基的羧基、氨基、羟基、硫醇基或醛基。亲水性官能团更优选为硅烷醇基。
92.亲水性官能团可以通过干法(例如氧等离子体、电晕或uv臭氧处理)形成,但优选通过湿法使用不受磁性影响的酸性材料形成,同时能够在磁性微棒的表面上均匀地形成亲水性官能团。即,壳层表面用酸性材料,特别是食人鱼溶液进行氧化亲水化处理,以大大增加可与探针结合的活性位点(亲水性官能团)的数量,从而产生高荧光强度(参见图5)。
93.用于壳层的玻璃(例如,硼硅酸盐玻璃)几乎没有表现出由通过化学反应与反应样本吸附引起的非特异性结合。特别地,磁性颗粒的表面非常均匀,因为壳层具有源自液体成分的涂层。壳层的平均表面粗糙度(ra)可以为15nm或更小,优选地为10nm或更小,更优选地为5nm或更小,更优选地为2nm或更小,特别地为1.5nm或更小。ra可以是例如3nm或更大、2nm或更大或1nm或更大。如果表面粗糙度超过15nm,则壳层表面的荧光材料的非特异性吸附可能增加,导致荧光观察期间的噪声增加。
94.壳层的厚度可以为1至100μm,优选为1至50μm,更优选为1至10μm,进一步优选为4至8μm。如果壳层的厚度小于下限,则壳层的表面趋于变脆或易于破裂。同时,如果壳层的厚度超过上限,则玻璃切割过程中激光的特性和波长可能会引起问题。
95.磁性颗粒可以具有1ng/ml或更小的检测极限和至少log3的动态范围。磁性颗粒即使在1ng/ml的浓度下也可以用于荧光分析,如图13所示,在30ng/ml左右荧光变化最大。因此,本发明的磁性颗粒具有1ng/ml的检测极限或更少,优选地为3.7ng/ml或更少,最优选地为7ng/ml或更少。检测极限可以是例如至少0.001ng/ml、至少0.01ng/ml或至少0.1ng/ml。如图14所示,磁性颗粒具有至少log3,优选至少log5的动态范围。例如,动态范围可以是log3到log10,优选地是log5到log7。如图14所示,随着浓度在0至60ng/ml范围内的增加,荧光信号增加,表明它们之间具有非常高的相关性(测定系数,r2:0.9909)。总之,与使用常规磁性颗粒相比,使用根据本发明的磁性颗粒导致灵敏度提高约40倍。当优化时,本发明的磁性颗粒可以具有比常规磁性颗粒高至少100倍的灵敏度。
96.磁性颗粒可以具有两种或更多种不同的长度并且可以同时诊断两种或更多种类型的生物标志物。在这种情况下,磁性颗粒可能会结合不同的捕获探针,这具体取决于它们的长度(图8)。结果,根据捕获探针产生的不同的荧光长度,从而能够同时诊断两种或更多种类型的生物标志物。为此目的,磁性颗粒可以具有2到20种不同的长度,它们相差5到200μm。使用具有不同长度的磁性颗粒能够同时检测2至20种生物标志物。如果磁性颗粒的长度相差小于5μm,则使用光学系统可能难以区分长度差异。同时,如果磁性颗粒的长度相差超过200μm,则很容易区分长度差异,但可能难以使用多个长度的磁性颗粒,从而难以同时识别多种类型的生物标志物。
97.例如,可以将能够与gp88反应的抗体作为捕获探针偶联在长度为300μm的磁性颗粒的表面上,并且能够将能够与p53反应的抗体作为捕获探针偶联在长度为400μm的磁性颗粒的表面上。当使用不同长度的磁性材料时,产生相同的荧光,但由于磁性材料的长度不同,因此可以读取生物标志物是gp88(荧光长度300μm)还是p53(荧光长度400μm),其表明即使不需要pcr等基因检测,也可以通过简单的光学观察来准确确定生物标志物的类型。
98.这可以扩展到具有大量不同长度的磁性颗粒。例如,当磁性颗粒具有10种不同的长度并与捕获探针耦合时,可以同时识别10种生物标志物。然而,当磁性颗粒具有20个或更
多不同长度时,对应于每个长度的磁性颗粒的数量不足,不能获得足够的荧光。因此,为了获得足够的荧光,必须使用大量的磁性颗粒,这不可避免地导致效率低下。
99.磁性颗粒可以通过切割玻璃镀膜的金属微线获得。只需用激光将玻璃镀膜的金属微线切割成不同长度即可获得不同长度的磁性颗粒。
100.磁性颗粒可以是未成形的或成形的形式。当成形时,磁性颗粒呈棒状、片状或球状。片状磁性颗粒可以具有各种截面形状,例如星形、多边形和圆形,但在此不特别限制。磁性颗粒为微棒状、微盘状或微珠状,从制作方便、观察容易等方面考虑是优选的。磁性颗粒特别优选为微棒的形式。微棒形式的磁性颗粒由于它们的重叠而易于相互区分。当放置在孔中时,微棒形式的磁性颗粒很容易聚焦。由于微棒形式的单个颗粒占据的区域很小,因此可以在单个屏幕上显示大量的微粒。磁性颗粒可以具有复杂的横截面形状,例如星形。然而,在这种情况下,磁性颗粒在孔中移动时倾向于相互碰撞或与孔壁碰撞,从而导致边缘处的破损。因此,磁性颗粒具有简单的形状,例如微棒形状是有利的。
101.微棒可以具有10至1000μm的长度。如果微棒具有小于下限的不同长度,则它们不容易相互区分,并且由于它们的磁性降低而难以混合、洗涤和使用磁体移动。同时,如果微棒的长度超过上限,则颗粒可能重叠,使得它们的观察变得困难,并且难以将所需量的磁性颗粒引入到一个孔中,给诊断带来困难。微棒的长度与直径之比(即纵横比)可以至少是2、至少是5或至少是10并且可以是20或更小。如果纵横比小于2,则微棒接近于球形微粒,难以相互区分。同时,如果纵横比超过20,则磁性颗粒的直径减小导致磁核的厚度相对较小,导致低磁性。此外,磁性颗粒的直径减小导致耐久性差,导致磁性颗粒在测试过程中破裂。
102.磁性颗粒可适合用于体外诊断以检测源自活生物体的样本溶液中的生物材料。样本溶液可以是组织提取物、细胞裂解物、全血、血浆、血清、唾液、眼液、脑脊液、汗液、尿液、乳汁、腹水、滑液和腹膜液。为了快速诊断,样本溶液的预处理可以被简化甚至可以省略。
103.生物材料可以是生物标志物、血液、血浆、血清、体液、蛋白质、肽、核酸、细菌、病毒、内质网、mirna、外泌体和循环肿瘤细胞。优选地,生物材料是生物标志物。特别地,本发明的磁性颗粒对于生物标志物检测非常有用,因为它们能够在一次测试中检测各种类型的生物材料以快速和早期诊断疾病。生物标志物不受限制,只要它们在一般科学或医学应用中用于测量或评估生物治疗、发病机制和药物治疗过程即可。生物标志物可以是,例如可以在诸如血液、唾液和尿液的生物流体中检测到的多肽、肽、核酸、蛋白质或代谢物。具体地,可以无限制地使用生物标志物,只要它们的血液浓度在存在乳腺癌、肺癌、肝癌、胆囊癌、卵巢癌、肾癌、白血病或胶质母细胞瘤,特别是乳腺癌的情况下增加。一种生物标志物优选地是gp88。已知生物标志物甚至在肺癌、肝癌、胆囊癌、卵巢癌、肾癌、白血病或胶质母细胞瘤以及乳腺癌中都有表达。因此,本发明的磁性颗粒不仅可以用于诊断症状明显的重症患者,还可以用于诊断轻度患者。
104.在本发明的一个实施例中,可以将捕获探针引入壳层上以捕获样本溶液中的生物材料。捕获探针允许生物材料被磁性颗粒捕获,因为它们具有与生物材料特异性结合的能力。捕获探针可以是抗体、蛋白质、核酸或适体。例如,捕获探针可以是能够特异性结合生物标志物以捕获生物标志物的捕获抗体。捕获探针可以通过吸附或化学键合固定在磁性颗粒的表面上。优选地,捕获探针与存在于壳层表面上的亲水性官能团连接。例如,捕获探针可以通过在捕获探针的表面上引入生物素并且将能够与生物素结合的抗生物素蛋白、中性抗
生物素蛋白或链霉抗生物素蛋白引入到磁性颗粒上以附接到磁性颗粒上。或者,捕获探针可以经由磁性颗粒表面上的亲水性官能团与磁性颗粒连接。
105.亲水性官能团可以直接与捕获探针结合。优选地,亲水性官能团经由连接键与捕获探针结合。每个连接键可以是硅烷化合物,如上所述(参见图4)。
106.现在将基于制备磁性颗粒的方法详细描述本发明。
107.本发明还涉及一种制备用于检测生物材料的磁性颗粒的方法,包括(i)制备由玻璃制成的壳和包含磁性材料的核组成的磁性微棒,(ii)用酸性溶液处理该磁性微棒的表面以形成硅烷醇基,(iii)将表面处理过的所述磁性微棒浸入硅烷基溶液中以将硅烷化合物与该硅烷醇基结合,(iv)将硅烷分子的末端基团转化为能够与探针结合的末端基团,以及(v)将探针附接到该硅烷分子的末端基团,其中每个探针包含针对作为抗原的用于癌症诊断的生物标志物的抗体。
108.在步骤(i)中,制备由玻璃制成的壳和包含磁性材料的核组成的磁性微棒。
109.具体地,磁性微棒的制备方法是在玻璃管中填充金属粉末,在加热条件下从填充的玻璃管中拉出涂覆有玻璃的微线,然后将微线切割成均匀的长度(参见图2)。该方法基于talyor-ulitovsky技术,其基本原理例如在wo1993/005904a2中有所描述,该文档通过引用并入本文。
110.涂覆有玻璃的微线的制备将更详细地被解释。首先,将金属(磁性颗粒)填充到玻璃管中,并将填充后的玻璃管放置在由加热装置加热的加热单元中。金属可以是粉末形式或者可以是在熔化时形成金属的化合物。熔融金属可以直接填充在玻璃管中。金属粉末的平均粒径为40至300μm,优选地为50至200μm,更优选地为70至150μm。如果金属粉末的平均粒径小于40μm,金属粉末在加工过程中可能会飞散在空气中,导致粉末价格上涨,导致整体生产成本增加。同时,如果金属粉末的平均粒径超过300μm,则可能无法确保金属粉末顺利转移到玻璃管中,由此产生的微线可能具有空的空间,其中金属不存在,导致缺陷的形成(图3)。
111.玻璃管的内径为0.2至2mm,优选地为0.3至1.5mm,更优选地为0.5至1mm。如果玻璃管的内径小于0.2mm,则构成核的金属可能不容易填充在玻璃管中。同时,如果玻璃管的内径超过2mm,则核的相对直径可能会增加,因此在拉制过程中玻璃壳层可能会变薄,导致耐久性差或在表面形成弯曲或突起(图3)。
112.玻璃管可以由钠钙、硼硅酸盐、铝硅酸盐、二氧化硅、碱金属硅酸盐、耐热玻璃或石英制成。或者,玻璃管可以通过将包含氧化铅、二氧化碲或二氧化硅作为主要成分的玻璃加工成管来制造。玻璃的软化点在约1000至约1900℃,优选约1100至约1700℃的范围内。如果玻璃的软化点低于1000℃,则玻璃管可能在金属粉末熔化之前软化,导致形成缺陷。同时,如果玻璃的软化点超过1900℃,则加热时间长且成本高,在经济上是不利的。
113.用于壳层的玻璃(例如,硼硅酸盐玻璃)几乎没有通过化学反应与反应样本吸附引起的非特异性结合,从而最大限度地减少噪音的发生。
114.优选地,金属的熔点低于玻璃管的软化点。如果金属的熔化温度高于玻璃的软化点,金属粉末在拉制过程中可能不会熔化而可能留在玻璃管中,因此在使用过程中金属粉末可能会泄漏,从而降低磁性颗粒的寿命并导致异物污染。
115.加热装置可以设置在玻璃管的下方或靠近玻璃管的位置,以将玻璃管加热到可以
拉出玻璃管的软化点。
116.金属粉末在加热过程中形成液滴,并且与金属粉末相邻的玻璃管被软化以包围由金属粉末形成的液滴。具体地,由于玻璃管与填充在玻璃管中的金属粉末的熔融同时软化并被拉出,所以磁性颗粒的核在被玻璃覆盖的同时被拉出。
117.例如,加热装置可以是本领域已知的感应加热器,特别是感应器。例如,螺旋线圈(例如,铜线圈)可以缠绕在电感器中。具体地,加热区域可以形成在线圈中。可以考虑熔融金属的期望高度等来选择线圈的数量。加热区域由在所需频率的磁场产生的涡流损耗加热。加热装置可以是高频感应器,其中频率例如可以为0.5至800khz左右,具体约为10至500khz左右,但不限于此。
118.加热区域的内部温度优选为1000至2000℃,在该温度下玻璃管可以被软化,并且可以根据玻璃管的材料和构成磁性颗粒芯核的金属类型而变化。
119.如上所述,填充在玻璃管中的磁性颗粒可以包括铜(cu)、金(au)、银(ag)、铁(fe)或铂(pt),更优选地包括超顺磁性金属。
120.在这方面,可以提及钴合金或富铁合金作为磁性金属的代表性示例。在一个具体实施例中,可以在磁性金属中添加或掺入少量铜(例如,至多约5原子%,特别地至多约3原子%)以增加成核中心的数量并促进纳米化。
121.加热完成后,将构成玻璃管中微线的核的熔融金属填充到玻璃毛细管中并被拉出。
122.在拉制过程中,玻璃管的内部可以处于惰性气体气氛中,例如氦气、氖气、氩气或氮气气氛。用惰性气体气氛代替玻璃管的气氛可以防止磁性颗粒在熔化过程中的氧化。
123.拉制导致形成微线,其中金属核基本上完全被玻璃覆盖。拉制的微线可以在被布置在加热装置后端的冷却装置冷却的同时被固化。
124.可以使用任何可以加热微线的冷却装置而不受限制。冷却装置可以使用浸入微线的冷却剂进行冷却。冷却剂可以是水、油或制冷剂,但优选地是水。
125.如上所述,固化的微线通过安装在系统中的收线机被回收。收线机可以具有线圈形状。具体而言,收线机是绕线管型的
126.在玻璃镀膜的金属微线中,核金属的直径在30至100μm,优选地为40至80μm,更优选地为50至70μm的范围内。玻璃涂层(壳层)的厚度在3至50μm,优选地5至20μm,更优选地7至15μm的范围内。微线的总直径例如可以为约30至120μm,优选地为30至100μm,更优选地为40至80μm。
127.包括磁性材料的微线可以在收线机上连续生产1至15km,优选地5至10km的长度,并以卷筒形式包装。微线可用于制备非球形微棒,如下所述。
128.可以将微线切割成预定长度以制备非球形磁性微棒。更具体地,将微线沿横向(例如平行)排列并切割成预定长度以制备大量非球形/不对称微粒。激光以非接触方式用于切割。
129.具体地,可以通过韩国专利公开号2018-0130436的专利中公开的方法来切割微线。更具体地,可以通过以下方法制备微线,包括:制备具有沿横向排列的多个凹槽的线架,并将玻璃镀膜的金属微线定位在线架的各个凹槽中;以及使用激光以非接触模式在横向上以预定间隔切割位于线架中的玻璃镀膜的金属微线,其中激光具有比玻璃镀膜的金属微线
的热传播时间短的脉冲宽度。
130.得到的磁性微棒用强酸和过氧化氢的混合物进行表面处理,使其表面光滑。该方法还可包括在表面处理之前洗涤表面以去除表面上存在的异物。
131.可以使用各种有机溶剂进行洗涤。更具体地,用有机溶剂洗涤磁性颗粒(磁性微棒),然后用乙醇除去有机溶剂。有机溶剂优选地为丙酮。用有机溶剂处理后,用酸处理磁性颗粒。酸优选地是硫酸。酸处理过的磁性颗粒用水和乙醇的混合物洗涤。酸处理的磁性颗粒用碱处理。碱是氢氧化钠,优选地是在水和乙醇的混合溶剂中的氢氧化钠。碱处理过的磁性颗粒优选地用水和乙醇洗涤。
132.在步骤(ii)中,用酸性溶液处理磁性微棒的表面以形成硅烷醇基。
133.例如,在完成洗涤之后,可以用酸性溶液对磁性颗粒进行表面处理。
134.酸性溶液优选地为强酸和过氧化氢的混合物,例如食人鱼溶液。食人鱼溶液通常是指硫酸和过氧化氢的混合物,并且旨在包括硫酸和过氧化氢以各种比例的混合物。典型的食人鱼溶液是体积比为3:1到7:1的硫酸和过氧化氢溶液。除此之外,氨水和过氧化氢的混合物称为基本食人鱼溶液。
135.酸性溶液优选地为强酸和过氧化氢的体积比为1:1至7:1,更优选地2:1至5:1,最优选地3:1的混合物。如果比值小于《1:1,即过氧化氢的含量高于强酸,在制备酸性溶液的过程中可能会放出大量的热量和气体,增加爆炸的风险。同时,如果该比率》7:1,食人鱼溶液可能无法充分氧化,从而难以形成硅烷醇基。过氧化氢可以是10至50体积%,优选地20至40体积%,更优选地30体积%的过氧化氢的溶液。如果使用小于10体积%的过氧化氢溶液,食人鱼溶液可能无法充分氧化,从而难以形成硅烷醇基。同时,如果使用超过50体积%的过氧化氢溶液,在制备酸性溶液的过程中可能会释放出大量的热量和气体,从而增加爆炸的风险。
136.由于食人鱼溶液是一种高腐蚀性和强氧化剂,因此在处理时应小心。在使用食人鱼溶液之前,需要彻底洗涤目标物体表面的异物,并且还必须去除用于洗涤的溶剂。食人鱼溶液可以溶解和去除有机污染物,但大量污染物或洗涤溶剂可能会剧烈产生气泡或引发爆炸反应以释放大量气体。
137.食人鱼溶液优选地通过将过氧化氢添加到硫酸中来制备。将硫酸添加到过氧化氢中会产生大量气体并增加爆炸的风险。即使在硫酸中加入过氧化氢,也会发生剧烈的放热反应。因此优选地通过适当的冷却来降低温度。将过氧化氢的含量限制在50体积%或以下,更优选地30体积%,以控制剧烈反应。
138.食人鱼溶液可以氧化金属表面或玻璃表面。特别地,食人鱼溶液氧化并去除玻璃表面上的异物和不需要的突起,并使玻璃表面亲水化以形成大量的硅烷醇基。
139.酸性溶液可以将磁性微棒的玻璃表面上1至90%的分子转化为硅烷醇基。在磁性微棒的表面形成大量的硅烷醇基,使得大量探针能够附接在磁性颗粒的表面上。即,使用酸性溶液在表面形成硅烷醇基,可使大量亲水性官能团或与硅烷键合的大量官能团(连接键)与硅烷醇基结合(图5)。如果硅烷醇基的密度小于1/nm2,可能会观察到低荧光,这很难测量。同时,如果硅烷醇基的密度超过80/nm2,由于与硅烷醇基结合的探针之间的干扰,可能观察不到荧光的进一步增加。
140.当捕获探针直接与硅烷醇基结合时,硅烷醇基的密度可以为1至80/nm2。如图4所
示,连接键与三个硅烷醇分子结合。在这种情况下,当硅烷醇基经由连接键与捕获探针结合时,它们的密度为1至30/nm2。
141.在步骤(iii)中,将表面处理过的磁性微棒浸入硅烷基溶液中以将硅烷化合物结合到硅烷醇基上。
142.在完成表面处理(步骤(ii))之后,使硅烷化合物与磁性颗粒的壳层反应。如上所述,硅烷化合物可以通过3-氨基丙基三乙氧基硅烷(aptes)与形成在壳层表面上的硅烷醇基连接。aptes优选地为丙酮或甲苯溶液的形式。aptes可以与硅烷醇基键合以形成氨基硅烷。反应时间优选地在6至24小时内。在这种情况下,可以在后续荧光分析期间检测到最佳荧光。如果反应时间短于6小时,与硅烷醇基键合的aptes的量可能会减少,从而导致荧光强度降低。同时,如果反应时间超过24小时,则制备磁性颗粒需要很长时间而荧光强度没有任何变化,导致成本增加(参见图7)。
143.在步骤(iv)中,硅烷分子的末端基团被转化为能够与探针结合的末端基团。
144.其上形成氨基硅烷的磁性颗粒的壳层表面优选地被羧基、羟基、硫醇基或醛基取代。捕获探针很容易与不同的末端绑定,具体取决于它们的类型。因此,氨基硅烷的末端基团(胺基)可以转化为能够与探针结合的末端基团。氨基硅烷(连接键)的氨基容易与捕获探针结合的情况下,也可以不进行转化而使用。
145.氨基硅烷的胺基更优选地通过与γ-丁内酯或琥珀酸酐反应而转变为羧基。
146.在步骤(v)中,探针附接到硅烷分子的末端基团。
147.磁性微棒可在使用前与探针附接。探针优选地为捕获探针。捕获探针是与生物标志物进行抗原-抗体反应的探针。生物标志物通过捕获探针附接在磁性微棒上。检测探针可以单独附接到生物标志物上。可以通过位于检测探针上的荧光材料或酶的作用来检测生物标志物。
148.每个捕获探针可以包括针对作为抗原的用于癌症诊断的生物标志物的抗体。生物标志物可以是gp88,已知其在乳腺癌、肺癌、肝癌、胆囊癌、卵巢癌、肾癌、白血病或胶质母细胞瘤,特别是乳腺癌中表达。探针中抗gp88抗体的存在使得能够制造出高精度的癌症诊断试剂盒。
149.根据本发明的另一方面,提供了一种使用磁性颗粒检测生物材料的方法。该方法包括(1)将磁性颗粒提供至第一孔,(2)使用磁力将该磁性颗粒从第一孔转移至第二孔,(3)向第二孔提供检测探针,该检测探针能够与生物材料特异性结合并与响应于外部刺激而发光的发光材料缀合,以及允许该捕获探针、生物材料和检测探针相互反应以形成该磁性颗粒、生物材料和检测探针的复合物,以及(4)使用磁力将磁性颗粒-生物材料-检测探针复合物转移到第三孔中,并测量该复合物中存在的发光材料响应于外部刺激产生的发光信号以检测生物材料。
150.在步骤(1)中,将磁性颗粒提供给第一孔。
151.磁性颗粒可以是通过上述方法制备的磁性微棒。磁性微棒可浸入并储存在第一孔中。
152.在步骤(2)中,使用磁力将磁性颗粒从第一孔转移到第二孔。
153.由于磁性颗粒的磁性,可以使用磁力将它们转移到第第二孔中。磁力优选地由磁棒产生。在使用覆盖有盖的磁棒将磁性颗粒转移到第二孔后,去除盖帽的磁棒。结果,磁性
颗粒可以浸入第二孔中或者可以悬浮在第二孔中的溶剂中。可以以与上述相同的方式执行随后使用磁性的磁性颗粒的转移。
154.在步骤(3)中,将能够与生物材料特异性结合并与响应于外部刺激而发光的发光材料缀合的检测探针提供给第二孔,并且允许捕获探针、生物材料和检测探针相互反应形成磁性颗粒、生物材料和检测探针的复合物。
155.与捕获探针一样,检测探针可以是能够与生物材料特异性结合的抗体、蛋白质、核酸或适体。例如,检测探针可以是特异性结合生物标志物并与发光材料缀合的检测抗体。
156.捕获探针的检测抗体和捕获抗体可以是针对作为抗原的癌症生物标志物的抗体。例如,在发生乳腺癌、肺癌、肝癌、胆囊癌、卵巢癌、肾癌、白血病或胶质母细胞瘤,特别是乳腺癌的位置,其血液浓度增加的任何生物标志物都可以不受限制地用作抗原。一种生物标志物优选地是gp88。已知这些生物标志物甚至在肺癌、肝癌、胆囊癌、卵巢癌、肾癌、白血病或胶质母细胞瘤以及乳腺癌中都有表达。因此,本发明的磁性颗粒不仅可以用于诊断症状明显的重症患者,还可以用于诊断轻度患者。
157.发光材料与检测探针结合并响应外部刺激产生光以检测生物材料的存在。外部刺激选自紫外线、电子束、化学反应和酶-底物反应。合适的发光材料的示例包括荧光分子、量子点、金属纳米颗粒、磁性纳米颗粒、酶和酶底物。特别地,荧光分子是优选的,因为它们易于购买且应用方便。荧光分子可以选自异硫氰酸荧光素(fitc)、荧光素、亚胺荧光素(fam)、藻红蛋白(pe)、四甲基罗丹明异硫氰酸酯(tritc)、花青3(cy3)、花青5(cy5)、花青7(cy7)、alexa fluor染料和罗丹明。
158.磁性颗粒、生物材料和检测探针的复合物可以通过将固定有捕获抗体的磁性颗粒、与生物材料特异性结合的检测抗体和含有生物材料的样本溶液混合在反应管中来制备。复合物可以通过在反应管中同时诱导生物材料与磁性颗粒之间的第一免疫反应以及生物材料与检测抗体之间的第二免疫反应来制备。
159.复合物的形成可以包括在存在外磁力的情况下促进反应。例如,可以通过将加热块上的反应管加热到适当的温度并允许磁棒在反应管中连续上下移动以快速混合免疫反应材料来促进免疫反应。
160.该方法还可以包括在存在外磁力的情况下洗涤复合物。即,该方法还可以包括在完成第一和第二免疫反应之后,在两个或更多个洗涤管中连续洗涤微粒、生物材料、检测探针和磁棒的复合物。洗涤后,检测复合物的发光信号,以准确识别生物材料的种类和数量。
161.如上所述,该方法可以使用独立的反应管进行,但优选使用多孔板。在这种情况下,磁性颗粒可以被引入到孔板的第一孔中并且可以被转移到孔板的第二孔中用于测试。可以将检测探针和生物颗粒引入第二孔中。因此,允许磁性颗粒、检测探针和生物颗粒在第二孔中反应以形成磁性颗粒-生物材料-检测探针复合物。可以将复合物转移到孔板的第三孔中进行荧光测量。
162.在第二孔和第三孔之间可以设置2至10个洗涤孔。洗涤孔是填充洗涤溶液的简单孔。磁性颗粒-生物材料-检测探针复合物可以在洗涤孔中浸泡和洗涤。洗涤用于去除未与磁性颗粒结合的生物材料和检测探针。如上所述,本发明的磁性颗粒可以使非特异性结合的荧光分子(检测探针)的量最小化,从而能够进行准确的荧光测量。在洗涤过程中,磁性颗粒-生物材料-检测探针复合物能够以与形成复合物相同的方式被浸入并使用外磁力转移。
163.在步骤(4)中,使用磁力将磁性颗粒-生物材料-检测探针复合物转移到第三孔中,并测量由复合物中存在的发光材料响应于外部刺激而产生的发光信号以检测生物材料。
164.本发明的方法可以通过免疫诊断测定来进行。特别地,可以通过合适的技术检测发光信号,例如elisa或荧光测量。
165.更具体地说,elisa技术是通过将样本中的目标材料与固定在巨磁性颗粒上的捕获抗体结合并处理检测抗体来进行的。检测抗体结合到目标材料的与捕获抗体结合的侧面的相对侧面。一种称为辣根过氧化物酶(hrp,horseradish peroxidase)的酶与检测抗体结合。该酶使用过氧化氢降解tmb底物,产生颜色。颜色的色度由od值决定。即,该方法基于与样本中目标材料的量成比例地大量附着的捕获抗体和检测抗体的原理,结果,与检测抗体缀合的hrp的含量增加,使酶反应进行得比较快,引起tmb底物颜色的快速变化。样本中目标材料的含量可以通过预先用不同浓度的目标材料处理以得到od值,根据od值绘制标准曲线,使用实际样本处理得到od值,并将实际od值与标准曲线进行比较。此时,所有的od值和浓度都可以用分析仪的自动分析程序计算出来。
166.荧光测量技术基于与elisa技术相同的原理,其中捕获抗体和检测抗体用于夹心测定,不同之处在于生物素与检测抗体而不是hrp酶缀合并用链霉亲和素缀合处理荧光材料来测量荧光值。首先,gp88蛋白与捕获抗体反应并附着在其上,然后用与生物素缀合的检测抗体进行处理,以将检测抗体附接到与捕获抗体连接的gp88侧面相对的侧面。此后,在使用电子面粉作为与链霉亲和素缀合的荧光材料处理后,测量来自磁性颗粒的荧光信号。根据目标诊断标志物浓度越高,磁性颗粒发出的荧光信号越强的原理,用明场显微镜识别反应孔中磁性颗粒的位置,并以像素为单位测量来自相应位置的荧光信号,并自动分析来自约10个微粒的荧光信号图像。与不同浓度的目标材料反应后,用同样的方法测定荧光值,将测得的荧光值绘制成标准曲线,将试验检测的荧光值应用到标准曲线上,以计算最终样本中相应目标蛋白的浓度。使用分析仪的自动分析程序分析所有图像并计算所有荧光值。
167.本发明的方法可以通过poct过程进行。poct是“即时检验(point-of-care test)”的缩写,是指在患者在场的情况下进行的直接测试。换句话说,poct是指不是由医疗技术人员在独立空间(如医院的中心实验室)进行的测试,而是由靠近患者的医生、护士或医疗技术人员进行的测试,例如在病房中、急诊室、手术室或重症监护室。传统的癌症诊断方法需要ct或mri等大型系统,无法进行现场检测。传统的免疫诊断方法需要大规模的诊断系统,例如pcr系统,因此在现场诊断中的使用受到限制。相比之下,本发明的方法可以使用小型化的诊断系统,从而能够通过poct过程进行现场诊断。
168.将参考附图详细描述本发明的优选实施例,以便本领域技术人员可以容易地实践本发明。在描述本发明时,当认为相关已知功能或构造的详细解释可能不必要地模糊本发明的本质时,将它们省略。为便于说明,附图中所示的某些特征被放大、缩小或简化,并且附图及其元素不一定具有适当的比例。然而,本领域技术人员应当容易理解这些细节。
169.[示例]
[0170]
步骤1:磁性微棒的制备和表面处理
[0171]
根据韩国专利公开号为10-2018-0130436的专利的公开内容生产涂覆有玻璃的微线。将涂覆有玻璃的微线切割成具有适当尺寸的磁性微棒。优选地,将涂覆有玻璃的微线切割成长度为400μm,磁性金属核的直径为50μm,玻璃涂层的厚度为5μm。因此,最终的磁性微
棒具有60μm的直径和400μm的长度。
[0172]
洗涤磁性微棒以从其表面去除异物。将洗涤过的磁性微棒置于小瓶中,通过加入丙酮沉淀,用乙醇洗涤并干燥。将干燥后的磁性微棒浸入硫酸中,用水和乙醇洗涤并干燥。酸处理过的磁性微棒用氢氧化钠溶液(1g naoh、4ml水和6ml乙醇的混合物)处理并用乙醇洗涤。
[0173]
接下来,将与样本中的抗原结合的第一抗体与磁性微棒结合。为此,对磁性微棒的玻璃表面进行了适当的改性。首先,将洗涤过的磁性微棒浸入食人鱼溶液(h2so4和30体积%的h2o2以3:1体积比混合的溶液)中,用硅烷醇(si-oh)对表面玻璃进行改性,用水和乙醇洗涤,然后干燥。此后,将表面改性的磁性微棒浸入2体积%的aptes溶液中进行硅烷化,用甲苯、乙醇和水洗涤,并在110℃的温度下固化。
[0174]
第一抗体被固定在用氨基硅烷改性的微棒表面上。为了更好地与第一抗体固定,氨基优选地被转化为羧基。在这种情况下,产生了羧基珠。大约10000个微棒(500
×
75μm)可以在1.5ml e-管中被处理。使用γ-丁内酯或琥珀酸酐和三乙胺的混合物的两种方法可用于转化为羧基。使用琥珀酸酐和三乙胺的方法被认为更有效。
[0175]
最后,用异硫氰酸荧光素异构体(fitc)包覆氨基硅烷进行荧光测量,以确定改性的均匀性和程度。与先前已知的二氧化硅(teos)处理的磁珠相比,发现表面改性的微棒具有非常均匀的表面(参见图6)。因此,减少了不需要的材料的非特异性结合,从而显着降低了噪音。此外,可以检测和分析作为抗原的gp88生物标志物,即使在非常低的浓度(约《~1ng/ml)下也可以观察到信号放大效应。
[0176]
大量的氨基硅烷结合到用食人鱼溶液改性的本发明的磁性颗粒表面,结果,与常规磁性颗粒相比,本发明的磁性颗粒显示出高荧光(参见图5(b))。
[0177]
步骤2:制备使用第一抗体固定的巨型磁性微棒复合物
[0178]
使用步骤1中制备的表面改性的磁性微棒(优选地用羧基进行表面改性)制备了与作为抗原的目标标志物特异性结合的第一抗体在样品溶液中固定的巨型磁性微棒复合物(棒珠)。具体地,通过以下程序制备巨型磁性微棒复合物。
[0179]
1)将磁性微棒(约2,500/瓶)转移到新的e-管中。
[0180]
2)用500μl mes缓冲液(ph 5.0)洗涤磁性微棒一次。
[0181]
3)将400μl mes缓冲液(ph 5.0)、50mg/ml的edc和50mg/ml的nhs(总反应体积500μl)放入含有磁性微棒的e-管中,然后在室温下(25℃)缓慢摇动30分钟(在旋转振动筛(旋转机)上以30rpm旋转)。
[0182]
4)用500μl mes缓冲液洗涤两次(同时轻敲30次)。
[0183]
5)完全从e-管中移除mes缓冲液。
[0184]
6)将0.1mg/ml的第一抗体放入试管中的mes缓冲液(ph 6.0)中,然后在室温下缓慢摇动2小时(在旋转振动筛(旋转机)上以30rpm旋转)。
[0185]
7)用500μl洗涤缓冲液(0.1%bsa、1x pbs、0.1%t-20、0.05%nan3)洗涤两次(同时轻敲30次)。
[0186]
8)从e-管中完全移除洗涤缓冲液(0.1%bsa、1x pbs、0.1%t-20、0.05%nan3)。
[0187]
9)加入500μl封闭缓冲液(1%bsa、1x pbs、0.1%t-20、0.05%nan3),然后在室温下缓慢摇动1小时(在旋转振动筛(旋转机)上以30rpm旋转)。
[0188]
10)用500μl洗涤缓冲液(0.1%bsa、1x pbs、0.1%t-20、0.05%nan3)洗涤两次并储存在封闭缓冲液中(产生的磁性微棒称为“rsmp”)。
[0189]
总之,所需的抗体可以通过非特异性反应与磁性微棒的玻璃涂层偶联。巨型磁性微棒复合物可识别基质多重密码,并以尽可能高的滴度与抗体结合。第一抗体是与样本溶液中的目标对应的抗原(gp88)特异性结合的抗体。
[0190]
根据磁性微棒的长度,不同的第一抗体可以与磁性微棒结合,形成可用于多路检测测定的长度编码系统。
[0191]
步骤3:使用第一抗体固定的巨型微棒的qc
[0192]
1)将步骤2中制备的约30个rsmp放入新的1.5ml e-管中,并去除上清液。
[0193]
2)加入500μl洗涤缓冲液(0.1%bsa、1x pbs、0.1%t-20、0.05%nan3)并完全去除1%bsa/pbs缓冲液(重复2次)。
[0194]
3)使用样本缓冲液(0.1%bsa、1x pbs、0.1%t-20)制备生物素(2μg/ml)缀合的第二抗体。
[0195]
4)将500μl步骤3中制备的第二抗体溶液加入已去除洗涤缓冲液(0.1%bsa、1x pbs、0.1%t-20、0.05%nan3)的试管中,然后在室温下缓慢摇动1小时(在旋转振动筛(旋转机)上以30rpm旋转)。
[0196]
5)用500μl洗涤缓冲液(0.1%bsa、1x pbs、0.1%t-20、0.05%nan3)洗涤两次(同时轻敲30次)。
[0197]
6)使用样本缓冲液(0.1%bsa,1x pbs、0.1%t-20)制备浓度调整为2μg/ml的链霉亲和素-藻红蛋白(sape),加入500μl制备的链霉亲和素-藻红蛋白,然后缓慢摇动30分钟(在旋转振动筛(旋转机)上以30rpm旋转)。
[0198]
7)用500μl洗涤缓冲液(0.1%bsa、1x pbs、0.1%t-20、0.05%nan3)洗涤两次,并使用荧光显微镜测量荧光(曝光时间:200ms/增益5.1
×
)。
[0199]
步骤4:制备免疫反应材料
[0200]
制备样本溶液、固定有与目标对应的抗原特异性结合的抗体的巨型磁性微棒复合物(rsmp)以及特异性结合抗原的第二抗体-荧光材料缀合物。
[0201]
样本溶液是组织提取物、细胞裂解物、全血、血浆、血清、唾液、眼液、脑脊液、汗液、尿液、乳汁、腹水、滑液或腹膜液。
[0202]
当要检测样本溶液中的多种标志物抗原时,制备了具有不同形状(例如,不同长度)的磁性微棒。每个磁性微棒都固定有抗体,该抗体能够特异性结合到并仅捕获样本溶液中存在的特定标志物之一。
[0203]
制备与样本溶液中的标志物抗原特异性结合的第二抗体-荧光材料缀合物。可以使用酶代替荧光材料。
[0204]
步骤5:样本装载
[0205]
将大约30个固定有与标志物对应的抗原特异性结合的抗体的巨型磁性微棒复合物(rsmp)引入第一孔中(参见图10)。
[0206]
使用磁棒将rsmp转移到第二孔中。用样本稀释剂(1x pbs、1%bsa(不含脂肪酸)、10mm edta(ph 8)、1%t-20、0.2mg/ml tru-block、1%人混合血清)按1:1稀释抗原,并放置在第二孔中。将1μg/ml的第二抗体和4μg/ml的sape引入第二孔中(总反应体积250μl)。
[0207]
此时,由于样本溶液(目标)中的rsmp上存在与标志物相对应的抗原,因此在抗原和rsmp之间引发了第一和第二免疫反应。在同一反应器中同时进行第一和第二免疫反应可以缩短反应时间。优选地使用具有以预定间隔排列的孔的常用孔板。可以使用管式反应器代替孔板。
[0208]
步骤6:混合/加热
[0209]
将执行步骤5的孔放置在加热块上并加热至适当控制的温度。一般免疫反应在约35℃时活跃地发生。免疫反应材料快速混合,同时位于孔上方的磁棒连续上下移动。这种快速混合缩短了免疫反应时间。
[0210]
步骤7:洗涤
[0211]
反应完成后,洗涤第二孔中的rsmp,同时使用磁棒将它们依次移至第三孔至第五孔。将250μl洗涤缓冲液(0.1%bsa,1x pbs,0.1%t-20,0.05%nan3)填充到第三至第五个孔中的每个孔中,并使用磁棒去除非特异性附着到每个孔中的rsmp的荧光材料2分钟。在此,免疫反应材料快速混合以用于洗涤,同时位于孔上方的磁棒以与步骤6相同的方式连续上下移动。
[0212]
这种洗涤去除了非特异性材料,允许洗涤/回收巨型磁性微棒复合物,并能够检测全样本以及血清和血浆样本。
[0213]
步骤8:检测信号测量
[0214]
反应完成后,使用专为磁性颗粒设计的超灵敏荧光图像分析仪测量检测信号(参见图11)。基于图像分析进行代码识别。即使使用一种荧光材料也能实现多路检测。抗原作为单一标志物以及荧光信号可以通过elisa通过酶促反应进行检测。完成上述所有步骤大约需要30分钟,检测极限约为几ng/ml至10000ng/ml。如图11的(c)和(d)所示,当使用相同浓度的生物标志物时,观察到更强的荧光。
[0215]
elisa技术是通过将样本中的目标材料与固定在巨型磁性微棒复合体上的捕获抗体结合并处理检测抗体来进行的。检测抗体结合到标志物材料的与捕获抗体结合的侧面的相对侧面。一种称为辣根过氧化物酶(hrp)的酶与检测抗体结合。该酶使用过氧化氢降解tmb底物,产生颜色。颜色的色度由od值确定。即,该方法基于与样本中标志物材料的量成比例地大量附着的捕获抗体和检测抗体的原理,结果,与检测抗体缀合的hrp的含量增加,使酶反应进行得比较快,引起tmb底物颜色的快速变化。样本中标志物材料的含量可以通过预先用不同浓度的标志物材料处理以得到od值,根据od值绘制标准曲线,使用实际样本处理得到od值,并将实际od值与标准曲线进行比较。使用数据绘制的趋势线计算浓度。此时,所有的od值和浓度都可以用分析仪的自动分析程序计算出来。
[0216]
荧光测量技术基于与elisa技术相同的原理,其中捕获抗体和检测抗体用于夹心测定,不同之处在于生物素与检测抗体而不是hrp酶缀合并用链霉亲和素缀合处理荧光材料来测量荧光值。首先,生物标志物蛋白(gp88)与捕获抗体反应并附着在其上,然后用与生物素缀合的检测抗体进行处理,以将检测抗体附接到与捕获抗体连接的生物标志物蛋白(gp88)侧面相对的侧面。此后,在使用电子面粉作为与链霉亲和素缀合的荧光材料处理后,自动测量来自磁珠的荧光值。根据目标诊断标志物浓度越高,磁性颗粒发出的荧光信号越强的原理,用明场显微镜识别反应孔中微粒的位置,并以像素为单位测量来自相应位置的荧光信号,并计算平均值。计算约10个磁性颗粒的平均值以确定荧光值的平均值。
[0217]
与不同浓度的目标标志物材料反应后,以同样的方式测定荧光值,将测得的荧光值绘制成标准曲线,将试验检测的荧光值应用于标准曲线,以计算最终样本中相应标志物蛋白的浓度。使用数据绘制的趋势线计算浓度。在这里,所有的图像都被分析,所有的荧光值都是用分析仪的自动分析程序计算的。
[0218]
使用本发明的磁性微棒测试以下类型的抗原,由于磁性微棒的快速反应,能够实现快速测试和高精度的多路检测。
[0219]
《实验例1》gp88测试
[0220]
将通过上述方法制备的rsmp偶联的捕获抗体(抗gp88抗体)用于gp88检测。将抗原gp88以0、1、3.7、7、15、30和60ng/ml的浓度添加到血清中,并以与上述相同的方式应用。
[0221]
使用本发明的诊断系统在浓度为0-60ng/ml的gp88下进行测试。结果,本发明的诊断系统具有与现有免疫学癌症诊断测试方法相同的动态范围(≥log3),并且在0-60ng/ml范围内随着浓度的增加显示出增加的荧光信号,其实现了非常高的相关值(确定系数,r2:0.9909)(见图13和14)。
[0222]
当使用本发明的诊断系统在超低gp88浓度的测试中使用黑色孔板时,达到了1ng/ml的检测极限,与现有检测方法相比,这相当于灵敏度提高了约40倍,这表明本发明的诊断系统在优化时可能具有至少100倍的灵敏度(图13)。
[0223]
在步骤1中观察到荧光强度随硅烷化时间的变化。为此,在1小时、3小时、9小时和24小时的硅烷化时间进行了相同的实验。结果,当硅烷化时间超过9小时时观察到高荧光值,而24小时后观察到非常微不足道的增加(参见图7)。
[0224]
《实验例2》gp88和p53的多路检测
[0225]
使用本发明的诊断系统对gp88(在400μm磁性颗粒上)和p53(在300μm磁性颗粒上)进行多路测定。结果如图12所示。根据抗原的浓度,仅检测与添加用于免疫反应的特定抗原结合的磁性颗粒的荧光信号。也就是说,可以通过粒子图像(明场)上的长度来识别和检测所需的磁性微棒,并且可以在荧光图像上检测和分析与磁性微棒结合的所需生物标志物的荧光信号(图15)。
[0226]
尽管已经详细描述了本发明的细节,但是对于本领域的技术人员来说显而易见的是,这些细节仅仅是优选的实施例,并不用于限制本发明的范围。因此,本发明的真正范围由所附权利要求及其等同物限定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。