补体组分c5抗体
1.本技术是2015年2月19日提交的申请号为pct/us2015/016699、发明名称为“补体组分c5抗体”的国际申请的分案申请,所述国际申请于2016年10月19日进入中国国家阶段,其申请号为201580020565.9。
2.交叉引用
3.本技术根据35 u.s.c.
§
119(e)要求2014年2月20日提交的美国临时申请序列号61/768,374和2014年2月26日提交的美国临时申请序列号61/944,943的优先权,所述两个临时申请均以引用的方式并入本文。
4.发明技术领域
5.本公开涉及抗体及其组合物、编码所述抗体的多核苷酸、用于产生所述抗体的表达载体和宿主细胞以及用于诊断和治疗由补体介导的疾病的组合物和方法。
6.发明背景
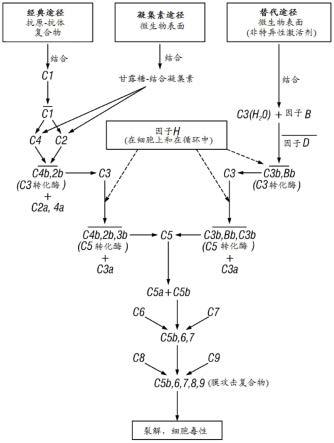
7.补体系统由将近50种单个蛋白质组成,所述蛋白质作为先天免疫系统的一部分起作用,从而提供宿主防御的初始阶段、对异物的调理作用以及组织动态平衡。(ricklin d.,2010,complement:a key system for immune surveillance and homeostasis.nature:immunology,785-795)补体系统可见于所有多细胞生物体中并且系统发生地先于适应性免疫系统的形成(zarkadis i.k.,2001 phylogenetic aspects of the complement system.development and comparative immunology,745-762.)。补体系统的激活沿着三种主要途径发生:经典途径、凝集素途径和替代途径。图1示出了三种主要补体途径的示意图。还参见,donoso等,“the role of inflammation in the pathogenesis of age-related macular degeneration”,survey of ophthalmology,第51卷,第2期,2006年3月-4月。
8.在激活过程中,连续的蛋白质-蛋白质相互作用和蛋白水解活性引起c3和c5转化酶的产生。这些转化酶负责产生补体激活分裂产物,所述分裂产物表示对于调理作用、过敏毒素产生以及膜攻击复合物(mac)形成重要的补体级联的效应分子。这些转化酶中的后者为补体级联的细胞裂解活性所必需的(ricklin d.,2010)。在正常条件下,补体级联的激活提供了针对致病性细菌、病毒的防御以及对患病和损伤组织的清除。在正常情况下,mac的形成由于存在细胞表面组分和可溶性调节组分而不影响外围组织,所述组分包括cfh、cfh相关蛋白质、c4bp、cd46、cd55、cd59以及补体因子i(cfi)。然而,当发生过量激活时或者当补体调节组分出现故障时,诱导了急性和慢性疾病状态。其中不受控制的补体激活被识别为人体病理学的原因的实例包括:肾小球肾炎、系统性红斑性狼疮、阵发性睡眠性血红蛋白尿症、阿尔兹海默病、遗传性血管性水肿、重症肌无力以及年龄相关性黄斑变性(amd)(ricklin和lambris,2013,complement in immune and inflammatory disorders:pthaological mechanisms.journal of immunology,3831-3838)。
9.c5为包含通过二硫键连接在一起的两条多肽链(α,115kda以及β,75kda)的190kda蛋白质。c5转化酶在c5α-链n末端下游的75个氨基酸的精氨酸残基处切割,从而产生7.4kd c5a和180kd c5b补体分裂产物。c5b组分充当用于通过依次添加c6、c7、c8以及c9而组装膜
攻击复合物(mac)的初始组分。c6-c8亚基以1:1关系组装到c5b,而多个c9亚基并入到所述复合物中,从而产生原核生物和真核生物质膜中的非特异性孔,图2。还参见,bubeck d.,2014,“the making of a macromolecular machine:assembly of the membrane attack complex”biochemistry,53(12):1908-15。细胞表面上的mac形成对细胞具有多种结果。在高水平下,未调节的溶质的流入量和流出量导致细胞肿胀和最终细胞裂解。这引起细胞物质不受控制的释放,从而促成促炎环境和细胞损失。在细胞表面上mac以亚细胞裂解浓度形成可有助于促炎性细胞因子和促血管发生细胞因子以及生长因子的释放、细胞应激的提高以及最终坏死细胞死亡。
10.年龄相关性黄斑变性(amd)为发达国家老年人目盲的主导原因。仅在美国群体中,与视力丧失相关的amd晚期形式的患病率在将近2百万个体中发生。患有中度amd的另外7百万个体处于发展amd晚期形式的高危险下。欧洲群体包括将近受影响个体数目的两倍。amd的特征在于可归因于引起视神经视网膜进行性变性的副炎性(para-inflammatory)过程的进行性视力丧失,以及包括视网膜色素上皮(rpe)和脉络膜血管层的支撑组织。大部分临床上显著的视力丧失发生在神经变性的变化影响眼睛高度特化区域内负责良好视敏度的视网膜中心(黄斑)时。所述疾病由于视力丧失和进行每日工作对家庭成员增加的依赖性而对个体的生理健康和心理健康具有巨大影响。
11.补体系统的失调与amd的发展高度相关。首先,在超过20种基因中的遗传突变已与个人发展amd的危险相关,这估计占了总危险的70%。(fritsche等,“age related macular degeneration:genetics and biology coming together”,annu rev genomics hum genet.2014;15:151-71)。在这20种基因内,五种为补体基因,它们单独占了发展amd晚期形式的总危险的57%。另外,amd-相关性炎症和补体活性的相关失调(如通过经由组织学分析获得的体循环中和amd组织中的补体激活产物提高所指示的)在补体蛋白中不存在已知遗传多态性的情况下发生。新发现已突出显示了膜攻击复合物在患病组织中和amd晚期形式发生中的鉴定和存在对补体的潜在病理学影响(whitmore s等,2014,“complement activation and choriocapillaris loss in early amd:implications for pathophysiology and therapy.”progress in retinal and eye research,2014年12月5日,电子版先于印刷版;nishigauchi km等,2012“c9-r95x polymorphism in patients with neovascular age-related macular degeneration”,1月131;53(1)508-12)。这些结果表明了阻断作为用于治疗amd的治疗靶标的最终补体途径组分的可行性。迄今为止,靶向mac形成的大部分治疗剂通过阻断c5b(开始mac形成所需要的关键性结构单元)的形成来实现此治疗。然而,这样做时,它们也阻断c5a的形成,从而导致已与组织动态平衡(调理作用粒子的去除)、神经存活和抗血管形成反应相关联的c5a功能活性丧失。在人类中,选择性阻断mac形成的此过程通常通过阻断mac组装的细胞表面蛋白cd59并且通过可溶性因子玻连蛋白和簇蛋白来进行。为了模拟天然机制并保留补体激活的有利上游活性,本技术揭示了一种新型治疗性单克隆抗体的开发,所述抗体结合c5但独特地允许c5分子加工成c5a和c5b,但抑制mac的形成,图2,因此防止与amd相关联的关键性致病组分的形成。通过阻断mac的形成同时保留关键性支持性眼组织即脉络膜血管层和rpe,将保持对于维持视力至关重要的神经视网膜的功能和存活。
12.发明概述
13.本发明涵盖了包含抗补体c5抗体或抗-c5抗体的药物制剂的方法和组合物。在一方面,所述抗-c5抗体不结合于c5a并且抑制补体依赖性溶血。在另一方面,所述抗-c5抗体结合于c5b并且抑制患者中的膜攻击复合物(mac)的形成。在一个实施方案中,所述抗-c5抗体阻断c5结合于人补体组分6。在另一个实施方案中,所述抗-c5抗体阻断c5结合于人补体组分7。在另一方面,所述抗-c5抗体的特征在于以下特性:一旦它并入到膜攻击复合物中,它就不再结合于c5或者与c5(或其亚基)结合减少。
14.在另一方面,所述抗-补体c5抗体或抗-c5抗体结合于c5,其中kd小于约10pm。在另一方面,所述抗-c5抗体为单克隆抗体。在另一个实施方案中,所述抗-c5抗体选自由以下组成的组:单克隆抗体、多克隆抗体、重组抗体、人源化抗体、嵌合抗体、多特异性抗体以及抗体片段。在一个实施方案中,所述抗-c5抗体为抗体片段并且所述抗体片段为fab片段、fab'片段、f(ab')2片段、fv片段、双抗体或单链抗体分子。在另一个实施方案中,所述抗-c5抗体为igg1、igg2、igg3或igg4。在另一个实施方案中,所述抗-c5抗体为igg1。
15.在另一方面,所述抗-c5抗体偶联到标记基团。在另一个实施方案中,所述抗-c5抗体偶联到标记基团并且该标记基团为光学标记、放射性同位素、放射性核素、酶基团以及生物素基团。
16.在另一方面,本发明包括一种用于制备结合于补体c5的分离抗体的方法,所述方法包括从分泌所述抗体的宿主细胞中分离所述抗体。
17.在另一方面,本发明为包含选自由seq id no:13、18、23、28、33以及38组成的组的氨基酸序列的抗-补体c5抗体。在另一方面,所述抗-c5抗体包含选自由seq id no:14、19、24、29、34以及39组成的组的氨基酸序列。在另一方面,所述抗-c5抗体包含选自由gts、sgs、rts、yts以及was组成的组的氨基酸序列。在另一方面,所述抗-c5抗体包含选自由seq id no:15、20、25、30、35以及40组成的组的氨基酸序列。在另一方面,所述抗-c5抗体包含选自由seq id no:16、21、26、31、36以及41组成的组的氨基酸序列。在另一方面,所述抗-c5抗体包含选自由seq id no:17、22、27、32、37以及42组成的组的氨基酸序列。在另一方面,本发明为包含第一氨基酸序列和第二氨基酸序列的抗体,所述第一氨基酸序列包含选自由seq id no:13、18、23、28、33以及38组成的组的cdr1;选自由氨基酸序列gts、sgs、yts以及was组成的组的cdr2;选自由seq id no:14、19、24、29、34以及39组成的组的cdr3;并且第二氨基酸序列包含选自由seq id no:15、20、25、30、35以及40组成的组的cdr1;选自由seq id no:16、21、26、31、36以及41组成的组的cdr2;以及选自由seq id no:17、22、27、32、37以及42组成的组的cdr3。在另一个实施方案中,本发明为一种包含seq id no:10和seq id no:2的氨基酸序列的抗体。
18.在另一方面,本发明包括一种编码结合于补体c5的分离抗体的核酸分子。在一个实施方案中,编码结合于补体c5的所述抗体的所述核酸分子可操作地连接至控制序列。
19.在另一方面,本发明包括一种抗-补体c5抗体和一种药学上可接受的载体。在一个实施方案中,所述抗-补体c5抗体还包含另外的活性剂。在另一个实施方案中,所述抗-补体c5抗体和另外的活性剂还包括药学上可接受的载体。
20.在另一方面,本发明包括一种用于在需要治疗或预防的患者中治疗或预防适应症的方法,所述方法包括向所述患者施用有效量的至少一种抗-补体c5抗体。在一个实施方案中,所述适应症为年龄相关性黄斑变性(amd)。在另一个实施方案中,在需要治疗或预防的
患者中的疾病或病症为眼部病状。
21.附图简述
22.图1示出补体途径的示意图。
23.图2示出mac形成的示意图并且示出单克隆抗体治疗剂阻断mac而不阻断c5a产生的机制。
24.图3示出抗-c5抗体亚克隆对mac的抑制百分比。
25.图4a和图4b示出抗-c5抗体亚克隆对mac的抑制百分比。
26.图5a、图5b和图5c示出抗-c5抗体亚克隆对mac的抑制百分比。
27.图6a、图6b和图6c示出通过检查单点测定或者通过滴定抗体来产生c5a抑制。
28.图7示出单克隆抗体与直接涂覆到elisa板上的c5的剂量依赖性相互作用。
29.图8示出抗-c5单克隆抗体与c5的结合亲和力。
30.图9示出使用生物层干涉测量法(bli)获得的单克隆抗体与溶液中的c5蛋白质的结合。
31.图10示出当在用igm进行补体激活之后沉积到elisa板底部时识别c5b-9复合物内的c5的能力。
32.图11a和图11b示出使用生物层干涉测量法(bli)技术获得的单克隆抗体结合可溶性c5b-9的能力。
33.图12a、图12b和图12c示出具有10c9的人源化重链和轻链的全长抗体对于mac的抑制。
34.图13a、图13b和图13c示出具有10c9的人源化重链和轻链的fab片段的活性。
35.图14a和图14b示出h5l2(人源化10c9)抗体在非人灵长类轻损伤模型中相对于对照有效于阻断视网膜(图14a)和脉络膜(图14b)中的补体沉积。
36.发明详述
37.本文所用的章节标题仅出于组织目的,并且不应解释为限制所述主题。
38.标准技术可用于重组dna、寡核苷酸合成、组织培养和转化、蛋白质纯化等等。酶促反应和纯化技术可根据制造商说明书或者如本领域常见地完成或如本文所述地来执行。以下程序和技术通常可根据本领域中熟知以及如本说明书整篇引用和论述的各种一般性和更特定参考文献中所述的常规方法来执行。还参见,sambrook等,2001,molecular cloning:a laboratory manual,第3版,cold spring harborlaboratory press,cold spring harbor,n.y.,所述文献以引用的方式整体并入。除非提供明确定义,否则关联本文所述的分子生物学、生物化学、物理和生物物理化学、分析化学、有机化学以及医学和药物化学使用的命名法和这些学科的实验室程序和技术是本领域中熟知并且通常使用的那些。标准技术可用于化学合成、化学分析、药物制剂、配制和输送以及患者治疗。
39.本文中使用以下定义:
[0040]“amd”是指所有形式的年龄相关性黄斑变性,包括但不限于疾病发作(即,早期和晚期)、疾病阶段(即,早期、中期或晚期)、疾病类型(地图状委缩或新生血管性黄斑病变)、疾病分布(即,单侧、双侧、中心或周边)或者存在/不存在玻璃疣沉积物、存在/不存在网状假性玻璃疣、视网膜色素上皮细胞异常、光感受体异常、萎缩性年龄相关性黄斑变性、地图状委缩(ga)以及新生血管性黄斑病变。
[0041]
如本文所用的“蛋白质”意思是指至少两个共价连接的氨基酸并且与多肽、寡肽和肽可互换使用。两个或更多个共价连接的氨基酸通过肽键连接。
[0042]“c5”是指人补体组分5。如本文所用,因子c5、组分因子5与c5为同义词。
[0043]“c5a”是指具有大约77-74氨基酸并且为约7kda的较小c5片段,所述片段在c5被补体级联中激活的c5转化酶切割时产生。“c5b”是指较大c5片段,所述片段在被补体级联中激活的c5转化酶切割时产生。c5b由通过单一的二硫键连接的α链(约104kda)和β链(约75kda)组成。
[0044]
术语“抗体”和“免疫球蛋白”可互换地使用,它们在最广义上是指一种包含一条或多条多肽链的蛋白质,所述多肽链通过结合抗体上的多个cdr和抗原表位来与特异性抗原相互作用。抗体可以是单克隆抗体(例如,全长或完整单克隆抗体)、多克隆抗体、多价抗体和/或多特异性抗体(例如,双特异性抗体,只要它们展现出所需的生物活性)。抗体还可以是或者包括抗体片段(如本文所述的)。
[0045]“表位”用于指示由抗体识别并结合的序列、结构或部分。表位可以被称为“抗原位点”。
[0046]“抗体片段”包含仅完整抗体的一部分,其中所述部分保留至少一种、大部分或所有当存在于完整抗体中时通常与该部分相关联的功能。抗体片段的实例包括fab、fab'、f(ab')2和fv片段;双抗体;线性抗体;单链抗体分子;以及由抗体片段形成的多特异性抗体。在一个实施方案中,抗体片段包含完整抗体的抗原结合位点并且因此保留结合抗原的能力。在另一个实施方案中,抗体片段,例如包含fc区的抗体片段,保留了当存在于完整抗体时通常与所述fc区相关联的至少一种生物功能,诸如fcr结合、抗体半衰期调节、adcc功能以及补体结合。在一个实施方案中,抗体片段为具有基本上类似于完整抗体的体内半衰期的单价抗体。例如,这种抗体片段可包含连接至能够向所述片段赋予体内稳定性的fc序列的抗原结合臂。
[0047]
如本文所用的“单克隆”是指从细胞群体中获得的抗体,其中所述细胞群体为克隆地来源于单一亲代细胞。单克隆抗体为同源抗体,即构成所述群体的个别抗体的相同之处在于,它们都来源于相同基因并且具有相同氨基酸序列和蛋白质结构,除了可以少量存在的天然发生的突变和在一些情况下可能不同的翻译后修饰之外。在一些实施方案中,单克隆抗体为可以是高度特异性的。在一些实施方案中,单克隆抗体可以是针对单一抗原位点。此外,与通常包括针对不同决定簇(表位)的不同抗体的其他抗体制剂不同,各单克隆抗体针对抗原上的同一表位。个别单克隆抗体可通过任何特定方法来产生。例如,根据本公开使用的单克隆抗体可通过首先由kohler等(1975)nature 256:495描述的杂交瘤法来制成或者可通过重组dna方法(参见,例如,美国专利号4,816,567)来制成,或者由噬菌体抗体库使用clackson等(1991)nature 352:624-628和marks等(1991)j.mol.biol.222:581-597中所述的技术来制成。
[0048]“多克隆”用于描述一种来源于异源亲代产抗体细胞群体的异源抗体群体。在大部分情况下,多克隆抗体对不同表位具有不同亲和力并且由具有不同序列的基因产生。
[0049]“嵌合”抗体为包含来源于两种或更多种不同物种的氨基酸序列的抗体。
[0050]“人源化”抗体为来源于非人亲代抗体的嵌合抗体。在许多情况下,人源化抗体中的特定氨基酸位置已被改变为与人抗体中的相应位置处的氨基酸的同一性相对应。在许多
情况下,在亲代(非人)抗体的可变区中的位置被来自人类的可变区的氨基酸置换。这创建了具有所需特异性、亲和力和能力的人源化小鼠、大鼠、兔或非人灵长类抗体。
[0051]“变体”是指与亲代序列相比包含至少一个差异的序列。变体多肽为与亲代序列具有至少约75%氨基酸序列同一性的蛋白质。变体蛋白可与亲代氨基酸序列具有至少约80%氨基酸序列同一性或至少约85%氨基酸序列同一性或至少约90%氨基酸序列同一性或至少约95%氨基酸序列同一性或至少约98%氨基酸序列同一性或至少约99%氨基酸序列同一性。在一些情况下,变体抗体为与亲代抗体相比在氨基酸序列中具有一个或多个差异的抗体。人源化抗体和嵌合抗体为变体抗体。因此,变体抗体包含与亲代抗体的小于100%序列同一性。变体核苷酸序列包含与亲代核苷酸序列的小于约100%序列同一性。
[0052]“分离”或“纯化”是指已与其天然环境中的至少一种组分分离和/或从中回收的分子,其中所述组分为可干扰分子的使用或活性的物质。组分包括肽、糖、核酸、酶、激素以及其他蛋白质性或非蛋白质性溶质。
[0053]“互补决定区”(cdr)是指抗体内的一个或多个区域,其中一个或多个cdr的残基有助于抗原结合。在许多情况下,cdr的个别氨基酸可非常接近于靶抗原的原子。在一些实施方案中,cdr可位于可包含三个cdr区的免疫球蛋白内。在一些情况下,如在较大氨基酸序列中存在超过一个cdr序列的情况下,cdr可通过其他序列分离并且对cdr进行编号。在一些情况下,多个cdr被鉴定为cdr1、cdr2和cdr3。每个cdr可包含来自如kabat所定义的互补决定区的氨基酸残基。kabat等,sequences of proteins of immunological interest,第5版,public health service,national institutes of health,bethesda,md.(1991))。cdr以及抗体内的其他序列或抗体片段的氨基酸编号是根据kabat的编号。在许多情况下,cdr可通过它们在可变区序列中的位置来定义(如在kabat中的编号),例如轻链cdr 1可包含位置24与位置33之间;lc cdr2的位置50与位置56之间;以及lc cdr 3的位置89与位置97之间的氨基酸序列;并且重链cdr可位于cdr1的位置26与位置33之间;hc cdr 2的位置50与位置66之间;以及hc cdr 3的位置97与位置103之间。和/或高变环可位于轻链残基26-32(lc cdr1)、残基50-52(lc cdr2)以及残基91-96(lc cdr3);与重链残基26-32(hc cdr1)、残基53-55(hc cdr2)和残基97-101(hc cdr3)之间。在一些情况下,互补决定区可包含来自根据kabat定义的cdr区和高变环二者的氨基酸。在一些实施方案中,如在抗体为单链免疫球蛋白的情况下,可存在超过一个cdr、超过两个cdr、超过三个cdr、超过四个cdr或超过五个cdr。在一些实施方案中,抗体可包含六个cdr。
[0054]“框架区”fr为不同于cdr残基的可变结构域残基。在大部分实施方案中,可变结构域具有依次鉴定的两个与四个之间的fr。例如,包含三个cdr的可变区具有四个fr:fr1、fr2、fr3和fr4。在cdr根据kabat定义的情况下,轻链fr残基位于约残基1-23(lcfr1)、34-49(lcfr2)、57-88(lcfr3)以及98-107(lcfr4)处并且重链fr残基位于重链残基中的约残基1-25(hcfr1)、34-49(hcfr2)、67-96(hcfr3)以及104-113(hcfr4)处。如果cdr包含来自高变环的氨基酸残基,则轻链fr残基位于轻链中的约残基1-23(lcfr1)、34-49(lcfr2)、57-88(lcfr3)以及98-107(lcfr4)处并且重链fr残基位于重链残基中的约残基1-25(hcfr1)、34-49(hcfr2)、67-96(hcfr3)以及104-113(hcfr4)处。在一些情况下,当cdr包含来自如kabat定义的cdr和高变环二者的氨基酸时,fr残基将相应地调整。例如,当hc cdr1包括氨基酸h26-h35时,重链fr1残基处于位置1-25处并且fr2残基处于位置36-49处。
[0055]“可变结构域”是指传统抗体分子的轻链和重链部分,它包含互补决定区(cdr)的氨基酸序列和框架区(fr)。vh是指重链可变结构域。vl是指轻链可变结构域。
[0056]“fv”或“fv片段”是指含有完整抗原识别和结合位点、包含fr和cdr序列的抗体片段。在许多实施方案中,所述fv由紧密缔合的一个重链可变结构域和一个轻链可变结构域的二聚体组成,所述缔合在自然界中可以是共价的,例如在单链fv分子(scfv)中。每个可变结构域的三个cdr相互作用以限定vh-vl多肽表面上的抗原结合位点。总的来说,六个cdr或其亚型向抗体赋予抗原结合特异性。然而,在一些情况下,甚至单一可变结构域(或仅包含对于抗原具有特异性的三个cdr的一半fv)具有识别并结合至抗原的能力,尽管通常亲和力比整个结合位点低。
[0057]“fab”或“fab”片段含有轻链的可变结构域和恒定结构域(cl)和重链的可变结构域和第一恒定结构域(ch1)。f(ab')2抗体片段包含一对fab片段,所述片段通常通过它们之间的铰合半胱氨酸来共价连接在其羧基端附近。抗体片段的其他化学偶合也是本领域已知的。
[0058]“氨基酸序列同一性百分比(%)”被定义为在比对序列并且必要时引入间隙以实现最大序列同一性百分比,并且不考虑任何保守性取代作为序列同一性的一部分之后,候选序列中与参照序列中的氨基酸残基相同的氨基酸残基的百分比。出于测定氨基酸序列同一性百分比的目的的比对可以属于本领域中的技能的多种方式实现,所述方式例如使用可公开获得的计算机软件,如blast、blast-2、align或megalign(dnastar)软件。本领域技术人员可确定测量比对的适当参数,包括对所比较的序列的全长获得最大比对所需的任何算法。然后相对于较长序列计算序列同一性,即,即使较短序列与较长序列的一部分显示100%序列同一性,总体序列同一性将小于100%。
[0059]“氨基酸序列同源性百分比(%)”被定义为在比对序列并且必要时引入间隙以实现最大序列同源性百分比之后,候选序列中与参照序列中的氨基酸残基同源的氨基酸残基的百分比。此方法将保守性取代考虑在内。保守性取代为允许氨基酸被类似氨基酸取代的那些取代。氨基酸在几种特征方面可能类似,例如,尺寸、性状、疏水性、亲水性、电荷、等电点、极性、芳香性等等。出于测定氨基酸序列同源性百分比的目的的比对可以属于本领域技术人员中的普通技能的多种方式实现。在一些情况下,氨基酸序列可使用可公开获得的计算机软件诸如blast、blast-2、align或megalign(dnastar)软件来进行比对。本领域技术人员可确定测量比对的适当参数,包括对所比较的序列的全长获得最大比对所需的任何算法。然后相对于较长序列计算序列同源性,即,即使较短序列与较长序列的一部分显示100%序列同一性,总体序列同一性将小于100%。
[0060]“核酸序列同源性百分比(%)”被定义为在比对序列并且必要时引入间隙以实现最大序列同一性百分比之后,候选序列中与参照序列中的核苷酸相同的核苷酸百分比。出于测定核酸序列同一性百分比的目的的比对可以属于本领域中的技能的多种方式实现,所述方式例如使用可公开获得的计算机软件,如blast、blast-2、align或megalign(dnastar)软件。本领域技术人员可确定测量比对的适当参数,包括对所比较的序列的全长获得最大比对所需的任何算法。然后相对于较长序列计算序列同一性,即,即使较短序列与较长序列的一部分显示100%序列同一性,总体序列同一性将小于100%。
[0061]
分子的“活性”或“生物活性”可依赖于分子的类型和用于测定给定活性的测试有
效性。例如,在c5抗体的情况下,活性是指其部分或完全抑制c5的生物活性的能力,所述生物活性例如结合于其他补体蛋白、通过如c5转化酶或能够切割c5的外源激活途径的其他已知蛋白质所列举的蛋白酶进行的切割(krisinger m.j.等,thrombin generates previously unidentified c5 products that support the terminal complement activation pathway.blood,2012 120(8)1717-1725)或mac形成。要求保护的c5抗体的优选生物活性为阻断与c5分子激活相关联的过程的能力。优选地,抑制活性在例如c5相关疾病或病状,例如像补体相关眼睛病状的状态下将实现可测量的提高。在一些情况下,通过公开的抗-c5抗体抑制的活性是通过阻断c5蛋白酶或c5切割。在其他情况下,所述活性为结合复合物中的其他补体蛋白从而防止膜插入和细胞裂解的能力。在一些实施方案中,公开的抗-c5抗体的活性通过其抑制溶血、c5a产生、mac形成或其他补体蛋白与c5缔合的能力来测量的。所述活性可通过使用体外或体内测试,包括结合测定、mac形成测定、补体分裂产物的产生、细胞因子释放的诱导,或通过使用相关动物模型或人临床试验来测定。
[0062]“补体相关眼睛病状”在最广义上使用并且包括其病理学涉及通过经典途径、凝集素途径、替代途径或外源途径激活的补体的所有眼睛病状。补体相关眼睛病状包括而不限于,黄斑变性疾病(诸如所有阶段的年龄相关性黄斑变性(amd),包括干性和渗出性(非渗出性和渗出性)形式)、脉络膜新生血管形成(cnv)、葡萄膜炎、糖尿病和其他缺血相关性视网膜病变(包括糖尿病性黄斑水肿)、视网膜中央静脉阻塞(crvo)、视网膜分支静脉阻塞(brvo)以及其他眼内新生血管性疾病(诸如糖尿病性黄斑水肿)、病理性近视、von hippel-lindau病、眼睛组织胞浆菌病、角膜血管新生以及视网膜新生血管形成。一组优选的补体相关眼睛病状包括年龄相关性黄斑变性(amd)(包括干性和湿性(非渗出性和渗出性)amd)、脉络膜新生血管形成(cnv)、黄斑毛细血管扩张症、葡萄膜炎、糖尿病性和其他缺血相关新生血管相关视网膜病变或细胞变性糖尿病性黄斑水肿、病理性近视、vonhippel-lindau病、眼睛组织胞浆菌病、doyne蜂窝状视网膜萎缩/蜂巢状网膜变性、stargarts病、青光眼、视网膜中央静脉阻塞(crvo)、brvo、角膜血管新生、视网膜新生血管形成。
[0063]“药学上可接受的”是指由联邦或州政府的管理机构批准或可获批准的或在美国药典或其他一般公知的药典中列出的用于动物并且更具体地说人的。
[0064]“药学上可接受的盐”是指化合物的盐,其具有亲代化合物的期望的药理学活性。此类盐包括与无机酸形成的酸加成盐,所述无机酸例如盐酸、氢溴酸、硫酸、硝酸、磷酸及类似无机酸;或与有机酸形成的酸加成盐,所述有机酸例如乙酸、丙酸、己酸、环戊烷丙酸、乙醇酸、丙酮酸、乳酸、丙二酸、丁二酸、苹果酸、马来酸、富马酸、酒石酸、柠檬酸、苯甲酸、3-(4-羟基苯甲酰基)苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、1,2-乙烷-二磺酸、2-羟乙基磺酸、苯磺酸、4-氯苯磺酸、2-萘磺酸、4-甲苯磺酸、樟脑磺酸、4-甲基二环[2.2.2]-辛-2-烯-1-羧酸、葡庚糖酸、3-苯基丙酸、三甲基乙酸、叔丁基乙酸、十二烷基硫酸、葡萄糖酸、谷氨酸、羟基萘甲酸、水杨酸、硬脂酸、粘康酸及类似有机酸;以及亲代化合物中存在的酸性质子被金属离子置换时形成的盐,所述金属离子例如碱金属离子、碱土金属离子或铝离子;或与有机碱所成的配位体,所述有机碱例如乙醇胺、二乙醇胺、三乙醇胺、n-甲基葡萄糖胺以及类似有机碱。在某些实施方案中,药学上可接受的盐为氯化物盐。在某些实施方案中,药学上可接受的盐为钠盐。
[0065]“药学上可接受的赋形剂”是指可与本公开提供的化合物一起施用给患者的药学
上可接受的稀释剂、药学上可接受的佐剂、药学上可接受的媒介物、药学上可接受的载体或任何以上各项的组合,当以足以提供治疗有效量的化合物或其药理学活性代谢物的剂量施用时它不会破坏其药理学活性并且为无毒的。
[0066]“治疗”为施用用于预防病症发展或改变病症病理学的至少一种治疗剂。因此,治疗是指治疗性治疗与防治性或预防性措施两者。需要治疗者包括已患有病症者以及待预防病症者。如本文所公开的,用于施用的优选药剂包括至少一种公开的抗-c5抗体。在补体相关疾病的治疗中,治疗剂(包括至少一种目前公开的抗体或此抗体的编码序列)可直接或间接改变补体途径组分的反应大小,或者致使所述疾病更易于被其他治疗剂治疗,所述治疗剂例如抗生素、抗真菌剂、抗炎剂、化疗药物等等。
[0067]“治疗有效量”是指当药剂当施用给受试者以用于治疗疾病或至少一种疾病临床症状时足以实现疾病或其症状的此治疗的量。特定治疗有效量可根据例如药剂、疾病和/或疾病症状、疾病和/或疾病症状的严重性、年龄、体重和/或待治疗的患者健康以及处方医生的判断来改变。任何给定化合物的适当量可通过本领域技术人员确定和/或能够通过常规实验确定。
[0068]“治疗有效剂量”是指在患者中提供疾病的有效治疗的剂量。治疗有效剂量可因药剂不同和/或患者不同而改变,并且可取决于诸如患者病状和疾病严重性等因素。治疗有效剂量可根据本领域技术人员已知的常规药理学程序来确定。
[0069]
疾病诸如补体相关眼睛病状的“病理学”包括危害患者健康的所有现象。这包括而不限于,异常或不受控制的细胞生长、蛋白质产生、异常或不受控制的细胞死亡、自体抗体产生、补体产生、补体激活、mac形成、对相邻细胞的正常功能的干扰、异常水平的细胞因子或其他分泌产物的释放、任何炎性反应或免疫反应的抑制或加重、炎性细胞渗入到细胞间隙、水肿等等。
[0070]
如本文所用的“哺乳动物”是指分类为哺乳动物的任何动物,包括而不限于,人类、高等灵长类、牲畜和家畜以及动物园动物、竞技动物或宠物动物诸如马、猪、牛、猫以及雪貂等等。在本发明的一个优选实施方案中,所述哺乳动物为人。
[0071]
与一种或多种其他治疗剂“组合”施药包括同时(并行)施药和以任何顺序连续施药。
[0072]
本公开提供了结合补体组分5蛋白的抗体。确切的说,本文公开了结合c5和c5b而不结合c5a的抗体。目前公开的抗体并不抑制c5切割,但抑制mac形成和mac依赖性细胞裂解。
[0073]
本文所述的抗体包含具有一个或多个互补决定区(cdr)的支架结构。在某些实施方案中,cdr包含来自亲代序列例如seq idno:13-48的重链cdr1、cdr2和cdr3以及轻链cdr1、cdr2和cdr3中的一种或多种的不超过两个氨基酸添加、缺失或取代。
[0074]
在其他实施方案中,cdr通过具有如本文所述的常见保守性氨基酸序列和可变氨基酸序列的共有序列来定义。
[0075]
在某些实施方案中,本公开的c5抗体的支架结构可基于抗体,包括但不限于单克隆抗体、双特异性抗体、微型抗体、结构域抗体、合成抗体(例如抗体模拟物)、嵌合抗体、人源化抗体、抗体融合物(例如抗体缀合物)及上述每种抗体各自的片段。下文进一步描述并定义各种结构。在一些实施方案中,所述支架结构包含seq id no:1-12中的一种或多种。在
某些实施方案中,支架序列包含与seq id no:1-12相比的一种或多种氨基酸添加、缺失或取代。
[0076]
抗-c5抗体适用于治疗与补体激活相关的结果、症状和/或病变。这些包括但不限于,动脉粥样硬化、急性心肌梗死继发的缺血再灌注、henoch-schonlein二氏紫癜性肾炎、免疫复合性血管炎、类风湿关节炎、动脉炎、动脉瘤、中风、心肌症、出血性休克、挤压伤、多器官功能衰竭、低血容量性休克和肠道缺血、移植排斥、心脏手术、ptca、自然流产、神经元损伤、脊髓损伤、重症肌无力、亨廷顿氏病、肌萎缩性侧索硬化、多发性硬化、guillain barre综合征、帕金森病、阿耳茨海默病、急性呼吸窘迫综合征、哮喘、慢性阻塞性肺病、输血相关性急性肺损伤、急性肺损伤、goodpasture氏病、心肌梗死、心肺分流术后炎症、心肺分流术、败血性休克、移植排斥、异种移植、烧伤、系统性红斑性狼疮、膜肾炎、脑型疟疾、berger氏病、牛皮癣、类天疱疮、皮肌炎、抗磷脂综合征、炎症性肠病、血液透析、白细胞分离法、血浆除去法、肝素诱导型体外膜式氧合ldl沉淀、体外膜式氧合白细胞分离法、血浆除去法、肝素诱导型体外膜式氧合ldl沉淀、体外膜式氧合以及类似应用。
[0077]
所公开的抗体的其他用途包括例如诊断补体-和c5-相关疾病。
[0078]
本公开的方面提供了抗-c5抗体,具体地是包含至少一个cdr的抗体,所述至少一个cdr包含如下文更充分描述的重链和/或轻链cdr或其组合。
[0079]
在一方面,抗-c5抗体抑制c5和/或c5b的活性,并且抑制c5b形成蛋白质复合物的能力。在不受限于特定机制或理论的情况下,在一些实施方案中,抗体中断补体途径,因此中断补体级联、mac的形成和细胞裂解。此破坏可以防止或改变在以下各项但不包括以下各项的疾病过程:地图状委缩和渗出性amd、葡萄膜炎、糖尿病性和其他新生血管或缺血相关视网膜病变、糖尿病性黄斑水肿、病理性近视、von hippel-lindau病、眼睛组织胞浆菌病、视网膜血管瘤样增生、视网膜中央静脉阻塞(crvo)、视网膜分支静脉阻塞(brvo)、角膜血管新生、视网膜血管新生以及类似疾病。在一些实施方案中,抗-c5抗体可抑制mac形成的c5b启动。
[0080]
本公开的抗体因此可用于鉴定与c5或补体系统相关的病状或相关疾病或病状。另外,抗体可用于调节和/或抑制由c5和/或其他下游补体蛋白介导的作用,这样具有治疗和预防与补体和/或c5相关的各种疾病和病状的功效。
[0081]
更确切地说,本公开提供了抗-c5抗体和编码所述抗体的多核苷酸。在不同方面,抗-c5抗体抑制由c5、c5b和/或其他补体蛋白介导的至少一种生物反应,并且这样可适用于改善补体相关和c5相关疾病和病症的影响。本公开还提供了用于产生抗-c5抗体的表达系统,包括哺乳动物细胞系和细菌细胞,以及治疗与补体激活相关的疾病的方法。
[0082]
本公开的抗体包含支架结构和结合于c5的一个或多个互补决定区(cdr)。在不同实施方案中,抗体包含第一氨基酸序列和/或第二氨基酸序列。
[0083]
在一个实施方案中,所述第一氨基酸序列和/或第二氨基酸序列包含选自由seq id no:1-48组成的组的序列。
[0084]
在不同实施方案中,抗体包含第一氨基酸序列和第二氨基酸序列中的一者或二者。第一氨基酸序列和第二氨基酸序列可为单一线性氨基酸序列,可通过二硫桥键共价结合,或者可以是非共价结合的。
[0085]
补体组分5、c5
[0086]
膜攻击复合物(mac)通常作为补体系统的三种主要途径(例如替代途径、凝集素途径或经典途径)中的一种或多种的激活结果来形成,或者通过经由较不常见的外源途径进行的c5确认或激活中的改变来形成。mac为免疫系统的效应蛋白之一并且形成跨膜通道。这些通道破坏了靶细胞的磷脂双分子层,从而导致细胞裂解和死亡。mac组装中的关键蛋白为c5。c5具有约190kda(约1600aa)的分子量并且由两条多肽链α链(α,115kda)和β链(β,75kda)组成。α链和β链通过二硫键连接。c5转化酶切割从α链的n末端下游的75个残基的精氨酸处切割c5。此切割释放小c5a片段(长度大约77-74aa并且约11kda),其为有效炎性分子。c5转化酶切割还引起c5b激活,然后可启动膜攻击复合物(mac)的形成。c5b蛋白由α链(现在为104kda)和β链(75kda)组成。
[0087]
通过c5转化酶切割c5导致形成c5a和c5b。最新形成的c5b片段募集c6,接着依次添加c7、c8和多个c9分子,以组装mac。活性mac具有c5b-c6-c7-c8-c9{n}的亚基组成。通过c9形成的环结构为靶细胞膜中的孔。如果形成足够的孔,则细胞由于分子自由扩散进出细胞而不再能够存在。在亚细胞裂解浓度下,这些孔可促成促炎性细胞激活,而在细胞裂解浓度下,孔形成导致细胞死亡。mac的形成在图2中示意性示出。c5a和c5b二者均为促炎性分子。c5a结合c5a受体(c5ar)并且刺激促炎性细胞因子诸如tnf-α、il-1β、il-6和il-8从人白细胞中合成和释放。c5a还已显示与组织动态平衡(调理作用粒子的去除)、神经存活和对抗血管形成反应的促进相关联。大部分抗-c5抗体抑制c5a和c5b的形成,这不仅通过阻断c5b形成来干扰mac激活,而且有害地阻断可有助于维持视网膜健康的c5a活性。需要一种选择性阻断c5b以便抑制mac形成同时保留c5a的作用的抗体。
[0088]
减少c5b的形成可有助于治疗许多补体系统的疾病以及炎性疾病。一种这样的疾病为年龄相关性黄斑变性或amd。amd为由于视网膜退化而导致视力丧失的医学病状。补体系统通过补体系统中的几种基因与发展amd的个人危险之间的强相关性来参与amd。因此,通过防止c5b蛋白结合在mac中来抑制补体系统对于amd的治疗性治疗可为重要的。
[0089]
抗-c5抗体
[0090]
在一方面,本公开提供了结合c5、不结合c5a并且不抑制c5a形成的抗体。在某些方面,本公开提供了结合c5的重组抗体,即抗-c5抗体。在此情形下,重组抗体可使用重组技术,即经由表达如下文所述的重组核酸来产生。用于产生重组蛋白的方法和技术为本领域所熟知的。
[0091]
在一些实施方案中,分离或纯化本公开的抗体。分离或纯化的抗体可未伴随通常在天然状态下与其缔合的至少一些物质(污染物质)。在一个实施方案中,污染物质构成给定样品的总重量的小于约50重量%,可选地小于约20重量%并且可选地小于10重量%。在一些实施方案中,污染物可以是蛋白质。
[0092]
在许多实施方案中,纯化的抗-c5抗体在或从除它所来源的生物体之外的生物体中产生。在一些实施方案中,抗-c5抗体可以与通常所见浓度相比显著较高的浓度来制得,方法是经由使用诱导型启动子或高表达启动子,以使得抗体以增加的浓度水平制得。
[0093]
在一些实施方案中,分离或纯化的抗体可从可干扰抗体的诊断和/或治疗用途的组分中取出。在一些实施方案中,抗体将纯化至按抗体重量计大于90%,其中总蛋白浓度例如通过lowry方法来测定并且抗体浓度百分比通过目视法诸如蛋白质凝胶法来测定。在一个实施方案中,抗-c5抗体大于99重量%,例如纯到足以通过使用常见氨基酸测序法来获得
n-末端或内源性氨基酸序列的至少15个残基(例如,edman降解和质谱法),或者足以通过sds-page在还原或非还原条件下使用coomassie蓝或银染色来同质化。分离抗体包括重组细胞内的原位抗体,因为抗体的天然环境的至少一种组分将不存在。然而,通常将通过至少一个纯化步骤来制备分离抗体。
[0094]
公开的抗体可特异性结合c5并且可用于抑制或调节c5和c5b的生物活性。在某些实施方案中,公开的抗体通过免疫动物来产生,在其他情况下,抗体可通过重组dna技术来产生。在另外的实施方案中,抗-c5抗体可通过酶切割或化学切割传统抗体来产生(传统抗体可与人类抗体同义)。在一些实施方案中,抗体可包含四聚体。在这些实施方案的一些实施方案中,每个四聚体通常由两对相同的多肽链组成,每一对具有一条轻链(通常具有约25kda的分子量)和一条重链(通常具有约50-70kda的分子量)。每条链的氨基端部分包含具有约100至110个或更多个氨基酸的可变区并且可负责抗原识别。每条链的羧基-末端部分可定义主要负责效应子功能的恒定区。人轻链分类为κ轻链和λ轻链。重链被分类为μ、δ、γ、α或ε,并且将抗体的同种型分别定义为igm、igd、igg、iga以及ige。igg具有若干亚类,包括但不限于igg1、igg2、igg3及igg4。
[0095]
一些抗体,例如已见于骆驼和美洲驼中的抗体可以是由两条重链组成的二聚体,并且不包含轻链。muldermans等,2001,j.biotechnol.74:277-302;desmyter等,2001,j.biol.chem.276:26285-26290。骆驼抗体的结晶学研究已揭示这些抗体的cdr3区形成与抗原相互作用的表面并且因此对于抗原结合,如在更典型的四聚体抗体中的抗原结合是关键的。本公开涵盖了由两条重链组成的二聚体抗体或其片段,它们可结合c5和/或c5b和/或抑制所述c5和/或c5b的生物活性。
[0096]
本公开的抗体特异性结合于人c5。当抗体对c5具有比对任何其他抗原或蛋白质更高的结合亲和力时,所述抗体可特异性结合c5。在不同实施方案中,结合亲和力通过测定平衡结合常数例如kd(或kd)或者ka(或ka)来测量。在一些实施方案中,公开的抗体结合于靶抗原,其中kd为约10-7
m至约10-13
m或约10-9
m至约10-12
m或约10-11
m至约10-12
m。在不同实施方案中,kd小于约10-8
m、10-9
m、10-10
m、10-11
m或10-12
m以及大于约10-13
m、10-12
m、10-11
m、10-10
m、10-9
m。
[0097]
在一些情况下,对其他抗原的kd大于靶抗原kd的1x、大于靶抗原kd的2x、大于靶抗原kd的3x、大于靶抗原kd的4x、大于靶抗原kd的5x、大于靶抗原kd的6x、大于靶抗原kd的7x、大于靶抗原kd的8x、大于靶抗原kd的9x、大于靶抗原kd的10x(例如当抗体的kd对靶抗原为x-09
m时,抗体对另一种抗原的kd可以是10x大或者x-08
m)、大于100x(例如当抗体的kd对靶抗原为x-10
m时,抗体对另一种抗原的kd可以是10x大或者x-08
m)。在一些情况下,平衡结合常数可被表示为平衡缔合常数ka或ka。
[0098]
平衡结合常数可使用各种方法测定。在一些情况下,公开的抗体的平衡结合常数通过在蛋白结合测定法中测量结合(k1)和解离(k-1
)速率来测定。测定平衡结合常数的一种示例性方法为通过生物层干涉测量法(bli)。bli为能够测定溶液中的结合动力学的无标记技术。在一种示例性方法中,抗体可以是人igg,并且抗-c5抗体可根据制造商指导通过抗人igg fc捕获(ahc)生物传感器尖端(fort
é
bio,menlopark,ca,usa)来捕获。其他类型的蛋白结合测定法包括:共免疫沉淀法;双分子荧光补充法;亲和电泳;拖拉(pull-down)测定;标记转移法;酵母双杂交筛选;噬菌体展示;使用光反应性氨基酸类似物进行蛋白质复合物的
体内交联;串联亲和纯化;化学交联;化学交联,接着高质量maldi质谱法;spine(链霉蛋白(strepprotein)相互作用实验);与敲低组合的定量免疫沉淀法;亲近连接测定生物层干涉测量法;双偏振干涉测量法;静态光散射;动态光散射;表面等离振子共振;荧光偏振/各向异性;荧光相关光谱法;荧光共振能量转移;通过nmr多核弛豫测量或溶液中的2d-ft nmr光谱法与nmr弛豫或2d-ft光谱数据集的非线性回归分析组合进行的蛋白质活性测定;蛋白质-蛋白质接合(docking);等温滴定量热法;以及微观热迁移。
[0099]
在其中抗-c5抗体用于治疗性应用的实施方案中,抗-c5抗体的一个特征在于它可调节和/或抑制c5的或由c5介导的一种或多种生物活性。在此情况下,抗体可特异性结合c5,可基本上调节c5和/或c5b的活性,和/或可抑制c5b与其他蛋白质(例如c6、c7)的结合。
[0100]
在许多实施方案中,c5活性和抗体抑制该活性的能力通过分析在10%人血清存在下红血细胞的细胞裂解来测量。(ap)的替代途径的激活需要比经典途径更高的血清浓度。通常,在其中egta优先螯合ca
的测定中在5mm egta存在下使用最终浓度5mm mg
。大部分哺乳动物物种的ap通过兔红细胞自发激活,因此它们是方便的靶标。通过用gvb0(comptech产品)洗涤3次并且将其重新悬浮成5x108/ml来制备兔红细胞(complement technology,inc.)。用gvb0稀释不同量的抗因子c5抗体。在冰上以连续稀释的抗因子bb抗体、0.1m mgegta(comptech产品)、1/2nhs(用稀释的人血清)和兔红细胞的顺序混合100ul反应物。然后,在振动器上在37℃下将反应物孵育30分钟。添加1.0ml冷gvbe。在约1000xg或更高速度下混合并离心3分钟,以使细胞沉淀。将100ul上清液转移到96孔板中并且在412nm下读数(softmax pro 4.7.1)。使用graphpad prism 4分析数据。
[0101]
并非特异性结合于抗原的每种抗体都可阻断抗原结合于其正常配体并且因此抑制或调节抗原的生物效应。如本领域已知的,这种效应可取决于抗体结合哪部分抗原并且取决于抗原和抗体(在此情况下为c5抗体)的绝对浓度和相对浓度。为了考虑到能够抑制或调节c5和/或c5b的生物活性,如本文所意指的,抗体可以能够例如将人血清介导的溶血抑制至少约20%、40%、60%、80%、85%、90%、95%、99%或更大。
[0102]
抑制c5和/或c5b活性所需要的抗体浓度可广泛改变并且可取决于抗体与c5和/或c5b结合的紧密程度。例如,每个c5分子一个或更少抗体分子可足以抑制生物活性。在一些实施方案中,抑制c5的生物活性可需要约1,000:1至约1:1,000的c5:抗-c5抗体比率,包括约2:1、1:1、1:2、1:4、1:6、1:8、1:10、1:20、1:40、1:60、1:100、1:500、1:1,000或更大比率。在许多情况下,抑制c5活性的能力可取决于c5的浓度和/或抗-c5抗体的浓度。
[0103]
在一些实施方案中,本公开的抗体包括(a)支架和(b)一个或多个cdr,所述cdr为决定抗原结合特异性和亲和力的区域。互补决定区或cdr为抗体中构成用于抗原结合的主要表面接触点的区域。一个或多个cdr包埋在抗体的支架结构中。本公开的抗体的支架结构可以是抗体或其片段或变体,或者可以是在自然界中完全合成的。下文进一步描述了本公开的抗体的各种支架结构。
[0104]
在目前公开的抗体的一个实施方案中,所述抗体可以是其氨基酸序列与亲代氨基酸序列的氨基酸序列具有至少75%氨基酸序列同一性、同源性或类似性(similarity)的变体抗体。例如,在一些实施方案中,变体抗体的重链或轻链可变结构域序列与亲代序列的重链或轻链可变结构域序列是75%相同的,可选地至少80%、可选地至少85%、可选地至少90%以及可选地至少95%。在大部分情况下,变体抗体在cdr序列中将具有很少或不具有变
化,并且因此在大部分情况下将以类似亲和力结合靶抗原。关于此序列的同一性或类似性在本文中定义为在比对序列并且引入间隙(必要时)以实现最大序列同一性百分比之后,变体序列中与亲代抗体氨基酸序列相同(即相同的残基)或相似(即基于共同侧链性质来自相同组的氨基酸残基,参见下文)的的氨基酸残基百分比。
[0105]
cdr
[0106]
本公开的抗体包含支架区和一个或多个cdr。本公开的抗体可具有一个与六个之间的cdr(如通常天然存在的抗体),例如一条重链cdr1(“hc cdr1”或“cdrh1”)和/或一条重链cdr2(“hc cdr2”或“cdrh2”)和/或一条重链cdr3(“hc cdr3”或“cdrh3”)和/或一条轻链cdr1(“lc cdr1”或“cdrl1”)和/或一条轻链cdr2(“lc cdr2”或“cdrl2”)和/或一条轻链cdr3(“lc cdr3”或“cdrl3”)。如本说明书整篇与诸如多肽、核酸、宿主细胞以及类似物的生物物质结合使用的术语“天然存在”是指可见于自然界中的物质。在天然存在的抗体中,重链cdr1通常包含约五个(5)至约七个(7)氨基酸,重链cdr2通常包含约十六个(16)至约十九个(19)氨基酸,并且重链cdr3通常包含约三个(3)至约二十五个(25)氨基酸。轻链的cdr1通常包含约十个(10)至约十七个(17)氨基酸,轻链cdr2通常包含约七个(7)氨基酸,并且轻链cdr3通常包含约七个(7)至约十个(10)氨基酸。
[0107]
本公开的氨基酸包含天然氨基酸和合成氨基酸(例如,高苯丙氨酸、瓜胺酸、鸟氨酸以及正亮氨酸)。此类合成的氨基酸可以并入,特别是当抗体通过本领域已熟知的常规方法体外合成时。另外,可以使用肽模拟的、合成的和天然存在的残基/结构的任何组合。氨基酸包含亚氨基酸残基,诸如脯氨酸和羟脯氨酸。氨基“r基团”或“侧链”可处于(l)-构型或(s)-构型中。在一个特定实施方案中,氨基酸为(l)-构型或(s)-构型中。在一些实施方案中,氨基酸可形成肽模拟结构,即肽或蛋白质类似物,诸如肽类似物(参见simon等,1992,proc.natl.acad.sci.u.s.a.89:9367,所述文献以引用的方式并入本文),所述结构可以抵抗蛋白酶或其他生理学条件和/或贮存条件。
[0108]
下文进一步描述了天然存在的抗体内的cdr的结构和性质。简言之,在传统抗体支架中,cdr包埋在重链和轻链可变区中的框架内,在框架中,它们构成负责抗原结合和识别的区域。可变区包含至少三个重链或轻链cdr,参见同上(kabat等,1991,sequences of proteins of immunological interest,public health service n.i.h.,bethesda,md;还参见chothia和lesk,1987,j.mol.biol.196:901-917;chothia等,1989,nature 342:877-883),它们是在框架区内(表示为框架区1-4,fr1、fr2、fr3和fr4,kabat等,1991,同上;还参见chothia和lesk,1987,同上)。参见下文。然而,本公开提供的cdr可不仅用于定义传统抗体结构的抗原结合结构域,而且可包埋在如本文所述的多种其他支架结构中。
[0109]
表1中呈现了用于公开的抗体的特定cdr。
[0110]
[0111][0112]
[0113]
在另一个实施方案中,本公开提供了结合c5的抗体,其中所述抗体包含具有seq id no:16-18、22-24、28-30、34-36、40-42以及46-48中任一项的不超过两个(2)氨基酸添加、缺失或取代的至少一个hc cdr区,和/或具有seq id no:13-15、19-21、25-27、31-33、37-39以及43-45中任一项的不超过两个(2)氨基酸添加、缺失或取代的至少一个lc cdr区。本公开的各种重链和轻链可变区的实施方案在表2和seq id no:1-12中描绘。在一些实施方案中,具有hc cdr3区和/或lc cdr3区的抗体具有特别的用途。另外,在一些实施方案中,抗体可具有包含选自seq id no:16-18、22-24、28-30、34-36、40-42以及46-48中任一项的hc cdr的不超过两个(2)序列氨基酸添加、缺失或取代的一个cdr,以及具有seq id no:13-15、19-21、25-27、31-33、37-39以及43-45中任一项的不超过两个(2)氨基酸添加、缺失或取代的lc cdr(例如,所述抗体具有两个cdr区、一个hc cdr和一个lc cdr,特定实施方案为具有hc cdr3和lc cdr3二者的抗体,例如seq id no:45和48)。
[0114]
表2
[0115]
[0116][0117]
变体cdr序列
[0118]
在另一个实施方案中,本公开提供了结合c5蛋白的抗体,其中所述抗体包含具有seq id no:16-18、22-24、28-30、34-36、40-42以及46-48中任何hc cdr1、hc cdr2或hc cdr3区(如上所讨论的)的不超过两个(2)氨基酸添加、缺失或取代的至少一个hc cdr区,和/或具有seq id no:13-15、19-21、25-27、31-33、37-39以及43-45中任何lc cdr1、lc cdr2或lc cdr3区(如上所讨论的)的不超过两个(2)氨基酸添加、缺失或取代的至少一个lc cdr区。在此实施方案中,具有hc cdr3区或lc cdr3区的抗体具有特别的用途。另外的实施方案利用具有以下各项的抗体:具有选自seq id no:16-18、22-24、28-30、34-36、40-42以及46-48中任一项的hc cdr区的不超过2个序列氨基酸添加、缺失或取代的一个cdr,以及具有seq id no:13-15、19-21、25-27、31-33、37-39以及43-45中任一项的不超过两个(2)氨基酸添加、缺失或取代的lc cdr区(例如,所述抗体具有两个cdr区、一个hc cdr和一个lc cdr,特定实施方案为具有hc cdr3区和lc cdr3区二者的抗体,例如seq id no:45和48)。
[0119]
如本领域技术人员将了解的,对于具有来自所描绘序列的超过一个cdr的任何抗体,独立地选自所描述序列的任何cdr组合为有用的。因此,可产生具有一个、两个、三个、四
个、五个或六个独立选自的cdr的抗体。然而,如本领域技术人员将了解的,特定实施方案通常利用非重复性cdr组合,例如抗体通常并未制成具有两个hc cdr2区,等等。
[0120]
本公开的另一方面提供了一种结合c5的分离抗体,其中所述分离抗体包含具有seq id no:16-18、22-24、28-30、34-36、40-42以及46-48中任一项的不超过两个(2)氨基酸添加、缺失或取代的重链氨基酸序列,以及具有seq id no:13-15、19-21、25-27、31-33、37-39以及43-45中任一项的不超过两个(2)氨基酸添加、缺失或取代的轻链氨基酸序列。注意任何重链序列可与任何轻链序列混合并匹配。
[0121]
通常,本文所述的个别变体cdr之间的氨基酸同源性、类似性或同一性当与本文公开的序列相比时为至少80%。在许多情况下,aa同源性、类似性或同一性为至少85%、90%、91%、92%、93%、94%、95%、96%、97%、98%以及99%。
[0122]
序列同一性/同源性
[0123]
如本领域已知的,许多不同程序可用于鉴定蛋白质或核酸与第二种序列的序列同一性或类似性程度。
[0124]
对于氨基酸序列,序列同一性和/或同源性通过使用本领域已知的标准技术来测定,所述标准技术包括但不限于,smith和waterman,1981,adv.appl.math.2:482的局部序列同一性算法;needleman和wunsch,1970,j.mol.biol.48:443的序列同一性算法;pearson和lipman,1988,proc.nat.acad.sci.u.s.a.85:2444的类似性方法搜索;这些算法的计算机实施形式(在madison,wis.的575science drive的遗传学计算机组wisconsin遗传学软件包中的gap、bestfit、fasta和tfasta);由devereux等,1984,nucl.acid res.12:387-395描述的best fit序列程序,使用默认设置或通过审查。同一性百分比可通过fastdb基于以下参数来计算:错配罚分1;空位罚分1;缺口尺寸罚分0.33;以及连接罚分30,“current methods in sequence comparison and analysis,”macromolecule sequencing and synthesis,selected methods and applications,第127-149页(1988),alan r.liss,inc。
[0125]
有用算法的实例为pileup。pileup使用渐进性成对比对从一组相关序列来产生多重序列比对。它还可绘制显示用于产生比对的聚类关系的树形图。pileup使用feng和doolittle,1987,j.mol.evol.35:351-360的渐进性比对方法的简化方法;所述方法类似于higgins和sharp,1989,cabios 5:151-153所述的方法。有用的pileup参数包括默认缺口权重3.00、默认缺口长度权重0.10以及权重端缺口。
[0126]
有用的算法的另一个实例为以下各项中描述的blast算法:altschul等,1990,j.mol.biol.215:403-410;altschul等,1997,nucleic acids res.25:3389-3402;以及karin等,1993,proc.natl.acad.sci.u.s.a.90:5873-5787。特别有用的blast程序为从altschul等,1996,methods in enzymology 266:460-480获得的wu-blast-2程序。wu-blast-2使用若干搜索参数,大部分参数被设置为默认参数。对于蛋白质,可调节参数被设置为以下数值:重叠跨接=1、重叠分数=0.125、单词阈值(word threshold)t=11。hsp s和hsp s2参数为动态值并且通过程序自身基于特定序列组成和其中检索感兴趣的序列的特定数据库的组成来建立;然而,所述值可被调节为增加灵敏度。
[0127]
另一有用算法为缺口blast,如altschul等,1993,nucl.acids res.25:3389-3402所报道的。缺口blast使用blosum-62取代评分;阈值t参数设置为9;引发无缺口延伸的双击
法以10 k为代价承担缺口长度k;xu设置为16并且对于数据库搜索阶段,xg设置为40,并且对于算法的输出阶段设置为67。缺口算法通过与约22位相对应的评分来引发。
[0128]
通常,个别变体cdr或可变区之间的氨基酸同源性、类似性或同一性为所述序列的至少80%,或者可选地使同源性或同一性增加至少85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%以及几乎100%。
[0129]
以一种类似的方式,相对于编码公开抗体的核酸序列的核酸序列同一性百分比(%)为候选序列中与抗体编码序列中的核苷酸残基相同的核苷酸残基百分比。特定方法利用设置为默认参数的wu-blast-2的blastn模块,其中重叠跨接和重叠分数分别设置为1和0.125。
[0130]
通常,编码个别变体cdr与变体可变结构域序列的核苷酸序列之间的核酸序列同源性、类似性或同一性为至少80%,或者可选地使同源性或同一性增加至少85%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%以及几乎100%。在许多情况下,不相同的核酸序列由于遗传密码的简并性而可编码相同氨基酸序列。
[0131]
核苷酸序列之间的同源性通常通过它们彼此杂交的能力来定义。在一些实施方案中,选择性杂交可以是指以高特异性结合。根据本公开的多核苷酸、寡核苷酸及其片段在使与非特异性核酸的可检测结合的可观量最小化的杂交和洗涤条件下与核酸链选择性杂交。高严格性条件可用于实现如本领域中已知及本文论述的选择性杂交条件。
[0132]
杂交反应的严格性容易通过本领域普通技术人员来确定,并且通常为依赖于探针长度、探针浓度/组成、靶浓度/组成、洗涤温度以及盐浓度的经验计算。通常,较长探针对于适当退火需要较高温度,而较短探针需要较低温度。杂交通常取决于变性dna在互补链存在于低于其解链温度的环境中时再退火的能力。探针与可杂交序列之间希望的同源性程度越高,可使用的相对温度就越高。因此,由此得出较高的相对温度倾向于使反应条件更严格,而较低温度则较不严格。对于另外的详情和杂交反应严格性的说明,参见ausubel等,current protocols in molecular biology,wiley interscience publishers,(1995)。
[0133]
高严格条件为本领域已知的;参见,例如sambrook等,2001,同上以及short protocols in molecular biology,第二版,ausubel等编著,john wiley&sons,1992,两份文献均以引用的方式并入。严格条件为序列依赖性的并且在不同情况下有所不同。较长的序列在较高温度下特异性杂交。核酸杂交的详尽指南参见tijssen,techniques in biochemistry and molecular biology
‑‑
hybridization with nucleic acid probes,“overview of principles of hybridization and the strategy of nucleic acid assays”(1993)。
[0134]
在一些实施方案中,严格条件或高严格条件可通过以下各项来鉴定:(1)在50℃下采用低离子强度和高温度用于洗涤,例如0.015m氯化钠/0.0015m柠檬酸钠/0.1%十二烷基硫酸钠;(2)在杂交期间在42c下采用变性剂,诸如甲酰胺,例如具有0.1%牛血清白蛋白/0.1%ficoll/0.1%聚乙烯吡咯酮/50mm ph 6.5磷酸盐缓冲液和750mm氯化钠、75mm柠檬酸钠的50%(v/v)甲酰胺;或者(3)在42℃下采用50%甲酰胺、5xssc(0.75m nacl,0.075m柠檬酸钠)、50mm磷酸钠(ph 6.8)、0.1%焦磷酸钠、5x denhardt氏溶液、声波处理的鲑精dna(50μg/ml)、0.1%sds以及10%硫酸葡聚糖,在42℃以0.2xssc(氯化钠/柠檬酸钠)洗涤并在55℃以50%甲酰胺洗涤,接着在55℃下进行由含有edta的0.1xssc组成的高严格洗涤。
[0135]
通常,对于在限定离子强度和ph下的特定序列,严格条件被选择为低于热熔点(tm)约5℃-10℃。tm为平衡时50%与靶序列互补的探针与靶序列杂交的温度(在限定离子强度、ph和核酸浓度下)(因为靶序列过量存在,所以在tm下,平衡时50%探针被占据)。严格度条件将是其中如下所述的那些:在ph 7.0至8.3时盐浓度低于约1.0m钠离子、通常约0.01至1.0m钠离子浓度(或其他盐),并且温度对于短探针(例如10至50个核苷酸)而言为至少约30℃,而对于长探针(例如,大于50个核苷酸)而言为至少约60℃。还可通过加入去稳定剂诸如甲酰胺来实现严格条件。
[0136]
在另一个实施方案中,使用较不严格杂交条件;例如,可使用中度严格条件或低严格条件,如本领域已知的;参见,sambrook等,2001,同上;ausubel等,1992,同上;以及tijssen,1993,同上。
[0137]
在一些情况下,中度严格条件可包括使用比以上所述严格条件更不严格的洗涤溶液和杂交条件(例如,温度、离子强度和sds%)。中度严格条件的实例为在37℃下在包含以下各项的溶液中孵育过夜:20%甲酰胺、5xssc(150mm nacl、15mm柠檬酸三钠)、50mm磷酸钠(ph 7.6)、5x denhardt氏溶液、10%硫酸葡聚糖以及20mg/ml变性剪切鲑精dna,接着在约37℃-50℃下以1xssc洗涤过滤物。技术人员将知道如何根据需要来调整温度、离子强度等等,以调节诸如探针长度等因素。
[0138]
在一些实施方案中,公开的抗体及其变体可通过位点特异性诱变编码所述抗体的dna序列内的核苷酸来制备。这可使用序列盒或pcr诱变或本领域熟知的其他技术来实现,以便产生编码变体的dna,并且此后在本文列出的细胞培养物中表达重组dna。在一些情况下,包含变体cdr的具有多达约100-150个残基的抗体片段可通过使用确定技术进行体外合成来制备。这些变体可展现出与天然存在的类似物相同的定性生物活性,例如结合于c5并抑制补体,但也可选择具有改进特征的变体,如将在本文中更充分概述。
[0139]
当预先确定用于引入氨基酸序列变化的位点或区域时,不需要预先确定突变本身。例如,为了优化给定位点处的突变,可在靶密码子或区域内进行随机诱变并且对于最佳的希望的抗体活性筛选表达抗体cdr或可变区序列变体。用于在具有已知序列的dna的预先确定位点处形成取代突变的技术为已熟知的,例如m13引物诱变和pcr诱变。突变体的筛选使用抗体活性(诸如c5结合)测定来完成。
[0140]
氨基酸取代通常具有单一残基;插入通常将为约一个(1)至约二十个(20)氨基酸残基,尽管可以忍受适当较大的插入。缺失范围为约1个(1)至约二十个(20)氨基酸残基,尽管在一些情况下,缺失可能大许多。
[0141]
取代、缺失、插入或其任何组合可以用于得到最终衍生物或变体。通常这些改变在几个氨基酸上进行,以使分子的改变最小化,特别是抗体的免疫原性和特异性。然而,在某些情形下可忍受更大的改变。保守性取代通常根据表3所描绘的以下突变来进行。
[0142][0143]
功能和免疫同一性变化可通过选择比表3所示取代更不保守的取代来形成。例如,取代可被形成为更显著地影响以下各项:变化区域内多肽主链的结构,例如α螺旋结构或β折叠结构;靶位点处的分子电荷或亲水性;或大体积侧链。通常预期在多肽性质中产生最大改变的取代为以下那些取代:其中(a)亲水性残基例如丝氨酰基或苏氨酰基被取代成(或被取代为)疏水性残基例如亮氨酰基、异亮氨酰基、苯丙氨酰基、缬氨酰基或丙氨酰基;(b)半胱氨酸或脯氨酸被取代成(或被取代为)任何其他残基;(c)具有正电侧链的残基例如赖氨酰基、精氨酰基或组氨酰基被取代成(或被取代为)负电性残基例如谷氨酰基或天门冬氨酰基;或者(d)具有大体积侧链的残基例如苯丙氨酸被取代成(或被取代为)不具有侧链的残基例如甘氨酸。
[0144]
所述变体通常展现出相同的定性生物活性并且将引起与天然存在的类似物相同的免疫反应,尽管变体也被选择为按需要修饰公开的c5抗体的特征。可选地,可选择其中公开抗体的生物活性被改变的变体。例如,糖基化位点可如本文所讨论地改变或去除。
[0145]
本文公开了与seq id no:1-48同源的多肽序列。本文公开的多肽可包含与公开的氨基酸序列相同的氨基酸序列。在其他情况下,要求保护的多肽包含可含有与公开序列相比的保守性氨基酸取代的氨基酸序列。保守性氨基酸取代可包含与取代的氨基酸具有共同特征的氨基酸。在不同情况下,可进行保守性取代而不对多肽的结构或功能产生显著改变。
[0146]
保守性氨基酸取代可基于侧链、尺寸、电荷、疏水性、亲水性、等电点等等的相对类似性来进行。在不同情况下,可通过常规测试测定取代对蛋白质功能的影响。保守性氨基酸
取代包括具有类似亲水性值的氨基酸,如其中氨基酸具有可基于氨基酸疏水性和电荷的亲水指数。在不同情况下,保守性氨基酸取代可在相同类别的氨基酸之间进行,例如非极性氨基酸、酸性氨基酸、碱性氨基酸以及中性氨基酸。保守性取代也可基于尺寸或体积。氨基酸还可基于其形成或破坏给定结构的能力来分类,所述结构诸如α螺旋、β折叠或分子内相互作用或分子间相互作用。在不同情况下,保守性氨基酸取代基于不超过一种特征。
[0147]
目前公开的多肽可包含天然氨基酸和非天然氨基酸。在不同情况下,天然氨基酸侧链可被非天然侧链取代。在不同情况下,氨基酸可被衍生化。
[0148]
公开的多肽包括与seq id no:1-48的序列同源的多肽。同源性可被表示为同一性%或类似性%或相似性(positive)%。在不同情况下,同一性%为两种比对的多肽之间相同的氨基酸百分比,并且类似性%或相似性%为不相同但表示保守性取代的氨基酸百分比。保守性取代可以是带相同电荷的氨基酸、相同尺寸的氨基酸、相同极性的氨基酸等等。例如,赖氨酸到精氨酸可被视为保守性取代,其中考虑到电荷。
[0149]
在不同情况下,两种多肽可通过算法例如blastp来比对。在不同情况下,blastp参数可设置成最大靶序列长度等于、大于或小于两种多肽中较长多肽的长度,预期阈值可设置为10,单词尺寸设置为3,并且评分矩阵可以是blosum62,其中缺口成本对于存在性为11并且对于扩展为1。blastp可将比对的多肽的同源性报道为“同一性”和“相似性(positive)”。比对的序列可包含实现比对的缺口。
[0150]
在不同情况下,氨基酸序列的同源性可反映当如上文所述地最佳比对时的同一性百分比或者相似性百分比。在不同情况下,同源性%(相似性%)或同一性%可通过除以比较窗口内比对的氨基酸数目来计算。如果两种多肽具有不等的长度,则比较窗口可以是一种多肽或另一种多肽的完整长度。在其他情况下,比较窗口可以是所述多肽之一的一部分。在不同情况下,用于测量两种多肽序列的同源性或同一性的比较窗口大于约40aa(氨基酸)、45aa、50aa、55aa、60aa、65aa、70aa、75aa、80aa、85aa、90aa、95aa、100aa、150aa或200aa和/或小于约200aa、150aa、100aa、95aa、90aa、85aa、80aa、75aa、70aa、65aa、60aa、55aa、50aa或45aa。在一些实施方案中,如在使用cdr序列的情况下,比较窗口可小于40aa,例如在小于约25aa、24aa,23aa,22aa,21aa,20aa,19aa,18aa、17aa、16aa、15aa、14aa、13aa、12aa、11aa、10aa、9aa,8aa、7aa、6aa、5aa或4aa,与大于约3aa、4aa、5aa、6aa、7aa、8aa、9aa、10aa、11aa、12aa、13aa、14aa、15aa、16aa、17aa、18aa、19aa、20aa、21aa、22aa、23aa或24aa之间。
[0151]
在不同情况下,要求保护的氨基酸序列可在给定的比较窗口上具有以下同一性%或同源性%(相似性%):大于约60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%和/或小于约100%、99%、98%、97%、96%、95%、94%、93%、92%、91%、90%、85%、80%、75%或70%。
[0152]
在不同情况下,序列比对可使用不同算法来进行,包括动态比对、局部比对和总体对比。例如,smith和waterman,1981,adv.appl.math2:482的算法;needleman和wunsch,1970,j.mol.biol.48:443的比对算法;pearson和lipman,1988,proc.natl.acad.sci.usa 85:2444的类似性方法。在不同情况下,计算机程序可实施这些算法(诸如emboss、gap、bestfit、fasta、tfasta blast、blosum等等)。
[0153]
在替代情况下,可进行保守性氨基酸取代,其中氨基酸残基被取代为相同类别中的另一种氨基酸残基,例如其中氨基酸被分成非极性、酸性、碱性和中性类别,如下:非极
性:ala、val、leu、ile、phe、trp、pro、met;酸性:asp、glu;碱性:lys、arg、his;中性:gly、ser、thr、cys、asn、gln、tyr。
[0154]
在一些情况下,可进行保守性氨基酸取代,其中氨基酸残基被取代为具有类似亲水性值的另一种氨基酸残基(例如,在加或减2.0的值内),其中以下各项可以是具有分配给氨基酸残基的约-1.6的亲水指数的氨基酸,诸如tyr(-1.3)或pro(-1.6):arg( 3;0);lys( 3.0);asp( 3.0);glu( 3.0);ser( 0.3);asn( 0.2);gin( 0.2);gly(o);pro(-0.5);thr(-0.4);ala(-0.5);his(-0.5);cys(-1.0);met(-1.3);val(-1.5);leu(-1.8);ile(-1.8);tyr(-2.3);phe(-2.5);以及trp(-3.4)。
[0155]
在替代情况下,可进行保守性氨基酸取代,其中氨酸残基被取代为具有类似亲水指数的另一种氨基酸残基(例如,在加或减2.0的值内)。在此类情况下,每种氨基酸残基可基于其疏水性和电荷特征来分配亲水指数,如下:lie( 4.5);val( 4.2);leu( 3.8);phe( 2.8);cys( 2.5);met( 1.9);ala( 1.8);gly(-0.4);thr(-0.7);ser(-0.8);trp(-0.9);tyr(-1.3);pro(-1.6);his(-3.2);glu(-3.5);gln(-3.5);asp(-3.5);asn(-3.5);lys(-3.9);以及arg(-4.5)。
[0156]
在替代情况下,保守性氨基酸改变包括基于亲水性或疏水性、尺寸或体积或电荷的考虑因素的改变。氨基酸通常可表征为疏水性或亲水性的,这主要取决于氨基酸侧链的性质。疏水性氨基酸展现出大于零的疏水性,并且亲水性氨基酸展现出小于零的亲水性,这是基于eisenberg等的归一化共有疏水性标度(j.mol.bio.179:125-142,184)。遗传编码的疏水性氨基酸包括gly、ala、phe、val、leu、lie、pro、met以及trp,并且遗传编码的亲水性氨基酸包括thr、his、glu、gln、asp、arg、ser以及lys。非遗传编码的疏水性氨基酸包括叔丁基丙氨酸,而非遗传编码的亲水性氨基酸包括瓜氨酸和高半胱氨酸。
[0157]
疏水性氨基酸或亲水性氨基酸可基于其侧链的特征来进一步细分。例如,芳族氨基酸为具有含有至少一个芳香环或杂芳环的侧链的疏水性氨基酸,所述氨基酸可含有一个或多个取代基,诸如
‑‑
oh、
‑‑
sh、
‑‑
cn、
‑‑
f、
‑‑
cl、
‑‑
br、
‑‑
i、
‑‑
no2、
‑‑
no、
‑‑
nh2、
‑‑
nhr、
‑‑
nrr、
‑‑
c(o)r、
‑‑
c(o)oh、
‑‑
c(o)or、
‑‑
c(o)nh2、
‑‑
c(o)nhr、
‑‑
c(o)nrr等等,其中r独立地为(c
1-c6)烷基、取代的(c
1-c6)烷基、(c
0-c6)烯基、取代的(c
1-c6)烯基、(c
1-c6)炔基、取代的(c
0-c6)炔基、(c
5-c
20
)芳基、取代的(c
0-c
20
)芳基、(c
6-c
26
)烷芳基、取代的(c
6-c
26
)烷芳基、5-20元杂芳基、取代的5-20元杂芳基、6-26元烷基杂芳基或取代的6-26元烷基杂芳基。遗传编码的芳族氨基酸包括phe、tyr和trp。
[0158]
非极性或无极性氨基酸为具有侧链的疏水性氨基酸,所述侧链在生理ph下不带电荷并且具有其中由两个原子共同享有的一对电子通常通过两个原子各自等同地占有的键(即,侧链为非极性的)。遗传编码的无极性氨基酸包括gly、leu、val、ile、ala以及met。无极性氨基酸可进一步细分为包括脂肪族氨基酸,所述脂肪族氨基酸为具有脂肪烃侧链的疏水性氨基酸。遗传编码的脂肪族氨基酸包括ala、leu、val以及ile。
[0159]
极性氨基酸为具有侧链的亲水性氨基酸,所述侧链在生理ph下不带电荷,但是具有其中由两个原子共同享有的一对电子通过两个原子之一更紧密占有的键。遗传编码的极性氨基酸包括ser、thr、asn以及gln。
[0160]
酸性氨基酸为具有小于7的侧链pka值的亲水性氨基酸。酸性氨基酸通常由于失去氢离子而在生理ph下具有带负电荷的侧链。遗传编码的酸性氨基酸包括asp和glu。碱性氨
基酸为具有大于7的侧链pka值的亲水性氨基酸。碱性氨基酸通常由于与水合氢离子缔合而在生理ph下具有带正电荷的侧链。遗传编码的碱性氨基酸包括arg、lys和his。
[0161]
氨基酸序列同一性百分比值通过匹配的相同残基数目除以比较窗口中“较长”序列残基的总数目来确定。“较长”序列为具有比较窗口中的大部分实际残基的序列(忽略通过wu-blast-2引入的使比对得到最大化的缺口)。
[0162]
比对可包括比对序列中的缺口引入。另外,对于含有比由公开的多肽的序列编码的蛋白质更多或更少的氨基酸的序列,应理解,在一种情况下,序列同一性百分比将基于相同氨基酸数目相对于氨基酸总数目来确定。在同一性百分比计算中,相对权重被分配给不同表现形式的序列变化,诸如插入、缺失、取代等等。
[0163]
在一种情况下,仅同一性为正性评分( 1)并且所有形式的序列变化(包括缺口)被分配值“0”,这排除了如下所述用于序列类似性计算的权重标度或参数的需要。序列同一性百分比可例如通过将匹配的相同残基数目除以比对区内“较短”序列残基总数目并且乘以100来计算。“较长”序列为具有比对区内大部分实际残基的序列。
[0164]
支架
[0165]
如本文所述的,本公开的抗体可包含以上所述cdr可移植到的支架结构。在一个实施方案中,支架结构为传统抗体结构,即,包含两个重链可变结构域序列和两个轻链可变结构域序列的抗体。在一些情况下,本文所述的抗体组合可包含构成重链和/或轻链的另外组分(框架、j区和d区、恒定区等等)。一些实施方案包括使用人支架组分。
[0166]
因此,在不同实施方案中,本公开的抗体包含传统抗体的支架。在一些实施方案中,公开的抗体可以是人抗体和单克隆抗体、双特异性抗体、双抗体、微型抗体、结构域抗体、合成抗体、嵌合抗体、抗体融合物以及每种抗体各自的片段。以上所述cdr和cdr的组合可以移植到任何以下支架中。
[0167]
本公开的嵌合抗体可包含与源自特定物种的对应序列相同或同源的重链序列和/或轻链序列。例如,在一个实施方案中,抗-c5抗体为包含人fc结构域的嵌合抗体,而所述抗体的其余部分可以是与对应小鼠或啮齿动物序列相同或同源的。嵌合抗体可以是此类抗体的片段,只要所述片段展现出希望的生物活性并且包含源自另一物种、抗体类别或抗体亚类的序列(美国专利号4,816,567;以及morrison等(1984)proc.natl.acad.sci.usa 81:6851-6855)。
[0168]
在一些实施方案中,目前公开的抗-c5抗体的可变区包含至少三个重链或轻链cdr,参见同上(kabat等,1991,sequences of proteins of immunological interest,public health service n.i.h.,bethesda,md;还参见chothia和lesk,1987,j.mol.biol.196:901-917;chothia等,1989,nature 342:877-883),它们包埋在框架区内(表示为框架区1-4,fr1、fr2、fr3和fr4,kabat等,1991,同上;还参见chothia和lesk,1987,同上)。
[0169]
在一些情况下,所述抗体包含重链可变结构域序列或轻链可变结构域序列。在一些情况下,重链可变结构域序列或轻链可变结构域序列可包含选自表1序列的序列。
[0170]
在大部分情况下,传统抗体结构单元包含四聚体。每个四聚体通常由两对相同的多肽链组成,每一对具有一条轻链(通常具有约25kda的分子量)和一条重链(通常具有约50-70kda的分子量)。每条链的氨基端部分包含主要负责抗原识别的具有约100至110个或
更多个氨基酸的可变区。每条链的羧基-末端部分定义一个恒定区,而重链可包含总计三个恒定区(ch1、ch2和ch3),其中所述恒定区可有助于调节效应子功能。人轻链分类为κ轻链和λ轻链。重链被分类为μ、δ、γ、α或ε,并且将抗体的同种型分别定义为igm、igd、igg、iga以及ige。igg具有若干亚类,包括但不限于igg1、igg2、igg3及igg4。igm具有的亚类包括但不限于igm1及igm2。
[0171]
在轻链和重链内,可变区与恒定区通过具有约十二个(12)或更多个氨基酸的“j”区加以接合,其中重链也包含具有约十个(10)或更多个氨基酸的“d”区。通常参见,paul,w.编著,1989,fundamental immunology ch.7,第2版,raven press,n.y.各轻链和重链对的可变区形成抗体结合位点。
[0172]
一些天然存在的抗体,例如已见于骆驼和美洲驼中的抗体是由两条重链组成的二聚体,并且不包含轻链。muldermans等,2001,j.biotechnol.74:277-302;desmyter等,2001,j.biol.chem.276:26285-26290。骆驼抗体的结晶学研究已揭示cdr3区形成与抗原相互作用的表面并且因此对于抗原结合,如在更典型的四聚体抗体中的抗原结合是关键的。本公开涵盖了由两条重链组成的二聚体抗体或其片段,它们可结合于c5和/或抑制所述c5的生物活性。
[0173]
重链和轻链的可变区通常展现相对保守的框架区(fr)由三个互补决定区或cdr接合的相同一般性结构。所述cdr包含负责抗原识别和结合的抗体高变区。来自各对的两个链的cdr通过框架区对准并支撑,从而使得能够结合于特定表位。自n末端至c末端,轻链与重链两者均包含结构域fr1、cdr1、fr2、cdr2、fr3、cdr3以及fr4。对各结构域指定氨基酸是根据具有免疫意义的蛋白质的kabat序列的定义。chothia等,1987,j.mol.biol.196:901-917;chothia等,1989,nature 342:878-883。
[0174]
cdr构成用于抗原结合的主要表面接触点。例如,参见,chothia和lesk,1987,j.mol.biol.196:901-917。另外,轻链的cdr3以及尤其是重链的cdr3可构成轻链和重链可变区内的抗原结合中的最重要的决定簇。例如,参见,chothia和lesk,1987,同上;desiderio等,2001,j.mol.biol.310:603-615;xu和davis,2000,immunity 13:37-45;desmyter等,2001,j.biol.chem.276:26285-26290;以及muyldermans,2001,j.biotechnol.74:277-302。在一些抗体中,重链cdr3似乎构成抗原与抗体之间的主要接触区域。desmyter等,2001,同上。其中cdr3单独改变的体外选择方案可用于改变抗体的结合性质。muyldermans,2001,同上;desiderio等,2001,同上。
[0175]
天然存在的抗体通常包含信号序列,其引导抗体进入蛋白质分泌的细胞途径并且不存在于成熟抗体中。编码本公开的抗体的多核苷酸可编码如下所述的天然存在的信号序列或异源信号序列。
[0176]
在一个实施方案中,抗-c5抗体为具有一个(1)至六个(6)cdr的单克隆抗体,如本文所列出的。本公开的抗体可具有任何类型,包括igm、igg(包括igg1、igg2、igg3、igg4)、igd、iga或ige抗体。在一些实施方案中,所述抗体为igg型抗体。在一个实施方案中,所述抗体为igg2型抗体。
[0177]
在一些实施方案中,抗体可包含完整重链和轻链,其中cdr全部来自相同物种,例如人类。可选地,例如在其中抗体含有小于六个来自以上所列出序列的cdr的实施方案中,另外的cdr可来自其他物种(例如,鼠类cdr),或者可以是与序列中所描绘的那些不同的人
cdr。例如,可使用来自本文鉴定的适当序列的人hc cdr3区和lc cdr3区,其中hc cdr1、hc cdr2、lc cdr1和lc cdr2任选地选自替代物种或不同人抗体序列或其组合。例如,本公开的cdr可置换商业相关嵌合抗体或人源化抗体的cdr区。
[0178]
特定实施方案可包括含有人序列的抗体支架。
[0179]
然而,在一些实施方案中,支架组分可以是来自不同物种的混合物。因此,所述抗体可以是嵌合抗体和/或人源化抗体。一般而言,嵌合抗体和人源化抗体二者可以是组合来自超过一种物种的多个区域或氨基酸的抗体。例如,在大部分实施方案中,嵌合抗体包含来自小鼠、大鼠、兔或其他适合的非人动物的可变区和来自人的恒定区。在其他实施方案中,嵌合抗体包含人fr序列和非人cdr。
[0180]
人源化抗体为最初源自非人抗体例如小鼠抗体的抗体。在人源化抗-c5抗体的不同实施方案中,源自非人抗体的可变结构域框架区或框架氨基酸可被改变为人抗体对应位置可见的氨基酸同一性。在人源化抗体的一些实施方案中,整个抗体除了cdr之外,可以由人来源的多核苷酸编码或者除了其cdr内之外可与此抗体相同。在其他实施方案中,人源化抗体可包含特定氨基酸位置,所述位置的同一性已被改变为对应人抗体中的相同或类似位置的同一性。部分或全部可由来源于非人生物体的核酸编码的cdr被移植到人抗体可变区的β折叠框架中以产生抗体,所述抗体的特异性由所移入的cdr决定。此类抗体的产生描述于例如wo 92/11018,jones,1986,nature 321:522-525,verhoeyen等,1988,science 239:1534-1536中。人源化抗体也可使用具有遗传工程化的免疫系统的小鼠产生。roque等,2004,biotechnol.prog.20:639-654。在一些实施方案中,cdr可以人的,并且因此在此背景下人源化抗体和嵌合抗体二者可包含一些非人cdr。在一些情况下,可产生人源化抗体,其包含hc cdr3区和lc cdr3区,其中一个或多个其他cdr区具有不同的特定来源。
[0181]
在一个实施方案中,c5抗体可以是多特异性抗体,并且显著地是双特异性抗体(例如,双抗体)。这些抗体为结合于两种(或更多种)不同抗原例如c5和另一种抗原或者c5的两个不同表位的抗体。双抗体可以本领域已知的多种方式制造(holliger和winter,1993,current opinion biotechnol.4:446-449),例如以化学方式制备或者由杂种杂交瘤制备。
[0182]
在一个实施方案中,抗-c5抗体为微型抗体。微型抗体是最小化的抗体样蛋白质,其包含scfv连接至ch3域。hu等,1996,cancerres.56:3055-3061。
[0183]
在一个实施方案中,抗-c5抗体为结构域抗体;参见,例如美国专利号6,248,516。结构域抗体(dab)为抗体的功能结合结构域,与人抗体dab的重链(vh)或轻链(vl)的可变区相对应,具有大约13kda的分子量或者小于完整抗体尺寸的十分之一。dab在多种宿主中良好表达,所述宿主包括细菌、酵母和哺乳动物细胞系统。另外,dab高度稳定并且甚至在经受苛刻条件诸如冷冻干燥或热变性之后仍保留活性。参见,例如,美国专利6,291,158;6,582,915;6,593,081;6,172,197;美国序列号2004/0110941;欧洲专利0368684;美国专利6,696,245、wo04/058821、wo04/003019和wo03/002609,所有专利均以引用的方式整体并入。
[0184]
在一个实施方案中,抗-c5抗体为抗体片段,其为本文所列出的保留与c5的特异性结合的任何抗体的片段。在不同实施方案中,所述抗体为f(ab)、f(ab')、f(ab')2、fv或单链fv片段。至少,如本文所意指的抗体包括可特异性结合抗原的多肽,其中所述多肽包含所有或一部分轻链和/或重链可变区。
[0185]
特异性抗体片段包括但不限于,(i)由vl、vh、cl和ch1结构域组成的fab片段;(ii)
由vh和ch1结构域组成的fd片段;(iii)由单一抗体的vl和vh结构域组成的fv片段;(iv)由单一可变区组成的dab片段(ward等,1989,nature 341:544-546);(v)分离的cdr区、(vi)包含两个连接的fab片段的二价片段f(ab')2片段;(vii)单链fv分子(scfv),其中vh结构域和vl结构域通过允许两个结构域缔合形成抗原结合位点的肽接头连接(bird等,1988,science 242:423-426,huston等,1988,proc.natl.acad.sci.u.s.a.85:5879-5883);(viii)双特异性单链fv二聚体(pct/us92/09965);以及(ix)双抗体或三抗体,它们为基因融合物构建的多价或多特异性片段(tomlinson等,2000,methods enzymol.326:461-479;wo94/13804;holliger等,1993,proc.natl.acad.sci.u.s.a.90:6444-6448)。可修饰抗体片段。例如,可通过并入连接vh结构域和vl结构域的二硫桥来稳定分子(reiter等,1996,nature biotech.14:1239-1245)。
[0186]
在一个实施方案中,c5抗体为传统抗体,例如人免疫球蛋白。在此实施方案中,如以上所列出的,特异性结构包含所描绘的含有cdr区的完整重链和轻链。另外的实施方案利用一种或多种本公开的cdr,其中其他cdr、框架区、j区和d区、恒定区等等来自其他人抗体。例如,本公开的cdr可置换任何数目的人抗体,特别是商业上相关的抗体的cdr。
[0187]
在一个实施方案中,c5抗体为抗体融合蛋白(例如,抗体缀合物)。在此实施方案中,所述抗体融合至缀合配伍物。所述缀合配伍物可以是蛋白质的或非蛋白质的;后者通常使用抗体上(参见,关于抗体共价修饰的讨论)和缀合配伍物上的官能团来产生。例如,接头为本领域已知的;例如,同或异双功能接头为本领域已知的(参见,pierce chemical company catalog,technical section on cross-linkers,第155-200页,所述文献以引用的方式并入本文)。
[0188]
在一个实施方案中,c5抗体为抗体类似物。在一些情况下,抗体类似物可被称为合成抗体。例如,多种最近的工作利用了具有移植的cdr的替代性蛋白支架或人工支架。此类支架包括但不限于,被引入以便使抗体的三维结构稳定的突变,以及由例如生物相容性聚合物组成的完全合成的支架。参见,例如korndorfer等,2003,proteins:structure,function,and bioinformatics,第53卷,第1期:121-129。roque等,2004,biotechnol.prog.20:639-654。另外,可使用肽抗体模拟物(pam)以及基于利用纤连蛋白组分作为支架的抗体模拟物的工作。
[0189]
vh和vl变体
[0190]
如以上所列出,在一些实施方案中,本公开提供了分别包含含有seq id no:2、4、6、8、10以及12的重链可变区和/或seq id no:1、3、5、7、9以及11的轻链可变区或由其组成的抗体或其如上所定义的片段。因此,在那些实施方案中,所述抗体不仅包含至少一个cdr或变体,而且包含至少一部分描绘的框架序列。另外,本公开涵盖了此类重链可变序列或轻链可变序列的变体。
[0191]
变体可变区通常与亲代可变区(诸如本文所公开的那些)共享至少80%的氨基酸同源性、类似性或同一性。在一些实施方案中,变体和亲代序列同源性或同一性为至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%以及几乎100%。编码个别变体vh和vl的核苷酸序列与本文所描绘的核酸序列之间的核酸序列同源性、类似性或同一性为本文所描绘的那些序列的至少70%,或者更可选地使同源性或同一性增加至少80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%以及几乎
100%。此外,在许多实施方案中,变体可变区可享有生物功能,包括但不限于,亲代cdr的特异性和/或活性的至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。在一些情况下,同源性和/或同一性仅在可能相同的cdr序列之外测量。在其他情况下,同源性和/或同一性在整个完整序列(包含cdr序列)中测量。在其他实施方案中,还可包括恒定区变体。
[0192]
在不同情况下,氨基酸序列的同源性可反映当如上文所述地最佳比对时的同一性百分比或者相似性百分比。在不同情况下,同源性%(相似性%)或同一性%可通过除以比较窗口内比对的氨基酸数目来计算。如果两种多肽具有不等的长度,则比较窗口可以是一种或另一种比较多肽的完整长度。在其他情况下,比较窗口可以是所述多肽之一的一部分。在不同情况下,用于测量两种多肽序列的同源性或同一性的比较窗口大于约40aa(氨基酸)、45aa、50aa、55aa、60aa、65aa、70aa、75aa、80aa、85aa、90aa、95aa、100aa、150aa或200aa和/或小于约200aa、150aa、100aa、95aa、90aa、85aa、80aa、75aa、70aa、65aa、60aa、55aa、50aa或45aa。在一些实施方案中,如在使用本公开的不同cdr序列的情况下,比较窗口可小于40aa,例如在小于约25aa、24aa,23aa,22aa,21aa,20aa,19aa,18aa、17aa、16aa、15aa、14aa、13aa、12aa、11aa、10aa、9aa,8aa、7aa、6aa、5aa或4aa,与大于约3aa、4aa、5aa、6aa、7aa、8aa、9aa、10aa、11aa、12aa、13aa、14aa、15aa、16aa、17aa、18aa、19aa、20aa、21aa、22aa、23aa或24aa之间。
[0193]
在不同情况下,要求保护的氨基酸序列可在给定的比较窗口上具有以下同一性%或同源性%(相似性%):大于约70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%和/或小于约100%、99%、98%、97%、96%、95%、94%、93%、92%、91%、90%、85%、80%或75%。
[0194]
抗-c5抗体的共价修饰
[0195]
抗体的共价修饰包括在本公开的范围以内,并且通常,但不总是,在翻译后进行。举例来说,通过使抗体的特定氨基酸残基与能够同选定侧链或n末端或c末端残基反应的有机衍生剂反应,来将几种类型的抗体共价修饰引入分子中。
[0196]
半胱胺酰残基最常见地与α-卤乙酸盐(和对应的胺),如氯乙酸或氯乙酰胺反应,得到羧基甲基或羧酰胺甲基(carboxyamidomethyl)衍生物。半胱氨酰残基还通过与溴三氟丙酮、α-溴-β-(5-咪唑基)丙酸、氯乙酰基磷酸酯、n-烷基马来酰亚胺、3-硝基-2-吡啶基二硫化物、甲基2-吡啶基二硫化物、对氯汞苯甲酸、2-氯汞-4-硝基酚或氯-7-硝基苯并-2-氧杂-1,3-二唑反应来衍生化。
[0197]
组氨酰残基通过与焦碳酸二乙酯在ph 5.5-7.0下反应而衍生,因为所述试剂相对地对组氨酰基侧链具特异性。对溴苯酰甲基溴(para-bromophenacyl bromide)也为有用的;反应可在0.1m二甲胂酸钠中在ph 6.0下执行。
[0198]
赖氨酰基和氨基端残基与琥珀酸或其他羧酸酐反应。利用所述试剂的衍生具有逆转赖氨酰残基的电荷的作用。用于衍生含α-氨基的残基的其他适合试剂包括亚氨酸酯(imidoester),如甲基吡啶亚胺甲酯(methyl picolinimidate);磷酸吡哆醛(pyridoxal phosphate);吡哆醛;硼氢化氯(chloroborohydride);三硝基苯磺酸;o-甲基异脲;2,4-戊二酮;以及转胺酶催化的与乙醛酸盐的反应。
[0199]
精氨酰残基通过与一种或几种常规试剂反应而修饰,所述常规试剂中有苯乙二醛
(phenylglyoxal)、2,3-丁二酮、1,2-环己二酮以及茚三酮(ninhydrin)。精氨酸残基的衍生要求反应在碱性条件下进行,这是因为胍官能团具有高pka。此外,所述试剂可与赖氨酸的基团以及精氨酸ε-氨基反应。
[0200]
酪氨酰残基的特定修饰可通过与芳族重氮化合物或四硝基甲烷反应来进行,尤其关注将光谱标记引入酪氨酰残基中。最常见地,使用n-乙酰基咪唑和四硝基甲烷分别形成o-乙酰基酪氨酰基物质和3-硝基衍生物。使用
125
i或
131
i碘化酪氨酰残基,以制备标记的蛋白质以供用于放射性免疫测定中,上文描述的氯胺t方法是适合的。
[0201]
羧基侧基(天冬氨酰基或谷氨酰基)通过与碳化二亚胺(r'—n=c=n
‑‑
r')反应进行选择性修饰,其中r及r'任选地为不同烷基,如1-环己基-3-(2-吗啉基-4-乙基)碳化二亚胺或1-乙基-3-(4-氮阳离子-4,4-二甲基戊基)碳化二亚胺。此外,天冬氨酰和谷氨酰残基可通过与铵离子反应而转化为天冬酰胺酰和谷酰胺酰残基。
[0202]
利用双官能试剂的衍生适用于将抗体交联至水不可溶载体基质或表面以供用于多种方法中。常用的交联剂包括例如1,1-双(重氮乙酰基)-2-苯基乙烷;戊二醛;n-羟基琥珀酰亚胺酯,例如与4-叠氮基水杨酸的酯;同双官能亚氨酸酯(homobifunctional imidoester),包括二琥珀酰亚氨基酯,诸如3,3'-二硫代双(琥珀酰亚氨基丙酸酯);以及双官能顺丁烯二酰亚胺,诸如双-n-顺丁烯二酰亚氨基-1,8-辛烷。诸如甲基-3-[(对-叠氮苯基)二硫代]丙亚氨酸酯(methyl-3-[(p-azidophenyl)dithio]propioimidate)的衍生剂产生能够于光存在下形成交联的光可活化中间物。可选地,反应性水不溶性基质诸如溴化氰激活的碳水化物和反应性底物描述于美国专利号3,969,287;3,691,016;4,195,128;4,247,642;4,229,537;以及4,330,440(所有这些专利均以引用的方式整体并入本文),它们用于蛋白质固定。
[0203]
谷酰胺酰和天冬酰胺酰残基常经受去酰氨基作用,分别得到对应谷氨酰和天冬氨酰残基。或者,这些残基在温和酸性条件下脱去酰氨基。这些残基的任一种形式属于本公开的范围内。
[0204]
其他修饰包括脯氨酸和赖氨酸的羟基化、丝氨酰基或苏氨酰基残基的羟基的磷酸化、赖氨酸、精氨酸和组氨酸侧链的α-氨基的甲基化(t.e.creighton,proteins:structure and molecular properties,w.h.freeman&co.,san francisco,1983,第79-86页)、n末端胺的乙酰化以及以任何c-末端羧基的酰胺化。
[0205]
糖化作用
[0206]
本公开范围内包括的另一种类型的抗体共价修饰包括改变蛋白质的糖基化模式。正如本领域所知,糖基化模式可以取决于蛋白质的序列(例如,存在或不存在特定的糖基化氨基酸残基,在下文中讨论)或其中产生蛋白质的宿主细胞或有机体两者。以下讨论特定的表达系统。
[0207]
多肽的糖基化通常为n-连接或o-连接的。n-连接是指碳水化合物部分与天门冬酰胺残基的侧链连接。三肽序列天冬酰胺-x-丝氨酸和天冬酰胺-x-苏氨酸为用于将碳水化合物部分酶促连接于天冬酰胺侧链的识别序列,其中x为除脯氨酸之外的任何氨基酸。因此,在多肽中存在这些三肽序列的任何一个产生一个潜在的糖基化位点。o-连接糖基化是指糖n-乙酰半乳糖胺、半乳糖或木糖之一与羟氨基酸(最常见的是丝氨酸或苏氨酸)连接,不过也可使用5-羟基脯氨酸或5-羟基赖氨酸。
[0208]
糖化位点至公开的抗体的添加宜通过改变氨基酸序列以使得其含有上述三肽序列中的一个或多个来实现(对于n连接糖化位点)。所述改变也可通过向起始序列添加或取代一个或多个丝氨酸或苏氨酸残基来实现(对于o-连接糖基化位点)。为方便起见,抗体的氨基酸序列经由dna水平的变化来改变,尤其通过使编码靶多肽的dna在预选的碱基处突变以使得产生将翻译成所需氨基酸的密码子。
[0209]
增加抗体上碳水化合物部分的数目的另一手段是糖苷至蛋白质的化学或酶偶联。这些程序之所以是有利的,是因为它们不需要在对n-连接和o-连接糖基化具有糖基化能力的宿主细胞中产生所述蛋白质。根据所使用的偶联方式,糖可连接至(a)精氨酸和组氨酸,(b)游离羧基,(c)游离巯基诸如半胱氨酸的那些游离巯基,(d)游离羟基诸如丝氨酸、苏氨酸或羟基脯氨酸的那些游离羟基,(e)芳香残基诸如苯丙氨酸、酪氨酸或色氨酸的那些芳香残基,或(f)谷氨酰胺的酰胺基。这些方法在1987年9月11日公布的wo 87/05330和aplin和wriston,1981,crc crit.rev.biochem.,第259-306页中描述。
[0210]
除去起始抗体上存在的碳水化合物部分可以化学或酶促方式实现。化学去糖基化需要蛋白质暴露于化合物三氟甲磺酸或等效化合物。这种处理导致除连接糖(n-乙酰葡糖胺或n-乙酰半乳糖胺)外的大部分或所有糖裂解,而剩下多肽是完整的。化学去糖基化通过hakimuddin等,1987,arch.biochem.biophys.259:52并且通过edge等,1981,anal.biochem.118:131描述。多肽上的碳水化合物部分的酶裂解可通过使用如thotakura等,1987,meth.enzymol.138:350所述的各种内切-和外切-糖苷酶实现。在潜在糖基化位点处的糖基化可通过使用如由duskin等,1982,j.biol.chem.257:3105所述的化合物衣霉素来预防。衣霉素阻断蛋白质-n-糖苷键的形成。
[0211]
聚乙二醇化作用
[0212]
另一种类型的抗体的共价修饰包括以美国专利号4,640,835;4,496,689;4,301,144;4,670,417;4,791,192或4,179,337中所示的方式将抗体与各种非蛋白质聚合物连接,所述非蛋白质聚合物包括但不限于,各种多元醇如聚乙二醇、聚丙二醇或聚氧化烯。此外,如本领域中所已知,氨基酸取代可在抗体内的各种位置上进行,以促进聚合物诸如如peg的添加。
[0213]
标记
[0214]
在一些实施方案中,本公开的抗体的共价修饰包括一种或多种标记的添加。
[0215]
术语“标记基团”是指任何可检测标记。适合的标记基团的实例包括但不限于以下:放射性同位素或放射性核素(例如,3h、
14
c、
15
n、
35
s、
90
y、
99
tc、
111
in、
125
i、
131
i)、荧光基团(例如,fitc、若丹明、镧系元素磷光体)、酶基团(例如,辣根过氧化物酶、β-半乳糖苷酶、荧光素酶、碱性磷酸酶)、化学发光基团、生物素基团或由二级报道体识别的预定多肽表位(例如,亮氨酸拉链对序列、二级抗体的结合位点、金属结合结构域、表位标记)。在一些实施方案中,标记基团通过具有各种长度的间隔子臂使标记基团偶联到抗体,以降低潜在空间位阻。用于标记蛋白质的各种方法为本领域中已知的并且可用于实施本公开。
[0216]
一般而言,根据待检测标记所在的测定而定,标记属于多种类别:a)同位素标记,其可以是放射性或重同位素;b)磁性标记(例如,磁性颗粒);c)氧化还原活性部分;d)光学染料;酶基团(例如,辣根过氧化物酶、β-半乳糖苷酶、荧光素酶、碱性磷酸酶);e)生物素化基团;以及f)由二级报道体识别的预定多肽表位(例如,亮氨酸拉链对序列、二级抗体的结
合位点、金属结合结构域、表位标签等)。在一些实施方案中,标记基团通过具有各种长度的间隔子臂使标记基团偶联到抗体,以降低潜在空间位阻。用于标记蛋白质的各种方法为本领域中已知的并且可用于实施本公开。
[0217]
特定标记包括光学染料,包括但不限于发色团、磷光体和荧光团,其中后者在许多情况下具有特异性。荧光团可为“小分子”荧光剂或蛋白质性荧光剂。
[0218]
荧光标记可以是可通过其固有荧光性质检测的任何分子。适合的荧光标记包括但不限于,荧光素、若丹明、四甲基若丹明、伊红、藻红、香豆素、甲基香豆素、芘、孔雀石绿(malacite green)、二苯乙烯、荧光黄(lucifer yellow)、层叠蓝j(cascade bluej)、德克萨斯红(texas red)、iaedans、edans、bodipy fl、lc红640,cy 5、cy 5.5、lc红705、俄勒冈绿(oregon green)、alexa-fluor染料(alexa fluor 350、alexa fluor 430、alexa fluor 488、alexa fluor 546、alexa fluor 568、alexa fluor 594、alexa fluor 633、alexa fluor 660、alexa fluor 680)、层叠蓝、层叠黄(cascade yellow)和r-藻红素(phycoerythrin,pe)(molecular probes,eugene,or)、fitc、若丹明和德克萨斯红(pierce,rockford,il)、cy5、cy5.5、cy7(amersham life science,pittsburgh,pa)。包括荧光团的适合光学染料描述于由richard p.haugland所著的molecular probes handbook中,所述手册特此以引用的方式明确并入。
[0219]
适合的蛋白质荧光标记也包括但不限于,绿荧光蛋白,包括gfp的renilla、ptilosarcus或aequorea物种(chalfie等,1994,science 263:802-805)、egfp(clontech laboratories,inc.,genbank登录号u55762)、蓝荧光蛋白(bfp,quantum biotechnologies,inc.1801demaisonneuve blvd.west,8th floor,montreal,quebec,canada h3h1j9;stauber,1998,biotechniques 24:462-471;heim等,1996,curr.biol.6:178-182)、增强的黄荧光蛋白(eyfp,clontech laboratories,inc.)、荧光素酶(ichiki等,1993,j.immunol.150:5408-5417)、β半乳糖苷酶(nolan等,1988,proc.natl.acad.sci.u.s.a.85:2603-2607)以及renilla(wo92/15673、wo95/07463、wo98/14605、wo98/26277、wo99/49019、美国专利号5292658、5418155、5683888、5741668、5777079、5804387、5874304、5876995、5925558)。所有以上引用的参考文献均以引用的方式明确地并入本文。
[0220]
编码抗-c5抗体的多核苷酸
[0221]
在某些方面,本公开提供了编码本文所述的抗体的核酸分子。在一些情况下,公开的核酸编码本文所述的抗体、可变区或cdr。核酸包括dna和rna分子。核酸可以是天然核酸、非天然核酸、核酸类似物或合成核酸。本公开的核酸通常为多核酸;即,通过磷酸二酯键共价连接的个别核苷酸的聚合物。在不同情况下,核苷酸序列可以是单链、双链或其组合。核苷酸序列还可包括非核酸分子诸如氨基酸或其他单体。
[0222]
在许多实施方案中,编码序列可以是分离的核酸分子。分离的核酸分子被鉴定并且与至少一种组分(它在自然来源中通常与所述至少一种组分缔合)分离。在一些情况下,组分可以是核苷酸序列、蛋白质或非蛋白质分子。分离的抗-c5多肽-编码核酸分子不同于它在自然界中所存在的形式或配置。分离的抗-c5抗体编码核酸分子因此不同于当它存在于天然细胞中时的编码核酸分子。然而,分离的抗-c5抗体编码核酸分子包括通常表达抗-c5抗体的细胞中含有的抗-c5抗体编码核酸分子,在所述细胞中,例如核酸分子处于不同于
天然细胞的位置的染色体位置中。分离的核酸分子因此不同于当它存在于生物体中时的核酸分子。然而,在一些情况下,分离的核酸分子可以是细胞内含有的核酸,例如,其中分离的核酸分子被引入到细胞中并且驻留在染色体外位置或者不同于其天然位置的染色体位置。
[0223]
根据其用途,核酸可以是单链、双链,或者可含有双链或单链序列二者的一部分。如本领域技术人员将了解的,单链(有时也称为“watson”链)的描绘也定义了另一条链(有时也称为“crick”链)的序列。重组核酸可以是一般通过内切核酸酶对核酸进行处理的最初于体外形成的核酸,通常为自然界中未发现的形式。因此,出于本公开的目的,可通过呈线性形式的核酸编码的分离抗体,或通过连接通常不连接的dna分子在体外形成的表达载体两者均被认为是重组的。应理解,一旦具有必需控制元件的重组核酸制成并且重新引入至宿主细胞或生物体中,它就可非重组地复制,即,使用宿主细胞的体内细胞机制而非体外操纵;然而,出于本公开的目的,此类核酸,一旦重组产生,虽然随后非重组地复制,但仍然被认为是重组的。
[0224]
在一些实施方案中,重组核酸可包含一种或多种控制元件或控制序列。控制元件和控制序列是指在具体生物体中表达可操作地连接的编码序列所需的核酸序列。适于原核生物的控制序列例如包括启动子,任选地包括操纵子序列,和核糖体结合位点。已知真核细胞利用启动子、多腺苷酸化信号和增强子。如本文所用,可操作地连接的序列为与另一核酸序列呈某一功能关系的核酸序列。例如,核酸编码序列可以可操作地连接至核酸控制序列。例如,如果前序列或分泌前导序列的dna被表达为参与多肽分泌的前蛋白,那么其可以可操作地连接至多肽的dna;如果启动子或增强子影响序列的转录,那么其可操作地连接至编码序列;或者如果核糖体结合位点被定位为促进翻译,那么其可操作地连接至编码序列。在大部分实施方案中,可操作地连接的序列为共价连接至例如分泌前导序列的dna序列。然而,如以上所述的,一些控制序列可以具有作为rna序列的活性。在许多实施方案中,增强子序列不需要与编码序列相邻,而两种序列可通过一个或多个核酸分开。
[0225]
在不同情况下,公开的核苷酸序列的核酸可包含以与天然存在的核苷酸类似的方式代谢的核苷酸。还包括具有合成主链类似物的核酸样结构,所述合成主链类似物包括而不限于,磷酸二酯、硫代磷酸酯、二硫代磷酸酯、甲基膦酸酯、氨基磷酸酯、烷基磷酸三酯、氨基磺酸酯、3'-硫代乙酸酯、亚甲基(甲基亚氨基)、3'-n-氨基甲酸酯、吗啉代氨基甲酸酯以及肽核酸(pna)(例如,参见:“oligonucleotides and analogues,a practical approach,”edited by f.eckstein,irl press at oxford university press(1991);“antisense strategies,”annals of the new york academy of sciences,第600卷,baserga和denhardt编著(nyas 1992);milligan(1993)j.med.chem.36:1923-1937;以及“antisense research and applications”(1993,crc press))。pna含有非离子型主链,诸如n-(2-氨基乙基)甘氨酸单元。二硫代磷酸酯键描述于:wo 97/03211;wo 96/39154;以及mata(1997)toxicol.appl.pharmacol.144:189-197。由此术语涵盖的其他合成主链包括甲基磷酸酯键或交替性甲基磷酸酯和磷酸二酯键(strauss-soukup(1997)biochemistry 36:8692-8698)以及苯基磷酸酯键(samstag(1996)antisense nucleic acid drug dev 6:153-156)。
[0226]
如本领域技术人员将了解,归因于遗传密码的简并性,可制备极大数目的全部都编码本公开的cdr(和抗体的重链和轻链或其他组分)的核酸。因此,在已鉴定特定氨基酸序
列的情况下,本领域技术人员可通过以不改变编码蛋白质的氨基酸序列的方式,仅修改一个或多个密码子的序列来制备许多不同核酸。
[0227]
在不同情况下,包括编码多肽序列seq id no:1-48的核苷酸序列。这些核苷酸编码序列可被翻译成具有与公开的多肽序列相同的氨基酸序列的多肽。在许多情况下,编码相同多肽的核苷酸可不具有相同的核苷酸序列。公开的编码序列还可包含非翻译序列,例如多腺苷酸化序列。本发明的编码序列还可包含内含子或在翻译前剪切掉转录的mrna的插入的非翻译序列。在不同情况下,转录的mrna可用末端7-甲基胍封端。在一些实施方案中,编码序列将包含最终抗体中并不出现的氨基酸的编码序列,例如输出抗体所需要的序列。
[0228]
核苷酸编码序列可通过如上所述的blastn进行比对。在不同情况下,这些比对的核苷酸序列的同源性(或者在blastn中的同一性)可大于约40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或95%和/或小于约100%、95%、90%、85%、80%、75%、70%、65%、60%、55%、50%或45%。在不同情况下,同源比对的序列可小于约700nt、600nt、500nt、400nt、300nt、200nt、100nt、90nt、80nt、70nt、60nt、50nt或40nt,和/或大于约50nt、60nt、70nt、80nt、90nt、100nt、200nt、300nt、400nt、500nt或600nt。
[0229]
在不同情况下,编码序列指导根据标准遗传密码可翻译成氨基酸序列的核糖核酸序列的转录。在不同情况下,密码可包括规范密码的变化。在不同变型中,编码序列可包含内含子或者并不编码氨基酸但可被转录并且随后在核糖核酸翻译成多肽之前除去的插入序列。
[0230]
产生抗体的方法
[0231]
本公开还提供了呈质粒、表达载体、转录或表达盒形式的包含至少一种如上多核苷酸的表达系统和构建体。此外,本公开提供了包含此类表达系统或构建体的宿主细胞。
[0232]
通常,用于任何宿主细胞中的表达载体都将含有用于质粒维持和用于外源性核苷酸序列的克隆和表达的序列。在某些实施方案中总称为侧接序列的此类序列通常将包括以下核苷酸序列中的一个或多个:启动子、一种或多种增强子序列、复制起点、转录终止序列、含有供体和受体拼接位点的完全内含子序列、编码用于多肽分泌的前导序列的序列、核糖体结合位点、聚腺苷酸化序列、用于插入编码待表达的多肽的核酸的多接头区域以及可选择标记元件。以下论述这些序列中的每一个。
[0233]
任选地,载体可含有“标签”编码序列,即位于c5抗体编码序列的5'端或3'端的寡核苷酸分子;寡核苷酸序列可编码多his标签(诸如六his)或可商购抗体存在的另一“标签”,诸如flag、ha(血球凝集素流感病毒(hemaglutinin influenza virus))或myc。此标签通常在多肽表达后融合于多肽,并且可充当一种从宿主细胞亲和纯化或检测c5抗体的手段。亲和纯化可例如通过使用针对标记的抗体作为亲和基质进行柱色谱来达成。任选地,所述标签可随后通过各种手段,诸如使用用于切割的某些肽酶从纯化的抗-c5抗体中去除。
[0234]
侧接序列可以是同源的(即来自与宿主细胞相同的物种和/或品系)、异源的(即与除宿主细胞物种或品系不同的物种)、杂交的(即来自超过一种来源的侧接序列的组合)、合成的或天然的。因此,侧接序列的来源可以是任何原核或真核生物体、任何脊椎动物或无脊椎动物生物体或任何植物,前提是侧接序列在宿主细胞机构中具有功能性,并且可通过宿主细胞机构激活。
[0235]
适用于本公开的载体中的侧接序列可通过本领域中熟知的若干方法中的任一种
方法获得。通常,适用于本文中的侧接序列将已先前通过图谱分析和/或通过限制核酸内切酶消化鉴定,并且因此可使用适当限制核酸内切酶自适当组织来源分离。在一些情况下,侧接序列的完整核苷酸序列可以是已知的。在本文中,侧接序列可使用本文对于核酸合成或克隆所述的方法合成。
[0236]
无论已知全部侧接序列还是仅一部分侧接序列,它都可使用聚合酶链反应(pcr)和/或通过用适合探针,诸如来自相同或另一物种的寡核苷酸和/或侧接序列片段筛选基因组文库来获得。当侧接序列未知时,含有侧接序列的dna片段可从一段可含有例如编码序列或甚至另外一种或多种基因的较大dna分离。分离可通过以下方式达成:限制核酸内切酶消化以产生适当dna片段,随后使用琼脂糖凝胶纯化柱色谱(chatsworth,ca)或熟练技术人员已知的其他方法进行分离。对用以达成这个目的的适合酶的选择将易于为本领域普通技术人员所显而易知。
[0237]
复制起点通常是那些商购原核表达载体的一部分,并且起点有助于在宿主细胞中扩增载体。如果所选载体不含有复制起点位点,那么可基于已知序列化学合成复制起点位点,并且将其连接至载体中。举例来说,来自质粒pbr322(new england biolabs,beverly,ma)的复制起点适用于大多数革兰氏阴性细菌,并且各种病毒起点(例如sv40、多瘤、腺病毒、水泡性口炎病毒(vsv)或乳头状瘤病毒诸如hpv或bpv)适用于哺乳动物细胞中的克隆载体。通常,复制起点组分不为哺乳动物表达载体所需(例如仅因为sv40起点也含有病毒早期启动子而常使用它)。
[0238]
转录终止序列通常位于多肽编码区的末端的3',并且用于终止转录。通常,原核细胞中的转录终止序列是g-c富集片段,继之以多聚t序列。尽管序列易于自文库克隆或甚至作为载体的一部分商购,但它也可易于使用用于核酸合成的方法(如本文所述的那些)合成。
[0239]
可选择标记基因编码为在选择性培养基中生长的宿主细胞的存活和生长所必需的蛋白质。典型选择标记基因编码以下蛋白质:(a)对原核宿主细胞赋予对抗生素或其他毒素,例如胺苄青霉素、四环素或卡那霉素的抗性;(b)弥补细胞的营养缺陷不足;或(c)供应不可从复合或组分确定培养基获得的关键养分。特定可选择标记是卡那霉素抗性基因、胺苄青霉素抗性基因和四环素抗性基因。有利的是,新霉素(neomycin)抗性基因也可用于在原核宿主细胞与真核宿主细胞两者中进行选择。
[0240]
可使用其他可选择基因来扩增将表达的基因。扩增是产生对生长或细胞存活关键的蛋白质所需的基因在连续多代重组细胞的染色体内串联重复的过程。用于哺乳动物细胞的适合可选择标记的实例包括二氢叶酸还原酶(dhfr)和无启动子胸苷激酶基因。将哺乳动物细胞转化体置于选择压力下,其中仅转化体借助于载体中存在的可选择基因而唯一适应于存活。选择压力通过在以下条件下培养转化的细胞来施加:连续增加培养基中的选择剂的浓度,由此导致扩增可选择基因与编码另一基因(诸如结合于c5多肽或c5表位的抗体)的dna两者。因此,从扩增的dna合成增加量的多肽,诸如抗-c5抗体。
[0241]
核糖体结合位点通常为mrna的翻译起始所必需且特征在于具有shine-dalgarno序列(原核生物)或kozak序列(真核生物)。所述元件通常位于启动子的3'和待表达的多肽的编码序列的5'。
[0242]
在一些情况下,如当在真核宿主细胞表达系统中需要糖基化时,可操作各种前序
列或原序列以改进糖基化或产率。举例来说,可改变特定信号肽的肽酶裂解位点,或添加原序列,此也可影响糖基化。最终蛋白质产物可在-1位置(相对于成熟蛋白质的第一个氨基酸)具有一个或多个与表达相伴的可能尚未完全移除的额外氨基酸。举例来说,最终蛋白质产物可具有一个或两个见于肽酶裂解位点中的连接于氨基末端的氨基酸残基。或者,如果酶在成熟多肽内的所述区域处切割,那么使用一些酶裂解位点可产生所需多肽的略微截短形式。
[0243]
本公开的表达和克隆载体将通常含有由宿主生物体识别,并且可操作地连接于编码c5抗体的分子的启动子。启动子为位于结构基因(通常在约100至1000bp内)的起始密码子上游(即5')的未转录序列,其控制结构基因的转录。启动子依照惯例分组至以下两个类别中的一个:诱导性启动子和组成性启动子。诱导性启动子可反应于培养条件的某一变化(如存在或不存在某一养分或温度变化)来引发在它们控制下自dna的转录程度增加。另一方面,组成性启动子均一转录它们所可操作地连接的基因,即少许控制或不控制基因表达。许多由多种潜在宿主细胞识别的启动子是熟知的。通过限制酶消化从来源dna移除启动子并且将所需启动子序列插入导载体中,使适合的启动子可操作地连接于编码构成本公开的c5抗体的重链或轻链的dna。
[0244]
在一些实施方案中,酵母细胞可用于产生目前公开的抗-c5抗体。适合与酵母宿主一起使用的启动子在本领域中也是熟知的。酵母增强子有利地与酵母启动子一起使用。适合与哺乳动物宿主细胞一起使用的启动子为已熟知的并且包括但不限于,自病毒的基因组获得的那些启动子,所述病毒诸如多形瘤病毒、禽痘病毒、腺病毒(如腺病毒2)、牛乳头状瘤病毒、禽肉瘤病毒、巨细胞病毒、逆转录病毒、乙型肝炎病毒和或猿猴病毒40(sv40)。其他适合哺乳动物启动子包括异源哺乳动物启动子,例如热休克启动子和肌动蛋白(actin)启动子。
[0245]
可能感兴趣的其他启动子包括但不限于:sv40早期启动子(benoist和chambon,1981,nature 290:304-310);cmv启动子(thornsen等,1984,proc.natl.acad.u.s.a.81:659-663);劳斯肉瘤病毒的3'长末端重复序列中含有的启动子(yamamoto等,1980,cell 22:787-797);疱疹胸苷激酶启动子(wagner等,1981,proc.natl.acad.sci.u.s.a.78:1444-1445);来自金属硫蛋白基因的启动子和调节序列(prinster等,1982,nature 296:39-42);以及原核生物启动子诸如β-内酰胺酶启动子(villa-kamaroff等,1978,proc.natl.acad.sci.u.s.a.75:3727-3731);或tac启动子(deboer等,1983,proc.natl.acad.sci.u.s.a.80:21-25)。还感兴趣的是以下动物转录控制区,它们展现出组织特异性并且已用于转基因动物:在胰腺腺泡细胞中有活性的弹性蛋白酶i基因控制区(swift等,1984,cell 38:639-646;ornitz等,1986,cold spring harbor symp.quant.biol.50:399-409;macdonald,1987,hepatology 7:425-515);在胰腺β细胞中有活性的胰岛素基因控制区(hanahan,1985,nature 315:115-122);在淋巴样细胞中有活性的免疫球蛋白基因控制区(grosschedl等,1984,cell 38:647-658;adames等,1985,nature 318:533-538;alexander等,1987,mol.cell.biol.7:1436-1444);在睾丸细胞、乳腺细胞、淋巴细胞和肥大细胞中有活性的小鼠乳腺瘤病毒控制区(leder等,1986,cell 45:485-495);在肝脏中有活性的白蛋白基因控制区(pinkert等,1987,genes and devel.1:268-276);在肝脏中有活性的α-胎蛋白基因控制区(krumlauf等,1985,mol.cell.biol.5:
1639-1648;hammer等,1987,science 253:53-58);在肝脏中有活性的α1-抗胰蛋白酶基因控制区(kelsey等,1987,genes and devel.1:161-171);在髓样细胞中有活性的β-球蛋白基因控制区(mogram等,1985,nature 315:338-340;kollias等,1986,cell 46:89-94);在大脑的少突胶质细胞中有活性的髓磷脂碱性蛋白基因控制区(readhead等,1987,cell 48:703-712);在骨骼肌中有活性的肌球蛋白轻链-2基因控制区(sani,1985,nature 314:283-286);以及在下丘脑中有活性的促性腺激素释放激素基因控制区(mason等,1986,science 234:1372-1378)。
[0246]
增强子序列可插入载体中以增加高等真核生物对编码构成本公开的c5抗体的轻链或重链的dna的转录。增强子是dna的顺式作用元件,长度通常约10-300bp,其作用于启动子以增加转录。增强子具有相对定向和位置非依赖性,其已见于转录单元的5'位置与3'位置两者处。可自哺乳动物基因获得的若干增强子序列为已知的(例如球蛋白、弹性蛋白酶、白蛋白、α-胎蛋白和胰岛素)。然而,通常使用来自病毒的增强子。本领域中已知的sv40增强子、巨细胞病毒早期启动子增强子、多瘤增强子和腺病毒增强子是用于活化真核启动子的示例性增强元件。尽管增强子可在载体中位于编码序列的5'或3',但其通常位于启动子的5'位点处。编码适当天然或异源信号序列(前导序列或信号肽)的序列可并入表达载体中以促进抗体的细胞外分泌。对信号肽或前导物的选择取决于待在其中产生抗体的宿主细胞的类型,并且异源信号序列可替换天然信号序列。在哺乳动物宿主细胞中具有功能的信号肽的实例包括以下:美国专利号4,965,195中所述的白介素-7(il-7)的信号序列;cosman等,1984,nature 312:768中所述的白介素-2受体的信号序列;ep专利号0367 566中所述的白介素-4受体信号肽;美国专利号4,968,607中所述的i型白介素-1受体信号肽;ep专利号0 460 846中所述的ii型白介素-1受体信号肽。
[0247]
用于表达本公开目前要求保护的抗体的表达载体可由起始载体诸如可商购载体构建。所述载体可或可不含有全部所需侧接序列。当本文所述的一种或多种侧接序列未已存在于载体中时,它们可个别地加以获得并且连接至载体中。用于获得各侧接序列的方法为本领域技术人员所熟知。
[0248]
在已构建载体并且已将编码构成抗-c5抗体的轻链、重链或轻链和重链的核酸分子插入到载体的适当位点之后,所完成的载体可插入到适合的宿主细胞中以进行扩增和/或多肽表达。将抗-c5抗体的表达载体转化至所选宿主细胞中可通过熟知方法来达成,所述方法包括转染、感染、磷酸钙共沉淀、电穿孔、显微注射、脂质体转染、deae-葡聚糖介导的转染或其他已知技术。所选方法将部分地随待使用的宿主细胞的类型而变。这些方法和其他适合方法为熟练技术人员所熟知的,并且例如阐述于sambrook等,2001,同上中。
[0249]
当在适当条件下培养时,宿主细胞合成抗-c5抗体,其可随后自培养基收集(如果宿主细胞将它分泌至培养基中)或直接自产生它的宿主细胞收集(如果它未被分泌)。对适当宿主细胞的选择将取决于各种因素,如所需表达水平、合乎活性需要或为活性所必需的多肽修饰(如糖基化或磷酸化)和折叠成生物活性分子的容易性。宿主细胞可以是真核细胞或原核细胞。
[0250]
可用作表达宿主的哺乳动物细胞系为本领域已熟知的并且包括但不限于,可自美国典型培养物保藏中心(american type culture collection,atcc)获得的永生化细胞系,包括但不限于中国仓鼠卵巢(cho)细胞、hela细胞、幼小仓鼠肾(bhk)细胞、猴肾细胞
(cos)、人肝细胞癌细胞(例如,hep g2)以及许多其他细胞系。在某些实施方案中,可通过确定哪些细胞系具有高表达水平并且组成性产生具有c5结合性质的抗体来选择细胞系。在另一实施方案中,可选择来自b细胞谱系的不产生它的自身抗体,但能够制备并且分泌异源抗体的细胞系。
[0251]
出于诊断和治疗目的使用抗-c5抗体
[0252]
本公开的抗体适用于检测生物样品中的c5和/或c5b并且鉴定产生c5蛋白的细胞或组织。在一些实施方案中,本公开的抗-c5抗体可用于诊断测定,例如,检测和/或量化组织或细胞中表达的c5或者血清或组织中或细胞上的c5b的结合测定。
[0253]
在一些实施方案中,特异性结合c5的本公开的抗体可用于治疗有需要的患者的补体或c5介导性疾病。另外,本公开的抗-c5抗体可用于通过与其他补体蛋白形成复合物来抑制c5,从而调节细胞或组织内c5的生物活性。结合c5的抗体因此可调节和/或阻断与其他结合化合物的相互作用并且因此可具有缓解补体和c5介导性疾病的治疗用途。
[0254]
在一些实施方案中,通过抗-c5抗体结合c5可导致c5-介导性补体级联的破坏。
[0255]
诊断方法
[0256]
本公开的抗体可用于诊断目的以检测、诊断或监测与补体或c5相关联的疾病和/或病状。本公开提供了使用本领域技术人员已知的经典免疫组织学方法检测样品中c5的存在(例如,tijssen,1993,practice and theory of enzyme immunoassays,第15卷(r.h.burdon和p.h.van knippenberg编著,elsevier,amsterdam);zola,1987,monoclonal antibodies:a manual of techniques,第147-158页(crc press,inc.);jalkanen等,1985,j.cell.biol.101:976-985;jalkanen等,1987,j.cell biol.105:3087-3096)。可在体内或在体外对c5进行检测。
[0257]
本文提供的诊断应用包括使用抗体检测c5的表达。适用于检测c5的存在的方法的实例包括免疫测定,诸如酶联免疫吸附测定(elisa)和放射免疫测定(ria)。
[0258]
对于诊断应用,抗体通常可用可检测标记基团标记。适合的标记基团包括但不限于以下:放射性同位素或放射性核素(例如,3h、
14
c、
15
n、
35
s、
90
y、
99
tc、
111
in、
125
i、
131
i)、荧光基团(例如,fitc、若丹明、镧系元素磷光体)、酶基团(例如,辣根过氧化物酶、β-半乳糖苷酶、荧光素酶、碱性磷酸酶)、化学发光基团、生物素基团或由二级报道体识别的预定多肽表位(例如,亮氨酸拉链对序列、二级抗体的结合位点、金属结合结构域、表位标记)。在一些实施方案中,标记基团通过具有各种长度的间隔子臂使标记基团偶联到抗体,以降低潜在空间位阻。用于标记蛋白质的各种方法为本领域中已知的并且可用于实施本公开。
[0259]
本公开的一方面提供对表达c5的一种或多种细胞的鉴定。在一个特定实施方案中,所述抗体用标记基团标记并且检测标记的抗体与c5的结合。在另一个特定实施方案中,可在体内检测抗体与c5的结合。在另一个特定实施方案中,分离抗体/c5复合物并且使用本领域已知的技术进行测量。参见,例如,harlow和lane,1988,antibodies:a laboratory manual,new york:cold spring harbor(1991和定期增补版中编著);john e.coligan编著,1993,current protocols in immunology new york:john wiley&sons。
[0260]
本公开的另一方面提供对与本公开的抗-c5抗体竞争结合c5的测试分子的存在的检测。这种测定的实例将涉及在存在或不存在测试分子的情况下检测含有一定量的c5的溶液中的游离抗体的量。游离抗体(即,未结合于c5的抗体)的量的增加将指示测试分子能够
与抗-c5抗体竞争结合c5。在一个实施方案中,将抗体用标记基团标记。或者,标记测试分子且在存在和不存在抗体的情况下监测游离测试分子的量。
[0261]
适应症
[0262]
补体系统涉及促成急性和慢性病状,包括动脉粥样硬化、急性心肌梗死继发的缺血再灌注、henoch-schonlein紫癜性肾炎、免疫复合性血管炎、类风湿关节炎、动脉炎、动脉瘤、中风、心肌症、出血性休克、挤压伤、多器官功能衰竭、低血容量性休克和肠道缺血、移植排斥、心脏手术、ptca、自然流产、神经元损伤、脊髓损伤、重症肌无力、亨廷顿氏病、肌萎缩性侧索硬化、多发性硬化、guillain barre综合征、帕金森病、阿耳茨海默病、急性呼吸窘迫综合征、哮喘、慢性阻塞性肺病、输血相关性急性肺损伤、急性肺损伤、goodpasture氏病、心肌梗死、心肺分流术后炎症、心肺分流术、败血性休克、移植排斥、异种移植、烧伤、系统性红斑性狼疮、膜肾炎、berger氏病、牛皮癣、类天疱疮、皮肌炎、抗磷脂综合征、炎症性肠病、血液透析、白细胞分离法、血浆除去法、肝素诱导型体外膜式氧合ldl沉淀、体外膜式氧合以及黄斑变性。
[0263]
黄斑变性疾病(诸如所有阶段的年龄相关性黄斑变性(amd),包括干性和湿性(非渗出性和渗出性)形式)、脉络膜新生血管形成(cnv)、葡萄膜炎、糖尿病和其他缺血相关性视网膜病变以及其他眼内新生血管性疾病(诸如糖尿病性黄斑水肿)、病理性近视、vonhippel-lindau病、眼睛组织胞浆菌病、视网膜中央静脉阻塞(crvo)、角膜血管新生以及视网膜新生血管形成。一组补体相关眼睛病状包括年龄相关性黄斑变性(amd)(包括非渗出性(湿性)和渗出性(干性或萎缩性)amd)、脉络膜新生血管形成(cnv)、糖尿病性视网膜病(dr)以及内眼炎。
[0264]
目前公开的抗-c5抗体可与一种或多种细胞因子、淋巴因子、血细胞产生因子和/或抗炎剂组合使用。
[0265]
本文所述的疾病和病症的治疗可包括使用首选药物(治疗前、治疗后或同时治疗)与使用本文提供的一种或多种抗-c5抗体的治疗组合来控制疼痛和炎症。在一些情况下,所述药物被分类为非甾体抗炎药(nsaid)。二级治疗包括皮质激素、长效抗风湿药(saard)或疾病改善(dm)药。关于以下化合物的信息可见于the merck manual ofdiagnosis and therapy,第十六版,merck,sharp&dohme researchlaboratories,merck&co.,rahway,n.j.(1992)和pharmaprojects,pjbpublications ltd中。
[0266]
在一个特定实施方案中,本公开涉及使用抗体和任何一种或多种nsaid来治疗本文所述的疾病和病症。nsaid的抗炎作用至少部分归因于前列腺素合成的抑制(goodman和gilman,在“the pharmacological basis of therapeutics,”macmillan第7版(1985)中)。nsaid可被表征为至少九组:(1)水杨酸衍生物;(2)丙酸衍生物;(3)乙酸衍生物;(4)芬那酸衍生物;(5)羧酸衍生物;(6)丁酸衍生物;(7)昔康类;(8)吡唑类;以及(9)吡唑啉酮类。
[0267]
在另一个特定实施方案中,本公开涉及使用抗体(治疗前、治疗后或同时治疗)与一种或多种水杨酸衍生物、其前药酯或药学上可接受的盐中任一种的组合。此类水杨酸衍生物、其前药酯或药学上可接受的盐包括:醋氨沙洛、阿洛泼林(aloxiprin)、阿司匹灵、扑炎痛(benorylate)、溴水杨醇、乙酰水杨酸钙、三水杨酸胆碱镁、水杨酸镁、水杨酸胆碱、二氟尼柳(diflusinal)、依特柳酯(etersalate)、芬多沙(fendosal)、龙胆酸、水杨酸乙二醇酯、水杨酸咪唑、赖氨酸乙酰水杨酸酯、美沙拉嗪(mesalamine)、水杨吗啉、水杨酸1-萘酯、
奥沙拉秦(olsalazine)、帕沙米特(parsalmide)、乙酰水杨酸苯酯、水杨酸苯酯、醋水杨胺、水杨酰胺o-乙酸、双水杨酯、水杨酸钠以及柳氮磺胺吡啶。此组还意图涵盖具有类似镇痛和抗炎性质的结构相关水杨酸衍生物。
[0268]
在另外的特定实施方案中,本公开涉及使用抗体(治疗前、治疗后或同时治疗)与一种或多种丙酸衍生物、其前药酯或药学上可接受的盐中任一种的组合。丙酸衍生物、其前药酯和药学上可接受的盐包括:阿明洛芬、苯噁洛芬、布氯酸、卡洛芬(carprofen)、右吲哚洛芬、非诺洛芬、氟诺洛芬、氟洛芬(fluprofen)、氟比洛芬、呋洛芬、布洛芬、布洛芬铝、异丁普生、吲哚洛芬、异洛芬、酮洛芬、洛索洛芬、咪洛芬、萘普生、萘普生钠、噁丙嗪、吡酮洛芬、匹美洛芬(pimeprofen)、吡洛芬、普拉洛芬、丙替嗪酸、吡哆洛芬(pyridoxiprofen)、舒洛芬、噻洛芬酸以及硫噁洛芬。此组还意图涵盖具有类似镇痛和抗炎性质的结构相关丙酸衍生物。
[0269]
在又一个特定实施方案中,本公开涉及使用抗体(治疗前、治疗后或同时治疗)与一种或多种乙酸衍生物、其前药酯或药学上可接受的盐中任一种的组合。乙酸衍生物、其前药酯和药学上可接受的盐包括:阿西美辛(acemetacin)、阿氯芬酸、氨芬酸、丁苯羟酸、桂美辛(cinmetacin)、氯吡酸、地美辛、双氯芬酸钾、双氯芬酸钠、依托度酸、联苯乙酸、芬氯酸、苯克洛酸、芬克洛酸、芬替酸、呋罗芬酸、葡美辛、异丁芬酸、吲哚美辛、三苯唑酸、伊索克酸、氯那唑酸、甲嗪酸、奥沙美辛、奥昔平酸(oxpinac)、吡美辛、丙谷美辛、舒林酸、他美辛(talmetacin)、噻拉米特(tiaramide)、硫平酸(tiopinac)、托美丁、托美丁钠、齐多美辛以及佐美酸。此组还意图涵盖具有类似镇痛和抗炎性质的结构相关乙酸衍生物。
[0270]
在另一个特定实施方案中,本公开涉及使用抗体(治疗前、治疗后或同时治疗)与一种或多种芬那酸衍生物、其前药酯或药学上可接受的盐中任一种的组合。芬那酸衍生物、其前药酯和药学上可接受的盐包括:恩芬那酸、依托芬那酯、氟芬那酸、异尼辛、甲氯芬那酸、甲氯芬那酸钠、美多灭酸(meclofenamic acid)、甲芬那酸、尼氟酸、他尼氟酯、特罗芬那酯、托芬那酸以及乌芬那酯。此组还意图涵盖具有类似镇痛和抗炎性质的结构相关芬那酸衍生物。
[0271]
在另外的特定实施方案中,本公开涉及使用抗体(治疗前、治疗后或同时治疗)与一种或多种羧酸衍生物、其前药酯或药学上可接受的盐中任一种的组合。可使用的羧酸衍生物、其前药酯和药学上可接受的盐包括:环氯茚酸、二氟尼柳(diflunisal)、氟苯柳、伊诺立定(inoridine)、酮咯酸以及替诺立定。此组还意图涵盖具有类似镇痛和抗炎性质的结构相关羧酸衍生物。
[0272]
在又一个特定实施方案中,本公开涉及使用抗体(治疗前、治疗后或同时治疗)与一种或多种丁酸衍生物、其前药酯或药学上可接受的盐中任一种的组合。丁酸衍生物、其前药酯和药学上可接受的盐包括:布马地宗(bumadizon)、布替布芬、芬布芬以及联苯丁酸。此组还意图涵盖具有类似镇痛和抗炎性质的结构相关丁酸衍生物。
[0273]
在另一个特定实施方案中,本公开涉及使用抗体(治疗前、治疗后或同时治疗)与一种或多种昔康类、其前药酯或药学上可接受的盐中任一种的组合。昔康类、其前药酯和药学上可接受的盐包括:屈噁昔康、依诺利康、伊索昔康、吡罗昔康、舒多昔康、替诺昔康以及4-羟基-1,2-苯并噻嗪1,1-二氧化物4-(n-苯基)-甲酰胺。此组还意图涵盖具有类似镇痛和抗炎性质的结构相关昔康类。
[0274]
在又一个特定实施方案中,本公开涉及使用抗体(治疗前、治疗后或同时治疗)与一种或多种吡唑类、其前药酯或药学上可接受的盐中任一种的组合。可使用的吡唑类、其前药酯和药学上可接受的盐包括:二苯米唑和依匹唑。此组还意图涵盖具有类似镇痛和抗炎性质的结构相关吡唑类。
[0275]
在另外的特定实施方案中,本公开涉及使用抗体(治疗前、治疗后或同时治疗)与一种或多种吡唑啉酮类、其前药酯或药学上可接受的盐中任一种的组合。可使用的吡唑啉酮类、其前药酯和药学上可接受的盐包括:阿扎丙宗(apazone)、阿扎丙宗(azapropazone)、苄哌立隆、非普拉宗、莫非布宗、吗拉宗、羟基保泰松、保泰松、哌布宗、丙基非那宗(propylphenazone)、雷米那酮、琥布宗以及噻唑丁炎酮。此组还意图涵盖具有类似镇痛和抗炎性质的结构相关吡唑啉酮类。
[0276]
在另一个特定实施方案中,本公开涉及使用抗体(治疗前、治疗后或同时治疗)与一种或多种以下nsaid中任一种的组合:ε-乙酰氨基己酸、s-腺苷基-蛋氨酸、3-氨基-4-羟基丁酸、阿米西群(amixetrine)、阿尼扎芬、安曲非宁(antrafenine)、苄达酸、苄达赖氨酸酯、苄达明、双苯硫胺(beprozin)、溴哌莫(broperamole)、布可隆(bucolome)、丁苯唑酸、环丙喹宗、氯克西酯(cloximate)、达齐胺(dazidamine)、地波沙美(deboxamet)、地托咪定(detomidine)、联苯吡胺、difenpyramide、difisalamine、地他唑(ditazol)、依莫法宗(emorfazone)、甲磺酸法奈替唑(fanetizole mesylate)、芬氟咪唑、夫洛非宁、氟鲁咪唑、氟尼辛、氟丙喹宗、伏哌托宁(fopirtoline)、磷柳酸(fosfosal)、呱美柳(guaimesal)、guaiazolene、isonixirn、利非他明hcl(lefetamine hcl)、来氟米特(leflunomide)、罗非咪唑(lofemizole)、诺替法唑(lotifazole)、溶素氯尼辛(lysin clonixinate)、美西拉宗、萘丁美酮、尼克吲哚(nictindole)、尼美舒利、肝蛋白(orgotein)、奥帕诺辛(orpanoxin)、奥沙西罗(oxaceprol)、奥沙帕多(oxapadol)、瑞尼托林(paranyline)、哌立索唑(perisoxal)、柠檬酸哌立索唑、哌福肟(pifoxime)、piproxen、吡拉唑酸(pirazolac)、吡非尼酮、普罗喹宗、普罗沙唑、thielavin b、替氟咪唑、替美加定(timegadine)、甲苯酰吡咯乙酸(tolectin)、托帕朵、tryptamid以及由诸如以下各项的公司代码号指示的那些药物:480156s、aa861、ad1590、afp802、afp860、ai77b、ap504、au8001、bppc、bw540c、chinoin 127、cn100、eb382、el508、f1044、fk-506、gv3658、itf182、kcntei6090、kme4、la2851、mr714、mr897、my309、ono3144、pr823、pv102、pv108、r830、rs2131、scr152、sh440、sir133、spas510、sq27239、st281、sy6001、ta60、tai-901(4-苯甲酰基-1-茚满羧酸)、tvx2706、u60257、ur2301以及wy41770。此组还意图涵盖具有与nsaid类似的镇痛和抗炎性质的结构相关nsaid。
[0277]
在另一个特定实施方案中,本公开涉及使用抗体(治疗前、治疗后或同时治疗)与一种或多种皮质激素、其前药酯或药学上可接受的盐中任一种的组合,以用于治疗本文所述的疾病和病症,包括急性和慢性炎症,诸如风湿性疾病、移植物抗宿主疾病和多发性硬化。皮质激素、其前药酯和药学上可接受的盐包括氢化可的松和源自氢化可的松的化合物,诸如21-乙酰氧孕烯醇酮、阿氯米松(alclomerasone)、阿尔孕酮、安西缩松、倍氯米松、倍他米松、戊酸倍他米松、布地缩松、氯泼尼松、氯倍他索、丙酸氯倍他索、氯倍他松、丁酸氯倍他松、氯可托龙、氯泼尼醇、皮质脂酮、可的松、可的伐唑、醋噁唑龙(deflazacon)、地索奈德(desonide)、去羟米松(desoximerasone)、地塞米松、双氟拉松、二氟可龙、二氟泼尼酯
(difluprednate)、甘草次酸、氟扎可特、氟氯奈德、氟米松、氟米松特戊酸酯、醋酸氟轻松(flucinolone acetonide)、氟尼缩松、氟轻松醋酸酯(fluocinonide)、氟轻松醋酸酯(fluorocinolone acetonide)、氟可丁丁酯(fluocortin butyl)、氟可龙、氟可龙己酸、戊酸二氟可龙、氟米龙、醋酸氟培龙、醋酸氟泼尼定、氟泼尼龙、氟羟可舒松(flurandenolide)、醛基缩松、哈西缩松、卤米松、醋酸卤泼尼松、氢可松氨酯、氢化可的松、醋酸氢化可的松、丁酸氢化可的松、磷酸氢化可的松、氢化可的松21-琥珀酸钠、氢化可的松叔丁基乙酸酯、马泼尼酮、甲羟松、甲泼尼松、甲泼尼龙、莫米松糠酸酯、帕拉米松、泼尼卡酯、泼尼松龙、泼尼松龙21-二乙氨基乙酸(diedryaminoacetate)、泼尼松龙磷酸钠、泼尼松龙琥珀酸钠、泼尼松龙21-m-磺苯甲酸钠、泼尼松龙21-硬羟基乙酸钠、泼尼松龙叔丁乙酯、泼尼松龙21-三甲基乙酸酯、强的松、泼尼松龙戊酸酯(prednival)、泼尼立定(prednylidene)、泼尼立定21-二乙基氨基乙酸酯、替可的松(tixocortol)、曲安西龙(triamcinolone)、缩丙酮曲安西龙、苯曲安缩松以及己曲安缩松。此组还意图涵盖具有类似镇痛和抗炎性质的结构相关皮质激素类。
[0278]
在另一个特定实施方案中,本公开涉及使用抗体(治疗前、治疗后或同时治疗)与一种或多种长效抗风湿药(saard)或疾病改善抗风湿药(dmard)、其前药酯或药学上可接受的盐中任一种的组合,以用于治疗本文所述的疾病和病症,包括急性和慢性炎症,诸如风湿性疾病、移植物抗宿主疾病和多发性硬化。saard或dmard、其前药酯和药学上可接受的盐包括:阿洛酮钠、金诺芬、金硫葡糖、金硫醋苯胺、硫唑嘌呤、布喹那钠、布西拉明、3-金硫基-2-丙醇-1-磺酸钙、苯丁酸氮芥、氯醌醇、氯丁扎利(clobuzarit)、铜克索林(cuproxoline)、环磷酰胺、环孢霉素、氨苯砜(dapsone)、15-去氧精胍菌素、双醋瑞因(diacerein)、葡萄糖胺、金盐(例如,环喹金盐、硫代苹果酸金钠、硫代硫酸金钠)、羟氯喹、硫酸羟氯喹、羟基脲、酮保泰松、左咪唑、氯苯扎利、蜂毒素、6-巯基嘌呤、甲氨蝶呤、咪唑立宾、麦考酚酸酯、金硫乙酸(myoral)、氮芥、d-青霉胺、羟基吡啶咪唑类诸如sknf86002和sb203580、雷帕霉素、硫醇类、胸腺产生素以及长春新碱。此组还意图涵盖具有类似镇痛和抗炎性质的结构相关saard或dmard。
[0279]
在另一个特定实施方案中,本公开涉及使用抗体(治疗前、治疗后或同时治疗)与一种或多种cox2抑制剂、其前药酯或药学上可接受的盐中任一种的组合,以用于治疗本文所述的疾病和病症,包括急性和慢性炎症。cox2抑制剂、其前药酯或药学上可接受的盐的实例包括例如塞来昔布。此组还意图涵盖具有类似镇痛和抗炎性质的结构相关cox2抑制剂。cox-2选择性抑制剂的实例包括但不限于,依托昔布、伐地昔布、塞来昔布、利考非隆、卢米昔布、罗非昔布以及类似药物。
[0280]
在又一个特定实施方案中,本公开涉及使用抗体(治疗前、治疗后或同时治疗)与一种或多种抗微生物剂、其前药酯或药学上可接受的盐中任一种的组合,以用于治疗本文所述的疾病和病症,包括急性和慢性炎症。抗微生物剂包括例如大类别的青霉素类、头孢菌素类和其他β-内酰胺类、氨基糖苷类、唑类、喹诺酮类、大环内酯类、利福霉素类、四环素类、磺胺类、林可酰胺类以及多粘菌素类。青霉素类包括但不限于,青霉素g、青霉素v、甲氧西林、萘夫西林、苯唑西林、氯唑西林、双氯西林、氟氯西林、氨比西林/舒巴坦、阿莫西林、阿莫西林/克拉维酸盐、海他西林、环青霉素、巴卡西林、羧苄西林、卡茚西林、替卡西林、替卡西林/克拉维酸盐、阿洛西林、美洛西林、哌拉西林(peperacillin)以及美西林。头孢菌素类和
其他β-内酰胺包括但不限于,头孢噻吩、头孢匹林、头孢氨苄、头孢拉啶(cephradine)、头孢唑林、头孢羟氨苄、头孢克洛、头孢孟多、头孢替坦、头孢西丁、头孢呋辛(ceruroxime)、头孢尼西、头孢拉定(ceforadine)、头孢克肟、头孢噻肟、拉氧头孢、头孢唑肟、头孢曲松(cetriaxone)、头孢哌酮(cephoperazone)、头孢他啶、亚胺培南以及氨曲南。氨基糖苷类包括但不限于,链霉素、庆大霉素、妥布霉素、阿米卡星、奈替米星、卡那霉素以及新霉素。唑类包括但不限于氟康唑。喹诺酮类包括但不限于,萘啶酸、诺氟沙星、依诺沙星、环丙沙星、氧氟沙星、司帕沙星以及替马沙星。大环内酯类包括但不限于红霉素、螺旋霉素和阿奇霉素。利福霉素类包括但不限于利福平。四环素类包括但不限于,斯匹环素(spicycline)、金霉素、氯莫环素、地美环素、去氧土霉素、胍甲环素、赖甲环素、甲氯环素、美他环素(methacycline)、米诺环素、氧四环素、青哌环素、匹哌环素、罗利环素、山环素、琥珀酸氯霉素吡甲四环素(senociclin)以及四环素。磺胺类包括但不限于,磺胺、磺胺甲噁唑、乙酰磺胺、磺胺嘧啶、磺胺异噁唑以及磺胺甲基异恶唑(甲氧苄啶/磺胺甲噁唑)。林可酰胺类包括但不限于克林霉素和林可霉素。多粘菌素类(多肽)包括但不限于多粘菌素b和粘菌素。
[0281]
治疗方法:药物制剂、施用路径
[0282]
公开了包含治疗有效量的一种或多种本公开的抗体连同药学上可接受的稀释剂、载体、增溶剂、乳化剂、防腐剂和/或佐剂的组合物。此外,本公开提供了通过施用此类药物组合物治疗患者的方法。患者可以是人受试者或动物受试者。
[0283]
包含一种或多种抗-c5抗体的药物组合物可用于减小c5活性。包含一种或多种抗体的药物组合物可用于治疗与c5相关联的结果、症状和/或病理学。在不同实施方案中,包含一种或多种抗体的药物组合物可用在抑制补体途径的方法中。包含一种或多种抗体的药物组合物可用在治疗与c5相关联的结果、症状和/或病理学的方法中。包含一种或多种抗体的药物组合物可用在抑制mac产生的方法中。包含一种或多种抗体的药物组合物可用在抑制黄斑变性的方法中。
[0284]
各种可接受的配制物质在所用剂量和浓度下对接受者无毒。在特定实施方案中,提供包含治疗有效量的抗-c5抗体的药物组合物。
[0285]
在某些实施方案中,可接受的配制物质在所用剂量和浓度下对接受者无毒。在某些实施方案中,药物组合物可含有用于调节、维持或保持例如组合物的ph、摩尔渗透压浓度、粘度、澄清度、颜色、等张性、气味、无菌性、稳定性、溶解或释放速率、吸收或渗透的配制物质。在此类实施方案中,适合配制物质包括但不限于,氨基酸(诸如甘氨酸、谷氨酰胺、天冬酰胺、精氨酸或赖氨酸);抗微生物剂;抗氧化剂(诸如抗坏血酸、亚硫酸钠或亚硫酸氢钠);缓冲剂(诸如硼酸盐、碳酸氢盐、tris-hcl、柠檬酸盐、磷酸盐或其他有机酸);膨胀剂(诸如甘露糖醇或甘氨酸);螯合剂(诸如乙二胺四乙酸(edta));络合剂(诸如咖啡碱、聚乙烯吡咯烷酮、β-环糊精或羟丙基-β-环糊精);填充剂;单糖;双糖;以及其他碳水化合物(如葡萄糖、甘露糖或糊精);蛋白质(诸如血清白蛋白、明胶或免疫球蛋白);着色剂、调味剂和稀释剂;乳化剂;亲水性聚合物(诸如聚乙烯吡咯烷酮);低分子量多肽;成盐相对离子(诸如钠);防腐剂(诸如氯化苯甲烃铵、苯甲酸、水杨酸、硫柳汞、苯乙醇、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、氯己定、山梨酸或过氧化氢);溶剂(诸如甘油、丙二醇或聚乙二醇);糖醇(诸如甘露糖醇或山梨糖醇);混悬剂;表面活性剂或湿润剂(诸如普洛尼克(pluronic)、peg、脱水山梨醇酯、聚山梨醇酯(如聚山梨醇酯20、聚山梨醇酯)、氚核(triton)、氨丁三醇、卵磷
脂、胆固醇、泰洛沙泊(tyloxapal));稳定性增强剂(如蔗糖或山梨糖醇);张力增强剂(如碱金属卤化物(优选氯化钠或氯化钾)、甘露糖醇山梨糖醇);递送媒介物;稀释剂;赋形剂和/或药物佐剂。参见remington'spharmaceutical sciences,第18版,(a.r.genrmo编著),1990,mack publishing company。
[0286]
在某些实施方案中,最佳药物组合物将由本领域技术人员根据例如预定施用路径、递送形式和所需剂量来确定。参见例如remington's pharmaceutical sciences,同上。在某些实施方案中,此类组合物可影响本公开的抗体的物理状态、稳定性、体内释放速率以及体内清除速率。在某些实施方案中,药物组合物中的主要媒介物或载体在性质方面可以是水性或非水性。举例来说,适合媒介物或载体可以是注射用水、生理盐水溶液或人工脑脊液,可能补充有用于胃肠外施用的组合物中常见的其他物质。中性缓冲盐水或与血清白蛋白混合的盐水是其他示例性媒介物。在特定实施方案中,药物组合物包含约ph 7.0-8.5的tris缓冲液或约ph 4.0-5.5的乙酸盐缓冲液,并且可还包括山梨糖醇或其适合替代物。在本公开的某些实施方案中,可通过混合具有所需纯度的所选组合物与任选的配制剂(remington's pharmaceutical sciences,同上)来以冻干饼或水溶液形式制备c5抗体组合物以供储存。此外,在某些实施方案中,可使用适当赋形剂诸如蔗糖将c5抗体产物配制成冻干物。
[0287]
可选择本公开的药物组合物以用于胃肠外递送。或者,组合物可选择用来吸入或通过消化道递送,诸如口服。制备此类药学上可接受的组合物属于本领域的技能。
[0288]
制剂组分可以对于施用部位可接受的浓度存在。在某些实施方案中,缓冲剂用于将组合物维持在生理ph或略微较低ph下,通常在约5至约8的ph范围内。
[0289]
当预期胃肠外施用时,用于本公开中的治疗组合物可以于药学上可接受的媒介物中包含所需c5抗体的无热原、胃肠外可接受的水溶液形式提供。特别适于胃肠外注射的媒介物为c5抗体于其中被配制成适当防腐的无菌等张溶液的无菌蒸馏水。在某些实施方案中,制备可涉及用可提供可经由积存注射递送的产品的控制或持续释放的试剂,诸如可注射微球、生物蚀解性颗粒、聚合化合物(诸如聚乳酸或聚乙醇酸)、珠粒或脂质体配制所需分子。在某些实施方案中,也可使用具有提升在循环中的持续时间的作用的透明质酸。在某些实施方案中,可植入的药物递送装置可用于引入所需抗体。
[0290]
可配制用于吸入的本公开的药物组合物。在这些实施方案中,c5抗体被有利地配制成干燥可吸入粉末。在特定实施方案中,c5抗体吸入溶液也可与推进剂一起配制以用于气雾剂递送。在某些实施方案中,溶液可被雾化吸入。经肺施药和因此配制方法进一步描述于国际专利申请号pct/us94/001875中,所述申请以引用的方式并入本文,并且描述化学修饰蛋白质的经肺递送。也预期制剂可经口施用。以这个方式施用的c5抗体可与或不与惯常用于混配固体剂型诸如片剂和胶囊的载体一起配制。在某些实施方案中,胶囊可被设计为在于胃肠道中时释放制剂的活性部分,此时生物可用度最大,并且预先全身降解最小。可包括其他试剂以促进c5抗体吸收。也可采用稀释剂、调味剂、低熔点蜡、植物油、润滑剂、混悬剂、片剂崩解剂以及粘合剂。
[0291]
提供了本公开的药物组合物以包含有效量的一种或多种c5抗体与适于制造片剂的无毒赋形剂的混合物。通过将片剂溶解于无菌水或另一适当的媒介物中,可制备呈单位剂量形式的溶液。适合赋形剂包括但不限于,惰性稀释剂,诸如碳酸钙、碳酸钠或碳酸氢盐、
乳糖或磷酸钙;或粘合剂,如淀粉、明胶或阿拉伯胶(acacia);或润滑剂,如硬脂酸镁、硬脂酸或滑石。
[0292]
其他药物组合物将为本领域技术人员所显而易知,包括涉及呈持续或控制递送制剂形式的c5抗体的制剂。用于配制多种其他持续或控制递送装置,如脂质体载体、生物可腐蚀微粒或多孔珠粒和储槽注射液的技术也为本领域技术人员所知。参见例如国际专利申请号pct/us93/00829,其以引用的方式并入本文,并且描述用于递送药物组合物的多孔聚合微粒的控制释放。持续释放制剂可包括呈定形物品,例如薄膜或微胶囊形式的半透性聚合物基质。持续释放基质可包括聚酯、水凝胶、聚交酯(如美国专利号3,773,919和欧洲专利申请公布号ep 058481所公开的,所述专利各自以引用的方式并入本文)、l-谷氨酸与γ乙基-l-谷氨酸酯的共聚物(sidman等,1983,biopolymers 2:547-556)、聚(2-羟乙基-甲基丙烯酸酯(inethacrylate))(langer等,1981,j.biomed.mater.res.15:167-277和langer,1982,chem.tech.12:98-105)、乙烯乙酸乙烯酯(langer等,1981,同上)或聚-d(-)-3-羟基丁酸(欧洲专利申请公布号ep 133,988)。持续释放组合物也可包括可通过本领域中已知的若干方法中的任一种方法制备的脂质体。参见例如eppstein等,1985,proc.natl.acad.sci.u.s.a.82:3688-3692;欧洲专利申请公布号ep 036,676;ep 088,046和ep 143,949,所述文献均以引用的方式并入。
[0293]
通常以无菌制剂形式提供用于体内施用的药物组合物。灭菌可通过无菌过滤膜进行过滤来实现。当冻干组合物时,使用这个方法进行的灭菌可在冻干和重构之前或之后进行。用于胃肠外施药的组合物可以冻干形式或以溶液形式储存。胃肠外组合物通常放置入具有无菌入口的容器,例如具有可由皮下注射针刺穿的塞的静脉内溶液袋或小瓶中。
[0294]
一旦药物组合物已被配制,它可作为溶液、混悬液、凝胶剂、乳液、固体、晶体或作为脱水或冻干粉末储存在无菌小瓶中。此类制剂可以备用形式或以在施用之前重构的形式(例如冻干形式)储存。本公开还提供用于产生单剂量施药单位的试剂盒。本公开的试剂盒可各自含有具有干燥蛋白质的第一容器和具有水性制剂的第二容器两者。在本公开的某些实施方案中,提供含有单室和多室预填充注射器(例如液体注射器和冷冻注射器)的试剂盒。
[0295]
待采用的含有c5抗体的药物组合物的治疗有效量将例如取决于治疗情形和目标。本领域技术人员将了解,适用于治疗的剂量水平将部分地视递送的分子、使用c5抗体所针对的适应症、施药途径和患者的尺寸(体重、身体表面或器官尺寸)和/或状况(年龄和总体健康状况)而变化。在某些实施方案中,临床医师可滴定剂量并且改变施用途径以获得最佳治疗效应。根据上述因素,常用剂量的范围可为约0.1μg/kg至达到约30mg/kg或更高。在特定实施方案中,剂量的范围可为0.1μg/kg直至约30mg/kg,任选地1μg/kg直至约30mg/kg或10μg/kg直至约5mg/kg。
[0296]
给药频率将取决于所用制剂中的特定c5抗体的药物动力学参数。通常,临床医师施用组合物直至达到实现所需效应的剂量。因此,组合物可以单次剂量形式,或随时间以两次或更多次剂量(其可含有或可不含有相同量的所需分子)形式,或以通过植入装置或导管的连续输注形式施用。适当剂量的进一步细化由本领域普通技术人员按常规方式进行并且处于由其常规执行的任务范围内。适当的剂量可通过使用适当的剂量-反应数据来确定。在某些实施方案中,本公开的抗体可在整个延长时期期间向患者施用。本公开的抗体的长期
施用最小化通常与非完全人类抗体相关联的不良免疫反应或变态反应,所述抗体例如针对非人动物中的人抗原产生的抗体,例如在非人物种中产生的非完全人抗体或非人抗体。
[0297]
药物组合物的施用途径是依照已知方法,例如经口;通过由静脉内、腹膜内、脑内(实质内)、脑室内、肌肉内、眼内、玻璃体内、视网膜下、动脉内、门静脉内或病变内途径达成的注射;通过持续释放系统或通过植入装置。在某些实施方案中,组合物可通过快速浓注施用,或通过输注连续施用,或通过植入装置施用。
[0298]
所述药物组合物也可经由植入其上已吸收或囊封期望分子的膜、海绵或另一合适材料来局部施用。在某些实施方案中,当使用植入装置时,所述装置可植入到任何适合的组织或器官中,并且所要分子的递送可经由扩散、定时释放推注或连续施用来达成。对于眼部植入物,所述植入物可经由眼部注射、玻璃体内注射、视网膜下注射、脉络膜上腔注射、球后注射或注射到眼球囊下间隙来植入。
[0299]
也可合乎需要的是离体使用根据本公开的c5抗体药物组合物。在此类情况下,将已从患者中取出的细胞、组织或器官暴露于c5抗体药物组合物,然后再将所述细胞、组织和/或器官植入回患者中。
[0300]
特别地,可使用诸如本文所述的那些方法等方法通过植入某些已遗传工程改造为表达并分泌c5抗体的细胞来递送c5抗体。在某些实施方案中,此类细胞可以是动物细胞或人类细胞,并且可以是自体的、异体的或异种的。在某些实施方案中,细胞可以是永生化的。在其他实施方案中,为降低免疫反应的机会,可将所述细胞囊封以避免周围组织的浸润。在另外的实施方案中,囊封材料通常为允许蛋白产物释放但防止患者的免疫系统或来自周围组织的其他有害因素破坏细胞的生物兼容性、半透性聚合外套或膜。
[0301]
本说明书的主体内引用的所有参考文献均以引用的方式明确整体并入本文。
实施例
[0302]
仅出于说明的目的提供以下实施例(包括进行的实验和达成的结果)并且不欲解释为限制本公开。
[0303]
实施例1
–
免疫和杂交瘤形成
[0304]
对于杂交瘤和单克隆抗体的产生,基本上如下所述地进行免疫和筛选:antibodies,a laboratory mannual,cold spring harbor laboratory。对如本技术所述的抗-c5单克隆抗体的产生特异的程序简要描述如下:通过足垫注射使用75μg在完全弗氏佐剂中的人c5(目录号a403),接着在第28天通过使用具有不完全弗氏佐剂的75μg c5蛋白质进行腹膜内(i.p.)施用来依次进行第二次强化,从而免疫补体c5(jacksonbar harbor maine)缺陷型b10.d2-hcoh2dh2-t18c/02snj小鼠。在二次强化后9-10天进行用于针对c5蛋白的反应性的血清滴度的elisa筛选。对于初始组的融合物,在第82天、第83天和第84天用融合强化物(在pbs中的75μg c5,i.p.)免疫显示有利滴度的小鼠,其中在第85天脾脏使用标准技术融合到sp2/0小鼠骨髓瘤中。在第68天和第175天进一步免疫第二组小鼠,接着在第195天、第196天和第197天进行融合强化,其中在第198天进行融合。在融合后18天通过elisa筛选所有融合物孔针对c5蛋白的反应性并且使用标准技术亚克隆阳性杂交瘤,以允许衍生单克隆抗体。
[0305]
实施例2
–
杂交瘤培养
[0306]
在含有15%fetal clone ii、opi、hat、非必需氨基酸和重组小鼠il-6的dmem中维持杂交瘤。通过酶联免疫测定(elisa)筛选杂交瘤上清液,以检测抗人c5抗体。在含有15%fetal clone ii、opi和非必需氨基酸的dmem中扩增c5的阳性培养物,并且通过有效稀释亚克隆两次。根据制造商方案亚克隆杂交瘤与sba clonotyping system/hrp(southernbiotech)为同种型。
[0307]
实施例3
–
单克隆可变重链和轻链结构域的克隆和序列测定
[0308]
在重新进行rt-pcr扩增之后,克隆可变轻链(vl)和重链(vh)结构域。简言之,使用总rna分离试剂盒从选定的亚克隆杂交瘤细胞系分离总rna。使用第一链cdna合成试剂盒进行cdna合成。正向引物对于vl区和vh区的n末端氨基酸序列特异,并且lc和hc反向引物被设计为使恒定轻链结构域(cl)和恒定重链结构域1(ch1)中的区域退火。用于重新克隆的引物列出如下。分离扩增的vl或vh片段并且将其亚克隆到载体并且使用标准方法进行测序。
[0309][0310]
如下进行pcr:
[0311]
cdna 5μl
[0312]
10x pcr缓冲液5μl
[0313]
dntp 1μl
[0314]
引物混合物2.5μl
[0315]
聚合酶1μl
[0316]
dh2o 35.5μl
[0317]
总体积,50μl
[0318][0319]
实施例4
–
抗-c5抑制活性筛选(ch50溶血测定)
[0320]
通过在37℃下将抗rbc基质抗体孵育1小时(sigma aldrich,目录号s8014)接着洗涤来激发羊红血细胞(rbc)(innovative research ic100-0210)并且以5x108/ml的浓度使其重悬于gvb 缓冲液中,并存储在4℃下直到使用为止。对于溶血活性的分析,在人血清存在下在gvb 缓冲液中将rbc稀释至4.1x107/ml最终浓度,接着在37℃下孵育1小时。通过在4℃下以10,000x g沉淀未裂解rbc和细胞碎片并且经由监控541nm处的吸光度以测量上清液中释放的血红蛋白水平来确定溶血活性水平。在检查抗体功能活性的研究中,在4℃下将血清和抗体孵育20分钟,之后添加到红血细胞中。对于测试杂交瘤细胞培养上清液中的活性,在4℃下用1:1比率的gvb缓冲液中的3%nhs孵育上清液60分钟,之后添加到激发的rbc中。对照包含单独的血清(阳性对照)、dh2o(100%裂解物)和血清 edta 10mm(阴性对照)。对于替代途径的分析,使用gvb 10mm egta(boston bioproducts ibb-310)和c1q缺陷性人血清(quidel,a509)。在一些测定中,用羊红血细胞取代未激发的兔红血细胞(1x107)并且在含有0.5mm egta的gvb缓冲液(boston bioproducts ibb-310)存在下进行测定。
[0321]
图3为用于选定的许多筛选的克隆的溶血测定结果的图示。克隆5b201与5d7-5之间的黑线表示来自商购的小鼠单克隆抗体a239(quidel a239)的结果。从此线左侧的克隆表示显示更高/更好补体激活抑制(其导致细胞裂解)的抗体。特别感兴趣的一个亚克隆为10c9(以及后代,它具有名称10c9-x,其中x表示来自亲代的不同亚克隆数目)。
[0322]
实施例5
–
抗-c5抑制活性筛选(igm elisa测定)
[0323]
在4℃下用涂覆缓冲液ph 9.5中的2μg/ml人igm(bd-biosciences 51-2713kc)涂覆96-孔eia板(costar#3590)过夜。用洗涤缓冲液(bd-biosciences 51-9003739)洗涤板。将血清在gvb(bd-biosciences 51-2713kc)中稀释至2%并且与不同浓度的杂交瘤上清液或纯化的igg组合并在4℃下孵育20分钟。在孵育时段之后,将100ul血清/抗体混合物添加到洗涤的igm涂覆板中并且在37℃下孵育1小时。在孵育时段之后,将板用洗涤缓冲液洗涤三次并且然后在室温下用测定稀释液(bd-biosciences 51-2641kc)中以1:10.000稀释的抗-c5b-9小鼠单克隆抗体(quidel a239)孵育30分钟。在孵育后,将板洗涤三次并且然后用在测定稀释液中1:3000稀释的山羊抗小鼠hrp缀合物探测。将板孵育30分钟并且以洗涤缓冲液洗涤三次,并通过添加底物(bd-biosciences 51-2606kz和bd-biosciences 51-2607kz)接着在室温下孵育10分钟之后添加终止溶液(bd-biosciences 51-2608kz)来检测信号。然后通过读取在450nm处的吸收度来测定补体激活水平。
[0324]
图5a、图5b和图5c示出使用全血清进行的igm elisa的结果,其中所有补体途径均具有活性;使用c2缺陷型血清进行的igm elisa的结果,其中仅替代途径具有活性;以及使用因子b缺陷型血清进行的igm elisa的结果,其中经典途径和凝集素途径具有活性。针对c5(图5a-图5c中标记的抗-c5)的a239抗体(quidel a239)充当阴性对照。抗因子d抗体(图5a-图5c中标记的抗-fd)充当替代途径中的阳性对照比较物(图5b)。总之,10c9-19抗体在所有三种条件血清条件下同样良好地进行。
[0325]
实施例6
–
抗-c5 elisa
[0326]
在4℃下用涂覆缓冲液ph 9.5.(bd-biosciences 51-2713kc)中的1μg/ml人c5涂覆96-孔eia板(costar#3590)过夜。在几天后,洗涤板。用洗涤缓冲液(bd-biosciences 51-9003739)洗涤板,并且然后用测定稀释液封闭30分钟(bd-biosciences 51-2641kc)。然后在测定稀释液中稀释纯化的单克隆抗体或杂交瘤上清液并且将其添加到先前涂覆有c5的孔中,并且在室温下孵育60分钟。将板洗涤3次并且使用小鼠hpr缀合二级抗体和底物检测结合的单克隆抗体水平。通过测量在450nm处的吸光度来测定结合抗体的水平。图7为使用选定的单克隆抗体/杂交瘤上清液的c5结合的图示。
[0327]
实施例7
–
不溶性c5b-9测定的检测
[0328]
在4℃下用涂覆缓冲液ph 9.5.中的2μg/ml人igm igm(v)(bd-biosciences 51-2713kc)涂覆96-孔eia板(costar#3590)过夜。用洗涤缓冲液(bd-biosciences 51-9003739)洗涤板。将正常人血清在gvb(bd-biosciences 51-2713kc)中稀释至2%并且将100μl血清/gvb混合物添加到洗涤的igm涂覆的板中并在37℃下孵育1小时。在孵育时段之后,将板用洗涤缓冲液洗涤三次并且然后用在测定缓冲液中稀释至如附图所指示的浓度的抗-c5单克隆抗体孵育。在孵育后,将板洗涤三次并且然后用在测定稀释液中1:3000稀释的抗小鼠hrp缀合物二级抗体探测30分钟,接着用洗涤缓冲液洗涤三次。然后通过添加底物(bd-biosciences 51-2606kz和bd-biosciences 51-2607kz)接着在室温下孵育10分钟之后添加终止溶液(bd-biosciences 51-2608kz)来检测结合抗体。然后通过读取在450nm处的吸收度来测定补体激活水平。
[0329]
图10示出所述结果的图示。在筛选的单克隆抗体中,10c9-19r(r用于指示所使用的抗体为10c9-19克隆的重组版本)不结合于不溶性c5b9。这与以下假设一致:此抗体在并入mac之后并不识别或结合c5。
[0330]
实施例8
–
可溶性c5b-9的检测
[0331]
将胺反应尖端(ar2g)(18-5092)用于固定octet red 96中的抗体。在装料盘中,首先将ar2g尖端在ddh20中再水合10分钟。在开始octet方案后,然后将尖端转移到ddh20的次级水合溶液中60秒,以确定不存在异常读数。在再水合之后,在新鲜混合的20mm 1-乙基-3-[3-二甲基氨基丙基]碳二亚胺盐酸盐(edc)、10mm磺基-n-羟基硫代琥珀酰亚胺(s-nhs)中将所述尖端激活300秒。将结合至ar2g尖端的抗体以ph 5.0的10mm乙酸钠中稀释至20μg/ml。在ar2g尖端激活后,将它们置于抗体溶液中600秒。然后将所述尖端在ph 8.5的1m乙醇胺中淬火300秒。在淬火后,将所述尖端移入到kinetics缓冲液中120秒,以获得基线读数。将可溶性c5b-9(comptech,a127)以kinetics缓冲液(kb)稀释至30μg/ml。在基线后,将抗体结合尖端置于可溶性c5b-9溶液中300秒,以测量缔合。最后将所述尖端返回到kb溶液中,在所述溶液中基线已得到测量并且断开缔合步
骤已测量600秒。将缔合300秒时与基线偏离水平用作结合亲和力的指示。在96孔平底黑板中,所有使用的溶液均为每孔200μl体积(greiner bio-one,655209)。在1000rpm和30℃下进行octet方案。
[0332]
结果示出在图11a和图11b中。quidel a239抗体(图11a和图11b中标记的a239)当它结合于c5b-9(mac的一部分)时充当阳性对照。根据结果,正如预期,使用10c9-19r抗体观察到没有结合/极少的结合。这与以下假设一致:10c9(及其后代/亚克隆)不结合于可溶性c5b-9。
[0333]
实施例9
–
c5a产生测定
[0334]
在4℃下用涂覆缓冲液ph 9.5.中的2μg/ml人igm(bd-biosciences 51-2713kc)涂覆96-孔eia板(costar#3590)过夜。用洗涤缓冲液(bd-biosciences 51-9003739)洗涤板。在纯化的igg(抗-c5抗体)存在或不存在下将血清在gvb(bd-biosciences 51-2713kc)中稀释至10%并且在4℃下孵育20分钟。在孵育时段之后,将100μl血清/抗体混合物添加到洗涤的igm涂覆板中并在37℃下孵育1小时。在孵育之后,收集上清液。然后使用microvue c5a eia kit(quidel,目录号a021)测定上清液中的c5a水平。
[0335]
图6a、图6b和图6c示出测定的结果。图6a示出对于筛选的选定抗-c5抗体的上清液中的c5a水平。黑色水平线描绘了背景水平。如由图表中看出,一些抗体比阻断c5a形成中的其他抗体更好。图6b比较c5a形成中的10c9-19抗体。如由图表中看出,ms igg条件充当阳性对照并且“无cvf”(无眼镜蛇毒因子)对照充当无蛋白酶阴性对照。在5μg/ml浓度下,另一种抗-c5抗体8c7-26抑制c5a形成,但在0.05ug/ml浓度下并不抑制c5a形成。然而,10c9-19在5μg/ml浓度或在0.05ug/ml浓度下均不抑制c5a形成。
[0336]
实施例10
–
统计分析
[0337]
以下描述抑制百分比和其他统计分析如何在此实施例部分中包括的实验中进行。
[0338]
溶血测定:抑制%=1-((t-n)/(p-n))*100
[0339]
t为测试od(在测定期间释放的血红蛋白的水平)
[0340]
n=阴性对照od(在其中补体激活已通过将edta增加至10mm来阻断的条件下在测定内的血红蛋白释放)
[0341]
p=阳性对照od(当红细胞在血清存在下在抑制剂不存在下孵育时的血红蛋白释放,这表示100%活性)。
[0342]
z-因子:z-因子=1-((3*(dp-dn))/(abs(mp-mn))),其中dp为阳性对照的标准偏差,dn为阴性对照的标准偏差,mp为阳性对照的平均值,并且mn为阴性对照的平均值。
[0343]
曲线拟合(graphpad prism)ic90:y=y
最小
(y
最大-y
最小
)/(1 10
(ecx-x)*m)
),其中ecx为log ic90-(1/m)*log(90/(100-90))。
[0344]
实施例11
–
c5缺陷型小鼠的免疫
[0345]
c5缺陷型小鼠的免疫允许产生能够抑制补体介导的红血细胞裂解的杂交瘤细胞培养上清液,如通过ch50溶血测定确定的。通过选定杂交瘤的反应比使用常规商业上可获得的抗体时所见的反应大得多,如通过图3的黑线指示的。
[0346]
具有依次纯化的igg的初代杂交瘤的扩增和克隆允许通过滴定igg的浓度来分析阻断补体介导型细胞裂解中的功能和功效。获得对给定单克隆抗体抑制补体介导型细胞裂解的相对功效的更充分理解,如图4a和图4b中所示的。
[0347]
抗c5单克隆抗体的功能活性可基于用于抑制选定补体途径的功效来表征。抑制性抗体基于它们所抑制的特定抗体来选择,如图5a、图5b和图5c中所示的。
[0348]
阻断细胞裂解可通过防止膜攻击复合物组装或通过经由c5转化酶阻断c5转化成c5b来发生。进一步表征允许检查抑制机制,即在抑制试剂破坏c5的蛋白水解切割从而导致c5b产生并且破坏c5b-9复合物的组装或者仅阻断c5b-9复合物的组装而不阻断c5a的产生的情况下。在后一种情况下,阻断转化酶活性的抑制剂的鉴定通过检查必须为c5b产生中的产物的c5a的产生来鉴定。这通过检查单点测定或者通过滴定抗体来实现,如图6a、图6b和图6b中所示。
[0349]
c5的单克隆抗体的特异性通过检查它与直接涂覆在elisa板上的c5的相互作用剂量依赖性相互作用,如图7所示。
[0350]
进一步表征可通过使用生物层干涉测量法(bli)研究单克隆抗体的亲和力以鉴定单克隆抗体的kd值和相对亲和力来发生,如图8所示。另外的表征通过研究单克隆抗体与溶液中c5蛋白的结合性来获得,如图9所示。
[0351]
实施例12
–
c5抗体的选择
[0352]
一个优选的实施方案为对于一旦并入膜攻击复合物就不识别c5的抗体的选择。根据当在用igm进行补体激活之后沉积到elisa板底部时识别c5b-9复合物内的c5的能力检查单克隆抗体,如图10所示。
[0353]
与c5b-9内的c5的其他交叉反应性通过使用生物层干涉测量法(bli)检查单克隆抗体结合可溶性c5b-9的能力并且测定偏离水平来鉴定,如图11所示。
[0354]
实施例13
–
人源化抗体的产生
[0355]
选择前导抗体并对其进行人源化。将严格内容优化(string content optimization)的人源化方法(lazar等,us7657380b2,2010年2月2日授权;us7930107b2,2011年4月19日授权;us20060008883a1,2004年12月3日提交;us20080167449a1,2007年10月31日提交;us20110236969a1,2011年3月21日提交;us20100190247a1,2012年3月12日提交,所有专利均以引用的方式整体并入)应用于小鼠10c9抗体。选定的人源化序列列出在seq id no:1-12和表2中。
[0356]
使用标准技术,产生igg。在图12a、图12b和图12c中示出使用以上实施例6所述的elisa测定获得的全长抗体的抑制百分比。另外,使用标准技术产生fab片段并且使用实施例6所述的elisa测定知道,它们的活性类似于亲代分子的活性。在图13a、图13b和图13c中示出所述结果的图示。
[0357]
实施例14
–
使用c5抗体预防c5b-9在视网膜和脉络膜组织中的沉积
[0358]
另外,化合物通过玻璃体内递送产生的阻断视网膜和脉络膜组织中的c5b-9形成的治疗可能性可通过使用导致感兴趣的组织中的补体激活的标准模型来评定,如al-78898a inhibits complement deposition in a primate light damage model,arvo ab a387 2012中所提供的。由小鼠单克隆抗体亚克隆10c9人源化产生人源化h5l2(分别为seq id no:10和seq id no:2)抗体。在非人灵长类轻度损伤模型中测试h5l2。h5l2抗体的玻璃体内给药提供阻断视网膜内补体沉积的功效,这比得上阴性对照(pbs,无轻度损伤,标记为“pbs no bl”)。还使用具有轻度损伤的pbs的阳性对照(标记为“pbs”)。在图14a(视网膜)和图14b(脉络膜)中示出所述结果的图示。这些数据表明h5l2抗体的局部递送在与黄斑变性
和其他眼部适应症的治疗的体内模型中是有效的。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。