1.本发明属于微生物检测和生物实验技术领域,尤其涉及一种检测外源微生物进入体内后动态分布(空间及时间分布)的方法及其用途。
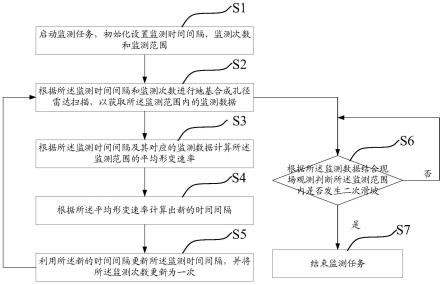
背景技术:
2.人和动物体内存在着大量的微生物群落,无论是胃肠道、呼吸道等内脏器官,还是鼻腔、口腔、尿道等对外腔道,其内部都有大量微生物的定殖,并且,这些微生物在生物体的生长代谢过程中发挥着巨大的作用,如参与食物的消化和营养的摄取、调节机体代谢、促进免疫系统的驯化、保障皮肤和粘膜系统屏障功能的完整性、防止病原体对宿主的定殖和入侵等。而且,在生物体生长发育过程中,始终伴随着外源微生物的入侵,外源微生物通过不同方式进入机体内部,对肠道菌群、呼吸道菌群、口腔菌群等造成重要的影响。
3.研究证实,外源微生物可通过饮食、呼吸、伤口以及皮肤等媒介进入机体内部,并且,现在已有一些方法能够观测到这些外源微生物进入体内后的分布情况,但是,现行方法中,绝大部分都是基于活体成像系统对生物活体进行观察,只能相对大范围地观察外源微生物在体内的大致分布位置,并不能针对具体的组织器官或体液进行外源微生物检测,而且,其观测对象大多限于通过饮食方式进入机体肠道内的外源微生物,极少对通过其他方式定殖或存在于其他器官或体液内的外源微生物进行观察和检测,因此,很难满足对外源微生物体内分布进行精确检测的应用需求。
技术实现要素:
4.为了克服活体成像方法检测外源微生物体内分布时具有的上述缺陷,本发明提供了一种解决方案。本发明方法采用荧光蛋白基因标记目标菌株与荧光显微镜合并使用的方式对外源微生物进入动物体内后的动态分布情况进行检测,由于本方法针对离体器官、组织和体液进行外源微生物检测,因此能够更精确地检测外源微生物进入动物体内后的动态分布状态,包括分布空间以及分布时间,相比活体成像检测方法,本方法的检测准确性和精密度都得到了显著提高,而且本方法不受接种方式的限制,灌胃与注射接种方式均适用,检测部位也不仅限于胃肠道,适用于各类器官与组织中的外源微生物检测,因此,大大拓宽了体内微生物检测方法的适用范围。
5.具体而言,本发明提供了一种检测外源微生物进入体内后动态分布的方法,该方法在确定目标菌株稳定表达后,将经荧光蛋白基因标记的目标菌株以不同方式接种到实验动物体内,采集实验动物的体内组织和体液样本,经生理盐水溶解处理后,在荧光显微镜下观察,获得该目标菌株在实验动物体内的动态分布结果。
6.进一步地,本发明检测外源微生物进入体内后动态分布的方法包括下述步骤:
7.(1)荧光蛋白基因标记目标菌株培养及荧光蛋白基因激活
8.采用与目标菌株相匹配的液体培养基培养经荧光蛋白基因标记的目标菌株,37℃过夜,过夜后的培养液以2%培养基体积分数重新接种到新的上述培养基中,37℃培养2h,
向其中添加与上述目标菌株种类及培养液量相匹配的诱导剂,37℃培养3h,取所得培养液进行荧光显微镜观察,以确定荧光蛋白基因标记的有效性;
9.(2)荧光蛋白基因标记目标菌株菌液的制备
10.上步所得培养液经1000r/min离心3-10min,收集沉淀,30-50倍量生理盐水悬浮,重复离心收集沉淀三次,混合生理盐水悬浮液,紫外分光光度计检测混合生理盐水悬浮液的吸光度,即得到目标菌株菌液;
11.(3)动物实验
12.将实验动物分为两组,分别采取灌胃和皮下注射的方式给予上述目标菌株菌液,给液量为该目标菌株针对该种实验动物的实验室常规给予量,每周给液一次,连续给液三周,第三次给液后三天采集实验动物的体内组织和体液样本;
13.(4)体内组织样本的处理
14.对上述体内组织样本进行破碎裂解处理后用10-20倍量生理盐水溶解, 1000r/min离心3-5min,收集上清液;
15.(5)结果检测
16.对上步所得上清液进行荧光显微镜拍摄,获得该目标菌株在实验动物体内的动态分布结果。
17.作为一种优选,本发明方法中的标记基因为含有荧光基因的质粒,所述经荧光蛋白基因标记的目标菌株为含有荧光基因的质粒的宿主。
18.此外,本发明还涉及上述检测外源微生物进入体内后动态分布的方法在体内微生物示踪技术中的用途。
19.以及,上述检测外源微生物进入体内后动态分布的方法在微生物药物制剂开发中的用途。
20.综上,本发明提供了一种检测外源微生物进入体内后动态分布的方法,利用本方法对离体器官、组织和体液进行外源微生物检测,能够更精确地检测外源微生物进入动物体内后的动态分布状态,包括分布空间以及分布时间(空间上,不同接种方式均可从接种部位扩散并定殖至动物体内各组织与体液中;时间上,接种目标菌株后,随时间变化目标菌株会在体内发生扩散,扩散并定殖在动物体内各组织与体液中),相比活体成像检测方法,本方法具有检测准确性好、精密度高、接种方式灵活、检测部位多、适用范围广等优点。
附图说明
21.为了更清楚地说明本发明实施例的技术方案,下面对本发明实施例中需要使用的附图作简要介绍,显而易见地,下述附图仅是本发明中记载的一些实施例,对于本领域技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
22.图1为荧光蛋白基因标记大肠杆菌有效性荧光显微镜观察图。
23.图2为小鼠灌胃接种大肠杆菌后,血液样本荧光显微镜观察图。
24.图3为小鼠灌胃接种大肠杆菌后,肠道样本荧光显微镜观察图。
25.图4为小鼠皮下注射接种大肠杆菌后,血液样本荧光显微镜观察图。
26.图5为小鼠皮下注射接种大肠杆菌后,肠道样本荧光显微镜观察图。
27.图6为pet-28a-mcherry质粒图谱。
具体实施方式
28.为使本发明的目的、技术方案和优点更加清楚,下面将结合具体实施例及相应的附图对本发明的技术方案进行清楚、完整地描述。显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例,本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
29.同时,应理解,本发明的保护范围并不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。
30.当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术术语与本领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本领域技术人员对现有技术的掌握及本发明的记载,还可使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
31.在本发明中,若非特指,所有的份、百分比均为重量单位,若无特别说明,所有的仪器和试剂均可从商业途径得到或是本行业常用的。下述实施例中的实验方法和操作,如无特别说明,均为本领域的常规实验方法和操作。
32.实施例1:pet-28a-mcherry基因表达蛋白的有效性评价(参见图1和图6)
33.(一)试剂、材料、仪器
34.诱导剂:iptg诱导剂,购自索莱宝公司。
35.培养基:即用型lb液体培养基(卡那抗生素),购自上海雅酶生物科技有限公司。
36.荧光蛋白基因标记目标菌株:抗卡那霉素pet-28a-mcherry基因标记大肠杆菌,购自北京百欧博伟生物技术有限公司,质粒大小为6046bp,培养温度 37℃。
37.荧光显微镜:基恩士有限公司bz-x系列一体化荧光显微镜成像系统。
38.(二)实验方法
39.将甘油保存大肠杆菌从-80℃冰箱中取出解冻,在超净台中将解冻好的大肠杆菌30μl接种到lb液体培养基3ml中,37℃恒温培养箱中培养过夜。取 60μl过夜后的培养液在超净台中以2%培养基体积分数加入到新lb培养基中, 37℃恒温培养2h后,向其中加入0.1mmol/l的iptg诱导剂2μl,继续37℃恒温培养3h。培养结束后采集样本荧光显微镜下观察,结果如图1所示。
40.图1中左图为明场下拍摄的大肠杆菌照片,能够清晰看到大肠杆菌的杆状形态;中图为暗场下拍摄的大肠杆菌荧光照片,可以看到红色荧光点,符合 m-cherry荧光颜色特征;右图是将明暗场照片结合后得到的重叠图,能够清楚地看到大肠杆菌结构及荧光点,并且能够观察到荧光点的位置均在大肠杆菌短杆结构内,表明大肠杆菌内部m-cherry荧光蛋白稳定表达,可作为下一步实验所需菌液。
41.实施例2:一种检测外源微生物进入动物体内后动态分布的方法(参见图2-5)
42.(一)试剂、材料、仪器
43.诱导剂:iptg诱导剂,购自索莱宝公司。
44.培养基:即用型lb液体培养基(卡那抗生素),购自上海雅酶生物科技有限公司。
45.荧光蛋白基因标记目标菌株:抗卡那霉素pet-28a-mcherry基因标记大肠杆菌,购自北京百欧博伟生物技术有限公司,质粒大小为6046bp,培养温度 37℃。
46.荧光显微镜:基恩士有限公司bz-x系列一体化荧光显微镜成像系统。
47.(二)实验动物
48.实验用小鼠为8周龄雌性无特定病原体(spf)级昆明种小鼠,购自成都达硕实验动物有限公司。每笼饲养3只小鼠,在恒温23℃
±
2℃,暗/光周期为 12h的环境中,自由饮食,所用饲料购自苏州双狮实验动物饲料科技有限公司,普通饮食适应2周后进行实验。
49.(三)实验方法
50.(1)荧光蛋白基因标记大肠杆菌培养及荧光蛋白基因激活
51.采用lb液体培养基3ml培养经荧光蛋白基因标记的大肠杆菌30μl,37℃过夜,取60μl过夜后的培养液以2%培养基体积分数重新接种到新的lb培养基中,37℃恒温培养2h后,向其中加入0.1mmol/l的iptg诱导剂2μl,继续 37℃恒温培养3h。培养结束后采集样本荧光显微镜下观察,以确定荧光蛋白基因标记的有效性。
52.(2)荧光蛋白基因标记大肠杆菌菌液的制备
53.上步所得培养液经1000r/min离心5min,收集沉淀,30倍量生理盐水悬浮,重复离心收集沉淀三次,混合生理盐水悬浮液,紫外分光光度计检测混合生理盐水悬浮液的吸光度,即得到大肠杆菌菌液。
54.(3)动物实验
55.将实验动物分为两组,分别采取灌胃和皮下注射的方式给予上述大肠杆菌菌液,给液量为每12只昆明小鼠(体重为35
±
1g)给予含有108-109cfu大肠杆菌的菌液,各小鼠平均给液,每只小鼠灌胃或皮下注射菌液200μl,每周给液一次,连续给液三周,第三次给液后三天采集实验小鼠的血液和肠道样本。
56.(4)样本的处理
57.将上述肠道样本用液氮速冻后研磨碾碎,然后用20倍量生理盐水溶解, 1000r/min离心5min,收集上清液。
58.(5)结果检测
59.对上步所得上清液进行荧光显微镜拍摄,获得大肠杆菌在小鼠体内的动态分布结果。
60.在两种不同接种方式中,在荧光显微镜下,通过观察荧光显微镜拍摄的图像(参见图2-5),能够在血液及肠道样本中观察到荧光蛋白基因标记大肠杆菌荧光蛋白的表达结果,表现为红色荧光的存在,同时,在对照组实验中,无法观测到红色荧光,证明上述两种接种方式均能够通过不同运输途径分布到血液及肠道中。在小鼠接种荧光蛋白基因标记大肠杆菌后,在空间上,皮下注射和灌胃两种接种方式中,目标菌株发生动态扩散过程,均扩散到血液及肠道中;在时间上,在连续三周接种目标菌株后的第三天,目标菌株就能够在小鼠血液及肠道中检测到。
61.(6)结论
62.根据本实施例所涉及的检测外源微生物进入动物体内后动态分布的方法,因为成功培养并激活荧光蛋白基因标记大肠杆菌的传代与表达,在以不同方式接种入体内后,样本的荧光显微镜观察图能够明确看到在血液及肠道中,均存在荧光标记的大肠杆菌,所以
能够确定大肠杆菌通过不同接种方式都能够分布到血液及肠道中,空间上表明外源微生物能够从皮下及胃肠道扩散至血液及组织,时间上表明在接种外源微生物后随时间变化可扩散至体内血液及组织中。
63.以上所述仅为本发明的实施例而已,并不用于限制本发明。对于本领域技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原理之内所作的任何修改、替换等,均应包含在本发明的权利要求保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。