1.本发明涉及sers检测技术领域,具体涉及一种纳米农药拉曼探针、制备方法及其应用。
背景技术:
2.表面增强拉曼散射(surface-enhanced raman scattering,sers)极大地提高了拉曼光谱的检测灵敏度,可以通过独特的分子振动指纹,进行定性和定量分析超衡量水平的样品。随着纳米材料技术的发展,拉曼光谱应用越来越广发。目前为止,sers已经广泛应用于农药检测、生物分子、食品安全、分子成像、癌细胞识别等领域。sers具有检测速度快和灵敏度高等优点,在农药残留检测中的应用也越发广泛,近年来有许多sers应用于农残检测的报道。在农业中,将纳米材料作为载体负载农药,可以保护农药免受恶劣环境的影响,并起到缓释农药和将农药输送到指定的位点的作用,在提高农药化学稳定性的同时降低了农药的流失,从而提高农药的功效、减少农药的使用量并且降低环境的负担。
3.纳米颗粒在植物体内的吸收和转运是一个复杂的过程,目前国内外还没有公开用sers检测负载农药的纳米金二氧化硅拉曼探针,追踪纳米农药在植物体内的渗透的相关技术。因此,提出一种纳米农药拉曼探针、制备方法及其应用。
技术实现要素:
4.本发明所要解决的技术问题在于:如何为农药制剂的研发和纳米农药与植物互作机理研究提供帮助,提供了一种纳米农药拉曼探针制备方法。
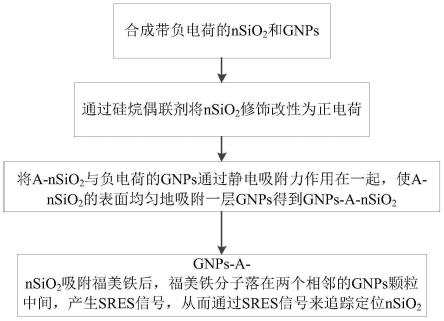
5.如图1所示,本发明是通过以下技术方案解决上述技术问题的,本发明包括以下步骤:
6.s11:合成带负电荷的nsio2和gnps;
7.s12:通过硅烷偶联剂将nsio2修饰改性为正电荷,即得到a-nsio2;
8.s13:将a-nsio2与负电荷的gnps通过静电吸附力作用在一起,使a-nsio2的表面均匀地吸附一层gnps得到gnps-a-nsio2;
9.s14:gnps-a-nsio2吸附福美铁后,福美铁分子落在两个相邻的gnps颗粒中间,产生sres信号,从而通过sres信号来追踪定位nsio2。
10.更进一步地,在所述步骤s1中,nsio2的粒径包括50nm、100nm、150nm,不同粒径nsio2的合成过程如下:
11.50nm nsio2合成:依次在烧杯中加入50ml无水乙醇、1ml 1680ppm单水氢氧化锂、2ml氨水、1ml teos,室温下搅拌6h,反应完成后用去离子水离心洗涤3遍,于60℃干燥过夜得到50nm的实心nsio2;
12.100nm nsio2合成:依次在烧杯中加入50ml无水乙醇、1ml 1680ppm单水氢氧化锂、2.5ml氨水、1ml teos,室温下搅拌6h,反应完成后用去离子水离心洗涤3遍,于60℃干燥过夜得到100nm的实心nsio2;
13.150nm nsio2合成:依次在烧杯中加入50ml无水乙醇、1ml 2100ppm单水氢氧化锂、3ml氨水、1ml teos,室温下搅拌6h,反应完成后用去离子水离心洗涤3遍,于60℃干燥过夜得到150nm的实心nsio2。
14.更进一步地,在所述步骤s11中,gnps的合成过程为:在振动搅拌的条件下,于98.9ml超纯水中加入1ml柠檬酸盐溶液,在加热台上加热,添加100μl氯金酸溶液,在冰上冷却后得到直径为15nm的gnps颗粒。
15.更进一步地,在所述步骤s12中,通过硅烷偶联剂将nsio2修饰改性为正电荷的方式为:称5mg不同粒径的nsio2超声分散于50ml乙醇中,加入50μl aptms,于设定温度条件下油浴中加热回流设定时长,各溶液反应完成后用去离子水和乙醇各离心洗涤2遍,后于40℃干燥过夜分别得到不同粒径的a-nsio2;将不同粒径的a-nsio2分散于去离子水中,用粒径仪测定zeta电位和粒径。
16.更进一步地,在所述步骤s13中,得到gnps-a-nsio2的具体过程为:取5mg a-nsio2超声分散于2ml乙醇,逐滴滴入不断搅拌的20ml的15nm gnps溶液中,滴加完成后搅拌2h,于14000r/min条件下离心10min,用去离子水离心洗涤3遍,分散于300μl去离子水中,得到不同粒径的gnps-a-nsio2。
17.更进一步地,在所述步骤s14中,gnps-a-nsio2吸附福美铁的具体过程为:准确称取2.5mg福美铁标品,用去离子水于50ml容量瓶定容,得到50ppm福美铁溶液;取1ml gnps-a-nsio2和1ml福美铁溶液于恒温振荡器振摇2h,得到负载福美铁的纳米金二氧化硅拉曼探针。
18.本发明还提供了一种纳米农药拉曼探针,采用上述的纳米农药拉曼探针制备方法制备而得。
19.本发明还提供了一种纳米农药拉曼探针的应用,利用sers检测上述的拉曼探针在茶树体内的信号,进而测定纳米农药在植物体内的渗透情况,具体应用步骤如下:
20.s21:将合成的gnps和gnps-a-nsio2负载福美铁后滴加在茶树叶片和根部,进行拉曼测试,并设置多个采集时间采集拉曼扫描光谱;
21.s22:将20μl不同粒径的负载福美铁的纳米金二氧化硅拉曼探针溶液分别滴加在活体茶树嫩叶和老叶的上表面及下表面,在室温下等待1h后完全干燥,记为0h;分别原位测定负载福美铁的纳米金二氧化硅拉曼探针溶液滴加在茶树叶片上下表面0h二维表面信号和0、1、2、3、4、5h后在茶树叶片上的二维深层信号,观察其在茶树叶片的渗透情况;
22.s23:将茶树新生根活体放入200μl不同尺寸的负载福美铁的纳米金二氧化硅拉曼探针溶液中,在0、1、2、3、4、5h分别取相同部位根,冷冻干燥48h后,测定茶树根部0、1、2、3、4、5h的二维深层信号,观察其在茶树根部的渗透;
23.s24:拍摄步骤s22中测定前和测定5h后的茶树叶片显微图像;将20μl 100nm的负载福美铁的纳米金二氧化硅拉曼探针溶液滴加在活体茶树嫩叶的下表面,并在室温下等待1h后完全干燥,记为0h,测定5h后在茶树叶片上的二维深层信号,观察其在茶树叶片的渗透;将20μl 100nm的定负载福美铁的纳米金二氧化硅拉曼探针溶液滴加在活体茶树嫩叶的下表面,并在室温下等待1h后完全干燥,记为0h,在5h后洗去表面的纳米探针溶液后测定在茶树叶片上的二维深层信号,观察其在茶树叶片的渗透。
24.更进一步地,在所述步骤s22中,嫩叶为第一叶,老叶为第三叶。
25.本发明相比现有技术具有以下优点:该纳米农药拉曼探针、制备方法及应用,可以利用sers检测此拉曼探针在茶树体内的信号,从而原位无损地测定纳米农药在植物体内的渗透。为后续的农药制剂的研发和纳米农药与植物互作机理研究提供帮助和新的思路,值得被推广使用。
附图说明
26.图1是本发明纳米农药拉曼探针制备方法的流程示意图;
27.图2a是本发明实施例中50nm的nsio
2 tem图;
28.图2b是本发明实施例中100nm的nsio
2 tem图;
29.图2c是本发明实施例中150nm的nsio
2 tem图;
30.图3a是本发明实施例中50nm的gnps-a-nsio
2 tem图;
31.图3b是本发明实施例中100nm的gnps-a-nsio
2 tem图;
32.图3c是本发明实施例中150nm的gnps-a-nsio
2 tem图;
33.图4a是本发明实施例中14000r/min,10min离心3次前gnps-a-nsio2粒径分布图;
34.图4b是本发明实施例中14000r/min,10min离心3次后gnps-a-nsio2粒径分布图;
35.图5a是本发明实施例中15nm gnps与商业合成15nm aunps对福美铁增强的对比拉曼光谱图;
36.图5b是本发明实施例中15nm gnps与不同尺寸的gnps-a-nsio2对福美铁增强的对比拉曼光谱图;
37.图6a是本发明实施例中50nm的gnps-a-nsio2在金板、茶树叶片和茶树根对福美铁增强的对比拉曼光谱图;
38.图6b是本发明实施例中100nm的gnps-a-nsio2在金板、茶树叶片和茶树根对福美铁增强的对比拉曼光谱图;
39.图6c是本发明实施例中150nm的gnps-a-nsio2在金板、茶树叶片和茶树根对福美铁增强的对比拉曼光谱图;
40.图7a是本发明实施例中50nm、100nm和150nm的gnps-a-nsio2在茶树叶片对福美铁增强的对比拉曼光谱图;
41.图7b是本发明实施例中为50nm、100nm和150nm的gnps-a-nsio2在茶树根部对福美铁增强的对比拉曼光谱图;
42.图8是本发明实施例中不同采集时间下ferbam@gnps-a-nsio2在茶树叶片的拉曼光谱图;
43.图9a1是本发明实施例中50nm的ferbam@gnps-a-nsio2在茶树嫩叶上表面的0h二维表面信号图和0、1、2、3、4、5h的二维深层信号图(a点为二维深层扫描所选点);
44.图9a2是本发明实施例中50nm的ferbam@gnps-a-nsio2在茶树嫩叶下表面的0h二维表面信号图和0、1、2、3、4、5h的二维深层信号图(a点为二维深层扫描所选点);
45.图9a3是本发明实施例中50nm的ferbam@gnps-a-nsio2在老叶上表面的0h二维表面信号图和0、1、2、3、4、5h的二维深层信号图(a点为二维深层扫描所选点);
46.图9a4是本发明实施例中50nm的ferbam@gnps-a-nsio2在老叶下表面的0h二维表面信号图和0、1、2、3、4、5h的二维深层信号图(a点为二维深层扫描所选点);
47.图9b1是本发明实施例中100nm的ferbam@gnps-a-nsio2在茶树嫩叶上表面的0h二维表面信号图和0、1、2、3、4、5h的二维深层信号图(a点为二维深层扫描所选点);
48.图9b2是本发明实施例中100nm的ferbam@gnps-a-nsio2在茶树嫩叶下表面的0h二维表面信号图和0、1、2、3、4、5h的二维深层信号图(a点为二维深层扫描所选点);
49.图9b3是本发明实施例中100nm的ferbam@gnps-a-nsio2在老叶上表面的0h二维表面信号图和0、1、2、3、4、5h的二维深层信号图(a点为二维深层扫描所选点);
50.图9b4是本发明实施例中100nm的ferbam@gnps-a-nsio2在老叶下表面的0h二维表面信号图和0、1、2、3、4、5h的二维深层信号图(a点为二维深层扫描所选点);
51.图9c1是本发明实施例中150nm的ferbam@gnps-a-nsio2在茶树嫩叶上表面的0h二维表面信号图和0、1、2、3、4、5h的二维深层信号图(a点为二维深层扫描所选点);
52.图9c2是本发明实施例中150nm的ferbam@gnps-a-nsio2在茶树嫩叶下表面的0h二维表面信号图和0、1、2、3、4、5h的二维深层信号图(a点为二维深层扫描所选点);
53.图9c3是本发明实施例中150nm的ferbam@gnps-a-nsio2在老叶上表面的0h二维表面信号图和0、1、2、3、4、5h的二维深层信号图(a点为二维深层扫描所选点);
54.图9c4是本发明实施例中150nm的ferbam@gnps-a-nsio2在老叶下表面的0h二维表面信号图和0、1、2、3、4、5h的二维深层信号图(a点为二维深层扫描所选点);
55.图10a1是本发明实施例中50nm的ferbam@gnps-a-nsio2在茶树嫩叶上表面0、1、2、3、4、5h的二维深层信号最强点拉曼光谱图;
56.图10a2是本发明实施例中50nm的ferbam@gnps-a-nsio2在茶树嫩叶下表面0、1、2、3、4、5h的二维深层信号最强点拉曼光谱图;
57.图10a3是本发明实施例中50nm的ferbam@gnps-a-nsio2在老叶上表面0、1、2、3、4、5h的二维深层信号最强点拉曼光谱图;
58.图10a4是本发明实施例中50nm的ferbam@gnps-a-nsio2在老叶下表面0、1、2、3、4、5h的二维深层信号最强点拉曼光谱图;
59.图10b1是本发明实施例中100nm的ferbam@gnps-a-nsio2在茶树嫩叶上表面0、1、2、3、4、5h的二维深层信号最强点拉曼光谱图;
60.图10b2是本发明实施例中100nm的ferbam@gnps-a-nsio2在茶树嫩叶下表面0、1、2、3、4、5h的二维深层信号最强点拉曼光谱图;
61.图10b3是本发明实施例中100nm的ferbam@gnps-a-nsio2在老叶上表面0、1、2、3、4、5h的二维深层信号最强点拉曼光谱图;
62.图10b4是本发明实施例中100nm的ferbam@gnps-a-nsio2在老叶下表面0、1、2、3、4、5h的二维深层信号最强点拉曼光谱图;
63.图10c1是本发明实施例中150nm的ferbam@gnps-a-nsio2在茶树嫩叶上表面0、1、2、3、4、5h的二维深层信号最强点拉曼光谱图;
64.图10c2是本发明实施例中150nm的ferbam@gnps-a-nsio2在茶树嫩叶下表面0、1、2、3、4、5h的二维深层信号最强点拉曼光谱图;
65.图10c3是本发明实施例中150nm的ferbam@gnps-a-nsio2在老叶上表面0、1、2、3、4、5h的二维深层信号最强点拉曼光谱图;
66.图10c4是本发明实施例中150nm的ferbam@gnps-a-nsio2在老叶下表面0、1、2、3、
4、5h的二维深层信号最强点拉曼光谱图;
67.图11a是本发明实施例中50nm 5h的ferbam@gnps-a-nsio2在茶树嫩叶下表面的拉曼光谱层扫图;
68.图11b是本发明实施例中100nm 5h的ferbam@gnps-a-nsio2在茶树嫩叶下表面的拉曼光谱层扫图;
69.图11c是本发明实施例中150nm 5h的ferbam@gnps-a-nsio2在茶树嫩叶下表面的拉曼光谱层扫图;
70.图11d是本发明实施例中空白叶片的拉曼光谱层扫图;
71.图12a是本发明实施例中50nm的ferbam@gnps-a-nsio2在茶树根部的0、1、2、3、4、5h的二维深层信号图;
72.图12b是本发明实施例中100nm的ferbam@gnps-a-nsio2在茶树根部的0、1、2、3、4、5h的二维深层信号图;
73.图12c是本发明实施例中150nm的ferbam@gnps-a-nsio2在茶树根部的0、1、2、3、4、5h的二维深层信号图;
74.图13a是本发明实施例中50nm的ferbam@gnps-a-nsio2在茶树根部的0、1、2、3、4、5h的二维深层信号最强点拉曼光谱图;
75.图13b是本发明实施例中100nm的ferbam@gnps-a-nsio2在茶树根部的0、1、2、3、4、5h的二维深层信号最强点拉曼光谱图;
76.图13c是本发明实施例中150nm的ferbam@gnps-a-nsio2在茶树根部的0、1、2、3、4、5h的二维深层信号最强点拉曼光谱图;
77.图14a是本发明实施例中50nm 5h的ferbam@gnps-a-nsio2在茶树根部的拉曼光谱层扫图;
78.图14b是本发明实施例中100nm 5h的ferbam@gnps-a-nsio2在茶树根部的拉曼光谱层扫图;
79.图14c是本发明实施例中150nm 5h的ferbam@gnps-a-nsio2在茶树根部的拉曼光谱层扫图;
80.图14d是本发明实施例中空白根部的拉曼光谱层扫图;
81.图15a是本发明实施例中拉曼深层扫描前茶树叶片显微图像;
82.图15b是本发明实施例中拉曼深层扫描5h后的茶树叶片显微图像;
83.图15c是本发明实施例中100nm ferbam@gnps-a-nsio2在茶树嫩叶下表面渗透5h后的拉曼光谱层扫图;
84.图15d是本发明实施例中100nm ferbam@gnps-a-nsio2在茶树嫩叶下表面渗透5h后洗去表面ferbam@gnps-a-nsio2的拉曼光谱层扫图。
具体实施方式
85.下面对本发明的实施例作详细说明,本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
86.本实施例提供一种技术方案:一种纳米农药拉曼探针制备方法,即负载福美铁的
纳米金二氧化硅拉曼探针(ferbam@gnps-a-nsio2)的制备及表征过程,包括以下步骤:首先合成带负电荷的nsio2和gnps,再通过硅烷偶联剂将nsio2修饰改性为正电荷(a-nsio2),与负电荷的gnps通过静电吸附力作用在一起,使a-nsio2的表面均匀的吸附一层gnps得到gnps-a-nsio2。gnps-a-nsio2吸附福美铁后,福美铁分子落在两个相邻的gnps颗粒中间,产生sres信号,从而可以通过sres信号来追踪定位nsio2。
87.在本实施例中,不同粒径nsio2的合成过程如下:
88.①
50nm nsio2合成:依次在烧杯中加入50ml无水乙醇、1ml 1680ppm单水氢氧化锂、2ml氨水、1ml teos,室温(25℃)下搅拌6h。
89.②
100nm nsio2合成:依次在烧杯中加入50ml无水乙醇、1ml 1680ppm单水氢氧化锂、2.5ml氨水、1ml teos,室温(25℃)下搅拌6h。
90.③
150nm nsio2合成:依次在烧杯中加入50ml无水乙醇、1ml 2100ppm单水氢氧化锂、3ml氨水、1ml teos,室温(25℃)搅拌6h。
91.上述各溶液反应完成后用去离子水离心洗涤3遍,于60℃干燥过夜分别得到不同粒径的实心nsio2。
92.在本实施例中,nsio2的改性修饰条件如下表1所示:
93.表1 nsio2不同的改性修饰条件
[0094][0095]
查阅文献资料发现aptms、aptes和kh590是最常用于改性二氧化硅纳米的硅烷偶联剂,首先对这三种硅烷偶联剂对合成的二氧化硅纳米的改性效果进行比较,在相同的条件下,aptms的改性效果最佳,因此后续反应采用aptms作为改性材料。称取上述5mg不同粒径nsio2超声分散于50ml乙醇中,加入50μl aptms,分别于30、50、70、90、110℃集热式恒温加热磁力搅拌器油浴中加热回流2、4、6、8h。上述各溶液反应完成后用去离子水和乙醇各离心洗涤2遍(14000r/min,10min),后于40℃干燥过夜分别得到不同粒径的改性nsio2(a-nsio2)。将不同粒径的改性nsio2分散于去离子水中,用zeta电位及纳米粒径分析仪测定zeta电位和粒径。
[0096]
在本实施例中,纳米金(gnps)的制备过程如下:
[0097]
在振动搅拌的条件下,于98.9ml超纯水中加入1ml柠檬酸盐溶液(30mg ml-1
),在加热台上加热,快速添加100μl氯金酸溶液(100mm),在冰上快速冷却,得到直径为15nm的纳米金颗粒。
[0098]
在本实施例中,纳米金二氧化硅复合材料(gnps-a-nsio2)的合成过程如下:
[0099]
取上述5mg a-nsio2超声分散于2ml乙醇,逐滴滴入不断搅拌的20ml的15nm gnps溶液中,滴加完成后搅拌2h,于14000r/min条件下离心10min,用去离子水离心洗涤3遍,分散于300μl去离子水中,得到不同粒径的纳米金二氧化硅复合材料(gnps-a-nsio2)。
[0100]
在本实施例中,nsio2和gnps-a-nsio2结构表征主要通过hitachi ht7700透射电子显微镜(tem)观察样品结构,电压80kv。
[0101]
在本实施例中,gnps-a-nsio2吸附福美铁的具体过程如下:
[0102]
准确称取2.5mg福美铁标品,用去离子水于50ml容量瓶定容,得到50ppm福美铁溶液。取1ml gnps-a-nsio2和1ml福美铁溶液于恒温振荡器(30℃、300r)振摇2h,得到负载福美铁的纳米金二氧化硅拉曼探针(ferbam@gnps-a-nsio2)。
[0103]
在本实施例中,ferbam@gnps-a-nsio2的sers表征过程如下:
[0104]
将上述合成的gnps和gnps-a-nsio2负载福美铁滴加在金板上,在激光器:785nm-edge,物镜:
×
50-vis-lvd,采集时间:5s,采集次数:5,激光功率:5%,采集范围:400-2000cm-1
的条件下对其进行拉曼测试。
[0105]
本实施例还提供了一种负载福美铁的纳米二氧化硅拉曼探针的应用,主要测定负载福美铁的纳米二氧化硅拉曼探针(ferbam@gnps-a-nsio2)在茶树体内的吸收渗透情况,具体包括以下过程:
[0106]
s1:ferbam@gnps-a-nsio2在茶树表面的sers表征
[0107]
将上述合成的gnps和gnps-a-nsio2负载福美铁滴加在茶树叶片和根部,在激光器:785nm-edge,物镜:
×
50-vis-lvd,采集时间:5s,采集次数:5,激光功率:5%,采集范围:400-2000cm-1
的条件下对其进行拉曼测试。
[0108]
s2:拉曼深层扫描时间的选择
[0109]
为在测得植物组织深层扫描信号的同时缩短扫描时间,分别设置了14个采集时间(0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、2、3、4和5s)采集拉曼扫描光谱。在激光器:785nm-edge,物镜:
×
50-vis-lvd,采集次数:1,激光功率:5%,采集范围:400-2000cm-1
的条件下对其进行拉曼测试。
[0110]
s3:ferbam@gnps-a-nsio2在茶树叶片的吸收渗透
[0111]
将20μl不同尺寸的ferbam@gnps-a-nsio2分别滴加在活体茶树嫩叶(刚刚舒展开的第一叶)和老叶(第三叶)的上表面及下表面,在室温下等待1h后完全干燥,记为0h。分别原位测定ferbam@gnps-a-nsio2滴加在茶树叶片上下表面0h二维表面信号和0、1、2、3、4、5h后在茶树叶片上的二维深层信号,观察其在茶树叶片的渗透。拉曼参数:激光器:785nm-edge,物镜:
×
50-vis-lvd,采集时间:1s,采集次数:1,激光功率:5%,采集范围:400-2000cm-1
。使用100个扫描点(x轴和y轴分别为10个点)生成二维表面图,每个图像包含100个点,每个点的距离为10μm。二维深度图由x轴上的五个扫描点和z轴上的30个扫描点生成(深度:0-290μm),每个图像包含150个点,每个点的距离为10μm。
[0112]
s4:ferbam@gnps-a-nsio2在茶树根部的吸收渗透
[0113]
将茶树新生根活体放入200μl不同尺寸的ferbam@gnps-a-nsio2溶液中,在0、1、2、3、4、5h分别取相同部位根,冷冻干燥48h后,测定茶树根部0、1、2、3、4、5h的二维深层信号,观察其在茶树根部的渗透。拉曼参数:激光器:785nm-edge,物镜:
×
50-vis-lvd,采集时间:1s,采集次数:1,激光功率:25%,采集范围:400-2000cm-1
。二维深度图由x轴上的五个扫描点和z轴上的30个扫描点生成(深度:0-290μm),每个图像包含150个点,每个点的距离为10μm。
[0114]
s5:ferbam@gnps-a-nsio2拉曼探针在茶树的渗透示踪验证实验
[0115]
拍摄步骤s3测定前和测定5h后的茶树叶片显微图像。将20μl 100nm的ferbam@gnps-a-nsio2滴加在活体茶树嫩叶(刚刚舒展开的第一叶)的下表面,并在室温下等待1h后完全干燥,记为0h,测定5h后在茶树叶片上的二维深层信号,观察其在茶树叶片的渗透。将20μl 100nm的ferbam@gnps-a-nsio2滴加在活体茶树嫩叶(刚刚舒展开的第一叶)的下表面,并在室温下等待1h后完全干燥,记为0h,在5h后洗去表面的纳米探针后测定在茶树叶片上的二维深层信号,观察其在茶树叶片的渗透,其中拉曼参数:同步骤s3。
[0116]
本实施例中的结果与分析:
[0117]
1、负载福美铁的纳米金二氧化硅拉曼探针(ferbam@gnps-a-nsio2)的表征:
[0118]
1.1、不同粒径nsio2的结构表征
[0119]
纳米二氧化硅团聚是纳米二氧化硅合成中常见的问题,团聚后会使得纳米二氧化硅的实际应用尺寸大于单个材料尺寸,从而无法发挥应有的尺寸效应。合成50nm、100nm和150nm三种不同尺寸的nsio2,对合成的nsio2测定tem图像(图2)。合成的三种尺寸的nsio2都具有较好的均匀度和分散性,没有团聚和粘连,可以代表50、100、150nm二氧化硅的尺寸特性,可用作下一步吸附示踪实验。
[0120]
1.2、nsio2的改性修饰
[0121]
zeta电位可用于表征胶态分散的稳定性,zeta电位的绝对值越高,体系的稳定性就越强。由于合成的纳米金带负电荷,因此改性nsio2的电荷越高,吸附金的效果越好。合成的gnps的zeta电位为-17.8mv,直径为15nm。不同改性方法对nsio2的修饰结果如表2所示,添加50μl aptms于90℃油浴中加热回流6h改性后的nsio2具有最高的zeta电位和最低的半径,说明这种改性方法得到的nsio2的分散性和对纳米金的吸附效果最好,因此采用此改性方式得到的改性nsio2进行吸附和示踪实验。
[0122]
表2不同的改性方法对nsio2的修饰结果
[0123][0124]
1.3、不同粒径的gnps-a-nsio2的结构表征
[0125]
对合成的50nm、100nm和150nm的gnps-a-nsio2测定tem结果(图3),15nm的gnps均可以通过静电吸附在这三种尺寸的a-nsio2上,且这三种尺寸的gnps-a-nsio2都具有较好的分散性。
[0126]
由于gnps紧密结合在nsio2的表面,而gnps对福美铁具有拉曼增强效应,因此检测到福美铁拉曼信号的位置就代表了nsio2的位置,从而可以通过拉曼追踪定位纳米农药。但如果体系中有游离的gnps,游离金也会与福美铁结合,从而产生拉曼信号,对结果产生干扰。因此选用了离心将游离金去除,以保证实验结果的准确性。将用去离子水离心3次(14000r/min,10min)前(图4a)后(图4b)的gnps-a-nsio2粒径分布图做对比。由图中可以看出,离心前的gnps-a-nsio2在15nm左右有粒径分布,表明体系中有游离的gnps,离心后粒径只在100nm左右有分布,说明离心可以有效去除体系中游离的gnps。
[0127]
1.4、不同粒径的ferbam@gnps-a-nsio2的sers表征
[0128]
福美铁与纳米金混合后在448、551、945、1139和1371cm-1
处具有拉曼特征峰,1371cm-1
处的最高峰来自cn和c=s伸缩的混合振动,以及对称的ch3变形。因此选用1371cm-1
处的拉曼特征峰的峰强来表示该材料对福美铁的拉曼信号增强效果。
[0129]
对合成的gnps和gnps-a-nsio2对福美铁的拉曼增强效果进行判定和比较。合成的15nm gnps与商业15nm aunps对福美铁的拉曼信号增强对比结果(图5a),ferbam@15nm gnps在1371cm-1
处的拉曼峰强为397.195,ferbam@15nm aunps在1371cm-1
处的拉曼峰强为313.016,从结果看出,与福美铁相比,合成的15nm gnps与商业15nm aunps对福美铁都具有拉曼增强效果,且合成的15nm gnps对福美铁的增强效果好于商业15nm aunps。
[0130]
合成的不同尺寸的gnps-a-nsio2对福美铁的拉曼信号增强对比结果(图5b),15nm gnps及50nm、100nm和150nm的gnps-a-nsio2在1371cm-1
处的拉曼峰强分别为397.195、261.241、287.135和249.467。从结果看出,合成的不同尺寸的gnps-a-nsio2对福美铁都具有拉曼增强效果,且弱于15nm gnps,增强效果从大到小为100nm、50nm、150nm,增强效果差异不大。分析原因为:sers活性纳米结构可以分为三代sers热点,第一代sers热点是单个纳
米材料产生的,第二代sres热点是纳米材料间隙或交叉纳米间隙的耦合纳米结构中产生,第三代sres热点混合结构产生的。gnps-a-nsio2表面吸附的gnps不是很均匀密集,因此纳米金的间隙结构变少,导致第二代sres热点减少,从而使得gnps-a-nsio2的拉曼增强效果弱于15nm gnps。a-nsio2和gnps是通过静电吸附,50nm、100nm和150nm的a-nsio2的表面电荷大致都在5.07mv,因此不同尺寸的a-nsio2吸附的gnps的数量应大致相同。150nm的nsio2尺寸较大,因此表面吸附相同数量的gnps,金与金之间的距离也会较大,造成纳米金的间隙结构变少,导致第二代sres热点减少,拉曼信号减弱。50nm的nsio2与gnps的尺寸差异较小,因此表面吸附的gnps的数量也会相对减少,从而导致拉曼信号的减弱。
[0131]
2、负载福美铁的纳米二氧化硅拉曼探针(ferbam@gnps-a-nsio2)在茶树体内的渗透示踪:
[0132]
2.1、ferbam@gnps-a-nsio2在茶树表面的sers表征
[0133]
茶树叶片和根部组织的组成和结构的不同会造成ferbam@gnps-a-nsio2的拉曼信号强度的差异,且茶树体内含有大量拉曼干扰物质,如拉曼光谱可用于类胡萝卜素类物质的检测,因此茶树叶片和根部有较强的拉曼干扰。因而在渗透示踪实验前需测定合成的不同尺寸的ferbam@gnps-a-nsio2拉曼探针在茶树叶片和根部的拉曼信号(图6)。不同尺寸的ferbam@gnps-a-nsio2拉曼探针在茶树叶片和根部均可检测到拉曼信号,50nm的在金板上1371cm-1
处的拉曼峰强为261.241,叶片上为95.857,根部为120.682;100nm的在金板上1371cm-1
处的拉曼峰强为287.135,叶片上为100.737,根部为124.845。150nm的在金板上1371cm-1
处的拉曼峰强为249.467,叶片上为83.890,根部为116.161。
[0134]
ferbam@gnps-a-nsio2在茶树叶片和根部的拉曼信号与空白茶树叶片和根部的拉曼信号有明显区别(图7),ferbam@gnps-a-nsio2在茶树叶片和根部的增强效果从大到小为100nm、50nm、150nm,与在金板上的趋势一致,且增强效果差异不大。因此合成的不同尺寸的ferbam@gnps-a-nsio2拉曼探针可以用于后续的渗透示踪检测。
[0135]
2.2、拉曼深层扫描时间的选择
[0136]
为建立快速原位拉曼深层扫描方法,需在满足拉曼信号较好的前提下选择时间更短的方法。一共设置了14个采集时间(0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、2、3、4和5s)采集ferbam@gnps-a-nsio2在茶树叶片表面的拉曼扫描光谱(图8。结果表明,随着扫描时间的增加,拉曼信号增强,在0.1s时,叶片的噪音较大,干扰较强,拉曼信号很弱,从0.4s开始,拉曼峰逐渐明显。取样间隔时间为1h,而茶树组织深层干扰较大,会导致拉曼信号弱于组织表面,扫描时间越长拉曼信号越好,因此需要将采集总时间控制在1h内的同时选用拉曼信号较强的时间扫描。综上所述,为使每层的扫描所用时间较短且拉曼信号较好,采集时间选用1s、150个点采集总时间为55min。
[0137]
2.3、ferbam@gnps-a-nsio2在茶树叶片的渗透示踪
[0138]
通过拉曼光谱测定了ferbam@gnps-a-nsio2拉曼探针在茶树叶片的渗透示踪结果(图9)。同时为验证测得的二维深层扫描结果的准确性,选取了ferbam@gnps-a-nsio2的二维深层信号最强点的拉曼光谱图(图10),由拉曼光谱图可以看出所测得的信号均为福美铁的sers信号,表明了图9的渗透结果为拉曼探针在茶树叶片的渗透示踪结果,验证了实验结果的正确性。
[0139]
图9a1所示50nm的ferbam@gnps-a-nsio2拉曼探针在嫩叶上表面滴加5h后渗透至
250μm处,a2显示50nm的ferbam@gnps-a-nsio2拉曼探针在下嫩叶表面滴加4h后已渗透至300μm处,b1显示100nm的ferbam@gnps-a-nsio2拉曼探针在嫩叶上表面滴加5h后渗透至150μm处,b2显示100nm的ferbam@gnps-a-nsio2拉曼探针在嫩叶下表面滴加5h后渗透至300μm处,c1和c2显示150nm的ferbam@gnps-a-nsio2拉曼探针在嫩叶上表面和下表面滴加5h后都没有渗透,a3-c4显示50nm、100nm和150nm的ferbam@gnps-a-nsio2拉曼探针在茶树老叶上表面和下表面滴加5h后均没有渗透。
[0140]
福美铁本身没有渗透能力,而在茶树叶片上施加ferbam@gnps-a-nsio2后可以在内部检测到福美铁的sers信号,说明纳米二氧化硅可以改变福美铁的渗透行为,使其从非内吸性农药变为内吸性农药。从图9可以看出,50nm和100nm的ferbam@gnps-a-nsio2可以在茶树嫩叶的上下表面随着时间向下进行渗透,且50nm的ferbam@gnps-a-nsio2渗透速率快于100nm,下表面的渗透速率快于上表面,150nm的ferbam@gnps-a-nsio2在茶树嫩叶没有渗透,三个尺寸的ferbam@gnps-a-nsio2在茶树老叶均没有渗透。分析原因可能为叶片下表面存在气孔,纳米材料通过气孔进入到叶片内部,从而加快了纳米材料的吸收渗透。50nm和100nm的ferbam@gnps-a-nsio2拉曼探针均可进入茶树嫩叶内部,而150nm的材料无法在嫩叶内部检测到信号,说明150nm的ferbam@gnps-a-nsio2无法进入茶树嫩叶,这表明纳米材料能否进入茶树叶片以及在叶片内的渗透速率与纳米材料的尺寸相关,尺寸越大,越难进入叶片且在叶片内的渗透速率越慢。而不论哪个尺寸的ferbam@gnps-a-nsio2都无法在茶树老叶中测得信号,说明50nm以上的纳米材料在茶树老叶中无法渗透。茶树老嫩叶渗透结果的差异原因也许为叶片蜡质层厚度不同,刚刚舒展开的第一叶叶片柔软,蜡质层薄,纳米材料容易穿透叶片表面,进入叶片内部,而第三叶叶质厚实,蜡质层厚,纳米材料穿透表面较为困难,因此无法进入叶片内部。
[0141]
将图9中不同尺寸的ferbam@gnps-a-nsio2在茶树嫩叶下表面渗透5h的拉曼二维深层信号图在红线所在位置取每一层的拉曼图,得到拉曼层扫光谱图(图11)。由结果可以看出50nm和100nm的ferbam@gnps-a-nsio2在每一层都能测得福美铁的sers信号,而150nm的ferbam@gnps-a-nsio2只能在表层测得福美铁的sers信号,深层的拉曼光谱图与空白叶片的信号一致。进一步说明了在茶树嫩叶下表面滴加5h后,50nm和100nm的ferbam@gnps-a-nsio2渗透至叶片深层,而150nm的ferbam@gnps-a-nsio2的渗透只停留在叶片表面,没有向下渗透,验证了拉曼二维深层信号图结果的准确性。
[0142]
2.4、ferbam@gnps-a-nsio2在茶树根部的渗透示踪
[0143]
通过拉曼光谱测定了ferbam@gnps-a-nsio2拉曼探针在茶树根部的渗透示踪结果(图12)。同时为验证测得的二维深层扫描结果的准确性,选取了ferbam@gnps-a-nsio2的二维深层信号最强点的拉曼光谱图(图13),由拉曼光谱图可以看出所测得的信号均为福美铁的sers信号,表明了图8的渗透结果为拉曼探针在茶树根部的渗透示踪结果,验证了实验结果的正确性。
[0144]
图12所示50nm、100nm和150nm的ferbam@gnps-a-nsio2拉曼探针在茶树根部滴加5h后均停留在表面,没有渗透。说明不论哪个尺寸的ferbam@gnps-a-nsio2都无法进入茶树根部内部,原因可能与茶树根部结构和制样方式有关。选用的是茶树的新生根,根部一旦离开水环境,就会迅速失水、皱缩,破坏原有的结构,而拉曼必须保证样品在干燥的环境下才能聚焦测定,因此只能将根浸入纳米材料溶液中,吸收一定时间后再冷冻干燥,保留原本的
结构再测定。因此不像叶片的原位测定,根只能选取类似的结构和取样点进行测定,这对选点也造成了一定困难。
[0145]
将图12中不同尺寸的ferbam@gnps-a-nsio2在茶树根部渗透5h的拉曼二维深层信号图在红线所在位置取每一层的拉曼图,得到拉曼层扫光谱图(图14)。由结果可以看出50nm、100nm和150nm的ferbam@gnps-a-nsio2只能在表层测得福美铁的sers信号,深层的拉曼光谱图与空白根部的信号一致。进一步说明了在茶树根部滴加5h后,50nm、100nm和150nm的ferbam@gnps-a-nsio2渗只停留在根部表面,没有向下渗透,验证了拉曼二维深层信号图结果的准确性。
[0146]
3、ferbam@gnps-a-nsio2拉曼探针在茶树的渗透示踪验证实验
[0147]
拉曼光谱是通过激光照射到样品的表明来测定信号,而茶树为生物样品,表面较为柔软,在重复原位测样的过程中也许会对组织造成损伤,从而对结果造成影响。因此拍摄拉曼深层扫描前和扫描5h后的茶树叶片显微图像(图15a、b),从图中看出拉曼深层扫描前后的叶片没有损伤,形态一致,说明拉曼深层扫描不会对茶树组织造成损伤。再重新选点直接测定100nm ferbam@gnps-a-nsio2在茶树嫩叶下表面渗透5h后的拉曼二维深层信号图和层扫图(图15c),结果表明可以在0-300μm处均可测得福美铁的渗透sers信号,排除了原位重复扫描对渗透结果的影响。测定100nm ferbam@gnps-a-nsio2在茶树嫩叶下表面渗透5h后清洗表面的纳米材料的拉曼二维深层信号图和层扫图(图15d),仍旧可以检测到深层sers信号,排除了表层拉曼探针对深层拉曼信号的影响,验证了实验的可行性和结果的准确性。
[0148]
图15拉曼深层扫描前(a)和扫描5h后(b)的茶树叶片显微图像以及100nm ferbam@gnps-a-nsio2在茶树嫩叶下表面渗透5h(c)和渗透5h后洗去表面ferbam@gnps-a-nsio2(d)的拉曼光谱层扫图。
[0149]
综上所述,非系统性农药福美铁本身没有渗透能力,但与纳米金二氧化硅复合颗粒结合后,在茶树嫩叶内部检测到福美铁的sers信号。说明纳米金二氧化硅复合颗粒改变了福美铁的渗透行为。并且负载福美铁的纳米金二氧化硅拉曼探针的渗透速度很快,在5小时内,拉曼探针迅速渗透至茶树嫩叶中,深度约为150-300μm。渗透速率取决于拉曼探针大小,与100nm的拉曼探针相比,50nm的ferbam@gnps-a-nsio2渗透速率更快,150nm的拉曼探针无法渗透至茶树嫩叶内部,且三种尺寸的拉曼探针都无法渗透至茶树老叶和根内部;结果表明,sers是研究农药和纳米材料的相互作用以及纳米农药在植物体内的渗透运输的有效方法,且拉曼可以无损地原位检测植物组织内外的相互作用;其次,纳米金二氧化硅复合材料改变了福美铁的非系统行为,使其可以渗透到茶树嫩叶内部;纳米材料的尺寸和植物组织的形态影响纳米农药在植物体内的渗透行为;小尺寸的纳米材料更容易进入植物体内,且渗透速率更快,越成熟的植物组织纳米农药越难渗透;本发明所述的负载福美铁的纳米金二氧化硅拉曼探针,可以利用sers检测此拉曼探针在茶树体内的信号,从而原位无损地测定纳米农药在植物体内的渗透;为后续的农药制剂的研发和纳米农药与植物互作机理研究提供帮助和新的思路。
[0150]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
