1.本发明涉及药物技术领域,具体涉及一种免疫检查点抑制剂及应用。
背景技术:
2.随着黑色素瘤治疗的初步成功,通过抗体为基础的 pd-1/pd-l1阻断癌症免疫疗法为治疗多种晚期和转移癌提供了重大突破性进展,已迅速成为多种实体癌症的主要治疗方法,包括一部分结直肠癌。免疫疗法包括两种程序性细胞死亡1(pd-1)抑制剂,如pembrolizumab 和 nivolumab,对于包含高度微卫星不稳定(msi-h)的结直肠癌患者显示出很好的疗效。研究表明,多个免疫检查点分子,包括 pd-1,pd-l1,ctla-4,lag-3,在 msi-h 结直肠癌中高度表达。
3.目前,fda批准的免疫检查点封闭抗体分为两大类: 一类是针对细胞程序性死亡蛋白1(pd-1)和程序性死亡配体1(pd-l1),另一类是针对细胞毒性t细胞抗原4(ctla-4)的 ctla-4。目前上市的pd-l1位点结合抗体atezolizumab, durvalumab, bms-963559, and avelumab,其原理为通过与pd-l1不同的结合位点结合来实现与 pd-1的结构性竞争以阻断 pd-1/pd-l1的相互作用。
4.然而,pd-1/pd-l1阻断癌症免疫疗法存在以下问题:第一,免疫检查点封闭抗体主要是针对某一个单一免疫检查点相关分子。第二,在这些治疗性抗体取得良好的肿瘤抑制疗效的同时,仍有其特殊的结构限制性:由于抗体药物体积较大,其组织/肿瘤渗透性较差。因此,开发低分子量蛋白质药物或调节 pd-1/pd-l1信号,特别是同时结合pd-1、pd-l1、ctla-4等多个的小分子药物是治疗结肠癌在内的实体肿瘤的发展方向,小分子调节剂和抗体药物联合治疗可能是通过完全阻断pd-1/pd-l1治疗实体肿瘤的一个很好的选择。第三,糖基化也可以影响一些主要免疫检查点分子的结构和功能。例如,n-糖基化通过减少它的蛋白酶降解来稳定细胞程式死亡-配体1(pdl1),并因此增强其免疫抑制活性。阻止肿瘤相关糖基化与抑制性免疫受体的相互作用可作为肿瘤的一种治疗方法。采用针对肿瘤糖基化的特异性凝集素受体,选择性抑制糖基化和凝集素的相互作用,可以作为肿瘤的一种新的免疫疗法,目前还需要进行更深入的研究。
5.我们的实验数据表明, zg16可以通过其凝集素结构域直接与糖基化pd-l1结合。其次通过实验还进一步验证了 zg16在结肠癌细胞中的过表达影响检查点分子的基因表达,包括 cd40,pd1和 ctla4。并且zg16可能作为一种免疫检查点抑制剂,通过阻断 pd1和 ctla4基因的表达及调节cd40基因来激活 t细胞。
技术实现要素:
6.本发明的目的在于提供一种免疫检查点抑制剂及应用。
7.为实现上述发明目的,本发明采取的技术方案是:一种免疫检查点抑制剂,所述抑制剂为至少含有lectin短肽和zg16蛋白中的一种,所述lectin短肽和zg16蛋白具有seq id no:1所示的氨基酸序列。
8.所述免疫检查点包括pd-l1、pd1、ctla4和cd40中的任一种或两种以上。
9.所述的免疫检查点抑制剂在制备治疗肿瘤疾病的药物中的应用。
10.在应用时,将免疫检查点抑制剂与化疗药物组合使用。
11.所述化疗药物选自氟尿嘧啶、喹诺酮类、铂类、他滨类化疗药、细胞毒类、影响核酸合成类药物、拓扑异构酶抑制剂、激素类、生物反应调节剂、靶向药物注射用药物和小分子靶向治疗药物中的一种。
12.所述喹诺酮类包括莫西沙星、氧氟沙星、环丙沙星和左氧氟沙星中的一种;所述铂类为注射用奥沙利铂、注射用顺铂、注射用卡铂、注射用奈达铂、顺铂氯化钠注射液、奥沙利铂注射液和注射用洛铂中的一种;所述他滨类化疗药为卡培他滨、吉西他滨等,替吉奥和伊利替康中的一种;所述细胞毒类为环磷酰胺、丝裂霉素、多柔比星和表柔比星中的一种;所述影响核酸合成类药物为培美曲赛或阿糖胞苷;所述拓扑异构酶抑制剂为依托泊苷;所述激素类为甲地孕酮或戈舍瑞林;所述生物反应调节剂为白介素-2或干扰素;所述靶向药物注射用药物为巴利昔单抗;所述小分子靶向治疗药物甲磺酸伊马替尼。
13.所述肿瘤疾病为结肠癌、肝癌、胰腺癌、乳腺癌、恶性黑色素瘤、肺癌和肾癌中的一种或者两种以上。
14.所述药物的给药途径为口服给药或胃肠外给药。
15.所述胃肠外给药方式为静脉注射、皮下注射、肌肉注射、腹腔注射和局部注射中的一种。
16.与现有技术相比,本发明的技术优势在于:1)将zg16用于肿瘤治疗药物中是本发明首创,所采用的 zg16是胃肠道中天然存在的蛋白质,由于蛋白质是天然存在于胃肠道中的,因此与常规治疗相比,预期较少的副作用;2)实验数据表明,zg16可以通过其凝集素结构域直接与糖基化pd-l1结合。其次,通过实验还进一步验证了 zg16在结肠癌细胞中的过表达影响检查点分子的基因表达,包括 cd40,pd1和 ctla4。这表明,zg16作为一种免疫检查点抑制剂,通过阻断 pd1和 ctla4和调节cd40基因的表达来激活t细胞,基因的表达来激活t细胞,从而实现对肿瘤疾病及抗pd-l1治疗的相关疾病的治疗效果;因此,zg16可以作为一种免疫检查点抑制剂,而其之所以具有上述功能,其主要原因在于zg16蛋白上具有如seq id no:1所示的氨基酸序列,也即凝集素结构域,也即lectin短肽,可以直接与免疫检查点结合,当单独使用lectin短肽时,发现lectin短肽同样可以作为免疫检查点抑制剂来激活 t细胞,从而杀伤肿瘤细胞;3)实验表明zg16相当耐胰蛋白酶降解,因此zg16可以口服给药。考虑到蛋白质很少通过该途径给药的事实,这是本发明的一个显著优点。
附图说明
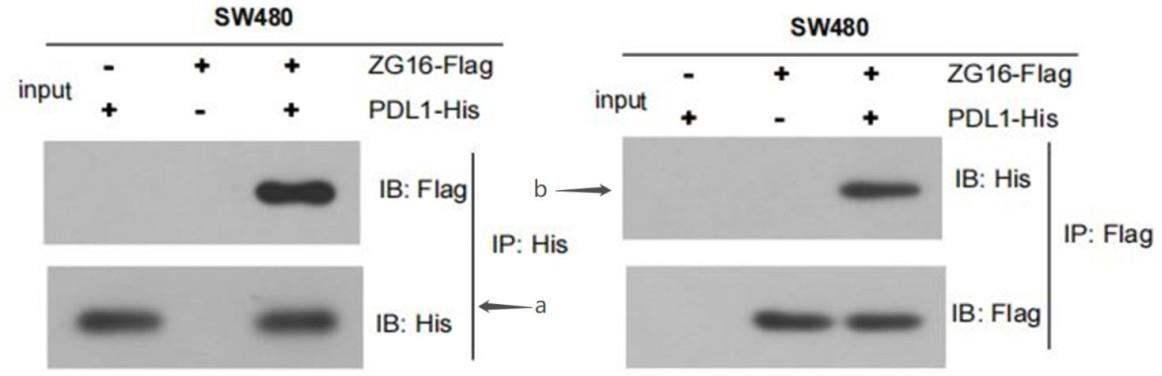
17.图1是flag标记zg16(zg16-flag)与his标记pd-l1(pd-l1-his)免疫共沉淀图;图2是引入了pd-l1的4nq (n35q,n192q,n200q 和 n219q)糖基化突变后的免疫共沉淀图;图3是在转染结构域上引入 zg16的凝集素结构域突变d151a 或 m5(k36a、r37a、k79a、r53a 和r55a) 的免疫共沉淀图;
图4是小鼠结肠癌细胞ct26和ct26-zg16(高表达zg16的癌细胞ct26)基因的异种移植物生长曲线(n = 6)(a)和ct26和 ct26-zg16异种移植瘤动物瘤体活体成像图(b);图5a图是肿瘤体积和生长曲线:mc38小鼠结肠癌细胞zg16蛋白处理组和 zg16蛋白 5-fu处理组或5-fu 作用组。数据显示为平均
±ꢀ
s.d。* p 《 0.05,* * * p 《 0.001。左图是不同处理条件下的肿瘤体积,右图是不同处理条件下肿瘤的生长曲线;b图是mc38小鼠结肠癌细胞zg16蛋白处理组和 zg16蛋白 5-fu处理组或5-fu 作用组肿瘤实体结果照片。
18.图6:a图是由尾静脉注射给药的lectin短肽在大肠癌异种移植瘤中的体内疗效。用lectin短肽、5
‑ꢀ
氟尿嘧啶或它们的联合用药治疗 mc38异种移植瘤。(n = 3)。数据显示为平均
±ꢀ
s.d。* p 《 0.05,* * * p 《 0.001,左图是不同处理条件下的肿瘤体积,右图是不同处理条件下肿瘤的生长曲线。b图: 5-fu、lectin短肽及其联合5
‑ꢀ
氟尿嘧啶应用治疗 mc38肿瘤体积变化 (n = 3)。
19.图7是cd3 t细胞与 sw480癌细胞或zg16蛋白处理sw480癌细胞(sw480-zg16蛋白)共培养24小时的免疫印迹。
20.图8是zg16蛋白对结肠癌细胞株pd-l1的表达影响。
21.图9是cd3 t细胞与 sw480癌细胞或lectin短肽处理sw480癌细胞共培养24小时的免疫印迹。
22.图10是lectin短肽对结肠癌细胞株中pd-l1的表达影响。
23.图11是zg16蛋白及lectin短肽的应用对动物的结肠癌肿瘤细胞免疫微环境的影响。
24.图12是zg16蛋白及lectin短肽的应用各组动物的体重增长曲线。图中,图中从左到右依次是mc38、5-fu(iv)、lectin(iv)、lectin 5-fu(iv)、zg16 protins6(iv)、zg16protins6 5-fu(iv)。
具体实施例
25.下面结合具体实施例进一步说明本发明效果。需要说明的是,其中,本发明中zg16为重组蛋白。
26.本发明通过原核表达方法获得zg16重组蛋白。
27.1.1原核表达以人源cdna为模板,扩增出zg16完整的开放阅读框(orf), 将其连接到pgemt-easy载体中,通过双酶切将其连接到表达载体pcold i中,提取dmrt1-pclod i、amh-pcold i 及cyp11b2-pcold i重组质粒,将此质粒分别转入表达菌株de3摇菌,待菌液od达到0.6-0.8时,加入iptg(终浓度 1mmol/l)37℃诱导表达3-4h,或30℃过夜表达,8000rpm离心5min收集菌液,加入适量上样缓冲液沸水处理后,sds-page电泳检测。
28.具体操作步骤如下:1.1.1目的基因扩增1.1.1.1 cdna模板合成1)组织总rna的提取通过rnaiso plus方法从性腺中提取总rna(rna样品的量为5ug);总rna用dnaase i处理后用于反转录合成cdna模板。
29.取材:分别快速取精巢和卵组织约为25mg放入无rna酶离心管中,然后放入液氮速冻组织匀浆: 向装有样品的离心管中加入1ml总rna提取试剂,离心管置于冰上进行匀浆,尽可能使组织研磨充分,离心管室温放置5min,加入250ul氯仿,剧烈振荡15s,室温放置5min后,4℃,1200*g离心15min,将上清液移至新的1.5ml离心管,加250ul异丙醇,充分振荡后室温静止20min,于4℃,1200*g离心15min,缓慢倒掉上清液后加1ml无水乙醇,振荡,于4℃,7500*g离心5min,倒掉上清液,加1ml 75% depc乙醇,振荡4℃,7500*g离心5min,弃上清,倒置离心管,沥干rna沉淀;在rna沉淀中加入适量的depc水,用核酸蛋白定量仪nanodrop 2000测定od260/280值和浓度,同时取适量rna用1%琼脂糖凝胶进行电泳以鉴定rna的质量,然后保存于-80℃冰箱。
30.)第一链cdna的合成第一链cdna的合成参照逆转录酶m-mulv reverse transcriptase使用说明书:在冰上向0.2ml pcr管中加入以下混合物:oligo(dt)(10um)
ꢀꢀꢀꢀꢀ
1ultotal rna
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
5ug上述混合物于65℃加热10min,然后立即放置冰上2-3min,在冰浴的条件下,向上述pcr管中加入以下反应物5xm-mulv reaction buffer
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
8uldntp mixture(10mm)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
5ulm-mulv reverse transcriptase
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1uldepc water
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
20ultatal
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
40ul将上述混合物低速离心后,立即置于37℃水浴锅中温育90min,合成第一链cdna,然后在65℃加热5min,终止反应。
31.3)pcr扩增目的片段pcr反应体系如下:(以下所有pcr反应体系均参照此方法)10x pcr buffer
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2.5uldntp mixture(2.5mm)
ꢀꢀꢀꢀ
1.0ulforward primer(10um)
ꢀꢀꢀ
0.5ulreverse primer(10um)
ꢀꢀꢀ
0.5ulcdna template
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1.0ulddh2o
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
18ultag
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
0.2ultotal
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
25ulpcr循环参数为:94℃预变性2min:94℃ 30s,60℃ 30s,72℃ 30s,循环32圈,72℃延伸10min,4℃保存。
32.4)pcr产物回收和纯化将扩增产物50ul跑1.8%琼脂糖凝胶电泳,经eb染色后,用蒸馏水漂洗,在紫外灯下用消毒干净的刀片切下含有目的片段的凝胶带。参照gel extraction kit(qiagen)的操作
说明进行目的片段的回收纯化。
33.5)t载体连接按照pgemt-easy克隆载体说明书,建立如下连接反应体系:ligation solution i
ꢀꢀꢀꢀꢀꢀ
5ulpgemt-easy vector
ꢀꢀꢀꢀꢀꢀꢀꢀ
0.3ulpcr production
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
3ulddh2o
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1.7ultotal
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
10ul将上述混合物混匀后,置于4℃过夜或16℃,3h。
34.1.1.1.2 亚克隆、鉴定以及质粒提取1、超级感受态细胞法(inoue)1)从培养过夜的lb平板上挑取单菌落;2)接种于250ml sob,18℃培养至od=0.6;3)菌液置冰上10分钟;4)4℃,2500*g离心10分钟;5)小心用80ml预冷tb重悬细胞;6)菌液置冰上10分钟;7)4℃、2500*g离心10分钟;8)小心用20ml预冷tb重悬细胞;9)加入dmso至终浓度为7%;10)置冰上10分钟,分装,液氮速冻,-80℃冻存;2、重组质粒转化感受态细胞1)取上述新鲜制备的感受态细胞,加入5ul连接产物;2)置冰上30min,其间轻轻摇动2-3次;3)42℃水浴中热激90s,迅速置冰上静置,至少2min4)加入800ul的lb培养基,于37℃,120rpm恒温摇床培养10min后调转速到180rpm培养1h5)低速离心5min,吸出约800ul上清液后,混匀菌体沉淀6)将40il x-gal(20mg/ml)和7ul iptg(200mg/ml)混匀,均匀涂布在含amp抗生素的lb固体培养基表面,37℃放置,直至表面所有液体被培养基吸收7)将步骤5)的转化菌液涂布于上述lb固体选择性培养基表面,正置培养皿待菌液被培养基完全吸收,37℃倒置培养过夜3、筛选和鉴定重组质粒用无菌牙签挑取平板上的白色单菌落,接种到5ml的含有浓度为50mg/ml amp的lb液体培养基中,37℃,200rpm摇床培养6-10hpcr鉴定重组质粒:取上述菌液1ul作为模板,pcr反应体系和循环参数同上。取pcr产物8ul,用浓度为1.2%的琼脂糖凝胶进行电泳,分析结果,依据大小初步筛选出阳性克隆,并将此阳性克隆送去华大生物测序,以确定是否为阳性菌克隆4、重组质粒的提取
使用市售solarbio质粒提取试剂盒进行提取。
35.货号:d11001.1.2 zg16重组载体构建引物设计以及重组载体的构建:设计罗非鱼zg16表达型的基因特异性引物(表1),并在引物两端加上适当的酶切位点,通过pcr扩增回收dna片段后将其连接到pgemt-easy载体中,测序验证后,将连接有目的基因的pgemt-easy和空载的pcold i同时经相同的限制性内切酶双酶切后,将目的基因亚克隆入原核表达载体pcold i。
36.双酶切酶切的反应体系:10x t buffer
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
4ulnde i
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2ulxba i
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2ulpcold i/dmrt1-pgemt-easy
ꢀꢀ
2ug(总量)ddh2ototal
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
40ul反应于37℃水浴锅中进行,时间为3-4h,酶切产物经琼脂糖电泳后切胶回收。
37.表1
ꢀꢀ
克隆所需引物序列引物
ꢀꢀ
序列(5-3’)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
酶切位点zg16
ꢀꢀ
ftggagcgactatgtgggtgg
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
ndei(划线)zg16
ꢀꢀ
rggacggcattgaaacttgtg
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
xbai(划线)表达载体与目的基因连接反应体系:ligation solution i
ꢀꢀꢀꢀꢀ
2.5ulpcold i
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1ultarget gene segment
ꢀꢀꢀꢀ
3ulddh2o
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
3.5ultotal
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
10ul 将上述混合物混匀,离心后,置于4℃过夜。
38.转化感受态细胞用前文感受态细胞制备方法制作表达菌株感受态细胞,此处感受态菌株为bl21(de3),同时不需要在细菌培养板上涂iptg和x-gal。筛选,鉴定重组质粒和重组质粒的提取方法也同前面所述。此步骤之后可以再次进行测序验证1.1.3 zg16重组蛋白表达与检测将构建好的表达重组载体亚克隆到大肠杆菌bl21(de3)中,经引物和测序验证之后,用lb液体培养基于37℃,150rpm培养至od值达到0.6-0.8,此时菌体生长处于旺盛时期,加入iptg(终浓度为1mmol/l)于150rpm诱导3-4h。12000转离心5min收集菌体,用适当体积的双蒸水稀释后加入上样缓冲液(每10ml标准通常加入200ul水,50ul的5*buffer),然后于沸水中煮沸10min,再于12000转离心10min收集上清,用于sds-page电泳检测。
39.1.1.4 zg16蛋白纯化
sds-page电泳检测重组质粒有表达之后,将蛋白表达的体系扩大到1l,诱导方法同1.3.1.3.收集菌体后,加入bufffer b进行裂解,待裂解彻底(溶液呈清亮)后,12000rpm离心10min,上清用0.45um膜过滤后过镍柱收集目的蛋白,方法见qiagen公司的ni-nta superflow cartridges说明书。用1.5ml离心管收集10管,用于sds-page检测。
40.纯化步骤:在原有的基础上扩大体系,进行大量表达(如原来的5ml,扩大到1l),12000rpm离心10min收集菌体后,放冰上30min,用buffer b进行裂解(每克菌体加5ml buffer b),不停的用手或者摇床进行缓慢摇动,切忌产生气泡,直至菌体由原来的浑浊至半透明,于12000转离心收集上清,将制备好的蛋白样品用针头过滤器(孔径0.45um)过滤;用10倍体积的buffer b平衡镍柱,流速不得高于1ml/min;将过滤后的蛋白样品上柱,一次上完静置5min,流速不得高于1ml/min;用10倍柱体积的buffer c洗柱,流速不得高于1ml/min,用于除去杂蛋白;最后用10倍体积的buffer e进行洗脱,分别收集到10个不同的1.5ml离心管,每管1ml(开始输送管中仍为buffer c,不收集)以buffer e为空白对照,测定收集到的蛋白浓度,每管取出10ul纯化的蛋白样品进行sds-page电泳分析,以确定纯化的效果。
41.本发明zg16的氨基酸序列与人类基因库中hgnc: 30961.zg16一致。
42.其蛋白表达:该蛋白为多段折叠结构,去除1-16aa 为信号肽,剩余序列构建到可溶表达系统,表达可溶蛋白。保存的缓冲液为 30mm 组氨酸醋酸,ph5.5,浓度大于 10mg/ml,纯度大于 95% ,溶液形式的,缓冲液浓度 10mg/ml。
43.17-167aa:naiqarsssysgeygggggkrfshsgnqldgpitalrvrvntyyivglqvrygkvwsdyvggrngdleeiflhpgesviqvsgkykwylkklvfvtdkgrylsfgkdsgtsfnavplhpntvlrfisgrsgslidaiglhwdvypsscsrc分子量为:16616.72 daltons7.512 charge at ph 7.0151种氨基酸18种强碱性( )氨基酸(k,r)11种强酸性(-)氨基酸(d,e)47种疏水性氨基酸(a,i,l,f,w,v)45种极性氨基酸(n,c,q,s,t,y) 9.534等电点7.512ph 值7.0凝集素结构域氨基酸序列lectin短肽:talrvrvntyyivglqvrygkvwsdyvggrngdleeiflhpgesviqvsgkykwylkklvfvtdkgrylsfgkdsgtsfnavplhpntvlrfisgrsgslidaiglhwdvyptscsrc合成购买自爱必信(absin)生物科技公司。
44.实施例1一种免疫检查点抑制剂,本实施例中抑制剂为zg16蛋白,所述zg16蛋白分别具有seq id no:1所示的氨基酸序列。其他实施例中可以为凝集素(lectin短肽)。
45.本实施例中免疫检查点为pd-l1、pd1、ctla4和cd40中的任一种或两种以上。
46.在其他实施例中,将免疫检查点抑制剂应用于制备治疗肿瘤疾病的药物中。
47.在应用时,将免疫检查点抑制剂与化疗药物组合使用。
48.所述化疗药物选自氟尿嘧啶、喹诺酮类、铂类、他滨类化疗药、细胞毒类、影响核酸合成类药物、拓扑异构酶抑制剂、激素类、生物反应调节剂、靶向药物注射用药物和小分子靶向治疗药物中的一种。
49.所述喹诺酮类包括莫西沙星、氧氟沙星、环丙沙星和左氧氟沙星中的一种;所述铂类为注射用奥沙利铂、注射用顺铂、注射用卡铂、注射用奈达铂、顺铂氯化钠注射液、奥沙利铂注射液和注射用洛铂中的一种;所述他滨类化疗药为卡培他滨、吉西他滨等,替吉奥和伊利替康中的一种;所述细胞毒类为环磷酰胺、丝裂霉素、多柔比星和表柔比星中的一种;所述影响核酸合成类药物为培美曲赛或阿糖胞苷;所述拓扑异构酶抑制剂为依托泊苷;所述激素类为甲地孕酮或戈舍瑞林;所述生物反应调节剂为白介素-2或干扰素;所述靶向药物注射用药物为巴利昔单抗;所述小分子靶向治疗药物甲磺酸伊马替尼。
50.所述肿瘤疾病为结肠癌、肝癌、胰腺癌、乳腺癌、恶性黑色素瘤、肺癌和肾癌中的一种或者两种以上。
51.所述药物的给药途径为口服给药或胃肠外给药。
52.所述胃肠外给药方式为静脉注射、皮下注射、肌肉注射、腹腔注射和局部注射中的一种。
53.实施例2
ꢀꢀ
co-ip验证zg16与pd-l1的结合为说明zg16蛋白在作为pd-l1抗体治疗肿瘤等疾病中的机理,本发明进行了co-ip(免疫共沉淀),证明了zg16通过其凝集素结构域可以直接与糖基化pd-l1结合,并证实了zg16在结肠癌细胞中的过表达影响免疫检查点分子的基因表达。
54.co-ip实验过程为:一、co-ip验证zg16与pd-l1的结合1)根据人zg16(nm_152338.4,cds区长504 bp)构建其过表达载体(携带flag标签)及阴性对照;2)根据人pd-l1(nm_014143.4,cds区长873 bp)构建其过表达载体(携带his标签)及阴性对照;3)正常培养sw480细胞:90 % l-15培养基 10 %血清,待细胞生长状态良好时,选取上述构建好的质粒进行转染,具体分组和处理方式如下:实验设置:a. sw480细胞b. sw480细胞 vector-flagc. sw480细胞 vector-hisd. sw480细胞 zg16-flage. sw480细胞 pd-l1-his4)细胞转染48 h后,real-time pcr检测a、b、d组细胞zg16 mrna的表达水平(共5组,1个指标)5)细胞转染48 h后,real-time pcr检测a、c、e组细胞pd-l1 mrna的表达水平(共5组,1个指标)6)细胞转染48 h后,western blot检测b-e组细胞flag-zg16和his-pd-l1融合蛋
白的表达水平(共4组,2个指标,需2板胶)排版顺序:第一板:bflag-zg16、dflag-zg16第二板:chis-pd-l1、ehis-pd-l17)免疫共沉淀(co-ip)实验验证zg16与pd-l1的相互作用(1)sw480细胞分别转染flag-zg16和his-pd-l1质粒,具体分组如下。细胞转染48 h后,收集细胞进行co-ip实验。
55.实验设置:a. sw480 pd-l1-hisb. sw480 zg16-flagc. sw480 pd-l1-his zg16-flag(2)分组设置:a:以flag抗体进行ip,his抗体进行western blotb:以flag抗体进行ip,flag抗体进行western blotc:以his抗体进行ip,flag抗体进行western blotd:以his抗体进行ip,his抗体进行western blot(3) western blot排版顺序(需4板胶):第一板:aa、ba、ca第二板:ab、bb、cb第三板:ac、bc、cc第四板:ad、bd、cd实验结果如图1所示,图1flag标记zg16(zg16-flag)与his标记pd-l1(pd-l1-his)免疫共沉淀图;图1a中,将 zg16-flag 质粒与pd-l1-his 共转染到 sw480细胞中。单个矢量表达每个标签(flag,his)作为阴性对照。观察到 zg16和pd-l1之间的直接结合。图1b中,将 zg16-flag 质粒与pd-l1-his 共转染到 sw480细胞中。单个矢量表达每个标签(flag,his)作为阴性对照。我们将标记为 zg16的过表达质粒和标记为pd-l1的过表达质粒共转染 sw480细胞,进行免疫共沉淀(co-ip)。观察到 zg16和pd-l1之间的直接结合。因此,由图1a和图1b可知,zg16可以直接与pd-l1结合。
56.为了验证这种结合是否依赖于糖基化pd-l1,本发明还引入了pd-l1的4nq (n35q,n192q,n200q 和 n219q)糖基化突变。
57.其具体实验过程为:1)正常培养 sw480 细胞和 hct116 细胞,待细胞生长状态良好时,将 his-pd-l1、flag-zg16 his-pd-l1-nger1(pd-l1 突变型质粒)共转染 sw480 和 hct116 细胞,细胞转染 48 h 后收集细胞进行 co-ip 实验,下面以 1 种细胞为例,2)具体分组和处理方式如下:实验设置:a. flag-zg16b. his-pd-l1 flag-zg16c. his-pd-l1-nger1 flag-zg16
分组设置:a:以 flag 抗体进行 ip,his 抗体进行 western blotb:以 flag 抗体进行 ip,flag 抗体进行 western blotc:以 his 抗体进行 ip,flag 抗体进行 western blotd:以 his 抗体进行 ip,his 抗体进行 western blot3)western blot 排版顺序(2 种细胞,需 4 板胶):第一板:asw480a、bsw480a、csw480a、ahct116a、bhct116a、chct116a第二板:asw480b、bsw480b、csw480b、ahct116b、bhct116b、chct116b第三板:asw480c、bsw480c、csw480c、ahct116c、bhct116c、chct116c第四板:asw480d、bsw480d、csw480d、ahct116d、bhct116d、chct116d实验发现,如果将糖基化突变位点导入pd-l1,zg16和pd-l1之间的结合就会明显降低,这表明pd-l1的糖基化对于结合是必要的。这进一步表明, zg16可以通过其凝集素结构域直接与糖基化pd-l1结合。如图2所示。
58.为了探讨 zg16与pd-l1之间的结合是否依赖于凝集素结构域,我们在转染结构域上引入 zg16凝集素结构域的突变:即d151a 或 m5(k36a、 r37a、 k79a、 r53a 和 r55a)突变。
59.其具体实验过程为:1)正常培养 sw480 细胞和 hct116 细胞。待细胞生长状态良好时,将 his-pd-l1、flag-zg16 及flag-zg16-m5/ flag-zg16-d151a(zg16 突变型质粒)共转染 sw480 和 hct116 细胞,细胞转染 48 h 后收集细胞进行 co-ip 实验,下面以 1 种细胞为例,2)具体分组和处理方式如下:实验设置:a. his-pd-l1b. his-pd-l1 flag-zg16c. his-pd-l1 flag-zg16-d151ad. his-pd-l1 flag-zg16-m5分组设置:a:以 flag 抗体进行 ip,his 抗体进行 western blotb:以 flag 抗体进行 ip,flag 抗体进行 western blotc:以 his 抗体进行 ip,flag 抗体进行 western blotd:以 his 抗体进行 ip,his 抗体进行 western blot3) western blot 排版顺序(2 种细胞,需 4 板胶):第一板:asw480a、bsw480a、csw480a、dsw480a、ahct116a、bhct116a、chct116a、 dhct116a第二板:asw480b、bsw480b、csw480b、dsw480b、ahct116b、bhct116b、chct116b、dhct116b第三板:asw480c、bsw480c、csw480c、dsw480c、ahct116c、bhct116c、chct116c、dhct116c第四板:asw480d、bsw480d、csw480d、dsw480d、ahct116d、bhct116d、chct116d、
dhct116d实验数据及结果分析结果表明,突变导入凝集素结构域,zg16和pd-l1之间的结合力在结肠癌细胞系中显著降低,这表明,zg16和pd-l1之间相互作用需要 zg16的凝集素结构域,如图3所示。
60.综上所述,这些数据表明, zg16可以通过其凝集素结构域直接与糖基化pd-l1结合。
61.实施例3
ꢀꢀ
zg16在大肠癌异种移植瘤中过度表达的体内疗效具体实验过程:1)鼠结肠癌细胞ct26和 ct26-zg16异种移植瘤体积细胞培养,将鼠 ct26细胞或 ct26-zg16细胞移植于雌性 balb/c 小鼠右侧皮下,形成同基因小鼠模型,监测 ct26-zg16或 ct26异种移植35天。观察zg16过度表达对肿瘤的生长抑制。
62.2)小鼠结肠癌细胞ct26培养条件:90 % rpmi-1640(添加nahco
3 1.5 g/l,glucose 2.5 g/l,sodium pyruvate 0.11g/l) 10 %血清。将细胞置于37℃,5% co2培养箱中培养。待细胞生长状态良好时收集细胞进行成瘤实验。
63.3)模型建立取6-8周龄雌性balb/c鼠,分别于每只鼠右侧皮下接种5
×
104个小鼠结肠癌细胞(ct26)与等体积基质胶混合的悬液。每组6只。观察时间1个月,在目测瘤体动态发生变化时最佳时间点取瘤。细胞接种1个月后处死小鼠并收集肿瘤组织。具体分组和处理方式如下:4)实验设置:a. 空白对照组b. ct26组c. ct26-zg16注射组实验数据及结果分析小鼠成瘤后,定期(每周3次)测量肿瘤长径a及短径b,根据公式计算肿瘤体积v=(a
×
b2)/2[1](共4组,每组6只,12个时间点),得到ct26和 ct26-zg16异种移植物生长曲线,如图4a、4b所示,图4a:小鼠结肠癌细胞ct26和ct26-zg16(高表达zg16蛋白的癌细胞ct26)基因的异种移植物生长曲线(n = 6)。数据显示为平均
ꢀ±ꢀ
s.d。* * p 《 0.01由 turkey 的多重比较测验的双因子变异数分析得出。图4b: ct26和 ct26-zg16异种移植瘤动物瘤体活体成像结果表明:zg16蛋白在大肠癌异种移植瘤中过度表达可以显著抑制肿瘤生长。
[0064]
实施例4
ꢀꢀ
zg16蛋白与化疗药物组合对结肠癌移植瘤小鼠肿瘤生长的影响,及验证lectin短肽在大肠癌异种移植瘤中的体内疗效为了验证zg16蛋白与化疗药物组合对结肠癌移植瘤小鼠肿瘤生长的影响,及验证lectin短肽在大肠癌异种移植瘤中的体内疗效,本实施例以化疗药物5
‑ꢀ
氟尿嘧啶为例进行如下实验。
[0065]
实验步骤为:1)根据小鼠zg16(nm_026918.3,cds区504 bp)构建过表达慢病毒及阴性对照;2)正常培养小鼠结肠癌细胞mc38:90 % rpmi-1640 10 %胎牛血清 1 %双抗,待细胞生长状态良好时进行感染,具体分组和处理方式如下:实验设置:
zg16蛋白组:a.阴性对照组b. 5-fu治疗组(小剂量)c. zg16蛋白处理组(小剂量)d.zg16蛋白 5-fu治疗组lectin短肽组:a.阴性对照组b. 5-fu治疗组(小剂量)c.lectin短肽处理组(小剂量)d. lectin短肽 5-fu治疗组3)模型建立取5-6周龄雌性c57bl/6j小鼠。细胞接种后的第10 d和第18 d,给小鼠腹膜内注射50 mg/kg的5-fu;细胞接种后的第6、8、10、12、14、16 d,c、d组小鼠尾静脉注射150 μg/只或5 mg/kg的小鼠zg16蛋白/lectin短肽(小剂量) 。细胞注射30 d后处死裸鼠,收集肿瘤组织进行相应指标的检测;4)接种细胞第10 d开始,每4 d测量肿瘤长径a、短径b,根据公式计算肿瘤体积v=(a
×
b2)/2;5)接种细胞第10 d开始,每4 d称量动物体重;6)处死动物前,每组单独拍照;7)取出瘤体后,并称量记录每个瘤体的重量;8)收集各组小鼠的肿瘤组织、脾脏及外周血,试剂盒分离淋巴细胞;9)流式细胞术检测肿瘤组织、脾脏及外周血淋巴细胞中cd4 、cd8 细胞的比例;10)流式细胞术检测肿瘤组织、脾脏及外周血淋巴细胞中cd4 ki67 、cd8 ki67 的表达,以检测cd4 、cd8 细胞的增殖情况;实验结果如图(5a、5b)所示,其中,a图是肿瘤体积和生长曲线:mc38小鼠结肠癌细胞组、zg16蛋白处理组和 zg16蛋白 5-fu处理组或5-fu 作用组。数据显示为平均
±
s.d。* p 《 0.05,* * * p 《 0.001。左图是不同处理条件下的肿瘤体积,右图是不同处理条件下肿瘤的生长曲线;b图是mc38小鼠结肠癌细胞zg16蛋白处理组和 zg16蛋白 5-fu处理组或5-fu 作用组肿瘤实体结果照片。结果表明,zg16蛋白注射治疗显著抑制肿瘤生长,表现出与化疗相似的效果。其小剂量应用抗肿瘤作用与化疗相当,且未观察到短期毒副作用。
[0066]
其次,本发明还测试了由尾静脉注射给药的 lectin短肽在大肠癌异种移植瘤中的体内疗效。研究结果表明,lectin短肽可显著抑制肿瘤生长,其小剂量应用抗肿瘤作用与化疗相当。如图(6a、6b)所示,图6a:由尾静脉注射给药的lectin短肽在大肠癌异种移植瘤中的体内疗效。用 lectin短肽、5
‑ꢀ
氟尿嘧啶或它们的联合用药治疗 mc38异种移植瘤。(n = 3)。数据显示为平均
ꢀ±ꢀ
s.d。* p 《 0.05,* * * p 《 0.001,左图是不同处理条件下的肿瘤体积,右图是不同处理条件下肿瘤的生长曲线。研究结果表明,lectin短肽可显著抑制肿瘤生长,其小剂量蛋白应用抗肿瘤作用与化疗相当。图6b:5-fu、lectin短肽及其联合5
‑ꢀ
氟尿嘧啶应用治疗 mc38肿瘤体积变化 (n = 3)。由尾静脉注射给药的 lectin短肽、5
‑ꢀ
氟
尿嘧啶或它们的联合用药治疗在大肠癌异种移植瘤中的体内疗效。研究结果表明,lectin短肽可显著抑制肿瘤生长,且lectin短肽注射(小剂量) 5-fu (小剂量)联合治疗对肿瘤生长的抑制作用明显大于单一化疗药物。
[0067]
实施例5: zg16蛋白影响免疫检查点分子的基因表达实验,包括 pd-l1,cd40,pd1和 ctla4实验步骤为:1)全血中分离出pbmc,采用磁分选方法分选出cd3 t细胞,用加有il-2的1640完全培养基培养;使用cd3和cd28单抗活化t细胞。
[0068]
2)分组如下:a.阴性对照组癌细胞,b.zg16蛋白高表达癌细胞,c. t淋巴细胞单独培养组。
[0069]
3)t细胞活化48h后,将活化好的t细胞收集至50ml离心管中,1500rpm,5min,弃上清,用1640完全培养基重悬后计数。将重悬的t细胞与上述3组细胞共孵育。共孵育48h后收取培养基中悬浮的t细胞至1.5mlep管中,置于冰上;收取细胞前6小时对t细胞进行刺激,加入pma、离子霉素刺激内因子的产生,各1ul/孔,孵育1h后,加入bfa,1ul/孔,孵育5h,阻断内因子分泌至胞外。
[0070]
4)进一步western blot检测癌细胞、混合细胞及t淋巴细胞蛋白样本中tnfr 超家族的细胞表面分子cd40抗原、细胞程式死亡-受体1 (pd-1)、细胞毒性 t 淋巴细胞相关蛋白4 (ctla4)等(主要存在于淋巴细胞)及细胞程式死亡-受体配体1 (pd-l1) 的表达。证明zg16蛋白对免疫检查点信号通路相关因子糖基化蛋白的结合及调控。
[0071]
图7是cd3 t细胞与 sw480癌细胞或 zg16蛋白处理sw480癌细胞(sw480-zg16蛋白)共培养24小时的免疫印迹。进一步验证了 zg16蛋白在结肠癌细胞中影响检查点分子的基因表达,包括 cd40,pd1和 ctla4。我们将原代培养的 cd3 t细胞与zg16蛋白处理的 sw480细胞或未加处理的sw480细胞共培养,进一步western blot 检测其蛋白表达水平。观察到原代培养的 cd3 t细胞与高表达zg16蛋白组的 sw480细胞共培养时,检测到不同的 cd40亚型,这可能是由于糖基化配体结合功能。并且,cd3 t细胞与zg16蛋白处理的 sw480细胞共培养时,pd1和 ctla4的表达明显降低。
[0072]
为了评价zg16蛋白处理对 pd-l1的调节作用,我们检测了zg16蛋白对结肠癌细胞株pd-l1的表达。pd-l1在zg16蛋白高表达的sw480细胞中的表达明显下降,表明在结肠癌中,pd-l1受到 zg16蛋白的直接调节(图8)。
[0073]
因此,原代培养的 cd3 t细胞与zg16蛋白处理的sw480细胞共培养时检测到不同的 cd40亚型,这是由于糖基化配体结合功能,pd1和 ctla4的表达明显降低。并且,过表达 zg16的 sw480中pd-l1的表达明显降低。
[0074]
实施例6: lectin短肽影响免疫检查点分子的基因表达实验,包括 pd-l1,cd40,pd1和 ctla4实验步骤为:1)全血中分离出pbmc,采用磁分选方法分选出cd3 t细胞,用加有il-2的1640完全培养基培养;使用cd3和cd28单抗活化t细胞。
[0075]
2)分组如下:a.阴性对照组癌细胞,b.lectin短肽组 (35
µ
g/ml小剂量)处理癌细胞,c. t淋巴细胞单独培养组。
[0076]
3)t细胞活化48h后,将活化好的t细胞收集至50ml离心管中,1500rpm,5min,弃上清,用1640完全培养基重悬后计数。将重悬的t细胞与上述3组细胞共孵育。共孵育24h,48h后收取培养基中悬浮的t细胞至1.5mlep管中,置于冰上;收取细胞前6小时对t细胞进行刺激,加入pma、离子霉素刺激内因子的产生,各1ul/孔,孵育1h后,加入bfa,1ul/孔,孵育5h,阻断内因子分泌至胞外。
[0077]
4)进一步western blot检测癌细胞、混合细胞及t淋巴细胞蛋白样本中tnfr 超家族的细胞表面分子cd40抗原、细胞程式死亡-受体1(pd-1)、细胞毒性 t 淋巴细胞相关蛋白4(ctla4)等(主要存在于淋巴细胞)及细胞程式死亡-受体配体1(pd-l1)的表达。证明lectin短肽对免疫检查点信号通路相关因子糖基化蛋白的结合及调控。
[0078]
图9是cd3 t细胞与 sw480癌细胞或lectin短肽处理sw480癌细胞共培养24小时的免疫印迹。进一步验证了lectin短肽在结肠癌细胞中影响检查点分子的基因表达,包括 cd40,pd1和 ctla4。我们将原代培养的 cd3 t细胞与lectin短肽处理的 sw480细胞或未加处理的sw480细胞共培养,进一步western blot 检测其蛋白表达水平。观察到原代培养的 cd3 t细胞与lectin短肽处理的 sw480细胞共培养时,检测到不同的 cd40亚型,并且,cd3 t细胞与lectin短肽处理的 sw480细胞共培养时,pd1和 ctla4的表达明显降低。
[0079]
为了评价lectin短肽对 pd-l1的调节作用,我们检测了lectin短肽对结肠癌细胞株中pd-l1的表达的影响。pd-l1在lectin短肽处理的 sw480细胞中的表达明显下降,表明在结肠癌中,pd-l1受到lectin短肽的直接调节(图10)。
[0080]
因此,原代培养的 cd3 t细胞与lectin短肽处理的sw480细胞共培养时检测到不同的 cd40亚型,这可能是由于糖基化配体结合功能,pd1和 ctla4的表达明显降低。并且,cd3 t细胞与lectin短肽处理的 sw480细胞共培养时, pd-l1的表达明显降低。
[0081]
实施例7:zg16蛋白及lectin短肽通过影响免疫检查点分子对动物体内血液、脾脏、肿瘤组织中cd4 及cd8 的t淋巴细胞的调节作用(对杀伤肿瘤的免疫微环境的调控)实验步骤为:步骤1)~步骤8)同【实施例4】9)取出瘤体后,并称量记录每个瘤体的重量;10)收集各组小鼠的肿瘤组织、脾脏及外周血,试剂盒分离淋巴细胞;11)流式细胞术检测肿瘤组织、脾脏及外周血淋巴细胞中cd4 、cd8 细胞的比例;12)流式细胞术检测肿瘤组织、脾脏及外周血淋巴细胞中cd4 ki67 、cd8 ki67 的表达,以检测cd4 、cd8 细胞的增殖情况;实验结果如图11所示:为了验证zg16蛋白及lectin短肽的应用对肿瘤细胞免疫微环境的影响,在 mc38和异种移植动物中,用zg16蛋白/lectin短肽、5-fu 或它们的联合处理动物结肠癌。我们测量了动物的肿瘤 (图11a)、脾脏 (图11b)、和血液 (图11c) 中 cd4 t 细胞和 cd8 t细胞的百分比。我们观察到联合治疗组 cd4 细胞和 cd8 t细胞数量增加。总的来说,这些结果表明,zg16蛋白/lectin短肽可以改善化疗的效果,并且可以作为一种蛋白质短肽免疫检查点抑制剂来激活 t细胞,从而杀伤肿瘤细胞。
[0082]
图12所示各组小鼠体重增长曲线。从图中可以看出,随着时间的增长,各组小鼠体重也均稳步增长,且各组体重相差不大,这表明,zg16蛋白、lectin短肽对小鼠没有观察到毒副作用。
[0083]
seq id no:1talrvrvntyyivglqvrygkvwsdyvggrngdleeiflhpgesviqvsgkykwylkklvfvtdkgrylsfgkdsgtsfnavplhpntvlrfisgrsgslidaiglhwdvyptscsrc。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。