1.本发明属于生物技术领域,具体涉及一种寨卡疫苗及其制备方法。
背景技术:
2.寨卡病毒是一种借由蚊子传播的病毒,属黄病毒科(flaviviriade)黄病毒属(flavivirus)。该病毒于1947年第一次在乌干达寨卡森林的猴子身上发现。在发现之后有零星的报告其在非洲和亚洲有小规模的流行与爆发。寨卡病毒拥有非洲型和亚洲型两个血清型。2015年前,寨卡病毒主要流行于非洲,东南亚以及太平洋岛国等地区。2015年,寨卡病毒突然在美国、巴西等美洲国家流行开来。目前,全球已有30多个国家报道寨卡病毒感染病例,已经成为全球性的公共卫生问题。然而关键的问题在于,从爆发的疫情分析来看,寨卡病毒可能导致先天性的寨卡综合征(包括小头畸形)、格林-巴利综合征等严重的神经系统疾病。虽然寨卡病毒的主要传播途径是通过被感染的蚊虫叮咬传播,但也有可能通过其它方式传播,如性传播、输血传播和母婴传播。目前,国内外没有批准的疫苗或抗病毒药物用于寨卡病毒的防治。
3.目前,国际上普遍选用寨卡病毒的前膜蛋白 /膜蛋白(precursor membrane/membrane,prm/m)和包膜蛋白(envelope,e)作为寨卡疫苗设计的靶抗原,并基于此提出了候选寨卡疫苗的9种形式:减毒活疫苗、灭活疫苗、dna疫苗、vlp疫苗、纳米颗粒-甲病毒复制子疫苗、腺病毒载体疫苗、亚单位疫苗、mrna疫苗和嵌合疫苗。其中多种候选疫苗已在动物试验中获得良好的效果。然而,这些疫苗设计策略存在共性缺陷:不能完全消除或减弱与其它黄病毒,如登革热病毒的抗体交叉反应所引发的抗体依赖感染增强效应(antibody-mediated enhancement of infection,ade)对疾病的加重风险。虽然寨卡病毒仅有1种血清型,但其产生的抗体仍然可以使二次感染登革病毒的症状加重,同理,登革病毒的抗体也可对寨卡病毒的感染产生ade效应,使感染症状加重。因此,传统的黄病毒疫苗(乙型脑炎、登革热和蜱传脑炎)设计策略对和登革病毒有抗体交叉反应的寨卡病毒是无效的。新的疫苗设计策略需要避免疫苗接种后可能引起的ade效应。
4.所以,理想的寨卡疫苗是应该具有足够免疫原性的,并且也不能加重其它黄病毒的感染,单次免疫后就能为接种者提供快速、持久的保护。既能抵抗寨卡病毒的攻击,又要能有效地预防新生儿小头症及成人格林-巴利综合征的发生。因此如何克服现有技术的不足是目前生物技术领域亟需解决的问题。
技术实现要素:
5.本发明的目的是为了避免疫苗接种后可能引起的ade效应,提供一种基于无交叉反应的 edⅲ抗原多表位嵌合噬菌体载体寨卡疫苗及其制备方法,使用本发明制备的疫苗免疫小鼠后,与对照组相比较疫苗在小鼠体内能诱导较高的特异性抗体水平,并且抗体水平能维持较长的时间。
6.为实现上述目的,本发明采用的技术方案如下:
7.一种寨卡疫苗,活性成分包括重组噬菌体zedⅲ/t7;
8.所述的重组噬菌体zedⅲ/t7的构建方法包括如下步骤:
9.扩增zedⅲ序列;
10.将zedⅲ序列5’端引入ecori的酶切位点,3’端引入hindⅲ酶切位点,并且在基因末尾终止密码子之前加上6
×
his-tag标签,将目的基因送华大基因合成,并将合成后基因片段构建于pgem-t质粒载体上得到重组质粒zedⅲ/t;
11.将构建得到的质粒zedⅲ/t转化大肠杆菌top10f’感受态细胞,克隆扩增,提取重组质粒zedⅲ/t;
12.重组质粒zedⅲ/t和t7噬菌体载体均采用ecori和hindⅲ双酶切后,过夜连接,构建成为重组噬菌体zedⅲ/t7;
13.所述的zedⅲ序列如seq id no.1所示。
14.进一步,优选的是,6
×
his-tag标签序列如seq id no.5所示。
15.进一步,优选的是,克隆扩增的具体方法是:将合成构建得到的质粒zedⅲ/t转化大肠杆菌top10f’感受态细胞,涂布lb固体培养基,37℃倒置培养过夜,挑取lb固体培养基中的单菌落至装有5ml lb液体培养基的试管中,于恒温摇床37℃,150rpm/min过夜培养,次日将该5ml菌液接种400ml lb液体培养基,于恒温摇床37℃,150rpm/min过夜培养,次日收获菌液,用质粒大量抽提试剂盒从克隆扩增收获的菌液中提取重组质粒zedⅲ/t。
16.进一步,优选的是,重组质粒zedⅲ/t双酶切体系如下:
17.10
×
h buffer 30μl;
18.ecor i 10μl;
19.hindⅲ10μl;
20.重组质粒zedⅲ/t 250μl;
21.总体积300μl;
22.t7噬菌体载体双酶切体系如下:
23.10
×
h buffer 2μl;
24.ecor i 1μl;
25.hindⅲ1μl;
26.t7 select 10-3b 5μl;
27.h2o 11μl;
28.总体积20μl。
29.进一步,优选的是,连接反应体系为:
30.t7噬菌体载体双酶切回收产物0.5μl;
31.zedⅲ/t重组质粒双酶切电泳后的胶回收产物2μl;
32.solution i 2.5μl;
33.总体积5μl;
34.室温连接过夜,得重组噬菌体zedⅲ/t7。
35.本发明同时提供上述构建方法构建得到的重组噬菌体zedⅲ/t7。
36.本发明还提供上述重组噬菌体zedⅲ/t7在制备寨卡疫苗中的应用。
37.本发明另外提供一种寨卡疫苗的制备方法,采用上述构建方法构建得到的重组噬
菌体 zedⅲ/t7进行制备。
38.进一步,优选的是,所述的寨卡疫苗的制备方法,包括如下步骤:
39.将重组噬菌体zedⅲ/t7在大肠杆菌株blt5403中扩增后,按收获噬菌体,测定噬菌体的滴度,滴度按pfu/ml计数,调整噬菌体浓度为所需滴度,将甲醛按1∶4000体积比加入噬菌体中,用常规方法灭活,得寨卡疫苗。
40.进一步,优选的是,所述的寨卡疫苗的制备方法,具体制备方法是:
41.(1)将甘油冻存的e.coli blt5403菌株在lb固体培养基上划线接种,37℃过夜培养;
42.(2)从平板上挑取单菌落接种5ml lb培养基,37℃、150rpm振荡过夜;
43.(3)过夜培养的e.coli blt5403菌液按1∶100比例分别接种5ml、500ml lb液体培养基各一份,37℃、150rpm振荡培养至od600=0.6~0.8,时间为1~3h,得新鲜e.coli blt5403 菌液,存放于4℃备用;
44.(4)接种50μl 10
11
pfu/ml zedⅲ/t7噬菌体种子至步骤(3)得到的5ml od600=0.6~ 0.8的新鲜e.coli blt5403菌液中,37℃、150rpm培养1~3h至菌液澄清并出现细丝状残片;
45.(5)将步骤(4)所得噬菌体液接种至步骤(3)得到的500ml od600=0.6~0.8的新鲜 e.coli blt5403菌液中,37℃、150rpm培养3h至菌液澄清并出现细丝状残片;
46.(6)所得噬菌体液4℃离心10000rpm,10min,取上清,加入固体nacl使其终浓度为1m,振摇至溶解,4℃1h或4℃过夜;
47.(7)4℃,10000rpm离心10min,收集上清,向上清中加入peg8000,振荡至完全溶解后,4℃过夜;peg8000与上清的质量体积比1g/10ml;
48.(8)4℃,10000rpm离心30min,弃上清;
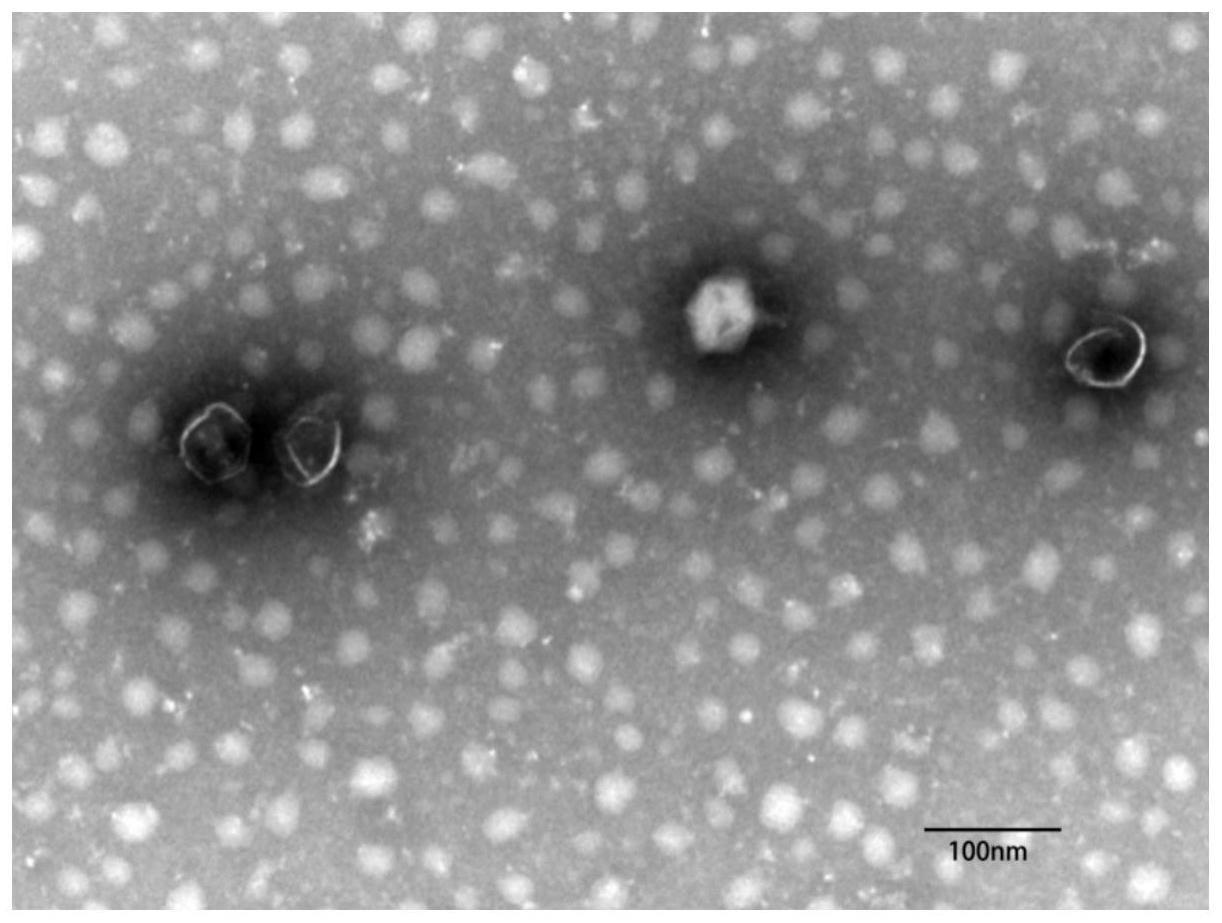
49.(9)所得沉淀物用10ml噬菌体稀释液剧烈抽提后,4℃、10000rpm离心15min,收集上清;所述的噬菌体稀释液含有1m nacl,10mm ris-hcl,ph8.0,1mm edta;
50.(10)余下的沉淀物重复一次步骤(9),合并收集的上清之后保存;
51.(11)测定噬菌体的滴度,滴度按pfu/ml计数,调整噬菌体浓度为所需滴度,将甲醛按 1∶4000体积比加入噬菌体中灭活,然后中和残余甲醛;
52.(12)取灭活的重组噬菌体zedⅲ/t7溶液与13mg/ml的al(oh)3混合,然后使用pbs 调节重组噬菌体的终浓度为2
×
10
12
pfu/ml,al(oh)3的终浓度为2mg/ml,制备成为铝佐剂重组寨卡疫苗。
53.本发明选择zikv gz01株(mf036115.1)中寨卡病毒特异且与登革病毒无交叉的e蛋白第ⅲ结构域基因序列(edⅲ)为疫苗设计靶点,扩增zedⅲ序列。
54.zikv gz01株(mf036115.1)e蛋白第三结构域的基因序列如seq id no.1所示。
55.zedⅲ表位基因序列的5'端加ecorⅰ序列,在3'端加hindⅲ序列,并且在基因末尾终止密码子之前加上6
×
his-tag(5'-catcatcaccatcaccat-3')标签后的基因序列如seq idno.2所示。
56.寨卡病毒e蛋白的第ⅲ结构域(e domainⅲ,edⅲ)上聚集了众多可诱导机体产生中和抗体的寨卡病毒特异性表位,这些表位与登革等其它黄病毒无交叉。因此,我们提出一种新的寨卡疫苗设计策略:基于无交叉反应的edⅲ抗原多表位嵌合噬菌体载体寨卡疫苗。
噬菌体载体能够有效展示外源基因而不影响噬菌体的感染特性,同时又保留外源基因产物的结构和生物学功能,是新型疫苗的理想载体。噬菌体载体疫苗与传统疫苗相比,具有成本低、理化特性稳定、安全可靠、免疫效果好等优点。通过将亚洲型和非洲型寨卡病毒edⅲ进行拼接并展示在t7 噬菌体表面,构建成噬菌体载体寨卡疫苗,该疫苗理论上可同时激活针对寨卡病毒2个基因型的抗体反应,且不会引发对登革热病毒等其它黄病毒的ade效应。
57.理想的寨卡疫苗应该具有足够免疫原性,并且需要避免疫苗接种后可能引起的ade效应。因此我们提出一种新型寨卡疫苗的研制策略:本发明以寨卡病毒特异且与登革病毒无交叉的e 蛋白第ⅲ结构域(edⅲ)为疫苗设计靶点,以t7噬菌体为疫苗载体,通过将寨卡病毒edⅲ蛋白展示在噬菌体表面,构建成与登革病毒无交叉抗体反应且能针对寨卡病毒提供中和保护的新型寨卡疫苗。
58.本发明利用t7噬菌体作为疫苗载体构建重组t7噬菌体多表位疫苗具有多种优势:(1)噬菌体作为表达产物的载体展示的是生物体自身翻译机制产生的天然构象产物,能很好的诱发机体的抗原-抗体免疫反应;(2)噬菌体可以募集t辅助细胞,而且噬菌体颗粒的不对称性有利于引发t细胞依赖的免疫反应;(3)由于噬菌体颗粒是由感染的细菌细胞分泌,噬菌体颗粒可以方便的大规模生产抗原用抗原表位,还可以在同一噬菌体上展示多个具有保护性作用的抗原决定簇,构建多价抗原;(4)纯化简单、花费少;(5)噬菌体颗粒稳定,对理化因素的抵抗力强。 (6)另外t7噬菌体已完成全序列分析,遗传背景清楚。它的复制周期短,胞质蛋白组装、操作和储存方便,克隆效率高,以及t7噬菌体对理化因素抵抗力强等特点也使得t7噬菌体展示系统优于其它的噬菌体展示系统。由于应用噬菌体展示技术研究基因工程抗原具有以上的优点,弥补了传统抗原和其它基因工程抗原产量不高、纯化复杂等缺陷,对新型疫苗的开发具有重要意义。
59.本发明把疫苗设计的重点聚焦于edⅲ蛋白之上,以t7噬菌体为疫苗载体,通过基因重组技术将寨卡病毒包膜蛋白(envelope,e蛋白)第三结构域(edⅲ)的基因与t7噬菌体10-3b 的10b衣壳蛋白基因融合,使edⅲ蛋白与t7 10b蛋白融合表达,构建成与登革病毒无交叉抗体反应且能针对寨卡病毒提供中和保护的新型寨卡疫苗。这种构建方法的优势在于:(1)e蛋白上具有特殊的糖基化位点,可以被人体细胞表面的受体分子特异性的识别,且存在许多特异免疫位点且与其它的黄病毒无交叉的大部分中和表位都集中在edⅲ结构域上。(2)t7噬菌体是一种广泛应用在生命科学领域的一种工程载体,其易于培养,基因组较小,方便基因工程操作。噬菌体载体能够有效展示外源基因而不影响噬菌体的感染特性,同时又保留外源基因产物的结构和生物学功能,是新型疫苗的理想载体。噬菌体载体疫苗与传统疫苗相比,具有成本低、理化特性稳定、安全可靠、免疫效果好等优点。
60.本发明成功构建了zedⅲ/t7重组噬菌体,经过western blot分析,在大约53kda处观察到了明显的条带(图2),并且对照组并没有特异性的条带出现,可以确定重组蛋白在重组噬菌体体内得到了表达。
61.将重组噬菌体(滴度约10
12
pfu/ml)滴加到电镜复膜铜网上,待沉淀15min样品完全干燥后,向样品中滴加2%的磷钨酸(pta)复染1~2min。等待干燥后进行电镜观察,可观察到含有尾部的完整噬菌体结构,其头部由约45nm的正多面体构成,尾部长约20nm,宽约5nm,证明了t7噬菌体在重组后仍具有完整的形态结构,外源蛋白的插入并不会改变其形态(图3)。
62.重组噬菌体t7-zedⅲ能否稳定的将外源基因zedⅲ遗传下去是我们务必要关心的问题。为此,我们将重组正确的噬菌体铺平板培养作为原代噬菌体,然后在此单克隆的基础上连续传代30次,并且在第5、10、15、20、25、30代中每代次取5个单克隆进行pcr鉴定目的基因,并送样测序。结果(图4、5)显示,在每个代次的重组噬菌体pcr扩增得到的基因序列电泳条带都和原代重组噬菌体一致。在第10、20、30代取单克隆经扩增纯化后利用western blot 方法检测外源目的蛋白的表达稳定性,看到在蛋白marker 43-55kda之间有明亮的条带,说明外源蛋白在每个代次之间也能够稳定的表达,结果(图6)。
63.待小鼠进入6周龄免疫系统发育成熟后进行免疫实验,经过腹腔注射进小鼠体内 2
×
10
12
pfu/ml灭活噬菌体与铝佐剂混合的疫苗500μl。免疫前尾静脉取血采取0周的血清作为本底对照,并在免疫后第2周采血后进行一次加强免疫,之后采取第4、6、8、10周血样,为了检测血清抗体的长期水平,在免疫后的第23周采血进行实验。将采集的血液样本放置于37℃水浴1h,然后4℃过夜取上清液,并将血清按照1:2000、1:4000梯度稀释至1:1024000 后进行elisa检测。在405nm下检测od值,以血清稀释比为横坐标,以血清od值/阴参 od值为纵坐标,当清od值》2.1
×
阴参od值时,取最高的血清稀释度作为血清抗体水平。如图7所示,虚线是y=2.1,当血清od值/阴参od值》2.1时,判定为阳性。反之则判定为阴性。实验结果表明,在小鼠免疫第2周后就可以观察到的血清抗体水平为1:8000;在第4周加强免疫后,血清抗体水平达到了一个较高的水平为1:128000;在免疫后第6周血清抗体水平仍保持在1:128000;第八周抗体水平略有下降,为1:64000;第十周血清抗体水平为1: 32000;观察至第23周后发现其血清抗体水平仍能够维持在1:32000。整个免疫周期内小鼠的抗体水平如图8所示说明zedⅲ/t7重组噬菌体免疫小鼠后,可产生较高水平的抗-ed
ⅲꢀ
igg抗体,高水平抗体可以维持到第23周。
64.将105.5tcid50/ml的寨卡病毒用包被液稀释100倍进行包板,并在第二天将血清使用 1
×
bsa稀释至1:20、1:40、1:80、1:160、1:320、1:720系列梯度,进行elisa检测,结果显示,在首免后两周时,小鼠血清就有了特异结合寨卡病毒颗粒的能力,其效价为1:40。第4、6周的血清表现出同样的效价,在第8周时,血清效价达到了最高,此时为1:160,但是在第 10周和23周血清1:20稀释度下并未表现出能特异的结合寨卡病毒颗粒,可能是其效价低于 1:20,具体结果见图9、10。
附图说明
65.图1为重组噬菌体zedⅲ/t7的设计图;
66.图2为重组噬菌体zedⅲ/t7的western blot检测结果;其中,m:蛋白质marker;1:重组噬菌体zedⅲ/t7;2:t7噬菌体
67.图3为重组噬菌体zedⅲ/t7电镜照片;
68.图4为原代重组噬菌体zedⅲ/t7 pcr电泳图;m:dl2000 maker;1-5:5个单克隆噬斑浸出液pcr扩增条带。
69.图5为第5、10、15、20、25、30代中每代次取5个单克隆进行pcr扩增后电泳图;m: dl2000 maker;1-5:5个单克隆噬斑浸出液pcr扩增条带。
70.图6为重组噬菌体zedⅲ/t7蛋白表达稳定性;其中,m:蛋白质marker;1:第10代重组噬菌体纯化样品;2:第20代重组噬菌体纯化样品;3:第30代重组噬菌体纯化样品;4: t7
噬菌体;
71.图7为免疫后各时间段血清抗zedⅲigg水平检测结果;
72.图8为免疫后血清抗zedⅲigg水平变化趋势图;
73.图9为各组免疫后血清抗-edⅲigg结合寨卡病毒颗粒能力图;
74.图10为免疫血清抗-edⅲigg结合寨卡病毒颗粒能力变化图。
具体实施方式
75.下面结合实施例对本发明作进一步的详细描述。
76.本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用材料或设备未注明生产厂商者,均为可以通过购买获得的常规产品。
77.本发明除非另有说明,否则百分号为体积百分数,比例为体积比。
78.本发明试验所用试剂如表1。
79.表1
80.[0081][0082]
本发明试验所用试剂盒如表2。
[0083]
表2
[0084][0085]
培养基配方:
[0086]
上层琼脂:
[0087][0088]
用去离子水溶解后,调节ph至7.5,定容至1000ml,15lbf/in2(1.034
×
105pa)高压下蒸汽灭菌20min后,分装成5ml/试管,4℃存放备用。
[0089]
lb液体培养基:
[0090]
细菌培养用胰化蛋白胨
ꢀꢀ
10g/l
[0091]
细菌培养用酵母提取物
ꢀꢀ
5g/l
[0092]
nacl
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
10g/l
[0093]
用去离子水溶解后,调节ph至7.5,定容至1000ml,15lbf/in2(1.034
×
105pa)高压下蒸汽灭菌20min。
[0094]
lb固体培养基:
[0095][0096]
用去离子水溶解后,调节ph至7.5,定容至1000ml,15lbf/in2(1.034
×
105pa)高压下蒸汽灭菌20min。
[0097]
噬菌体稀释液:
[0098]
1m nacl,10mm tris-hcl,ph8.0,1mm edta 10
×
sds-page电泳缓冲液如表4。
[0099]
表4
[0100]
成分含量tris30g
sds10g甘氨酸144g
[0101]
将上述成分溶解到700ml超纯水中,利用玻璃棒搅拌均匀,定容至1000ml。室温保存,用超纯水稀释至1
×
。
[0102]
转膜缓冲液如表5。
[0103]
表5
[0104]
成分含量甘氨酸2.9gtris5.8gsds0.37g甲醇200ml
[0105]
将上述三种成分溶解至600ml超纯水中,用玻璃棒搅拌均匀后加入甲醇,最终定容至1000ml,室温保存。
[0106]
10
×
tbs缓冲液如表6。
[0107]
表6
[0108]
成分含量nacl180gtris24.2g
[0109]
将上述两种成分溶解至800ml超纯水中,用玻璃棒搅拌混匀,然后用2~4mol/l盐酸将 ph调至7.4,然后定容至1000ml,高压(1.034
×
105pa,121℃)蒸汽灭菌20min,待冷却后于室温保存。临用稀释为1
×
。
[0110]
tbst(0.1%tween 20)如表7。
[0111]
表7
[0112]
成分含量tbs1ltween 201ml
[0113]
混合后摇匀,现用现配。
[0114]
封闭液如表8。
[0115]
表8
[0116]
成分含量tbst50ml脱脂奶粉2.5g
[0117]
混合后摇匀,现用现配。
[0118]
1、zedⅲ/t重组质粒的构建。选择zikv gz01株(mf036115.1)中寨卡病毒特异且与登革病毒无交叉的e蛋白第ⅲ结构域基因序列(edⅲ)为疫苗设计靶点,扩增zedⅲ序列。将 zedⅲ序列5’端引入ecori的酶切位点,3’端引入hindⅲ酶切位点,并且在基因末尾终止密码子之前加上6
×
his-tag标签,将设计好的目的基因送华大基因合成,并构建于pgem-t质粒载体上得到建重组质粒zedⅲ/t;
[0119]6×
his-tag:5'-catcatcaccatcaccat-3'(seq id no.5);
[0120]
2、将合成构建得到的质粒zedⅲ/t转化大肠杆菌top10f’感受态细胞,涂布lb固体培养基,37℃倒置培养过夜,挑取lb固体培养基中的单菌落至装有5ml lb液体培养基的试管中,于恒温摇床37℃150rpm/min过夜培养,次日将该5ml菌液接种400ml lb液体培养基,于恒温摇床37℃,150rpm/min过夜培养,次日收获菌液,用质粒大量抽提试剂盒从克隆扩增收获的菌液中提取zedⅲ/t重组质粒。
[0121]
3、重组质粒zedⅲ/t用限制性内切酶ecori和hindⅲ进行双酶切,双酶切体系如下:
[0122]
10
×
h buffer 30μl;
[0123]
ecor i 10μl;
[0124]
hindⅲ10μl;
[0125]
重组质粒zedⅲ/t 250μl;
[0126]
总体积300μl;
[0127]
37℃水浴60min,1%琼脂糖凝胶电泳,用小量胶回收试剂盒回收目的片段;
[0128]
4、t7噬菌体载体的处理及准备。
[0129]
将t7噬菌体载体用限制性内切酶ecori和hindⅲ进行双酶切,并回收酶切产物,t7噬菌体载体双酶切体系如下:
[0130]
10
×
h buffer 2μl;
[0131]
ecor i 1μl;
[0132]
hindⅲ1μl;
[0133]
t7 select 10-3b 5μl;
[0134]
h2o 11μl;
[0135]
总体积20μl;
[0136]
37℃水浴60min,按dna片段纯化的操作用小量胶回收试剂盒回收酶切产物;
[0137]
5、zedⅲ片段与t7噬菌体载体的连接,zedⅲ/t重组质粒经过ecori和hindⅲ双酶切电泳后的胶回收所得的目的片段与t7噬菌体载体双酶切后回收所得的酶切产物进行连接,其连接反应体系为:
[0138]
t7噬菌体载体双酶切回收产物0.5μl;
[0139]
zedⅲ/t重组质粒双酶切电泳后的胶回收产物2μl;
[0140]
solution i 2.5μl;
[0141]
总体积5μl;
[0142]
室温连接过夜,得重组噬菌体zedⅲ/t7。
[0143]
6、重组噬菌体zedⅲ/t7的包装
[0144]
利用t7 select packaging kit试剂盒包装zedⅲ/t7重组噬菌体,包装体系为:
[0145]
步骤5的连接产物5μl;
[0146]
t7 packaging extracts 25μl;
[0147]
总体积30μl;
[0148]
室温包装2h后在反应体系中加入270μllb液体培养基终止。
[0149]
7、zedⅲ/t7包装产物的琼脂板扩增
[0150]
100μl zedⅲ/t7包装反应物与250μl于恒温摇床37℃,150rpm/min新鲜培养的blt5403 菌液(od600=0.6~0.8)混匀后,迅速与5ml融化后40℃温浴的上层琼脂混合均匀并铺平板,平板静置至上层琼脂凝固后,37℃过夜倒置培养至形成噬斑。
[0151]
8、zedⅲ/t7重组噬菌体的pcr鉴定及扩增
[0152]
(1)噬菌斑单克隆挑取
[0153]
用高压灭菌的牙签从上层琼脂培养基上挑取独立的、边缘整齐的、圆形半透明单克隆噬菌斑,并在无菌ep管中用牙签捣碎,根据噬斑大小加入50~200μl10mm edta(ph8.0),4℃浸泡过夜,浸出液中含有重组噬菌体。
[0154]
(2)重组噬菌体的pcr鉴定和测序鉴定
[0155]
以噬菌体浸出液上清为模板,以t7-up、t7-down一对引物,对单个噬斑进行pcr鉴定。选出阳性克隆。t7-up和t7-down分别是t7 select 10-3b多克隆位点上下游引物,用于重组噬菌体的鉴定:
[0156]
t7-up:5
’‑
ggagctgtcgtattccagtc-3’;(seq id no.3)
[0157]
t7-down:5
’‑
aacccctcaagacccgttta-3’。(seq id no.4)
[0158]
pcr反应体系:
[0159]
10
×
pcr buffer(mg
2
plus)1μl;
[0160]
10mm dntps 1μl;
[0161]
t7-up(100μm)0.5μl;
[0162]
t7-down(100μm)0.5μl;
[0163]
噬菌体浸出液1μl;
[0164]
taq 0.1μl;
[0165]
h2o 5.9μl;
[0166]
总体积10μl;
[0167]
pcr反应过程:94℃10min;94℃30s,50℃30s,72℃60s,30个循环;72℃10min。将 pcr产物进行琼脂糖凝胶电泳,含有目的片段大小的为阳性。
[0168]
将pcr鉴定选出的阳性重组噬菌体在e.coli blt5403扩增后保存。
[0169]
扩增方法:甘油冻存的e.coli blt5403菌株用在lb固体培养基上划线接种,37℃过夜培养;从平板上挑取单菌落接种5ml lb液体培养基,37℃、150rpm振荡过夜;过夜培养e.coliblt5403菌液按1∶100比例接种5ml lb液体培养基,37℃、150rpm振荡培养至od600=0.6~ 0.8成新鲜e.coli blt5403菌液;将pcr鉴定选出的阳性重组噬菌斑浸出液接种至5ml新鲜 e.coli blt5403菌液37℃、150rpm培养1~3h至菌液澄清并出现细丝状残片;所得噬菌体液4℃离心10000rpm,10min,取上清-80℃或液氮中冻存作为种子。
[0170]
同时将pcr鉴定选出的阳性重组噬菌体用pcr鉴定的相同条件进行pcr扩增,将扩增所得产物进行琼脂糖凝胶电泳回收目的片段,与pgem-t载体连接按照宝生物连接试剂盒试剂的说明书进行连接操作。具体如表9
[0171]
表9
[0172]
[0173][0174]
将上述成分混匀后瞬时离心,室温连接5min。将100ul top10感受态细胞在冰中融化后加入到连接体系中,然后放于冰上5min,42℃热激90s,再放回冰面上静置2min。加入500μl 的不含amp抗性的lb培养基。取200μl涂板,然后放置于37℃恒温培养箱中倒置培养13h。
[0175]
用pcr鉴定阳性菌落,pcr反应体系如下:
[0176]
10
×
pcr buffer(mg
2
plus)1μl;
[0177]
10mm dntps 1μl;
[0178]
t7-up(100μm)0.5μl;
[0179]
t7-down(100μm)0.5μl;
[0180]
噬菌体浸出液1μl;
[0181]
taq 0.1μl;
[0182]
h2o 5.9μl;
[0183]
总体积10μl;
[0184]
pcr反应程序:94℃10min;94℃30s,50℃30s,72℃60s,30个循环;
[0185]
pcr产物进行琼脂糖凝胶电泳后挑选出阳性克隆,送到擎科生物测序以鉴定zedⅲ/t7重组噬菌体插入基因的正确性。
[0186]
9、western blot检测重组蛋白的表达:
[0187]
(1)将测序正确的重组噬菌体样品与5
×
上样缓冲液混合为上样工作液,并在沸水中水浴 10min使蛋白变性,取出待用。
[0188]
(2)将商品化预制sds-page凝胶放置到蛋白电泳槽中组装好,加入1
×
电泳缓冲液至加满,注意不能漏液。
[0189]
(3)把胶上的梳子取下,然后按照25μl/孔上样工作液、7.5μl/孔蛋白marker进行上样, 110v电泳1h。
[0190]
(4)剪裁一张与电泳凝胶大小一致的pvdf膜放置于25%浓度的甲醇溶液中活化1min,然后放入1
×
转膜缓冲液中待用。
[0191]
(5)把完成sds-page凝胶电泳的凝胶样品和剪裁成与凝胶样品大小一致的厚滤纸一同放置于1
×
转膜缓冲液中待用,按照湿转“三明治”的要求组装凝胶与pvdf膜,300ma恒流转膜1h(可以在电泳槽外加入冰水使其降温)(6)待转膜完成,将膜用tbst漂洗,然后置于 30ml封闭液(含有5%脱脂牛奶的tbst)中,室温封闭2h。
[0192]
(7)将抗his-tag的一抗用封闭液1:8000稀释,然后将膜置于一抗稀释液中并放置在水平摇床上4℃过夜孵育。
[0193]
(8)用tbst在水平摇床上洗膜3次,每次10min。
[0194]
(9)将羊抗鼠igg二抗抗体用封闭液1:10000稀释,然后将膜置于二抗稀释液中并
放置在水平摇床上室温孵育2h。
[0195]
(10)用tbst在水平摇床上洗膜3次,每次10min。
[0196]
(11)配制显影液(现用现配),在显影时将显影液滴加到膜上至完全覆盖,避光反应。
[0197]
(12)在uvp仪器中曝光蛋白条带。
[0198]
重组噬菌体t7-zedⅲ的western blot检测结果见图2。
[0199]
10、重组噬菌体zedⅲ/t7的形态学观察:
[0200]
将重组噬菌体(滴度约10
12
pfu/ml)滴加到电镜复膜铜网上,待沉淀15min样品完全干燥后,向样品中滴加2%的磷钨酸(pta)复染1~2min。等待干燥后即可进行电镜观察。可观察到含有尾部的完整噬菌体结构,其头部由约45nm的正多面体构成,尾部长约20nm,宽约5nm,证明了t7噬菌体在重组后仍具有完整的形态结构,外源蛋白的插入并不会改变其形态见图3。
[0201]
11、重组噬菌体zedⅲ/t7遗传稳定性的测定
[0202]
(1)将重组噬菌体做10倍连续稀释,37℃培养4h。选取出现30~100个噬斑的琼脂平板上的噬菌体作为原代重组噬菌体。
[0203]
(2)从原代重组噬菌体挑出5个单克隆进行pcr鉴定,pcr反应体系如下:
[0204]
10
×
pcr buffer(mg
2
plus)1μl;
[0205]
10mm dntps 1μl;
[0206]
t7-up(100μm)0.5μl;
[0207]
t7-down(100μm)0.5μl;
[0208]
噬菌体浸出液1μl;
[0209]
taq 0.1μl;
[0210]
h2o 5.9μl;
[0211]
总体积10μl;
[0212]
pcr反应程序:94℃10min;94℃30s,50℃30s,72℃60s,30个循环;
[0213]
从中挑取一个单克隆培养后按照步骤(1)进行操作,选出二代重组噬菌体。连续传代30 代。
[0214]
(3)每隔5代取样进行pcr鉴定,每隔10代取样进行western blot验证,观察重组噬菌体能否稳定的遗传外源基因。
[0215]
我们在第5、10、15、20、25、30代中每代次取5个单克隆进行pcr鉴定目的基因,并送样测序。结果显示(如图4、5),在每个代次的重组噬菌体pcr扩增得到的基因序列电泳条带都和原代重组噬菌体一致。在第10、20、30代取单克隆经扩增纯化后利用western blot 方法检测外源目的蛋白的表达稳定性,看到在蛋白marker 43-55kda之间有明亮的条带,说明外源蛋白在每个代次之间也能够稳定的表达,结果见图6。
[0216]
12、zedⅲ/t7的大量制备及滴度测定
[0217]
zedⅲ/t7的大量制备:
[0218]
(1)将甘油冻存的e.coli blt5403菌株在lb固体培养基上划线接种,37℃过夜培养;
[0219]
(2)从平板上挑取单菌落接种5ml lb培养基,37℃、150rpm振荡过夜;
[0220]
(3)过夜培养的e.coli blt5403菌液按1∶100比例分别接种5ml、500ml lb液体培养基各一份,37℃、150rpm振荡培养至od600=0.6~0.8,时间为1~3h,得新鲜e.coli blt5403 菌液,存放于4℃备用;
[0221]
(4)接种50μl10
11
pfu/ml zedⅲ/t7噬菌体种子至步骤(3)得到的5ml od600=0.6~ 0.8的新鲜e.coli blt5403菌液中,37℃、150rpm培养1~3h至菌液澄清并出现细丝状残片;
[0222]
(5)将步骤(4)所得噬菌体液接种至步骤(3)得到的500ml od600=0.6~0.8的新鲜 e.coli blt5403菌液中,37℃、150rpm培养3h至菌液澄清并出现细丝状残片;
[0223]
(6)所得噬菌体液4℃离心10000rpm,10min,取上清,加入固体nacl使其终浓度为1m,振摇至溶解,4℃1h或4℃过夜;
[0224]
(7)4℃,10000rpm离心10min,收集上清,向上清中加入peg8000,振荡至完全溶解后,4℃过夜;peg8000与上清的质量体积比1g/10ml;
[0225]
(8)4℃,10000rpm离心30min,弃上清;
[0226]
(9)所得沉淀物用10ml噬菌体稀释液剧烈抽提后,4℃、10000rpm离心15min,收集上清;所述的噬菌体稀释液含有1m nacl,10mm ris-hcl,ph8.0,1mm edta;
[0227]
(10)余下的沉淀物重复一次(9)步骤,即用10ml噬菌体稀释液剧烈抽提后,4℃、10000rpm 离心15min,收集上清,合并收集的上清之后保存。
[0228]
(11)噬菌体滴度测定:取100μl待测噬菌体,用900μl lb液体培养基按10n倍比稀释;取100μl稀释液与250μl新鲜e.coli blt5403菌液(od600=0.6~0.8)混匀后,迅速与5ml融化后40℃温浴的上层琼脂混合均匀并铺平板,平板静置至上层琼脂凝固后,37℃过夜培养至形成噬斑,计数。噬菌体滴度按pfu/ml记数,数值等于“噬斑数
×
稀释倍数
×
10”。例如:如果稀释倍数为106的平板上有50个噬斑,滴度为50
×
106×
10=5
×
108pfu/ml。
[0229]
甲醛灭活zedⅲ/t7重组噬菌体调整zedⅲ/t7重组噬菌体至所需滴度,将甲醛按1∶4000 体积比加入噬菌体中,37℃、100rpm振荡72h,得重组噬菌体灭活液。
[0230]
在灭活噬菌体溶液中加入20%(w/v)的nahso3(终浓度为4.0mg/ml),轻轻摇匀5分钟,使其充分中和甲醛终止灭活。
[0231]
(12)取灭活的重组噬菌体zedⅲ/t7溶液与13mg/ml的al(oh)3按一定比例混合,然后使用pbs调节重组噬菌体的终浓度为2
×
10
12
pfu/ml,al(oh)3的终浓度为2mg/ml,制备成为铝佐剂重组寨卡疫苗。
[0232]
13、所得重组寨卡噬菌体疫苗的免疫试验和效果如下:
[0233]
a、免疫方案
[0234]
将6~8周的balb/c雌性(18~20g)按每组8只进行随机分组,一共设置1组实验组与1 组空载对照组以及1组空白对照组。以10
12
pfu的重组噬菌体zedⅲ/t7注射实验组,以10
12
pfu 的t7噬菌体注射对照组,以pbs注射空白对照组,以上全部加入铝佐剂使用腹腔注射的方法每只小鼠注射500μl。然后在免疫后第二周加强免疫一次。
[0235]
b、检测方法
[0236]
分别与第一次免疫前,第0、2、4、6、8、10、23周对小鼠进行尾静脉采血,每只200μl。采取的血清在37℃放置1h,放于4℃下过夜,取上清。
[0237]
b1/使用elisa试剂盒来检测血清抗-edⅲigg的水平
[0238]
(1)取一定量的edⅲ蛋白溶于10ml的1
×
包被液中使蛋白的终浓度为5μg/ml,混匀。于100μl/孔加入到96孔酶标板中,4℃过夜包被。
[0239]
(2)将96孔板中的液体倒掉。然后将板子拍净。
[0240]
(3)加入1
×
bsa封闭液封闭,200μl/孔,37湿盒1h。倒掉板中的液体,然后将板子拍净。
[0241]
(4)加入实验采集到的免疫后小鼠血清,血清使用1
×
bsa封闭液倍比稀释为1:20、1: 40、1:80、1:160等,同时加入阳参(zika virus envelope antibody)和阴参(免疫实验开始前采集分离到的小鼠血清),100μl/孔,37湿盒1h。
[0242]
(5)利用洗板机对96孔板进行清洗,共四次,每次5min。当最后一次洗完后将板子在吸水纸上拍干。
[0243]
(6)将辣根过氧化物酶结合的羊抗鼠igg按照使用浓度用1
×
bsa进行稀释(1:10000),然后加入96孔板中,100μl/孔,37湿盒1h。
[0244]
(7)洗板,步骤同(5)。
[0245]
(8)将显色液abts substrate solution a与peroxidase solution b在使用前等体积混合, 100μl/孔,室温避光显色15-25min。
[0246]
(9)每孔加入100μl提前稀释好的1
×
终止液终止显色反应。在酶标仪405nm处测定吸光度。
[0247]
(10)如所测样品的od值大于阴参平均值的2.1倍,则判断为阳性,否则视为阴性。
[0248]
b2、血清抗-edⅲigg结合寨卡病毒颗粒能力的检测:
[0249]
具体操作步骤同血清抗-edⅲigg的水平检测,只需要把包被的edⅲ蛋白换为寨卡病毒颗粒。
[0250]
c、实验结果
[0251]
(1)血清抗-edⅲigg水平的检测实验结果表明,在小鼠免疫第2周后就可以观察到的血清抗体水平为1:8000;在第4周加强免疫后,血清抗体水平达到了一个较高的水平为1: 128000;在免疫后第6周血清抗体水平仍保持在1:128000;第八周抗体水平略有下降,为1: 64000;第十周血清抗体水平为1:32000;观察至第23周后发现其血清抗体水平仍能够维持在1:32000。整个免疫周期内小鼠的抗体水平如图8所示。
[0252]
(2)血清抗-edⅲigg结合寨卡病毒颗粒能力的检测结果显示,在首免后两周时,小鼠血清就有了特异结合寨卡病毒颗粒的能力,其效价为1:40。第4、6周的血清表现出同样的效价,在第8周时,血清效价达到了最高,此时为1:160,但是在第10周和23周血清1:20稀释度下并未表现出能特异的结合寨卡病毒颗粒,可能是其效价低于1:20,具体结果见图9和图 10。
[0253]
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
