fcrn抗体及其使用方法
1.优先权主张本技术要求2019年8月1日提交的美国临时专利申请序号62/881,897的权益。上述的全部内容通过引用并入本文。
背景技术:
2.治疗性蛋白质(例如治疗性抗体)已经迅速成为免疫疾病患者的临床重要药物类别。许多自身免疫和同种免疫疾病是由致病性抗体介导的。需要治疗免疫疾病的新方法。
技术实现要素:
3.本公开的特征在于用于静脉内给予针对人类新生儿fc受体(fcrn)的抗体的方法。抗fcrn抗体可用于例如促进受试者自身抗体的清除、抑制受试者的抗原呈递、阻断受试者的免疫应答(例如阻断受试者中基于免疫复合物的免疫应答的激活)或治疗受试者的免疫疾病(例如自身免疫疾病)。
4.本文描述了一种治疗同种免疫和/或自身免疫病症的方法,其包括向受试者静脉内输注5-60或30-60 mg/kg剂量的抗fcrn抗体,其中静脉内输注进行90分钟或更短并且其中抗fcrn抗体包含:1)包含cdr l1、cdr l2和cdr l3的轻链可变区和(2)包含cdr h1、cdr h2和cdr h3的重链可变区,其中:cdr l1包含相对于tgtgsdvgsynlvs (seq id no: 1)的序列具有不多于两个氨基酸取代的序列,cdr l2包含相对于gdserps (seq id no: 2)的序列具有不多于一个氨基酸取代的序列,cdr l3包含相对于ssyagsgiyv (seq id no: 3)的序列具有不多于一个氨基酸取代的序列,cdr h1包含相对于tyamg (seq id no: 4)、dyamg (seq id no: 5)或nyamg (seq id no: 6)的序列具有不多于一个氨基酸取代的序列,cdr h2包含相对于sigssgaqtryads (seq id no: 7)、sigasgsqtryads (seq id no: 8)、sigasgaqtryads (seq id no: 9)或sigasggqtryads (seq id no: 10)的序列具有不多于两个氨基酸取代的序列,且cdr h3包含相对于laigdsy (seq id no: 11)的序列具有不多于一个氨基酸取代的序列。
5.在各种实施方案中:cdr l1包含序列tgtgsdvgsynlvs (seq id no: 1),cdr l2包含序列gdserps (seq id no: 2),cdr l3包含序列ssyagsgiyv (seq id no: 3),cdr h1包含序列tyamg (seq id no: 4),cdr h2包含序列sigasgsqtryads (seq id no: 8),且cdr h3包含序列laigdsy (seq id no: 11);输注进行7-90分钟、7-60分钟、7-45分钟、7-30分钟、10-90分钟、10-60分钟、10-45分钟、10-30分钟或15-30分钟;抗体的fc结构域未被岩藻糖基化;抗体的fc结构域未被糖基化;同种免疫和/或自身免疫病症选自胎儿和新生儿同种免疫血小板减少症、胎儿和新生儿的溶血性疾病、同种免疫泛血小板减少症、先天性心脏传导阻滞、胎儿关节挛缩、新生儿重症肌无力、新生儿自身免疫溶血性贫血、新生儿抗磷脂综合征、新生儿多发性肌炎、皮肌炎、新生儿狼疮、新生儿硬皮病、白塞病、新生儿格雷夫斯病、新生儿川崎病、新生儿自身免疫甲状腺疾病和新生儿i型糖尿病。
6.在各种实施方案中:同种免疫和/或自身免疫病症选自血小板减少症、泛血小板减
少症、先天性心脏传导阻滞、关节挛缩、重症肌无力、自身免疫溶血性贫血、温抗体型自身免疫溶血性贫血、抗磷脂综合征、多发性肌炎、皮肌炎、狼疮、硬皮病、白塞病、格雷夫斯病、川崎病、自身免疫甲状腺疾病和i型糖尿病。
7.在各种实施方案中:所述输注是输注包含5-60 mg/ml的抗体的组合物;所述输注是输注包含30 mg/ml的抗体的组合物;重链包含与seq id no: 20-24中任一个的序列具有至少95%、97%、99%或100%同一性的序列,且轻链包含与seq id no: 19的序列具有至少95%、97%、99%或100%同一性的序列;抗体重链包含seq id no: 20-24中任一个的氨基酸序列,在seq id no: 20-24的296位具有除n以外的氨基酸;所述输注是输注包含10-60 mg/ml的抗体、20-30mm磷酸钠、20-30 mm氯化钠、80-100 mg/ml海藻糖和0.1-0.005% w/v聚山梨酯80的组合物;抗体重链包含seq id no: 24的氨基酸序列,具有相对于seq id no: 24的序列的以下氨基酸取代中的一个或多个:a23v、s30r、l80v、a84t、e85d、a93v,且抗体轻链包含seq id no: 19的氨基酸序列,具有相对于seq id no: 19的序列的以下氨基酸取代中的一个或多个:q38h、v58i和g99d;抗体重链不含有c末端赖氨酸;施用的抗体包含含有seq id no: 19的轻链和含有seq id no: 24或seq id no: 24的变体的重链,其中296位处的氨基酸不是n;抗体以5-30 mg/kg施用;静脉内输注的抗体浓度在10 mg/ml和30 mg/ml之间。
8.在各种实施方案中:受试者是孕妇;剂量基于首次给药时孕妇的体重,而不基于孕妇的体重增加向上调整;剂量是每次施用的剂量,且基于首次给药时孕妇的体重,并基于孕妇的体重增加向上调整;剂量至少每隔一周施用;剂量每隔一周施用;剂量至少每周施用;剂量每周施用;受试者是孕妇,并且第一次输注在妊娠早期施用;受试者是孕妇,并且第一次输注在妊娠中期施用;受试者是孕妇,并且第一次输注在妊娠后期施用;受试者是孕妇,并且孕妇具有严重胎儿贫血的产科史;受试者是孕妇,并且孕妇具有胎儿和新生儿的溶血性疾病的产科史;受试者是孕妇,并且孕妇具有升高的抗rhd、抗rhc或抗kell免疫球蛋白同种抗体滴度;受试者是孕妇,并且孕妇具有升高的抗rhc或抗kell免疫球蛋白同种抗体滴度;受试者是孕妇,并且孕妇具有针对一种或多种抗体的升高的免疫球蛋白同种抗体滴度,所述抗体选自抗lua、lub、bg、kna、yta、e. c. k. cw、fya、ce、ce、d、ce、ce、k、kpa、kpb、fya、m、n、s、lea、leb、fy、jka. diego、p和mia/mur;受试者是孕妇,并且孕妇具有在≤24孕周时严重胎儿贫血或死产的产科史和升高的抗d或抗kell igg同种抗体滴度,并且怀有抗原阳性胎儿;受试者是孕妇,并且第一次输注在妊娠的第12至16周;和受试者是孕妇,并且一次输注在妊娠的第14周期间。
9.一方面,分离的抗体含有:(1)包含cdr l1、cdr l2和cdr l3的轻链可变区和(2)包含cdr h1、cdr h2和cdr h3的重链可变区,其中cdr l1包含相对于tgtgsdvgsynlvs (seq id no: 1)的序列具有不多于两个氨基酸取代的序列,cdr l2包含相对于gdserps (seq id no: 2)的序列具有不多于一个氨基酸取代的序列,cdr l3包含相对于ssyagsgiyv (seq id no: 3)的序列具有不多于一个氨基酸取代的序列,cdr h1包含相对于tyamg (seq id no: 4)、dyamg (seq id no: 5)或nyamg (seq id no: 6)的序列具有不多于一个氨基酸取代的序列,cdr h2包含相对于sigssgaqtryads (seq id no: 7)、sigasgsqtryads (seq id no: 8)、sigasgaqtryads (seq id no: 9)或sigasggqtryads (seq id no: 10)的序列具有不多于两个氨基酸取代的序列,且cdr h3包含相对于laigdsy (seq id no: 11)的序列具有不多于一个氨基酸取代的序列。
10.在一些实施方案中,抗体以小于200、150、100、50或40 pm的kd结合人fcrn。
11.在一些实施方案中,分离的抗体含有具有tgtgsdvgsynlvs (seq id no: 1)的序列的cdr l1,具有gdserps (seq id no: 2)的序列的cdr l2,具有ssyagsgiyv (seq id no: 3)的序列的cdr l3,具有tyamg (seq id no: 4)的序列的cdr h1,具有sigssgaqtryads (seq id no: 7)的序列的cdr h2和具有laigdsy (seq id no: 11)的序列的cdr h3。
12.在一些实施方案中,分离的抗体含有具有tgtgsdvgsynlvs (seq id no: 1)的序列的cdr l1,具有gdserps (seq id no: 2)的序列的cdr l2,具有ssyagsgiyv (seq id no: 3)的序列的cdr l3,具有dyamg (seq id no: 5)的序列的cdr h1,具有sigasgsqtryads (seq id no: 8)的序列的cdr h2和具有laigdsy (seq id no: 11)的序列的cdr h3。
13.在一些实施方案中,分离的抗体含有具有tgtgsdvgsynlvs (seq id no: 1)的序列的cdr l1,具有gdserps (seq id no: 2)的序列的cdr l2,具有ssyagsgiyv (seq id no: 3)的序列的cdr l3,具有nyamg (seq id no: 6)的序列的cdr h1,具有sigasgaqtryads (seq id no: 9)的序列的cdr h2和具有laigdsy (seq id no: 11)的序列的cdr h3。
14.在其他实施方案中,分离的抗体含有具有tgtgsdvgsynlvs (seq id no: 1)的序列的cdr l1,具有gdserps (seq id no: 2)的序列的cdr l2,具有ssyagsgiyv (seq id no: 3)的序列的cdr l3,具有tyamg (seq id no: 4)的序列的cdr h1,具有sigasggqtryads (seq id no: 10)的序列的cdr h2和具有laigdsy (seq id no: 11)的序列的cdr h3。
15.然而在其他实施方案中,分离的抗体含有具有tgtgsdvgsynlvs (seq id no: 1)的序列的cdr l1,具有gdserps (seq id no: 2)的序列的cdr l2,具有ssyagsgiyv (seq id no: 3)的序列的cdr l3,具有tyamg (seq id no: 4)的序列的cdr h1,具有sigasgsqtryads (seq id no: 8)的序列的cdr h2和具有laigdsy (seq id no: 11)的序列的cdr h3。
16.在一些实施方案中,分离抗体的轻链包含与qsaltqpasvsgspgqsitisctgtgsdvgsynlvswyqqhpgkapklmiygdserpsgvsnrfsgsksgntasltisglqaedeadyycssyagsgiyvfgtgtkvtvlgqpkaapsvtlfppsseelqankatlvclisdfypgavtvawkadsspvkagvetttpskqsnnkyaassylsltpeqwkshksyscqvthegstvektvaptecs (seq id no: 19)的序列具有至少90%同一性的序列。
17.在一些实施方案中,分离抗体的重链包含与evqllesggglvqpggslrlscaasgftfstyamgwvrqapgkglewvssigssgaqtryadsvkgrftisrdnskntlylqmnslraedtavyycarlaigdsywgqgtmvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqyastyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg (seq id no: 20)的序列具有至少90%同一性的序列。
18.在其他实施方案中,分离抗体的重链包含与evqllesggglvqpggslrlscaasgftfsdyamgwvrqapgkglewvssigasgsqtryadsvkgrftisrdnskntlylqmnslraedtavyycarlaigdsywgqgtmvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqyastyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg (seq id no: 21)的序列具有至少90%同一性的序列。
19.在其他实施方案中,分离抗体的重链包含与evqllesggglvqpggslrlscaasgftfsnyamgwvrqapgkglewvssigasgaqtryadsvkgrftisrdnskntlylqmnslraedtavyycarlaigdsywgqgtmvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqyastyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg (seq id no: 22)的序列具有至少90%同一性的序列。
20.在一些实施方案中,分离抗体的重链包含与evqllesggglvqpggslrlscaasgftfstyamgwvrqapgkglewvssigasggqtryadsvkgrftisrdnskntlylqmnslraedtavyycarlaigdsywgqgtmvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqyastyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg (seq id no: 23)的序列具有至少90%同一性的序列。
21.在其他实施方案中,分离抗体的重链包含与evqllesggglvqpggslrlscaasgftfstyamgwvrqapgkglewvssigasgsqtryadsvkgrftisrdnskntlylqmnslraedtavyycarlaigdsywgqgtmvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqyastyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg (seq id no: 24)的序列具有至少90%同一性的序列。
22.另一方面,分离抗体具有轻链和重链,其中轻链包含与qsaltqpasvsgspgqsitisctgtgsdvgsynlvswyqqhpgkapklmiygdserpsgvsnrfsgsksgntasltisglqaedeadyycssyagsgiyvfgtgtkvtvlgqpkaapsvtlfppsseelqankatlvclisdfypgavtvawkadsspvkagvetttpskqsnnkyaassylsltpeqwkshksyscqvthegstvektvaptecs (seq id no: 19)的序列具有至少90%、95%、98%或99%同一性的序列;且重链包含与evqllesggglvqpggslrlscaasgftfstyamgwvrqapgkglewvssigssgaqtryadsvkgrftisrdnskntlylqmnslraedtavyycarlaigdsywgqgtmvtvssastkgpsvfplapsskstsggtaalgcl
vkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqyastyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg (seq id no: 20)的序列具有至少90%、95%、98%或99%同一性的序列。
23.另一方面,分离抗体具有轻链和重链,其中轻链包含与qsaltqpasvsgspgqsitisctgtgsdvgsynlvswyqqhpgkapklmiygdserpsgvsnrfsgsksgntasltisglqaedeadyycssyagsgiyvfgtgtkvtvlgqpkaapsvtlfppsseelqankatlvclisdfypgavtvawkadsspvkagvetttpskqsnnkyaassylsltpeqwkshksyscqvthegstvektvaptecs (seq id no: 19)的序列具有至少90%、95%、98%或99%同一性的序列;且重链包含与evqllesggglvqpggslrlscaasgftfsdyamgwvrqapgkglewvssigasgsqtryadsvkgrftisrdnskntlylqmnslraedtavyycarlaigdsywgqgtmvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqyastyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg (seq id no: 21)的序列具有至少90%、95%、98%或99%同一性的序列。
24.另一方面,分离抗体具有轻链和重链,其中轻链包含与qsaltqpasvsgspgqsitisctgtgsdvgsynlvswyqqhpgkapklmiygdserpsgvsnrfsgsksgntasltisglqaedeadyycssyagsgiyvfgtgtkvtvlgqpkaapsvtlfppsseelqankatlvclisdfypgavtvawkadsspvkagvetttpskqsnnkyaassylsltpeqwkshksyscqvthegstvektvaptecs (seq id no: 19)的序列具有至少90%、95%、98%或99%同一性的序列;且重链包含与evqllesggglvqpggslrlscaasgftfsnyamgwvrqapgkglewvssigasgaqtryadsvkgrftisrdnskntlylqmnslraedtavyycarlaigdsywgqgtmvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqyastyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg (seq id no: 22)的序列具有至少90%、95%、98%或99%同一性的序列。
25.另一方面,分离抗体具有轻链和重链,其中轻链包含与qsaltqpasvsgspgqsitisctgtgsdvgsynlvswyqqhpgkapklmiygdserpsgvsnrfsgsksgntasltisglqaedeadyycssyagsgiyvfgtgtkvtvlgqpkaapsvtlfppsseelqankatlvclisdfypgavtvawkadsspvkagvetttpskqsnnkyaassylsltpeqwkshksyscqvthegstvektvaptecs (seq id no: 19)的序列具有至少90%、95%、98%或99%同一性的序列;且重链包含与evqllesggglvqpggslrlscaasgftfstyamgwvrqapgkglewvssigasggqtryadsvkgrftisrdnskntlylqmnslraedtavyycarlaigdsywgqgtmvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqyastyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfy
psdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg (seq id no: 23)的序列具有至少90%、95%、98%或99%同一性的序列。
26.又一方面,分离抗体具有轻链和重链,其中轻链包含与qsaltqpasvsgspgqsitisctgtgsdvgsynlvswyqqhpgkapklmiygdserpsgvsnrfsgsksgntasltisglqaedeadyycssyagsgiyvfgtgtkvtvlgqpkaapsvtlfppsseelqankatlvclisdfypgavtvawkadsspvkagvetttpskqsnnkyaassylsltpeqwkshksyscqvthegstvektvaptecs (seq id no: 19)的序列具有至少90%、95%、98%或99%同一性的序列;且重链包含与evqllesggglvqpggslrlscaasgftfstyamgwvrqapgkglewvssigasgsqtryadsvkgrftisrdnskntlylqmnslraedtavyycarlaigdsywgqgtmvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqyastyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg (seq id no: 24)序列具有至少90%、95%、98%或99%同一性的序列。
27.在一些实施方案中,抗体包含含有与以下至少95%、97%、99%或100%相同的氨基酸序列的轻链可变区:qsaltqpasvsgspgqsitisctgtgsdvgsynlvswyqqhpgkapklmiygdserpsgvsnrfsgsksgntasltisglqaedeadyycssyagsgiyvfgtgtkvtvl (seq id no: x)。在一些实施方案中,轻链可变区含有具有tgtgsdvgsynlvs (seq id no: 1)的序列的cdr l1,具有gdserps (seq id no: 2)的序列的cdr l2,具有ssyagsgiyv (seq id no: 3)的序列的cdr l3。在一些实施方案中,抗体包含含有与以下至少95%、97%、99%或100%相同的氨基酸序列的重链可变区:evqllesggglvqpggslrlscaasgftfstyamgwvrqapgkglewvssigasgsqtryadsvkgrftisrdnskntlylqmnslraedtavyycarlaigdsywgqgtmvtvss (seq id no: y)。在一些实施方案中,重链可变区含有具有tyamg (seq id no: 4)的序列的cdr h1,具有sigasgsqtryads (seq id no: 8)的序列的cdr h2,和具有laigdsy (seq id no: 11)的序列的cdr h3。
28.在一些实施方案中,分离抗体的重链包含与seq id no: 20-24中任一个的序列具有至少95%、97%、99%或100%同一性的序列。在其他实施方案中,分离抗体的轻链包含与seq id no: 19的序列具有至少95%、97%、99%或100%同一性的序列。
29.在一些实施方案中,分离抗体的重链包含相对于seq id no: 20-24中任一个的氨基酸序列具有不多于5、4、3、2或1个单个氨基酸取代的序列。在一些实施方案中,分离抗体的轻链包含相对于seq id no: 19的序列具有不多于5、4、3、2或1个单个氨基酸取代的序列。
30.在一些实施方案中,分离抗体进一步包含相对于seq id no: 20-24中任一个的序列的氨基酸取代n297a(根据eu编号)。
31.在其他实施方案中,分离抗体进一步包含相对于seq id no: 20-24中任一个的序列的氨基酸取代d355e和l357m(根据eu编号)。
32.在其他实施方案中,分离抗体进一步包含相对于seq id no: 20-24中任一个的序列的以下氨基酸取代中的任一个或多个:a23v、s30r、l80v、a84t、e85d、a93v(根据eu编号),和相对于seq id no: 19的序列的q38h、v58i和g99d(根据eu编号)。
33.在又一实施方案中,相对于seq id no: 20-24中任一个的序列,分离抗体在残基446处不含有c末端赖氨酸。
34.在一些实施方案中,上述任一方面的抗体以小于或等于具有n022、n023、n024、n026或n027的轻链可变区和重链可变区且还具有与所比较的抗体相同的fc区的抗体的kd结合人fcrn。例如,在特定的kd测定中,抗体的kd小于200、150、100、50或40 pm。
35.根据kabat的eu索引(sequences of proteins of immuno:logical interest, 第5版。public health service, national institutes of health, bethesda, md. (1991))定义指定给本文所述任何分离的抗体的互补决定区(cdr)和框架区(fr)的氨基酸位置。fc区序列位置根据eu编号(edelman等人, proc natl acad usa, 63:78-85 (1969)。
36.另一方面,分离抗体具有轻链和重链,其中轻链包含以下序列或由其组成:qsaltqpasvsgspgqsitisctgtgsdvgsynlvswyqqhpgkapklmiygdserpsgvsnrfsgsksgntasltisglqaedeadyycssyagsgiyvfgtgtkvtvlgqpkaapsvtlfppsseelqankatlvclisdfypgavtvawkadsspvkagvetttpskqsnnkyaassylsltpeqwkshksyscqvthegstvektvaptecs (seq id no: 19);且重链包含以下序列或由其组成:evqllesggglvqpggslrlscaasgftfstyamgwvrqapgkglewvssigssgaqtryadsvkgrftisrdnskntlylqmnslraedtavyycarlaigdsywgqgtmvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqyastyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg (seq id no: 20)。
37.另一方面,分离抗体具有轻链和重链,其中轻链包含以下序列或由其组成:qsaltqpasvsgspgqsitisctgtgsdvgsynlvswyqqhpgkapklmiygdserpsgvsnrfsgsksgntasltisglqaedeadyycssyagsgiyvfgtgtkvtvlgqpkaapsvtlfppsseelqankatlvclisdfypgavtvawkadsspvkagvetttpskqsnnkyaassylsltpeqwkshksyscqvthegstvektvaptecs (seq id no: 19);且重链包含以下序列或由其组成:evqllesggglvqpggslrlscaasgftfsdyamgwvrqapgkglewvssigasgsqtryadsvkgrftisrdnskntlylqmnslraedtavyycarlaigdsywgqgtmvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqyastyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg (seq id no: 21)。
38.另一方面,分离抗体具有轻链和重链,其中轻链包含以下序列:qsaltqpasvsgspgqsitisctgtgsdvgsynlvswyqqhpgkapklmiygdserpsgvsnrfsgsksgntasltisglqaedeadyycssyagsgiyvfgtgtkvtvlgqpkaapsvtlfppsseelqankatlvclisdfypgavtvawkadsspvkagvetttpskqsnnkyaassylsltpeqwkshksyscqvthegstvektvaptecs (seq id no: 19);且重链包含以下序列或由其组成:evqllesggglvqpggslrlscaasgftfsnyamgwvrqapgkglewvssigasgaqtryadsvkgrf
tisrdnskntlylqmnslraedtavyycarlaigdsywgqgtmvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqyastyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg (seq id no: 22)。
39.另一方面,分离抗体具有轻链和重链,其中轻链包含以下序列或由其组成:qsaltqpasvsgspgqsitisctgtgsdvgsynlvswyqqhpgkapklmiygdserpsgvsnrfsgsksgntasltisglqaedeadyycssyagsgiyvfgtgtkvtvlgqpkaapsvtlfppsseelqankatlvclisdfypgavtvawkadsspvkagvetttpskqsnnkyaassylsltpeqwkshksyscqvthegstvektvaptecs (seq id no: 19);且重链包含以下序列或由其组成:evqllesggglvqpggslrlscaasgftfstyamgwvrqapgkglewvssigasggqtryadsvkgrftisrdnskntlylqmnslraedtavyycarlaigdsywgqgtmvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqyastyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg (seq id no: 23)。
40.又一方面,分离抗体具有轻链和重链,其中轻链包含以下序列或由其组成:qsaltqpasvsgspgqsitisctgtgsdvgsynlvswyqqhpgkapklmiygdserpsgvsnrfsgsksgntasltisglqaedeadyycssyagsgiyvfgtgtkvtvlgqpkaapsvtlfppsseelqankatlvclisdfypgavtvawkadsspvkagvetttpskqsnnkyaassylsltpeqwkshksyscqvthegstvektvaptecs (seq id no: 19);且重链包含以下序列或由其组成:evqllesggglvqpggslrlscaasgftfstyamgwvrqapgkglewvssigasgsqtryadsvkgrftisrdnskntlylqmnslraedtavyycarlaigdsywgqgtmvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqyastyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspg (seq id no: 24)。
41.另一方面,本公开的特征在于增加受试者的igg分解代谢的方法。另一方面,本公开的特征在于减少受试者的自身抗体的方法。又一方面,本公开的特征在于治疗或减少受试者中基于免疫复合物的免疫应答的激活的方法。所述方法包括向受试者施用本文所述的任何分离的抗体或包含本文所述的任何分离的抗体的药物组合物。
42.在一些实施方案中,受试者的免疫应答是急性或慢性免疫应答。
43.在一些实施方案中,受试者患有选自以下的医学病况或由所述医学病况激活急性免疫应答:寻常性天疱疮、狼疮性肾炎、重症肌无力、格林-巴利综合征、抗体介导的排斥反应、灾难性抗磷脂抗体综合征、免疫复合物介导的血管炎、肾小球炎、离子通道病、视神经脊髓炎、自身免疫听力丧失、特发性血小板减少性紫癜(itp)、自身免疫溶血性贫血(aiha)、免
疫粒细胞减少症、扩张型心肌病和血清病。
44.在一些实施方案中,受试者患有选自以下的医学病况或由所述医学病况激活慢性免疫应答:慢性炎性脱髓鞘性多发性神经病(cidp)、系统性狼疮、指示急性治疗的慢性形式的病症、反应性关节病、原发性胆汁性肝硬化、溃疡性结肠炎和抗中性粒细胞胞质抗体(anca)相关血管炎。
45.在一些实施方案中,受试者患有自身免疫疾病或由自身免疫疾病激活免疫应答。特别地,自身免疫疾病选自斑秃、强直性脊柱炎、抗磷脂综合征、阿狄森病、溶血性贫血、自身免疫肝炎、肝炎、白塞病、大疱性类天疱疮、心肌病、乳糜泻口皮炎、慢性疲劳免疫功能障碍综合征、慢性炎性脱髓鞘性多发性神经病、变应性肉芽肿性血管炎、瘢痕性类天疱疮、局限性硬皮病(crest综合征)、冷凝集素病、克罗恩病、皮肌炎、盘状狼疮、特发性混合冷球蛋白血症、纤维肌痛、纤维肌炎、格雷夫斯病、桥本甲状腺炎、甲状腺功能减退、炎性肠病、自身免疫淋巴增生综合征、特发性肺纤维化、iga肾病、胰岛素依赖型糖尿病、幼年关节炎、扁平苔藓、狼疮、美尼尔氏综合症、混合性结缔组织病、多发性硬化症、恶性贫血、结节性多动脉炎、多发性软骨炎、多腺体综合征、风湿性多发性肌痛症、多发性肌炎、原发性无丙种球蛋白血症、原发性胆汁性肝硬化、牛皮癣、雷诺现象、赖特综合征、风湿热、类风湿关节炎、肉样瘤病、硬皮病、干燥综合征、僵人综合征、大动脉炎、颞动脉炎、溃疡性结肠炎、葡萄膜炎、白癜风和韦格纳肉芽肿病。
46.另一方面,本公开的特征在于治疗胎儿和新生儿同种免疫和/或自身免疫病症的方法,所述方法包括向怀孕受试者iv施用本文所述的抗体、由向怀孕受试者iv施用本文所述的抗体组成或基本上由其组成。
47.在所有方面的一些实施方案中,受试者具有先前已患有胎儿和新生儿同种免疫和/或自身免疫病症的历史。例如,在一些实施方案中,怀孕受试者先前已经怀孕,其中胎儿或新生儿已经患有胎儿和新生儿同种免疫和/或自身免疫病症。在所有方面的一些实施方案中,受试者处于患有胎儿和新生儿同种免疫和/或自身免疫病症的风险中。
48.在所有方面的一些实施方案中,胎儿和新生儿同种免疫和/或自身免疫病症选自胎儿和新生儿同种免疫血小板减少症、胎儿和新生儿的溶血性疾病、同种免疫泛血小板减少症、先天性心脏传导阻滞、胎儿关节挛缩、新生儿重症肌无力、新生儿自身免疫溶血性贫血、新生儿抗磷脂综合征、新生儿多发性肌炎、皮肌炎、新生儿狼疮、新生儿硬皮病、白塞病、新生儿格雷夫斯病、新生儿川崎病、新生儿自身免疫甲状腺疾病和新生儿i型糖尿病。在所有方面的一些实施方案中,胎儿和新生儿自身免疫和/或自身免疫病症是胎儿和新生儿的溶血性疾病。在所有方面的一些实施方案中,胎儿和新生儿自身免疫和/或自身免疫病症是胎儿和新生儿同种免疫血小板减少症。在所有方面的一些实施方案中,胎儿和新生儿自身免疫和/或自身免疫病症是先天性心脏传导阻滞。
49.在所有方面的一些实施方案中,治疗降低流产的风险。
50.在所有方面的一些实施方案中,受试者具有先前已患有胎儿和新生儿同种免疫和/或自身免疫病症的历史。例如,在一些实施方案中,怀孕受试者先前已经怀孕,其中胎儿或新生儿患有胎儿和新生儿同种免疫和/或自身免疫病症。在所有方面的一些实施方案中,受试者处于患有胎儿和新生儿同种免疫和/或自身免疫病症的风险中。
51.在所有方面的一些实施方案中,胎儿和新生儿同种免疫和/或自身免疫病症选自
胎儿和新生儿同种免疫血小板减少症、胎儿和新生儿的溶血性疾病、同种免疫泛血小板减少症、先天性心脏传导阻滞、胎儿关节挛缩、新生儿重症肌无力、新生儿自身免疫溶血性贫血、新生儿抗磷脂综合征、新生儿多发性肌炎、皮肌炎、新生儿狼疮、新生儿硬皮病、白塞病、新生儿格雷夫斯病、新生儿川崎病、新生儿自身免疫甲状腺疾病和新生儿i型糖尿病。在所有方面的一些实施方案中,胎儿和新生儿自身免疫和/或自身免疫病症是胎儿和新生儿的溶血性疾病。在所有方面的一些实施方案中,胎儿和新生儿自身免疫和/或自身免疫病症是胎儿和新生儿同种免疫血小板减少症。在所有方面的一些实施方案中,胎儿和新生儿自身免疫和/或自身免疫病症是先天性心脏传导阻滞。在所有方面的一些实施方案中,治疗降低流产的风险。
52.在所有方面的一些实施方案中,所述方法治疗怀孕受试者、怀孕受试者的胎儿和/或其组合。
53.在所有方面的一些实施方案中,自身免疫病症选自斑秃、强直性脊柱炎、抗磷脂综合征、阿狄森病、溶血性贫血、自身免疫肝炎、肝炎、白塞病、大疱性类天疱疮、心肌病、乳糜泻口皮炎、慢性疲劳免疫功能障碍综合征、慢性炎性脱髓鞘性多发性神经病、变应性肉芽肿性血管炎、瘢痕性类天疱疮、局限性硬皮病(crest综合征)、冷凝集素病、克罗恩病、皮肌炎、盘状狼疮、特发性混合冷球蛋白血症、纤维肌痛、纤维肌炎、格雷夫斯病、桥本甲状腺炎、甲状腺功能减退、炎性肠病、自身免疫淋巴增生综合征、特发性肺纤维化、iga肾病、胰岛素依赖型糖尿病、幼年关节炎、扁平苔藓、狼疮、美尼尔氏综合症、混合性结缔组织病、多发性硬化症、恶性贫血、结节性多动脉炎、多发性软骨炎、多腺体综合征、风湿性多发性肌痛症、多发性肌炎、原发性无丙种球蛋白血症、原发性胆汁性肝硬化、牛皮癣、雷诺现象、赖特综合征、风湿热、类风湿关节炎、肉样瘤病、硬皮病、干燥综合征、僵人综合征、大动脉炎、颞动脉炎、溃疡性结肠炎、葡萄膜炎、白癜风或韦格纳肉芽肿病。
54.还描述了降低自身免疫或同种免疫病症的风险或降低发展自身免疫或同种免疫病症的风险的方法,其包括向怀孕受试者iv施用本文所述的fcrn抗体、由向怀孕受试者iv施用本文所述的fcrn抗体组成或基本上由其组成。
55.另一方面,本公开的特征在于增加受试者的抗体分解代谢的方法,所述方法包括向怀孕受试者iv施用本文所述的抗体、由向怀孕受试者iv施用本文所述的抗体组成或基本上由其组成。
56.在所有方面的一些实施方案中,增加抗体分解代谢包括增加致病性抗体分解代谢。在所有方面的一些实施方案中,致病性抗体对母亲、胎儿或母亲和胎儿二者是致病性的。在所有方面的一些实施方案中,致病性抗体是igg抗体。在所有方面的一些实施方案中,抗体在怀孕受试者的胎儿中引起胎儿和新生儿同种免疫和/或自身免疫病症。
57.在所有方面的一些实施方案中,胎儿和新生儿同种免疫和/或自身免疫病症选自胎儿和新生儿同种免疫血小板减少症、胎儿和新生儿的溶血性疾病、同种免疫泛血小板减少症、先天性心脏传导阻滞、胎儿关节挛缩、新生儿重症肌无力、新生儿自身免疫溶血性贫血、新生儿抗磷脂综合征、新生儿多发性肌炎、皮肌炎、新生儿狼疮、新生儿硬皮病、白塞病、新生儿格雷夫斯病、新生儿川崎病、新生儿自身免疫甲状腺疾病和新生儿i型糖尿病。
58.另一方面,本公开的特征在于减少受试者的自身抗体的方法,所述方法包括向怀孕受试者施用本文所述的抗体、由向怀孕受试者施用本文所述的抗体组成或基本上由其组
成。
59.在所有方面的一些实施方案中,免疫应答是受试者的急性或慢性免疫应答。
60.在所有方面的一些实施方案中,急性免疫应答由选自以下的医学病况激活:寻常性天疱疮、狼疮性肾炎、重症肌无力、格林-巴利综合征、抗体介导的排斥反应、灾难性抗磷脂抗体综合征、免疫复合物介导的血管炎、肾小球炎、离子通道病、视神经脊髓炎、自身免疫听力丧失、特发性血小板减少性紫癜、自身免疫溶血性贫血、免疫粒细胞减少症、扩张型心肌病和血清病。例如,在一些实施方案中,急性免疫应答由怀孕受试者的医学病况激活。例如,在一些实施方案中,急性免疫应答在胎儿或新生儿中由怀孕受试者的医学病况激活。在所有方面的一些实施方案中,急性免疫应答由怀孕受试者的医学病况激活。在所有方面的一些实施方案中,急性免疫应答在胎儿或新生儿中由怀孕受试者的医学病况激活。在所有方面的一些实施方案中,急性免疫应答由特发性血小板减少性紫癜激活。在所有方面的一些实施方案中,急性免疫应答由寻常性天疱疮激活。在所有方面的一些实施方案中,急性免疫应答由灾难性抗磷脂抗体综合征激活。在所有方面的一些实施方案中,急性免疫应答由视神经脊髓炎激活。在所有方面的一些实施方案中,急性免疫应答由抗体介导的排斥反应激活。在所有方面的一些实施方案中,急性免疫应答由重症肌无力激活。
61.本文还描述了治疗胎儿和新生儿同种免疫和/或自身免疫病症的方法,其包括例如以15 mg/kg或30 mg/kg的剂量(例如每周给药),向受试者(例如怀孕受试者)施用m281(例如具有seq id no: 19的轻链序列和具有seq id no: 24(或其变体(例如其中seq id no: 24的296位氨基酸不是n的变体)的重链序列的抗体)、由其组成或基本上由其组成。在一些情况下,所述方法包括如果受试者表现出低白蛋白血症(例如血清白蛋白水平低于30g/l、25g/l、20g/l)则停止施用。还描述了包括治疗胎儿和新生儿同种免疫和/或自身免疫病症、由治疗胎儿和新生儿同种免疫和/或自身免疫病症组成或基本上由其组成的方法,所述方法包括向怀孕受试者施用本文所述的抗体(例如以15 mg/kg或30 mg/kg的剂量,例如每周给药),并且如果受试者表现出低白蛋白血症(例如,血清白蛋白水平低于30g/l、25g/l、20g/l),则施用白蛋白。还描述了包括治疗胎儿和新生儿同种免疫和/或自身免疫病症、由治疗胎儿和新生儿同种免疫和/或自身免疫病症组成或基本上由其组成的方法,所述方法包括向怀孕受试者施用本文所述的抗体(例如以15 mg/kg或30 mg/kg的剂量,例如每周给药),并且如果受试者表现出低白蛋白血症(例如,血清白蛋白水平低于30g/l、25g/l、20g/l),则施用高渗溶液(例如甘露醇或本领域已知的其它溶液)。还描述了包括治疗胎儿和新生儿同种免疫和/或自身免疫病症、由治疗胎儿和新生儿同种免疫和/或自身免疫病症组成或基本上由其组成的方法,所述方法包括向怀孕受试者施用m281(例如以15 mg/kg或30 mg/kg的剂量,例如每周给药),并且在施用m281之前或之后测试受试者的血清白蛋白水平至少一次。在该方法的一些情况下,可以继续或不继续施用m281。
62.在所有方面的一些实施方案中,慢性免疫应答由选自以下的医学病况激活:慢性炎性脱髓鞘性多发性神经病(cidp)、系统性狼疮、反应性关节病、原发性胆汁性肝硬化、溃疡性结肠炎和抗中性粒细胞胞质抗体相关血管炎。在所有方面的一些实施方案中,慢性免疫应答由慢性炎性脱髓鞘性多发性神经病激活。
63.在所有方面的一些实施方案中,受试者患有自身免疫疾病。在所有方面的一些实施方案中,自身免疫疾病选自斑秃、强直性脊柱炎、抗磷脂综合征、阿狄森病、溶血性贫血、
温抗体型自身免疫溶血性贫血、抗因子抗体、肝素诱导的血小板减少症、致敏移植、自身免疫肝炎、肝炎、白塞病、大疱性类天疱疮、心肌病、乳糜泻口皮炎、慢性疲劳免疫功能障碍综合征、慢性炎性脱髓鞘性多发性神经病、变应性肉芽肿性血管炎、瘢痕性类天疱疮、局限性硬皮病(crest综合征)、冷凝集素病、克罗恩病、皮肌炎、盘状狼疮、特发性混合冷球蛋白血症、纤维肌痛、纤维肌炎、格雷夫斯病、桥本甲状腺炎、甲状腺功能减退、炎性肠病、自身免疫淋巴增生综合征、特发性肺纤维化、iga肾病、胰岛素依赖型糖尿病、幼年关节炎、扁平苔藓、狼疮、美尼尔氏综合症、混合性结缔组织病、多发性硬化症、恶性贫血、结节性多动脉炎、多发性软骨炎、多腺体综合征、风湿性多发性肌痛症、多发性肌炎、原发性无丙种球蛋白血症、原发性胆汁性肝硬化、牛皮癣、雷诺现象、赖特综合征、风湿热、类风湿关节炎、肉样瘤病、硬皮病、干燥综合征、僵人综合征、大动脉炎、颞动脉炎、溃疡性结肠炎、葡萄膜炎、白癜风和韦格纳肉芽肿病。在所有方面的一些实施方案中,自身免疫疾病是温抗体型自身免疫溶血性贫血。在所有方面的一些实施方案中,自身免疫疾病是抗因子抗体。在所有方面的一些实施方案中,自身免疫疾病是肝素诱导的血小板减少症。在所有方面的一些实施方案中,自身免疫疾病是是致敏移植。
64.另一方面,本公开的特征在于减少抗体穿过怀孕受试者的胎盘的转运的方法,所述方法包括、由其组成。
65.另一方面,本公开的特征在于治疗胎儿或新生儿中抗体介导的病毒性疾病增强的方法,所述方法包括向怀孕受试者施用抗体、由向怀孕受试者施用抗体组成或基本上由其组成,其中抗体包括以下、由以下组成或基本上由以下组成:轻链和重链,其中轻链包含与seq id no: 19的序列具有至少90%同一性的序列、由其组成或基本上由其组成;且重链包含与选自seq id no: 20、seq id no: 21、seq id no: 22、seq id no: 23和seq id no: 24的序列具有至少90%同一性的序列、由其组成或基本上由其组成。
66.另一方面,本公开的特征在于治疗胎儿或新生儿中抗体介导的病毒性疾病增强的方法,所述方法包括向怀孕受试者施用抗体、由向怀孕受试者施用抗体组成或基本上由其组成,其中所述抗体包括以下、由以下组成或基本上由以下组成:轻链和重链,其中轻链包含seq id no: 19的序列、由其组成或基本上由其组成;且重链包含选自seq id no: 20、seq id no: 21、seq id no: 22、seq id no: 23和seq id no: 24的序列、由其组成或基本上由其组成。
67.在所有方面的一些实施方案中,病毒性疾病由选自以下的病毒引起:α病毒感染、黄病毒感染、寨卡病毒感染、奇昆古尼亚病毒感染、罗斯河病毒感染、严重急性呼吸综合征冠状病毒感染、中东呼吸综合征、禽流感感染、流感病毒感染、人呼吸道合胞病毒感染、埃博拉病毒感染、黄热病病毒感染、登革热病毒感染、人免疫缺陷病毒感染、呼吸道合胞病毒感染、汉坦病毒感染、getah病毒感染、辛德毕斯病毒感染、bunyamwera病毒感染、西尼罗病毒感染、日本脑炎病毒b感染、兔痘病毒感染、乳酸脱氢酶升高病毒感染、呼肠孤病毒感染、狂犬病病毒感染、口蹄疫病毒感染、猪繁殖与呼吸综合征病毒感染、猴出血热病毒感染、马传染性贫血病毒感染、山羊关节炎病毒感染、非洲猪瘟病毒感染、慢病毒感染、bk乳多空病毒感染、墨累山谷脑炎病毒感染、肠道病毒感染、巨细胞病毒感染、肺病毒感染、麻疹病毒(morbillivirus)感染和麻疹(measles)病毒感染。
68.在所有方面的一些实施方案中,怀孕受试者患有在怀孕受试者中激活免疫应答的
医学病况或处于患有所述医学病况的风险中。在所有方面的一些实施方案中,医学病况是寻常性天疱疮、狼疮性肾炎、重症肌无力、格林-巴利综合征、抗体介导的排斥反应、灾难性抗磷脂抗体综合征、免疫复合物介导的血管炎、肾小球炎、离子通道病、视神经脊髓炎、自身免疫听力丧失、特发性血小板减少性紫癜、自身免疫溶血性贫血、免疫粒细胞减少症、扩张性心肌病、血清病、慢性炎性脱髓鞘性多发性神经病、系统性狼疮、反应性关节病、原发性胆汁性肝硬化、溃疡性结肠炎、抗中性粒细胞胞质抗体(anca)相关血管炎、斑秃、强直性脊柱炎、抗磷脂综合征、阿狄森病、溶血性贫血、自身免疫肝炎、肝炎、白塞病、大疱性类天疱疮、心肌病、乳糜泻口皮炎、慢性疲劳免疫功能障碍综合征、慢性炎性脱髓鞘性多发性神经病、变应性肉芽肿性血管炎、瘢痕性类天疱疮、局限性硬皮病(crest综合征)、冷凝集素病、克罗恩病、皮肌炎、盘状狼疮、特发性混合冷球蛋白血症、纤维肌痛、纤维肌炎、格雷夫斯病、桥本甲状腺炎、甲状腺功能减退、炎性肠病、自身免疫淋巴增生综合征、特发性肺纤维化、iga肾病、胰岛素依赖型糖尿病、幼年关节炎、扁平苔藓、狼疮、美尼尔氏综合症、混合性结缔组织病、多发性硬化症、恶性贫血、结节性多动脉炎、多发性软骨炎、多腺体综合征、风湿性多发性肌痛症、多发性肌炎、原发性无丙种球蛋白血症、原发性胆汁性肝硬化、牛皮癣、雷诺现象、赖特综合征、风湿热、类风湿关节炎、肉样瘤病、硬皮病、干燥综合征、僵人综合征、大动脉炎、颞动脉炎、溃疡性结肠炎、葡萄膜炎、白癜风和韦格纳肉芽肿病。
69.在所有方面的一些实施方案中,受试者具有先前的胎儿和新生儿患有胎儿和新生儿同种免疫和/或自身免疫病症的历史。例如,在一些实施方案中,怀孕受试者先前已经怀孕,其中胎儿或新生儿患有胎儿和新生儿同种免疫和/或自身免疫病症。
70.在所有方面的一些实施方案中,在从怀孕受试者获得的生物样品中检测到与免疫疾病相关的抗体。在所有方面的一些实施方案中,生物样品是血液或尿液样品。在所有方面的一些实施方案中,生物样品是血液样品。
71.另一方面,本公开的特征在于治疗胎儿和新生儿同种免疫和/或自身免疫病症或降低其发展风险的方法,所述方法包括:向孕妇iv施用包含抗体(m281)的组合物,所述抗体包含具有seq id no: 19的氨基酸序列的轻链和具有seq id no: 24的氨基酸序列的重链,其中m281的施用在34周孕龄后停止。
72.另一方面,本公开的特征在于治疗胎儿和新生儿同种免疫和/或自身免疫病症或降低其发展风险的方法,其包括向孕妇施用包含抗体(m281)的组合物,所述抗体包含具有seq id no: 19的氨基酸序列的轻链和具有seq id no: 24的氨基酸序列的重链,其中m281的施用在出生前至少一周停止。
73.在所有方法的各个方面中,所述方法包括:在停止施用m281后和出生前(例如,出生前40-100小时或1-15天)向孕妇施用ivig;在35孕周后停止施用m281;在36、37或38孕周之前停止施用m281;基于孕妇体重以200 mg/kg-1000 mg/kg施用ivig;基于孕妇体重以30 mg/kg施用m281;基于孕妇体重以15 mg/kg施用m281;剂量是每次施用的剂量,且基于首次给药时孕妇的体重,而不基于孕妇的体重增加向上调整;剂量是每次施用的剂量,且基于首次给药时孕妇的体重,并基于孕妇的体重增加向上调整;组合物至少每隔一周施用;组合物每隔一周施用;组合物至少每周施用;组合物每周施用;在妊娠早期开始施用;在妊娠中期开始施用;在妊娠后期开始施用;施用途径为静脉内;孕妇具有严重胎儿贫血的产科史;孕妇具有升高的抗rhd、抗rhc或抗kell免疫球蛋白同种抗体滴度;孕妇具有升高的抗rhc或抗
kell免疫球蛋白同种抗体滴度;孕妇具有针对一种或多种抗体的升高的免疫球蛋白同种抗体滴度,所述抗体选自抗lua、lub、bg、kna、yta、e. c. k. cw、fya、ce、ce、d、ce、ce、k、kpa、kpb、fya、m、n、s、lea、leb、fy、jka. diego、p和mia/mur;孕妇具有在≤24孕周时严重胎儿贫血或死产的产科史和升高的抗d或抗kell igg同种抗体滴度,并且怀有抗原阳性胎儿;第一次给药在妊娠的第12至16周;第一次给药在妊娠的第14周期间;且在妊娠早期开始施用。
74.在所有方法的各个方面中,输注时间是相同的且进行90分钟或更短、60分钟或更短、45分钟或更短、30分钟或更短、15分钟或更短或7分钟或更短。在所有方法的各个方面中,第一次输注进行90分钟或更短、60分钟或更短、45分钟或更短、30分钟或更短、15分钟或更短,且随后的输注时间减少。在一些实施方案中,第二次输注和第三次输注时间相同,进行60分钟或更短、45分钟或更短、30分钟或更短、15分钟或更短或7分钟或更短,且随后的输注时间减少。在所有方法的各个方面中,第一次输注和第二次输注时间相同,进行90分钟或更短、60分钟或更短、45分钟或更短、30分钟或更短、15分钟或更短,且随后的输注时间减少。在所有方法的各个方面中,第一次输注进行60分钟且随后的输注进行45分钟或更短、30分钟或更短或15分钟或更短;或第一次输注进行45分钟且随后的输注进行30分钟或更短或15分钟或更短;或第一次输注进行30分钟且随后的输注进行15分钟或更短。在所有方法的各个方面中,第一次输注和第二次输注均进行60分钟且随后的输注进行45分钟或更短、30分钟或更短或15分钟或更短;或第一次输注和第二次输注均进行45分钟且随后的输注进行30分钟或更短或15分钟或更短;或第一次输注和第二次输注均进行30分钟且随后的输注进行15分钟或更短。
75.本文尤其描述了向受试者施用抗fcrn抗体的方法,其包括向受试者静脉内输注5-60 mg/kg剂量的抗fcrn抗体,其中静脉内输注进行90分钟或更短且其中抗fcrn抗体包含:(1)包含cdr l1、cdr l2和cdr l3的轻链可变区和(2)包含cdr h1、cdr h2和cdr h3的重链可变区,其中cdr l1包含相对于tgtgsdvgsynlvs (seq id no: 1)的序列具有不多于两个氨基酸取代的序列,cdr l2包含相对于gdserps (seq id no: 2)的序列具有不多于一个氨基酸取代的序列,cdr l3包含相对于ssyagsgiyv (seq id no: 3)的序列具有不多于一个氨基酸取代的序列,cdr h1包含相对于tyamg (seq id no: 4)、dyamg (seq id no: 5)或nyamg (seq id no: 6)的序列具有不多于一个氨基酸取代的序列,cdr h2包含相对于sigssgaqtryads (seq id no: 7)、sigasgsqtryads (seq id no: 8)、sigasgaqtryads (seq id no: 9)或sigasggqtryads (seq id no: 10)的序列具有不多于两个氨基酸取代的序列,且cdr h3包含相对于laigdsy (seq id no: 11)的序列具有不多于一个氨基酸取代的序列。
76.在一些实施方案中,cdr l1包含序列tgtgsdvgsynlvs (seq id no: 1),cdr l2包含序列gdserps (seq id no: 2),
cdr l3包含序列ssyagsgiyv (seq id no: 3),cdr h1包含序列tyamg (seq id no: 4),cdr h2包含序列sigasgsqtryads (seq id no: 8),且cdr h3包含序列laigdsy (seq id no: 11)。
77.在本文所述的所有方法的一些实施方案中,输注进行7-90分钟、7-60分钟、7-45分钟、7-30分钟、10-90分钟、10-60分钟、10-45分钟、10-30分钟或15-30分钟。
78.在本文所述的所有方法的一些实施方案中,抗体的fc结构域未被岩藻糖基化。在本文所述的所有方法的一些实施方案中,抗体的fc结构域未被糖基化。在本文所述的所有方法的一些实施方案中,抗体是igg1抗体。
79.在本文所述的所有方法的一些实施方案中,抗体是全人源抗体。在本文所述的所有方法的一些实施方案中,受试者患有选自以下的同种免疫和/或自身免疫病症:胎儿和新生儿同种免疫血小板减少症、胎儿和新生儿的溶血性疾病、同种免疫泛血小板减少症、先天性心脏传导阻滞、胎儿关节挛缩、新生儿重症肌无力、新生儿自身免疫溶血性贫血、新生儿抗磷脂综合征、新生儿多发性肌炎、皮肌炎、新生儿狼疮、新生儿硬皮病、白塞病、新生儿格雷夫斯病、新生儿川崎病、新生儿自身免疫甲状腺疾病和新生儿i型糖尿病。在本文所述的所有方法的一些实施方案中,受试者患有选自以下的同种免疫和/或自身免疫病症:血小板减少症、泛血小板减少症、先天性心脏传导阻滞、关节挛缩、重症肌无力、自身免疫溶血性贫血、温抗体型自身免疫溶血性贫血、抗磷脂综合征、多发性肌炎、皮肌炎、狼疮、硬皮病、白塞病、格雷夫斯病、川崎病、自身免疫甲状腺疾病和i型糖尿病。
80.在本文所述的所有方法的一些实施方案中,所述输注是输注包含5-60 mg/ml的抗体的组合物。在本文所述的所有方法的一些实施方案中,所述输注是输注包含30、45或60 mg/ml的抗体的组合物。在本文所述的所有方法的一些实施方案中,重链包含与seq id no: 20-24中任一个的序列具有至少95%、97%、99%或100%同一性的序列,且轻链包含与seq id no: 19的序列具有至少95%、97%、99%或100%同一性的序列。在本文所述的所有方法的一些实施方案中,抗体重链包含seq id no: 20-24中任一个的氨基酸序列,在seq id no: 20-24的296位具有除n以外的氨基酸。
81.在本文所述的所有方法的一些实施方案中,所述输注是输注包含10-60 mg/ml(或10、20或30 mg/ml)的抗体、20-30mm磷酸钠、20-30 mm氯化钠、80-100 mg/ml海藻糖和0.1-0.005% w/v聚山梨酯80、ph 6.5的组合物。
82.在本文所述的所有方法的一些实施方案中,抗体重链包含seq id no: 24的氨基酸序列,具有相对于seq id no: 24的序列的以下氨基酸取代中的一个或多个:a23v、s30r、l80v、a84t、e85d、a93v,且抗体轻链包含seq id no: 19的氨基酸序列,具有相对于seq id no: 19的序列的以下氨基酸取代中的一个或多个:q38h、v58i和g99d。在本文所述的所有方法的一些实施方案中,抗体重链不含有c末端赖氨酸。在本文所述的所有方法的一些实施方案中,施用的抗体包含含有seq id no: 19的轻链和含有seq id no: 24或seq id no: 24的变体的重链,其中296位处的氨基酸不是n。
83.在本文所述的所有方法的一些实施方案中,抗体以5-30 mg/kg施用。在本文所述的所有方法的一些实施方案中,抗体以30-60 mg/kg施用。在本文所述的所有方法的一些实施方案中,静脉内输注的抗体浓度在10 mg/ml和30 mg/ml之间。
84.在本文所述的所有方法的一些实施方案中,受试者是孕妇。在本文所述的所有方法的一些实施方案中,剂量基于首次给药时孕妇的体重,而不基于孕妇的体重增加向上调整。在本文所述的所有方法的一些实施方案中,剂量是每次施用的剂量,且基于首次给药时孕妇的体重,并基于孕妇的体重增加向上调整。
85.在本文所述的所有方法的一些实施方案中,组合物至少每隔一周施用。在本文所述的所有方法的一些实施方案中,组合物每隔一周施用。在本文所述的所有方法的一些实施方案中,组合物至少每周施用。在本文所述的所有方法的一些实施方案中,组合物每周施用。
86.在本文所述的所有方法的一些实施方案中,受试者是孕妇,并且第一次输注在妊娠早期施用。在本文所述的所有方法的一些实施方案中,受试者是孕妇,并且第一次输注在妊娠中期施用。在本文所述的所有方法的一些实施方案中,受试者是孕妇,并且第一次输注在妊娠后期施用。在本文所述的所有方法的一些实施方案中,受试者是孕妇,并且孕妇具有严重胎儿贫血的产科史。在本文所述的所有方法的一些实施方案中,受试者是孕妇,并且孕妇具有胎儿和新生儿的溶血性疾病的产科史。在本文所述的所有方法的一些实施方案中,受试者是孕妇,并且孕妇具有升高的抗rhd、抗rhc或抗kell免疫球蛋白同种抗体滴度。在本文所述的所有方法的一些实施方案中,受试者是孕妇,并且孕妇具有升高的抗rhc或抗kell免疫球蛋白同种抗体滴度。在本文所述的所有方法的一些实施方案中,受试者是孕妇,并且孕妇具有针对一种或多种抗体的升高的免疫球蛋白同种抗体滴度,所述抗体选自抗lua、lub、bg、kna、yta、e. c. k. cw、fya、ce、ce、d、ce、ce、k、kpa、kpb、fya、m、n、s、lea、leb、fy、jka. diego、p和mia/mur。在本文所述的所有方法的一些实施方案中,受试者是孕妇,并且孕妇具有在≤24孕周时严重胎儿贫血或死产的产科史和升高的抗d或抗kell igg同种抗体滴度,并且怀有抗原阳性胎儿。在本文所述的所有方法的一些实施方案中,受试者是孕妇,并且第一次输注在妊娠的第12至16周;在本文所述的所有方法的一些实施方案中,受试者是孕妇,并且第一次输注在妊娠的第14周。
87.在本文所述的所有方法的一些实施方案中,输注时间是相同的且进行90分钟或更短、60分钟或更短、45分钟或更短、30分钟或更短、15分钟或更短或7分钟或更短。在本文所述的所有方法的一些实施方案中,第一次输注进行90分钟或更短、60分钟或更短、45分钟或更短、30分钟或更短、15分钟或更短,且随后的输注时间减少。在本文所述的所有方法的一些实施方案中,第一次输注进行60分钟且随后的输注进行45分钟或更短、30分钟或更短或15分钟或更短;或第一次输注进行45分钟且随后的输注进行30分钟或更短或15分钟或更短;或第一次输注进行30分钟且随后的输注进行15分钟或更短。
88.在本文所述的所有方法的一些实施方案中,第二次输注和第三次输注时间相同,进行60分钟或更短、45分钟或更短、30分钟或更短、15分钟或更短或7分钟或更短,且随后的输注时间减少。
89.在本文所述的所有方法的一些实施方案中,第一次输注和第二次输注时间相同,进行90分钟或更短、60分钟或更短、45分钟或更短、30分钟或更短、15分钟或更短,且随后的输注时间减少。在本文所述的所有方法的一些实施方案中,第一次输注和第二次输注均进行60分钟且随后的输注进行45分钟或更短、30分钟或更短或15分钟或更短;或第一次输注和第二次输注均进行45分钟且随后的输注进行30分钟或更短或15分钟或更短;或第一次输
注和第二次输注均进行30分钟且随后的输注进行15分钟或更短。
90.制剂用于静脉内输注的组合物是生理上相容(例如,缓冲至生理ph并且基本上等渗)的水性组合物。组合物可以包含例如:氯化钠、海藻糖和表面活性剂聚山梨酯(ps) 80和缓冲剂。组合物可以包含离子渗透稳定剂(氯化钠)和非离子渗透稳定剂(海藻糖)二者。
91.合适的制剂包含(1) 25 mm磷酸钠,25 mm氯化钠,90.5 mg ml-1
海藻糖,0.01%聚山梨酯(ps) 80和10或30 mg ml-1
的抗体,缓冲至ph 6.5;和(2) 25 mm琥珀酸钠,25mm氯化钠,90.5 mg ml-1
海藻糖,0.01%聚山梨酯(ps) 80和10或30 mg ml-1
的抗体,缓冲至ph 6.6或ph 6.5。
92.定义术语“抗体”在本文中以最广泛的含义使用并且涵盖各种抗体结构,包括但不限于单克隆抗体、多克隆抗体、多特异性抗体(例如双特异性抗体)和抗体片段,只要它们表现出fcrn抗原结合活性。
[0093]“抗体片段”包含完整抗体的一部分,优选完整抗体的抗原结合区或可变区。抗体片段的实例包括fab、fab’、f(ab’)2和fv片段、双抗体、线性抗体、单链抗体分子和多特异性抗体。
[0094]
如本文所用,术语“分离的抗体”是指已经从制造它的宿主细胞环境的组分中分离和/或回收的抗体。制造它的宿主细胞环境的污染成分是会干扰抗体的研究、诊断或治疗应用的物质。污染物组分可包括酶、激素和其它蛋白或非蛋白溶质。在一些实施方案中,抗体被纯化(1)至大于95重量%的抗体,如通过例如lowry法所测定,并且在一些实施方案中,至大于99重量%;(2)至足以通过使用例如旋杯测序仪获得n-末端或内部氨基酸序列的至少15个残基的程度,或(3)至通过sds-page在还原或非还原条件下使用例如考马斯蓝或银染获得同质性。分离的抗体包括重组细胞内的原位抗体。然而,通常通过至少一个纯化步骤制备分离的抗体。分离的抗体的药物制剂通常具有小于250 ppm(例如,小于200 ppm、150 ppm、100 ppm)的宿主细胞蛋白(hcp),如通过基于elisa的hcp测定所确定的,所述测定如fda“工业指南”文件所推荐的进行。
[0095]
如本文所用,术语“单克隆抗体”是指从基本上同质的抗体群体获得的抗体,即群体中的个体抗体具有相同的一级序列,除了可能少量存在的可能的自然发生的突变。单克隆抗体是高度特异性的并且针对单个抗原位点(即,人fcrn上的表位)。与通常包括针对不同表位的不同抗体的多克隆抗体制剂相反,每种单克隆抗体针对抗原上的单个表位。修饰语“单克隆”表示抗体的特征在于从基本上同质的抗体群体获得,并且不应被解释为需要通过任何特定方法产生抗体。
[0096]
如本文所用,术语“可变区”和“可变结构域”是指抗体的轻链和重链的部分,其包括互补决定区(cdr,例如cdr l1、cdr l2、cdr l3、cdr h1、cdr h2和cdr h3)和框架区(fr)的氨基酸序列。根据本公开中使用的方法,根据kabat (sequences of proteins of immuno:logical interest,第5版. public health service, national institutes of health, bethesda, md. (1991))定义指定给cdr和fr的氨基酸位置。使用该编号系统,实际的线性氨基酸序列可含有较少或额外的氨基酸,其对应于缩短或插入可变区的cdr(本文进一步定义)或fr(本文进一步定义)。例如,重链可变区可包含在cdr h2的残基52之后的单
个插入的残基(即,根据kabat的残基52a)和在重链fr的残基82之后的插入的残基(即,根据kabat的残基82a、82b、82c等)。对于给定抗体,残基的kabat编号可以通过将抗体的序列的同源区与“标准”kabat编号的序列比对来确定。
[0097]
如本文所用,术语“互补决定区”和“cdr”是指序列高变和/或形成结构上限定的环的抗体可变结构域或可变区的区域。cdr也称为高变区。轻链和重链可变区各自具有三个cdr。轻链可变区含有cdr l1、cdr l2和cdr l3。重链可变区含有cdr h1、cdr h2和cdr h3。每个cdr可包含来自如kabat定义的互补决定区的氨基酸残基(即轻链可变区中的约残基24-34(cdr l1)、50-56(cdr l2)和89-97(cdr l3)和重链可变区中的约残基31-35(cdr h1)、50-65(cdr h2)和95-102(cdr h3))。
[0098]
如本文所用,术语“fcrn”是指与igg抗体例如igg1抗体的fc区结合的新生儿fc受体。示例性fcrn是具有uniprot id no. p55899的人fcrn。人fcrn被认为通过结合和运输组成性内化的igg回到细胞表面以再利用igg而负责维持igg的半衰期。
[0099]
如本文所用,术语“亲和力”和“结合亲和力”是指两个分子之间的结合相互作用的强度。通常,结合亲和力是指分子的单个结合位点与其结合配偶体,例如分离的抗体及其靶标(例如分离的抗fcrn抗体和人fcrn)之间的非共价相互作用的总和的强度。除非另外指明,否则结合亲和力是指固有结合亲和力,其反映结合对成员之间的1:1相互作用。两个分子之间的结合亲和力通常由解离常数(kd)或亲和力常数(ka)描述。彼此具有低结合亲和力的两个分子通常结合缓慢,倾向于容易解离,并表现出大kd。彼此具有高亲和力的两个分子通常容易结合,倾向于保持更长的结合,并表现出小kd。测定抗体对人fcrn的kd的一种方法描述于实施例2(“spr法”)。使用该方法,n022、n023、n024、n026和n027的kd分别为31、31.4、35.5、36.5和19.3 pm。
[0100]
如本文所用,术语“抑制igg与fcrn结合”是指抗fcrn抗体阻断或抑制igg(例如igg1)与人fcrn结合的能力。在一些实施方案中,抗fcrn抗体在例如人fcrn上igg结合的位点结合fcrn。因此,抗fcrn抗体能够抑制igg(例如受试者的自身抗体)与fcrn的结合。在一些实施方案中,分子(例如,本公开的抗fcrn抗体)基本上或完全抑制igg的结合。在一些实施方案中,igg的结合降低10%、20%、30%、50%、70%、80%、90%、95%或甚至100%。
[0101]
如本文所用,术语“抑制致病性抗体与fcrn结合”是指抗fcrn抗体阻断或抑制致病性抗体(例如致病性igg抗体)与人fcrn结合的能力。在一些实施方案中,抗fcrn抗体在例如人fcrn上致病性抗体结合的位点结合fcrn。因此,抗fcrn抗体能够抑制致病性抗体(例如致病性igg抗体)与fcrn的结合。在一些实施方案中,分子(例如抗fcrn抗体)基本上或完全抑制致病性抗体的结合。在一些实施方案中,致病性抗体与fcrn的结合降低10%、20%、30%、50%、70%、80%、90%、95%或甚至100%。
[0102]
如本文所用,术语“疏水性氨基酸”是指具有相对低水溶性的氨基酸。疏水性氨基酸包括但不限于亮氨酸、异亮氨酸、丙氨酸、苯丙氨酸、缬氨酸和脯氨酸。本公开中特别优选的疏水性氨基酸是丙氨酸、亮氨酸、异亮氨酸和缬氨酸。
[0103]
如本文所用,术语“极性氨基酸”是指在其侧链中具有由具有不同电负性的原子诱导的化学极性的氨基酸。极性氨基酸的极性取决于氨基酸侧链中原子之间的电负性和侧链结构的不对称性。极性氨基酸包括但不限于丝氨酸、苏氨酸、半胱氨酸、甲硫氨酸、酪氨酸、色氨酸、天冬酰胺和谷氨酰胺。本公开中特别优选的极性氨基酸是丝氨酸、苏氨酸、天冬酰
胺、谷氨酰胺、半胱氨酸和酪氨酸。
[0104]
如本文所用,术语“酸性氨基酸”是指其侧链含有pka在3.5与4.5之间的羧酸基团的氨基酸。在一些实施方案中,酸性氨基酸是天冬氨酸和谷氨酸。
[0105]
如本文所用,术语“碱性氨基酸”是指其侧链含有pka在9.5与13之间的氨基的氨基酸。在一些实施方案中,碱性氨基酸是组氨酸、赖氨酸和精氨酸。
[0106]
如本文所用,术语“同一性百分比(%)”是指在比对序列和引入缺口(如果需要)以实现最大同一性百分比(即,为了最佳比对可在候选序列和参考序列之一或二者中引入缺口,并且为了比较目的可忽略非同源序列)后,候选序列(例如,本公开的抗fcrn抗体)的氨基酸(或核酸)残基与参考序列(例如,野生型抗fcrn抗体)的氨基酸(或核酸)残基相同的百分比。用于确定同一性百分比目的的比对可以以本领域技术范围内的各种方式实现,例如使用公众可获得的计算机软件例如blast、align或megalign (dnastar)软件。本领域技术人员可以确定用于测量比对的合适参数,包括在被比较的序列的全长上实现最大比对所需的任何算法。在一些实施方案中,给定候选序列与(和,或针对)给定参考序列(其可替代地表述为与(和,或针对)给定参考序列具有或包括一定氨基酸(或核酸)序列同一性百分比的给定候选序列)的氨基酸(或核酸)序列同一性百分比计算如下:100 x (a/b的分数)其中a是在候选序列和参考序列的比对中记为相同的氨基酸(或核酸)残基的数目,而其中b是参考序列中氨基酸(或核酸)残基的总数。在候选序列的长度不等于参考序列的长度的一些实施方案中,候选序列相对于参考序列的氨基酸(或核酸)序列同一性百分比将不等于参考序列相对于候选序列的氨基酸(或核酸)序列同一性百分比。
[0107]
在特定实施方案中,为了与候选序列比较而比对的参考序列可显示出,在候选序列的全长或候选序列的连续氨基酸(或核酸)残基的选定部分上候选序列表现出50%至100%的同一性。出于比较目的而比对的候选序列的长度为参考序列长度的至少30%,例如至少40%,例如至少50%、60%、70%、80%、90%或100%。当候选序列中的位置被与参考序列中的相应位置相同的氨基酸(或核酸)残基占据时,则分子在该位置是相同的。可通过取代、缺失或插入来改变位置。取代、缺失或插入可包含一定数量的氨基酸(例如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15或更多)。当描述不超过n个氨基酸的取代、缺失或插入时,这意味着取代、缺失或插入包含例如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15或n个氨基酸。取代、缺失或插入的数目可以占总序列的某一百分比(例如,1%、5%、10%、15%、20%或更多),其中取代、缺失或插入的数目改变总序列中5%、10%、15%、20%或更多的氨基酸。
[0108]
如本文所用,术语“胎儿和新生儿同种免疫和/或自身免疫病症”是指胎儿和/或新生儿中由针对胎儿和/或新生儿抗原的母源抗体(例如致病性母源抗体)的经胎盘转移引起的免疫病症。例如,怀孕受试者的抗体(例如,致病性抗体)可与胎儿的抗原(例如,胎儿从胎儿父亲遗传的抗原)反应。本文提供了胎儿和新生儿同种免疫和/或自身免疫疾病的实例。
[0109]
如本文所用,术语“致病性抗体”是指在受试者(例如怀孕受试者)、怀孕受试者的胎儿和/或新生儿中引起一种或多种免疫疾病或病症的抗体。在一些实施方案中,致病性抗体是在受试者(例如,怀孕受试者)中针对受试者自身蛋白中的一种或多种产生的自身抗体,从而在受试者中引起自身免疫疾病或病症。在一些实施方案中,怀孕受试者中的致病性抗体可通过胎盘转移至胎儿并与来自胎儿的抗原(例如,胎儿从胎儿父亲遗传的抗原)反
应,从而引起例如胎儿和新生儿同种免疫和/或自身免疫病症。
[0110]
如本文所用,术语“抗体介导的病毒性疾病的增强”是指其中抗体可促进病毒进入宿主细胞,从而导致细胞中感染性增加或增强的病毒性疾病。在一些实施方案中,抗体可结合病毒表面蛋白,并且抗体/病毒复合物可通过抗体和受体之间的相互作用结合细胞表面上的fcrn受体。随后,抗体/病毒复合物可内化到细胞中。
[0111]
如本文所用,术语“孕龄”描述怀孕多久。孕龄可用周描述。确定孕龄的方法是本领域已知的(例如,committee on obstetric practice american institute of ultrasound in medicine society for maternal-fetal medicine, committee opinion. 700号. 2017年5月;其整体并入本文)。在一些情况下,可以通过超声、自最后一次月经期(lmp)的第一天起的周数或其组合来确定孕龄。
[0112]
如本文所用,术语“药物组合物”是指含有活性成分以及一种或多种赋形剂和稀释剂以使活性成分适于施用方法的医药或药物制剂。本公开的药物组合物包含与抗fcrn抗体相容的药学上可接受的组分。药物组合物可以是用于静脉内或皮下施用的水性形式或用于口服施用的片剂或胶囊形式。
[0113]
如本文所用,术语“药学上可接受的载体”是指药物组合物中的赋形剂或稀释剂。药学上可接受的载体必须与制剂的其它成分相容并且对接受者无害。在本公开中,药学上可接受的载体必须为fc构建体提供足够的药物稳定性。载体的性质随施用方式而不同。例如,对于静脉内施用,通常使用水溶液载体;对于口服施用,优选固体载体。
[0114]
如本文所用,术语“治疗有效量”是指在受试者或患者中或在治疗患有本文所述的病况或病症的患者中有效诱导期望的生物效果的量,例如药物剂量。在本文中还应当理解,“治疗有效量”可以解释为给予期望的治疗效果的量,以一个剂量或以任何剂量或途径服用,单独或与其它治疗剂组合服用。
[0115]
如本文所用,术语“不多于”是指少于或等于的量。这可以是整数的量。例如,不多于两个取代可以指0、1或2个取代。
[0116]
如本文所用,术语“治疗(treatment)”或“治疗(treating)”是指减少特定疾病或病况、降低特定疾病或病况、降低特定疾病或病况的风险或降低其副作用。减少、降低、降低风险或降低副作用是相对于未接受治疗的受试者(例如对照、基线或已知的对照水平或测量值)。
附图说明
[0117]
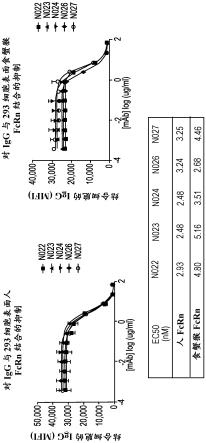
图1包括显示抗体n022-n024、n026和n027在ph 6.0下对人或食蟹猴fcrn的igg竞争性结合的两个图和一个表。
[0118]
图2包括显示抗体n023、n024、n026和n027对小鼠中igg分解代谢的影响的图。
[0119]
图3包括显示抗体n027对小鼠中igg水平和靶标占用的剂量依赖性作用的图。
[0120]
图4a-4c包括显示施用不同剂量的抗体n027后食蟹猴中igg分解代谢和靶标占用的选择性诱导的图。
[0121]
图5包括实验时间线和显示n027在小鼠慢性特发性血小板减少性紫癜(itp)模型中的功效的两个图。
具体实施方式
[0122]
本文描述了用于静脉内(iv)施用抗fcrn抗体的方法。iv抗体可以相对快速而安全。
[0123]
i. 抗fcrn抗体一般而言,本公开的特征在于静脉内施用以高亲和力结合人fcrn的某些分离的抗体。抗fcrn抗体是指可结合人fcrn并抑制igg(例如igg自身抗体)结合fcrn的抗体。
[0124]
一方面,本公开的特征在于静脉内施用能够结合人fcrn的分离的抗体。在一些实施方案中,分离的抗体含有:(1)包含cdr l1、cdr l2和cdr l3的轻链可变区和(2)包含cdr h1、cdr h2和cdr h3的重链可变区,其中cdr l1包含tgtgsdvgsynlvs (seq id no: 1),cdr l2包含gdserps (seq id no: 2),cdr l3包含ssyagsgiyv (seq id no: 3),cdr h1包含tyamg (seq id no: 4)、dyamg (seq id no: 5)或nyamg (seq id no: 6),cdr h2包含sigssgaqtryads (seq id no: 7)、sigasgsqtryads (seq id no: 8)、sigasgaqtryads (seq id no: 9)或sigasggqtryads (seq id no: 10),且cdr h3包含laigdsy (seq id no: 11)。在一些实施方案中,抗体包含含有与seq id no: 20-24中任一个的序列具有至少95%、97%、99%或100%同一性的序列的重链和含有与seq id no: 19的序列具有至少95%、97%、99%或100%同一性的序列的轻链。在一些实施方案中,抗体重链包含seq id no: 20-24中任一个的氨基酸序列,在seq id no: 20-24的296位具有除n以外的氨基酸。在一些实施方案中,抗体重链包含seq id no: 24的氨基酸序列,具有相对于seq id no: 24的序列的以下氨基酸取代中的一个或多个:a23v、s30r、l80v、a84t、e85d、a93v。在一些实施方案中,抗体轻链包含seq id no: 19的氨基酸序列,具有相对于seq id no: 19的序列的以下氨基酸取代中的一个或多个:q38h、v58i和g99d。在一些实施方案中,抗体重链不含有c末端赖氨酸。在一些实施方案中,重链包含seq id no: 24或seq id no: 24的变体,其中296位处的氨基酸不是n。在一些实施方案中,抗体以小于200、150、100、50或40 pm的kd结合人fcrn。在一些实施方案中,抗体以小于或等于具有n022、n023、n024、n026或n027的轻链可变区和重链可变区且还具有与所比较的抗体相同的fc区的抗体的kd结合人fcrn。在一些实施方案中,抗体是igg1同种型。在一些实施方案中,抗体是全人源的。在一些实施方案中,抗体在根据eu编号的n297位脱糖基化。在一些情况下,施用的抗体组合物中少于20%、10%或5%wt/wt的抗体在fc结构域上被糖基化。
[0125]
表1显示本公开的一些示例性抗fcrn抗体的轻链和重链互补决定区(cdr)的氨基酸序列。
[0126]
表1
表2显示本公开的这些示例性抗fcrn抗体的轻链和重链的seq id no。
[0127]
表2此外,在本文所述的任何抗fcrn抗体中,抗体的重链包含与seq id no: 20-24中任一个的序列具有至少95%、97%、99%或100%同一性的序列。在本文所述的任何抗fcrn抗体中,轻链包含与seq id no: 19的序列具有至少95%、97%、99%或100%同一性的序列。在本文所述的任何抗fcrn抗体中,抗体的重链可变区包含seq id no: 20-24中任一个。在本文所述的任何抗fcrn抗体中,抗体的轻链可变区包含seq id no: 19。在一些实施方案中,抗体包含含有与seq id no: 20-24中任一个的序列具有至少95%、97%、99%或100%同一性的序列的重链和含有与seq id no: 19的序列具有至少95%、97%、99%或100%同一性的序列的轻链。在一些实施方案中,抗体重链包含seq id no: 20-24中任一个的氨基酸序列,在seq id no: 20-24的296位具有除n以外的氨基酸。在一些实施方案中,抗体重链包含seq id no: 24的氨基酸序列,具有相对于seq id no: 24的序列的以下氨基酸取代中的一个或多个:a23v、s30r、l80v、a84t、e85d、a93v。在一些实施方案中,抗体轻链包含seq id no: 19的氨
基酸序列,具有相对于seq id no: 19的序列的以下氨基酸取代中的一个或多个:q38h、v58i和g99d。在一些实施方案中,抗体重链不含有c末端赖氨酸。在一些实施方案中,重链包含seq id no: 24或seq id no: 24的变体,其中296位处的氨基酸不是n。
[0128]
在一些实施方案中,轻链可变区包含cdr l1、cdr l2和cdr l3且重链可变区包含cdr h1、cdr h2和cdr h3,其中cdr l1包含相对于tgtgsdvgsynlvs (seq id no: 1)的序列具有不多于两个氨基酸取代的序列,cdr l2包含相对于gdserps (seq id no: 2)的序列具有不多于一个氨基酸取代的序列,cdr l3包含相对于ssyagsgiyv (seq id no: 3)的序列具有不多于一个氨基酸取代的序列,cdr h1包含相对于tyamg (seq id no: 4)、dyamg (seq id no: 5)或nyamg (seq id no: 6)的序列具有不多于一个氨基酸取代的序列,cdr h2包含相对于sigssgaqtryads (seq id no: 7)、sigasgsqtryads (seq id no: 8)、sigasgaqtryads (seq id no: 9)或sigasggqtryads (seq id no: 10)的序列具有不多于两个氨基酸取代的序列,且cdr h3包含相对于laigdsy (seq id no: 11)的序列具有不多于一个氨基酸取代的序列。
[0129]
抗体还可在cdr之外(即在构架区(fr)中)含有氨基酸取代、添加和/或缺失。在一些实施方案中,抗体可进一步包含以下氨基酸取代中的任何一个或多个:相对于seq id no: 20-24中任一个的序列的a23v、s30r、l80v、a84t、e85d、a93v,和相对于seq id no: 19的序列的q38h、v58i和g99d(根据eu系统编号)。
[0130]
抗体还可在cdr之外(即在构架区(fr)中)含有氨基酸取代、添加和/或缺失。氨基酸取代、添加和/或缺失可以是一个或多个氨基酸(例如,1、2、3、4、5、6、7、8或更多个)的取代、添加和/或缺失。氨基酸取代、添加和/或缺失可以是8个或更少、7个或更少、6个或更少、5个或更少、4个或更少、3个或更少、或2个或更少的单个氨基酸的取代、添加和/或缺失。在一些实施方案中,抗体可进一步包含以下氨基酸取代中的任何一个或多个:相对于seq id no: 20-24中任一个的序列的a23v、s30r、l80v、a84t、e85d、a93v,和相对于seq id no: 19的序列的q38h、v58i和g99d(根据eu系统编号)。
[0131]
在一些实施方案中,抗体可在抗体的恒定区(例如fc区)中包含氨基酸取代、添加和/或缺失,其例如导致降低的效应子功能,例如降低的补体依赖性细胞溶解(cdc)、抗体依赖性细胞介导的细胞溶解(adcc)和/或抗体依赖性细胞介导的吞噬作用(adcp)和/或降低的b细胞杀伤。恒定区不直接参与抗体与其靶标的结合,但表现出各种效应子功能,例如抗体参与抗体依赖性细胞毒性。在一些实施方案中,抗体的特征在于与天然杀伤(nk)细胞上的人补体因子c1q和/或人fc受体的结合降低(即不存在结合)。在其它实施方案中,抗体的特征在于与人fcγri、fcγriia和/或fcγriiia的结合降低(即不存在结合)。为了改变或降低抗体依赖性效应子功能,例如cdc、adcc、adcp和/或b细胞杀伤,抗体可以是igg类的,并且含有e233、l234、g236、d265、d270、n297、e318、k320、k322、a327、a330、p331和/或p329(根据eu系统编号)中的一个或多个氨基酸取代。在一些实施方案中,抗体含有l234a/l235a或d265a/n297a突变。在一些情况下,抗fcrn抗体在297位脱糖基化。在一些情况下,抗fcrn抗体在seq id no: 20-24中任一个的297位(eu编号)不具有n,使得抗体在该位置脱糖基化。在一些情况下,抗fcrn抗体具有经修饰的序列,使得297位(eu编号)的n未被糖基化。所得无效应子抗体显示与补体或fc受体的结合(即补体c1q结合)非常少,表明cdc潜力低。
[0132]
在其他实施方案中,抗体可包括具有提高抗体稳定性的特定氨基酸变化的那些抗
体。
[0133]
此外,在其他实施方案中,为了最小化潜在的免疫原性,本公开的一些抗体,例如n024、n026和n027,可通过将氨基酸d355和l357(相对于seq id no: 20-24中任一个的序列)分别替换为谷氨酸和甲硫氨酸而经历从g1m17.1到g1m17的同种异型变换。
[0134]
在其它实施方案中,相对于seq id no: 20-24中任一个的序列,本公开的抗体(例如,n022-n024、n026和n027)在残基446处不含有c末端赖氨酸。
[0135]
不受理论的束缚,认为抗fcrn抗体与igg竞争并抑制igg与人fcrn的结合。通过抗体的氢-氘交换的表位作图表明抗体结合位于fc-fcrn相互作用界面中和/或邻近fc-fcrn相互作用界面的fcrn上的表位,这表明抗体通过方向抑制而阻断igg结合fcrn。此外,表位作图的结合位点远离fcrn的白蛋白结合位点。因此,不应抑制血清白蛋白结合并且不应降低血清白蛋白水平。实际上,实验证据显示小鼠白蛋白水平在施用抗fcrn抗体后保持恒定,表明白蛋白再循环不受抗体与fcrn结合的干扰ii. fcrn抑制fcrn是i型跨膜蛋白,其作为结合igg和血清白蛋白的细胞内囊泡运输蛋白起作用。fcrn在内皮细胞、腔上皮细胞、肝细胞、足细胞、粒细胞、单核细胞、巨噬细胞、树突细胞和nk细胞中表达,但不在b或t细胞上表达。fcrn通过与组成性内化的igg结合并转运回细胞表面来维持igg的半衰期。fcrn与fc和血清白蛋白的结合均发生在ph 6.0下的早期核内体中,随后将fcrn分选成小泡,其将fcrn结合的igg或白蛋白转运回细胞表面,其中fcrn在ph 7.4下快速释放igg或白蛋白。这种运输循环通过在循环中再利用二者并防止运输到溶酶体而降解来维持igg和白蛋白的半衰期。fcrn还在上皮细胞中捕获内化的igg fc并将它们双向转运至相对的顶端或基底外侧膜。该功能允许igg转运到器官例如胃肠道的腔,或使igg或igg-抗原复合物从腔转运到血管或基质层中的淋巴组织。
[0136]
为了研究fcrn对igg动态平衡的贡献,对小鼠进行了工程改造,使得fcrn的轻链和重链部分被“敲除”,使得这些蛋白不表达(junghans等人, proc natl acad sci usa 93:5512, 1996)。在这些小鼠中,igg的血清半衰期和浓度显著降低,表明igg动态平衡的fcrn依赖性机制。在啮齿动物模型中的研究,例如上文讨论的研究,表明阻断fcrn可增加igg分解代谢,包括致病性自身抗体的分解代谢,从而抑制疾病(例如自身免疫疾病)发展。fcrn还可以通过将免疫复合物运输至抗原降解和mhc装载区室而有助于抗原呈递。
[0137]
本公开提供了以高亲和力结合人fcrn的分离的抗fcrn抗体。抗fcrn抗体与其它抗fcrn抗体(例如,igg、igg自身抗体)竞争并有效抑制其与fcrn结合,从而增加其它抗fcrn抗体(例如,igg、igg自身抗体)的分解代谢并降低其半衰期。抗fcrn抗体可用于治疗或减少受试者中基于免疫复合物的免疫应答(例如由自身免疫病中的自身抗体引起的免疫应答)的激活的方法。
[0138]
母体igg抗体向胎儿的胎盘转移是重要的fcrn依赖性机制,其在新生儿的体液应答低效时提供对新生儿的保护。在胎儿生命中,胎盘的合体滋养细胞层中的fcrn负责将母体igg抗体转移至胎儿。致病性母体抗体(例如,致病性母体igg抗体)也可通过与fcrn结合而穿过胎盘,并在胎儿和新生儿中引起同种免疫病症和/或自身免疫病症。在一些实施方案中,怀孕受试者中的致病性抗体引起怀孕受试者中胎儿的胎儿和新生儿同种免疫和/或自身免疫病症。本文所述的抗fcrn抗体(例如n022-n024、n026和n027,优选n027和/或n024)可
与母体致病性抗体(例如母体致病性igg抗体)竞争并抑制其与fcrn的结合,从而增加这些致病性抗体的分解代谢并降低其半衰期。
[0139]
本公开提供了结合人fcrn的分离的抗fcrn抗体。抗fcrn抗体可与其它抗fcrn抗体(例如,igg、igg自身抗体)竞争并抑制其与fcrn的结合,从而增加其它抗fcrn抗体(例如,igg、igg自身抗体)的分解代谢并降低其半衰期。抗fcrn抗体可用于治疗或减少受试者中基于免疫复合物的免疫应答(例如由自身免疫病中的自身抗体引起的免疫应答)的激活的方法。降低免疫应答可描述为相对于未接受治疗的受试者(例如,对照受试者)降低免疫应答。抗fcrn抗体还可用于通过向怀孕受试者施用结合人fcrn的分离的抗体来减少穿过怀孕受试者胎盘的致病性抗体转运(例如,致病性母体igg抗体转运)、增加怀孕受试者中致病性抗体分解代谢,和治疗胎儿或新生儿中抗体介导的病毒性疾病的增强的方法中。降低穿过怀孕受试者胎盘的致病性抗体转运可被描述为相对于未接受治疗的受试者(例如,对照受试者)降低致病性抗体转运。
[0140]
iii. 载体、宿主细胞和抗体生产抗fcrn抗体可由宿主细胞产生。宿主细胞是指包含从它们相应的核酸表达本文所述的多肽和构建体所需的必要细胞组分(例如细胞器)的载体。核酸可包含在核酸载体中,所述核酸载体可通过本领域已知的常规技术(例如转化、转染、电穿孔、磷酸钙沉淀、直接显微注射、感染等)引入宿主细胞中。核酸载体的选择部分取决于所用的宿主细胞。通常,优选的宿主细胞是原核(例如细菌)或真核(例如哺乳动物)来源的。
[0141]
核酸载体构建和宿主细胞编码抗fcrn抗体的氨基酸序列的核酸序列可通过本领域已知的多种方法制备。这些方法包括但不限于寡核苷酸介导的(或定点)诱变和pcr诱变。编码抗fcrn抗体的核酸分子可使用标准技术获得,例如基因合成。或者,编码野生型抗fcrn抗体的核酸分子可使用本领域的标准技术例如quikchange
tm
诱变进行突变以含有特定的氨基酸取代。可以使用核苷酸合成仪或pcr技术合成核酸分子。
[0142]
编码抗fcrn抗体的核酸序列可插入能够在原核或真核宿主细胞中复制和表达核酸分子的载体中。许多载体在本领域中是可用的并且可以用于本公开的目的。每个载体可以含有多种组分,这些组分可以针对与特定宿主细胞的相容性进行调整和优化。例如,载体组分可包括但不限于复制起点、选择标记基因、启动子、核糖体结合位点、信号序列、编码目的蛋白的核酸序列和转录终止序列。
[0143]
在一些实施方案中,哺乳动物细胞用作本公开的宿主细胞。哺乳动物细胞类型的实例包括但不限于人胚肾(hek)(例如hek293、hek 293f),中国仓鼠卵巢(cho)、hela、cos、pc3、vero、mc3t3、ns0、sp2/0、very、bhk、mdck、w138、bt483、hs578t、htb2、bt20、t47d、ns0(不内源性产生任何免疫球蛋白链的鼠骨髓瘤细胞系)、crl7o3o和hss78bst细胞。在其他实施方案中,大肠杆菌细胞用作本公开的宿主细胞。大肠杆菌菌株的实例包括但不限于大肠杆菌294 (atcc
® 31,446)、大肠杆菌λ 1776 (atcc
® 31,537、大肠杆菌bl21 (de3) (atcc
® baa-1025)和大肠杆菌rv308 (atcc
® 31,608)。不同的宿主细胞具有蛋白产物翻译后加工和修饰的特征和特异性机制。可以选择合适的细胞系或宿主系统以确保表达的抗fcrn抗体的正确修饰和加工。使用本领域的常规技术,例如转化、转染、电穿孔、磷酸钙沉淀和直接显微注射,可以将上述表达载体引入合适的宿主细胞中。一旦将载体引入宿主细胞中用于蛋
白生产,将宿主细胞培养在经改良以适用于诱导启动子、选择转化体或扩增编码所需序列的基因的常规营养培养基中。用于表达治疗性蛋白的方法是本领域已知的,参见,例如,paulina balbas, argelia lorence (eds.) recombinant gene expression: reviews and protocols (methods in molecular biology), humana press;第二版. 2004 (2004年7月20日)和vladimir voynov和justin a. caravella (eds.) therapeutic proteins: methods and protocols (methods in molecular biology) humana press;第二版. 2012 (2012年6月28日)。
[0144]
蛋白产生、回收和纯化用于产生抗fcrn抗体的宿主细胞可以在本领域已知的且适于培养所选择的宿主细胞的培养基中生长。用于哺乳动物宿主细胞的合适培养基的实例包括最小必需培养基(mem)、杜氏改良的伊格尔培养基(dmem)、expi293
™
表达培养基、补充有胎牛血清(fbs)的dmem和rpmi-1640。用于细菌宿主细胞的合适培养基的实例包括luria肉汤(lb)加上必要的补充物(例如选择剂,例如氨苄青霉素)。宿主细胞在合适的温度(例如约20℃至约39℃,例如25℃至约37℃,优选37℃)和co2水平(例如5至10%(优选8%))下培养。培养基的ph通常为约6.8-7.4,例如7.0,这主要取决于宿主生物体。如果在本公开的表达载体中使用诱导型启动子,则在适于启动子激活的条件下诱导蛋白表达。
[0145]
蛋白回收通常涉及破坏宿主细胞,通常通过例如渗透压休克、超声处理或裂解的方法。一旦细胞被破坏,可通过离心或过滤除去细胞碎片。蛋白可进一步纯化。抗fcrn抗体可通过蛋白纯化领域已知的任何方法纯化,例如通过蛋白a亲和、其它层析法(例如离子交换、亲和和尺寸排阻柱层析法)、离心、差异溶解度或通过用于纯化蛋白的任何其它标准技术。(参见process scale purification of antibodies, uwe gottschalk (ed.) john wiley & sons, inc., 2009)。在一些情况下,抗fcrn抗体可缀合至标记序列,例如肽以促进纯化。标记氨基酸序列的实例是六组氨酸肽(his-标签),其以微摩尔亲和力结合镍功能化的琼脂糖亲和柱。可用于纯化的其它肽标签包括但不限于血凝素“ha”标签,其对应于衍生自流感血凝素蛋白的表位。
[0146]
或者,抗fcrn抗体可由受试者(例如人)的细胞产生,例如在治疗的背景下,通过施用含有编码本公开的抗fcrn抗体的核酸分子的载体(例如逆转录病毒载体、腺病毒载体、痘病毒载体(例如痘苗病毒载体,例如修饰的安卡拉痘苗(mva)),腺相关病毒载体和α病毒载体)来产生。载体一旦在受试者的细胞内(例如,通过转化、转染、电穿孔、磷酸钙沉淀、直接显微注射、感染等)将促进抗fcrn抗体的表达,然后抗fcrn抗体从细胞分泌。如果疾病或病症的治疗是期望的结果,则不需要进一步的行动。如果需要收集蛋白,可以从受试者收集血液并通过本领域已知的方法从血液中纯化蛋白。
[0147]
iv. 药物组合物和制剂本公开的特征在于包含本文所述的一种或多种抗fcrn抗体的药物组合物。在一些实施方案中,药物组合物含有一种或多种本公开的抗体作为治疗性蛋白,例如n022-n024、n026和n027。在其它实施方案中,含有一种或多种本公开的抗体(例如n022-n024、n026和n027)的药物组合物在疗法中可与其它药剂(例如治疗性生物制剂和/或小分子)或组合物组合。除了治疗有效量的抗体之外,药物组合物还可含有一种或多种药学上可接受的载体或赋形剂,其可以通过本领域技术人员已知的方法配制。
[0148]
药物组合物中可接受的载体和赋形剂在所用剂量和浓度下对接受者无毒。可接受的载体和赋形剂可包括缓冲剂、抗氧化剂、防腐剂、聚合物、氨基酸和碳水化合物。药物组合物可以以可注射制剂的形式肠胃外施用。用于注射(即,静脉内注射)的药物组合物可以使用无菌溶液或任何药学上可接受的液体作为媒介物来配制。药学上可接受的媒介物包括但不限于无菌水、生理盐水和细胞培养基(例如,杜氏改良的伊格尔培养基(dmem),α-改良的伊格尔培养基(α-mem),f-12培养基)。制剂方法是本领域已知的,参见例如banga (ed.) therapeutic peptides and proteins: formulation, processing and delivery systems (第二版) taylor & francis group, crc press (2006)。
[0149]
药物组合物可以根据需要以单位剂量形式形成。药物制剂中包含的活性组分例如一种或多种抗fcrn抗体(例如n022-n024、n026和n027,优选n027和/或n024)的量使得提供指定范围内的合适剂量(例如0.01-500 mg/kg体重范围内的剂量)。
[0150]
在一些实施方案中,制剂可以用不同浓度的氯化钠、海藻糖和表面活性剂聚山梨酯(ps) 80、缓冲剂并在不同ph (ph 5-8)下缓冲来制备。在一些实施方案中,组合物包含离子渗透稳定剂(氯化钠)和非离子渗透稳定剂(海藻糖)二者。可以通过外观、ph、蛋白浓度、尺寸纯度、电荷分布和热稳定性随时间变化评估制剂和组合物的稳定性。这些稳定性参数可通过分析技术测量,包括ph、uv-vis、尺寸排阻层析法、离子交换层析法、ce-sds和差示扫描量热法。
[0151]
在各种实施方案中,制剂可包含:(1) 25 mm磷酸钠,25 mm氯化钠,90.5 mg ml-1
海藻糖,0.01%聚山梨酯(ps) 80和10或30 mg ml-1
本公开的抗体,缓冲至ph 6.5;和(2) 25 mm琥珀酸钠,25mm氯化钠,90.5 mg ml-1
海藻糖,0.01%聚山梨酯(ps) 80和10或30 mg ml-1
本公开的抗体,缓冲至ph 6.6。可以在选择的机械、热和化学应力的存在下进一步测试上述两种制剂的稳定性。在一些实施方案中,对于制剂(1) 25 mm磷酸钠,25 mm氯化钠,90.5 mg ml-1
海藻糖,0.01%聚山梨酯(ps) 80和10或30 mg ml-1
本公开的抗体,缓冲至ph 6.5,组合物的稳定性可维持超过30个月。在各种实施方案中,制剂可以包含25mm磷酸钠,25mm氯化钠,90.5 mg ml-1
海藻糖和本文公开的抗体,缓冲至ph 6.5,具有不同量的聚山梨酯80。在一些实施方案中,药物组合物包含:10或30 mg/ml本文公开的具有至多5个单个氨基酸插入、取代或缺失的抗体,20-30 mm磷酸钠,20-30 mm氯化钠,80-100 mg/ml海藻糖和0.10-0.005% w/v聚山梨酯80,缓冲至ph 6.5。
[0152]
v. 途径、剂量和施用含有一种或多种抗fcrn抗体(例如n022-n024、n026和n027,优选n027和/或n024)作为治疗性蛋白的药物组合物可配制用于静脉内施用。
[0153]
药物组合物的剂量取决于包括施用途径、待治疗的疾病和受试者的身体特征(例如年龄、体重、一般健康状况)的因素。通常,包含在单剂量中的抗fcrn抗体(例如n022-n024、n026和n027中的任一种,优选n027或n024)的量可以是有效预防、延迟或治疗疾病而不诱导显著毒性的量。药物组合物可包含0.01至500 mg/kg范围(例如,0.01、0.1、0.2、0.3、0.4、0.5、1、2、3、4、5、10、15、20、25、30、35、40、45、50、60、100、150、200、250、300、350、400、450或500 mg/kg)的剂量的抗fcrn抗体,且在更具体的实施方案中,约1至约100 mg/kg,且在更具体的实施方案中,约1至约50 mg/kg,且在另一个实施方案中,约30至60 mg/kg。剂量可由医师根据常规因素如疾病的程度和受试者的不同参数进行调整。此外,剂量可由医师
根据例如孕龄、分娩准备、妇女体重增加和/或孕期长短等因素调整。
[0154]
在一些情况下,本文所述的组合物和药物组合物在整个怀孕期间向孕妇施用。在一些情况下,本文所述的组合物和药物组合物在怀孕期间向孕妇施用约5-25周(例如,约5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25周)。在一些情况下,组合物和药物组合物的施用在约34周孕龄(34周)后停止(例如,在34、35、36或37周后)。在一些情况下,在停止施用组合物和药物组合物之后向孕妇施用ivig。在一些情况中,在停止施用组合物和药物组合物之后约3-15天(例如,3、4、5、6、7、8、9、10、11、12、13、14或15天)施用ivig。在一些情况下,在停止施用组合物和药物组合物后ivig施用的时间根据例如妇女体重增加的因素调整。在一些情况下,本文所述的组合物和药物组合物首先在12周孕龄(例如,在12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30周)后施用。在一些情况下,它们在14-26周孕龄之间(例如,14-25;15-25;或15-26周等)的怀孕期间施用。在一些情况下,它们在12-36周孕龄之间(例如,12-36;12-35;12-34;13-36;13-35;13-34;14-36;14-35;14-34;15-36;15-35;15-34;16-36;16-35;或16-34周等)的怀孕期间施用。
[0155]
药物组合物以与剂量制剂相容的方式施用,并且以治疗有效的量施用以改善或矫正症状。含有抗fcrn抗体(例如n022-n024、n026和n027中的任一种,优选n027或n024)的药物组合物可以例如每天、每周、每两周、每四周、每月、每月两次、每两年、每年或根据医学需要施用给对其有需要的受试者一次或多次(例如1-10次或更多次)。可以以单剂或多剂方案提供剂量。施用之间的时间可随着医疗状况的改善而减少,或者随着患者健康的衰退而增加。
[0156]
药物组合物以与剂量制剂相容的方式和速率施用。在一些情况下,受试者通过90分钟或更短的静脉内输注接受单剂30或60 mg/kg抗体。在一些情况下,静脉内输注进行60分钟或更短、45分钟或更短、30分钟或更短、15分钟或更短或7分钟或更短。
[0157]
在一些实施方案中,受试者通过15分钟的静脉内输注接受30 mg/kg抗体的剂量。在一些实施方案中,受试者通过30分钟的静脉内输注接受30 mg/kg抗体的剂量。在一些实施方案中,受试者通过15分钟的静脉内输注接受45 mg/kg抗体的剂量。在一些实施方案中,受试者通过30分钟的静脉内输注接受45 mg/kg抗体的剂量。在一些实施方案中,受试者通过30分钟的静脉内输注接受60 mg/kg抗体的剂量。在一些实施方案中,受试者通过60分钟的静脉内输注接受30 mg/kg抗体的剂量。在一些实施方案中,受试者通过静脉内输注经第一时间段的第一次输注和第二时间段的第二次输注,接受30-60 mg/kg的剂量。在一些情况下,第一时间段长于第二时间段。在一些情况下,第二次输注是第二次施用抗体。在一些情况下,第二次输注是第三次施用抗体。在一些情况下,受试者通过静脉内输注经30分钟的第一时间段的第一次输注和15分钟的第二时间段的第二次输注,接受30 mg/kg的剂量。在一些情况下,受试者通过静脉内输注经30分钟的第一时间段的第一次输注和15分钟的第二时间段的第二次输注,接受45 mg/kg的剂量。在一些情况下,受试者通过静脉内输注经60分钟的第一时间段的第一次输注和30分钟的第二时间段的第二次输注,接受60 mg/kg的剂量。药物组合物的施用剂量和速率取决于包括受试者的先前治疗、待治疗的疾病和受试者的身体特征(例如年龄、体重、一般健康状况)的因素。
[0158]
表3:给药方案的实例
剂量频率第一次输注的时间第二次输注的时间任何随后输注的时间
30mg/kg每两周30分钟30分钟15分钟30mg/kg每两周30分钟15分钟15分钟30mg/kg每两周15分钟15分钟15分钟30mg/kg每四周30分钟30分钟15分钟30mg/kg每四周30分钟15分钟15分钟30mg/kg每四周15分钟15分钟15分钟45mg/kg每两周30分钟30分钟15分钟45mg/kg每两周30分钟15分钟15分钟45mg/kg每两周15分钟15分钟15分钟45mg/kg每四周30分钟30分钟15分钟45mg/kg每四周30分钟15分钟15分钟45mg/kg每四周15分钟15分钟15分钟60mg/kg每两周60分钟60分钟30分钟60mg/kg每两周60分钟30分钟30分钟60mg/kg每两周30分钟30分钟30分钟60mg/kg每四周60分钟60分钟30分钟60mg/kg每四周60分钟30分钟30分钟60mg/kg每四周30分钟30分钟30分钟
表3:额外给药方案的实例
剂量频率第一次输注的时间第二次输注的时间任何随后输注的时间30mg/kg每月两次30分钟30分钟15分钟30mg/kg每月两次30分钟15分钟15分钟30mg/kg每月两次15分钟15分钟15分钟30mg/kg每月两次30分钟30分钟15分钟30mg/kg每月两次30分钟15分钟15分钟30mg/kg每月两次15分钟15分钟15分钟45mg/kg每月两次30分钟30分钟15分钟45mg/kg每月两次30分钟15分钟15分钟45mg/kg每月两次15分钟15分钟15分钟45mg/kg每月两次30分钟30分钟15分钟45mg/kg每月两次30分钟15分钟15分钟45mg/kg每月两次15分钟15分钟15分钟60mg/kg每月两次60分钟60分钟30分钟60mg/kg每月两次60分钟30分钟30分钟60mg/kg每月两次30分钟30分钟30分钟60mg/kg每月一次60分钟60分钟30分钟60mg/kg每月一次60分钟30分钟30分钟60mg/kg每月一次30分钟30分钟30分钟
在一些实施方案中,以本文公开的速率施用抗fcrn抗体,而受试者不经历严重不良事件或反应。
[0159]
vi. 治疗方法和适应症通过抗fcrn抗体阻断人fcrn可在由igg自身抗体驱动的疾病中具有治疗益处。fcrn阻断诱导总体igg分解代谢和去除多种自身抗体而不干扰血清白蛋白、小循环代谢物或脂蛋白的能力提供了扩展自身抗体去除策略对患有自身抗体驱动的自身免疫疾病病理的患者的效用和可及性的方法。尽管本公开不受理论束缚,但抗fcrn抗体的主要作用机制可以是增加循环中致病性自身抗体的分解代谢并减少自身抗体和免疫复合物在受影响组织中的沉积。
[0160]
含有一种或多种抗fcrn抗体(例如,n022-n024、n026和n027,优选n027和/或n024)的药物组合物和方法可用于促进受试者中致病性抗体(例如,igg和igg自身抗体)的分解代谢和清除,以减少受试者的免疫应答,例如,阻断受试者中基于免疫复合物的免疫应答的激活,以及治疗受试者的免疫病症或疾病。特别地,所述药物组合物和方法可用于减少或治疗基于免疫复合物的急性或慢性免疫应答的激活。急性免疫应答可以通过选自以下的医学病况激活:寻常性天疱疮、狼疮性肾炎、重症肌无力、格林-巴利综合征、抗体介导的排斥反应、灾难性抗磷脂抗体综合征、免疫复合物介导的血管炎、肾小球炎、离子通道病、视神经脊髓炎、自身免疫听力丧失、特发性血小板减少性紫癜(itp)、自身免疫溶血性贫血(aiha)、免疫粒细胞减少症、扩张性心肌病和血清病。慢性免疫应答可以通过选自以下的医学病况激活:慢性炎性脱髓鞘性多发性神经病(cidp)、系统性狼疮、指示急性治疗的慢性形式的病症、反应性关节病、原发性胆汁性肝硬化、溃疡性结肠炎和抗中性粒细胞胞质抗体(anca)相关血管炎。
[0161]
在一些实施方案中,药物组合物和方法可用于减轻或治疗选自以下的病症:斑秃、强直性脊柱炎、抗磷脂综合征、阿狄森病、温抗体型自身免疫溶血性贫血(aiha)、溶血性贫血、自身免疫肝炎、肝炎、白塞病、大疱性类天疱疮、心肌病、乳糜泻口皮炎、慢性疲劳免疫功能障碍综合征、慢性炎性脱髓鞘性多发性神经病、变应性肉芽肿性血管炎、瘢痕性类天疱疮、局限性硬皮病(crest综合征)、冷凝集素病、克罗恩病、皮肌炎、盘状狼疮、特发性混合冷球蛋白血症、纤维肌痛、纤维肌炎、格雷夫斯病、桥本甲状腺炎、甲状腺功能减退、炎性肠病、自身免疫淋巴增生综合征、特发性肺纤维化、iga肾病、胰岛素依赖型糖尿病、幼年关节炎、扁平苔藓、狼疮、美尼尔氏综合症、混合性结缔组织病、多发性硬化症、恶性贫血、结节性多动脉炎、多发性软骨炎、多腺体综合征、风湿性多发性肌痛症、多发性肌炎、原发性无丙种球蛋白血症、原发性胆汁性肝硬化、牛皮癣、雷诺现象、赖特综合征、风湿热、类风湿关节炎、肉样瘤病、硬皮病、干燥综合征、僵人综合征、大动脉炎、颞动脉炎、溃疡性结肠炎、葡萄膜炎、白癜风、膜性肾小球肾炎、重症肌无力、胎儿和新生儿的溶血性疾病(hdfn)、慢性炎性脱髓鞘性多发性神经病(cidp)、膜性肾病、肺出血-肾炎综合征、多发性肌炎、特发性血小板减少性紫癜(itp;也称为“免疫血小板减少症”)、硬皮病、复发性风湿病、格雷夫斯病、自身免疫甲状腺炎、多腺体自身免疫综合征、肾小球肾炎、狼疮性肾炎、系统性红斑狼疮(sle)、干燥综合征、i型糖尿病和韦格纳肉芽肿病。
[0162]
特别地,药物组合物和方法可用于减少或治疗由以下激活的免疫应答:系统性红斑狼疮、抗磷脂综合征、寻常性天疱疮/大疱性类天疱疮、抗中性粒细胞胞质抗体(anca)相关血管炎、重症肌无力或视神经脊髓炎。
[0163]
在一些实施方案中,药物组合物和方法可用于降低胎儿贫血的风险或降低发展胎
儿贫血的风险。在一些实施方案中,药物组合物和方法可用于减少或消除对iut(子宫内输血)的需要。在一些实施方案中,药物组合物和方法可用于减少或消除对产前pp ivig、产后输血、ivig和/或光疗的需要。
[0164]
在一些实施方案中,药物组合物和方法可用于减少或治疗由自身免疫疾病激活的免疫应答。自身免疫疾病可选自斑秃、强直性脊柱炎、抗磷脂综合征(例如,抗磷脂抗体综合征)、阿狄森病、溶血性贫血(例如,温抗体型自身免疫溶血性贫血)、自身免疫肝炎、肝炎、白塞病、大疱性类天疱疮、心肌病、乳糜泻口皮炎、慢性疲劳免疫功能障碍综合征、慢性炎性脱髓鞘性多发性神经病、变应性肉芽肿性血管炎、瘢痕性类天疱疮、局限性硬皮病(crest综合征)、冷凝集素病、克罗恩病、皮肌炎、盘状狼疮、特发性混合冷球蛋白血症、大疱性表皮松解症;纤维肌痛、纤维肌炎、格雷夫斯病、桥本甲状腺炎、甲状腺功能减退、炎性肠病、自身免疫淋巴增生综合征、特发性肺纤维化、iga肾病、胰岛素依赖型糖尿病、幼年关节炎、扁平苔藓、狼疮、膜性肾病、美尼尔氏综合症、混合性结缔组织病、多发性硬化症、恶性贫血、结节性多动脉炎、多发性软骨炎、多腺体综合征、风湿性多发性肌痛症、多发性肌炎、原发性无丙种球蛋白血症、原发性胆汁性肝硬化、牛皮癣、雷诺现象、赖特综合征、风湿热、类风湿关节炎、肉样瘤病、硬皮病、干燥综合征、僵人综合征、大动脉炎、颞动脉炎、溃疡性结肠炎、葡萄膜炎、白癜风和韦格纳肉芽肿病。在一些实施方案中,药物组合物和方法可用于降低或治疗胎儿或新生儿的免疫应答。在一些实施方案中,药物组合物和方法用于降低或治疗由怀孕母亲的自身免疫疾病激活的胎儿或新生儿的免疫应答。
[0165]
特别地,药物组合物和方法可用于减少或治疗由系统性红斑狼疮、抗磷脂综合征、寻常性天疱疮/大疱性类天疱疮、抗中性粒细胞胞质抗体(anca)相关血管炎、重症肌无力或视神经脊髓炎激活的免疫应答。在一些实施方案中,药物组合物和方法可用于降低或治疗胎儿或新生儿的免疫应答。在一些实施方案中,药物组合物和方法可用于降低或治疗由怀孕母亲的系统性红斑狼疮、抗磷脂综合征、寻常性天疱疮/大疱性类天疱疮、抗中性粒细胞胞质抗体(anca)相关血管炎、重症肌无力或视神经脊髓炎激活的免疫应答。
[0166]
药物组合物和方法可用于通过向怀孕受试者施用结合人fcrn的分离的抗体来减少穿过怀孕受试者胎盘的致病性抗体转运(例如,致病性母体igg抗体转运)、增加怀孕受试者的致病性抗体分解代谢,和治疗胎儿或新生儿中抗体介导的病毒性疾病的增强的方法中。可受益于本文所述的分离的抗fcrn抗体(例如n022-n024、n026和n027,优选n027和/或n024)的fcrn抑制的疾病和病症包括胎儿和/或新生儿中由母体致病性抗体(例如母体致病性igg抗体)穿过胎盘从怀孕受试者转移至胎儿和/或新生儿引起的疾病和病症。
[0167]
在一些实施方案中,可受益于本文所述的分离的抗fcrn抗体(例如n022-n024、n026和n027,优选n027和/或n024)的fcrn抑制的疾病和病症是胎儿和新生儿同种免疫和/或自身免疫病症。胎儿和新生儿同种免疫病症是胎儿和/或新生儿中由怀孕受试者中的致病性抗体引起的病症。怀孕受试者中的致病性抗体可攻击胎儿的抗原(例如,胎儿从胎儿父亲遗传的抗原),导致胎儿或新生儿患有胎儿和新生儿同种免疫和/或自身免疫病症。
[0168]
可通过本文所述的方法治疗的胎儿和新生儿同种免疫和/或自身免疫病症的实例包括但不限于胎儿和新生儿同种免疫血小板减少症(fnait)、胎儿和新生儿的溶血性疾病(hdfn)、同种免疫泛血小板减少症、先天性心脏传导阻滞、胎儿关节挛缩、新生儿重症肌无力、新生儿自身免疫溶血性贫血、新生儿抗磷脂综合征、新生儿多发性肌炎、皮肌炎、新生儿
狼疮、新生儿硬皮病、白塞病、新生儿格雷夫斯病、新生儿川崎病、新生儿自身免疫甲状腺疾病和新生儿i型糖尿病。
[0169]
在一些实施方案中,可受益于本文所述的分离的抗fcrn抗体(例如,n022-n024、n026和n027,优选n027和/或n024)的fcrn抑制的疾病和病症是病毒性疾病,其中抗体促进病毒进入宿主细胞,导致细胞中感染性增加或增强,例如抗体介导的病毒性疾病的增强。在一些实施方案中,抗体可结合病毒表面蛋白,并且抗体/病毒复合物可通过抗体和受体之间的相互作用结合细胞表面上的fcrn。随后,抗体/病毒复合物可内化到细胞中。例如,病毒可通过与母体igg抗体形成复合物而进入胎儿的细胞和/或组织。母体igg抗体可与病毒表面蛋白结合,而igg/病毒复合物可与胎盘合体滋养细胞中的fcrn结合,然后将复合物转移到胎儿中。
[0170]
在一些实施方案中,本文所述的方法可用于治疗抗体介导的病毒性疾病的增强。在一些实施方案中,由致病性抗体(例如致病性igg抗体)增强的病毒性疾病包括但不限于由α病毒感染、黄病毒感染、寨卡病毒感染、奇昆古尼亚病毒感染、罗斯河病毒感染、严重急性呼吸综合征冠状病毒感染、中东呼吸综合征、禽流感感染、流感病毒感染、人呼吸道合胞病毒感染、埃博拉病毒感染、黄热病病毒感染、登革热病毒感染、人免疫缺陷病毒感染、呼吸道合胞病毒感染、汉坦病毒感染、getah病毒感染、辛德毕斯病毒感染、bunyamwera病毒感染、西尼罗病毒感染、日本脑炎病毒b感染、兔痘病毒感染、乳酸脱氢酶升高病毒感染、呼肠孤病毒感染、狂犬病病毒感染、口蹄疫病毒感染、猪繁殖与呼吸综合征病毒感染、猴出血热病毒感染、马传染性贫血病毒感染、山羊关节炎病毒感染、非洲猪瘟病毒感染、慢病毒感染、bk乳多空病毒感染、墨累山谷脑炎病毒感染、肠道病毒感染、巨细胞病毒感染、肺病毒感染、麻疹病毒(morbillivirus)感染和麻疹(measles)病毒感染引起的病毒性疾病。
[0171]
抗fcrn抗体对人fcrn的阻断可在由致病性抗体(例如致病性igg抗体)驱动的疾病中具有治疗益处。fcrn阻断诱导总体致病性抗体分解代谢和去除多种致病性抗体、小循环代谢物或脂蛋白的能力提供了扩展致病性抗体去除策略对患有致病性抗体驱动的自身免疫疾病病理的患者的效用和可及性的方法。虽然不受理论束缚,但抗fcrn抗体的主要作用机制可能是增加循环中致病性抗体的分解代谢并减少致病性抗体和免疫复合物在受影响组织中的沉积。
[0172]
本文所述的抗fcrn抗体(例如n022-n024、n026和n027,优选n027和/或n024)可施用于患有在怀孕受试者中激活免疫应答的医学病况或处于患有所述医学病况的风险的怀孕受试者。在一些实施方案中,怀孕受试者在过去可能已经患有在怀孕受试者中激活免疫应答的医学病况。在一些实施方案中,怀孕受试者具有先前的胎儿或新生儿患有胎儿和新生儿同种免疫和/或自身免疫病症的历史。在一些实施方案中,如果在从怀孕受试者获得的生物样品(例如血液或尿液样品)中检测到与免疫疾病相关的致病性抗体,则可将本文所述的抗fcrn抗体施用于怀孕受试者。在一些实施方案中,已知在怀孕受试者的生物样品中检测到的致病性抗体结合来自怀孕受试者胎儿的抗原(例如,胎儿从胎儿父亲遗传的抗原)。
[0173]
在一些实施方案中,本文所述的抗fcrn抗体(例如n022-n024、n026和n027,优选n027和/或n024)可施用于计划怀孕且患有在怀孕受试者中激活免疫应答的医学病况或处于患有所述医学病况的风险,和/或过去已经患有在怀孕受试者中激活免疫应答的医学病况的受试者。在一些实施方案中,受试者计划怀孕并且具有先前的胎儿或新生儿患有胎儿
和新生儿同种免疫和/或自身免疫病症的历史。在一些实施方案中,本文所述的抗fcrn抗体可施用于计划怀孕且其生物样品含有与免疫疾病相关的致病性抗体的受试者。
[0174]
在一些实施方案中,本文所述的抗fcrn抗体可施用于受试者(例如怀孕受试者)以减少或治疗受试者中基于免疫复合物的急性或慢性免疫应答的激活。急性免疫应答可由医学病况(例如寻常性天疱疮、狼疮性肾炎、重症肌无力、格林-巴利综合征、抗体介导的排斥反应、灾难性抗磷脂抗体综合征、免疫复合物介导的血管炎、肾小球炎、离子通道病、视神经脊髓炎、自身免疫听力丧失、特发性血小板减少性紫癜、自身免疫溶血性贫血、免疫粒细胞减少症、扩张性心肌病、血清病、慢性炎性脱髓鞘性多发性神经病、系统性狼疮、反应性关节病、原发性胆汁性肝硬化、溃疡性结肠炎或抗中性粒细胞胞质抗体(anca)相关血管炎)激活。
[0175]
在一些实施方案中,本文所述的抗fcrn抗体可施用于受试者(例如怀孕受试者)以减少或治疗由自身免疫疾病激活的免疫应答。自身免疫疾病可为例如,斑秃、强直性脊柱炎、抗磷脂综合征、阿狄森病、溶血性贫血、温抗体型自身免疫溶血性贫血(waiha)、抗因子抗体、肝素诱导的血小板减少症(hict)、致敏移植、自身免疫肝炎、肝炎、白塞病、大疱性类天疱疮、心肌病、乳糜泻口皮炎、慢性疲劳免疫功能障碍综合征、慢性炎性脱髓鞘性多发性神经病、变应性肉芽肿性血管炎、瘢痕性类天疱疮、局限性硬皮病(crest综合征)、冷凝集素病、克罗恩病、皮肌炎、盘状狼疮、特发性混合冷球蛋白血症、纤维肌痛、纤维肌炎、格雷夫斯病、桥本甲状腺炎、甲状腺功能减退、炎性肠病、自身免疫淋巴增生综合征、特发性肺纤维化、iga肾病、胰岛素依赖型糖尿病、幼年关节炎、扁平苔藓、狼疮、美尼尔氏综合症、混合性结缔组织病、多发性硬化症、恶性贫血、结节性多动脉炎、多发性软骨炎、多腺体综合征、风湿性多发性肌痛症、多发性肌炎、原发性无丙种球蛋白血症、原发性胆汁性肝硬化、牛皮癣、雷诺现象、赖特综合征、风湿热、类风湿关节炎、肉样瘤病、硬皮病、干燥综合征、僵人综合征、大动脉炎、颞动脉炎、溃疡性结肠炎、葡萄膜炎、白癜风或韦格纳肉芽肿病。
实施例
[0176]
在wo 2019/118791 (pct/us2018/065568)中详细描述了本文所述的各种fcrn抗体及其性质。
[0177]
实施例1-igg竞争在异位表达细胞表面的糖磷脂酰肌醇(gpi)连接的fcrn的人胚肾(hek)293细胞上评价抗fcrn抗体与igg竞争结合人或食蟹猴fcrn的能力。人和食蟹猴fcrn α氨基酸序列显示97.5%的序列同一性。在人和食蟹猴fcrn α之间,355个中的9个氨基酸残基是不同的,但没有一个在表位作图的结合区中。使用66 nm荧光探针标记的非特异性igg测定结合细胞的igg水平。igg与细胞表面fcrn的结合在ph 6.0下进行,其允许igg的fc部分与fcrn相互作用。如图1所示,结合细胞的igg的量随着抗fcrn抗体(n022-n024,n026或n027)的浓度增加而显著降低。本公开的五种示例性抗fcrn抗体中的每一种均以浓度和饱和依赖性方式抑制igg的结合,表明抗fcrn抗体n022-n024、n026和n027在ph 6.0下有效竞争并抑制igg与fcrn的结合的能力。抗体的ec50值在2-6 nm范围。
[0178]
实施例2-抗fcrn抗体对小鼠igg分解代谢的影响为了测量抗fcrn抗体对体内igg分解代谢的影响,使用人fcrn转基因小鼠品系
fcrn-/-hfcrn (32) tg小鼠,其缺乏小鼠fcrn但以类似于内源小鼠和人fcrn的组织分布表达人fcrn。在第1天和第4天向在第0天注射500 mg/kg人igg的fcrn-/-hfcrn (32) tg小鼠施用单剂10 mg/kg抗fcrn抗体。如图2所示,通过施用抗fcrn抗体,igg的分解代谢增加,如通过在抗fcrn抗体治疗的小鼠中随时间测量的较低水平的igg所示。在10 mg/kg下,n024 (k
d =35.5 pm)、n026 (k
d =36.5 pm)和n027 (k
d =19.4 pm)的活性显示是类似的。
[0179]
实施例3-抗fcrn抗体的体外和体内功能表征体外在异位表达细胞表面的糖磷脂酰肌醇(gpi)连接的人或食蟹猴fcrn的人胚肾(hek)293细胞上评价抗体的细胞结合亲和力。fcrn是i型跨膜蛋白,当转运到质膜时,其igg和白蛋白结合结构域朝向内体膜的腔侧或朝向细胞表面。抗fcrn抗体在ph 7.4下与hek293细胞上的细胞表面膜相关fcrn的结合模拟在生理相关环境中和在仅抗体的fab结构域而非fc结构域与fcrn相互作用的ph下的结合。fcrn细胞外结构域通过c末端工程改造的gpi连接以高密度展示在细胞表面。用荧光探针标记抗fcrn抗体。使抗体在冰上结合30分钟。然后在4℃下洗涤细胞,并使用荧光标记的二抗(例如山羊抗人igg f(ab)2)检测结合的抗体。与人fcrn的结合是浓度依赖性的,且抗体显示4-7 nm范围的ec50值。
[0180]
还对内源表达的人fcrn测量了抗体的细胞结合亲和力。在小鼠和人血液中单核细胞表达最高水平的fcrn,并显示最高百分比的fcrn表达阳性。单核细胞系thp-1用于评价抗fcrn抗体在ph 7.4下与内源人fcrn的结合。由于内源fcrn主要在thp-1细胞的细胞内内体囊泡中,因此首先用温和去垢剂渗透细胞并固定,然后在4℃下在牛血清存在下与抗fcrn抗体孵育30分钟以阻断非特异性fc受体结合。该测定能够区分与内源人fcrn结合更好的抗体。抗fcrn抗体与thp-1细胞的结合是浓度依赖性的。本公开的所有抗体,例如n022-n024、n026和n027,显示出比igg1更好的结合亲和力。抗体n027显示最高的结合亲和力,ec50值为3.0 nm。
[0181]
在异位表达细胞表面gpi连接的fcrn的人胚肾(hek)293细胞上评价抗fcrn抗体与igg竞争结合人或食蟹猴fcrn的能力。使用荧光探针标记的非特异性igg确定结合细胞的igg的水平。igg与细胞表面fcrn的结合在ph 6.0下进行,其允许igg的fc部分与fcrn相互作用。如实施例3和图1所示,结合细胞的igg的量随着抗fcrn抗体浓度的增加而显著降低。本公开的五种示例性抗fcrn抗体(例如n022-n024、n026和n027)中的每一种以浓度和饱和依赖性方式抑制igg的结合,表明抗fcrn抗体在ph 6.0下有效竞争并抑制igg与fcrn的结合的能力。抗体的ec50值在2-6 nm范围。
[0182]
通过抗体的氢-氘交换的表位作图表明抗体结合位于fc-fcrn相互作用界面中和/或邻近fc-fcrn相互作用界面的人fcrn上的表位,这表明抗体通过方向抑制而阻断igg结合fcrn。此外,表位作图的结合位点远离fcrn的白蛋白结合位点。使用酶联免疫吸附测定(elisa)证实抗体不抑制血清白蛋白与fcrn的结合。将人fcrn的可溶性his-标记的细胞外结构域结合到平板表面,并在ph 6.0下用增加浓度的抗fcrn抗体预孵育。使辣根过氧化物酶(hrp)缀合的人血清白蛋白与可溶性his-标记的fcrn结合。没有一种抗体抑制白蛋白与fcrn的结合。此外,体内实验证据还显示在施用抗fcrn抗体后小鼠白蛋白水平保持恒定,表明白蛋白再循环不受抗体与fcrn结合的干扰。
[0183]
体内
为了测试抗fcrn抗体对igg分解代谢的体内作用,使用人fcrn转基因小鼠品系fcrn-/-hfcrn (32) tg小鼠,其缺乏小鼠fcrn但以类似于内源小鼠和人fcrn的组织分布表达人fcrn。在第1天和第4天向在第0天注射人igg的fcrn-/-hfcrn (32) tg小鼠施用单剂10 mg/kg抗fcrn抗体。如图2所示,通过施用抗fcrn抗体,igg的分解代谢增加,如通过在抗fcrn抗体治疗的小鼠中随时间测量的较低水平的igg所示。在10 mg/kg下,n024 (k
d =35.5 pm)、n026 (k
d =36.5 pm)和n027 (k
d =19.4 pm)的活性显示是类似的。
[0184]
实施例4-抗fcrn抗体对小鼠中igg水平和靶标占用的影响在向tg32人fcrn (hfcgrt)转基因、小鼠fcrn (mfcgrt)敲除小鼠施用500 mg/kg ivig(示踪剂)后24小时,静脉内(i.v.)给药n027。每天通过elisa检测循环人igg。在用免疫表型细胞表面标记物孵育细胞,然后固定和渗透后,通过荧光激活细胞分选术(facs)每天测量来自裂解全血的单核细胞中的靶标占用。通过用dy650标记的n027染色测量未占用的fcrn(每组n=4只雄性)。如图3所示,通过以剂量依赖性方式施用n027,降低了igg水平和未占用的fcrn的百分比。
[0185]
实施例5-食蟹猴中igg分解代谢和靶标占用的选择性诱导在t=0时向食蟹猴i.v.给药n027。通过elisa检测循环内源igg和白蛋白。在用免疫表型细胞表面标记物孵育细胞,然后固定和渗透后,通过facs测量来自裂解全血的单核细胞中的靶标占用。通过用dy650标记的n027染色测量未占用的fcrn(每组n=3只雄性)。如图4所示,通过施用n027,igg水平和未占用的fcrn的百分比以剂量依赖性方式降低,而血浆白蛋白水平保持不变。
[0186]
实施例6-n027在小鼠慢性特发性血小板减少性紫癜(itp)中的疗效通过连续输注抗血小板抗体(抗cd41,mwreg30)皮下(s.c.)微渗透泵在tg32人fcrn (hfcgrt)转基因、小鼠fcrn (mfcgrt)敲除小鼠中诱导血小板减少症。在泵植入后72小时(第3天),循环血小板水平降至300x109/l或更低。在泵植入后72小时(第3天)和120小时(第5天)治疗性i.v.给药n027 (a,每组n=4;b,每组n=7)。图5显示了no27对患有血小板减少症的小鼠血小板水平的影响。
[0187]
实施例7-静脉输注抗fcrn抗体的安全性和耐受性进行抗体的单剂、顺序、随机、双盲(申办者公开)、安慰剂对照、递增剂量和递增输注速率研究,所述抗体具有seq id no: 19的轻链和seq id no: 24的重链序列(n027; m281)。在第1天,受试者通过静脉内输注随机接受单剂30或60 mg/kg的抗体或安慰剂。五组中的每一组由接受抗体的六名受试者和接受安慰剂的两名受试者组成,总共40名受试者。五个组为:在60分钟内施用30 mg/kg抗体(6名受试者)或安慰剂(2名受试者);在30分钟内施用30 mg/kg抗体(6名受试者)或安慰剂(2名受试者);在15分钟内施用30 mg/kg 抗体(6名受试者)或安慰剂(2名受试者);在7.5分钟内施用30 mg/kg抗体(6名受试者)或安慰剂(2名受试者);和在15分钟内施用60 mg/kg抗体(6名受试者)或安慰剂(2名受试者)。静脉内输注的抗体浓度为30 mg/ml。
[0188]
没有导致受试者退出研究的死亡、严重不良事件(sae)或不良事件。最常报告的治疗紧急不良事件为:活性治疗组中6名(20%)受试者和接受安慰剂的1名(10%)受试者报告头痛,和接受活性治疗的3名(10%)受试者报告恶心。在7.5分钟内输注30 mg/kg和在15分钟内输注60 mg/kg,尽管耐受,但似乎比在较低输注速率下具有更高比例的头痛和恶心。
[0189]
其他实施方案虽然已经结合其具体实施方案描述了本公开,但是将理解的是,它能够进行进一步的修改,并且本技术旨在覆盖总体上遵循原则的任何变化、应用或调整,并且包括在本公开所属领域内的已知或惯例范围内的与本公开的这种偏离,并且可以应用于上文阐述的必要特征。
[0190]
所有出版物、专利和专利申请通过引用整体并入本文,其程度如同每个单独的出版物、专利或专利申请被具体地和单独地指明通过引用整体并入。
[0191]
其他实施方案在所附权利要求范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。