培养容器、使用培养容器的再生毛囊原基的制造方法
1.本技术是主张2019年6月28日提出申请的日本专利申请2019-121816号的优先权的申请,为了参照而将该先前的申请的揭示整体并入至本文中。
技术领域
2.本揭示关于培养容器、使用培养容器的再生毛囊原基的制造方法。
背景技术:
3.以男性型脱毛症(aga)为首的先天性脱毛、疤痕、烧伤性脱毛、女性的休止期脱毛等脱毛症的治疗方法已知有以下述方式进行治疗的方法:从取得自患者的正常头皮的少量毛囊器官分离上皮性干细胞及间叶性干细胞,使包含这些干细胞的细胞集团凝集而成再插入导引丝而制造再生毛囊原基,将该再生毛囊原基移植至患者的脱毛症部位(例如参照专利文献1)。
4.根据如此的毛囊再生治疗,可通过培养分离自毛囊器官的上皮性干细胞及间叶性干细胞,而从少量检体制造大量的再生毛囊原基,因此可不提高侵袭性而增加患者的头皮的毛发(毛囊)的总数。
5.[现有技术文献]
[0006]
[专利文献]
[0007]
专利文献1:国际公开第2012/108069号。
技术实现要素:
[0008]
[发明所欲解决的问题]
[0009]
本揭示的实施方式的培养容器可培养:具有导引丝、及位于前述导引丝的的前端部的多个细胞的再生毛囊原基,该培养容器具备第一凹部、及开口于前述第一凹部的第一底部的第二凹部,于俯视前述开口时,前述第二凹部具有可将前述导引丝定位于前述开口的中央部的第二底部。
[0010]
另外,本揭示的实施方式的再生毛囊原基的制造方法包含下列步骤:在本揭示的任一前述培养容器的前述第二凹部内使包含上皮性细胞的细胞集团凝集的步骤;在前述第二凹部内使包含间叶性细胞的细胞集团凝集的步骤;将导引丝插入至前述第二凹部的步骤;及一边使包含经凝集的上皮性细胞的细胞集团及经凝集的间叶性细胞接触一边进行培养的步骤。
附图说明
[0011]
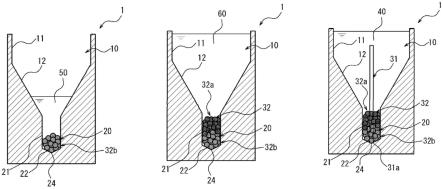
图1是本揭示的一实施方式的培养容器的纵剖面图。
[0012]
图2是图1所示的培养容器的俯视图。
[0013]
图3是图1所示的培养容器的第二凹部的部分放大剖面图。
[0014]
图4a是概略性地表示通过图1所示的培养容器培养再生毛囊原基的模样的图。
[0015]
图4b是图4a中的导引丝的前端部分的放大图。
[0016]
图5是变化例的第二凹部的放大剖面图。
[0017]
图6a是表示通过本揭示的一实施方式的再生毛囊原基的制造方法制造再生毛囊原基的程序的说明图。
[0018]
图6b是表示通过本揭示的一实施方式的再生毛囊原基的制造方法制造再生毛囊原基的程序的说明图。
[0019]
图6c是表示通过本揭示的一实施方式的再生毛囊原基的制造方法制造再生毛囊原基的程序的说明图。
[0020]
图7是表示实施例中所使用的培养容器的第二凹部的穴径及深度的表的图。
[0021]
图8是表示实施例的培养容器中所制造的小鼠再生毛囊原基的代表性照片、及再生毛囊原基的形成率的图。
[0022]
图9是表示使用no.3的培养容器所制造的代表性小鼠再生毛囊原基的照片、及移植再生毛囊原基后的发毛的照片的图。
[0023]
图10是表示使用no.4的培养容器所制造的代表性小鼠再生毛囊原基的照片、及移植再生毛囊原基后的发毛的照片的图。
具体实施方式
[0024]
先前,使分离自毛囊器官的上皮性干细胞及间叶性干细胞的细胞集团凝集而高密度、区隔化后,于该细胞集团中插入导引丝而制造附有导引丝的再生毛囊原基。然而,由于先前以人的手工作业制造再生毛囊原基,故再生毛囊原基的完成度偏差大,且,制造耗费时间。
[0025]
本揭示的目的在于提供一种可简便或稳定地制造再生毛囊原基的培养容器、及使用该培养容器的再生毛囊原基的制造方法。
[0026]
根据本揭示的实施方式,可提供一种可简便或稳定地制造再生毛囊原基的培养容器及使用该培养容器的再生毛囊原基的制造方法。
[0027]
以下,一边参照附图,一边对本揭示的一实施方式的培养容器及再生毛囊原基的制造方法进行详细说明。
[0028]
此外,于本说明书、权利要求的范围中,上下方向意指将培养容器设为图1所示的正立姿势的状态下的上下方向。
[0029]
如图1至图3所示,本实施方式的培养容器1具备第一凹部10及第二凹部20。第一凹部10及第二凹部20分别构成培养容器1的收纳空间2。
[0030]
收纳空间2例如可设为通过封闭构件以液密方式封闭的构成,该封闭构件装卸自如地安装于朝向培养容器1(第一凹部10)的上方的开口的盖体等。
[0031]
第一凹部10具备第一侧壁部11及第一底部12。第一侧壁部11具有圆筒状的形状,于上下方向的各部位中直径(内径)固定。第一底部12具有以直径(内径)朝向下方变小的方式倾斜的圆锥台状的形状,且一体地连接于第一侧壁部11的下端。第一底部12的上下方向的长度长于第一侧壁部11的上下方向的长度。此外,第一侧壁部11也可倾斜。
[0032]
第一凹部10的上下方向的长度(深度)可设为7至11mm,第一侧壁部11的上下方向的长度(深度)可设为4至6mm,第一底部12的上下方向的长度(深度)可设为3至5mm。于本实
施方式中,第一凹部10的上下方向的长度(深度)为9mm,第一侧壁部11的上下方向的长度(深度)为5.1mm,第一底部12的上下方向的长度(深度)为3.9mm。另外,第一侧壁部11的直径可设为4.0至5.5mm,于本实施方式中为4.9mm。另外,第一底部12的张开角度θ1可设为30至90
°
,第一侧壁部11的张开角度θ2可设为0至10
°
。于本实施方式中,第一底部12的张开角度θ1为60
°
,第一侧壁部11的张开角度θ2为4
°
。
[0033]
于本实施方式中,第一凹部10设为具备第一侧壁部11的构成,但于第一底部12以直径朝向下方变小的方式倾斜的构成时,也可设为不具备第一侧壁部11的构成。另外,于本实施方式中,第一底部12设为直径朝向下方以固定的比例直线性变小的圆锥台状的形状,但并不限定于此,其形状可进行各种变更,例如设为直径朝向下方逐渐变小的凸状或凹状的弯曲面形状等。尤其是,于第一凹部10具备第一侧壁部11的构成时,第一底部12也可设为相对于上下方向呈垂直的平面形状。
[0034]
第二凹部20具备第二侧壁部21及第二底部22。第二凹部20设置于第一凹部10的下方,并且开口于第二侧壁部21向第一凹部10的第一底部12的中央部。第二凹部20的上下方向的长度(深度)较第一凹部10的上下方向的长度(深度)短(浅)。
[0035]
第二侧壁部21具有于上下方向的各部位中直径(内径)固定的圆筒状的形状,朝向第一底部12的开口23成为圆形。另外,第二侧壁部21成为其上下方向的长度a较开口23的直径(直径)b长的纵长形状。
[0036]
第二底部22具有以直径朝向下方变小的方式倾斜的圆锥状的形状,且一体地连接于第二侧壁部21的下端。24于俯视(俯视)第二凹部20的开口23时,第二底部22的顶点位于第二底部22的中央部。连接有第二侧壁部21及第二底部22的连接部25为圆形,连接部25的直径(直径)b及开口23的直径(直径)相同。
[0037]
第二底部22的上下方向的长度,也就是,第二底部22的深度c较优选为小于连接部25的直径(直径)b。
[0038]
另外,第二底部22的深度c较优选为小于第二侧壁部21的上下方向的长度a。
[0039]
另外,第二底部22的表面粗糙度较优选为大于第二侧壁部21的表面粗糙度。
[0040]
第二凹部20的上下方向的长度(深度)可设为0.56至1.70mm,第二侧壁部21的上下方向的长度(深度)可设为0.5至1.5mm,第二底部22的上下方向的长度(深度)可设为0.06至0.20mm。于本实施方式中,第二凹部20的上下方向的长度(深度)为1.0mm,第二侧壁部21的上下方向的长度(深度)为0.9mm,第二底部22的上下方向的长度(深度)为0.09mm。另外,第二侧壁部21,也就是,连接部25的直径b可设为0.3至1.0mm,于本实施方式中为0.42mm。另外,第二底部22的张开角度θ3可设为60至170
°
。于本实施方式中,第二底部22的打开角度θ3为120
°
。
[0041]
如图4所示,培养容器1可于收纳空间2培养再生毛囊原基30。再生毛囊原基30具有导引丝31、及位于导引丝31的前端部的多个细胞32。
[0042]
于上述再生毛囊原基30中,导引丝31例如可设受通过尼龙等聚合物、不锈钢等金属、碳纤维、玻璃纤维等化学纤维等而形成丝状(纤维状)。本实施方式中,导引丝31为尼龙制。导引丝31使用较第二凹部20的第二侧壁部21的直径(连接部25的直径b)细,且长度较第二凹部20的上下方向的长度长的导引丝。
[0043]
导引丝31的长度可设为3至10mm,导引丝31的直径可设为0.02至1.20mm。在本实施
方式中,导引丝31的长度为5mm,导引丝31的直径为0.5mm。
[0044]
于上述再生毛囊原基30中,多个细胞32例如可设为由包含多个上皮性细胞32a(于图4中标示为交叉剖面线)的细胞集团、及包含多个间叶性细胞32b(于图4中标示为剖面线)的细胞集团构成。此时,较优选为相比于包含多个上皮性细胞32a的细胞集团,将包含多个间叶性细胞32b的细胞集团配置于更靠导引丝31的前端31a的侧(第二底部22的侧)。
[0045]
所谓“上皮性细胞”意指采集自上皮组织的细胞及培养所采集的细胞而获得的细胞,例如可列举:从源自毛囊的隆突(bulge)区域的外毛根鞘的最外层所采集的细胞(源自隆突区域的上皮性细胞)、从成体或胎儿皮肤的表皮采集的细胞、衍生自多能性干细胞的上皮性细胞、有分化为构成毛囊、皮肤的上皮性干细胞的可能性的上皮性前驱细胞或这些的干细胞等。
[0046]
所谓“间叶性细胞”意指采集自间叶组织的细胞及培养所采集的细胞而获得的细胞,例如可列举:源自毛乳头的细胞(例如毛乳头细胞)、毛母细胞、毛根鞘细胞、内毛根鞘细胞、外毛根鞘细胞(排除最外层的细胞)、成体或胎儿皮肤间叶性细胞、衍生自多能性干细胞的毛囊间叶性细胞、不含血液细胞的骨髓细胞、源自骨髓的间叶性细胞、颚骨内部的骨髓细胞、源自头部神经丛细胞的间叶性细胞或有分化为这些细胞的可能性的间叶性前驱细胞或干细胞等。
[0047]
所谓“多能性干细胞(pluripotent stem cell)”意指具有分化为生物体的各种组织的能力的细胞,例如可列举:es细胞(embryonic stem cells)、ntes细胞(nuclear transfer embryonic stem cells)、eg细胞(embryonic germ cells)、gs细胞(germline stem cells)、ips细胞(induced pluripotent stem cells)。
[0048]
为了制作再生毛囊原基而使用的上皮性细胞及间叶性细胞可采集自哺乳动物的人类、猴、猪、牛、马、小鼠、大鼠、天竺鼠、兔、狗、猫等各种动物等。
[0049]
自毛囊、皮肤等组织外科采集或使分散酶、胶原蛋白酶、胰蛋白酶等酵素反应,据此分离为上皮组织及间叶组织,使分离的上皮组织或间叶组织与分散酶、胶原蛋白酶、胰蛋白酶等酵素反应,据此可采集上皮性细胞或间叶性细胞。酵素的反应时间根据组织的大小、构成组织的细胞的性质(例如,参与细胞间结合的蛋白质或细胞间结合的强度等)等而适当地变更。另外,为了上皮组织与间叶组织的分离或自上皮组织或间叶组织采集上皮性细胞或间叶性细胞而进行反应的酵素也可混合2种以上。
[0050]
所谓“细胞集团”意指细胞分散于液体内的状态的细胞悬浮液,可通过对所采集的上皮性细胞或间叶性细胞、或培养了这些细胞的细胞添加可培养该细胞的培养基,并进行混合,据此使其分散而调制。
[0051]
为了获得大量的上皮性细胞或间叶性细胞,可培养该细胞。于培养该细胞时,用于培养的培养基可为用于动物细胞培养的基础培养基,例如可列举:杜贝可改良伊格尔培养基(dulbecco's modified eagle's medium,dmem)或advanced dmem/f12培养基等。另外,为了使上皮性细胞或间叶性细胞有效率地增殖,可添加血清或fgf(fibroblast growth factor)、egf(epidermal growth factor)等细胞增殖因子。另外,就用以维持细胞功能的添加剂而言,可添加y27632、noggin或sag等,也可任选添加盘尼西林(penicillin)或链霉素(streptomycin)等抗生素。根据上皮性细胞或间叶性细胞的性质,适当地变更基础培养基、血清、细胞生长因子、添加剂。细胞的培养条件可为细胞可增殖的环境,例如适用于37℃
的温度下、5%co2浓度的培养箱内的培养。
[0052]
包含多个上皮性细胞32a的细胞集团较优选为使用包含源自隆突区域上皮的细胞的细胞集团。另外,包含多个间叶性细胞32b的细胞集团,较优选为使用包含源自毛乳头的细胞的细胞集团。
[0053]
上述构成的再生毛囊原基30由于具有使多个细胞32定位于导引丝31的前端部的构成,因此于通过设置于头皮的切开部分将多个细胞32移植至头皮的内部时,可通过镊子抓住导引丝31,因此移植时的操作容易。另外,通过使导引丝31突出至头皮的外部而将多个细胞32移植至头皮,并且将多个细胞32设置为由包含多个上皮性细胞32a的细胞集团、及包含多个间叶性细胞32b的细胞集团构成时,可以将包含上皮性细胞32a的细胞集团位于头皮的表面侧,将包含间叶性细胞32b的细胞集团位于头皮的内部侧的方式容易地移植多个细胞32。另外,导引丝31通过提高移植后的头皮皮肤组织的上皮性细胞与构成再生毛囊原基30的上皮性细胞32a的连续性,而促进生毛作用。
[0054]
使用本实施方式的培养容器1培养再生毛囊原基30时,收纳空间2被培养液40充满,多个细胞32收容于第二凹部20的内部,导引丝31于朝向下方侧的前端31a与第二底部22相接,朝向上方侧的另一端侧的部分自多个细胞32向上方突出。
[0055]
此处,于本实施方式的培养容器1中,第二凹部20的第二底部22成为下述构成:于顶视(俯视)开口23时,可将收纳于收纳空间2的再生毛囊原基30的导引丝31定位于开口23的中央部。也就是,当再生毛囊原基30被收纳于收纳空间2时,第二底部22可以容易将再生毛囊原基30的导引丝31沿着第二凹部20的轴心配置的方式定位。
[0056]
于本实施方式中,第二底部22具有以直径朝向下方变小的方式倾斜的圆锥状的形状,于俯视下位于中央部的顶点24成为朝向下方最深凹陷的形状。因此,将再生毛囊原基30收纳于培养容器1的收纳空间2时,可减少导引丝31的前端31a自顶点24向直径方向的移动,从而于俯视开口23时容易以位于开口23的中央部的方式定位导引丝31。
[0057]
据此,于本实施方式的培养容器1中,第二凹部20具有于俯视开口23时可将导引丝31定位于开口23的中央部的第二底部22,因此在收纳空间2培养具有导引丝31、及位于导引丝31的前端部的多个细胞32的再生毛囊原基30时,可将该导引丝31定位于第二凹部20的中央部。据此,由于可以将导引丝31沿着第二凹部20的轴心配置,所以可简便或稳定地制造再生毛囊原基30。
[0058]
另外,于本实施方式的培养容器1中,由于设为使第二底部22以直径朝向下方变小的方式倾斜的构成,因此将导引丝31插入至第二凹部20的内部时,导引丝31的前端31a沿着第二底部22的倾斜被引导至第二底部22的中央部,从而可更容易地将导引丝31定位于开口23的中央部。
[0059]
尤其是,如本实施方式般,将第二底部22设为圆锥状的形状的情形,将导引丝31插入至第二凹部20的内部时,可通过顶点24引导导引丝31的前端31a,而将导引丝31定位于开口23的中央部。
[0060]
于本实施方式中,第二凹部20具备第二侧壁部21,但于第二底部22以直径朝向下方变小的方式倾斜的构成时,也可设为不具备第二侧壁部21的构成。另外,于本实施方式中,第二底部22设为直径朝向下方变小的圆锥状的形状,但并不限定于此,只要于俯视开口23时可将导引丝31定位于开口23的中央部,其形状可进行各种变更,例如设为直径朝向下
方逐渐变小的凸状或凹状的弯曲面形状等。
[0061]
在本实施方式中,因为将第一底部12以直径朝向下方变小的方式倾斜的构成,所以将再生毛囊原基30收纳于收纳空间2时,导引丝31的先端31a及多个细胞32沿着第一底部12被导引至第二凹部20,而可将导引丝31的先端31a及多个细胞32容易地收纳于第二凹部20。
[0062]
上述构成的培养容器1例如可设为聚苯乙烯制。此时,培养容器1可设为对聚苯乙烯块进行切削加工而形成,也可设为使用成形模具对聚苯乙烯进行射出成形而形成。使用成形模具将聚苯乙烯射出成形而制造培养容器1时,培养容器1的量产较为容易。
[0063]
此外,培养容器1并不限定于聚苯乙烯制,可设为以例如,特氟龙(teflon)(注册商标)、聚丙烯、聚氯乙烯、聚乙烯、环状聚烯烃、聚对苯二甲酸乙二酯、聚碳酸酯、聚二甲基硅氧烷、聚甲基丙烯酸甲酯、聚芳酯、聚砜、聚醚砜、聚醚醚酮、聚醚酰亚胺、聚甲基戊烯、硅树脂、丙烯酸、pfa等其它树脂材料形成,另外,也可设为已玻璃等其它材质形成。
[0064]
于上述构成的培养容器1中,第二凹部20成为第二侧壁部21的上下方向的长度a较开口23的直径b长的形状,因此,培养于第二凹部20的多个细胞32能够被培养成适合毛发生长的形状。此外,第二凹部20也可设为第二侧壁部21的上下方向的长度a成为与开口23的直径b相同长度的形状,也可设为第二侧壁部21的上下方向的长度a短于开口23的直径b的形状。
[0065]
另外,于上述构成的培养容器1中,由于第二凹部20成为第二侧壁部21的上下方向的长度a较第二底部22的深度c长的形状,因此可将培养于第二凹部20的多个细胞32,以成为导引丝31的前端31a的侧的底部成为适合生长成带弧度的毛发形状的方式进行培养。另外,第二凹部20也可设为第二侧壁部21的上下方向的长度a成为及第二底部22的深度c相同的长度的形状,也可设为第二侧壁部21的上下方向的长度a短于第二底部22的深度c的形状。
[0066]
另外,于上述构成的培养容器1中,第二凹部20成为第二底部22的深度c小于连接部25的直径b的形状,因此可将于第二凹部20培养的多个细胞32稳定地以成为导引丝31的前端31a的侧的底部成为适于带弧度的发毛的形状的方式进行培养。另外,第二凹部20可设为第二底部22的深度c成为与连接部25的直径b相同的长度的形状,也可设为第二底部22的深度c大于连接部25的直径b的形状。
[0067]
另外,于上述构成的培养容器1中,第二底部22的表面粗糙度大于第二侧壁部21的表面粗糙度,因此可稳定地培养在第二凹部20培养的多个细胞32。此外,第二凹部20也可设为第二底部22的表面粗糙度与第二侧壁部21的表面粗糙度相同的构成,也可设为第二底部22的表面粗糙度小于第二侧壁部21的表面粗糙度的构成。
[0068]
在上述构成的培养容器1中,因为第一凹部10及第二凹部20成为适合制造再生毛囊原基30的形状,所以多个细胞32可以制造适合毛发生长的形状的再生毛囊原基30。
[0069]
图5是变化例的第二凹部20的放大剖面图。
[0070]
如图5所示,第二凹部20也可设为第二侧壁部21以直径朝向下方变小的方式倾斜的构成。此时,培养容器1成为第一底部12、第二侧壁部21及第二底部22分别相对于上下方向倾斜的构成,第一底部12及第二底部22相对于上下方向的角度大于第二侧壁部21相对于上下方向的角度。此外,第二侧壁部21的张开角度θ4可设为0至30
°
。于本实施方式中,第二
侧壁部21的张开角度θ4为2
°
。
[0071]
通过如此的构成,导引丝31的前端31a及多个细胞32沿着以直径朝向下方变小的方式倾斜的第一底部12被引导至第二凹部20,并且沿着以直径朝向下方变小的方式倾斜的第二侧壁部21被引导至第二底部22,据此可使导引丝31的前端31a容易地定位于第二底部22的中央部,并且使多个细胞32容易地收纳于第二凹部20的内部。
[0072]
其次,一边参照图6一边说明使用本实施方式的培养容器1制造再生毛囊原基30的方法。
[0073]
于本实施方式的再生毛囊原基的制造方法中,首先,进行于培养容器1的第二凹部20内使包含间叶性细胞32b的细胞集团凝集的步骤。于该步骤中,将含有多个间叶性细胞的细胞悬浮液50(细胞密度:1x105个至2x106个/ml)适量地填充至培养容器1的收纳空间2(10至100μl),通过离心(以500至700xg进行1至10分钟),使多个间叶性细胞32b凝集于第二凹部20的第二底部22的侧(细胞数:1x103至2x105个)。此外,于该步骤中,所添加的细胞悬浮液量只要为不会自容器溢出的量即可,另外,只要为即便于离心条件下也不会产生细胞的功能障碍的条件即可。据此,如图6a所示,使邻接于第二凹部20的内部及第二底部22且包含多个间叶性细胞32b的细胞集团凝集。
[0074]
其次,进行于培养容器1的第二凹部20内使包含上皮性细胞32a的细胞集团凝集的步骤。于该步骤中,将包含多个间叶性细胞的细胞悬浮液50的上清液去除后,将包含多个上皮性细胞的细胞悬浮液60(细胞密度:1x105至4x106个/ml)适量地填充至培养容器1的收纳空间2(10至100μl),通过离心(以500至700xg进行1至10分钟),使多个上皮性细胞32a于第二凹部20中重叠于间叶性细胞32b的上方而凝集(细胞数:1x103至4x105个)。于该步骤中,所添加的细胞悬浮液量只要为不会自容器溢出的量即可,另外,只要为即便于离心条件下也不会产生细胞的功能障碍的条件即可。据此,如图6b所示,于第二凹部20的内部,使重叠于间叶性细胞32b的上方且包含多个上皮性细胞32a的细胞集团凝集。此外,也可不去除细胞悬浮液50的上清液。
[0075]
其次,如图6c所示,将导引丝31插入至第二凹部20。插入至第二凹部20的导引丝31自上方朝向下方贯通包含间叶性细胞32b及上皮性细胞32a的细胞集团,朝向其下方侧的前端31a抵接于第二底部22。如上所述,于俯视开口23时,第二凹部20的第二底部22成为可将导引丝31定位于开口23的中央部的构成,因此前端31a及第二底部22相接的导引丝31通过第二底部22而以前端31a与顶点24一致的方式定位,且以俯视开口23时位于开口23的中央部的方式配置。据此,以贯通包含间叶性细胞32b及上皮性细胞32a的细胞集团的中央部的方式配置引导丝31。
[0076]
其次,可将包含上述步骤中经凝集的上皮性细胞32a的细胞集团及经凝集的间叶性细胞32b于第二凹部20的内部一边相互接触一边培养。该培养可于维持上皮性细胞及间叶性细胞的功能并且可相互作用的培养条件下进行,例如只要于约37℃的温度下于5%co2浓度的培养箱内培养12至36小时即可。
[0077]
通过如此的再生毛囊原基的制造方法,可使包含经凝集的间叶性细胞32b及经凝集的上皮性细胞32a的多个细胞32均匀地定位于导引丝31的前端部的周围,而简便且稳定地制造适于毛发生长的形状的再生毛囊原基30。
[0078]
例如,通过使用第二侧壁部21的上下方向的长度a为900
±
10μm、第二凹部20的开
口23及连接部25的直径b为450
±
10μm作为培养容器1,可容易简便且稳定地制造再生毛囊原基30。
[0079]
此外,于本实施方式中,于培养容器1的第二凹部20内进行使包含上皮性细胞32a的细胞集团凝集的步骤之前,进行使包含间叶性细胞32b的细胞集团凝集的步骤,但也可于培养容器1的第二凹部20内进行使包含上皮性细胞32a的细胞集团凝集的步骤的后,进行使包含间叶性细胞32b的细胞集团凝集的步骤。
[0080]
另外,于本实施方式中,于使包含上皮性细胞32a的细胞集团及包含间叶性细胞32b的细胞集团凝集的步骤后,进行插入导引丝31的步骤,但也可于最初将导引丝31插入至第二凹部20中并通过第二底部22将该导引丝31定位于开口23的中央部后,进行使包含上皮性细胞32a的细胞集团及包含间叶性细胞32b的细胞集团凝集的步骤。此时,也可容易且精度良好地制造包含间叶性细胞32b及上皮性细胞32a的细胞集团均匀地定位于导引丝31的前端部的周围的再生毛囊原基30。
[0081]
于本实施方式中,将包含上皮性细胞32a的细胞集团设为包含源自隆突区域上皮的细胞的细胞集团,但并不限定于此,也可使用其它细胞集团作为包含上皮性细胞32a的细胞集团。另外,于本实施方式中,将包含间叶性细胞32b的细胞集团设为包含源自毛乳头的细胞的细胞集团,但并不限定于此,也可使用其它细胞集团作为包含间叶性细胞32b的细胞集团。
[0082]
[实施例]
[0083]
以下,参照实施例更详细地说明本发明。此外,本发明可通过将细胞播种数、培养基更换的时期、培养期间、所使用的试剂、试剂的浓度、酶的反应时间等进行各种变更而成的各种态样而具体化,并不限定于此处所记载的实施例。
[0084]
如图7所示,实施例的培养容器分别具有前述构成,并且第二凹部的穴径(开口的直径)为0.30mm、第二凹部的深度为0.75mm的no.1的容器、第二凹部的穴径为0.30mm、第二凹部的深度为1.00mm的no.2的容器、第二凹部的穴径为0.45mm、第二凹部的深度为0.75mm的no.3的容器、第二凹部的穴径为0.45mm、第二凹部的深度为0.90mm的no.4的容器、及第二凹部的穴径为0.45mm,准备第二凹部的深度为1.00mm的no.5的容器。另外,针对各个容器,准备将聚苯乙烯或特氟龙(teflon)(注册商标)进行切削加工而形成的容器(切削型))。
[0085]
[实施例1]使用小鼠的再生毛囊原基的制造及器官诱导能力评估
[0086]
(1)试剂的调制
[0087]
(1-1)解剖用培养基的调制
[0088]
于dmem(thermo fisher scientific公司制)中混合fbs(biowest公司制,最终浓度:10%)、hepes(thermo fisher scientific公司制,最终浓度:10mm)及penicillin-streptomycin(thermo fisher scientific公司制,最终浓度:1%)。
[0089]
(1-2)小鼠毛乳头细胞培养用培养基的调制
[0090]
于dmem中添加fbs(最终浓度:10%)、盘尼西林-链霉素(penicillin-streptomycin)(最终浓度:1%)及bfgf(富士软片和光纯药公司制,最终浓度:10ng/ml)后,进行混合。
[0091]
(1-3)0.05%胰蛋白酶(trypsin)-edta的调制
[0092]
通过利用pbs(-)(nacalai tesque公司制)将0.5%胰蛋白酶-2g/ledta-4na
(sigma-aldrich公司制造)稀释10倍并进行混合而调制。
[0093]
(1-4)小鼠毛乳头细胞回收用培养基的调制
[0094]
于dmem中添加fbs(最终浓度:10%)及盘尼西林-链霉素(最终浓度:1%)后,进行混合。
[0095]
(1-5)分离酵素液的调制
[0096]
于分散酶(dispase)(becton dickinson and company公司制,浓度:50酪蛋白水解(caseinolytic)u/ml)中添加胶原酶i(collagenasei)(worthington公司制,最终浓度:50u/ml)并混合。
[0097]
(1-6)单一化酵素反应液的调制
[0098]
将2.5%胰蛋白酶(thermo fisher scientific公司制)以pbs(-)稀释50倍并混合(最终浓度:0.05%)。
[0099]
(1-7)nffse培养基的调制
[0100]
于advanced dmem/f-12(thermo fisher scientific公司制)中添加hepes(thermo fisher scientific公司制,最终浓度:10mm)、glutamax(thermo fisher scientific公司制,最终浓度:1x)、b27补充物(supplement)(thermo fisher scientific公司制,最终浓度:1x)、n2补充物(thermo fisher scientific公司制,最终浓度:1x)、rock抑制剂(inhibitor)(y27632、富士软片和光纯药公司制,最终浓度:10μm)、egf(peprotech公司制,最终浓度:50ng/ml)、fgf-7(r&dsystems公司制,最终浓度:50ng/ml)、fgf-10(r&d systems公司制,最终浓度:50ng/ml)、shh促效剂(agonist)(sag,cayman chemical公司制造,最终浓度:50ng/ml)、及bmp抑制剂(noggin,peprotech公司制,50ng/ml)、以及盘尼西林-链霉素(最终浓度:1%)并混合。
[0101]
(1-8)hepes的调制
[0102]
将hepes(dojindo公司(同仁化学研究所)制)溶解于milliq水中后,利用naoh(富士软片和光纯药公司制造)将ph值调整为7.4,据此调制1m hepes。
[0103]
(1-9)nahco3的调制
[0104]
将nahco3(富士软片和光纯药公司制)溶解于milliq水中,据此调制1m nahco3。
[0105]
(1-10)dmem的调制
[0106]
使1l用的dmem粉末(thermo fisher scientific公司制造)溶解于milliq水100ml中,据此调制10xdmem。
[0107]
(2)小鼠毛乳头的培养
[0108]
(2-1)小鼠毛乳头的采集及播种
[0109]
通过使7-8周龄的c57bl/6小鼠(slc公司)或c57bl/6-tgn(act-egfp)小鼠(slc公司)颈椎脱臼而安乐死后,使用剪力去除胡须。使用剪刀以不伤及毛球部的方式采集颊须组织。利用isodine(meiji seika pharma公司制)、pbs(-)、解剖用培养基(前述),各消毒及清洗2次。于解剖用培养基中去除颊须组织的皮下组织后,通过自颊须组织拔出颊须毛囊而回收颊须毛囊。选择成长期i至iv期的颊须毛囊后,使用手术刀切断毛球部的上部,使用25g注射针自毛球部摘出毛乳头。此外,将摘出的毛乳头回收至解剖用培养基中。将所回收的毛乳头播种于35mm培养用盘(dish)(becton dickinson and company公司制)或60mm培养用盘(becton dickinson and company公司制)中,于小鼠毛乳头细胞培养用培养基(前述)中培
养6至8天。
[0110]
(2-2)小鼠毛乳头细胞的回收
[0111]
培养6至8日后,去除上清液,以pbs(-)洗涤2次。洗涤后,添加0.05%胰蛋白酶-edta(前述)遍布使全体后,于37℃反应5分钟。通过添加小鼠毛乳头细胞回收用培养基(前述),使反应停止,通过回收细胞,调制出细胞回收液。将细胞回收液于250xg、4℃下离心5分钟,去除上清液后,利用小鼠毛乳头细胞回收用培养基进行悬浮,据此调制出小鼠毛乳头细胞悬浮液。调制后,计测细胞浓度。将小鼠毛乳头细胞悬浮液以小鼠毛乳头细胞回收用培养基调制成1
×
104个/10至50μl。
[0112]
(3)小鼠上皮性细胞的培养
[0113]
(3-1)小鼠上皮性细胞的采集及播种
[0114]
通过用手术刀切开颊须毛囊的圆环(ringwurst),且移除胶原蛋白鞘来分离隆突区域组织。于添加有解剖用培养基的35mm盘养盘(petri dish)(becton dickinson and company公司制)回收隆突区域组织。去除解剖用培养基,添加分离酵素液(前述)后(对约150根隆突区域组织添加1ml),以设定为37℃及设定co2浓度为5%的co2培养箱(panasonic healthcare公司制)反应5分钟。反应后,以解剖用培养基洗涤2次,添加2ml的含有35u/ml dnase typei(sigma-aldrich公司制)的解剖用培养基后,使用25g注射针外科地去除位于隆突区域组织周围的间叶组织,据此采集隆突区域上皮组织。利用pbs(-)将隆突区域上皮组织洗涤2次后,对约150根隆突区域上皮组织添加2ml的单一化酵素反应液(前述),于设定为37℃及co2浓度设定为5%的co2培养箱中反应1小时。反应后,通过添加含有70u/ml dnase typei的解剖用培养基1ml,使酵素反应停止,通过移液操作混合,通过35μm细胞滤器(corning公司制),以310xg、4℃离心3分钟。离心后,通过添加及混合解剖用培养基,调制出小鼠上皮性细胞。测定小鼠上皮性细胞的细胞浓度后,将细胞悬浮液分取至管中。将管于310xg、4℃下离心3分钟而去除上清液,通过添加并混合含有hepes(dojindo公司(同仁化学研究所)公司制,最终浓度:10mm)、nahco3(前述,最终浓度:10mm)及dmem(前述,最终浓度:1x)的1%去端肽胶原蛋白(atelocollagen)溶液(高研),调制出5
×
104至1
×
105个/ml的细胞悬浮液。通过离心去除气泡后,将细胞悬浮液以90μl/孔接种于6孔盘(becton dickinson and company公司制造)。于设定为37℃及co2浓度设定为5%的co2培养箱内使凝胶固化30分钟左右后,以3ml/孔添加nffse培养基,于设定为37℃及co2浓度设定为5%的co2培养箱中进行5至6天的三维培养。
[0115]
(3-2)小鼠上皮性细胞的回收
[0116]
培养5至6天后,对于细胞形成菌落的凝胶,利用细胞刮刀将凝胶自培养皿剥离。将剥离的凝胶回收至1.5ml管中(最大凝胶3个/管),添加培养上清液1ml。以最终浓度成为100u/ml的方式添加胶原蛋白酶i(collagenasei),于37℃下反应60至90分钟,据此使凝胶溶解。于590xg、4℃下离心3分钟后,去除上清液,以1ml洗涤1次pbs(-)。洗涤后,添加以pbs(-)稀释的0.125%胰蛋白酶(thermo fisher scientific公司制)500μl,于37℃反应20分钟。通过添加及混合含有35u/ml dnase typei的解剖用培养基1ml而调制出细胞悬浮液。将细胞悬浮液通过35μm细胞滤器,于590xg、4℃离心3分钟。离心后,除去上清液,以含有1%盘尼西林-链霉素的advanced dmem/f-12培养基悬浮,调制出小鼠上皮性细胞悬浮液。调制后,计测细胞浓度。将小鼠上皮性细胞悬浮液以nffse培养基调制成1
×
104至2
×
104个/20至
50μl。
[0117]
(4)培养容器(再构成用容器)的清洗
[0118]
将no.1至no.5的切削型的培养容器分别浸渍于以milliq水稀释99.5%乙醇(富士软片和光纯药公司制)而成的70%乙醇中,于室温下进行超声波处理30分钟,利用实体显微镜(carl zeiss公司制)确认有无切削的残留物。将培养容器浸渍于添加有中性洗剂(花王公司制)的milliq水(对于50ml的milliq水添加7滴中性洗剂)中,利用振荡器(60rpm)于室温下洗涤3小时。洗涤后,将培养容器流水洗涤1小时后(流水洗涤开始30分钟后以实体显微镜确认有无切削的残留物),浸渍于milliq水中,以震荡器(60rpm)于室温洗涤1小时。此外,通过移液操作实施排除空气。更换milliq水,以震荡器(60rpm)于室温洗涤一晚。再次更换milliq水,以震荡器(60rpm)于室温洗涤1小时。以70%乙醇消毒2次,再以99.5%乙醇消毒2次(通过移液操作实施排除空气)。于生物安全柜(safety cabinet)内(sanyo公司制)将培养容器于培养皿上风干。
[0119]
(6)再生毛囊原基的制作
[0120]
使用no.1至no.5的切削型培养容器制作再生毛囊原基。将经洗涤的各培养容器插入至96孔盘(becton dickinson and company公司制)中。针对各培养容器,将小鼠毛乳头细胞培养用培养基添加至第二凹部的上部后,将小鼠毛乳头细胞悬浮液10至50μl添加至培养容器(细胞数:1x104个/容器),以590xg于室温离心3至5分钟。离心后,去除上清液至第二凹部的上部,于培养容器中添加小鼠上皮性细胞悬浮液20至50μl(细胞数:1
×
104至2
×
104个/容器),以590xg于室温离心3至5分钟。离心后,将全长5mm的尼龙丝(松田医科工业公司制)作为导引丝,以贯通培养容器内的小鼠毛乳头细胞及小鼠上皮性细胞的方式插入至第二凹部。插入后,于设定为37℃及co2浓度设定为5%的co2培养箱内器官培养16至26小时。培养后,以小鼠毛乳头细胞凝集体及小鼠上皮性细胞凝集体不会自导引丝脱离的方式抽出导引丝,利用相位差显微镜(carl zeiss公司制)拍摄再生毛囊原基的照片。根据小鼠毛乳头细胞凝集体及小鼠上皮性细胞凝集体的状态、凝集体彼此的接触状态、导引丝及各凝集体的位置关系判断是否可形成再生毛囊原基,算出再生毛囊原基的形成率(再生毛囊原基的形成数/再生毛囊原基的总制作数
×
100),结果于第二凹部的穴径为0.45mm的培养容器中显示出更高的再生毛囊原基的形成率,因此可制造更稳定的再生毛囊原基(图8)。
[0121]
(6)再生毛囊原基的器官诱导能力评估
[0122]
根据熟知方法将再生毛囊原基移植至小鼠皮内。也就是,将6至8周龄的balb/c nu/nu小鼠(slc公司)依照标准方法进行麻醉,将背部进行isodine消毒后,使小鼠呈自然横卧位。使用v采血微量(nippon arkon公司制)进行穿刺,形成自皮肤表皮层至真皮层下层部的移植伤口。移植创伤是自体表面至垂直方向约400μm的深度,水平方向约为1mm左右。使用尖锐镊子no.5(河目制作所公司制)将插入有导引丝的再生毛囊原基以上皮性细胞成分朝向移植伤口的体表侧的方式插入。调节移植深度以使再生毛囊原基的上皮性细胞成分的上端部露出于移植伤口上端部,使尼龙丝制的导丝以露出于体表面的方式定位。将导引丝以斯特利条(steri strip)(3m公司制)固定于接近移植伤口的皮肤表面,其后,以nurse van(sunplanet公司制,注册商标)及手术胶带(3m公司制)保护移植伤口。移植后5至7天除去保护胶带(nurse van及手术胶带)。以目视判定移植物的植入后,进行经过观察(2至4日1次)。经过观察是利用荧光实体显微镜(carl zeiss公司制)对麻醉下的小鼠的移植部位进行观
察性摄影,评估再生毛囊的器官诱导能力。将结果示于图9、图10。由于no.3及no.4的培养容器所制作的再生毛囊原基产生毛发生长,因此具有器官诱导能力(白箭头)。
[0123]
本揭示并不限定于前述实施方式,可于不脱离其主旨的范围内进行各种变更。
[0124]
附图标记说明
[0125]
1 培养容器
[0126]
2 收纳空间
[0127]
10 第一凹部
[0128]
11 第一侧壁部
[0129]
12 第一底部
[0130]
20 第二凹部
[0131]
21 第二侧壁部
[0132]
22 第二底部
[0133]
23 开口
[0134]
24 顶点
[0135]
25 连接部
[0136]
30 再生毛囊原基
[0137]
31 导引丝
[0138]
31a 前端
[0139]
32 细胞
[0140]
32a 上皮性细胞
[0141]
32b 间叶性细胞
[0142]
40 培养液
[0143]
50 包含多个间叶性细胞的细胞悬浮液
[0144]
60 包含多个上皮性细胞的细胞悬浮液。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
