抗原性多肽及其使用方法
1.相关申请的交叉引用
2.本技术要求2019年7月24日提交的标题为“antigenic polypeptides and methods of use thereof”的美国临时专利申请序列号62/878,159和2019年10月24日提交的标题为“antigenic polypeptides and methods of use thereof”的美国临时专利申请序列号62/925,616的优先权。前述申请的内容据此以引用的方式整体并入本文。
技术领域
3.本公开涉及新型抗原性多肽和组合物,以及此类抗原性多肽和组合物作为免疫疗法(例如,癌症疫苗)的用途。
背景技术:
4.免疫疗法正在成为治疗癌症的重要工具。一种免疫治疗方法涉及包含癌症特异性抗原肽的治疗性癌症疫苗的使用,所述癌症特异性抗原肽可以主动训练患者的免疫系统以靶向和破坏癌细胞。然而,此类治疗性癌症疫苗的产生受到免疫原性癌症特异性抗原肽的可用性的限制。
5.因此,本领域需要改善的免疫原性癌症特异性肽和包含这些肽的有效抗癌疫苗的产生。
技术实现要素:
6.本公开提供了包括肿瘤相关肽的新型抗原性多肽,以及包含它们的组合物。此类抗原性多肽和组合物可特别用作免疫疗法(例如,癌症疫苗)。还提供了使用所述多肽和组合物来诱导细胞免疫应答的方法、使用所述多肽和组合物来治疗疾病的方法、包括所述多肽和组合物的试剂盒、制备所述组合物的方法、以及特异性结合至所述多肽的抗体和t细胞受体。
7.因此,本公开提供了以下非限制性实施方案:
8.实施方案1.一种长度为8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59,60,61,62,63,64,65,66,67,68,69,70,71,72,73,74,75,76,77,78,79,80,81,82,83,84,85,86,87,88,89,90,91,92,93,94,95,96,97,98,99或100个氨基酸的抗原性多肽,所述抗原性多肽包括mhc结合肽,所述mhc结合肽包含选自由seq id no:98-1371、3921-3996和4149-4171组成的组的氨基酸序列。
9.实施方案2.如实施方案1所述的抗原性多肽,其中所述mhc结合肽的氨基酸序列由选自由seq id no:98-1371、3921-3996和4149-4171组成的组的氨基酸序列组成。
10.实施方案3.如实施方案1所述的抗原性多肽,其中所述抗原性多肽的氨基酸序列由选自由seq id no:98-1371、3921-3996和4149-4171组成的组的氨基酸序列组成。
11.实施方案4.如实施方案1或2所述的抗原性多肽,还包括hsp结合肽。
no:41的氨基酸序列,任选地其中所述hsp结合肽的氨基酸序列由seq id no:41的氨基酸序列组成。
55.实施方案43.如实施方案4所述的抗原性多肽,其中所述hsp结合肽包含seq id no:42的氨基酸序列,任选地其中所述hsp结合肽的氨基酸序列由seq id no:42的氨基酸序列组成。
56.实施方案44.如前述实施方案中任一项所述的抗原性多肽,其中所述mhc结合肽的长度为8至50个氨基酸,任选地8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49或50个氨基酸。
57.实施方案45.如实施方案4-44中任一项所述的抗原性多肽,其中所述mhc结合肽的c-末端连接至所述hsp结合肽的n-末端。
58.实施方案46.如实施方案4-44中任一项所述的抗原性多肽,其中所述mhc结合肽的n-末端连接至所述hsp结合肽的c-末端。
59.实施方案47.如实施方案4-46中任一项所述的抗原性多肽,其中所述hsp结合肽通过化学接头连接至所述mhc结合肽。
60.实施方案48.如实施方案4-46中任一项所述的抗原性多肽,其中所述hsp结合肽通过肽接头连接至所述mhc结合肽。
61.实施方案49.如实施方案48所述的抗原性多肽,其中所述肽接头包含seq id no:43的氨基酸序列,任选地其中所述肽接头的氨基酸序列由seq id no:43的氨基酸序列组成。
62.实施方案50.如实施方案48所述的抗原性多肽,其中所述肽接头包含fr的氨基酸序列,任选地其中所述肽接头的氨基酸序列由fr的氨基酸序列组成。
63.实施方案51.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的n-末端连接至以下各项的c-末端:
64.(a)x1x2x3x4x5x6x7ffrk(seq id no:68)的氨基酸序列,其中x1被省略,是n、f或q;x2是w、l或f;x3是l或i;x4是r、l或k;x5是l、w或i;x6是t、l、f、k、r或w;并且x7是w、g、k或f;
65.(b)x1lx2ltx3ffrk(seq id no:69)的氨基酸序列,其中x1是w或f;x2是r或k;并且x3是w、f或g;
66.(c)nx1lx2ltx3ffrk(seq id no:70)的氨基酸序列,其中x1是w或f;x2是r或k;并且x3是w、f或g;
67.(d)wlx1ltx2ffrk(seq id no:71)的氨基酸序列,其中x1是r或k;并且x2是w或g;
68.(e)nwlx1ltx2ffrk(seq id no:72)的氨基酸序列,其中x1是r或k;并且x2是w或g;
69.(f)nwx1x2x3x4x5ffrk(seq id no:73)的氨基酸序列,其中x1是l或i;x2是l、r或k;x3是l或i;x4是t、l、f、k、r或w;并且x5是w或k;或者
70.(g)选自由seq id no:74-97组成的组的氨基酸序列。
71.实施方案52.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的n-末端连接至seq id no:74所示的氨基酸序列的c-末端。
72.实施方案53.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的n-末端连接至seq id no:75所示的氨基酸序列的c-末端。
73.实施方案54.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的n-末端连接至seq id no:76所示的氨基酸序列的c-末端。
74.实施方案55.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的n-末端连接至seq id no:77所示的氨基酸序列的c-末端。
75.实施方案56.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的n-末端连接至seq id no:78所示的氨基酸序列的c-末端。
76.实施方案57.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的n-末端连接至seq id no:79所示的氨基酸序列的c-末端。
77.实施方案58.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的n-末端连接至seq id no:80所示的氨基酸序列的c-末端。
78.实施方案59.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的n-末端连接至seq id no:81所示的氨基酸序列的c-末端。
79.实施方案60.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的n-末端连接至seq id no:82所示的氨基酸序列的c-末端。
80.实施方案61.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的n-末端连接至seq id no:83所示的氨基酸序列的c-末端。
81.实施方案62.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的n-末端连接至seq id no:84所示的氨基酸序列的c-末端。
82.实施方案63.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的n-末端连接至seq id no:85所示的氨基酸序列的c-末端。
83.实施方案64.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的n-末端连接至seq id no:86所示的氨基酸序列的c-末端。
84.实施方案65.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的n-末端连接至seq id no:87所示的氨基酸序列的c-末端。
85.实施方案66.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的n-末端连接至seq id no:88所示的氨基酸序列的c-末端。
86.实施方案67.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的n-末端连接至seq id no:89所示的氨基酸序列的c-末端。
87.实施方案68.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的n-末端连接至seq id no:90所示的氨基酸序列的c-末端。
88.实施方案69.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的n-末端连接至seq id no:91所示的氨基酸序列的c-末端。
89.实施方案70.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的n-末端连接至seq id no:92所示的氨基酸序列的c-末端。
90.实施方案71.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的n-末端连接至seq id no:93所示的氨基酸序列的c-末端。
91.实施方案72.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的n-末端连接至seq id no:94所示的氨基酸序列的c-末端。
92.实施方案73.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的n-末端
连接至seq id no:95所示的氨基酸序列的c-末端。
93.实施方案74.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的n-末端连接至seq id no:96所示的氨基酸序列的c-末端。
94.实施方案75.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的n-末端连接至seq id no:97所示的氨基酸序列的c-末端。
95.实施方案76.如实施方案49或50所述的分离的多肽,其中所述mhc结合肽的c-末端连接至以下各项的n-末端:
96.(a)ffrkx1x2x3x4x5x6x7(seq id no:44)的氨基酸序列,其中x1被省略,是n、f或q;x2是w、l或f;x3是l或i;x4是r、l或k;x5是l、w或i;x6是t、l、f、k、r或w;并且x7是w、g、k或f;
97.(b)ffrkx1lx2ltx3(seq id no:45)的氨基酸序列,其中x1是w或f;x2是r或k;并且x3是w、f或g;
98.(c)ffrknx1lx2ltx3(seq id no:46)的氨基酸序列,其中x1是w或f;x2是r或k;并且x3是w、f或g;
99.(d)ffrkwlx1ltx2(seq id no:47)的氨基酸序列,其中x1是r或k;并且x2是w或g;
100.(e)ffrknwlx1ltx2(seq id no:48)的氨基酸序列,其中x1是r或k;并且x2是w或g;
101.(f)ffrknwx1x2x3x4x5(seq id no:49)的氨基酸序列,其中x1是l或i;x2是l、r或k;x3是l或i;x4是t、l、f、k、r或w;并且x5是w或k;或者
102.(g)选自由seq id no:50-67组成的组的氨基酸序列。
103.实施方案77.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的c-末端连接至seq id no:50所示的氨基酸序列的n-末端。
104.实施方案78.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的c-末端连接至seq id no:51所示的氨基酸序列的n-末端。
105.实施方案79.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的c-末端连接至seq id no:52所示的氨基酸序列的n-末端。
106.实施方案80.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的c-末端连接至seq id no:53所示的氨基酸序列的n-末端。
107.实施方案81.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的c-末端连接至seq id no:54所示的氨基酸序列的n-末端。
108.实施方案82.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的c-末端连接至seq id no:55所示的氨基酸序列的n-末端。
109.实施方案83.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的c-末端连接至seq id no:56所示的氨基酸序列的n-末端。
110.实施方案84.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的c-末端连接至seq id no:57所示的氨基酸序列的n-末端。
111.实施方案85.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的c-末端连接至seq id no:58所示的氨基酸序列的n-末端。
112.实施方案86.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的c-末端连接至seq id no:59所示的氨基酸序列的n-末端。
113.实施方案87.如实施方案49或50所述的抗原性多肽,其中所述mhc结合肽的c-末端
id no:3920的氨基酸序列组成。
132.实施方案106.如实施方案101-105中任一项所述的组合物,其中所述应激蛋白是重组蛋白。
133.实施方案107.如实施方案100-106中任一项所述的组合物,包含2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49或50种不同的抗原性多肽。
134.实施方案108.如实施方案107所述的组合物,其中所述不同的多肽中的每种包括相同的hsp结合肽和不同的mhc结合肽。
135.实施方案109.如实施方案100-108中任一项所述的组合物,其中所述组合物中的所述多肽的总量为约0.1至20nmol,任选地约3、4、5或6nmol。
136.实施方案110.如实施方案101-109中任一项所述的组合物,其中所述组合物中的所述应激蛋白的量为约10μg至600μg,任选地约120μg、240μg或480μg。
137.实施方案111.如实施方案101-110中任一项所述的组合物,其中所述抗原性多肽与所述应激蛋白的摩尔比为约0.5:1至约5:1,任选地约1:1,1.25:1,1.5:1,2:1,2.5:1,3:1,3.5:1,4:1,4.5:1或5:1。
138.实施方案112.如实施方案100-111中任一项所述的组合物,其中所述组合物还包含佐剂。
139.实施方案113.如实施方案112所述的组合物,其中所述佐剂包括皂苷或免疫刺激性核酸。
140.实施方案114.如实施方案113所述的组合物,其中所述佐剂包括qs-21。
141.实施方案115.如实施方案114所述的组合物,其中所述组合物中的所述qs-21的量为约10μg至约200μg,任选地约25μg、50μg、75μg、100μg、125μg、150μg、175μg或200μg。
142.实施方案116.如实施方案112-115中任一项所述的组合物,其中所述佐剂包括tlr激动剂,任选地tlr4激动剂、tlr5激动剂、tlr7激动剂、tlr8激动剂和/或tlr9激动剂。
143.实施方案117.如实施方案100-116中任一项所述的组合物,还包含药学上可接受的载剂或赋形剂。
144.实施方案118.如实施方案117所述的组合物,其中所述组合物为单位剂型。
145.实施方案119.一种在受试者中诱导对抗原性多肽的细胞免疫应答的方法,所述方法包括将有效量的如实施方案1-99中任一项所述的抗原性多肽或如实施方案100-118中任一项所述的组合物施用于所述受试者。
146.实施方案120.如实施方案119所述的方法,其中所述受试者患有癌症,任选地急性骨髓性白血病(aml)或结肠直肠癌。
147.实施方案121.一种治疗受试者的疾病的方法,所述方法包括将有效量的如实施方案1-99中任一项所述的抗原性多肽或如实施方案100-118中任一项所述的组合物施用于所述受试者。
148.实施方案122.如实施方案121所述的方法,其中所述疾病是癌症,任选地aml或结肠直肠癌。
149.实施方案123.如实施方案119-122中任一项所述的方法,其中将所述组合物每周一次施用于所述受试者持续四周。
150.实施方案124.如实施方案123所述的方法,其中在四个每周一次剂量之后,将至少两个另外剂量的所述组合物每两周一次施用于所述受试者。
151.实施方案125.如实施方案123或124所述的方法,其中在最后的每周一次或每两周一次剂量之后三个月,施用至少一个加强剂量的所述组合物。
152.实施方案126.如实施方案125所述的方法,其中将所述组合物每三个月一次另外施用持续至少1年。
153.实施方案127.如实施方案119-126中任一项所述的方法,还包括将来那度胺、地塞米松、白介素-2、重组干扰素α-2b或peg-干扰素α-2b施用于所述受试者。
154.实施方案128.如实施方案119-127中任一项所述的方法,还包括将吲哚胺双加氧酶-1(ido-1)抑制剂施用于所述受试者。
155.实施方案129.如实施方案128所述的方法,其中ido-1抑制剂是4-氨基-n-(3-氯-4-氟苯基)-n'-羟基-1,2,5-噁二唑-3-甲脒。
156.实施方案130.如实施方案119-129中任一项所述的方法,还包括将免疫检查点抗体施用于所述受试者。
157.实施方案131.如实施方案130所述的方法,其中所述免疫检查点抗体选自由以下各项组成的组:激动性抗gitr抗体、激动性抗ox40抗体、拮抗性抗pd-1抗体、拮抗性抗ctla-4抗体、拮抗性抗tim-3抗体、拮抗性抗lag-3抗体、拮抗性抗tigit抗体、激动性抗cd96抗体、拮抗性抗vista抗体、拮抗性抗cd73抗体、激动性抗cd137抗体、拮抗性抗ceacam1抗体、激动性抗icos抗体和/或它们的抗原结合片段。
158.实施方案132.一种试剂盒,所述试剂盒包括含有如实施方案1-99中任一项所述的多肽或如实施方案100-118中任一项所述的组合物的第一容器以及含有能够结合至所述多肽的纯化的应激蛋白的第二容器。
159.实施方案133.如实施方案132所述的试剂盒,其中所述第一容器中的所述多肽的总量为约0.1至20nmol,任选地约3、4、5或6nmol。
160.实施方案134.如实施方案132或133所述的试剂盒,其中所述应激蛋白选自以下各项组成的组:hsc70、hsp70、hsp90、hsp110、grp170、gp96、钙网蛋白以及它们的突变体或融合蛋白。
161.实施方案135.如实施方案134所述的试剂盒,其中所述应激蛋白是hsc70,任选地人hsc70。
162.实施方案136.如实施方案135所述的试剂盒,其中所述hsc70包含seq id no:3920的氨基酸序列。
163.实施方案137.如实施方案135所述的试剂盒,其中所述hsc70的氨基酸序列由seq id no:3920的氨基酸序列组成。
164.实施方案138.如实施方案132-137中任一项所述的试剂盒,其中所述应激蛋白是重组蛋白。
165.实施方案139.如实施方案132-138中任一项所述的试剂盒,其中所述第二容器中的所述应激蛋白的量为约10μg至600μg,任选地约120μg、240μg或480μg。
166.实施方案140.如实施方案132-139中任一项所述的试剂盒,其中所述多肽与所述应激蛋白的摩尔比为约0.5:1至5:1,任选地约1:1,1.25:1,1.5:1,2:1,2.5:1,3:1,3.5:1,
4:1,4.5:1或5:1。
167.实施方案141.如实施方案132-140中任一项所述的试剂盒,还包括含有佐剂的第三容器。
168.实施方案142.如实施方案141所述的试剂盒,其中所述佐剂包括皂苷或免疫刺激性核酸。
169.实施方案143.如实施方案142所述的试剂盒,其中所述佐剂包括qs-21。
170.实施方案144.如实施方案143所述的试剂盒,其中所述第三容器中的所述qs-21的量为约10μg至约200μg,任选地约25μg、50μg、75μg、100μg、125μg、150μg、175μg或200μg。
171.实施方案145.如实施方案141-144中任一项所述的试剂盒,其中所述佐剂包括tlr激动剂,任选地tlr4激动剂、tlr5激动剂、tlr7激动剂、tlr8激动剂和/或tlr9激动剂。
172.实施方案146.一种制备疫苗的方法,所述方法包括将如实施方案1-99中任一项所述的多肽中的一种或多种或如实施方案100-118中任一项所述的组合物与纯化的应激蛋白在合适的条件下混合,以使得所述纯化的应激蛋白应激蛋白结合至所述多肽中的至少一种。
173.实施方案147.如实施方案146所述的方法,其中所述应激蛋白选自以下各项组成的组:hsc70、hsp70、hsp90、hsp110、grp170、gp96、钙网蛋白以及它们的突变体或融合蛋白。
174.实施方案148.如实施方案147所述的方法,其中所述应激蛋白是hsc70,任选地人hsc70。
175.实施方案149.如实施方案148所述的方法,其中所述hsc70包含seq id no:3920的氨基酸序列。
176.实施方案150.如实施方案148所述的方法,其中所述hsc70的氨基酸序列由seq id no:3920的氨基酸序列组成。
177.实施方案151.如实施方案146-150中任一项所述的方法,其中所述应激蛋白是重组蛋白。
178.实施方案152.如实施方案146-151中任一项所述的方法,其中所述多肽与所述应激蛋白的摩尔比为约0.5:1至5:1,任选地约1:1,1.25:1,1.5:1,2:1,2.5:1,3:1,3.5:1,4:1,4.5:1或5:1。
179.实施方案153.如实施方案146-152中任一项所述的方法,其中所述合适条件包括约37℃的温度。
180.实施方案154.一种分离的抗体,所述抗体:(i)特异性结合至mhc结合肽,所述mhc结合肽选自由以下各项组成的组:seq id no:98-1371、3921-3996和4149-4171,任选地其中所述抗体不特异性结合至所述mhc结合肽的未磷酸化的变体;和/或(ii)特异性结合至mhc分子和mhc结合肽的复合物,所述mhc结合肽选自由以下各项组成的组:seq id no:98-1371、3921-3996和4149-4171,任选地其中所述抗体不特异性结合至mhc分子和所述mhc结合肽的未磷酸化变体的复合物。
181.实施方案155.如实施方案154所述的抗体,是嵌合抗原受体。
182.实施方案156.一种分离的t细胞受体(tcr),所述t细胞受体特异性结合至mhc分子和mhc结合肽的复合物,所述mhc结合肽选自由以下各项组成的组:seq id no:98-1371、3921-3996和4149-4171,任选地其中所述tcr不特异性结合至所述mhc分子和所述mhc结合
肽的未磷酸化变体的复合物。
183.实施方案157.如实施方案156所述的tcr,是可溶性tcr。
184.实施方案158.如实施方案156或157所述的tcr,还包含cd3结合部分。
185.实施方案159.一种分离的多核苷酸,所述多核苷酸编码如实施方案154或155所述的抗体的vh和/或vl。
186.实施方案160.一种分离的多核苷酸,所述多核苷酸编码如实施方案156-158中任一项所述的tcr的可变区,任选地vα和/或vβ。
187.实施方案161.如实施方案159或160所述的分离的多核苷酸,其是mrna。
188.实施方案162.一种载体,所述载体包含如实施方案159或160所述的多核苷酸。
189.实施方案163.一种经工程化的细胞,所述经工程化的细胞包含如实施方案154或155所述的抗体,或者如实施方案156-158中任一项所述的tcr。
190.实施方案164.一种经工程化的细胞,所述经工程化的细胞包含如实施方案159-161中任一项所述的多核苷酸或者如实施方案162所述的载体。
191.实施方案165.如实施方案163或164所述的经工程化的细胞,其中所述经工程化的细胞是人淋巴细胞。
192.实施方案166.如实施方案163-165中任一项所述的经工程化的细胞,其中所述经工程化的细胞选自由以下各项组成的组:t细胞、cd8 t细胞、cd4 t细胞、自然杀伤t(nkt)细胞、不变自然杀伤t(inkt)细胞、粘膜相关不变t(mait)细胞和自然杀伤(nk)细胞。
具体实施方式
193.本公开提供了包括肿瘤相关肽的新型抗原性多肽,以及包含它们的组合物。此类抗原性多肽和组合物可特别用作免疫疗法(例如,癌症疫苗)。还提供了使用所述多肽和组合物来诱导细胞免疫应答的方法、使用所述多肽和组合物来治疗疾病的方法、包括所述多肽和组合物的试剂盒、制备所述组合物的方法、以及特异性结合至所述多肽的抗体和t细胞受体。
194.定义
195.除非本文另外定义,否则本文所用的科学和技术术语应具有本领域的普通技术人员通常理解的含义。如果存在任何潜在的歧义,则本文提供的定义优先于任何字典或外部定义。除非上下文另外要求,否则单数术语应包括复数并且复数术语应包括单数。除非另有说明,否则“或”的使用意指“和/或”。术语“包括”以及其他形式诸如“包含”和“含有”的使用并非是限制性的。
196.如本文所用,术语“约”和“大约”,当用于修饰数值或数值范围时,表示大5%至10%(例如,大最多5%至10%)和小5%至10%(例如,小最多5%至10%)的偏差,所述值或范围保持在所述值或范围的预期含义内。
197.如本文所用,术语“抗原性多肽”是指包含一种或多种mhc结合肽的聚合物。抗原性多肽可以包含一个或多个非氨基酸残基结构。在某些实施方案中,抗原性多肽包含化学接头,例如连接抗原性多肽的两个肽部分的化学接头。
198.如本文所用,术语“主要组织相容性复合体”和“mhc”可互换使用,是指mhc i类分子和/或mhc ii类分子。
proteins of immunological interest(nih publication no.91-3242,bethesda),该文献以引用的方式整体并入本文)。
208.如本文所用,术语“嵌合抗原受体”是指包含一个或多个抗体可变区的融合蛋白,所述抗体可变区与异源跨膜区和胞质区(例如,来自t细胞共刺激受体诸如cd28或41bb的胞质区)连接。
209.如本文所用,术语“t细胞受体”和“tcr”可互换使用,是指包含来自αβ或γδt细胞受体的cdr或可变区的分子。tcr的实例包括但不限于全长tcr、tcr的抗原结合片段、缺乏跨膜和胞质区的可溶性tcr、含有通过柔性接头连接的tcr的可变区的单链tcr、通过经工程化的二硫键连接的tcr链、单个tcr可变结构域、单个肽-mhc特异性tcr、多特异性tcr(包括双特异性tcr)、tcr融合体、包含共刺激区的tcr、人tcr、人源化tcr、嵌合tcr、重组产生的tcr和合成tcr。在某些实施方案中,tcr是包含全长α链和全长β链的全长tcr。在某些实施方案中,tcr是缺乏跨膜和/或胞质区的可溶性tcr。在某些实施方案中,tcr是包含通过肽接头连接的vα和vβ的单链tcr(sctcr),诸如具有如pct公开号:wo 2003/020763、wo 2004/033685或wo 2011/044186中描述的结构的sctcr,这些公开中的每个均以引用的方式整体并入本文。在某些实施方案中,tcr包含跨膜区。在某些实施方案中,tcr包含共刺激信号区。
210.如本文所用,术语“全长tcr”是指包含第一和第二多肽链的二聚体的tcr,这些多肽链中的每个包含tcr可变区和tcr恒定区,所述tcr恒定区包含tcr跨膜区和tcr胞质区。在某些实施方案中,全长tcr包含一个或两个未经修饰的tcr链,例如未经修饰的α、β、γ或δtcr链。在某些实施方案中,全长tcr包含一个或两个改变的tcr链,诸如嵌合tcr链和/或相对于未经修饰的tcr链包含一个或多个氨基酸置换、插入或缺失的tcr链。在某些实施方案中,全长tcr包含成熟的全长tcrα链和成熟的全长tcrβ链。在某些实施方案中,全长tcr包含成熟的全长tcrγ链和成熟的全长tcrδ链。
211.如本文所用,术语“tcr可变区”是指成熟的tcr多肽链(例如,tcrα链或β链)的一部分,它不由tcrα链的trac基因,tcrβ链的trbc1或trbc2基因,tcrδ链的trdc基因或tcrγ链的trgc1或trgc2基因编码。在一些实施方案中,tcrα链的tcr可变区涵盖由trav和/或traj基因编码的成熟的tcrα链多肽的所有氨基酸,并且tcrβ链的tcr可变区涵盖由trbv、trbd和/或trbj基因编码的成熟的tcrβ链多肽的所有氨基酸(参见,例如,t细胞受体factsbook,(2001)lefranc and lefranc,academic press,isbn 0-12-441352-8,该文献以引用的方式整体并入本文)。tcr可变区通常包含框架区(fr)1、2、3和4以及互补决定区(cdr)1、2和3。
212.如本文所用,术语“α链可变区”和“vα”可互换使用,并且是指tcrα链的可变区。
213.如本文所用,术语“β链可变区”和“vβ”可互换使用,并且是指tcrβ链的可变区。
214.如本文所用,术语“特异性结合至”是指抗体或tcr优先地结合至特定抗原(例如,特异性mhc结合多肽,或mhc结合多肽/mhc复合物)的能力,因为这种结合是本领域的技术人员所理解的。例如,特异性结合至抗原的抗体或tcr可以结合至其他抗原,通常具有较低的亲和力,如通过例如或本领域已知的其他免疫测定法所测定(参见,例如,savage等人,immunity.1999,10(4):485-92,该文献以引用的方式整体并入本文)。在一个具体实施方案中,特异性结合至抗原的抗体或tcr结合至抗原的缔合常数(ka)比所述抗体或tcr结合至另一种抗原时的ka大至少10倍、50倍、100倍、500倍、1,000倍、5,000倍或10,000倍。
215.如本文所用,术语“治疗(treat、treating和treatment)”是指通常涉及将药剂(例
如,本文公开的多肽)施用于患有疾病或障碍或倾向于患有此类疾病或障碍的受试者的方法,以治愈、延迟、降低所述疾病或障碍的严重性或改善所述疾病或障碍的一种或多种症状,或者将受试者的存活时间延长至超过在不存在此类治疗的情况下的预期存活时间。
216.如本文所用,在将疗法施用于受试者的上下文中,术语“有效量”是指实现所期望的预防或治疗效果的疗法的量。
217.如本文所用,术语“受试者”包括任何人或非人动物。
218.抗原性多肽
219.在一个方面,本公开提供了一种抗原性多肽,所述抗原性多肽包括肿瘤相关性mhc结合肽。用于本文公开的抗原性多肽的示例性mhc结合肽列于本文的表1中。
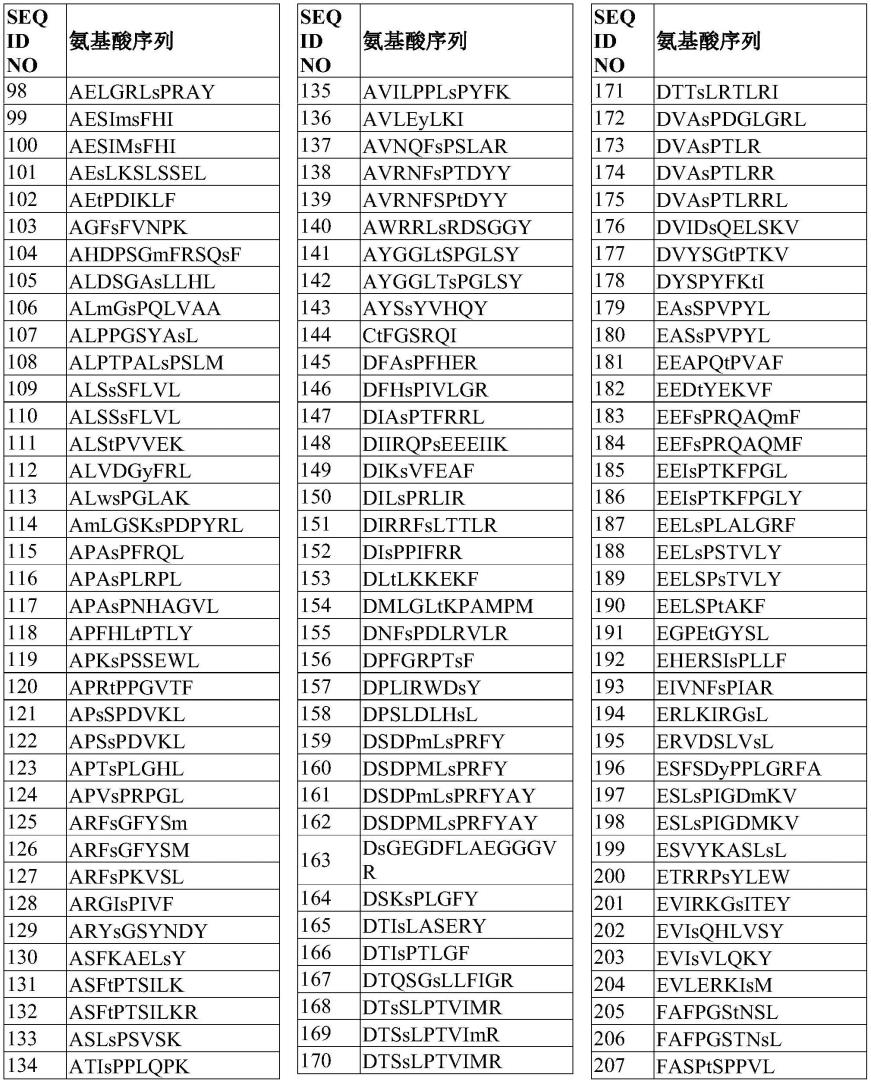
220.表1.示例性mhc结合肽的氨基酸序列
221.222.223.224.225.226.227.228.229.230.231.[0232][0233]
因此,在某些实施方案中,本公开提供了一种抗原性多肽,所述抗原性多肽包括mhc结合肽,所述mhc结合肽包含选自由seq id no:98-1371、3921-3996和4149-4171组成的组的氨基酸序列。在某些实施方案中,mhc结合肽的氨基酸序列由选自由seq id no:98-1371、3921-3996和4149-4171组成的组的氨基酸序列组成。在某些实施方案中,抗原性多肽的氨基酸序列由选自由seq id no:98-1371、3921-3996和4149-4171组成的组的氨基酸序列组成。在某些实施方案中,抗原性多肽由选自由seq id no:98-1371、3921-3996和4149-4171组成的组的氨基酸序列组成。
[0234]
在某些实施方案中,本文公开的mhc结合肽的长度为8至50个氨基酸(例如,8,9,
10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49或50个氨基酸)。
[0235]
在某些实施方案中,本文公开的抗原肽的长度为8至100个氨基酸(例如,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59,60,61,62,63,64,65,66,67,68,69,70,71,72,73,74,75,76,77,78,79,80,81,82,83,84,85,86,87,88,89,90,91,92,93,94,95,96,97,98,99或100个氨基酸)。在某些实施方案中,抗原肽的长度为8至50个氨基酸。
[0236]
在某些实施方案中,本文公开的抗原肽的长度小于9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59,60,61,62,63,64,65,66,67,68,69,70,71,72,73,74,75,76,77,78,79,80,81,82,83,84,85,86,87,88,89,90,91,92,93,94,95,96,97,98,99或100个氨基酸。
[0237]
在某些实施方案中,本文公开的抗原性多肽的氨基酸序列包含不超过蛋白质(例如,天然存在的蛋白质)的8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59,60,61,62,63,64,65,66,67,68,69,70,71,72,73,74,75,76,77,78,79,80,81,82,83,84,85,86,87,88,89,90,91,92,93,94,95,96,97,98,99或100个连续氨基酸,所述蛋白质包含选自由seq id no:98-1371、3921-3996和4149-4171组成的组的氨基酸序列。
[0238]
在另一个方面,本公开提供了一种抗原性多肽,所述抗原性多肽包括肿瘤相关性mhc结合肽和hsp结合肽。示例性hsp结合肽列于本文的表2中。包括hsp结合肽的示例性抗原性多肽列于本文的表3和表4中。
[0239]
表2.示例性hsp结合肽、接头和hsp的氨基酸序列
[0240]
[0241]
[0242]
[0243]
[0244][0245]
表3.示例性抗原性多肽的氨基酸序列
[0246]
[0247]
[0248]
[0249]
[0250]
[0251]
[0252]
[0253]
[0254]
[0255]
[0256]
[0257]
[0258]
[0259]
[0260]
[0261]
[0262]
[0263]
[0264][0265]
表4.示例性抗原性多肽的氨基酸序列
[0266]
[0267]
[0268]
[0269]
[0270]
[0271]
[0272]
[0273]
[0274]
[0275]
[0276]
[0277]
[0278]
[0279]
[0280]
[0281]
[0282]
[0283]
[0284][0285]
在某些实施方案中,本公开提供了:一种抗原性多肽,所述抗原性多肽包括mhc结合肽,其包含选自由seq id no:98-1371、3921-3996和4149-4171组成的组的氨基酸序列;以及hsp结合肽,其包含x1x2x3x4x5x6x7(seq id no:1)的氨基酸序列,其中x1被省略,是n、f或q;x2是w、l或f;x3是l或i;x4是r、l或k;x5是l、w或i;x6是t、l、f、k、r或w;并且x7是w、g、k或f。
[0286]
在某些实施方案中,hsp结合肽包含以下的氨基酸序列:
[0287]
(a)x1lx2ltx3(seq id no:2),其中x1是w或f;x2是r或k;并且x3是w、f或g;
[0288]
(b)nx1lx2ltx3(seq id no:3),其中x1是w或f;x2是r或k;并且x3是w、f或g;
[0289]
(c)wlx1ltx2(seq id no:4),其中x1是r或k;并且x2是w或g;
[0290]
(d)nwlx1ltx2(seq id no:5),其中x1是r或k;并且x2是w或g;或者
[0291]
(e)nwx1x2x3x4x5(seq id no:6),其中x1是l或i;x2是l、r或k;x3是l或i;x4是t、l、f、k、r或w;并且x5是w或k。
[0292]
在某些实施方案中,本公开提供了:一种抗原性多肽,所述抗原性多肽包括mhc结合肽,其包含选自由seq id no:98-1371、3921-3996和4149-4171组成的组的氨基酸序列,任选地其中mhc结合肽的氨基酸序列由选自由seq id no:98-1371、3921-3996和4149-4171组成的组的氨基酸序列组成;以及hsp结合肽,其包含选自由seq id no:1-42组成的组的氨基酸序列,任选地其中hsp结合肽的氨基酸序列由选自由seq id no:1-42组成的组的氨基酸序列组成。
[0293]
在某些实施方案中,mhc结合肽的c-末端连接(直接或间接)至hsp结合肽的n-末端。因此,在某些实施方案中,抗原性多肽包括mhc结合肽,其包含选自由seq id no:98-1371、3921-3996和4149-4171组成的组的氨基酸序列,以及hsp结合肽,其包含选自由seq id no:1-42组成的组的氨基酸序列,其中mhc结合肽的c-末端连接(直接或间接)至hsp结合肽的n-末端。
[0294]
在某些实施方案中,mhc结合肽的n-末端连接(直接或间接)至hsp结合肽的c-末端。因此,在某些实施方案中,抗原性多肽包括mhc结合肽,其包含选自由seq id no:98-1371、3921-3996和4149-4171组成的组的氨基酸序列,以及hsp结合肽,其包含选自由seq id no:1-42组成的组的氨基酸序列,其中mhc结合肽的n-末端连接(直接或间接)至hsp结合肽的c-末端。
[0295]
在某些实施方案中,mhc结合肽的长度为8至50个氨基酸,任选地长度为8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49或50个氨基酸。
[0296]
在某些实施方案中,hsp结合肽的长度为6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49或50个氨基酸。在某些实施方案中,hsp结合肽的长度小于7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49或50个氨基酸。
[0297]
在某些实施方案中,hsp结合肽通过化学接头连接至mhc结合肽。可以使用任何化学接头来连接hsp结合肽和mhc结合肽。示例性化学接头包括由化学交联(参见,例如,wong,1991,chemistry of protein conjugation and cross-linking,crc press,该文献以引用的方式整体并入本文)、uv交联和点击化学反应(参见,例如,美国专利公开20130266512,该文献以引用的方式并入本文)产生的部分。
[0298]
在某些实施方案中,hsp结合肽通过肽接头(例如,本文公开的肽接头)连接至mhc结合肽。在某些实施方案中,肽接头包含seq id no:43或fr的氨基酸序列。在某些实施方案中,肽接头的氨基酸序列由seq id no:43或fr的氨基酸序列组成。
[0299]
在某些实施方案中,mhc结合肽的c-末端通过seq id no:43或fr的肽接头连接至hsp结合肽的n-末端。因此,在某些实施方案中,抗原性多肽从n-末端至c-末端包含:mhc结合肽,其包含选自由seq id no:98-1371、3921-3996和4149-4171组成的组的氨基酸序列;seq id no:43或fr的肽接头;以及hsp结合肽,其包含选自由seq id no:1-42组成的组的氨
基酸序列。在某些实施方案中,mhc结合肽的氨基酸序列由选自由seq id no:98-1371、3921-3996和4149-4171组成的组的氨基酸序列组成,并且hsp结合肽的氨基酸序列由选自由seq id no:1-42组成的组的氨基酸序列组成。
[0300]
在某些实施方案中,抗原性多肽包含选自由seq id no:1372-3919、3997-4148和4172-4217组成的组的氨基酸序列。在某些实施方案中,抗原性多肽的氨基酸序列由选自由seq id no:1372-3919、3997-4148和4172-4217组成的组的氨基酸序列组成。在某些实施方案中,抗原性多肽由选自由seq id no:1372-3919、3997-4148和4172-4217组成的组的氨基酸序列组成。
[0301]
在某些实施方案中,mhc结合肽的n-末端通过seq id no:43或fr的肽接头连接至hsp结合肽的c-末端。因此,在某些实施方案中,抗原性多肽从n-末端至c-末端包括:hsp结合肽,其包含选自由seq id no:1-42组成的组的氨基酸序列;seq id no:43或fr的肽接头;以及mhc结合肽,其包含选自由seq id no:98-1371、3921-3996和4149-4171组成的组的氨基酸序列。在某些实施方案中,mhc结合肽的氨基酸序列由选自由seq id no:98-1371、3921-3996和4149-4171组成的组的氨基酸序列组成,并且hsp结合肽的氨基酸序列由选自由seq id no:1-42组成的组的氨基酸序列组成。
[0302]
在某些实施方案中,抗原性多肽包括mhc结合肽,其包含选自由seq id no:98-1371、3921-3996和4149-4171组成的组的氨基酸序列,并且其中mhc结合肽的n-末端连接至选自由seq id no:74-97组成的组的氨基酸序列的c-末端。在某些实施方案中,mhc结合肽的氨基酸序列由选自由seq id no:98-1371、3921-3996和4149-4171组成的组的氨基酸序列组成。
[0303]
在某些实施方案中,抗原性多肽包括mhc结合肽,其包含选自由seq id no:98-1371、3921-3996和4149-4171组成的组的氨基酸序列,并且其中mhc结合肽的c-末端连接至选自由seq id no:50-67组成的组的氨基酸序列的n-末端。在某些实施方案中,mhc结合肽的氨基酸序列由选自由seq id no:98-1371、3921-3996和4149-4171组成的组的氨基酸序列组成。
[0304]
在某些实施方案中,本文公开的抗原肽的长度为8至100个氨基酸(例如,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59,60,61,62,63,64,65,66,67,68,69,70,71,72,73,74,75,76,77,78,79,80,81,82,83,84,85,86,87,88,89,90,91,92,93,94,95,96,97,98,99或100个氨基酸)。在某些实施方案中,抗原肽的长度为8至50个氨基酸。
[0305]
在某些实施方案中,本文公开的抗原肽的长度小于9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59,60,61,62,63,64,65,66,67,68,69,70,71,72,73,74,75,76,77,78,79,80,81,82,83,84,85,86,87,88,89,90,91,92,93,94,95,96,97,98,99或100个氨基酸。
[0306]
在某些实施方案中,本文公开的抗原性多肽的氨基酸序列包含不超过蛋白质(例如,天然存在的蛋白质)的8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,
52,53,54,55,56,57,58,59,60,61,62,63,64,65,66,67,68,69,70,71,72,73,74,75,76,77,78,79,80,81,82,83,84,85,86,87,88,89,90,91,92,93,94,95,96,97,98,99或100个连续氨基酸,所述蛋白质包含选自由seq id no:98-1371、3921-3996和4149-4171组成的组的氨基酸序列。
[0307]
本文公开的抗原性多肽可以包括一个或多个mhc结合肽。在某些实施方案中,抗原肽包括一个mhc结合肽。在某些实施方案中,抗原性多肽包括两个或更多个(例如,3、4、5、6、7、8、9、10或更多个)mhc结合肽。两个或更多个mhc结合肽可以通过化学接头或肽接头连接,其中肽接头任选地包含可以被蛋白酶识别和/或切割的氨基酸序列。
[0308]
在某些实施方案中,本公开提供了包含选自由seq id no:98-3919和3921-4217组成的组的氨基酸序列的多肽。在某些实施方案中,多肽的长度为8至100个氨基酸(例如,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59,60,61,62,63,64,65,66,67,68,69,70,71,72,73,74,75,76,77,78,79,80,81,82,83,84,85,86,87,88,89,90,91,92,93,94,95,96,97,98,99或100个氨基酸)。在某些实施方案中,多肽的长度为8至50个氨基酸。在某些实施方案中,多肽的氨基酸序列由选自由seq id no:98-3919和3921-4217组成的组的氨基酸序列组成。在某些实施方案中,多肽由选自由seq id no:98-3919和3921-4217组成的组的氨基酸序列组成。
[0309]
技术人员将理解,本文公开的抗原性多肽还包括在合成期间或之后被修饰的抗原性多肽的衍生物。此类修饰包括但不限于:糖基化、乙酰化、甲基化、磷酸化(例如,在侧链羟基或胺上的tyr、ser、thr、arg、lys或his的磷酸化)、甲酰化或酰胺化(例如,c-末端羧基的酰胺化);使用反应性化学基团的衍生化(例如,游离nh2、cooh或oh基团的衍生化);特定的化学切割(例如,通过溴化氰、羟胺、bnps-粪臭素、酸、nabh4或碱水解进行);酶促切割(例如,通过胰蛋白酶、胰凝乳蛋白酶、木瓜蛋白酶、v8蛋白酶;氧化;还原等进行)。对抗原性多肽进行上述修饰的方法是本领域熟知的。
[0310]
在某些实施方案中,抗原性多肽包含一个或多个经修饰的氨基酸残基(例如,在抗原性多肽的mhc结合肽部分中)。在某些实施方案中,抗原性多肽包含磷酸化残基(例如,已经在侧链羟基或胺上被磷酸化的tyr、ser、thr、arg、lys或his)。在某些实施方案中,抗原性多肽包含磷酸模拟残基(例如,已经在侧链羟基或胺上被磷酸化的tyr、ser、thr、arg、lys或his氨基酸的模拟物)。磷酸模拟基团的非限制性实例包括o-硼磷酸、硼、o-二硫代磷酸、磷酰胺、h-膦酸、烷基膦酸、硫代磷酸、二硫代磷酸和氟磷酸,它们中的任一者都可以在tyr、thr、ser、arg、lys或his残基上衍生。在某些实施方案中,asp或glu残基被用作磷酸模拟物来置换肽中的磷酸-tyr、磷酸-thr、磷酸-ser、磷酸-arg、磷酸-lys和/或磷酸his残基。在某些实施方案中,磷酸模拟残基是磷酸化残基的不可水解的类似物。因此,在某些实施方案中,抗原性多肽包含选自由seq id no:98-1371、3921-3996和4149-4171组成的组的磷酸肽,其中磷酸肽的磷酸化氨基酸残基被磷酸化氨基酸残基的不可水解的模拟物置换。
[0311]
技术人员将进一步理解,在某些实施方案中,本文公开的抗原性多肽可以包含一个或多个天然和/或非天然氨基酸(例如,d-氨基酸)以及氨基酸类似物和衍生物(例如,二取代氨基酸、n-烷基氨基酸、乳酸、4-羟脯氨酸、γ-羧基谷氨酸、ε-n,n,n-三甲基赖氨酸、ε-n-乙酰赖氨酸、o-磷酸丝氨酸、n-乙酰丝氨酸、n-甲酰甲硫氨酸、3-甲基组氨酸、5-羟赖氨
酸、σ-n-甲基精氨酸)。在某些实施方案中,本文公开的抗原性多肽包含一个或多个逆反肽。“逆反肽”是指在两个或多个位置具有肽序列的逆转以及在手性氨基酸中具有从l至d构型的立体化学逆转的肽。因此,逆反肽具有逆转的末端,逆转的肽键方向,以及从n至c末端逆转的肽序列,同时大致保持侧链的拓扑结构与天然肽序列相同。逆反肽类似物的合成在bonelli,f.等人,int j pept protein res.24(6):553-6(1984);verdini,a和viscomi,g.c,j.chem.soc.perkin trans.1:697-701(1985);和美国专利号6,261,569中有所描述,这些文献以引用的方式整体并入本文。
[0312]
通过化学合成来产生抗原性多肽
[0313]
本文公开的抗原性多肽可以通过标准化学方法,包括使用肽合成仪来合成。可以使用本领域熟知的常规肽合成或其他合成方案。
[0314]
在某些实施方案中,本文公开的多肽由通过肽键连接的氨基酸残基(天然或非天然)组成。此类多肽可以例如通过固相肽合成法使用类似于merrifield,1963,j.am.chem.soc.,85:2149所述的程序来合成,该文献以引用的方式整体并入本文。在合成过程中,将具有保护侧链的n-α-保护氨基酸逐步添加至生长的多肽链中,所述多肽链通过其c-末端连接至不溶性聚合物支持物,即聚苯乙烯珠粒。多肽通过将n-α-去保护氨基酸的氨基连接至n-α-保护氨基酸的α-羧基来合成,所述羧基已经通过与试剂反应来活化,所述试剂诸如二环己基碳二亚胺或2-(6-氯-1-h-苯并三唑-1-基)-1,1,3,3-四甲基六氟磷酸铵。游离的氨基与活化的羧基的连接引起肽键形成。最常用的n-α-保护基团包括酸不稳定性boc和碱不稳定性fmoc。适当的化学物质、树脂、保护基团、保护氨基酸和试剂的细节是本领域熟知的(参见,atherton等人,1989,solid phase peptide synthesis:a practical approach,irl press,和bodanszky,1993,peptide chemistry,a practical textbook,第2版,springer-verlag,这些文献中的每个均以引用的方式整体并入本文)。
[0315]
此外,多肽的类似物和衍生物可以如上文所述化学合成。如果需要,可以将非经典氨基酸或化学氨基酸类似物作为置换或添加引入肽序列中。非经典氨基酸包括但不限于常见氨基酸的d-异构体、α-氨基异丁酸、4-氨基丁酸、羟脯氨酸、肌氨酸、瓜氨酸、磺基丙氨酸、叔丁基甘氨酸、叔丁基丙氨酸、苯甘氨酸、环己基丙氨酸、β-丙氨酸、设计氨基酸(诸如β-甲基氨基酸、c-α-甲基氨基酸和n-α-甲基氨基酸)。
[0316]
tyr、ser、thr、arg、lys和his的侧链上的磷酸化多肽可以在fmoc固相合成中使用适当的侧链保护性fmoc-磷酸氨基酸来合成。通过这种方式,可以合成具有磷酸化和非磷酸化tyr、ser、thr、arg、lys和his残基的组合的多肽。例如,可以利用staerkaer等人的方法(1991,tetrahedron letters 32:5389-5392)。其他程序(一些针对特定氨基酸的程序)在de bont等人(1987,trav.chim pays bas 106:641,642),bannwarth和trezeciak(1987,helv.chim.acta 70:175-186),perich和johns(1988,tetrahedron letters 29:2369-2372),kitas等人(1990,j.org.chem.55:4181-4187),valerio等人(1989,int.j.peptide protein res.33:428-438),perich等人(1991,tetrahedron letters 32:4033-4034),pennington(1994,meth.molec.biol.35:195-2)和perich(1997,methods enzymol.289:245-266)中有所详细描述,这些文献中的每个以引用的方式整体并入本文。
[0317]
磷酸化多肽还可以通过首先培养用编码多肽的氨基酸序列的核酸转化的细胞来产生。在通过细胞培养产生这种多肽之后,使用有机合成或使用磷酸化酶的酶促方法将合
适的氨基酸的羟基基团取代为磷酸基团。例如,在丝氨酸特异性磷酸化的情况下,可以使用丝氨酸激酶。
[0318]
还可以合成磷酸肽模拟物,其中多肽中的磷酸化氨基酸残基被磷酸模拟基团置换。磷酸模拟基团的非限制性实例包括o-硼磷酸、硼、o-二硫代磷酸、磷酰胺、h-膦酸、烷基膦酸、硫代磷酸、二硫代磷酸和氟磷酸,它们中的任一者都可以在tyr、thr、ser、arg、lys或his残基上衍生。在某些实施方案中,asp或glu残基被用作磷酸模拟物。asp或glu残基也可以用作磷酸模拟基团,并且可用于置换肽中的磷酸-tyr、磷酸-thr、磷酸-ser、磷酸-arg、磷酸-lys和/或磷酸his残基。
[0319]
所得的肽的纯化通过常规程序,诸如使用反相、凝胶渗透、分配和/或离子交换色谱的制备型hplc来完成。适当的基质和缓冲液的选择是本领域熟知的,因此本文不再详细描述。
[0320]
使用重组dna技术来产生抗原性多肽
[0321]
本文公开的多肽还可以通过本领域已知的重组dna方法来制备。编码多肽的核酸序列可以通过氨基酸序列的反向翻译来获得,并且通过标准化学方法(诸如使用寡核苷酸合成仪)来合成。或者,多肽的编码信息可以使用专门设计的寡核苷酸引物和pcr方法从dna模板获得。多肽的变异体和片段可以通过提供功能等效分子的置换、插入或缺失来制备。由于核苷酸编码序列的简并性,编码相同或多肽变体的dna序列可用于实施本发明。这些包括但不限于通过置换编码序列内功能等效氨基酸残基的不同密码子而改变,从而产生沉默或保守变化的核苷酸序列。可以将编码多肽的核酸插入表达载体中以在宿主细胞中增殖和表达。
[0322]
由于本文所考虑长度的肽的编码序列可以通过化学技术,例如matteucci等人,j.am.chem.soc.103:3185(1981)(以引用的方式整体并入本文)的磷酸三酯方法来合成,因此可以简单地通过用合适的碱基取代编码天然肽序列的碱基来进行修饰。然后可以为编码序列提供合适的接头并连接至本领域通常可用的表达载体中,并且该载体用于转化合适的宿主以产生所需的肽或融合蛋白。现在有许多这样的载体和合适的宿主系统可用。对于肽或融合蛋白的表达,编码序列将提供可操作地连接的起始和终止密码子、启动子和终止子区域以及通常的复制系统,以提供用于在所需细胞宿主中表达的表达载体。
[0323]
表达构建体是指编码多肽的核苷酸序列,该多肽与一个或多个调控区域可操作地连接,所述调控区域使得肽能够在合适的宿主细胞中表达。“可操作地连接”是指其中调控区域和待表达的肽序列以允许转录和最终翻译的方式连接和定位的缔合。
[0324]
肽转录所必需的调控区域可以由表达载体提供。如果要表达缺少其同源起始密码子的肽基因序列,也可以提供翻译起始密码子(atg)。在相容性宿主-构建体系统中,细胞转录因子(诸如rna聚合酶)将与表达构建体上的调控区域结合,以影响宿主生物体中肽序列的转录。基因表达所需的调控区域的精确性质可以因宿主细胞而异。通常,需要能够结合rna聚合酶并且促进可操作结合的核酸序列转录的启动子。此类调控区域可以包括那些涉及转录和翻译起始的5'非编码序列,诸如tata盒、加帽序列、caat序列等。编码序列的3'非编码区可以包含转录终止调节序列,诸如终止子和多腺苷酸化位点。
[0325]
为了将具有调控功能的dna序列(诸如启动子)连接至肽基因序列或将肽基因序列插入载体的克隆位点,可以通过本领域熟知的技术将提供适当相容性限制性位点的接头或
衔接子连接至cdna的末端(wu等人,1987,methods in enzymol 152:343-349,该文献以引用的方式整体并入本文)。用限制性酶切割可以在连接前通过回切或补充单链dna末端来进行修饰以产生平末端。或者,可以通过使用含有所需限制性酶位点的引物的pcr扩增dna,从而将所需限制性酶位点引入dna片段。
[0326]
可以将包含与调控区域可操作地连接的多肽编码序列的表达构建体直接引入合适的宿主细胞中,用于肽的表达和产生,而无需进一步克隆。表达构建体还可以包含促进dna序列整合至宿主细胞的基因组中(例如通过同源重组)的dna序列。在这种情况下,为了在宿主细胞中复制和表达肽,不必使用包含适合于适当宿主细胞的复制起点的表达载体。
[0327]
可以使用多种表达载体,包括质粒、粘粒、噬菌体、噬菌粒或经修饰的病毒。通常,此类表达载体包含用于载体在适当宿主细胞中增殖的功能性复制起点、用于插入肽基因序列的一个或多个限制性核酸内切酶位点以及一个或多个选择性标记。可以构建表达载体以携带本文公开的一种或多种多肽的核苷酸序列。表达载体必须与相容的宿主细胞一起使用,该宿主细胞可以来源于原核或真核生物,包括但不限于细菌、酵母、昆虫、哺乳动物和人。此类宿主细胞可以被转化以表达一种或多种本文公开的多肽,诸如通过用含有编码本文公开的任何多肽的多个核苷酸序列的单一表达载体转化宿主细胞,或通过用多种编码本文公开的不同多肽的表达载体转化宿主细胞。
[0328]
在细菌系统中,可以有利地选择许多表达载体来产生多肽。例如,当要产生大量此类蛋白质,诸如用于产生药物组合物时,可以需要指导易于纯化的高水平融合蛋白产物表达的载体。此类载体包括大肠杆菌(e.coli)表达载体pur278(ruther等人,1983,embo j.2,1791,该文献以引用的方式整体并入本文),其中肽编码序列可以单独连接至载体lac z编码区框内,以产生融合蛋白;pin载体(inouye和inouye,1985,nucleic acids res.13,3101-3109;van heeke和schuster,1989,j.biol.chem 264,5503-5509,这些文献中的每个均以引用的方式整体并入本文);等等。pgex载体也可以用于将这些肽表达为与谷胱甘肽s-转移酶(gst)的融合蛋白。通常,此类融合蛋白是可溶性的,并且可以通过吸附到谷胱甘肽-琼脂糖珠粒上,然后在游离谷胱甘肽存在下洗脱,从而来容易地从裂解细胞纯化。pgex载体被设计为包含凝血酶或因子xa蛋白酶切割位点,从而多肽可以从gst部分释放。
[0329]
或者,对于适当加工的肽复合物的长期、高收率产生,在哺乳动物细胞中稳定表达是优选的。稳定表达肽复合物的细胞系可以通过使用包含选择性标记的载体进行工程化改造。例如,在引入表达构建体之后,经工程化的细胞可以在滋养培养基中生长1-2天,然后切换到选择性培养基。表达构建体中的选择性标记赋予选择抗性,并最佳地允许细胞将表达构建体稳定地整合到它们的染色体中并在培养物中生长并扩增到细胞系中。此类细胞可以在肽连续表达的同时培养很长时间。
[0330]
重组细胞可以在温度、温育时间、光密度和培养基组成的标准条件下培养。然而,重组细胞的生长条件可以与多肽表达的条件不同。改良的培养条件和培养基也可以用于增强肽的产生。例如,含有肽及其同源启动子的重组细胞可以暴露于热或其他环境压力或化学压力中。可以利用本领域已知的任何技术来建立产生肽复合物的最佳条件。
[0331]
在本文公开的一个实施方案中,在编码多肽的核苷酸序列的5'末端添加编码甲硫氨酸的密码子,以提供用于启动肽翻译的信号。该甲硫氨酸可以保持与多肽的连接,或者可以通过添加一种或多种酶来除去甲硫氨酸,所述酶可以催化肽中的甲硫氨酸的切割。例如,
在原核生物和真核生物中,n-末端甲硫氨酸被甲硫氨酸氨基肽酶(map)除去(tsunasawa等人,1985,j.biol.chem.260,5382-5391,该文献以引用的方式整体并入本文)。甲硫氨酸氨基肽酶已经从包括大肠杆菌、酵母和大鼠在内的若干生物中分离和克隆。
[0332]
可以通过已知方法从细菌、哺乳动物或其他宿主细胞类型或从培养基中回收肽(参见,例如,current protocols in immunology,第2卷,第8章,coligan等人(编),john wiley&sons,inc.;pathogenic and clinical microbiology:a laboratory manual,rowland等人,little brown&co.,june 1994,该文献以引用的方式整体并入本文)。
[0333]
上述两种方法均可用于合成本文公开的多肽。例如,可以化学合成包含hsp结合肽的氨基酸序列的肽,并通过肽键与任选地通过重组dna技术产生的抗原性肽连接。
[0334]
包括在本文公开的范围内的是本文公开的多肽的衍生物或类似物,它们在翻译过程中或翻译后被修饰,例如通过糖基化、乙酰化、磷酸化、酰胺化(例如,c-末端羧基)或通过已知的保护/封闭基团衍生化,或蛋白水解切割来修饰。多种化学修饰中的任一种都可以通过已知技术进行,包括但不限于用于保护或修饰游离的nh
2-基团、游离的cooh-基团、oh-基团、trp-侧基、tyr-侧基、phe-侧基、his侧基-、arg-侧基或lys-侧基的试剂;溴化氰、羟胺、bnps-粪臭素、酸或碱水解的特定化学切割;通过胰蛋白酶、胰凝乳蛋白酶、木瓜蛋白酶、v8蛋白酶、nabh4酶切;乙酰化、甲酰化、氧化、还原;在衣霉素存在下的代谢合成;等等。
[0335]
包含抗原性多肽的组合物
[0336]
在另一个方面,本公开提供了包含一种或多种如本文公开的抗原性多肽的组合物(例如,药物组合物、疫苗或其单位剂型)。在某些实施方案中,组合物包含多种本文公开的抗原性多肽。例如,在某些实施方案中,组合物包含如本文公开的2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49或50种不同的抗原性多肽。
[0337]
包含与应激蛋白复合的抗原性多肽的组合物
[0338]
在某些实施方案中,本公开提供了一种组合物(例如,药物组合物),所述组合物包含一种或多种如本文公开的抗原性多肽和纯化的应激蛋白。在某些实施方案中,至少一部分纯化的应激蛋白与组合物中的抗原性多肽结合。此类组合物可用作治疗癌症的疫苗。
[0339]
在本发明的实践中有用的应激蛋白,在本文中也可互换地称为热休克蛋白(hsp),可以选自能够结合其他蛋白质或肽并且能够在三磷酸腺苷(atp)存在下或在酸性条件下释放结合的蛋白质或肽的任何细胞蛋白质。当细胞暴露于压力刺激时,这种蛋白质的胞内浓度可以增加。除那些由应激诱导的热休克蛋白之外,hsp60、hsp70、hsp90、hsp100、shsp和pdi家族还包括与应激诱导的hsp序列相似性相关的蛋白质,例如,具有大于35%氨基酸同一性,但是其表达水平不会因应激而改变。因此,应激蛋白或热休克蛋白包括与这些家族成员具有至少35%(例如,至少40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95或99%)氨基酸同一性的其他蛋白质、它们的突变体、类似物和变体,这些家族成员在细胞中的表达水平响应于应激刺激而增强。因此,在某些实施方案中,应激蛋白是应激蛋白的hsp60、hsp70或hsp90家族的成员(例如,hsc70、人hsc70)或它们的突变体、类似物或变体。在某些实施方案中,应激蛋白选自由以下各项组成的组:hsc70、hsp70、hsp90、hsp110、grp170、gp96、钙网蛋白、它们的突变体以及它们的两个或更多个的组合。在某些实施方案中,应激蛋白是hsc70(例如,人hsc70)。在某些实施方案中,应激蛋白包含seq id no:3920
的氨基酸序列。在某些实施方案中,应激蛋白的氨基酸序列由seq id no:3920的氨基酸序列组成。在某些实施方案中,应激蛋白是hsp70(例如,人hsp70)。在某些实施方案中,应激蛋白(例如,人hsc70)是重组蛋白。
[0340]
天然存在的hsp的氨基酸序列和核苷酸序列通常可在序列数据库诸如genbank中获得。例如,智人(homo sapiens)热休克蛋白hsp70(热休克70kda蛋白1a)具有以下标识符hgnc:5232、entrez gene:3303、ensembl:ensg00000204389、omim:140550、uniprotkb:p08107和ncbi参考序列:nm_005345.5。计算机程序(诸如entrez)可用于浏览数据库,并通过登录号检索任何所关注的氨基酸序列和基因序列数据。也可以使用程序(诸如fasta和blast)搜索这些数据库以鉴定与查询序列具有不同程度相似性的序列,这些程序通过比对分数和统计对相似序列进行排序。可用于制备本文公开的hsp肽结合片段的hsp的非限制性实例的核苷酸序列如下:人hsp70,genbank登录号nm_005345,sargent等人,1989,proc.natl.acad.sci.u.s.a.,86:1968-1972;人hsc70:genbank登录号p11142,y00371;人hsp90,genbank登录号x15183,yamazaki等人,nucl.acids res.17:7108;人gp96:genbank登录号x15187,maki等人,1990,proc.natl.acad sci.,87:5658-5562;人bip:genbank登录号m19645;ting等人,1988,dna 7:275-286;人hsp27,genbank登录号m24743;hickey等人,1986,nucleic acids res.14:4127-45;小鼠hsp70:genbank登录号m35021,hunt等人,1990,gene,87:199-204;小鼠gp96:genbank登录号m16370,srivastava等人,1987,proc.natl.acad.sci.,85:3807-3811;和小鼠bip:genbank登录号u16277,haas等人,1988,proc.natl.acad.sci.u.s.a.,85:2250-2254(这些参考文献中的每个以引用的方式整体并入本文)。
[0341]
除上述主要应激蛋白家族之外,内质网驻留蛋白钙网蛋白也被鉴定为另一种热休克蛋白,可用于在与抗原分子复合时引发免疫应答(basu和srivastava,1999,j.exp.med.189:797-202;该文献以引用的方式整体并入本文)。可用于本发明的其他应激蛋白包括grp78(或bip)、蛋白质二硫键异构酶(pdi)、hsp110和grp170(lin等人,1993,mol.biol.cell,4:1109-1119;wang等人,2001,j.immunol.,165:490-497,这些文献中的每个都以引用的方式整体并入本文)。随后发现这些家族的很多成员响应于其他应激刺激而被诱导,这些刺激包括营养剥夺、代谢中断、氧自由基、缺氧和胞内病原体感染(参见welch,1993年5月,scientific american 56-64;young,1990,annu.rev.immunol.8:401-420;craig,1993,science 260:1902-1903;gething等人,1992,nature 355:33-45;和lindquist等人,1988,annu.rev.genetics 22:631-677,这些文献中的每个以引用的方式整体并入本文)。预期属于所有这些家族的hsp/应激蛋白可用于本文公开的实践中。在某些实施方案中,应激蛋白包括促进肽-mhc呈递的任何分子伴侣蛋白。合适的分子伴侣蛋白包括但不限于er分子伴侣蛋白和tap相关蛋白(例如,人tap相关蛋白)。
[0342]
主要应激蛋白可以在应激细胞中积聚到非常高的水平,但是它们在没有受到应激的细胞中以低到中等水平出现。例如,高度诱导型哺乳动物hsp70在常温下几乎无法检测到,但是在热冲击时成为细胞中最活跃的合成蛋白质之一(welch等人,1985,j.cell.biol.101:1198-1211,该文献以引用的方式整体并入本文)。相比之下,hsp90和hsp60蛋白在大多数(但不是全部)哺乳动物细胞中在常温下含量丰富,并且进一步被热诱导(lai等人,1984,mol.cell.biol.4:2802-10;van bergen en henegouwen等人,1987,
genes dev.1:525-31,这些文献中的每个以引用的方式整体并入本文)。
[0343]
在多个实施方案中,编码家族内的热休克蛋白或热休克蛋白变体的核苷酸序列可以通过与包含编码hsp的核苷酸序列的探针在低至中等严格条件下杂交来鉴定和获得。例如,使用这种低严格性条件的程序如下(另外参见shilo和weinberg,1981,proc.natl.acad.sci.usa 78:6789-6792)。含有dna的滤膜在40℃下在含有35%甲酰胺、5xssc、50mm tris-hcl(ph7.5)、5mm edta、0.1%pvp、0.1%ficoll、1%bsa和500μg/ml变性鲑鱼精子dna的溶液中预处理6小时。杂交在相同的溶液中进行,但作出以下修改:0.02%pvp、0.02%ficoll、0.2%bsa、100μg/ml鲑鱼精子dna、10%(重量/体积)硫酸葡聚糖。滤膜在杂交混合物中在40℃下温育18-20小时,然后在含有2xssc、25mm tris-hcl(ph7.4)、5mm edta和0.1%sds的溶液中在55℃下洗涤1.5小时。用新鲜溶液替换洗涤溶液并在60℃下再温育1.5小时。将滤膜吸干并暴露以进行信号检测。如有必要,在检测信号之前,在65-68℃下第三次洗涤滤膜。可以使用的其他低严格条件是本领域熟知的(例如,如用于跨物种杂交)。
[0344]
在使用应激蛋白的情况下,还可以使用应激蛋白的肽结合片段以及它们的功能活性衍生物、类似物和变体。因此,在某些实施方案中,应激蛋白是全长hsp。在某些实施方案中,应激蛋白是包含hsp结构域的多肽(例如,hsp60、hsp70或hsp90家族的成员,诸如hsc70,特别是人hsc70),其中所述结构域能够与肽(例如,本文所述的hsp结合肽)非共价缔合以形成复合物并任选地引发免疫应答,并且其中应激蛋白不是全长hsp。
[0345]
在某些实施方案中,应激蛋白是能够与肽(例如,本文所述的hsp结合肽)非共价缔合以形成复合物并任选地引发免疫应答的多肽,其中所述应激蛋白与野生型hsp(例如,hsp60、hsp70或hsp90家族的成员,诸如hsc70,特别是人hsc70)共有高度的序列相似性。为了确定两个氨基酸序列或核酸序列之间的同一性区域,出于最佳比对目的对序列进行比对(例如,可以在第一氨基酸或核酸序列的序列中引入空位以实现与第二氨基酸或核酸序列的最佳比对)。然后比较相应氨基酸位置或核苷酸位置处的氨基酸残基或核苷酸。当第一序列中的一个位置被与第二序列中的相应位置相同的氨基酸残基或核苷酸占据时,则该位置的分子是相同的。两个序列之间的同一性百分比是序列共有的相同位置数量的函数(即,%同一性=相同重叠位置的数量/位置的总数
×
100%)。在一个实施方案中,两个序列的长度相同。
[0346]
两个序列之间的同一性百分比的确定还可以使用数学算法来完成。用于比较两个序列的数学算法的非限制性示例是karlin和altschul,1990,proc.natl.acad.sci.usa 87:2264-2268的算法,该算法在karlin和altschul,1993,proc.natl.acad.sci.usa 90:5873-5877中进行了修改(这些文献中的每个以引用的方式整体并入本文)。这种算法被纳入altschul等人,1990,j.mol.biol.215:403-410(该文献以引用的方式整体并入本文)的nblast和xblast程序中。blast核苷酸搜索可以用nblast程序进行,例如分数=100,字长=12,以获得与本文公开的核酸分子同源的核苷酸序列。blast蛋白质搜索可以用xblast程序进行,例如分数=50,字长=3,以获得与本文公开的蛋白质分子同源的氨基酸序列。为了获得用于比较目的的空位比对,可以使用空位blast,如altschul等人,1997,nucleic acids res.25:3389-3402所述。或者,psi-blast可用于执行迭代搜索,以检测分子之间的远距离关系(altschul等人,1997,同上)。当使用blast、空位blast和psi-blast程序时,可以使用
bio.4:220-229,该文献以引用的方式整体并入本文)、大肠杆菌麦芽糖结合蛋白(guan等人,1987,gene 67:21-30,该文献以引用的方式整体并入本文)和各种纤维素结合结构域(美国专利号5,496,934、5,202,247、5,137,819;tomme等人,1994,protein eng.7:117-123,这些文献中的每个以引用的方式整体并入本文)。
[0352]
可以测定此类重组应激蛋白的肽结合活性(参见例如klappa等人,1998,embo j.,17:927-935,该文献以引用的方式整体并入本文),以确定它们引发免疫应答的能力。在某些实施方案中,宿主细胞中产生的重组应激蛋白与免疫原性组合物的预期受体属于同一物种(例如,人)。
[0353]
应激蛋白可以与一种或多种多肽非共价或共价结合。在某些实施方案中,应激蛋白与多肽非共价结合。制备此类复合物的方法如下文所述。
[0354]
总多肽与总应激蛋白的摩尔比可以为从约0.01:1至约100:1的任何比率,包括但不限于约0.01:1,0.02:1,0.05:1.0.1:1.0.2:1,0.5:1,1:1,1.5:1,2:1,2.5:1,3:1,4:1,5:1,6:1,7:1,8:1,9:1,10:1,11:1,12:1,13:1,14:1,15:1,16:1,17:1,18:1,19:1,20:1,30:1,40:1,49:1,最多100:1。在某些实施方案中,组合物包含多个复合物,每个复合物包含本文公开的多肽和应激蛋白,其中每个复合物中的多肽与应激蛋白的摩尔比为至少约1:1(例如,约1.5:1,2:1,2.5:1,3:1,4:1,5:1,6:1,7:1,8:1,9:1,10:1,11:1,12:1,13:1,14:1,15:1,16:1,17:1,18:1,19:1,20:1,30:1,40:1,49:1,最多100:1)。
[0355]
在某些实施方案中,总多肽与总应激蛋白的摩尔比为约0.5:1至5:1。在某些实施方案中,总多肽与总应激蛋白的摩尔比为约1:1至2:1。在某些实施方案中,总多肽与总应激蛋白的摩尔比为约1:1、1.25:1、1.5:1、2:1、2.5:1、3:1、3.5:1、4:1、4.5:1或5:1。这种比率,特别是接近1:1的比率,是有利的,因为组合物不包含大量过量的不与应激蛋白结合的游离肽。由于许多包含mhc结合肽的抗原肽倾向于包含疏水区,过量的游离肽可以倾向于在组合物的制备和储存期间聚集。多肽与应激蛋白的高结合亲和力使得能够以接近1:1(例如,1:1、1.25:1、1.5:1或2:1)的总多肽与总应激蛋白的摩尔比与应激蛋白进行大规模复合。因此,在某些实施方案中,多肽以小于10-3m、10-4
m、10-5
m、10-6
m、10-7
m、10-8
m或10-9
m的kd结合至hsp(
例如
,hsc70、hsp70、hsp90、hsp110、grp170、gp96或钙网蛋白)。在某些实施方案中,多肽以10-3m、10-4
m、10-5
m、10-6
m、10-7
m、10-8
m、10-9
m或更小的kd结合至hsc70(
例如
,人hsc70)。
[0356]
在某些实施方案中,至少40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或95%的应激蛋白与组合物中的多肽结合。在某些实施方案中,基本上所有应激蛋白都与组合物中的多肽结合。
[0357]
任何数量的不同多肽可以包含在如本文公开的单一组合物中。在某些实施方案中,组合物包含不超过100种不同的多肽,例如2-50、2-30、2-20、5-20、5-15、5-10或10-15种不同的多肽。
[0358]
在某些实施方案中,每种抗原性多肽包含相同的hsp结合肽和不同的抗原性肽。在某些实施方案中,组合物包含单一应激蛋白,其中应激蛋白能够结合至hsp结合肽。
[0359]
包含本文公开的应激蛋白和抗原性多肽的复合物的药物组合物可以配制成含有一种或多种药学上可接受的载剂或赋形剂,所述载剂或赋形剂包括填充剂、稳定剂、缓冲剂、氯化钠、钙盐、表面活性剂、抗氧化剂、螯合剂、其他赋形剂它们的组合。
[0360]
在制备组合物的冻干制剂时填充剂是优选的。此类填充剂形成冻干产物的结晶部
分并且可以选自由以下各项组成的组:甘露糖醇、甘氨酸、丙氨酸和羟乙基淀粉(hes)。
[0361]
稳定剂可以选自由以下各项组成的组:蔗糖、海藻糖、棉子糖和精氨酸。这些试剂优选地以在1-4%之间的量存在。氯化钠可以优选地以100-300mm的量包含在本制剂中,或者如果在不存在上述填充剂的情况下使用,则可以以300-500mm nacl的量包含在制剂中。钙盐包括氯化钙、葡萄糖酸钙、葡乳醛酸钙或葡庚糖酸钙。
[0362]
缓冲剂可以是具有充当缓冲剂的能力的任何生理上可接受的化学实体或化学实体的组合,包括但不限于组氨酸、磷酸钾、tris[三-(羟甲基)-氨基甲烷]、bis-tris丙烷(1,3-双-[三-(羟甲基)甲基氨基]-丙烷)、pipes[哌嗪-n,n'-双-(2-乙烷磺酸)]、mops[3-(n-吗啉)乙烷磺酸]、hepes(n-2-羟乙基-哌嗪-n'-2-乙烷磺酸)、mes[2-(n-吗啉代)乙烷磺酸]和aces(n-2-乙酰氨基-2-氨基乙烷磺酸)。通常,缓冲剂以10-50mm的浓度包含在内。基础缓冲液的具体实例包括(i)pbs;(ii)10mm kpo4、150mm nacl;(iii)10mm hepes、150mm nacl;(iv)10mm咪唑、150mm nacl;(v)20mm柠檬酸钠。可以使用的赋形剂包括(i)甘油(10%、20%);(ii)吐温50(0.05%、0.005%);(iii)9%蔗糖;(iv)20%山梨糖醇;(v)10mm赖氨酸;或(vi)0.01mm硫酸葡聚糖。
[0363]
如果存在的话,表面活性剂的浓度优选地为0.1%或更小,并且可以选自包括但不限于以下各项组成的组:聚山梨醇酯20、聚山梨醇酯80、普朗尼克多元醇和brij 35(聚氧乙烯23月桂醚)。如果使用抗氧化剂,则必须与药物制备物相容,并且优选地是水溶性的。合适的抗氧化剂包括高半胱氨酸、谷胱甘肽、硫辛酸、6-羟基-2,5,7,8-四甲基色满-2-甲酸(trolox)、甲硫氨酸、硫代硫酸钠、铂、甘氨酸-甘氨酸-组氨酸(三肽)和丁基化羟基甲苯(bht)。如果在组合物中使用钙盐,则螯合剂应优选地以比钙更大的亲和力结合金属(诸如铜和铁)。示例性螯合剂是去铁胺。
[0364]
可以使用本领域已知的许多制剂。例如,美国专利号5,763,401描述了一种这样的治疗制剂,其包含15-60mm蔗糖、最多50mm nacl、最多5mm氯化钙、65-400mm甘氨酸和最多50mm组氨酸。在一些实施方案中,治疗制剂是在磷酸钾缓冲液中的9%蔗糖溶液。
[0365]
美国专利号5,733,873(该专利以引用的方式整体并入本文)公开了包含在0.01-1mg/ml之间的表面活性剂的制剂。该专利公开了具有以下赋形剂范围的制剂:聚山梨醇酯20或80,其量为至少0.01mg/ml,优选地0.02-1.0mg/ml;至少0.1m nacl;至少0.5mm钙盐;和至少1mm组氨酸。具体而言,还公开了以下具体制剂:(1)14.7-50-65mm组氨酸、0.31-0.6m nacl、4mm氯化钙、0.001-0.02-0.025%聚山梨醇酯80,含有或不含有0.1%peg 4000或19.9mm蔗糖;以及(2)20mg/ml甘露糖醇、2.67mg/ml组氨酸、18mg/ml nacl、3.7mm氯化钙和0.23mg/ml聚山梨醇酯80。
[0366]
低或高浓度氯化钠的使用已经有所描述,例如美国专利号4,877,608(该专利以引用的方式整体并入本文)教导了具有相对低浓度氯化钠的制剂,诸如包含0.5mm-15mm nacl、5mm氯化钙、0.2mm-5mm组氨酸、0.01-10mm赖氨酸盐酸盐和最多10%麦芽糖、10%蔗糖或5%甘露糖醇的制剂。
[0367]
美国专利号5,605,884(该专利以引用的方式整体并入本文)教导了使用具有相对高浓度氯化钠的制剂。这些制剂包含0.35m-1.2m nacl、1.5-40mm氯化钙、1mm-50mm组氨酸和最多10%糖(诸如甘露糖醇、蔗糖或麦芽糖)。示例为包含0.45m nacl、2.3mm氯化钙和1.4mm组氨酸的制剂。
[0368]
国际专利申请wo 96/22107(该专利以引用的方式整体并入本文)描述了包含海藻糖的制剂,例如包含以下的制剂:(1)0.1m nacl、15mm氯化钙、15mm组氨酸和1.27m(48%)海藻糖;或者(2)0.011%氯化钙、0.12%组氨酸、0.002%tris、0.002%吐温80、0.004%peg 3350、7.5%海藻糖;和0.13%或1.03%nacl。
[0369]
美国专利号5,328,694(该专利以引用的方式整体并入本文)描述了一种这样的制剂,其包含100-650mm二糖和100mm-1.0m氨基酸,例如(1)0.9m蔗糖、0.25m甘氨酸、0.25m赖氨酸和3mm氯化钙;以及(2)0.7m蔗糖、0.5m甘氨酸和5mm氯化钙。药物组合物可以任选地制备为冻干产物,然后可以将其配制用于口服施用或复原为液体形式用于肠胃外施用。
[0370]
在某些实施方案中,组合物在施用组合物的受试者中刺激针对表达或展示包括一种或多种mhc结合肽的多肽的细胞的t细胞反应。表达多肽的细胞可以是包含编码多肽的多核苷酸的细胞,其中多核苷酸在细胞的基因组中、在游离型载体中、或在已感染细胞的病毒的基因组中。展示多肽的细胞可以不包含编码多肽的多核苷酸,并且可以通过使细胞与多肽或其衍生物接触来产生。
[0371]
在某些实施方案中,组合物诱导分离自受试者的外周血单个核细胞(pbmc)中的t细胞的体外活化。t细胞的体外活化包括但不限于t细胞的体外增殖、从t细胞产生细胞因子(例如,ifnγ)和增加t细胞上活化标志物(例如,cd25、cd45ro)的表面表达。
[0372]
抗原性多肽和应激蛋白的复合物的制备
[0373]
在另一个方面,本公开提供了一种制备抗原性多肽和应激蛋白的复合物的方法(例如,用于制备疫苗的目的),所述方法包括在体外将本文公开的一种或多种抗原性多肽与纯化的应激蛋白在合适的条件下混合,以使得纯化的应激蛋白结合至至少一种抗原性多肽。该方法在本文中也称为复合反应。在某些实施方案中,使用两种或更多种纯化的应激蛋白,其中每种纯化的应激蛋白结合至至少一种抗原性多肽。在某些实施方案中,至少一部分纯化的应激蛋白与组合物中的抗原性多肽结合。
[0374]
应激蛋白可以与多肽非共价或共价结合。在某些实施方案中,应激蛋白与多肽非共价结合。在多个实施方案中,体外形成的复合物任选地被纯化。应激蛋白和多肽的纯化的复合物基本上不含与细胞中或细胞提取物中的此类复合物缔合的物质。当纯化的应激蛋白和纯化的多肽用于体外复合反应时,术语“纯化的复合物”不排除还包含游离的应激蛋白和缀合物或不存在于复合物中的肽的组合物。
[0375]
上文描述的任何应激蛋白均可用于本文公开的方法中。在某些实施方案中,应激蛋白选自由以下各项组成的组:hsc70、hsp70、hsp90、hsp110、grp170、gp96、钙网蛋白、它们的突变体以及它们的两个或更多个的组合。在一个实施方案中,应激蛋白是hsc70,例如人hsc70。在另一个实施方案中,应激蛋白是hsp70,例如人hsp70。在某些实施方案中,应激蛋白(例如,人hsc70或人hsp70)是重组蛋白。
[0376]
在复合之前,hsp可以用atp预处理或暴露在酸性条件下以除去可以与所关注的hsp非共价缔合的任何肽。酸性条件是低于ph7的任何ph水平,包括ph1-ph2、ph2-ph3、ph3-ph4、ph4-ph5、ph5-ph6和ph6-ph6.9的范围。当使用atp程序时,通过添加去吡喃酶从制剂中除去过量的atp,如levy等人,1991,cell 67:265-274(该文献以引用的方式整体并入本文)所述。当使用酸性条件时,通过添加ph调节剂将缓冲液重新调节至中性ph。
[0377]
在某些实施方案中,在与纯化的应激蛋白复合之前,多肽可以在100%dmso中从粉
末复原。然后可以将等摩尔量的肽合并在用无菌水稀释的75%dmso溶液中。
[0378]
在某些实施方案中,在与纯化的应激蛋白复合之前,多肽可以在中性水中复原。
[0379]
在某些实施方案中,在与纯化的应激蛋白复合之前,多肽可以在含有hcl的酸性水中复原。
[0380]
在某些实施方案中,在与纯化的应激蛋白复合之前,多肽可以在含有naoh的碱性水中复原。
[0381]
在某些实施方案中,在与纯化的应激蛋白复合之前,可以测试每种多肽在水中的溶解度。如果多肽可溶于中性水,则中性水可以用作多肽的溶剂。如果多肽不溶于中性水,则可以测试在含有hcl或另一种酸(例如,乙酸、磷酸或硫酸)的酸性水中的溶解度。如果多肽可溶于含有hcl(或另一种酸)的酸性水中,则含有hcl(或另一种酸)的酸性水可以用作多肽的溶剂。如果多肽不溶于含有hcl(或另一种酸)的酸性水中,则可以测试在含有naoh的碱性水中的溶解度。如果多肽可溶于含有naoh的碱性水中,则可以使用含有naoh的碱性水作为多肽的溶剂。如果多肽不溶于含有naoh的碱性水中,则可以将多肽溶解于dmso中。如果多肽不溶于dmso,则可以排除该多肽。然后可以混合溶解的多肽以制备多肽合并液。溶解的多肽可以以等体积混合。溶解的多肽可以以等摩尔量混合。
[0382]
总多肽与总应激蛋白的摩尔比可以为从0.01:1至100:1的任何比率,包括但不限于0.01:1,0.02:1,0.05:1.0.1:1.0.2:1,0.5:1,1:1,1.5:1,2:1,2.5:1,3:1,4:1,5:1,6:1,7:1,8:1,9:1,10:1,11:1,12:1,13:1,14:1,15:1,16:1,17:1,18:1,19:1,20:1,30:1,40:1,49:1,最多100:1。在某些实施方案中,待制备的组合物包含多个复合物,每个复合物包含本文公开的多肽和应激蛋白,并且复合反应包括将多肽与应激蛋白混合,其中在每个复合物中多肽与应激蛋白的摩尔比为至少1:1(例如,约2:1,3:1,4:1,5:1,6:1,7:1,8:1,9:1,10:1,11:1,12:1,13:1,14:1,15:1,16:1,17:1,18:1,19:1,20:1,30:1,40:1,49:1,最多100:1)。
[0383]
在某些实施方案中,总多肽与总应激蛋白的摩尔比为约0.5:1至5:1。在某些实施方案中,总多肽与总应激蛋白的摩尔比为约1:1至2:1。在某些实施方案中,总多肽与总应激蛋白的摩尔比为约1:1、1.25:1、1.5:1、2:1、2.5:1、3:1、3.5:1、4:1、4.5:1或5:1。这种比率,特别是接近1:1的比率,是有利的,因为组合物不包含大量过量的不与应激蛋白结合的游离肽。由于许多包含mhc结合肽的抗原肽倾向于包含疏水区,过量的游离肽可以倾向于在组合物的制备和储存期间聚集。多肽与应激蛋白的高结合亲和力使得能够以接近1:1(例如,1:1、1.25:1、1.5:1或2:1)的总多肽与总应激蛋白的摩尔比与应激蛋白进行大规模复合。因此,在某些实施方案中,用于复合反应的多肽以小于10-3m、10-4
m、10-5
m、10-6
m、10-7
m、10-8
m或10-9
m的kd结合至hsp(
例如
,hsc70、hsp70、hsp90、hsp110、grp170、gp96或钙网蛋白)。在某些实施方案中,多肽以10-3m、10-4
m、10-5
m、10-6
m、10-7
m、10-8
m、10-9
m或更小的kd结合至hsc70(
例如
,人hsc70)。
[0384]
本文公开的方法可以用于制备大量(例如,大于或等于30mg、50mg、100mg、200mg、300mg、500mg或1g总肽和蛋白质)组合物(例如,药物组合物)。然后可以将制备的组合物转移到单次使用或多次使用的容器中,或分配到单位剂型中。或者,本文公开的方法可以用于制备小量(例如,小于或等于300μg、1mg、3mg、10mg、30mg或100mg总肽和蛋白质)组合物(例如,药物组合物)。在某些实施方案中,组合物制备为一次性使用,任选地单位剂型形式。
[0385]
在某些实施方案中,组合物中的多肽和应激蛋白的总量为约10μg至600μg(例如,约50μg、100μg、200μg、300μg、400μg或500μg,任选地约120μg、240μg或480μg)。在某些实施方案中,组合物中的多肽和应激蛋白的总量为约300μg。下文公开了单位剂型中的应激蛋白和多肽的量。
[0386]
本文提供了多肽群与应激蛋白的体外非共价复合的示例性方案。多肽群可以包含本文公开的不同多肽种类的混合物。然后,将混合物与纯化的和/或预处理的应激蛋白在合适的结合缓冲液中在4℃至50℃(例如,37℃)下温育15分钟至3小时(例如,1小时),所述结合缓冲液诸如磷酸盐缓冲盐水ph7.4,任选地补充有0.01%聚山梨醇酯20;在磷酸钾缓冲液中包含9%蔗糖的缓冲液;包含2.7mm磷酸氢二钠、1.5mm磷酸二氢钾、150mm nacl,ph7.2的缓冲液;含有20mm磷酸钠ph7.2-7.5、350-500mm nacl、3mm mgcl2和1mm苯甲基磺酰氟(pmsf)的缓冲液;以及任选地包含1mm adp的缓冲液。可以使用与应激蛋白相容的任何缓冲液。然后任选地通过centricon 10组件(millipore;billerica,ma)离心来纯化制备物,以除去任何未结合的肽。蛋白质/肽与hsp的非共价缔合可以通过高效液相色谱(hplc)、质谱(ms)、混合淋巴细胞靶细胞测定法(mltc)或酶联免疫斑点(elispot)测定法来测定(taguchi t等人,j immunol methods 1990;128:65-73,该文献以引用的方式整体并入本文)。一旦复合物被分离和稀释,它们就可以任选地在动物模型中使用本文所述的施用方案和赋形剂进一步表征(参见例如下文的实施例2)。
[0387]
可以制备来自单独的共价和/或非共价复合反应的应激蛋白和抗原性多肽的复合物,以在施用于受试者之前形成组合物。在某些实施方案中,组合物在施用于受试者之前的1、2、3、4、5、6或7天内制备。在某些实施方案中,组合物在施用于受试者之前的1、2、3、4、5、6、7或8周内制备。在某些实施方案中,组合物在施用于受试者之前的1、2、3、4、5、6、7、8、9、10、11或12个月内制备。组合物在制备后和使用前可以任选地储存在约4℃、-20℃或-80℃下。
[0388]
在某些实施方案中,通过本文公开的方法制备的复合物在即将施用于患者之前在床边与佐剂混合。在某些实施方案中,佐剂包括皂苷或免疫刺激性核酸。在某些实施方案中,佐剂包括qs-21。在某些实施方案中,qs-21的剂量为10μg、25μg、50μg、75μg、100μg、125μg、150μg、175μg或200μg。在某些实施方案中,qs-21的剂量为约100μg。在某些实施方案中,佐剂包括tlr激动剂。在某些实施方案中,tlr激动剂是tlr4的激动剂。在某些实施方案中,tlr激动剂是tlr7和/或tlr8的激动剂。在某些实施方案中,tlr激动剂是tlr9的激动剂。在某些实施方案中,tlr激动剂是tlr5的激动剂。
[0389]
作为制备应激蛋白和多肽的非共价复合物的替代方案,多肽可以共价连接至应激蛋白,例如通过化学交联或uv交联。可以使用本领域已知的任何化学交联或uv交联方法(参见例如,wong,1991,chemistry of protein conjugation and cross-linking,crc press,该文献以引用的方式整体并入本文)。例如,可以使用戊二醛交联(参见,例如,barrios等人,1992,eur.j.immunol.22:1365-1372,该文献以引用的方式整体并入本文)。在一个示例性方案中,1-2mg hsp-肽复合物在0.002%戊二醛存在下交联2小时。通过对磷酸盐缓冲盐水(pbs)透析过夜来除去戊二醛(lussow等人,1991,eur.j.immunol.21:2297-2302,该文献以引用的方式整体并入本文)。
[0390]
疫苗
[0391]
在另一个方面,本公开提供了一种包含本文公开的抗原性多肽组合物的疫苗。疫苗可以通过产生稳定、无菌、优选地注射用制剂的任何方法来制备。
[0392]
在某些实施方案中,疫苗包含一种或多种本文公开的组合物和一种或多种佐剂。可以使用多种佐剂,包括例如全身佐剂和粘膜佐剂。全身佐剂是可以肠胃外递送的佐剂。全身佐剂包括产生储库效应的佐剂、刺激免疫系统的佐剂以及二者兼有的佐剂。
[0393]
产生储库效应的佐剂是使抗原在体内缓慢释放,从而延长免疫细胞与抗原的暴露的佐剂。这类佐剂包括明矾(例如,氢氧化铝、磷酸铝);或基于乳剂的制剂,包括矿物油、非矿物油、油包水或油包水包油乳剂、水包油乳剂,诸如seppic isa系列montanide佐剂(例如,montanide isa 720,airliquide,paris,france);mf-59(用斯潘85和吐温80稳定的水包角鲨烯乳剂;chiron corporation,emeryville,calif.);以及provax(含有稳定洗涤剂和胶束形成剂的水包油乳剂;idec,pharmaceuticals corporation,san diego,calif.)。
[0394]
其他佐剂刺激免疫系统,例如,导致免疫细胞产生和分泌细胞因子或igg。这类佐剂包括免疫刺激性核酸,诸如cpg寡核苷酸;从皂树(q.saponaria)树皮纯化的皂苷,诸如qs-21;聚[二(羧基苯氧基)磷腈(pcpp聚合物;virus research institute,usa);rna模拟物,诸如聚肌苷酸:聚胞苷酸(多聚i:c)或用聚赖氨酸稳定的聚i:c(多聚-iclc)[oncovir,inc.];脂多糖(lps)的衍生物,诸如单磷酰脂a(mpl;ribi immunochem research,inc.,hamilton,mont.)、胞壁酰二肽(mdp;ribi)和苏氨酰-胞壁酰二肽(t-mdp;ribi);om-174(与脂质a相关的葡糖胺二糖;om pharma sa,meyrin,switzerland);以及利什曼原虫延伸因子(纯化的利什曼原虫蛋白;corixa corporation,seattle,wash.)。
[0395]
其他全身佐剂是产生储库效应和刺激免疫系统的佐剂。这些化合物具有全身佐剂的上述两种功能。这类佐剂包括但不限于iscom(免疫刺激复合物,含有混合皂苷、脂质,并且形成具有孔的病毒大小的颗粒,所述孔可以容纳抗原;csl,melbourne,australia);as01,它是含有mpl和qs-21的基于脂质体的制剂(glaxosmithkline,belgium);as02(glaxosmithkline,它是含有mpl和qs-21的水包油乳剂:glaxosmithkline,rixensart,belgium);as04(glaxosmithkline,含有明矾和mpl;gsk,belgium);as15,它是含有cpg寡核苷酸、mpl和qs-21的基于脂质体的制剂(glaxosmithkline,belgium);形成胶束(诸如crl 1005)的非离子嵌段共聚物(这些含有疏水性聚氧丙烯的直链,侧接有聚氧乙烯链;vaxcel,inc.,norcross,ga.);以及syntex佐剂制剂(saf,含有吐温80和非离子嵌段共聚物的水包油乳剂;syntex chemicals,inc.,boulder,colo.)。
[0396]
根据本发明使用的粘膜佐剂是当与本文公开的复合物组合施用于粘膜表面时能够在受试者中诱导粘膜免疫应答的佐剂。粘膜佐剂包括cpg核酸(例如,pct公开专利申请wo 99/61056,该专利申请以引用的方式整体并入本文)、细菌毒素:例如,霍乱毒素(ct)、ct衍生物(包括但不限于ct b亚基(ctb)、ctd53(val至asp)、ctk97(val至lys)、ctk104(tyr至lys)、ctd53/k63(val至asp、ser至lys)、cth54(arg至his)、ctn107(his至asn)、cte114(ser至glu)、cte112k(glu至lys)、cts61f(ser至phe)、cts 106(pro至lys)和ctk63(ser至lys))、闭锁小带毒素(zot)、大肠杆菌不耐热肠毒素、不稳定毒素(lt)、lt衍生物(包括但不限于lt b亚基(ltb)、lt7k(arg至lys)、lt61f(ser至phe)、lt112k(glu至lys)、lt118e(gly至glu)、lt146e(arg至glu)、lt192g(arg至gly)、ltk63(ser至lys)和ltr72(ala至arg))、百日咳毒素,pt(包括pt-9k/129g);毒素衍生物(参见下文);脂质a衍生物(例如,单磷酰脂质
a,mpl);胞壁酰二肽(mdp)衍生物;细菌外膜蛋白(例如,布氏疏螺旋体(borrelia burgdorferi)的外表面蛋白a(ospa)脂蛋白、脑膜炎奈瑟氏菌(neisseria meningitidis)的外膜蛋白);水包油乳剂(例如,mf59);铝盐(isaka等人,1998,1999);和皂苷(例如,qs-21,例如,qs-21antigenics llc,lexington,ma)、iscom、mf-59(用斯潘85和吐温80稳定的水包角鲨烯乳剂;chiron corporation,emeryville,calif.);seppic isa系列montanide佐剂(例如,montanide isa 720;airliquide,paris,france);provax(含有稳定洗涤剂和胶束形成剂的水包油乳剂;idec pharmaceuticals corporation,san diego,calif.);syntext佐剂制剂(saf;syntex chemicals,inc.,boulder,colo.);聚[二(羧基苯氧基)]磷腈(pcpp聚合物;virus research institute,usa)和利什曼原虫延伸因子(corixa corporation,seattle,wash.)。
[0397]
在某些实施方案中,添加至本文公开的组合物的佐剂包括皂苷和/或免疫刺激性核酸。在某些实施方案中,添加至组合物的佐剂包括或另外包括qs-21。
[0398]
在某些实施方案中,添加至本文公开的组合物的佐剂包括toll样受体(tlr)激动剂。在某些实施方案中,tlr激动剂是tlr4的激动剂。在某些实施方案中,tlr激动剂是tlr7和/或tlr8的激动剂。在某些实施方案中,tlr激动剂是tlr9的激动剂。在某些实施方案中,tlr激动剂是tlr5的激动剂。
[0399]
本文所述的本文公开的组合物可以以若干方式与佐剂组合。例如,不同的多肽可以首先混合在一起形成混合物,然后与应激蛋白和/或佐剂复合形成组合物。又如,不同的多肽可以单独与应激蛋白和/或佐剂复合,然后可以混合所得的复合物批次以形成组合物。
[0400]
佐剂可以在施用包含应激蛋白和多肽的复合物的组合物之前、期间或之后施用。佐剂和组合物的施用可以在相同或不同的施用部位。
[0401]
单位剂型
[0402]
在另一个方面,本公开提供了一种本文公开的组合物(例如,药物组合物或疫苗)的单位剂型。
[0403]
本文公开的疫苗的功效有效的抗原性多肽、应激蛋白和/或佐剂的量和浓度可以根据多肽、应激蛋白和/或佐剂的化学性质和效力而变化。通常,疫苗中的起始量和浓度是使用常规施用途径,例如肌肉内注射,常规用于引发所需免疫应答的量和浓度。然后可以调整肽、缀合物、应激蛋白和/或佐剂的量和浓度,例如,通过使用稀释剂稀释,从而实现有效免疫应答,如使用本领域已知的标准方法所评估(例如,通过相对于对照制剂对疫苗的抗体或t细胞反应来确定)。
[0404]
在某些实施方案中,组合物中的多肽和应激蛋白的总量为约10μg至600μg(例如,约50μg、100μg、200μg、300μg、400μg或500μg,任选地约120μg、240μg或480μg)。在某些实施方案中,组合物中的多肽和应激蛋白的总量为约300μg。在某些实施方案中,组合物中的应激蛋白的量为约250μg至290μg。
[0405]
在某些实施方案中,组合物中的应激蛋白的量为约10μg至600μg(例如,约50μg、100μg、200μg、300μg、400μg或500μg,任选地约120μg、240μg或480μg)。在某些实施方案中,组合物中的应激蛋白的量为约300μg。根据指定的摩尔比和多肽的分子量来计算多肽的量。
[0406]
在某些实施方案中,组合物的单位剂型中的多肽的总摩尔量为约0.1至10nmol(例如,约0.1nmol、0.5nmol、1nmol、2nmol、3nmol、4nmol、5nmol、6nmol、7nmol、8nmol、9nmol或
10nmol)。在某些实施方案中,组合物的单位剂型中的多肽的总摩尔量为约4nmol。在某些实施方案中,组合物的单位剂型中的多肽的总摩尔量为约5nmol。
[0407]
总多肽与总应激蛋白的摩尔比可以为约0.01:1至约100:1的任何比率,包括但不限于约0.01:1,0.02:1,0.05:1.0.1:1.0.2:1,0.5:1,1:1,1.5:1,2:1,2.5:1,3:1,4:1,5:1,6:1,7:1,8:1,9:1,10:1,11:1,12:1,13:1,14:1,15:1,16:1,17:1,18:1,19:1,20:1,30:1,40:1,49:1,最多100:1。在某些实施方案中,组合物包含多个复合物,每个复合物包含多肽和应激蛋白,其中每个复合物中的多肽与应激蛋白的摩尔比为至少约1:1(例如,约1.5:1,2:1,2.5:1,3:1,4:1,5:1,6:1,7:1,8:1,9:1,10:1,11:1,12:1,13:1,14:1,15:1,16:1,17:1,18:1,19:1,20:1,30:1,40:1,49:1,最多100:1)。在某些实施方案中,总多肽与总应激蛋白的摩尔比为约0.5:1至5:1。
[0408]
在某些实施方案中,总多肽与总应激蛋白的摩尔比为约1:1至2:1。在某些实施方案中,总多肽与总应激蛋白的摩尔比为约1:1、1.25:1或1.5:1。这种比率,特别是接近1:1的比率,是有利的,因为组合物不包含大量过量的不与应激蛋白结合的游离肽。由于许多包含mhc结合肽的抗原肽倾向于包含疏水区,过量的游离肽可以倾向于在组合物的制备和储存期间聚集。多肽与应激蛋白的高结合亲和力使得能够以接近1:1(例如,1:1、1.25:1、1.5:1或2:1)的总多肽与总应激蛋白的摩尔比与应激蛋白进行大规模复合。因此,在某些实施方案中,多肽以小于10-3m、10-4
m、10-5
m、10-6
m、10-7
m、10-8
m或10-9
m的kd结合至hsp(
例如
,hsc70、hsp70、hsp90、hsp110、grp170、gp96或钙网蛋白)。在某些实施方案中,多肽以10-3m、10-4
m、10-5
m、10-6
m、10-7
m、10-8
m、10-9
m或更小的kd结合至hsc70(
例如
,人hsc70)。
[0409]
提供了计算单位剂型中的组分的量的方法。例如,在某些实施方案中,多肽具有的平均分子量为约3kd,并且hsc70的分子量为约71kd。在一个实施方案中,假设组合物中的多肽和应激蛋白的总量为300μg,多肽与hsc70的摩尔比为1.5:1。hsc70的摩尔量的计算公式可以为300μg除以71kd 1.5
×
3kd,得到约4.0nmol,并且hsc70的质量的计算公式可以为摩尔量乘以71kd,得到约280kd。多肽的总摩尔量的计算公式可以为1.5
×
4.0nmol,得到6.0nmol。如果使用10种不同的多肽,则每种多肽的摩尔量为0.60nmol。在另一个实施方案中,假设希望将300μg剂量的hsc70包含在单位剂型中,并且多肽与hsc70的摩尔比为1.5:1。多肽的总摩尔量的计算公式可以为300μg除以71kd然后乘以1.5,得到6.3nmol。如果使用10种不同的多肽,则每种多肽的摩尔量为0.63nmol。在一个或多个变量与实例中的变量不同的情况下,相应地调整应激蛋白和多肽的量。
[0410]
还可以理解的是,单位剂型可以任选地包含一种或多种佐剂,如上文所公开。在某些实施方案中,佐剂包括皂苷和/或免疫刺激性核酸。在某些实施方案中,佐剂包括或另外包括qs-21。在某些实施方案中,组合物的单位剂型中的qs-21的量为10μg、25μg、50μg、75μg、100μg、125μg、150μg、175μg或200μg。在某些实施方案中,组合物的单位剂型中的qs-21的量为100μg。在某些实施方案中,佐剂包括toll样受体(tlr)激动剂。在某些实施方案中,tlr激动剂是tlr4的激动剂。在某些实施方案中,tlr激动剂是tlr7和/或tlr8的激动剂。在某些实施方案中,tlr激动剂是tlr9的激动剂。在某些实施方案中,tlr激动剂是tlr5的激动剂。
[0411]
使用方法
[0412]
本文公开的组合物(例如,药物组合物和疫苗,以及它们的单位剂型)对于诱导细胞免疫应答特别有用。应激蛋白可以通过抗原呈递细胞(apc)(例如,巨噬细胞和树突细胞
(dc))中的交叉呈递途径通过膜受体(主要是cd91)或通过与toll样受体结合来递送抗原性多肽,从而引起cd8
和cd4
t细胞的活化。应激蛋白/抗原性多肽复合物的内化引起apc功能成熟,产生趋化因子和细胞因子,从而活化自然杀伤细胞(nk)、单核细胞以及th1和th2介导的免疫应答。
[0413]
因此,在一个方面,本公开提供了一种在受试者中诱导对抗原肽的细胞免疫应答的方法,所述方法包括将有效量的本文公开的组合物施用于受试者。在另一个方面,本公开提供了一种治疗受试者的疾病(例如,癌症)的方法,所述方法包括将有效量的本文公开的组合物施用于受试者。本文公开的组合物还可以用于制备用于治疗受试者的药物或疫苗。
[0414]
在多个实施方案中,此类受试者可以是动物,例如哺乳动物、非人灵长类动物和人。术语“动物”包括伴侣动物,诸如猫和狗;动物园动物;野生动物,包括鹿、狐狸和浣熊;农场动物、家畜和家禽,包括马、牛、绵羊、猪、火鸡、鸭和鸡,以及实验室动物,诸如啮齿动物、兔和豚鼠。在某些实施方案中,受试者患有癌症。
[0415]
癌症的治疗
[0416]
本文公开的组合物可以单独或与其他疗法组合使用以治疗癌症。本文公开的一种或多种mhc结合肽可以存在于受试者的癌细胞中。在某些实施方案中,一种或多种mhc结合肽在癌症的类型和/或阶段在某些实施方案中,一种或多种mhc结合肽存在于超过5%的癌症中。在某些实施方案中,一种或多种mhc结合肽对受试者的癌症具有特异性。
[0417]
可以使用本文公开的组合物治疗的癌症包括但不限于实体瘤、血液癌症(例如,白血病、淋巴瘤、骨髓瘤,例如,多发性骨髓瘤)和转移性病变。在一个实施方案中,癌症是实体瘤。实体瘤的实例包括恶性肿瘤,例如肉瘤和癌,例如各种器官系统的腺癌,诸如影响肺、乳腺、卵巢、淋巴、胃肠(例如,结肠)、肛门、生殖器和泌尿生殖道(例如,肾、尿路上皮、膀胱细胞、前列腺)、咽、cns(例如,脑细胞、神经细胞或神经胶质细胞)、头颈部、皮肤(例如,黑素瘤)和胰腺的那些腺癌,以及包括恶性肿瘤的腺癌,例如结肠癌、直肠癌、肾细胞癌、肝癌、肺癌(例如,非小细胞肺癌或小细胞肺癌)、小肠癌和食道癌。癌症可以处于早期、中期、晚期或可以是转移性癌症。在某些实施方案中,癌症与升高的pd-1活性(例如,升高的pd-1表达)相关。
[0418]
在一个实施方案中,癌症选自肺癌(例如,肺腺癌或非小细胞肺癌(nsclc)(例如,具有鳞状和/或非鳞状组织学的nsclc、或nsclc腺癌))、黑素瘤(例如,晚期黑素瘤)、肾癌(例如,肾细胞癌)、肝癌(例如,肝细胞癌或肝内胆管细胞癌)、骨髓瘤(例如,多发性骨髓瘤)、前列腺癌、乳腺癌(例如,不表达一种、两种或所有雌激素受体的乳腺癌、孕酮受体、或her2/neu,例如,三阴性乳腺癌)、卵巢癌、结肠直肠癌、胰腺癌、头颈癌(例如,头颈部鳞状细胞癌(hnscc))、肛门癌、胃食管癌(例如,食管鳞状细胞癌)、间皮瘤、鼻咽癌、甲状腺癌、宫颈癌、上皮癌、腹膜癌或淋巴增生性疾病(例如,移植后淋巴增生性疾病)。在一个实施方案中,癌症是nsclc。在一个实施方案中,癌症是肾细胞癌。在一个实施方案中,癌症是卵巢癌,任选地其中卵巢癌与人乳头瘤病毒(hpv)感染有关。在一个具体实施方案中,卵巢癌是铂难治性卵巢癌。
[0419]
在一个实施方案中,癌症是血液癌症,例如白血病、淋巴瘤或骨髓瘤。在一个实施方案中,癌症是白血病,例如,急性淋巴性白血病(all)、急性粒细胞性白血病(aml)、急性成髓细胞性白血病(aml)、慢性淋巴细胞性白血病(cll)、慢性粒细胞性白血病(cml)、慢性骨
髓性白血病(cml)、慢性髓单核细胞白血病(cmml)、慢性淋巴细胞性白血病(cll)或毛细胞白血病。在一个实施方案中,癌症是淋巴瘤,例如,b细胞淋巴瘤、弥散性大b细胞淋巴瘤(dlbcl)、活化b细胞样(abc)弥漫性大b细胞淋巴瘤、生殖中心b细胞(gcb)弥漫性大b细胞淋巴瘤、套细胞淋巴瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、复发性非霍奇金淋巴瘤、难治性非霍奇金淋巴瘤、复发性滤泡性非霍奇金淋巴瘤、伯基特淋巴瘤、小淋巴细胞性淋巴瘤、滤泡性淋巴瘤、淋巴浆细胞性淋巴瘤或结外边缘区淋巴瘤。在一个实施方案中,癌症是骨髓瘤,例如多发性骨髓瘤。
[0420]
在另一个实施方案中,癌症选自癌(例如,晚期或转移性癌)、黑素瘤或肺癌(例如,非小细胞肺癌)。
[0421]
在一个实施方案中,癌症是肺癌,例如肺腺癌、非小细胞肺癌或小细胞肺癌。
[0422]
在一个实施方案中,癌症是黑素瘤,例如晚期黑素瘤。在一个实施方案中,癌症是对其他疗法无反应的晚期或不可切除的黑素瘤。在其他实施方案中,癌症是具有braf突变(例如,braf v600突变)的黑素瘤。在另外其他实施方案中,在存在或不存在braf抑制剂(例如,威罗非尼或达拉非尼)的情况下,本文公开的组合物在用抗ctla-4抗体(例如,伊匹单抗)治疗之后施用。
[0423]
在另一个实施方案中,癌症是伴有或不伴有病毒感染(例如,慢性病毒性肝炎)的肝癌(例如,晚期肝癌)。
[0424]
在另一个实施方案中,癌症是前列腺癌,例如晚期前列腺癌。
[0425]
在又一个实施方案中,癌症是骨髓瘤,例如多发性骨髓瘤。
[0426]
在又一个实施方案中,癌症是肾癌,例如肾细胞癌(rcc)(例如,转移性rcc、透明细胞肾细胞癌(ccrcc)或肾乳头状细胞癌)。
[0427]
在又一个实施方案中,癌症选自肺癌、黑素瘤、肾癌、乳腺癌、结肠直肠癌、白血病或癌症的转移性病变。
[0428]
在一个特定实施方案中,癌症是aml。在另一个特定实施方案中,癌症是结肠直肠癌。
[0429]
本文公开的组合物可以在检测到癌症时施用,或者在复发的发作之前或期间施用。
[0430]
施用可以在癌症或复发的第一征象开始,然后加强剂量,直到至少症状明显减轻,其后持续一段时间。
[0431]
在一些实施方案中,组合物可以施用于患有癌症的受试者,所述受试者已经经历肿瘤切除手术,从而导致切除的肿瘤组织的量不足(例如,小于7g、小于6g、小于5g、小于4g、小于3g、小于2g或小于1g切除的肿瘤组织),以便产生治疗有效量的自体癌症疫苗,所述疫苗包含从切除的肿瘤组织收集的一组代表性抗原。参见,例如,癌症疫苗在expert opin.biol.ther.2009年2月;9(2):179-86中有所描述;该文献以引用的方式并入本文。
[0432]
本文公开的组合物还可以用于针对癌症的复发进行免疫。组合物至个体的预防性施用可以赋予对癌症的未来复发的保护。
[0433]
组合疗法
[0434]
组合疗法是指使用本文公开的组合物作为第一治疗方式与第二治疗方式来治疗癌症。因此,在某些实施方案中,本公开提供了一种如本文公开的在受试者中诱导对抗原肽
的细胞免疫应答的方法,或一种如本文公开的治疗受试者的疾病的方法,所述方法包括将有效量的(a)如本文公开的组合物和(b)第二治疗方式施用于受试者。
[0435]
在一个实施方案中,第二治疗方式是非hsp治疗方式,例如,不包括hsp作为组分的治疗方式。这种方法通常称为组合疗法、辅助疗法或组合治疗(这些术语可互换使用)。通过组合疗法,可以观察到加合效力或加合治疗效果。在治疗功效大于加合的情况下寻求协同结局。与单独施用第一治疗方式或第二治疗方式相比,组合疗法的使用还可以提供更好的治疗特征。
[0436]
加合或协同效应可以允许减少任一种或两种治疗方式的剂量和/或给药频率以减轻不良反应。在某些实施方案中,单独施用的第二治疗方式在临床上不足以治疗受试者(例如,受试者对单一治疗方式无反应或难治),以使得受试者需要另外的治疗方式。在某些实施方案中,受试者已经对第二治疗方式作出反应,但是仍遭受副作用、复发、产生耐药性等,以使得受试者需要另外的治疗方式。本文公开的方法包括将本文公开的组合物施用于此类受试者以改善第二治疗方式的治疗效果。可以使用本领域已知的方法在体内或体外测定治疗方式的有效性。
[0437]
在一个实施方案中,需要较少量的第二治疗方式来在受试者中产生治疗益处。在具体实施方案中,可以实现第二治疗方式的量减少约10%、20%、30%、40%和50%。第二治疗方式的量,包括在不产生任何可观察的治疗益处的范围内的量,可以通过本领域熟知的方法在动物模型中进行的剂量反应实验来确定。
[0438]
在某些实施方案中,第二治疗方式包括tcr,例如可溶性tcr或表达tcr的细胞。在某些实施方案中,第二治疗方式包括表达嵌合抗原受体(car)的细胞。在某些实施方案中,表达tcr或car的细胞是t细胞。在一个特定实施方案中,tcr或car结合至(例如,特异性结合至)本文公开的组合物中的至少一个mhc结合表位。
[0439]
在某些实施方案中,第二治疗方式包括tcr模拟抗体。在某些实施方案中,tcr模拟抗体是特异性结合至肽-mhc复合物的抗体。tcr模拟抗体的非限制性实例在美国专利号9,074,000、美国公开号us 2009/0304679 a1和us 2014/0134191 a1中有所公开,所有这些专利均以引用的方式整体并入本文。在一个特定实施方案中,tcr模拟抗体结合至(例如,特异性结合至)本文公开的组合物中的至少一个mhc结合表位。
[0440]
在某些实施方案中,第二治疗方式包括检查点靶向剂。在某些实施方案中,检查点靶向剂选自由以下各项组成的组:拮抗性抗ctla-4抗体、拮抗性抗pd-l1抗体、拮抗性抗pd-l2抗体、拮抗性抗pd-1抗体、拮抗性抗tim-3抗体、拮抗性抗lag-3抗体、拮抗性抗ceacam1抗体、激动性抗cd137抗体、拮抗性抗tigit抗体、拮抗性抗vista抗体、激动性抗gitr抗体和激动性抗ox40抗体。
[0441]
在某些实施方案中,抗pd-1抗体在本文公开的方法中用作第二治疗方式。在某些实施方案中,抗pd-1抗体是bristol-myers squibb开发的纳武单抗(nivolumab),也称为bms-936558或mdx1106。在某些实施方案中,抗pd-1抗体是merck&co.开发的帕博利珠单抗(pembrolizumab),也称为兰布鲁珠单抗(lambrolizumab)或mk-3475。在某些实施方案中,抗pd-1抗体是curetech开发的皮地利珠单抗(pidilizumab),也称为ct-011。在某些实施方案中,抗pd-1抗体是medimmune开发的medi0680,也称为amp-514。在某些实施方案中,抗pd-1抗体是novartis pharmaceuticals开发的pdr001。在某些实施方案中,抗pd-1抗体是
regeneron pharmaceuticals开发的regn2810。在某些实施方案中,抗pd-1抗体是pfizer开发的pf-06801591。在某些实施方案中,抗pd-1抗体是beigene开发的bgb-a317。在某些实施方案中,抗pd-1抗体是anaptysbio和tesaro开发的tsr-042。在某些实施方案中,抗pd-1抗体是恒瑞开发的shr-1210。
[0442]
可以用于本文公开的治疗方法的抗pd-1抗体的其他非限制性实例公开于以下专利和专利申请中,所有这些专利和专利申请均以引用的方式整体并入本文用于所有目的:美国专利号6,808,710、美国专利号7,332,582、美国专利号7,488,802、美国专利号8,008,449、美国专利号8,114,845、美国专利号8,168,757、美国专利号8,354,509、美国专利号8,686,119、美国专利号8,735,553、美国专利号8,747,847、美国专利号8,779,105、美国专利号8,927,697、美国专利号8,993,731、美国专利号9,102,727、美国专利号9,205,148、美国公开号us 2013/0202623 a1、美国公开号us 2013/0291136 a1、美国公开号us 2014/0044738 a1、美国公开号us 2014/0356363 a1、美国公开号us 2016/0075783 a1以及pct公开号wo 2013/033091 a1、pct公开号wo 2015/036394 a1、pct公开号wo 2014/179664 a2、pct公开号wo 2014/209804 a1、pct公开号wo 2014/206107 a1、pct公开号wo 2015/058573 a1、pct公开号wo 2015/085847 a1、pct公开号wo 2015/200119 a1、pct公开号wo 2016/015685 a1和pct公开号wo 2016/020856 a1。
[0443]
在某些实施方案中,抗pd-l1抗体在本文公开的方法中用作第二治疗方式。在某些实施方案中,抗pd-l1抗体是genentech开发的阿特珠单抗(atezolizumab)。在某些实施方案中,抗pd-l1抗体是astrazeneca、celgene和medimmune开发的德瓦鲁单抗(durvalumab)。在某些实施方案中,抗pd-l1抗体是merck serono和pfizer开发的阿维鲁单抗(avelumab),也称为msb0010718c。在某些实施方案中,抗pd-l1抗体是bristol-myers squibb开发的mdx-1105。在某些实施方案中,抗pd-l1抗体是amplimmune和gsk开发的amp-224。
[0444]
可以用于本文公开的治疗方法的抗pd-l1抗体的非限制性实例公开于以下专利和专利申请中,所有这些专利和专利申请均以引用的方式整体并入本文用于所有目的:美国专利号7,943,743、美国专利号8,168,179、美国专利号8,217,149、美国专利号8,552,154、美国专利号8,779,108、美国专利号8,981,063、美国专利号9,175,082、美国公开号us 2010/0203056 a1、美国公开号us 2003/0232323 a1、美国公开号us 2013/0323249 a1、美国公开号us 2014/0341917 a1、美国公开号us 2014/0044738 a1、美国公开号us 2015/0203580 a1、美国公开号us 2015/0225483 a1、美国公开号us 2015/0346208 a1、美国公开号us 2015/0355184 a1以及pct公开号wo 2014/100079 a1、pct公开号wo 2014/022758 a1、pct公开号wo 2014/055897 a2、pct公开号wo 2015/061668 a1、pct公开号wo 2015/109124 a1、pct公开号wo 2015/195163 a1、pct公开号wo 2016/000619 a1和pct公开号wo 2016/030350 a1。
[0445]
在某些实施方案中,靶向免疫调节酶(诸如ido(吲哚胺-(2,3)-双加氧酶)和/或tdo(色氨酸2,3-双加氧酶))的化合物被用作本文公开的方法中的第二治疗方式。因此,在一个实施方案中,化合物靶向一种或多种免疫调节酶,诸如吲哚胺-(2,3)-双加氧酶(ido)的抑制剂。在某些实施方案中,此类化合物选自由以下各项组成的组:依帕卡司他(epacadostat)(incyte corp;参见,例如,wo 2010/005958,该文献以引用的方式整体并入本文)、f001287(flexus biosciences/bristol-myers squibb)、英妥昔莫(indoximod)
(newlink genetics)和nlg919(newlink genetics)。在一个实施方案中,化合物是依帕卡司他。在另一个实施方案中,化合物是f001287。在另一个实施方案中,化合物是英妥昔莫(indoximod)。在另一个实施方案中,化合物是nlg919。在一个具体实施方案中,将本文公开的抗tim-3(例如,人tim-3)抗体与ido抑制剂组合施用于受试者以治疗癌症。如本文所述的用于治疗癌症的ido抑制剂存在于组合物的固体剂型(诸如片剂、丸剂或胶囊剂)中,其中组合物包含ido抑制剂和药学上可接受的赋形剂。因此,如本文所述的抗体和如本文所述的ido抑制剂可以作为单独的剂型单独、按顺序或同时施用。在一个实施方案中,抗体肠胃外施用,ido抑制剂口服施用。在特定实施方案中,抑制剂选自由以下各项组成的组:依帕卡司他(incyte corporation)、f001287(flexus biosciences/bristol-myers squibb)、英妥昔莫(newlink genetics)和nlg919(newlink genetics)。依帕卡司他已经在pct公开号wo 2010/005958中有所描述,该公开以引用的方式整体并入本文用于所有目的。在一个实施方案中,抑制剂是依帕卡司他。在另一个实施方案中,抑制剂是f001287。在另一个实施方案中,抑制剂是英妥昔莫。在另一个实施方案中,抑制剂是nlg919。
[0446]
在某些实施方案中,第二治疗方式包括用于治疗癌症的不同疫苗(例如,肽疫苗、dna疫苗或rna疫苗)。在某些实施方案中,疫苗是基于热休克蛋白的肿瘤疫苗或基于热休克蛋白的病原体疫苗(例如,如wo2016/183486中所述的疫苗,该文献以引用的方式整体并入本文)。在一个具体实施方案中,第二治疗方式包括基于应激蛋白的疫苗。例如,在某些实施方案中,第二治疗方式包括如本文公开的不同于第一治疗方式的组合物。在某些实施方案中,第二治疗方式包括与本文公开的那些相似的组合物,不同之处在于具有不同的hsp结合肽的序列。在某些实施方案中,基于应激蛋白的疫苗来源于肿瘤制备物,以使得疫苗引发的免疫力特异性针对每个受试者的癌症表达的独特抗原肽库。
[0447]
在某些实施方案中,第二治疗方式包括一种或多种佐剂,诸如上文公开的可以包含在本文公开的疫苗制剂中的佐剂。在某些实施方案中,第二治疗方式包括皂苷、免疫刺激性核酸和/或qs-21。在某些实施方案中,第二治疗方式包括toll样受体(tlr)激动剂。在某些实施方案中,tlr激动剂是tlr4的激动剂。在某些实施方案中,tlr激动剂是tlr7和/或tlr8的激动剂。在某些实施方案中,tlr激动剂是tlr9的激动剂。在某些实施方案中,tlr激动剂是tlr5的激动剂。
[0448]
在某些实施方案中,第二治疗方式包括一种或多种选自由以下各项组成的组的药剂:来那度胺、地塞米松、白介素-2、重组干扰素α-2b和聚乙二醇干扰素α-2b。
[0449]
在某些实施方案中,当组合物用于治疗患有癌症的受试者时,第二治疗方式包括化疗剂或放疗剂。在某些实施方案中,化疗剂是低甲基化剂(例如,阿扎胞苷)。
[0450]
本文所公开的组合物可以单独、与第二治疗方式(例如,化疗剂、放疗剂、检查点靶向剂、ido抑制剂、疫苗、佐剂、可溶性tcr、表达tcr的细胞、表达car的细胞和/或tcr模拟抗体)通过相同的或不同的递送途径按顺序或同步施用。
[0451]
剂量方案
[0452]
本文公开的组合物的剂量,以及在施用组合疗法的情况下任何其他治疗方式的剂量,在很大程度上取决于接受治疗的受试者的体重和一般健康状况,以及治疗的频率和施用途径。用于这种用途的有效量还取决于疾病的阶段和严重性以及处方医生的判断,但是通常初始免疫(即,治疗性施用)的范围为对于70kg患者约1.0μg至约1000μg(1mg)(包括,例
如,10,20,25,30,40,50,60,70,80,90,100,150,200,240,250,300,350,400,450,500,550,600,650,700,750,800,850,900,950或1000μg)本文公开的组合物中的任一种,然后是约1.0μg至约1000μg组合物(包括,例如,10,20,25,30,40,50,60,70,80,90,100,150,200,250,300,350,400,450,500,550,600,650,700,750,800,850,900,950或1000μg)的加强剂量,根据患者的反应和状况,通过测量患者血液中的特定ctl活性,在数周至数月内进行加强方案。持续治疗的方案,包括部位、剂量和频率,可以由初始反应和临床判断来指导。佐剂的剂量范围和方案是本领域的技术人员已知的,参见,例如vogel和powell,1995,a compendium of vaccine adjuvants and excipients;m.f.powell,m.j.newman(编),plenum press,new york,第141-228页。
[0453]
优选的佐剂包括qs-21,例如,qs-21和cpg寡核苷酸。qs-21的示例性剂量范围是每次施用1μg至200μg。在其他实施方案中,qs-21的剂量可以是每次施用10、25和50μg。在某些实施方案中,佐剂包括toll样受体(tlr)激动剂。在某些实施方案中,tlr激动剂是tlr4的激动剂。在某些实施方案中,tlr激动剂是tlr7和/或tlr8的激动剂。在某些实施方案中,tlr激动剂是tlr9的激动剂。在某些实施方案中,tlr激动剂是tlr5的激动剂。
[0454]
在某些实施方案中,组合物的施用量取决于施用途径和组合物中的hsp的类型。例如,组合物中的hsp的量可以在例如每次施用5至1000μg(1mg)的范围内。在某些实施方案中,包含hsc70-、hsp70-和/或gp96-多肽复合物的组合物的施用量为例如5,10,20,25,30,40,50,60,70,80,90,100,200,250,300,400,500,600,700,750,800,900或1000μg。在某些实施方案中,组合物的施用量在每次施用约10至600μg的范围内,如果皮内施用组合物,则为约5至100μg。在某些实施方案中,组合物的施用量为约5μg至600μg、约5μg至300μg、约5μg至150μg或约5μg至60μg。在某些实施方案中,组合物的施用量小于100μg。在某些实施方案中,组合物的施用量为约5μg、25μg、50μg、120μg、240μg或480μg。在某些实施方案中,纯化包含应激蛋白和多肽的复合物的组合物。
[0455]
在治疗方案的一个实施方案中,与观察到在较小的非人动物(例如,小鼠或豚鼠)中有效的剂量基本上相等的剂量对于人施用是有效的,任选地经历不超过五十倍的校正因子增加,取决于此类哺乳动物和人的相对淋巴结尺寸。具体而言,对于人剂量,与抗原分子非共价结合或混合的应激蛋白(或hsp)的物种间剂量反应等效性以在小鼠中观察到的治疗剂量和单个比例尺比率的乘积估算,增加不超过五十倍。在某个实施方案中,组合物的剂量可以远小于通过推导估算的剂量。
[0456]
上述剂量可以一次或多次施用,诸如每天、每隔一天、每周、每两周或每月,持续长达一年或一年以上的时间。剂量优选地每28天给予一次,持续约52周或更长的时间。
[0457]
在一个实施方案中,将组合物与一种或多种另外的治疗方式合理地同时施用于受试者。该方法规定两次施用在小于一分钟至约五分钟的时间范围内进行,或者彼此间隔最多约六十分钟,例如,在同一医生访视时。
[0458]
在另一个实施方案中,组合物和一种或多种另外的治疗方式同时施用。
[0459]
在又一个实施方案中,组合物和一种或多种另外的治疗方式按顺序和在时间间隔内施用,以使得本文公开的复合物和一种或多种另外的治疗方式可以共同作用,以提供比它们单独施用时增加的益处。
[0460]
在另一个实施方案中,组合物和一种或多种另外的治疗方式在时间上足够接近地
施用,以提供所需的治疗或预防结局。每次可以同时或分别以任何合适的形式和通过任何合适的途径施用。在一个实施方案中,本文公开的复合物和一种或多种另外的治疗方式通过不同的施用途径施用。在一个替代性实施方案中,每次都通过相同的施用途径施用。组合物可以在相同或不同部位施用,例如手臂和腿。当同时施用时,组合物和一种或多种另外的治疗方式可以混合施用或可以不混合施用,或者通过相同的施用途径在相同的施用部位施用。
[0461]
在多个实施方案中,组合物和一种或多种另外的治疗方式的施用间隔小于1小时、间隔约1小时、间隔1小时至2小时、间隔2小时至3小时、间隔3小时至4小时、间隔4小时至5小时、间隔5小时至6小时、间隔6小时至7小时、间隔7小时至8小时、间隔8小时至9小时、间隔9小时至10小时、间隔10小时至11小时、间隔11小时至12小时,间隔不超过24小时或间隔不超过48小时。在其他实施方案中,组合物和疫苗组合物的施用间隔2至4天、间隔4至6天、间隔1周、间隔1至2周、间隔2至4周、间隔一个月、间隔1至2个月或间隔2个月或更长的时间。在优选的实施方案中,组合物和一种或多种另外的治疗方式在二者仍然有效的时间范围内施用。本领域的技术人员将能够通过确定每种施用组分的半衰期来确定这种时间范围。
[0462]
在某些实施方案中,将组合物每周施用于受试者持续至少四周。在某些实施方案中,在四个每周剂量之后,将至少2个(例如,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19或20个)另外剂量的组合物每两周施用于受试者。在某些实施方案中,组合物在最后的每周或每两周剂量之后三个月作为加强剂量施用。每三个月施用的加强剂量可以在受试者的一生中施用(例如,至少1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,25,30,40,50或更多年)。在某些实施方案中,施用于受试者的组合物的总剂量是1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19或20剂。
[0463]
在一个实施方案中,组合物和一种或多种另外的治疗方式在同一患者访视中施用。在某些实施方案中,组合物在施用一种或多种另外的治疗方式之前施用。在一个替代性具体实施方案中,组合物在施用一种或多种另外的治疗方式之后施用。
[0464]
在某些实施方案中,将组合物和一种或多种另外的治疗方式周期性地施用于受试者。周期疗法涉及施用组合物一段时间,然后施用治疗方式一段时间,并且重复该顺序施用。周期疗法可以减少对一种或多种疗法产生耐受性,避免或减少一种疗法的副作用,和/或改善治疗的功效。在这些实施方案中,本公开考虑交替施用组合物,然后在4至6天后、优选地2至4天后、更优选地1至2天后施用治疗方式,其中这种周期可以根据需要重复多次。在某些实施方案中,组合物和治疗方式以少于3周、每两周一次、每10天一次或每周一次的周期交替施用。在某些实施方案中,组合物在治疗方式施用之后一小时至二十四小时的时间范围内施用于受试者。如果使用缓慢或连续释放类型的治疗方式递送系统,则时间范围可以进一步延长至几天或更长的时间。
[0465]
施用途径
[0466]
本文公开的组合物可以使用任何所需的施用途径来施用。许多方法可以用于引入上述组合物,包括但不限于口服、皮内、肌肉内、腹膜内、静脉内、皮下、粘膜、鼻内、肿瘤内和淋巴结内途径。非粘膜施用途径包括但不限于皮内和局部施用。粘膜施用途径包括但不限于口服、直肠和鼻腔施用。皮内施用的优点分别包括使用较低剂量和快速吸收。皮下或肌肉内施用的优点包括分别适用于一些不溶性悬浮液和油性悬浮液。用于粘膜施用的制备物适
用于如下所述的各种制剂。
[0467]
溶解度和施用部位是选择组合物的施用途径时应考虑的因素。施用方式可以在多种施用途径之间变化,包括上文列出的那些。
[0468]
如果组合物是水溶性的,则可以将其配制在适当的缓冲液中,例如磷酸盐缓冲盐水或其他生理相容性溶液,优选地无菌的。或者,如果组合物在水性溶剂中的溶解度差,则它可以与非离子表面活性剂(诸如吐温或聚乙二醇)一起配制。因此,可以将组合物配制成通过吸入或吹入(通过口或鼻)或口服、面颊、肠胃外或直肠施用来施用。
[0469]
对于口服施用,组合物可以是液体形式,例如溶液剂、糖浆剂或混悬剂,或者可以作为药物产物存在,用于在使用前用水或其他合适的媒介物复原。这种液体制备物可以通过常规方法与药学上可接受的添加剂,诸如助悬剂(例如,山梨糖醇糖浆剂、纤维素衍生物或氢化食用脂肪);乳化剂(例如,卵磷脂或阿拉伯胶);非水性媒介物(例如,杏仁油、油性酯或分馏植物油);和防腐剂(例如,对羟基苯甲酸甲酯或对羟基苯甲酸丙酯或山梨酸)一起制备。组合物可以采取例如片剂或胶囊剂的形式,它们通过常规方法与药学上可接受的赋形剂,诸如粘合剂(例如,预糊化的玉米淀粉、聚乙烯吡咯烷酮或羟丙基甲基纤维素);填充剂(例如,乳糖、微晶纤维素或磷酸氢钙);润滑剂(例如,硬脂酸镁、滑石或二氧化硅);崩解剂(例如,马铃薯淀粉或羟基乙酸淀粉钠);或润湿剂(例如,十二烷基硫酸钠)一起制备。片剂可以通过本领域熟知的方法进行包衣。
[0470]
用于口服施用的组合物可以适当地配制为以受控和/或定时的方式释放。
[0471]
对于面颊施用,组合物可以采用以常规方式配制的片剂或锭剂的形式。
[0472]
制备物可以配制成用于通过注射,例如通过弹丸注射或连续输注来肠胃外施用。注射用制剂可以以单位剂型(例如,添加有防腐剂的安瓿或多剂量容器)提供。制备物可以采取诸如溶于油性媒介物或水性媒介物的悬浮剂、溶液剂或乳剂的形式,并且可以含有配制剂(诸如助悬剂、稳定剂和/或分散剂)。或者,活性成分可以是粉末形式,以便在使用前用合适的媒介物(例如,无菌无热原水)复原。
[0473]
制备物还可以配制成直肠制备物,诸如栓剂或保留灌肠剂,例如含有常规栓剂基质,诸如可可脂或其他甘油酯。
[0474]
除上述制剂之外,制备物还可以配制成长效制剂。这种长效制剂可以通过移植(例如,皮下或肌肉内)或通过肌肉内注射来施用。因此,例如,制备物可以与合适的聚合物或疏水材料(例如,作为可接受的油中的乳剂)或离子交换树脂一起,或作为微溶性衍生物,例如作为微溶性盐来配制。脂质体和乳剂是亲水性药物的递送媒介物或载剂的熟知的实例。
[0475]
对于吸入施用,组合物以气溶胶喷雾形式从加压包装或雾化器,使用合适的推进剂(例如,二氟二氯甲烷、三氯氟甲烷、二氯四氟乙烷、二氧化碳或其他合适的气体)方便地递送。在加压气溶胶的情况下,剂量单位可以通过提供阀门以递送计量的量来确定。可以配制用于吸入器或吹药器的例如明胶的胶囊和筒,所述胶囊和筒包含化合物和合适的粉末基质(诸如乳糖或淀粉)的粉末混合物。
[0476]
患者(受试者)评估
[0477]
可以测试用本文公开的组合物治疗的患者的抗肿瘤免疫应答。就此而言,可以获得来自患者的外周血并测定抗肿瘤免疫的标志物。使用标准实验室程序,可以从外周血中获得白细胞,并测定不同免疫细胞表型、hla亚型和抗肿瘤免疫细胞功能的频率。
[0478]
抗肿瘤反应中的大多数效应免疫细胞是cd8
t细胞,因此是hla i类限制的。在其他肿瘤类型中使用免疫治疗策略,在大多数患者中发现了识别hla i类限制性抗原的cd8 细胞的扩增。然而,其他细胞类型涉及抗肿瘤免疫应答,包括例如cd4 t细胞、巨噬细胞和树突细胞,它们可以作为抗原呈递细胞。可以使用流式细胞术来确定t细胞(cd4 、cd8 和treg细胞)、巨噬细胞和抗原呈递细胞的群体。hla分型可以使用本领域的常规方法,诸如boegel等人genome medicine 2012,4:102(seq2hla)描述的方法,或使用hla测序基因包(illumina,inc.)来进行。cd8 t细胞的hla亚型可以通过补体依赖性微细胞毒性测试来确定。
[0479]
为了确定抗肿瘤t细胞反应是否增加,可以进行酶联免疫斑点测定法以定量产生ifnγ的外周血单个核细胞(pbmc)。该技术提供了抗原识别和免疫细胞功能的测定法。在一些实施方案中,对疫苗有临床反应的受试者可以具有肿瘤特异性t细胞和/或产生ifnγ的pbmc的增加。在一些实施方案中,使用流式细胞术来评估免疫细胞频率。在一些实施方案中,抗原识别和免疫细胞功能使用酶联免疫斑点测定法来评估。
[0480]
在一些实施方案中,可以进行一组测定法以表征对单独的组合物或与护理标准(例如,最大程度的手术切除、放射疗法以及与替莫唑胺一起用于多形性胶质母细胞瘤的伴随和辅助化疗)组合给予而产生的免疫应答。在一些实施方案中,所述一组测定法包括以下测试中的一者或多者:全血细胞计数、绝对淋巴细胞计数、单核细胞计数、cd4
cd3
t细胞的百分比、cd8
cd3
t细胞的百分比、cd4
cd25
foxp3
调节t细胞的百分比和pbl表面标志物的其他表型分型、胞内细胞因子染色(在蛋白质水平上检测促炎性细胞因子)、qpcr(在mrna水平上检测细胞因子)和cfse稀释(测定t细胞增殖)。
[0481]
在评估受试者时,可以进行许多其他测试以确定受试者的整体健康状况。例如,可以从受试者收集血液样品并分析血液学、凝血时间和血清生物化学。cbc的血液学可以包括红细胞计数、血小板、血细胞比容、血红蛋白、白细胞(wbc)计数以及wbc分类(以提供中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、淋巴细胞和单核细胞的绝对计数)。血清生物化学可以包括白蛋白、碱性磷酸酶、天冬氨酸氨基转移酶、丙氨酸氨基转移酶、总胆红素、bun、葡萄糖、肌酐、钾和钠。还可以测试凝血酶原时间(pt)和部分促凝血酶原激酶时间(ptt)。还可以进行以下一项或多项测试:抗甲状腺(抗微粒体或甲状腺球蛋白)抗体测试、抗核抗体和类风湿因子评估。可以进行尿液分析以评估尿液中的蛋白质、rbc和wbc水平。此外,还可以进行采血以确定组织相容性白细胞抗原(hla)状态。
[0482]
在一些实施方案中,在整个治疗过程中进行一次或多次放射肿瘤评估,以评估肿瘤大小和状态。例如,可以在手术前30天内、手术后48小时内(例如,评估切除百分比)、第一次疫苗接种前1周(最多14天)(例如,作为基线评估)进行肿瘤评估扫描,并且此后大约每8周一次,持续一段特定的时间。可以使用mri或ct成像。通常,用于基线评估的相同成像治疗方式用于每次肿瘤评估访视。
[0483]
抗体和t细胞受体
[0484]
在另一个方面,本公开提供了一种分离的抗体,所述分离的抗体特异性结合至mhc结合肽,所述mhc结合肽选自由seq id no:98-1371、3921-3996和4149-4171组成的组,和/或mhc分子和mhc结合肽的复合物,所述mhc结合肽选自由seq id no:98-1371、3921-3996和4149-4171组成的组。在某些实施方案中,抗体不特异性结合(或以低亲和力结合)至mhc结
合肽的未磷酸化变体、和/或mhc分子和mhc结合肽的未磷酸化变体的复合物。抗体可以是本领域已知的或本文公开的任何形式。在某些实施方案中,抗体是嵌合抗原受体。嵌合抗原受体是本领域熟知的(参见,例如,subklewe m等人,transfus med hemother 2019;46:15-24.doi:10.1159/000496870,该文献以引用的方式整体并入本文)。
[0485]
在另一个方面,本公开提供了一种编码前述抗体的vh区和/或vl区的分离的多核苷酸。分离的多核苷酸可以包含dna和/或rna,和/或它们的类似物或衍生物。在某些实施方案中,分离的多核苷酸是mrna。在某些实施方案中,分离的多核苷酸包含在载体中。
[0486]
在另一个方面,本公开提供了一种经工程化的细胞,所述经工程化的细胞包含前述抗体、分离的多核苷酸(例如,mrna)或载体。在某些实施方案中,经工程化的细胞是人淋巴细胞,例如,t细胞、cd8 t细胞、cd4 t细胞、自然杀伤t(nkt)细胞、不变自然杀伤t(inkt)细胞、粘膜相关不变t(mait)细胞或自然杀伤(nk)细胞。
[0487]
在另一个方面,本公开提供了一种分离的t细胞受体(tcr),所述t细胞受体特异性结合至mhc分子和mhc结合肽的复合物,所述mhc结合肽选自由seq id no:98-1371、3921-3996和4149-4171组成的组。在某些实施方案中,tcr不特异性结合(或以低亲和力结合)至mhc分子和mhc结合肽的未磷酸化变体的复合物。tcr可以是本领域已知的或本文公开的任何形式。在某些实施方案中,tcr是可溶性tcr。在某些实施方案中,tcr还包含cd3结合部分。在某些实施方案中,tcr是全长tcr。
[0488]
在另一个方面,本公开提供了一种编码前述tcr的可变区(例如,vα和/或vβ)的分离的多核苷酸。分离的多核苷酸可以包含dna和/或rna,和/或它们的类似物或衍生物。在某些实施方案中,分离的多核苷酸是mrna。在某些实施方案中,分离的多核苷酸包含在载体中。
[0489]
在另一个方面,本公开提供了一种经工程化的细胞,所述经工程化的细胞包含前述tcr、分离的多核苷酸(例如,mrna)或载体。在某些实施方案中,经工程化的细胞是人淋巴细胞,例如,t细胞、cd8 t细胞、cd4 t细胞、自然杀伤t(nkt)细胞、不变自然杀伤t(inkt)细胞、粘膜相关不变t(mait)细胞或自然杀伤(nk)细胞。
[0490]
试剂盒
[0491]
还提供了用于实施本文公开的预防和治疗方法的试剂盒。试剂盒可以任选地另外包括关于如何使用试剂盒的各种组分的说明。
[0492]
在某些实施方案中,试剂盒包括含有组合物(例如,包含本文公开的应激蛋白和抗原性多肽的组合物)的第一容器,以及含有一种或多种佐剂的第二容器。佐剂可以是本文公开的任何佐剂,例如皂苷、免疫刺激性核酸或qs-21(例如,qs-21)。在某些实施方案中,试剂盒还包括含有另外的治疗方式的第三容器。试剂盒可以另外包括关于组合物、佐剂和另外的治疗方式的适应症、剂量方案和施用途径的说明,例如,如本文所公开。
[0493]
或者,试剂盒可以在单独的容器中包含本文公开的组合物的应激蛋白和抗原性多肽。在某些实施方案中,试剂盒包括含有一种或多种本文公开的抗原性多肽的第一容器,以及含有能够与多肽结合的纯化的应激蛋白的第二容器。
[0494]
第一容器可以含有任何数量的不同的多肽。例如,在某些实施方案中,第一容器含有不超过100种不同的多肽,例如2-50、2-30、2-20、5-20、5-15、5-10或10-15种不同的多肽.在某些实施方案中,每种不同的多肽包含相同的hsp结合肽和不同的抗原肽。在某些实施方
案中,第一容器中的多肽的总量是单位剂量的合适量。在某些实施方案中,第一容器中的多肽的总量为约0.1至20nmol(例如,3、4、5或6nmol)。
[0495]
第二容器可以含有本文公开的任何应激蛋白。在某些实施方案中,应激蛋白选自由以下各项组成的组:hsc70、hsp70、hsp90、hsp110、grp170、gp96或钙网蛋白以及它们的突变体或融合蛋白。在某些实施方案中,应激蛋白是hsc70(例如,人hsc70)。在某些实施方案中,应激蛋白是重组蛋白。在某些实施方案中,第二容器中的应激蛋白的总量为约10μg至600μg(例如,120μg、240μg或480μg)。在某些实施方案中,第二容器中的应激蛋白的总量为约50μg、100μg、200μg、300μg、400μg或500μg。在某些实施方案中,组合物中的应激蛋白的量为约300μg。在某些实施方案中,第二容器中的应激蛋白的总摩尔量根据第一容器中的多肽的总摩尔量来计算,以使得多肽与应激蛋白的摩尔比为约0.5:1至5:1(例如,约1:1、1.25:1、1.5:1、2:1、2.5:1、3:1、3.5:1、4:1、4.5:1或5:1)。在某些实施方案中,第二容器中的应激蛋白的总量是多次施用的量(例如,小于或等于1mg、3mg、10mg、30mg或100mg)。
[0496]
在某些实施方案中,试剂盒还包括用于从第一容器中的多肽和第二容器中的应激蛋白制备组合物的说明(例如,本文公开的复合反应的说明)。
[0497]
在某些实施方案中,试剂盒还包括含有一种或多种佐剂的第三容器。佐剂可以是本文所公开的任何佐剂,例如皂苷、免疫刺激性核酸或qs-21(例如,qs-21)。在某些实施方案中,试剂盒还包括含有另外的治疗方式的第四容器。试剂盒可以另外包括关于从多肽和应激蛋白制备的组合物、佐剂和另外的治疗方式的适应症、剂量方案和施用途径的说明,例如,如本文所公开。
[0498]
在某些实施方案中,容器中的组合物、多肽、应激蛋白、佐剂和另外的治疗方式以有效治疗癌症的预定量存在。如果需要,组合物可以以包装或分配装置的形式提供,所述包装或分配装置可以含有组合物的一个或多个单位剂型。例如,包装可以包含金属或塑料箔,诸如泡罩包装。包装或分配装置可以附有施用说明。
[0499]
实施例
[0500]
本节中的实施例仅用于说明而非限制。
[0501]
实施例1:磷酸肽分离和鉴定
[0502]
本实施例描述了从癌症患者组织样品和癌细胞系样品分离和鉴定肿瘤相关磷酸肽新抗原。
[0503]
磷酸肽的分离如下所述进行。首先,使用泛hla i类抗体从样品中免疫纯化hla:肽复合物。简而言之,将nhs活化的琼脂糖珠粒与抗人hla i类抗体(w6/32,bio x)缀合。在蛋白酶和磷酸酶抑制剂存在的情况下裂解样品中的细胞,然后与抗人hla i类抗体缀合的珠粒一起温育。在温育后,将珠粒上样到聚制备柱上并洗涤。将珠粒重新悬浮在无盐缓冲液中,并转移到30k mwco超旋转过滤器中,以除去缓冲液。
[0504]
使用含有c18反相基质的停走萃取(stage)吸头对hla结合肽进行洗脱、脱盐和浓缩。简而言之,将分离的hla:肽复合物从30k mwco超旋转过滤器转移到低蛋白结合管中,随后使用水冲洗将,以确保完全转移。将珠粒离心,并将所得上清液上样到平衡的stage吸头上。再次洗涤珠粒,并将上清液以3500
×
g上样到stage吸头上各1分钟,以确保已从hla分子解离的任何肽得以上样。
[0505]
然后,用150μl的10%乙酸从hla分子洗脱肽。将珠粒以300
×
g离心30秒,然后将上
清液转移到低结合管中。重复该过程以确保从hla分子完全洗脱肽,并将上清液添加到低结合管中。将上清液以150μl等分试样以3500
×
g上样到stage吸头上,直到整个体积通过。使用三轮100μl 1%乙酸洗涤stage吸头,随后使用逐渐增加的乙腈浓度的梯度洗脱肽。
[0506]
使用固定化亚氨基二乙酸铁金属亲和色谱法(fe-ida imac),通过固定化金属亲和色谱法来富集富集的磷酸肽在orbitrap fusion
tm lumos
tm
质谱仪上使用互补断裂方法进行色谱分离和分析,并使用byonic
tm
软件进行测序。
[0507]
使用xcalibur
tm
查看软件进行数据分析。使用byonic
tm
对swissprot人类蛋白质数据库和磷酸肽数据库(含有从此前分析的样品中鉴定的磷酸肽)进行原始数据文件搜索。搜索参数包括:无酶特异性、
±
10ppm前体质量容差、
±
0.4da产物离子质量容差和1%错误数据率(fdr)。允许的修饰包括:甲酯(天冬氨酸、谷氨酸和c-末端)的固定修饰,以及氧化(甲硫氨酸、色氨酸和半胱氨酸)和磷酸化(丝氨酸、苏氨酸和酪氨酸)的可变修饰。来自搜索结果的肽命中通过准确的质量测量得到确认,并通过检查所得串联质谱的正确氨基酸序列和磷酸化位点分配来手动确认。
[0508]
实施例2:磷酸肽合成
[0509]
seq id no:119,120,228,290,339,424,433,547,654,657,933,1157,1179,1207,1224,1335,1337,1357,2668,2972,3205,3705,3755,3883,3885和3905中列出的抗原肽在x自动合成仪(gyros protein technologies)中使用标准fmoc固相化学合成和预上样的聚苯乙烯wang(ps-wang)树脂来合成。将来自c-末端的加载有第一氨基酸的树脂样品放置于干燥反应容器中,并装入24个反应/预活化容器中的每个。合成仪被编程为使用o-(1h-6-氯苯并三唑-1-基)-1,1,3,3-四甲基脲六氟磷酸盐/n-甲基吗啉hctu/nmm活化化学来运行完整的合成循环。分别使用n-α-fmoc-o-苄基-l-磷酸丝氨酸、n-α-fmoc-o-苄基-l-磷酸苏氨酸和n-α-fmoc-o-苄基-l-磷酸酪氨酸作为丝氨酸、苏氨酸和酪氨酸来掺入磷酸基团。将5倍过量的氨基酸、5倍过量的活化试剂(hctu)和10倍过量的n-甲基吗啉用于肽偶联反应。对于整个合成过程中的任何不完全偶联,双偶联循环的偶联反应进行10分钟。重复这些步骤,直到获得所需的序列。
[0510]
在肽合成结束时,树脂用二氯甲烷(dcm)洗涤并干燥。在完成磷酸肽组装后,将树脂转移到切割容器中,以便从树脂中对肽进行切割。将切割试剂(tfa:dtt:水:tis,88:5:5:2(v/w/v/v))与树脂混合并在25℃下搅拌4小时。粗肽通过过滤从树脂分离,并用n2气体蒸发,然后用冷却的乙醚沉淀并在20℃下储存12小时。
[0511]
将沉淀的肽离心并用乙醚洗涤两次,干燥,溶解在乙腈和水的1:1(v/v)混合物中,并冻干以产生粗干粉。利用水(0.1%tfa)-乙腈(0.1%tfa)梯度使用c18分析柱(inc)通过反相hplc来分析粗肽。利用水(0.1%tfa)-乙腈(0.1%tfa)梯度使用制备型c18色谱柱(inc)通过制备型hplc来进一步纯化肽。使用分析型hplc来分析纯化的级分,合并纯级分用于后续的冻干。使用分析型c18色谱柱(inc)测来试肽纯度,并通过lc/ms(6550q-tof,agilent)或msq plus
tm
(thermonorth america)来确认身份。
[0512]
实施例3:hla结合
[0513]
在该实施例中,确定实施例1中鉴定的所选的磷酸肽的hla结合亲和力。使用预测
算法(iedb.org)来确定hla单倍型特异性,该预测算法将单个hla单倍型的实验衍生的结合基序与指定的肽序列相匹配。将此信息与每个患者样品中代表的已知hla单倍型相结合,可以预测呈现每种磷酸肽的单倍型。
[0514]
根据实施例2描述的方法合成磷酸肽。
[0515]
将测定法用于评估肽与hla分子的结合。将与链霉亲和素缀合的供体珠粒和与抗人hla i类抗体w6/32缀合的受体珠粒用于评估肽结合。将生物素酰化的hla(a*02:01、b*07:02、c*07:01或c*07:02)与固定过量的β2m混合,并将混合物添加到384孔微孔板的每个孔中。将合成的磷酸肽的连续稀释液添加至孔中,并将所得的hla/β2/肽混合物在18℃下温育过夜。随后将w6/32缀合的受体珠粒添加至孔中,并将混合物在21℃下温育1小时。然后将链霉亲和素缀合的供体珠粒添加至孔中,并将混合物在21℃下再温育1小时。
[0516]
使用读板器读取微孔板,并使用michaelis-menten方程绘制数据以确定每种磷酸肽的kd。
[0517]
表5列出了每个选定的磷酸肽与指定的hla(a*02:01、b*07:02、c*07:01或c*07:02)结合的kd。nt表示未测试到结合。nb表示未检测到结合。lb代表低结合,表示虽然观察到一些结合,但是低于允许准确计算kd的水平。在每种情况下,磷酸肽结合如下文所示。
[0518]
表5:所选的磷酸肽的hla结合特征
[0519][0520]
本发明在范围上不受本文所述的具体实施方案的限制。实际上,根据上述说明和附图,除所述的那些修改之外,本文公开的各种修改对于本领域技术人员来说将是显而易见的。此类修改旨在落在所附权利要求的范围内。
[0521]
本文引用的所有参考文献(例如,出版物或专利或专利申请)以引用的方式整体并入本文并且用于所有目的,达到如同每个单独的参考文献(例如,出版物或专利或专利申请)被具体和单独指出一样以引用的方式整体并入用于所有目的的相同程度。其他实施方案在以下权利要求范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
