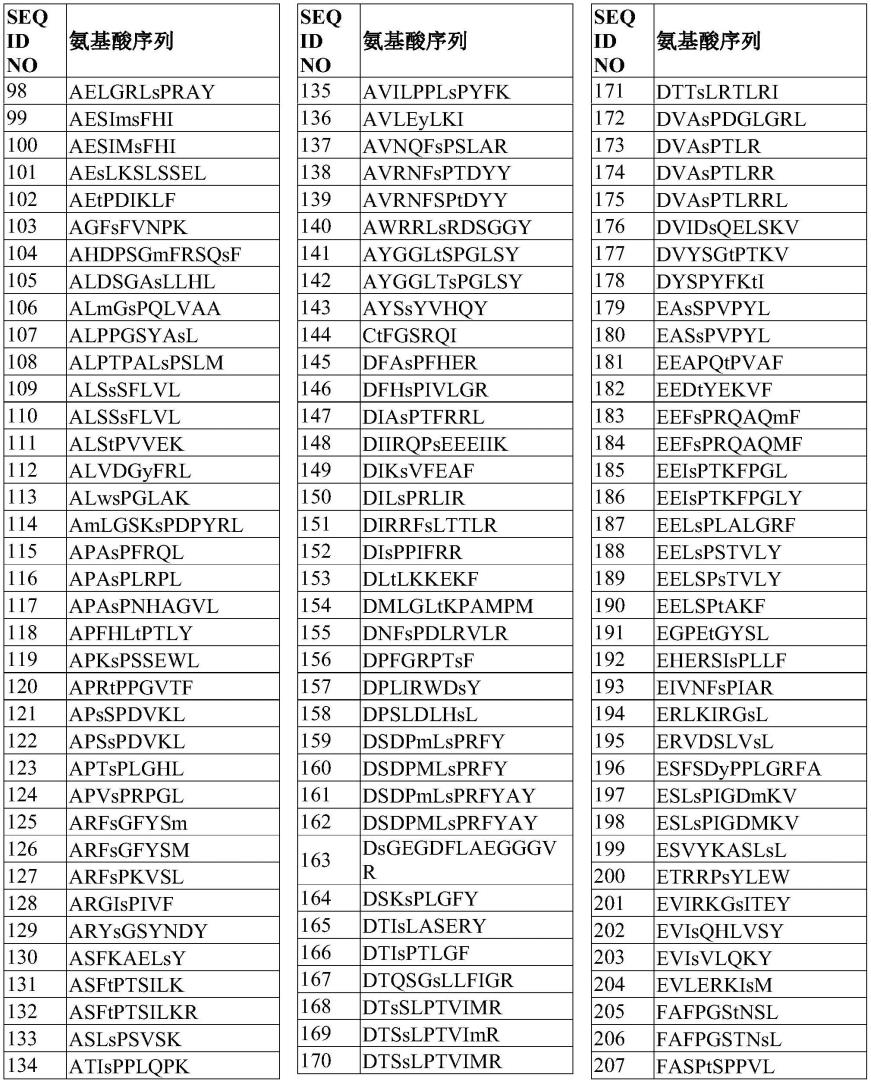
新型抗cldn18.2抗体
技术领域:
:1.本公开总体上涉及与人cldn18.2特异性结合的新型抗cldn18.2抗体。
背景技术:
::2.claudin-18(cldn18)分子(genbank登录号:剪接变体1(cldn18a1或cldn18.1):np_057453、nm_016369和剪接变体2(cldn18a2或cldn18.2):nm_001002026、np_001002026)是具有分子量约为27.9/27.72kd的整合跨膜蛋白。cldn18蛋白位于上皮和内皮的紧密连接内,其在相邻细胞之间组织膜内颗粒互连链的网络。cldn18和闭合蛋白是紧密连接中最突出的跨膜蛋白成分。由于其紧密的细胞间粘附特性,这些紧密连接蛋白质可形成主要屏障,以防止和控制溶质的细胞旁转运,并限制膜脂和蛋白质的横向扩散,以维持细胞极性。因此,它们在组织上皮组织结构中起关键作用。3.cldn18是四跨膜蛋白家族的成员,具有4个疏水区。cldn18显示了几种不同的构象,可以通过抗体选择性地对其进行处理(参见sahinu,koslowskim,dhaenek等人,claudin-18splicevariant2isapan-cancertargetsuitablefortherapeuticantibodydevelopment[j].clinicalcancerresearch,2008,14(23):7624-7634)。如针对绝大多数cldn家族成员所述,cldn18-构象-1的所有四个疏水区域均作为跨膜结构域(tm),并形成两个细胞外环(被疏水区1和疏水区2包围的第1环;被疏水区3和4包围的第2环)。第二构象(cldn18-构象-2)意味着,如针对pmp22所述,第二和第三疏水区未完全穿过质膜,因此第一和第四跨膜结构域之间的部分(d3环)位于细胞外。第三构象(cldn18-构象-3)显示了具有两个内部疏水区的很大的胞外结构域,其被第一和第四疏水区包围。由于d3环中具有典型的n-糖基化位点,因此cldn-18拓扑变体cldn18拓扑-2和cldn18拓扑-3包含额外的细胞外n-糖基化位点。[0004]cldn18具有两种不同的剪接变体,其在小鼠和人中均存在。剪接变体cldn18.1和cldn18.2在包含第一个tm和第1环的n端处的前21个氨基酸不同,而c端的蛋白序列相同(参见niimit,nagashimak,wardjm等人,claudin-18,anoveldownstreamtargetgeneforthet/ebp/nkx2.1homeodomaintranscriptionfactor,encodeslung-andstomach-specificisoformsthroughalternativesplicing[j].molecularandcellularbiology,2001,21(21):7380-7390)。[0005]cldn18.1在正常的肺和胃的上皮细胞上选择性表达,而cldn18.2仅在胃细胞上表达。最重要的是,cldn18.2的表达仅限于胃上皮细胞的分化后的短寿细胞中,但不在胃部干细胞区域表达。使用灵敏的rt-pcr,在任何其他正常人体器官中都无法检测到这两种变体。但是,它们在几种癌症类型中(包括胃癌、食道癌、胰腺癌和肺癌以及人癌细胞系)高表达(参见matsuday,sembas,uedaj等人,gastricandintestinalclaudinexpressionattheinvasivefrontofgastriccarcinoma[j].cancerscience,2007,98(7):1014-1019)。[0006]迫切需要可用于治疗cldn18.2表达呈阳性的疾病(例如癌症)的新型抗cldn18.2100%、60-100%、70-100%、80-100%、90-100%、40-90%、50-90%、60-90%、70-90%、80-90%、40-80%、40-70%、40-60%、40-50%、50-80%、50-70%、50-60%、60-80%、60-70%、或70-80%)的细胞为阳性染色的水平表达人cldn18.2;所述人cldn18.2中等表达细胞以如通过ihc所测定的至少1 且低于2 的强度和以ihc中至少30%(或至少35%)但低于40%的细胞为阳性染色的水平表达人cldn18.2;所述人cldn18.2低表达细胞以如通过ihc所测定的高于0但低于1 的强度和以ihc中高于0但低于30%(例如5%、10%、15%、20%、25%、5-25%、10-25%、15-25%、20-25%、5-20%、5-15%、5-10%、10-20%、或10-15%)的细胞为阳性染色的水平表达人cldn18.2。[0019]在某些实施方式中,与nugc4细胞结合的ec50值不超过70μg/ml(或不超过65、60、55、50、45、40、35、30、25、20、15、12或10μg/ml)。[0020]在某些实施方式中,如通过adcc报告基因分析所测定的,所述nugc4细胞上的adcc的ec50值不超过2μg/ml(或不超过1.9、1.8、1.7、1.6、1.5、1.4、1.3、1.2、1.1、1.0、0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2或0.1μg/ml)。[0021]在一个方面,本公开提供了一种分离的抗体或其抗原结合片段,其能够与人cldn18.2特异性结合并具有至少一个以下特征:[0022]a)如通过kinexa分析所测定的,以不超过imab362的80%、70%、60%、50%、40%、30%、20%、15%的kd值与人cldn18.2结合;[0023]b)如通过流式细胞术分析所测定的,以不超过imab362的80%、70%、60%、50%、40%、30%、20%、15%或10%的ec50值与表达人或小鼠cldn18.2的细胞结合;[0024]c)如通过细胞毒性分析所测定的,以不超过imab362的80%、70%、60%、50%、40%、30%、20%、10%或5%的ec50值在表达人cldn18.2的细胞上诱导补体依赖的细胞毒性(cdc);以及[0025]d)如通过adcc报告基因分析所测定的,以不超过imab362的80%、70%、60%、50%、40%、30%、20%、10%、5%或1%的ec50值在表达人cldn18.2的细胞上诱导抗体依赖的细胞毒性(adcc);[0026]其中imab362是包含重链可变区和轻链可变区的抗体,所述重链可变区包含如seqidno:72所示的氨基酸序列,所述轻链可变区包含如seqidno:73所示的氨基酸序列。[0027]在某些实施方式中,所述细胞包含nugc4细胞、snu-620细胞、snu-601细胞、katoiii细胞、或细胞系,所述细胞系具有与nugc4细胞、snu-620细胞、snu-601细胞、katoiii细胞相当的或不超过上述细胞的人cldn18.2蛋白表达水平。在某些实施方式中,所述细胞包含人cldn18.2高表达细胞、人cldn18.2中等表达细胞、或人cldn18.2低表达细胞。[0028]在某些实施方式中,所述人cldn18.2高表达细胞以如通过ihc所测定的至少2 的强度和以ihc中至少40%(例如,至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、40-100%、50-100%、60-100%、70-100%、80-100%、90-100%、40-90%、50-90%、60-90%、70-90%、80-90%、40-80%、40-70%、40-60%、40-50%、50-80%、50-70%、50-60%、60-80%、60-70%、或70-80%)的细胞为阳性染色的水平表达人cldn18.2;所述人cldn18.2中等表达细胞以如通过ihc所测定的至少1 且低于2 的强度和以ihc中至少30%(或至少35%)但低于40%的细胞为阳性染色的水平表达人cldn18.2;所述人cldn18.2低表达细胞以如通过ihc所测定的高于0但低于1 的强度和以ihc中高于0但低于30%(例如5%、10%、15%、20%、25%、5-25%、10-25%、15-25%、20-25%、5-20%、5-15%、5-10%、10-20%、或10-15%)的细胞为阳性染色的水平表达人cldn18.2。[0029]在某些实施方式中,所述分离的抗体或其抗原结合片段能够与表位结合,所述表位包含如seqidno:30所示的氨基酸序列中d28、w30、v43、n45、y46、l49、w50、r51、r55、e56、f60、e62、y66、l72、l76、v79和r80位处的至少一个、两个或三个氨基酸残基。在某些实施方式中,所述表位包含在e56位处的氨基酸残基。在某些实施方式中,所述表位不含有至少一个以下残基:a42或n45。在某些实施方式中,所述表位包含在w30、l49、w50、r55和e56位处的氨基酸残基。在某些实施方式中,所述表位进一步包含t41、n45、y46、r51、f60、e62和r80中的一个或多个氨基酸残基。在某些实施方式中,所述表位进一步包含d28、v43、n45、y46、y66、l72、l76和v79中的一个或多个氨基酸残基。[0030]在一个方面,本公开提供了一种抗cldn18.2抗体或其抗原结合片段,其包含重链hcdr1、hcdr2和hcdr3和/或轻链lcdr1、lcdr2和lcdr3序列,其中:[0031]所述hcdr1序列包含gynmn(seqidno:1)或tyfigvg(seqidno:13),或与其具有至少80%序列同一性的同源序列;[0032]所述hcdr2序列包含x1idpyyx2x3tx4ynqkfx5g(seqidno:32)或hiwwndnkyyntalks(seqidno:15),或与其具有至少80%(或至少85%、90%、95%)序列同一性的同源序列;[0033]所述hcdr3序列包含x6x7x8gnafdy(seqidno:33)或mgsgawfty(seqidno:17),或与其具有至少80%序列同一性的同源序列;[0034]所述lcdr1序列包含kssqx9lx10nx11gnx12knylt(seqidno:34),或与其具有至少80%(或至少85%、90%、95%)序列同一性的同源序列;[0035]所述lcdr2序列包含wastrx13s(seqidno:35),或与其具有至少80%序列同一性的同源序列;[0036]所述lcdr3序列包含qndyx14x15px16t(seqidno:36),或与其具有至少80%序列同一性的同源序列;[0037]其中x1是n或y或h,x2是g或v,x3是a或g或t,x4是r或t或s,x5是k或r,x6是s或m,x7是y或f,x8是y或h,x9是s或n,x10是l或f,x11是s或n,x12是q或l,x13是e或k,x14是s或y,x15是f或y,且x16是f或l。[0038]在一个方面,本公开提供了一种抗cldn18.2抗体或其抗原结合片段,其中所述重链可变区包含:[0039]a)hcdr1包含选自seqidno:1和seqidno:13的序列,[0040]b)hcdr2包含选自seqidno:3、seqidno:7、seqidno:9、seqidno:15、seqidno:19和seqidno:22的序列,以及[0041]c)hcdr3包含选自seqidno:5、seqidno:11、seqidno:17和seqidno:21的序列,[0042]和/或[0043]轻链可变区包含:[0044]d)lcdr1包含如seqidno:2、seqidno:10、seqidno:14和seqidno:20所示的序列,[0045]e)lcdr2包含如seqidno:4和seqidno:16所示的序列,以及[0046]f)lcdr3包含选自seqidno:6、seqidno:8、seqidno:12和seqidno:18的序列。[0047]在某些实施方式中,本文提供的所述抗体或其抗原结合片段,其中所述重链可变区选自下组:[0048]a)包含hcdr1、hcdr2和hcdr3的重链可变区,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:3所示的序列,所述hcdr3包含如seqidno:5所示的序列;[0049]b)包含hcdr1、hcdr2和hcdr3的重链可变区,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:7所示的序列,所述hcdr3包含如seqidno:5所示的序列;[0050]c)包含hcdr1、hcdr2和hcdr3的重链可变区,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:9所示的序列,所述hcdr3包含如seqidno:11所示的序列;[0051]d)包含hcdr1、hcdr2和hcdr3的重链可变区,所述hcdr1包含如seqidno:13所示的序列,所述hcdr2包含如seqidno:15所示的序列,所述hcdr3包含如seqidno:17所示的序列;[0052]e)包含hcdr1、hcdr2和hcdr3的重链可变区,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:19所示的序列,所述hcdr3包含如seqidno:21所示的序列;以及[0053]f)包含hcdr1、hcdr2和hcdr3的重链可变区,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:22所示的序列,所述hcdr3包含如seqidno:5所示的序列。[0054]在某些实施方式中,本文提供的所述抗体或其抗原结合片段,其中所述轻链可变区选自下组:[0055]a)包含lcdr1、lcdr2和lcdr3的轻链可变区,所述lcdr1包含如seqidno:2所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:6所示的序列;[0056]b)包含lcdr1、lcdr2和lcdr3的轻链可变区,所述lcdr1包含如seqidno:2所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:8所示的序列;[0057]c)包含lcdr1、lcdr2和lcdr3的轻链可变区,所述lcdr1包含如seqidno:10所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:6所示的序列;[0058]d)包含lcdr1、lcdr2和lcdr3的轻链可变区,所述lcdr1包含如seqidno:2所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:12所示的序列;[0059]e)包含lcdr1、lcdr2和lcdr3的轻链可变区,所述lcdr1包含如seqidno:14所示的序列,所述lcdr2包含如seqidno:16所示的序列,所述lcdr3包含如seqidno:18所示的序列;[0060]f)包含lcdr1、lcdr2和lcdr3的轻链可变区,所述lcdr1包含如seqidno:20所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:6所示的序列。[0061]在某些实施方式中,本文提供的所述抗体或其抗原结合片段,其中:[0062]a)所述重链可变区包含hcdr1、hcdr2和hcdr3,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:3所示的序列,所述hcdr3包含如seqidno:5所示的序列;并且,所述轻链可变区包含lcdr1、lcdr2和lcdr3,所述lcdr1包含如seqidno:2所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:6所示的序列;[0063]b)所述重链可变区包含hcdr1、hcdr2和hcdr3,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:7所示的序列,所述hcdr3包含如seqidno:5所示的序列;并且,所述轻链可变区包含lcdr1、lcdr2和lcdr3,所述lcdr1包含如seqidno:2所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:8所示的序列;[0064]c)所述重链可变区包含hcdr1、hcdr2和hcdr3,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:9所示的序列,所述hcdr3包含如seqidno:11所示的序列;并且,所述轻链可变区包含lcdr1、lcdr2和lcdr3,所述lcdr1包含如seqidno:10所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:6所示的序列;[0065]d)所述重链可变区包含hcdr1、hcdr2和hcdr3,所述hcdr1包含如seqidno:13所示的序列,所述hcdr2包含如seqidno:15所示的序列,所述hcdr3包含如seqidno:17所示的序列;并且,所述轻链可变区包含lcdr1、lcdr2和lcdr3,所述lcdr1包含如seqidno:2所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:12所示的序列;[0066]e)所述重链可变区包含hcdr1、hcdr2和hcdr3,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:19所示的序列,所述hcdr3包含如seqidno:21所示的序列;并且,所述轻链可变区包含lcdr1、lcdr2和lcdr3,所述lcdr1包含如seqidno:14所示的序列,所述lcdr2包含如seqidno:16所示的序列,所述lcdr3包含如seqidno:18所示的序列;或者[0067]f)所述重链可变区包含hcdr1、hcdr2和hcdr3,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:22所示的序列,所述hcdr3包含如seqidno:5所示的序列;并且,所述轻链可变区包含lcdr1、lcdr2和lcdr3,所述lcdr1包含如seqidno:20所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:6所示的序列。[0068]在某些实施方式中,其中所述重链可变区包含选自下组的序列:seqidno:25、seqidno:27、seqidno:29、seqidno:37、seqidno:39、seqidno:41、seqidno:43、seqidno:45和seqidno:47,和与上述序列具有至少80%(例如至少85%、90%、95%、96%、97%、98%或99%)序列同一性但仍保留与cldn18.2的特异性结合亲和力的同源序列。[0069]在某些实施方式中,其中所述轻链可变区包含选自下组的序列:seqidno:26、seqidno:28、seqidno:38、seqidno:40、seqidno:42、seqidno:44、seqidno:46和seqidno:48,和与上述序列具有至少80%(例如至少85%、90%、95%、96%、97%、98%或99%)序列同一性但仍保留与cldn18.2的特异性结合亲和力的同源序列。[0070]在某些实施方式中,本文提供的所述抗体或其抗原结合片段,其中,[0071]a)所述重链可变区包含如seqidno:23所示的序列,并且所述轻链可变区包含如seqidno:24所示的序列;[0072]b)所述重链可变区包含如seqidno:25所示的序列,并且所述轻链可变区包含如seqidno:26所示的序列;[0073]c)所述重链可变区包含如seqidno:27所示的序列,并且所述轻链可变区包含如seqidno:28所示的序列;[0074]d)所述重链可变区包含如seqidno:29所示的序列,并且所述轻链可变区包含如seqidno:26或28所示的序列;[0075]e)所述重链可变区包含如seqidno:37所示的序列,并且所述轻链可变区包含如seqidno:38所示的序列;[0076]f)所述重链可变区包含如seqidno:39所示的序列,并且所述轻链可变区包含如seqidno:40所示的序列;[0077]g)所述重链可变区包含如seqidno:41所示的序列,并且所述轻链可变区包含如seqidno:42所示的序列;[0078]h)所述重链可变区包含如seqidno:43所示的序列,并且所述轻链可变区包含如seqidno:44所示的序列;[0079]i)所述重链可变区包含如seqidno:45所示的序列,并且所述轻链可变区包含如seqidno:46所示的序列;或者[0080]j)所述重链可变区包含如seqidno:47所示的序列,并且所述轻链可变区包含如seqidno:48所示的序列。[0081]在某些实施方式中,本文提供的所述抗cldn18.2抗体或其抗原结合片段进一步包含一个或多个重链hfr1、hfr2、hfr3和hfr4,和/或一个或多个轻链lfr1、lfr2、lfr3和lfr4,其中:[0082]所述hfr1包含qvqlvqsgaevkkpgasvkvsckasgyx17ft(seqidno:54)或与其具有至少80%(或至少85%、90%、95%)序列同一性的同源序列,[0083]所述hfr2包含wvx18qapgqglewx19g(seqidno:55)或与其具有至少80%(或至少90%)序列同一性的同源序列,[0084]所述hfr3序列包含rvtx20tidkststvymelsslrsedtavyycar(seqidno:56)或与其具有至少80%(或至少85%、90%、95%)序列同一性的同源序列,[0085]所述hfr4包含wgqgttvtvss(seqidno:57)或与其具有至少80%序列同一性的同源序列,[0086]所述lfr1包含divmtqspdslavslgeratx21nc(seqidno:58)或与其具有至少80%(或至少85%、90%、95%)序列同一性的同源序列,[0087]所述lfr2包含wyqqkpgqppklliy(seqidno:59)或与其具有至少80%(或至少85%、90%)序列同一性的同源序列,[0088]所述lfr3包含gvpdrfx22gsgsgtdftltisslqaedvavyyc(seqidno:60)或与其具有至少80%(或至少85%、90%、95%)序列同一性的同源序列,以及[0089]所述lfr4包含fgggtkveik(seqidno:61)或与其具有至少80%(或至少90%)序列同一性的同源序列,[0090]其中x17是t或s,x18是r或k,x19是m或i,x20是m或l,x21是i或m,且x22是s或t。[0091]在某些实施方式中,[0092]所述hfr1包含选自下组的序列:seqidno:62和63,[0093]所述hfr2包含选自下组的序列:seqidno:64和65,[0094]所述hfr3包含选自下组的序列:seqidno:66和67,[0095]所述hfr4包含如seqidno:57所示的序列,[0096]所述lfr1包含选自下组的序列:seqidno:68和69,[0097]所述lfr2包含如seqidno:59所示的序列,[0098]所述lfr3包含选自下组的序列:seqidno:70和71,以及[0099]所述lfr4包含如seqidno:61所示的序列。[0100]在某些实施方式中,本文提供的所述抗体或其抗原结合片段,其进一步包含一个或多个氨基酸残基取代或修饰但仍保留与cldn18.2的特异性结合亲和力。在某些实施方式中,至少一个所述取代或修饰是在一个或多个cdr序列中,和/或在一个或多个所述vh或vl序列的非cdr区域中。[0101]在某些实施方式中,所述抗体与表位结合,所述表位包含具有如seqidno:30所示的氨基酸序列的人cldn18.2的d28、w30、v43、n45、y46、l49、w50、r51、r55、e56、f60、e62、y66、l72、l76、v79和r80位处的至少一个、两个或三个氨基酸残基。[0102]在某些实施方式中,所述抗体或其抗原结合片段包含免疫球蛋白恒定区,可选地人ig的恒定区,或可选地人igg的恒定区。在某些实施方式中,所述恒定区包含人igg1、igg2、igg3或igg4的恒定区。在某些实施方式中,所述人igg1的恒定区包含seqidno:49或与其具有至少80%(例如至少85%、90%、95%、96%、97%、98%或99%)序列同一性的同源序列。[0103]在某些实施方式中,所述恒定区包含一个或多个氨基酸残基取代或修饰,所述氨基酸残基取代或修饰导致了相对于野生型恒定区增加的cdc或adcc。在某些实施方式中,所述恒定区包含针对seqidno:49中的一个或多个氨基酸残基取代,所述取代选自下组:l235v、f243l、r292p、y300l、p396l或其任何组合。在某些实施方式中,所述恒定区包含如seqidno:51所示的序列。[0104]在某些实施方式中,所述抗体或其抗原结合片段是非岩藻糖基化的。[0105]在某些实施方式中,所述抗体或其抗原结合片段是人源化的。在某些实施方式中,所述抗体或其抗原结合片段为骆驼化单域抗体(camelizedsingledomainantibody)、双功能抗体(diabody)、scfv、scfv二聚体、bsfv、dsfv、(dsfv)2、fv片段、fab、fab'、f(ab')2、二硫键稳定的双功能抗体(dsdiabody)、纳米抗体、域抗体或双价域抗体。[0106]在某些实施方式中,所述抗体或其抗原结合片段是双特异性的。在某些实施方式70%、或70-80%)的细胞为阳性染色的水平表达cldn18.2;所述cldn18.2中等表达癌细胞以如通过ihc所测定的至少1 且低于2 的强度和以ihc中至少30%(或至少35%)但低于40%的细胞为阳性染色的水平表达cldn18.2;并且所述cldn18.2低表达癌细胞以如通过ihc所测定的高于0但低于1 的强度和以ihc中高于0但低于30%(例如5%、10%、15%、20%、25%、5-25%、10-25%、15-25%、20-25%、5-20%、5-15%、5-10%、10-20%、或10-15%)的细胞为阳性染色的水平表达cldn18.2。[0116]在某些实施方式中,所述方法进一步包括施用治疗有效量的第二治疗剂。在某些实施方式中,所述疾病或病况是cldn18.2相关的疾病或病况。在某些实施方式中,所述疾病或病况是癌症,可选地为表达cldn18.2的癌症。[0117]在某些实施方式中,所述受试者是人。[0118]在某些实施方式中,所述施用是经由口服、鼻内、静脉内、皮下、舌下或肌内施用。[0119]在某些实施方式中,所述方法进一步包括施用治疗有效量的第二治疗剂。在某些实施方式中,所述第二治疗剂选自化疗剂、抗癌药、放射治疗、免疫治疗剂、抗血管生成剂、靶向治疗剂、细胞治疗剂、基因治疗剂、激素治疗剂或细胞因子。[0120]在一个方面,本公开提供了一种试剂盒,其包含本文提供的抗体或其抗原结合片段,以及第二治疗剂。[0121]在一个方面,本公开提供了在表达cldn18.2的细胞中调节cldn18.2活性的方法,所述方法包括将所述表达cldn18.2的细胞暴露于本文提供的所述抗体或其抗原结合片段。[0122]在一个方面,本公开提供了检测样品中cldn18.2的存在或含量的方法,所述方法包括将所述样品与本文提供的所述抗体或其抗原结合片段接触,以及确定所述样品中cldn18.2的存在或含量。[0123]在一个方面,本公开提供了在受试者中诊断cldn18.2相关的疾病或病况的方法,所述方法包括:a)将从所述受试者获得的样品与本文提供的所述抗体或其抗原结合片段接触;b)测定所述样品中cldn18.2的存在或含量;以及c)将所述cldn18.2的存在或含量与所述受试者中cldn18.2相关疾病或病况的存在或状态相关联。[0124]在一个方面,本公开提供了本文提供的所述抗体或其抗原结合片段在制备用于治疗受试者中cldn18.2相关疾病或病况的药物中的用途。[0125]在一个方面,本公开提供了本文提供的所述抗体或其抗原结合片段在制备用于诊断cldn18.2相关疾病或病况的诊断试剂中的用途。[0126]在一个方面,本公开提供了一种用于检测cldn18.2的试剂盒,其包括本文提供的所述抗体或其抗原结合片段。[0127]在一个方面,本公开提供了一种嵌合抗原受体(car),其包含抗原结合结构域、跨膜结构域、共刺激信号传导区和tcr信号传导结构域,其中所述抗原结合结构域与cldn18.2特异性结合并且包含本文提供的其抗原结合片段。[0128]在某些实施方式中,所述抗原结合片段为fab或scfv。[0129]在某些实施方式中,所述car是双特异性的。在某些实施方式中,所述car能与cldn18.2上的第一表位,和第二表位特异性结合。在某些实施方式中,所述第二表位在cldn18.2上。在某些实施方式中,所述第二表位在不同于cldn18.2的第二个抗原上。在某些实施方式中,所述第二抗原包含肿瘤抗原。[0130]在一个方面,本公开提供了一种核酸序列,其编码本文提供的所述嵌合抗原受体(car)。在一个方面,本公开提供了一种细胞,其包含本文提供的所述核酸序列。在一个方面,本公开提供了一种经过基因修饰的细胞以表达所述car。[0131]在一个方面,本公开提供了一种载体,其包含本文提供的所述核酸序列。[0132]在一个方面,本公开提供了在哺乳动物中刺激t细胞介导的对表达cldn18.2的细胞或组织的免疫应答的方法,所述方法包括向所述哺乳动物施用有效量的经过基因修饰的细胞以表达本文提供的所述car。[0133]在一个方面,本公开提供了治疗具有cldn18.2相关疾病或病况的哺乳动物的方法,所述方法包括向所述哺乳动物施用有效量本文提供的所述细胞,从而治疗所述哺乳动物。[0134]在某些实施方式中,所述细胞是自体t细胞。在某些实施方式中,所述cldn18.2相关疾病或病况是癌症。在某些实施方式中,所述哺乳动物是人受试者。在某些实施方式中,所述哺乳动物被鉴定为具有表达cldn18.2的癌细胞,可选地,所述哺乳动物被鉴定为具有cldn18.2高表达癌细胞、cldn18.2中等表达癌细胞或cldn18.2低表达癌细胞。附图说明[0135]图1a是散点图,其显示了7c12、11f12、12e9和26g6对表达人cldn18.2的hek293-cldn18.2细胞的结合亲和力。图1b是散点图,其显示了59a9、18b10、7c12、12c12和11f12对hek293-cldn18.2细胞的结合亲和力。图1c是散点图,其显示了7c12、11f12、12e9和26g6对nugc4细胞的结合亲和力。图1d是散点图,其显示了59a9、18b10、7c12、12c12和11f12对nugc4细胞的结合亲和力。除非另有说明,否则在此以及在附图和实施例中描述的包含“cldn18.2”细胞系的名称是指人cldn18.2。小鼠cldn18.2的缩写为“mcldn18.2”。[0136]图2a是散点图,其显示了嵌合抗体7c12-c、11f12-c、12e9-c以约0.6μg/ml的ec50与hek293-cldn18.2细胞结合,26g6-c以约1μg/ml的ec50与hek293-cldn18.2细胞结合。图2b是散点图,其显示了抗体7c12-c、11f12-c、12e9-c和26g6-c的cdc效价比imab362高两倍以上。图2c是散点图,其显示了59a9-c的ec50(1.3μg/ml)比18b10-c(1.0μg/ml)略高。图2d是散点图,其显示了与imab362相比,抗体59a9-c和18b10-c的cdc效价高3倍以上。[0137]图3a是散点图,其显示了18b10-c以比imab362明显更高的亲和力与mkn45-cldn18.2-高表达细胞结合。图3b是散点图,其显示了使用mkn45-cldn18.2细胞,两条曲线表明18b10-c具有比imab362更佳的adcc活性。图3c是散点图,其显示了18b10-c以比imab362明显更高的亲和力与mkn45-cldn18.2-中等表达细胞结合。图3d是散点图,其显示了在mkn45-cldn18.2-中等表达细胞中,通过ec50测定,18b10-c的adcc效价比imab362高50倍以上。[0138]图4a是散点图,其显示了除了26g6-c外,4种嵌合抗体中的3种以约10μg/ml的ec50与nugc4细胞结合。图4b是散点图,其显示了7c12-c、11f12-c、12e9-c和26g6-c嵌合抗体针对nugc4细胞的adcc活性。图4c是散点图,其显示了18b10-c嵌合抗体以约10μg/ml的ec50与nugc4细胞结合,但不适用于59a9-c。图4d是散点图,其显示了在单独的实验中,59a9-c和18b10-c嵌合抗体分别针对nugc4细胞的adcc活性。[0139]图5是柱状图,其显示了18b10-c和imab362对表达cldn18.2或cldn18.1的hek293细胞的选择性结合。[0140]图6a和6b是散点图,其分别显示了当杂交瘤抗体18b10在mkn45-cldn18.2-高表达细胞上与10μg/ml的imab362竞争时和在mkn45-cldn18.2-高等表达细胞上与5μg/ml的18b10-c竞争时的结合亲和力。杂交瘤抗体18b10可以完全阻断imab362与mkn45-cldn18.2-高等表达细胞的结合。[0141]图7a-b是柱状图,其显示了使用表位鉴定的嵌合抗体与突变的hcldn18.2变体的结合信号。当e56突变为q时,18b10-c的结合完全丧失。这一变化也适用于除了59a9-c之外的imab362和其他嵌合抗体。其他氨基酸(例如a42、n45)也在一定程度上促进了imab362和其他抗体的结合,但对于18b10-c并非如此。[0142]图8a是散点图,其显示了所有人源化抗体变体及其嵌合对应抗体的结合能力。图8b是散点图,其显示了人源化抗体18b10-hala相较于imab362和对照hlgg1的结合能力。18b10-hala以比imab362更佳的效价和更高的mfi与小鼠cldn18.2良好结合。[0143]图9是散点图,其显示了人源化抗体18b10-hala对hek293-cldn18.2的cdc作用。18b10-hala的cdc活性比imab362高20倍以上。[0144]图10a是散点图,其显示了18b10的人源化抗体变体相较于嵌合18b10对表达中等水平cldn18.2蛋白的mkn45细胞(mkn45-cldn18.2-中)的结合亲和力。18b10的所有人源化抗体变体均以与嵌合18b10相当的亲和力与mkn45-cldn18.2-中等表达细胞结合。图10b是散点图,其显示了在mkn45-cldn-18.2中等表达细胞上的18b10-hala和imab362的adcc报告基因分析。18b10-hala的ec50(0.05μg/ml)比imab362低得多,与嵌合18b10一致。[0145]图11a是散点图,其显示了18b10-hala对nugc4细胞的结合亲和力的结果。图11b是散点图,其显示了与imab362相比18b10-hala的adcc作用。18b10-hala具有比imab362更佳的adcc效价。[0146]图12是散点图,其显示了使用pbmc(供体id:a18z017017)作为效应细胞的adcc分析结果。18b10-hala显示了比imab362更佳的adcc效价。[0147]图13a是柱状图,其显示了18b10-hala表位鉴定的结果(抗体浓度:10μg/ml)。图13b是柱状图,其显示了59a9-c表位鉴定的结果(抗体浓度:10μg/ml)。[0148]图14a是散点图,其显示了18b10-hala-vcmmae和imab362-vcmmae对hek293-cldn18.2细胞的adc细胞毒性。18b10-hala-vcmmae和imab362-vcmmae均诱导了对hek293-cldn18.2细胞的细胞毒性,但对照higg1-vcmmae没有诱导该毒性。图14b是散点图,其显示了18b10-hala-mmae和imab362-mmae对nugc-4的adc细胞毒性作用的结果。18b10-hala-vcmmae显示剂量依赖性细胞生长抑制作用始于0.03μg/ml的浓度,而imab362-vcmmae仅在10μg/ml(浓度高得多)抑制细胞生长。图14c是散点图,其显示了18b10-hala-mmae和imab362-mmae对mkn45-cldn18.2-高表达细胞的adc细胞毒性。18b10-hala-vcmmae达到86%的最大细胞杀伤率,也高于imab362(60%)。[0149]图15是散点图,其显示了同种型对照、imab362和18b10-hala的肿瘤体积相对于时间的变化。如通过肿瘤大小和tgi(肿瘤生长抑制)所测定的,18b10-hala显示出比imab362或同种型对照明显更佳的抗肿瘤活性。[0150]图16是散点图,其分别显示了模型组(无pbmc)、同种型对照、18b10-hala3mg/kg(mpk)和18b10-hala10mpk的肿瘤体积相对于时间的变化。相对于同种型对照或pbmc对照,无论3mpk还是10mpk的18b10-hala对肿瘤生长均具有明显抑制作用。[0151]图17是散点图,其分别示出了同种型对照、18b10-hala0.1mpk、18b10-hala0.3mpk和18b10-hala1mpk的肿瘤体积相对于时间的变化。结果表明18b10-hala的抗肿瘤活性是剂量依赖性的。[0152]图18a-i是散点图,其显示了18b10-halahigg1与hfcγri-his、hfcγriib-his、hfcγriiia(f176)-his、hfcγriiia(v176)-his、小鼠fcγri-his、小鼠fcγriib-his、小鼠fcγriiia-his、fcγriv-his和食蟹猴fcγriii-his、小鼠fcγrllla-his、fcγrlv-his和食蟹猴fcγrlll-his结合。18b10-hala_vlpyll和18b10-hala-wt在与人fcγri或fcγriib的结合上没有明显差异。但是,与野生型(wt)相比,18b10-hala_vlpyll显示与人fcγriiia(f176)和fcγriiia(v176)的结合提高了10倍。小鼠fcγrs和食蟹猴fcγrs显示了相似的结果。[0153]图19a-19b是散点图,其分别显示了18b10halahlgg1对hufcrn-生物素和人c1q的结合亲和力。图19a中的结果表明18b10-hala_vlpyll和18b10-halawt之间在fcrn结合上没有明显差异。图19b中的结果表明,在较低的c1q浓度下,18b10-hala_vlpyll的结合信号略佳于18b10-halawt。[0154]图20a是散点图,其显示了使用jurkat-nfat-luc-fcγriiia-v176作为效应细胞的在nugc-4(e/t比=6:1)上的18b10-halahlgg1报告基因分析的结果。与18b10-halawt(ec50~0.032μg/ml)相比,18b10-hala-vlpyll的adcc效价(ec50~0.0097μg/ml)提高了3倍。图20b是散点图,其显示了使用pbmc(供体id:a18z017017)作为效应细胞的nugc-4adcc分析的结果。与18b10-halawt相比,18b10-hala-vlpyll的adcc效价提高了3倍;与imab362相比,18b10-hala-vlpyll的adcc效价提高了100倍。[0155]图21显示了在不同胃癌细胞系中cldn18.2表达水平的比较。[0156]图22a至22d是散点图,其显示了具有不同cldn18.2表达水平的不同胃癌细胞系的adcc分析。[0157]图23是散点图,其显示了nugc4(e/t比=6:1)上的adcc报告基因分析的结果。使用添加50μm2f-o-f的工艺所产生的抗体与使用不添加2f-o-f的工艺所产生的参比样品相比,adcc活性提高了30倍以上,或者与imab362相比,adcc活性提高了1000倍以上。[0158]图24a-24c是散点图,其显示了使用18b10-hala低岩藻糖的不同胃癌细胞系的facs结合。[0159]图25a-25e是散点图,其显示了使用18b10-hala低岩藻糖在不同胃癌细胞系上的adcc报告基因分析的结果。[0160]图26a-26d是散点图,其显示了使用pbmc(供体id:a19028011)作为效应细胞和18b10-hala的50μm2f-o-f样品,在不同胃癌细胞系上的adcc分析的结果。[0161]图27显示了在nugc-4细胞上的adcc分析中18b10-hala低岩藻糖的特异性细胞毒性。[0162]图28a至28b显示了在mkn45-cldn18.2-高表达细胞和hpbmc共接种异种移植肿瘤模型中不同剂量的18b10-hala低岩藻糖的肿瘤生长抑制。[0163]图29显示了在mkn45-cldn18.2-高表达细胞肿瘤模型上18b10-hala低岩藻糖与奥沙利铂(oxaliplatin)和5-fu联用的肿瘤生长抑制。[0164]图30a和30b显示了在mkn45-cldn18.2-高报道基因异种移植肿瘤模型中抗体的肿瘤生长抑制。[0165]图31a、31b和31c显示了在裸鼠的gc02-0004pdx肿瘤模型中,18b10-hala低岩藻糖与紫杉醇(paclitaxel)联用的疗效。[0166]图31d和31e显示了在gc02-0004pdx肿瘤模型中抗体的肿瘤生长抑制。[0167]图32显示了mkn45-cldn18.2异种移植模型中抗体的肿瘤生长抑制(tgi)。[0168]图33a和33b显示了使用18b10-hala低岩藻糖的与胰腺癌细胞系的facs结合。[0169]图34a和34b显示了使用jurkat-nfat-luc-fcγriiia-v176作为效应细胞在胰腺癌细胞系上的adcc报告基因分析。[0170]图35显示了在miapaca-2-cldn18.2异种移植模型中的抗体的肿瘤生长抑制(tgi)。[0171]图36显示了在bxpc-3-cldn18.2异种移植模型中抗体的肿瘤生长抑制(tgi)。[0172]图37a和37b显示了使用18b10-hala低岩藻糖的与肺癌细胞系的facs结合。[0173]图38显示了使用jurkat-nfat-luc-fcγriiia-v176作为效应细胞在nci-h146上的adcc报告基因分析。[0174]图39显示了使用pbmc作为效应细胞在nci-h460-cldn18.2上的adcc分析。[0175]图40a和40b显示了在nci-h146和pbmc共接种模型中抗体的肿瘤生长抑制(tgi)。[0176]图41显示了在nci-h460-cldn18.2肿瘤模型中的抗体的肿瘤生长抑制(tgi)。[0177]图42显示了使用18b10-hala低岩藻糖的与结肠癌细胞系的facs结合。[0178]图43显示了使用jurkat-nfat-luc-fcγriiia-v176作为效应细胞在结肠癌细胞系上的adcc报告基因分析。[0179]发明详述[0180]本公开的以下描述只为说明本公开的各种实施方式。因此,所讨论的具体修改方式不应理解为对公开范围的限制。在不偏离本公开范围的情况下,作出各种等同方式、变化和修改对本领域技术人员而言是显而易见的,并且应当理解,这样的等同实施方式包括在本文的范围内。在本公开中引用的所有参考文献,包括公开出版物、专利和专利申请都通过引用的方式全文并入。[0181]定义[0182]如本文使用的,本发明上下文中(尤其是在权利要求书的上下文中)所使用的术语“一种(a)”、“一个(an)”、“所述(the)”和类似术语,除非本文另外指出或与上下文明显矛盾,否则应被解释为涵盖单数形式和复数形式。[0183]本发明中的术语“抗体”包括任何可结合某特定抗原的免疫球蛋白、单克隆抗体、多克隆抗体、多价抗体、双价抗体、单价抗体、多特异性抗体或双特异性抗体。一个天然的完整抗体包含两条重(h)链和两条轻(l)链。哺乳动物的重链可分为α、δ、ε、γ和μ,每条重链由一个可变区(vh)以及第一、第二和第三恒定区(分别为ch1、ch2、ch3)组成;哺乳动物的轻链可分为λ或κ,而每条轻链由一个可变区(vl)以及一个恒定区组成。抗体呈“y”型,“y”型结构的茎部由通过二硫键结合的两条重链的第二和第三恒定区组成。“y”型结构的每条臂包括与单条轻链的可变区和恒定区结合的单条重链的可变区和第一恒定区。轻链和重链的可变区决定抗原的结合。每条链的可变区通常含有三个高变区,称互补决定区(cdr)(轻链cdr包含lcdr1、lcdr2、lcdr3,重链cdr包含hcdr1、hcdr2、hcdr3)。本发明中公开的抗体和抗原结合结构域的cdr边界可通过kabat、imgt、abm、chothia或al-lazikani命名法命名或识别(al-lazikani,b.,chothia,c.,lesk,a.m.,j.mol.biol.,273(4),927(1997);chothia,c.等人,jmolbiol.dec5;186(3):651-63(1985);chothia,c.和lesk,a.m.,j.mol.biol.,196,901(1987);n.r.whitelegg等人,proteinengineering,v13(12),819-824(2000);chothia,c.等人,nature.dec21-28;342(6252):877-83(1989);kabate.a.等人,nationalinstitutesofhealth,bethesda,md.(1991);marie-paulelefranc等人,developmentalandcomparativeimmunology,27:55-77(2003);marie-paulelefranc等人,immunomeresearch,1(3),(2005);marie-paulelefranc,molecularbiologyofbcells(第二版),chapter26,481-514,(2015))。三个cdr由被称为框架区(fr)的侧翼部分间隔开,框架区比cdr更加高度保守,并形成一个支架支撑高变环。重链和轻链的恒定区与抗原结合无关,但具有多种效应功能。抗体依据其重链恒定区的氨基酸序列可以分成几类。根据是否含有α、δ、ε、γ和μ重链,抗体可分别分为五个主要的分类或同种型:iga、igd、ige、igg和igm。几个主要的抗体分类还可分为亚类,如igg1(γ1重链)、igg2(γ2重链)、igg3(γ3重链)、igg4(γ4重链)、iga1(α1重链)或iga2(α2重链)等。在某些实施方式中,本文提供的所述抗体包含其任何抗原结合片段。[0184]如本文使用的,术语“抗原结合片段”是指由含有一个或多个cdr的抗体的片段形成的抗体片段,或者与抗原结合但不具有完整的天然抗体结构的任何其他抗体部分。抗原结合片段的例子包括,但不限于,如双功能抗体(diabody)、fab、fab'、f(ab')2、fd、fv片段、二硫键稳定的fv片段(dsfv)、(dsfv)2、双特异性dsfv(dsfv-dsfv')、二硫键稳定的双功能抗体(dsdiabody)、单链抗体分子(scfv)、scfv二聚体(双价的双功能抗体)、多特异性抗体、骆驼化单域抗体(camelizedsingledomainantibody)、纳米抗体(nanobody)、域抗体(domainantibody)和双价域抗体(bivalentdomainantibody)。抗原结合片段能够与亲本抗体结合相同的抗原。在某些实施方式中,抗原结合片段可以包含来自特定人抗体的一个或多个cdr。[0185]关于抗体的“fab”是指抗体的单价抗原结合片段,其由单条轻链(包含可变区和恒定区)与单条重链的可变区和第一恒定区经二硫键结合起来组成的。“fab”可以在铰链区的重链之间二硫键的n-末端附近的残基处,通过对抗体进行木瓜蛋白酶消化来获得。[0186]“fab'”是指包含了部分铰链区的fab片段,其可以在铰链区重链之间二硫键c-末端附近的残基处通过对抗体进行胃蛋白酶消化而获得,因此其铰链区的少量残基(包含一个或多个半胱氨酸)不同于fab。[0187]“f(ab’)2”是指fab’的二聚体,其包含两条轻链和两条重链的一部分。[0188]关于抗体的“fc”是指由第一重链的第二和第三恒定区经由二硫键与第二重链的第二和第三恒定区结合组成的抗体的一部分。igg和igmfc区包含三个重链恒定区(每条链中的第二、第三和第四重链恒定区)。它可以通过木瓜蛋白酶消化抗体而获得。抗体的fc部分负责各种效应子功能,例如adcc、adcp和cdc,但在抗原结合中不起作用。[0189]关于抗体的“fv”是指携带完整抗原结合位点的抗体的最小片段。fv片段由单条轻链的可变区与单条重链的可变区结合组成。“dsfv”是指二硫键稳定的fv片段,其中单个轻链的可变区和单个重链的可变区之间的连接是二硫键。[0190]“单链fv抗体”或“scfv”是指由直接或通过肽接头序列相互连接的轻链可变区与重链可变区组成的工程化抗体(hustonjs等人,procnatlacadsciusa,85:5879(1988))。“scfv二聚体”是指包含具有接头的两个重链可变区和两个轻链可变区的单链。在某些实施方式中,“scfv二聚体”是双价的双功能抗体或双价scfv(bsfv),其包含与另一个vh-vl部分二聚化的vh-vl(通过肽接头连接),使得一个部分的vh与另一部分的vl配位并形成两个结合位点,它们可以靶向相同的抗原(或表位)或不同的抗原(或表位)。在其他实施方式中,“scfv二聚体”是双特异性双功能抗体,其包含vh1-vl2(通过肽接头连接)与vl1-vh2(也通过肽接头连接)相结合,使得vh1和vl1配位并且vh2和vl2配位且每个配位对具有不同的抗原特异性。[0191]“单链fv-fc抗体”或“scfv-fc”是指由与抗体的fc区连接的scfv组成的工程化抗体。[0192]“骆驼化单域抗体”、“重链抗体”、“纳米抗体”或“hcab”是指包含两个vh结构域且无轻链的抗体(riechmannl.和muyldermanss.,jimmunolmethods.dec10;231(1-2):25-38(1999);muyldermanss.,jbiotechnol.jun;74(4):277-302(2001);wo94/04678;wo94/25591;u.s.专利号6,005,079)。重链抗体最初来自骆驼科(骆驼、单峰骆驼和美洲驼)。尽管没有轻链,但骆驼抗体具有真正的抗原结合库(authenticantigen-bindingrepertoire)(hamers-castermanc.等人,nature.jun3;363(6428):446-8(1993);nguyenvk.等人,“heavy-chainantibodiesincamelidae;acaseofevolutionaryinnovation,”immunogenetics.apr;54(1):39-47(2002);nguyenvk.等人,immunology.may;109(1):93-101(2003))。重链抗体的可变结构域(vhh结构域)代表由适应性免疫应答产生的最小的已知抗原结合单元(koch-noltef.等人,fasebj.nov;21(13):3490-8.epub2007jun15(2007))。“双功能抗体”包含具有两个抗原结合位点的小抗体片段,其中所述片段包含在单个多肽链中连接到vl结构域的vh结构域(vh-vl或vl-vh)(参见例如,holligerp.等人,procnatlacadsciusa.jul15;90(14):6444-8(1993);ep404097;wo93/11161)。由于接头过短,同一条链上的两个结构域无法配对,因此,这些结构域被迫与另一条链的互补结构域配对,从而创建了两个抗原结合位点。抗原结合位点可以靶向相同或不同抗原(或表位)。[0193]“域抗体”是指仅包含重链的可变区或轻链的可变区的抗体片段。在某些实施方式中,两个或更多个vh结构域与肽接头共价连接以形成双价或多价结构域抗体。双价结构域抗体的两个vh结构域可以靶向相同或不同的抗原。[0194]在某些实施方式中,“(dsfv)2”包含三个肽链:通过肽接头连接并通过二硫键与两个vl部分结合的两个vh部分。[0195]在某些实施方式中,“双特异性ds双功能抗体”包含经由vh1和vl1之间的二硫键与vl1-vh2(通过肽接头连接)结合的vh1-vl2(也通过肽接头连接)。[0196]在某些实施方式中,“双特异性dsfv”或“dsfv-dsfv'”包含三个肽链:vh1-vh2部分,其中重链由肽接头(例如,长的柔性接头)结合并通过二硫键分别与vl1和vl2部分配对。每个二硫键配对的重链和轻链具有不同的抗原特异性。[0197]如本文所使用的,术语“人源化的”是指抗体或抗原结合片段,其包含源于非人动物的cdr、源于人的fr区、以及在适用的情况下,源于人的恒定区。在某些实施方式中,人源化cldn18.2抗体的可变区框架的氨基酸残基被取代以进行序列优化。在某些实施方式中,人源化cldn18.2抗体链的可变区框架序列与相应的人可变区框架序列至少65%、70%、75%、80%、85%、90%、95%或100%相同。[0198]如本文所使用的,术语“嵌合”是指抗体或抗原结合片段,其重链和/或轻链的一部分源于一个物种,而重链和/或轻链的其余部分源于不同的物种。在说明性实例中,嵌合抗体可包含源于人的恒定区和源于非人物种(例如,小鼠)的可变区。[0199]术语“种系序列”是指编码可变区氨基酸序列或子序列的核酸序列,与由种系免疫球蛋白可变区序列编码的所有其他已知的可变区氨基酸序列相比,其与参考可变区氨基酸序列或子序列具有最高确定的氨基酸序列同一性。与所有其他评估的可变区氨基酸序列相比,种系序列还可以指与参考可变区氨基酸序列或子序列具有最高氨基酸序列同一性的可变区氨基酸序列或子序列。种系序列可以仅是框架区、仅是互补决定区、框架和互补决定区、可变区段(如上所定义),或包含可变区的序列或子序列的其他组合。序列同一性可以使用本文描述的方法来确定,例如,使用blast、align或本领域已知的另一种比对算法比对两个序列。种系核酸或氨基酸序列可与参考可变区核酸或氨基酸序列具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性。种系序列可以例如通过公开可获得的国际immunogenetics数据库(imgt)和v-base确定。[0200]如本文所使用的,“抗cldn18.2抗体”或“针对cldn18.2的抗体”是指能够以足够的亲和力与cldn18.2(例如,人或非人cldn18.2)特异性结合的抗体,例如以提供诊断和/或治疗用途。[0201]如本文所使用的,术语“亲和力”是指免疫球蛋白分子(即抗体)或其片段和抗原之间的非共价相互作用的强度。[0202]如本文所使用的,术语“特异性结合”或“特异性地结合”是指两个分子之间,例如抗体和抗原之间的非随机结合反应。在某些实施方式中,本文提供的抗体或抗原结合片段以≤10-6m(例如,≤5x10-7m、≤2x10-7m、≤10-7m、≤5x10-8m、≤2x10-8m、≤10-8m、≤5x10-9m、≤4x10-9m、≤3x10-9m、≤2x10-9m、或≤10-9m的结合亲和力(kd))与人和/或非人cldn18.2特异性结合。本文所使用的kd是指解离率与结合率的比率(koff/kon),其可通过使用本领域已知的任何常规方法来确定,包括但不限于表面等离子体共振法、微尺度热泳法、hplc-ms法和流式细胞术(例如facs)法。在某些实施方式中,可以通过使用流式细胞术法适当地确定kd值。可以使用多种免疫分析形式来选择与特定蛋白质发生特异性免疫反应的抗体。例如,常规地使用固相elisa免疫分析来选择与蛋白质特异性免疫反应的抗体(参见,例如harlow&lane,usingantibodies,alaboratorymanual(1998),可用于确定特异性免疫反应性的免疫分析形式和条件的描述)。通常,特异性或选择性结合反应产生的信号是背景信号的至少两倍,更通常是背景信号的至少10至100倍。[0203]关于氨基酸序列(或核酸序列)的“序列同一性百分比(%)”定义为在比对序列并且(如有必要)引入缺口以实现最大对应性后,候选序列中与参考序列中氨基酸(或核酸)残基相同的氨基酸(或核酸)残基的百分比。例如,可以使用公开可获得的工具如blastn、blastp(可在美国国家生物技术信息中心(ncbi)的网站上获得,也参见altschuls.f.等人,j.mol.biol.,215:403–410(1990);stephenf.等人,nucleicacidsres.,25:3389–3402(1997)),clustalw2(可在欧洲生物信息学研究所的网站上获得,也参见higginsd.g.等人,methodsinenzymology,266:383-402(1996);larkinm.a.等人,bioinformatics(oxford,england),23(21):2947-8(2007))和align或megalign(dnastar)软件,来实现用于确定氨基酸(或核酸)序列同一性百分比的比对。本领域技术人员可以使用工具提供的默认参数,或者可以例如通过选择合适的算法来自定义适合比对的参数。在某些实施方式中,不完全相同的残基位置可以通过保守氨基酸取代而不同。“保守氨基酸取代”是指其中氨基酸残基被具有相似化学性质(例如,电荷或疏水性)的侧链(r基团)的另一个氨基酸残基取代。通常,保守的氨基酸取代基本上不会改变蛋白质的功能特性。如果两个或更多个氨基酸序列之间由于保守取代而彼此不同,可以向上调整相似性的百分比或程度以校正取代的保守性。进行这种调整的手段是本领域技术人员公知的(参见,例如pearson(1994)methodsmol.biol.24:307-331),其通过引用并入本文。[0204]如本文所使用的,“同源序列”和“同源性序列”可互换使用,并且是指当可选地比对时,与另一序列具有至少80%(例如,至少85%、88%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%)的序列同一性的多核苷酸序列(或其互补链)或氨基酸序列。[0205]“分离的”物质已从自然状态被人为改变。如果自然界出现了“分离的”成分或物质,则说明其已从其原始环境中被更改或去除,或两者均有。例如,天然存在于活体动物中的多核苷酸或多肽不是“分离的”,但是如果已经从天然状态的共存材料中充分分离以使其以基本纯净的状态存在,则该多核苷酸或多肽是“分离的”。分离的“核酸”或“多核苷酸”可互换使用,并且是指分离的核酸分子的序列。在某些实施方式中,“分离的抗体或其抗原结合片段”是指通过电泳方法(例如sds-page、等电聚焦、毛细管电泳)或色谱方法(例如离子交换色谱或反相hplc)测定的纯度至少为60%、70%、75%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的抗体或抗原结合片段。[0206]如本文所使用的,“阻断结合”或“竞争相同表位”的能力是指抗体或抗原结合片段以任何可检测的程度抑制两个分子之间(例如人cldn18.2和抗cldn18.2抗体)的结合作用的能力。在某些实施方式中,阻断两个分子之间结合的抗体或抗原结合片段将两个分子之间的结合作用抑制至少50%。在某些实施方式中,该抑制可大于60%、大于70%、大于80%或大于90%。[0207]如本文所使用的,术语“抗体药物缀合物”是指抗体或其抗原结合片段与另一种试剂(例如化疗剂、毒素、免疫治疗剂、成像探针等)的连接。连接可以是共价键,也可以是非共价相互作用(例如通过静电力)。为了形成抗体药物缀合物,可以使用本领域已知的各种接头。另外,抗体药物缀合物可以以融合蛋白的形式提供,所述融合蛋白可以从编码缀合物的多核苷酸表达而来。如本文所使用的,“融合蛋白”是指通过两个或更多个最初编码单独蛋白质(包含肽和多肽)的基因或基因片段的连接而产生的蛋白质。融合基因的翻译产生具有源于每个原始蛋白质的功能特性的单个蛋白质。[0208]术语“受试者”包括人和非人动物。非人动物包括所有脊椎动物,例如哺乳动物和非哺乳动物,例如非人灵长类、小鼠、大鼠、猫、兔、羊、狗、牛、鸡、两栖动物和爬行动物。除另有说明外,术语“患者”或“受试者”在本文中可互换使用。[0209]术语“抗肿瘤活性”是指肿瘤细胞增殖、生存力或转移活性的降低。例如,抗肿瘤活性可以通过在治疗期间出现的异常细胞生长速率的下降,或肿瘤尺寸稳定或减少,或由于治疗引起的与未进行治疗的对照相比更长的生存期来表明。可以使用可接受的体外或体内肿瘤模型,包括但不限于异种移植模型、同种异体移植模型、小鼠乳腺肿瘤病毒(mmtv)模型和本领域已知的研究抗肿瘤活性的其他模型,来评估这种活性。[0210]如本文所使用的,“效应子功能”或“抗体效应子功能”是指可归因于抗体的fc区与其效应子(例如c1复合物和fc受体)结合的生物学活性。示例性效应子功能包括:通过抗体和c1复合物上的c1q相互作用诱导的补体依赖性细胞毒性(cdc);通过抗体的fc区与效应细胞上的fc受体结合而诱导的抗体依赖性细胞介导的细胞毒性(adcc);和抗体依赖性细胞介导的吞噬作用(adcp),其中表达fcγrs的非特异性细胞毒性细胞识别靶细胞上结合的抗体,随后引起靶细胞的吞噬作用。效应子功能包括在结合抗原之后起作用的那些和独立于抗原结合而起作用的那些。[0211]本文所使用的病况的“治疗(treating)”或“治疗(treatment)”包括预防或减轻病况,减缓病况的发作或发展速度,降低发展病况的风险,预防或延迟与病况相关的症状的发展,减轻或消除与病况有关的症状,使病况完全或部分消退,治愈病况或其一些组合。[0212]如本文所使用的,术语“载体”是指可以将遗传因子可操作地插入其中以引起该遗传因子的表达(例如产生由该遗传因子编码的蛋白质、rna或dna)或复制遗传因子的载体。载体可用于转化、转导或转染宿主细胞,以使遗传因子在携带其的宿主细胞内表达。载体的实例包括质粒、噬菌粒、黏粒、人工染色体(例如,酵母菌人工染色体(yac)、细菌人工染色体(bac)、或p1来源的人工染色体(pac))、噬菌体(诸如λ噬菌体或m13噬菌体)和动物病毒。载体可包含多种用于控制表达的因子,包含启动子序列、转录起始序列、增强子序列、选择因子和报告基因。另外,载体可以包含复制起点。载体还可以包括有助于其进入细胞的材料,包含但不限于病毒颗粒、脂质体或蛋白质衣壳。载体可以是表达载体或克隆载体。本公开提供了载体(例如表达载体),其包含编码抗体或其抗原结合片段的本文提供的核酸序列,与该核酸序列可操作地连接的至少一个启动子(例如sv40、cmv,ef-1α),和至少一个选择标记。[0213]如本文所使用的,“宿主细胞”是指已向其中引入外源多核苷酸和/或载体的细胞。[0214]术语“cldn18.2”是指源于哺乳动物例如灵长类动物(例如人、猴)和啮齿动物(例如小鼠)的claudin-18剪接变体2。在某些实施方式中,cldn18.2是人cldn18.2。人cldn18.2的示例性序列包含人cldn18.2蛋白(ncbi参考序列号np_001002026.1,或seqidno:30)。cldn18.2的示例性序列包含小家鼠(小鼠)(musmusculus(mouse))cldn18.2蛋白(ncbi参考序列号np_001181852.1)、食蟹猴(食蟹猕猴)(macacafascicularis(crab-eatingmacaque))cldn18.2蛋白(ncbi参考序列号xp_015300615.1)。cldn18.2在癌细胞中表达。在一个实施方式中,所述cldn18.2在癌细胞表面上表达。[0215]术语“cldn18.1”是指源于哺乳动物例如灵长类动物(例如人、猴)和啮齿动物(例如小鼠)的claudin-18剪接变体1。在某些实施方式中,cldn18.1是人cldn18.1。人cldn18.1的示例性序列包含人cldn18.1蛋白(ncbi参考序列号np_057453.1或seqidno:31)、小家鼠(小鼠)cldn18.2蛋白(ncbi参考序列号np_001181851.1)、食蟹猴(食蟹猕猴)cldn18.2蛋白(ncbirefseqno.xp_005545920.1)。[0216]本文所使用的“cldn18.2相关的”疾病或病况是指由cldn18.2的表达或活性的增加或降低引起、加剧或与其相关联的任何疾病或病况。在一些实施方式中,cldn18.2相关病况是例如癌症。[0217]如本文所使用的,“癌症”是指以恶性细胞生长或肿瘤、异常增殖、浸润或转移为特征的任何医学病况,并且包含实体瘤和非实体癌(例如血液系统恶性肿瘤),例如白血病。如本文所使用的,“实体瘤”是指肿瘤和/或恶性细胞的实体块。术语“药学上可接受的”表示指定的载体、载剂、稀释剂、赋形剂和/或盐通常与构成该制剂的其他成分在化学和/或物理上相容,并且与其接受者在生理上相容。[0218]在本文中对“约”值或参数的引用包括(并描述)针对该值或参数本身的实施方式。例如,提及“约x”的描述包括“x”的描述。数值范围包括定义范围的数值。一般而言,术语“约”是指变量的指定值,以及在指定值的实验误差范围内(例如,平均值的95%置信区间内)或指定值的10%以内(以较大者为准)的变量的所有值。在时间段(年、月、周、天等)的上下文中使用术语“约”时,术语“约”是指该时间段加上或减去下一个子时间段的一个量(例如,约1年表示11至13个月;约6个月表示6个月加或减1周;约1周表示6至8天;以此类推),或者在指定值的10%以内,以较大者为准。[0219]抗cldn18.2抗体[0220]本公开提供了抗cldn18.2抗体及其抗原结合片段。本文提供的抗cldn18.2抗体和抗原结合片段能够与cldn18.2(例如,人cldn18.2)或表达cldn18.2的细胞特异性结合。如本文所使用的,“特异性结合”是指≤10-6m(例如,≤5x10-7m、≤2x10-7m、≤10-7m、≤5x10-8m、≤2x10-8m、≤10-8m、≤5x10-9m、≤4x10-9m、≤3x10-9m、≤2x10-9m、或≤10-9m)的结合亲和力(例如,kd)。[0221]i.结合亲和力[0222]本文提供的抗cldn18.2抗体和抗原结合片段的结合亲和力可以用kd值表示,其表示当抗原和抗原结合分子之间的结合达到平衡时解离率与结合率的比率(koff/kon)。低亲和力抗体通常会缓慢地结合抗原并倾向于容易解离,而高亲和力抗体通常会更快地结合抗原并倾向于保持更长的结合时间。抗原结合亲和力(例如kd)可以使用本领域已知的任何合适方法适当地确定,包括例如动力学排斥分析(kinexa)或流式细胞术。[0223]在某些实施方式中,根据本公开的“kd”或“kd值”在通过kinexa分析测定的实施方式中,如以下分析所述的用抗cldn18.2抗体和cldn18.2进行测定,所述以下分析测量抗cldn18.2抗体的溶液结合亲和力。通常,kinexa的工作原理是使恒定量的一个结合伴侣(bindingpartner)(cbp)与不同浓度的另一个结合伴侣(滴定剂)平衡,然后在较短的接触时间内通过荧光标记的第二抗体捕获一部分游离cbp,所述接触时间比解离预先形成的cbp-滴定剂复合物所需的时间短。从捕获的cbp生成的荧光信号与平衡样品中游离cbp的浓度直接成正比,并在一系列测量时用于生成结合曲线(游离cbp百分比相对于总滴定剂浓度)。可从schreiber,g.,fersht,a.r.naturestructuralbiology.1996,3(5),427-431获得更多详细信息。当抗cldn18.2抗体用作具有恒定量的cbp时,则cldn18.2表达细胞可用作滴定剂,反之亦然。通过kinexa,可以使用cldn18.2或表达cldn18.2的细胞测量kd。在某些实施方式中,抗cldn18.2抗体或其抗原结合片段的kd根据本公开的实施例10的第3节中描述的方法确定。[0224]在适用的情况下也可以使用其他适合于kd测定的方法,例如,放射性标记的抗原结合分析(参见,例如chen等人,(1999)j.molbiol293:865-881),或表面等离子共振分析,例如biacore,其使用固定的cldn18.2cm5芯片在适当的响应单元(ru)进行。[0225]在某些实施方式中,通过流式细胞术测量抗cldn18.2抗体的结合亲和力。通常,将表达cldn18.2的细胞与一定浓度范围的抗cldn18.2抗体孵育,然后与荧光标记的二抗孵育,然后分析荧光信号强度。在某些实施方式中,根据本公开实施例5中所述的方法来确定抗cldn18.2抗体或其抗原结合片段的结合亲和力。[0226]在某些实施方式中,本文提供的抗cldn18.2抗体及其抗原结合片段如通过kinexa分析所测定的,以不超过2.5nm(或不超过2.4、2.3、2.2、2.1、2.0、1.9、1.8、1.7、1.6、1.5、1.4、1.3、1.2、1.1、1.0、0.9、0.8、0.7、0.6、0.5、0.4nm)的kd值特异性结合人cldn18.2(或表达人cldn18.2的细胞)。[0227]或者,本文提供的抗cldn18.2抗体和抗原结合片段对人cldn18.2的结合亲和力也可以用“半最大有效浓度”(ec50)值表示,其是指观察到其最大作用(例如结合)的50%时的抗体浓度。可以通过本领域已知的方法例如,夹心分析法(例如elisa)、蛋白质印迹法、流式细胞术分析法和其他结合分析法来测定ec50值。在某些实施方式中,本文提供的抗cldn18.2抗体和其片段如通过流式细胞术所测定的,以不超过70μg/ml(或不超过65、60、55、50、45、40、35、30、25、20、15、12或10、9、8、7、6、5、4、3、2或1μg/ml)的ec50值与人cldn18.2(例如,表达人cldn18.2的细胞)特异性结合。[0228]可以针对重组cldn18.2或表达cldn18.2的细胞系测定结合亲和力。本文提供的抗体和抗原结合片段能够结合表达不同水平的人cldn18.2的细胞,特别是表达相对中等或较低水平的人cldn18.2的细胞。[0229]在某些实施方式中,用表达人cldn18.2的细胞,例如nugc4细胞、snu-620细胞、snu-601细胞、katoiii细胞、或与其相当的细胞来测定结合亲和力,所述与其相当的细胞具有与nugc4细胞、snu-620细胞、snu-601细胞或katoiii细胞相当的或不超过上述细胞的人cldn18.2蛋白表达水平,。[0230]nugc4细胞是从癌症患者的胃旁淋巴结建立的细胞系(参见akiyamas等人,jpnjsurg.1988jul;18(4):438-46)。nugc4细胞系可从jcrb细胞库获得,其登录号为jcrb0834。[0231]snu-601细胞和snu-620细胞都是人胃癌细胞系,由首尔国立大学(snu)从癌症患者的腹水建立(kujl等人,cancerrestreat.2005feb;37(1):1–19;park等人,intjcancer.1997feb7;70(4):443-449)。snu-601细胞和snu-620细胞可从韩国细胞系库获得,其登录号分别为00601和00620。[0232]katoiii细胞是源于胃癌患者转移部位的细胞系(参见,sekiguchim,等人,jpn.j.exp.med.48:61-68,1978)。katoiii细胞系可从atcc获得,其登录号为atcchtb-103。[0233]重组表达人cldn18.2蛋白的细胞系还可以例如通过在诸如中国仓鼠卵巢(cho)、hek细胞或mkn45细胞系(国家细胞系资源基础设施,目录号3111c0001ccc000229)等细胞系中转染并表达编码人cldn18.2的dna来建立。[0234]在某些实施方式中,用人cldn18.2高表达细胞、人cldn18.2中等表达细胞或人cldn18.2低表达细胞测定结合亲和力。[0235]人cldn18.2蛋白的表达水平在不同细胞系中可以有所变化。细胞中cldn18.2蛋白的表达水平可以通过本领域已知的任何合适方法来测定,例如,通过定量荧光细胞术或免疫组织化学(ihc)。在某些实施方式中,根据ihc确定人cldn18.2蛋白在给定细胞上的表达水平。ihc涉及通过抗原-抗体相互作用使抗原可视化,从而检测细胞或组织中的抗原(例如cldn18.2)。通常,用针对抗原的一抗来检测抗原。可以标记一抗,以直接检测抗原。可替代地,一抗可以是未标记的,并且进一步与缀合有可检测标记的二抗接触,以允许间接检测抗原。一抗可以是能够与人cldn18.2特异性结合的任何抗体,例如但不限于本文提供的任何抗cldn18.2抗体,或本领域已知的任何抗cldn18.2抗体。在某些实施方式中,细胞或组织可以例如使用多聚甲醛固定。[0236]如本文所使用的,关于表达人cldn18.2细胞的术语“高表达”旨在表示以如通过ihc所测定的至少2 的强度和以ihc中至少40%(例如,至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、40-100%、50-100%、60-100%、70-100%、80-100%、90-100%、40-90%、50-90%、60-90%、70-90%、80-90%、40-80%、40-70%、40-60%、40-50%、50-80%、50-70%、50-60%、60-80%、60-70%或70-80%)的细胞为阳性染色的水平表达人cldn18.2的细胞。类似地,如本文所使用的,术语“中等表达”表示以如通过ihc测定的至少1 且低于2 的强度和以ihc中至少30%(或至少35%)但低于40%的细胞为阳性染色的水平表达人cldn18.2的细胞。此外,如本文所使用的,术语“低表达”表示以如通过ihc所测定的高于0但低于1 的强度和以ihc中高于0但低于30%(例如,5%、10%、15%、20%、25%、5-25%、10-25%、15-25%、20-25%、5-20%、5-15%、5-10%、10-20%、或10-15%)的细胞为阳性染色的水平表达人cldn18.2的细胞。该定义也显示在下表a中。[0237]表a.表达细胞的类别[0238][0239]在某些实施方式中,如实施例15的第6节和第7节所述,通过ihc测定人cldn18.2的表达水平。简而言之,将表达人cldn18.2的细胞固定在石蜡中,并使用抗人cldn18.2抗体经由ihc进行检测,然后测定阳性染色细胞的相对比例和细胞膜上的染色强度。在某些实施方式中,在ihc过程中用生物素化的抗cldn18.2抗体gc182对细胞进行染色。抗体gc182具有如seqidno:74所示的重链可变区序列和如seqidno:75所示的轻链可变区序列(也参见wo2013167259)。[0240]基于本文提供的免疫组织化学(ihc)测定结果(表13),nugc4细胞可以表征为人cldn18.2中等表达细胞系,而snu-620、snu-601和katoiii细胞可以表征为低表达细胞系。另外,可以制备重组细胞系以高表达人cldn18.2。高表达细胞的实例包括但不限于如本文实施例1的第3节所述的mkn45-cldn18.2-高细胞系和hek293-cldn18.2细胞系。[0241]发明人惊讶地发现,本文提供的抗cldn18.2抗体及其片段对人cldn18.2中等表达细胞系(例如nugc4细胞)、低表达细胞系(例如snu-620、snu-601和katoiii细胞)具有高亲和力。这与现有的抗体(例如imab362)不同,现有抗体无法显示与人cldn18.2低表达细胞特异性或相当的结合。嵌合igg1抗体imab362是由ganymedpharmaceuticalsag开发的抗人cldn18.2抗体,其具有美国专利申请us2009169547a1中公开的氨基酸序列(imb362的重链和轻链可变区序列包括在本文中,分别为seqidno:72和seqidno:73)和cas号1496553-00-4。imab362识别cldn18.2的第一胞外结构域(ecd1),并且不与任何其他claudin家族成员(包含紧密相关的claudin18剪接变体1(cldn18.1))结合。[0242]在某些实施方式中,本文提供的抗cldn18.2抗体及其片段如通过kinexa分析所测定的,以不超过2.5nm(或不超过2.4、2.3、2.2、2.1、2.0、1.9、1.8、1.7、1.6、1.5、1.4、1.3、1.2、1.1、1.0、0.9、0.8、0.7、0.6、0.5、0.4nm)的kd值与表达人cldn18.2的细胞(例如,nugc4细胞系或katoiii细胞系)特异性结合。在某些实施方式中,本文提供的抗cldn18.2抗体及其片段如通过kinexa分析所测定的,以不高于imab362kd值的80%、70%、60%、50%、40%、30%、20%、15%的kd值与表达人cldn18.2的细胞特异性结合。在某些实施方式中,用nugc4细胞、katoiii细胞、snu-601细胞、snu-620细胞、或与其相当的细胞来测定kd值,所述与其相当的细胞具有与nugc4细胞、katoiii细胞、snu-601细胞、或snu-620细胞相当的或不超过上述细胞的人cldn18.2蛋白表达水平。在某些实施方式中,用人cldn18.2高表达细胞系或人cldn18.2中等表达细胞系来测定kd值。[0243]在某些实施方式中,本文提供的抗体和抗原结合片段如通过流式细胞术分析所测定的,具有不高于70μg/ml(或不高于65、60、55、50、45、40、35、30、25、20、15、12或10、9、8、7、6、5、4、3、2或1μg/ml)的ec50值以与表达人cldn18.2(或小鼠cldn18.2)的细胞结合。在某些实施方式中,本文提供的抗体和抗原结合片段如通过流式细胞术分析所测定的,以不超过imab362ec50值的80%、70%、60%、50%、40%、30%、20%、15%、10%、1%或0.1%的ec50值与表达人cldn18.2的细胞特异性结合。在某些实施方式中,用nugc4细胞系、katoiii细胞系、snu-601细胞系、snu-620细胞系、或与其相当的细胞测定ec50,所述与其相当的细胞具有与nugc4细胞系、katoiii细胞系、snu-601细胞系、或snu-620细胞系(例如人cldn18.2低表达细胞系或人cldn18.2中等表达细胞系)相当的或不超过上述细胞的人cldn18.2蛋白表达水平。在某些实施方式中,用人cldn18.2高表达细胞系测定ec50。[0244]在某些实施方式中,本文提供的抗体和抗原结合片段具有不超过5、4、3或2μg/ml的ec50值以与人cldn18.2高表达细胞系或人cldn18.2中等表达细胞系结合。[0245]在某些实施方式中,本文提供的抗cldn18.2抗体和抗原结合片段如通过流式细胞术分析所测定的,具有不超过70μg/ml(或不超过65、60、55、50、45、40、35、30、25、20、15、12或10、9、8、7、6、5、4、3、2或1μg/ml)的ec50值以与nugc4细胞结合。[0246]在某些实施方式中,抗cldn18.2抗体和其抗原结合片段不与cldn18.1(例如,人cldn18.1或小鼠cldn18.1)结合。[0247]在某些实施方式中,所述抗体和其抗原结合片段如通过流式细胞术所测定的,能够以不超过1.5μg/ml的ec50值与小鼠cldn18.2(例如,表达小鼠cldn18.2的细胞)特异性结合。在某些实施方式中,所述抗体和其抗原结合片段,如通过流式细胞术所测定的,以0.1μg/ml-1.5μg/ml(例如,0.1μg/ml-1.2μg/ml、0.2μg/ml-1μg/ml、0.5μg/ml-1μg/ml、0.6μg/ml-1μg/ml、0.6μg/ml-0.8μg/ml或0.67μg/ml)的ec50与小鼠cldn18.2结合。[0248]1.adcc和cdc活性[0249]在某些实施方式中,本文提供的抗cldn18.2抗体和抗原结合片段能够在表达不同水平的人cldn18.2的细胞中诱导抗体依赖性细胞介导的细胞毒性(adcc)活性和/或cdc活性。[0250]如本文所使用的,“抗体依赖性细胞介导的细胞毒性”或“adcc”是指细胞介导的反应,其中表达fc受体(fcr)的非特异性细胞毒性细胞(例如,天然杀伤(nk)细胞、嗜中性粒细胞和巨噬细胞)识别靶细胞上结合的抗体,随后引起靶细胞的溶解。靶细胞的溶解是细胞外的,需要直接的细胞间接触,并且不涉及补体。adcc可以被视为直接诱导可变程度的即时肿瘤破坏的机制,该机制导致抗原呈递和诱导肿瘤定向t细胞应答。据信体内adcc的诱导导致肿瘤定向t细胞应答和源于宿主的抗体应答。[0251]用于进行adcc的方法是本领域已知的。通常,将靶细胞(例如,表达cldn18.2的细胞)与一定浓度范围的抗cldn18.2抗体孵育,洗涤后,添加效应细胞(例如,表达fc受体的细胞)以允许adcc发生。在靶细胞与效应细胞混合后数小时的一个时间点测定细胞毒性或细胞存活率,以定量adcc的水平。可通过从溶解的靶细胞释放的标记物(例如,放射性底物、荧光染料或天然细胞内蛋白如乳酸脱氢酶(ldh))来检测细胞毒性。在另一个实施方式中,使用荧光素酶报告基因,通过代谢活性细胞的指标(例如atp)测定细胞存活率(参见,例如crouch,s.p.等人,(1993)j.immunol.methods160,81–8),所述荧光素酶报告基因产生与培养中活细胞数量成比例的发光信号(即adcc报告基因分析)。效应细胞的实例是nk细胞、pbmc或表达fcγriii的细胞。在某些实施方式中,本文提供的抗cldn18.2抗体或其抗原结合片段的adcc活性是根据实施例7第2节中描述的方法测定的。[0252]“补体依赖的细胞毒性”或“cdc”是另一种细胞杀伤方法,其可在补体存在下由抗体指引溶解靶标。igm是补体激活最有效的同种型。igg1和igg3在通过经典补体激活途径指引cdc方面也非常有效。在这种级联反应中,抗原-抗体复合物的形成导致在参与抗体分子(例如,与同源抗原复合的igg分子)的ch2结构域上紧密相邻的多个clq结合位点的暴露(clq是补体c1的三个子成分之一)。这些暴露的clq结合位点将先前低亲和力的clq-igg相互作用转换为高亲和力的相互作用,从而触发涉及一系列其他补体蛋白的级联事件,并导致效应细胞趋化/激活剂c3a和c5a的蛋白水解释放。补体级联终止于膜攻击复合物(mac)的形成,其会在细胞膜上形成孔,促进水和溶质自由进出细胞。[0253]如上所述,cdc活性可以通过类似于adcc活性的方法来测定,除了不使用效应细胞以外,需要源于人血清的补体存在。简而言之,将抗体样品在测定培养基中连续稀释,并在人血清补体存在下与表达cldn18.2的靶细胞一起孵育。在孵育后,通过从溶解的靶细胞中释放的标记,或通过代谢活性细胞的指标(例如atp)来测定细胞毒性或细胞存活率。可以使用测定代谢活性细胞中atp的celltiter-glo试剂,并且可以通过使用适当的读取器测量发光强度来量化细胞溶解的程度。在某些实施方式中,本文提供的抗cldn18.2抗体或其抗原结合片段的cdc活性是根据实施例7的第1节中所述的方法测定的。[0254]在某些实施方式中,经由本文提供的抗cldn18.2抗体及其抗原结合片段的adcc或cdc诱导的细胞死亡可以通过膜完整性的丧失来确定,如相较于未处理的细胞,评估碘化丙啶(pi)、锥虫蓝(参见moore等人,cytotechnology17:1-11(1995))或7aad的摄取。[0255]发明人惊奇地发现,本文提供的抗cldn18.2抗体及其片段能够诱导对人cldn18.2中等表达细胞系(例如,nugc4细胞)或人cldn18.2低表达细胞系(例如snu-620、snu-601细胞和katoiii细胞)的adcc和/或cdc。这不同于现有的抗体,例如imab362,其不能诱导对该人cldn18.2中等表达或低表达细胞系的adcc或cdc。[0256]在某些实施方式中,如通过细胞毒性分析所测定的,本文提供的所述抗cldn18.2抗体和抗原结合片段能够以不超过1μg/ml(或不超过0.9、0.8、0.7、0.6、0.5μg/ml)的ec50值在表达人cldn18.2的细胞上诱导补体依赖的细胞毒性(cdc)。在某些实施方式中,如通过细胞毒性分析所测定的,本文提供的所述抗cldn18.2抗体和其片段能够以不超过imab362ec50值80%、70%、60%、50%、40%、30%、20%、10%或5%的ec50值在表达人cldn18.2的细胞上诱导cdc。在某些实施方式中,用人cldn18.2中等表达细胞系或人cldn18.2高表达细胞系来测定cdc。[0257]在某些实施方式中,如通过adcc报告基因分析所测定的,本文提供的所述抗cldn18.2抗体和抗原结合片段能够以不超过2μg/ml(或不超过1.9、1.8、1.7、1.6、1.5、1.4、1.3、1.2、1.1、1.0、0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2或0.1μg/ml)的ec50值在表达人cldn18.2的细胞上诱导抗体依赖的细胞毒性(adcc)。在某些实施方式中,如通过adcc报告基因分析所测定的,本文提供的所述抗cldn18.2抗体和其抗原结合片段以不超过imab362ec50值的80%、70%、60%、50%、40%、30%、20%、10%、5%或1%的ec50值,或以至少为imab362adcc总容量的120%、150%、180%或200%的adcc总容量(例如,表示为抗体浓度相对于adcc活性水平的图中观察到的adcc活性的最高水平)在表达人cldn18.2的细胞上诱导adcc。在某些实施方式中,用nugc4细胞系、katoiii细胞系、snu-601细胞系、snu-620细胞系、或与其相当的细胞来测定adcc,所述与其相当的细胞具有与nugc4细胞系、katoiii细胞系、snu-601细胞系、或snu-620细胞系(例如,人cldn18.2中等表达细胞系或人cldn18.2低表达细胞系)相当的或不超过上述细胞的人cldn18.2蛋白表达水平。[0258]在某些实施方式中,如通过adcc报告基因分析所测定的,本文提供的所述抗cldn18.2抗体和抗原结合片段能够以不超过2μg/ml(或不超过1.9、1.8、1.7、1.6、1.5、1.4、1.3、1.2、1.1、1.0、0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2或0.1μg/ml)的ec50值在nugc4细胞上诱导adcc。[0259]表位[0260]在某些实施方式中,本文提供的所述抗cldn18.2抗体或其抗原结合片段与表位结合,所述表位包含具有seqidno:30的氨基酸序列的人cldn18.2的d28、w30、v43、n45、y46、l49、w50、r51、r55、e56、f60、e62、y66、l72、l76、v79和r80位处的至少一个或多个(例如,一个、两个、三个或更多个)氨基酸残基。[0261]如本文所使用的,术语“表位”是指抗体结合的抗原上的原子或氨基酸的特定基团。表位可以包括直接接触抗体的特定氨基酸、糖侧链、磷酰基或磺酰基。本领域技术人员将认识到,可以通过确定二者是否竞争结合cldn18.2抗原多肽,无需过多实验就可以确定抗体是否结合与本公开的抗体(例如本文提供的杂交瘤/嵌合或人源化抗体7c12、11f12、26g6、59a9、18b10及其任何嵌合和人源化的变体)相同、重叠或相邻的表位。[0262]如本文所使用的,关于两种抗原结合蛋白(例如抗体)的术语“竞争结合”,是指通过竞争结合分析确定,一种抗原结合蛋白阻断或减少另一种抗原结合蛋白与抗原(例如,人/小鼠cldn18.2)的结合。竞争结合分析是本领域所公知的,包括例如直接或间接放射免疫分析(ria)、直接或间接酶免疫分析(eia)和夹心竞争分析(参见,例如,stahli等人,1983,methodsinenzymology9:242-253)。通常,这种分析涉及使用结合到固体表面上的纯化抗原或带有抗原的细胞,未标记的测试抗体和标记的参考抗体。通过测定在测试抗体存在下结合至固体表面或细胞的标记物的含量来测量竞争抑制。通常,测试抗体过量存在。如果两种抗体竞争结合cldn18.2,则这两种抗体与相同或重叠的表位结合,或者与另一种抗体结合的表位足够近的相邻表位结合,以产生空间位阻(sterichindrance)。通常,当竞争性抗体过量存在时,其将抑制(例如,减少)至少50-55%、55-60%、60-65%、65-70%、70-75%、75-80%、80-85%、85-90%或更多的测试抗体与共同抗原的特异性结合。[0263]在某些实施方式中,可以通过使抗原(即,cldn18.2)中的特定残基突变来确定抗体结合的表位或表位中的氨基酸残基。如果抗体以相对于与野生型cldn18.2结合显著降低的水平,与具有突变的氨基酸残基(例如,丙氨酸)的突变cldn18.2结合,则此表明该突变残基直接参与抗体与cldn18.2抗原的结合,或者当抗体与抗原结合时紧邻抗体。这种突变残基被认为在表位内,并且该抗体被认为与包含该残基的表位特异性结合。如本文所使用的,结合水平的显著降低是指相对于抗体和野生型cldn18.2之间的结合,抗体与突变cldn18.2之间的结合亲和力(例如ec50、kd或结合能力)降低了大于10%、20%、30%、40%、50%、60%、70%、80%、90%或更高。可以使用本领域已知的和本文公开的任何合适的方法进行这样的结合测量,例如但不限于kinexa分析和流式细胞术。[0264]在某些实施方式中,本文提供的抗cldn18.2抗体或其抗原结合片段对突变cldn18.2表现出明显更低的结合,其中野生型cldn18.2中的残基被丙氨酸取代,所述残基选自下组:人cldn18.2的d28、w30、v43、n45、y46、l49、w50、r51、r55、e56、f60、e62、y66、l72、l76、v79和r80。在某些实施方式中,残基是e56。在某些实施方式中,残基选自下组:w30、l49、w50、r55和e56。在某些实施方式中,残基选自下组:t41、n45、y46、r51、f60、e62和r80。在某些实施方式中,残基选自下组:d28、v43、n45、y46、y66、l72、l76和v79。[0265]在某些实施方式中,相对于抗体和野生型cldn18.2之间的结合,本文提供的抗cldn18.2抗体或其抗原结合片段显示出,与包含人cldn18.2e56a的突变cldn18.2的结合降低了至少80%、90%、95%或99%或更多。[0266]在某些实施方式中,相对于抗体和野生型cldn18.2之间的结合,本文提供的抗cldn18.2抗体或其抗原结合片段显示出,与包含一个或多个突变残基的突变cldn18.2的结合降低了至少50%、60%、70%、80%或90%,所述一个或多个突变残基选自下组:人cldn18.2的w30a、l49a、w50a、r55a和e56a。[0267]在某些实施方式中,相对于抗体和野生型cldn18.2之间的结合,本文提供的抗cldn18.2抗体或其抗原结合片段显示出,与包含一个或多个突变残基的突变cldn18.2的结合降低了至少30%、35%、40%、45%或50%,所述一个或多个突变残基选自下组:人cldn18.2的d28、v43、n45、y46、y66、l72、l76和v79。[0268]在某些实施方式中,相对于抗体和野生型cldn18.2之间的结合,本文提供的抗cldn18.2抗体或其抗原结合片段显示出,与包含一个或多个突变残基的突变cldn18.2的结合降低了至少10%、15%、20%、25%或30%,所述一个或多个突变残基选自下组:人cldn18.2的t41a、n45a、y46a、r51a、f60a、e62a和r80a。[0269]在某些实施方式中,本文提供的抗cldn18.2抗体或其抗原结合片段不与a42和/或n45结合。[0270]在某些实施方式中,本文提供的抗cldn18.2抗体或其抗原结合片段能够与本文提供的表位结合,并在人cldn18.2中等表达细胞系或人cldn18.2低表达细胞系中诱导adcc或cdc活性。[0271]抗体序列[0272]在另一个方面,本公开提供了一种抗cldn18.2抗体或其抗原结合片段,其包含重链hcdr1、hcdr2和hcdr3和/或轻链lcdr1、lcdr2和lcdr3序列,其中:[0273]所述hcdr1序列包含gynmn(seqidno:1)或tyfigvg(seqidno:13),或与其具有至少80%序列同一性的同源序列;[0274]所述hcdr2序列包含x1idpyyx2x3tx4ynqkfx5g(seqidno:32)或hiwwndnkyyntalks(seqidno:15),或与其具有至少80%(或至少85%、90%、95%)序列同一性的同源序列;[0275]所述hcdr3序列包含x6x7x8gnafdy(seqidno:33)或mgsgawfty(seqidno:17),或与其具有至少80%序列同一性的同源序列;[0276]所述lcdr1序列包含kssqx9lx10nx11gnx12knylt(seqidno:34),或与其具有至少80%(或至少85%、90%、95%)序列同一性的同源序列;[0277]所述lcdr2序列包含wastrx13s(seqidno:35),或与其具有至少80%序列同一性的同源序列;并且[0278]所述lcdr3序列包含qndyx14x15px16t(seqidno:36),或与其具有至少80%序列同一性的同源序列;[0279]其中x1是n或y或h,x2是g或v,x3是a或g或t,x4是r或t或s,x5是k或r,x6是s或m,x7是y或f,x8是y或h,x9是s或n,x10是l或f,x11是s或n,x12是q或l,x13是e或k,x14是s或y,x15是f或y,且x16是f或l。[0280]在一个方面,本公开提供了一种抗cldn18.2抗体或其抗原结合片段,其中所述重链可变区包含:[0281]a)hcdr1包含选自seqidno:1和seqidno:13的序列,[0282]b)hcdr2包含选自seqidno:3、seqidno:7、seqidno:9、seqidno:15、seqidno:19和seqidno:22的序列,以及[0283]c)hcdr3包含选自seqidno:5、seqidno:11、seqidno:17和seqidno:21的序列,和/或[0284]轻链可变区包含:[0285]d)lcdr1包含如seqidno:2、seqidno:10、seqidno:14和seqidno:20所示的序列,[0286]e)lcdr2包含如seqidno:4和seqidno:16所示的序列,以及[0287]f)lcdr3包含选自seqidno:6、seqidno:8、seqidno:12和seqidno:18的序列。[0288]在某些实施方式中,本文提供的所述抗体或其抗原结合片段,其中所述重链可变区选自下组:[0289]a)包含hcdr1、hcdr2和hcdr3的重链可变区,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:3所示的序列,所述hcdr3包含如seqidno:5所示的序列;[0290]b)包含hcdr1、hcdr2和hcdr3的重链可变区,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:7所示的序列,所述hcdr3包含如seqidno:5所示的序列;[0291]c)包含hcdr1、hcdr2和hcdr3的重链可变区,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:9所示的序列,所述hcdr3包含如seqidno:11所示的序列;[0292]d)包含hcdr1、hcdr2和hcdr3的重链可变区,所述hcdr1包含如seqidno:13所示的序列,所述hcdr2包含如seqidno:15所示的序列,所述hcdr3包含如seqidno:17所示的序列;[0293]e)包含hcdr1、hcdr2和hcdr3的重链可变区,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:19所示的序列,所述hcdr3包含如seqidno:21所示的序列;以及[0294]f)包含hcdr1、hcdr2和hcdr3的重链可变区,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:22所示的序列,所述hcdr3包含如seqidno:5所示的序列。[0295]在某些实施方式中,本文提供的所述抗体或其抗原结合片段,其中所述轻链可变区选自下组:[0296]a)包含lcdr1、lcdr2和lcdr3的轻链可变区,所述lcdr1包含如seqidno:2所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:6所示的序列;[0297]b)包含lcdr1、lcdr2和lcdr3的轻链可变区,所述lcdr1包含如seqidno:2所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:8所示的序列;[0298]c)包含lcdr1、lcdr2和lcdr3的轻链可变区,所述lcdr1包含如seqidno:10所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:6所示的序列;[0299]d)包含lcdr1、lcdr2和lcdr3的轻链可变区,所述lcdr1包含如seqidno:2所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:12所示的序列;[0300]e)包含lcdr1、lcdr2和lcdr3的轻链可变区,所述lcdr1包含如seqidno:14所示的序列,所述lcdr2包含如seqidno:16所示的序列,所述lcdr3包含如seqidno:18所示的序列;[0301]f)包含lcdr1、lcdr2和lcdr3的轻链可变区,所述lcdr1包含如seqidno:20所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:6所示的序列。[0302]在某些实施方式中,本文提供的所述抗体或其抗原结合片段,其中[0303]a)所述重链可变区包含hcdr1、hcdr2和hcdr3,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:3所示的序列,所述hcdr3包含如seqidno:5所示的序列;并且,所述轻链可变区包含lcdr1、lcdr2和lcdr3,所述lcdr1包含如seqidno:2所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:6所示的序列;[0304]b)所述重链可变区包含hcdr1、hcdr2和hcdr3,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:7所示的序列,所述hcdr3包含如seqidno:5所示的序列;并且,所述轻链可变区包含lcdr1、lcdr2和lcdr3,所述lcdr1包含如seqidno:2所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:8所示的序列;[0305]c)所述重链可变区包含hcdr1、hcdr2和hcdr3,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:9所示的序列,所述hcdr3包含如seqidno:11所示的序列;并且,所述轻链可变区包含lcdr1、lcdr2和lcdr3,所述lcdr1包含如seqidno:10所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:6所示的序列;[0306]d)所述重链可变区包含hcdr1、hcdr2和hcdr3,所述hcdr1包含如seqidno:13所示的序列,所述hcdr2包含如seqidno:15所示的序列,所述hcdr3包含如seqidno:17所示的序列;并且,所述轻链可变区包含lcdr1、lcdr2和lcdr3,所述lcdr1包含如seqidno:2所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:12所示的序列;[0307]e)所述重链可变区包含hcdr1、hcdr2和hcdr3,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:19所示的序列,所述hcdr3包含如seqidno:21所示的序列;并且,所述轻链可变区包含lcdr1、lcdr2和lcdr3,所述lcdr1包含如seqidno:14所示的序列,所述lcdr2包含如seqidno:16所示的序列,所述lcdr3包含如seqidno:18所示的序列;或者[0308]f)所述重链可变区包含hcdr1、hcdr2和hcdr3,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:22所示的序列,所述hcdr3包含如seqidno:5所示的序列;并且,所述轻链可变区包含lcdr1、lcdr2和lcdr3,所述lcdr1包含如seqidno:20所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:6所示的序列。[0309]在某些实施方式中,本文提供的所述抗体包含cldn18.2抗体7c12、11f12、26g6、59a9、18b10和12e9的一个或多个(例如1、2、3、4、5或6)cdr序列。[0310]如本文所使用的,“7c12”是指小鼠抗体,其具有如seqidno:37所示的重链可变区和如seqidno:38所示的轻链可变区。[0311]如本文所使用的,“11f12”是指小鼠抗体,其具有如seqidno:39所示的重链可变区和如seqidno:40所示的轻链可变区。[0312]如本文所使用的,“26g6”是指小鼠抗体,其具有如seqidno:41所示的重链可变区和如seqidno:42所示的轻链可变区。[0313]如本文所使用的,“59a9”是指小鼠抗体,其具有如seqidno:43所示的重链可变区和如seqidno:44所示的轻链可变区。[0314]如本文所使用的,“18b10”是指小鼠抗体,其具有如seqidno:45所示的重链可变区和如seqidno:46所示的轻链可变区。[0315]如本文所使用的,“12e9”是指小鼠抗体,其具有如seqidno:47所示的重链可变区和如seqidno:48所示的轻链可变区。[0316]表1示出了这些cldn18.2抗体的cdr序列。下表2还提供了重链和轻链可变区序列。[0317]表1.cldn18.2抗体cdr区的序列[0318][0319][0320]表2.小鼠/嵌合抗体vh/vl的序列[0321][0322][0323]本文提供的所述抗cldn18.2抗体或其抗原结合片段可以是单克隆抗体、多克隆抗体、人源化抗体、嵌合抗体、重组抗体、双特异性抗体、标记抗体、双价抗体或抗独特型抗体。重组抗体是在体外而不是在动物中使用重组方法制备的抗体。[0324]已知cdr负责抗原结合,但是,发现并非所有6个cdr都是必不可少或不可改变的。换言之,可以替换或更改或修饰抗cldn18.2抗体7c12、11f12、26g6、59a9、18b10或12e9中的1个、2个或3个cdr(对应于seqidno:1-22中的任何一个),但基本上保留了与cldn18.2的特异性结合亲和力。[0325]在某些实施方式中,本文提供的所述抗cldn18.2抗体和抗原结合片段包含抗cldn18.2抗体7c12、11f12、26g6、59a9、18b10或12e9中的一个的重链cdr3序列。在某些实施方式中,本文提供的所述抗cldn18.2抗体和抗原结合片段包含如seqidno:5、11、17和21所示的重链cdr3序列。重链cdr3区位于抗原结合位点的中心,因此被认为与抗原接触最多,并为抗体对抗原的亲和力提供了最大的自由能。还据信,通过多种多样化机制(tonegawas.nature.302:575-81)就长度、氨基酸组成和构象而言,重链cdr3是抗原结合位点迄今为止最多样化的cdr。重链cdr3的多样性足以产生大多数抗体特异性(xujl,davismm.immunity.13:37-45)以及所需的抗原结合亲和力(schierr等,jmolbiol.263:551-67)。[0326]在一些实施方式中,本文提供的所述抗cldn18.2抗体和抗原结合片段包含全部或部分的重链可变结构域和/或全部或部分的轻链可变结构域。在一个实施方式中,本文提供的所述抗cldn18.2抗体和抗原结合片段是单域抗体,其由本文提供的全部或部分重链可变结构域组成。本领域可获得此种单域抗体的更多信息(参见,例如,美国专利号6,248,516)。[0327]在某些实施方式中,本文提供的所述抗体及其抗原结合片段包含合适的框架区(fr)序列,只要所述抗体及其抗原结合片段可以与cldn18.2特异性结合即可。表1中提供的cdr序列获取自小鼠抗体,但是可以使用本领域已知的合适方法(例如,重组技术),将它们嫁接到任何合适物种(例如,小鼠、人、大鼠、兔等)的任何合适fr序列上。[0328]在某些实施方式中,本文提供的所述抗体及其抗原结合片段是人源化的。由于人源化抗体或抗原结合片段在人中免疫原性降低,因此是理想的。因为将非人cdr序列嫁接到人或基本人的fr序列上,所以人源化抗体在其可变区中是嵌合的。抗体或抗原结合片段的人源化基本上可以通过用非人(例如鼠)cdr基因替换人免疫球蛋白基因中的相应人cdr基因来进行(参见,例如,jones等人,(1986)nature321:522-525;riechmann等人,(1988)nature332:323-327;verhoeyen等人,(1988)science239:1534-1536)。[0329]使用本领域已知的方法,可以选择合适的人重链和轻链可变结构域以实现该目的。在说明性的实例中,可以使用“最适合(best-fit)”方法,其中针对已知的人可变结构域种系序列的数据库筛选或blast非人(例如,啮齿动物)抗体的可变结构域序列,并且鉴定最接近非人查询序列的人序列,并将其用作嫁接非人cdr序列的人支架(humanscaffold)(参见,例如,sims等人,(1993)j.immunol.151:2296;chothia等人,(1987)j.mot.biol.196:901)。或者,可以使用源于所有人抗体的共有序列的框架区来嫁接非人cdr(参见,例如,carter等人,(1992)proc.natl.acad.sci.usa,89:4285;presta等人,(1993)j.immunol.,151:2623)。[0330]在某些实施方式中,本文提供的所述人源化抗体或抗原结合片段基本上由除非人cdr序列以外所有的人序列组成。在一些实施方式中,可变区fr和恒定区(如果存在的话)全部或基本上来自人免疫球蛋白序列。人fr序列和人恒定区序列可以衍生自不同的人免疫球蛋白基因,例如,fr序列源于一种人抗体而恒定区源于另一种人抗体。在一些实施方式中,所述人源化抗体或抗原结合片段包含人重链/轻链fr1-4。[0331]在一些实施方式中,源于人的fr区可包含与源于其的人免疫球蛋白相同的氨基酸序列。在一些实施方式中,人fr的一个或多个氨基酸残基被来自亲本非人抗体的相应残基所取代。在某些实施方式中,这可能是所期望的以使人源化抗体或其片段紧密接近非人亲本抗体结构,从而减少或避免免疫原性和/或改善或保持结合活性或结合亲和力。[0332]在某些实施方式中,本文提供的所述人源化抗体或抗原结合片段在每个人fr序列中包含不超过10、9、8、7、6、5、4、3、2或1个氨基酸残基取代,或在重链或轻链可变结构域的所有fr中包含不超过10、9、8、7、6、5、4、3、2或1个氨基酸残基取代。在一些实施方式中,氨基酸残基的这种改变可以仅存在于重链fr区中、仅存在于轻链fr区中、或存在于两条链中。在某些实施方式中,将一个或多个氨基酸残基突变,例如,突变回cdr序列源自的非人亲本抗体中(例如,在小鼠框架区中)发现的相应残基。本领域技术人员可以按照本领域已知的原理选择合适的突变位置。例如,可以选择用于突变的位置,其中:1)人种系序列框架中的残基很少(例如,在人可变区序列中少于20%或少于10%);2)因为该位置可能与cdr中的残基相互作用,所以其与人种系链一级序列中3个cdr的一个或多个紧邻;或3)该位置在3维模型中靠近cdr,因此与cdr中的氨基酸相互作用的可能性很高。所选位置上的残基可以突变回亲本抗体中的相应残基,或突变为既不是人种系序列也不是亲本抗体中的相应残基,而是人序列的典型残基,即在与人种系序列属于同一亚组的已知人序列中,其更频繁地发生在该位置上(参见美国专利号5,693,762)。[0333]在某些实施方式中,本公开的所述的人源化轻链和重链在人中基本上是无免疫原性的,并且与针对cldn18.2的亲本抗体相比保留了基本上相同或甚至更高的亲和力。[0334]在某些实施方式中,本文提供的所述人源化抗体及其抗原结合片段包含人种系框架序列vk/4-1的一个或多个轻链fr序列,和/或人种系框架序列vh/1-46的一个或多个重链fr序列,有或无反向突变。如果需要,可以将反向突变引入人种系框架序列中。在某些实施方式中,人源化抗体18b10可以在重链框架序列vh/1-46中包含选自下组的一个或多个反向突变:r71i、t73k、t28s、m69l、r38k和m48i(全部基于kabat编号)。人源化抗体18b10可以在轻链框架序列vk/4-1中包含选自下组的一个或多个反向突变:s63t和i21m(全部基于kabat编号)。[0335]在某些实施方式中,本文提供的所述抗cldn18.2抗体或其抗原结合片段包含重链可变区,所述重链可变区包含选自下组的序列:seqidno:25、seqidno:27、seqidno:29、seqidno:37、seqidno:39、seqidno:41、seqidno:43、seqidno:45和seqidno:47,和与上述序列具有至少80%(例如,至少85%、90%、95%、96%、97%、98%、或99%)序列同一性但仍保留与cldn18.2(尤其是人cldn18.2)的特异性结合亲和力的同源序列。[0336]在某些实施方式中,本文提供的所述抗cldn18.2抗体或其抗原结合片段包含轻链可变区,所述轻链可变区包含选自下组的序列:seqidno:26、seqidno:28、seqidno:38、seqidno:40、seqidno:42、seqidno:44、seqidno:46、seqidno:48,和与上述序列具有至少80%(例如,至少85%、90%、95%、96%、97%、98%、或99%)序列同一性但仍保留与cldn18.2(尤其是人cldn18.2)的特异性结合亲和力的同源序列。[0337]在某些实施方式中,本文提供的所述抗cldn18.2抗体或其抗原结合片段,其包含,[0338]包含如seqidno:25所示序列的重链可变区,和包含如seqidno:26所示序列的轻链可变区;[0339]包含如seqidno:27所示序列的重链可变区,和包含如seqidno:28所示序列的轻链可变区;[0340]包含如seqidno:29所示序列的重链可变区,和包含如seqidno:26或28所示序列的轻链可变区;[0341]包含如seqidno:37所示序列的重链可变区,和包含如seqidno:38所示序列的轻链可变区;[0342]包含如seqidno:39所示序列的重链可变区,和包含如seqidno:40所示序列的轻链可变区;[0343]包含如seqidno:41所示序列的重链可变区,和包含如seqidno:42所示序列的轻链可变区;[0344]包含如seqidno:43所示序列的重链可变区,和包含如seqidno:44所示序列的轻链可变区;[0345]包含如seqidno:45所示序列的重链可变区,和包含如seqidno:46所示序列的轻链可变区;或者[0346]包含如seqidno:47所示序列的重链可变区,和包含如seqidno:48所示序列的轻链可变区。[0347]在某些实施方式中,本文提供的所述抗cldn18.2抗体或其抗原结合片段进一步包含一个或多个重链hfr1、hfr2、hfr3和hfr4,和/或一个或多个轻链lfr1、lfr2、lfr3和lfr4,其中:[0348]所述hfr1包含qvqlvqsgaevkkpgasvkvsckasgyx17ft(seqidno:54)或与其具有至少80%(或至少85%、90%、95%)序列同一性的同源序列,[0349]所述hfr2包含wvx18qapgqglewx19g(seqidno:55)或与其具有至少80%(或至少90%)序列同一性的同源序列,[0350]所述hfr3序列包含rvtx20tidkststvymelsslrsedtavyycar(seqidno:56)或与其具有至少80%(或至少85%、90%、95%)序列同一性的同源序列,[0351]所述hfr4包含wgqgttvtvss(seqidno:57)或与其具有至少80%序列同一性的同源序列,[0352]所述lfr1包含divmtqspdslavslgeratx21nc(seqidno:58)或与其具有至少80%(或至少85%、90%、95%)序列同一性的同源序列,[0353]所述lfr2包含wyqqkpgqppklliy(seqidno:59)或与其具有至少80%(或至少85%、90%)序列同一性的同源序列,[0354]所述lfr3包含gvpdrfx22gsgsgtdftltisslqaedvavyyc(seqidno:60)或与其具有至少80%(或至少85%、90%、95%)序列同一性的同源序列,以及[0355]所述lfr4包含fgggtkveik(seqidno:61)或与其具有至少80%(或至少90%)序列同一性的同源序列,[0356]其中x17是t或s,x18是r或k,x19是m或i,x20是m或l,x21是i或m,且x22是s或t。[0357]在某些实施方式中,所述hfr1包含选自下组的序列:seqidno:62和63,所述hfr2包含选自下组的序列:seqidno:64和65,所述hfr3包含选自下组的序列:seqidno:66和67,所述hfr4包含如seqidno:57所示的序列,所述lfr1包含选自下组的序列:seqidno:68和69,所述lfr2包含如seqidno:59所示的序列,所述lfr3包含选自下组的序列:seqidno:70和71,以及所述lfr4包含如seqidno:61所示的序列。[0358]表3-1.人源化cldn18.2抗体18b10的框架(fr)序列[0359][0360]表3-2示出了人源化18b10抗体的可变区序列。[0361]表3-2.人源化18b10的序列[0362][0363][0364]在某些实施方式中,本文提供的所述人源化抗体可包含与人igg1同种型的恒定区融合的重链可变区和与人κ链的恒定区融合的轻链可变区。[0365]本文提供的所述人源化抗cldn18.2抗体保留了与表达cldn18.2细胞的特异性结合亲和力,并且在该方面至少与亲本抗体相当或甚至更佳。本文提供的所述人源化抗体还可以保留其与表达cldn18.2细胞(例如nugc4细胞、snu-620细胞、snu-601细胞或katoiii细胞)的功能性相互作用,其中所有抗体均可介导adcc、cdc和凋亡诱导产生的细胞杀伤作用,所述凋亡通过肿瘤细胞表面靶标的交联和直接抑制增殖所诱导。在某些实施方式中,本文提供的所述抗cldn18.2抗体及其片段进一步包含免疫球蛋白恒定区,可选地人ig的恒定区,或可选地人igg的恒定区。在一些实施方式中,免疫球蛋白恒定区包含重链和/或轻链恒定区。重链恒定区包含ch1、铰链和/或ch2-ch3区。在某些实施方式中,重链恒定区包含fc区。在某些实施方式中,轻链恒定区包含cκ或cλ。[0366]在某些实施方式中,本文提供的抗cldn18.2抗体及其片段进一步包含人igg1、igg2、igg3或igg4的恒定区。在某些实施方式中,本文提供的所述抗cldn18.2抗体及其抗原结合片段包含igg1同种型的恒定区。在某些实施方式中,人igg1的恒定区包含如seqidno:49所示的序列,或与其具有至少80%(例如,至少85%、90%、95%、96%、97%、98%、或99%)序列同一性的同源序列。[0367]igg1同种型的恒定区可以诱导效应子功能,例如adcc或cdc。本文提供的所述抗cldn18.2抗体及其抗原结合片段的效应子功能可对表达cldn18.2的细胞产生细胞毒性。可以使用各种分析法,例如fc受体结合分析、c1q结合分析和细胞溶解分析,以及上述用于确定adcc或cdc的任何分析来评估效应子功能。[0368]抗体变体[0369]本文提供的抗cldn18.2抗体及其抗原结合片段也涵盖本文提供的抗体序列的各种类型的变体。[0370]在某些实施方式中,变体在表1提供的1、2或3个cdr序列中,在一个或多个fr序列中,在本文提供的所述重链或轻链可变区序列中,和/或在恒定区(例如,fc区)中,包含一个或多个修饰或取代。这样的抗体变体保留了其亲本抗体对cldn18.2的特异性结合亲和力,但是具有修饰或取代所赋予的一种或多种期望的性质。例如,仅举几例,抗体变体可以具有改善的抗原结合亲和力、改善的糖基化模式、降低的糖基化风险、减少的脱氨基、减少的或增加的效应子功能、改善的fcrn受体结合、增加的药代动力学半衰期、ph敏感性和/或与缀合物的相容性(例如,一个或多个引入的半胱氨酸残基)。[0371]可使用本领域已知的方法,例如“丙氨酸扫描诱变”,筛选亲本抗体序列以鉴定合适的或优选的残基来进行修饰或取代(参见,例如,cunninghamandwells(1989)science,244:1081-1085)。简而言之,可以鉴定靶标残基(例如带电荷的残基,如arg、asp、his、lys和glu),并用中性或带负电荷的氨基酸(例如丙氨酸或聚丙氨酸)替换,从而产生修饰的抗体并筛选感兴趣的性质。如果在特定氨基酸位置的取代显示出令人感兴趣的功能变化,则可以将该位置鉴定为用于修饰或取代的潜在残基。可以通过用不同类型的残基(例如,半胱氨酸残基、带正电的残基等)取代来进一步评估潜在的残基。[0372]1.亲和力变体[0373]亲和力变体保留了其亲本抗体与cldn18.2的特异性结合亲和力,或甚至具有相比于亲本抗体改善的cldn18.2特异性结合亲和力。可以使用本领域中已知的各种方法来实现该目的。例如,可以使用噬菌体展示技术来产生和表达抗体变体(例如fab或scfv变体)的文库,然后筛选与人cldn18.2的结合亲和力。再例如,计算机软件可用于虚拟模拟抗体与人cldn18.2的结合,并鉴定抗体上形成结合界面的氨基酸残基。可以在取代中避免此类残基以防止结合亲和力降低,或靶向取代此类残基以提供更强的结合。[0374]在某些实施方式中,cdr序列、fr序列或可变区序列中的至少一个(或全部)取代包含保守取代。关于氨基酸序列的“保守取代”是指用具有相似理化性质的侧链的不同氨基酸残基替换氨基酸残基。例如,可以在具有疏水性侧链的氨基酸残基(例如,met、ala、val、leu和ile)中,在具有中性亲水性侧链的残基(例如,cys、ser、thr、asn和gln)中,在具有酸性侧链的残基(例如,asp、glu)中,在具有碱性侧链的氨基酸(例如,his、lys和arg)中,或在具有芳香族侧链的残基(例如,trp、tyr和phe)中进行保守取代。如本领域已知的,保守取代通常不会引起蛋白质构象结构的显著变化,因此可以保留蛋白质的生物学活性。[0375]在某些实施方式中,本文提供的所述抗体或抗原结合片段在一个或多个cdr序列中和/或一个或多个fr序列中包含一个或多个氨基酸残基取代。在某些实施方式中,亲和力变体在一个或多个cdr序列和/或fr序列中总共包含不超过10、9、8、7、6、5、4、3、2或1个取代。[0376]在某些实施方式中,抗cldn18.2抗体及其抗原结合片段包含1、2或3个cdr序列,所述cdr序列具有与表1中所列的一种或多种序列至少80%(例如,至少85%、88%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%)的序列同一性,同时保留了与其亲本抗体相似或甚至更高水平的cldn18.2结合亲和力,。[0377]在某些实施方式中,抗cldn18.2抗体及其抗原结合片段包含一个或多个可变区序列,所述可变区序列具有与如seqidno:23-29和37-48所示的一种或多种序列至少80%(例如,至少85%、88%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%)的序列同一性,同时保留了与其亲本抗体相似或甚至更高水平的cldn18.2结合亲和力,。在一些实施方式中,在选自seqidno:25-29和37-48的序列中,总共1至10个氨基酸被取代、插入或缺失。在一些实施方式中,取代、插入或缺失发生在cdr之外的区域(即,fr中)。[0378]2.糖基化变体[0379]本文提供的抗cldn18.2抗体和抗原结合片段还包含糖基化变体,可以获得其以增加或降低抗体或抗原结合片段的糖基化程度。如本文所使用的,术语“糖基化”是指将聚糖例如岩藻糖、木糖、甘露糖或glcnac磷酸丝氨酸聚糖连接到蛋白质、脂质或其他有机分子上的酶促过程。根据与聚糖连接的碳,糖基化可分为五类,其包括:n-联糖基化、o-联糖基化、二氧磷基-糖基化、c-联糖基化和糖基磷脂酰肌醇化。[0380]抗体的糖基化通常是n-连接或o-连接的。n-连接的是指碳水化合物部分与天冬酰胺残基(例如,三肽序列中的天冬酰胺残基,例如天冬酰胺-x-丝氨酸和天冬酰胺-x-苏氨酸,其中x是脯氨酸以外的任何氨基酸)侧链的连接。o-联糖基化是指糖n-乙酰半乳糖胺、半乳糖或木糖中的一个与羟基氨基酸的连接,最常见地与丝氨酸或苏氨酸的连接。[0381]在某些实施方式中,本文提供的所述抗cldn18.2抗体和抗原结合片段包含具有改善的效应子功能的糖基化变体,例如adcc或cdc。[0382]在某些实施方式中,本文提供的所述抗体或其抗原结合片段是非岩藻糖基化的。术语“非岩藻糖基化”或“非岩藻糖基化的”是指减少或去除与抗体连接的n-聚糖上的核心岩藻糖。人igg抗体的大多数聚糖称为g0、g1和g2,它们是复杂的双四分体分子(biantennarymolecules),其核心岩藻糖残基带有零个、一个或两个末端半乳糖。[0383]非岩藻糖基化的抗体变体可以使用本领域已知的方法来制备,例如,如在us2003/0157108、wo2000/61739、wo2001/29246、us2003/0115614、us2002/0164328、us2004/0093621、us2004/0132140、us2004/0110704、us2004/0110282、us2004/0109865、wo2003/085119、wo2003/084570、wo2005/035586、wo2005/035778、wo2005/053742、wo2002/031140、okazaki等人,j.mol.biol.336:1239-1249(2004)、yamane-ohnuki等人,biotech.bioeng.87:614(2004)所描述的。[0384]在某些实施方式中,抗体糖基化变体在抗体fc中ch2区的asn297位点是非岩藻糖基化的。asn297是指位于fc区中约297位(fc区残基的eu编号)的天冬酰胺残基。然而,由于抗体中的微小序列变化,asn297也可位于297位上游或下游约±3个氨基酸,即在294和300位之间。[0385]在某些实施方式中,抗体糖基化变体可通过例如去除天然糖基化位点(例如,通过n297a取代)获得,以使得在抗体或fc序列中不再存在n-连接的糖基化位点的三肽序列或o-连接的糖基化位点的丝氨酸或苏氨酸残基。备选地,在某些实施方式中,可以通过在宿主细胞系中产生抗体来获得抗体糖基化变体,所述宿主细胞系在将所选糖基添加到抗体的成熟核心碳水化合物结构中是有缺陷的。[0386]3.半胱氨酸工程化的变体[0387]本文提供的所述抗cldn18.2抗体和抗原结合片段还涵盖半胱氨酸工程化的变体,其包含一个或多个引入的游离半胱氨酸氨基酸残基。[0388]游离的半胱氨酸残基是不属于二硫键桥联的部分。半胱氨酸工程化的变体可用于在工程化半胱氨酸的位点通过例如马来酰亚胺或卤代乙酰基与例如细胞毒性和/或成像化合物,标记或放射性同位素缀合。工程化抗体或抗原结合片段以引入游离半胱氨酸残基的方法是本领域已知的,参见例如wo2006/034488。[0389]4.fc变体[0390]本文提供的所述抗cldn18.2抗体和抗原结合片段还涵盖fc变体,其在其fc区和/或铰链区包含一个或多个氨基酸残基修饰或取代。[0391]在某些实施方式中,抗cldn18.2抗体或其抗原结合片段包含恒定区,该恒定区包含一个或多个氨基酸残基取代或修饰,这导致了相对于野生型恒定区增加的cdc或adcc。可以取代fc区的ch2结构域中的某些氨基酸残基以例如通过增强fc结构域与fcγriiia的亲和力来提供增强的adcc活性。通过抗体工程改变adcc活性的方法已经在本领域中有所描述,参见例如,shieldsrl.等人,jbiolchem.2001.276(9):6591-604;idusogieee.等人,jimmunol.2000.164(8):4178-84;steurerw.等人,jimmunol.1995,155(3):1165-74;idusogieee.等人,jimmunol.2001,166(4):2571-5;lazarga.等人,pnas,2006,103(11):4005-4010;ryanmc.等人,mol.cancerther.,2007,6:3009-3018;richardsjo,.等人,molcancerther.2008,7(8):2517-27;shieldsr.l.等人,j.biol.chem,2002,277:26733-26740;shinkawat.等人,j.biol.chem,2003,278:3466-3473.[0392]在某些实施方式中,抗cldn18.2抗体或抗原结合片段包含一个或多个氨基酸取代,其例如通过改善或减少c1q结合和/或补体依赖性细胞毒性(cdc)来改变补体依赖性细胞毒性(cdc)(参见,例如wo99/51642、duncan&winternature322:738-40(1988)、美国专利号5,648,260、美国专利号5,624,821、和关于fc区变体其他实例的wo94/29351)。[0393]在某些实施方式中,本文提供的抗体或其抗原结合片段的恒定区包含相对于seqidno:49(即野生型序列)的一个或多个氨基酸残基取代,所述取代选自下组:l235v、f243l、r292p、y300l、p396l或其任何组合。在某些实施方式中,所述恒定区包含如seqidno:51所示的序列。[0394]在某些实施方式中,抗cldn18.2抗体或抗原结合片段包含一个或多个氨基酸取代,其改善对新生儿fc受体(fcrn)的ph依赖性结合。这样的变体可以具有延长的药代动力学半衰期,因为它在酸性ph下与fcrn结合,从而使其能够逃离溶酶体中的降解,然后被转运并释放到细胞外。工程化抗体及其抗原结合片段以改善与fcrn的结合亲和力的方法是本领域公知的,参见例如vaughn,d.等人,structure,6(1):63-73,1998;kontermann,r.等人,antibodyengineering,volume1,chapter27:engineeringofthefcregionforimprovedpk,publishedbyspringer,2010;yeung,y.等人,cancerresearch,70:3269-3277(2010);和hinton,p.等人,j.immunology,176:346-356(2006)。[0395]抗原结合片段[0396]本文还提供了抗cldn18.2抗原结合片段。各种类型的抗原结合片段是本领域已知的,并且可以基于本文提供的所述抗cldn18.2抗体进行开发,包括例如cdr序列如表1所示的示例性抗体,以及它们的不同变体(例如亲和性变体、糖基化变体、fc变体、半胱氨酸工程化的变体等)。[0397]在某些实施方式中,本文提供的抗cldn18.2抗原结合片段是双功能抗体(diabody)、fab、fab'、f(ab')2、fd、fv片段、二硫键稳定的fv片段(dsfv)、(dsfv)2、双特异性dsfv(dsfv-dsfv')、二硫键稳定的双功能抗体(dsdiabody)、单链抗体分子(scfv)、scfv二聚体(双价的双功能抗体)、多特异性抗体、骆驼化单域抗体(camelizedsingledomainantibody)、纳米抗体、域抗体或双价域抗体。[0398]各种技术可用于产生这种抗原结合片段。说明性方法包括完整抗体的酶消化(参见,例如morimoto等人,journalofbiochemicalandbiophysicalmethods24:107-117(1992);和brennan等人,science,229:81(1985)),通过宿主细胞(例如大肠杆菌)重组表达(例如,对于fab、fv和scfv抗体片段),如上所述从噬菌体展示文库进行筛选(例如,对于scfv)以及将两个fab'-sh片段化学偶联以形成f(ab')2片段(carter等人,bio/technology10:163-167(1992))。产生抗体片段的其他技术对于熟练的从业者将是显而易见的。[0399]在某些实施方式中,所述抗原结合片段是scfv。scfv的产生描述于例如,wo93/16185、美国专利号5,571,894和5,587,458。scfv可以在氨基或羧基末端与效应蛋白融合以提供融合蛋白(参见,例如,antibodyengineering,ed.borrebaeck)。[0400]在某些实施方式中,本文提供的所述抗cldn18.2抗体及其抗原结合片段是双价、四价、六价或多价的。如本文所使用的,术语“价”是指在给定分子中存在指定数目的抗原结合位点。因此,术语“双价”、“四价”和“六价”分别表示在抗原结合分子中存在两个结合位点、四个结合位点和六个结合位点。任何大于双价的分子被认为是多价的,涵盖例如三价、四价、六价等。[0401]如果两个结合位点都对结合相同的抗原或相同的表位是特异性的,则双价分子可以是单特异性的。在某些实施方式中,这提供了比单价对应物更强的与抗原或表位的结合。类似地,多价分子也可以是单特异性的。在某些实施方式中,在双价或多价抗原结合部分中,结合位点的第一价和结合位点的第二价在结构上相同(即具有相同的序列),或在结构上不同(即,尽管具有相同的特异性但具有不同的序列)。[0402]如果两个结合位点对不同的抗原或表位是特异性的,则双价也可以是双特异性的。这也适用于多价分子。例如,当两个结合位点对第一抗原(或表位)单特异性且第三结合位点对第二抗原(或表位)特异性时,三价分子可以是双特异性的。[0403]双特异性抗体[0404]在某些实施方式中,本文提供的抗体及其抗原结合片段是双特异性的。如本文所使用的,术语“双特异性”涵盖具有两个特异性的分子和具有两个以上特异性(即,多特异性)的分子。在某些实施方式中,本文提供的所述双特异性抗体及其抗原结合片段能够与cldn18.2的第一和第二表位特异性结合,或者能够与cldn18.2和第二抗原特异性结合。在某些实施方式中,cldn18.2的第一表位和第二表位彼此不同或不重叠。在某些实施方式中,双特异性抗体及其抗原结合片段可以同时与第一表位和第二表位结合。在某些实施方式中,第二抗原不同于cldn18.2。[0405]在某些实施方式中,所述第二抗原是免疫相关靶标。在一些实施方式中,所述双特异性抗体及其抗原结合片段与cldn18.2和免疫相关靶标特异性结合,并且能够将免疫细胞靶向表达cldn18.2的细胞(例如,表达cldn18.2的肿瘤细胞)和/或激活对表达cldn18.2的靶细胞的cldn18.2特异性免疫应答。如本文所使用的免疫相关靶标,涵盖与免疫应答(可选地,细胞免疫应答)的产生或调节有关的生物分子。免疫相关靶标的一个实例是免疫检查点分子和细胞溶解性免疫细胞(例如,t细胞或自然杀伤(nk)细胞)的表面分子。[0406]免疫检查点分子可介导共刺激信号以增强免疫应答,或可介导共抑制信号以抑制免疫应答。免疫检查点分子的实例包括,例如,pd-l1、pd-l2、pd-1、clta-4、tim-3、lag3、a2ar、cd160、2b4、tgfβ、vista、btla、tigit、lair1、ox40、cd2、cd27、cd28、cd30、cd40、cd122、icam-1、ido、nkg2c、slamf7、siglec7、nkp80、cd160、b7-h3、lfa-1、icos、4-1bb、gitr、baffr、hvem、cd7、light、il-2、il-15、cd3、cd16和cd83。[0407]细胞溶解性免疫细胞可以由其表面分子触发,以攻击和介导目标细胞(例如,肿瘤细胞)的溶解。在某些实施方式中,第二抗原是t细胞表面抗原。t细胞表面抗原的实例包括但不限于选自下组的抗原:cd3、cd2、cd4、cd5、cd6、cd8、cd28、cd40l和/或cd44,优选为cd3。在某些实施方式中,所述第二抗原是cd3的ε链。在某些实施方式中,所述双特异性抗体与t细胞上的cd3结合导致了所述t细胞的增殖和/或活化,这诱导细胞毒性因子(例如,穿孔素和颗粒酶)的释放以及靶细胞的细胞溶解和凋亡。在某些实施方式中,所述第二抗原是nk细胞表面抗原,例如cd16(fcγriii)或cd56。在某些实施方式中,双特异性抗体与nk细胞上的cd16结合导致了nk细胞脱粒和靶细胞的穿孔素依赖性靶细胞裂解(adcc)。[0408]在某些实施方式中,所述第二抗原包含肿瘤抗原。如本文所使用的,“肿瘤抗原”是指肿瘤特异性抗原(例如,肿瘤细胞所特有的抗原,通常在非肿瘤细胞上不存在),肿瘤相关抗原(例如,在肿瘤和非肿瘤细胞中均存在但在肿瘤细胞中表达不同)和肿瘤新抗原(例如,由于体细胞突变而在癌细胞中表达的抗原,所述突变改变了蛋白质序列或在两个不相关序列之间产生融合蛋白)。[0409]肿瘤抗原的实例包括但不限于epcam、her2/neu、her3/neu、c250、cea、mage、蛋白聚糖、vegf、egfr、αvβ3-整联蛋白、hla、hla-dr、asc、cd1、cd2、cd4、cd6、cd7、cd8、cd11、cd13、cd14、cd19、cd20、cd21、cd22、cd23、cd24、cd30、cd33、cd37、cd40、cd41、cd47、cd52、c-erb-2、calla、mhcii、cd44v3、cd44v6、p97、神经节苷脂gm1、gm2、gm3、gd1a、gd1b、gd2、gd3、gt1b、gt3、gq1、ny-eso-1、nfx2、ssx2、ssx4、trp2、gp100(pmel17)、酪氨酸酶、muc-1、端粒酶、存活蛋白、g250、p53、ca125muc、wue抗原、lewisy抗原、hsp-27、hsp-70、hsp-72、hsp-90、pgp、mcsp、epha2和细胞表面靶标gc182、gt468或gt512、pd-l1、树状病毒e蛋白表位、神经胶质瘤相关抗原、癌胚抗原(cea)、β-人绒毛膜促性腺激素、甲胎蛋白(afp)、凝集素反应性afp、甲状腺球蛋白、rage-1、mn-caix、人端粒酶逆转录酶、ru1、ru2(as)、肠羧基酯酶、muthsp70-2、m-csf、蛋白酶、前列腺特异性抗原(psa)、pap、ny-eso-1、lage-1a、p53、前列腺素、psma、存活蛋白和端粒酶、前列腺癌肿瘤抗原-1(pcta-1)、mage、elf2m、嗜中性弹性蛋白酶、肝配蛋白b2、cd22、胰岛素生长因子(igf)-i、igf-ii、igf-1受体和间皮素、art-1/melana(mart-1)、酪氨酸酶、trp-1、trp-2和肿瘤特异性多谱系抗原,例如mage-1、mage-3、bage、gage-1、gage-2、pi5;ras,由于染色体易位而产生的独特肿瘤抗原;如bcr-abl、e2a-prl、h4-ret、1gh-igk、myl-rar;和病毒抗原,例如爱泼斯坦巴尔病毒抗原ebva和人乳头瘤病毒(hpv)抗原e6和e7;基于蛋白质的抗原包括tsp-180、mage-4、mage-5、mage-6、rage、ny-eso、pl85erbb2、pl80erbb-3、c-met、nm-23h1、psa、tag-72、ca19-9、ca72-4、cam17.1、numa、k-ras、β-连环素、cdk4、mum-1、p15、p16、43-9f、5t4(791tgp72)、甲胎蛋白、β-hcg、bca225、btaa、ca125、ca15-3\ca27.29\bcaa、ca195、ca242、ca-50、cam43、cd68\i、co-029、fgf-5、g250、ga733vepcam、htgp-175、m344、ma-50、mg7-ag、mov18、nb/70k、ny-co-1、rcas1、sdccag16、ta-90\mac-2结合蛋白、亲环蛋白c相关蛋白、taal6、tag72、tlp和tps。[0410]在某些实施方式中,肿瘤抗原与胃癌、食道癌、胰腺癌、肺癌、卵巢癌、结肠癌、肝癌、头颈癌、胆囊癌及其转移有关。此类肿瘤抗原的实例包括但不限于ca-125、神经节苷脂g(d2)、g(m2)和g(d3)、cd20、cd52、cd33、ep-cam、cea、蛙皮素样肽、psa、her2/neu、表皮生长因子受体(egfr)、erbb2、erbb3/her3、erbb4、cd44v6、ki-67、癌症相关粘蛋白、vegf、vegfr(例如vegfr3)、雌激素受体、lewis-y抗原、tgfβ1、igf-1受体、egfα、c-kit受体、转铁蛋白受体、il-2r或co17-1a、ca19-9和ca72-4。在某些实施方式中,所述肿瘤抗原存在于表达cldn18.2的细胞(例如,表达cldn18.2的癌细胞)中。[0411]本文提供的双特异性抗体及其抗原结合片段可以是本领域已知的合适形式。例如,示例性双特异性形式可以是双特异性双抗体、基于scfv的双特异性形式、igg-scfv融合、双可变结构域(dvd)-ig、quadroma、knobs-into-holes、共同轻链(例如,带有knobs-into-holes的普通轻链等)、bite、crossmab、crossfab、duobody、seedbody、亮氨酸拉链、双作用fab(daf)-igg和mab2双特异性形式(参见,例如brinkmann等人,2017,mabs,9(2):182-212)。双特异性分子可以是对称或不对称的结构。[0412]本文提供的所述双特异性抗体和抗原结合片段可以通过本领域已知的任何合适方法来制备。[0413]在一个实施方式中,将具有不同抗原特异性的两个免疫球蛋白重链-轻链对在宿主细胞中共表达,以重组方式产生双特异性抗体(参见,例如milsteinandcuello,nature,305:537(1983)),然后通过亲和力层析纯化。[0414]在另一个实施方式中,将编码具有两种特异性的抗体重链可变结构域的序列分别与免疫球蛋白恒定结构域序列融合,然后插入一个或多个表达载体中,所述一个或多个表达载体与用于轻链序列的表达载体共转染到合适的宿主细胞中,以重组表达双特异性抗体。(参见,例如,wo94/04690;suresh等人,methodsinenzymology,121:210(1986))。类似地,scfv二聚体也可以从宿主细胞重组构建并表达。(参见,例如,gruber等人,j.immunol.,152:5368(1994))。[0415]在另一种方法中,可以通过基因融合将来自fos和jun蛋白的亮氨酸拉链肽连接至两种不同抗体的fab'部分。所连接的抗体在铰链区被还原成四个半抗体(即单体),然后再氧化形成异二聚体(kostelny等人,j.immunol.,148(5):1547-1553(1992))。[0416]两个抗原结合结构域也可以缀合或交联以形成双特异性抗体或抗原结合片段。例如,一种抗体可以与生物素偶联,而另一种抗体与抗生物素蛋白偶联,生物素与抗生物素蛋白之间的强结合将两种抗体复合在一起形成双特异性抗体(参见,例如,美国专利号4,676,980;wo91/00360、wo92/00373和ep03089)。以另一个实施例为例,两种抗体或抗原结合片段可以通过本领域已知的常规方法交联,例如,如美国专利号4,676,980中所公开的。[0417]双特异性抗原结合片段可以从双特异性抗体例如,通过蛋白水解切割或通过化学连接产生。例如,可以制备抗体的抗原结合片段(例如,fab')并将其转化为fab'-硫醇衍生物,然后与具有不同抗原特异性的另一种转化的fab'衍生物混合并反应,以形成双特异性抗原-结合片段(参见,例如,brennan等人,science,229:81(1985))。[0418]在某些实施方式中,本文提供的所述双特异性抗体或其抗原结合片段可以在界面上被工程化,从而可以形成knob-into-hole的结合以促进两个不同抗原结合位点的异二聚化。这可以使从重组细胞培养物中回收的异二聚体的百分比最大化。如本文所使用的,“knob-into-hole”是指两个多肽(例如fc)之间的相互作用,其中一个多肽由于存在具有大侧链的氨基酸残基而具有突起(即“knob”)(例如酪氨酸或色氨酸),另一个多肽具有一个空腔(即“hole”),小侧链氨基酸残基位于其中(例如丙氨酸或苏氨酸),并且该突起在该空腔中可定位,从而促进两个多肽中的相互作用以形成异二聚体或复合物。产生具有knobs-into-hole的多肽的方法在本领域中是已知的,例如,如美国专利号5,731,168所述。[0419]缀合物[0420]在一些实施方式中,抗cldn18.2抗体及其抗原结合片段与一个或多个缀合部分连接。缀合物是可以附着于抗体或其抗原结合片段的部分。预期各种缀合物可与本文提供的抗体或抗原结合片段连接(参见,例如,“conjugatevaccines”,contributionstomicrobiologyandimmunology,j.m.cruseandr.e.lewis,jr.(eds.),cargerpress,newyork,(1989))。这些共轭物可以通过共价结合、亲和力结合、嵌入、配位结合、复合、缔合、掺合或添加等方法与抗体或抗原结合片段连接。在某些实施方式中,抗体或其抗原结合片段通过接头与一种或多种缀合物连接。在某些实施方式中,接头是腙接头(hydrazonelinker)、二硫接头、双功能接头、二肽接头、葡糖醛酸苷接头、硫醚接头。[0421]在某些实施方式中,本文公开的抗cldn18.2抗体和抗原结合片段可以被工程化为在表位结合部分之外包含可用于结合一种或多种缀合物的特异性位点。例如,这样的位点可以包括一个或多个反应性氨基酸残基(例如,半胱氨酸或组氨酸残基),以促进与缀合物的共价连接。[0422]缀合物可以是清除修饰剂、治疗剂(例如化疗剂)、毒素、放射性同位素、可检测标记(例如,镧系元素、发光标记、荧光标记或酶底物标记),药代动力学修饰部分,dna烷化剂、拓扑异构酶抑制剂、微管蛋白结合剂,其他抗癌药物或纯化部分(例如磁珠或纳米颗粒)。[0423]可检测标记的实例可以包括荧光标记(例如,荧光素、若丹明、丹酰、藻红蛋白或德克萨斯红)、酶底物标记(例如,辣根过氧化物酶、碱性磷酸酶、萤光素酶、葡糖淀粉酶、溶菌酶、糖类氧化酶或β-d-半乳糖苷酶)、放射性同位素、其他镧系元素、发光标记、发色部分、洋地黄毒苷、生物素/亲和素、dna分子或用于检测的金。[0424]放射性同位素的实例可以包括123i、124i、125i、131i、35s、3h、111in、112in、14c、64cu、67cu、86y、88y、90y、177lu、211at、186re、188re、153sm、212bi和32p。放射性同位素标记的抗体可用于受体靶向成像实验。[0425]在某些实施方式中,缀合物可以是有助于增加抗体半衰期的药代动力学修饰部分,例如peg。其他合适的聚合物包括例如羧甲基纤维素、葡聚糖、聚乙烯醇、聚乙烯吡咯烷酮、乙二醇/丙二醇的共聚物等。[0426]在某些实施方式中,缀合物可以是纯化部分(例如磁珠或纳米颗粒)。[0427]抗体-药物缀合物[0428]在某些实施方式中,本公开提供了抗体-药物缀合物(adc),其包含与细胞毒性剂缀合的任何上述抗cldn18.2抗体或抗原结合片段。[0429]adc可用于局部递送细胞毒性剂,例如在癌症治疗中。这允许将细胞毒性剂靶向递送至肿瘤并在其中进行细胞内积累,这在以下方面特别有用:全身施用这些未缀合的细胞毒性剂可能导致对正常细胞以及寻求消除的肿瘤细胞的不可接受水平的毒性(baldwin等人,(1986)lancetpp.(mar.15,1986):603-05;thorpe,(1985)“antibodycarriersofcytotoxicagentsincancertherapy:areview,”inmonoclonalantibodies'84:biologicalandclinicalapplications,a.pinchera等人,(ed.s),pp.475-506;syrigosandepenetos(1999)anticancerresearch19:605-614;niculescu-duvazandspringer(1997)adv.drgdel.rev.26:151-172;美国专利号4,975,278).)。[0430]在某些实施方式中,细胞毒性剂可以是对细胞有害或可以损害或杀死细胞的任何试剂。在某些实施方式中,细胞毒性剂可选地是毒素、化疗剂(例如dna烷化剂、拓扑异构酶抑制剂、微管蛋白结合剂、生长抑制剂或其他抗癌药物)或放射性同位素。[0431]毒素的实例包括细菌毒素和植物毒素,例如白喉毒素、外毒素a链(来自铜绿假单胞菌)、蓖麻毒蛋白、阿布林、莫德霉素、α帚曲毒蛋白、拟南芥(aleuritesfordii)蛋白、石黄素蛋白、美洲疫霉蛋白(pari、papii和pap-s)、苦瓜抑制剂、姜黄素、巴豆菌素、皂角抑制剂(sapaonariaofficinalisinhibitor)、多花白树毒蛋白、限制酶,苯霉素,依诺霉素和单端孢霉毒素(参见wo93/21232)。可以使用本领域已知的方法将这种大分子毒素与本文提供的所述抗体或抗原结合片段缀合,例如,如在vitetta等人,(1987)science,238:1098所描述的。[0432]细胞毒性剂也可以是小分子毒素和化疗剂,例如格尔德霉素(mandler等人,(2000)jour.ofthenat.cancerinst.92(19):1573-1581;mandler等人,(2002)bioconjugatechem.13:786-791)、美登素和美登木素生物碱((ep1391213;liu等人,(1996)proc.natl.acad.sci.usa93:8618-8623;u.s.pat.no.5,208,020)、加利车霉素(lode等人,(1998)cancerres.58:2928;hinman等人,(1993)cancerres.53:3336-3342)、紫杉醇、细胞松弛素b、短杆菌肽d、溴化乙锭、依米丁、丝裂霉素、依托泊苷、替诺泊苷、长春新碱、长春花碱、长春地辛、秋水仙碱、阿霉素、柔红霉素、二羟基蒽醌二酮、米托蒽醌、光神霉素、放线菌素d、1-脱氢睾丸激素、糖皮质激素、普鲁卡因、丁卡因、利多卡因、普萘洛尔、嘌呤霉素及其类似物、抗代谢物(例如甲氨蝶呤、6-巯基嘌呤、6-硫鸟嘌呤、阿糖胞苷、5-氟尿嘧啶脱羧嗪)、烷基化剂(例如氮芥、噻菌灵苯丁酸氮芥、美法仑、卡莫司汀(bsnu)和洛莫司汀(ccnu)、环磷酰胺、白消安、二溴甘露醇、链脲佐菌素、丝裂霉素c和顺式二氯二胺铂(ii)(ddp)顺铂)、蒽环类药物(例如柔红霉素(以前为道诺霉素)和阿霉素)、抗生素类药物(例如放线菌素(dactinomycin)(以前为放线菌素(actinomycin))、博来霉素、神霉素和蒽霉素(amc))和抗有丝分裂剂(例如长春新碱和长春花碱)、加利车霉素、美登木素生物碱、多拉司他汀、耳他汀,例如mmae和mmaf(美国专利号5,635,483、5,780,588)、多洛他汀、单端孢霉毒素和cc1065,及其具有细胞毒性活性的衍生物。[0433]细胞毒性剂也可以是高放射性同位素。实例包括at211、i131、i125、y90、re186、sm153、bi212、p32、pb212和lu的放射性同位素。放射性同位素与抗体的缀合方法在本领域是已知的,例如,通过合适的配体试剂(参见,例如,wo94/11026;currentprotocolsinimmunology,volumes1and2,coligenetal,ed.wiley-interscience,newyork,n.y.,pubs.(1991))。配体试剂具有可以结合、螯合或复合放射性同位素金属的螯合配体,并且还具有与抗体或抗原结合片段的半胱氨酸的巯基反应的官能团。示例性的螯合配体包括dota、dotp、dotma、dtpa和teta(macrocyclics,dallas,tex.)。[0434]细胞毒性剂可以通过本领域已知的任何合适的接头与抗体或抗原结合片段连接,参见例如美国专利号5,208,020、6,441,163或欧洲专利0425235b1、chari等人,cancerresearch52:127-131(1992)和us2005/0169933a1,其公开内容通过引用明确地并入本文。[0435]在某些实施方式中,接头在特定的生理环境下是可裂解的,从而促进细胞毒性药物在细胞中的释放。例如,接头可以是酸不稳定的接头、对肽酶敏感的接头、光不稳定的接头、二甲基接头或含二硫键的接头、硫醚接头和酯酶不稳定的接头(chari等人,cancerresearch52:127-131(1992)、美国专利号5,208,020)。在一些实施方式中,接头可包含氨基酸残基,例如二肽、三肽、四肽或五肽。连接子中的氨基酸残基可以是天然或非天然存在的氨基酸残基。此类接头的实例包括:缬氨酸-瓜氨酸(ve或val-cit)、丙氨酸-苯丙氨酸(af或ala-phe)、甘氨酸-缬氨酸-瓜氨酸(gly-yal-cit)、甘氨酸-甘氨酸-甘氨酸(gly-gly-gly)、缬氨酸-瓜氨酸-对氨基苄氧基氧酰基(“vc-pab”)。可以设计和优化氨基酸接头成分的选择性,以通过特定的酶(例如,肿瘤相关的蛋白酶、组织蛋白酶b、c和d或纤溶酶蛋白酶)进行酶促裂解。[0436]在某些实施方式中,细胞毒性剂可以通过双功能接头试剂与本文提供的抗体或其抗原结合片段连接,所述双功能接头试剂包括例如n-琥珀酰亚胺基-3-(2-吡啶基二硫代)丙酸酯(spdp)、琥珀酰亚胺基-4-(n-马来酰亚胺基甲基)环己烷-1-甲酸酯(smcc)、n-琥珀酰亚胺基-4-(2-吡啶硫基)戊酸酯(spp)、亚氨基硫杂环戊烷(it)、亚氨基酯的双功能衍生物(例如己二酸二甲酯hcl)、活性酯(如辛二酸二琥珀酰亚胺基酯)、醛(如戊二醛)、双叠氮基化合物(如双(对叠氮基苯甲酰基)己二胺)、双重氮鎓衍生物(如双-(对重氮苯甲酰基)-乙二胺)、二异氰酸酯(如甲苯2,6-二异氰酸酯)、双活性氟化合物(例如1,5-二氟-2,4-二硝基苯)、bmps、emcs、gmbs、hbvs、lc-smcc、mbs、mprh、sbap、sia、siab、smpb、smph、磺基-emcs、磺基-gmbs、磺基-kmus、磺基-mbs、磺基-siab、磺基-smcc和磺基-smpb和svsg(琥珀酰亚胺基-(4-乙烯基砜)苯甲酸酯)。这些接头试剂是可商购的(例如,从piercebiotechnology,inc.,rockford,ill.,u.s.a,参见pages467-498,2003-2004applicationshandbookandcatalog)。[0437]在某些实施方式中,在本文提供的adc中,抗体(或其抗原结合片段)在抗体处与一种或多种细胞毒性剂缀合:试剂比率为约1至约20、约1至约6、约2至约6、约3至约6、约2至约5、约2至约4、或约3至约4。[0438]本文提供的adc可以通过本领域已知的任何合适的方法来制备。在某些实施方式中,首先使抗体(或其抗原结合片段)的亲核基团与双功能接头试剂反应,然后与细胞毒性剂连接,或者相反,即首先使细胞毒性剂的亲核试剂与双功能接头反应,然后与抗体连接。[0439]在某些实施方式中,细胞毒性剂可以包含(或修饰为包含)可以与本文提供的抗体或抗原结合片段的游离半胱氨酸的半胱氨酸硫醇反应的硫醇反应性官能基团。示例性的硫醇反应性官能基团包括例如马来酰亚胺、碘乙酰胺、吡啶基二硫化物、卤代乙酰基、琥珀酰亚胺酯(例如,nhs、n-羟基琥珀酰亚胺)、异硫氰酸酯、磺酰氯、2,6-二氯三嗪基、五氟苯基酯或亚磷酰胺(haugland,2003,molecularprobeshandbookoffluorescentprobesandresearchchemicals,molecularprobes,inc.;brinkley,1992,bioconjugatechem.3:2;garman,1997,non-radioactivelabelling:apracticalapproach,academicpress,london;means(1990)bioconjugatechem.1:2;hermanson,g.inbioconjugatetechniques(1996)academicpress,sandiego,pp.40-55,643-671)。[0440]细胞毒性剂或抗体在缀合形成adc之前可以与连接剂反应。例如,可以进行、分离、纯化和/或表征细胞毒性剂的n-羟基琥珀酰亚胺酯(nhs),或者可以原位形成并与抗体的亲核基团反应。通常,缀合物的羧基形式是通过与以下试剂的组合反应来活化:碳二亚胺试剂,例如二环己基碳二亚胺、二异丙基碳二亚胺,或铀试剂,例如tstu(o-(n-琥珀酰亚胺基)-n,n,n',n'-四甲基铀鎓四氟硼酸酯、hbtu(o-苯并三唑-1-基)-n,n,n',n'-四甲基尿铵六氟磷酸盐)或hatu(o-(7-氮杂苯并三唑-1-基)-n,n,n',n'-四甲基尿铵六氟磷酸盐),活化剂,例如1-羟基苯并三唑(hobt)和n-羟基琥珀酰亚胺,以得到nhs酯。在某些情况下,细胞毒性剂和抗体可以通过原位活化和反应连接在一起,从而一步形成adc。其他活化和连接试剂包括tbtu(2-(1h-苯并三唑-1-基)-1,1,3,3-四甲基尿铵六氟磷酸盐)、tffh(n,n',n″,n″′‑四甲基尿铵2-氟-六氟磷酸盐)、pybop(苯并三唑-1-基-氧-三-吡咯烷基-六氟磷酸膦)、eedq(2-乙氧基-1-乙氧基羰基-1,2-二氢-喹啉)、dcc(二环己基碳二亚胺)、dipcdi(二异丙基碳二亚胺)、msnt(1-(均三甲苯-2-磺酰基)-3-硝基-1h-1,2,4-三唑和芳基磺酰卤,例如三异丙基苯磺酰氯。在另一个实例中,抗体或抗原结合片段可以与生物素缀合,然后间接与第二缀合物缀合,所述第二缀合物与抗生物素蛋白缀合。[0441]嵌合抗原受体(car)组合物[0442]本公开还提供了嵌合抗原受体(car),其包含如本文提供的抗cldn18.2抗原结合结构域和t细胞活化结构域。嵌合抗原受体(car)是工程化的嵌合受体,其将抗体的抗原结合结构域与一个或多个信号传导结构域结合以用于t细胞活化。可以对t细胞和自然杀伤(nk)细胞等免疫细胞进行基因工程改造以表达car。表达car的t细胞被称为car-t细胞。car可以介导t细胞中的抗原特异性细胞免疫活性,使car-t细胞能够消除表达目标抗原的细胞(例如肿瘤细胞)。在一个实施方式中,本文提供的car-t细胞与在诸如癌细胞的细胞上表达的cldn18.2的结合导致所述car-t细胞的增殖和/或活化,其中所述活化的car-t细胞可以释放细胞毒性因子,例如穿孔素、颗粒酶和颗粒溶素,并启动癌细胞的细胞溶解和/或凋亡。[0443]在一些实施方式中,car的t细胞活化结构域包含共刺激性信号传导结构域和tcr信号传导结构域,其可以随机或以指定顺序彼此连接,任选地与具有例如2至10个氨基酸之间的长度的短肽接头(例如,甘氨酸-丝氨酸双联体接头)连接。[0444]在一些实施方式中,car进一步包含跨膜结构域。当在细胞中表达时,抗cldn18.2抗原结合结构域在细胞外,而t细胞活化结构域在细胞内。[0445]在某些实施方式中,car包含抗cldn18.2抗原结合结构域、跨膜结构域、共刺激信号传导区和tcr信号传导结构域,其中所述抗原结合结构域与cldn18.2特异性结合,并且包含本文提供的抗体的抗原结合片段。[0446]1.抗原结合结构域[0447]在一些实施方式中,car的抗cldn18.2抗原结合结构域包含本文提供的一个或多个cdr序列、本文提供的一个或多个重链可变结构域或轻链可变结构域、或一种或多种源于本文提供的任何抗cldn18.2抗体的抗原结合片段。[0448]在一些实施方式中,源于相同物种对于抗原结合结构域是有益的,其中car将最终用于该相同物种。例如,用于人时,使car中使用的抗原结合结构域源于人抗体或人源化抗体可能是有益的。在一些实施方式中,抗原结合结构域包含单链可变片段(scfv)。在一些实施方式中,抗原结合结构域可以以多种其他形式存在,其包括例如fv、fab和(fab')2,以及双功能(即双特异性)杂交抗体片段(例如,lanzavecchia等人,eur.j.immunol.17,105(1987))。在某些实施方式中,抗原结合结构域包含fab或scfv。[0449]2.跨膜结构域[0450]在某些实施方式中,car包含与car的细胞外抗原结合结构域融合的跨膜结构域。在一个实施方式中,可以选择跨膜结构域,使得其与car中的一个结构域自然缔合。在一些情况下,可以选择或修饰跨膜结构域以避免与t细胞受体复合物的其他成员的跨膜结构域结合。[0451]本文提供的car的跨膜结构域可以源于任何天然膜结合或跨膜蛋白的跨膜结构域,例如t细胞受体的α、β或ζ链、cd28、cd3ε、cd45、cd4、cd5、cd8、cd9、cd16、cd22、cd33、cd37、cd64、cd80、cd86、cd134、cd137和cd154。在一些实施方式中,car的跨膜结构域也可以使用多种人铰链,例如人ig(免疫球蛋白)铰链。[0452]替代地,本文提供的car的跨膜结构域可以是合成的,例如,主要包含疏水性残基(例如,亮氨酸和缬氨酸)。在一个实施方式中,在合成的跨膜结构域的每个末端包括苯丙氨酸、色氨酸和缬氨酸的三联体。可选地,长度在2至10个氨基酸之间的短寡肽接头或多肽接头可形成car的跨膜结构域和细胞内信号传导结构域之间的连接。甘氨酸-丝氨酸二联体提供了特别合适的接头。[0453]3.tcr信号传导结构域[0454]本文提供的car的t细胞活化结构域包括tcr信号传导结构域。tcr信号传导结构域可以激活表达car的t细胞,以发挥t细胞的至少一种正常tcr效应子功能,例如,细胞溶解活性或包括细胞因子分泌的辅助活性。tcr信号传导结构域可以是全长的天然细胞内信号转导结构域,或者是其足以转导tcr效应子功能信号的片段。[0455]可用于本文提供的car的示例性胞内信号传导结构域包括t细胞受体(tcr)和共受体的细胞质序列,以及这些序列的任何衍生物或变体和具有相同功能能力的任何合成序列,所述共受体在抗原受体参与后共同启动信号转导。[0456]以刺激方式起作用的tcr信号传导结构域可以包含信号传导基序,所述信号传导基序被称为基于免疫受体酪氨酸的活化基序或itam。可用于本文提供的car中的包含tcr信号传导结构域的itam的实例包括那些源于tcrζ、fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd5、cd22、cd79a、cd79b和cd66d的itam。在某些实施方式中,tcr信号传导结构域包含源于cd3-ζ的细胞质信号传导序列。[0457]4.共刺激信号传导区[0458]本文提供的car的t细胞活化结构域进一步包含共刺激信号传导区。共刺激信号传导区以抗原非依赖性方式起作用以介导tcr激活,并且可以源于淋巴细胞对抗原的有效应答所需的共刺激分子。示例性的共刺激分子包括cd27、cd28、4-1bb(cd137)、ox40、cd30、cd40、pd-1、icos、淋巴细胞功能相关抗原-1(lfa-1)、cd2、cd7、light、nkg2c、b7-h3和与cd83特异性结合的配体等。[0459]5.双特异性car[0460]在某些实施方式中,car是双特异性的。在某些实施方式中,本文提供的双特异性car与cldn18.2的第一和第二表位特异性结合,或能够与cldn18.2和第二抗原特异性结合。[0461]在一个实施方式中,所述car与活细胞表面上存在的cldn18.2的天然表位结合。[0462]6.编码car的多核苷酸序列[0463]在一个方面,本公开进一步提供了编码本文提供的car的核酸序列,其包含编码本文提供的car的抗原结合结构域的第一多核苷酸序列,和可选地编码本文提供的跨膜结构域和t细胞活化结构域的第二多核苷酸序列。在一些实施方式中,编码抗原结合结构域的序列与编码跨膜结构域和t细胞活化结构域的序列可操作地连接。可以使用本领域已知的重组方法来获得编码所需分子的核酸序列,例如,通过从表达该基因的细胞中筛选文库,通过从已知包括该基因的载体中获得该基因,或者通过使用标准技术直接从含有该基因的细胞和组织中分离出来。替代地,目标基因可以通过合成制备,而非克隆。[0464]在一个方面,本公开提供了包含编码本文提供的car的核酸序列的载体。在一些实施方式中,载体是表达可以直接转导到细胞中的如本公开的car的逆转录病毒和慢病毒载体构建体,或者是可以直接转染到细胞中的rna构建体。[0465]在一个方面,本公开提供了分离的细胞,其包含编码本文提供的car和/或表达本文提供的car的核酸序列。[0466]在某些实施方案中,包含编码car或表达car的核酸的细胞选自t细胞、nk细胞、细胞毒性t淋巴细胞(ctl)和调节性t细胞。在一个实施方式中,当car的抗原结合结构域与其相应抗原结合时,包含编码car或表达car的核酸的细胞表现出抗肿瘤免疫。尽管可以使用异源细胞或同种异体细胞,但是细胞毒性淋巴细胞优选为自体细胞。如本文所使用的,“自体的”是指源于同一个体的任何材料,之后将其重新引入该个体。[0467]在一个方面,本公开进一步提供了用于在受试者中对表达cldn18.2的细胞或组织刺激t细胞介导的免疫应答的方法,所述方法包括向受试者施用有效量的经遗传修饰以表达本文提供的car的细胞。[0468]在一个方面,本公开进一步提供了用于治疗患有与cldn18.2的表达升高相关的疾病、病症或病况的哺乳动物的方法,其包括向所述哺乳动物施用有效量的经遗传修饰以表达本文提供的car的细胞,从而治疗哺乳动物。在某些实施方式中,所述细胞是自体t细胞。在某些实施方式中,已经诊断出哺乳动物患有与cldn18.2表达升高有关的疾病、病症或病况。[0469]多核苷酸和重组方法[0470]本公开提供了编码抗cldn18.2抗体及其抗原结合片段的分离的多核苷酸。本文所使用的术语“核酸”或“多核苷酸”是指单链或双链形式的脱氧核糖核酸(dna)或核糖核酸(rna)及其聚合物。除非另有说明,否则特定的多核苷酸序列还隐含地涵盖其保守修饰的变体(例如简并密码子取代)、等位基因、直系同源物、snp和互补序列以及明确指出的序列。具体来说,简并的密码子取代可以通过生成序列来实现,其中一个或多个选定(或全部)密码子的第三位被混合碱基和/或脱氧肌苷残基取代(参见batzer等人,nucleicacidres.19:5081(1991);ohtsuka等人,j.biol.chem.260:2605-2608(1985);androssolini等人,mol.cell.probes8:91-98(1994))。[0471]使用常规程序(例如,通过使用能够与编码抗体的重链和轻链的基因特异性结合的寡核苷酸探针)容易地分离和测序编码单克隆抗体的dna。编码dna也可以通过合成方法来获得。[0472]本公开提供了包含本文提供的分离的多核苷酸的载体(例如,表达载体)。在某些实施方式中,本文提供的表达载体包含编码本文提供的抗体或其抗原结合片段的多核苷酸,与该多核苷酸序列可操作连接的至少一种启动子(例如,sv40、cmv、ef-1α),以及至少一种选择标记。载体的实例包括但不限于逆转录病毒(包括慢病毒)、腺病毒、腺相关病毒、疱疹病毒(例如单纯疱疹病毒)、痘病毒、杆状病毒、乳头瘤病毒、乳腺病毒(例如,sv40)、λ噬菌体和m13噬菌体、质粒,例如pcdna3.3、pmd18-t、poptivec、pcmv、pegfp、pires、pqd-hyg-gseu、palter、pbad、pcdna、pcal、pl、pet、pgemex、pgex、pci、pegft、psv2、pfuse、pvitro、pvivo、pmal、pmono、pselect、puno、pduo、psg5l、pbabe、pwpxl、pbi、p15tv-l、ppro18、ptd、prs10、plexa、pact2.2、pcmv-script.rtm、pcdm8、pcdna1.1/amp、pcdna3.1、prc/rsv、pcr2.1、pef-1、pfb、psg5、pxt1、pcdef3、psvsport、pef-bos等。[0473]可以将包含编码抗体或其抗原结合片段的多核苷酸序列的载体导入宿主细胞以进行克隆或基因表达。用于在本文的载体中克隆或表达dna的合适的宿主细胞是上述的原核生物、酵母或更高等的真核细胞。用于该目的的合适的原核生物包括真细菌,例如革兰氏阴性或革兰氏阳性生物,例如肠杆菌科、例如大肠杆菌、肠杆菌、欧文氏菌、克雷伯菌、变形杆菌、沙门氏菌(例如,鼠伤寒沙门氏菌)、沙雷氏菌(例如,粘质沙雷氏菌)和志贺氏菌,以及枯草芽孢杆菌和地衣芽孢杆菌等芽孢杆菌,铜绿假单胞菌等假单胞菌和链霉菌。[0474]除原核生物外,真核微生物如丝状真菌或酵母菌也是抗cldn18.2抗体编码载体的合适克隆或表达宿主。酿酒酵母或普通的面包酵母是低等真核宿主微生物中最常用的。然而,许多其他属、种和菌株在本文中通常是可获得的和有用的,例如粟酒裂殖酵母;克鲁维酵母宿主例如乳酸克氏菌(k.lactis)、脆弱的克氏菌(k.fragilis)(atcc12,424)、保加利亚克氏菌(atcc16,045)、柳条克氏菌(atcc24,178)、沃氏克氏菌(atcc56,500)、果蝇克氏菌(atcc36,906)、耐高温克氏菌和马克斯克氏菌、耶氏酵母(ep402,226);巴斯德毕赤酵母(ep183,070);念珠菌;里氏木霉(ep244,234);克氏神经孢菌;许旺酵母(schwanniomyces),例如西方许旺酵母(schwanniomycesoccidentalis);和丝状真菌,例如神经孢菌、青霉、弯颈霉(tolypocladium)和曲霉宿主,例如构巢曲霉和黑曲霉。[0475]用于表达本文提供的糖基化抗体或抗原片段的合适的宿主细胞源于多细胞生物,例如无脊椎动物细胞,例如植物和昆虫细胞。已经鉴定出来自宿主的许多杆状病毒株和变体以及相应的允许的昆虫宿主细胞,这些宿主如spodopterafrugiperda(毛虫)、aedesaegypti(蚊)、aedesalbopictus(蚊)、drosophilamelanogaster(果蝇)和家蚕。用于转染的多种病毒株是可公开获得的,例如,苜蓿丫纹夜蛾核多角体病毒(autographacalifornicanpv)的l-1变体和家蚕核多角体病毒(bombyxmorinpv)的bm-5株;并且根据本发明,此类病毒可用作本文的病毒,特别是用于转染贪食斜纹夜蛾(spodopterafrugiperda)细胞。棉花、玉米、马铃薯、大豆、矮牵牛、番茄和烟草的植物细胞培养物也可以用作宿主。[0476]然而,对脊椎动物细胞的兴趣最大,并且在培养(组织培养)中繁殖脊椎动物细胞已成为常规程序。有用的哺乳动物宿主细胞系的实例是被sv40(cos-7、atcccrl1651)转化的猴肾cv1细胞系;人胚胎肾细胞系(在悬浮培养中亚克隆生长的293或293细胞,graham等人,j.genvirol.36:59(1977));婴儿仓鼠肾细胞(bhk、atccccl10);中国仓鼠卵巢细胞/-dhfr(cho,urlaub等人,proc.natl.acad.sci.usa77:4216(1980));小鼠睾丸支持细胞(tm4,mather,biol.reprod.23:243-251(1980));猴肾细胞(cv1atccccl70);非洲绿猴肾细胞(vero-76,atcccrl-1587);人宫颈癌细胞(hela,atccccl2);犬肾细胞(mdck,atccccl34);水牛大鼠肝细胞(brl3a,atcccrl1442);人肺细胞(w138,atccccl75);人肝细胞(hepg2,hb8065);小鼠乳腺肿瘤(mmt060562,atccccl51);tri细胞(mather等人,annalsn.y.acad.sci.383:44-68(1982));mrc5细胞;fs4细胞;和人类肝癌细胞系(hepg2)。在一些优选的实施方式中,宿主细胞是哺乳动物培养的细胞系,例如cho、bhk、ns0、293及其衍生物。[0477]用于制备抗cldn18.2抗体的上述表达或克隆载体转化宿主细胞,并在经适当修饰的常规营养培养基中培养,以诱导启动子,选择转化子或扩增编码所需序列的基因。在另一个实施方式中,可以通过本领域已知的同源重组法制备抗体。[0478]用于制备本文提供的抗体或抗原结合片段的宿主细胞可以在多种培养基中培养。诸如ham’sf10(sigma),基本必需培养基(mem)(sigma)、rpmi-1640(sigma)和dulbecco修饰的eagle's培养基(dmem)(sigma)等市售培养基均适于培养宿主细胞。此外,ham等人,meth.enz.58:44(1979),barnes等人,anal.biochem.102:255(1980)、美国专利号4,767,704;4,657,866;4,927,762;4,560,655;或5,122,469;wo90/03430;wo87/00195;或美国专利re.30,985中描述的任何培养基可用作宿主细胞的培养基。这些培养基中的任何一种均可根据需要补充激素和/或其他生长因子(例如,胰岛素、转铁蛋白或表皮生长因子)、盐(例如,氯化钠、钙、镁和磷酸盐)、缓冲液(例如,hepes)、核苷酸(例如,腺苷和胸苷)、抗生素(例如,gentamycintm药物)、微量元素(定义为通常以微摩尔范围的终浓度存在的无机化合物)和葡萄糖或等效能源。也可以以本领域技术人员已知的适当浓度包括任何其他必要的补充剂。培养条件(例如,温度、ph等),是先前选择用于表达的宿主细胞所使用的那些培养条件,并且对于本领域技术人员而言是显而易见的。[0479]当使用重组技术时,抗体可以在细胞内、周质空间中产生,或直接分泌到培养基中。如果抗体在细胞内产生,则第一步,例如通过离心或超滤除去宿主细胞或溶解片段的颗粒碎片。carter等人,bio/technology10:163-167(1992)描述了分离分泌到大肠杆菌周质空间的抗体的方法。简而言之,将细胞糊状物在乙酸钠(ph3.5)、edta、和苯甲基磺酰氟(pmsf)的存在下解冻约30分钟。可以通过离心去除细胞碎片。在抗体分泌到培养基中的情况下,通常首先使用可商购的蛋白质浓缩过滤器(例如,amicon或milliporepellicon超滤单元),浓缩来自此类表达系统的上清液。蛋白酶抑制剂(例如,pmsf)可以包括在上述任何步骤中,以抑制蛋白水解作用,并且抗生素可以包含在内,以防止不定污染物的生长。[0480]由细胞制备的抗cldn18.2抗体及其抗原结合片段可以使用例如,羟基磷灰石色谱、凝胶电泳、渗析、deae-纤维素离子交换色谱、硫酸铵沉淀、盐析和亲和色谱进行纯化,其中亲和色谱是优选的纯化技术。[0481]在某些实施方式中,固定在固相上的蛋白a用于抗体及其抗原结合片段的免疫亲和纯化。蛋白a作为亲和配体的适用性取决于抗体中存在的任何免疫球蛋白fc结构域的种属和同种型。蛋白a可用于纯化基于人γ1、γ2或γ4重链的抗体(lindmark等人,j.immunol.meth.62:1-13(1983))。蛋白质g被推荐用于所有小鼠同种型和人类γ3(guss等人,emboj.5:15671575(1986))。亲和配体附着的基质通常是琼脂糖,但也可以使用其他基质。机械稳定的基质(例如受控孔玻璃或聚(苯乙烯二乙烯基)苯)比琼脂糖具有更快的流速和更短的处理时间。如果抗体包含ch3结构域,则bakerbondabx.tm.树脂(j.t.baker,phillipsburg,n.j.)可用于纯化。根据要回收的抗体,也可以使用其他蛋白质纯化技术,例如在离子交换柱上分级分离、乙醇沉淀、反相hplc、硅胶色谱、肝素色谱、阴离子或阳离子交换树脂上的sepharosetm色谱(例如,聚天冬氨酸柱)、色谱聚焦、sds-page、和硫酸铵沉淀。[0482]在任何初步纯化步骤之后,可使用在约2.5-4.5的ph下的洗脱缓冲液,对包含感兴趣的抗体和污染物的混合物进行低ph疏水相互作用色谱,优选在低盐浓度下(例如,约0-0.25m的盐)进行。[0483]组合物[0484]另一方面,本公开提供了包含抗cldn18.2抗体或其抗原结合片段的组合物。[0485]在另一个方面,本公开提供了包含非岩藻糖基化的抗cldn18.2抗体或其抗原结合片段的组合物。在某些实施方式中,根据eu编号系统,所述组合物中的所述抗cldn18.2抗体在asn297处具有寡糖(糖)总量60%或更少(例如,少于55%、50%、45%、40%、35%、30%、25%、20%、15%或10%)的量的岩藻糖。相对于与asn297相连的所有糖结构的总和(例如复杂、杂合和高甘露糖结构),可以通过计算asn297处的糖链中岩藻糖的平均含量来确定连接到fc区ch2结构域的岩藻糖的含量。岩藻糖的含量可以通过本领域已知的方法(例如,通过质谱法)来测量。在一个示例性的实施方式中,用n-糖苷酶(pngasef)处理抗体以水解来自抗体的n-糖链寡糖。水解的寡糖用荧光标记rapifluor-ms试剂标记,并通过超高效液相亲水相互作用色谱法进行分离,并通过荧光检测器(uplc-hilic-flr)进行检测。面积归一化法用于计算各种低聚糖的比例。在另一个说明性实施例中,如在wo2008/077546中所述,岩藻糖的含量可以通过maldi-tof质谱法测量。[0486]药物组合物[0487]本公开进一步提供了药物组合物,其包含抗cldn18.2抗体或其抗原结合片段(可选地非岩藻糖基化的)和一种或多种药学上可接受的载体。[0488]用于本文公开的药物组合物中的药学上可接受的载体可以包括例如药学上可接受的液体、凝胶或固体载体、水性介质、非水介质、抗微生物剂、等渗剂、缓冲剂、抗氧化剂、麻醉剂、悬浮剂/分散剂、掩蔽剂或螯合剂、稀释剂、佐剂、赋形剂或无毒辅助物质、本领域已知的其他组分或其各种组合。[0489]合适的组分可包括例如抗氧化剂、填充剂、粘合剂、崩解剂、缓冲剂、防腐剂、润滑剂、调味剂、增稠剂、着色剂、乳化剂或稳定剂(例如,糖和环糊精)。合适的抗氧化剂可包括例如甲硫氨酸、抗坏血酸、edta、硫代硫酸钠、铂、过氧化氢酶、柠檬酸、半胱氨酸、硫代甘油、硫代乙醇酸、硫代山梨糖醇、丁基化羟基黄苯酚、丁基化羟基甲苯和/或没食子酸丙酯。如本文所公开的,在包含如本文所提供的抗体或抗原结合片段和缀合物的组合物中加入一种或多种抗氧化剂(例如,蛋氨酸),减少了抗体或抗原结合片段的氧化。这种氧化的减少防止或减少了结合亲和力的损失,从而改善了抗体的稳定性并使保质期最大化。因此,在某些实施方式中,提供了包含本文公开的一种或多种抗体或抗原结合片段和一种或多种抗氧化剂(例如,蛋氨酸)的组合物。本文进一步提供了方法,所述方法通过将抗体或抗原结合片段与一种或多种抗氧化剂(例如,蛋氨酸)混合来防止本文所提供的抗体或抗原结合片段的氧化,延长其货架寿命和/或改善其功效。[0490]为了进一步说明,药学上可接受的载体可以包括例如水性介质(例如,氯化钠注射剂、林格氏注射剂、等渗右旋糖注射剂、无菌水注射剂或右旋糖和乳酸林格氏注射剂)、非水介质(例如,植物来源的不挥发性油、棉籽油、玉米油、芝麻油或花生油)、抑菌或抑真菌浓度下的抗微生物剂、等渗剂(例如,氯化钠或右旋糖)、缓冲剂(例如,磷酸盐或柠檬酸盐缓冲剂)、抗氧化剂(例如,硫酸氢钠)、局部麻醉剂(例如盐酸普鲁卡因)、悬浮剂和分散剂(例如,羧甲基纤维素钠,羟丙基甲基纤维素或聚乙烯吡咯烷酮)、乳化剂(例如,聚山梨酯80(tween-80))、掩蔽剂或螯合剂(例如,edta(乙二胺四乙酸)或egta(乙二醇四乙酸)、乙醇,聚乙二醇、丙二醇、氢氧化钠、盐酸、柠檬酸或乳酸。可用作载体的抗微生物剂可以添加到在多剂量容器中的药物组合物中,所述多剂量容器包括苯酚或甲酚、汞、苯甲醇、氯丁醇、对羟基苯甲酸甲酯和丙酯、硫柳汞、苯扎氯铵和苄索氯铵。合适的赋形剂可包括例如水、盐水、右旋糖、甘油或乙醇。合适的无毒辅助物质可以包括,例如,润湿剂或乳化剂、ph缓冲剂、稳定剂、溶解度增强剂或诸如乙酸钠、脱水山梨糖醇单月桂酸酯、三乙醇胺油酸酯或环糊精的试剂。[0491]药物组合物可以是液体溶液、悬浮液、乳剂、丸剂、胶囊剂、片剂、缓释制剂或粉剂。口服制剂可包括标准载体,例如药用级的甘露醇、乳糖、淀粉、硬脂酸镁、聚乙烯吡咯烷酮、糖精钠、纤维素、碳酸镁等。[0492]在某些实施方式中,药物组合物被配制成可注射的组合物。可以任何常规形式制备可注射药物组合物,例如液体溶液、悬浮液、乳剂或适于产生液体溶液、悬浮液或乳剂的固体形式。注射制剂可包括准备用于注射的无菌和/或无热源溶液、无菌干燥可溶性产品,如准备在使用前与溶剂混合的冻干粉,包括皮下注射用片剂,准备用于注射的无菌悬浮液、准备在使用前与溶媒结合的无菌干燥的不溶性产品,以及无菌和/或无热源乳液。溶液可以是水性或非水性的。[0493]在某些实施方式中,单位剂量肠胃外制剂包装在安瓿、小瓶或带针注射器中。如本领域已知和实践的,用于肠胃外施用的所有制剂应是无菌的且无热源的。[0494]在某些实施方式中,通过将如本文公开的抗体或抗原结合片段溶解在合适的溶剂中来制备无菌的冻干粉。溶剂可包含赋形剂,其可改善由粉末制备的粉末或重构溶液的稳定性或其他药理学成分。可以使用的赋形剂包括但不限于水、右旋糖、山梨醇、果糖、玉米糖浆、木糖醇、甘油、葡萄糖、蔗糖或其他合适的试剂。在一个实施方式中,溶剂可以含有约中性ph下的缓冲剂,例如柠檬酸盐、磷酸钠或磷酸钾、或本领域技术人员已知的其他此类缓冲剂。随后对溶液进行无菌过滤,然后在本领域技术人员已知的标准条件下冻干,这提供了理想的制剂。在一个实施方式中,将所得溶液分配到小瓶中以冻干。每个小瓶可以包含单剂量或多剂量的抗cldn18.2抗体或其抗原结合片段或其组合物。可以接受超出一个剂量或一组剂量所需量的少量过量(例如,约10%)灌装样品瓶,以利于准确抽取样品和准确给药。冻干粉末可以在适当的条件下,例如在约4℃至室温下储存。[0495]用注射用水重构冻干粉提供了用于肠胃外给药的制剂。在一个实施方式中,为了重构,将无菌和/或无热源水或其他液体状合适载体添加至冻干粉末中。精确的剂量取决于所选择的治疗方法,并且可以凭经验确定。[0496]使用方法[0497]本公开还提供了治疗方法,其包括:向有需要的受试者施用治疗有效量的本文提供的抗体或抗原结合片段(可选地非岩藻糖基化的)和/或本文提供的药物组合物,从而治疗或预防cldn18.2相关疾病或病况。[0498]在另一个方面,本文提供了治疗将从cldn18.2活性调节中受益的受试者的疾病或病况的方法,所述方法包括向有需要的受试者施用治疗有效量的本文提供的抗体或抗原结合片段(可选地非岩藻糖基化的)和/或本文提供的药物组合物。在某些实施方式中,所述疾病或病况是cldn18.2相关的疾病或病况。在一些实施方案中,cldn18.2相关的疾病或病症是癌症。[0499]在某些实施方式中,所述癌症选自胃癌、肺癌、支气管癌、骨癌、肝胆管癌、胰腺癌、乳腺癌、肝癌、卵巢癌、睾丸癌、肾癌、膀胱癌、头颈癌、脊柱癌、脑癌、子宫颈癌、子宫癌、子宫内膜癌、结肠癌、结肠直肠癌、直肠癌、肛门癌、食道癌、胃肠道癌、皮肤癌、前列腺癌、垂体癌、胃癌、阴道癌、甲状腺癌、胶质母细胞瘤、星形细胞瘤、黑素瘤、骨髓增生异常综合症、肉瘤、畸胎瘤和腺癌。[0500]癌症的实例包括但不限于非小细胞肺癌(鳞状/非鳞状)、小细胞肺癌、肾细胞癌、结肠直肠癌、结肠癌、卵巢癌、乳腺癌(包括基底性乳腺癌、导管癌、和小叶乳腺癌)、胰腺癌、胃癌、膀胱癌、食道癌、间皮瘤、黑素瘤、头颈癌、甲状腺癌、肉瘤、前列腺癌、胶质母细胞瘤、子宫颈癌、胸腺癌、黑素瘤、骨髓瘤、霉菌性真菌病、默克尔细胞癌、肝细胞癌(hcc)、纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、成骨肉瘤和其他肉瘤、滑膜瘤、间皮瘤、尤因氏肿瘤、平滑肌肉瘤、横纹肌肉瘤、淋巴样恶性肿瘤、基底细胞癌、腺癌、汗腺癌、甲状腺髓样癌、甲状腺乳头状癌、嗜铬细胞瘤皮脂腺癌、乳头状癌、乳头状腺癌、延髓喉癌、支气管癌、肝癌、胆管癌、绒毛膜癌、威尔姆氏肿瘤、子宫颈癌、睾丸癌、精原细胞瘤、经典霍奇金淋巴瘤(chl)、原发性纵隔大b细胞淋巴瘤、t细胞/富含组织细胞的b细胞细胞淋巴瘤、急性淋巴细胞性白血病、急性骨髓性白血病(acutemyelocyticleukemia)、急性骨髓性白血病(acutemyelogenousleukemia)、慢性骨髓性白血病(chronicmyelocyticleukemia)(粒细胞性白血病)、慢性骨髓性白血病(chronicmyelogenousleukemia)、慢性淋巴细胞性白血病、真性红细胞增多症、肥大细胞源性肿瘤、ebv-阳性和-阴性ptld以及弥漫性大b细胞淋巴瘤(dlbcl)、浆母细胞淋巴瘤、结外nk/t细胞淋巴瘤、鼻咽癌、hhv8相关原发性淋巴瘤、非霍奇金淋巴瘤、多发性骨髓瘤、华登斯特罗姆巨球蛋白血症、重链疾病、骨髓增生异常综合征、毛细胞白血病和骨髓增生异常、原发性中枢神经系统淋巴瘤、脊髓轴肿瘤、脑干神经胶质瘤、星形细胞瘤、髓母细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、血管母细胞瘤、听神经瘤、少突胶质细胞瘤、血管瘤、黑色素瘤、神经母细胞瘤和成视网膜细胞瘤。[0501]在某些实施方式中,所述癌症是表达cldn18.2的癌症。如本文所使用的,“表达cldn18.2的癌症”是指涉及表达cldn18.2的癌细胞的任何癌症或肿瘤。[0502]在某些实施方式中,所述受试者被鉴定为具有表达cldn18.2的癌细胞。可以通过本领域已知的各种方法确定癌细胞上cldn18.2的存在和/或表达水平。可以从受试者获得含有或怀疑含有癌细胞的生物样品。在一些实施方式中,生物样品可以源于癌细胞或癌组织或肿瘤浸润的免疫细胞。在某些实施方式中,可以进一步处理生物样品以例如分离分析物,例如核酸或蛋白质。cldn18.2的存在和/或表达水平可以通过例如定量荧光细胞计数法、免疫组织化学(ihc)、或基于核酸的方法来确定。例如,可以将来自受试者的生物样品暴露于抗cldn18.2抗体或其抗原结合片段,其结合并检测表达的cldn18.2蛋白。替代地,也可以使用诸如qpcr、逆转录酶pcr、微阵列、sage、fish等方法在核酸表达水平上检测cldn18.2。[0503]在某些实施方式中,通过ihc确定或测量生物样品或癌细胞中cldn18.2的表达。在某些实施方式中,人cldn18.2蛋白在受试者的癌细胞上的表达水平可以根据本文提供的实施例15的第6节和第7节中描述的方法确定。[0504]在某些实施方式中,所述受试者被鉴定为具有cldn18.2高表达癌细胞、cldn18.2中等表达癌细胞、或cldn18.2低表达癌细胞。在某些实施方式中,所述cldn18.2高表达癌细胞以如通过ihc所测定的至少2 的强度和以ihc中至少40%(例如,至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、40-100%、50-100%、60-100%、70-100%、80-100%、90-100%、40-90%、50-90%、60-90%、70-90%、80-90%、40-80%、40-70%、40-60%、40-50%、50-80%、50-70%、50-60%、60-80%、60-70%、或70-80%)的细胞为阳性染色的水平表达cldn18.2;所述cldn18.2中等表达癌细胞以如通过ihc所测定的至少1 且低于2 的强度和以ihc中至少30%(或至少35%)但低于40%的细胞为阳性染色的水平表达cldn18.2;所述cldn18.2低表达癌细胞以如通过ihc所测定的高于0但低于1 的强度和以ihc中高于0但低于30%(例如5%、10%、15%、20%、25%、5-25%、10-25%、15-25%、20-25%、5-20%、5-15%、5-10%、10-20%、或10-15%)的细胞为阳性染色的水平表达cldn18.2。[0505]表达cldn18.2的癌症的实例包括但不限于胃癌、食道癌、胰腺癌、肺癌(例如非小细胞肺癌(nsclc)和小细胞肺癌(sclc))、卵巢癌、结肠癌、结直肠癌、胃肠道间质瘤(gist)、胃肠道类癌、直肠癌、肛门癌、胆管癌、小肠癌、阑尾癌、前列腺癌、肾癌(例如,肾细胞癌)、肝癌、头颈癌和胆囊癌及其转移(例如,胃癌转移(例如,克鲁肯伯格肿瘤)、腹膜转移和淋巴结转移)。[0506]在某些实施方式中,表达cldn18.2的癌症可以是腺癌,例如晚期腺癌。在某些实施方式中,所述癌症选自胃、食道、胰管、胆管、肺和卵巢的腺癌。在某些实施方式中,表达cldn18.2的癌症包括胃癌、食道癌(尤其是下食道癌)、食道-胃交界癌和胃食管癌。[0507]不希望受任何理论的束缚,据信cldn18的分子和功能特性使其成为基于抗体的癌症治疗的高度感兴趣的靶标。这些包括(i)大多数毒性相关的正常组织中均不存在cldn18,(ii)cldn18.2变体仅在非必需的细胞群表达(如分化的胃细胞,可被胃的靶标为阴性的干细胞补充),(iii)正常细胞与肿瘤细胞之间潜在的糖基化差异,以及(iv)存在不同的构象拓扑。[0508]已经发现cldn18蛋白的分子量在肿瘤和邻近的正常组织之间是不同的。在健康组织中观察到较高分子量的cldn18蛋白,可通过用去糖基化化合物pngasef处理正常组织溶解物将其降低至与在肿瘤中观察到的相同分子量。这表明与其正常组织相比,cldn18在肿瘤中的n-糖基化程度较低。典型的n-糖基化基序在cldn18分子的环d3结构域内的氨基酸残基116中。分子量差异和推断的结构差异可能代表用于抗体结合的表位改变。[0509]此外,cldn18作为紧密连接蛋白也可能有助于形成良好的治疗窗口。由于肿瘤细胞表达cldn,但通常不像正常上皮组织那样通过cldn的同型和异型缔合形成典型的紧密连接,因此它们可能具有相当数量的游离cldn,其适用于细胞外抗体结合和免疫疗法。健康上皮细胞中cldn的结合表位有可能在紧密连接中被屏蔽,以阻止抗体结合。[0510]本文提供的抗体或抗原结合片段的治疗有效量将取决于本领域已知的各种因素,例如体重、年龄、既往病史、当前用药、受试者的健康状况以及潜在的交叉反应、过敏、敏感性和不良副作用,以及给药途径和疾病发展程度。如这些和其他情况或要求所示,本领域普通技术人员(例如医师或兽医)可以按比例减少或增加剂量。[0511]在某些实施方式中,本文提供的抗体或抗原结合片段可以约0.01mg/kg至约100mg/kg的治疗有效剂量施用。在某些实施方案中,施用剂量可以在治疗过程中改变。在某些实施方式中,取决于受试者的反应,给药剂量可以在治疗过程中变化。[0512]可以调整剂量方案以提供最佳的期望反应(例如,治疗反应)。例如,可以施用单一剂量,或者可以随时间施用数个分开的剂量。[0513]本文公开的抗体和抗原结合片段可以通过本领域已知的任何途径施用,例如肠胃外(例如皮下、腹腔内、静脉内,包括静脉内输注、肌肉内或皮内注射)或非肠胃外(例如,口服、鼻内、眼内、舌下、直肠或局部)途径。[0514]在一些实施方式中,本文公开的抗体或抗原结合片段可以单独施用或与一种或多种其他治疗手段或试剂组合施用。例如,本文公开的抗体或抗原结合片段可以与第二治疗剂,(例如,化疗剂、抗癌药、放射治疗、免疫治疗、抗血管生成剂、靶向治疗、细胞治疗、基因治疗、激素治疗、姑息治疗),用于癌症治疗的手术(例如,肿瘤切除术),或一种或多种止吐药或其他用于化疗引起的并发症的治疗联合施用。[0515]如本文所使用的,术语“免疫疗法”是指刺激免疫系统对抗疾病如癌症或以一般方式增强免疫系统的一种类型。免疫疗法包括被动免疫疗法,即通过递送具有确定的肿瘤免疫反应性的药物(例如,效应细胞)来进行被动免疫疗法,所述药物可以直接或间接介导抗肿瘤作用,而不必依赖完整的宿主免疫系统(例如,抗体疗法或car-t细胞疗法)。免疫疗法可以进一步包括主动免疫疗法,其中治疗依赖于内源宿主免疫系统的体内刺激,以通过施用免疫应答调节剂来对抗患病细胞。[0516]免疫疗法的实例包括但不限于检查点调节剂、过继性细胞转移、细胞因子、溶瘤病毒和治疗性疫苗。[0517]检查点调节剂可以干扰癌细胞避免免疫系统攻击的能力,并帮助免疫系统对肿瘤做出更强烈的应答。免疫检查点分子可介导共刺激信号以增强免疫应答,或可介导共抑制信号以抑制免疫应答。检查点调节剂的实例包括但不限于pd-1、pd-l1、pd-l2、clta-4、tim-3、lag3、a2ar、cd160、2b4、tgfβ、vista、btla、tigit、lair1、ox40、cd2、cd27、cd28、cd30、cd40、cd122、icam-1、ido、nkg2c、slamf7、siglec7、nkp80、cd160、b7-h3、lfa-1、icos、4-1bb、gitr、baffr、hvem、cd7、light、il-2、il-15、cd3、cd16和cd83的调节剂。[0518]过继性细胞转移,其为一种试图增强t细胞抵抗癌症的天然能力的治疗方法。在这种治疗中,从患者体内获取t细胞,并在体外扩增和激活。在某些实施方式中,t细胞在体外被修饰成car-t细胞。将对癌症最具活性的t细胞或car-t细胞在体外大量培养2至8周。在此期间,患者将接受诸如化疗和放射疗法等治疗,以降低人体的免疫力。经过这些治疗后,将体外培养的t细胞或car-t细胞输还给患者。在某些实施方式中,免疫疗法是car-t疗法。[0519]细胞因子疗法也可以用于增强向免疫系统的肿瘤抗原提呈。用于治疗癌症的两种主要细胞因子是干扰素和白介素。细胞因子疗法的实例包括但不限于干扰素(例如,干扰素-α、干扰素-β、和干扰素–γ)、集落刺激因子(例如,巨噬细胞csf、粒细胞巨噬细胞csf、和粒细胞csf)、胰岛素生长因子(igf-1)、血管内皮生长因子(vegf)、转化生长因子(tgf)、成纤维细胞生长因子(fgf)、白介素(例如,il-1、il-1α、il-2、il-3、il-4、il-5、il-6、il-7、il-8、il-9、il-10、il-11和il-12)、肿瘤坏死因子(例如,tnf-α和tnf-β)、或其任意组合。[0520]溶瘤病毒是可以杀死癌细胞的基因修饰病毒。溶瘤病毒可特异性感染肿瘤细胞,从而导致肿瘤细胞溶解,随后释放大量肿瘤抗原,从而触发免疫系统靶向并消除具有此类肿瘤抗原的癌细胞。溶瘤病毒的实例包括但不限于他莫替丁拉赫帕氏菌(talimogenelaherparepvec)。[0521]治疗性疫苗通过增强免疫系统对癌细胞的应答来抵抗癌症。治疗性疫苗可包含非致病性微生物(例如,牛分枝杆菌芽孢杆菌卡介特-卡伦菌(mycobacteriumbovisbacilluscalmette-guérin,bcg)),靶向肿瘤细胞的基因修饰病毒或一种或多种免疫原性成分。例如,bcg可以通过导管直接插入膀胱,并且可以引起针对膀胱癌细胞的免疫应答。[0522]抗血管生成剂可以阻断支持肿瘤生长的血管的生长。一些抗血管生成剂靶向vegf或其受体vegfr。抗血管生成剂的实例包括但不限于阿昔替尼、贝伐单抗、卡博替尼、依维莫司、来那度胺、甲磺酸来那替尼、帕唑帕尼、拉莫昔单抗、雷戈拉非尼、索拉非尼、舒尼替尼、沙利度胺、凡德他尼和齐夫-阿非贝西普。[0523]“靶向疗法”是一种作用于与癌症相关的特定分子的疗法,例如存在于癌细胞中但不存在于正常细胞中或在癌细胞中含量更高的特定蛋白质,或癌症微环境中有助于癌症生长和存活的靶分子。靶向疗法将治疗剂靶向肿瘤,从而使正常组织免受治疗剂的影响。[0524]靶向疗法可以靶向例如酪氨酸激酶受体和核受体。此类受体的实例包括erbb1(egfr或her1)、erbb2(her2)、erbb3、erbb4、fgfr,源于血小板的生长因子受体(pdgfr)和胰岛素样生长因子-1受体(igf-1r)、雌激素受体(er)、核受体(nr)和pr。[0525]靶向疗法可以靶向酪氨酸激酶或核受体信号级联反应中的分子,例如erk和pi3k/akt、ap-2α,ap-2β,ap-2γ、促分裂原激活的蛋白激酶(mapk)、pten、p53、p19arf、rb、apaf-1、cd-95/fas、trail-r1/r2、caspase-8、forkhead、box03a、mdm2、iap、nf-kb、myc、p13k、ras、flip、调蛋白(hrg)(也称为gp30)、bcl-2、bcl-xl、bax、bak、bad、bok、bik、blk、hrk、bnip3、biml、bid和egl-1。[0526]靶向疗法还可以靶向与肿瘤相关的配体,例如雌激素(estrogen)、雌二醇(e2)、孕酮、雌激素(oestrogen)、雄激素、糖皮质激素、催乳激素、甲状腺激素、胰岛素、p70s6激酶蛋白(ps6)、存活蛋白、成纤维细胞生长因子(fgf)、egf、neu分化因子(ndf)、转化生长因子α(tgf-α)、il-1a、tgf-β、igf-1、igf-ii、igfbp、igfbp蛋白酶和il-10。[0527]在这些实施方式中的某些实施方式中,与一种或多种另外的治疗剂组合施用的本文公开的抗体或抗原结合片段可以与一种或多种另外的治疗剂同时施用,并且在这些实施方式的某些实施方式中,抗体或抗原结合片段和另外的治疗剂可以作为相同药物组合物的一部分施用。然而,与另一种治疗剂“组合”施用的抗体或抗原结合片段不必与该药剂同时或以相同的组合物施用。即使抗体或抗原结合片段和第二药剂是通过不同途径施用,但是在另一种药剂之前或之后施用的抗体或抗原结合片段被认为是本文所用的短语与该药剂“组合”施用。在可能的情况下,可根据另外的治疗剂产品信息表中列出的时间表,或根据physicians'sdeskreference2003(physicians'deskreference,57thed;medicaleconomicscompany;isbn:1563634457;57thedition(november2002))或本领域公知的方案,施用与本文公开的抗体或抗原结合片段组合施用的另外的治疗剂。[0528]本公开进一步提供了使用抗cldn18.2抗体或其抗原结合片段的方法。在一些实施方式中,本公开提供了体内或体外抑制表达cldn18.2的细胞生长的方法,所述方法包括:使表达cldn18.2的细胞与本文提供的抗体或其抗原结合片段接触。在一些实施方式中,本公开提供了在表达cldn18.2的细胞中调节cldn18.2活性的方法,所述方法包括将表达cldn18.2的细胞暴露于本文提供的抗体或其抗原结合片段。[0529]在一些实施方式中,本公开提供了检测源于受试者的样品中cldn18.2的存在或含量的方法,所述方法包括使样品与抗体或其抗原结合片段接触,并确定样本中的cldn18.2的存在或含量。在某些实施方式中,生物样品包含癌细胞。[0530]在一些实施方式中,本公开提供了在受试者中诊断与cldn18.2相关的疾病或病况的方法,所述方法包括:a)将从所述受试者获得的样品与本文提供的抗体或其抗原结合片段接触;b)测定在所述样品中cldn18.2的存在或含量;以及c)将所述cldn18.2的存在或含量与所述受试者中cldn18.2相关疾病或病况的存在或状态相关联。在某些实施方式中,生物样品包含癌细胞。在一些实施方式中,癌细胞中cldn18.2的表达水平通过ihc测定(例如,根据本文提供的实施例15的第6节和第7节中描述的方法)。在一些实施方式中,受试者被鉴定为具有cldn18.2高表达癌细胞、cldn18.2中等表达癌细胞、或cldn18.2低表达癌细胞。[0531]在一些实施方式中,该方法进一步包括向受试者施用治疗有效量的本文提供的抗体或其抗原结合片段。在一些实施方式中,受试者具有cldn18.2中等表达癌细胞、或cldn18.2的低表达癌细胞。[0532]在一些实施方式中,本公开提供了试剂盒,所述试剂盒包括本文提供的抗体或其抗原结合片段,其可选地与可检测部分缀合。该试剂盒可用于检测生物样品中cldn18.2的存在或含量,或可用于本文提供的诊断方法。[0533]在一些实施方式中,本公开提供了试剂盒,所述试剂盒包括本文提供的抗体或其抗原结合片段和第二治疗剂。该试剂盒可用于治疗、预防和/或改善cldn18.2相关疾病。[0534]在一些实施方式中,本公开还提供了本文提供的抗体或其抗原结合片段在制备用于治疗受试者中cldn18.2相关疾病或病况的药物中的用途。实施例[0535]虽然参考特定实施方式(其中一些是优选实施方式)已经特别地示出和描述了本公开,但是本领域技术人员应当理解,在不脱离在本公开的主旨和范围的条件下,可以在形式和细节上做多种改变。[0536]实施例1:cldn18.2或cldn18.1表达细胞系的制备[0537]1.hek293-人cldn18.2、hek293-人cldn18.1和hek293-小鼠cldn18.2细胞系的生成[0538]由迈博斯生物医药(苏州)有限公司构建hek293-人cldn18.2细胞(以下称为hek293-cldn18.2)和hek293-小鼠cldn18.2细胞(以下称为hek293-mcldn18.2)。简而言之,用pcdna3.1/hcldn18.2或pcdna3.1/mcldn18.2质粒转染hek293细胞(上海生物科学研究院,目录号gnhu43),并用g418选择以获得稳定表达的细胞系hek293-cldn18.2或hek293-mcldn18.2。使用可以与人和小鼠cldn18.2结合的imab362抗体检测了hcldn18.2或mcldn18.2的表达水平。imab362根据us2009169547a1中公开的序列进行表达。选择具有最高信号的单细胞克隆并扩增以用于细胞储存。[0539]imab362的重链可变区(seqidno:72)[0540]qvqlqqpgaelvrpgasvklsckasgytftsywinwvkqrpgqglewigniypsdsytnynqkfkdkatltvdkssstaymqlssptsedsavyyctrswrgnsfdywgqgttltvss[0541]imab362的轻链可变区(seqidno:73)[0542]divmtqspssltvtagekvtmsckssqsllnsgnqknyltwyqqkpgqppklliywastresgvpdrftgsgsgtdftltissvqaedlavyycqndysypftfgsgtkleik[0543]也如上所述构建hek293-人cldn18.1细胞(以下称为hek293-cldn18.1)。用识别cldn18.1和cldn18.2的抗-cldn18抗体(abcam,目录号ab222513)检测cldn18.1的表达。[0544]2.cho-cldn18.2瞬时表达细胞的产生[0545]按照如下构建cho-cldn18.2表达细胞:用不含选择试剂的pcdna3.1/cldn18.2瞬时转染cho细胞。使用mem-pertmplus膜蛋白提取试剂盒提取细胞膜蛋白,并将细胞膜蛋白用于动物免疫增强。[0546]3.mkn45-cldn18.2瞬时表达细胞的产生[0547]mkn45-cldn18.2细胞由迈博斯生物医药(苏州)有限公司构建。简而言之,用pcdna3.1/cldn18.2质粒转染mkn45细胞(国家细胞系资源目录,目录号3111c0001ccc000229),并用g418选择以获得稳定表达的细胞系mkn45-cldn18.2。采用facs方法通过imab362抗体检测cldn18.2的表达水平。选择具有最高、中等和低信号的单克隆细胞,并将其扩增以用于细胞储存。[0548]以上所述细胞系用于以下的实验中。[0549]实施例2:抗体的产生[0550]1.免疫接种[0551]制备dna和细胞免疫原以进行免疫接种。将6-8周龄的不同品系的小鼠分为两组。一组的初始免疫和增强免疫是通过静脉注射100μg/小鼠pvac2-mcs/cldn18.2质粒和100μg/小鼠cpg进行的。另一组是通过肌肉注射相同的dna和cpg进行的。两组均在第1天和第10天注射,并在第18天通过facs结合hek293-cldn18.2细胞检测抗体滴度。将100μl/孔稀释的小鼠血清添加到含有hek293-cldn18.2或胃癌nugc4细胞(jcrb,目录号jcrbb0834)的孔板中,然后在4℃孵育30分钟。用缓冲液清洗后,加入100μl/孔的山羊抗-migg-fitc(1:500稀释),在4℃下再孵育30分钟。随后用facs清洗缓冲液清洗,通过流式细胞术分析细胞。选择具有更高结合信号和滴度的小鼠用于以下融合步骤。[0552]2.融合[0553]在融合前的四天,每只小鼠腹膜内注射5×107hek293-cldn18.2细胞。在融合当天,无菌去除脾脏,然后将其加工成单一的细胞悬液。将活的对数期骨髓瘤细胞(sp2/0)与鼠脾细胞在融合培养基中以1:1的比例混合,然后电融合1分钟。将细胞重悬并在37℃、5%co2的培养箱中,以200μl/孔在96孔培养板中进行培养。培养7天后,将生长培养基更换为新鲜的生长培养基,然后在2-3天后筛选杂交瘤上清液。[0554]实施例3:抗体筛选[0555]1.通过facs试验筛选人cldn18.2阳性结合物[0556]将表达cldn18.2的hek293-cldn18.2对数期细胞以每孔105/100μl的密度重悬于pbs中。使用facs清洗缓冲液(pbs 2%fbs)洗涤细胞3次后,将100μl/孔杂交瘤细胞上清液添加到每个孔中,在4℃下孵育30分钟。再次,使用facs清洗缓冲液洗涤细胞3次,然后与100μl/孔的山羊抗-migg-fitc(1:400稀释)在4℃下再孵育30分钟。使用facs清洗缓冲液进行3次最终洗涤后,通过流式细胞术分析细胞。[0557]2.通过facs试验筛选人cldn18.1阴性结合物[0558]将表达cldn18.1的hek293-cldn18.1对数期细胞以每孔105/100μl的密度重悬于pbs中。使用facs清洗缓冲液(pbs 2%fbs)洗涤细胞3次后,将100μl/孔杂交瘤细胞上清液添加到每个孔中,在4℃下孵育30分钟。再次,使用facs清洗缓冲液洗涤细胞3次,然后与100μl/孔的山羊抗-migg-fitc(1:400稀释)在4℃下再孵育30分钟。使用facs清洗缓冲液进行3次最终洗涤后,通过流式细胞术分析细胞。[0559]选择具有高cldn18.2结合信号但没有cldn18.1结合信号的克隆用于随后的亚克隆以产生单克隆,包括7c12、11f12、12e9、26g6、59a9、18b10和12c12。[0560]实施例4:阳性杂交瘤克隆的亚克隆和小规模抗体制备[0561]1.阳性杂交瘤克隆的亚克隆[0562]选择来自facs阳性杂交瘤孔的具有所需结合特征的细胞在96孔板中进行有限稀释。使这些细胞生长7天。当达到足够的细胞量时,收集每个孔的上清液,并使用细胞结合试验进行重新筛选(参见实施例3)。[0563]从每个96孔板中,将具有最高细胞结合活性的克隆扩增到每孔含200μl杂交瘤生长培养基的96孔板中进行第二轮有限稀释。7天后,通过facs试验分析来自96孔板的细胞的上清液。亚克隆进行了2次以上,直到超过90/96孔显示出阳性结合信号。鉴定具有最高结合活性的克隆,并进一步扩增和培养以产生抗体。使用标准方法确定同种型。[0564]2.小规模抗体制备[0565]接种杂交瘤细胞并培养14天。使用蛋白质a色谱柱(蛋白质a高性能(bio-rad))通过亲合色谱法从杂交瘤细胞培养物中纯化cldn18.2单克隆抗体(mab)。[0566]纯化后,使用10,000mwco膜(pierceslide-a-lyzer或透析管)通过透析在pbs中配制cldn18.2mab,然后进行过滤步骤。[0567]实施例5:纯化的cldn18.2杂交瘤抗体的细胞结合分析[0568]将对数期的hek293-cldn18.2和nugc4细胞在pbs中重悬。使用facs清洗缓冲液(pbs 2%fbs)洗涤细胞3次后,将100μl/孔稀释的400nm到0.002nm范围的杂交瘤抗体加入到每个孔中于4℃孵育30分钟。再次,使用facs清洗缓冲液洗涤细胞3次,然后与100μl/孔的山羊抗-migg-fitc(1:400稀释)在4℃下再孵育30分钟。使用facs洗涤缓冲液进行3次最终洗涤后,通过流式细胞术分析细胞。[0569]大多数杂交瘤抗体显示出与hek293-cldn18.2细胞的高亲和结合力,但与nugc4细胞的结合力却较低。结合差异可能是由于这两种细胞系中cldn18.2蛋白的不同表达密度,构象和/或糖基化状态。有趣的是,7c12、11f12、59a9和18b10具有与hek293-cldn18.2和nugc4细胞相当的结合亲和力(图1a-1d,表4)。选择这些杂交瘤抗体用于基因克隆和嵌合抗体表达,以用于进一步的功能性adcc/cdc表征。[0570]表4[0571][0572]实施例6:嵌合抗体的产生[0573]通过聚合酶链式反应(pcr)扩增从候选杂交瘤细胞系中获得小鼠抗人cldn18.2抗体轻链和重链可变区的序列。经过测序分析并确认后,将包括与人iggkappa恒定区融合的轻链可变区(vl)序列和与人igg1恒定区融合的重链可变区(vh)序列的上述可变区基因克隆到重组表达载体pcdna3.1( )中,用于抗体产生和纯化。[0574]使用具有来自重链载体和轻链载体的等量dna的expicho转染试剂盒转染expicho细胞。将转染的细胞在摇瓶中以125rpm的速度于8%co2和37℃的培养箱中进行培养。在第10天收集细胞培养物,并使用亲和色谱纯化收集的抗体。使用sds-page和空间排阻色谱(tskgelg3000swxl,tosoh)分析所得抗体以确定纯度水平。嵌合抗体命名为:7c12-c、11f12-c、12e9-c、26g6-c、59a9-c、18b10-c和12c12-c。[0575]实施例7:纯化的嵌合cldn18.2抗体的表征[0576]1.对hek293-cldn18.2细胞的结合和细胞毒性作用[0577]按照实施例5所述的方法检测嵌合抗体的细胞结合。[0578]如图2a所示,具有非常相似的cdr(只有2-3个氨基酸不同)的7c12-c、11f12-c和12e9-c以约为0.6μg/ml的ec50与hek293-cldn18.2细胞结合。26g6-c的ec50为1.1μg/ml。59a9-c和18b10-c是后续产生的,因此分别对其进行测试。如图2c所示,具有不同种系和cdr的59a9-c的ec50(1.3μg/ml)比18b10-c(1.0μg/ml)稍高。[0579]cdc(补体依赖的细胞毒性)是免疫保护的重要机制。因此,此处将cdc试验用于评估抗体的生物效价。简而言之,将对数期的hek293-cldn18.2细胞重悬于含10%fbs的rpmi1640中。将这些细胞以每孔8×103/100μl铺板。使用含有20mmhepes和40%人血清的60%rpmi1640稀释抗cldn18.2嵌合抗体和对照抗体imab362,然后以10至0.0012μg/ml的最终浓度,100μl/孔,加到细胞板中。将板在37℃下孵育80分钟。接下来,使细胞培养板平衡至室温,持续30分钟。通过酶标仪(thermovarioskanflash3001),在室温下,用celltiter-glo发光细胞活力测定试剂盒进行细胞活力分析。[0580]如图2b和2d所示,与imab362相比,所有6种cldn18.2嵌合抗体均以较低的浓度诱导cdc效应。4种抗体(7c12-c、11f12-c、12e9-c和26g6-c)的效价比imab362提高了2倍以上。与imab362相比,59a9-c和18b10-c的效价提高了3倍以上。[0581]2.对mkn45-cldn18.2细胞的结合和细胞毒性作用[0582]mkn45是低分化胃腺癌,适合于评估体内抗肿瘤功效。但是,除非转染,否则mkn45细胞不表达人类cldn18.2。我们发现在mkn45细胞上,人cldn18.2的不同表达水平赋予cldn18.2抗体不同的敏感性。接下来,选择较高和中等cldn18.2表达的mkn45细胞(见图21)进行以下研究。[0583]使用较高和中等cldn18.2表达的mkn45细胞,如实施例5中所述,进行嵌合抗体的细胞结合测定。如图3a(高)和3c(中)所示,18b10-c以比imab362显著更高的亲和力与较高和中等表达hcldn18.2的细胞结合。在mkn45-cldn18.2-高细胞中,18b10-c的效价比imab362提高了约2倍。在mkn45-cldn18.2-中细胞中看到了更为显著的差异,18b10-c显示ec50为0.96μg/ml,而imab362没有结合。[0584]使用jurkat-nfat-luc-fcγriiia-v176细胞作为效应细胞和mkn45-cldn18.2细胞作为靶细胞来评估adcc活性。jurkat-nfat-luc-fcγriiia-v176细胞由迈博斯生物医药(苏州)有限公司构建。简而言之,用pgl4.30-luc/nfat-re/hygro质粒转染jurkat细胞(上海生物科学研究所,目录号scsp-513),并用潮霉素进行选择以获得稳定表达的细胞系jurkat-nfat-luc。用pcdna3.1-fcγriiia-v176质粒进一步转染jurkat-nfat-luc细胞系,并用抗生素g418选择以获得稳定表达的细胞系jurkat-nfat-luc-fcγriiia-v176。[0585]接下来,将对数期靶细胞重悬于具有10%fbs的rpmi1640中,然后以每孔1×104个细胞铺板,在37℃下孵育30分钟。通过使用含有10%fbs的rpmi1640稀释抗-hcldn18.2嵌合抗体和对照抗体imab362,然后以100至0.0017μg/ml的最终浓度将其加到靶细胞板中。将对数期的jurkat-nfat-luc-fcγriiia-v176细胞以每孔6×104个细胞添加到上述板中。将板在37℃下孵育6小时。接下来,将细胞培养板平衡至室温,持续30分钟。使用酶标仪(thermovarioskanflash3001),在室温下用celltiter-glo发光细胞活力测定试剂盒进行细胞活力分析。[0586]基于报告基因的读出曲线,可以计算ec50并将其用于评估adcc效应。如使用mkn45-cldn18.2-高细胞的图3b所示,尽管imab362可以计算ec50的点较少,但两条曲线表明18b10-c具有比imab362更好的adcc活性。如图3d所示,在mkn45-cldn18.2中细胞中,如通过ec50所测量的,18b10-c的adcc效价比imab362高50倍以上。这些结果表明,具有cldn18.2中等表达的细胞可能比高表达细胞更好地将18b10-c抗体与imab362区分开。在mkn45-hcldn18.2细胞上未观察到cdc活性(数据未显示)。[0587]3.对nugc4细胞的结合和细胞毒性作用[0588]nugc4代表具有与来自胃癌患者类似的hcldn18.2表达水平的胃细胞系。[0589]按照上述相同的方法(参见本实施例的第2节)进行细胞结合试验和adcc报告基因分析。如图4a和4c所示,除26g6-c和59a9-c外,6种嵌合抗体中的5种以大约10μg/ml的ec50与nugc4细胞结合(参见表5)。26g6-c以较高的ec50(67μg/ml)与nugc4结合,表明了较低的亲和力。59a9-c显示更高的ec50(19μg/ml)和更低的最大信号。另外,图4b和4d显示了针对nugc4细胞,它们adcc活性的相似趋势。由于两个单独的实验,ec50和最大信号可能会在图4b和图4d之间不同。重要的是,所有测试的嵌合抗体均显示出比imab362更好的adcc活性,尤其是18b10-c比imab362高40倍以上。在nugc4细胞上未观察到cdc活性(数据未显示)。[0590]表5总结了所有嵌合抗体和imab362对hek293-cldn18.2和nugc4细胞的facs结合数据。[0591]表5[0592][0593]4.嵌合cldn18.2抗体的特异性[0594]cldn18.2仅有几种氨基酸与存在于许多正常组织和器官中的cldn18.1不同。对cldn18.2的抗体结合特异性是非常重要的。细胞结合试验与上述相同(参见本实施例的第1节)。图5显示了18b10-c和imab362与表达cldn18.2或cldn18.1的hek293细胞的结合。两种抗体仅结合表达cldn18.2的细胞,而不结合表达cldn18.1的细胞。其他嵌合抗体也具有相似的良好选择性(数据未显示)。[0595]实施例8:表位结合[0596]杂交瘤抗体与基准抗体竞争结合表达cldn18.2的细胞[0597]将对数期mkn45-cldn18.2-高细胞重悬于facs清洗缓冲液(具有2%bsa的pbs)中,然后以每孔1×105个细胞的密度加入到96孔v底板中。将稀释的杂交瘤抗体或imab362-migg2a(终浓度:100至0.01μg/ml)加到培养板中。将板在4℃下孵育1小时以使抗体完全占据细胞表面上的抗原。将细胞用facs清洗缓冲液洗涤2次,然后将10μg/mlimab362或5μg/ml18b10-c添加到细胞中,在4℃下进一步孵育1小时。然后将细胞洗涤3次,并与山羊抗-higg(h l)-fitc(1:200稀释)一起孵育。最后,使用facs清洗缓冲液洗涤细胞3次,并通过流式细胞术进行分析。[0598]如图6a和6b所示,杂交瘤抗体18b10可以完全阻断imab362与mkn45-cldn18.2细胞的结合,这表明18b10可能比imab362具有更高的结合亲和力,但依赖于相似或附近的氨基酸(表6)。[0599]表6[0600][0601]√:完全阻断;部分:部分阻断;-:未检测到[0602]实施例9:在与cldn18.1不同的cldn18.2氨基酸上通过定点诱变对选定的抗体进行表位鉴定[0603]1.人cldn18.2-mrfp和人cldn18.1-mrfp构建体的产生[0604]编码人cldn18.1(氨基酸1-261,seqidno:31)-mrfp1(氨基酸1-225)和人cldn18.2(氨基酸1-261,seqidno:30)-mrfp1(氨基酸1-225)的cdna是在体外合成的(seqidno:52和seqidno:53分别是氨基酸序列)。然后按照制造商的说明使用syno组装混合试剂(synbio),通过同源重组的方法将pcr产物克隆到pcdna3.1( )载体中。使用qiagenplasmidmega试剂盒(qiagen)纯化质粒。[0605]根据人cldn18.1和cldn18.2的序列(genbank登录号:剪接变体1(cldn18.1):np_057453,nm_016369和剪接变体2(cldn18.2):nm_001002026,np_001002026),8种不同的氨基酸位于28-70之间,这可能是与人cldn18.2特异性结合而不与cldn18.1特异性结合的决定因素。使用上述产生的野生型人cldn18.2-mrfp质粒作为模板,用引物产生了一个整合序列的两个片段。在人cldn18.2-mrfp的指定位置上具有单个氨基酸改变的变体是通过使用引物的重叠pcr进行扩增的。特异性突变在q29m、n37d、a42s、n45q、q47e、e56q、g65p和l69i上。在人cldn18.1-mrfp的指定位置上具有单个氨基酸改变的变体是通过使用引物的重叠pcr进行扩增的。特定突变在m29q、d37n、s42a、q45n、e47q、q56e、p65g、i69l上。然后通过同源重组的方法将pcr产物克隆到pcdna3.1( )载体中。通过对单个阳性克隆进行测序来鉴定并确认人cldn18.2-mrfp变体。[0606]随后,将这些突变体和野生型人cldn18.2-mrfp或人cldn18.1-mrfp的质粒转染到hek293细胞系中。首先,将5×106个hek293细胞以60%~80%的比例接种到60mm培养皿中进行转染。将400μl1×hbs中的10μgdna和10μl25kda线性pei转染试剂(溶于1×hbs中,1mg/ml储备液)混合,以达到1:2.5的dna/pei比。接下来,将混合物逐滴加入hek293细胞培养物中。6-8小时后,将转染的细胞培养液更换为完全dmem,过夜。转染后24小时,收集细胞,使用嵌合抗体进行facs分析。[0607]人cldn18.1的氨基酸序列(seqidno:31)[0608]mstttcqvvafllsilglagciaatgmdmwstqdlydnpvtsvfqyeglwrscvrqssgftecrpyftilglpamlqavralmivgivlgaigllvsifalkcirigsmedsakanmtltsgimfivsglcaiagvsvfanmlvtnfwmstanmytgmggmvqtvqtrytfgaalfvgwvaggltliggvmmciacrglapeetnykavsyhasghsvaykpggfkastgfgsntknkkiydggartedevqsypskhdyv[0609]人cldn18.1-mrfp1的氨基酸序列(seqidno:52)[0610]mstttcqvvafllsilglagciaatgmdmwstqdlydnpvtsvfqyeglwrscvrqssgftecrpyftilglpamlqavralmivgivlgaigllvsifalkcirigsmedsakanmtltsgimfivsglcaiagvsvfanmlvtnfwmstanmytgmggmvqtvqtrytfgaalfvgwvaggltliggvmmciacrglapeetnykavsyhasghsvaykpggfkastgfgsntknkkiydggartedevqsypskhdyvmassedvikefmrfkvrmegsvnghefeiegegegrpyegtqtaklkvtkggplpfawdilspqfqygskayvkhpadipdylklsfpegfkwervmnfedggvvtvtqdsslqdgefiykvklrgtnfpsdgpvmqkktmgweastermypedgalkgeikmrlklkdgghydaevkttymakkpvqlpgayktdiklditshnedytiveqyeraegrhstga[0611]人cldn18.2的氨基酸序列(seqidno:30)[0612]mavtacqglgfvvsligiagiiaatcmdqwstqdlynnpvtavfnyqglwrscvressgftecrgyftllglpamlqavralmivgivlgaigllvsifalkcirigsmedsakanmtltsgimfivsglcaiagvsvfanmlvtnfwmstanmytgmggmvqtvqtrytfgaalfvgwvaggltliggvmmciacrglapeetnykavsyhasghsvaykpggfkastgfgsntknkkiydggartedevqsypskhdyv[0613]人cldn18.2-mrfp1的氨基酸序列(seqidno:53)[0614]mavtacqglgfvvsligiagiiaatcmdqwstqdlynnpvtavfnyqglwrscvressgftecrgyftllglpamlqavralmivgivlgaigllvsifalkcirigsmedsakanmtltsgimfivsglcaiagvsvfanmlvtnfwmstanmytgmggmvqtvqtrytfgaalfvgwvaggltliggvmmciacrglapeetnykavsyhasghsvaykpggfkastgfgsntknkkiydggartedevqsypskhdyvmassedvikefmrfkvrmegsvnghefeiegegegrpyegtqtaklkvtkggplpfawdilspqfqygskayvkhpadipdylklsfpegfkwervmnfedggvvtvtqdsslqdgefiykvklrgtnfpsdgpvmqkktmgweastermypedgalkgeikmrlklkdgghydaevkttymakkpvqlpgayktdiklditshnedytiveqyeraegrhstga[0615]2.cldn18.2嵌合抗体与位点突变的hek293-cldn18.2或hek293-cldn18.1细胞的结合[0616]将转染的hek293-cldn18.2或hek293-cldn18.1细胞以105/孔的密度、100μl/孔重悬于含2%bsa的pbs中。用facs清洗缓冲液(pbs 2%fbs)洗涤细胞3次,并与100μl/孔、10μg/ml的嵌合抗体和imab362在4℃下孵育30分钟。接下来,将细胞用facs清洗缓冲液洗涤3次,并与100μl/孔的山羊抗higg(h l)-fitc(1:200稀释)在4℃下再孵育30分钟。最后,使用facs清洗缓冲液洗涤细胞3次,并通过流式细胞术进行分析。为了分析与cldn18.2转染细胞的结合,将rfp阳性细胞用于对照门控。[0617]表7计算并总结了这些嵌合抗体与突变的cldn18.2变体的结合信号相比于与野生型的结合信号的百分比。如图7a-7b所示,当e56突变为q时,18b10-c的结合完全消失。这种变化也适用于imab362和其他嵌合抗体,但59a9-c除外。此外,我们发现其他氨基酸(例如a42、n45)也在一定程度上参与了imab362和其他抗体的结合,但此种情况不适用于18b10-c。[0618]表7[0619][0620][0621]实施例10:人源化抗体的产生和表征[0622]1.人源化抗体18b10的产生、表达和纯化[0623]用于轻链的人种系框架序列vk/4-1和用于重链的vh/1-46分别用于cdr移植。[0624]通过将三个cdr直接移植到种系序列(18b10hc种系,seqidno:23),并且分别对于hc变体1(hu18b10_ha,seqidno:25)进行r71i、t73k反向突变,对于hc变体2(hu18b10_hb,seqidno:27)进行r71i、t73k、t28s、m69l反向突变以及对于hc变体3(hu18b10_hc,seqidno:29)进行r71i、t73k、t28s、m69l、r38k、m48i反向突变来获得重链(hc)变体1、2和3。[0625](1)18b10hc的种系序列:[0626]vh/1-46(18b10-种系,seqidno:23):[0627]qvqlvqsgaevkkpgasvkvsckasgytftsyymhwvrqapgqglewmgiinpsggstsyaqkfqgrvtmtrdtststvymelsslrsedtavyycar[0628]vh/1-46变体1(hu18b10_ha,seqidno:25):[0629]qvqlvqsgaevkkpgasvkvsckasgytftgynmnwvrqapgqglewmgnidpyyggtsynqkfkgrvtmtidkststvymelsslrsedtavyycarmyhgnafdywgqgttvtvss[0630]vh/1-46变体2(hu18b10_hb,seqidno:27):[0631]qvqlvqsgaevkkpgasvkvsckasgysftgynmnwvrqapgqglewmgnidpyyggtsynqkfkgrvtltidkststvymelsslrsedtavyycarmyhgnafdywgqgttvtvss[0632]vh/1-46变体3(hu18b10_hc,seqidno:29):[0633]qvqlvqsgaevkkpgasvkvsckasgysftgynmnwvkqapgqglewignidpyyggtsynqkfkgrvtltidkststvymelsslrsedtavyycarmyhgnafdywgqgttvtvss[0634]通过将三个cdr直接移植到种系序列(18b10lc种系,seqidno:24),并且变体1(hu18b10_la,seqidno:26)不进行反向突变,和对lc变体2(hu18b10_lb,seqidno:28)进行s63t、i21m反向突变来获得轻链(lc)变体1和2。[0635](2)18b10lc的种系序列:[0636]vk/4-1(18b10lc种系,seqidno:24)[0637]divmtqspdslavslgeratinckssqnnknylawyqqkpgqppklliywastresgvpdrfsgsgsgtdftltisslqaedvavyycqqyystp[0638]vk/4-1变体1(hu18b10_la,seqidno:26)[0639]divmtqspdslavslgeratinckssqsllnsgnlknyltwyqqkpgqppklliywastrksgvpdrfsgsgsgtdftltisslqaedvavyycqndysypltfgggtkveik[0640]vk/4-1变体2(hu18b10_lb,seqidno:28)[0641]divmtqspdslavslgeratmnckssqsllnsgnlknyltwyqqkpgqppklliywastrksgvpdrftgsgsgtdftltisslqaedvavyycqndysypltfgggtkveik[0642]以上所述的重链可变区和轻链可变区组合形成了以下的人源化18b10抗体:[0643]18b10-hala(具有seqidno:25的vh和seqidno:26的vl),18b10-hbla(具有seqidno:27的vh和seqidno:26的vl),18b10-hcla(具有seqidno:29的vh和seqidno:26的vl),18b10-halb(具有seqidno:25的vh和seqidno:28的vl),18b10-hblb(具有seqidno:27的vh和seqidno:28的vl),18b10-hclb(具有seqidno:29的vh和seqidno:28的vl)。[0644]如下所示的,18b10的重链和轻链的人源化变体与人igg1重链恒定区和kappa轻链恒定区相连接:[0645]人igg1重链恒定区(seqidno:49):[0646]astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk[0647]人kappa轻链恒定区(seqidno:50):[0648]rtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec[0649]合成上述重链和轻链cdna的可变区,并与人igg1和人kappa的恒定区融合。将所选抗体基因的重链和轻链克隆到表达载体中,并使用来自qiagen的plasmidmaxiprepsystem大规模地制备dna。按照生产商的操作说明,使用invitrogen的expifectaminetmcho试剂进行转染。当细胞活力为约60%时收集上清液。将细胞培养上清液通过0.22um滤膜过滤以除去细胞碎片。将上清液加到预先平衡的蛋白质a亲合柱上。然后,用平衡缓冲液(pbs)洗涤柱内的proteina树脂,并使用25mm柠檬酸盐(ph3.5)洗脱抗体。用1mtris-碱(ph9.0)将ph调节至约6.0-7.0。内毒素控制在1eu/mg以下。然后通过sds-page和sec-hplc表征纯化的抗体。[0650]2.与人和小鼠cldn18.2的结合[0651]按照与实施例5中所述的相同的方法测试人源化抗体的结合。[0652]如图8a所示,所有人源化变体都与嵌合变体进行了头对头测试,以筛选出最佳变体。所有变体均完全保留了它们的结合。接下来,测试仅具有一个反向突变的18b10-hala与hek293-小鼠cldn18.2细胞的结合(图8b)。18b10-hala可以以比imab362更好的效价和更高的mfi与小鼠cldn18.2很好地结合,这表明18b10-hala对小鼠具有良好的交叉反应性。[0653]3.通过kinexa进行的人源化cldn18.2抗体的亲合性分析[0654]通过kinexa头对头评估18b10-hala和imab362与表达cldn18.2的细胞的结合亲合力。按照kinexa4000(sapidyneinstrumentsinc.)的说明,用30μg山羊抗人iggfc抗体将200mgpmma硬珠(sapidyne,#440176)包被2h,然后用10mg/mlbsa封闭1h。在对数期收集两个胃细胞系nugc4和katoiii(atcc,目录号htb-103),并与0.2nm18b10-hala或imab362混合。用0.2nm18b10-hala或imab362将细胞-抗体混合物稀释2倍,并在室温下孵育3小时。游离抗体的数量随着稀释而增加。用山羊抗人iggfc包被的珠子捕获这些游离抗体,然后用1μg/mlalexafluor647抗人igg标记以读取结果。[0655]每种抗体的结合亲合力总结在表8中。18b10-hala与nugc4细胞和katoiii结合的kd约为0.3nm,比imab362高8倍以上。这与上述的facs结合结果相一致。[0656]表8.cldn18.2抗体对胃细胞系的kd[0657]kd(nm)18b10-halaimab362nugc40.3032.58katoiii0.315nd[0658]4.hek293-cldn18.2细胞上的cdc试验[0659]与上述方法(参见实施例7的第1节)相似,在cdc活性测定中,用imab362对18b10-hala进行了头对头测试。如图9所示,18b10-hala的cdc活性比imab362高20倍以上。在浓度为0.3μg/ml的情况下,依赖18b10-hala的特异性细胞杀伤百分比达到86%,而imab362在相同浓度下没有细胞杀伤力。[0660]5.对mkn45-cldn18.2细胞的结合和细胞毒性作用[0661]细胞结合测定与上述相同。如图10a所示,所有18b10的人源化变体结合具有与嵌合18b10相当的亲合力的细胞。选择仅具有一个反向突变的18b10-hala进行进一步的adcc活性研究。[0662]使用jurkat-nfat-luc-fcγriiia-v176细胞作为效应细胞和mkn45-cldn18.2细胞作为靶细胞来测试adcc活性。试验方案与上述相同(参见实施例7的第2节)。如图10b中所示,18b10-hala的ec50(0.05μg/ml)比imab362低得多,这与嵌合的18b10一致。[0663]6.对nugc4细胞的结合和细胞毒性作用[0664]细胞结合和adcc试验与上述相同。图11a显示了18b10-hala与nugc4细胞的结合亲合力结果。图11b显示了与imab362相比,18b10-hala(ec50~0.59μg/ml)更好的adcc效价。[0665]7.使用nugc4作为靶细胞并且pbmc作为效应细胞的adcc试验[0666]将对数期nugc4细胞重悬于具有10%fbs的rpmi1640中。将细胞以每孔1×104个细胞预接种到96孔u底板中。将抗cldn18.2抗体和imab362在含10%fbs的rpmi1640中进行梯度稀释,并以200至0.2μg/ml的终浓度加至上述板中,并在37℃下孵育30分钟。从液氮中移出来自苗舜(上海)生物技术有限公司的冷冻pbmc,并立即放入37℃水浴中。离心后,将细胞重悬于添加了10%fbs的rpmi1640中,并以每孔40×104个细胞接种到上述96孔u底板中。然后将板在37℃的培养箱中放置5小时。[0667]孵育后,将板平衡至22℃。使用promegacytotox-one均质膜完整性测定试剂盒(g7892)或非放射性细胞毒性试验(g1780)检测ldh。在按照生产商的说明添加裂解液、试剂和终止液后,在激发波长560nm和发射波长590nm(g7892)或490nm或492nm的吸光度(g1780)下测量荧光。[0668]图12显示了使用pbmc作为效应细胞的代表性数据。18b10-hala显示出比imab362更好的adcc效价。由于不符合回归曲线,因此可能无法准确计算ec50。[0669]8.使用人cldn18.2上的定点诱变对所选抗体进行表位鉴定[0670]使用与实施例9相同的方法和人cldn18.2-mrfp质粒,将如下所列的人cldn18.228-80之间的42个氨基酸替换为丙氨酸,每次替换一个。使用引物通过重叠pcr扩增这些变体。特定突变为q28a,q29a,w30a,s31a,t32a,q33a,d34a,l35a,y36a,n37a,n38a,v40a,t41a,v43a,f44a,n45a,y46a,q47a,l49a,w50a,r51a,s52a,v54a,r55a,e56a,e56a,s57a,s58a,f60a,t61a,e62a,r64a,y66a,f67a,t68a,l69a,l70a,l72a,m75a,l76a,q77a,v79a,r80a。然后按照生产商的说明,使用syno组装混合试剂(synbio),通过同源重组的方法将pcr产物克隆到pcdna3.1( )载体中。使用qiagenplasmidmegakit(qiagen)纯化质粒。[0671]随后,将这些突变体和野生型cldn18.2-mrfp的质粒转染到hek293细胞中。如实施例9,转染后24小时通过流式细胞术分析细胞。[0672]如图13a所示,当w30、l49、w50、e56突变为a时,18b10-hala的结合完全丧失(结合百分比《10%),这表明了这4种氨基酸对于其与人cldn18.2的结合至关重要。特别地,e56是构成结合表位中最重要的一个。除了这4个关键氨基酸外,其它几种氨基酸被丙氨酸替代(如r51、f60、e62、r80)后也会影响结合(结合百分比介于10%和25%之间)。图13b显示了59a9-c与位点突变的cldn18.2的结合,其仅部分地依赖于e56(结合百分比为约22%)。表9总结了与野生型相比,突变的cldn18.2与抗体的结合百分比。[0673]表9[0674][0675][0676]实施例11:抗体药物缀合物(adc)内化和细胞毒性[0677]使用mc-vc-pab-mmaekit(levenabiopharma,cat#set0201)将18b10-hala和对照higg1与vcmmae缀合。嵌合的18b10-hala的药物抗体比(dar)为4.05,而imab362和对照higg1的药物抗体比分别为2.9和4.96。使用检测细胞代谢活性的比色测定法评估18b10-hala-vcmmae对细胞活力的作用。[0678]将对数期的hek293-cldn18.2,nugc4或mkn45-cldn18.2-高细胞重悬于其相应的培养基中,然后以每孔1×104个细胞,50μl/孔加入到细胞培养板中,并在37℃下孵育过夜。接下来,将抗体-vcmmae,对照higg1-vcmmae和抗体进行梯度稀释,并以50μl/孔加入到每个孔中。最终浓度为4.75nm的vcmmae用作细胞毒性的阳性对照。72小时后,在室温下将100μl/孔的来自celltiter-glo发光细胞活性测定试剂盒的检测试剂加入到每个孔中,孵育10分钟,然后使用酶标仪读数。[0679]如图14a所示,18b10-hala-vcmmae和imab362-vcmmae在hek293-cldn18.2细胞上诱导了细胞毒性,但对照higg1-vcmmae没有,这表明该细胞毒性是hcldn18.2特异性的。虽然单独的18b10-hala和imab362对靶细胞没有细胞毒性(数据未显示),这表明观察到的细胞毒性是vcmmae介导的。图14b显示了对胃癌细胞nugc4的细胞毒性作用。18b10-hala-vcmmae表现出剂量依赖性的细胞生长抑制作用,起始浓度为0.03μg/ml。相反,imab362-vcmmae仅以10μg/ml(更高的浓度)抑制细胞生长。在另一个用cldn18.2(高表达)转染的胃癌细胞mkn-45中,18b10-hala-vcmmae达到的最大细胞杀伤率为86%,也高于imab362(60%)(如图14c所示)。[0680]众所周知,adc通过抗原结合和内化进入靶细胞而发挥作用。与抗体缀合的药物只有在内化并转移至用于降解的溶酶体后才能释放并杀死细胞。我们用此试验作为对18b10-hala内化特征的初步估计。结果表明,它具有潜在的内化活性,可以开发为adc治疗药物。[0681]实施例12:人源化cldn18.2抗体在mkn45-cldn18.2-高异种移植模型中的体内功效评估[0682]1.使用裸鼠在mkn45-cldn18.2-高异种移植模型上的抗肿瘤功效[0683]体外研究(实施例10)显示,人源化的cldn18.2抗体可诱导对mkn45-cldn18.2-高细胞的adcc作用(实施例1)。因此,建立了体内模型并将其用于抗肿瘤活性评估。简而言之,每只雌性balb/c裸鼠经右侧腹腔皮下接种具有50%基质胶(bd)的5×106个mkn45-cldn18.2-高细胞。接种后12天,选择24只肿瘤大小在70mm3左右的小鼠并随机分为3组(n=8)。然后,以0.3mg/kg的剂量用同种型对照或人源化cldn18.2抗体,经腹腔注射治疗小鼠,每周两次,持续3周。在研究结束时,使用吸入二氧化碳的方式处死动物。每周测量2-3次肿瘤大小和体积。使用prismgraphpad分析结果,并表示为平均值±s.e.m。[0684]如图15所示,如通过肿瘤大小和tgi所测量的,18b10-hala显示出比imab362稍微更优的抗肿瘤活性,而两者均显著优于同种型对照(表10)。[0685]表10.mkn45-cldn18.2-高异种移植模型中18b10-hala和imab362的肿瘤生长抑制(tgi)(平均值±s.e.m.,n=8)[0686][0687]2.使用nod-scid小鼠测试mkn45-cldn18.2-高和hpbmc共接种异种移植模型上的抗肿瘤功效[0688]从allcells获取人pbmc细胞。将24只spf级nod-scid雌性小鼠随机分为3组(n=8),经右侧腹腔皮下注射,用5×106个mkn45-cldn18.2-高细胞和50%基质胶(bd)对6只小鼠进行接种,并作为模型组(无pbmc),用5×106个mkn45-cldn18.2-高细胞和5×106人pbmc细胞(含50%基质胶(bd))对18只小鼠进行接种,并作为治疗组。接种后4小时,用10mg/kg同种型对照,3mg/kg和10mg/kg18b10-hala通过腹腔注射处理小鼠,每周两次,持续4周。在研究结束时,使用吸入二氧化碳的方式处死动物。每周测量2-3次肿瘤大小和体积。使用prismgraphpad分析结果,并表示为平均值±s.e.m。[0689]如图16所示,在治疗期间18b10-hala组的肿瘤生长被完全抑制。治疗后,3mg/kg组的肿瘤在20天后开始长大,而10mg/kg组则没有。没有pbmc的组和有pbmc的pbs组之间没有显著差异,表明在没有抗体的情况下pbmc单独作为效应细胞不能抑制肿瘤生长。表11中总结了肿瘤生长抑制作用(tgi)。18b10-hala对动物体重没有影响(数据未显示)。[0690]表11.在mkn45-cldn18.2-高和hpbmc共接种的异种移植肿瘤模型中18b10-hala的肿瘤生长抑制(平均值±s.e.m.,n=6)[0691][0692]3.18b10-hala剂量依赖性的抑制裸鼠中mkn45-cldn18.2-高异种移植的肿瘤生长[0693]经右侧腹腔皮下注射,用具有50%基质胶(bd)的5×106个细胞对每只雌性balb/c裸鼠进行接种。接种后9天,选择32只肿瘤大小在100mm3左右的小鼠并随机分为4组(n=8)。然后,通过腹腔注射,用同种型对照,0.1mg/kg,0.3mg/kg和1mg/kg18b10-hala处理小鼠,每周两次,持续3周。在研究结束时,使用吸入二氧化碳的方式处死动物。每周测量2-3次肿瘤大小和体积。使用prismgraphpad分析结果,并表示为平均值±s.e.m。[0694]如图17所示,18b10-hala的抗肿瘤活性是剂量依赖性的。1mg/kg组显示出最佳的肿瘤生长抑制活性(表12)。[0695]表12.在mkn45-cldn18.2-高异种移植肿瘤模型中18b10-hala的剂量依赖性肿瘤生长抑制(平均值±s.e.m.,n=8)[0696][0697]实施例13:具有增强的adcc效应的18b10-hala-vlpyll突变体的产生、表达、纯化和表征[0698]1.18b10-hala-vlpyll突变体的产生[0699]根据futamimoto等人的研究,l235v/f243l/r292p/y300l/p396l突变对fcγriiia结合亲和力可以增加10倍,而对fcγriib(抑制性fcγr同工型)却没有任何改变。为了验证该假设,构建并产生了18b10-hala-l235v/f243l/r292p/y300l/p396l(18b10-hala-vlpyll)突变体以增强其adcc效应。按照与实施例12的第1节相同的方法,瞬时转染该fc变体,并进行表达和纯化。[0700]据报道,fc中的五个突变l235v/f243l/r292p/y300l/p396l可以增加与人cd16a(fcγriiia)的两个等位基因的结合亲合力,而对fcγriib(抑制性fcγr同工型)没有任何改变。(futamimoto等人,novelasymmetricallyengineeredantibodyfcvariantwithsuperiorfcγrbindingaffinityandspecificitycomparedwithafucosylatedfcvariant[c]//mabs.taylor&francis,2013,5(2):229-236)。为了验证该假设,通过使用重叠延伸pcr将这些突变引入hu18b10_ha_higg1,并将新构建体命名为hu18b10_ha_higg1_l235v/f243l/r292p/y300l/p396l。使用琼脂糖凝胶电泳表征最终的pcr产物。从凝胶中提取正确大小的片段,并将其克隆到表达载体中。然后通过测序分析确认了hu18b10_ha_higg1_p330s的正确构建体。使用来自qiagen的plasmidmaxi-prepsystem制备hu18b10_ha_higg1_l235v/f243l/r292p/y300l/p396l和hu18b10_la_hkappa的质粒。然后如上述一样,按照与实施例10的第1节相同的方法,将重链和轻链质粒共转染到expi-cho细胞中进行表达和纯化。[0701]工程化的fcl235v/f243l/r292p/y300l/p396l(seqidno:51)的序列:[0702]astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapelvggpsvfllppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkppeeqynstlrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttplvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk[0703]2.与fcγ受体的结合[0704]futamimoto等人将vlpyllfc突变体与野生型进行了比较,发现该突变可以增加其与fcγriiiaf176(63倍)和fcγriiiav176(33倍)的结合亲和力,而不会影响其他fcgr。为了证实这一发现,测试了抗体与这些fcγr之间的elisa结合。简而言之,以1μg/ml的浓度将18b10-hala-vlpyll或18b10-hala-wt抗体包被在板上。封闭并洗涤后,加入用his-标签标记的系列稀释(5μg/ml~0.02μg/ml)的fcγr,并孵育1小时。然后加入抗his-hrp和tmb以在od450nm下检测fcγr的结合。[0705]如图18a和18b所示,在与人fcγri或fcγriib的结合上,18b10-hala_vlpyll和18b10-hala-wt之间没有显著差异。但是,与野生型(wt)相比,18b10-hala_vlpyll显示出与人fcγriiia(f176)和fcγriiia(v176)的结合增加了10倍(图18c和18d)。在小鼠fcγr和食蟹猴fcγr上显示出相似的结果(图18e至18i)。[0706]3.与fcrn和c1q的结合[0707]通过elisa方法评估fcrn结合。简而言之,将18b10-hala_vlpyll或wt固定在板上。将生物素化的fcrn在ph6.0稀释缓冲液中连续稀释(1μg/ml~0.0002μg/ml),然后加入并孵育1小时。接下来,加入链霉亲和素-hrp和tmb以在od450nm下检测结合。[0708]c1q结合试验采用以下方法。将两种抗体固定在板上。加入系列稀释的c1q(20μg/ml~0.31μg/ml)孵育1小时。然后加入抗c1q-hrp和tmb以在od450nm下进行检测。[0709]如图19a所示,18b10-hala_vlpyll和wt之间在fcrn结合上没有显著差异,这表明vlpyll突变对fcrn结合没有影响。图19b显示18b10-hala_vlpyll在比wt低的c1q浓度下达到相同的结合信号,这可能导致cdc效价增加。[0710]4.使用jurkat-nfat-luc-fcγriiia-v176作为效应细胞在nugc4细胞上的adcc试验[0711]按照与上述相同的方法进行adcc报告基因试验(参见实施例7的第2节)。如图20a所示,与wt(ec50~0.032μg/ml)相比,18b10-hala_vlpyll的adcc效价(ec50~0.0097μg/ml)增加了3倍。[0712]5.使用人pbmc作为效应细胞在nugc4细胞上的adcc试验[0713]按照上述方法,使用人pbmc进行adcc试验(参见实施例10的第7节)。如图20b所示,尽管18b10-hala_vlpyll和wt的最高细胞毒性相似(~45%),但与wt相比,18b10-hala_vlpyll的adcc效价也增加了3倍。与imab362相比,18b10-hala_vlpyll的效价增加了100倍。[0714]6.一组胃癌细胞系中cldn18.2表达的mesf[0715]quantumtmmesf(等效可溶性荧光染料分子)微球试剂盒可实现荧光强度单位的标准化,以用于定量荧光细胞计数法。使用30μg/ml18b10-hala和山羊抗人igg-fitc对一组胃癌细胞(gc)进行染色。在具有固定荧光装置的流式细胞仪上,使用quantumtmmesf珠检测细胞。简要地说,将一滴参考空白“b”滴加到400μl悬浮液中,然后将每个荧光强度种群的1滴合并到400μl相同的缓冲液中进行分析。在流式细胞仪上分析微球。使用下载的bangslaboratories的定量分析模板,v.2.3进行数据分析,其使用校准曲线和回归系数(r2)值。对于准确的mesf分配,可以确保仪器线性,并且达到回归系数≥0.9995。另外,进行了适当的平行对照(例如,未染色的细胞、同种型对照)。[0716]如图21所示,两个转染的细胞系hek293-cldn18.2和mkn45-cldn18.2-高具有比其他细胞系高得多的cldn18.2表达水平,这可能并不代表来自gc患者的肿瘤细胞。在gc细胞系中,nugc4的cldn18.2表达最高。snu-601(cobioer,目录号cbp60507)和snu-620(cobioer,目录号cbp60508)具有中等水平,而katoiii和ocum-1(cobioer,目录号cbp60494)具有较低的表达。因此,cldn18.2在胃癌细胞中具有不同的表达水平。[0717]7.在一组胃癌细胞系中cldn18.2表达的ihc检测[0718]在对数生长期收集胃癌细胞系,并分别用磷酸盐缓冲盐水(pbs)洗涤后,在室温下于4%中性缓冲的多聚甲醛(pfa)中固定30分钟。离心后,将细胞以约2-5×107的密度重悬于pbs中,随后与200μl熔融琼脂混合,然后在梯度酒精中脱水,在二甲苯中澄清,然后包埋在石蜡中用于切片。使用3μg/mlgc182-生物素,通过免疫组织化学(ihc)检测这些细胞的cldn18.2表达水平,所述gc182-生物素是由迈博斯生物医药根据wo2013167259中的序列产生并在实验室内进行生物素化,这是用于cldn18.2ihc检测的可用的单克隆抗体。通过阳性细胞的相对比例和细胞膜上的染色强度评估ihc结果。根据imab362在临床试验中的评分指南,对这些细胞系进行打分和评估(表13)。只有在至少40%的肿瘤细胞中具有中度(2 )和强(3 )染色的患者才有资格纳入imab362的fast研究。因此,nugc4,mkn45-cldn18.2-高和hek293-cldn18.2符合标准。这些结果与实施例13第6节(quantumtmmesf方法)一致。[0719]gc182的重链可变区(seqidno:74):[0720]qiqlvqsgpelkkfgetvkisckasgytftdysihwvkqapgkglkwmgwintetgvptyaddfkgrfafsletsastaylqinnlknedtatyfcarrtgfdywgqgttltvss[0721]gc182的轻链可变区(seqidno:75):[0722]divmtqaafsipvtlgtsasiscrssknllhsdgitylywylqrpgqspqlliyrvsnlasgvpnrfsgsesgtdftlrisrveaedvgvyycvqvlelpftfgggtkleik[0723]表13.使用ihc方法分析胃癌细胞系的cldn18.2表达[0724][0725][0726]8.使用人pbmc作为效应细胞,在具有不同cldn18.2表达水平的胃癌(gc)细胞系上的adcc分析[0727]为了进一步检验cldn18.2抗体的adcc活性受gc细胞上cldn18.2表达水平调控的假设,按照上述相同方法(实施例10第7节),使用人pbmc作为效应细胞进行adcc试验。将具有不同cldn18.2表达水平的4种胃细胞系用作靶细胞。如图22a-22d所示,在所有cldn18.2抗体中,nugc4细胞诱导了最高的adcc活性(最大细胞毒性~40%)。在三种测试的抗体中,18b10-hala-vlpyll显示了比18b10-hala-wt和imab362更好的效价。snu-601和snu-620细胞诱导中等的adcc活性(最大细胞毒性分别为30%和15%),而ocum-1细胞具有最低的细胞毒性(低于10%)。这些结果表明,adcc活性与这些细胞系上的cldn18.2表达水平相关。[0728]实施例14:18b10-hala的工艺优化和adcc效应的表征[0729]1.18b10-hala的工艺优化[0730]众所周知,非岩藻糖基化或去岩藻糖基化选择性地和显著地增加对fcγriii的结合亲合力并导致adcc功能增强。以下描述了减少岩藻糖和增强adcc的工艺优化。[0731]简而言之,收获细胞库的种子并在cd-cho培养基(gibco)中培养3天后,将细胞在基础培养基(hyclone,actipro 4mmgln 1╳ht)中扩增6天。然后将0(作为参考样品)或50μm的2f-o-f(2-脱氧-2-氟-l-岩藻糖)添加到生物反应器中,并将do(溶解氧)控制在40%左右。添加饲养培养基1/2(hyclone,cellboost7a,cellboost7b),并且当vcd(可变细胞密度)低于80%或在第13天时收集细胞悬液。[0732]收集细胞悬浮液后,使用hplc测量参考样品和50μm2f-o-f样品的抗体滴度。在第13天,50μm2f-o-f样品的滴度为4.73g/l,甚至高于参考样品,这表明它不受2f-o-f的影响。[0733]纯化后通过hplc测量抗体质量,并且50μm的2f-o-f样品(98.3%)具有与参照样品(98.2%)相似的纯度。2f-o-f对抗体质量没有显著影响。[0734]同时通过hplc分析n-聚糖,结果示于表14中。与参考样品相比,2f-o-f的添加降低了g0f(fa2)(从61.6%降至1.9%)和岩藻糖(从87.7%降至13.7%)的百分比,但增加了g0(a2)的百分比(从8.1%增加到69.8%)。因此,50μm的2f-o-f足以将岩藻糖控制在15%以下,这可能导致adcc效应增强。将该工艺下的产物(含50μm2f-o-f)命名为18b10-hala低岩藻糖。[0735]表14.18b10-hala样品的n-聚糖的分析[0736][0737]为了证明18b10-hala低岩藻糖增强了有效fcγiiia受体的亲合性,同时保持了对fcrn的亲合性,我们通过fortebio系统的生物层干涉法(bli)技术比较了18b10-hala低岩藻糖和imab362-类似物的亲合性。将具有人igg1同种型和正常糖基化的imab362-类似物作为对照。[0738]在这项研究中,将fcγri,fcγriia-h167,fcγriia-r167,fcγriib,fcγriiia-v176,fcγriiia-f176,fcγriiib-na1,fcγriiib-na2和fcrn加载到生物传感器上并浸入到不同浓度的imab362和18b10-hala低岩藻糖溶液。所有结合数据在30℃下收集。当测量18b10-hala低岩藻糖或imab362-类似物与c1q的亲和力时,将生物素化的抗体加载到生物传感器上,然后与c1q在溶液中孵育。通过bli测定抗体对fcrn的亲和力时,ph值为6.0,而对于其他fc受体的结合试验,ph值为7.4。实验包括5个步骤:1.基线获取;2.将人fcγ受体加载到生物传感器上;3.第二次基线获取;4.将18b10-hala低岩藻糖和imab362-类似物缔合用于测量kon;和5.抗体解离用于测量koff。18b10-hala低岩藻糖和imab362-类似物对fcγri,fcrn或c1q具有相似的亲和力,而18b10-hala低岩藻糖显示出对其他受体的亲合力比imab362-类似物略高。这些结果表明,在临床试验中,18b10-hala低岩藻糖将表现出增强的adcc活性,并具有与正常糖基化抗体相似的半衰期。[0739]表15.通过fortebiooctet检测的18b10-hala低岩藻糖和imab362-类似物对人fc受体的亲合力数据[0740][0741]如表15所示,18b10-hala低岩藻糖对人fcγriiia-v176和人fcγriiia-f176蛋白的亲和力比imab362稍高,这可能是较低程度的岩藻糖基化所致。如表15所示,18b10-hala低岩藻糖对人fcrn蛋白的亲和力不受较低的岩藻糖基化影响,甚至比imab362略高。如表15所示,18b10-hala低岩藻糖对人c1q蛋白的亲和力与imab362的亲和力不太相似。[0742]2.使用jurkat-nfat-luc-fcγriiia-v176作为效应细胞在nugc4上的adcc报告基因分析[0743]按照上面相同的方案进行adcc试验(参见实施例7的第2节)。如图23所示,使用添加50μm2f-o-f(18b10-hala低岩藻糖)的工艺所产生的抗体与使用不添加2f-o-f的工艺所产生的参考样品相比,adcc活性提高了30倍以上。瞬时表达的18b10-hala也包含在此对比中,并且由于工艺优化,代表adcc活性的最大信号也增加了。[0744]3.使用18b10-hala低岩藻糖对不同胃癌细胞系的facs结合[0745]按照与实施例7的第2节相同的方案进行facs结合。如图24a-24c所示,18b10-hala低岩藻糖可以以比imab362更高的效价与这些细胞系结合。18b10-hala低岩藻糖的ec50为0.5~1.6μg/ml,而imab362在约1μg/ml浓度下几乎没有结合信号。[0746]4.使用jurkat-nfat-luc-fcγriiia-v176作为效应细胞在不同胃癌细胞系上的adcc报告基因分析[0747]按照上述相同的方案进行adcc试验(参见实施例7的第2节)。如图25a-e所示,使用具有不同cldn18.2表达水平的胃癌细胞系,18b10-hala低岩藻糖的adcc活性的ec50为约0.008μg/ml。与imab362相比,18b10-hala低岩藻糖的adcc效价至少高100倍。[0748]5.使用pbmc作为效应细胞在不同胃癌细胞系上的adcc报告基因分析[0749]按照与上述相同的方案进行adcc试验(参见实施例10的第7节)。如图26a-26d所示,在不同的胃癌细胞系上,18b10-hala低岩藻糖比imab362显著诱导出更高的adcc作用。imab362在低浓度(0.01~0.1μg/ml)几乎不诱导任何细胞毒性。然而,在0.1μg/ml的浓度下,18b10-hala低岩藻糖的细胞毒性几乎饱和。[0750]6.使用pbmc作为效应细胞在nugc4上的优化的adcc试验[0751]开发使用人pbmc作为效应细胞的优化的adcc试验以用于进一步研究。简而言之,从液氮中收获冷冻的pbmc,并用rpmi1640 10%fbs以5x106/ml的密度重悬细胞,并在使用前,于37℃5%co2培养箱中孵育5h。按照说明,用celltracetmfarred(invitrogen,目录号c34564)标记靶细胞nugc4细胞。将标记的nugc4细胞和稀释的抗体加到96孔板中,并在37℃5%co2培养箱中孵育30分钟。然后将pbmc细胞加到相应的孔中,并在培养箱中孵育细胞15小时。在培养结束时,加入碘化丙啶(pi)染色液以标记死的nugc4细胞。通过流式细胞术分析celltracetmfarred阳性细胞中的pi阳性细胞百分比。通过减去非特异性杀伤百分比来计算特异性细胞毒性。[0752]如图27所示,代表性数据,在浓度为1.2μg/ml时18b10-hala低岩藻糖的最大特异性细胞毒性达到60%以上,其ec50为0.014μg/ml,而在最高浓度(30μg/ml)时imab362-类似物的最大值仅为40%,其ec50为0.54μg/ml,这是18b10-hala低岩藻糖的30倍以上。[0753]实施例15:18b10-hala低岩藻糖体内抗肿瘤活性[0754]1.使用nod-scid小鼠测试在mkn45-cldn18.2-高和hpbmc共接种异种移植模型上的抗肿瘤功效[0755]从allcells获取人pbmc细胞。将60只spf级雌性nod-scid小鼠随机分为6组(n=10),经右侧腹腔皮下注射,用5×106个mkn45-cldn18.2-高细胞和50%基质胶(bd)对10只小鼠进行接种,并作为模型组(无pbmc),用5×106个mkn45-cldn18.2-高细胞和5×106人pbmc细胞(含50%基质胶(bd))对50只小鼠进行接种,并作为治疗组。接种后4小时,通过腹腔内注射10mg/kg同种型对照,1mg/kg,3mg/kg和10mg/kg18b10-hala低岩藻糖来处理小鼠,每周两次,持续5周。在研究结束时,用吸入二氧化碳的方式处死动物。每周测量2-3次肿瘤大小和体积。使用prismgraphpad分析结果,并将结果表示为平均值±s.e.m。[0756]如图28a所示,18b10-hala低岩藻糖以剂量依赖性方式显著抑制肿瘤的生长。特别是用10mg/kg的18b10-hala低岩藻糖,大多数肿瘤(7/10)在研究结束时消失了(图28b)。18b10-hala低岩藻糖的肿瘤生长抑制率也取决于剂量,并且10mg/kgtgi组达到95.86%(表16)。与imab362-类似物相比,1810-hala低岩藻糖具有更强的抗肿瘤活性。同时18b10-hala低岩藻糖对动物的体重没有影响(数据未显示)。[0757]表16.在第36天时,mkn45-cldn18.2-高和hpbmc共接种异种移植肿瘤模型中抗体的肿瘤生长抑制(平均值±s.e.m.,n=10)[0758][0759]2.18b10-hala低岩藻糖与奥沙利铂和5-fu联用对裸鼠mkn45-cldn18.2-高肿瘤模型的功效[0760]用具有50%基质胶的混合的5×106mkn45-cldn18.2-高细胞对spf级雌性裸鼠进行接种。当肿瘤大小在90mm3左右时,选择荷瘤小鼠并随机分为4组(n=8)。用10mg/kg同种型对照和赋形剂,10mg/kg18b10-hala低岩藻糖,2.5mg/kg奥沙利铂,和30mg/kg5-fu,以及10mg/kg18b10-hala低岩藻糖与2.5mg/kg奥沙利铂和30mg/kg5-fu联用对动物进行处理,18b10-hala低岩藻糖通过腹膜内注射进行施用,每周两次,持续4周,而奥沙利铂和5-fu是通过静脉注射施用,每周一次,持续四周。在二维尺度上,使用卡尺(insize)每周测量两次或三次肿瘤大小,并使用以下公式以mm3表示体积:v=0.5a×b2其中a和b分别代表肿瘤的长径和短径。使用prismgraphpad分析结果,并将结果表示为平均值±s.e.m。两组之间通过t检验进行比较,如果p为*《0.05和**《0.01,则认为差异显著。[0761]如图29和表17所示,在没有pbmc的情况下,单一药剂组18b10-hala低岩藻糖和奥沙利铂 5-fu仅对肿瘤生长有轻度抑制,tgi分别为47%和52%。但它们的组合具有增强的肿瘤抑制作用69%,与单一药剂组相比有显着差异。[0762]表17.在第28天,18b10-hala低岩藻糖与奥沙利铂和5-fu联用对mkn45-cldn18.2-高肿瘤模型的肿瘤生长抑制(平均值±s.e.m.,n=8)[0763][0764]3.18b10-hala低岩藻糖与紫杉醇联用对裸鼠mkn45-cldn18.2-高肿瘤模型的功效[0765]在37℃,含5%co2的条件下,将mkn45-cldn18.2-高细胞在体外作为单层培养物培养在rpmi1640培养基(thermofisher)中,所述培养基补充了10%热灭活的胎牛血清(excellbiology),100u/ml青霉素和100ug/ml链霉素(hyclone)。收集处于指数生长期的细胞,并计数用于肿瘤接种。经右侧腹腔皮下注射,用具有50%基质胶(bd)的5×106细胞对每只雌性balb/c裸鼠进行接种。接种后8-11天,选择24只肿瘤大小在100mm3左右的小鼠并随机分为3组(n=8)。然后用同种型对照或18b10-hala低岩藻糖以10mg/kg的剂量,通过腹膜注射处理小鼠,每周两次,持续3周。静脉注射5mg/kg的紫杉醇,每周一次。在研究结束时,通过吸入二氧化碳的方式处死动物。在二维尺度上使用卡尺(insize)测量肿瘤大小,并使用以下公式以mm3表达体积:v=0.5a×b2(其中a和b分别代表肿瘤的长度和宽度)。使用以下公式计算肿瘤生长抑制率(tgi%):tgi%=(1-(tvdt(治疗组)/tvdt(对照组))×100%。tvdt代表每次后续测量的肿瘤体积。使用prismgraphpad(均值±sem)生成直方图,使用t分析进行统计学分析。p《0.05,表示组间差异显著;p《0.01,表示组间差异非常显著。[0766]如图30a所示,与同种型对照相比,从第5天起18b10-hala低岩藻糖显著抑制肿瘤生长,其tgi约为43%。同样,紫杉醇作为胃癌常用的二线化疗药物,其tgi也约为45%。但是当将它们组合使用时,肿瘤抑制率达到61%,与单一药剂组相比有显著差异(图30b,表18)。但是,在不具有肿瘤接种的人pbmc的情况下,肿瘤体积将明显大于具有人pbmc的肿瘤体积。在所有组中均未观察到明显的体重变化。[0767]表18.在第29天,mkn45-cldn18.2-高异种移植肿瘤模型中抗体的肿瘤生长抑制(平均值±s.e.m,n=10)[0768][0769]4.在裸鼠gc02-0004pdx肿瘤模型中18b10-hala低岩藻糖与紫杉醇联用的功效[0770]源自胃癌患者的异种移植物(pdx)模型的肿瘤组织来自北京癌症医院的腺癌/胃癌患者(no:gc-02-004),并且在裸鼠中传代6次后进行分析。使用3μg/mlgc182-生物素通过免疫组织化学(ihc)检测cldn18.2表达,所述gc182-生物素是用于cldn18.2检测的公认ihc抗体。由迈博斯生物医药根据wo2013167259中的序列生成gc182。在该肿瘤组织中阳性细胞的相对比例在40%至70%之间(图31a,放大200倍)。还分别使用兔单克隆抗体d8f12(cellsignalingtechnology,cat#4290)和sp263(由迈博斯生物医药根据wo2016124558的序列制备)通过ihc检测her2和pd-l1的表达。因此,该肿瘤组织均为her2阴性(图31b)和pd-l1阴性(图31c)。[0771]向每只小鼠皮下接种直径约3mm的小肿瘤组织块,该小肿瘤组织块是从荷瘤小鼠的整个肿瘤剥离物中切下。接种后2周,选择肿瘤大小约50mm3的动物,随机分为3组,每组8只。以10mg/kg腹腔内注射18b10-hala低岩藻糖和对照抗体,每周两次。静脉注射5mg/kg紫杉醇,每周注射一次。首次注射后继续治疗5周。每周测量2-3次肿瘤体积和小鼠体重。在研究结束时,通过吸入二氧化碳的方式处死动物。在二维尺度上使用卡尺(insize)测量肿瘤大小,并使用以下公式以mm3表示体积:v=0.5a×b2(其中a和b分别代表肿瘤的长度和宽度)。使用以下公式计算肿瘤生长抑制率(tgi%):tgi%=(1-(tvdt(治疗组)/tvdt(对照组))×100%。tvdt代表每次后续测量的肿瘤体积。使用prismgraphpad(均值±sem)生成直方图,并使用t分析进行统计学分析。p《0.05,表示组间差异显著;p《0.01,表示组间差异非常显著。[0772]如图31d所示,18b10-hala低岩藻糖导致48%的肿瘤抑制率。同样,紫杉醇作为胃癌常用的二线化疗药物,其肿瘤抑制率也仅为45%。但是当将它们组合使用时,肿瘤抑制率达到68%,与单一药剂组相比有显著差异(表19)。如图31e所示,5mg/kg的紫杉醇似乎对小鼠的体重具有轻微的毒性作用,而其他治疗则没有。[0773]表19.在第36天,gc02-0004pdx肿瘤模型中抗体的肿瘤生长抑制(平均值±s.e.m.,n=10)[0774][0775][0776]5.在mkn45-cldn18.2高异种移植肿瘤模型中与dc101的联用[0777]dc101是与小鼠vegfr-2(血管内皮生长因子受体2)反应的单克隆抗体,也称为cd309,kdr和flk-1。vegfr-2是酪氨酸蛋白激酶家族的成员。一旦与其配体vegf结合,vegfr-2在血管发展和渗透性中起关键作用。事实证明,dc101竞争性阻断vegf和vegfr-2的结合,从而导致肿瘤微血管密度降低和肿瘤生长减缓。由迈博斯生物医药(苏州)有限公司根据us5840301中的序列制备了该抗体。[0778]用与50%基质胶混合的5×106mkn45-cldn18.2-高细胞对雌性spf级裸鼠进行接种。当肿瘤大小在90mm3左右时,选择荷瘤小鼠并随机分为4组(n=8)。用10mg/kg同种型对照,10mg/kg18b10-hala低岩藻糖,3mg/kgdc101和与3mg/kgdc101组合的10mg/kg18b10-hala低岩藻糖处理动物。通过腹腔内注射施用所有抗体,每周两次,持续4周。在二维尺度上,使用卡尺(insize)测量肿瘤大小,每周测量两次或三次,并使用以下公式以mm3表示体积:v=0.5a×b2,其中a和b分别代表肿瘤的长径和短径。使用prismgraphpad分析结果,并将结果表示为平均值±s.e.m。两组之间通过t检验进行比较,如果p为*《0.05和**《0.01,则graphpad分析结果,并将其表示为平均值±s.e.m。[0793]如图35所示,如通过肿瘤大小和tgi所测量的,18b10-hala低岩藻糖显示出比imab362更好的抗肿瘤活性,而两者均显著优于同种型对照(表21)。在所有组中均未观察到明显的体重变化。[0794]表21.第36天miapaca-2-cldn18.2异种移植模型中抗体的肿瘤生长抑制(tgi)(平均值±s.e.m.,n=6)[0795][0796]2.使用裸鼠在bxpc-3-cldn18.2异种移植模型上的功效[0797]按照与miapaca-2-cldn18.2模型相同的步骤(实施例19的第1节),建立bxpc-3-cldn18.2异种移植模型,并用抗体进行处理。[0798]如图36所示,imab362完全不能抑制肿瘤生长,而18b10-hala低岩藻糖显示出一定程度的抗肿瘤活性(表22)。在所有组中均未观察到明显的体重变化。[0799]表22.在第34天,bxpc-3-cldn18.2异种移植模型中抗体的肿瘤生长抑制(tgi)(平均值±s.e.m.,n=6)[0800][0801]实施例20:在体外肺癌细胞上的18b10-hala低岩藻糖抗肿瘤活性[0802]1.使用18b10-hala低岩藻糖与肺癌细胞系的facs结合[0803]nci-h146购自atcc(cat#,htb-173)。nci-h460-cldn18.2购自kyinno(cat#,kc-1450),其是用cldn18.2稳定转染的。按照与实施例7的第2节相同的方案进行facs结合。如图37a-37b所示,18b10-hala低岩藻糖可以以剂量依赖的方式与两种细胞系结合。对于nci-h460-cldn18.2细胞上的cldn18.2表达水平比nci-h146细胞高得多,前一细胞的最大结合信号也显著高于后一细胞。[0804]2.使用jurkat-nfat-luc-fcγriiia-v176作为效应细胞在nci-h146上的adcc报告基因分析[0805]按照上述相同的方案进行adcc测试(参见实施例7的第2节)。如图38所示,18b10-hala低岩藻糖可以在nci-h146细胞上诱导adcc,ec50约为0.003μg/ml。与imab362相比,18b10-hala低岩藻糖的adcc效价高约150倍。[0806]3.使用pbmc作为效应细胞在nci-h460-cldn18.2上的adcc试验[0807]按照上面类似的方案(实施例16的第6节)进行了原代pbmc介导的adcc试验。简而言之,从液氮中收获冷冻的pbmc,并用rpmi1640 10%fbs以5x106/ml的密度重悬细胞,并在使用前于37℃5%co2培养箱中孵育5h。按照说明,用celltracetmfarred标记靶细胞nci-h460-cldn18.2细胞或nci-h292细胞。将标记的靶细胞和稀释的抗体加到24孔细胞培养板中,并在37℃5%co2培养箱中孵育30分钟。然后将pbmc细胞以40:1的e:t比加入相应的孔中,并在培养箱中孵育15小时。培养结束时,将每个孔的悬浮细胞和贴壁细胞(用温和的胰蛋白酶消化)收集到相应的15ml试管中。离心这些试管以去除上清液。加入含碘化丙啶(pi)染色溶液的pbs以重悬靶细胞并标记死的靶细胞。通过流式细胞术分析celltracetmfarred阳性细胞中的pi阳性细胞百分比。通过减去非特异性杀伤百分比来计算特异性细胞毒性。[0808]如图39所示,18b10-hala低岩藻糖仅对nci-h460-cldn18.2细胞具有adcc活性,而对ncl-h292(cldn18.2阴性的人肺腺癌细胞)没有adcc活性。[0809]实施例21:在体内肺癌细胞上的18b10-hala低岩藻糖抗肿瘤活性[0810]1.使用裸鼠在nci-h146和人pbmc共接种肿瘤模型上的功效[0811]按照与mkn45-cldn18.2-高模型相同的方法(实施例17的第1节),建立nci-h146和人pbmc共接种肿瘤模型并通过抗体进行治疗。用5×106nci-h146 1.5×106人pbmc和50%基质胶对30只nod-scid小鼠进行接种。接种后4小时,将动物随机分为3组(n=10)。[0812]如图40a-40b和表23所示,用人pbmc和18b10-hala低岩藻糖治疗,nci-h146肿瘤几乎完全不生长,并且组内差异很小。[0813]表23.在第32天,nci-h146和pbmc共接种模型中抗体的肿瘤生长抑制(tgi)(平均值±s.e.m.,n=10)[0814][0815]2.使用nod-scid小鼠测试在nci-h460-cldn18.2和人pbmc共接种肿瘤模型上的功效[0816]人pbmc细胞来自allcells。将20只spf级雌性nod-scid小鼠随机分为2组(n=10)。经右侧腹腔皮下注射,用3×106nci-h460-cldn18.2细胞和具有50%基质胶(bd)的5×106人pbmc细胞对小鼠进行接种,并作为模型组。接种后4小时,通过腹膜内注射,用10mg/kg同种型对照和10mg/kg18b10-hala低岩藻糖处理小鼠,每周两次,持续5周。在研究结束时,通过吸入二氧化碳的方式处死动物。每周测量2-3次肿瘤大小和体积。使用prismgraphpad分析结果,并将其表示为平均值±s.e.m。[0817]如图41和表24所示,具有人pbmc的情况下,18b10-hala低岩藻糖组的肿瘤生长要慢于同种型对照组(tgi为36%)。[0818]表24.在第25天,nci-h460-cldn18.2肿瘤模型中抗体的肿瘤生长抑制(tgi)(平均值±s.e.m.,n=10)[0819][0820]实施例22:在体外结肠癌细胞上的18b10-hala低岩藻糖抗肿瘤活性[0821]1.使用18b10-hala低岩藻糖与结肠癌细胞系的facs结合[0822]sk-co-1购自atcc(cat#,htb-39)。按照与实施例7的第2节相同的方案进行facs结合。如图42所示,18b10-hala低岩藻糖可以以剂量依赖性方式结合sk-co-1细胞。ec50约为1.78μg/ml。[0823]2.使用jurkat-nfat-luc-fcγriiia-v176作为效应细胞在结肠癌细胞系上的adcc报告基因分析[0824]按照上述相同的方案(参见实施例7的第2节)进行adcc试验。如图43所示,18b10-hala低岩藻糖可以在sk-co-1细胞上诱导adcc。与imab362相比,18b10-hala低岩藻糖具有高得多的adcc效价。[0825]实施例23:使用fortebiooctetred9618b10-hala低岩藻糖与人fc受体的相互作用分析[0826]1.与fcγriiia蛋白的相互作用[0827]将100nm在1x动力学缓冲液(1xpbs,ph7.4,0.002%tween20)中的,具有his标签的生物素化的人fcγriiia-v176或生物素化的人fcγriiia-f176蛋白加到7个预湿式sa生物传感器(pall,fortebio,目录号18-5019)上,并与不同浓度的18b10-hala低岩藻糖或imab362溶液一起孵育。所有结合数据在30℃下收集。实验包括5个步骤:1.获取基线(60s);2.将生物素化的人fcγriiia-v176蛋白或生物素化的人fcγriiia-f176蛋白加到sa生物传感器上(120s);3.获取第二次基线(60s);4.缔合18k10-hala低岩藻糖或imab362以用于测量kon(60s);和5.解离抗体以用于测量koff(60s)。使用了7种不同浓度的抗体,包括1000nm,500nm,250nm,125nm,62.5nm,31.3nm和0nm,并用1×动力学缓冲液稀释抗体。仅在1×动力学缓冲液中进行基线和解离步骤。koff与kon的比值确定kd。在再生缓冲液(10mm甘氨酸-hcl,ph1.5)中将生物传感器再生5s,然后在中和缓冲液(1xpbs,ph7.4,0.002%tween20)中中和5s,重复该过程3次。[0828]如表25所示,相比于imab362,18b10-hala低岩藻糖对人fcγriiia-v176和人fcγriiia-f176蛋白的亲和力略高,这可能是由较低程度的岩藻糖基化所致。[0829]表25.cldn18.2抗体与人fcγriiia蛋白的动力学结合常数[0830][0831]2.与fcrn(fcgrt&b2m)蛋白的相互作用[0832]将50nm在fcrn1×动力学缓冲液(1×pbs,ph6.0,0.002%tween20)中的,具有his标签的人fcrn(fcgrt&b2m)蛋白加到7个预湿的ni-nta生物传感器上,并与不同浓度的18b10-hala低岩藻糖或imab362溶液一同孵育。在30℃下收集所有结合数据。实验包括5个步骤:1.获取基线(60s);2.将人fcγfcrn(fcgrt&b2m)蛋白加载到ni-nta生物传感器上(150s);3.获取第二次基线(80s);4.缔合18b10-hala低岩藻糖或imab362以用于测量kon(60s);和5.解离抗体以用于测量koff(60s)。使用了7种不同浓度的抗体,包括500nm,250nm,125nm,62.5nm,31.3nm,15.6nm和0nm,并用fcrn动力学缓冲液(ph6.0)稀释抗体。仅在1x动力学缓冲液中进行基线步骤,在fcrn动力学缓冲液(ph6.0)中进行基线2和解离步骤。koff与kon的比值确定kd。在再生缓冲液中将生物传感器再生5s,然后在中和缓冲液中中和5s,重复此过程3次。[0833]如表26中所示,18b10-hala低岩藻糖与人fcrn蛋白的亲和力不受低岩藻糖基化的影响,甚至比imab362的亲和力略高。[0834]表26.cldn18.2抗体与人fcrn蛋白的动力学结合常数[0835][0836]3.与人c1q蛋白的相互作用[0837]通过在dmf中与生物素氨基己酸n-羟基琥珀酰亚胺酯(sigma)混合,将18b10-hala低岩藻糖或imab362生物素化。将100nm在1x动力学缓冲液中的生物素化的18b10-hala低岩藻糖或imab362加到7个预湿的sa生物传感器上,并与不同浓度的人c1q溶液一起孵育。在30℃下收集所有结合数据。实验包括5个步骤:1.获取基线(60s);2.将生物素化的18b10-hala低岩藻糖或imab362加载到sa生物传感器上(150s);3.获取第二次基线(60s);4.缔合人c1q以用于测量kon(30s);和5.解离人c1q以用于测量koff(30s)。使用了7种不同浓度的抗体,包括50nm,25nm,12.5nm,6.25nm,3.13nm,1.56nm和0nm,并且用1x动力学缓冲液稀释人c1q。仅在1×动力学缓冲液中进行基线和解离步骤。koff与kon的比值确定kd。仅使用一次生物传感器。[0838]如表27所示,18b10-hala低岩藻糖对人c1q蛋白的亲和力与imab362对人c1q蛋白的亲和力不太相似。[0839]表27.cldn18.2抗体与人c1q蛋白的动力学结合常数[0840]当前第1页12当前第1页12
技术领域:
:1.本公开总体上涉及与人cldn18.2特异性结合的新型抗cldn18.2抗体。
背景技术:
::2.claudin-18(cldn18)分子(genbank登录号:剪接变体1(cldn18a1或cldn18.1):np_057453、nm_016369和剪接变体2(cldn18a2或cldn18.2):nm_001002026、np_001002026)是具有分子量约为27.9/27.72kd的整合跨膜蛋白。cldn18蛋白位于上皮和内皮的紧密连接内,其在相邻细胞之间组织膜内颗粒互连链的网络。cldn18和闭合蛋白是紧密连接中最突出的跨膜蛋白成分。由于其紧密的细胞间粘附特性,这些紧密连接蛋白质可形成主要屏障,以防止和控制溶质的细胞旁转运,并限制膜脂和蛋白质的横向扩散,以维持细胞极性。因此,它们在组织上皮组织结构中起关键作用。3.cldn18是四跨膜蛋白家族的成员,具有4个疏水区。cldn18显示了几种不同的构象,可以通过抗体选择性地对其进行处理(参见sahinu,koslowskim,dhaenek等人,claudin-18splicevariant2isapan-cancertargetsuitablefortherapeuticantibodydevelopment[j].clinicalcancerresearch,2008,14(23):7624-7634)。如针对绝大多数cldn家族成员所述,cldn18-构象-1的所有四个疏水区域均作为跨膜结构域(tm),并形成两个细胞外环(被疏水区1和疏水区2包围的第1环;被疏水区3和4包围的第2环)。第二构象(cldn18-构象-2)意味着,如针对pmp22所述,第二和第三疏水区未完全穿过质膜,因此第一和第四跨膜结构域之间的部分(d3环)位于细胞外。第三构象(cldn18-构象-3)显示了具有两个内部疏水区的很大的胞外结构域,其被第一和第四疏水区包围。由于d3环中具有典型的n-糖基化位点,因此cldn-18拓扑变体cldn18拓扑-2和cldn18拓扑-3包含额外的细胞外n-糖基化位点。[0004]cldn18具有两种不同的剪接变体,其在小鼠和人中均存在。剪接变体cldn18.1和cldn18.2在包含第一个tm和第1环的n端处的前21个氨基酸不同,而c端的蛋白序列相同(参见niimit,nagashimak,wardjm等人,claudin-18,anoveldownstreamtargetgeneforthet/ebp/nkx2.1homeodomaintranscriptionfactor,encodeslung-andstomach-specificisoformsthroughalternativesplicing[j].molecularandcellularbiology,2001,21(21):7380-7390)。[0005]cldn18.1在正常的肺和胃的上皮细胞上选择性表达,而cldn18.2仅在胃细胞上表达。最重要的是,cldn18.2的表达仅限于胃上皮细胞的分化后的短寿细胞中,但不在胃部干细胞区域表达。使用灵敏的rt-pcr,在任何其他正常人体器官中都无法检测到这两种变体。但是,它们在几种癌症类型中(包括胃癌、食道癌、胰腺癌和肺癌以及人癌细胞系)高表达(参见matsuday,sembas,uedaj等人,gastricandintestinalclaudinexpressionattheinvasivefrontofgastriccarcinoma[j].cancerscience,2007,98(7):1014-1019)。[0006]迫切需要可用于治疗cldn18.2表达呈阳性的疾病(例如癌症)的新型抗cldn18.2100%、60-100%、70-100%、80-100%、90-100%、40-90%、50-90%、60-90%、70-90%、80-90%、40-80%、40-70%、40-60%、40-50%、50-80%、50-70%、50-60%、60-80%、60-70%、或70-80%)的细胞为阳性染色的水平表达人cldn18.2;所述人cldn18.2中等表达细胞以如通过ihc所测定的至少1 且低于2 的强度和以ihc中至少30%(或至少35%)但低于40%的细胞为阳性染色的水平表达人cldn18.2;所述人cldn18.2低表达细胞以如通过ihc所测定的高于0但低于1 的强度和以ihc中高于0但低于30%(例如5%、10%、15%、20%、25%、5-25%、10-25%、15-25%、20-25%、5-20%、5-15%、5-10%、10-20%、或10-15%)的细胞为阳性染色的水平表达人cldn18.2。[0019]在某些实施方式中,与nugc4细胞结合的ec50值不超过70μg/ml(或不超过65、60、55、50、45、40、35、30、25、20、15、12或10μg/ml)。[0020]在某些实施方式中,如通过adcc报告基因分析所测定的,所述nugc4细胞上的adcc的ec50值不超过2μg/ml(或不超过1.9、1.8、1.7、1.6、1.5、1.4、1.3、1.2、1.1、1.0、0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2或0.1μg/ml)。[0021]在一个方面,本公开提供了一种分离的抗体或其抗原结合片段,其能够与人cldn18.2特异性结合并具有至少一个以下特征:[0022]a)如通过kinexa分析所测定的,以不超过imab362的80%、70%、60%、50%、40%、30%、20%、15%的kd值与人cldn18.2结合;[0023]b)如通过流式细胞术分析所测定的,以不超过imab362的80%、70%、60%、50%、40%、30%、20%、15%或10%的ec50值与表达人或小鼠cldn18.2的细胞结合;[0024]c)如通过细胞毒性分析所测定的,以不超过imab362的80%、70%、60%、50%、40%、30%、20%、10%或5%的ec50值在表达人cldn18.2的细胞上诱导补体依赖的细胞毒性(cdc);以及[0025]d)如通过adcc报告基因分析所测定的,以不超过imab362的80%、70%、60%、50%、40%、30%、20%、10%、5%或1%的ec50值在表达人cldn18.2的细胞上诱导抗体依赖的细胞毒性(adcc);[0026]其中imab362是包含重链可变区和轻链可变区的抗体,所述重链可变区包含如seqidno:72所示的氨基酸序列,所述轻链可变区包含如seqidno:73所示的氨基酸序列。[0027]在某些实施方式中,所述细胞包含nugc4细胞、snu-620细胞、snu-601细胞、katoiii细胞、或细胞系,所述细胞系具有与nugc4细胞、snu-620细胞、snu-601细胞、katoiii细胞相当的或不超过上述细胞的人cldn18.2蛋白表达水平。在某些实施方式中,所述细胞包含人cldn18.2高表达细胞、人cldn18.2中等表达细胞、或人cldn18.2低表达细胞。[0028]在某些实施方式中,所述人cldn18.2高表达细胞以如通过ihc所测定的至少2 的强度和以ihc中至少40%(例如,至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、40-100%、50-100%、60-100%、70-100%、80-100%、90-100%、40-90%、50-90%、60-90%、70-90%、80-90%、40-80%、40-70%、40-60%、40-50%、50-80%、50-70%、50-60%、60-80%、60-70%、或70-80%)的细胞为阳性染色的水平表达人cldn18.2;所述人cldn18.2中等表达细胞以如通过ihc所测定的至少1 且低于2 的强度和以ihc中至少30%(或至少35%)但低于40%的细胞为阳性染色的水平表达人cldn18.2;所述人cldn18.2低表达细胞以如通过ihc所测定的高于0但低于1 的强度和以ihc中高于0但低于30%(例如5%、10%、15%、20%、25%、5-25%、10-25%、15-25%、20-25%、5-20%、5-15%、5-10%、10-20%、或10-15%)的细胞为阳性染色的水平表达人cldn18.2。[0029]在某些实施方式中,所述分离的抗体或其抗原结合片段能够与表位结合,所述表位包含如seqidno:30所示的氨基酸序列中d28、w30、v43、n45、y46、l49、w50、r51、r55、e56、f60、e62、y66、l72、l76、v79和r80位处的至少一个、两个或三个氨基酸残基。在某些实施方式中,所述表位包含在e56位处的氨基酸残基。在某些实施方式中,所述表位不含有至少一个以下残基:a42或n45。在某些实施方式中,所述表位包含在w30、l49、w50、r55和e56位处的氨基酸残基。在某些实施方式中,所述表位进一步包含t41、n45、y46、r51、f60、e62和r80中的一个或多个氨基酸残基。在某些实施方式中,所述表位进一步包含d28、v43、n45、y46、y66、l72、l76和v79中的一个或多个氨基酸残基。[0030]在一个方面,本公开提供了一种抗cldn18.2抗体或其抗原结合片段,其包含重链hcdr1、hcdr2和hcdr3和/或轻链lcdr1、lcdr2和lcdr3序列,其中:[0031]所述hcdr1序列包含gynmn(seqidno:1)或tyfigvg(seqidno:13),或与其具有至少80%序列同一性的同源序列;[0032]所述hcdr2序列包含x1idpyyx2x3tx4ynqkfx5g(seqidno:32)或hiwwndnkyyntalks(seqidno:15),或与其具有至少80%(或至少85%、90%、95%)序列同一性的同源序列;[0033]所述hcdr3序列包含x6x7x8gnafdy(seqidno:33)或mgsgawfty(seqidno:17),或与其具有至少80%序列同一性的同源序列;[0034]所述lcdr1序列包含kssqx9lx10nx11gnx12knylt(seqidno:34),或与其具有至少80%(或至少85%、90%、95%)序列同一性的同源序列;[0035]所述lcdr2序列包含wastrx13s(seqidno:35),或与其具有至少80%序列同一性的同源序列;[0036]所述lcdr3序列包含qndyx14x15px16t(seqidno:36),或与其具有至少80%序列同一性的同源序列;[0037]其中x1是n或y或h,x2是g或v,x3是a或g或t,x4是r或t或s,x5是k或r,x6是s或m,x7是y或f,x8是y或h,x9是s或n,x10是l或f,x11是s或n,x12是q或l,x13是e或k,x14是s或y,x15是f或y,且x16是f或l。[0038]在一个方面,本公开提供了一种抗cldn18.2抗体或其抗原结合片段,其中所述重链可变区包含:[0039]a)hcdr1包含选自seqidno:1和seqidno:13的序列,[0040]b)hcdr2包含选自seqidno:3、seqidno:7、seqidno:9、seqidno:15、seqidno:19和seqidno:22的序列,以及[0041]c)hcdr3包含选自seqidno:5、seqidno:11、seqidno:17和seqidno:21的序列,[0042]和/或[0043]轻链可变区包含:[0044]d)lcdr1包含如seqidno:2、seqidno:10、seqidno:14和seqidno:20所示的序列,[0045]e)lcdr2包含如seqidno:4和seqidno:16所示的序列,以及[0046]f)lcdr3包含选自seqidno:6、seqidno:8、seqidno:12和seqidno:18的序列。[0047]在某些实施方式中,本文提供的所述抗体或其抗原结合片段,其中所述重链可变区选自下组:[0048]a)包含hcdr1、hcdr2和hcdr3的重链可变区,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:3所示的序列,所述hcdr3包含如seqidno:5所示的序列;[0049]b)包含hcdr1、hcdr2和hcdr3的重链可变区,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:7所示的序列,所述hcdr3包含如seqidno:5所示的序列;[0050]c)包含hcdr1、hcdr2和hcdr3的重链可变区,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:9所示的序列,所述hcdr3包含如seqidno:11所示的序列;[0051]d)包含hcdr1、hcdr2和hcdr3的重链可变区,所述hcdr1包含如seqidno:13所示的序列,所述hcdr2包含如seqidno:15所示的序列,所述hcdr3包含如seqidno:17所示的序列;[0052]e)包含hcdr1、hcdr2和hcdr3的重链可变区,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:19所示的序列,所述hcdr3包含如seqidno:21所示的序列;以及[0053]f)包含hcdr1、hcdr2和hcdr3的重链可变区,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:22所示的序列,所述hcdr3包含如seqidno:5所示的序列。[0054]在某些实施方式中,本文提供的所述抗体或其抗原结合片段,其中所述轻链可变区选自下组:[0055]a)包含lcdr1、lcdr2和lcdr3的轻链可变区,所述lcdr1包含如seqidno:2所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:6所示的序列;[0056]b)包含lcdr1、lcdr2和lcdr3的轻链可变区,所述lcdr1包含如seqidno:2所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:8所示的序列;[0057]c)包含lcdr1、lcdr2和lcdr3的轻链可变区,所述lcdr1包含如seqidno:10所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:6所示的序列;[0058]d)包含lcdr1、lcdr2和lcdr3的轻链可变区,所述lcdr1包含如seqidno:2所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:12所示的序列;[0059]e)包含lcdr1、lcdr2和lcdr3的轻链可变区,所述lcdr1包含如seqidno:14所示的序列,所述lcdr2包含如seqidno:16所示的序列,所述lcdr3包含如seqidno:18所示的序列;[0060]f)包含lcdr1、lcdr2和lcdr3的轻链可变区,所述lcdr1包含如seqidno:20所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:6所示的序列。[0061]在某些实施方式中,本文提供的所述抗体或其抗原结合片段,其中:[0062]a)所述重链可变区包含hcdr1、hcdr2和hcdr3,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:3所示的序列,所述hcdr3包含如seqidno:5所示的序列;并且,所述轻链可变区包含lcdr1、lcdr2和lcdr3,所述lcdr1包含如seqidno:2所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:6所示的序列;[0063]b)所述重链可变区包含hcdr1、hcdr2和hcdr3,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:7所示的序列,所述hcdr3包含如seqidno:5所示的序列;并且,所述轻链可变区包含lcdr1、lcdr2和lcdr3,所述lcdr1包含如seqidno:2所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:8所示的序列;[0064]c)所述重链可变区包含hcdr1、hcdr2和hcdr3,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:9所示的序列,所述hcdr3包含如seqidno:11所示的序列;并且,所述轻链可变区包含lcdr1、lcdr2和lcdr3,所述lcdr1包含如seqidno:10所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:6所示的序列;[0065]d)所述重链可变区包含hcdr1、hcdr2和hcdr3,所述hcdr1包含如seqidno:13所示的序列,所述hcdr2包含如seqidno:15所示的序列,所述hcdr3包含如seqidno:17所示的序列;并且,所述轻链可变区包含lcdr1、lcdr2和lcdr3,所述lcdr1包含如seqidno:2所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:12所示的序列;[0066]e)所述重链可变区包含hcdr1、hcdr2和hcdr3,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:19所示的序列,所述hcdr3包含如seqidno:21所示的序列;并且,所述轻链可变区包含lcdr1、lcdr2和lcdr3,所述lcdr1包含如seqidno:14所示的序列,所述lcdr2包含如seqidno:16所示的序列,所述lcdr3包含如seqidno:18所示的序列;或者[0067]f)所述重链可变区包含hcdr1、hcdr2和hcdr3,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:22所示的序列,所述hcdr3包含如seqidno:5所示的序列;并且,所述轻链可变区包含lcdr1、lcdr2和lcdr3,所述lcdr1包含如seqidno:20所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:6所示的序列。[0068]在某些实施方式中,其中所述重链可变区包含选自下组的序列:seqidno:25、seqidno:27、seqidno:29、seqidno:37、seqidno:39、seqidno:41、seqidno:43、seqidno:45和seqidno:47,和与上述序列具有至少80%(例如至少85%、90%、95%、96%、97%、98%或99%)序列同一性但仍保留与cldn18.2的特异性结合亲和力的同源序列。[0069]在某些实施方式中,其中所述轻链可变区包含选自下组的序列:seqidno:26、seqidno:28、seqidno:38、seqidno:40、seqidno:42、seqidno:44、seqidno:46和seqidno:48,和与上述序列具有至少80%(例如至少85%、90%、95%、96%、97%、98%或99%)序列同一性但仍保留与cldn18.2的特异性结合亲和力的同源序列。[0070]在某些实施方式中,本文提供的所述抗体或其抗原结合片段,其中,[0071]a)所述重链可变区包含如seqidno:23所示的序列,并且所述轻链可变区包含如seqidno:24所示的序列;[0072]b)所述重链可变区包含如seqidno:25所示的序列,并且所述轻链可变区包含如seqidno:26所示的序列;[0073]c)所述重链可变区包含如seqidno:27所示的序列,并且所述轻链可变区包含如seqidno:28所示的序列;[0074]d)所述重链可变区包含如seqidno:29所示的序列,并且所述轻链可变区包含如seqidno:26或28所示的序列;[0075]e)所述重链可变区包含如seqidno:37所示的序列,并且所述轻链可变区包含如seqidno:38所示的序列;[0076]f)所述重链可变区包含如seqidno:39所示的序列,并且所述轻链可变区包含如seqidno:40所示的序列;[0077]g)所述重链可变区包含如seqidno:41所示的序列,并且所述轻链可变区包含如seqidno:42所示的序列;[0078]h)所述重链可变区包含如seqidno:43所示的序列,并且所述轻链可变区包含如seqidno:44所示的序列;[0079]i)所述重链可变区包含如seqidno:45所示的序列,并且所述轻链可变区包含如seqidno:46所示的序列;或者[0080]j)所述重链可变区包含如seqidno:47所示的序列,并且所述轻链可变区包含如seqidno:48所示的序列。[0081]在某些实施方式中,本文提供的所述抗cldn18.2抗体或其抗原结合片段进一步包含一个或多个重链hfr1、hfr2、hfr3和hfr4,和/或一个或多个轻链lfr1、lfr2、lfr3和lfr4,其中:[0082]所述hfr1包含qvqlvqsgaevkkpgasvkvsckasgyx17ft(seqidno:54)或与其具有至少80%(或至少85%、90%、95%)序列同一性的同源序列,[0083]所述hfr2包含wvx18qapgqglewx19g(seqidno:55)或与其具有至少80%(或至少90%)序列同一性的同源序列,[0084]所述hfr3序列包含rvtx20tidkststvymelsslrsedtavyycar(seqidno:56)或与其具有至少80%(或至少85%、90%、95%)序列同一性的同源序列,[0085]所述hfr4包含wgqgttvtvss(seqidno:57)或与其具有至少80%序列同一性的同源序列,[0086]所述lfr1包含divmtqspdslavslgeratx21nc(seqidno:58)或与其具有至少80%(或至少85%、90%、95%)序列同一性的同源序列,[0087]所述lfr2包含wyqqkpgqppklliy(seqidno:59)或与其具有至少80%(或至少85%、90%)序列同一性的同源序列,[0088]所述lfr3包含gvpdrfx22gsgsgtdftltisslqaedvavyyc(seqidno:60)或与其具有至少80%(或至少85%、90%、95%)序列同一性的同源序列,以及[0089]所述lfr4包含fgggtkveik(seqidno:61)或与其具有至少80%(或至少90%)序列同一性的同源序列,[0090]其中x17是t或s,x18是r或k,x19是m或i,x20是m或l,x21是i或m,且x22是s或t。[0091]在某些实施方式中,[0092]所述hfr1包含选自下组的序列:seqidno:62和63,[0093]所述hfr2包含选自下组的序列:seqidno:64和65,[0094]所述hfr3包含选自下组的序列:seqidno:66和67,[0095]所述hfr4包含如seqidno:57所示的序列,[0096]所述lfr1包含选自下组的序列:seqidno:68和69,[0097]所述lfr2包含如seqidno:59所示的序列,[0098]所述lfr3包含选自下组的序列:seqidno:70和71,以及[0099]所述lfr4包含如seqidno:61所示的序列。[0100]在某些实施方式中,本文提供的所述抗体或其抗原结合片段,其进一步包含一个或多个氨基酸残基取代或修饰但仍保留与cldn18.2的特异性结合亲和力。在某些实施方式中,至少一个所述取代或修饰是在一个或多个cdr序列中,和/或在一个或多个所述vh或vl序列的非cdr区域中。[0101]在某些实施方式中,所述抗体与表位结合,所述表位包含具有如seqidno:30所示的氨基酸序列的人cldn18.2的d28、w30、v43、n45、y46、l49、w50、r51、r55、e56、f60、e62、y66、l72、l76、v79和r80位处的至少一个、两个或三个氨基酸残基。[0102]在某些实施方式中,所述抗体或其抗原结合片段包含免疫球蛋白恒定区,可选地人ig的恒定区,或可选地人igg的恒定区。在某些实施方式中,所述恒定区包含人igg1、igg2、igg3或igg4的恒定区。在某些实施方式中,所述人igg1的恒定区包含seqidno:49或与其具有至少80%(例如至少85%、90%、95%、96%、97%、98%或99%)序列同一性的同源序列。[0103]在某些实施方式中,所述恒定区包含一个或多个氨基酸残基取代或修饰,所述氨基酸残基取代或修饰导致了相对于野生型恒定区增加的cdc或adcc。在某些实施方式中,所述恒定区包含针对seqidno:49中的一个或多个氨基酸残基取代,所述取代选自下组:l235v、f243l、r292p、y300l、p396l或其任何组合。在某些实施方式中,所述恒定区包含如seqidno:51所示的序列。[0104]在某些实施方式中,所述抗体或其抗原结合片段是非岩藻糖基化的。[0105]在某些实施方式中,所述抗体或其抗原结合片段是人源化的。在某些实施方式中,所述抗体或其抗原结合片段为骆驼化单域抗体(camelizedsingledomainantibody)、双功能抗体(diabody)、scfv、scfv二聚体、bsfv、dsfv、(dsfv)2、fv片段、fab、fab'、f(ab')2、二硫键稳定的双功能抗体(dsdiabody)、纳米抗体、域抗体或双价域抗体。[0106]在某些实施方式中,所述抗体或其抗原结合片段是双特异性的。在某些实施方式70%、或70-80%)的细胞为阳性染色的水平表达cldn18.2;所述cldn18.2中等表达癌细胞以如通过ihc所测定的至少1 且低于2 的强度和以ihc中至少30%(或至少35%)但低于40%的细胞为阳性染色的水平表达cldn18.2;并且所述cldn18.2低表达癌细胞以如通过ihc所测定的高于0但低于1 的强度和以ihc中高于0但低于30%(例如5%、10%、15%、20%、25%、5-25%、10-25%、15-25%、20-25%、5-20%、5-15%、5-10%、10-20%、或10-15%)的细胞为阳性染色的水平表达cldn18.2。[0116]在某些实施方式中,所述方法进一步包括施用治疗有效量的第二治疗剂。在某些实施方式中,所述疾病或病况是cldn18.2相关的疾病或病况。在某些实施方式中,所述疾病或病况是癌症,可选地为表达cldn18.2的癌症。[0117]在某些实施方式中,所述受试者是人。[0118]在某些实施方式中,所述施用是经由口服、鼻内、静脉内、皮下、舌下或肌内施用。[0119]在某些实施方式中,所述方法进一步包括施用治疗有效量的第二治疗剂。在某些实施方式中,所述第二治疗剂选自化疗剂、抗癌药、放射治疗、免疫治疗剂、抗血管生成剂、靶向治疗剂、细胞治疗剂、基因治疗剂、激素治疗剂或细胞因子。[0120]在一个方面,本公开提供了一种试剂盒,其包含本文提供的抗体或其抗原结合片段,以及第二治疗剂。[0121]在一个方面,本公开提供了在表达cldn18.2的细胞中调节cldn18.2活性的方法,所述方法包括将所述表达cldn18.2的细胞暴露于本文提供的所述抗体或其抗原结合片段。[0122]在一个方面,本公开提供了检测样品中cldn18.2的存在或含量的方法,所述方法包括将所述样品与本文提供的所述抗体或其抗原结合片段接触,以及确定所述样品中cldn18.2的存在或含量。[0123]在一个方面,本公开提供了在受试者中诊断cldn18.2相关的疾病或病况的方法,所述方法包括:a)将从所述受试者获得的样品与本文提供的所述抗体或其抗原结合片段接触;b)测定所述样品中cldn18.2的存在或含量;以及c)将所述cldn18.2的存在或含量与所述受试者中cldn18.2相关疾病或病况的存在或状态相关联。[0124]在一个方面,本公开提供了本文提供的所述抗体或其抗原结合片段在制备用于治疗受试者中cldn18.2相关疾病或病况的药物中的用途。[0125]在一个方面,本公开提供了本文提供的所述抗体或其抗原结合片段在制备用于诊断cldn18.2相关疾病或病况的诊断试剂中的用途。[0126]在一个方面,本公开提供了一种用于检测cldn18.2的试剂盒,其包括本文提供的所述抗体或其抗原结合片段。[0127]在一个方面,本公开提供了一种嵌合抗原受体(car),其包含抗原结合结构域、跨膜结构域、共刺激信号传导区和tcr信号传导结构域,其中所述抗原结合结构域与cldn18.2特异性结合并且包含本文提供的其抗原结合片段。[0128]在某些实施方式中,所述抗原结合片段为fab或scfv。[0129]在某些实施方式中,所述car是双特异性的。在某些实施方式中,所述car能与cldn18.2上的第一表位,和第二表位特异性结合。在某些实施方式中,所述第二表位在cldn18.2上。在某些实施方式中,所述第二表位在不同于cldn18.2的第二个抗原上。在某些实施方式中,所述第二抗原包含肿瘤抗原。[0130]在一个方面,本公开提供了一种核酸序列,其编码本文提供的所述嵌合抗原受体(car)。在一个方面,本公开提供了一种细胞,其包含本文提供的所述核酸序列。在一个方面,本公开提供了一种经过基因修饰的细胞以表达所述car。[0131]在一个方面,本公开提供了一种载体,其包含本文提供的所述核酸序列。[0132]在一个方面,本公开提供了在哺乳动物中刺激t细胞介导的对表达cldn18.2的细胞或组织的免疫应答的方法,所述方法包括向所述哺乳动物施用有效量的经过基因修饰的细胞以表达本文提供的所述car。[0133]在一个方面,本公开提供了治疗具有cldn18.2相关疾病或病况的哺乳动物的方法,所述方法包括向所述哺乳动物施用有效量本文提供的所述细胞,从而治疗所述哺乳动物。[0134]在某些实施方式中,所述细胞是自体t细胞。在某些实施方式中,所述cldn18.2相关疾病或病况是癌症。在某些实施方式中,所述哺乳动物是人受试者。在某些实施方式中,所述哺乳动物被鉴定为具有表达cldn18.2的癌细胞,可选地,所述哺乳动物被鉴定为具有cldn18.2高表达癌细胞、cldn18.2中等表达癌细胞或cldn18.2低表达癌细胞。附图说明[0135]图1a是散点图,其显示了7c12、11f12、12e9和26g6对表达人cldn18.2的hek293-cldn18.2细胞的结合亲和力。图1b是散点图,其显示了59a9、18b10、7c12、12c12和11f12对hek293-cldn18.2细胞的结合亲和力。图1c是散点图,其显示了7c12、11f12、12e9和26g6对nugc4细胞的结合亲和力。图1d是散点图,其显示了59a9、18b10、7c12、12c12和11f12对nugc4细胞的结合亲和力。除非另有说明,否则在此以及在附图和实施例中描述的包含“cldn18.2”细胞系的名称是指人cldn18.2。小鼠cldn18.2的缩写为“mcldn18.2”。[0136]图2a是散点图,其显示了嵌合抗体7c12-c、11f12-c、12e9-c以约0.6μg/ml的ec50与hek293-cldn18.2细胞结合,26g6-c以约1μg/ml的ec50与hek293-cldn18.2细胞结合。图2b是散点图,其显示了抗体7c12-c、11f12-c、12e9-c和26g6-c的cdc效价比imab362高两倍以上。图2c是散点图,其显示了59a9-c的ec50(1.3μg/ml)比18b10-c(1.0μg/ml)略高。图2d是散点图,其显示了与imab362相比,抗体59a9-c和18b10-c的cdc效价高3倍以上。[0137]图3a是散点图,其显示了18b10-c以比imab362明显更高的亲和力与mkn45-cldn18.2-高表达细胞结合。图3b是散点图,其显示了使用mkn45-cldn18.2细胞,两条曲线表明18b10-c具有比imab362更佳的adcc活性。图3c是散点图,其显示了18b10-c以比imab362明显更高的亲和力与mkn45-cldn18.2-中等表达细胞结合。图3d是散点图,其显示了在mkn45-cldn18.2-中等表达细胞中,通过ec50测定,18b10-c的adcc效价比imab362高50倍以上。[0138]图4a是散点图,其显示了除了26g6-c外,4种嵌合抗体中的3种以约10μg/ml的ec50与nugc4细胞结合。图4b是散点图,其显示了7c12-c、11f12-c、12e9-c和26g6-c嵌合抗体针对nugc4细胞的adcc活性。图4c是散点图,其显示了18b10-c嵌合抗体以约10μg/ml的ec50与nugc4细胞结合,但不适用于59a9-c。图4d是散点图,其显示了在单独的实验中,59a9-c和18b10-c嵌合抗体分别针对nugc4细胞的adcc活性。[0139]图5是柱状图,其显示了18b10-c和imab362对表达cldn18.2或cldn18.1的hek293细胞的选择性结合。[0140]图6a和6b是散点图,其分别显示了当杂交瘤抗体18b10在mkn45-cldn18.2-高表达细胞上与10μg/ml的imab362竞争时和在mkn45-cldn18.2-高等表达细胞上与5μg/ml的18b10-c竞争时的结合亲和力。杂交瘤抗体18b10可以完全阻断imab362与mkn45-cldn18.2-高等表达细胞的结合。[0141]图7a-b是柱状图,其显示了使用表位鉴定的嵌合抗体与突变的hcldn18.2变体的结合信号。当e56突变为q时,18b10-c的结合完全丧失。这一变化也适用于除了59a9-c之外的imab362和其他嵌合抗体。其他氨基酸(例如a42、n45)也在一定程度上促进了imab362和其他抗体的结合,但对于18b10-c并非如此。[0142]图8a是散点图,其显示了所有人源化抗体变体及其嵌合对应抗体的结合能力。图8b是散点图,其显示了人源化抗体18b10-hala相较于imab362和对照hlgg1的结合能力。18b10-hala以比imab362更佳的效价和更高的mfi与小鼠cldn18.2良好结合。[0143]图9是散点图,其显示了人源化抗体18b10-hala对hek293-cldn18.2的cdc作用。18b10-hala的cdc活性比imab362高20倍以上。[0144]图10a是散点图,其显示了18b10的人源化抗体变体相较于嵌合18b10对表达中等水平cldn18.2蛋白的mkn45细胞(mkn45-cldn18.2-中)的结合亲和力。18b10的所有人源化抗体变体均以与嵌合18b10相当的亲和力与mkn45-cldn18.2-中等表达细胞结合。图10b是散点图,其显示了在mkn45-cldn-18.2中等表达细胞上的18b10-hala和imab362的adcc报告基因分析。18b10-hala的ec50(0.05μg/ml)比imab362低得多,与嵌合18b10一致。[0145]图11a是散点图,其显示了18b10-hala对nugc4细胞的结合亲和力的结果。图11b是散点图,其显示了与imab362相比18b10-hala的adcc作用。18b10-hala具有比imab362更佳的adcc效价。[0146]图12是散点图,其显示了使用pbmc(供体id:a18z017017)作为效应细胞的adcc分析结果。18b10-hala显示了比imab362更佳的adcc效价。[0147]图13a是柱状图,其显示了18b10-hala表位鉴定的结果(抗体浓度:10μg/ml)。图13b是柱状图,其显示了59a9-c表位鉴定的结果(抗体浓度:10μg/ml)。[0148]图14a是散点图,其显示了18b10-hala-vcmmae和imab362-vcmmae对hek293-cldn18.2细胞的adc细胞毒性。18b10-hala-vcmmae和imab362-vcmmae均诱导了对hek293-cldn18.2细胞的细胞毒性,但对照higg1-vcmmae没有诱导该毒性。图14b是散点图,其显示了18b10-hala-mmae和imab362-mmae对nugc-4的adc细胞毒性作用的结果。18b10-hala-vcmmae显示剂量依赖性细胞生长抑制作用始于0.03μg/ml的浓度,而imab362-vcmmae仅在10μg/ml(浓度高得多)抑制细胞生长。图14c是散点图,其显示了18b10-hala-mmae和imab362-mmae对mkn45-cldn18.2-高表达细胞的adc细胞毒性。18b10-hala-vcmmae达到86%的最大细胞杀伤率,也高于imab362(60%)。[0149]图15是散点图,其显示了同种型对照、imab362和18b10-hala的肿瘤体积相对于时间的变化。如通过肿瘤大小和tgi(肿瘤生长抑制)所测定的,18b10-hala显示出比imab362或同种型对照明显更佳的抗肿瘤活性。[0150]图16是散点图,其分别显示了模型组(无pbmc)、同种型对照、18b10-hala3mg/kg(mpk)和18b10-hala10mpk的肿瘤体积相对于时间的变化。相对于同种型对照或pbmc对照,无论3mpk还是10mpk的18b10-hala对肿瘤生长均具有明显抑制作用。[0151]图17是散点图,其分别示出了同种型对照、18b10-hala0.1mpk、18b10-hala0.3mpk和18b10-hala1mpk的肿瘤体积相对于时间的变化。结果表明18b10-hala的抗肿瘤活性是剂量依赖性的。[0152]图18a-i是散点图,其显示了18b10-halahigg1与hfcγri-his、hfcγriib-his、hfcγriiia(f176)-his、hfcγriiia(v176)-his、小鼠fcγri-his、小鼠fcγriib-his、小鼠fcγriiia-his、fcγriv-his和食蟹猴fcγriii-his、小鼠fcγrllla-his、fcγrlv-his和食蟹猴fcγrlll-his结合。18b10-hala_vlpyll和18b10-hala-wt在与人fcγri或fcγriib的结合上没有明显差异。但是,与野生型(wt)相比,18b10-hala_vlpyll显示与人fcγriiia(f176)和fcγriiia(v176)的结合提高了10倍。小鼠fcγrs和食蟹猴fcγrs显示了相似的结果。[0153]图19a-19b是散点图,其分别显示了18b10halahlgg1对hufcrn-生物素和人c1q的结合亲和力。图19a中的结果表明18b10-hala_vlpyll和18b10-halawt之间在fcrn结合上没有明显差异。图19b中的结果表明,在较低的c1q浓度下,18b10-hala_vlpyll的结合信号略佳于18b10-halawt。[0154]图20a是散点图,其显示了使用jurkat-nfat-luc-fcγriiia-v176作为效应细胞的在nugc-4(e/t比=6:1)上的18b10-halahlgg1报告基因分析的结果。与18b10-halawt(ec50~0.032μg/ml)相比,18b10-hala-vlpyll的adcc效价(ec50~0.0097μg/ml)提高了3倍。图20b是散点图,其显示了使用pbmc(供体id:a18z017017)作为效应细胞的nugc-4adcc分析的结果。与18b10-halawt相比,18b10-hala-vlpyll的adcc效价提高了3倍;与imab362相比,18b10-hala-vlpyll的adcc效价提高了100倍。[0155]图21显示了在不同胃癌细胞系中cldn18.2表达水平的比较。[0156]图22a至22d是散点图,其显示了具有不同cldn18.2表达水平的不同胃癌细胞系的adcc分析。[0157]图23是散点图,其显示了nugc4(e/t比=6:1)上的adcc报告基因分析的结果。使用添加50μm2f-o-f的工艺所产生的抗体与使用不添加2f-o-f的工艺所产生的参比样品相比,adcc活性提高了30倍以上,或者与imab362相比,adcc活性提高了1000倍以上。[0158]图24a-24c是散点图,其显示了使用18b10-hala低岩藻糖的不同胃癌细胞系的facs结合。[0159]图25a-25e是散点图,其显示了使用18b10-hala低岩藻糖在不同胃癌细胞系上的adcc报告基因分析的结果。[0160]图26a-26d是散点图,其显示了使用pbmc(供体id:a19028011)作为效应细胞和18b10-hala的50μm2f-o-f样品,在不同胃癌细胞系上的adcc分析的结果。[0161]图27显示了在nugc-4细胞上的adcc分析中18b10-hala低岩藻糖的特异性细胞毒性。[0162]图28a至28b显示了在mkn45-cldn18.2-高表达细胞和hpbmc共接种异种移植肿瘤模型中不同剂量的18b10-hala低岩藻糖的肿瘤生长抑制。[0163]图29显示了在mkn45-cldn18.2-高表达细胞肿瘤模型上18b10-hala低岩藻糖与奥沙利铂(oxaliplatin)和5-fu联用的肿瘤生长抑制。[0164]图30a和30b显示了在mkn45-cldn18.2-高报道基因异种移植肿瘤模型中抗体的肿瘤生长抑制。[0165]图31a、31b和31c显示了在裸鼠的gc02-0004pdx肿瘤模型中,18b10-hala低岩藻糖与紫杉醇(paclitaxel)联用的疗效。[0166]图31d和31e显示了在gc02-0004pdx肿瘤模型中抗体的肿瘤生长抑制。[0167]图32显示了mkn45-cldn18.2异种移植模型中抗体的肿瘤生长抑制(tgi)。[0168]图33a和33b显示了使用18b10-hala低岩藻糖的与胰腺癌细胞系的facs结合。[0169]图34a和34b显示了使用jurkat-nfat-luc-fcγriiia-v176作为效应细胞在胰腺癌细胞系上的adcc报告基因分析。[0170]图35显示了在miapaca-2-cldn18.2异种移植模型中的抗体的肿瘤生长抑制(tgi)。[0171]图36显示了在bxpc-3-cldn18.2异种移植模型中抗体的肿瘤生长抑制(tgi)。[0172]图37a和37b显示了使用18b10-hala低岩藻糖的与肺癌细胞系的facs结合。[0173]图38显示了使用jurkat-nfat-luc-fcγriiia-v176作为效应细胞在nci-h146上的adcc报告基因分析。[0174]图39显示了使用pbmc作为效应细胞在nci-h460-cldn18.2上的adcc分析。[0175]图40a和40b显示了在nci-h146和pbmc共接种模型中抗体的肿瘤生长抑制(tgi)。[0176]图41显示了在nci-h460-cldn18.2肿瘤模型中的抗体的肿瘤生长抑制(tgi)。[0177]图42显示了使用18b10-hala低岩藻糖的与结肠癌细胞系的facs结合。[0178]图43显示了使用jurkat-nfat-luc-fcγriiia-v176作为效应细胞在结肠癌细胞系上的adcc报告基因分析。[0179]发明详述[0180]本公开的以下描述只为说明本公开的各种实施方式。因此,所讨论的具体修改方式不应理解为对公开范围的限制。在不偏离本公开范围的情况下,作出各种等同方式、变化和修改对本领域技术人员而言是显而易见的,并且应当理解,这样的等同实施方式包括在本文的范围内。在本公开中引用的所有参考文献,包括公开出版物、专利和专利申请都通过引用的方式全文并入。[0181]定义[0182]如本文使用的,本发明上下文中(尤其是在权利要求书的上下文中)所使用的术语“一种(a)”、“一个(an)”、“所述(the)”和类似术语,除非本文另外指出或与上下文明显矛盾,否则应被解释为涵盖单数形式和复数形式。[0183]本发明中的术语“抗体”包括任何可结合某特定抗原的免疫球蛋白、单克隆抗体、多克隆抗体、多价抗体、双价抗体、单价抗体、多特异性抗体或双特异性抗体。一个天然的完整抗体包含两条重(h)链和两条轻(l)链。哺乳动物的重链可分为α、δ、ε、γ和μ,每条重链由一个可变区(vh)以及第一、第二和第三恒定区(分别为ch1、ch2、ch3)组成;哺乳动物的轻链可分为λ或κ,而每条轻链由一个可变区(vl)以及一个恒定区组成。抗体呈“y”型,“y”型结构的茎部由通过二硫键结合的两条重链的第二和第三恒定区组成。“y”型结构的每条臂包括与单条轻链的可变区和恒定区结合的单条重链的可变区和第一恒定区。轻链和重链的可变区决定抗原的结合。每条链的可变区通常含有三个高变区,称互补决定区(cdr)(轻链cdr包含lcdr1、lcdr2、lcdr3,重链cdr包含hcdr1、hcdr2、hcdr3)。本发明中公开的抗体和抗原结合结构域的cdr边界可通过kabat、imgt、abm、chothia或al-lazikani命名法命名或识别(al-lazikani,b.,chothia,c.,lesk,a.m.,j.mol.biol.,273(4),927(1997);chothia,c.等人,jmolbiol.dec5;186(3):651-63(1985);chothia,c.和lesk,a.m.,j.mol.biol.,196,901(1987);n.r.whitelegg等人,proteinengineering,v13(12),819-824(2000);chothia,c.等人,nature.dec21-28;342(6252):877-83(1989);kabate.a.等人,nationalinstitutesofhealth,bethesda,md.(1991);marie-paulelefranc等人,developmentalandcomparativeimmunology,27:55-77(2003);marie-paulelefranc等人,immunomeresearch,1(3),(2005);marie-paulelefranc,molecularbiologyofbcells(第二版),chapter26,481-514,(2015))。三个cdr由被称为框架区(fr)的侧翼部分间隔开,框架区比cdr更加高度保守,并形成一个支架支撑高变环。重链和轻链的恒定区与抗原结合无关,但具有多种效应功能。抗体依据其重链恒定区的氨基酸序列可以分成几类。根据是否含有α、δ、ε、γ和μ重链,抗体可分别分为五个主要的分类或同种型:iga、igd、ige、igg和igm。几个主要的抗体分类还可分为亚类,如igg1(γ1重链)、igg2(γ2重链)、igg3(γ3重链)、igg4(γ4重链)、iga1(α1重链)或iga2(α2重链)等。在某些实施方式中,本文提供的所述抗体包含其任何抗原结合片段。[0184]如本文使用的,术语“抗原结合片段”是指由含有一个或多个cdr的抗体的片段形成的抗体片段,或者与抗原结合但不具有完整的天然抗体结构的任何其他抗体部分。抗原结合片段的例子包括,但不限于,如双功能抗体(diabody)、fab、fab'、f(ab')2、fd、fv片段、二硫键稳定的fv片段(dsfv)、(dsfv)2、双特异性dsfv(dsfv-dsfv')、二硫键稳定的双功能抗体(dsdiabody)、单链抗体分子(scfv)、scfv二聚体(双价的双功能抗体)、多特异性抗体、骆驼化单域抗体(camelizedsingledomainantibody)、纳米抗体(nanobody)、域抗体(domainantibody)和双价域抗体(bivalentdomainantibody)。抗原结合片段能够与亲本抗体结合相同的抗原。在某些实施方式中,抗原结合片段可以包含来自特定人抗体的一个或多个cdr。[0185]关于抗体的“fab”是指抗体的单价抗原结合片段,其由单条轻链(包含可变区和恒定区)与单条重链的可变区和第一恒定区经二硫键结合起来组成的。“fab”可以在铰链区的重链之间二硫键的n-末端附近的残基处,通过对抗体进行木瓜蛋白酶消化来获得。[0186]“fab'”是指包含了部分铰链区的fab片段,其可以在铰链区重链之间二硫键c-末端附近的残基处通过对抗体进行胃蛋白酶消化而获得,因此其铰链区的少量残基(包含一个或多个半胱氨酸)不同于fab。[0187]“f(ab’)2”是指fab’的二聚体,其包含两条轻链和两条重链的一部分。[0188]关于抗体的“fc”是指由第一重链的第二和第三恒定区经由二硫键与第二重链的第二和第三恒定区结合组成的抗体的一部分。igg和igmfc区包含三个重链恒定区(每条链中的第二、第三和第四重链恒定区)。它可以通过木瓜蛋白酶消化抗体而获得。抗体的fc部分负责各种效应子功能,例如adcc、adcp和cdc,但在抗原结合中不起作用。[0189]关于抗体的“fv”是指携带完整抗原结合位点的抗体的最小片段。fv片段由单条轻链的可变区与单条重链的可变区结合组成。“dsfv”是指二硫键稳定的fv片段,其中单个轻链的可变区和单个重链的可变区之间的连接是二硫键。[0190]“单链fv抗体”或“scfv”是指由直接或通过肽接头序列相互连接的轻链可变区与重链可变区组成的工程化抗体(hustonjs等人,procnatlacadsciusa,85:5879(1988))。“scfv二聚体”是指包含具有接头的两个重链可变区和两个轻链可变区的单链。在某些实施方式中,“scfv二聚体”是双价的双功能抗体或双价scfv(bsfv),其包含与另一个vh-vl部分二聚化的vh-vl(通过肽接头连接),使得一个部分的vh与另一部分的vl配位并形成两个结合位点,它们可以靶向相同的抗原(或表位)或不同的抗原(或表位)。在其他实施方式中,“scfv二聚体”是双特异性双功能抗体,其包含vh1-vl2(通过肽接头连接)与vl1-vh2(也通过肽接头连接)相结合,使得vh1和vl1配位并且vh2和vl2配位且每个配位对具有不同的抗原特异性。[0191]“单链fv-fc抗体”或“scfv-fc”是指由与抗体的fc区连接的scfv组成的工程化抗体。[0192]“骆驼化单域抗体”、“重链抗体”、“纳米抗体”或“hcab”是指包含两个vh结构域且无轻链的抗体(riechmannl.和muyldermanss.,jimmunolmethods.dec10;231(1-2):25-38(1999);muyldermanss.,jbiotechnol.jun;74(4):277-302(2001);wo94/04678;wo94/25591;u.s.专利号6,005,079)。重链抗体最初来自骆驼科(骆驼、单峰骆驼和美洲驼)。尽管没有轻链,但骆驼抗体具有真正的抗原结合库(authenticantigen-bindingrepertoire)(hamers-castermanc.等人,nature.jun3;363(6428):446-8(1993);nguyenvk.等人,“heavy-chainantibodiesincamelidae;acaseofevolutionaryinnovation,”immunogenetics.apr;54(1):39-47(2002);nguyenvk.等人,immunology.may;109(1):93-101(2003))。重链抗体的可变结构域(vhh结构域)代表由适应性免疫应答产生的最小的已知抗原结合单元(koch-noltef.等人,fasebj.nov;21(13):3490-8.epub2007jun15(2007))。“双功能抗体”包含具有两个抗原结合位点的小抗体片段,其中所述片段包含在单个多肽链中连接到vl结构域的vh结构域(vh-vl或vl-vh)(参见例如,holligerp.等人,procnatlacadsciusa.jul15;90(14):6444-8(1993);ep404097;wo93/11161)。由于接头过短,同一条链上的两个结构域无法配对,因此,这些结构域被迫与另一条链的互补结构域配对,从而创建了两个抗原结合位点。抗原结合位点可以靶向相同或不同抗原(或表位)。[0193]“域抗体”是指仅包含重链的可变区或轻链的可变区的抗体片段。在某些实施方式中,两个或更多个vh结构域与肽接头共价连接以形成双价或多价结构域抗体。双价结构域抗体的两个vh结构域可以靶向相同或不同的抗原。[0194]在某些实施方式中,“(dsfv)2”包含三个肽链:通过肽接头连接并通过二硫键与两个vl部分结合的两个vh部分。[0195]在某些实施方式中,“双特异性ds双功能抗体”包含经由vh1和vl1之间的二硫键与vl1-vh2(通过肽接头连接)结合的vh1-vl2(也通过肽接头连接)。[0196]在某些实施方式中,“双特异性dsfv”或“dsfv-dsfv'”包含三个肽链:vh1-vh2部分,其中重链由肽接头(例如,长的柔性接头)结合并通过二硫键分别与vl1和vl2部分配对。每个二硫键配对的重链和轻链具有不同的抗原特异性。[0197]如本文所使用的,术语“人源化的”是指抗体或抗原结合片段,其包含源于非人动物的cdr、源于人的fr区、以及在适用的情况下,源于人的恒定区。在某些实施方式中,人源化cldn18.2抗体的可变区框架的氨基酸残基被取代以进行序列优化。在某些实施方式中,人源化cldn18.2抗体链的可变区框架序列与相应的人可变区框架序列至少65%、70%、75%、80%、85%、90%、95%或100%相同。[0198]如本文所使用的,术语“嵌合”是指抗体或抗原结合片段,其重链和/或轻链的一部分源于一个物种,而重链和/或轻链的其余部分源于不同的物种。在说明性实例中,嵌合抗体可包含源于人的恒定区和源于非人物种(例如,小鼠)的可变区。[0199]术语“种系序列”是指编码可变区氨基酸序列或子序列的核酸序列,与由种系免疫球蛋白可变区序列编码的所有其他已知的可变区氨基酸序列相比,其与参考可变区氨基酸序列或子序列具有最高确定的氨基酸序列同一性。与所有其他评估的可变区氨基酸序列相比,种系序列还可以指与参考可变区氨基酸序列或子序列具有最高氨基酸序列同一性的可变区氨基酸序列或子序列。种系序列可以仅是框架区、仅是互补决定区、框架和互补决定区、可变区段(如上所定义),或包含可变区的序列或子序列的其他组合。序列同一性可以使用本文描述的方法来确定,例如,使用blast、align或本领域已知的另一种比对算法比对两个序列。种系核酸或氨基酸序列可与参考可变区核酸或氨基酸序列具有至少约90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的序列同一性。种系序列可以例如通过公开可获得的国际immunogenetics数据库(imgt)和v-base确定。[0200]如本文所使用的,“抗cldn18.2抗体”或“针对cldn18.2的抗体”是指能够以足够的亲和力与cldn18.2(例如,人或非人cldn18.2)特异性结合的抗体,例如以提供诊断和/或治疗用途。[0201]如本文所使用的,术语“亲和力”是指免疫球蛋白分子(即抗体)或其片段和抗原之间的非共价相互作用的强度。[0202]如本文所使用的,术语“特异性结合”或“特异性地结合”是指两个分子之间,例如抗体和抗原之间的非随机结合反应。在某些实施方式中,本文提供的抗体或抗原结合片段以≤10-6m(例如,≤5x10-7m、≤2x10-7m、≤10-7m、≤5x10-8m、≤2x10-8m、≤10-8m、≤5x10-9m、≤4x10-9m、≤3x10-9m、≤2x10-9m、或≤10-9m的结合亲和力(kd))与人和/或非人cldn18.2特异性结合。本文所使用的kd是指解离率与结合率的比率(koff/kon),其可通过使用本领域已知的任何常规方法来确定,包括但不限于表面等离子体共振法、微尺度热泳法、hplc-ms法和流式细胞术(例如facs)法。在某些实施方式中,可以通过使用流式细胞术法适当地确定kd值。可以使用多种免疫分析形式来选择与特定蛋白质发生特异性免疫反应的抗体。例如,常规地使用固相elisa免疫分析来选择与蛋白质特异性免疫反应的抗体(参见,例如harlow&lane,usingantibodies,alaboratorymanual(1998),可用于确定特异性免疫反应性的免疫分析形式和条件的描述)。通常,特异性或选择性结合反应产生的信号是背景信号的至少两倍,更通常是背景信号的至少10至100倍。[0203]关于氨基酸序列(或核酸序列)的“序列同一性百分比(%)”定义为在比对序列并且(如有必要)引入缺口以实现最大对应性后,候选序列中与参考序列中氨基酸(或核酸)残基相同的氨基酸(或核酸)残基的百分比。例如,可以使用公开可获得的工具如blastn、blastp(可在美国国家生物技术信息中心(ncbi)的网站上获得,也参见altschuls.f.等人,j.mol.biol.,215:403–410(1990);stephenf.等人,nucleicacidsres.,25:3389–3402(1997)),clustalw2(可在欧洲生物信息学研究所的网站上获得,也参见higginsd.g.等人,methodsinenzymology,266:383-402(1996);larkinm.a.等人,bioinformatics(oxford,england),23(21):2947-8(2007))和align或megalign(dnastar)软件,来实现用于确定氨基酸(或核酸)序列同一性百分比的比对。本领域技术人员可以使用工具提供的默认参数,或者可以例如通过选择合适的算法来自定义适合比对的参数。在某些实施方式中,不完全相同的残基位置可以通过保守氨基酸取代而不同。“保守氨基酸取代”是指其中氨基酸残基被具有相似化学性质(例如,电荷或疏水性)的侧链(r基团)的另一个氨基酸残基取代。通常,保守的氨基酸取代基本上不会改变蛋白质的功能特性。如果两个或更多个氨基酸序列之间由于保守取代而彼此不同,可以向上调整相似性的百分比或程度以校正取代的保守性。进行这种调整的手段是本领域技术人员公知的(参见,例如pearson(1994)methodsmol.biol.24:307-331),其通过引用并入本文。[0204]如本文所使用的,“同源序列”和“同源性序列”可互换使用,并且是指当可选地比对时,与另一序列具有至少80%(例如,至少85%、88%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%)的序列同一性的多核苷酸序列(或其互补链)或氨基酸序列。[0205]“分离的”物质已从自然状态被人为改变。如果自然界出现了“分离的”成分或物质,则说明其已从其原始环境中被更改或去除,或两者均有。例如,天然存在于活体动物中的多核苷酸或多肽不是“分离的”,但是如果已经从天然状态的共存材料中充分分离以使其以基本纯净的状态存在,则该多核苷酸或多肽是“分离的”。分离的“核酸”或“多核苷酸”可互换使用,并且是指分离的核酸分子的序列。在某些实施方式中,“分离的抗体或其抗原结合片段”是指通过电泳方法(例如sds-page、等电聚焦、毛细管电泳)或色谱方法(例如离子交换色谱或反相hplc)测定的纯度至少为60%、70%、75%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的抗体或抗原结合片段。[0206]如本文所使用的,“阻断结合”或“竞争相同表位”的能力是指抗体或抗原结合片段以任何可检测的程度抑制两个分子之间(例如人cldn18.2和抗cldn18.2抗体)的结合作用的能力。在某些实施方式中,阻断两个分子之间结合的抗体或抗原结合片段将两个分子之间的结合作用抑制至少50%。在某些实施方式中,该抑制可大于60%、大于70%、大于80%或大于90%。[0207]如本文所使用的,术语“抗体药物缀合物”是指抗体或其抗原结合片段与另一种试剂(例如化疗剂、毒素、免疫治疗剂、成像探针等)的连接。连接可以是共价键,也可以是非共价相互作用(例如通过静电力)。为了形成抗体药物缀合物,可以使用本领域已知的各种接头。另外,抗体药物缀合物可以以融合蛋白的形式提供,所述融合蛋白可以从编码缀合物的多核苷酸表达而来。如本文所使用的,“融合蛋白”是指通过两个或更多个最初编码单独蛋白质(包含肽和多肽)的基因或基因片段的连接而产生的蛋白质。融合基因的翻译产生具有源于每个原始蛋白质的功能特性的单个蛋白质。[0208]术语“受试者”包括人和非人动物。非人动物包括所有脊椎动物,例如哺乳动物和非哺乳动物,例如非人灵长类、小鼠、大鼠、猫、兔、羊、狗、牛、鸡、两栖动物和爬行动物。除另有说明外,术语“患者”或“受试者”在本文中可互换使用。[0209]术语“抗肿瘤活性”是指肿瘤细胞增殖、生存力或转移活性的降低。例如,抗肿瘤活性可以通过在治疗期间出现的异常细胞生长速率的下降,或肿瘤尺寸稳定或减少,或由于治疗引起的与未进行治疗的对照相比更长的生存期来表明。可以使用可接受的体外或体内肿瘤模型,包括但不限于异种移植模型、同种异体移植模型、小鼠乳腺肿瘤病毒(mmtv)模型和本领域已知的研究抗肿瘤活性的其他模型,来评估这种活性。[0210]如本文所使用的,“效应子功能”或“抗体效应子功能”是指可归因于抗体的fc区与其效应子(例如c1复合物和fc受体)结合的生物学活性。示例性效应子功能包括:通过抗体和c1复合物上的c1q相互作用诱导的补体依赖性细胞毒性(cdc);通过抗体的fc区与效应细胞上的fc受体结合而诱导的抗体依赖性细胞介导的细胞毒性(adcc);和抗体依赖性细胞介导的吞噬作用(adcp),其中表达fcγrs的非特异性细胞毒性细胞识别靶细胞上结合的抗体,随后引起靶细胞的吞噬作用。效应子功能包括在结合抗原之后起作用的那些和独立于抗原结合而起作用的那些。[0211]本文所使用的病况的“治疗(treating)”或“治疗(treatment)”包括预防或减轻病况,减缓病况的发作或发展速度,降低发展病况的风险,预防或延迟与病况相关的症状的发展,减轻或消除与病况有关的症状,使病况完全或部分消退,治愈病况或其一些组合。[0212]如本文所使用的,术语“载体”是指可以将遗传因子可操作地插入其中以引起该遗传因子的表达(例如产生由该遗传因子编码的蛋白质、rna或dna)或复制遗传因子的载体。载体可用于转化、转导或转染宿主细胞,以使遗传因子在携带其的宿主细胞内表达。载体的实例包括质粒、噬菌粒、黏粒、人工染色体(例如,酵母菌人工染色体(yac)、细菌人工染色体(bac)、或p1来源的人工染色体(pac))、噬菌体(诸如λ噬菌体或m13噬菌体)和动物病毒。载体可包含多种用于控制表达的因子,包含启动子序列、转录起始序列、增强子序列、选择因子和报告基因。另外,载体可以包含复制起点。载体还可以包括有助于其进入细胞的材料,包含但不限于病毒颗粒、脂质体或蛋白质衣壳。载体可以是表达载体或克隆载体。本公开提供了载体(例如表达载体),其包含编码抗体或其抗原结合片段的本文提供的核酸序列,与该核酸序列可操作地连接的至少一个启动子(例如sv40、cmv,ef-1α),和至少一个选择标记。[0213]如本文所使用的,“宿主细胞”是指已向其中引入外源多核苷酸和/或载体的细胞。[0214]术语“cldn18.2”是指源于哺乳动物例如灵长类动物(例如人、猴)和啮齿动物(例如小鼠)的claudin-18剪接变体2。在某些实施方式中,cldn18.2是人cldn18.2。人cldn18.2的示例性序列包含人cldn18.2蛋白(ncbi参考序列号np_001002026.1,或seqidno:30)。cldn18.2的示例性序列包含小家鼠(小鼠)(musmusculus(mouse))cldn18.2蛋白(ncbi参考序列号np_001181852.1)、食蟹猴(食蟹猕猴)(macacafascicularis(crab-eatingmacaque))cldn18.2蛋白(ncbi参考序列号xp_015300615.1)。cldn18.2在癌细胞中表达。在一个实施方式中,所述cldn18.2在癌细胞表面上表达。[0215]术语“cldn18.1”是指源于哺乳动物例如灵长类动物(例如人、猴)和啮齿动物(例如小鼠)的claudin-18剪接变体1。在某些实施方式中,cldn18.1是人cldn18.1。人cldn18.1的示例性序列包含人cldn18.1蛋白(ncbi参考序列号np_057453.1或seqidno:31)、小家鼠(小鼠)cldn18.2蛋白(ncbi参考序列号np_001181851.1)、食蟹猴(食蟹猕猴)cldn18.2蛋白(ncbirefseqno.xp_005545920.1)。[0216]本文所使用的“cldn18.2相关的”疾病或病况是指由cldn18.2的表达或活性的增加或降低引起、加剧或与其相关联的任何疾病或病况。在一些实施方式中,cldn18.2相关病况是例如癌症。[0217]如本文所使用的,“癌症”是指以恶性细胞生长或肿瘤、异常增殖、浸润或转移为特征的任何医学病况,并且包含实体瘤和非实体癌(例如血液系统恶性肿瘤),例如白血病。如本文所使用的,“实体瘤”是指肿瘤和/或恶性细胞的实体块。术语“药学上可接受的”表示指定的载体、载剂、稀释剂、赋形剂和/或盐通常与构成该制剂的其他成分在化学和/或物理上相容,并且与其接受者在生理上相容。[0218]在本文中对“约”值或参数的引用包括(并描述)针对该值或参数本身的实施方式。例如,提及“约x”的描述包括“x”的描述。数值范围包括定义范围的数值。一般而言,术语“约”是指变量的指定值,以及在指定值的实验误差范围内(例如,平均值的95%置信区间内)或指定值的10%以内(以较大者为准)的变量的所有值。在时间段(年、月、周、天等)的上下文中使用术语“约”时,术语“约”是指该时间段加上或减去下一个子时间段的一个量(例如,约1年表示11至13个月;约6个月表示6个月加或减1周;约1周表示6至8天;以此类推),或者在指定值的10%以内,以较大者为准。[0219]抗cldn18.2抗体[0220]本公开提供了抗cldn18.2抗体及其抗原结合片段。本文提供的抗cldn18.2抗体和抗原结合片段能够与cldn18.2(例如,人cldn18.2)或表达cldn18.2的细胞特异性结合。如本文所使用的,“特异性结合”是指≤10-6m(例如,≤5x10-7m、≤2x10-7m、≤10-7m、≤5x10-8m、≤2x10-8m、≤10-8m、≤5x10-9m、≤4x10-9m、≤3x10-9m、≤2x10-9m、或≤10-9m)的结合亲和力(例如,kd)。[0221]i.结合亲和力[0222]本文提供的抗cldn18.2抗体和抗原结合片段的结合亲和力可以用kd值表示,其表示当抗原和抗原结合分子之间的结合达到平衡时解离率与结合率的比率(koff/kon)。低亲和力抗体通常会缓慢地结合抗原并倾向于容易解离,而高亲和力抗体通常会更快地结合抗原并倾向于保持更长的结合时间。抗原结合亲和力(例如kd)可以使用本领域已知的任何合适方法适当地确定,包括例如动力学排斥分析(kinexa)或流式细胞术。[0223]在某些实施方式中,根据本公开的“kd”或“kd值”在通过kinexa分析测定的实施方式中,如以下分析所述的用抗cldn18.2抗体和cldn18.2进行测定,所述以下分析测量抗cldn18.2抗体的溶液结合亲和力。通常,kinexa的工作原理是使恒定量的一个结合伴侣(bindingpartner)(cbp)与不同浓度的另一个结合伴侣(滴定剂)平衡,然后在较短的接触时间内通过荧光标记的第二抗体捕获一部分游离cbp,所述接触时间比解离预先形成的cbp-滴定剂复合物所需的时间短。从捕获的cbp生成的荧光信号与平衡样品中游离cbp的浓度直接成正比,并在一系列测量时用于生成结合曲线(游离cbp百分比相对于总滴定剂浓度)。可从schreiber,g.,fersht,a.r.naturestructuralbiology.1996,3(5),427-431获得更多详细信息。当抗cldn18.2抗体用作具有恒定量的cbp时,则cldn18.2表达细胞可用作滴定剂,反之亦然。通过kinexa,可以使用cldn18.2或表达cldn18.2的细胞测量kd。在某些实施方式中,抗cldn18.2抗体或其抗原结合片段的kd根据本公开的实施例10的第3节中描述的方法确定。[0224]在适用的情况下也可以使用其他适合于kd测定的方法,例如,放射性标记的抗原结合分析(参见,例如chen等人,(1999)j.molbiol293:865-881),或表面等离子共振分析,例如biacore,其使用固定的cldn18.2cm5芯片在适当的响应单元(ru)进行。[0225]在某些实施方式中,通过流式细胞术测量抗cldn18.2抗体的结合亲和力。通常,将表达cldn18.2的细胞与一定浓度范围的抗cldn18.2抗体孵育,然后与荧光标记的二抗孵育,然后分析荧光信号强度。在某些实施方式中,根据本公开实施例5中所述的方法来确定抗cldn18.2抗体或其抗原结合片段的结合亲和力。[0226]在某些实施方式中,本文提供的抗cldn18.2抗体及其抗原结合片段如通过kinexa分析所测定的,以不超过2.5nm(或不超过2.4、2.3、2.2、2.1、2.0、1.9、1.8、1.7、1.6、1.5、1.4、1.3、1.2、1.1、1.0、0.9、0.8、0.7、0.6、0.5、0.4nm)的kd值特异性结合人cldn18.2(或表达人cldn18.2的细胞)。[0227]或者,本文提供的抗cldn18.2抗体和抗原结合片段对人cldn18.2的结合亲和力也可以用“半最大有效浓度”(ec50)值表示,其是指观察到其最大作用(例如结合)的50%时的抗体浓度。可以通过本领域已知的方法例如,夹心分析法(例如elisa)、蛋白质印迹法、流式细胞术分析法和其他结合分析法来测定ec50值。在某些实施方式中,本文提供的抗cldn18.2抗体和其片段如通过流式细胞术所测定的,以不超过70μg/ml(或不超过65、60、55、50、45、40、35、30、25、20、15、12或10、9、8、7、6、5、4、3、2或1μg/ml)的ec50值与人cldn18.2(例如,表达人cldn18.2的细胞)特异性结合。[0228]可以针对重组cldn18.2或表达cldn18.2的细胞系测定结合亲和力。本文提供的抗体和抗原结合片段能够结合表达不同水平的人cldn18.2的细胞,特别是表达相对中等或较低水平的人cldn18.2的细胞。[0229]在某些实施方式中,用表达人cldn18.2的细胞,例如nugc4细胞、snu-620细胞、snu-601细胞、katoiii细胞、或与其相当的细胞来测定结合亲和力,所述与其相当的细胞具有与nugc4细胞、snu-620细胞、snu-601细胞或katoiii细胞相当的或不超过上述细胞的人cldn18.2蛋白表达水平,。[0230]nugc4细胞是从癌症患者的胃旁淋巴结建立的细胞系(参见akiyamas等人,jpnjsurg.1988jul;18(4):438-46)。nugc4细胞系可从jcrb细胞库获得,其登录号为jcrb0834。[0231]snu-601细胞和snu-620细胞都是人胃癌细胞系,由首尔国立大学(snu)从癌症患者的腹水建立(kujl等人,cancerrestreat.2005feb;37(1):1–19;park等人,intjcancer.1997feb7;70(4):443-449)。snu-601细胞和snu-620细胞可从韩国细胞系库获得,其登录号分别为00601和00620。[0232]katoiii细胞是源于胃癌患者转移部位的细胞系(参见,sekiguchim,等人,jpn.j.exp.med.48:61-68,1978)。katoiii细胞系可从atcc获得,其登录号为atcchtb-103。[0233]重组表达人cldn18.2蛋白的细胞系还可以例如通过在诸如中国仓鼠卵巢(cho)、hek细胞或mkn45细胞系(国家细胞系资源基础设施,目录号3111c0001ccc000229)等细胞系中转染并表达编码人cldn18.2的dna来建立。[0234]在某些实施方式中,用人cldn18.2高表达细胞、人cldn18.2中等表达细胞或人cldn18.2低表达细胞测定结合亲和力。[0235]人cldn18.2蛋白的表达水平在不同细胞系中可以有所变化。细胞中cldn18.2蛋白的表达水平可以通过本领域已知的任何合适方法来测定,例如,通过定量荧光细胞术或免疫组织化学(ihc)。在某些实施方式中,根据ihc确定人cldn18.2蛋白在给定细胞上的表达水平。ihc涉及通过抗原-抗体相互作用使抗原可视化,从而检测细胞或组织中的抗原(例如cldn18.2)。通常,用针对抗原的一抗来检测抗原。可以标记一抗,以直接检测抗原。可替代地,一抗可以是未标记的,并且进一步与缀合有可检测标记的二抗接触,以允许间接检测抗原。一抗可以是能够与人cldn18.2特异性结合的任何抗体,例如但不限于本文提供的任何抗cldn18.2抗体,或本领域已知的任何抗cldn18.2抗体。在某些实施方式中,细胞或组织可以例如使用多聚甲醛固定。[0236]如本文所使用的,关于表达人cldn18.2细胞的术语“高表达”旨在表示以如通过ihc所测定的至少2 的强度和以ihc中至少40%(例如,至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、40-100%、50-100%、60-100%、70-100%、80-100%、90-100%、40-90%、50-90%、60-90%、70-90%、80-90%、40-80%、40-70%、40-60%、40-50%、50-80%、50-70%、50-60%、60-80%、60-70%或70-80%)的细胞为阳性染色的水平表达人cldn18.2的细胞。类似地,如本文所使用的,术语“中等表达”表示以如通过ihc测定的至少1 且低于2 的强度和以ihc中至少30%(或至少35%)但低于40%的细胞为阳性染色的水平表达人cldn18.2的细胞。此外,如本文所使用的,术语“低表达”表示以如通过ihc所测定的高于0但低于1 的强度和以ihc中高于0但低于30%(例如,5%、10%、15%、20%、25%、5-25%、10-25%、15-25%、20-25%、5-20%、5-15%、5-10%、10-20%、或10-15%)的细胞为阳性染色的水平表达人cldn18.2的细胞。该定义也显示在下表a中。[0237]表a.表达细胞的类别[0238][0239]在某些实施方式中,如实施例15的第6节和第7节所述,通过ihc测定人cldn18.2的表达水平。简而言之,将表达人cldn18.2的细胞固定在石蜡中,并使用抗人cldn18.2抗体经由ihc进行检测,然后测定阳性染色细胞的相对比例和细胞膜上的染色强度。在某些实施方式中,在ihc过程中用生物素化的抗cldn18.2抗体gc182对细胞进行染色。抗体gc182具有如seqidno:74所示的重链可变区序列和如seqidno:75所示的轻链可变区序列(也参见wo2013167259)。[0240]基于本文提供的免疫组织化学(ihc)测定结果(表13),nugc4细胞可以表征为人cldn18.2中等表达细胞系,而snu-620、snu-601和katoiii细胞可以表征为低表达细胞系。另外,可以制备重组细胞系以高表达人cldn18.2。高表达细胞的实例包括但不限于如本文实施例1的第3节所述的mkn45-cldn18.2-高细胞系和hek293-cldn18.2细胞系。[0241]发明人惊讶地发现,本文提供的抗cldn18.2抗体及其片段对人cldn18.2中等表达细胞系(例如nugc4细胞)、低表达细胞系(例如snu-620、snu-601和katoiii细胞)具有高亲和力。这与现有的抗体(例如imab362)不同,现有抗体无法显示与人cldn18.2低表达细胞特异性或相当的结合。嵌合igg1抗体imab362是由ganymedpharmaceuticalsag开发的抗人cldn18.2抗体,其具有美国专利申请us2009169547a1中公开的氨基酸序列(imb362的重链和轻链可变区序列包括在本文中,分别为seqidno:72和seqidno:73)和cas号1496553-00-4。imab362识别cldn18.2的第一胞外结构域(ecd1),并且不与任何其他claudin家族成员(包含紧密相关的claudin18剪接变体1(cldn18.1))结合。[0242]在某些实施方式中,本文提供的抗cldn18.2抗体及其片段如通过kinexa分析所测定的,以不超过2.5nm(或不超过2.4、2.3、2.2、2.1、2.0、1.9、1.8、1.7、1.6、1.5、1.4、1.3、1.2、1.1、1.0、0.9、0.8、0.7、0.6、0.5、0.4nm)的kd值与表达人cldn18.2的细胞(例如,nugc4细胞系或katoiii细胞系)特异性结合。在某些实施方式中,本文提供的抗cldn18.2抗体及其片段如通过kinexa分析所测定的,以不高于imab362kd值的80%、70%、60%、50%、40%、30%、20%、15%的kd值与表达人cldn18.2的细胞特异性结合。在某些实施方式中,用nugc4细胞、katoiii细胞、snu-601细胞、snu-620细胞、或与其相当的细胞来测定kd值,所述与其相当的细胞具有与nugc4细胞、katoiii细胞、snu-601细胞、或snu-620细胞相当的或不超过上述细胞的人cldn18.2蛋白表达水平。在某些实施方式中,用人cldn18.2高表达细胞系或人cldn18.2中等表达细胞系来测定kd值。[0243]在某些实施方式中,本文提供的抗体和抗原结合片段如通过流式细胞术分析所测定的,具有不高于70μg/ml(或不高于65、60、55、50、45、40、35、30、25、20、15、12或10、9、8、7、6、5、4、3、2或1μg/ml)的ec50值以与表达人cldn18.2(或小鼠cldn18.2)的细胞结合。在某些实施方式中,本文提供的抗体和抗原结合片段如通过流式细胞术分析所测定的,以不超过imab362ec50值的80%、70%、60%、50%、40%、30%、20%、15%、10%、1%或0.1%的ec50值与表达人cldn18.2的细胞特异性结合。在某些实施方式中,用nugc4细胞系、katoiii细胞系、snu-601细胞系、snu-620细胞系、或与其相当的细胞测定ec50,所述与其相当的细胞具有与nugc4细胞系、katoiii细胞系、snu-601细胞系、或snu-620细胞系(例如人cldn18.2低表达细胞系或人cldn18.2中等表达细胞系)相当的或不超过上述细胞的人cldn18.2蛋白表达水平。在某些实施方式中,用人cldn18.2高表达细胞系测定ec50。[0244]在某些实施方式中,本文提供的抗体和抗原结合片段具有不超过5、4、3或2μg/ml的ec50值以与人cldn18.2高表达细胞系或人cldn18.2中等表达细胞系结合。[0245]在某些实施方式中,本文提供的抗cldn18.2抗体和抗原结合片段如通过流式细胞术分析所测定的,具有不超过70μg/ml(或不超过65、60、55、50、45、40、35、30、25、20、15、12或10、9、8、7、6、5、4、3、2或1μg/ml)的ec50值以与nugc4细胞结合。[0246]在某些实施方式中,抗cldn18.2抗体和其抗原结合片段不与cldn18.1(例如,人cldn18.1或小鼠cldn18.1)结合。[0247]在某些实施方式中,所述抗体和其抗原结合片段如通过流式细胞术所测定的,能够以不超过1.5μg/ml的ec50值与小鼠cldn18.2(例如,表达小鼠cldn18.2的细胞)特异性结合。在某些实施方式中,所述抗体和其抗原结合片段,如通过流式细胞术所测定的,以0.1μg/ml-1.5μg/ml(例如,0.1μg/ml-1.2μg/ml、0.2μg/ml-1μg/ml、0.5μg/ml-1μg/ml、0.6μg/ml-1μg/ml、0.6μg/ml-0.8μg/ml或0.67μg/ml)的ec50与小鼠cldn18.2结合。[0248]1.adcc和cdc活性[0249]在某些实施方式中,本文提供的抗cldn18.2抗体和抗原结合片段能够在表达不同水平的人cldn18.2的细胞中诱导抗体依赖性细胞介导的细胞毒性(adcc)活性和/或cdc活性。[0250]如本文所使用的,“抗体依赖性细胞介导的细胞毒性”或“adcc”是指细胞介导的反应,其中表达fc受体(fcr)的非特异性细胞毒性细胞(例如,天然杀伤(nk)细胞、嗜中性粒细胞和巨噬细胞)识别靶细胞上结合的抗体,随后引起靶细胞的溶解。靶细胞的溶解是细胞外的,需要直接的细胞间接触,并且不涉及补体。adcc可以被视为直接诱导可变程度的即时肿瘤破坏的机制,该机制导致抗原呈递和诱导肿瘤定向t细胞应答。据信体内adcc的诱导导致肿瘤定向t细胞应答和源于宿主的抗体应答。[0251]用于进行adcc的方法是本领域已知的。通常,将靶细胞(例如,表达cldn18.2的细胞)与一定浓度范围的抗cldn18.2抗体孵育,洗涤后,添加效应细胞(例如,表达fc受体的细胞)以允许adcc发生。在靶细胞与效应细胞混合后数小时的一个时间点测定细胞毒性或细胞存活率,以定量adcc的水平。可通过从溶解的靶细胞释放的标记物(例如,放射性底物、荧光染料或天然细胞内蛋白如乳酸脱氢酶(ldh))来检测细胞毒性。在另一个实施方式中,使用荧光素酶报告基因,通过代谢活性细胞的指标(例如atp)测定细胞存活率(参见,例如crouch,s.p.等人,(1993)j.immunol.methods160,81–8),所述荧光素酶报告基因产生与培养中活细胞数量成比例的发光信号(即adcc报告基因分析)。效应细胞的实例是nk细胞、pbmc或表达fcγriii的细胞。在某些实施方式中,本文提供的抗cldn18.2抗体或其抗原结合片段的adcc活性是根据实施例7第2节中描述的方法测定的。[0252]“补体依赖的细胞毒性”或“cdc”是另一种细胞杀伤方法,其可在补体存在下由抗体指引溶解靶标。igm是补体激活最有效的同种型。igg1和igg3在通过经典补体激活途径指引cdc方面也非常有效。在这种级联反应中,抗原-抗体复合物的形成导致在参与抗体分子(例如,与同源抗原复合的igg分子)的ch2结构域上紧密相邻的多个clq结合位点的暴露(clq是补体c1的三个子成分之一)。这些暴露的clq结合位点将先前低亲和力的clq-igg相互作用转换为高亲和力的相互作用,从而触发涉及一系列其他补体蛋白的级联事件,并导致效应细胞趋化/激活剂c3a和c5a的蛋白水解释放。补体级联终止于膜攻击复合物(mac)的形成,其会在细胞膜上形成孔,促进水和溶质自由进出细胞。[0253]如上所述,cdc活性可以通过类似于adcc活性的方法来测定,除了不使用效应细胞以外,需要源于人血清的补体存在。简而言之,将抗体样品在测定培养基中连续稀释,并在人血清补体存在下与表达cldn18.2的靶细胞一起孵育。在孵育后,通过从溶解的靶细胞中释放的标记,或通过代谢活性细胞的指标(例如atp)来测定细胞毒性或细胞存活率。可以使用测定代谢活性细胞中atp的celltiter-glo试剂,并且可以通过使用适当的读取器测量发光强度来量化细胞溶解的程度。在某些实施方式中,本文提供的抗cldn18.2抗体或其抗原结合片段的cdc活性是根据实施例7的第1节中所述的方法测定的。[0254]在某些实施方式中,经由本文提供的抗cldn18.2抗体及其抗原结合片段的adcc或cdc诱导的细胞死亡可以通过膜完整性的丧失来确定,如相较于未处理的细胞,评估碘化丙啶(pi)、锥虫蓝(参见moore等人,cytotechnology17:1-11(1995))或7aad的摄取。[0255]发明人惊奇地发现,本文提供的抗cldn18.2抗体及其片段能够诱导对人cldn18.2中等表达细胞系(例如,nugc4细胞)或人cldn18.2低表达细胞系(例如snu-620、snu-601细胞和katoiii细胞)的adcc和/或cdc。这不同于现有的抗体,例如imab362,其不能诱导对该人cldn18.2中等表达或低表达细胞系的adcc或cdc。[0256]在某些实施方式中,如通过细胞毒性分析所测定的,本文提供的所述抗cldn18.2抗体和抗原结合片段能够以不超过1μg/ml(或不超过0.9、0.8、0.7、0.6、0.5μg/ml)的ec50值在表达人cldn18.2的细胞上诱导补体依赖的细胞毒性(cdc)。在某些实施方式中,如通过细胞毒性分析所测定的,本文提供的所述抗cldn18.2抗体和其片段能够以不超过imab362ec50值80%、70%、60%、50%、40%、30%、20%、10%或5%的ec50值在表达人cldn18.2的细胞上诱导cdc。在某些实施方式中,用人cldn18.2中等表达细胞系或人cldn18.2高表达细胞系来测定cdc。[0257]在某些实施方式中,如通过adcc报告基因分析所测定的,本文提供的所述抗cldn18.2抗体和抗原结合片段能够以不超过2μg/ml(或不超过1.9、1.8、1.7、1.6、1.5、1.4、1.3、1.2、1.1、1.0、0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2或0.1μg/ml)的ec50值在表达人cldn18.2的细胞上诱导抗体依赖的细胞毒性(adcc)。在某些实施方式中,如通过adcc报告基因分析所测定的,本文提供的所述抗cldn18.2抗体和其抗原结合片段以不超过imab362ec50值的80%、70%、60%、50%、40%、30%、20%、10%、5%或1%的ec50值,或以至少为imab362adcc总容量的120%、150%、180%或200%的adcc总容量(例如,表示为抗体浓度相对于adcc活性水平的图中观察到的adcc活性的最高水平)在表达人cldn18.2的细胞上诱导adcc。在某些实施方式中,用nugc4细胞系、katoiii细胞系、snu-601细胞系、snu-620细胞系、或与其相当的细胞来测定adcc,所述与其相当的细胞具有与nugc4细胞系、katoiii细胞系、snu-601细胞系、或snu-620细胞系(例如,人cldn18.2中等表达细胞系或人cldn18.2低表达细胞系)相当的或不超过上述细胞的人cldn18.2蛋白表达水平。[0258]在某些实施方式中,如通过adcc报告基因分析所测定的,本文提供的所述抗cldn18.2抗体和抗原结合片段能够以不超过2μg/ml(或不超过1.9、1.8、1.7、1.6、1.5、1.4、1.3、1.2、1.1、1.0、0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2或0.1μg/ml)的ec50值在nugc4细胞上诱导adcc。[0259]表位[0260]在某些实施方式中,本文提供的所述抗cldn18.2抗体或其抗原结合片段与表位结合,所述表位包含具有seqidno:30的氨基酸序列的人cldn18.2的d28、w30、v43、n45、y46、l49、w50、r51、r55、e56、f60、e62、y66、l72、l76、v79和r80位处的至少一个或多个(例如,一个、两个、三个或更多个)氨基酸残基。[0261]如本文所使用的,术语“表位”是指抗体结合的抗原上的原子或氨基酸的特定基团。表位可以包括直接接触抗体的特定氨基酸、糖侧链、磷酰基或磺酰基。本领域技术人员将认识到,可以通过确定二者是否竞争结合cldn18.2抗原多肽,无需过多实验就可以确定抗体是否结合与本公开的抗体(例如本文提供的杂交瘤/嵌合或人源化抗体7c12、11f12、26g6、59a9、18b10及其任何嵌合和人源化的变体)相同、重叠或相邻的表位。[0262]如本文所使用的,关于两种抗原结合蛋白(例如抗体)的术语“竞争结合”,是指通过竞争结合分析确定,一种抗原结合蛋白阻断或减少另一种抗原结合蛋白与抗原(例如,人/小鼠cldn18.2)的结合。竞争结合分析是本领域所公知的,包括例如直接或间接放射免疫分析(ria)、直接或间接酶免疫分析(eia)和夹心竞争分析(参见,例如,stahli等人,1983,methodsinenzymology9:242-253)。通常,这种分析涉及使用结合到固体表面上的纯化抗原或带有抗原的细胞,未标记的测试抗体和标记的参考抗体。通过测定在测试抗体存在下结合至固体表面或细胞的标记物的含量来测量竞争抑制。通常,测试抗体过量存在。如果两种抗体竞争结合cldn18.2,则这两种抗体与相同或重叠的表位结合,或者与另一种抗体结合的表位足够近的相邻表位结合,以产生空间位阻(sterichindrance)。通常,当竞争性抗体过量存在时,其将抑制(例如,减少)至少50-55%、55-60%、60-65%、65-70%、70-75%、75-80%、80-85%、85-90%或更多的测试抗体与共同抗原的特异性结合。[0263]在某些实施方式中,可以通过使抗原(即,cldn18.2)中的特定残基突变来确定抗体结合的表位或表位中的氨基酸残基。如果抗体以相对于与野生型cldn18.2结合显著降低的水平,与具有突变的氨基酸残基(例如,丙氨酸)的突变cldn18.2结合,则此表明该突变残基直接参与抗体与cldn18.2抗原的结合,或者当抗体与抗原结合时紧邻抗体。这种突变残基被认为在表位内,并且该抗体被认为与包含该残基的表位特异性结合。如本文所使用的,结合水平的显著降低是指相对于抗体和野生型cldn18.2之间的结合,抗体与突变cldn18.2之间的结合亲和力(例如ec50、kd或结合能力)降低了大于10%、20%、30%、40%、50%、60%、70%、80%、90%或更高。可以使用本领域已知的和本文公开的任何合适的方法进行这样的结合测量,例如但不限于kinexa分析和流式细胞术。[0264]在某些实施方式中,本文提供的抗cldn18.2抗体或其抗原结合片段对突变cldn18.2表现出明显更低的结合,其中野生型cldn18.2中的残基被丙氨酸取代,所述残基选自下组:人cldn18.2的d28、w30、v43、n45、y46、l49、w50、r51、r55、e56、f60、e62、y66、l72、l76、v79和r80。在某些实施方式中,残基是e56。在某些实施方式中,残基选自下组:w30、l49、w50、r55和e56。在某些实施方式中,残基选自下组:t41、n45、y46、r51、f60、e62和r80。在某些实施方式中,残基选自下组:d28、v43、n45、y46、y66、l72、l76和v79。[0265]在某些实施方式中,相对于抗体和野生型cldn18.2之间的结合,本文提供的抗cldn18.2抗体或其抗原结合片段显示出,与包含人cldn18.2e56a的突变cldn18.2的结合降低了至少80%、90%、95%或99%或更多。[0266]在某些实施方式中,相对于抗体和野生型cldn18.2之间的结合,本文提供的抗cldn18.2抗体或其抗原结合片段显示出,与包含一个或多个突变残基的突变cldn18.2的结合降低了至少50%、60%、70%、80%或90%,所述一个或多个突变残基选自下组:人cldn18.2的w30a、l49a、w50a、r55a和e56a。[0267]在某些实施方式中,相对于抗体和野生型cldn18.2之间的结合,本文提供的抗cldn18.2抗体或其抗原结合片段显示出,与包含一个或多个突变残基的突变cldn18.2的结合降低了至少30%、35%、40%、45%或50%,所述一个或多个突变残基选自下组:人cldn18.2的d28、v43、n45、y46、y66、l72、l76和v79。[0268]在某些实施方式中,相对于抗体和野生型cldn18.2之间的结合,本文提供的抗cldn18.2抗体或其抗原结合片段显示出,与包含一个或多个突变残基的突变cldn18.2的结合降低了至少10%、15%、20%、25%或30%,所述一个或多个突变残基选自下组:人cldn18.2的t41a、n45a、y46a、r51a、f60a、e62a和r80a。[0269]在某些实施方式中,本文提供的抗cldn18.2抗体或其抗原结合片段不与a42和/或n45结合。[0270]在某些实施方式中,本文提供的抗cldn18.2抗体或其抗原结合片段能够与本文提供的表位结合,并在人cldn18.2中等表达细胞系或人cldn18.2低表达细胞系中诱导adcc或cdc活性。[0271]抗体序列[0272]在另一个方面,本公开提供了一种抗cldn18.2抗体或其抗原结合片段,其包含重链hcdr1、hcdr2和hcdr3和/或轻链lcdr1、lcdr2和lcdr3序列,其中:[0273]所述hcdr1序列包含gynmn(seqidno:1)或tyfigvg(seqidno:13),或与其具有至少80%序列同一性的同源序列;[0274]所述hcdr2序列包含x1idpyyx2x3tx4ynqkfx5g(seqidno:32)或hiwwndnkyyntalks(seqidno:15),或与其具有至少80%(或至少85%、90%、95%)序列同一性的同源序列;[0275]所述hcdr3序列包含x6x7x8gnafdy(seqidno:33)或mgsgawfty(seqidno:17),或与其具有至少80%序列同一性的同源序列;[0276]所述lcdr1序列包含kssqx9lx10nx11gnx12knylt(seqidno:34),或与其具有至少80%(或至少85%、90%、95%)序列同一性的同源序列;[0277]所述lcdr2序列包含wastrx13s(seqidno:35),或与其具有至少80%序列同一性的同源序列;并且[0278]所述lcdr3序列包含qndyx14x15px16t(seqidno:36),或与其具有至少80%序列同一性的同源序列;[0279]其中x1是n或y或h,x2是g或v,x3是a或g或t,x4是r或t或s,x5是k或r,x6是s或m,x7是y或f,x8是y或h,x9是s或n,x10是l或f,x11是s或n,x12是q或l,x13是e或k,x14是s或y,x15是f或y,且x16是f或l。[0280]在一个方面,本公开提供了一种抗cldn18.2抗体或其抗原结合片段,其中所述重链可变区包含:[0281]a)hcdr1包含选自seqidno:1和seqidno:13的序列,[0282]b)hcdr2包含选自seqidno:3、seqidno:7、seqidno:9、seqidno:15、seqidno:19和seqidno:22的序列,以及[0283]c)hcdr3包含选自seqidno:5、seqidno:11、seqidno:17和seqidno:21的序列,和/或[0284]轻链可变区包含:[0285]d)lcdr1包含如seqidno:2、seqidno:10、seqidno:14和seqidno:20所示的序列,[0286]e)lcdr2包含如seqidno:4和seqidno:16所示的序列,以及[0287]f)lcdr3包含选自seqidno:6、seqidno:8、seqidno:12和seqidno:18的序列。[0288]在某些实施方式中,本文提供的所述抗体或其抗原结合片段,其中所述重链可变区选自下组:[0289]a)包含hcdr1、hcdr2和hcdr3的重链可变区,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:3所示的序列,所述hcdr3包含如seqidno:5所示的序列;[0290]b)包含hcdr1、hcdr2和hcdr3的重链可变区,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:7所示的序列,所述hcdr3包含如seqidno:5所示的序列;[0291]c)包含hcdr1、hcdr2和hcdr3的重链可变区,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:9所示的序列,所述hcdr3包含如seqidno:11所示的序列;[0292]d)包含hcdr1、hcdr2和hcdr3的重链可变区,所述hcdr1包含如seqidno:13所示的序列,所述hcdr2包含如seqidno:15所示的序列,所述hcdr3包含如seqidno:17所示的序列;[0293]e)包含hcdr1、hcdr2和hcdr3的重链可变区,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:19所示的序列,所述hcdr3包含如seqidno:21所示的序列;以及[0294]f)包含hcdr1、hcdr2和hcdr3的重链可变区,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:22所示的序列,所述hcdr3包含如seqidno:5所示的序列。[0295]在某些实施方式中,本文提供的所述抗体或其抗原结合片段,其中所述轻链可变区选自下组:[0296]a)包含lcdr1、lcdr2和lcdr3的轻链可变区,所述lcdr1包含如seqidno:2所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:6所示的序列;[0297]b)包含lcdr1、lcdr2和lcdr3的轻链可变区,所述lcdr1包含如seqidno:2所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:8所示的序列;[0298]c)包含lcdr1、lcdr2和lcdr3的轻链可变区,所述lcdr1包含如seqidno:10所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:6所示的序列;[0299]d)包含lcdr1、lcdr2和lcdr3的轻链可变区,所述lcdr1包含如seqidno:2所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:12所示的序列;[0300]e)包含lcdr1、lcdr2和lcdr3的轻链可变区,所述lcdr1包含如seqidno:14所示的序列,所述lcdr2包含如seqidno:16所示的序列,所述lcdr3包含如seqidno:18所示的序列;[0301]f)包含lcdr1、lcdr2和lcdr3的轻链可变区,所述lcdr1包含如seqidno:20所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:6所示的序列。[0302]在某些实施方式中,本文提供的所述抗体或其抗原结合片段,其中[0303]a)所述重链可变区包含hcdr1、hcdr2和hcdr3,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:3所示的序列,所述hcdr3包含如seqidno:5所示的序列;并且,所述轻链可变区包含lcdr1、lcdr2和lcdr3,所述lcdr1包含如seqidno:2所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:6所示的序列;[0304]b)所述重链可变区包含hcdr1、hcdr2和hcdr3,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:7所示的序列,所述hcdr3包含如seqidno:5所示的序列;并且,所述轻链可变区包含lcdr1、lcdr2和lcdr3,所述lcdr1包含如seqidno:2所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:8所示的序列;[0305]c)所述重链可变区包含hcdr1、hcdr2和hcdr3,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:9所示的序列,所述hcdr3包含如seqidno:11所示的序列;并且,所述轻链可变区包含lcdr1、lcdr2和lcdr3,所述lcdr1包含如seqidno:10所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:6所示的序列;[0306]d)所述重链可变区包含hcdr1、hcdr2和hcdr3,所述hcdr1包含如seqidno:13所示的序列,所述hcdr2包含如seqidno:15所示的序列,所述hcdr3包含如seqidno:17所示的序列;并且,所述轻链可变区包含lcdr1、lcdr2和lcdr3,所述lcdr1包含如seqidno:2所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:12所示的序列;[0307]e)所述重链可变区包含hcdr1、hcdr2和hcdr3,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:19所示的序列,所述hcdr3包含如seqidno:21所示的序列;并且,所述轻链可变区包含lcdr1、lcdr2和lcdr3,所述lcdr1包含如seqidno:14所示的序列,所述lcdr2包含如seqidno:16所示的序列,所述lcdr3包含如seqidno:18所示的序列;或者[0308]f)所述重链可变区包含hcdr1、hcdr2和hcdr3,所述hcdr1包含如seqidno:1所示的序列,所述hcdr2包含如seqidno:22所示的序列,所述hcdr3包含如seqidno:5所示的序列;并且,所述轻链可变区包含lcdr1、lcdr2和lcdr3,所述lcdr1包含如seqidno:20所示的序列,所述lcdr2包含如seqidno:4所示的序列,所述lcdr3包含如seqidno:6所示的序列。[0309]在某些实施方式中,本文提供的所述抗体包含cldn18.2抗体7c12、11f12、26g6、59a9、18b10和12e9的一个或多个(例如1、2、3、4、5或6)cdr序列。[0310]如本文所使用的,“7c12”是指小鼠抗体,其具有如seqidno:37所示的重链可变区和如seqidno:38所示的轻链可变区。[0311]如本文所使用的,“11f12”是指小鼠抗体,其具有如seqidno:39所示的重链可变区和如seqidno:40所示的轻链可变区。[0312]如本文所使用的,“26g6”是指小鼠抗体,其具有如seqidno:41所示的重链可变区和如seqidno:42所示的轻链可变区。[0313]如本文所使用的,“59a9”是指小鼠抗体,其具有如seqidno:43所示的重链可变区和如seqidno:44所示的轻链可变区。[0314]如本文所使用的,“18b10”是指小鼠抗体,其具有如seqidno:45所示的重链可变区和如seqidno:46所示的轻链可变区。[0315]如本文所使用的,“12e9”是指小鼠抗体,其具有如seqidno:47所示的重链可变区和如seqidno:48所示的轻链可变区。[0316]表1示出了这些cldn18.2抗体的cdr序列。下表2还提供了重链和轻链可变区序列。[0317]表1.cldn18.2抗体cdr区的序列[0318][0319][0320]表2.小鼠/嵌合抗体vh/vl的序列[0321][0322][0323]本文提供的所述抗cldn18.2抗体或其抗原结合片段可以是单克隆抗体、多克隆抗体、人源化抗体、嵌合抗体、重组抗体、双特异性抗体、标记抗体、双价抗体或抗独特型抗体。重组抗体是在体外而不是在动物中使用重组方法制备的抗体。[0324]已知cdr负责抗原结合,但是,发现并非所有6个cdr都是必不可少或不可改变的。换言之,可以替换或更改或修饰抗cldn18.2抗体7c12、11f12、26g6、59a9、18b10或12e9中的1个、2个或3个cdr(对应于seqidno:1-22中的任何一个),但基本上保留了与cldn18.2的特异性结合亲和力。[0325]在某些实施方式中,本文提供的所述抗cldn18.2抗体和抗原结合片段包含抗cldn18.2抗体7c12、11f12、26g6、59a9、18b10或12e9中的一个的重链cdr3序列。在某些实施方式中,本文提供的所述抗cldn18.2抗体和抗原结合片段包含如seqidno:5、11、17和21所示的重链cdr3序列。重链cdr3区位于抗原结合位点的中心,因此被认为与抗原接触最多,并为抗体对抗原的亲和力提供了最大的自由能。还据信,通过多种多样化机制(tonegawas.nature.302:575-81)就长度、氨基酸组成和构象而言,重链cdr3是抗原结合位点迄今为止最多样化的cdr。重链cdr3的多样性足以产生大多数抗体特异性(xujl,davismm.immunity.13:37-45)以及所需的抗原结合亲和力(schierr等,jmolbiol.263:551-67)。[0326]在一些实施方式中,本文提供的所述抗cldn18.2抗体和抗原结合片段包含全部或部分的重链可变结构域和/或全部或部分的轻链可变结构域。在一个实施方式中,本文提供的所述抗cldn18.2抗体和抗原结合片段是单域抗体,其由本文提供的全部或部分重链可变结构域组成。本领域可获得此种单域抗体的更多信息(参见,例如,美国专利号6,248,516)。[0327]在某些实施方式中,本文提供的所述抗体及其抗原结合片段包含合适的框架区(fr)序列,只要所述抗体及其抗原结合片段可以与cldn18.2特异性结合即可。表1中提供的cdr序列获取自小鼠抗体,但是可以使用本领域已知的合适方法(例如,重组技术),将它们嫁接到任何合适物种(例如,小鼠、人、大鼠、兔等)的任何合适fr序列上。[0328]在某些实施方式中,本文提供的所述抗体及其抗原结合片段是人源化的。由于人源化抗体或抗原结合片段在人中免疫原性降低,因此是理想的。因为将非人cdr序列嫁接到人或基本人的fr序列上,所以人源化抗体在其可变区中是嵌合的。抗体或抗原结合片段的人源化基本上可以通过用非人(例如鼠)cdr基因替换人免疫球蛋白基因中的相应人cdr基因来进行(参见,例如,jones等人,(1986)nature321:522-525;riechmann等人,(1988)nature332:323-327;verhoeyen等人,(1988)science239:1534-1536)。[0329]使用本领域已知的方法,可以选择合适的人重链和轻链可变结构域以实现该目的。在说明性的实例中,可以使用“最适合(best-fit)”方法,其中针对已知的人可变结构域种系序列的数据库筛选或blast非人(例如,啮齿动物)抗体的可变结构域序列,并且鉴定最接近非人查询序列的人序列,并将其用作嫁接非人cdr序列的人支架(humanscaffold)(参见,例如,sims等人,(1993)j.immunol.151:2296;chothia等人,(1987)j.mot.biol.196:901)。或者,可以使用源于所有人抗体的共有序列的框架区来嫁接非人cdr(参见,例如,carter等人,(1992)proc.natl.acad.sci.usa,89:4285;presta等人,(1993)j.immunol.,151:2623)。[0330]在某些实施方式中,本文提供的所述人源化抗体或抗原结合片段基本上由除非人cdr序列以外所有的人序列组成。在一些实施方式中,可变区fr和恒定区(如果存在的话)全部或基本上来自人免疫球蛋白序列。人fr序列和人恒定区序列可以衍生自不同的人免疫球蛋白基因,例如,fr序列源于一种人抗体而恒定区源于另一种人抗体。在一些实施方式中,所述人源化抗体或抗原结合片段包含人重链/轻链fr1-4。[0331]在一些实施方式中,源于人的fr区可包含与源于其的人免疫球蛋白相同的氨基酸序列。在一些实施方式中,人fr的一个或多个氨基酸残基被来自亲本非人抗体的相应残基所取代。在某些实施方式中,这可能是所期望的以使人源化抗体或其片段紧密接近非人亲本抗体结构,从而减少或避免免疫原性和/或改善或保持结合活性或结合亲和力。[0332]在某些实施方式中,本文提供的所述人源化抗体或抗原结合片段在每个人fr序列中包含不超过10、9、8、7、6、5、4、3、2或1个氨基酸残基取代,或在重链或轻链可变结构域的所有fr中包含不超过10、9、8、7、6、5、4、3、2或1个氨基酸残基取代。在一些实施方式中,氨基酸残基的这种改变可以仅存在于重链fr区中、仅存在于轻链fr区中、或存在于两条链中。在某些实施方式中,将一个或多个氨基酸残基突变,例如,突变回cdr序列源自的非人亲本抗体中(例如,在小鼠框架区中)发现的相应残基。本领域技术人员可以按照本领域已知的原理选择合适的突变位置。例如,可以选择用于突变的位置,其中:1)人种系序列框架中的残基很少(例如,在人可变区序列中少于20%或少于10%);2)因为该位置可能与cdr中的残基相互作用,所以其与人种系链一级序列中3个cdr的一个或多个紧邻;或3)该位置在3维模型中靠近cdr,因此与cdr中的氨基酸相互作用的可能性很高。所选位置上的残基可以突变回亲本抗体中的相应残基,或突变为既不是人种系序列也不是亲本抗体中的相应残基,而是人序列的典型残基,即在与人种系序列属于同一亚组的已知人序列中,其更频繁地发生在该位置上(参见美国专利号5,693,762)。[0333]在某些实施方式中,本公开的所述的人源化轻链和重链在人中基本上是无免疫原性的,并且与针对cldn18.2的亲本抗体相比保留了基本上相同或甚至更高的亲和力。[0334]在某些实施方式中,本文提供的所述人源化抗体及其抗原结合片段包含人种系框架序列vk/4-1的一个或多个轻链fr序列,和/或人种系框架序列vh/1-46的一个或多个重链fr序列,有或无反向突变。如果需要,可以将反向突变引入人种系框架序列中。在某些实施方式中,人源化抗体18b10可以在重链框架序列vh/1-46中包含选自下组的一个或多个反向突变:r71i、t73k、t28s、m69l、r38k和m48i(全部基于kabat编号)。人源化抗体18b10可以在轻链框架序列vk/4-1中包含选自下组的一个或多个反向突变:s63t和i21m(全部基于kabat编号)。[0335]在某些实施方式中,本文提供的所述抗cldn18.2抗体或其抗原结合片段包含重链可变区,所述重链可变区包含选自下组的序列:seqidno:25、seqidno:27、seqidno:29、seqidno:37、seqidno:39、seqidno:41、seqidno:43、seqidno:45和seqidno:47,和与上述序列具有至少80%(例如,至少85%、90%、95%、96%、97%、98%、或99%)序列同一性但仍保留与cldn18.2(尤其是人cldn18.2)的特异性结合亲和力的同源序列。[0336]在某些实施方式中,本文提供的所述抗cldn18.2抗体或其抗原结合片段包含轻链可变区,所述轻链可变区包含选自下组的序列:seqidno:26、seqidno:28、seqidno:38、seqidno:40、seqidno:42、seqidno:44、seqidno:46、seqidno:48,和与上述序列具有至少80%(例如,至少85%、90%、95%、96%、97%、98%、或99%)序列同一性但仍保留与cldn18.2(尤其是人cldn18.2)的特异性结合亲和力的同源序列。[0337]在某些实施方式中,本文提供的所述抗cldn18.2抗体或其抗原结合片段,其包含,[0338]包含如seqidno:25所示序列的重链可变区,和包含如seqidno:26所示序列的轻链可变区;[0339]包含如seqidno:27所示序列的重链可变区,和包含如seqidno:28所示序列的轻链可变区;[0340]包含如seqidno:29所示序列的重链可变区,和包含如seqidno:26或28所示序列的轻链可变区;[0341]包含如seqidno:37所示序列的重链可变区,和包含如seqidno:38所示序列的轻链可变区;[0342]包含如seqidno:39所示序列的重链可变区,和包含如seqidno:40所示序列的轻链可变区;[0343]包含如seqidno:41所示序列的重链可变区,和包含如seqidno:42所示序列的轻链可变区;[0344]包含如seqidno:43所示序列的重链可变区,和包含如seqidno:44所示序列的轻链可变区;[0345]包含如seqidno:45所示序列的重链可变区,和包含如seqidno:46所示序列的轻链可变区;或者[0346]包含如seqidno:47所示序列的重链可变区,和包含如seqidno:48所示序列的轻链可变区。[0347]在某些实施方式中,本文提供的所述抗cldn18.2抗体或其抗原结合片段进一步包含一个或多个重链hfr1、hfr2、hfr3和hfr4,和/或一个或多个轻链lfr1、lfr2、lfr3和lfr4,其中:[0348]所述hfr1包含qvqlvqsgaevkkpgasvkvsckasgyx17ft(seqidno:54)或与其具有至少80%(或至少85%、90%、95%)序列同一性的同源序列,[0349]所述hfr2包含wvx18qapgqglewx19g(seqidno:55)或与其具有至少80%(或至少90%)序列同一性的同源序列,[0350]所述hfr3序列包含rvtx20tidkststvymelsslrsedtavyycar(seqidno:56)或与其具有至少80%(或至少85%、90%、95%)序列同一性的同源序列,[0351]所述hfr4包含wgqgttvtvss(seqidno:57)或与其具有至少80%序列同一性的同源序列,[0352]所述lfr1包含divmtqspdslavslgeratx21nc(seqidno:58)或与其具有至少80%(或至少85%、90%、95%)序列同一性的同源序列,[0353]所述lfr2包含wyqqkpgqppklliy(seqidno:59)或与其具有至少80%(或至少85%、90%)序列同一性的同源序列,[0354]所述lfr3包含gvpdrfx22gsgsgtdftltisslqaedvavyyc(seqidno:60)或与其具有至少80%(或至少85%、90%、95%)序列同一性的同源序列,以及[0355]所述lfr4包含fgggtkveik(seqidno:61)或与其具有至少80%(或至少90%)序列同一性的同源序列,[0356]其中x17是t或s,x18是r或k,x19是m或i,x20是m或l,x21是i或m,且x22是s或t。[0357]在某些实施方式中,所述hfr1包含选自下组的序列:seqidno:62和63,所述hfr2包含选自下组的序列:seqidno:64和65,所述hfr3包含选自下组的序列:seqidno:66和67,所述hfr4包含如seqidno:57所示的序列,所述lfr1包含选自下组的序列:seqidno:68和69,所述lfr2包含如seqidno:59所示的序列,所述lfr3包含选自下组的序列:seqidno:70和71,以及所述lfr4包含如seqidno:61所示的序列。[0358]表3-1.人源化cldn18.2抗体18b10的框架(fr)序列[0359][0360]表3-2示出了人源化18b10抗体的可变区序列。[0361]表3-2.人源化18b10的序列[0362][0363][0364]在某些实施方式中,本文提供的所述人源化抗体可包含与人igg1同种型的恒定区融合的重链可变区和与人κ链的恒定区融合的轻链可变区。[0365]本文提供的所述人源化抗cldn18.2抗体保留了与表达cldn18.2细胞的特异性结合亲和力,并且在该方面至少与亲本抗体相当或甚至更佳。本文提供的所述人源化抗体还可以保留其与表达cldn18.2细胞(例如nugc4细胞、snu-620细胞、snu-601细胞或katoiii细胞)的功能性相互作用,其中所有抗体均可介导adcc、cdc和凋亡诱导产生的细胞杀伤作用,所述凋亡通过肿瘤细胞表面靶标的交联和直接抑制增殖所诱导。在某些实施方式中,本文提供的所述抗cldn18.2抗体及其片段进一步包含免疫球蛋白恒定区,可选地人ig的恒定区,或可选地人igg的恒定区。在一些实施方式中,免疫球蛋白恒定区包含重链和/或轻链恒定区。重链恒定区包含ch1、铰链和/或ch2-ch3区。在某些实施方式中,重链恒定区包含fc区。在某些实施方式中,轻链恒定区包含cκ或cλ。[0366]在某些实施方式中,本文提供的抗cldn18.2抗体及其片段进一步包含人igg1、igg2、igg3或igg4的恒定区。在某些实施方式中,本文提供的所述抗cldn18.2抗体及其抗原结合片段包含igg1同种型的恒定区。在某些实施方式中,人igg1的恒定区包含如seqidno:49所示的序列,或与其具有至少80%(例如,至少85%、90%、95%、96%、97%、98%、或99%)序列同一性的同源序列。[0367]igg1同种型的恒定区可以诱导效应子功能,例如adcc或cdc。本文提供的所述抗cldn18.2抗体及其抗原结合片段的效应子功能可对表达cldn18.2的细胞产生细胞毒性。可以使用各种分析法,例如fc受体结合分析、c1q结合分析和细胞溶解分析,以及上述用于确定adcc或cdc的任何分析来评估效应子功能。[0368]抗体变体[0369]本文提供的抗cldn18.2抗体及其抗原结合片段也涵盖本文提供的抗体序列的各种类型的变体。[0370]在某些实施方式中,变体在表1提供的1、2或3个cdr序列中,在一个或多个fr序列中,在本文提供的所述重链或轻链可变区序列中,和/或在恒定区(例如,fc区)中,包含一个或多个修饰或取代。这样的抗体变体保留了其亲本抗体对cldn18.2的特异性结合亲和力,但是具有修饰或取代所赋予的一种或多种期望的性质。例如,仅举几例,抗体变体可以具有改善的抗原结合亲和力、改善的糖基化模式、降低的糖基化风险、减少的脱氨基、减少的或增加的效应子功能、改善的fcrn受体结合、增加的药代动力学半衰期、ph敏感性和/或与缀合物的相容性(例如,一个或多个引入的半胱氨酸残基)。[0371]可使用本领域已知的方法,例如“丙氨酸扫描诱变”,筛选亲本抗体序列以鉴定合适的或优选的残基来进行修饰或取代(参见,例如,cunninghamandwells(1989)science,244:1081-1085)。简而言之,可以鉴定靶标残基(例如带电荷的残基,如arg、asp、his、lys和glu),并用中性或带负电荷的氨基酸(例如丙氨酸或聚丙氨酸)替换,从而产生修饰的抗体并筛选感兴趣的性质。如果在特定氨基酸位置的取代显示出令人感兴趣的功能变化,则可以将该位置鉴定为用于修饰或取代的潜在残基。可以通过用不同类型的残基(例如,半胱氨酸残基、带正电的残基等)取代来进一步评估潜在的残基。[0372]1.亲和力变体[0373]亲和力变体保留了其亲本抗体与cldn18.2的特异性结合亲和力,或甚至具有相比于亲本抗体改善的cldn18.2特异性结合亲和力。可以使用本领域中已知的各种方法来实现该目的。例如,可以使用噬菌体展示技术来产生和表达抗体变体(例如fab或scfv变体)的文库,然后筛选与人cldn18.2的结合亲和力。再例如,计算机软件可用于虚拟模拟抗体与人cldn18.2的结合,并鉴定抗体上形成结合界面的氨基酸残基。可以在取代中避免此类残基以防止结合亲和力降低,或靶向取代此类残基以提供更强的结合。[0374]在某些实施方式中,cdr序列、fr序列或可变区序列中的至少一个(或全部)取代包含保守取代。关于氨基酸序列的“保守取代”是指用具有相似理化性质的侧链的不同氨基酸残基替换氨基酸残基。例如,可以在具有疏水性侧链的氨基酸残基(例如,met、ala、val、leu和ile)中,在具有中性亲水性侧链的残基(例如,cys、ser、thr、asn和gln)中,在具有酸性侧链的残基(例如,asp、glu)中,在具有碱性侧链的氨基酸(例如,his、lys和arg)中,或在具有芳香族侧链的残基(例如,trp、tyr和phe)中进行保守取代。如本领域已知的,保守取代通常不会引起蛋白质构象结构的显著变化,因此可以保留蛋白质的生物学活性。[0375]在某些实施方式中,本文提供的所述抗体或抗原结合片段在一个或多个cdr序列中和/或一个或多个fr序列中包含一个或多个氨基酸残基取代。在某些实施方式中,亲和力变体在一个或多个cdr序列和/或fr序列中总共包含不超过10、9、8、7、6、5、4、3、2或1个取代。[0376]在某些实施方式中,抗cldn18.2抗体及其抗原结合片段包含1、2或3个cdr序列,所述cdr序列具有与表1中所列的一种或多种序列至少80%(例如,至少85%、88%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%)的序列同一性,同时保留了与其亲本抗体相似或甚至更高水平的cldn18.2结合亲和力,。[0377]在某些实施方式中,抗cldn18.2抗体及其抗原结合片段包含一个或多个可变区序列,所述可变区序列具有与如seqidno:23-29和37-48所示的一种或多种序列至少80%(例如,至少85%、88%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%)的序列同一性,同时保留了与其亲本抗体相似或甚至更高水平的cldn18.2结合亲和力,。在一些实施方式中,在选自seqidno:25-29和37-48的序列中,总共1至10个氨基酸被取代、插入或缺失。在一些实施方式中,取代、插入或缺失发生在cdr之外的区域(即,fr中)。[0378]2.糖基化变体[0379]本文提供的抗cldn18.2抗体和抗原结合片段还包含糖基化变体,可以获得其以增加或降低抗体或抗原结合片段的糖基化程度。如本文所使用的,术语“糖基化”是指将聚糖例如岩藻糖、木糖、甘露糖或glcnac磷酸丝氨酸聚糖连接到蛋白质、脂质或其他有机分子上的酶促过程。根据与聚糖连接的碳,糖基化可分为五类,其包括:n-联糖基化、o-联糖基化、二氧磷基-糖基化、c-联糖基化和糖基磷脂酰肌醇化。[0380]抗体的糖基化通常是n-连接或o-连接的。n-连接的是指碳水化合物部分与天冬酰胺残基(例如,三肽序列中的天冬酰胺残基,例如天冬酰胺-x-丝氨酸和天冬酰胺-x-苏氨酸,其中x是脯氨酸以外的任何氨基酸)侧链的连接。o-联糖基化是指糖n-乙酰半乳糖胺、半乳糖或木糖中的一个与羟基氨基酸的连接,最常见地与丝氨酸或苏氨酸的连接。[0381]在某些实施方式中,本文提供的所述抗cldn18.2抗体和抗原结合片段包含具有改善的效应子功能的糖基化变体,例如adcc或cdc。[0382]在某些实施方式中,本文提供的所述抗体或其抗原结合片段是非岩藻糖基化的。术语“非岩藻糖基化”或“非岩藻糖基化的”是指减少或去除与抗体连接的n-聚糖上的核心岩藻糖。人igg抗体的大多数聚糖称为g0、g1和g2,它们是复杂的双四分体分子(biantennarymolecules),其核心岩藻糖残基带有零个、一个或两个末端半乳糖。[0383]非岩藻糖基化的抗体变体可以使用本领域已知的方法来制备,例如,如在us2003/0157108、wo2000/61739、wo2001/29246、us2003/0115614、us2002/0164328、us2004/0093621、us2004/0132140、us2004/0110704、us2004/0110282、us2004/0109865、wo2003/085119、wo2003/084570、wo2005/035586、wo2005/035778、wo2005/053742、wo2002/031140、okazaki等人,j.mol.biol.336:1239-1249(2004)、yamane-ohnuki等人,biotech.bioeng.87:614(2004)所描述的。[0384]在某些实施方式中,抗体糖基化变体在抗体fc中ch2区的asn297位点是非岩藻糖基化的。asn297是指位于fc区中约297位(fc区残基的eu编号)的天冬酰胺残基。然而,由于抗体中的微小序列变化,asn297也可位于297位上游或下游约±3个氨基酸,即在294和300位之间。[0385]在某些实施方式中,抗体糖基化变体可通过例如去除天然糖基化位点(例如,通过n297a取代)获得,以使得在抗体或fc序列中不再存在n-连接的糖基化位点的三肽序列或o-连接的糖基化位点的丝氨酸或苏氨酸残基。备选地,在某些实施方式中,可以通过在宿主细胞系中产生抗体来获得抗体糖基化变体,所述宿主细胞系在将所选糖基添加到抗体的成熟核心碳水化合物结构中是有缺陷的。[0386]3.半胱氨酸工程化的变体[0387]本文提供的所述抗cldn18.2抗体和抗原结合片段还涵盖半胱氨酸工程化的变体,其包含一个或多个引入的游离半胱氨酸氨基酸残基。[0388]游离的半胱氨酸残基是不属于二硫键桥联的部分。半胱氨酸工程化的变体可用于在工程化半胱氨酸的位点通过例如马来酰亚胺或卤代乙酰基与例如细胞毒性和/或成像化合物,标记或放射性同位素缀合。工程化抗体或抗原结合片段以引入游离半胱氨酸残基的方法是本领域已知的,参见例如wo2006/034488。[0389]4.fc变体[0390]本文提供的所述抗cldn18.2抗体和抗原结合片段还涵盖fc变体,其在其fc区和/或铰链区包含一个或多个氨基酸残基修饰或取代。[0391]在某些实施方式中,抗cldn18.2抗体或其抗原结合片段包含恒定区,该恒定区包含一个或多个氨基酸残基取代或修饰,这导致了相对于野生型恒定区增加的cdc或adcc。可以取代fc区的ch2结构域中的某些氨基酸残基以例如通过增强fc结构域与fcγriiia的亲和力来提供增强的adcc活性。通过抗体工程改变adcc活性的方法已经在本领域中有所描述,参见例如,shieldsrl.等人,jbiolchem.2001.276(9):6591-604;idusogieee.等人,jimmunol.2000.164(8):4178-84;steurerw.等人,jimmunol.1995,155(3):1165-74;idusogieee.等人,jimmunol.2001,166(4):2571-5;lazarga.等人,pnas,2006,103(11):4005-4010;ryanmc.等人,mol.cancerther.,2007,6:3009-3018;richardsjo,.等人,molcancerther.2008,7(8):2517-27;shieldsr.l.等人,j.biol.chem,2002,277:26733-26740;shinkawat.等人,j.biol.chem,2003,278:3466-3473.[0392]在某些实施方式中,抗cldn18.2抗体或抗原结合片段包含一个或多个氨基酸取代,其例如通过改善或减少c1q结合和/或补体依赖性细胞毒性(cdc)来改变补体依赖性细胞毒性(cdc)(参见,例如wo99/51642、duncan&winternature322:738-40(1988)、美国专利号5,648,260、美国专利号5,624,821、和关于fc区变体其他实例的wo94/29351)。[0393]在某些实施方式中,本文提供的抗体或其抗原结合片段的恒定区包含相对于seqidno:49(即野生型序列)的一个或多个氨基酸残基取代,所述取代选自下组:l235v、f243l、r292p、y300l、p396l或其任何组合。在某些实施方式中,所述恒定区包含如seqidno:51所示的序列。[0394]在某些实施方式中,抗cldn18.2抗体或抗原结合片段包含一个或多个氨基酸取代,其改善对新生儿fc受体(fcrn)的ph依赖性结合。这样的变体可以具有延长的药代动力学半衰期,因为它在酸性ph下与fcrn结合,从而使其能够逃离溶酶体中的降解,然后被转运并释放到细胞外。工程化抗体及其抗原结合片段以改善与fcrn的结合亲和力的方法是本领域公知的,参见例如vaughn,d.等人,structure,6(1):63-73,1998;kontermann,r.等人,antibodyengineering,volume1,chapter27:engineeringofthefcregionforimprovedpk,publishedbyspringer,2010;yeung,y.等人,cancerresearch,70:3269-3277(2010);和hinton,p.等人,j.immunology,176:346-356(2006)。[0395]抗原结合片段[0396]本文还提供了抗cldn18.2抗原结合片段。各种类型的抗原结合片段是本领域已知的,并且可以基于本文提供的所述抗cldn18.2抗体进行开发,包括例如cdr序列如表1所示的示例性抗体,以及它们的不同变体(例如亲和性变体、糖基化变体、fc变体、半胱氨酸工程化的变体等)。[0397]在某些实施方式中,本文提供的抗cldn18.2抗原结合片段是双功能抗体(diabody)、fab、fab'、f(ab')2、fd、fv片段、二硫键稳定的fv片段(dsfv)、(dsfv)2、双特异性dsfv(dsfv-dsfv')、二硫键稳定的双功能抗体(dsdiabody)、单链抗体分子(scfv)、scfv二聚体(双价的双功能抗体)、多特异性抗体、骆驼化单域抗体(camelizedsingledomainantibody)、纳米抗体、域抗体或双价域抗体。[0398]各种技术可用于产生这种抗原结合片段。说明性方法包括完整抗体的酶消化(参见,例如morimoto等人,journalofbiochemicalandbiophysicalmethods24:107-117(1992);和brennan等人,science,229:81(1985)),通过宿主细胞(例如大肠杆菌)重组表达(例如,对于fab、fv和scfv抗体片段),如上所述从噬菌体展示文库进行筛选(例如,对于scfv)以及将两个fab'-sh片段化学偶联以形成f(ab')2片段(carter等人,bio/technology10:163-167(1992))。产生抗体片段的其他技术对于熟练的从业者将是显而易见的。[0399]在某些实施方式中,所述抗原结合片段是scfv。scfv的产生描述于例如,wo93/16185、美国专利号5,571,894和5,587,458。scfv可以在氨基或羧基末端与效应蛋白融合以提供融合蛋白(参见,例如,antibodyengineering,ed.borrebaeck)。[0400]在某些实施方式中,本文提供的所述抗cldn18.2抗体及其抗原结合片段是双价、四价、六价或多价的。如本文所使用的,术语“价”是指在给定分子中存在指定数目的抗原结合位点。因此,术语“双价”、“四价”和“六价”分别表示在抗原结合分子中存在两个结合位点、四个结合位点和六个结合位点。任何大于双价的分子被认为是多价的,涵盖例如三价、四价、六价等。[0401]如果两个结合位点都对结合相同的抗原或相同的表位是特异性的,则双价分子可以是单特异性的。在某些实施方式中,这提供了比单价对应物更强的与抗原或表位的结合。类似地,多价分子也可以是单特异性的。在某些实施方式中,在双价或多价抗原结合部分中,结合位点的第一价和结合位点的第二价在结构上相同(即具有相同的序列),或在结构上不同(即,尽管具有相同的特异性但具有不同的序列)。[0402]如果两个结合位点对不同的抗原或表位是特异性的,则双价也可以是双特异性的。这也适用于多价分子。例如,当两个结合位点对第一抗原(或表位)单特异性且第三结合位点对第二抗原(或表位)特异性时,三价分子可以是双特异性的。[0403]双特异性抗体[0404]在某些实施方式中,本文提供的抗体及其抗原结合片段是双特异性的。如本文所使用的,术语“双特异性”涵盖具有两个特异性的分子和具有两个以上特异性(即,多特异性)的分子。在某些实施方式中,本文提供的所述双特异性抗体及其抗原结合片段能够与cldn18.2的第一和第二表位特异性结合,或者能够与cldn18.2和第二抗原特异性结合。在某些实施方式中,cldn18.2的第一表位和第二表位彼此不同或不重叠。在某些实施方式中,双特异性抗体及其抗原结合片段可以同时与第一表位和第二表位结合。在某些实施方式中,第二抗原不同于cldn18.2。[0405]在某些实施方式中,所述第二抗原是免疫相关靶标。在一些实施方式中,所述双特异性抗体及其抗原结合片段与cldn18.2和免疫相关靶标特异性结合,并且能够将免疫细胞靶向表达cldn18.2的细胞(例如,表达cldn18.2的肿瘤细胞)和/或激活对表达cldn18.2的靶细胞的cldn18.2特异性免疫应答。如本文所使用的免疫相关靶标,涵盖与免疫应答(可选地,细胞免疫应答)的产生或调节有关的生物分子。免疫相关靶标的一个实例是免疫检查点分子和细胞溶解性免疫细胞(例如,t细胞或自然杀伤(nk)细胞)的表面分子。[0406]免疫检查点分子可介导共刺激信号以增强免疫应答,或可介导共抑制信号以抑制免疫应答。免疫检查点分子的实例包括,例如,pd-l1、pd-l2、pd-1、clta-4、tim-3、lag3、a2ar、cd160、2b4、tgfβ、vista、btla、tigit、lair1、ox40、cd2、cd27、cd28、cd30、cd40、cd122、icam-1、ido、nkg2c、slamf7、siglec7、nkp80、cd160、b7-h3、lfa-1、icos、4-1bb、gitr、baffr、hvem、cd7、light、il-2、il-15、cd3、cd16和cd83。[0407]细胞溶解性免疫细胞可以由其表面分子触发,以攻击和介导目标细胞(例如,肿瘤细胞)的溶解。在某些实施方式中,第二抗原是t细胞表面抗原。t细胞表面抗原的实例包括但不限于选自下组的抗原:cd3、cd2、cd4、cd5、cd6、cd8、cd28、cd40l和/或cd44,优选为cd3。在某些实施方式中,所述第二抗原是cd3的ε链。在某些实施方式中,所述双特异性抗体与t细胞上的cd3结合导致了所述t细胞的增殖和/或活化,这诱导细胞毒性因子(例如,穿孔素和颗粒酶)的释放以及靶细胞的细胞溶解和凋亡。在某些实施方式中,所述第二抗原是nk细胞表面抗原,例如cd16(fcγriii)或cd56。在某些实施方式中,双特异性抗体与nk细胞上的cd16结合导致了nk细胞脱粒和靶细胞的穿孔素依赖性靶细胞裂解(adcc)。[0408]在某些实施方式中,所述第二抗原包含肿瘤抗原。如本文所使用的,“肿瘤抗原”是指肿瘤特异性抗原(例如,肿瘤细胞所特有的抗原,通常在非肿瘤细胞上不存在),肿瘤相关抗原(例如,在肿瘤和非肿瘤细胞中均存在但在肿瘤细胞中表达不同)和肿瘤新抗原(例如,由于体细胞突变而在癌细胞中表达的抗原,所述突变改变了蛋白质序列或在两个不相关序列之间产生融合蛋白)。[0409]肿瘤抗原的实例包括但不限于epcam、her2/neu、her3/neu、c250、cea、mage、蛋白聚糖、vegf、egfr、αvβ3-整联蛋白、hla、hla-dr、asc、cd1、cd2、cd4、cd6、cd7、cd8、cd11、cd13、cd14、cd19、cd20、cd21、cd22、cd23、cd24、cd30、cd33、cd37、cd40、cd41、cd47、cd52、c-erb-2、calla、mhcii、cd44v3、cd44v6、p97、神经节苷脂gm1、gm2、gm3、gd1a、gd1b、gd2、gd3、gt1b、gt3、gq1、ny-eso-1、nfx2、ssx2、ssx4、trp2、gp100(pmel17)、酪氨酸酶、muc-1、端粒酶、存活蛋白、g250、p53、ca125muc、wue抗原、lewisy抗原、hsp-27、hsp-70、hsp-72、hsp-90、pgp、mcsp、epha2和细胞表面靶标gc182、gt468或gt512、pd-l1、树状病毒e蛋白表位、神经胶质瘤相关抗原、癌胚抗原(cea)、β-人绒毛膜促性腺激素、甲胎蛋白(afp)、凝集素反应性afp、甲状腺球蛋白、rage-1、mn-caix、人端粒酶逆转录酶、ru1、ru2(as)、肠羧基酯酶、muthsp70-2、m-csf、蛋白酶、前列腺特异性抗原(psa)、pap、ny-eso-1、lage-1a、p53、前列腺素、psma、存活蛋白和端粒酶、前列腺癌肿瘤抗原-1(pcta-1)、mage、elf2m、嗜中性弹性蛋白酶、肝配蛋白b2、cd22、胰岛素生长因子(igf)-i、igf-ii、igf-1受体和间皮素、art-1/melana(mart-1)、酪氨酸酶、trp-1、trp-2和肿瘤特异性多谱系抗原,例如mage-1、mage-3、bage、gage-1、gage-2、pi5;ras,由于染色体易位而产生的独特肿瘤抗原;如bcr-abl、e2a-prl、h4-ret、1gh-igk、myl-rar;和病毒抗原,例如爱泼斯坦巴尔病毒抗原ebva和人乳头瘤病毒(hpv)抗原e6和e7;基于蛋白质的抗原包括tsp-180、mage-4、mage-5、mage-6、rage、ny-eso、pl85erbb2、pl80erbb-3、c-met、nm-23h1、psa、tag-72、ca19-9、ca72-4、cam17.1、numa、k-ras、β-连环素、cdk4、mum-1、p15、p16、43-9f、5t4(791tgp72)、甲胎蛋白、β-hcg、bca225、btaa、ca125、ca15-3\ca27.29\bcaa、ca195、ca242、ca-50、cam43、cd68\i、co-029、fgf-5、g250、ga733vepcam、htgp-175、m344、ma-50、mg7-ag、mov18、nb/70k、ny-co-1、rcas1、sdccag16、ta-90\mac-2结合蛋白、亲环蛋白c相关蛋白、taal6、tag72、tlp和tps。[0410]在某些实施方式中,肿瘤抗原与胃癌、食道癌、胰腺癌、肺癌、卵巢癌、结肠癌、肝癌、头颈癌、胆囊癌及其转移有关。此类肿瘤抗原的实例包括但不限于ca-125、神经节苷脂g(d2)、g(m2)和g(d3)、cd20、cd52、cd33、ep-cam、cea、蛙皮素样肽、psa、her2/neu、表皮生长因子受体(egfr)、erbb2、erbb3/her3、erbb4、cd44v6、ki-67、癌症相关粘蛋白、vegf、vegfr(例如vegfr3)、雌激素受体、lewis-y抗原、tgfβ1、igf-1受体、egfα、c-kit受体、转铁蛋白受体、il-2r或co17-1a、ca19-9和ca72-4。在某些实施方式中,所述肿瘤抗原存在于表达cldn18.2的细胞(例如,表达cldn18.2的癌细胞)中。[0411]本文提供的双特异性抗体及其抗原结合片段可以是本领域已知的合适形式。例如,示例性双特异性形式可以是双特异性双抗体、基于scfv的双特异性形式、igg-scfv融合、双可变结构域(dvd)-ig、quadroma、knobs-into-holes、共同轻链(例如,带有knobs-into-holes的普通轻链等)、bite、crossmab、crossfab、duobody、seedbody、亮氨酸拉链、双作用fab(daf)-igg和mab2双特异性形式(参见,例如brinkmann等人,2017,mabs,9(2):182-212)。双特异性分子可以是对称或不对称的结构。[0412]本文提供的所述双特异性抗体和抗原结合片段可以通过本领域已知的任何合适方法来制备。[0413]在一个实施方式中,将具有不同抗原特异性的两个免疫球蛋白重链-轻链对在宿主细胞中共表达,以重组方式产生双特异性抗体(参见,例如milsteinandcuello,nature,305:537(1983)),然后通过亲和力层析纯化。[0414]在另一个实施方式中,将编码具有两种特异性的抗体重链可变结构域的序列分别与免疫球蛋白恒定结构域序列融合,然后插入一个或多个表达载体中,所述一个或多个表达载体与用于轻链序列的表达载体共转染到合适的宿主细胞中,以重组表达双特异性抗体。(参见,例如,wo94/04690;suresh等人,methodsinenzymology,121:210(1986))。类似地,scfv二聚体也可以从宿主细胞重组构建并表达。(参见,例如,gruber等人,j.immunol.,152:5368(1994))。[0415]在另一种方法中,可以通过基因融合将来自fos和jun蛋白的亮氨酸拉链肽连接至两种不同抗体的fab'部分。所连接的抗体在铰链区被还原成四个半抗体(即单体),然后再氧化形成异二聚体(kostelny等人,j.immunol.,148(5):1547-1553(1992))。[0416]两个抗原结合结构域也可以缀合或交联以形成双特异性抗体或抗原结合片段。例如,一种抗体可以与生物素偶联,而另一种抗体与抗生物素蛋白偶联,生物素与抗生物素蛋白之间的强结合将两种抗体复合在一起形成双特异性抗体(参见,例如,美国专利号4,676,980;wo91/00360、wo92/00373和ep03089)。以另一个实施例为例,两种抗体或抗原结合片段可以通过本领域已知的常规方法交联,例如,如美国专利号4,676,980中所公开的。[0417]双特异性抗原结合片段可以从双特异性抗体例如,通过蛋白水解切割或通过化学连接产生。例如,可以制备抗体的抗原结合片段(例如,fab')并将其转化为fab'-硫醇衍生物,然后与具有不同抗原特异性的另一种转化的fab'衍生物混合并反应,以形成双特异性抗原-结合片段(参见,例如,brennan等人,science,229:81(1985))。[0418]在某些实施方式中,本文提供的所述双特异性抗体或其抗原结合片段可以在界面上被工程化,从而可以形成knob-into-hole的结合以促进两个不同抗原结合位点的异二聚化。这可以使从重组细胞培养物中回收的异二聚体的百分比最大化。如本文所使用的,“knob-into-hole”是指两个多肽(例如fc)之间的相互作用,其中一个多肽由于存在具有大侧链的氨基酸残基而具有突起(即“knob”)(例如酪氨酸或色氨酸),另一个多肽具有一个空腔(即“hole”),小侧链氨基酸残基位于其中(例如丙氨酸或苏氨酸),并且该突起在该空腔中可定位,从而促进两个多肽中的相互作用以形成异二聚体或复合物。产生具有knobs-into-hole的多肽的方法在本领域中是已知的,例如,如美国专利号5,731,168所述。[0419]缀合物[0420]在一些实施方式中,抗cldn18.2抗体及其抗原结合片段与一个或多个缀合部分连接。缀合物是可以附着于抗体或其抗原结合片段的部分。预期各种缀合物可与本文提供的抗体或抗原结合片段连接(参见,例如,“conjugatevaccines”,contributionstomicrobiologyandimmunology,j.m.cruseandr.e.lewis,jr.(eds.),cargerpress,newyork,(1989))。这些共轭物可以通过共价结合、亲和力结合、嵌入、配位结合、复合、缔合、掺合或添加等方法与抗体或抗原结合片段连接。在某些实施方式中,抗体或其抗原结合片段通过接头与一种或多种缀合物连接。在某些实施方式中,接头是腙接头(hydrazonelinker)、二硫接头、双功能接头、二肽接头、葡糖醛酸苷接头、硫醚接头。[0421]在某些实施方式中,本文公开的抗cldn18.2抗体和抗原结合片段可以被工程化为在表位结合部分之外包含可用于结合一种或多种缀合物的特异性位点。例如,这样的位点可以包括一个或多个反应性氨基酸残基(例如,半胱氨酸或组氨酸残基),以促进与缀合物的共价连接。[0422]缀合物可以是清除修饰剂、治疗剂(例如化疗剂)、毒素、放射性同位素、可检测标记(例如,镧系元素、发光标记、荧光标记或酶底物标记),药代动力学修饰部分,dna烷化剂、拓扑异构酶抑制剂、微管蛋白结合剂,其他抗癌药物或纯化部分(例如磁珠或纳米颗粒)。[0423]可检测标记的实例可以包括荧光标记(例如,荧光素、若丹明、丹酰、藻红蛋白或德克萨斯红)、酶底物标记(例如,辣根过氧化物酶、碱性磷酸酶、萤光素酶、葡糖淀粉酶、溶菌酶、糖类氧化酶或β-d-半乳糖苷酶)、放射性同位素、其他镧系元素、发光标记、发色部分、洋地黄毒苷、生物素/亲和素、dna分子或用于检测的金。[0424]放射性同位素的实例可以包括123i、124i、125i、131i、35s、3h、111in、112in、14c、64cu、67cu、86y、88y、90y、177lu、211at、186re、188re、153sm、212bi和32p。放射性同位素标记的抗体可用于受体靶向成像实验。[0425]在某些实施方式中,缀合物可以是有助于增加抗体半衰期的药代动力学修饰部分,例如peg。其他合适的聚合物包括例如羧甲基纤维素、葡聚糖、聚乙烯醇、聚乙烯吡咯烷酮、乙二醇/丙二醇的共聚物等。[0426]在某些实施方式中,缀合物可以是纯化部分(例如磁珠或纳米颗粒)。[0427]抗体-药物缀合物[0428]在某些实施方式中,本公开提供了抗体-药物缀合物(adc),其包含与细胞毒性剂缀合的任何上述抗cldn18.2抗体或抗原结合片段。[0429]adc可用于局部递送细胞毒性剂,例如在癌症治疗中。这允许将细胞毒性剂靶向递送至肿瘤并在其中进行细胞内积累,这在以下方面特别有用:全身施用这些未缀合的细胞毒性剂可能导致对正常细胞以及寻求消除的肿瘤细胞的不可接受水平的毒性(baldwin等人,(1986)lancetpp.(mar.15,1986):603-05;thorpe,(1985)“antibodycarriersofcytotoxicagentsincancertherapy:areview,”inmonoclonalantibodies'84:biologicalandclinicalapplications,a.pinchera等人,(ed.s),pp.475-506;syrigosandepenetos(1999)anticancerresearch19:605-614;niculescu-duvazandspringer(1997)adv.drgdel.rev.26:151-172;美国专利号4,975,278).)。[0430]在某些实施方式中,细胞毒性剂可以是对细胞有害或可以损害或杀死细胞的任何试剂。在某些实施方式中,细胞毒性剂可选地是毒素、化疗剂(例如dna烷化剂、拓扑异构酶抑制剂、微管蛋白结合剂、生长抑制剂或其他抗癌药物)或放射性同位素。[0431]毒素的实例包括细菌毒素和植物毒素,例如白喉毒素、外毒素a链(来自铜绿假单胞菌)、蓖麻毒蛋白、阿布林、莫德霉素、α帚曲毒蛋白、拟南芥(aleuritesfordii)蛋白、石黄素蛋白、美洲疫霉蛋白(pari、papii和pap-s)、苦瓜抑制剂、姜黄素、巴豆菌素、皂角抑制剂(sapaonariaofficinalisinhibitor)、多花白树毒蛋白、限制酶,苯霉素,依诺霉素和单端孢霉毒素(参见wo93/21232)。可以使用本领域已知的方法将这种大分子毒素与本文提供的所述抗体或抗原结合片段缀合,例如,如在vitetta等人,(1987)science,238:1098所描述的。[0432]细胞毒性剂也可以是小分子毒素和化疗剂,例如格尔德霉素(mandler等人,(2000)jour.ofthenat.cancerinst.92(19):1573-1581;mandler等人,(2002)bioconjugatechem.13:786-791)、美登素和美登木素生物碱((ep1391213;liu等人,(1996)proc.natl.acad.sci.usa93:8618-8623;u.s.pat.no.5,208,020)、加利车霉素(lode等人,(1998)cancerres.58:2928;hinman等人,(1993)cancerres.53:3336-3342)、紫杉醇、细胞松弛素b、短杆菌肽d、溴化乙锭、依米丁、丝裂霉素、依托泊苷、替诺泊苷、长春新碱、长春花碱、长春地辛、秋水仙碱、阿霉素、柔红霉素、二羟基蒽醌二酮、米托蒽醌、光神霉素、放线菌素d、1-脱氢睾丸激素、糖皮质激素、普鲁卡因、丁卡因、利多卡因、普萘洛尔、嘌呤霉素及其类似物、抗代谢物(例如甲氨蝶呤、6-巯基嘌呤、6-硫鸟嘌呤、阿糖胞苷、5-氟尿嘧啶脱羧嗪)、烷基化剂(例如氮芥、噻菌灵苯丁酸氮芥、美法仑、卡莫司汀(bsnu)和洛莫司汀(ccnu)、环磷酰胺、白消安、二溴甘露醇、链脲佐菌素、丝裂霉素c和顺式二氯二胺铂(ii)(ddp)顺铂)、蒽环类药物(例如柔红霉素(以前为道诺霉素)和阿霉素)、抗生素类药物(例如放线菌素(dactinomycin)(以前为放线菌素(actinomycin))、博来霉素、神霉素和蒽霉素(amc))和抗有丝分裂剂(例如长春新碱和长春花碱)、加利车霉素、美登木素生物碱、多拉司他汀、耳他汀,例如mmae和mmaf(美国专利号5,635,483、5,780,588)、多洛他汀、单端孢霉毒素和cc1065,及其具有细胞毒性活性的衍生物。[0433]细胞毒性剂也可以是高放射性同位素。实例包括at211、i131、i125、y90、re186、sm153、bi212、p32、pb212和lu的放射性同位素。放射性同位素与抗体的缀合方法在本领域是已知的,例如,通过合适的配体试剂(参见,例如,wo94/11026;currentprotocolsinimmunology,volumes1and2,coligenetal,ed.wiley-interscience,newyork,n.y.,pubs.(1991))。配体试剂具有可以结合、螯合或复合放射性同位素金属的螯合配体,并且还具有与抗体或抗原结合片段的半胱氨酸的巯基反应的官能团。示例性的螯合配体包括dota、dotp、dotma、dtpa和teta(macrocyclics,dallas,tex.)。[0434]细胞毒性剂可以通过本领域已知的任何合适的接头与抗体或抗原结合片段连接,参见例如美国专利号5,208,020、6,441,163或欧洲专利0425235b1、chari等人,cancerresearch52:127-131(1992)和us2005/0169933a1,其公开内容通过引用明确地并入本文。[0435]在某些实施方式中,接头在特定的生理环境下是可裂解的,从而促进细胞毒性药物在细胞中的释放。例如,接头可以是酸不稳定的接头、对肽酶敏感的接头、光不稳定的接头、二甲基接头或含二硫键的接头、硫醚接头和酯酶不稳定的接头(chari等人,cancerresearch52:127-131(1992)、美国专利号5,208,020)。在一些实施方式中,接头可包含氨基酸残基,例如二肽、三肽、四肽或五肽。连接子中的氨基酸残基可以是天然或非天然存在的氨基酸残基。此类接头的实例包括:缬氨酸-瓜氨酸(ve或val-cit)、丙氨酸-苯丙氨酸(af或ala-phe)、甘氨酸-缬氨酸-瓜氨酸(gly-yal-cit)、甘氨酸-甘氨酸-甘氨酸(gly-gly-gly)、缬氨酸-瓜氨酸-对氨基苄氧基氧酰基(“vc-pab”)。可以设计和优化氨基酸接头成分的选择性,以通过特定的酶(例如,肿瘤相关的蛋白酶、组织蛋白酶b、c和d或纤溶酶蛋白酶)进行酶促裂解。[0436]在某些实施方式中,细胞毒性剂可以通过双功能接头试剂与本文提供的抗体或其抗原结合片段连接,所述双功能接头试剂包括例如n-琥珀酰亚胺基-3-(2-吡啶基二硫代)丙酸酯(spdp)、琥珀酰亚胺基-4-(n-马来酰亚胺基甲基)环己烷-1-甲酸酯(smcc)、n-琥珀酰亚胺基-4-(2-吡啶硫基)戊酸酯(spp)、亚氨基硫杂环戊烷(it)、亚氨基酯的双功能衍生物(例如己二酸二甲酯hcl)、活性酯(如辛二酸二琥珀酰亚胺基酯)、醛(如戊二醛)、双叠氮基化合物(如双(对叠氮基苯甲酰基)己二胺)、双重氮鎓衍生物(如双-(对重氮苯甲酰基)-乙二胺)、二异氰酸酯(如甲苯2,6-二异氰酸酯)、双活性氟化合物(例如1,5-二氟-2,4-二硝基苯)、bmps、emcs、gmbs、hbvs、lc-smcc、mbs、mprh、sbap、sia、siab、smpb、smph、磺基-emcs、磺基-gmbs、磺基-kmus、磺基-mbs、磺基-siab、磺基-smcc和磺基-smpb和svsg(琥珀酰亚胺基-(4-乙烯基砜)苯甲酸酯)。这些接头试剂是可商购的(例如,从piercebiotechnology,inc.,rockford,ill.,u.s.a,参见pages467-498,2003-2004applicationshandbookandcatalog)。[0437]在某些实施方式中,在本文提供的adc中,抗体(或其抗原结合片段)在抗体处与一种或多种细胞毒性剂缀合:试剂比率为约1至约20、约1至约6、约2至约6、约3至约6、约2至约5、约2至约4、或约3至约4。[0438]本文提供的adc可以通过本领域已知的任何合适的方法来制备。在某些实施方式中,首先使抗体(或其抗原结合片段)的亲核基团与双功能接头试剂反应,然后与细胞毒性剂连接,或者相反,即首先使细胞毒性剂的亲核试剂与双功能接头反应,然后与抗体连接。[0439]在某些实施方式中,细胞毒性剂可以包含(或修饰为包含)可以与本文提供的抗体或抗原结合片段的游离半胱氨酸的半胱氨酸硫醇反应的硫醇反应性官能基团。示例性的硫醇反应性官能基团包括例如马来酰亚胺、碘乙酰胺、吡啶基二硫化物、卤代乙酰基、琥珀酰亚胺酯(例如,nhs、n-羟基琥珀酰亚胺)、异硫氰酸酯、磺酰氯、2,6-二氯三嗪基、五氟苯基酯或亚磷酰胺(haugland,2003,molecularprobeshandbookoffluorescentprobesandresearchchemicals,molecularprobes,inc.;brinkley,1992,bioconjugatechem.3:2;garman,1997,non-radioactivelabelling:apracticalapproach,academicpress,london;means(1990)bioconjugatechem.1:2;hermanson,g.inbioconjugatetechniques(1996)academicpress,sandiego,pp.40-55,643-671)。[0440]细胞毒性剂或抗体在缀合形成adc之前可以与连接剂反应。例如,可以进行、分离、纯化和/或表征细胞毒性剂的n-羟基琥珀酰亚胺酯(nhs),或者可以原位形成并与抗体的亲核基团反应。通常,缀合物的羧基形式是通过与以下试剂的组合反应来活化:碳二亚胺试剂,例如二环己基碳二亚胺、二异丙基碳二亚胺,或铀试剂,例如tstu(o-(n-琥珀酰亚胺基)-n,n,n',n'-四甲基铀鎓四氟硼酸酯、hbtu(o-苯并三唑-1-基)-n,n,n',n'-四甲基尿铵六氟磷酸盐)或hatu(o-(7-氮杂苯并三唑-1-基)-n,n,n',n'-四甲基尿铵六氟磷酸盐),活化剂,例如1-羟基苯并三唑(hobt)和n-羟基琥珀酰亚胺,以得到nhs酯。在某些情况下,细胞毒性剂和抗体可以通过原位活化和反应连接在一起,从而一步形成adc。其他活化和连接试剂包括tbtu(2-(1h-苯并三唑-1-基)-1,1,3,3-四甲基尿铵六氟磷酸盐)、tffh(n,n',n″,n″′‑四甲基尿铵2-氟-六氟磷酸盐)、pybop(苯并三唑-1-基-氧-三-吡咯烷基-六氟磷酸膦)、eedq(2-乙氧基-1-乙氧基羰基-1,2-二氢-喹啉)、dcc(二环己基碳二亚胺)、dipcdi(二异丙基碳二亚胺)、msnt(1-(均三甲苯-2-磺酰基)-3-硝基-1h-1,2,4-三唑和芳基磺酰卤,例如三异丙基苯磺酰氯。在另一个实例中,抗体或抗原结合片段可以与生物素缀合,然后间接与第二缀合物缀合,所述第二缀合物与抗生物素蛋白缀合。[0441]嵌合抗原受体(car)组合物[0442]本公开还提供了嵌合抗原受体(car),其包含如本文提供的抗cldn18.2抗原结合结构域和t细胞活化结构域。嵌合抗原受体(car)是工程化的嵌合受体,其将抗体的抗原结合结构域与一个或多个信号传导结构域结合以用于t细胞活化。可以对t细胞和自然杀伤(nk)细胞等免疫细胞进行基因工程改造以表达car。表达car的t细胞被称为car-t细胞。car可以介导t细胞中的抗原特异性细胞免疫活性,使car-t细胞能够消除表达目标抗原的细胞(例如肿瘤细胞)。在一个实施方式中,本文提供的car-t细胞与在诸如癌细胞的细胞上表达的cldn18.2的结合导致所述car-t细胞的增殖和/或活化,其中所述活化的car-t细胞可以释放细胞毒性因子,例如穿孔素、颗粒酶和颗粒溶素,并启动癌细胞的细胞溶解和/或凋亡。[0443]在一些实施方式中,car的t细胞活化结构域包含共刺激性信号传导结构域和tcr信号传导结构域,其可以随机或以指定顺序彼此连接,任选地与具有例如2至10个氨基酸之间的长度的短肽接头(例如,甘氨酸-丝氨酸双联体接头)连接。[0444]在一些实施方式中,car进一步包含跨膜结构域。当在细胞中表达时,抗cldn18.2抗原结合结构域在细胞外,而t细胞活化结构域在细胞内。[0445]在某些实施方式中,car包含抗cldn18.2抗原结合结构域、跨膜结构域、共刺激信号传导区和tcr信号传导结构域,其中所述抗原结合结构域与cldn18.2特异性结合,并且包含本文提供的抗体的抗原结合片段。[0446]1.抗原结合结构域[0447]在一些实施方式中,car的抗cldn18.2抗原结合结构域包含本文提供的一个或多个cdr序列、本文提供的一个或多个重链可变结构域或轻链可变结构域、或一种或多种源于本文提供的任何抗cldn18.2抗体的抗原结合片段。[0448]在一些实施方式中,源于相同物种对于抗原结合结构域是有益的,其中car将最终用于该相同物种。例如,用于人时,使car中使用的抗原结合结构域源于人抗体或人源化抗体可能是有益的。在一些实施方式中,抗原结合结构域包含单链可变片段(scfv)。在一些实施方式中,抗原结合结构域可以以多种其他形式存在,其包括例如fv、fab和(fab')2,以及双功能(即双特异性)杂交抗体片段(例如,lanzavecchia等人,eur.j.immunol.17,105(1987))。在某些实施方式中,抗原结合结构域包含fab或scfv。[0449]2.跨膜结构域[0450]在某些实施方式中,car包含与car的细胞外抗原结合结构域融合的跨膜结构域。在一个实施方式中,可以选择跨膜结构域,使得其与car中的一个结构域自然缔合。在一些情况下,可以选择或修饰跨膜结构域以避免与t细胞受体复合物的其他成员的跨膜结构域结合。[0451]本文提供的car的跨膜结构域可以源于任何天然膜结合或跨膜蛋白的跨膜结构域,例如t细胞受体的α、β或ζ链、cd28、cd3ε、cd45、cd4、cd5、cd8、cd9、cd16、cd22、cd33、cd37、cd64、cd80、cd86、cd134、cd137和cd154。在一些实施方式中,car的跨膜结构域也可以使用多种人铰链,例如人ig(免疫球蛋白)铰链。[0452]替代地,本文提供的car的跨膜结构域可以是合成的,例如,主要包含疏水性残基(例如,亮氨酸和缬氨酸)。在一个实施方式中,在合成的跨膜结构域的每个末端包括苯丙氨酸、色氨酸和缬氨酸的三联体。可选地,长度在2至10个氨基酸之间的短寡肽接头或多肽接头可形成car的跨膜结构域和细胞内信号传导结构域之间的连接。甘氨酸-丝氨酸二联体提供了特别合适的接头。[0453]3.tcr信号传导结构域[0454]本文提供的car的t细胞活化结构域包括tcr信号传导结构域。tcr信号传导结构域可以激活表达car的t细胞,以发挥t细胞的至少一种正常tcr效应子功能,例如,细胞溶解活性或包括细胞因子分泌的辅助活性。tcr信号传导结构域可以是全长的天然细胞内信号转导结构域,或者是其足以转导tcr效应子功能信号的片段。[0455]可用于本文提供的car的示例性胞内信号传导结构域包括t细胞受体(tcr)和共受体的细胞质序列,以及这些序列的任何衍生物或变体和具有相同功能能力的任何合成序列,所述共受体在抗原受体参与后共同启动信号转导。[0456]以刺激方式起作用的tcr信号传导结构域可以包含信号传导基序,所述信号传导基序被称为基于免疫受体酪氨酸的活化基序或itam。可用于本文提供的car中的包含tcr信号传导结构域的itam的实例包括那些源于tcrζ、fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd5、cd22、cd79a、cd79b和cd66d的itam。在某些实施方式中,tcr信号传导结构域包含源于cd3-ζ的细胞质信号传导序列。[0457]4.共刺激信号传导区[0458]本文提供的car的t细胞活化结构域进一步包含共刺激信号传导区。共刺激信号传导区以抗原非依赖性方式起作用以介导tcr激活,并且可以源于淋巴细胞对抗原的有效应答所需的共刺激分子。示例性的共刺激分子包括cd27、cd28、4-1bb(cd137)、ox40、cd30、cd40、pd-1、icos、淋巴细胞功能相关抗原-1(lfa-1)、cd2、cd7、light、nkg2c、b7-h3和与cd83特异性结合的配体等。[0459]5.双特异性car[0460]在某些实施方式中,car是双特异性的。在某些实施方式中,本文提供的双特异性car与cldn18.2的第一和第二表位特异性结合,或能够与cldn18.2和第二抗原特异性结合。[0461]在一个实施方式中,所述car与活细胞表面上存在的cldn18.2的天然表位结合。[0462]6.编码car的多核苷酸序列[0463]在一个方面,本公开进一步提供了编码本文提供的car的核酸序列,其包含编码本文提供的car的抗原结合结构域的第一多核苷酸序列,和可选地编码本文提供的跨膜结构域和t细胞活化结构域的第二多核苷酸序列。在一些实施方式中,编码抗原结合结构域的序列与编码跨膜结构域和t细胞活化结构域的序列可操作地连接。可以使用本领域已知的重组方法来获得编码所需分子的核酸序列,例如,通过从表达该基因的细胞中筛选文库,通过从已知包括该基因的载体中获得该基因,或者通过使用标准技术直接从含有该基因的细胞和组织中分离出来。替代地,目标基因可以通过合成制备,而非克隆。[0464]在一个方面,本公开提供了包含编码本文提供的car的核酸序列的载体。在一些实施方式中,载体是表达可以直接转导到细胞中的如本公开的car的逆转录病毒和慢病毒载体构建体,或者是可以直接转染到细胞中的rna构建体。[0465]在一个方面,本公开提供了分离的细胞,其包含编码本文提供的car和/或表达本文提供的car的核酸序列。[0466]在某些实施方案中,包含编码car或表达car的核酸的细胞选自t细胞、nk细胞、细胞毒性t淋巴细胞(ctl)和调节性t细胞。在一个实施方式中,当car的抗原结合结构域与其相应抗原结合时,包含编码car或表达car的核酸的细胞表现出抗肿瘤免疫。尽管可以使用异源细胞或同种异体细胞,但是细胞毒性淋巴细胞优选为自体细胞。如本文所使用的,“自体的”是指源于同一个体的任何材料,之后将其重新引入该个体。[0467]在一个方面,本公开进一步提供了用于在受试者中对表达cldn18.2的细胞或组织刺激t细胞介导的免疫应答的方法,所述方法包括向受试者施用有效量的经遗传修饰以表达本文提供的car的细胞。[0468]在一个方面,本公开进一步提供了用于治疗患有与cldn18.2的表达升高相关的疾病、病症或病况的哺乳动物的方法,其包括向所述哺乳动物施用有效量的经遗传修饰以表达本文提供的car的细胞,从而治疗哺乳动物。在某些实施方式中,所述细胞是自体t细胞。在某些实施方式中,已经诊断出哺乳动物患有与cldn18.2表达升高有关的疾病、病症或病况。[0469]多核苷酸和重组方法[0470]本公开提供了编码抗cldn18.2抗体及其抗原结合片段的分离的多核苷酸。本文所使用的术语“核酸”或“多核苷酸”是指单链或双链形式的脱氧核糖核酸(dna)或核糖核酸(rna)及其聚合物。除非另有说明,否则特定的多核苷酸序列还隐含地涵盖其保守修饰的变体(例如简并密码子取代)、等位基因、直系同源物、snp和互补序列以及明确指出的序列。具体来说,简并的密码子取代可以通过生成序列来实现,其中一个或多个选定(或全部)密码子的第三位被混合碱基和/或脱氧肌苷残基取代(参见batzer等人,nucleicacidres.19:5081(1991);ohtsuka等人,j.biol.chem.260:2605-2608(1985);androssolini等人,mol.cell.probes8:91-98(1994))。[0471]使用常规程序(例如,通过使用能够与编码抗体的重链和轻链的基因特异性结合的寡核苷酸探针)容易地分离和测序编码单克隆抗体的dna。编码dna也可以通过合成方法来获得。[0472]本公开提供了包含本文提供的分离的多核苷酸的载体(例如,表达载体)。在某些实施方式中,本文提供的表达载体包含编码本文提供的抗体或其抗原结合片段的多核苷酸,与该多核苷酸序列可操作连接的至少一种启动子(例如,sv40、cmv、ef-1α),以及至少一种选择标记。载体的实例包括但不限于逆转录病毒(包括慢病毒)、腺病毒、腺相关病毒、疱疹病毒(例如单纯疱疹病毒)、痘病毒、杆状病毒、乳头瘤病毒、乳腺病毒(例如,sv40)、λ噬菌体和m13噬菌体、质粒,例如pcdna3.3、pmd18-t、poptivec、pcmv、pegfp、pires、pqd-hyg-gseu、palter、pbad、pcdna、pcal、pl、pet、pgemex、pgex、pci、pegft、psv2、pfuse、pvitro、pvivo、pmal、pmono、pselect、puno、pduo、psg5l、pbabe、pwpxl、pbi、p15tv-l、ppro18、ptd、prs10、plexa、pact2.2、pcmv-script.rtm、pcdm8、pcdna1.1/amp、pcdna3.1、prc/rsv、pcr2.1、pef-1、pfb、psg5、pxt1、pcdef3、psvsport、pef-bos等。[0473]可以将包含编码抗体或其抗原结合片段的多核苷酸序列的载体导入宿主细胞以进行克隆或基因表达。用于在本文的载体中克隆或表达dna的合适的宿主细胞是上述的原核生物、酵母或更高等的真核细胞。用于该目的的合适的原核生物包括真细菌,例如革兰氏阴性或革兰氏阳性生物,例如肠杆菌科、例如大肠杆菌、肠杆菌、欧文氏菌、克雷伯菌、变形杆菌、沙门氏菌(例如,鼠伤寒沙门氏菌)、沙雷氏菌(例如,粘质沙雷氏菌)和志贺氏菌,以及枯草芽孢杆菌和地衣芽孢杆菌等芽孢杆菌,铜绿假单胞菌等假单胞菌和链霉菌。[0474]除原核生物外,真核微生物如丝状真菌或酵母菌也是抗cldn18.2抗体编码载体的合适克隆或表达宿主。酿酒酵母或普通的面包酵母是低等真核宿主微生物中最常用的。然而,许多其他属、种和菌株在本文中通常是可获得的和有用的,例如粟酒裂殖酵母;克鲁维酵母宿主例如乳酸克氏菌(k.lactis)、脆弱的克氏菌(k.fragilis)(atcc12,424)、保加利亚克氏菌(atcc16,045)、柳条克氏菌(atcc24,178)、沃氏克氏菌(atcc56,500)、果蝇克氏菌(atcc36,906)、耐高温克氏菌和马克斯克氏菌、耶氏酵母(ep402,226);巴斯德毕赤酵母(ep183,070);念珠菌;里氏木霉(ep244,234);克氏神经孢菌;许旺酵母(schwanniomyces),例如西方许旺酵母(schwanniomycesoccidentalis);和丝状真菌,例如神经孢菌、青霉、弯颈霉(tolypocladium)和曲霉宿主,例如构巢曲霉和黑曲霉。[0475]用于表达本文提供的糖基化抗体或抗原片段的合适的宿主细胞源于多细胞生物,例如无脊椎动物细胞,例如植物和昆虫细胞。已经鉴定出来自宿主的许多杆状病毒株和变体以及相应的允许的昆虫宿主细胞,这些宿主如spodopterafrugiperda(毛虫)、aedesaegypti(蚊)、aedesalbopictus(蚊)、drosophilamelanogaster(果蝇)和家蚕。用于转染的多种病毒株是可公开获得的,例如,苜蓿丫纹夜蛾核多角体病毒(autographacalifornicanpv)的l-1变体和家蚕核多角体病毒(bombyxmorinpv)的bm-5株;并且根据本发明,此类病毒可用作本文的病毒,特别是用于转染贪食斜纹夜蛾(spodopterafrugiperda)细胞。棉花、玉米、马铃薯、大豆、矮牵牛、番茄和烟草的植物细胞培养物也可以用作宿主。[0476]然而,对脊椎动物细胞的兴趣最大,并且在培养(组织培养)中繁殖脊椎动物细胞已成为常规程序。有用的哺乳动物宿主细胞系的实例是被sv40(cos-7、atcccrl1651)转化的猴肾cv1细胞系;人胚胎肾细胞系(在悬浮培养中亚克隆生长的293或293细胞,graham等人,j.genvirol.36:59(1977));婴儿仓鼠肾细胞(bhk、atccccl10);中国仓鼠卵巢细胞/-dhfr(cho,urlaub等人,proc.natl.acad.sci.usa77:4216(1980));小鼠睾丸支持细胞(tm4,mather,biol.reprod.23:243-251(1980));猴肾细胞(cv1atccccl70);非洲绿猴肾细胞(vero-76,atcccrl-1587);人宫颈癌细胞(hela,atccccl2);犬肾细胞(mdck,atccccl34);水牛大鼠肝细胞(brl3a,atcccrl1442);人肺细胞(w138,atccccl75);人肝细胞(hepg2,hb8065);小鼠乳腺肿瘤(mmt060562,atccccl51);tri细胞(mather等人,annalsn.y.acad.sci.383:44-68(1982));mrc5细胞;fs4细胞;和人类肝癌细胞系(hepg2)。在一些优选的实施方式中,宿主细胞是哺乳动物培养的细胞系,例如cho、bhk、ns0、293及其衍生物。[0477]用于制备抗cldn18.2抗体的上述表达或克隆载体转化宿主细胞,并在经适当修饰的常规营养培养基中培养,以诱导启动子,选择转化子或扩增编码所需序列的基因。在另一个实施方式中,可以通过本领域已知的同源重组法制备抗体。[0478]用于制备本文提供的抗体或抗原结合片段的宿主细胞可以在多种培养基中培养。诸如ham’sf10(sigma),基本必需培养基(mem)(sigma)、rpmi-1640(sigma)和dulbecco修饰的eagle's培养基(dmem)(sigma)等市售培养基均适于培养宿主细胞。此外,ham等人,meth.enz.58:44(1979),barnes等人,anal.biochem.102:255(1980)、美国专利号4,767,704;4,657,866;4,927,762;4,560,655;或5,122,469;wo90/03430;wo87/00195;或美国专利re.30,985中描述的任何培养基可用作宿主细胞的培养基。这些培养基中的任何一种均可根据需要补充激素和/或其他生长因子(例如,胰岛素、转铁蛋白或表皮生长因子)、盐(例如,氯化钠、钙、镁和磷酸盐)、缓冲液(例如,hepes)、核苷酸(例如,腺苷和胸苷)、抗生素(例如,gentamycintm药物)、微量元素(定义为通常以微摩尔范围的终浓度存在的无机化合物)和葡萄糖或等效能源。也可以以本领域技术人员已知的适当浓度包括任何其他必要的补充剂。培养条件(例如,温度、ph等),是先前选择用于表达的宿主细胞所使用的那些培养条件,并且对于本领域技术人员而言是显而易见的。[0479]当使用重组技术时,抗体可以在细胞内、周质空间中产生,或直接分泌到培养基中。如果抗体在细胞内产生,则第一步,例如通过离心或超滤除去宿主细胞或溶解片段的颗粒碎片。carter等人,bio/technology10:163-167(1992)描述了分离分泌到大肠杆菌周质空间的抗体的方法。简而言之,将细胞糊状物在乙酸钠(ph3.5)、edta、和苯甲基磺酰氟(pmsf)的存在下解冻约30分钟。可以通过离心去除细胞碎片。在抗体分泌到培养基中的情况下,通常首先使用可商购的蛋白质浓缩过滤器(例如,amicon或milliporepellicon超滤单元),浓缩来自此类表达系统的上清液。蛋白酶抑制剂(例如,pmsf)可以包括在上述任何步骤中,以抑制蛋白水解作用,并且抗生素可以包含在内,以防止不定污染物的生长。[0480]由细胞制备的抗cldn18.2抗体及其抗原结合片段可以使用例如,羟基磷灰石色谱、凝胶电泳、渗析、deae-纤维素离子交换色谱、硫酸铵沉淀、盐析和亲和色谱进行纯化,其中亲和色谱是优选的纯化技术。[0481]在某些实施方式中,固定在固相上的蛋白a用于抗体及其抗原结合片段的免疫亲和纯化。蛋白a作为亲和配体的适用性取决于抗体中存在的任何免疫球蛋白fc结构域的种属和同种型。蛋白a可用于纯化基于人γ1、γ2或γ4重链的抗体(lindmark等人,j.immunol.meth.62:1-13(1983))。蛋白质g被推荐用于所有小鼠同种型和人类γ3(guss等人,emboj.5:15671575(1986))。亲和配体附着的基质通常是琼脂糖,但也可以使用其他基质。机械稳定的基质(例如受控孔玻璃或聚(苯乙烯二乙烯基)苯)比琼脂糖具有更快的流速和更短的处理时间。如果抗体包含ch3结构域,则bakerbondabx.tm.树脂(j.t.baker,phillipsburg,n.j.)可用于纯化。根据要回收的抗体,也可以使用其他蛋白质纯化技术,例如在离子交换柱上分级分离、乙醇沉淀、反相hplc、硅胶色谱、肝素色谱、阴离子或阳离子交换树脂上的sepharosetm色谱(例如,聚天冬氨酸柱)、色谱聚焦、sds-page、和硫酸铵沉淀。[0482]在任何初步纯化步骤之后,可使用在约2.5-4.5的ph下的洗脱缓冲液,对包含感兴趣的抗体和污染物的混合物进行低ph疏水相互作用色谱,优选在低盐浓度下(例如,约0-0.25m的盐)进行。[0483]组合物[0484]另一方面,本公开提供了包含抗cldn18.2抗体或其抗原结合片段的组合物。[0485]在另一个方面,本公开提供了包含非岩藻糖基化的抗cldn18.2抗体或其抗原结合片段的组合物。在某些实施方式中,根据eu编号系统,所述组合物中的所述抗cldn18.2抗体在asn297处具有寡糖(糖)总量60%或更少(例如,少于55%、50%、45%、40%、35%、30%、25%、20%、15%或10%)的量的岩藻糖。相对于与asn297相连的所有糖结构的总和(例如复杂、杂合和高甘露糖结构),可以通过计算asn297处的糖链中岩藻糖的平均含量来确定连接到fc区ch2结构域的岩藻糖的含量。岩藻糖的含量可以通过本领域已知的方法(例如,通过质谱法)来测量。在一个示例性的实施方式中,用n-糖苷酶(pngasef)处理抗体以水解来自抗体的n-糖链寡糖。水解的寡糖用荧光标记rapifluor-ms试剂标记,并通过超高效液相亲水相互作用色谱法进行分离,并通过荧光检测器(uplc-hilic-flr)进行检测。面积归一化法用于计算各种低聚糖的比例。在另一个说明性实施例中,如在wo2008/077546中所述,岩藻糖的含量可以通过maldi-tof质谱法测量。[0486]药物组合物[0487]本公开进一步提供了药物组合物,其包含抗cldn18.2抗体或其抗原结合片段(可选地非岩藻糖基化的)和一种或多种药学上可接受的载体。[0488]用于本文公开的药物组合物中的药学上可接受的载体可以包括例如药学上可接受的液体、凝胶或固体载体、水性介质、非水介质、抗微生物剂、等渗剂、缓冲剂、抗氧化剂、麻醉剂、悬浮剂/分散剂、掩蔽剂或螯合剂、稀释剂、佐剂、赋形剂或无毒辅助物质、本领域已知的其他组分或其各种组合。[0489]合适的组分可包括例如抗氧化剂、填充剂、粘合剂、崩解剂、缓冲剂、防腐剂、润滑剂、调味剂、增稠剂、着色剂、乳化剂或稳定剂(例如,糖和环糊精)。合适的抗氧化剂可包括例如甲硫氨酸、抗坏血酸、edta、硫代硫酸钠、铂、过氧化氢酶、柠檬酸、半胱氨酸、硫代甘油、硫代乙醇酸、硫代山梨糖醇、丁基化羟基黄苯酚、丁基化羟基甲苯和/或没食子酸丙酯。如本文所公开的,在包含如本文所提供的抗体或抗原结合片段和缀合物的组合物中加入一种或多种抗氧化剂(例如,蛋氨酸),减少了抗体或抗原结合片段的氧化。这种氧化的减少防止或减少了结合亲和力的损失,从而改善了抗体的稳定性并使保质期最大化。因此,在某些实施方式中,提供了包含本文公开的一种或多种抗体或抗原结合片段和一种或多种抗氧化剂(例如,蛋氨酸)的组合物。本文进一步提供了方法,所述方法通过将抗体或抗原结合片段与一种或多种抗氧化剂(例如,蛋氨酸)混合来防止本文所提供的抗体或抗原结合片段的氧化,延长其货架寿命和/或改善其功效。[0490]为了进一步说明,药学上可接受的载体可以包括例如水性介质(例如,氯化钠注射剂、林格氏注射剂、等渗右旋糖注射剂、无菌水注射剂或右旋糖和乳酸林格氏注射剂)、非水介质(例如,植物来源的不挥发性油、棉籽油、玉米油、芝麻油或花生油)、抑菌或抑真菌浓度下的抗微生物剂、等渗剂(例如,氯化钠或右旋糖)、缓冲剂(例如,磷酸盐或柠檬酸盐缓冲剂)、抗氧化剂(例如,硫酸氢钠)、局部麻醉剂(例如盐酸普鲁卡因)、悬浮剂和分散剂(例如,羧甲基纤维素钠,羟丙基甲基纤维素或聚乙烯吡咯烷酮)、乳化剂(例如,聚山梨酯80(tween-80))、掩蔽剂或螯合剂(例如,edta(乙二胺四乙酸)或egta(乙二醇四乙酸)、乙醇,聚乙二醇、丙二醇、氢氧化钠、盐酸、柠檬酸或乳酸。可用作载体的抗微生物剂可以添加到在多剂量容器中的药物组合物中,所述多剂量容器包括苯酚或甲酚、汞、苯甲醇、氯丁醇、对羟基苯甲酸甲酯和丙酯、硫柳汞、苯扎氯铵和苄索氯铵。合适的赋形剂可包括例如水、盐水、右旋糖、甘油或乙醇。合适的无毒辅助物质可以包括,例如,润湿剂或乳化剂、ph缓冲剂、稳定剂、溶解度增强剂或诸如乙酸钠、脱水山梨糖醇单月桂酸酯、三乙醇胺油酸酯或环糊精的试剂。[0491]药物组合物可以是液体溶液、悬浮液、乳剂、丸剂、胶囊剂、片剂、缓释制剂或粉剂。口服制剂可包括标准载体,例如药用级的甘露醇、乳糖、淀粉、硬脂酸镁、聚乙烯吡咯烷酮、糖精钠、纤维素、碳酸镁等。[0492]在某些实施方式中,药物组合物被配制成可注射的组合物。可以任何常规形式制备可注射药物组合物,例如液体溶液、悬浮液、乳剂或适于产生液体溶液、悬浮液或乳剂的固体形式。注射制剂可包括准备用于注射的无菌和/或无热源溶液、无菌干燥可溶性产品,如准备在使用前与溶剂混合的冻干粉,包括皮下注射用片剂,准备用于注射的无菌悬浮液、准备在使用前与溶媒结合的无菌干燥的不溶性产品,以及无菌和/或无热源乳液。溶液可以是水性或非水性的。[0493]在某些实施方式中,单位剂量肠胃外制剂包装在安瓿、小瓶或带针注射器中。如本领域已知和实践的,用于肠胃外施用的所有制剂应是无菌的且无热源的。[0494]在某些实施方式中,通过将如本文公开的抗体或抗原结合片段溶解在合适的溶剂中来制备无菌的冻干粉。溶剂可包含赋形剂,其可改善由粉末制备的粉末或重构溶液的稳定性或其他药理学成分。可以使用的赋形剂包括但不限于水、右旋糖、山梨醇、果糖、玉米糖浆、木糖醇、甘油、葡萄糖、蔗糖或其他合适的试剂。在一个实施方式中,溶剂可以含有约中性ph下的缓冲剂,例如柠檬酸盐、磷酸钠或磷酸钾、或本领域技术人员已知的其他此类缓冲剂。随后对溶液进行无菌过滤,然后在本领域技术人员已知的标准条件下冻干,这提供了理想的制剂。在一个实施方式中,将所得溶液分配到小瓶中以冻干。每个小瓶可以包含单剂量或多剂量的抗cldn18.2抗体或其抗原结合片段或其组合物。可以接受超出一个剂量或一组剂量所需量的少量过量(例如,约10%)灌装样品瓶,以利于准确抽取样品和准确给药。冻干粉末可以在适当的条件下,例如在约4℃至室温下储存。[0495]用注射用水重构冻干粉提供了用于肠胃外给药的制剂。在一个实施方式中,为了重构,将无菌和/或无热源水或其他液体状合适载体添加至冻干粉末中。精确的剂量取决于所选择的治疗方法,并且可以凭经验确定。[0496]使用方法[0497]本公开还提供了治疗方法,其包括:向有需要的受试者施用治疗有效量的本文提供的抗体或抗原结合片段(可选地非岩藻糖基化的)和/或本文提供的药物组合物,从而治疗或预防cldn18.2相关疾病或病况。[0498]在另一个方面,本文提供了治疗将从cldn18.2活性调节中受益的受试者的疾病或病况的方法,所述方法包括向有需要的受试者施用治疗有效量的本文提供的抗体或抗原结合片段(可选地非岩藻糖基化的)和/或本文提供的药物组合物。在某些实施方式中,所述疾病或病况是cldn18.2相关的疾病或病况。在一些实施方案中,cldn18.2相关的疾病或病症是癌症。[0499]在某些实施方式中,所述癌症选自胃癌、肺癌、支气管癌、骨癌、肝胆管癌、胰腺癌、乳腺癌、肝癌、卵巢癌、睾丸癌、肾癌、膀胱癌、头颈癌、脊柱癌、脑癌、子宫颈癌、子宫癌、子宫内膜癌、结肠癌、结肠直肠癌、直肠癌、肛门癌、食道癌、胃肠道癌、皮肤癌、前列腺癌、垂体癌、胃癌、阴道癌、甲状腺癌、胶质母细胞瘤、星形细胞瘤、黑素瘤、骨髓增生异常综合症、肉瘤、畸胎瘤和腺癌。[0500]癌症的实例包括但不限于非小细胞肺癌(鳞状/非鳞状)、小细胞肺癌、肾细胞癌、结肠直肠癌、结肠癌、卵巢癌、乳腺癌(包括基底性乳腺癌、导管癌、和小叶乳腺癌)、胰腺癌、胃癌、膀胱癌、食道癌、间皮瘤、黑素瘤、头颈癌、甲状腺癌、肉瘤、前列腺癌、胶质母细胞瘤、子宫颈癌、胸腺癌、黑素瘤、骨髓瘤、霉菌性真菌病、默克尔细胞癌、肝细胞癌(hcc)、纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、成骨肉瘤和其他肉瘤、滑膜瘤、间皮瘤、尤因氏肿瘤、平滑肌肉瘤、横纹肌肉瘤、淋巴样恶性肿瘤、基底细胞癌、腺癌、汗腺癌、甲状腺髓样癌、甲状腺乳头状癌、嗜铬细胞瘤皮脂腺癌、乳头状癌、乳头状腺癌、延髓喉癌、支气管癌、肝癌、胆管癌、绒毛膜癌、威尔姆氏肿瘤、子宫颈癌、睾丸癌、精原细胞瘤、经典霍奇金淋巴瘤(chl)、原发性纵隔大b细胞淋巴瘤、t细胞/富含组织细胞的b细胞细胞淋巴瘤、急性淋巴细胞性白血病、急性骨髓性白血病(acutemyelocyticleukemia)、急性骨髓性白血病(acutemyelogenousleukemia)、慢性骨髓性白血病(chronicmyelocyticleukemia)(粒细胞性白血病)、慢性骨髓性白血病(chronicmyelogenousleukemia)、慢性淋巴细胞性白血病、真性红细胞增多症、肥大细胞源性肿瘤、ebv-阳性和-阴性ptld以及弥漫性大b细胞淋巴瘤(dlbcl)、浆母细胞淋巴瘤、结外nk/t细胞淋巴瘤、鼻咽癌、hhv8相关原发性淋巴瘤、非霍奇金淋巴瘤、多发性骨髓瘤、华登斯特罗姆巨球蛋白血症、重链疾病、骨髓增生异常综合征、毛细胞白血病和骨髓增生异常、原发性中枢神经系统淋巴瘤、脊髓轴肿瘤、脑干神经胶质瘤、星形细胞瘤、髓母细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、血管母细胞瘤、听神经瘤、少突胶质细胞瘤、血管瘤、黑色素瘤、神经母细胞瘤和成视网膜细胞瘤。[0501]在某些实施方式中,所述癌症是表达cldn18.2的癌症。如本文所使用的,“表达cldn18.2的癌症”是指涉及表达cldn18.2的癌细胞的任何癌症或肿瘤。[0502]在某些实施方式中,所述受试者被鉴定为具有表达cldn18.2的癌细胞。可以通过本领域已知的各种方法确定癌细胞上cldn18.2的存在和/或表达水平。可以从受试者获得含有或怀疑含有癌细胞的生物样品。在一些实施方式中,生物样品可以源于癌细胞或癌组织或肿瘤浸润的免疫细胞。在某些实施方式中,可以进一步处理生物样品以例如分离分析物,例如核酸或蛋白质。cldn18.2的存在和/或表达水平可以通过例如定量荧光细胞计数法、免疫组织化学(ihc)、或基于核酸的方法来确定。例如,可以将来自受试者的生物样品暴露于抗cldn18.2抗体或其抗原结合片段,其结合并检测表达的cldn18.2蛋白。替代地,也可以使用诸如qpcr、逆转录酶pcr、微阵列、sage、fish等方法在核酸表达水平上检测cldn18.2。[0503]在某些实施方式中,通过ihc确定或测量生物样品或癌细胞中cldn18.2的表达。在某些实施方式中,人cldn18.2蛋白在受试者的癌细胞上的表达水平可以根据本文提供的实施例15的第6节和第7节中描述的方法确定。[0504]在某些实施方式中,所述受试者被鉴定为具有cldn18.2高表达癌细胞、cldn18.2中等表达癌细胞、或cldn18.2低表达癌细胞。在某些实施方式中,所述cldn18.2高表达癌细胞以如通过ihc所测定的至少2 的强度和以ihc中至少40%(例如,至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、40-100%、50-100%、60-100%、70-100%、80-100%、90-100%、40-90%、50-90%、60-90%、70-90%、80-90%、40-80%、40-70%、40-60%、40-50%、50-80%、50-70%、50-60%、60-80%、60-70%、或70-80%)的细胞为阳性染色的水平表达cldn18.2;所述cldn18.2中等表达癌细胞以如通过ihc所测定的至少1 且低于2 的强度和以ihc中至少30%(或至少35%)但低于40%的细胞为阳性染色的水平表达cldn18.2;所述cldn18.2低表达癌细胞以如通过ihc所测定的高于0但低于1 的强度和以ihc中高于0但低于30%(例如5%、10%、15%、20%、25%、5-25%、10-25%、15-25%、20-25%、5-20%、5-15%、5-10%、10-20%、或10-15%)的细胞为阳性染色的水平表达cldn18.2。[0505]表达cldn18.2的癌症的实例包括但不限于胃癌、食道癌、胰腺癌、肺癌(例如非小细胞肺癌(nsclc)和小细胞肺癌(sclc))、卵巢癌、结肠癌、结直肠癌、胃肠道间质瘤(gist)、胃肠道类癌、直肠癌、肛门癌、胆管癌、小肠癌、阑尾癌、前列腺癌、肾癌(例如,肾细胞癌)、肝癌、头颈癌和胆囊癌及其转移(例如,胃癌转移(例如,克鲁肯伯格肿瘤)、腹膜转移和淋巴结转移)。[0506]在某些实施方式中,表达cldn18.2的癌症可以是腺癌,例如晚期腺癌。在某些实施方式中,所述癌症选自胃、食道、胰管、胆管、肺和卵巢的腺癌。在某些实施方式中,表达cldn18.2的癌症包括胃癌、食道癌(尤其是下食道癌)、食道-胃交界癌和胃食管癌。[0507]不希望受任何理论的束缚,据信cldn18的分子和功能特性使其成为基于抗体的癌症治疗的高度感兴趣的靶标。这些包括(i)大多数毒性相关的正常组织中均不存在cldn18,(ii)cldn18.2变体仅在非必需的细胞群表达(如分化的胃细胞,可被胃的靶标为阴性的干细胞补充),(iii)正常细胞与肿瘤细胞之间潜在的糖基化差异,以及(iv)存在不同的构象拓扑。[0508]已经发现cldn18蛋白的分子量在肿瘤和邻近的正常组织之间是不同的。在健康组织中观察到较高分子量的cldn18蛋白,可通过用去糖基化化合物pngasef处理正常组织溶解物将其降低至与在肿瘤中观察到的相同分子量。这表明与其正常组织相比,cldn18在肿瘤中的n-糖基化程度较低。典型的n-糖基化基序在cldn18分子的环d3结构域内的氨基酸残基116中。分子量差异和推断的结构差异可能代表用于抗体结合的表位改变。[0509]此外,cldn18作为紧密连接蛋白也可能有助于形成良好的治疗窗口。由于肿瘤细胞表达cldn,但通常不像正常上皮组织那样通过cldn的同型和异型缔合形成典型的紧密连接,因此它们可能具有相当数量的游离cldn,其适用于细胞外抗体结合和免疫疗法。健康上皮细胞中cldn的结合表位有可能在紧密连接中被屏蔽,以阻止抗体结合。[0510]本文提供的抗体或抗原结合片段的治疗有效量将取决于本领域已知的各种因素,例如体重、年龄、既往病史、当前用药、受试者的健康状况以及潜在的交叉反应、过敏、敏感性和不良副作用,以及给药途径和疾病发展程度。如这些和其他情况或要求所示,本领域普通技术人员(例如医师或兽医)可以按比例减少或增加剂量。[0511]在某些实施方式中,本文提供的抗体或抗原结合片段可以约0.01mg/kg至约100mg/kg的治疗有效剂量施用。在某些实施方案中,施用剂量可以在治疗过程中改变。在某些实施方式中,取决于受试者的反应,给药剂量可以在治疗过程中变化。[0512]可以调整剂量方案以提供最佳的期望反应(例如,治疗反应)。例如,可以施用单一剂量,或者可以随时间施用数个分开的剂量。[0513]本文公开的抗体和抗原结合片段可以通过本领域已知的任何途径施用,例如肠胃外(例如皮下、腹腔内、静脉内,包括静脉内输注、肌肉内或皮内注射)或非肠胃外(例如,口服、鼻内、眼内、舌下、直肠或局部)途径。[0514]在一些实施方式中,本文公开的抗体或抗原结合片段可以单独施用或与一种或多种其他治疗手段或试剂组合施用。例如,本文公开的抗体或抗原结合片段可以与第二治疗剂,(例如,化疗剂、抗癌药、放射治疗、免疫治疗、抗血管生成剂、靶向治疗、细胞治疗、基因治疗、激素治疗、姑息治疗),用于癌症治疗的手术(例如,肿瘤切除术),或一种或多种止吐药或其他用于化疗引起的并发症的治疗联合施用。[0515]如本文所使用的,术语“免疫疗法”是指刺激免疫系统对抗疾病如癌症或以一般方式增强免疫系统的一种类型。免疫疗法包括被动免疫疗法,即通过递送具有确定的肿瘤免疫反应性的药物(例如,效应细胞)来进行被动免疫疗法,所述药物可以直接或间接介导抗肿瘤作用,而不必依赖完整的宿主免疫系统(例如,抗体疗法或car-t细胞疗法)。免疫疗法可以进一步包括主动免疫疗法,其中治疗依赖于内源宿主免疫系统的体内刺激,以通过施用免疫应答调节剂来对抗患病细胞。[0516]免疫疗法的实例包括但不限于检查点调节剂、过继性细胞转移、细胞因子、溶瘤病毒和治疗性疫苗。[0517]检查点调节剂可以干扰癌细胞避免免疫系统攻击的能力,并帮助免疫系统对肿瘤做出更强烈的应答。免疫检查点分子可介导共刺激信号以增强免疫应答,或可介导共抑制信号以抑制免疫应答。检查点调节剂的实例包括但不限于pd-1、pd-l1、pd-l2、clta-4、tim-3、lag3、a2ar、cd160、2b4、tgfβ、vista、btla、tigit、lair1、ox40、cd2、cd27、cd28、cd30、cd40、cd122、icam-1、ido、nkg2c、slamf7、siglec7、nkp80、cd160、b7-h3、lfa-1、icos、4-1bb、gitr、baffr、hvem、cd7、light、il-2、il-15、cd3、cd16和cd83的调节剂。[0518]过继性细胞转移,其为一种试图增强t细胞抵抗癌症的天然能力的治疗方法。在这种治疗中,从患者体内获取t细胞,并在体外扩增和激活。在某些实施方式中,t细胞在体外被修饰成car-t细胞。将对癌症最具活性的t细胞或car-t细胞在体外大量培养2至8周。在此期间,患者将接受诸如化疗和放射疗法等治疗,以降低人体的免疫力。经过这些治疗后,将体外培养的t细胞或car-t细胞输还给患者。在某些实施方式中,免疫疗法是car-t疗法。[0519]细胞因子疗法也可以用于增强向免疫系统的肿瘤抗原提呈。用于治疗癌症的两种主要细胞因子是干扰素和白介素。细胞因子疗法的实例包括但不限于干扰素(例如,干扰素-α、干扰素-β、和干扰素–γ)、集落刺激因子(例如,巨噬细胞csf、粒细胞巨噬细胞csf、和粒细胞csf)、胰岛素生长因子(igf-1)、血管内皮生长因子(vegf)、转化生长因子(tgf)、成纤维细胞生长因子(fgf)、白介素(例如,il-1、il-1α、il-2、il-3、il-4、il-5、il-6、il-7、il-8、il-9、il-10、il-11和il-12)、肿瘤坏死因子(例如,tnf-α和tnf-β)、或其任意组合。[0520]溶瘤病毒是可以杀死癌细胞的基因修饰病毒。溶瘤病毒可特异性感染肿瘤细胞,从而导致肿瘤细胞溶解,随后释放大量肿瘤抗原,从而触发免疫系统靶向并消除具有此类肿瘤抗原的癌细胞。溶瘤病毒的实例包括但不限于他莫替丁拉赫帕氏菌(talimogenelaherparepvec)。[0521]治疗性疫苗通过增强免疫系统对癌细胞的应答来抵抗癌症。治疗性疫苗可包含非致病性微生物(例如,牛分枝杆菌芽孢杆菌卡介特-卡伦菌(mycobacteriumbovisbacilluscalmette-guérin,bcg)),靶向肿瘤细胞的基因修饰病毒或一种或多种免疫原性成分。例如,bcg可以通过导管直接插入膀胱,并且可以引起针对膀胱癌细胞的免疫应答。[0522]抗血管生成剂可以阻断支持肿瘤生长的血管的生长。一些抗血管生成剂靶向vegf或其受体vegfr。抗血管生成剂的实例包括但不限于阿昔替尼、贝伐单抗、卡博替尼、依维莫司、来那度胺、甲磺酸来那替尼、帕唑帕尼、拉莫昔单抗、雷戈拉非尼、索拉非尼、舒尼替尼、沙利度胺、凡德他尼和齐夫-阿非贝西普。[0523]“靶向疗法”是一种作用于与癌症相关的特定分子的疗法,例如存在于癌细胞中但不存在于正常细胞中或在癌细胞中含量更高的特定蛋白质,或癌症微环境中有助于癌症生长和存活的靶分子。靶向疗法将治疗剂靶向肿瘤,从而使正常组织免受治疗剂的影响。[0524]靶向疗法可以靶向例如酪氨酸激酶受体和核受体。此类受体的实例包括erbb1(egfr或her1)、erbb2(her2)、erbb3、erbb4、fgfr,源于血小板的生长因子受体(pdgfr)和胰岛素样生长因子-1受体(igf-1r)、雌激素受体(er)、核受体(nr)和pr。[0525]靶向疗法可以靶向酪氨酸激酶或核受体信号级联反应中的分子,例如erk和pi3k/akt、ap-2α,ap-2β,ap-2γ、促分裂原激活的蛋白激酶(mapk)、pten、p53、p19arf、rb、apaf-1、cd-95/fas、trail-r1/r2、caspase-8、forkhead、box03a、mdm2、iap、nf-kb、myc、p13k、ras、flip、调蛋白(hrg)(也称为gp30)、bcl-2、bcl-xl、bax、bak、bad、bok、bik、blk、hrk、bnip3、biml、bid和egl-1。[0526]靶向疗法还可以靶向与肿瘤相关的配体,例如雌激素(estrogen)、雌二醇(e2)、孕酮、雌激素(oestrogen)、雄激素、糖皮质激素、催乳激素、甲状腺激素、胰岛素、p70s6激酶蛋白(ps6)、存活蛋白、成纤维细胞生长因子(fgf)、egf、neu分化因子(ndf)、转化生长因子α(tgf-α)、il-1a、tgf-β、igf-1、igf-ii、igfbp、igfbp蛋白酶和il-10。[0527]在这些实施方式中的某些实施方式中,与一种或多种另外的治疗剂组合施用的本文公开的抗体或抗原结合片段可以与一种或多种另外的治疗剂同时施用,并且在这些实施方式的某些实施方式中,抗体或抗原结合片段和另外的治疗剂可以作为相同药物组合物的一部分施用。然而,与另一种治疗剂“组合”施用的抗体或抗原结合片段不必与该药剂同时或以相同的组合物施用。即使抗体或抗原结合片段和第二药剂是通过不同途径施用,但是在另一种药剂之前或之后施用的抗体或抗原结合片段被认为是本文所用的短语与该药剂“组合”施用。在可能的情况下,可根据另外的治疗剂产品信息表中列出的时间表,或根据physicians'sdeskreference2003(physicians'deskreference,57thed;medicaleconomicscompany;isbn:1563634457;57thedition(november2002))或本领域公知的方案,施用与本文公开的抗体或抗原结合片段组合施用的另外的治疗剂。[0528]本公开进一步提供了使用抗cldn18.2抗体或其抗原结合片段的方法。在一些实施方式中,本公开提供了体内或体外抑制表达cldn18.2的细胞生长的方法,所述方法包括:使表达cldn18.2的细胞与本文提供的抗体或其抗原结合片段接触。在一些实施方式中,本公开提供了在表达cldn18.2的细胞中调节cldn18.2活性的方法,所述方法包括将表达cldn18.2的细胞暴露于本文提供的抗体或其抗原结合片段。[0529]在一些实施方式中,本公开提供了检测源于受试者的样品中cldn18.2的存在或含量的方法,所述方法包括使样品与抗体或其抗原结合片段接触,并确定样本中的cldn18.2的存在或含量。在某些实施方式中,生物样品包含癌细胞。[0530]在一些实施方式中,本公开提供了在受试者中诊断与cldn18.2相关的疾病或病况的方法,所述方法包括:a)将从所述受试者获得的样品与本文提供的抗体或其抗原结合片段接触;b)测定在所述样品中cldn18.2的存在或含量;以及c)将所述cldn18.2的存在或含量与所述受试者中cldn18.2相关疾病或病况的存在或状态相关联。在某些实施方式中,生物样品包含癌细胞。在一些实施方式中,癌细胞中cldn18.2的表达水平通过ihc测定(例如,根据本文提供的实施例15的第6节和第7节中描述的方法)。在一些实施方式中,受试者被鉴定为具有cldn18.2高表达癌细胞、cldn18.2中等表达癌细胞、或cldn18.2低表达癌细胞。[0531]在一些实施方式中,该方法进一步包括向受试者施用治疗有效量的本文提供的抗体或其抗原结合片段。在一些实施方式中,受试者具有cldn18.2中等表达癌细胞、或cldn18.2的低表达癌细胞。[0532]在一些实施方式中,本公开提供了试剂盒,所述试剂盒包括本文提供的抗体或其抗原结合片段,其可选地与可检测部分缀合。该试剂盒可用于检测生物样品中cldn18.2的存在或含量,或可用于本文提供的诊断方法。[0533]在一些实施方式中,本公开提供了试剂盒,所述试剂盒包括本文提供的抗体或其抗原结合片段和第二治疗剂。该试剂盒可用于治疗、预防和/或改善cldn18.2相关疾病。[0534]在一些实施方式中,本公开还提供了本文提供的抗体或其抗原结合片段在制备用于治疗受试者中cldn18.2相关疾病或病况的药物中的用途。实施例[0535]虽然参考特定实施方式(其中一些是优选实施方式)已经特别地示出和描述了本公开,但是本领域技术人员应当理解,在不脱离在本公开的主旨和范围的条件下,可以在形式和细节上做多种改变。[0536]实施例1:cldn18.2或cldn18.1表达细胞系的制备[0537]1.hek293-人cldn18.2、hek293-人cldn18.1和hek293-小鼠cldn18.2细胞系的生成[0538]由迈博斯生物医药(苏州)有限公司构建hek293-人cldn18.2细胞(以下称为hek293-cldn18.2)和hek293-小鼠cldn18.2细胞(以下称为hek293-mcldn18.2)。简而言之,用pcdna3.1/hcldn18.2或pcdna3.1/mcldn18.2质粒转染hek293细胞(上海生物科学研究院,目录号gnhu43),并用g418选择以获得稳定表达的细胞系hek293-cldn18.2或hek293-mcldn18.2。使用可以与人和小鼠cldn18.2结合的imab362抗体检测了hcldn18.2或mcldn18.2的表达水平。imab362根据us2009169547a1中公开的序列进行表达。选择具有最高信号的单细胞克隆并扩增以用于细胞储存。[0539]imab362的重链可变区(seqidno:72)[0540]qvqlqqpgaelvrpgasvklsckasgytftsywinwvkqrpgqglewigniypsdsytnynqkfkdkatltvdkssstaymqlssptsedsavyyctrswrgnsfdywgqgttltvss[0541]imab362的轻链可变区(seqidno:73)[0542]divmtqspssltvtagekvtmsckssqsllnsgnqknyltwyqqkpgqppklliywastresgvpdrftgsgsgtdftltissvqaedlavyycqndysypftfgsgtkleik[0543]也如上所述构建hek293-人cldn18.1细胞(以下称为hek293-cldn18.1)。用识别cldn18.1和cldn18.2的抗-cldn18抗体(abcam,目录号ab222513)检测cldn18.1的表达。[0544]2.cho-cldn18.2瞬时表达细胞的产生[0545]按照如下构建cho-cldn18.2表达细胞:用不含选择试剂的pcdna3.1/cldn18.2瞬时转染cho细胞。使用mem-pertmplus膜蛋白提取试剂盒提取细胞膜蛋白,并将细胞膜蛋白用于动物免疫增强。[0546]3.mkn45-cldn18.2瞬时表达细胞的产生[0547]mkn45-cldn18.2细胞由迈博斯生物医药(苏州)有限公司构建。简而言之,用pcdna3.1/cldn18.2质粒转染mkn45细胞(国家细胞系资源目录,目录号3111c0001ccc000229),并用g418选择以获得稳定表达的细胞系mkn45-cldn18.2。采用facs方法通过imab362抗体检测cldn18.2的表达水平。选择具有最高、中等和低信号的单克隆细胞,并将其扩增以用于细胞储存。[0548]以上所述细胞系用于以下的实验中。[0549]实施例2:抗体的产生[0550]1.免疫接种[0551]制备dna和细胞免疫原以进行免疫接种。将6-8周龄的不同品系的小鼠分为两组。一组的初始免疫和增强免疫是通过静脉注射100μg/小鼠pvac2-mcs/cldn18.2质粒和100μg/小鼠cpg进行的。另一组是通过肌肉注射相同的dna和cpg进行的。两组均在第1天和第10天注射,并在第18天通过facs结合hek293-cldn18.2细胞检测抗体滴度。将100μl/孔稀释的小鼠血清添加到含有hek293-cldn18.2或胃癌nugc4细胞(jcrb,目录号jcrbb0834)的孔板中,然后在4℃孵育30分钟。用缓冲液清洗后,加入100μl/孔的山羊抗-migg-fitc(1:500稀释),在4℃下再孵育30分钟。随后用facs清洗缓冲液清洗,通过流式细胞术分析细胞。选择具有更高结合信号和滴度的小鼠用于以下融合步骤。[0552]2.融合[0553]在融合前的四天,每只小鼠腹膜内注射5×107hek293-cldn18.2细胞。在融合当天,无菌去除脾脏,然后将其加工成单一的细胞悬液。将活的对数期骨髓瘤细胞(sp2/0)与鼠脾细胞在融合培养基中以1:1的比例混合,然后电融合1分钟。将细胞重悬并在37℃、5%co2的培养箱中,以200μl/孔在96孔培养板中进行培养。培养7天后,将生长培养基更换为新鲜的生长培养基,然后在2-3天后筛选杂交瘤上清液。[0554]实施例3:抗体筛选[0555]1.通过facs试验筛选人cldn18.2阳性结合物[0556]将表达cldn18.2的hek293-cldn18.2对数期细胞以每孔105/100μl的密度重悬于pbs中。使用facs清洗缓冲液(pbs 2%fbs)洗涤细胞3次后,将100μl/孔杂交瘤细胞上清液添加到每个孔中,在4℃下孵育30分钟。再次,使用facs清洗缓冲液洗涤细胞3次,然后与100μl/孔的山羊抗-migg-fitc(1:400稀释)在4℃下再孵育30分钟。使用facs清洗缓冲液进行3次最终洗涤后,通过流式细胞术分析细胞。[0557]2.通过facs试验筛选人cldn18.1阴性结合物[0558]将表达cldn18.1的hek293-cldn18.1对数期细胞以每孔105/100μl的密度重悬于pbs中。使用facs清洗缓冲液(pbs 2%fbs)洗涤细胞3次后,将100μl/孔杂交瘤细胞上清液添加到每个孔中,在4℃下孵育30分钟。再次,使用facs清洗缓冲液洗涤细胞3次,然后与100μl/孔的山羊抗-migg-fitc(1:400稀释)在4℃下再孵育30分钟。使用facs清洗缓冲液进行3次最终洗涤后,通过流式细胞术分析细胞。[0559]选择具有高cldn18.2结合信号但没有cldn18.1结合信号的克隆用于随后的亚克隆以产生单克隆,包括7c12、11f12、12e9、26g6、59a9、18b10和12c12。[0560]实施例4:阳性杂交瘤克隆的亚克隆和小规模抗体制备[0561]1.阳性杂交瘤克隆的亚克隆[0562]选择来自facs阳性杂交瘤孔的具有所需结合特征的细胞在96孔板中进行有限稀释。使这些细胞生长7天。当达到足够的细胞量时,收集每个孔的上清液,并使用细胞结合试验进行重新筛选(参见实施例3)。[0563]从每个96孔板中,将具有最高细胞结合活性的克隆扩增到每孔含200μl杂交瘤生长培养基的96孔板中进行第二轮有限稀释。7天后,通过facs试验分析来自96孔板的细胞的上清液。亚克隆进行了2次以上,直到超过90/96孔显示出阳性结合信号。鉴定具有最高结合活性的克隆,并进一步扩增和培养以产生抗体。使用标准方法确定同种型。[0564]2.小规模抗体制备[0565]接种杂交瘤细胞并培养14天。使用蛋白质a色谱柱(蛋白质a高性能(bio-rad))通过亲合色谱法从杂交瘤细胞培养物中纯化cldn18.2单克隆抗体(mab)。[0566]纯化后,使用10,000mwco膜(pierceslide-a-lyzer或透析管)通过透析在pbs中配制cldn18.2mab,然后进行过滤步骤。[0567]实施例5:纯化的cldn18.2杂交瘤抗体的细胞结合分析[0568]将对数期的hek293-cldn18.2和nugc4细胞在pbs中重悬。使用facs清洗缓冲液(pbs 2%fbs)洗涤细胞3次后,将100μl/孔稀释的400nm到0.002nm范围的杂交瘤抗体加入到每个孔中于4℃孵育30分钟。再次,使用facs清洗缓冲液洗涤细胞3次,然后与100μl/孔的山羊抗-migg-fitc(1:400稀释)在4℃下再孵育30分钟。使用facs洗涤缓冲液进行3次最终洗涤后,通过流式细胞术分析细胞。[0569]大多数杂交瘤抗体显示出与hek293-cldn18.2细胞的高亲和结合力,但与nugc4细胞的结合力却较低。结合差异可能是由于这两种细胞系中cldn18.2蛋白的不同表达密度,构象和/或糖基化状态。有趣的是,7c12、11f12、59a9和18b10具有与hek293-cldn18.2和nugc4细胞相当的结合亲和力(图1a-1d,表4)。选择这些杂交瘤抗体用于基因克隆和嵌合抗体表达,以用于进一步的功能性adcc/cdc表征。[0570]表4[0571][0572]实施例6:嵌合抗体的产生[0573]通过聚合酶链式反应(pcr)扩增从候选杂交瘤细胞系中获得小鼠抗人cldn18.2抗体轻链和重链可变区的序列。经过测序分析并确认后,将包括与人iggkappa恒定区融合的轻链可变区(vl)序列和与人igg1恒定区融合的重链可变区(vh)序列的上述可变区基因克隆到重组表达载体pcdna3.1( )中,用于抗体产生和纯化。[0574]使用具有来自重链载体和轻链载体的等量dna的expicho转染试剂盒转染expicho细胞。将转染的细胞在摇瓶中以125rpm的速度于8%co2和37℃的培养箱中进行培养。在第10天收集细胞培养物,并使用亲和色谱纯化收集的抗体。使用sds-page和空间排阻色谱(tskgelg3000swxl,tosoh)分析所得抗体以确定纯度水平。嵌合抗体命名为:7c12-c、11f12-c、12e9-c、26g6-c、59a9-c、18b10-c和12c12-c。[0575]实施例7:纯化的嵌合cldn18.2抗体的表征[0576]1.对hek293-cldn18.2细胞的结合和细胞毒性作用[0577]按照实施例5所述的方法检测嵌合抗体的细胞结合。[0578]如图2a所示,具有非常相似的cdr(只有2-3个氨基酸不同)的7c12-c、11f12-c和12e9-c以约为0.6μg/ml的ec50与hek293-cldn18.2细胞结合。26g6-c的ec50为1.1μg/ml。59a9-c和18b10-c是后续产生的,因此分别对其进行测试。如图2c所示,具有不同种系和cdr的59a9-c的ec50(1.3μg/ml)比18b10-c(1.0μg/ml)稍高。[0579]cdc(补体依赖的细胞毒性)是免疫保护的重要机制。因此,此处将cdc试验用于评估抗体的生物效价。简而言之,将对数期的hek293-cldn18.2细胞重悬于含10%fbs的rpmi1640中。将这些细胞以每孔8×103/100μl铺板。使用含有20mmhepes和40%人血清的60%rpmi1640稀释抗cldn18.2嵌合抗体和对照抗体imab362,然后以10至0.0012μg/ml的最终浓度,100μl/孔,加到细胞板中。将板在37℃下孵育80分钟。接下来,使细胞培养板平衡至室温,持续30分钟。通过酶标仪(thermovarioskanflash3001),在室温下,用celltiter-glo发光细胞活力测定试剂盒进行细胞活力分析。[0580]如图2b和2d所示,与imab362相比,所有6种cldn18.2嵌合抗体均以较低的浓度诱导cdc效应。4种抗体(7c12-c、11f12-c、12e9-c和26g6-c)的效价比imab362提高了2倍以上。与imab362相比,59a9-c和18b10-c的效价提高了3倍以上。[0581]2.对mkn45-cldn18.2细胞的结合和细胞毒性作用[0582]mkn45是低分化胃腺癌,适合于评估体内抗肿瘤功效。但是,除非转染,否则mkn45细胞不表达人类cldn18.2。我们发现在mkn45细胞上,人cldn18.2的不同表达水平赋予cldn18.2抗体不同的敏感性。接下来,选择较高和中等cldn18.2表达的mkn45细胞(见图21)进行以下研究。[0583]使用较高和中等cldn18.2表达的mkn45细胞,如实施例5中所述,进行嵌合抗体的细胞结合测定。如图3a(高)和3c(中)所示,18b10-c以比imab362显著更高的亲和力与较高和中等表达hcldn18.2的细胞结合。在mkn45-cldn18.2-高细胞中,18b10-c的效价比imab362提高了约2倍。在mkn45-cldn18.2-中细胞中看到了更为显著的差异,18b10-c显示ec50为0.96μg/ml,而imab362没有结合。[0584]使用jurkat-nfat-luc-fcγriiia-v176细胞作为效应细胞和mkn45-cldn18.2细胞作为靶细胞来评估adcc活性。jurkat-nfat-luc-fcγriiia-v176细胞由迈博斯生物医药(苏州)有限公司构建。简而言之,用pgl4.30-luc/nfat-re/hygro质粒转染jurkat细胞(上海生物科学研究所,目录号scsp-513),并用潮霉素进行选择以获得稳定表达的细胞系jurkat-nfat-luc。用pcdna3.1-fcγriiia-v176质粒进一步转染jurkat-nfat-luc细胞系,并用抗生素g418选择以获得稳定表达的细胞系jurkat-nfat-luc-fcγriiia-v176。[0585]接下来,将对数期靶细胞重悬于具有10%fbs的rpmi1640中,然后以每孔1×104个细胞铺板,在37℃下孵育30分钟。通过使用含有10%fbs的rpmi1640稀释抗-hcldn18.2嵌合抗体和对照抗体imab362,然后以100至0.0017μg/ml的最终浓度将其加到靶细胞板中。将对数期的jurkat-nfat-luc-fcγriiia-v176细胞以每孔6×104个细胞添加到上述板中。将板在37℃下孵育6小时。接下来,将细胞培养板平衡至室温,持续30分钟。使用酶标仪(thermovarioskanflash3001),在室温下用celltiter-glo发光细胞活力测定试剂盒进行细胞活力分析。[0586]基于报告基因的读出曲线,可以计算ec50并将其用于评估adcc效应。如使用mkn45-cldn18.2-高细胞的图3b所示,尽管imab362可以计算ec50的点较少,但两条曲线表明18b10-c具有比imab362更好的adcc活性。如图3d所示,在mkn45-cldn18.2中细胞中,如通过ec50所测量的,18b10-c的adcc效价比imab362高50倍以上。这些结果表明,具有cldn18.2中等表达的细胞可能比高表达细胞更好地将18b10-c抗体与imab362区分开。在mkn45-hcldn18.2细胞上未观察到cdc活性(数据未显示)。[0587]3.对nugc4细胞的结合和细胞毒性作用[0588]nugc4代表具有与来自胃癌患者类似的hcldn18.2表达水平的胃细胞系。[0589]按照上述相同的方法(参见本实施例的第2节)进行细胞结合试验和adcc报告基因分析。如图4a和4c所示,除26g6-c和59a9-c外,6种嵌合抗体中的5种以大约10μg/ml的ec50与nugc4细胞结合(参见表5)。26g6-c以较高的ec50(67μg/ml)与nugc4结合,表明了较低的亲和力。59a9-c显示更高的ec50(19μg/ml)和更低的最大信号。另外,图4b和4d显示了针对nugc4细胞,它们adcc活性的相似趋势。由于两个单独的实验,ec50和最大信号可能会在图4b和图4d之间不同。重要的是,所有测试的嵌合抗体均显示出比imab362更好的adcc活性,尤其是18b10-c比imab362高40倍以上。在nugc4细胞上未观察到cdc活性(数据未显示)。[0590]表5总结了所有嵌合抗体和imab362对hek293-cldn18.2和nugc4细胞的facs结合数据。[0591]表5[0592][0593]4.嵌合cldn18.2抗体的特异性[0594]cldn18.2仅有几种氨基酸与存在于许多正常组织和器官中的cldn18.1不同。对cldn18.2的抗体结合特异性是非常重要的。细胞结合试验与上述相同(参见本实施例的第1节)。图5显示了18b10-c和imab362与表达cldn18.2或cldn18.1的hek293细胞的结合。两种抗体仅结合表达cldn18.2的细胞,而不结合表达cldn18.1的细胞。其他嵌合抗体也具有相似的良好选择性(数据未显示)。[0595]实施例8:表位结合[0596]杂交瘤抗体与基准抗体竞争结合表达cldn18.2的细胞[0597]将对数期mkn45-cldn18.2-高细胞重悬于facs清洗缓冲液(具有2%bsa的pbs)中,然后以每孔1×105个细胞的密度加入到96孔v底板中。将稀释的杂交瘤抗体或imab362-migg2a(终浓度:100至0.01μg/ml)加到培养板中。将板在4℃下孵育1小时以使抗体完全占据细胞表面上的抗原。将细胞用facs清洗缓冲液洗涤2次,然后将10μg/mlimab362或5μg/ml18b10-c添加到细胞中,在4℃下进一步孵育1小时。然后将细胞洗涤3次,并与山羊抗-higg(h l)-fitc(1:200稀释)一起孵育。最后,使用facs清洗缓冲液洗涤细胞3次,并通过流式细胞术进行分析。[0598]如图6a和6b所示,杂交瘤抗体18b10可以完全阻断imab362与mkn45-cldn18.2细胞的结合,这表明18b10可能比imab362具有更高的结合亲和力,但依赖于相似或附近的氨基酸(表6)。[0599]表6[0600][0601]√:完全阻断;部分:部分阻断;-:未检测到[0602]实施例9:在与cldn18.1不同的cldn18.2氨基酸上通过定点诱变对选定的抗体进行表位鉴定[0603]1.人cldn18.2-mrfp和人cldn18.1-mrfp构建体的产生[0604]编码人cldn18.1(氨基酸1-261,seqidno:31)-mrfp1(氨基酸1-225)和人cldn18.2(氨基酸1-261,seqidno:30)-mrfp1(氨基酸1-225)的cdna是在体外合成的(seqidno:52和seqidno:53分别是氨基酸序列)。然后按照制造商的说明使用syno组装混合试剂(synbio),通过同源重组的方法将pcr产物克隆到pcdna3.1( )载体中。使用qiagenplasmidmega试剂盒(qiagen)纯化质粒。[0605]根据人cldn18.1和cldn18.2的序列(genbank登录号:剪接变体1(cldn18.1):np_057453,nm_016369和剪接变体2(cldn18.2):nm_001002026,np_001002026),8种不同的氨基酸位于28-70之间,这可能是与人cldn18.2特异性结合而不与cldn18.1特异性结合的决定因素。使用上述产生的野生型人cldn18.2-mrfp质粒作为模板,用引物产生了一个整合序列的两个片段。在人cldn18.2-mrfp的指定位置上具有单个氨基酸改变的变体是通过使用引物的重叠pcr进行扩增的。特异性突变在q29m、n37d、a42s、n45q、q47e、e56q、g65p和l69i上。在人cldn18.1-mrfp的指定位置上具有单个氨基酸改变的变体是通过使用引物的重叠pcr进行扩增的。特定突变在m29q、d37n、s42a、q45n、e47q、q56e、p65g、i69l上。然后通过同源重组的方法将pcr产物克隆到pcdna3.1( )载体中。通过对单个阳性克隆进行测序来鉴定并确认人cldn18.2-mrfp变体。[0606]随后,将这些突变体和野生型人cldn18.2-mrfp或人cldn18.1-mrfp的质粒转染到hek293细胞系中。首先,将5×106个hek293细胞以60%~80%的比例接种到60mm培养皿中进行转染。将400μl1×hbs中的10μgdna和10μl25kda线性pei转染试剂(溶于1×hbs中,1mg/ml储备液)混合,以达到1:2.5的dna/pei比。接下来,将混合物逐滴加入hek293细胞培养物中。6-8小时后,将转染的细胞培养液更换为完全dmem,过夜。转染后24小时,收集细胞,使用嵌合抗体进行facs分析。[0607]人cldn18.1的氨基酸序列(seqidno:31)[0608]mstttcqvvafllsilglagciaatgmdmwstqdlydnpvtsvfqyeglwrscvrqssgftecrpyftilglpamlqavralmivgivlgaigllvsifalkcirigsmedsakanmtltsgimfivsglcaiagvsvfanmlvtnfwmstanmytgmggmvqtvqtrytfgaalfvgwvaggltliggvmmciacrglapeetnykavsyhasghsvaykpggfkastgfgsntknkkiydggartedevqsypskhdyv[0609]人cldn18.1-mrfp1的氨基酸序列(seqidno:52)[0610]mstttcqvvafllsilglagciaatgmdmwstqdlydnpvtsvfqyeglwrscvrqssgftecrpyftilglpamlqavralmivgivlgaigllvsifalkcirigsmedsakanmtltsgimfivsglcaiagvsvfanmlvtnfwmstanmytgmggmvqtvqtrytfgaalfvgwvaggltliggvmmciacrglapeetnykavsyhasghsvaykpggfkastgfgsntknkkiydggartedevqsypskhdyvmassedvikefmrfkvrmegsvnghefeiegegegrpyegtqtaklkvtkggplpfawdilspqfqygskayvkhpadipdylklsfpegfkwervmnfedggvvtvtqdsslqdgefiykvklrgtnfpsdgpvmqkktmgweastermypedgalkgeikmrlklkdgghydaevkttymakkpvqlpgayktdiklditshnedytiveqyeraegrhstga[0611]人cldn18.2的氨基酸序列(seqidno:30)[0612]mavtacqglgfvvsligiagiiaatcmdqwstqdlynnpvtavfnyqglwrscvressgftecrgyftllglpamlqavralmivgivlgaigllvsifalkcirigsmedsakanmtltsgimfivsglcaiagvsvfanmlvtnfwmstanmytgmggmvqtvqtrytfgaalfvgwvaggltliggvmmciacrglapeetnykavsyhasghsvaykpggfkastgfgsntknkkiydggartedevqsypskhdyv[0613]人cldn18.2-mrfp1的氨基酸序列(seqidno:53)[0614]mavtacqglgfvvsligiagiiaatcmdqwstqdlynnpvtavfnyqglwrscvressgftecrgyftllglpamlqavralmivgivlgaigllvsifalkcirigsmedsakanmtltsgimfivsglcaiagvsvfanmlvtnfwmstanmytgmggmvqtvqtrytfgaalfvgwvaggltliggvmmciacrglapeetnykavsyhasghsvaykpggfkastgfgsntknkkiydggartedevqsypskhdyvmassedvikefmrfkvrmegsvnghefeiegegegrpyegtqtaklkvtkggplpfawdilspqfqygskayvkhpadipdylklsfpegfkwervmnfedggvvtvtqdsslqdgefiykvklrgtnfpsdgpvmqkktmgweastermypedgalkgeikmrlklkdgghydaevkttymakkpvqlpgayktdiklditshnedytiveqyeraegrhstga[0615]2.cldn18.2嵌合抗体与位点突变的hek293-cldn18.2或hek293-cldn18.1细胞的结合[0616]将转染的hek293-cldn18.2或hek293-cldn18.1细胞以105/孔的密度、100μl/孔重悬于含2%bsa的pbs中。用facs清洗缓冲液(pbs 2%fbs)洗涤细胞3次,并与100μl/孔、10μg/ml的嵌合抗体和imab362在4℃下孵育30分钟。接下来,将细胞用facs清洗缓冲液洗涤3次,并与100μl/孔的山羊抗higg(h l)-fitc(1:200稀释)在4℃下再孵育30分钟。最后,使用facs清洗缓冲液洗涤细胞3次,并通过流式细胞术进行分析。为了分析与cldn18.2转染细胞的结合,将rfp阳性细胞用于对照门控。[0617]表7计算并总结了这些嵌合抗体与突变的cldn18.2变体的结合信号相比于与野生型的结合信号的百分比。如图7a-7b所示,当e56突变为q时,18b10-c的结合完全消失。这种变化也适用于imab362和其他嵌合抗体,但59a9-c除外。此外,我们发现其他氨基酸(例如a42、n45)也在一定程度上参与了imab362和其他抗体的结合,但此种情况不适用于18b10-c。[0618]表7[0619][0620][0621]实施例10:人源化抗体的产生和表征[0622]1.人源化抗体18b10的产生、表达和纯化[0623]用于轻链的人种系框架序列vk/4-1和用于重链的vh/1-46分别用于cdr移植。[0624]通过将三个cdr直接移植到种系序列(18b10hc种系,seqidno:23),并且分别对于hc变体1(hu18b10_ha,seqidno:25)进行r71i、t73k反向突变,对于hc变体2(hu18b10_hb,seqidno:27)进行r71i、t73k、t28s、m69l反向突变以及对于hc变体3(hu18b10_hc,seqidno:29)进行r71i、t73k、t28s、m69l、r38k、m48i反向突变来获得重链(hc)变体1、2和3。[0625](1)18b10hc的种系序列:[0626]vh/1-46(18b10-种系,seqidno:23):[0627]qvqlvqsgaevkkpgasvkvsckasgytftsyymhwvrqapgqglewmgiinpsggstsyaqkfqgrvtmtrdtststvymelsslrsedtavyycar[0628]vh/1-46变体1(hu18b10_ha,seqidno:25):[0629]qvqlvqsgaevkkpgasvkvsckasgytftgynmnwvrqapgqglewmgnidpyyggtsynqkfkgrvtmtidkststvymelsslrsedtavyycarmyhgnafdywgqgttvtvss[0630]vh/1-46变体2(hu18b10_hb,seqidno:27):[0631]qvqlvqsgaevkkpgasvkvsckasgysftgynmnwvrqapgqglewmgnidpyyggtsynqkfkgrvtltidkststvymelsslrsedtavyycarmyhgnafdywgqgttvtvss[0632]vh/1-46变体3(hu18b10_hc,seqidno:29):[0633]qvqlvqsgaevkkpgasvkvsckasgysftgynmnwvkqapgqglewignidpyyggtsynqkfkgrvtltidkststvymelsslrsedtavyycarmyhgnafdywgqgttvtvss[0634]通过将三个cdr直接移植到种系序列(18b10lc种系,seqidno:24),并且变体1(hu18b10_la,seqidno:26)不进行反向突变,和对lc变体2(hu18b10_lb,seqidno:28)进行s63t、i21m反向突变来获得轻链(lc)变体1和2。[0635](2)18b10lc的种系序列:[0636]vk/4-1(18b10lc种系,seqidno:24)[0637]divmtqspdslavslgeratinckssqnnknylawyqqkpgqppklliywastresgvpdrfsgsgsgtdftltisslqaedvavyycqqyystp[0638]vk/4-1变体1(hu18b10_la,seqidno:26)[0639]divmtqspdslavslgeratinckssqsllnsgnlknyltwyqqkpgqppklliywastrksgvpdrfsgsgsgtdftltisslqaedvavyycqndysypltfgggtkveik[0640]vk/4-1变体2(hu18b10_lb,seqidno:28)[0641]divmtqspdslavslgeratmnckssqsllnsgnlknyltwyqqkpgqppklliywastrksgvpdrftgsgsgtdftltisslqaedvavyycqndysypltfgggtkveik[0642]以上所述的重链可变区和轻链可变区组合形成了以下的人源化18b10抗体:[0643]18b10-hala(具有seqidno:25的vh和seqidno:26的vl),18b10-hbla(具有seqidno:27的vh和seqidno:26的vl),18b10-hcla(具有seqidno:29的vh和seqidno:26的vl),18b10-halb(具有seqidno:25的vh和seqidno:28的vl),18b10-hblb(具有seqidno:27的vh和seqidno:28的vl),18b10-hclb(具有seqidno:29的vh和seqidno:28的vl)。[0644]如下所示的,18b10的重链和轻链的人源化变体与人igg1重链恒定区和kappa轻链恒定区相连接:[0645]人igg1重链恒定区(seqidno:49):[0646]astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk[0647]人kappa轻链恒定区(seqidno:50):[0648]rtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec[0649]合成上述重链和轻链cdna的可变区,并与人igg1和人kappa的恒定区融合。将所选抗体基因的重链和轻链克隆到表达载体中,并使用来自qiagen的plasmidmaxiprepsystem大规模地制备dna。按照生产商的操作说明,使用invitrogen的expifectaminetmcho试剂进行转染。当细胞活力为约60%时收集上清液。将细胞培养上清液通过0.22um滤膜过滤以除去细胞碎片。将上清液加到预先平衡的蛋白质a亲合柱上。然后,用平衡缓冲液(pbs)洗涤柱内的proteina树脂,并使用25mm柠檬酸盐(ph3.5)洗脱抗体。用1mtris-碱(ph9.0)将ph调节至约6.0-7.0。内毒素控制在1eu/mg以下。然后通过sds-page和sec-hplc表征纯化的抗体。[0650]2.与人和小鼠cldn18.2的结合[0651]按照与实施例5中所述的相同的方法测试人源化抗体的结合。[0652]如图8a所示,所有人源化变体都与嵌合变体进行了头对头测试,以筛选出最佳变体。所有变体均完全保留了它们的结合。接下来,测试仅具有一个反向突变的18b10-hala与hek293-小鼠cldn18.2细胞的结合(图8b)。18b10-hala可以以比imab362更好的效价和更高的mfi与小鼠cldn18.2很好地结合,这表明18b10-hala对小鼠具有良好的交叉反应性。[0653]3.通过kinexa进行的人源化cldn18.2抗体的亲合性分析[0654]通过kinexa头对头评估18b10-hala和imab362与表达cldn18.2的细胞的结合亲合力。按照kinexa4000(sapidyneinstrumentsinc.)的说明,用30μg山羊抗人iggfc抗体将200mgpmma硬珠(sapidyne,#440176)包被2h,然后用10mg/mlbsa封闭1h。在对数期收集两个胃细胞系nugc4和katoiii(atcc,目录号htb-103),并与0.2nm18b10-hala或imab362混合。用0.2nm18b10-hala或imab362将细胞-抗体混合物稀释2倍,并在室温下孵育3小时。游离抗体的数量随着稀释而增加。用山羊抗人iggfc包被的珠子捕获这些游离抗体,然后用1μg/mlalexafluor647抗人igg标记以读取结果。[0655]每种抗体的结合亲合力总结在表8中。18b10-hala与nugc4细胞和katoiii结合的kd约为0.3nm,比imab362高8倍以上。这与上述的facs结合结果相一致。[0656]表8.cldn18.2抗体对胃细胞系的kd[0657]kd(nm)18b10-halaimab362nugc40.3032.58katoiii0.315nd[0658]4.hek293-cldn18.2细胞上的cdc试验[0659]与上述方法(参见实施例7的第1节)相似,在cdc活性测定中,用imab362对18b10-hala进行了头对头测试。如图9所示,18b10-hala的cdc活性比imab362高20倍以上。在浓度为0.3μg/ml的情况下,依赖18b10-hala的特异性细胞杀伤百分比达到86%,而imab362在相同浓度下没有细胞杀伤力。[0660]5.对mkn45-cldn18.2细胞的结合和细胞毒性作用[0661]细胞结合测定与上述相同。如图10a所示,所有18b10的人源化变体结合具有与嵌合18b10相当的亲合力的细胞。选择仅具有一个反向突变的18b10-hala进行进一步的adcc活性研究。[0662]使用jurkat-nfat-luc-fcγriiia-v176细胞作为效应细胞和mkn45-cldn18.2细胞作为靶细胞来测试adcc活性。试验方案与上述相同(参见实施例7的第2节)。如图10b中所示,18b10-hala的ec50(0.05μg/ml)比imab362低得多,这与嵌合的18b10一致。[0663]6.对nugc4细胞的结合和细胞毒性作用[0664]细胞结合和adcc试验与上述相同。图11a显示了18b10-hala与nugc4细胞的结合亲合力结果。图11b显示了与imab362相比,18b10-hala(ec50~0.59μg/ml)更好的adcc效价。[0665]7.使用nugc4作为靶细胞并且pbmc作为效应细胞的adcc试验[0666]将对数期nugc4细胞重悬于具有10%fbs的rpmi1640中。将细胞以每孔1×104个细胞预接种到96孔u底板中。将抗cldn18.2抗体和imab362在含10%fbs的rpmi1640中进行梯度稀释,并以200至0.2μg/ml的终浓度加至上述板中,并在37℃下孵育30分钟。从液氮中移出来自苗舜(上海)生物技术有限公司的冷冻pbmc,并立即放入37℃水浴中。离心后,将细胞重悬于添加了10%fbs的rpmi1640中,并以每孔40×104个细胞接种到上述96孔u底板中。然后将板在37℃的培养箱中放置5小时。[0667]孵育后,将板平衡至22℃。使用promegacytotox-one均质膜完整性测定试剂盒(g7892)或非放射性细胞毒性试验(g1780)检测ldh。在按照生产商的说明添加裂解液、试剂和终止液后,在激发波长560nm和发射波长590nm(g7892)或490nm或492nm的吸光度(g1780)下测量荧光。[0668]图12显示了使用pbmc作为效应细胞的代表性数据。18b10-hala显示出比imab362更好的adcc效价。由于不符合回归曲线,因此可能无法准确计算ec50。[0669]8.使用人cldn18.2上的定点诱变对所选抗体进行表位鉴定[0670]使用与实施例9相同的方法和人cldn18.2-mrfp质粒,将如下所列的人cldn18.228-80之间的42个氨基酸替换为丙氨酸,每次替换一个。使用引物通过重叠pcr扩增这些变体。特定突变为q28a,q29a,w30a,s31a,t32a,q33a,d34a,l35a,y36a,n37a,n38a,v40a,t41a,v43a,f44a,n45a,y46a,q47a,l49a,w50a,r51a,s52a,v54a,r55a,e56a,e56a,s57a,s58a,f60a,t61a,e62a,r64a,y66a,f67a,t68a,l69a,l70a,l72a,m75a,l76a,q77a,v79a,r80a。然后按照生产商的说明,使用syno组装混合试剂(synbio),通过同源重组的方法将pcr产物克隆到pcdna3.1( )载体中。使用qiagenplasmidmegakit(qiagen)纯化质粒。[0671]随后,将这些突变体和野生型cldn18.2-mrfp的质粒转染到hek293细胞中。如实施例9,转染后24小时通过流式细胞术分析细胞。[0672]如图13a所示,当w30、l49、w50、e56突变为a时,18b10-hala的结合完全丧失(结合百分比《10%),这表明了这4种氨基酸对于其与人cldn18.2的结合至关重要。特别地,e56是构成结合表位中最重要的一个。除了这4个关键氨基酸外,其它几种氨基酸被丙氨酸替代(如r51、f60、e62、r80)后也会影响结合(结合百分比介于10%和25%之间)。图13b显示了59a9-c与位点突变的cldn18.2的结合,其仅部分地依赖于e56(结合百分比为约22%)。表9总结了与野生型相比,突变的cldn18.2与抗体的结合百分比。[0673]表9[0674][0675][0676]实施例11:抗体药物缀合物(adc)内化和细胞毒性[0677]使用mc-vc-pab-mmaekit(levenabiopharma,cat#set0201)将18b10-hala和对照higg1与vcmmae缀合。嵌合的18b10-hala的药物抗体比(dar)为4.05,而imab362和对照higg1的药物抗体比分别为2.9和4.96。使用检测细胞代谢活性的比色测定法评估18b10-hala-vcmmae对细胞活力的作用。[0678]将对数期的hek293-cldn18.2,nugc4或mkn45-cldn18.2-高细胞重悬于其相应的培养基中,然后以每孔1×104个细胞,50μl/孔加入到细胞培养板中,并在37℃下孵育过夜。接下来,将抗体-vcmmae,对照higg1-vcmmae和抗体进行梯度稀释,并以50μl/孔加入到每个孔中。最终浓度为4.75nm的vcmmae用作细胞毒性的阳性对照。72小时后,在室温下将100μl/孔的来自celltiter-glo发光细胞活性测定试剂盒的检测试剂加入到每个孔中,孵育10分钟,然后使用酶标仪读数。[0679]如图14a所示,18b10-hala-vcmmae和imab362-vcmmae在hek293-cldn18.2细胞上诱导了细胞毒性,但对照higg1-vcmmae没有,这表明该细胞毒性是hcldn18.2特异性的。虽然单独的18b10-hala和imab362对靶细胞没有细胞毒性(数据未显示),这表明观察到的细胞毒性是vcmmae介导的。图14b显示了对胃癌细胞nugc4的细胞毒性作用。18b10-hala-vcmmae表现出剂量依赖性的细胞生长抑制作用,起始浓度为0.03μg/ml。相反,imab362-vcmmae仅以10μg/ml(更高的浓度)抑制细胞生长。在另一个用cldn18.2(高表达)转染的胃癌细胞mkn-45中,18b10-hala-vcmmae达到的最大细胞杀伤率为86%,也高于imab362(60%)(如图14c所示)。[0680]众所周知,adc通过抗原结合和内化进入靶细胞而发挥作用。与抗体缀合的药物只有在内化并转移至用于降解的溶酶体后才能释放并杀死细胞。我们用此试验作为对18b10-hala内化特征的初步估计。结果表明,它具有潜在的内化活性,可以开发为adc治疗药物。[0681]实施例12:人源化cldn18.2抗体在mkn45-cldn18.2-高异种移植模型中的体内功效评估[0682]1.使用裸鼠在mkn45-cldn18.2-高异种移植模型上的抗肿瘤功效[0683]体外研究(实施例10)显示,人源化的cldn18.2抗体可诱导对mkn45-cldn18.2-高细胞的adcc作用(实施例1)。因此,建立了体内模型并将其用于抗肿瘤活性评估。简而言之,每只雌性balb/c裸鼠经右侧腹腔皮下接种具有50%基质胶(bd)的5×106个mkn45-cldn18.2-高细胞。接种后12天,选择24只肿瘤大小在70mm3左右的小鼠并随机分为3组(n=8)。然后,以0.3mg/kg的剂量用同种型对照或人源化cldn18.2抗体,经腹腔注射治疗小鼠,每周两次,持续3周。在研究结束时,使用吸入二氧化碳的方式处死动物。每周测量2-3次肿瘤大小和体积。使用prismgraphpad分析结果,并表示为平均值±s.e.m。[0684]如图15所示,如通过肿瘤大小和tgi所测量的,18b10-hala显示出比imab362稍微更优的抗肿瘤活性,而两者均显著优于同种型对照(表10)。[0685]表10.mkn45-cldn18.2-高异种移植模型中18b10-hala和imab362的肿瘤生长抑制(tgi)(平均值±s.e.m.,n=8)[0686][0687]2.使用nod-scid小鼠测试mkn45-cldn18.2-高和hpbmc共接种异种移植模型上的抗肿瘤功效[0688]从allcells获取人pbmc细胞。将24只spf级nod-scid雌性小鼠随机分为3组(n=8),经右侧腹腔皮下注射,用5×106个mkn45-cldn18.2-高细胞和50%基质胶(bd)对6只小鼠进行接种,并作为模型组(无pbmc),用5×106个mkn45-cldn18.2-高细胞和5×106人pbmc细胞(含50%基质胶(bd))对18只小鼠进行接种,并作为治疗组。接种后4小时,用10mg/kg同种型对照,3mg/kg和10mg/kg18b10-hala通过腹腔注射处理小鼠,每周两次,持续4周。在研究结束时,使用吸入二氧化碳的方式处死动物。每周测量2-3次肿瘤大小和体积。使用prismgraphpad分析结果,并表示为平均值±s.e.m。[0689]如图16所示,在治疗期间18b10-hala组的肿瘤生长被完全抑制。治疗后,3mg/kg组的肿瘤在20天后开始长大,而10mg/kg组则没有。没有pbmc的组和有pbmc的pbs组之间没有显著差异,表明在没有抗体的情况下pbmc单独作为效应细胞不能抑制肿瘤生长。表11中总结了肿瘤生长抑制作用(tgi)。18b10-hala对动物体重没有影响(数据未显示)。[0690]表11.在mkn45-cldn18.2-高和hpbmc共接种的异种移植肿瘤模型中18b10-hala的肿瘤生长抑制(平均值±s.e.m.,n=6)[0691][0692]3.18b10-hala剂量依赖性的抑制裸鼠中mkn45-cldn18.2-高异种移植的肿瘤生长[0693]经右侧腹腔皮下注射,用具有50%基质胶(bd)的5×106个细胞对每只雌性balb/c裸鼠进行接种。接种后9天,选择32只肿瘤大小在100mm3左右的小鼠并随机分为4组(n=8)。然后,通过腹腔注射,用同种型对照,0.1mg/kg,0.3mg/kg和1mg/kg18b10-hala处理小鼠,每周两次,持续3周。在研究结束时,使用吸入二氧化碳的方式处死动物。每周测量2-3次肿瘤大小和体积。使用prismgraphpad分析结果,并表示为平均值±s.e.m。[0694]如图17所示,18b10-hala的抗肿瘤活性是剂量依赖性的。1mg/kg组显示出最佳的肿瘤生长抑制活性(表12)。[0695]表12.在mkn45-cldn18.2-高异种移植肿瘤模型中18b10-hala的剂量依赖性肿瘤生长抑制(平均值±s.e.m.,n=8)[0696][0697]实施例13:具有增强的adcc效应的18b10-hala-vlpyll突变体的产生、表达、纯化和表征[0698]1.18b10-hala-vlpyll突变体的产生[0699]根据futamimoto等人的研究,l235v/f243l/r292p/y300l/p396l突变对fcγriiia结合亲和力可以增加10倍,而对fcγriib(抑制性fcγr同工型)却没有任何改变。为了验证该假设,构建并产生了18b10-hala-l235v/f243l/r292p/y300l/p396l(18b10-hala-vlpyll)突变体以增强其adcc效应。按照与实施例12的第1节相同的方法,瞬时转染该fc变体,并进行表达和纯化。[0700]据报道,fc中的五个突变l235v/f243l/r292p/y300l/p396l可以增加与人cd16a(fcγriiia)的两个等位基因的结合亲合力,而对fcγriib(抑制性fcγr同工型)没有任何改变。(futamimoto等人,novelasymmetricallyengineeredantibodyfcvariantwithsuperiorfcγrbindingaffinityandspecificitycomparedwithafucosylatedfcvariant[c]//mabs.taylor&francis,2013,5(2):229-236)。为了验证该假设,通过使用重叠延伸pcr将这些突变引入hu18b10_ha_higg1,并将新构建体命名为hu18b10_ha_higg1_l235v/f243l/r292p/y300l/p396l。使用琼脂糖凝胶电泳表征最终的pcr产物。从凝胶中提取正确大小的片段,并将其克隆到表达载体中。然后通过测序分析确认了hu18b10_ha_higg1_p330s的正确构建体。使用来自qiagen的plasmidmaxi-prepsystem制备hu18b10_ha_higg1_l235v/f243l/r292p/y300l/p396l和hu18b10_la_hkappa的质粒。然后如上述一样,按照与实施例10的第1节相同的方法,将重链和轻链质粒共转染到expi-cho细胞中进行表达和纯化。[0701]工程化的fcl235v/f243l/r292p/y300l/p396l(seqidno:51)的序列:[0702]astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapelvggpsvfllppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkppeeqynstlrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttplvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk[0703]2.与fcγ受体的结合[0704]futamimoto等人将vlpyllfc突变体与野生型进行了比较,发现该突变可以增加其与fcγriiiaf176(63倍)和fcγriiiav176(33倍)的结合亲和力,而不会影响其他fcgr。为了证实这一发现,测试了抗体与这些fcγr之间的elisa结合。简而言之,以1μg/ml的浓度将18b10-hala-vlpyll或18b10-hala-wt抗体包被在板上。封闭并洗涤后,加入用his-标签标记的系列稀释(5μg/ml~0.02μg/ml)的fcγr,并孵育1小时。然后加入抗his-hrp和tmb以在od450nm下检测fcγr的结合。[0705]如图18a和18b所示,在与人fcγri或fcγriib的结合上,18b10-hala_vlpyll和18b10-hala-wt之间没有显著差异。但是,与野生型(wt)相比,18b10-hala_vlpyll显示出与人fcγriiia(f176)和fcγriiia(v176)的结合增加了10倍(图18c和18d)。在小鼠fcγr和食蟹猴fcγr上显示出相似的结果(图18e至18i)。[0706]3.与fcrn和c1q的结合[0707]通过elisa方法评估fcrn结合。简而言之,将18b10-hala_vlpyll或wt固定在板上。将生物素化的fcrn在ph6.0稀释缓冲液中连续稀释(1μg/ml~0.0002μg/ml),然后加入并孵育1小时。接下来,加入链霉亲和素-hrp和tmb以在od450nm下检测结合。[0708]c1q结合试验采用以下方法。将两种抗体固定在板上。加入系列稀释的c1q(20μg/ml~0.31μg/ml)孵育1小时。然后加入抗c1q-hrp和tmb以在od450nm下进行检测。[0709]如图19a所示,18b10-hala_vlpyll和wt之间在fcrn结合上没有显著差异,这表明vlpyll突变对fcrn结合没有影响。图19b显示18b10-hala_vlpyll在比wt低的c1q浓度下达到相同的结合信号,这可能导致cdc效价增加。[0710]4.使用jurkat-nfat-luc-fcγriiia-v176作为效应细胞在nugc4细胞上的adcc试验[0711]按照与上述相同的方法进行adcc报告基因试验(参见实施例7的第2节)。如图20a所示,与wt(ec50~0.032μg/ml)相比,18b10-hala_vlpyll的adcc效价(ec50~0.0097μg/ml)增加了3倍。[0712]5.使用人pbmc作为效应细胞在nugc4细胞上的adcc试验[0713]按照上述方法,使用人pbmc进行adcc试验(参见实施例10的第7节)。如图20b所示,尽管18b10-hala_vlpyll和wt的最高细胞毒性相似(~45%),但与wt相比,18b10-hala_vlpyll的adcc效价也增加了3倍。与imab362相比,18b10-hala_vlpyll的效价增加了100倍。[0714]6.一组胃癌细胞系中cldn18.2表达的mesf[0715]quantumtmmesf(等效可溶性荧光染料分子)微球试剂盒可实现荧光强度单位的标准化,以用于定量荧光细胞计数法。使用30μg/ml18b10-hala和山羊抗人igg-fitc对一组胃癌细胞(gc)进行染色。在具有固定荧光装置的流式细胞仪上,使用quantumtmmesf珠检测细胞。简要地说,将一滴参考空白“b”滴加到400μl悬浮液中,然后将每个荧光强度种群的1滴合并到400μl相同的缓冲液中进行分析。在流式细胞仪上分析微球。使用下载的bangslaboratories的定量分析模板,v.2.3进行数据分析,其使用校准曲线和回归系数(r2)值。对于准确的mesf分配,可以确保仪器线性,并且达到回归系数≥0.9995。另外,进行了适当的平行对照(例如,未染色的细胞、同种型对照)。[0716]如图21所示,两个转染的细胞系hek293-cldn18.2和mkn45-cldn18.2-高具有比其他细胞系高得多的cldn18.2表达水平,这可能并不代表来自gc患者的肿瘤细胞。在gc细胞系中,nugc4的cldn18.2表达最高。snu-601(cobioer,目录号cbp60507)和snu-620(cobioer,目录号cbp60508)具有中等水平,而katoiii和ocum-1(cobioer,目录号cbp60494)具有较低的表达。因此,cldn18.2在胃癌细胞中具有不同的表达水平。[0717]7.在一组胃癌细胞系中cldn18.2表达的ihc检测[0718]在对数生长期收集胃癌细胞系,并分别用磷酸盐缓冲盐水(pbs)洗涤后,在室温下于4%中性缓冲的多聚甲醛(pfa)中固定30分钟。离心后,将细胞以约2-5×107的密度重悬于pbs中,随后与200μl熔融琼脂混合,然后在梯度酒精中脱水,在二甲苯中澄清,然后包埋在石蜡中用于切片。使用3μg/mlgc182-生物素,通过免疫组织化学(ihc)检测这些细胞的cldn18.2表达水平,所述gc182-生物素是由迈博斯生物医药根据wo2013167259中的序列产生并在实验室内进行生物素化,这是用于cldn18.2ihc检测的可用的单克隆抗体。通过阳性细胞的相对比例和细胞膜上的染色强度评估ihc结果。根据imab362在临床试验中的评分指南,对这些细胞系进行打分和评估(表13)。只有在至少40%的肿瘤细胞中具有中度(2 )和强(3 )染色的患者才有资格纳入imab362的fast研究。因此,nugc4,mkn45-cldn18.2-高和hek293-cldn18.2符合标准。这些结果与实施例13第6节(quantumtmmesf方法)一致。[0719]gc182的重链可变区(seqidno:74):[0720]qiqlvqsgpelkkfgetvkisckasgytftdysihwvkqapgkglkwmgwintetgvptyaddfkgrfafsletsastaylqinnlknedtatyfcarrtgfdywgqgttltvss[0721]gc182的轻链可变区(seqidno:75):[0722]divmtqaafsipvtlgtsasiscrssknllhsdgitylywylqrpgqspqlliyrvsnlasgvpnrfsgsesgtdftlrisrveaedvgvyycvqvlelpftfgggtkleik[0723]表13.使用ihc方法分析胃癌细胞系的cldn18.2表达[0724][0725][0726]8.使用人pbmc作为效应细胞,在具有不同cldn18.2表达水平的胃癌(gc)细胞系上的adcc分析[0727]为了进一步检验cldn18.2抗体的adcc活性受gc细胞上cldn18.2表达水平调控的假设,按照上述相同方法(实施例10第7节),使用人pbmc作为效应细胞进行adcc试验。将具有不同cldn18.2表达水平的4种胃细胞系用作靶细胞。如图22a-22d所示,在所有cldn18.2抗体中,nugc4细胞诱导了最高的adcc活性(最大细胞毒性~40%)。在三种测试的抗体中,18b10-hala-vlpyll显示了比18b10-hala-wt和imab362更好的效价。snu-601和snu-620细胞诱导中等的adcc活性(最大细胞毒性分别为30%和15%),而ocum-1细胞具有最低的细胞毒性(低于10%)。这些结果表明,adcc活性与这些细胞系上的cldn18.2表达水平相关。[0728]实施例14:18b10-hala的工艺优化和adcc效应的表征[0729]1.18b10-hala的工艺优化[0730]众所周知,非岩藻糖基化或去岩藻糖基化选择性地和显著地增加对fcγriii的结合亲合力并导致adcc功能增强。以下描述了减少岩藻糖和增强adcc的工艺优化。[0731]简而言之,收获细胞库的种子并在cd-cho培养基(gibco)中培养3天后,将细胞在基础培养基(hyclone,actipro 4mmgln 1╳ht)中扩增6天。然后将0(作为参考样品)或50μm的2f-o-f(2-脱氧-2-氟-l-岩藻糖)添加到生物反应器中,并将do(溶解氧)控制在40%左右。添加饲养培养基1/2(hyclone,cellboost7a,cellboost7b),并且当vcd(可变细胞密度)低于80%或在第13天时收集细胞悬液。[0732]收集细胞悬浮液后,使用hplc测量参考样品和50μm2f-o-f样品的抗体滴度。在第13天,50μm2f-o-f样品的滴度为4.73g/l,甚至高于参考样品,这表明它不受2f-o-f的影响。[0733]纯化后通过hplc测量抗体质量,并且50μm的2f-o-f样品(98.3%)具有与参照样品(98.2%)相似的纯度。2f-o-f对抗体质量没有显著影响。[0734]同时通过hplc分析n-聚糖,结果示于表14中。与参考样品相比,2f-o-f的添加降低了g0f(fa2)(从61.6%降至1.9%)和岩藻糖(从87.7%降至13.7%)的百分比,但增加了g0(a2)的百分比(从8.1%增加到69.8%)。因此,50μm的2f-o-f足以将岩藻糖控制在15%以下,这可能导致adcc效应增强。将该工艺下的产物(含50μm2f-o-f)命名为18b10-hala低岩藻糖。[0735]表14.18b10-hala样品的n-聚糖的分析[0736][0737]为了证明18b10-hala低岩藻糖增强了有效fcγiiia受体的亲合性,同时保持了对fcrn的亲合性,我们通过fortebio系统的生物层干涉法(bli)技术比较了18b10-hala低岩藻糖和imab362-类似物的亲合性。将具有人igg1同种型和正常糖基化的imab362-类似物作为对照。[0738]在这项研究中,将fcγri,fcγriia-h167,fcγriia-r167,fcγriib,fcγriiia-v176,fcγriiia-f176,fcγriiib-na1,fcγriiib-na2和fcrn加载到生物传感器上并浸入到不同浓度的imab362和18b10-hala低岩藻糖溶液。所有结合数据在30℃下收集。当测量18b10-hala低岩藻糖或imab362-类似物与c1q的亲和力时,将生物素化的抗体加载到生物传感器上,然后与c1q在溶液中孵育。通过bli测定抗体对fcrn的亲和力时,ph值为6.0,而对于其他fc受体的结合试验,ph值为7.4。实验包括5个步骤:1.基线获取;2.将人fcγ受体加载到生物传感器上;3.第二次基线获取;4.将18b10-hala低岩藻糖和imab362-类似物缔合用于测量kon;和5.抗体解离用于测量koff。18b10-hala低岩藻糖和imab362-类似物对fcγri,fcrn或c1q具有相似的亲和力,而18b10-hala低岩藻糖显示出对其他受体的亲合力比imab362-类似物略高。这些结果表明,在临床试验中,18b10-hala低岩藻糖将表现出增强的adcc活性,并具有与正常糖基化抗体相似的半衰期。[0739]表15.通过fortebiooctet检测的18b10-hala低岩藻糖和imab362-类似物对人fc受体的亲合力数据[0740][0741]如表15所示,18b10-hala低岩藻糖对人fcγriiia-v176和人fcγriiia-f176蛋白的亲和力比imab362稍高,这可能是较低程度的岩藻糖基化所致。如表15所示,18b10-hala低岩藻糖对人fcrn蛋白的亲和力不受较低的岩藻糖基化影响,甚至比imab362略高。如表15所示,18b10-hala低岩藻糖对人c1q蛋白的亲和力与imab362的亲和力不太相似。[0742]2.使用jurkat-nfat-luc-fcγriiia-v176作为效应细胞在nugc4上的adcc报告基因分析[0743]按照上面相同的方案进行adcc试验(参见实施例7的第2节)。如图23所示,使用添加50μm2f-o-f(18b10-hala低岩藻糖)的工艺所产生的抗体与使用不添加2f-o-f的工艺所产生的参考样品相比,adcc活性提高了30倍以上。瞬时表达的18b10-hala也包含在此对比中,并且由于工艺优化,代表adcc活性的最大信号也增加了。[0744]3.使用18b10-hala低岩藻糖对不同胃癌细胞系的facs结合[0745]按照与实施例7的第2节相同的方案进行facs结合。如图24a-24c所示,18b10-hala低岩藻糖可以以比imab362更高的效价与这些细胞系结合。18b10-hala低岩藻糖的ec50为0.5~1.6μg/ml,而imab362在约1μg/ml浓度下几乎没有结合信号。[0746]4.使用jurkat-nfat-luc-fcγriiia-v176作为效应细胞在不同胃癌细胞系上的adcc报告基因分析[0747]按照上述相同的方案进行adcc试验(参见实施例7的第2节)。如图25a-e所示,使用具有不同cldn18.2表达水平的胃癌细胞系,18b10-hala低岩藻糖的adcc活性的ec50为约0.008μg/ml。与imab362相比,18b10-hala低岩藻糖的adcc效价至少高100倍。[0748]5.使用pbmc作为效应细胞在不同胃癌细胞系上的adcc报告基因分析[0749]按照与上述相同的方案进行adcc试验(参见实施例10的第7节)。如图26a-26d所示,在不同的胃癌细胞系上,18b10-hala低岩藻糖比imab362显著诱导出更高的adcc作用。imab362在低浓度(0.01~0.1μg/ml)几乎不诱导任何细胞毒性。然而,在0.1μg/ml的浓度下,18b10-hala低岩藻糖的细胞毒性几乎饱和。[0750]6.使用pbmc作为效应细胞在nugc4上的优化的adcc试验[0751]开发使用人pbmc作为效应细胞的优化的adcc试验以用于进一步研究。简而言之,从液氮中收获冷冻的pbmc,并用rpmi1640 10%fbs以5x106/ml的密度重悬细胞,并在使用前,于37℃5%co2培养箱中孵育5h。按照说明,用celltracetmfarred(invitrogen,目录号c34564)标记靶细胞nugc4细胞。将标记的nugc4细胞和稀释的抗体加到96孔板中,并在37℃5%co2培养箱中孵育30分钟。然后将pbmc细胞加到相应的孔中,并在培养箱中孵育细胞15小时。在培养结束时,加入碘化丙啶(pi)染色液以标记死的nugc4细胞。通过流式细胞术分析celltracetmfarred阳性细胞中的pi阳性细胞百分比。通过减去非特异性杀伤百分比来计算特异性细胞毒性。[0752]如图27所示,代表性数据,在浓度为1.2μg/ml时18b10-hala低岩藻糖的最大特异性细胞毒性达到60%以上,其ec50为0.014μg/ml,而在最高浓度(30μg/ml)时imab362-类似物的最大值仅为40%,其ec50为0.54μg/ml,这是18b10-hala低岩藻糖的30倍以上。[0753]实施例15:18b10-hala低岩藻糖体内抗肿瘤活性[0754]1.使用nod-scid小鼠测试在mkn45-cldn18.2-高和hpbmc共接种异种移植模型上的抗肿瘤功效[0755]从allcells获取人pbmc细胞。将60只spf级雌性nod-scid小鼠随机分为6组(n=10),经右侧腹腔皮下注射,用5×106个mkn45-cldn18.2-高细胞和50%基质胶(bd)对10只小鼠进行接种,并作为模型组(无pbmc),用5×106个mkn45-cldn18.2-高细胞和5×106人pbmc细胞(含50%基质胶(bd))对50只小鼠进行接种,并作为治疗组。接种后4小时,通过腹腔内注射10mg/kg同种型对照,1mg/kg,3mg/kg和10mg/kg18b10-hala低岩藻糖来处理小鼠,每周两次,持续5周。在研究结束时,用吸入二氧化碳的方式处死动物。每周测量2-3次肿瘤大小和体积。使用prismgraphpad分析结果,并将结果表示为平均值±s.e.m。[0756]如图28a所示,18b10-hala低岩藻糖以剂量依赖性方式显著抑制肿瘤的生长。特别是用10mg/kg的18b10-hala低岩藻糖,大多数肿瘤(7/10)在研究结束时消失了(图28b)。18b10-hala低岩藻糖的肿瘤生长抑制率也取决于剂量,并且10mg/kgtgi组达到95.86%(表16)。与imab362-类似物相比,1810-hala低岩藻糖具有更强的抗肿瘤活性。同时18b10-hala低岩藻糖对动物的体重没有影响(数据未显示)。[0757]表16.在第36天时,mkn45-cldn18.2-高和hpbmc共接种异种移植肿瘤模型中抗体的肿瘤生长抑制(平均值±s.e.m.,n=10)[0758][0759]2.18b10-hala低岩藻糖与奥沙利铂和5-fu联用对裸鼠mkn45-cldn18.2-高肿瘤模型的功效[0760]用具有50%基质胶的混合的5×106mkn45-cldn18.2-高细胞对spf级雌性裸鼠进行接种。当肿瘤大小在90mm3左右时,选择荷瘤小鼠并随机分为4组(n=8)。用10mg/kg同种型对照和赋形剂,10mg/kg18b10-hala低岩藻糖,2.5mg/kg奥沙利铂,和30mg/kg5-fu,以及10mg/kg18b10-hala低岩藻糖与2.5mg/kg奥沙利铂和30mg/kg5-fu联用对动物进行处理,18b10-hala低岩藻糖通过腹膜内注射进行施用,每周两次,持续4周,而奥沙利铂和5-fu是通过静脉注射施用,每周一次,持续四周。在二维尺度上,使用卡尺(insize)每周测量两次或三次肿瘤大小,并使用以下公式以mm3表示体积:v=0.5a×b2其中a和b分别代表肿瘤的长径和短径。使用prismgraphpad分析结果,并将结果表示为平均值±s.e.m。两组之间通过t检验进行比较,如果p为*《0.05和**《0.01,则认为差异显著。[0761]如图29和表17所示,在没有pbmc的情况下,单一药剂组18b10-hala低岩藻糖和奥沙利铂 5-fu仅对肿瘤生长有轻度抑制,tgi分别为47%和52%。但它们的组合具有增强的肿瘤抑制作用69%,与单一药剂组相比有显着差异。[0762]表17.在第28天,18b10-hala低岩藻糖与奥沙利铂和5-fu联用对mkn45-cldn18.2-高肿瘤模型的肿瘤生长抑制(平均值±s.e.m.,n=8)[0763][0764]3.18b10-hala低岩藻糖与紫杉醇联用对裸鼠mkn45-cldn18.2-高肿瘤模型的功效[0765]在37℃,含5%co2的条件下,将mkn45-cldn18.2-高细胞在体外作为单层培养物培养在rpmi1640培养基(thermofisher)中,所述培养基补充了10%热灭活的胎牛血清(excellbiology),100u/ml青霉素和100ug/ml链霉素(hyclone)。收集处于指数生长期的细胞,并计数用于肿瘤接种。经右侧腹腔皮下注射,用具有50%基质胶(bd)的5×106细胞对每只雌性balb/c裸鼠进行接种。接种后8-11天,选择24只肿瘤大小在100mm3左右的小鼠并随机分为3组(n=8)。然后用同种型对照或18b10-hala低岩藻糖以10mg/kg的剂量,通过腹膜注射处理小鼠,每周两次,持续3周。静脉注射5mg/kg的紫杉醇,每周一次。在研究结束时,通过吸入二氧化碳的方式处死动物。在二维尺度上使用卡尺(insize)测量肿瘤大小,并使用以下公式以mm3表达体积:v=0.5a×b2(其中a和b分别代表肿瘤的长度和宽度)。使用以下公式计算肿瘤生长抑制率(tgi%):tgi%=(1-(tvdt(治疗组)/tvdt(对照组))×100%。tvdt代表每次后续测量的肿瘤体积。使用prismgraphpad(均值±sem)生成直方图,使用t分析进行统计学分析。p《0.05,表示组间差异显著;p《0.01,表示组间差异非常显著。[0766]如图30a所示,与同种型对照相比,从第5天起18b10-hala低岩藻糖显著抑制肿瘤生长,其tgi约为43%。同样,紫杉醇作为胃癌常用的二线化疗药物,其tgi也约为45%。但是当将它们组合使用时,肿瘤抑制率达到61%,与单一药剂组相比有显著差异(图30b,表18)。但是,在不具有肿瘤接种的人pbmc的情况下,肿瘤体积将明显大于具有人pbmc的肿瘤体积。在所有组中均未观察到明显的体重变化。[0767]表18.在第29天,mkn45-cldn18.2-高异种移植肿瘤模型中抗体的肿瘤生长抑制(平均值±s.e.m,n=10)[0768][0769]4.在裸鼠gc02-0004pdx肿瘤模型中18b10-hala低岩藻糖与紫杉醇联用的功效[0770]源自胃癌患者的异种移植物(pdx)模型的肿瘤组织来自北京癌症医院的腺癌/胃癌患者(no:gc-02-004),并且在裸鼠中传代6次后进行分析。使用3μg/mlgc182-生物素通过免疫组织化学(ihc)检测cldn18.2表达,所述gc182-生物素是用于cldn18.2检测的公认ihc抗体。由迈博斯生物医药根据wo2013167259中的序列生成gc182。在该肿瘤组织中阳性细胞的相对比例在40%至70%之间(图31a,放大200倍)。还分别使用兔单克隆抗体d8f12(cellsignalingtechnology,cat#4290)和sp263(由迈博斯生物医药根据wo2016124558的序列制备)通过ihc检测her2和pd-l1的表达。因此,该肿瘤组织均为her2阴性(图31b)和pd-l1阴性(图31c)。[0771]向每只小鼠皮下接种直径约3mm的小肿瘤组织块,该小肿瘤组织块是从荷瘤小鼠的整个肿瘤剥离物中切下。接种后2周,选择肿瘤大小约50mm3的动物,随机分为3组,每组8只。以10mg/kg腹腔内注射18b10-hala低岩藻糖和对照抗体,每周两次。静脉注射5mg/kg紫杉醇,每周注射一次。首次注射后继续治疗5周。每周测量2-3次肿瘤体积和小鼠体重。在研究结束时,通过吸入二氧化碳的方式处死动物。在二维尺度上使用卡尺(insize)测量肿瘤大小,并使用以下公式以mm3表示体积:v=0.5a×b2(其中a和b分别代表肿瘤的长度和宽度)。使用以下公式计算肿瘤生长抑制率(tgi%):tgi%=(1-(tvdt(治疗组)/tvdt(对照组))×100%。tvdt代表每次后续测量的肿瘤体积。使用prismgraphpad(均值±sem)生成直方图,并使用t分析进行统计学分析。p《0.05,表示组间差异显著;p《0.01,表示组间差异非常显著。[0772]如图31d所示,18b10-hala低岩藻糖导致48%的肿瘤抑制率。同样,紫杉醇作为胃癌常用的二线化疗药物,其肿瘤抑制率也仅为45%。但是当将它们组合使用时,肿瘤抑制率达到68%,与单一药剂组相比有显著差异(表19)。如图31e所示,5mg/kg的紫杉醇似乎对小鼠的体重具有轻微的毒性作用,而其他治疗则没有。[0773]表19.在第36天,gc02-0004pdx肿瘤模型中抗体的肿瘤生长抑制(平均值±s.e.m.,n=10)[0774][0775][0776]5.在mkn45-cldn18.2高异种移植肿瘤模型中与dc101的联用[0777]dc101是与小鼠vegfr-2(血管内皮生长因子受体2)反应的单克隆抗体,也称为cd309,kdr和flk-1。vegfr-2是酪氨酸蛋白激酶家族的成员。一旦与其配体vegf结合,vegfr-2在血管发展和渗透性中起关键作用。事实证明,dc101竞争性阻断vegf和vegfr-2的结合,从而导致肿瘤微血管密度降低和肿瘤生长减缓。由迈博斯生物医药(苏州)有限公司根据us5840301中的序列制备了该抗体。[0778]用与50%基质胶混合的5×106mkn45-cldn18.2-高细胞对雌性spf级裸鼠进行接种。当肿瘤大小在90mm3左右时,选择荷瘤小鼠并随机分为4组(n=8)。用10mg/kg同种型对照,10mg/kg18b10-hala低岩藻糖,3mg/kgdc101和与3mg/kgdc101组合的10mg/kg18b10-hala低岩藻糖处理动物。通过腹腔内注射施用所有抗体,每周两次,持续4周。在二维尺度上,使用卡尺(insize)测量肿瘤大小,每周测量两次或三次,并使用以下公式以mm3表示体积:v=0.5a×b2,其中a和b分别代表肿瘤的长径和短径。使用prismgraphpad分析结果,并将结果表示为平均值±s.e.m。两组之间通过t检验进行比较,如果p为*《0.05和**《0.01,则graphpad分析结果,并将其表示为平均值±s.e.m。[0793]如图35所示,如通过肿瘤大小和tgi所测量的,18b10-hala低岩藻糖显示出比imab362更好的抗肿瘤活性,而两者均显著优于同种型对照(表21)。在所有组中均未观察到明显的体重变化。[0794]表21.第36天miapaca-2-cldn18.2异种移植模型中抗体的肿瘤生长抑制(tgi)(平均值±s.e.m.,n=6)[0795][0796]2.使用裸鼠在bxpc-3-cldn18.2异种移植模型上的功效[0797]按照与miapaca-2-cldn18.2模型相同的步骤(实施例19的第1节),建立bxpc-3-cldn18.2异种移植模型,并用抗体进行处理。[0798]如图36所示,imab362完全不能抑制肿瘤生长,而18b10-hala低岩藻糖显示出一定程度的抗肿瘤活性(表22)。在所有组中均未观察到明显的体重变化。[0799]表22.在第34天,bxpc-3-cldn18.2异种移植模型中抗体的肿瘤生长抑制(tgi)(平均值±s.e.m.,n=6)[0800][0801]实施例20:在体外肺癌细胞上的18b10-hala低岩藻糖抗肿瘤活性[0802]1.使用18b10-hala低岩藻糖与肺癌细胞系的facs结合[0803]nci-h146购自atcc(cat#,htb-173)。nci-h460-cldn18.2购自kyinno(cat#,kc-1450),其是用cldn18.2稳定转染的。按照与实施例7的第2节相同的方案进行facs结合。如图37a-37b所示,18b10-hala低岩藻糖可以以剂量依赖的方式与两种细胞系结合。对于nci-h460-cldn18.2细胞上的cldn18.2表达水平比nci-h146细胞高得多,前一细胞的最大结合信号也显著高于后一细胞。[0804]2.使用jurkat-nfat-luc-fcγriiia-v176作为效应细胞在nci-h146上的adcc报告基因分析[0805]按照上述相同的方案进行adcc测试(参见实施例7的第2节)。如图38所示,18b10-hala低岩藻糖可以在nci-h146细胞上诱导adcc,ec50约为0.003μg/ml。与imab362相比,18b10-hala低岩藻糖的adcc效价高约150倍。[0806]3.使用pbmc作为效应细胞在nci-h460-cldn18.2上的adcc试验[0807]按照上面类似的方案(实施例16的第6节)进行了原代pbmc介导的adcc试验。简而言之,从液氮中收获冷冻的pbmc,并用rpmi1640 10%fbs以5x106/ml的密度重悬细胞,并在使用前于37℃5%co2培养箱中孵育5h。按照说明,用celltracetmfarred标记靶细胞nci-h460-cldn18.2细胞或nci-h292细胞。将标记的靶细胞和稀释的抗体加到24孔细胞培养板中,并在37℃5%co2培养箱中孵育30分钟。然后将pbmc细胞以40:1的e:t比加入相应的孔中,并在培养箱中孵育15小时。培养结束时,将每个孔的悬浮细胞和贴壁细胞(用温和的胰蛋白酶消化)收集到相应的15ml试管中。离心这些试管以去除上清液。加入含碘化丙啶(pi)染色溶液的pbs以重悬靶细胞并标记死的靶细胞。通过流式细胞术分析celltracetmfarred阳性细胞中的pi阳性细胞百分比。通过减去非特异性杀伤百分比来计算特异性细胞毒性。[0808]如图39所示,18b10-hala低岩藻糖仅对nci-h460-cldn18.2细胞具有adcc活性,而对ncl-h292(cldn18.2阴性的人肺腺癌细胞)没有adcc活性。[0809]实施例21:在体内肺癌细胞上的18b10-hala低岩藻糖抗肿瘤活性[0810]1.使用裸鼠在nci-h146和人pbmc共接种肿瘤模型上的功效[0811]按照与mkn45-cldn18.2-高模型相同的方法(实施例17的第1节),建立nci-h146和人pbmc共接种肿瘤模型并通过抗体进行治疗。用5×106nci-h146 1.5×106人pbmc和50%基质胶对30只nod-scid小鼠进行接种。接种后4小时,将动物随机分为3组(n=10)。[0812]如图40a-40b和表23所示,用人pbmc和18b10-hala低岩藻糖治疗,nci-h146肿瘤几乎完全不生长,并且组内差异很小。[0813]表23.在第32天,nci-h146和pbmc共接种模型中抗体的肿瘤生长抑制(tgi)(平均值±s.e.m.,n=10)[0814][0815]2.使用nod-scid小鼠测试在nci-h460-cldn18.2和人pbmc共接种肿瘤模型上的功效[0816]人pbmc细胞来自allcells。将20只spf级雌性nod-scid小鼠随机分为2组(n=10)。经右侧腹腔皮下注射,用3×106nci-h460-cldn18.2细胞和具有50%基质胶(bd)的5×106人pbmc细胞对小鼠进行接种,并作为模型组。接种后4小时,通过腹膜内注射,用10mg/kg同种型对照和10mg/kg18b10-hala低岩藻糖处理小鼠,每周两次,持续5周。在研究结束时,通过吸入二氧化碳的方式处死动物。每周测量2-3次肿瘤大小和体积。使用prismgraphpad分析结果,并将其表示为平均值±s.e.m。[0817]如图41和表24所示,具有人pbmc的情况下,18b10-hala低岩藻糖组的肿瘤生长要慢于同种型对照组(tgi为36%)。[0818]表24.在第25天,nci-h460-cldn18.2肿瘤模型中抗体的肿瘤生长抑制(tgi)(平均值±s.e.m.,n=10)[0819][0820]实施例22:在体外结肠癌细胞上的18b10-hala低岩藻糖抗肿瘤活性[0821]1.使用18b10-hala低岩藻糖与结肠癌细胞系的facs结合[0822]sk-co-1购自atcc(cat#,htb-39)。按照与实施例7的第2节相同的方案进行facs结合。如图42所示,18b10-hala低岩藻糖可以以剂量依赖性方式结合sk-co-1细胞。ec50约为1.78μg/ml。[0823]2.使用jurkat-nfat-luc-fcγriiia-v176作为效应细胞在结肠癌细胞系上的adcc报告基因分析[0824]按照上述相同的方案(参见实施例7的第2节)进行adcc试验。如图43所示,18b10-hala低岩藻糖可以在sk-co-1细胞上诱导adcc。与imab362相比,18b10-hala低岩藻糖具有高得多的adcc效价。[0825]实施例23:使用fortebiooctetred9618b10-hala低岩藻糖与人fc受体的相互作用分析[0826]1.与fcγriiia蛋白的相互作用[0827]将100nm在1x动力学缓冲液(1xpbs,ph7.4,0.002%tween20)中的,具有his标签的生物素化的人fcγriiia-v176或生物素化的人fcγriiia-f176蛋白加到7个预湿式sa生物传感器(pall,fortebio,目录号18-5019)上,并与不同浓度的18b10-hala低岩藻糖或imab362溶液一起孵育。所有结合数据在30℃下收集。实验包括5个步骤:1.获取基线(60s);2.将生物素化的人fcγriiia-v176蛋白或生物素化的人fcγriiia-f176蛋白加到sa生物传感器上(120s);3.获取第二次基线(60s);4.缔合18k10-hala低岩藻糖或imab362以用于测量kon(60s);和5.解离抗体以用于测量koff(60s)。使用了7种不同浓度的抗体,包括1000nm,500nm,250nm,125nm,62.5nm,31.3nm和0nm,并用1×动力学缓冲液稀释抗体。仅在1×动力学缓冲液中进行基线和解离步骤。koff与kon的比值确定kd。在再生缓冲液(10mm甘氨酸-hcl,ph1.5)中将生物传感器再生5s,然后在中和缓冲液(1xpbs,ph7.4,0.002%tween20)中中和5s,重复该过程3次。[0828]如表25所示,相比于imab362,18b10-hala低岩藻糖对人fcγriiia-v176和人fcγriiia-f176蛋白的亲和力略高,这可能是由较低程度的岩藻糖基化所致。[0829]表25.cldn18.2抗体与人fcγriiia蛋白的动力学结合常数[0830][0831]2.与fcrn(fcgrt&b2m)蛋白的相互作用[0832]将50nm在fcrn1×动力学缓冲液(1×pbs,ph6.0,0.002%tween20)中的,具有his标签的人fcrn(fcgrt&b2m)蛋白加到7个预湿的ni-nta生物传感器上,并与不同浓度的18b10-hala低岩藻糖或imab362溶液一同孵育。在30℃下收集所有结合数据。实验包括5个步骤:1.获取基线(60s);2.将人fcγfcrn(fcgrt&b2m)蛋白加载到ni-nta生物传感器上(150s);3.获取第二次基线(80s);4.缔合18b10-hala低岩藻糖或imab362以用于测量kon(60s);和5.解离抗体以用于测量koff(60s)。使用了7种不同浓度的抗体,包括500nm,250nm,125nm,62.5nm,31.3nm,15.6nm和0nm,并用fcrn动力学缓冲液(ph6.0)稀释抗体。仅在1x动力学缓冲液中进行基线步骤,在fcrn动力学缓冲液(ph6.0)中进行基线2和解离步骤。koff与kon的比值确定kd。在再生缓冲液中将生物传感器再生5s,然后在中和缓冲液中中和5s,重复此过程3次。[0833]如表26中所示,18b10-hala低岩藻糖与人fcrn蛋白的亲和力不受低岩藻糖基化的影响,甚至比imab362的亲和力略高。[0834]表26.cldn18.2抗体与人fcrn蛋白的动力学结合常数[0835][0836]3.与人c1q蛋白的相互作用[0837]通过在dmf中与生物素氨基己酸n-羟基琥珀酰亚胺酯(sigma)混合,将18b10-hala低岩藻糖或imab362生物素化。将100nm在1x动力学缓冲液中的生物素化的18b10-hala低岩藻糖或imab362加到7个预湿的sa生物传感器上,并与不同浓度的人c1q溶液一起孵育。在30℃下收集所有结合数据。实验包括5个步骤:1.获取基线(60s);2.将生物素化的18b10-hala低岩藻糖或imab362加载到sa生物传感器上(150s);3.获取第二次基线(60s);4.缔合人c1q以用于测量kon(30s);和5.解离人c1q以用于测量koff(30s)。使用了7种不同浓度的抗体,包括50nm,25nm,12.5nm,6.25nm,3.13nm,1.56nm和0nm,并且用1x动力学缓冲液稀释人c1q。仅在1×动力学缓冲液中进行基线和解离步骤。koff与kon的比值确定kd。仅使用一次生物传感器。[0838]如表27所示,18b10-hala低岩藻糖对人c1q蛋白的亲和力与imab362对人c1q蛋白的亲和力不太相似。[0839]表27.cldn18.2抗体与人c1q蛋白的动力学结合常数[0840]当前第1页12当前第1页12
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。