使用自组装单层预官能化的纳米颗粒和制备其的方法
1.本发明涉及预官能化的纳米颗粒(np)的领域。其更具体地涉及使用自组装单层(sam)预官能化的np,以及使用生物分子官能化的np,使得所述np在溶液中稳定。所述np可以用于多种应用中,特别是作为诊断工具、对溶液中的目标分子(molecule of interest)的耗竭或浓缩工具、以及治疗工具。
2.现有技术和缺点
3.由一层sam覆盖的纳米颗粒在文献中有描述。例如,hurst k.m.等人的文章(journal of microelectromechanical systems;第20卷,第2期,2011年4月)中描述了将由对氨基苯基三甲氧基硅烷(aphts)和3-巯基丙基三甲氧基硅烷(mpts)组成的sam固定在np上以稳定所述np在微电子机械系统的硅化表面上的粘附。然而,这种np不适于使用生物分子进行官能化。
4.其他现有技术文献描述了覆盖有硫醇化单层的纳米颗粒。
5.hurst等人(2006)描述了其上携带有dna分子的金纳米颗粒,该研究的目的是在纳米颗粒表面携带(charge)最大量的dna分子。作者证明,当盐度条件受到控制(0.7m nacl)且dna分子含有聚乙二醇(peg)类型的间隔子时,可实现最大携带量。
6.wang等人(rsc adv.2017,7.3676-3679)描述了使用包含peg和硫醇化dna的混合单层官能化的球形金np。所述纳米颗粒分两步制备:使用硫醇化dna分子进行官能化,然后使用硫醇化peg,从而覆盖np的整个表面。
7.li等人(langmuir 2015,doi:10.1021/acs.iangmuir.5b01680)描述了使用dna分子官能化的纳米棒(nr)。由于金nr带正电,它们倾向于在带负电的dna的存在下连接在一起。作者提出在添加硫醇化dna之前,将peg和表面活性剂接枝到nr长分子上。
8.文献us 2011/165077描述了金纳米颗粒用于成像的用途。将报告分子接枝到np表面上,然后用peg-sh保护层将这些覆盖至饱和点;该层可防止颗粒聚集,并可使用特定探针进行官能化。
9.文献us 2019/142966描述了旨在用于治疗癌症的金属np的用途。这些np在一步中被peg-cooh分子覆盖,然后羧基在sds存在下与治疗分子和靶分子官能化。
10.文献us 2016/243254描述了作为治疗癌症的治疗诊断工具的纳米探针的制备。第一层硫醇化peg-cooh接枝到np表面;由于peg-cooh的高分子量,该第一层覆盖了大约30%(表示最大覆盖率)的np表面。添加第二层硫醇化dna-harpin分子,并将其夹在peg分子之间。在这种构造中,部分覆盖率和羧基官能基的组合存在有利于非特异性相互作用的出现。
11.在旨在用作固定生物探针的支持体的np的领域中,必须考虑各种限制。首先,预官能化或官能化的np必须在溶液中稳定,即它们不能聚集。它们还必须允许特定的探针/目标分子相互作用。
12.
技术实现要素:
和优点
13.本发明通过使用由具有低分子量的聚乙二醇(peg)分子形成的自组装单层(其覆盖是部分的)对np进行预官能化来提供对这些问题的解决方案。np表面上这种预制层(pre-layer)的存在使得可以单独或与其他分子结合(官能化)制备在溶液中稳定的np。这种单层
的特殊之处在于它由具有低分子量(100至732道尔顿)的分子组成,分子链较短;表面区域的体积是最佳的,这为纳米颗粒提供了如下所述的创新性。
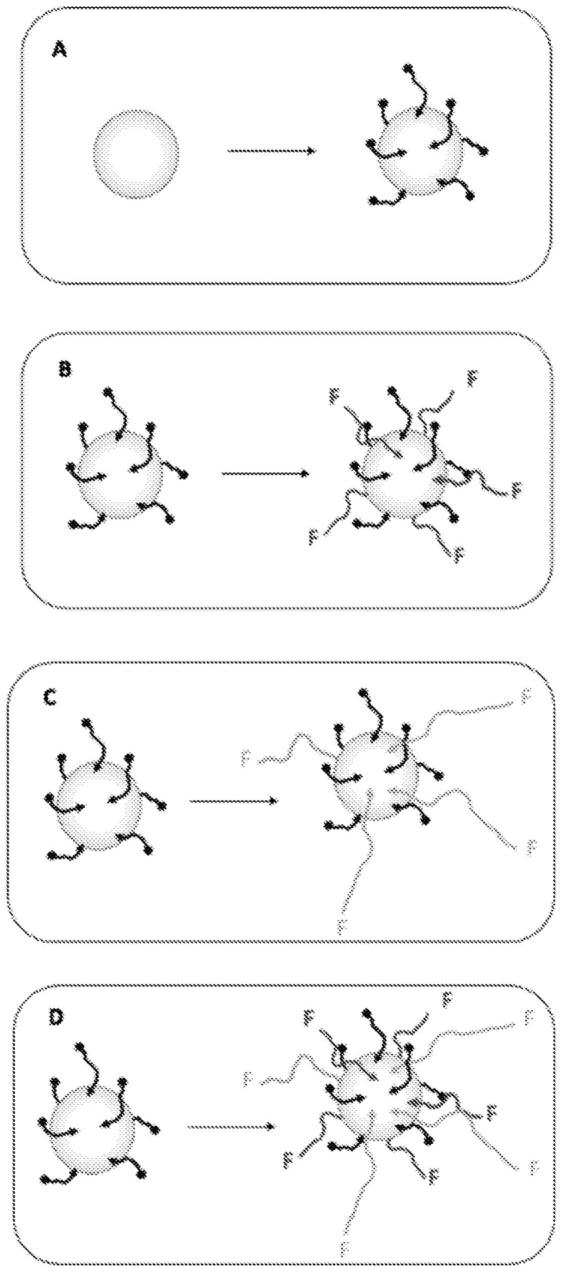
14.接枝到np表面的要素的构造呈现如图1所示。
15.根据本发明的官能化策略是一种表面化学,它可以通过控制固定在纳米颗粒表面的配体(生物分子)的数量、通过抑制非特异性相互作用和优化特异性相互作用来提高金属纳米颗粒(例如金)或核-壳混合型纳米颗粒在缓冲液和复杂介质(complex media)中的稳定性。该技术包括在固定一个或多个充当探针的生物分子之前进行预官能化。生物分子包含允许其直接固定在np表面上的硫醇化基团,或者生物分子的固定分两个步骤进行:1-固定一方面具有硫醇(用于将其固定在金属表面上),另一方面具有反应性官能团(用于固定生物分子)的接头分子,然后2-添加包含能够与接头分子上所存在的官能团反应或相互作用的基团的生物分子(探针或活性分子)。在此描述的方法特别适用于球形np、纳米棒、纳米立方体、纳米三角片(nanotriangle)和纳米海胆(nano-urchin)。
16.此外,这种预官能化允许优化探针的密度、探针的均匀分布,并且不存在非特异性相互作用。特别是,本发明使得可以具有使用探针进行官能化并且其密度低且经优化以实现高检测灵敏度的np。还可以组合多个不同的探针,同时为每个探针保持受控的密度和分布。
17.发明详述
18.本发明的第一个目的涉及一种包含使用自组装单层(sam)预官能化的金属表面的纳米颗粒,该自组装单层(sam)由在一个末端带有硫醇官能基而另一末端是惰性的分子的基质形成,所述纳米颗粒的特征在于,所述单层的覆盖率w为1.5%至99%。
19.自组装单层的特殊性在于它在np官能化之前应用于其表面,并且它是不饱和的。它起到保护表面的作用。该单层由式(i)的分子m形成:
20.hs(ch2)n(och2ch2)moh
21.其中:
22.n表示ch2的数量,其中3≤n≤11
23.m表示乙二醇的数量,其中1≤m≤12。
24.分子m的分子量为100至732道尔顿。
25.总体而言,为了观察到sam层的效果,需要覆盖率w最小为1.5%;低覆盖率允许在np表面具有高密度的生物分子,例如当存在2种不同的生物分子时,这可能是有意义的。相比之下,覆盖率w可以较高,接近饱和点(例如99%),允许单个分子沉积;由于缺乏适当灵敏的工具,这种方法的唯一限制可能是检测的限制。在任何情况下,对np表面进行预官能化的事实使得可以以受控方式固定生物分子,即确保所固定的生物分子之间的平均距离是均匀的。
26.在具体实施方式中,取决于应用,覆盖率w可以为3%至80%,例如10%至50%,或5%至30%,特别是2%、5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、98%。
27.在本发明的意义内,“覆盖率”是指理论初始覆盖率;这对应于分子的表面,并根据以下式(2)计算:
28.(以nm2表达的印记)
×
100/纳米颗粒的表面积
29.在本发明的意义内,“纳米颗粒”(np)可以是球形纳米颗粒(ns)、纳米棒(nr)、立方形纳米颗粒(nc)或纳米三角片(nt)或纳米海胆。这些可以特别是其直径为10nm至80nm的球形金纳米颗粒,纵横比为2.5至5的纳米棒,以及边长为40nm的纳米立方体,或边长为30nm至100nm且厚10-40nm的纳米三角片。np也可以是相同形状(球体、纳米棒等)的混合np,包括例如氧化物类型(例如氧化铁、氧化硅)或金属的核和金属壳(例如金)。核-壳混合纳米颗粒的金属表面与金属纳米颗粒的表面相似,且其表面的计算方法相同。
30.分子的表面积取决于其形状,必须知道这一点才能确定覆盖率。
31.在球形纳米颗粒的情况下,表面积对应于以下式(3):4πr232.其中r对应于纳米颗粒的半径。
33.在纳米棒的情况下,表面积对应于以下式(4):
34.2πrl 2πr235.其中r对应于纳米棒的半径,l对应于其长度。
36.在纳米立方体的情况下,表面积对应于以下式(5):
37.6a238.其中a对应于纳米立方体的边长。
39.在纳米三角片的情况下,表面积对应于以下式(6):
40.(ph/2) b
41.其中p对应于底部的周长,h对应于斜坡的高度,b对应于底部的面积。
42.存在于np表面上用于它们的预官能化或它们的官能化的分子可以选自以下分子:如上文定义的分子m、如下文定义的分子l-peg和peg-f,以及双链dna(dsdna)或单链dna(ssdna)、rna、蛋白质如抗体或肽、适体等。
43.因此,为了确定覆盖率,还需要知道存在于np表面的分子的理论印记(imprint):
44.m和peg-f的印记=0.23nm
2 1.45.l-peg印记=0.45nm
2 2.46.dsdna印记=3.14nm247.在有利的实施方式中,根据本发明的预官能化的纳米颗粒使用至少一种l-peg分子进行官能化,其覆盖率x为至少1%,优选为1%至10%。
[0048]“l-peg分子”是指高度长且具有高分子量的硫醇化聚乙二醇分子。
[0049]
l-peg分子可以具有式(7):
[0050]
sh-ch2ch2(ch2ch2o)qo-f
[0051]
其中:
[0052]
q表示乙二醇的数量,其中20≤q≤500;
[0053]
f表示如ch3、oh、cooh、nh2等官能团。
[0054]
l-peg分子的分子量大于或等于800道尔顿。
[0055]
使用l-peg分子的官能化对于稳定pbs溶液中的np特别有意义。它可以与使用分子m的预官能化结合,以制备可吸附一种或多种生物分子的“即用型”np。
[0056]
此外,当基团f不同于ch3或oh时,它可以与生物分子相互作用和/或反应,以便在np表面添加探针。
[0057]
在本发明的具体实施方式中,根据本发明的预官能化的纳米颗粒使用至少一种硫
醇化分子进行官能化,所述硫醇化分子是:
[0058]-在一个末端包含硫醇官能基并且在其另一末端带有能够与生物分子相互作用的活性或反应性基团的硫醇化接头分子;
[0059]-或者包含硫醇官能基的生物分子。
[0060]
所述纳米颗粒可以使用如上所述的l-peg分子进一步官能化。
[0061]
在感兴趣的实施方式中,硫醇化接头分子是peg-f分子,其中f是可激活的官能团,例如cooh,并且其覆盖率y为至少1%。np表面的整体覆盖率可以是部分或全部(饱和)的,这取决于应用。在优选的实施方式中,整体覆盖是部分的。
[0062]“peg-f”是指硫醇化聚乙二醇分子。
[0063]
peg-f分子可以例如具有式(8):
[0064]
hs(ch2)r(och2ch2)
p
o-f,其中:
[0065]
r表示ch2的数量,且为大于或等于3的整数;
[0066]
p表示乙二醇的数量,其中2≤p≤12,并且
[0067]
f表示如ch3、cooh、nh2等官能团。
[0068]
peg-f分子的分子量可低可高,扩展至超过800kda。
[0069]
在替代实施方式中,接头分子可以是包含可激活官能团的l-peg分子。
[0070]
在另一个感兴趣的实施方式中,根据本发明的预官能化的纳米颗粒使用充当探针的硫醇化生物分子(称为“硫醇化探针”)进行官能化,例如核酸(dna、rna、pna等)、蛋白质(抗体、抗原、激素等)、肽、激素、糖、脂肪酸、或甚至整个细胞。
[0071]
在另一个感兴趣的实施方式中,硫醇化生物分子是小分子,例如药物(夹心或络合的),在此称为“活性分子”。这些活性分子也可以通过存在于peg-f或l-peg分子上的可激活官能团结合。
[0072]
当硫醇化分子为双链或单链dna时,覆盖率z为至少10%。np表面的整体覆盖率可以是部分或全部(饱和)的,这取决于应用。在优选的实施方式中,整体覆盖是部分的。
[0073]
在优选的实施方式中,当peg-f较短时,l-peg分子以1%的比例添加以稳定np。
[0074]
在本发明的意义内,“硫醇化探针”是指起到探针作用的生物分子,该探针能够与位于水性介质(例如缓冲溶液)或复杂介质(培养基、生物培养基、体液、液体基质,如血液、血浆、血清、尿液、泪液、细胞提取物等)中的目标分子特异性相互作用(捕获)。所述充当探针的生物分子如下被固定到np的支持体上:(i)通过存在于生物分子上的硫醇化基团与np表面的直接相互作用,(ii)或借助硫醇化分子在其一个末端进行固定,该硫醇化分子在另一末端带有活性或反应性基团,该基团能够通过形成“强”键(例如共价键如酰胺键,螯合、“标签”型强亲和力如链霉亲和素-生物素键)与结合分子反应(结合);所述硫醇化分子在此称为“接头分子”。
[0075]
一旦基底如上所述被保护层sam保护,立即或在使用前即刻、在数小时、数天或数月后,接着进行沉积硫醇化探针的附加步骤。
[0076]
这些硫醇化探针可以是:
[0077]
·
直接硫醇化探针,需要的温育时间取决于浓度,该浓度通常较低(微摩尔级,或具有较低的浓度);
[0078]
·
具有反应性胺或羧基、碳-碳双键或三键(double or triple carbon-carbon)、
环氧基、点击化学等键的硫醇化分子,
[0079]
·
具有与互补分子相互作用以形成夹心体(例如生物素-链霉亲和素-生物素等)的活性基团的硫醇化分子。
[0080]
本发明的第二个目的涉及一种制备包含使用自组装单层(sam)预官能化的金属表面的纳米颗粒的方法,该自组装单层(sam)由在一个末端带有硫醇官能基而另一末端是惰性的分子的溶液形成,所述方法包括以下步骤:
[0081]-添加能够形成自组装单层的分子m,以实现1.5%至99%的覆盖率w,
[0082]-搅拌至少5分钟时长。
[0083]
这种方法使得可以制备在水中和pbs中稳定的预官能化的np。如此制备的np可在4℃下储存数月,直至使用。
[0084]
在这种方法中可以添加表面活性剂。所使用的表面活性剂可选自本领域技术人员已知的所有表面活性剂,特别是sds、chars、np40、tween20(sds:十二烷基硫酸钠,chars:3-[(3-胆酰氨基丙基)二甲基氨基]-1-丙磺酸盐)等。本领域技术人员熟悉使用表面活性剂制备溶液中的np。
[0085]
在本发明的具体实施方式中,进一步将l-peg分子溶液添加到使用sam层预官能化的np溶液中,以实现1%至10%的覆盖率y,然后进行温育,同时搅拌最少5分钟时长,通常为5分钟至1小时。
[0086]
使用分子m预官能化并且任选地使用l-peg分子官能化的np可以使用硫醇化分子和/或生物分子进一步官能化。在替代实施方式中,l-peg分子可以在peg-f分子之后添加。
[0087]
这种制备方法包括以下步骤:
[0088]-添加硫醇化分子,该硫醇化分子选自能够与生物分子相互作用的硫醇化接头分子或硫醇化生物分子,
[0089]-搅拌,例如5分钟至24小时时长,
[0090]-如果硫醇化分子是生物分子,则将其置于适合的缓冲条件中,
[0091]-去除过量的硫醇化分子,例如通过离心,
[0092]-重新分散在合适的溶液(蒸馏水、包含表面活性剂的缓冲溶液等)中,
[0093]-如果硫醇化分子是可激活分子,则添加活化剂(例如ecd/nhs或pdea),温育至少5分钟,离心并重新分散在缓冲溶液中,然后与已知的待固定的生物分子的溶液温育,
[0094]-如果硫醇化分子是硫醇化接头分子,则随后任选地添加能够与接头分子的基团相互作用的生物分子的溶液。
[0095]
该方法使得可以根据执行的步骤制备不同类型的官能化的np:
[0096]-m预官能化的np
[0097]-m l-peg预官能化的np
[0098]-m peg-f预官能化的np
[0099]-m l-peg peg-f预官能化的np
[0100]-m 硫醇化生物分子(例如:dna)预官能化的np
[0101]-m l-peg 硫醇化生物分子预官能化的np,等等,每种类型的生物分子都适合用作探针。
[0102]
实施方式如图1所示。
[0103]
从制备以不同覆盖率用分子m预官能化的np开始的方法的优点在于,np在以下官能化步骤中是稳定的,这些步骤可以在水中进行,也可以在缓冲溶液中进行。所述分子m是低分子量且惰性的小、短分子。使用分子m的预官能化确保官能化在np的整个表面上是均匀的,无论np的大小和形状如何。此外,它确保所固定的生物分子不会变性,并且朝向溶液而不是朝向np表面定位。另外,分子m可防止非特异性相互作用。
[0104]
本发明的第三个目的涉及根据本发明的纳米颗粒的用途。
[0105]
官能化的np可用于医学、农业食品和环境领域的本领域技术人员熟知的多种应用中。
[0106]
它们尤其可用于检测溶液中的目标分子,通常用于诊断测试中。
[0107]
因此,本发明涉及一种用于检测溶液、特别是复杂介质中的目标分子的方法,包括以下步骤:
[0108]-使溶液与至少一种如上文所定义的官能化的纳米颗粒接触,
[0109]-通过spr、试纸检验(strip test)或任何其他合适的方法检测当生物分子与溶液的成分之一相互作用时的特定信号。
[0110]
根据本发明的官能化的np也可用于耗竭特定分子,无论这些是旨在进行回收的目标分子,还是旨在进行消除的实际上不需要的分子。
[0111]
因此,本发明涉及一种用于检测溶液、特别是复杂介质中存在的目标分子的方法,所述方法包括以下步骤:
[0112]
a)使含有目标分子的溶液与如上文所定义的官能化的纳米颗粒接触,
[0113]
b)将所述溶液在所述纳米颗粒的存在下温育,
[0114]
c)回收纳米颗粒,
[0115]
d)任选地,重复步骤a)至c)直到目标分子的溶液已耗尽。
[0116]
长期以来,人们一直设想在癌症治疗中使用官能化的np以使其能够靶向靶细胞和/或接枝治疗化合物。在放疗中,可通过x射线激活的所述np可构成旨在受控破坏肿瘤的放疗实践中的重大进步。np也可用于光热疗法的方法,这是金纳米颗粒对抗癌症的最有前途的应用之一。理念是将金纳米颗粒注入患者的血液循环中。由于所述纳米颗粒的结构,它们倾向于固定在癌组织中,但可以通过用特定分子对其进行覆盖(官能化)而将它们更特异性地导向肿瘤。然后,使用激光将其“加热”。np释放的热量会在癌细胞中产生不可逆的损伤。该技术目前正在头颈癌或甚至肺癌和前列腺癌的多项临床试验中进行测试。
[0117]
因此,本发明涉及根据本发明的官能化的np在治疗癌症中的用途,特别是通过放射疗法或光热疗法。受控的光热疗法可以使先前接枝到纳米颗粒上的治疗分子盐析出来,而不会影响细胞或靶器官。
[0118]
本发明涉及根据本发明的官能化的np用于医学成像的用途。
[0119]
其中添加有np的溶液在性质上可能会有所不同。它可以是简单介质(水、pbs、模型介质),也可以是复杂介质(体液、废水、流出物等)。更一般地,它也可以是np可以在其中分散或者在与其接触时分散的基质。该基质可以是凝胶、沙或可能在其表面上包含目标分子的任何平坦表面。
[0120]
在具体实施方式中,溶液是复杂的生物介质,例如细胞提取物,细菌培养物提取物,选自血清、血液、尿液、羊水、泪液等的生物人体样品,选自废水、污染水、或可能是此类
的水、海水、来自水族馆的水等的水生介质。
附图说明
[0121]
图1:np官能化技术的视图。a)使用由分子m组成的sam进行预官能化(用短的黑色曲线表示);b)m l-peg(用长的浅灰色曲线表示);c)m peg-f或生物分子(用中等长度的中度灰色曲线表示);d)m peg-f或生物分子 l-peg。f表示官能团。
[0122]
图2:在存在或不存在表面活性剂的pbs中,根据覆盖率的用分子m预官能化的ns的吸收光谱。20nm的球形纳米颗粒;搅拌时间=4小时,m(n=11,m=4)。
[0123]
图3:在存在表面活性剂的pbs中,根据覆盖率的用分子m预官能化的nr的吸收光谱。纳米棒λ=800nm;搅拌时间=30分钟,m(n=11,m=4),w=8%。
[0124]
图4:离心后在pbs中,根据覆盖率的用分子m预官能化的ns的吸收光谱。20nm纳米颗粒;覆盖率1.6%至80%;搅拌时间=5分钟,m(n=11,m=4),pbs 0.005%表面活性剂。
[0125]
图5:在存在表面活性剂的pbs中,根据覆盖率的用分子m预官能化的ns的吸收光谱。20nm纳米颗粒;覆盖率1.6%至80%;搅拌时间=4小时,m(n=11,m=4),pbs 0.005%表面活性剂。
[0126]
图6:在存在表面活性剂的pbs中,根据覆盖率的用分子m预官能化的ns的吸收光谱。40nm商用纳米颗粒(参考:741981sigma aldrich);覆盖率0%、1.6%和16%;搅拌时间=4小时,m(n=11,m=12),pbs 0.005%表面活性剂。
[0127]
图7:分散在pbs中的用分子m预官能化的ns和用分子m预官能化并用l-peg官能化的np(w=5%)的吸收光谱,具有不同的l-peg覆盖率(x=0%、1%、10%)。40nm纳米颗粒(参考:741981sigma aldrich),温育时间l-peg=5分钟,m(n=11,m=4),l-peg分子量=6000,f=ch3。
[0128]
图8:分散在pbs中的用带有cooh官能基的硫醇化分子官能化(y=1.6%)的ns的吸收光谱,具有不同的分子m覆盖率(w=0%、1.6%和16%)。20nm纳米颗粒。m(n=11,m=4)和peg-cooh(r=11,p=6)。
[0129]
图9:根据l-peg官能化的存在,分散在pbs中的具有不同l-peg覆盖率(x=0%或10%)的用分子m预官能化和peg-cooh官能化(w=5%,y=5%)的ns的吸收光谱;ns大小=20nm。m(n=11,m=4),l-peg分子量=6000,且f=ch3,peg-cooh(r=11,p=6)。
[0130]
图10:分散在pbs中的具有不同l-peg覆盖率(x=0%或10%)的用分子m预官能化和peg-cooh官能化(w=5%,y=5%)的ns的吸收光谱;ns大小=80nm商用(参考742023sigma aldrich)。m(n=11,m=4),l-peg分子量=6000,f=ch3,peg-cooh(r=11,p=6)。
[0131]
图11:分散在pbs中的用分子m预官能化和dna官能化(w=0%或1.6%;z=12.5%)的ns的吸收光谱;m(n=11,m=4);ns大小=20nm。
[0132]
图12:分散在pbs中的具有不同l-peg覆盖率(x=0%或10%)的用分子m预官能化(w=10%)并用dna官能化(z=25%)的ns的吸收光谱,f=ch3;ns大小=20nm。商用(参考741965sigma aldrich)。
[0133]
图13:分散在pbs中的具有不同l-peg覆盖率(y=0%或10%)的用分子m预官能化(w=10%)并用dna官能化(z=25%)的ns的吸收光谱,f=ch3;ns大小=80nm商购(参考
742023sigma aldrich)。
[0134]
图14:根据温育时间的在pbs 0.005%表面活性剂中用分子m预官能化的ns的吸收光谱;20nm的ns;搅拌时间=5、30、120、240和1440分钟,m(n=11,m=4),w=40%。
[0135]
图15:用分子m预官能化和dna官能化(w=4%和z=50%)的ns的吸收光谱,对应于3个不同的实验。m(n=11,m=4),np 20nm。
[0136]
图16:用分子m预官能化和dna官能化(w=4%和z=50%)的ns的第一次洗涤的上清液的吸收光谱,对应于3个独立实验。m(n=11,m=4),ns 20nm。
[0137]
图17:制备并在4℃下储存1天、3个月和11个月后的用分子m预官能化的ns的吸收光谱。ns 20nm,m(n=11,m=4),其中w=32%。
[0138]
图18:在4℃下储存1天和2个月后的用分子m预官能化并用硫醇化dna官能化的ns的吸收光谱。m(n=11,m=4),其中w=0%和16%,z=12.5%。
[0139]
图19:在4℃下储存1天和3个月后的用分子m预官能化并用硫醇化dna官能化(w=32%和z=25%)的np的吸收光谱。ns大小=20nm,m(n=11,m=4)。
[0140]
图20:在添加细胞提取物(实线)之前、在稀释100倍的细胞提取物中温育1小时(虚线)之后,用分子m预官能化并用硫醇化dna官能化(w=30%,z=12.5%)的np的紫外-可见光谱。ns大小=20nm,m(n=11,m=4)。
[0141]
图21:稀释100倍的细胞提取物以及离心后3种上清液的总和(虚线)的吸收光谱。ns大小=20nm,m(n=11,m=4)(w=30%,z=12.5%)。
[0142]
图22:左图:cy5的荧光图像,用于定位互补的荧光dna;右图:凝胶的相差图像(contrast image),用于定位纳米颗粒。ns大小=20nm,m(n=11,m=4)(w=0%和16%,z=12.5%)。
实施例
[0143]
术语:
[0144]
·
硫醇化分子:“能够与生物分子相互作用的硫醇化接头分子”或“硫醇化生物分子”[0145]
·
w是由分子m形成的预制层的覆盖率。
[0146]
·
x是l-peg覆盖率
[0147]
·
y是peg-f覆盖率
[0148]
·
z是硫醇化dna覆盖率
[0149]
实施例1:用于纳米颗粒的预官能化/官能化的通用方案
[0150]
在任何预官能化之前,优选去除纳米颗粒(np)溶液(在水中稀释)中过量的表面活性剂(例如柠檬酸盐)。为了实现这一点,事先将np溶液离心,去除上清液,并将np饼重新分散在相同体积的蒸馏水中。离心速度和时间将根据np的大小进行调整。
[0151]
制备官能化的球形np的的实施例
[0152]
从np溶液(尺寸跨度为直径10nm至80nm)起进行以下步骤:
[0153]
a)添加分子m,以实现1.5%至99%的覆盖率w,
[0154]
b)搅拌5分钟至4小时时长,
[0155]
c)任选地添加l-peg分子,以实现1%至10%的覆盖率y,
[0156]
d)搅拌5至60分钟时长,
[0157]
e)添加硫醇化分子(能够与生物分子相互作用的硫醇化分子,或硫醇化生物分子),以实现至少1%的覆盖率y或z=至少10%,
[0158]
f)搅拌5分钟至24小时时长,
[0159]
g)如果硫醇化分子是生物分子,则将其置于适合的缓冲条件中,
[0160]
h)离心以去除过量的硫醇化分子,
[0161]
i)重新分散在合适的溶液(蒸馏水、包含表面活性剂的缓冲溶液等)中。
[0162]
实施例2:使用分子m对金纳米颗粒表面进行预官能化提高了所述纳米颗粒在pbs溶液中的稳定性
[0163]
a)球形纳米颗粒的情况
[0164]
将分子m(w=24%)的溶液添加到纳米颗粒溶液中。将混合物搅拌数小时(至少4小时),然后添加0%和0.005%的表面活性剂、ph 7.4的磷酸盐缓冲溶液和nacl。然后在存在或不存在0.005%表面活性剂的情况下,将np分散在pbs(磷酸盐10nm,ph=7.4,和0.1m nacl)中。
[0165]
与纳米颗粒稳定性有关的数据如图2所示。
[0166]
观察到在没有分子m的情况下,纳米颗粒不稳定并且聚集。相反,分子m的存在允许所述纳米颗粒保持悬浮。根据图2的吸收光谱,观察到在存在表面活性剂的pbs中纳米颗粒的稳定性有所改善,因为等离子体带(plasmon band)被细化。
[0167]
b)纳米棒的情况
[0168]
将分子m和0.005%表面活性剂的溶液添加到纳米棒(nr)溶液中。将混合物搅拌30分钟,然后添加ph 7.4的磷酸盐缓冲溶液和nacl。然后在0.005%表面活性剂的存在下将np分散在pbs(磷酸盐10nm,ph=7.4,和0.1m nacl)中。
[0169]
与纳米颗粒稳定性有关的数据如图3所示。观察到在没有分子m的情况下,纳米颗粒不稳定并且聚集。相反,分子m的存在允许所述纳米颗粒在pbs 0.005%表面活性剂中保持悬浮。
[0170]
其余实验均使用球形np进行。
[0171]
实施例3:使用分子m预官能化的纳米颗粒可以在存在表面活性剂的pbs溶液中冲洗并重新分散
[0172]
将分子m的溶液添加到纳米颗粒溶液中。将混合物搅拌5分钟或4小时,离心,并重新分散在存在0.005%表面活性剂的pbs 1x溶液中。
[0173]“pbs 1x”是指包含137mm nacl、10mm磷酸盐、2.7mm kcl且ph值为7.4的溶液。
[0174]
测试了各种方案:
[0175]
a)20nm的球形纳米颗粒,在分子m的溶液中温育5分钟。
[0176]
与纳米颗粒稳定性有关的数据如图4所示。
[0177]
b)20nm的球形纳米颗粒,在分子m的溶液中温育4小时。
[0178]
与纳米颗粒稳定性有关的数据如图5所示。
[0179]
c)40nm的球形纳米颗粒,在分子m的溶液中温育4小时。
[0180]
与纳米颗粒稳定性有关的数据如图6所示。
[0181]
这些结果清楚地表明,纳米颗粒的稳定性随着分子m溶液的覆盖率而增加。
[0182]
实施例4:使用l-peg分子的官能化提高了使用分子m预官能化的纳米颗粒在pbs溶液中的稳定性
[0183]
a)单独的预官能化
[0184]
对于单独的预官能化,将w=1.6%至80%的分子m的溶液添加到纳米颗粒溶液中。将混合物搅拌数分钟或数小时(5分钟至24小时),离心,并重新分散在适当的溶液中。
[0185]
b)预官能化然后使用l-peg分子进行官能化
[0186]
对于预官能化然后使用l-peg分子进行官能化,将分子m的溶液添加到纳米颗粒溶液中,以实现覆盖率w=5%。搅拌至少5分钟后,添加l-peg溶液,覆盖率为0%、1%和10%。将混合物再次搅拌15分钟,然后离心,并重新分散在pbs(1x)溶液中。
[0187]
与纳米颗粒稳定性有关的数据如图7所示。
[0188]
这些结果表明,从x=1%开始添加l-peg使得可以稳定pbs中的被单层分子m以低覆盖率(该情况w=5%)覆盖的np。事实上,等离子体带在采用l-peg时被细化,证实了稳定性的提高。
[0189]
实施例5:使用分子m对纳米颗粒进行预官能化提高了使用硫醇化分子官能化的所述纳米颗粒在pbs溶液中的的稳定性
[0190]
a)使用硫醇化羧基分子进行官能化而不进行预官能化
[0191]
将peg-cooh溶液添加到纳米颗粒溶液中,使得覆盖率y为1.6%。将混合物搅拌30分钟,离心,并重新分散在h2o或pbs 1x 0.005%表面活性剂中。
[0192]
b)预官能化然后使用硫醇化羧基分子进行官能化
[0193]
将分子m的溶液添加到纳米颗粒溶液中,使得理论初始覆盖率y为1.6%至80%。搅拌5分钟后,然后添加peg-cooh溶液以实现1.6%的覆盖率y。将混合物搅拌30分钟,离心,并重新分散在蒸馏水或pbs 1x 0.005%表面活性剂中。
[0194]
与纳米颗粒稳定性有关的数据如图8所示。
[0195]
这些结果表明,单独用peg-cooh官能化的np在pbs中聚集。使用分子m的溶液对np进行预官能化的事实可以提高np在溶液中的稳定性,特别是从覆盖率w=1.6%开始。通过增加温育时间和w,即通过增加np表面的分子m的密度(在这种情况下,曲线上w=16%,反映了最高的稳定性)进一步提高稳定性。
[0196]
实施例6:使用l-peg分子的官能化提高了使用分子m预官能化并使用硫醇化分子官能化的np在pbs溶液中的稳定性
[0197]
将分子m的溶液添加到np溶液中,以实现覆盖率w=5%。然后添加l-peg溶液,使得覆盖率x为0%或10%。然后添加peg-cooh溶液,以实现覆盖率y=5%。将混合物搅拌,离心,并重新分散在蒸馏水或pbs 1x 0.005%表面活性剂中。
[0198]
与纳米颗粒稳定性有关的数据对于20nm的球形np如图9所示,对于80nm的球形np如图10所示。
[0199]
注意到,添加10%l-peg会增加经预官能化和使用硫醇化分子(在这种情况下为peg-cooh)官能化的np的稳定性,特别是在分子m和硫醇化分子的覆盖率低时(各为5%覆盖率)。
[0200]
实施例7:使用分子m的预官能化提高了使用硫醇化分子官能化的np在pbs溶液中的稳定性:硫醇化dna分子的情况
[0201]
a)使用硫醇化dna分子进行官能化而不进行预官能化
[0202]
将dna溶液添加到纳米颗粒溶液中,以实现至少12.5%的覆盖率z。将混合物搅拌1小时,然后添加0.005%表面活性剂、磷酸盐缓冲液和nacl。将混合物搅拌18小时,离心,并重新分散在pbs 1x中。
[0203]
b)预官能化然后使用硫醇化dna分子进行官能化
[0204]
将分子m的溶液添加到np溶液中,以实现1.6%和80%的覆盖率。然后添加dna溶液,以实现至少12.5%的覆盖率z。搅拌1小时后,添加0.005%表面活性剂、磷酸盐缓冲液和nacl。将混合物搅拌18小时,离心,并重新分散在pbs 1x中。
[0205]
与纳米颗粒稳定性有关的数据如图11所示。
[0206]
注意到,用dna官能化的np在pbs中聚集。然而,从1.5%的覆盖率w起,使用分子m的预官能化提高了稳定性。通过增加温育时间和w,即通过增加np表面的分子m的密度,可以进一步提高稳定性(数据未示出)。
[0207]
实施例8:l-peg官能化提高了使用分子m预官能化并使用硫醇化dna官能化的np在pbs溶液中的稳定性
[0208]
将分子m的溶液添加到纳米颗粒溶液中,以实现1.6%和80%的覆盖率w。然后添加l-peg溶液以在温育30分钟后实现1%至10%的覆盖率x。将混合物搅拌15分钟。然后添加sh-dna溶液,以实现至少12.5%的理论初始覆盖率。添加dna溶液后,添加0.005%表面活性剂、ph 7.4的磷酸盐缓冲液(终浓度10mm)和nacl(终浓度0.1m)。将混合物搅拌18小时,离心,并重新分散在pbs 1x中。
[0209]
与纳米颗粒稳定性有关的数据对于20nm的np如图12所示,对于80nm的np如图13所示。
[0210]
当添加l-peg分子时,注意到np稳定性的改进。值得注意的是,l-peg层的存在使得可以在具有低水平分子m(w=10%)的情况下稳定pbs溶液中80nm的np。
[0211]
实施例9:np在含有分子m的溶液中的温育时间对稳定性的影响
[0212]
将分子m的溶液添加到纳米颗粒溶液中。将混合物搅拌数分钟或数小时(5分钟至24小时),然后添加0.005%表面活性剂、ph 7.4的磷酸盐缓冲溶液和nacl。然后在0.005%表面活性剂的存在下将np分散在pbs(磷酸盐10nm,ph=7.4,和0.1m nacl)中。
[0213]
与纳米颗粒稳定性有关的数据如图14所示。
[0214]
注意到,覆盖率作为时间的函数增加,并在温育120至240分钟达到最大值。超过此时长继续温育对w没有进一步影响。
[0215]
实施例10:用于稳定纳米颗粒的方法的再现性
[0216]
为了确认方案的再现性,将这些在不同的日子重复3次。样品的稳定性通过紫外-可见光谱表征。关于硫醇化dna的接枝,在洗涤去除过量dna的步骤期间的第一上清液通过紫外-可见光谱进行分析。
[0217]
关于官能化的np溶液的稳定性的结果如图15所示,并且关于在洗涤未吸收的dna的第一步骤期间获得的上清液的结果如图16所示。
[0218]
注意到,紫外-可见光谱包含可以叠加的精细等离子体带,这表明使用分子m预官能化并使用dna官能化的纳米颗粒np是稳定的,正如上清液的相同吸光度强度表明相同数量的dna已连接到np。总之,这些结果证实了样品制备的再现性。
[0219]
实施例11:使用分子m预官能化的np在水中稳定数月
[0220]
如上所述,使用分子m对20nm的np进行预官能化,然后在4℃和黑暗中储存数月。通过紫外-可见光谱研究稳定性。通常,提取1ml溶液,并通过uvikon光谱仪进行分析。比较在不同时间获得的光谱。
[0221]
与纳米颗粒稳定性有关的数据如图17所示。
[0222]
在储存1天和11个月后,观察到使用分子m预官能化的np的吸收光谱的良好相关性。这三个光谱显示出精细的等离子体带,等离子体带没有任何位移,证实了在4℃下储存11个月后,预官能化的np在水中仍然稳定。
[0223]
实施例12:使用分子m预官能化并使用dna官能化的np在pbs溶液中稳定数月
[0224]
如上所述,20nm的np使用分子m进行预官能化并使用dna进行官能化,然后在4℃和黑暗中储存数月。稳定性通过紫外-可见光谱进行评估。通常,提取1ml溶液,并通过uvikon光谱仪进行分析。比较在不同存储时间获得的光谱。
[0225]
与纳米颗粒稳定性有关的数据如图18和19所示。
[0226]
首先注意到,分子m的存在使得可以在其制备之后和在其储存期间稳定np。比较储存1天和2-3个月后获得的光谱,这些结果显示了经预官能化和使用dna官能化的np的光谱的良好相关性。2个光谱显示了两个精细的等离子体带,等离子体带没有任何位移,证实了在4℃下储存2-3个月后,np在pbs中仍然稳定。
[0227]
实施例13:经预官能化和使用dna官能化的np在复杂介质中稳定
[0228]
将10μl细胞提取物添加到1ml的使用分子m预官能化并使用1nm硫醇化dna官能化的np溶液中(复杂介质的稀释度为100倍)。将混合物搅拌1小时,然后离心,并重新分散在pbs 1x中。上清液中np的稳定性和细胞培养基的吸光度强度通过紫外-可见光谱表征。根据beer-lambert定律,吸光度强度与溶液中的浓度有关。如果细胞提取物的吸光度强度与上清液的吸光度强度相似,则这表明细胞提取物中存在的生物分子在np处没有以非特异性方式被吸收。
[0229]
与纳米颗粒稳定性有关的数据如图20和21所示。
[0230]
比较添加细胞提取物之前和温育1小时之后样品的吸收光谱。注意到,在复杂介质中没有发生聚集,表明颗粒得到了很好的保护。为了确定是否存在非特异性吸附,通过离心洗涤颗粒,以去除细胞提取物。将温育一小时后的3种上清液的总和叠加在初始细胞提取物的光谱上。可以观察到光谱是叠加的,这表明源自细胞提取物的蛋白质在官能化的np表面几乎没有或没有特异性吸附。
[0231]
实施例14:用分子m对np进行预官能化改进了在复杂介质中的杂交
[0232]
将1μl的100nm互补荧光dna(cy5)添加到200μl的1.5nm np溶液中,其在使用分子m进行或未进行预官能化的情况下使用dna官能化。因此,总互补dna浓度为500pm。杂交在在三种不同的介质中在37℃的2小时温育下进行:pbs 1x、细胞提取物和人血清。将复杂介质稀释100倍。为了区分荧光dna、用dna官能化的np和在用dna官能化之前经预官能化的np,将样品沉积在琼脂糖凝胶中进行电泳。电泳使得可以分离和区分杂交的纳米颗粒和溶液中游离的互补dna。
[0233]
在三种不同的介质中研究了互补荧光链与两种类型的纳米颗粒(仅使用dna分子官能化的np,或使用单层分子m预官能化然后使用dna分子官能化的np)的杂交:pbs、稀释
100倍的细胞提取物和稀释100倍的人血清。所使用的纳米颗粒在使用前已合成2个月,并在4℃下储存。
[0234]
该实验的结果如图22所示。
[0235]
观察到只有纳米颗粒是可见的,因为单独的荧光团没有被激发。使用dna官能化的纳米颗粒np的迁移距离,以及在使用dna官能化之前经预官能化的np的迁移距离,在pbs和细胞提取物中似乎没有受到影响。相比之下,在人血清中,对于在官能化之前经预官能化的np,迁移距离极细微地不同,但对于使用dna官能化的np(没有分子m),变化更显著,表明这些纳米颗粒上可能存在非特异性吸收(通过由于np大小的增加导致迁移速度减慢可见)。在图的左侧部分,仅观察到荧光的发射(凝胶中的黑色条带),表明凝胶中互补dna的位置。比较图22中条带的强度和条带的位置,可以关联dna的位置与凝胶中np的位置,以及因此的杂交有效性。虽然在pbs中,经预官能化的纳米颗粒和未经预官能化的纳米颗粒之间的杂交效率似乎没有受到影响,但在复杂介质中观察到明显的差异。事实上,似乎对于没有分子m(即仅dna)的样品,杂交受到影响,因为对应于游离dna的荧光明显更强(更少的互补dna与连接到np的dna杂交)。这些结果表明,在复杂介质中,经预官能化的样品的杂交效率(hybridization effectiveness)更高。可以假设,在复杂介质中,蛋白质在使用dna官能化(但未经预官能化)的np上的非特异性吸收阻止了互补dna与连接到np的dna之间的杂交。
[0236]
实施例15:不同介质中目标互补dna的检测的评估
[0237]
跟随所述互补靶荧光dna(cy5)与固定在使用分子m预官能化的纳米颗粒上的dna之间的杂交效率,允许检测单链靶dna(cdna)。一旦dna经杂交,在np离心前和离心后进行两次凝胶电泳。离心使得可以浓缩np,以实现np表面互补荧光dna的改进可视化。
[0238]
所遵循的杂交方案:将50pm至1nm荧光互补dna添加到2nm的np悬浮液中(np的大小=20nm,m(n=11和m=4),w=16%和z=12.5%)。将混合物在pbs或商用人血清(稀释100)(thermofisher,normal human serum,参考31876)中在37℃下温育2小时。
[0239]
进行了np的凝胶迁移(数据未示出)。“纳米颗粒图像”部分显示了生物缀合的np的位置,“荧光图像”部分显示了荧光互补dna的位置。对照对应于游离的荧光互补dna。从50pm至1nm填充(charge)不同浓度。
[0240]
这些结果证实杂交已经发生,因为荧光与纳米颗粒的位置相关。在pbs或人血清中,在高达50pm的靶dna浓度范围内观察到荧光。即使在低浓度的靶dna下,复杂介质的存在也没有阻止杂交。
[0241]
结论:dna探针在np上的杂交使得可以检测pbs或人血清中50pm至1nm的互补dna。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。