1.本发明涉及微生物检测技术领域,具体而言,涉及一种副溶血性弧菌的检测方法及应用。
背景技术:
2.副溶血性弧菌是一种嗜盐性革兰氏阴性菌,广泛存在于水体、水底沉积物和水生动物体内。副溶血性弧菌感染暴发在全球很多国家和地区常有报道,也是亚洲一些国家和地区细菌性食源性疾病的主要致病菌。常规的致病菌检测方法为平板培养法,但该方法具有培养时间长、操作工作量大、检测灵敏度低等缺点。
3.因此,为解决上述问题,提出一种简单方便的副溶血性弧菌的检测方法具有重要意义。
技术实现要素:
4.本发明的目的在于提供一种副溶血性弧菌的检测方法,其以磁性材料富集副溶血性弧菌dna的方式检测待测品中的副溶血性弧菌,具有方便简捷的优势,而且操作时间短,工作量较小,使用价值更高。
5.本发明的另一目的在于提供一种副溶血性弧菌的检测方法的应用,将上述提取材料制成传感器时,能够达到第一时间检测副溶血性弧菌的效果,使用更为便捷。
6.本发明解决其技术问题是采用以下技术方案来实现的。
7.一方面,本发明提出一种副溶血性弧菌的检测方法,主要包括以下步骤:
8.将缓冲液一、异丙醇和提取材料悬浮液混合后,制得混合液;将上述混合液的ph调节至6.5-7.0后,与上清液混合,再分离上述提取材料后,将上述提取材料与洗脱液混合,制得分离液;将上述分离液以副溶血性弧菌检测设备进行检测;上述上清液由需进行副溶血性弧菌检测的待测品获得;
9.上述提取材料的制备方式如下:
10.将β-环糊精与聚丙烯腈分别溶解后混合,然后在13kv-15kv的条件下进行静电纺丝,获得材料一;将上述材料一与纳米零价铁混合后,进行烧结,制得材料二;将上述材料二研磨后,制得上述提取材料。
11.另一方面,本发明提出一种副溶血性弧菌的检测方法的应用,将上述检测方法中用到的提取材料制成用于检测副溶血性弧菌的传感器。
12.本发明实施例的副溶血性弧菌的检测方法及应用至少具有以下有益效果:
13.一、以磁性材料富集副溶血性弧菌的方式检测待测品中的副溶血性弧菌,具有方便简捷的优势,而且操作时间短,工作量较小,使用价值更高。
14.二、本技术中提取材料以β-环糊精和聚丙烯腈作为主要材料进行制成,如此能够使得提取材料具有较好的富集能力,同时容易洗脱,达到快速分离以及快速检测的效果。
15.三、以静电纺丝的方式将合成材料制成纤维状结构,提升其与待测品间的接触面
积,更利于富集副溶血性弧菌,提取效果更好。
16.四、以纳米零价铁作为主要磁性物质,使得提取材料具有磁性,不仅便于分离,而且使用效果更好。同时,经过烧结后,提取材料的结构能够和纳米零价铁结合较好,避免其出现氧化的现象。
17.五、将上述提取材料制成传感器时,能够达到第一时间检测副溶血性弧菌的效果,使用更为便捷。
具体实施方式
18.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
19.需要说明的是,在不冲突的情况下,本技术中的实施例及实施例中的特征可以相互组合。下面将参考具体实施例来详细说明本发明。
20.本发明提出一种副溶血性弧菌的检测方法,主要包括以下步骤:
21.将缓冲液一、异丙醇和提取材料悬浮液混合后,制得混合液;将上述混合液的ph调节至6.5-7.0后,与上清液混合,再分离上述提取材料后,将上述提取材料与洗脱液混合,制得分离液;将上述分离液以副溶血性弧菌检测设备进行检测;上述上清液由需进行副溶血性弧菌检测的待测品获得;
22.上述提取材料的制备方式如下:
23.将β-环糊精与聚丙烯腈分别溶解后混合,然后在13kv-15kv的条件下进行静电纺丝,获得材料一;将上述材料一与纳米零价铁混合后,进行烧结,制得材料二;将上述材料二研磨后,制得上述提取材料。
24.具体地,将缓冲液一、异丙醇和提取材料悬浮液混合,制得混合液。其中缓冲液一可选为磷酸缓冲对作为缓冲液,亦可选择柠檬酸缓冲对作为缓冲液一,达到预期效果。
25.本技术中,缓冲液一的浓度为0.1mmol/l。
26.本技术中,缓冲液一、异丙醇以及提取材料的体积比为(7-8):20:1。
27.然后将混合液经过震荡混合均匀后,可静置几分钟后,再调节其ph。待其ph稳定后,与上清液混合,进行副溶血性弧菌提取,然后将富集副溶血性弧菌的提取材料通过磁性装置分离,再以洗脱液进行洗脱,制得含有副溶血性弧菌的分离液。
28.此时,可将分离液中提取获得副溶血性弧菌的dna进行pcr扩增,然后在副溶血性弧菌的检测仪器内进行检测,达到快速检测的效果。同时,由于以此方法能够准确吸附提取水产品中的dna,因此,能够避免重复多次提取的操作,以此降低提取过程的难度和工作量,使用效果更好。
29.详细地,将分离后的提取材料与600μl的去蛋白液混合,在震荡的条件下混合均匀,然后静置1min后,再次分离上述提取材料,并重复这一步骤三次后,将分离获得的提取材料与100μl的洗脱液在震荡的条件下混合均匀后,在65℃的条件下孵育3min,再去除提取材料后,获得的液体即为提取材料吸附的副溶血性弧菌dna。
30.本技术中,提取材料的制备方法具体如下:选择环糊精和聚丙烯腈为原料,在将其
分别以二甲基砜溶解后混合,并在室温条件下混合48h-56h。再以静电纺丝的方式将上述溶液制成具有纤维状结构的材料一;
31.再将材料一研磨至粉状,与纳米零价铁混合后,进行烧结,此时能够有效避免纳米零价铁团聚,并在混合均匀的条件下进行烧结,能够使得材料一与纳米零价铁间以分子间吸引力的方式吸附,然后烧结形成负载较好的材料二,将材料二再次进行研磨后,获得提取材料。
32.在此需要注意的是,材料一的粒径在120nm-200nm之间。
33.本技术中,上述上清液的制备方式如下:将上述待测品经预处理后,制得样品;将样品依次与缓冲液二和rna酶混合,制得浆液;将上述浆液在65℃-72℃下培育8min-10min,再进行离心,收集上清液。
34.本技术中,缓冲液二可选为磷酸盐缓冲液。缓冲液二与rna酶的体积比为80:1。而缓冲液二与样品的体积比为1:1。
35.本技术中,离心的转速为12000rpm,且离心时间为4min。
36.本技术中,上述待测品的预处理方法如下:将上述待测品洗净、去杂后,在无菌条件下搅拌,再依次与消化液和蛋白酶k混合,经均质后,制得样品;上述待测品为水产品。
37.详细地,在无菌条件下进行搅拌,搅拌速度为200rpm-220rpm,在搅拌完成后,取50mg的待测品与300μl的组织消化液和30μl蛋白酶k混合,均质1min后,制得样品。
38.本技术中,水产品可选为虾、牡蛎或贻贝。
39.本技术中,上述材料一与纳米零价铁的质量比为1:(0.3-0.35)。
40.本技术中,上述烧结的温度为130℃-185℃。
41.本技术中,上述β-环糊精与上述聚丙烯腈的质量比为1:(5-6)。
42.详细地,为避免提取材料对上清液中副溶血性弧菌dna的影响,将上述提取材料进行吸附提取之前,需进行预处理,达到更好的效果。本技术中,上述提取材料的预处理方法如下:
43.以70vol%-75vol%的乙醇溶液和去离子水依次对上述提取材料重复洗涤,至上述提取材料的悬清液透明后,分离上述提取材料;再将上述提取材料干燥后与100mmol/l-150mmol/l氯化钠溶液混合,获得上述提取材料悬浮液。
44.本技术中,干燥后的上述提取材料与氯化钠溶液的质量比为1:(25-28)。
45.本技术中,上述提取材料的干燥条件为60℃-65℃,且干燥时间为24h-28h。
46.本技术中提出一种副溶血性弧菌的检测方法的应用,将上述副溶血性弧菌的检测方法中的提取材料制成用于检测副溶血性弧菌的传感器。将上述提取材料制成传感器时,能够达到第一时间检测副溶血性弧菌的效果,使用更为便捷。
47.以下结合实施例对本发明的特征和性能作进一步的详细描述。
48.实施例1
49.本实施例的目的在于提供上清液的制备方式,具体如下:
50.将上述待测品洗净、去杂后,在无菌条件下搅拌,然后取出50mg的待测品,再依次与300μl的组织消化液和30μl蛋白酶k混合,使用均质机均质1min后,制得样品;上述待测品为虾。
51.将上述待测品经上述预处理后,制得样品;将300μl的样品依次与400μl的缓冲液
二(磷酸盐缓冲液)和5μl的rna酶混合,制得浆液;将上述浆液在70℃下培育10min,再在12000rpm的条件下离心4min后,收集上清液。
52.实施例2
53.本实施例的目的在于提供提取材料的制备方法,具体如下:
54.将β-环糊精与聚丙烯腈以质量比为1:5.5的比例混合,并且分别以二甲基砜溶解后进行混合,混合条件为在室温下混合52h。然后在14kv的条件下进行静电纺丝,获得材料一;将上述材料一在0.5mpa的条件下研磨后与纳米零价铁混合,且上述材料一与纳米零价铁的质量比为1:0.32。再在150℃的条件下进行烧结,烧结23min后制得材料二;将上述材料二在0.3mpa的条件下进行研磨后,制得上述提取材料。
55.实施例3
56.本实施例的目的在于提供提取材料的制备方法,具体如下:
57.将β-环糊精与聚丙烯腈以质量比为1:5的比例混合,并且分别以二甲基砜溶解后进行混合,混合条件为在室温下混合48h。然后在13kv的条件下进行静电纺丝,获得材料一;将上述材料一在0.5mpa的条件下研磨后与纳米零价铁混合,且上述材料一与纳米零价铁的质量比为1:0.3。再在130℃的条件下进行烧结,烧结30min后制得材料二;将上述材料二在0.3mpa的条件下进行研磨后,制得上述提取材料。
58.实施例4
59.本实施例的目的在于提供提取材料的制备方法,具体如下:
60.将β-环糊精与聚丙烯腈以质量比为1:6的比例混合,并且分别以二甲基砜溶解后进行混合,混合条件为在室温下混合56h。然后在15kv的条件下进行静电纺丝,获得材料一;将上述材料一在0.5mpa的条件下研磨后与纳米零价铁混合,且上述材料一与纳米零价铁的质量比为1:0.35。再在185℃的条件下进行烧结,烧结20min后制得材料二;将上述材料二在0.3mpa的条件下进行研磨后,制得上述提取材料。
61.实施例5
62.本实施例的目的在于提供一种副溶血性弧菌的检测方法,具体如下:
63.上述提取材料的预处理方法如下:以73vol%的乙醇溶液和去离子水依次对上述提取材料重复洗涤,至上述提取材料的悬清液透明后,分离上述提取材料;再将上述提取材料在63℃的条件下干燥26h后与130mmol/l氯化钠溶液以质量比1:26的比例混合,获得上述提取材料悬浮液。提取材料为实施例2制备而得的。
64.检测方式如下:将缓冲液一(0.1mmol/l的磷酸盐缓冲液)、异丙醇和提取材料悬浮液以体积比7.5:20:1的比例混合后,制得混合液;静置3min后,将上述混合液的ph调节至6.5-7.0后,与实施例1制备的上清液混合,再分离上述提取材料后,将上述提取材料与600μl得去蛋白液混合,震荡混匀后,静置1min,分离上述提取材料,重复三次后,将提取材料与100μl的洗脱液在震荡条件下混合,并在65℃条件下孵育3min后,除去提取材料制得分离液;将上述分离液中获取的副溶血性弧菌dna进行pcr扩增,再以副溶血性弧菌检测设备进行检测。
65.实施例6
66.本实施例的目的在于提供一种副溶血性弧菌的检测方法,具体如下:
67.上述提取材料的预处理方法如下:以75vol%的乙醇溶液和去离子水依次对上述
提取材料重复洗涤,至上述提取材料的悬清液透明后,分离上述提取材料;再将上述提取材料在65℃的条件下干燥28h后与150mmol/l氯化钠溶液以质量比1:28的比例混合,获得上述提取材料悬浮液。提取材料为实施例2制备而得的。
68.检测方式如下:将缓冲液一(0.1mmol/l的磷酸盐缓冲液)、异丙醇和提取材料悬浮液以体积比8:20:1的比例混合后,制得混合液;静置3min后,将上述混合液的ph调节至6.5-7.0后,与实施例1制备的上清液混合,再分离上述提取材料后,将上述提取材料与600μl得去蛋白液混合,震荡混匀后,静置1min,分离上述提取材料,重复三次后,将提取材料与100μl的洗脱液在震荡条件下混合,并在65℃条件下孵育3min后,除去提取材料制得分离液;将上述分离液中获取的副溶血性弧菌dna进行pcr扩增,再以副溶血性弧菌检测设备进行检测。
69.实施例7
70.本实施例的目的在于提供一种副溶血性弧菌的检测方法,具体如下:
71.上述提取材料的预处理方法如下:以72vol%的乙醇溶液和去离子水依次对上述提取材料重复洗涤,至上述提取材料的悬清液透明后,分离上述提取材料;再将上述提取材料在62℃的条件下干燥25h后与120mmol/l氯化钠溶液以质量比1:27的比例混合,获得上述提取材料悬浮液。提取材料为实施例3制备而得的。
72.检测方式如下:将缓冲液一(0.1mmol/l的磷酸盐缓冲液)、异丙醇和提取材料悬浮液以体积比7.5:20:1的比例混合后,制得混合液;静置3min后,将上述混合液的ph调节至6.5-7.0后,与实施例1制备的上清液混合,再分离上述提取材料后,将上述提取材料与600μl得去蛋白液混合,震荡混匀后,静置1min,分离上述提取材料,重复三次后,将提取材料与100μl的洗脱液在震荡条件下混合,并在65℃条件下孵育3min后,除去提取材料制得分离液;将上述分离液中获取的副溶血性弧菌dna进行pcr扩增,再以副溶血性弧菌检测设备进行检测。
73.实施例8
74.本实施例的目的在于提供一种副溶血性弧菌的检测方法,具体如下:
75.上述提取材料的预处理方法如下:以70vol%的乙醇溶液和去离子水依次对上述提取材料重复洗涤,至上述提取材料的悬清液透明后,分离上述提取材料;再将上述提取材料在60℃的条件下干燥24h后与100mmol/l氯化钠溶液以质量比1:25的比例混合,获得上述提取材料悬浮液。提取材料为实施例4制备而得的。
76.检测方式如下:将缓冲液一(0.1mmol/l的磷酸盐缓冲液)、异丙醇和提取材料悬浮液以体积比7:20:1的比例混合后,制得混合液;静置3min后,将上述混合液的ph调节至6.5-7.0后,与实施例1制备的上清液混合,再分离上述提取材料后,将上述提取材料与600μl得去蛋白液混合,震荡混匀后,静置1min,分离上述提取材料,重复三次后,将提取材料与100μl的洗脱液在震荡条件下混合,并在65℃条件下孵育3min后,除去提取材料制得分离液;将上述分离液中获取的副溶血性弧菌dna进行pcr扩增,再以副溶血性弧菌检测设备进行检测。
77.对比例1
78.参照《2021年国家食源性疾病监测工作手册》中副溶血性弧菌的检验操作程序进行检测。
79.检测程序包括:
80.(1)取样,获得样品;
81.(2)将上清液与3%的氯化钠碱性蛋白胨水混合,并在36℃的条件下培养12h,在弧菌显色平板上进行划线,再在36℃条件下培养20h;
82.(3)挑选弧菌显色平板上3个或以上的可疑菌落,并接种于3%的氯化钠胰蛋白胨大豆琼脂上,在36℃条件下培养20h后进行氧化酶实验、3%氯化钠三糖铁琼脂以及嗜盐性试验;
83.(4)进行系统生化鉴定后进行血清学分析、pcr毒力基因鉴定,以此获得结果。
84.效果例1
85.将实施例2-实施例4制备的提取材料进行表征,经过透射电镜后可知实施例2-实施例4制备而得的提取材料成纤维状,且表面粘附有零价铁颗粒,且分布较为均匀。
86.同时,实施例2-实施例4中提取材料的测试粒径分别为132nm、181nm、114nm,由此可见,当其与上清液混合时,不仅表面积较大,而且能够将其中的dna通过分子间作用力有效吸附,达到预期的富集和提取效果。
87.效果例2
88.将实施例5-实施例8获得的分离液以赛默飞便捷式qubit4荧光分析仪进行测定dna浓度,并计算dna的提取率。
89.测试方法如下:qubit buffer与染料的比例为200:1配制mix溶液。将mix溶液与vp基因组dna以199.1配置浓度测试液。随后取5ul测试液放入便携式qubit4荧光分析仪,测试dna浓度。
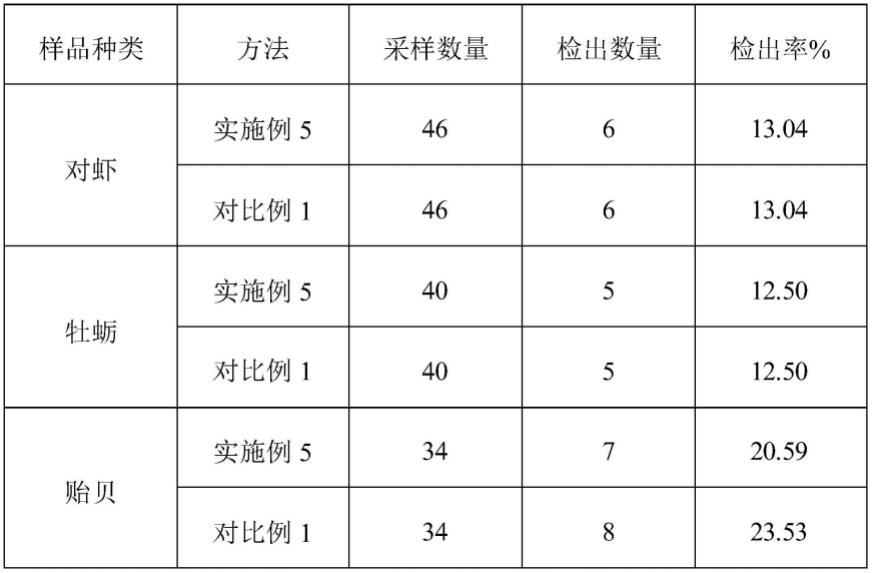
90.dna提取率计算公式如下:
91.提取率=(a
初-a
提
)
×
100%/a
初
;其中,a
初
为上清液中dna含量,a
提
为提取材料提取后分离液中dna含量。
92.表1测试结果
93.组别提取率%实施例583.2实施例686.7实施例783.6实施例882.1
94.由上表可知,以本技术提供的方式对上清液中副溶血性弧菌dna的提取效率较高,可有效提升检测的准确度,同时降低操作人员的工作量以及工作难度。
95.效果例3
96.将实施例5和对比例1分别对水产品进行检测,测试检出率。
97.在此需要注意的是,以实施例1、实施例2以及实施例5中上清液的制备方式、提取材料的制备方式以及检测方法对虾、牡蛎以及贻贝进行检测。且实施例5组的水产品和对比例1中的水产品为同一批水产品,样品相同。检出结果见表2。
98.表2产品检出率
[0099][0100]
由表2可见,本技术提供的检测方法具有较高的准确度。在此值得一提的是,以传统方法进行检测时需要耗费大量时间,且一次实验过程样品繁多,工作量大的同时工作难度较高。而本技术提供的检测方法则能够有效降低工作量,提升工作效率。
[0101]
综上,本技术提出的副溶血性弧菌检测方法以磁性材料富集副溶血性弧菌的方式检测待测品中的副溶血性弧菌,具有方便简捷的优势,而且操作时间短,工作量较小,使用价值更高。本技术中提取材料以β-环糊精和聚丙烯腈作为主要材料进行制成,如此能够使得提取材料具有较好的富集能力,同时容易洗脱,达到快速分离以及快速检测的效果。并以静电纺丝的方式将合成材料制成纤维状结构,提升其与待测品间的接触面积,更利于富集副溶血性弧菌,提取效果更好。同时,以纳米零价铁作为主要磁性物质,使得提取材料具有磁性,不仅便于分离,而且使用效果更好。同时,经过烧结后,提取材料的结构能够和纳米零价铁结合较好,避免其出现氧化的现象。另外,将上述提取材料制成传感器时,能够达到第一时间检测副溶血性弧菌的效果,使用更为便捷。
[0102]
以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
