环加氧酶抑制剂的局部制剂及其用途
1.本技术要求于2019年11月6日提交的名称为“环加氧酶抑制剂的局部制剂及其用途”的第62/931,466号美国临时申请的权益,该申请的全部内容,包括所有表格、附图和权利要求,特此并入本文。
背景技术:
2.以下对本公开背景技术的讨论仅仅是为了帮助读者理解本公开,而非承认为描述或构成本公开的现有技术。
3.环氧化酶(cox,也称为前列腺素内过氧化物合酶)是指负责从花生四烯酸形成前列腺素类(包括血栓烷和前列腺素诸如前列环素)的一个酶家族。由于前列腺素类是疼痛和炎症的介质,所以cox是常见的药物靶点。抑制前列腺素g/h合酶(环氧合酶或cox)的药物被称为cox抑制剂,所述前列腺素g/h合酶是催化由花生四烯酸产生前列腺素类(包括前列腺素、前列环素和血栓烷)的酶。诸如阿司匹林和布洛芬的常见的非甾体抗炎药(nsaid)通过抑制cox-1和cox-2酶而发挥作用,而诸如塞来昔布和依托考昔的nsaid对cox-2同工酶具有特异性。对乙酰氨基酚虽然因为它只有轻微的抗炎活性而不被视为nsaid,但它通过阻断cox-2来治疗疼痛,同时还抑制内源性大麻素的再摄取。
4.在局部制剂中使用cox抑制剂可以有利于降低患者出现与全身疗法相关联的副作用的可能性。直接应用于皮肤的药物可以要么旨在得到局部作用要么旨在得到全身效应。局部应用的药剂(例如,局部贴片、乳膏、凝胶、软膏、溶液等)可以旨在到达局部组织以达到所需的治疗效果,或者可以透皮作用以产生与口服药物相当的全身浓度。
5.在美国,有数种局部nsaid产品被批准用于治疗疼痛的情况。双氯芬酸钠1%凝胶(扶他林凝胶)被批准用于缓解能进行局部治疗的关节(诸如膝盖和手的关节)因骨关节炎引起的疼痛。这个产品在载体中含有各种附加成分,包括异丙醇、丙二醇和水,以帮助药物渗透到皮肤中。双氯芬酸钠外用溶液1.5%重量/重量(pennsaid)适用于治疗膝盖骨关节炎的体征和症状。这个产品中的附加吸收增强成分包括dmso、丙二醇、水和酒精。双氯芬酸依泊拉明1.3%局部贴片(flector贴片)适用于局部治疗由轻微劳损、扭伤和挫伤引起的急性疼痛。该贴片由含有1.3%双氯芬酸乙丙氨的粘合材料组成,应用于无纺聚酯毡背衬,并覆盖有在应用前被移除的聚丙烯膜释放衬垫。
6.有证据表明,局部制剂可以在局部组织中达到治疗药物浓度,同时维持低血清药物水平,并潜在地避免全身毒性。据报道,局部双氯芬酸制备剂的最大血清浓度为口服双氯芬酸所达到的最大血清浓度的0.4-2.2%,从而显著地降低了全身暴露量。作用部位的高药物浓度与低全身浓度相结合,可以产生大于或等于全身性nsaid疗效的疗效,同时降低不良反应的风险。
技术实现要素:
7.在第一方面,本公开提供了局部环氧合酶(cox)抑制剂制剂。这些制剂包括:
8.cox-1和/或cox-2的抑制剂;
9.约1.0至约15.0重量%的长链单不饱和脂肪酸、长链单不饱和脂肪醇、萜烯或其组合;
10.0至约5.0重量%的泊洛沙姆;
11.0至约5.0重量%的药学上可接受的纤维素赋形剂;
12.包括乙醇、丙二醇、2-(2-乙氧基乙氧基)乙醇和任选的二甲基亚砜的溶剂混合物;并且
13.其中,该制剂包括约5.0重量%或更少的水。
14.在各种实施方式中,所述制剂包括一种或多种cox抑制剂,所述cox抑制剂选自由大麻素类(例如,四氢大麻酚(d9-thc)、四氢大麻酚酸-a(thca-a)、大麻二酚(cbd)、大麻二酚酸(cbda)、大麻萜酚(cbg)和大麻萜酚酸(cbga))、萘普生、对乙酰氨基酚、苄达明、丁氨酚、双氯芬酸、依托芬那酯、氟芬那酸、布洛芬、吲哚美辛、酮洛芬和水杨酸盐(例如,水杨酸、水杨苷、二氟尼柳、水杨酸镁、水杨酸胆碱)。优选地,制剂包括双氯芬酸,并且最优选地,该制剂包括约1.0至约2.5重量%的双氯芬酸。在某些实施方式中,制剂中的一种或多种cox抑制剂包括约2重量%的双氯芬酸或由其组成。cox抑制剂可以以游离酸或各种盐(例如,双氯芬酸钠、萘普生钠、水杨酸三乙醇胺、布洛芬赖氨酸等)或酯(例如,双氯芬酸乙酯、萘普生甲酯、水杨酸甲酯、布洛芬二乙基氨基乙酯等)的形式存在。
15.在某些实施方式中,上述制剂提供cox抑制剂的经皮吸收,诸如制剂中存在的cox抑制剂的至少7%为双氯芬酸。经皮吸收(或皮肤渗透)可以视为由一系列按顺序进行的步骤组成:渗透剂分子在角质层表层上的吸附、扩散通过角质层和活表皮。在真皮的乳头层,分子被吸收到微循环中,用于随后的全身分布。用于测量局部应用药物的经皮吸收的方法是本领域已知的。参见,例如,kezic,hum.exp.toxicol.2008 27(4):289-95.doi:10.1177/0960327107085825。根据本发明权利要求书所述的局部cox抑制剂制剂优选提供至少10%的cox抑制剂的经皮吸收。
16.在某些实施方式中,本公开的局部cox抑制剂制剂包括不超过约2.5重量%,优选约1重量%或更少的水。在最优选实施方式中,制剂是无水的。“无水”是指制剂不包括水的使用,无论是作为水本身还是作为一种液体溶剂的组分加入。举例来说,在无水制剂中不使用95%乙醇,其是包含5%水的共沸混合物。然而,作为水合离子化合物的组分或吸湿性吸收产生的水可以存在于这样的无水制剂中。
17.本文使用的术语“重量%”是指(组分的质量/制剂的总质量)
×
100。举例来说,2重量%的双氯芬酸是每100g制剂中有2g双氯芬酸。
18.术语“长链单不饱和脂肪酸”是指具有至少14个碳和一个双键的脂肪酸。术语“长链单不饱和脂肪醇”是指等价的醇(也就是说,末端碳上附接的是-oh基团,而不是烷氧基)。例如,油酸的分子式为ch3(ch2)7ch=ch(ch2)7cooh,而等价油醇的分子式为ch3(ch2)
7-ch=ch-(ch2)8oh。属于这一组的单不饱和脂肪酸的实例包括但不限于以下:
19.[0020][0021]
在各种实施方式中,制剂中存在的长链单不饱和脂肪酸和/或长链单不饱和脂肪醇是c16:1至c22:1的脂肪酸或醇。在优选实施方式中,制剂中存在的长链单不饱和脂肪酸包括或由以下组成:约1至约15重量%的油酸或油醇或其混合物,更优选约1至约10重量%的油酸或油醇或其混合物,最优选约1至约5重量%的油酸或油醇或其混合物。在某些实施方式中,制剂中存在的长链单不饱和脂肪酸包括或由以下组成:约1重量%的油酸或油醇或其混合物,约2重量%的油酸或油醇或其混合物,约3重量%的油酸或油醇或其混合物,约4重量%的油酸或油醇或其混合物,约5重量%的油酸或油醇或其混合物,约6重量%的油酸或油醇或其混合物,约7重量%的油酸或油醇或其混合物,约8重量%的油酸或油醇或其混合物,约9重量%的油酸或油醇或其混合物,或者约10重量%的油酸或油醇或其混合物。
[0022]
泊洛沙姆是非离子型三嵌段共聚物,由聚氧丙烯的中心疏水链和位于其两侧的两个聚氧乙烯的亲水链组成。这些共聚物通常用字母p(代表泊洛沙姆)后跟三个数字来命名:前两个数字乘以100给出聚氧丙烯核的近似分子量,最后一个数字乘以10给出聚氧乙烯含量的百分比。可以用于本公开的泊洛沙姆的实例包括但不限于泊洛沙姆-101、泊洛沙姆-105、泊洛沙姆-105苯甲酸酯、泊洛沙姆-108、泊洛沙姆-122、泊洛沙姆-123、泊洛沙姆-124、泊洛沙姆-181、泊洛沙姆-182、泊洛沙姆-182二苯甲酸酯、泊洛沙姆-183、泊洛沙姆-184、泊洛沙姆-185、泊洛沙姆-188、泊洛沙姆-212、泊洛沙姆-215、泊洛沙姆-217、泊洛沙姆-231、泊洛沙姆-234、泊洛沙姆-235、泊洛沙姆-237、泊洛沙姆-238、泊洛沙姆-282、泊洛沙姆-284、泊洛沙姆-288、泊洛沙姆-331、泊洛沙姆-333、泊洛沙姆-334、泊洛沙姆-335、泊洛沙姆-338、泊洛沙姆-401、泊洛沙姆-402、泊洛沙姆-403和泊洛沙姆-407。在优选实施方式中,制剂中存在的泊洛沙姆包括约0.1至约5重量%的泊洛沙姆-188或由其组成,或者不含泊洛沙姆。
[0023]
纤维素及其衍生物(例如,醚和酯衍生物)是常用于具有各种目的的药物合成和工
业化产品中的赋形剂。它们的用途包括在口服液体制备剂中作为悬浮剂和在局部制剂中作为增粘剂。可以用于本公开的药学上可接受的纤维素赋形剂的实例包括但不限于羟丙基纤维素、羟丙基甲基纤维素、羧甲基纤维素、甲基纤维素、乙基纤维素、羟乙基纤维素、羟乙基甲基纤维素和乙基羟乙基纤维素。在优选实施方式中,制剂中存在的药学上可接受的纤维素赋形剂包括约1.0至约5重量%的羟丙基纤维素或由其组成。在某些实施方式中,制剂中的纤维素赋形剂包括或由以下组成:约1重量%的羟丙基纤维素,约2重量%的羟丙基纤维素,约3重量%的羟丙基纤维素,约4重量%的羟丙基纤维素或约5重量%的羟丙基纤维素。在某些其他实施方式中,制剂不含纤维素赋形剂。
[0024]
根据本公开的示例性局部cox抑制剂制剂包括如下溶剂混合物:
[0025]
约25.0至约50.0重量%的乙醇、约2.0至约12.5重量%的丙二醇、约0至约25.0重量%的dmso和约20.0至约49.9重量%的2-(2-乙氧基乙氧基)乙醇;并且其中溶剂混合物占制剂的约70.0至约95.0重量%,并且其中制剂具有约1重量%或更少的水,并且优选是无水的。
[0026]
在某些实施方式中,制剂包括约7.5至约12.5重量%的丙二醇,更优选约10至约12重量%的丙二醇。
[0027]
在某些实施方式中,制剂包括约10至约30重量%的2-(2-乙氧基乙氧基)乙醇,更优选约20至约27.5重量%的2-(2-乙氧基乙氧基)乙醇。
[0028]
在某些实施方式中,制剂包括约25至约45重量%的乙醇,更优选约30至约40重量%的乙醇。
[0029]
在某些实施方式中,制剂包括约15至约25重量%的二甲基亚砜,更优选约20重量%的二甲基亚砜。在某些其他实施方式中,制剂包括小于15重量%的二甲基亚砜,优选小于10重量%的二甲基亚砜,更优选小于5重量%的二甲基亚砜,还更优选0重量%的二甲基亚砜。
[0030]
优选局部cox抑制剂制剂包括或由以下组成:
[0031]
约1.0至约2.5重量%的双氯芬酸;
[0032]
约1.0至约10.0重量%的长链单不饱和脂肪酸、长链单不饱和醇或其混合物;
[0033]
0至约5.0重量%的泊洛沙姆;
[0034]
约2.0至约5.0重量%的药学上可接受的纤维素赋形剂;
[0035]
包括乙醇、丙二醇、二甲基亚砜和2-(2-乙氧基乙氧基)乙醇的无水溶剂混合物,
[0036]
其中制剂包括约25.0至约40.0重量%的乙醇、约2.0至约12.5重量%的丙二醇、约15.0至约25.0重量%的二甲基亚砜和约20.0至约49.9重量%的2-(2-乙氧基乙氧基)乙醇;并且其中溶剂混合物占制剂的约70.0至约95.0重量%,并且其中制剂具有约1重量%或更少的水且优选是无水的。
[0037]
根据本公开所述的优选局部cox抑制剂制剂是无水的,且包括或由以下组成:
[0038]
约2重量%的双氯芬酸;
[0039]
约27%的乙醇;
[0040]
约8wt%的油酸、油醇或其混合物;
[0041]
约0.5%泊洛沙姆188;
[0042]
约11%的丙二醇;
[0043]
约3wt%的羟丙基纤维素;
[0044]
约21%重量的dmso;和
[0045]
约25重量%的2-(2-乙氧基乙氧基)乙醇。
[0046]
根据本公开所述的另一种优选局部cox抑制剂制剂是无水的,且包括或由以下组成:
[0047]
约2.0重量%的双氯芬酸;
[0048]
约43.5%乙醇;
[0049]
约4.0重量%的油酸、油醇或其混合物;
[0050]
0重量%泊洛沙姆188;
[0051]
约3.0重量%的丙二醇;
[0052]
约3.0重量%的羟丙基纤维素;
[0053]
约20.0重量%的二甲基亚砜;和
[0054]
约24.5重量%的2-(2-乙氧基乙氧基)乙醇。
[0055]
根据本公开所述的另一种优选局部cox抑制剂制剂是无水的,且包括或由以下组成:
[0056]
约2.0重量%的双氯芬酸;
[0057]
约37.5%的乙醇;
[0058]
约2.0重量%的油酸、油醇或其混合物;
[0059]
0重量%的泊洛沙姆188;
[0060]
约11.0重量%的丙二醇;
[0061]
约3.0重量%的羟丙基纤维素;
[0062]
约20.0重量%的二甲基亚砜;和
[0063]
约24.5重量%的2-(2-乙氧基乙氧基)乙醇。
[0064]
整个说明书中使用的术语“约”是指给定值的 /-10%。
[0065]
在下表中可以找到本公开的示例性制剂的列表。在每种情况下,表中列举的值可以包括其范围内每一个值的 /-10%:
[0066][0067]
[0068][0069]
[0070][0071]
在一个相关的方面,本公开提供了用于局部治疗人体某一部位疼痛发作的方法,该方法包括将本公开所述的局部cox抑制剂制剂局部应用于该部位。在各种实施方式中,疼痛发作是急性疼痛发作或慢性疼痛发作。可以治疗的疼痛发作的实例包括但不限于由骨关节炎、类风湿性关节炎、轻度至中度炎症和组织损伤引起的疼痛、下背痛、炎性关节病(例如,强直性脊柱炎、银屑病关节炎、反应性关节炎)、网球肘、头痛、术后疼痛、帕金森病引起的肌肉僵硬和疼痛以及创伤性损伤。在优选实施方式中,本方法用于局部地治疗膝盖的骨关节炎的疼痛,包括将根据本公开所述的局部cox抑制剂制剂局部地应用于膝盖。
[0072]
在某些实施方式中,应用的根据本公开所述的局部cox抑制剂制剂的剂量提供了约80mg、约40mg、约30mg、约20mg或约10mg的cox抑制剂量。例如,在某些实施方式中,应用4ml 2重量%的双氯芬酸制剂将提供80mg双氯芬酸的局部剂量;2ml将提供40mg的双氯芬酸,1ml将提供20mg的双氯芬酸,等等。
[0073]
在一些实施方式中,本公开的制剂为凝胶、洗剂、霜剂、喷雾剂、气雾剂、软膏、乳剂、混悬剂、脂质体系统、漆、贴片、绷带、口含片剂、威化剂、舌下片剂、栓剂、阴道剂型或封闭敷料的形式。在特定实施方式中,制剂是凝胶。在一些实施方式中,本公开的制剂以例如凝胶、软膏或乳膏的形式直接地应用于皮肤,或者通过贴片、绷带或其他封闭敷料间接地应用于皮肤。根据患者的情况,本公开的制剂可以每天应用一次,或者每天应用多次。在一些实施方式中,所述制剂适于每日给药一次、两次、三次或四次,给药时间视需要而定,合适地为几天至几周至几个月的量级,或视需要更长。组合物可以施用于任何皮肤表面,包括手、臂、躯干、背、腿、脚等。
[0074]
应当理解,本公开在其应用中不限于以下描述中阐述的或附图中示出的构造细节和部件布置。除了所描述的那些实施方式之外,本公开还能够有别的实施方式,并且能够以
各种方式实践并执行。此外,应该理解的是,本文使用的措辞和术语以及摘要是为了描述的目的,不应该被认为是限制性的。
[0075]
因此,本领域技术人员将认识到,本公开所基于的概念可以容易地用作设计用于实现本公开的若干目的的其他结构、方法和系统的基础。因此,重要的是,权利要求被认为包括这些等同的构造,只要它们不脱离本公开的精神和范围。
附图说明
[0076]
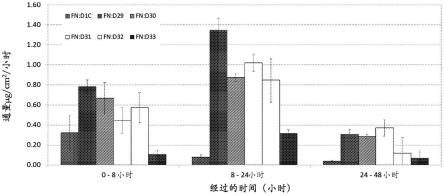
图1:表1中2%双氯芬酸制剂的皮肤渗透通量数据。
[0077]
图2:表1中2%双氯芬酸制剂的皮肤渗透递送剂量数据。
[0078]
图3:2%双氯芬酸制剂d34和pennsaid的递送的透皮剂量数据。
[0079]
图4:2%双氯芬酸制剂d34和pennsaid的皮肤保留剂量数据。
[0080]
图5:2%双氯芬酸制剂d34和pennsaid的递送的透皮剂量数据,以双氯芬酸的递送百分比表示。
[0081]
图6:2%双氯芬酸制剂d34和pennsaid的皮肤渗透通量数据。
[0082]
图7:2%双氯芬酸制剂d51-d55和pennsaid的递送的透皮剂量数据。
[0083]
图8:2%双氯芬酸制剂d51-d55和pennsaid的皮肤渗透通量数据。
[0084]
图9:2%双氯芬酸制剂d37-d39和pennsaid的递送的透皮剂量数据。
[0085]
图10:2%双氯芬酸制剂d37-d39和pennsaid的递送的透皮剂量数据,以双氯芬酸的递送百分比表示。
[0086]
图11:2%双氯芬酸制剂制剂d37-d39和pennsaid的皮肤渗透通量数据。
[0087]
图12:2%双氯芬酸制剂d51-d55和pennsaid的递送的透皮剂量数据。
[0088]
图13:2%双氯芬酸制剂d56和pennsaid的递送的透皮剂量数据。
[0089]
图14:2%双氯芬酸制剂d57-d59和pennsaid的递送的透皮剂量数据。
具体实施方式
[0090]
cox抑制剂经皮局部递送的最大障碍是皮肤最外层角质层(sc)的阻碍特性、皮肤结合、皮肤代谢、皮肤毒性和延迟时间延长。
[0091]
已经开发了不同的方法来增强透皮吸收,包括使用促进药物通过sc扩散的药物衍生物、过饱和系统、物理方法和化学渗透增强剂(吸收促进剂)。在这方面,许多化学品因其促进皮肤渗透的能力而被使用,包括脂肪酸、脂肪酸酯、脂肪醇或脂肪醇醚、脂肪醚、低级醇、甘油酯、多元醇、二醇、酰胺(例如,n,n-二乙基间甲苯酰胺)、胺、萜烯、极性溶剂、吡咯烷酮及其衍生物、亚砜、氮酮或月桂氮卓酮、表面活性剂、卵磷脂、多元醇、二醇、季铵化合物、硅酮、烷酸酯、某些生物制剂、酶、络合剂、大环化合物、溶剂等。
[0092]
本文所用的“渗透增强”是指增加皮肤对活性药物成分(api)的渗透性,从而增加api透过皮肤的速率。类似地,“渗透增强剂”(pe)是指实现这样的渗透增强的试剂或试剂混合物。适用于本公开的pe混合物通过以下机制中的一种或多种机制来促进api透过皮肤:(1)通过增加药物在皮肤中的扩散性;(2)通过引起sc脂质流化,这导致屏障功能降低(可逆作用);(3)通过增加并优化药物在载体中的热力学活性;(4)通过影响药物的分配系数;和(5)通过增加其从制剂释放到皮肤上层中。
[0093]
在某些实施方式中,适用于本公开的pe混合物具有以下特征中的一个或多个特征:无毒、无刺激性、无过敏性和/或对皮肤无致敏性;药理学上惰性的,至少在发挥充分渗透作用所需的浓度下是药理学上惰性的;即时、预测和/或可逆的效果;容易掺入药物制备剂中;和美容上可接受的。
[0094]
脂肪酸渗透增强剂
[0095]
本公开的pe混合物优选包括一种或多种脂肪酸,诸如长链脂肪酸。例如,脂肪酸可以是油酸(顺式-9-十八碳烯酸)或其功能衍生物。在某些实施方式中,pe是脂肪酸酯、脂肪醇或脂肪醇醚、脂肪醚、低级醇、甘油酯、多元醇、二醇、酰胺(例如,n,n-二乙基-间甲苯酰胺)、胺、萜烯、极性溶剂或其混合物。在某些实施方式中,脂肪酸是链烷酸、癸酸、二酸、乙基十八烷酸、己酸、乳酸、月桂酸、亚油酸、亚麻酸、新癸酸、油酸(顺式-9-十八碳烯酸)、棕榈酸、壬酸、丙酸或11-十八碳烯酸。在某些实施方式中,pe是c8-c22脂肪酸中的至少一种,诸如肉豆蔻酸异丙酯。
[0096]
虽然不希望被任何特定的理论所束缚,但是据信本公开的脂肪酸pe选择性地干扰sc中的细胞间脂质双层,从而增强api对sc的渗透。在某些实施方式中,基于不饱和脂肪酸在增强经皮吸收方面比饱和脂肪酸更有效(例如,超过5倍、10倍、15倍、20倍或更多)的一般趋势,可以通过调节双键的数量和脂肪酸异构体的顺/反构型来调节渗透增强效果的差异,特别是对于亲脂性药物/api。
[0097]
在某些实施方式中,pe是油酸、亚油酸、α-亚麻酸、花生四烯酸、棕榈酸、月桂酸、辛酸、异硬脂酸、肉豆蔻酸异丙酯或肉豆蔻酸,任选地还包括丙二醇、乙醇、2-乙基-1,3-己二醇和右泛烯中的一者或多者。在某些实施方式中,pe是棕榈酸,并且配制局部制剂以增强api对sc(特别是富含烷基的区域)的渗透。在某些实施方式中,pe是肉豆蔻酸,并且配制局部制剂以增强api对表皮的渗透。在某些实施方式中,pe是水杨酸辛酯,并且配制局部制剂以增强水溶性或油溶性api渗透到表皮和真皮中。
[0098]
另外的基于脂肪酸的pe可以在mx 9705070、gr 1004995、us 2005-020552a1、wo 05/060540、ca 2,420,895、mx 9800545、wo 04/054552、nz 537359、wo 98/18417、wo 96/30020、de 4301783、us 4中找到。
[0099]
萜烯渗透增强剂
[0100]
萜烯由于其高增强效果和低皮肤刺激性而可以在药物和化妆品制剂中用作渗透增强剂。萜烯主要从药用植物中提取,是挥发性化合物,其分子组分仅由碳、氢和氧原子组成。萜烯的基本化学结构由用于分类萜烯的许多重复异戊二烯(c5h8)单元组成。一些萜烯(例如,1,8-桉树脑、薄荷醇和薄荷酮)包括在由美国食品药品监督管理局发布的公认安全(gras)试剂清单中。适用于本公开的萜烯的实例可以选自薄荷醇、d-柠檬烯、香叶醇、橙花叔醇及其混合物。
[0101]
亚砜渗透增强剂
[0102]
在某些实施方式中,适用于本公开的pe混合物包括二甲基亚砜(dmso),用于增强亲水性和亲脂性api的渗透。可以替代dmso的其他dmso类pe包括类似的化学相关化合物,诸如二甲基乙酰胺(dmac)、二甲基甲酰胺(dmf)、环状亚砜、癸基甲基亚砜、二甲基亚砜和2-羟基十一烷基甲基亚砜。
[0103]
乙二醇渗透增强剂
麦芽吡喃糖苷;n-十二烷基-p-d-吡喃葡萄糖苷;n-十二烷基-p-d-麦芽糖苷;庚酰基-n-甲基葡糖酰胺;n-庚基-p-d-吡喃葡萄糖苷;n-庚基-p-d-硫代葡萄糖苷;n-己基-p-d-吡喃葡萄糖苷;壬酰基-n-甲基葡糖酰胺;n-酰基-p-d-吡喃葡萄糖苷;辛酰基-n-甲基葡糖酰胺;n-辛基-p-d-吡喃葡萄糖苷;辛基-对-d-硫代吡喃葡萄糖苷;等等。
[0110]
许多聚合乳化剂诸如泊洛沙姆和纤维素赋形剂也起胶凝剂的作用。凝胶是半固体的三维聚合物基质,其包括分散在相对大量液体中的少量固体但具有更像固体的特性。凝胶表现出固态的机械性能特征,分散组分和分散介质都在整个系统中连续延伸。凝胶通常是由于其不引人注目而受到患者的青睐的透明或半透明的半固体制剂。局部凝胶制剂为药物提供了合适的递送系统,因为与乳膏和软膏相比,它们不太油腻且提供了更好的应用性能和稳定性。
[0111]
其他成分
[0112]
在某些实施方式中,组合物还可以包括一种或多种添加剂或其组合,包括但不限于:湿润剂;质地增强剂;湿度调节器;ph调节剂;渗透压调节剂;uv-a和uv-b屏蔽剂;和抗氧化剂。例如,抗氧化剂可以是α-生育酚、丁基化羟基茴香醚或丁基化羟基甲苯、超氧化物歧化酶、泛醇或某些金属螯合剂。本领域技术人员将能够选择添加到这些组合物中的任选化合物,使得与本公开固有相关联的有利性质不会或基本上不会受到预期添加的不利影响。
[0113]
此外,组合物还可以包括一种或多种附加活性剂,诸如抗组胺药;皮质类固醇、局部麻醉剂、局部止痛剂和抗生素。在各种实施方式中,抗组胺药可以是盐酸苯海拉明或马来酸氯苯那敏;皮质类固醇可以是氢化可的松、氢化可的松-21-单酯(诸如氢化可的松-21-乙酸酯、氢化可的松-21-丁酸酯、氢化可的松-21-丙酸酯、氢化可的松-21-戊酸酯等)和氢化可的松-17,21-二酯(诸如氢化可的松-17,21-二乙酸酯、氢化可的松-17-乙酸酯-21-丁酸酯、氢化可的松-17,21-二丁酸酯)、地塞米松、氟米松、泼尼松龙、甲基强的松龙、丙酸氯倍他索、苯甲酸倍他米松、二丙酸倍他米松、二醋酸二氟米松、氟轻松、糠酸莫米松或曲安奈德;局部麻醉剂可以是苯佐卡因、利多卡因、丙胺卡因和地布卡因;局部止痛剂可以是1-薄荷醇、d,1-樟脑或辣椒素。
[0114]
本公开的优选实施例:
[0115]
1.一种局部环氧合酶(cox)抑制剂制剂,所述局部环氧合酶(cox)抑制剂制剂包括
[0116]
抑制人cox-1、人cox-2或同时抑制人cox-1和人cox-2的一种或多种cox抑制剂;
[0117]
约1.0至约15.0重量%的长链单不饱和脂肪酸、长链单不饱和脂肪醇、萜烯或其组合;
[0118]
0至约5.0重量%的泊洛沙姆;
[0119]
1.0至约5.0重量%的药学上可接受的纤维素赋形剂;
[0120]
包括乙醇、丙二醇、2-(2-乙氧基乙氧基)乙醇和任选的二甲基亚砜的溶剂混合物;并且
[0121]
其中所述制剂包括约5.0重量%或更少的水。
[0122]
2.根据实施方式1所述的局部cox抑制剂制剂,其中所述制剂包括cox抑制剂,所述cox抑制剂选自萘普生、对乙酰氨基酚、苄达明、丁苯羟酸、双氯芬酸、依托芬那酯、氟芬那酸、布洛芬、吲哚美辛、酮洛芬、水杨酸、水杨苷、二氟尼柳、水杨酸镁和水杨酸胆碱。
[0123]
3.根据实施方式2所述的局部cox抑制剂制剂,其中所述制剂中存在的所述一种或
多种cox抑制剂由双氯芬酸组成。
[0124]
4.根据实施方式3所述的局部cox抑制剂制剂,其中所述制剂包括约1.0至约2.5重量%的双氯芬酸。
[0125]
5.根据实施方式4所述的局部cox抑制剂制剂,其中所述制剂提供至少约7%的双氯芬酸的经皮吸收。
[0126]
6.根据实施方式5所述的局部cox抑制剂制剂,其中所述制剂提供至少约10%的双氯芬酸的经皮吸收。
[0127]
7.根据实施方式1-6中任一项所述的局部cox抑制剂制剂,其中所述制剂包括约1.0重量%或更少的水。
[0128]
8.根据实施方式7所述的局部cox抑制剂制剂,其中所述制剂是无水的。
[0129]
9.根据实施方式1-8中任一项所述的局部cox抑制剂制剂,其中所述制剂包括约25.0至约50.0重量%的乙醇、约2.0至约12.5重量%的丙二醇、约0至约25.0重量%的二甲基亚砜和约20.0至约49.9重量%的2-(2-乙氧基乙氧基)乙醇;并且其中所述溶剂混合物占所述制剂的约70.0至约95.0重量%。
[0130]
10.根据实施方式1-9中任一项所述的局部cox抑制剂制剂,其中所述制剂包括约1.0至约10.0重量%的长链单不饱和脂肪酸、长链单不饱和醇或其混合物。
[0131]
11.根据实施方式1-10中任一项所述的局部cox抑制剂制剂,其中所述制剂中存在的所述长链单不饱和脂肪酸、长链单不饱和醇或其混合物包括或由油酸、油醇或其混合物组成。
[0132]
12.根据实施方式1-11中任一项所述的局部cox抑制剂制剂,其中所述制剂包括泊洛沙姆,所述泊洛沙姆选自由泊洛沙姆-101、泊洛沙姆-105、泊洛沙姆-105苯甲酸酯、泊洛沙姆-108、泊洛沙姆-122、泊洛沙姆-123、泊洛沙姆-124、泊洛沙姆-181、泊洛沙姆-182、泊洛沙姆-182二苯甲酸酯、泊洛沙姆-183、泊洛沙姆-184、泊洛沙姆-185、泊洛沙姆-188、泊洛沙姆-212、泊洛沙姆-215、泊洛沙姆-217、泊洛沙姆-231、泊洛沙姆-234、泊洛沙姆-235、泊洛沙姆-237、泊洛沙姆-238、泊洛沙姆-282、泊洛沙姆-284、泊洛沙姆-288、泊洛沙姆-331、泊洛沙姆-333、泊洛沙姆-334、泊洛沙姆-335、泊洛沙姆-338、泊洛沙姆-401、泊洛沙姆-402、泊洛沙姆-403和泊洛沙姆-407组成的组。
[0133]
13.根据实施方式12所述的局部cox抑制剂制剂,其中所述制剂包括0至约5.0重量%的泊洛沙姆-188。
[0134]
14.根据实施方式1-11中任一项所述的局部cox抑制剂制剂,其中所述制剂包括药学上可接受的纤维素赋形剂,所述药学上可接受的纤维素赋形剂选自由羟丙基纤维素、羟丙基甲基纤维素、羧甲基纤维素、甲基纤维素、乙基纤维素、羟乙基纤维素、羟乙基甲基纤维素和乙基羟乙基纤维素组成的组。
[0135]
15.根据实施方式14所述的局部cox抑制剂制剂,其中所述制剂包括约1.0至约5.0重量%的羟丙基纤维素。
[0136]
16.根据实施方式1所述的局部cox抑制剂制剂,其中所述制剂包括:约1.0至约2.5重量%的双氯芬酸;
[0137]
约1.0至约10.0重量%的油酸、油醇或其混合物;
[0138]
0至约5.0重量%的泊洛沙姆;
[0139]
约2.0至约5.0重量%的羟丙基纤维素;
[0140]
包括乙醇、丙二醇、二甲基亚砜和2-(2-乙氧基乙氧基)乙醇的无水溶剂混合物,
[0141]
其中所述制剂包括约25.0至约50.0重量%的乙醇、约2.0至约12.5重量%的丙二醇、约15.0至约25.0重量%的二甲基亚砜和约20.0至约49.9重量%的2-(2-乙氧基乙氧基)乙醇;并且其中所述溶剂混合物占所述制剂的约70.0至约95.0重量%。
[0142]
17.根据实施方式1所述的局部cox抑制剂制剂,其中所述制剂是无水的,且包含或由以下组成:
[0143]
约2.0重量%的双氯芬酸;
[0144]
约27.0重量%的乙醇;
[0145]
约8.0重量%的油酸、油醇或其混合物;
[0146]
约0.5重量%的泊洛沙姆188;
[0147]
约11.0重量%的丙二醇;
[0148]
约3.0重量%的羟丙基纤维素;
[0149]
约21.0重量%的二甲基亚砜;和
[0150]
约25.0重量%的2-(2-乙氧基乙氧基)乙醇。
[0151]
18.根据实施方式1所述的局部cox抑制剂制剂,其中所述制剂是无水的,且包含或由以下组成:
[0152]
约2.0重量%的双氯芬酸;
[0153]
约43.5%的乙醇;
[0154]
约4.0重量%的油酸、油醇或其混合物;
[0155]
0重量%的泊洛沙姆188;
[0156]
约3.0重量%的丙二醇;
[0157]
约3.0重量%的羟丙基纤维素;
[0158]
约20.0重量%的二甲基亚砜;和
[0159]
约24.5重量%的2-(2-乙氧基乙氧基)乙醇。
[0160]
19.根据实施方式1所述的局部cox抑制剂制剂,其中所述制剂是无水的,且包含或由以下组成:
[0161]
约2.0重量%的双氯芬酸;
[0162]
约37.5%的乙醇;
[0163]
约2.0重量%的油酸、油醇或其混合物;
[0164]
0重量%的泊洛沙姆188;
[0165]
约11.0重量%的丙二醇;
[0166]
约3.0重量%的羟丙基纤维素;
[0167]
约20.0重量%的二甲基亚砜;和
[0168]
约24.5重量%的2-(2-乙氧基乙氧基)乙醇。
[0169]
20.根据实施方式1所述的局部cox抑制剂制剂,其中所述制剂是无水的,且包含或由以下组成:
[0170]
约2.0重量%的双氯芬酸;
[0171]
约31.5%的乙醇;
[0172]
约8.0重量%的油酸、油醇或其混合物;
[0173]
0重量%的泊洛沙姆188;
[0174]
约11.0重量%的丙二醇;
[0175]
约3.0重量%的羟丙基纤维素;
[0176]
约20.0重量%的二甲基亚砜;和
[0177]
约24.5重量%的2-(2-乙氧基乙氧基)乙醇。
[0178]
21.一种局部治疗人体某一部位疼痛发作的方法,所述方法包括将根据实施方式1-20中任一项所述的局部cox抑制剂制剂局部地应用于所述部位。
[0179]
22.根据实施方式21所述的方法,其中所述疼痛发作是急性疼痛发作。
[0180]
23.根据实施方式21所述的方法,其中所述疼痛发作是慢性疼痛发作。
[0181]
24.一种局部地治疗膝盖的骨关节炎的疼痛的方法,所述方法包括将根据实施方式1-20中任一项所述的局部cox抑制剂制剂局部地应用于所述膝盖。
[0182]
25.根据实施方式21-24中任一项所述的方法,其中所述cox抑制剂为双氯芬酸,并且双氯芬酸的局部剂量为约80mg或更少。
[0183]
26.根据实施方式25所述的方法,其中双氯芬酸的局部剂量为约80mg、约40mg、约30mg、约20mg或约10mg。
[0184]
27.根据实施方式21-26中任一项所述的方法,其中所述局部cox抑制剂制剂包括约2重量%的双氯芬酸。
[0185]
实施例
[0186]
以下实施例用于说明本公开。这些实施例决不是为了限制本公开的范围。
[0187]
实施例1:局部双氯芬酸制剂
[0188]
材料:
[0189]
dmso,cas编号:67-68-5
[0190]
油酸,cas编号112-80-1
[0191]
trascutol(二甘醇单乙醚;2-(2-乙氧基乙氧基)乙醇),cas编号111-90-0
[0192]
乙醇,200标准,无水,cas编号64-17-5
[0193]
泊洛沙姆188,cas编号9003-11-6
[0194]
1,2-丙二醇,cas编号:57-55-6
[0195]
klucel
tm
gf pharm(羟丙基纤维素(hpc),cas编号:9004-64-2)
[0196]
双氯芬酸钠(2-[(2,6-二氯苯基)氨基]苯乙酸钠盐),cas编号:15307-79-6
[0197]
用于制备2%双氯芬酸制剂的方法:
[0198]
将油酸加热至60℃,然后将泊洛沙姆188混合并溶解在油酸中。
[0199]
在20℃下,将丙二醇加入到dmso,同时混合。向混合物中缓慢加入羟丙基纤维素。混合1小时。
[0200]
将transcutol加热至60
°
,并将双氯芬酸钠溶解在transcutol中。
[0201]
混合时,将transcutol/双氯芬酸钠加入到dmso/丙二醇。与油酸/泊洛沙姆188混合,然后加入乙醇并混合至均匀。
[0202]
不含泊洛沙姆188的可替换方法:
[0203]
在20℃下,将丙二醇加入到dmso,同时混合。
[0204]
在20℃下,将双氯芬酸钠溶解在transcutol中。
[0205]
混合时,将transcutol/双氯芬酸钠加入到dmso/丙二醇。向混合物中缓慢加入羟丙基纤维素。然后加入乙醇并混合至均匀。加入油酸并混合至均匀。
[0206]
本公开的示例性制剂(重量%)
[0207]
双氯芬酸钠1.8-2.2重量%
[0208]
dmso 18.0-22.0重量%
[0209]
transcutol 15.0-25.0%
[0210]
丙二醇10.0-12.0重量%
[0211]
乙醇25.0-40.0重量%
[0212]
羟丙基纤维素2.7-3.3重量%
[0213]
泊洛沙姆p188 0.0-3.0重量%
[0214]
油酸7.0-9.0重量%
[0215]
实施例2.渗透测试
[0216]
franz扩散池实验用于分析本公开教导的组合物中双氯芬酸穿过人体皮肤的流速。参见,例如,bartosova and bajgar,transdermal drug delivery in vitro using diffusion cells,curr.med.chem.2012,19:4671-4677。
[0217]
在本文描述的实施例中,使用了具有3.3ml受体孔体积的franz扩散池(“fdc”),其具有猪皮肤或人尸体皮肤。对于人尸体皮肤,从allosource(centennial,co)或skin bank new york fireworks(纽约,ny)获得分裂厚度的人尸体皮肤(0.015
″‑
0.018
″
)。皮肤组织由组织库制成厚约250μm的皮肤组织,并在干冰上冷冻运输。从尸体皮肤供应商处获得的关于组织来源、供体信息、身体部位、组织状况和接收前储存期限的所有信息都保存在研究文件中。收到供体皮肤后,皮肤片在使用前储存在-20℃。使用前,从冰箱中取出皮肤片,并在环境温度下完全解冻。
[0218]
供体孔处理约0.55cm2的皮肤面积。受体孔填充有含0.01%叠氮化钠的pbs(“受体流体”),已证实这种流体在整个实验中提供下沉条件。fdc的受体孔在搅拌干块中保持在37℃(皮肤表面的温度为32℃
±
0.5℃),同时使用磁力搅拌棒连续搅拌受体孔中的受体流体。使用夹紧钳在均匀压力下将供体和受体室夹在皮肤片周围。
[0219]
在组装fdc后,让皮肤与受体流体接触20分钟进行水合。丢弃在此时间段期间任何有泄漏迹象的fdc。
[0220]
在应用测试制剂之前,通过测量氚水的透皮通量或透皮电阻(“teer”)来测试每个皮肤片的完整性和质量(通常不在猪皮肤片上测试皮肤完整性)。如下进行teer测量。将150μl的pbs的等分试样引入每个fdc供体孔中。10分钟后,将钝头电极探针放入供体孔中,在其自身重量的作用下轻轻停留在皮肤表面。然后通过fdc的受体室上的取样口将第二个电极插入受体流体中。使用波形发生器在皮肤上应用在100hz下具有100mv均方根(rms)的交流(ac)信号,然后使用数字万用表测量阻抗,结果以kω为单位进行记录。丢弃任何显示异常低阻抗(标称值《2kω)的fdc,并根据测得的阻抗读数大小对fdc进行排序。然后将供试品分配到该批fdc,使得每个供试品的复本都被应用到平均透皮电阻值几乎相等的皮肤片。
[0221]
在膜完整性测试完成且细胞被适当分类后,将测试物品的样品应用到皮肤的角质层。研究采用一次性给药方案。在典型的总共约36个fdc的批次中检查测试制剂中的每一者
的六个复本。
[0222]
使用nichiryo正排量移液器应用剂量。剂量从移液器分配到皮肤,并使用玻璃棒的钝端在表面上铺开。对于大多数实验,典型的吸入剂量是每个细胞10ml制剂。制剂本身典型地以1wt%制成。假设应用到皮肤的剂量为10ml,在展开制剂时玻璃棒没有损失,制剂中活性物质的重量百分比为1%,制剂的比重为1.0,每个细胞的表面积为0.55cm2,那么每个fdc的双氯芬酸剂量为约181.8mg/cm2。
[0223]
在预设时间,典型地是24小时,从每个受体孔中抽取样品。使用带刻度的hamilton型注射器,在24小时时从每个fdc的取样口抽取300μl等分试样。将每个抽取的等分试样引入到96孔微量滴定板的孔中。在hplc分析之前,样品储存在4-8℃的冰箱中。在收集的5天内分析样本。
[0224]
在24小时时,用透明胶带将皮肤胶带剥离三次,每次胶带剥离都包括用轻微的压力将一片透明胶带应用到皮肤并剥离胶带,从而系统地去除角质层的最上层。丢弃胶带。
[0225]
胶带剥离完成后,用一对刮刀将剩余的皮肤分成表皮和真皮部分。如果需要,将皮肤放在设定为60℃的热板上一分钟,以帮助促进皮肤的分离。然后将表皮和真皮部分分别放入玻璃瓶中,向其中加入3ml的dmso。然后在温和搅拌下,将皮肤片在40℃温育24小时。24小时温育期后,收集样品。
[0226]
然后,使用chemstation软件通过经验证的hplc方法分析从受体孔和皮肤提取物中抽取的样品。记录双氯芬酸的auc,并使用从校准标准的auc值和已知浓度值得到的校准曲线将双氯芬酸的auc转换成mg/ml值。这些mg/ml值被导入到研究结果excel工作簿中。然后将这些浓度乘以受体体积(3.3ml)或皮肤提取体积(3ml),然后除以暴露于受体流体的皮肤表面积(0.55cm2),得到单位为mg/cm2的最终累积量。在每种情况下,分析并报告活性物质的浓度。
[0227]
测试的制剂(表1)
[0228][0229]
图1描绘了表1中2%双氯芬酸制剂的皮肤渗透通量数据,而图2描绘了表1中2%双氯芬酸制剂的皮肤渗透递送剂量数据。
[0230]
实施例3:
[0231]
从制剂d32推断,通过相同的方法检测含有减少量的dmso和增加量的transcutol的其他制剂。
[0232]
测试的制剂(表2):
[0233][0234]
图3、图4和图5描绘了作为递送的透皮剂量、保留在皮肤中的剂量和计算为双氯芬酸递送百分比的pennsaid和制剂d34的头对头比较。可以看出,与pennsaid相比,制剂d34透皮递送的双氯芬酸比pennsaid明显更多,而pennsaid在表皮和真皮中保留的量更大。在48小时时,制剂d34中双氯芬酸的透皮递送百分比大于15%。
[0235]
图6示出了这两种制剂的双氯芬酸通量随时间的变化。在应用后12小时内观察到双氯芬酸的最大流量。
[0236]
实施例4:
[0237]
改变油酸、丙二醇和乙醇的量的其他制剂通过相同的方法进行检测。
[0238]
测试的制剂(表3):
[0239][0240]
图7描绘了表1中2%双氯芬酸制剂的皮肤渗透递送剂量数据,而图8描绘了表1中2%双氯芬酸制剂的皮肤渗透通量数据。如图所示,这些制剂可以递送与制剂d1c等量的双氯芬酸,而dmso显著减少,并且所施用的制剂量低得多。
[0241]
实施例5:
[0242]
通过相同的方法检测改变transcutol和乙醇的量的其他制剂。
[0243]
测试的制剂(表4):
[0244][0245]
图9、10和11描绘了作为递送的透皮剂量、保留在皮肤中的剂量和计算为双氯芬酸递送百分比的pennsaid和制剂d34的头对头比较。
[0246]
实施例6:
[0247]
通过相同的方法检测改变油酸、丙二醇和乙醇的量的其他制剂。
[0248]
测试的制剂(表5):
[0249][0250]
在这组制剂中,油酸浓度从8.0%的高浓度下降到2.0%。测试数据开始改变剂量,从pennsaid的6μl到制剂的3μl。这是显示在1/2该剂量时制剂具有更好渗透性的数据。在制剂d56的第二数据组中,使用第二剂量6μl的pennsaid和3μl的制剂d56来模拟第二次应用。所有数据集的对照是实际的pennsaid产品。参见图12和图13。
[0251]
在图12中,柱1:pennsaid 2%双氯芬酸,dc1对照,剂量6μl;柱2:2%双氯芬酸d51,剂量-3μl;柱3:2%双氯芬酸d52,剂量-3μl;柱4:2%双氯芬酸d53,剂量-3μl;柱4,2%双氯芬酸d53;柱5:2%双氯芬酸d54;柱6:2%双氯芬酸d55。
[0252]
在图13中,臂#1:dic pennsaid,剂量6μl;臂#2:d56,剂量6μl;臂#3:d56,剂量3μl;臂#4:d1c pennsaid在24小时时再应用6μl剂量;臂#4:d56在24小时时再应用3μl剂量。
[0253]
尸体皮肤渗透数据显示pennsaid(6μl剂量)和制剂d56(3μl剂量)产品中的2%双氯芬酸渗透到表皮和真皮中,并渗透穿过尸体皮肤样品。以下计算显示了这些制剂在48小时后保留在每cm2皮肤表面上的双氯芬酸钠的量。如图所示,与制剂d56相比,pennsaid产品在皮肤表面/cm2上残留的双氯芬酸钠几乎多7倍,对于局部处方药,这可能是重复每日给药的消费者所担心的。
[0254][0255]
实施例7:
[0256]
通过相同的方法检测改变油酸、丙二醇和乙醇的量的其他制剂。
[0257][0258]
在这些制剂中,制剂中没有添加油酸。在制剂d58中,加入4.0%的甘油。在制剂d59中,油醇的加入量为4.0%。
[0259]
在制剂中没有油酸的情况下,双氯芬酸的渗透显著降低到渗透小于pennsaid的程度。油酸和油醇增强双氯芬酸的渗透。
[0260]
在图14中,臂#1:dic pennsaid;臂#2:d57;臂#3:d58;臂#4:d59。
[0261]
实施例8:出版物
[0262]
以下出版物的全部内容通过引入并入本文。
[0263]
mcpherson and cimino,topical nsaid formulations,pain medicine,volume 14,issue suppl_1,december 2013,pages s35
–
s39,doi.org/10.1111/pme.12288
[0264]
wo2009081217
[0265]
wo2016033308
[0266]
wo2017173269
[0267]
us 9101591
[0268]
本领域的技术人员容易认识到,本公开非常适于实现这些目的并获得所提及的目的和优点,以及其中固有的那些目的和优点。本文提供的实施例是优选实施方式的代表,是示范性的,并且不旨在限制本公开的范围。
[0269]
对于本领域技术人员来说,显而易见的是,在不脱离本公开的范围和精神的情况下,可以对本文公开的内容进行各种替换和修改。
[0270]
说明书中提到的所有专利和出版物表明了本公开所属领域的普通技术人员的水平。所有专利和出版物通过引用并入本文,其程度如同每个单独的出版物被具体且单独地指出通过引用而并入。
[0271]
本文说明性描述的本公开可以在没有本文没有具体公开的任何一个或多个元素、一个或多个限制的情况下适当地实践。因此,例如,在本文的每个实例中,术语“包括”、“基本上由
……
组成”和“由
……
组成”中的任何一者都可以用其他两个术语中的任何一者来代替。已经采用的术语和表达用作描述性术语而非限制性术语,并且在使用这些术语和表达时,并不意图排除所示出和描述的特征或其部分的任何等同物,而是应当意识到,在所要求保护的本公开的范围内,各种修改是可能的。因此,应该理解,尽管本公开已经通过优选实施方式和任选特征具体地公开了,但是本领域技术人员可以对本文公开的概念进行修改和变型,并且这样的修改和变型被认为在由所附权利要求书限定的本公开的范围内。
[0272]
在下面的权利要求书中阐述了其他实施例。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。