多孔pt纳米花负载乳酸氧化酶的纳米制剂及其制备和应用
技术领域
1.本发明涉及药物制剂领域,具体涉及一种多孔pt纳米花负载乳酸氧化酶的纳米制剂及其制备方法和应用。
背景技术:
2.乳腺癌是全球女性最常见的恶性肿瘤之一,其发病率和死亡率逐年上升,并呈现年轻化趋势。目前,放射治疗(放疗)作为局部晚期乳腺癌的临床标准疗法之一,约70%的乳腺癌患者需接受放疗,这归因于放疗过程中具有强组织穿透力的高能离子辐射可直接离子化深部肿瘤细胞核dna,或者通过组织细胞中水和有机物的辐射分解产生多种活性氧物质增强dna损伤,从而有效杀伤肿瘤细胞。然而,当前的肿瘤放疗研究仍面临着较大的挑战。一方面是大多数实体肿瘤存在乏氧特征、乏氧肿瘤细胞对射线不敏感易造成辐射抵抗;另一方面是放疗过程中弥散的高能辐射易损伤瘤旁正常组织和细胞,导致放疗毒性。此外由于人体辐射耐受剂量受限,单一小剂量放疗的效果时常不佳,而当前临床常用的小分子放疗增敏药物也存在血液半衰期较短,缺乏一定肿瘤特异性等不足。因此,构建既能显著提高放疗效果,又能降低放疗毒性的新型肿瘤靶向协同的放疗增敏策略,仍是恶性肿瘤放疗研究的热点和难点,具有重要的研究意义。
3.近年来,研究者们提出了一系列物理、化学和生物手段,用于实现肿瘤的放疗增敏。其中,以含高原子序数的金、铂、钆等金属元素为基础构建的金属放疗增敏剂凭借其较强的x射线吸收能力,可有效沉积辐射,提高到达肿瘤部位的辐射剂量,并且在溶酶体的酸性环境中可逐渐降解成离子状态后经肾脏排泄,展现出良好的生物安全性,因此备受关注。此类金属放疗增敏剂到达肿瘤部位后,通过沉积辐射能量可有效降低弥散的高能辐射对瘤旁组织产生的非特异性损伤,同时沉积的辐射能量在缓慢释放过程中可直接离子化细胞,或通过光电效应和康普顿效应释放出光电子、康普顿电子或俄歇电子等二次电子,与肿瘤组织细胞中有机物和水反应生成ros,进一步损伤细胞核dna,最终达到实现放疗增敏与保护瘤旁组织的“双赢”局面。此外,研究表明金属pt离子可与细胞核dna结合形成dna-pt配合物,可抑制dna复制过程,具有铂类化疗药物的抗肿瘤潜能,这也成为pt基放疗增敏剂的独特优势。
4.然而,肿瘤组织存在10%-50%的乏氧肿瘤细胞,研究发现乏氧肿瘤细胞对射线的敏感性比足氧细胞显著下降约三倍,更易产生辐射抵抗,影响放疗效果。因此,改善肿瘤乏氧状态有望成为肿瘤放疗增敏研究的一个重要“突破口”。与正常组织不同,肿瘤微环境具有高h2o2水平特性,究其原因可能是超氧化物歧化酶过量生成,催化超氧阴离子自由基转化为大量的h2o2。由于酶在底物催化中的高选择性和高效率,典型的酶包被纳米驱动剂(如过氧化氢酶、脲酶和己糖激酶)已经产生,并在体外表现出正向趋化作用。它们可以随底物浓度梯度向特定的方向运动,这是由有效底物催化由热力学驱动力持续转化为系统化学势所驱动的。然而,针对肿瘤微环境(tme)的特定特征,体内底物梯度诱导酶趋化尚未得到很好的开发,这将为开发“智能”给药系统,特别是促进药物的深度渗透提供一个有前景的策略。
5.近年来,已有研究者设计不同载体携载过氧化氢酶达到肿瘤部位,实现原位催化h2o2产氧以改善肿瘤乏氧微环境。但与过氧化氢酶这类天然酶相比,金属“h2o2纳米酶”的性质更加稳定且合成工艺简单,同时具有和天然酶相似的催化h2o2产氧性能。其中,金属pt基“h2o2纳米酶”具有辐射沉积和催化h2o2产氧的双重特性,有望发挥更强的放疗增敏作用。同时,研究表明肿瘤微环境不仅存在乏氧和高h2o2水平特性,也具备高乳酸水平特性。肿瘤细胞在快速增殖过程中,通过葡萄糖和谷氨酰胺的积极代谢来应对缺氧,从而产生大量的乳酸,因此高水平的乳酸是tme的另一个标志。值得注意的是,更严重的氧缺乏是由扩散到实体肿瘤中心的减少引起的,特别是在离血管较远的地方,在那里厌氧和有氧糖酵解被大大促进产生更多的乳酸。乳酸氧化酶能够高效催化降解乳酸,而生成的efmnh2-pyruvate复合体极不稳定,当pyruvate从复合体上分离后,还原型中间体efmnh2易分解生成h2o2。这将为金属pt基“h2o2纳米酶”的催化产氧过程进一步提供“燃料”,有利于增强改善肿瘤乏氧状态。同时h2o2作为一类活性氧物质,其浓度的提高也将促进对肿瘤细胞的损伤。此外,越来越多的研究证实乳酸不仅仅是一种代谢废物,也是一类能够促进肿瘤进程的生物分子,因此降低肿瘤组织的乳酸水平,也有利于抑制肿瘤的发展。目前对乳酸梯度诱导的正向趋化作用的研究还不多,乳酸梯度诱导的正向趋化作用在体外和体内都有待于实现和揭示。因此,我们提出了乳酸氧化酶(lox)修饰纳米平台的想法,在乳酸梯度驱动的正向趋化作用的指导下,促进肿瘤的深度渗透。此外,长期以来,乳酸一直被认为是一种“代谢废物”,但目前已清楚,乳酸在促进肿瘤增殖、转移和耐药等方面发挥着重要作用。因此,通过乳酸自耗或lox催化转化为h2o2降低瘤内乳酸水平可进一步抑制肿瘤的发展。
技术实现要素:
6.本发明提供了一种新型多功能靶向放化疗增敏的多孔pt纳米花负载乳酸氧化酶的纳米制剂。为克服单一小剂量放疗效果的不足,构建放疗联合的协同治疗策略,通过纳米制剂表面peg化使其具备体内长循环特性,并通过增强渗透与滞留效应,达到肿瘤被动靶向的效果。
7.一种多孔pt纳米花负载乳酸氧化酶的纳米制剂,以多孔pt纳米花为载体携载化疗药物,同时共载乳酸氧化酶,并包被crdg修饰的脂质体膜。
8.本发明以正向趋化作用促进深度穿透和彻底缓解缺氧为重点,构建了一种新型乳酸驱动的多功能纳米放射增感剂,具有自氧和正向趋化作用。利用具有良好沉积辐射和类过氧化氢酶活性的多孔pt纳米花作为载体负载阿霉素(dox)等化疗药物,通过静电吸附法制备lox修饰后,再包被crgd修饰脂质体膜。首次证实并充分利用了体外和体内对乳酸水平梯度响应的乳酸驱动正向趋化作用,显示出其在高乳酸水平肿瘤部位的深部中心的最佳效果。最终,增强的放射增敏作用实现了更深的穿透,彻底的缺氧缓解,通过沉积pt纳米花放射增加肿瘤内x射线剂量,以及ph反应化疗协同作用。因此,这种乳酸驱动的自氧和正趋化纳米放射增敏剂为肿瘤放射增敏增强提供了一种有前途的策略。
9.本发明首次探讨了乳酸作为底物的、乳酸氧化酶的趋化特性。并首次将其应用于促进药物的瘤内渗透。同时进一步引入靶向环状rgd肽(crgd),利用其与新生血管内皮细胞以及恶性肿瘤细胞表面高度表达的整合素αvβ3受体之间的高亲和力及强特异性,实现epr被动靶向与crgd主动靶向的双重靶向效应,有望进一步提高纳米制剂的肿瘤靶向能力。
10.本发明的纳米制剂以pt元素为基础构建的金属放疗增敏剂,具备良好的辐射沉积能力与催化h2o2产氧性能的多孔pt纳米花,以多孔pt纳米花作为递送载体,构建“放疗-化疗”协同治疗策略,以多孔pt纳米花共载dox与lox,并包被crgd修饰的脂质体膜,构建新型的多功能靶向放化疗增敏剂。
11.化疗药物可选自盐酸阿霉素、博来霉素、佐柔比星、表柔比星、柔红霉素、喜树碱、紫杉醇中的至少一种,通过抑制细胞dna复制、rna转录以及产生大量ros,导致脂质过氧化、dna损伤或烷基化。
12.本发明通过微流控装置研究发现了乳酸氧化酶-乳酸底物的趋化特性,并将该乳酸氧化酶-乳酸底物趋化性用于药物的体内递送。由于肿瘤组织中高水平的乳酸浓度,所述的多孔pt纳米花,由于纳米粒表面lox的修饰,可用于促进药物的肿瘤组织内渗透。
13.多孔pt纳米花表面peg化修饰,具备良好的辐射沉积能力与催化过氧化氢产氧性能的,实现放疗增敏的目的。
14.乳酸氧化酶通过表面修饰聚丙烯胺盐酸(pah)进行正电子化,增强静电吸附作用进行负载,利用乳酸氧化酶-乳酸底物趋化性实现药物瘤内渗透。
15.所述纳米制剂中,pt、化疗药物(如阿霉素等)、乳酸氧化酶和crdg修饰的脂质体膜的质量比为1~4:1~4:0.0025~0.1:6~12。
16.本发明还提供了所述的纳米制剂的制备方法,包括步骤:
17.(1)通过物理搅拌及静电吸附在多孔pt纳米花上负载化疗药物,制备pt/化疗药物;
18.(2)将pt/化疗药物与聚丙烯胺盐酸溶液混合搅拌以转变表面的带电性,离心、沉淀经去离子水洗后分散于去离子水中,获得带正电的pt/化疗药物,随后加入乳酸氧化酶,搅拌、离心、沉淀经去离子水洗后分散于去离子水中,得到共载化疗药物和乳酸氧化酶的多孔pt纳米花;
19.(3)通过薄膜分散法制备crgd修饰的脂质体,经液氮反复冻融与离心提取crgd修饰的脂质体膜;
20.(4)将共载化疗药物和乳酸氧化酶的多孔pt纳米花和crgd修饰的脂质体膜于水中混合搅拌,冰浴超声,获得所述多孔pt纳米花负载乳酸氧化酶的纳米制剂。
21.在一优选例中,本发明的多孔pt纳米花为利用超声化学还原、hno3硝蚀以及表面peg化修饰合成的多孔pt纳米花,具体包括步骤:
22.(i)称取普郎尼克f-127溶解于na2pdcl4、k2ptcl4、h2ptcl6的混合溶液中,调节反应溶液的ph值为酸性,再将抗坏血酸溶液注入上述溶液中,40℃水浴超声反应,产物离心、洗涤、分散于去离子水后冷冻干燥得到铂纳米花粉末;
23.(ii)取铂纳米花粉末和sh-peg5000(分子量为5000的一端由巯基修饰的聚乙二醇)超声重悬于去离子水中,室温搅拌混匀后,产物离心、洗涤、分散于去离子水中经冷冻干燥得到peg修饰的铂纳米花;
24.(iii)上述peg修饰的铂纳米花分散于hno3浓度不低于35wt%的浓硝酸中,室温搅拌充分溶解pd物种后,产物离心、洗涤、分散于去离子水中经冷冻干燥得到peg修饰的多孔pt纳米花。
25.在一优选例中,步骤(3)具体为:取磷脂、胆固醇和dspe(二硬脂酰基磷脂酰乙醇
胺)-peg(聚乙二醇)-crgd溶解有机溶剂中,旋转蒸发得到均匀的脂质薄膜,加入去离子水充分水化并使用冰浴探头超声得crgd修饰的脂质体,将脂质体经液氮反复冻融离心、沉淀、离心提取即为crgd修饰的脂质体膜。
26.其中,磷脂、胆固醇和dspe-peg-crgd的质量比优选为4~8:1~2:1~2。
27.dspe-peg-crgd可直接购买得到,也可自制。
28.在一优选例中,步骤(4)具体为:将共载化疗药物和乳酸氧化酶的多孔pt纳米花和crgd修饰的脂质体膜按质量比1:2在4℃下于水中混合搅拌30min,冰浴探头超声,超声功率65w,按照3s开、2s关的方式交替进行,共进行3min,获得所述多孔pt纳米花负载乳酸氧化酶的纳米制剂。
29.本发明还提供了所述的纳米制剂在制备放化疗联合增敏抗肿瘤药物中的应用。
30.与现有技术相比,本发明具有如下显著的技术效果:
31.1)得到的多孔pt纳米花(pt nfs)负载乳酸氧化酶的纳米制剂,peg修饰pt纳米花具有“金属放疗增敏剂”与“金属h2o2纳米酶”的双重特性,pt nfs可发挥良好的辐射沉积与催化h2o2产氧作用,通过改善肿瘤乏氧状态、提高ros水平以及增强辐射引起的细胞核dna损伤等作用机制,实现小剂量放疗增敏的目的,进一步提高放疗射线对肿瘤细胞的杀伤效果。
32.2)得到的多孔pt纳米花负载乳酸氧化酶的纳米制剂,以多孔pt nfs作为递药载体,通过物理搅拌和静电吸附作用负载化疗药物dox,成功制备了载药制剂pt/dox,发挥了良好的体内外“放疗-化疗”协同抗肿瘤作用,有利于改善小剂量单一放疗效果的不足。球花状的pt/dox,表面负电性减弱,具有良好的载药性能,并在ph 5.0酸性环境中可有效释放dox,具有良好的生物相容性;pt/dox能被肿瘤细胞有效摄取并释放dox入核,联合小剂量放疗可在pt nfs放疗增敏作用的基础上,进一步提高细胞杀伤、增强细胞dna损伤、抑制细胞克隆增殖。
33.3)得到的多孔pt纳米花负载乳酸氧化酶的纳米制剂,具有epr与crgd的双重靶向效应以及肿瘤高h2o2和乳酸水平的双重特性,共载lox后可有效催化降解乳酸并生成h2o2,进一步降低肿瘤hif-1α的表达水平,有利于增强改善肿瘤乏氧状态。
34.4)本发明首次探讨了乳酸作为底物的、乳酸氧化酶的趋化特性,并首次将其应用于促进药物的瘤内渗透。揭示一种新型的以乳酸作为底物的酶趋化策略,扩大了纳米载体在抗肿瘤药物渗透中的应用。
附图说明
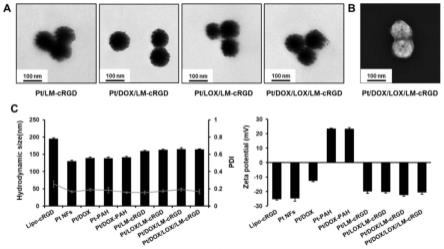
35.图1中,a为透射电镜照片,标尺:100nm;b为扫描电镜照片,标尺:100nm;c为平均水合粒径和zeta电位图;
36.图2为溶血实验结果;
37.图3中,a为乳酸的标准曲线;b展示了溶液层面的乳酸水平;c展示了肿瘤细胞培养液的乳酸水平;d展示了肿瘤组织的乳酸水平;
38.图4中,a展示了通过dls法验证lox修饰的pt nfs在乳酸条件下静置2min后的扩散增强;b为三入口一出口微流控装置示意图,尺寸为4cm(l)
×
360μm(w)
×
100μm(h),通过每个入口的典型流量为10μl/min;c为在3分钟可视化视频中pdlr/dii或pdr/dii的dii红色荧光图像;d展示了每个时间点dii荧光带边缘向乳酸通道和pbs通道移动的相对距离;e展示
了利用matlab测量dii荧光带边缘到顶部通道的相对距离;f为注射48h后截面积最大的肿瘤组织切片荧光扫描图像;g展示了采用icp-ms法检测注射48h后瘤内pt元素浓度;h为注射24h后pdlr/did或pdr/did在肿瘤缺氧区(离血管较远)分布的荧光扫描图像;
39.图5中,a为h2o2的标准曲线;b展示了溶液层面的h2o2水平;c展示了肿瘤细胞培养液的h2o2水平;d展示了肿瘤细胞内的h2o2水平,标尺:100μm;e展示了肿瘤组织的h2o2水平;
40.图6中,a展示了与pdl或pdlr孵育1小时后,通过激光共聚焦显微镜研究crgd修饰对促进细胞吸收的作用;b展示了采用cck-8法检测不同制剂联合0gy或5gy放疗24h后缺氧肿瘤细胞的生存能力;c展示了通过calcein am/pi染色评价不同处理后活细胞和死细胞的比例;d展示了采用流式细胞仪分析不同处理后细胞凋亡水平;
41.图7为小动物活体荧光成像技术考察不同时间点的活体荧光分布情况图;
42.图8中,a为体内抑瘤曲线;b展示了各治疗组的肿瘤质量;c为肿瘤组织的h&e染色评价,标尺:50μm;
43.图9中,a为肿瘤组织的ki67免疫组化评价,标尺:20μm;b为肿瘤组织的tunel免疫荧光染色评价,标尺:20μm。
具体实施方式
44.下面结合附图及具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的操作方法,通常按照常规条件,或按照制造厂商所建议的条件。
45.1、多孔pt纳米花pt nfs的制备
46.称取普郎尼克f-127(127mg)溶解于3.6ml混合溶液中(含有0.6ml na2pdcl4(20mm)、1.2ml k2ptcl4(20mm)、1.8ml h2ptcl6(20mm))。加入240μl hcl溶液(6m)调节反应溶液的ph值。再将30ml抗坏血酸(aa)溶液(0.1m)快速注入上述溶液中,40℃水浴超声反应5h。产物15000rpm离心10min,经去离子水和无水乙醇分别洗涤2次后,分散于去离子水后冷冻干燥得到铂纳米花粉末。
47.取一定质量的铂纳米花粉末和sh-peg5000(m:m=1:2)超声重悬于去离子水中,室温搅拌48h,产物15000rpm离心10min,经去离子水洗涤3次后,分散于去离子水中经冷冻干燥得到peg修饰的铂纳米花。
48.上述peg修饰的铂纳米花分散于35wt%浓硝酸中,室温搅拌48h。产物15000rpm离心10min,去离子水洗涤3次后,分散于去离子水中经冷冻干燥得到peg修饰的介孔铂纳米花,提高铂纳米花的孔隙和表面积,有利于其包载药物,以及发挥过氧化氢纳米粒的催化作用。
49.2、双载药纳米花pt/dox的制备
50.将pt nfs(5mg/ml,4ml)与dox
·
hcl溶液(5mg/ml,4ml)混合,搅拌24h,产物15000rpm离心10min,经去离子水洗涤后分散于去离子水中,即得到dox载药铂纳米粒pt/dox,置于4℃保存。
51.将pt nfs(5mg/ml,4ml)与聚丙烯胺盐酸pah溶液(5mg/ml,8ml)混合,搅拌120min,产物15000rpm离心10min,经去离子水洗涤3次后,分散于去离子水中得到带正电的铂纳米粒;将一定量的乳酸氧化酶lox加到上述pah修饰的铂纳米粒中4℃搅拌30min,产物
15000rpm离心10min,经去离子水洗涤后分散于去离子水中,即得到lox载药铂纳米粒pt/lox置于4℃保存。若将pt nfs替换成pt/dox按上述操作进行,即可得到dox和lox双载药no纳米粒pt/dox/lox。
52.3、脂质体膜的提取制备
53.精密称取50mg dmpc(二肉豆蔻酰磷脂酰胆碱),12mg胆固醇和10mg dspe-peg-crgd充分溶解于无水乙醇中。经旋转蒸发得到均匀的薄膜,加入去离子水化得到crgd修饰的脂质体。将dspe-peg-crgd替换为dspe-mpeg可得到普通脂质体。加入0.5mg膜染料did可得到荧光标记的脂质体。将脂质体经液氮速冻和37℃水浴反复冻融10次,经15000rpm离心15min即可得到脂质体膜lm-crgd/did,置于-20℃保存。
54.4、脂膜包被铂纳米粒的制备
55.取pt/dox/lox和上述脂质体膜(质量比1:2)超声重悬于去离子水中,经探头超声(功率65w)冰浴超声3min(3s开、2s关的方式交替进行),即可得到脂质体膜包被的铂纳米粒pt/dox/lox-crgd(pdlr),即所述多孔pt纳米花负载乳酸氧化酶的纳米制剂。
56.应用例1多孔pt纳米花负载乳酸氧化酶的纳米制剂表征研究
57.通过tem和sem观察外观形貌特征;采用dls测定平均水合粒径及zeta电位;采用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,sds-page)进行lox的蛋白条带显影,结合bca蛋白浓度检测法测定lox的负载效率;通过uv/nis进行紫外光谱扫描。
58.结论:表面可清晰观察到一层脂膜外层,粒径约为110nm,结果如图1,pah修饰后的制剂带正电荷,有利于提高与带负电脂膜之间的静电吸附作用。
59.应用例2多孔pt纳米花负载乳酸氧化酶的纳米制剂生物相容性
60.balb/c小白鼠的抗凝全血经4℃,3500rpm离心3min,取血细胞沉淀。用pbs配制50%(v/v)的红细胞悬液,加入不同制剂于37℃静置4h。经4℃,15000rpm离心1min,观察上清液溶血情况并拍照,通过uv/nis检测上清液540nm的吸光度值。以di water组作为阳性对照,视其溶血率为100%。
61.结论:利用uv/nis测定溶血率,将di water组的溶血率作为100%,计算出各制剂组的溶血率均小于4%,如图2,表明所述制剂具有良好的生物相容性,为其体内应用的安全性提供保障。
62.应用例3多孔pt纳米花负载乳酸氧化酶的纳米制剂乳酸催化能力
63.取对数生长期的4t1细胞以每只100万个细胞注射于balb/c小白鼠的右侧第四对乳头皮下,当肿瘤体积约为100cm3时,分别瘤内注射50μlpbs、pt/lm-crgd、free lox、pt/lox/lm-crgd溶液(pt nfs浓度为25mg/kg,lox浓度为0.455mg/kg)。24h后脱颈处死小鼠并取出肿瘤组织,用pbs洗去表面杂质,吸干并精密称重。按照重量(g):体积(ml)=1:5的比例加入预冷的pbs,使用全自动快速研磨仪进行机械匀浆(4℃,65hz,60s,2次),2500rpm,4℃离心10min,吸取100μl组织上清液并使用乳酸检测试剂盒和m5全波段多功能酶标仪测定其在530nm处的吸光度值,代入标准曲线计算乳酸浓度,最终以乳酸浓度与肿瘤质量之比作为评价指标。
64.结论:与对照组相比,所述制剂组的乳酸浓度明显下降(p《0.001),如图3,并与free lox发挥的效果一致。综上表明,lox负载后其催化活性未受影响,使得所述制剂具备
良好的催化降解乳酸能力。
65.应用例4多孔pt纳米花负载乳酸氧化酶的纳米制剂乳酸驱动阳性趋化调查
66.采用dls实验检测不同乳酸水平下plr的扩散率增加情况,在体内评价plr的乳酸驱动阳性趋化性。如图4所示,扩散系数显著升高,且与基质浓度相关,说明基质翻转对这些微粒产生推进作用。此外,通过构建尺寸为4cm(l)
×
360μm(w)
×
100μm(h)的三入口一出口微流控通道,通过荧光显微镜实时观察有无lox修饰的pt nfs的体外正向趋化作用。如图4b所示,底物(乳酸)或缓冲液(pbs)分别通过上通道或下通道,形成乳酸浓度梯度。在3min的可视化视频中,制剂组的dii红色荧光明显向底物通道一侧移动,荧光带增宽,通过量化dii荧光带边缘移动的相对距离和荧光强度剖面向乳酸侧移动的相对距离(图4d和图4e),可以更形象地展示这一点。因此,乳酸氧化酶修饰的pt纳米花明显向乳酸通道移动,支持体外乳酸驱动正向趋化。
67.其次,实体瘤的深中心显示出更多的低氧和快速生长的肿瘤细胞产生的更高水平的乳酸,因此我们分别在静脉注射所述制剂后,研究体内乳酸驱动阳性趋化促进实体瘤深穿透的作用。通过扫描肿瘤组织最大截面积的荧光信号(图4h),该组在乳酸水平较高的肿瘤部位的深部中心处,dox和did的荧光信号更为明显,通过体内乳酸驱动的正向趋化,表现出最佳的深层渗透效应。此外,体内did荧光成像和icp-ms定量分析(图4g)显示,制剂组肿瘤组织的荧光信号更强(p《0.05),pt元素浓度更高(p《0.05),也说明穿透肿瘤的纳米颗粒更多。此外,还研究了肿瘤缺氧区的深部分布。
68.结论:初步验证了乳酸氧化酶修饰的pt纳米花在体内外均具有乳酸驱动的正向趋化作用,特别是在乳酸水平较高的情况下,其对肿瘤深部的渗透增强,希望提出一种促进药物深度渗透的新策略。
69.应用例5多孔pt纳米花负载乳酸氧化酶的纳米制剂h2o2生成效果
70.使用h2o2检测试剂盒和m5全波段多功能酶标仪测定组织上清液在405nm处的吸光度值,代入标准曲线计算h2o2浓度,最终以h2o2浓度与肿瘤质量之比作为评价指标。
71.结论:如图5,负载lox的pt nfs可有效催化降解乳酸并生成h2o2,这为pt nfs的催化产氧过程进一步补充了“燃料”,有利于增强改善肿瘤乏氧状态,进一步缓解乏氧引起的辐射抵抗。并且h2o2作为一类活性氧物质,其浓度的增加会促进对细胞核dna的损伤,也利于提高对肿瘤细胞的杀伤作用。
72.应用例6多孔pt纳米花负载乳酸氧化酶的纳米制剂细胞摄取能力
73.取对数生长期的4t1细胞以每孔10万个细胞种于共聚焦皿中,置于37℃,5%co2,21%o2条件中培养过夜。吸去培养液,每孔加入1ml pt/dox/lox/lm-crgd含药培养液(pt nfs浓度为50μg/ml,dox浓度为2μg/ml,lox浓度为0.91μg/ml)。孵育6h后撤药,pbs洗后加入1ml hoechst 33258染色液,37℃避光孵育20min。pbs洗后加入1ml培养液,通过激光共聚焦显微镜观察制剂的细胞摄取情况。此外,为进一步考察所述制剂在胞内的释药行为,撤药后将细胞继续培养24h,并再次通过激光共聚焦显微镜观察胞内的dox红色荧光分布。
74.结论:结果如图6所示,与肿瘤细胞共同孵育6h后,均可在细胞内观察到明显的dox红色荧光,展现出良好的肿瘤细胞摄取能力,但由于外层包被脂膜及释药过程具有时间依赖性,故此时核内的dox红色荧光较弱;随着时间的延长及溶酶体ph环境的影响,制剂外层脂膜的稳定性下降,pt nfs的酸响应降解程度提高,促进了所述制剂释放dox入核,因此撤
药24h时可在核内观察到较为明显的dox红色荧光。
75.应用例7多孔pt纳米花负载乳酸氧化酶的纳米制剂细胞毒性
76.取对数生长期的4t1细胞以每孔5000个细胞种于96孔板中,置于37℃,5%co2,21%o2条件中培养过夜。设置非照射组(0gy)和照射组(5gy)(n=6)。吸去培养液,首先每孔加入50μl h2o2(2mm)模拟肿瘤高h2o2水平特性,随后每孔分别加入50μl含药培养液(pt nfs浓度为100μg/ml,dox浓度为4μg/ml,lox浓度为1.82μg/ml),并将细胞转移至低氧箱(1%o2)中以模拟肿瘤乏氧微环境,促进肿瘤细胞产生乳酸。孵育6h后撤药,pbs洗后,加入100μl含h2o2(1mm)的新鲜培养液。照射组给予5gy剂量的x射线照射后,继续在乏氧环境中孵育24h。吸去培养液,每孔加入100μl培养液(含10μl cck-8检测试剂),孵育1h并通过酶标仪检测各孔450nm的od值。采用以下公式计算细胞的存活率:
[0077][0078]
结论:如图6所示,所述制剂使细胞凋亡水平进一步提高,展现出更强的体外协同抗肿瘤作用,为其体内应用奠定了有力基础。
[0079]
应用例8多孔pt纳米花负载乳酸氧化酶的纳米制剂体内靶向分布
[0080]
为考察crgd提高纳米制剂肿瘤靶向能力的作用,选取肿瘤体积约为100mm3的荷瘤小鼠,随机分为2组(n=3),实验前一天对小鼠进行腹部剃毛。分别尾静脉注射药物溶液,分别于注射后第6、12、24、48h使用小动物活体成像仪观察did的荧光分布情况(did为近红色荧光,ex/em=644/663nm),并通过imagej对肿瘤部位的荧光强度进行半定量分析。此外,于注射后48h脱颈处死各组小鼠并取出肿瘤和心、肝、脾、肺、肾进行荧光成像。
[0081]
结论:所述制剂静脉注射后可在小鼠肿瘤部位观察到更加明显的did荧光信号,如图7,展现出更强的肿瘤靶向能力,并通过imagej进行荧光半定量分析显示在48h时仍存在显著性差异(p《0.01)。
[0082]
应用例9多孔pt纳米花负载乳酸氧化酶的纳米制剂体内药效学与安全性评价
[0083]
选取肿瘤体积约为100mm3的荷瘤小鼠,分别于第1、4、7天尾静脉注射药物,其中放疗组于第2、5、8天在肿瘤部位给予5gy剂量的x射线照射。在治疗第15天进行眼眶取血检测肝功能、肾功能、心肌功能的血生化指标以及血常规指标,并取出各治疗组的肿瘤组织以及心、肝、脾、肺、肾,pbs洗去表面杂质,吸干并精密称重。各治疗组的肿瘤组织经4%多聚甲醛固定后,石蜡包埋,制作肿瘤组织切片,通过h&e染色、ki67免疫组化染色以及tunel免疫荧光染色考察肿瘤细胞的增殖能力及凋亡水平。各治疗组的心、肝、脾、肺、肾经4%多聚甲醛固定后,石蜡包埋,制作器官切片,通过h&e染色考察器官毒性,综合评价体内安全性。
[0084]
结论:取出治疗第15天各制剂组的肿瘤组织并进行称重,图8显示所述制剂治疗组的肿瘤质量最小(p《0.05),并且通过对肿瘤组织进行h&e染色,可观察到该组的“蓝色”细胞核数量最少,出现最明显的核皱缩等dna损伤现象。结合肿瘤组织的ki67免疫组化染色与tunel免疫荧光染色两种评价方式,如图9,更加准确地判断肿瘤的生长变化,所述制剂联合小剂量放疗有望实现更加有效的体内放化疗协同抗肿瘤效果。
[0085]
此外应理解,在阅读了本发明的上述描述内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。