用于判断西瓜果肉硬度的snp位点、hf-kasp1标记及其应用
技术领域
1.本发明涉及生物技术领域,具体涉及一种用于判断西瓜果肉硬度的snp位点、hf-kasp1标记及其应用。
背景技术:
2.西瓜(citrullus lanatus)是我国重要的蔬菜作物,其产销量位于世界第一。随着果品生产销售及运输途径的发展,西瓜果实硬度作为一种重要的西瓜品质性状日益受到人们的重视。
3.目前市场青睐硬果肉的西瓜品种,耐储运且便于果实切片及拼盘,但大部分传统栽培品种果肉松脆,如何有效培育硬肉品种是目前西瓜育种工作的热点。育种实践证明,利用分子标记辅助育种可以大大缩短育种周期,提高育种效率。但目前国内外对西瓜果实硬度基因的相关研究较少,尚未能对硬度基因进行精确定位。因此确定控制果实硬度的关键目标基因,并开发的功能型分子标记是分子标记辅助转育西瓜硬肉性状的前提条件。在西瓜分子育种研究中,我国科学家首次公布了西瓜全基因组序列及变异组序列,使得我国西瓜分子生物学的研究走在了世界的前列。而确定西瓜果实硬度控制基因的位置,开发稳定可用的分子标记是这项工作的前提。本实验室基于各品种西瓜的硬度表型及其后续基因开发了针对两个候选西瓜硬度基因位点附近的差异序列情况开发的相关的分子标记,并获得了国家发明专利(专利号:zl201610591704.x,zl201610542951.0)。但上述标记需要对pcr产物进行测序,过程较为繁琐且通量低,且这两个标记与目的基因尚有一定距离。造成这些标记在西瓜果实硬度分子标记辅助育种方面的应用具有一定的局限性。为了更好的服务西瓜品质育种的实践,提高西瓜果实品质是分子育种工作效率,需要对果肉硬度基因进行进一步的精细定位,获得紧密连锁的snp标记,同时开发高通量的分子标记检测手段。
技术实现要素:
4.为了解决现有技术中存在的上述问题,本发明提供了一种用于判断西瓜果肉硬度的snp位点、hf-kasp1标记及其应用。
5.第一方面,本发明要求保护用于检测西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸是t还是a还是t和a的物质在如下任一中的应用:
6.(a)鉴定或辅助鉴定西瓜果肉硬度;
7.(b)制备用于鉴定或辅助鉴定西瓜果肉硬度的产品;
8.(c)鉴定或辅助鉴定待测西瓜为硬肉西瓜品种还是非硬肉西瓜品种;
9.(d)制备用于鉴定或辅助鉴定待测西瓜为硬肉西瓜品种还是非硬肉西瓜品种的产品;
10.(e)选育硬肉西瓜品种;
11.(f)制备用于选育硬肉西瓜品种的产品;
12.(g)选育非硬肉西瓜品种;
13.(h)制备用于选育非硬肉西瓜品种的产品。
14.其中,用于检测西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸是t还是a还是t和a的物质可为成套引物或含有所述成套引物的试剂或试剂盒。
15.所述成套引物中含有两条上游引物和一条下游引物。
16.所述上游引物根据所述西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸及其上游序列进行设计,且一条所述上游引物的3’末端脱氧核糖核苷酸为所述西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸t,另一条所述上游引物的3’末端脱氧核糖核苷酸为所述西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸a;所述下游引物根据所述西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸的下游序列进行设计。
17.进一步地,所述成套引物可为由seq id no.1的第22-46位所示的单链dna分子或其衍生物、seq id no.2的第22-46位所示的单链dna分子或其衍生物和seq id no.3所示的单链dna分子组成的成套引物。
18.更进一步地,所述seq id no.1的第22-46位所示的单链dna分子的衍生物为seq id no.1的第22-46位所示的单链dna分子的5'端连接特异荧光标签序列a。所述seq id no.2的第22-46位所示的单链dna分子的衍生物为seq id no.2的第22-46位所示的单链dna分子的5'端连接特异荧光标签序列b。
19.所述试剂或试剂盒中还可含有荧光探针a、荧光探针b、淬灭探针a和淬灭探针b。
20.所述荧光探针a为与所述特异荧光标签序列a一致的序列,5’末端连接荧光报告基团a;所述淬灭探针a为所述特异荧光标签序列a的反向互补序列,3’末端连接荧光淬灭基团。
21.所述荧光探针b为与所述特异荧光标签序列b一致的序列,5’末端连接荧光报告基团b;所述淬灭探针b为所述特异荧光标签序列b的反向互补序列,3’末端连接荧光淬灭基团。
22.进一步地,所述特异荧光标签序列a为荧光标签序列fam,所述特异荧光标签序列b为荧光标签序列hex;所述荧光报告基团a为fam,所述荧光报告基团b为hex;所述荧光淬灭基团为bhq。
23.在本发明的具体实施方式中,所述荧光标签序列fam具体为seq id no.1的第1-21位;所述荧光标签序列hex具体为seq id no.2的第1-21位。即,所述成套引物为由seq id no.1所示的单链dna分子、seq id no.2所示的单链dna分子和seq id no.3所示的单链dna分子组成的成套引物。
24.本发明中所述荧光探针a、所述荧光探针b、所述淬灭探针a和淬灭探针b是存在于kasp 2
×
master mix中,其中所述kasp 2
×
master mix是英国lgc公司产品。
25.在所述试剂或试剂盒中还可含有高保真taq酶和dntp。
26.第二方面,本发明要求保护如下任一方法:
27.方法a:一种检测西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸是t还是a还是t和a的方法,可包括如下步骤(a1)或(a2):
28.(a1)直接测序。
29.(a2)用前文所述的试剂或试剂盒对待测西瓜基因组dna进行pcr扩增,将所扩增的产物进行荧光信号扫描(采用kraken软件对扫描数据进行分析),然后按照如下确定所述待
测西瓜基因中6号染色体上第13317084位脱氧核糖核苷酸是t还是a还是t和a:
30.若所述待测西瓜的扩增产物的荧光信号为所述荧光基团a的信号(经kraken软件分析在所得分型聚类图中呈现蓝色),则所述待测西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸是t的纯合体。
31.若所述待测西瓜的扩增产物的荧光信号为所述荧光基团b的信号(经kraken软件分析在所得分型聚类图中呈现红色),则所述待测西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸是a的纯合体。
32.若所述待测西瓜的扩增产物的荧光信号为所述荧光基团a和所述荧光基团b的信号(经kraken软件分析在所得分型聚类图中呈现绿色),则所述待测西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸是t和a的杂合体。
33.其中,进行所述pcr扩增的条件可为:94℃预变性15min;94℃20s,61-55℃1min,共循环10次,每个循环降0.6℃;94℃20s,55℃1min,共循环26次。
34.方法b:一种鉴定或辅助鉴定待测西瓜为硬肉西瓜品种还是非硬肉西瓜品种的方法,可包括如下步骤:
35.(b1)检测西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸是t还是a还是t和a;
36.(b2)按照如下确定所述待测西瓜为硬肉西瓜品种还是非硬肉西瓜品种:
37.若所述待测西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸是a的纯合体,则所述待测西瓜为或候选为硬肉西瓜品种。
38.若所述待测西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸不是a的纯合体,则所述待测西瓜为或候选为非硬肉西瓜品种。
39.进一步地,若所述待测西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸是t的纯合体,则所述待测西瓜为或候选为软肉西瓜品种;若所述待测西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸是t和a的杂合体,则所述待测西瓜为或候选为中硬肉西瓜品种。
40.方法c:一种选育硬肉西瓜品种的方法,可包括如下步骤:
41.(c1)检测西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸是t还是a还是t和a;
42.(c2)选择基因组中6号染色体上第13317084位脱氧核糖核苷酸是a的纯合体的待测西瓜作为亲本进行选育,并在育种各世代选择基因组中6号染色体上第13317084位脱氧核糖核苷酸是a的纯合体的西瓜,最终获得硬肉西瓜品种。
43.所述(c2)具体可如:以软肉(非硬肉)、品质优良材料为受体亲本p1,与具有硬肉基因(即西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸是a的纯合体)、品质一般的供体亲本p2配制f1代杂交组合;再以受体亲本p1作为轮回亲本进行回交,获得bc1f1代回交分离群体;对所述bc1f1代回交分离群体,选取基因型为纯合硬肉(即西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸是a的纯合体)的单株继续回交,获得bc2f1代回交分离群体;选取基因型为纯合硬肉(即西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸是a的纯合体)的单株,继续回交n代,获得bcnf1代回交分离群体;对bcnf1代回交分离群体,继续选取基因型为纯合硬肉(即西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸是a
的纯合体)的单株自交,获得纯合硬肉系。
44.方法d:一种选育非硬肉(软肉)西瓜品种的方法,可包括如下步骤:
45.(d1)检测西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸是t还是a还是t和a;
46.(d2)选择基因组中6号染色体上第13317084位脱氧核糖核苷酸是t的纯合体的待测西瓜作为亲本进行选育,并在育种各世代选择基因组中6号染色体上第13317084位脱氧核糖核苷酸是t的纯合体的西瓜,最终获得非硬肉(软肉)西瓜品种。
47.所述(d2)具体可如:以硬肉、品质优良材料为受体亲本p1,与具有非硬肉(软肉)基因(即西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸是t的纯合体)、品质一般的供体亲本p2配制f1代杂交组合;再以受体亲本p1作为轮回亲本进行回交,获得bc1f1代回交分离群体;对所述bc1f1代回交分离群体,选取基因型为纯合非硬肉(软肉)(即西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸是t的纯合体)的单株继续回交,获得bc2f1代回交分离群体;选取基因型为纯合非硬肉(软肉)(即西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸是t的纯合体)的单株,继续回交n代,获得bcnf1代回交分离群体;对bcnf1代回交分离群体,继续选取基因型为纯合非硬肉(软肉)(即西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸是t的纯合体)的单株自交,获得纯合非硬肉(软肉)系。
48.进一步地,在所述方法b、所述方法c和所述方法d中,所述检测西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸是t还是a还是t和a的物质的方法均可为所述方法a。
49.第三方面,本发明要求保护具有如下(a)-(d)中至少一种功能的物质:
50.(a)鉴定或辅助鉴定西瓜果肉硬度;
51.(b)鉴定或辅助鉴定待测西瓜为硬肉西瓜品种还是非硬肉(软肉或者中硬肉)西瓜品种;
52.(c)选育硬肉西瓜品种;
53.(d)选育非硬肉(软肉)西瓜品种。
54.本发明所要求保护的物质为前文所述的用于检测西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸是t还是a还是t和a的物质。具体如:前文所述的成套引物或含有所述成套引物的试剂或试剂盒。
55.第四方面,本发明要求保护前文所述的方法或所述的物质在西瓜分子标记辅助育种中的应用。
56.在上述各方面中,所述硬肉西瓜具体为果肉硬度值大于或等于12.5kg/cm2的西瓜。所述非硬肉西瓜具体为果肉硬度值小于12.5kg/cm2的西瓜。所述非硬肉包括软肉和中硬肉。进一步地,所述软肉西瓜为果肉硬度值小于8kg/cm2的西瓜;所述中硬肉西瓜为果肉硬度值大于等于8kg/cm2且小于12.5kg/cm2的西瓜。
57.在本发明中,所述西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸是以西瓜基因组(watermelon 97103genome v2)作为参考基因组的。
58.在本发明中,所述西瓜基因组中6号染色体上第13317084位脱氧核糖核苷酸也即西瓜基因组中6号染色体上seq id no.4所示序列的第51位所示脱氧核糖核苷酸。
59.在本发明中,西瓜果肉硬度值是采用手持硬度计(kmh-51,kiya seisakushd,ltd.)对待测西瓜的果实中心瓤进行检测,得到的数值。
60.本发明基于西瓜97103全基因组序列及硬肉材料gs43(pi482307),软肉材料twf的重测序信息,根据确定的snp(single nucleotide polymorphism)设计标记,利用野生硬瓤西瓜gs43与栽培西瓜twf杂交后的bc1f9代定位群体对西瓜硬肉(hard flesh,hf)基因进行精细定位,开发的紧密连锁的kasp标记。通过实验证明:本发明的分子标记kasp可以进行西瓜果肉硬度品种的初期筛选,达到分子辅助育种的目的。
附图说明
61.图1为果实硬度基因在bc1f9群体精细定位结果图。
62.图2为实施例1中kasp引物对bc1f8群体的检测结果。图中,红色标注a:a,蓝色标注t:t,绿色标注a:t均是按照snp位点chr.6:13317084进行标注的。
具体实施方式
63.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
64.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
65.实施例1、西瓜果肉硬度相关的snp、hf-kasp1标记的开发以及基因型检测方法建立
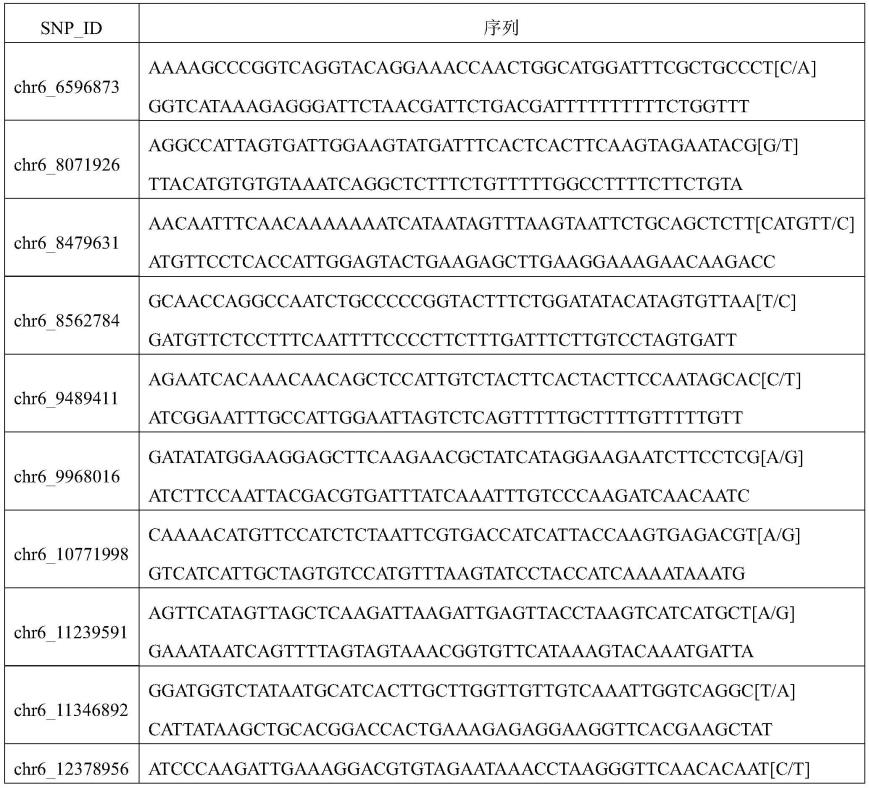
66.一、供试材料
67.供试材料包括父本、母本、bc1f9群体;
68.父本为:gs43(pi482307,https://npgsweb.ars-grin.gov/gringlobal/accessiondetail?id=1377243),为典型野生类型西瓜材料,果实硬度高(果肉硬度值为15kg/cm2),含糖量低;
69.母本为:twf,为典型的东亚类型栽培西瓜品种,是商品杂交瓜的优良亲本材料,含糖量高,但果肉脆易裂(果肉硬度值为5kg/cm2)。
70.bc1f9群体为:上述bc1f8代自交获得的bc1f9群体,共144株
71.上述各个供试材料均为北京市农林科学院蔬菜研究中心种质资源库保存的种质资源材料。
72.二、西瓜果肉硬度紧密连锁的kasp标记的获得
73.1、bc1f9群体的单株果肉硬度鉴定
74.采用手持硬度计(kmh-51,kiya seisakushd,ltd.)检测步骤一中的bc1f9群体和亲本材料的果实中心瓤,得到果肉硬度的数值。果肉硬度值大于或等于12.5kg/cm2的西瓜为硬肉西瓜品种,果肉硬度值小于12.5kg/cm2的西瓜为非硬肉西瓜品种(果肉硬度值小于8kg/cm2的西瓜为软肉西瓜,果肉硬度值大于等于8kg/cm2且小于12.5kg/cm2的西瓜为中硬肉西瓜)。各供试材料分别种植三次取平均值,以确保果肉硬度数值的准确性。
75.2、kasp标记引物的开发
76.基于kasp技术设计高通量kasp标记。kasp为竞争性等位基因特异性pcr技术体系,
具备流程简单、高效、灵活、易操作等特点,其引物设计原则是针对等位基因snp位点设计两个上游引物和一个下游引物;两个上游引物3'末端碱基分别为不同的等位基因,5'端含有特异性接头gaaggtgaccaagttcatgct和gaaggtcggagtcaacggatt,可与荧光标记结合。第一轮pcr,能够和模板互补的上游引物得到延伸,无法和模板互补的上游引物无法延伸;第二轮pcr,上游引物互补的特异性序列得以延伸,将通用标签序列引入与snp对应的pcr产物。随着pcr循环数增加,扩增数量呈指数增长,荧光探针更多地退火到新合成的互补链上,发出荧光。不同颜色荧光即反映不同snp类型,对实验结果进行检测即达到检测目的。
77.利用西瓜全基因重测序结果,对亲本材料在6号染色体区间内的snp进行分析,共筛选出30个snp位点(如表1所示),并开发相关kasp标记,用于精细定位。
78.表1、软硬肉亲本材料twt及gs43在6号染色体区间内用于定位的snp差异
79.80.[0081][0082]
注:表中的snp位点的物理位置是以watermelon(97103)v2 genome(http://www.cucurbitgenomics.org/organism/21)为参考基因组的。
[0083]
3、西瓜果肉硬度基因的精细定位分析
[0084]
供试西瓜材料基因组dna的提取参照murray等(1980)的方法并稍加改进,具体步骤如下:
[0085]
(1)取0.3-0.5g幼嫩叶片于1.5ml离心管中,每管加300μl ctab,放入2粒钢珠,用retch仪进行打碎。
[0086]
(2)每管再加入300μl ctab,混匀后65℃水浴60min,每隔10min颠倒混匀一次。
[0087]
(3)水浴后置于室温冷却10min,加入300μl的氯仿、异戊醇混合液(氯仿和异戊醇的体积比为24:1),充分混匀,4500rpm离心15min。
[0088]
(4)取400μl上清液,加入预先加好的400μl预冷的异丙醇中(于96孔深孔板),轻轻混匀;-20℃放置30min。
[0089]
(5)于4500rpm离心30min,弃上清,用70%的乙醇洗沉淀2-3次,室温下风干至无乙醇味。
[0090]
(6)加入50-100μl(含0.5-1μl rnase 10mg/ml)ddh2o,37℃水浴30min。
[0091]
(7)取5μl样品在1.0%的琼脂糖凝胶上电泳检测,并以标准λdna为对照,将样品浓度调为一致。
[0092]
利用joinmap软件对bc1f9群体的果肉硬度表型数据与该群体所构建的高密度kasp分子标记遗传图谱进行遗传连锁分析,精细定位位于西瓜6号染色体上hf目标基因区间。图1为西瓜果肉硬度基因精细定位结果图。
[0093]
4、与硬度控制基因紧密连锁的hf-kasp1标记的获得
[0094]
发现表1中的snp位点chr.6:13317084(对应序列如seq id no.4所示,seq id no.4的第51位w即为该snp位点,其核苷酸多态性为t或a)和与果实硬度表型紧密连锁。据此获得与西瓜硬度基因紧密连锁的hf-kasp1标记核心引物序列。
[0095]
hf-kasp1标记核心引物序列如下:
[0096]
上游引物1:
[0097]
上游引物2:
[0098]
下游引物:5
’-
gcatctgaacaggcatgaaagtctatat-3’。
[0099]
上述核心引物序列中,上游引物1和2的3
′
端为等位变异碱基(粗体下划线部分的t或a),在上游引物1的5’端加上相应的通用接头序列(fam荧光标签序列),在上游引物2的5’端加上相应的通用接头序列(hex荧光标签序列),获得用于高通量检测西瓜硬度的kasp标记引物组合:
[0100]
所述hf-kasp1标记引物组合包括如下三条引物:
[0101]
上游引物3:5
’-
gaaggtgaccaagttcatgctaggcctcctgagaatattaggagat-3’(seq id no.1,下划线部分为特异荧光标签序列fam);
[0102]
上游引物4:5
’-
gaaggtcggagtcaacggattaggcctcctgagaatattaggagaa-3’(seq id no.2,下划线部分为特异荧光标签序列hex);
[0103]
下游引物:5
’-
gcatctgaacaggcatgaaagtctatat-3’(seq id no.3)。
[0104]
上述引物均由上海生工公司北京合成部合成。
[0105]
上述上游引物3与下游引物用于扩增西瓜基因组snp位点chr.6:13317084处为t的片段(即seq id no.4所示序列的第51位为t)。
[0106]
上述上游引物4与下游引物用于扩增西瓜基因组snp位点chr.6:13317084处为a的片段(即seq id no.4所示序列的第51位为a)。
[0107]
5、利用hf-kasp1标记检测基因型的方法建立
[0108]
kasp基因分型pcr反应体系:
[0109]
96孔板:10ng基因组dna,5μl kasp v4.0 2
×
master mix,0.14μl引物混合液(上游引物3、上游引物4和下游引物),加ddh2o至10μl。
[0110]
384孔板:5 ng dna,2.5μl kasp v4.0 2
×
master mix,0.07μl引物混合液(上游引物3、上游引物4和下游引物),加ddh2o至5μl。
[0111]
1536孔板:5 ng dna,2.5μl kasp v4.0 2
×
master mix,0.07μl引物混合液(上游引物3、上游引物4和下游引物),加ddh2o至5μl。
[0112]
其中,kasp v4.0 2
×
master mix为lgc公司产品,用于96/384孔板的kasp v4.0 2
×
master mix的产品目录号为kbs-1016-002;用于1536孔板的kasp v4.0 2
×
master mix的产品目录号为kbs-1016-011。
[0113]
其中,所述引物混合液中上游引物3和上游引物4的终浓度均为12μm,下游引物的终浓度为30μm。
[0114]
其中,kasp master mix由荧光探针a、荧光探针b、淬灭探针a和淬灭探针b,以及高保真taq酶,dntp,mg
2
等组成。荧光探针a的核苷酸序列为:5'-gaaggtgaccaagttcatgct-3',其5'端连接一个fam荧光基团;荧光探针b的核苷酸序列为:5'-gaaggtcggagtcaacggatt-3',5'末端连接一个hex荧光基团;淬灭探针a的核苷酸序列为:5'-agcatgaacttggtcaccttc-3',其3'端连接一个淬灭基团bhq;淬灭探针b的核苷酸序列为:5'-aatccgttgactccgaccttc-3',其3'端连接一个淬灭基团bhq。
[0115]
pcr反应程序:阶段1:94℃预变性15min;阶段2:94℃20s;61-55℃1min,共循环10次,每个循环降0.6℃;阶段3:94℃20s,55℃1min,共循环26次。
[0116]
pcr产物采用双向单激发读板仪pherastar对pcr扩增产物进行扫描,fam激发波长为485nm,发射波长为520nm,hex激发波长为528nm,发射波长为560nm,系统参比荧光rox激发波长为575nm,发射波长为610nm。,荧光信号采用kraken
tm
软件对双向单激发读板仪
pherastar扫描数据分析(具体操作方法参考kraken
tm
软件说明书,公众可以直接从lgc公司购买,见网址http://www.lgcgroup.com/products/genotyping-software/kraken/#.vhcat9kl8_m)。
[0117]
实验可同时设置反应体系中不添加模板dna的空白对照(ntc),每个板设置1个或多个空白对照。
[0118]
按照如下确定所述待测西瓜基因组中snp位点chr.6:13317084的基因型:
[0119]
若所述待测西瓜的扩增产物的荧光信号数据经kraken软件分析在所得分型聚类图中呈现红色,则所述待测西瓜基因组中snp位点chr.6:13317084处是a的纯合体(记作:西瓜果肉硬度基因的基因型为hh,硬肉型)。
[0120]
若所述待测西瓜的扩增产物的荧光信号数据经kraken软件分析在所得分型聚类图中呈现蓝色或绿色,则所述待测西瓜基因组中snp位点chr.6:13317084处不是a的纯合体(记作:非硬肉型)。
[0121]
具体地,若所述待测西瓜的扩增产物的荧光信号数据经kraken软件分析在所得分型聚类图中呈现蓝色,则所述待测西瓜基因组中snp位点chr.6:13317084处是t的纯合体(记作:西瓜果肉硬度基因的基因型为hh,软肉型)。若所述待测西瓜的扩增产物的荧光信号数据经kraken软件分析在所得分型聚类图中呈现绿色,则所述待测西瓜基因组中snp位点chr.6:13317084处是t和a的杂合体(记作:西瓜果肉硬度基因的基因型为hh,中硬肉型)。
[0122]
三、kasp标记的初步验证
[0123]
利用hf-kasp1标记对父本、母本、bc1f8代群体进行验证,部分结果如图2所示。结果显示共400株群体中119个果实测定为硬肉(果肉硬度值大于等于12.5kg/cm2)的单株,其hf-kasp1标记检测的基因型为硬肉型(hh型);106个果实测定为软肉(果肉硬度值小于8kg/cm2)的单株,其hf-kasp1标记检测的基因型也为软肉型(hh型);另外175个果实测定为中硬肉(果肉硬度值大于等于8kg/cm2且小于12.5kg/cm2)的单株,其hf-kasp1标记检测的基因型为中硬肉型(hh型)。即,经检测snp位点chr.6:13317084处为a的纯合体的西瓜其果肉硬度值均大于等于12.5kg/cm2(硬肉),snp位点chr.6:13317084处为t的纯合体的西瓜其肉硬度值均小于8kg/cm2(软肉),snp位点chr.6:13317084处为t和a的杂合体的西瓜其肉硬度值均大于等于8kg/cm2且小于12.5kg/cm2(中硬肉)。结果显示位于西瓜基因组6号染色体上的hf-kasp1标记与西瓜果肉硬度表型共分离,说明该snp位点以及利用该snp位点所设计的hf-kasp1标记在鉴别西瓜果肉硬度上有较高的利用价值,可以有效地运用于西瓜分子辅助育种。
[0124]
实施例2、kasp1标记的验证
[0125]
为进一步验证实施例1中的hf-kasp1标记与西瓜果肉硬度基因hf(对应性状:果肉硬度)的连锁关系,利用自然群体进行验证。具体步骤如下:
[0126]
供试材料为自然资源群体;自然群体为:在1484份西瓜资源库中96份具有代表性的西瓜种质资源构成的自然群体(详见表2);表2中各个供试材料均为北京市农林科学院蔬菜研究中心种质资源库保存的种质资源材料。
[0127]
参照实施例1,一方面对各供试西瓜种质资源进行果肉硬度实测(得到表2中的“硬度”一栏数值),另一方面采用hf-kasp1标记鉴定snp位点chr.6:13317084基因型,结果如表2所示。
[0128]
表2、96份西瓜种质资源构成的自然群体单株材料及其单株果肉硬度鉴定结果(标记检测中hh为软肉型,hh为硬肉型)
[0129]
[0130]
[0131]
[0132][0133]
注:表中“硬度”一栏,“软”表示果肉硬度值小于8kg/cm2,“硬”表示果肉硬度值大于等于12.5kg/cm2。
[0134]
结果表明:果肉硬度实测结果与采用hf-kasp1标记鉴定snp位点chr.6:13317084基因型结果100%相符。hf-kasp1标记在自然群体材料的硬肉材料中均可检测出纯合硬肉基因型。上述检测结果进一步证实了本发明的hf-kasp1标记可以用于西瓜硬肉品种的分子标记辅助育种。
[0135]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,
可以进行一些基本特征的应用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
