一种进行sirna表达和体内递送的细胞疗法
技术领域
1.本发明属于生物技术领域,涉及一种进行sirna表达和体内递送的细胞疗法。
背景技术:
2.sirna能够特异性结合并降解mrna,在转录后水平干扰基因的表达。sirna药物在疾病治疗中显示出了巨大潜力,但如何在体内将sirna安全、有效、稳定地递送到靶细胞或者靶器官,是开发sirna药物最为关键的问题之一。目前sirna药物的体内递送策略主要可以分为裸sirna直接递送、病毒性载体、化学修饰、纳米颗粒、脂质体等几大类。以合成的未经修饰的裸sirna为例,经静脉注射后,sirna需要随血液循环流动直到抵达靶细胞。这期间,很大一部分sirna会被肾脏过滤清除出体外,有一部分将被吞噬细胞处理掉。而采用化学修饰、纳米、脂质体或病毒载体的递送方式,均存在其各自的安全性问题,因此急需高效、安全的sirna药物递送系统。
3.近年来,基于外泌体递送系统的sirna传输技术发展迅速,其优势在于外泌体是在细胞间、组织间传递mirna的天然载体,可以包裹和保护mirna(sirna类似物)自由穿越细胞膜和生物屏障并达到受体细胞。该方法已被广泛报道在多种疾病模型上获得成功,但是这些实验往往是不计成本和代价的,而在实际操作过程中,将sirna包装进入外泌体需要大规模的细胞培养,耗时耗力,而且花费十分昂贵,此外分离纯化外泌体也需要耗费大量的人力物力,因此在体外大批量生产包裹sirna的外泌体并不现实,很难满足生产质控的要求,无法实现工业化生产。
4.因此,本领域迫切需要开发一种将细胞疗法中的细胞体内传输技术与mirna分泌和循环机制相结合,以细胞作为sirna药物的递送载体和天然sirna药物合成机器,体外利用基因工程技术在细胞中稳定表达sirna,然后将细胞回输体内进行疾病治疗的新方法。
技术实现要素:
5.本发明的目的在于提供一种将细胞疗法中的细胞体内传输技术与mirna分泌和循环机制相结合,以细胞作为sirna药物的递送载体和天然sirna药物合成机器,体外利用基因工程技术在细胞中稳定表达sirna,然后将细胞回输体内进行疾病治疗的新方法。
6.在本发明的第一方面,提供了一种细胞,所述细胞中表达sirna组合物,所述sirna组合物包括:
7.降低第一靶基因的表达的第一sirna分子;
8.任选的,靶向肽元件的编码序列;和
9.任选的,降低第二靶基因的表达的第二sirna分子;
10.其中所述第一靶基因选自下组:egfr、kras、tnc、或其组合,并且所述sirna组合物降低一个或多个基因的表达。
11.在另一优选例中,所述第二靶基因选自下组:egfr、tnc、或其组合。
12.在另一优选例中,所述第一靶基因和第二靶基因相同或不同。
13.在另一优选例中,所述第一sirna分子具有如seq id no.:1或2所示的序列。
14.在另一优选例中,所述第一sirna分子的序列如seq id no.:1或2所示。
15.在另一优选例中,所述第二sirna分子具有如seq id no.:3所示的序列。
16.在另一优选例中,所述第二sirna分子的序列如seq id no.:3所示。
17.在另一优选例中,所述靶向肽元件为所有已知靶向肽段的一种。
18.在另一优选例中,所述靶向肽元件选自下组:rvg、lamp2b、或其组合。
19.在另一优选例中,所述靶向肽元件为所有已知靶向肽段的一种或与其他蛋白的融合蛋白。
20.在另一优选例中,所述靶向肽元件为rvg与lamp2b组成的融合蛋白。
21.在另一优选例中,所述靶向肽元件的序列如seq id no.:4所示。
22.在另一优选例中,所述细胞包括异体或自体细胞。
23.在另一优选例中,所述细胞选自下组:干细胞、前体细胞、分化细胞、成纤维细胞、或其组合。在另一优选例中,所述细胞选自下组:白色脂肪细胞、褐色脂肪细胞、间充质干细胞、胚胎干细胞、免疫细胞、成纤维细胞或其组合。
24.在另一优选例中,所述细胞含有表达sirna组合物的载体。
25.在另一优选例中,所述载体包括:
26.启动子元件;
27.降低第一靶基因的表达的第一sirna分子;
28.任选的,靶向肽元件的编码序列;和
29.任选的,降低第二靶基因的表达的第二sirna分子;其中所述第一靶基因选自下组:egfr、kras、tnc、或其组合,并且所述sirna分子降低一个或多个基因的表达。
30.在另一优选例中,所述载体具有5’-3’的式i所示的结构:
31.z0-z1-z2-z3(i)
32.其中,z0为启动子元件;
33.z1为任选的靶向肽元件的编码序列;
34.z2为降低第一靶基因的表达的第一sirna分子;
35.z3为任选的降低第二靶基因的表达的第二sirna分子。
36.在另一优选例中,所述启动子元件包括组成型启动子。
37.在另一优选例中,所述启动子元件选自下组:cmv、u6、或其组合。
38.在另一优选例中,所述第一靶基因选自下组:egfr、kras、tnc、或其组合。
39.在另一优选例中,所述第二靶基因选自下组:egfr、tnc、或其组合。
40.在另一优选例中,所述第一靶基因和第二靶基因相同或不同。
41.在另一优选例中,所述第一sirna分子具有如seq id no.:1或2所示的序列。
42.在另一优选例中,所述第二sirna分子具有如seq id no.:3所示的序列。
43.在另一优选例中,所述载体的序列如seq id no.:5所示。
44.在另一优选例中,所述的载体含有启动子、复制起点和标记基因。
45.在另一优选例中,所述的表达载体包括病毒载体、非病毒载体。
46.在另一优选例中,所述病毒载体包括逆转录病毒、慢病毒、腺病毒、腺相关病毒载体。
47.在另一优选例中,所述的表达载体为质粒。
48.本发明第二方面提供了一种细胞制剂,所述细胞制剂含有本发明第一方面所述的细胞。
49.在另一优选例中,所述细胞制剂中,所述细胞的含量为1
×
107-2
×
108个细胞/人次,较佳地,2
×
107-1.5
×
108个/人次,更佳地,3
×
107-1
×
108个/人次。
50.在另一优选例中,所述细胞制剂还含有药学上可接受的载体。
51.在另一优选例中,所述药学上可接受的载体选自下组:磷酸盐缓冲液、生理盐水、海藻糖溶液、或其组合。
52.在另一优选例中,所述的制剂为液体剂型。
53.在另一优选例中,所述的制剂为注射剂。
54.在另一优选例中,所述细胞制剂包括其他用于治疗癌症的药物。
55.在另一优选例中,所述其他用于治疗癌症的药物包括吉非替尼、帕尼单抗、索拉非尼。
56.本发明第三方面提供了一种本发明第一方面所述的细胞或本发明第二方面所述的细胞制剂的用途,用于制备治疗疾病的药物或制剂。
57.在另一优选例中,所述疾病选自下组:癌症、恶性肿瘤、消化系统疾病、免疫系统疾病、循环系统疾病、生殖系统疾病、呼吸系统疾病、内分泌系统疾病、神经系统疾病、运动系统疾病、泌尿系统疾病、心血管疾病、器官移植、炎症、糖尿病、血液疾病、皮肤病、传染性疾病、精神类疾病、感染性疾病、器官损伤、组织创伤、或其组合。
58.在另一优选例中,所述癌症或恶性肿瘤选自下组:肺癌、胶质母细胞瘤、胃癌、结直肠癌、肝癌、乳腺癌、膀胱癌、胰腺癌、前列腺癌、子宫癌、卵巢癌、或其组合。
59.在另一优选例中,所述制剂为液体制剂。
60.在另一优选例中,所述药物或制剂中,1
×
107-2
×
108个细胞/人次,较佳地,2
×
107-1.5
×
108个/人次,更佳地,3
×
107-1
×
108个/人次。
61.本发明第四方面提供了一种治疗癌症的方法,包括:
62.向需要的对象施用本发明第一方面所述的细胞或本发明第二方面所述的细胞制剂。
63.在另一优选例中,所述施用的剂量为所述细胞的含量为1
×
107-2
×
108个细胞/人次,较佳地,2
×
107-1.5
×
108个/人次,更佳地,3
×
107-1
×
108个/人次。
64.在另一优选例中,所述施用包括注射。
65.在另一优选例中,所述施用包括静脉注射、肌肉注射、皮下注射、颅内注射、涂抹。
66.在另一优选例中,所述的对象包括人或非人哺乳动物。
67.在另一优选例中,所述的对象包括啮齿动物,如小鼠、大鼠。
68.应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
69.图1是本发明基因元件构成的质粒分子示意图。
70.图2是sirna体外表达时干扰效率检测。
71.按照图2所示方法构建表达sirna的293t细胞,利用细胞实验验证干扰效率。a-c:表达cmv-sire的293t细胞外泌体共培llc细胞,并检测sirna的表达水平,以及其对egfr基因mrna(b)和蛋白(c)表达的抑制情况。*表示p《0.05,**表示p《0.01,***表示p《0.005。
72.图3是细胞传输的sirna在不同组织的含量分布。
73.注射细胞1、3、6、9、12、24、48小时后,处死小鼠,取小鼠血浆及组织:a:小鼠血浆中检测sirna表达量,及其在血浆外泌体中的含量;b:在上述时间点肺、肾、脾、脑、心脏、胰腺、肌肉、cd4
t细胞等组织中分别检测sirna水平。
74.图4是细胞传输的sirna对llc原位植瘤肺癌小鼠模型的治疗效果,及生存情况统计。
75.将llc原位植瘤肺癌小鼠模型平均分组,每两天注射一次pbs、对照293t细胞、吉非替尼或sirna表达293t细胞,为期2周,治疗前后分别通过ct扫描检测小鼠肿瘤大小,并统计生存情况。a:代表性ct扫描3d成像结果;b:生存统计。其中,*表示p《0.05,**表示p《0.01,***表示p《0.005。
76.图5是细胞传输的sirna的体内安全性检测。
77.a-f:293t细胞注射对小鼠血清中谷丙转氨酶、谷草转氨酶、总胆红素、尿素、碱性磷酸酶和肌酐等生化指标的影响。
具体实施方式
78.本发明人经过广泛而深入的研究,首次开发了一种表达sirna组合物的细胞,以及含有表达sirna组合物的细胞的细胞制剂,本发明意外发现,本发明的表达sirna组合物的细胞或含有表达sirna组合物的细胞的细胞制剂可用于治疗疾病,比如癌症。在此基础上,本发明人完成了本发明。
79.术语
80.为了可以更容易地理解本公开,首先定义某些术语。如本技术中所使用的,除非本文另有明确规定,否则以下术语中的每一个应具有下面给出的含义。在整个申请中阐述了其它定义。
81.术语“约”可以是指在本领域普通技术人员确定的特定值或组成的可接受误差范围内的值或组成,其将部分地取决于如何测量或测定值或组成。例如,如本文所用,表述“约100”包括99和101和之间的全部值(例如,99.1、99.2、99.3、99.4等)。
82.如本文所用,术语“含有”或“包括(包含)”可以是开放式、半封闭式和封闭式的。换言之,所述术语也包括“基本上由
…
构成”、或“由
…
构成”。
83.如本文使用的,术语“宿主”、“受试者”、“所需对象”指任何哺乳动物或非哺乳动物。哺乳动物包括但不限于人类、脊椎动物诸如啮齿类、非人类灵长类,如牛、马、狗、猫、猪、绵羊、山羊、骆驼、大鼠、小鼠、野兔和家兔。
84.第一sirna分子
85.在本发明中,第一sirna分子指能够降低第一靶基因(如egfr、kras、tnc)的表达的sirna分子。
86.在一优选实施方式中,第一sirna的序列如seq id no.:1或2所示。
87.seq id no.1:auaccuauuccguuacacacu(egfr sirna);
88.seq id no.2:5
’‑
gcaaauacacaaagaaagccc-3’(kras sirna)
89.第二sirna分子
90.在本发明中,第二sirna分子指能够降低第二靶基因(如egfr、tnc)的表达的sirna分子。
91.在一优选实施方式中,第二sirna的序列如seq id no.:3所示。
92.seq id no.3:5
’‑
cacacaagccaucuacacaug-3’(tnc sirna)
93.sirna组合物
94.在本发明中,提供了一种sirna组合物,包括:
95.降低第一靶基因的表达的第一sirna分子;
96.任选的,靶向肽元件的编码序列;和
97.任选的,降低第二靶基因的表达的第二sirna分子;
98.其中所述第一靶基因选自下组:egfr、kras、tnc、或其组合。
99.在一优选实施方式中,所述第二靶基因选自下组:egfr、tnc、或其组合。
100.在一优选实施方式中,所述第一靶基因和第二靶基因相同或不同。
101.在本发明,本发明的sirna组合物可降低一个或多个基因的表达。在本发明中,在细胞中表达本发明的sirna组合物,并将该细胞用于治疗癌症。
102.载体
103.本发明还提供一种载体,它含有本发明所述的sirna组合物。所述的表达载体通常还含有启动子、复制起点和/或标记基因等。本领域的技术人员熟知的方法能用于构建本发明所需的表达载体。这些方法包括体外重组dna技术、dna合成技术、体内重组技术等。所述的表达载体优选地包含一个或多个选择性标记基因,以提供用于选择转化的宿主细胞的表型性状,如卡拉霉素、庆大霉素、潮霉素、氨苄青霉素抗性。
104.在本发明中,代表性的启动子包括(但并不限于):cmv启动子、u6、t7启动子。
105.靶向肽元件
106.在本发明中,靶向肽元件选自下组包括但并不限于,rvg、lamp2b。在一优选实施方式中,本发明的靶向肽元件包括狂犬病毒糖蛋白。狂犬病毒糖蛋白(rabies virus glycoprotein,rvg)是一种嗜神经性的蛋白质,能够与神经细胞表达的乙酰胆碱受体相结合。狂犬病毒为弹状病毒科狂犬病毒属,具有囊膜的单股负链rna病毒。该病毒主要编码糖蛋白g,g蛋白以三聚体的形式锚定于病毒囊膜表面,并能够与细胞表面的受体结合,介导膜融合使病毒侵入细胞。同时,g蛋白是狂犬病毒主要的抗原蛋白,刺激机体产生中和抗体。rvg肽特异性结合神经元细胞所表达的胆碱体,rvg靶点在细胞膜外表达,引导外泌体通过血脑屏障,运输到神经细胞。
107.在一优选实施方式中,本发明的靶向肽元件为rvg-lamp2b,即rvg与lamp2b组成的融合蛋白。
108.在一优选实施方式中,本发明的靶向肽元件可以为无。
109.细胞制剂
110.本发明的细胞制剂,含有安全有效量的表达本发明的sirna组合物的细胞及药学上可接受的载体或赋形剂。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙
醇、粉剂、及其组合。药物制剂应与给药方式相匹配。
111.本发明的细胞制剂可以被制成液态制剂,其制备可通过常规方法进行,液态制剂宜在无菌条件下制造。活性成分的给药量是治疗有效量,例如每天约1微克/千克体重-约50毫克/千克体重,约5微克/千克体重-约10毫克/千克体重,约10微克/千克体重-约5毫克/千克体重。此外,本发明制剂还可与其他治疗剂一起使用。
112.使用本发明的制剂时,是将安全有效量的药物施用于哺乳动物,其中该安全有效量通常至少约10微克/千克体重,而且在大多数情况下不超过约50毫克/千克体重,较佳地该剂量是约10微克/千克体重-约20毫克/千克体重。当然,具体剂量还应考虑给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
113.治疗方法
114.本发明还提供了一种治疗疾病,比如癌症的方法,即,将安全有效量的表达本发明的sirna组合物的细胞或本发明的细胞制剂施用于所需对象,从而治疗疾病,比如癌症。
115.本发明的主要优点包括:
116.(1)本发明首次发现,表达本发明的sirna组合物的细胞或含有表达本发明的sirna组合物的细胞的细胞制剂可有效治疗癌症。
117.(2)本发明首次发现,本发明的通过细胞实现sirna体内生产和运输的技术方法很大程度上解决了目前sirna生产成本高、易降解的问题,是一种低成本、高效率的干扰药物生产递送方式,同时证明了基于本发明的新型细胞-基因治疗模式的安全性。
118.(3)本发明设计的基因工程化细胞可以在体内进行加工表达,产生sirna,再以外泌体的形式将sirna分子分泌到其他组织器官,发挥调控基因表达功能。本发明利用该系统递送抑制egfr基因的sirna,在肺癌原位植瘤中得到了良好的治疗效果。
119.下面结合具体实施例,进一步详陈本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明详细条件的实验方法,通常按照常规条件如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。以下实施例中所用的实验材料和试剂如无特别说明均可从市售渠道获得。
120.通用方法
121.i.质粒构建:
122.(1)双酶切实验
123.以bamhι(new england biolab,货号:#r0136),xhoι(biolabs,货号:#r0146)双酶切实验为例:
124.反应体系:
125.nebuffer 3.15.0μlbamhi1.0μlxhoi1.0μl载体dna1.0μgddh20to 50μltotal volume50μl
126.反应程序:
127.37度,孵育60分钟
128.跑胶(1%琼脂糖)
129.胶回收,将骨架暂存于-20度冰箱。
130.(2)退火
131.将2对合成好的寡聚单链dna用ddh2o溶解成100μm,互补单链各取5μl两两混合,按表二给出体系进行退火。将2份oligo混合物在95度加热5分钟,然后放置室温20分钟,形成双链dna。
132.oligo dna退火体系
133.100μm top strand oligo5μl100μm bottom strand oligo5μl10
×
oligo annealing buffer2μlddh2o8μltotal volume20μl
134.(3)连接
135.将退火的双链dna继续稀释成10nm浓度,按表三给出体系在室温连接30分钟。
136.t4酶连接体系:
[0137]5×
ligation buffer4μl载体2μlds oligo(10nm)4μlt4 dna ligase(1u/μl)1μlddh2o9μltotal volume20μl
[0138]
(4)转化
[0139]
取10μl连接产物转化100μl感受态细胞dh5α,冰浴30分钟,42度热激90-120秒,冰浴5min。
[0140]
涂lb平板(含50μg/ml壮观霉素)后,37℃孵育过夜。加入无抗性lb培养基,37度摇菌培养1小时。
[0141]
取500μl,涂板(壮观),37度培养16小时。
[0142]
(5)测序验证
[0143]
每个转化平板分别挑取3个克隆,摇菌抽提质粒后进行测序,以验证重组克隆中插入片段序列是否与设计的寡聚单链dna序列一致。
[0144]
ii.细胞培养传代
[0145]
1.显微镜下观察细胞密度达80%-90%后,进行传代培养。
[0146]
2.弃去旧培养基,用pbs润洗细胞。吸净弃掉pbs。
[0147]
3. 10cm培养皿中加ml消化液(0.25%trypsin)于培养瓶中,置于37℃培养箱中消化5分钟。
[0148]
4.加2ml新培养基(10%fbs),轻轻吹打混匀后吸出,1000rpm离心5分钟,弃去上清液,补加1-2ml培养液后吹匀。
[0149]
5.将细胞悬液按1/2到1/5的比例分到新的含10ml培养基的新培养皿中。
[0150]
iii.细胞冻存和复苏
[0151]
1.细胞冻存时,按传代相同步骤消化细胞后,用细胞计数板进行计数,每1x106细胞加1ml冻存液,冻存液为胎牛血清和dmso混合液,dmso终浓度为10%。吹打混匀细胞,分装入冻存管。
[0152]
2.将冻存管置于程序降温盒中,放入-80度冰箱,过夜以后转入液氮灌储存。
[0153]
3.将细胞冻存管在37℃水浴中迅速摇晃解冻,吸取冻存细胞悬液,加入4ml培养基混合均匀。在1000rpm条件下离心4分钟,弃去上清液,用新的完全培养基重悬细胞后,加入培养瓶中培养过夜,第二天换液并检查细胞状态。
[0154]
iv.细胞转染
[0155]
1.将细胞接种于培养平板中(按照实验目的选择合适规格),并养至大约50%-80%细胞密度。
[0156]
2.按lipofectamine 2000转染说明书,将lipofectamine 2000用opti-mem稀释,并吹打混匀,静置备用(a液)。
[0157]
3.同样参考转染说明书,吸取适量质粒用opti-mem稀释为b液,备用。
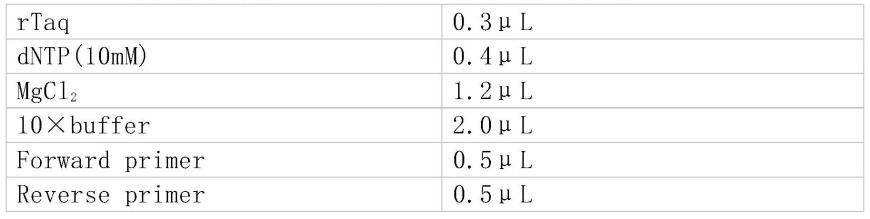
[0158]
4.将a、b液混合,吹打10-15次,静置20min。并将待转染的细胞培液换为opti-mem。
[0159]
5.在混合好的ab混合液均匀滴加入细胞中,轻轻摇匀。
[0160]
6.转染6h后将培养基替换为2%胎牛血清的培养基,36h后收集细胞用于后续实验分析。
[0161]
v.rna提取
[0162]
1.按每107个细胞或10mg组织中加入1ml的比例加trizol(通风橱操作),剧烈震荡充分混匀,室温静置10分钟。
[0163]
2.加入trizol体积1/5的三氯甲烷(通风橱操作),剧烈震荡充分混匀,室温静置5分钟后,12000g离心20分钟。
[0164]
3.小心吸取上清,避免碰触蛋白层,并加入上清2倍体积的异丙醇(预冷),-20度静置至少1h。
[0165]
4.12000g,4度离心20分钟,加入trizol等体积depc水配置的75%乙醇清洗。
[0166]
5.12000g,4度离心15分钟,完全弃去上清,室温晾干不超过10min。
[0167]
6.用25μl depc水溶解。
[0168]
vi.除内毒素质粒小提
[0169]
1.将目的菌株接种于10-15ml的lb培养基中,37℃下培养14-16小时。
[0170]
2.收集菌体:取10-15ml菌液,5000g室温离心10分钟。
[0171]
3.倒掉培养基,将离心管导致扣干完全去除菌液,加入500μl含有rna酶a的solution 1混合液,剧烈涡旋,使细胞完全重悬。
[0172]
4.向重悬后的菌液中加入500μl solution 2,轻柔颠倒7-10次以达到混匀,此步骤裂解时间不应该超过5分钟。
[0173]
5.加入250μl事先冰浴的solution 3,轻柔颠倒7-10次离心管至形成白色絮状沉淀,≥12000g离心10分钟。
[0174]
6.转移上清至1.5ml离心管中,加入0.1倍体积的etr溶液,轻柔颠倒混匀后,冰浴
10分钟。裂解液由浑浊变澄清。
[0175]
7.立即转移至42℃,水浴5分钟,≥12000g室温离心3分钟。etr在离心管底部分层。
[0176]
8.用移液枪小心转移上清至离心管中,加入0.5倍体积无水乙醇,轻柔颠倒混匀。转移混合液至吸附柱内10000g离心1分钟,弃掉滤液。
[0177]
9.向离心柱加入500μl hb buffer,10000g离心1分钟,弃掉滤液。
[0178]
10.加入700μl dna wash buffer,10000g离心1分钟,弃掉滤液。
[0179]
11.重复步骤12洗涤过程一次。
[0180]
12.弃滤液,12000g离心空甩2分钟。
[0181]
13.将吸附柱装到新的离心管,加入35-40ul ddh2o到柱子中心滤网上,室温静置2-5分钟,12000g离心2分钟,洗脱并收集dna。
[0182]
14.检测浓度,琼脂糖凝胶验证,并保存于-20度。
[0183]
vii.除内毒素质粒大提
[0184]
以6l菌液为例:
[0185]
1.摇菌:每个2l锥形瓶装1l lb,6瓶共摇菌液6l。摇菌时间不超过16h
[0186]
2.菌液装入3个离心瓶中,中心对称配平(国产瓶不超过1/2,进口瓶不超过2/3),5000rpm,10min离心,倒掉上清收集菌体。
[0187]
3.向每个离心瓶中加入75ml solution 1,剧烈震荡至看不到块状物质。
[0188]
4. 3个离心瓶每瓶分别加入150ml solution 2,出现絮状粘稠物质,轻柔摇动,不要太剧烈,裂解过程不超过10min。
[0189]
5. 3个离心瓶每瓶分别加入112.5ml预冷的solution 3,充分轻摇至沉淀散开,此时可见白色沉淀。
[0190]
6.配平后5000rpm,20min,4度离心。用试剂盒中的csi过滤器将上清滤入国产离心瓶中。
[0191]
7.把进口瓶洗净、晾干,将国产瓶中滤液转移至进口瓶。
[0192]
8. 3个离心瓶每瓶分别加入210ml异丙醇,颠倒约20下充分混匀。-20度沉淀1h以上。
[0193]
9.将上面所得溶液5000rpm,20min,4度离心,倒掉上清。
[0194]
10.向一个瓶子中加入60ml p1,剧烈混匀后,分别量取30ml加入到另外两个离心瓶中,即得到2个分别装有30ml p1的离心瓶,剧烈摇晃使沉淀溶解。
[0195]
11. 37度静置10min.2个离心瓶每瓶分别加入30ml p2,温和颠倒数次,静置7-9min。
[0196]
12. 2个离心瓶每瓶分别加入30ml p2,温和颠倒数次至溶液出现白色分散絮状沉淀,静置7-9min。
[0197]
13. 5000rpm,10min,4度离心。
[0198]
14.用试剂盒中的csi过滤器将上清滤入1个离心瓶中。
[0199]
15.加入19ml红色的去内毒素溶液er,颠倒混匀。
[0200]
16.加入60ml异丙醇,充分混匀,-20度沉淀1h以上。
[0201]
17.柱平衡:取6个吸附柱,每个加入2.5ml bl,8000rpm,2min离心,倒掉废液。(角转子,圆底,用平衡液处理过的吸附柱最好立即使用)。
[0202]
18.过柱:6个吸附柱每个吸附柱分别倒入10ml液体,8000rpm,2min离心,倒掉废液,至全部过滤完。
[0203]
19.6个吸附柱每个吸附柱分别倒入10ml缓冲液ed,8000rpm,2min离心,倒掉废液。
[0204]
20.6个吸附柱每个吸附柱分别倒入10ml漂洗液pw(提前加入无水乙醇),8000rpm,2min离心,倒掉废液。
[0205]
21.重复20。
[0206]
22.每个吸附柱分别加入2mlddh2o,静置5min,7000rpm,2min离心。将液体重新倒回吸附柱中再离一次。
[0207]
23.将液体混匀,测浓度,-20度保存。
[0208]
viii.荧光定量qrt-pcr检测
[0209]
1.mrna的荧光定量pcr分析,
[0210]
逆转录体系
[0211]5×
amv buffer2.0μldntp(10mm)0.5μlrri0.20μloligo dt1.0μlamv rtase0.5μlrna0.5-1μgdepc水to 10μl总体积10μl
[0212]
逆转录步骤:
[0213]
16℃15min,
[0214]
42℃60min,
[0215]
85℃5min,
[0216]
12℃∞
[0217]
2.mrna实时荧光定量pcr(qpcr)体系及步骤如下:
[0218][0219][0220]
pcr反应条件为:
[0221]
95℃10min,
[0222]
(95℃15s,60℃30s,72℃30s)
×
40cycles
[0223]
溶解曲线:95℃10s,60℃10s,72℃30s
[0224]
3.sirna\mirna的逆转录pcr分析,采用miscript rt kit
[0225]5×
hispec buffer2.0μl10
×
miscript nucleics mix0.5μlmiscript rtase0.5μlrna0.5μgdepc水to 10μl总体积10μl
[0226]
逆转录步骤:
[0227]
37℃60min,
[0228]
95℃5min,
[0229]
12℃∞
[0230]
稀释10倍后
[0231]
sirna\mirna的逆转录pcr分析,采用miscript sybr green pcr kit:
[0232]
reverse primer0.5μl2
×
sybr green pcr master mix1.0μlddh2o13.1μlcdna1.0μltotal20.0μl
[0233]
pcr反应条件为:
[0234]
95℃15min,
[0235]
(95℃15s,55℃30s,72℃30s)
×
40cycles
[0236]
溶解曲线:95℃10s,60℃10s,72℃30s
[0237]
3.如无特殊说明,mrna内参为gapdh,mirna内参为u6。目的基因的相对表达量可以用方程2-δct
表示,其中δct=c
样品-c
内参
。
[0238]
引物序列:
[0239]
egfr(forward):5
’‑
gccatctgggccaaagatacc-3’(seq id no.:6)
[0240]
egfr(reverse):5
’‑
gtcttcgcatgaataggccaat-3’(seq id no.:7)
[0241]
k-ras(forward):5
’‑
caagagcgccttgacgataca-3’(seq id no.:8)
[0242]
k-ras(reverse):5
’‑
ccaagagacaggtttctccatc-3’(seq id no.:9)
[0243]
rvg(forward):5
’‑
ccaatagcagagggaagagagc-3’(seq id no.:10)
[0244]
rvg(reverse):5
’‑
tccatcgtgtgtcgccttg-3’(seq id no.:11)
[0245]
gapdh(forward):5
’‑
gatattgttgccatcaatgac-3’(seq id no.:12)
[0246]
gapdh(reverse):5
’‑
ttgattttggagggatctcg-3’(seq id no.:13)
[0247]
egfr-si precursor(forward):5
’‑
ggcacagacaggcagtcagca-3’(seq id no.:14)
[0248]
egfr-si precursor(reverse):5
’‑
ctgtctgtgtgctgtgtcagtc-3’(seq id no.:15)
[0249]
egfr-si(forward):5
’‑
ggtgttgcttctcttaattc-3’(seq id no.:16)
[0250]
egfr-sh-ps(forward):5
’‑
aggagttaagagaagccac-3’(seq id no.:17)
[0251]
egfr-si-ps(forward):5
’‑
gaggagttaagaagccaca-3’(seq id no.:18)
[0252]
u6(forward):5
’‑
acactccagctggggtgctcgcttcggca-3’(seq id no.:19)
[0253]
mir-16(forward):5
’‑
tagctagcagcacgtaaat-3’(seq id no.:20)
[0254]
ix.western blot检测蛋白表达水平
[0255]
(1)蛋白质样品制备:
[0256]
向细胞中加入预冷的ripa裂解液(通常6孔板每孔细胞加入100微升裂解液,使用前加入pmsf,使其浓度为1mm)。吹打混匀后,在冰上裂解30分钟后,4℃以14000g离心10分钟。如果是组织,根据组织特性(通常每20毫克组织加入100微升裂解液)加入适量的ripa裂解液,加入钢珠后,选取合适条件,用组织研磨机研磨。
[0257]
离心后,小心吸取上清蛋白裂解液。
[0258]
取样,适当稀释(一般稀释10倍),使用bca法测定蛋白浓度。
[0259]
加入上清体积1/4的5
×
sds-page缓冲液,吹打混匀,95℃金属浴5min,样品保存在-20℃冰箱待用。
[0260]
(2)聚丙烯酰胺凝胶(sds-page胶)的制备:
[0261]
将清洗好并烘干的玻璃板与配胶架固定好。按下表配制10%的下层胶溶液。在配制分离胶溶液时,10%ap、temed溶液最后加,然后立即混匀,并即刻将分离胶溶液加入两玻璃板间。加入的下层胶溶液到达合适高度后,在下层胶溶液表面加1ml的异丙醇。当下层胶凝固后(在异丙醇下可见清晰的界面),倾倒异丙醇,配制上层胶,将上层胶加入两块玻璃板之间,加满后小心吸掉气泡,插入梳齿。上层胶凝固后小心拔出梳齿即可使用。如要保存可以用保鲜膜包住胶置于4℃冰箱中。
[0262]
5%的上层胶及10%的下层胶配方
[0263][0264]
(3)蛋白质垂直凝胶电泳:
[0265]
将胶置于电泳槽中,在槽中加入电泳缓冲液,使整块胶浸没于电泳缓冲液之下,向加样孔中加入蛋白样品,并加入合适的蛋白预染marker。以稳压方式进行电泳,先调节电压强度至80v。待样品完全跑出上层胶,将电压调至120v。根据marker的情况选取合适的电泳时间,终止电泳。
[0266]
(4)转膜
[0267]
将转膜缓冲液提前放在冰箱-20度预冷,在垂直凝胶电泳完成后,拆开电泳槽,小
心撬开玻璃板,切掉凝胶多余部分,泡在转膜缓冲液中,按凝胶大小剪下pvdf膜,在甲醇内浸泡1分钟,使其活化,按照负极-海绵-滤纸-凝胶-pvdf膜-滤纸-海绵-正极的顺序,逐层排列好转膜夹,整个过程在转膜缓冲液浸泡下完成,要保证各层之间没有气泡。将转膜夹插入转膜仪,然后倒入转移缓冲液,放入塑料冰盒并将整个转膜仪埋在冰浴环境中,使整个转膜过程在低温下进行,采用恒流法进行转膜,设定电流为300ma,根据目的蛋白大小确定转膜时间。
[0268]
(5)封闭
[0269]
使用5%脱脂牛奶封闭1h。
[0270]
(6)免疫印迹
[0271]
按照1:2000比例(不同抗体可从1:200-2000范围内选择最适浓度),用5%脱脂牛奶配置一抗,将pvdf膜放入孵育盒中,使配置好的一抗工作液完全浸没pvdf膜,室温缓慢摇动孵育盒,孵育1小时后,4度静置过夜。
[0272]
用tbst缓冲液,在摇床上洗涤pvdf膜,每次15分钟,共洗涤4次;然后同样用5%脱脂牛奶按照1:5000比例稀释二抗,室温缓慢摇动孵育1小时。然后使用tbst清洗条带,每次15分钟,洗4次。
[0273]
(7)曝光
[0274]
将super signal ecl试剂盒中的a\b液等体积混合均匀配成反应液,将pvdf膜放入曝光仪,将反应液加在膜上,通过tanon配套软件进行曝光显影。
[0275]
x.llc原位肺癌模型:
[0276]
为了产生原位肺癌模型,我们通过尾静脉静脉注射5
×
106llc细胞到裸鼠中。30天后,使用非侵入性micro-ct扫描监测小鼠以确保在肺中成功地形成肿瘤。然后,将荷瘤小鼠随机分为4组:每2天静脉注射pbs或5mg/kg cmv-scrr或cmv-sire基因环路,1组5mg/kg吉非替尼灌胃,共治疗7次。治疗过程为期2周。
[0277]
由于需要在特定时间点处死小鼠,用于取组织进行分子生物学分析,因此对于植瘤成功的小鼠进行随机分组,并用于评估存活时间和肿瘤进展。用于存活分析的小鼠,在治疗后一直监测小鼠而不进行任何进一步处理。对于肿瘤进展分析,仅使用micro-ct分析在2周治疗期结束后仍存活的小鼠。在micro-ct扫描后,处死小鼠,取肺组织,并使用组织病理学染色和免疫组织化学方法进行分析,进而采用。
[0278]
xi.kras
lsl-g12d
;p53
fl/f1
转基因肺癌模型
[0279]
1.将6周龄的kraslsl-g12d;p53fl/f1小鼠用适量的5%水合氯醛麻醉。
[0280]
2.按每只小鼠5
×
106pfu的用量吸取表达cre的腺病毒adeno-cre,每只小鼠50μl体积用pbs稀释后备用。
[0281]
3.在小鼠颈部外皮褪毛,沿着颈部腹面中轴纵切小口,暴露主气管。
[0282]
4.用弯头镊子固定气道位置,并引导动脉监测针经口腔插入气管后,注射器推入腺病毒稀释液。
[0283]
5.缝合外皮,并用红霉素软膏处理伤口,以防感染。
[0284]
利用该方法,可以将adeno-cre准确、定向输送至小鼠肺部,而不会滞留在口腔和呼吸道。在吸入后不同时间(30,40和50天)用micro-ct监测确保肿瘤形成。在adeno-cre施用50天后,将小鼠随机分成两组,并通过尾静脉用5mg/kg cmv-scrr或cmv-sirk治疗2周(7
次注射)。然后,监测小鼠以确定存活时间或评估肿瘤生长。
[0285]
xii.小动物micro-ct监测肺部肿瘤进展情况
[0286]
本文采用小动物micro-ct分析的方式评估肺部肿瘤生长,因为即使没有任何造影剂,micro-ct图像也清楚地区分肺肿瘤与周围组织,并且重建的3-d肺图像能更直观地反应出肿瘤在肺组织中的实际位置。使用bruker公司skyscan 1176型micro-ct分析仪进行micro-ct扫描,该分析仪以35μm的分辨率扫描180
°
区域,旋转步长为0.800。该系统包括两个金属陶瓷管,配有固定的0.5毫米铝过滤器和两个1280
×
1024像素的数字x射线摄像机。在50kv和500μa下获得x射线图像。在仰卧位置扫描小鼠。
[0287]
根据制造商(bruker公司)的使用说明,使用n-recon程序对微ct数据进行批量分类,处理和重建。随后使用dataviewer对重建的数据进行成像,辨别并鉴定出肿瘤位置后,进一步使用ctan程序计算肿瘤体积,利用ctvol程序完成全肺重构。
[0288]
xiii.外泌体的分离:
[0289]
从小鼠收集静脉血样并置于血浆分离管中。在室温下使用800
×
g离心10分钟分离血浆,并在室温下以10,000
×
g离心15分钟除去细胞碎片。回收上清血浆,并使用total exosome isolation试剂盒根据制造商的说明分离外泌体。
[0290]
xiv.免疫共沉淀
[0291]
(1)使用ripa裂解液细胞(含1mm pmsf、1%pi)冰上裂解30分钟。
[0292]
(2)12000g 4度离心10分钟。
[0293]
(3)按1:200浓度配置,并加入10ul flag抗体或igg(一抗),4度摇床孵育过夜。
[0294]
(4)加入50ul protein g agarose beads室温孵育2小时。
[0295]
(5)300rpm室温离心5min。
[0296]
(6)使用洗脱液将蛋白洗脱下来后进行免疫印迹分析。
[0297]
xv.统计分析
[0298]
所有结果均以means
±
se表示,2组比较数据用student t-test进行比较分析,多组比较用单因素方差分析进行比较,均通过graphpad 7.0进行分析。p值《0.05视为具有统计学上的差异。
[0299]
实施例1不同可替换元件的验证,以及细胞体外分泌的sirna的干扰效率检测
[0300]
本发明首先设计了基因元件构成的质粒分子(图1)。基于此,构建了针对egfr基因的质粒分子,将启动子元件与sirna表达元件串联,无靶向肽元件,构建了质粒分子,将质粒分子转染进入293t细胞,48小时后收集培养基,检测发现egfr sirna在外泌体中显著富集(图2a),分离外泌体后处理小鼠肺癌细胞系llc,36小时后利用qrt-pcr和western blotting实验检测细胞中egfr基因的mrna和蛋白质表达水平(图2,b和c)。
[0301]
实施例2细胞传输的sirna在体内表达后的各组织分布情况
[0302]
将表达sirna的293t细胞按照1*10^6/20g的剂量对正常小鼠进行尾静脉注射;分别在1、3、6、9、12、24、48小时后,处死小鼠,取小鼠的血浆、肝、肺、肾、肾、脾、脑、心脏、胰腺、肌肉、cd4
t细胞等组织分别检测sirna水平。结果表明,在血浆中能检测到sirna,且主要以微囊泡包裹的形式存在(图3a)。而在肺、肾、脾、胰腺和cd4
t细胞中均能检测到大量的sirna表达,在其他组织中的表达量较低或无信号(图3b)。
[0303]
实施例3细胞传输的sirna对肺部肿瘤模型的治疗效果
[0304]
为了进一步确认细胞传输的sirna在体内的治疗效果,我们利用llc肺癌原位植瘤小鼠模型作为实验对象,确认对肺部肿瘤的治疗效果。我们将原位植瘤成功的小鼠随机分为4组,分别按照1*10^6/20g的剂量注射对照293t细胞、sirna表达293t细胞、pbs以及灌胃吉非替尼药物。每周给药一次,共治疗两周,治疗前后分别利用ct成像的方式检测肺部肿瘤变化情况,并统计小鼠的生存情况。结果表明,在治疗前后,注射sirna表达293t细胞组的小鼠肺部肿瘤体积明显减小,部分小鼠中完全消失,而其他三组小鼠肿瘤均显著增大(图4a)。同时注射sirna表达293t细胞组小鼠生存期得到显著延长(图4b)。
[0305]
实施例4细胞传输的sirna体内安全性检测
[0306]
为了检测该治疗手段的安全性,我们又检测了对照组小鼠和注射sirna表达293t细胞的实验组小鼠血清中谷丙转氨酶(图5a)、谷草转氨酶(图5b)、总胆红素(图5c)、尿素(图5d)、碱性磷酸酶(图5e)和肌酐(图5f)等生化指标的水平。结果显示,注射sirna表达细胞的实验组小鼠上述指标与对照组没有明显差异,是一种比较安全的给药方式。
[0307]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
