1.本发明属于分子生物学技术领域,具体涉及一种检测结核分枝杆菌利福平耐药基因突变情况的试剂盒。
背景技术:
2.结核分枝杆菌是一种常见的,诱发结核病的病原菌。以肺结核为主要发病模式,亦可侵犯全身其他器官。据who估算,2018年,全球估算利福平耐药结核病患者数约为56万,其中多耐药结核病约占82%。在全球30个结核病高负担国家中,利福平耐药结核病患者数最多的为印度(13.5万,占全球的24%)。根据估算结核病发病数计算的中国利福平耐药结核病患者数为7.3万(占全球的13%);根据已发现的肺结核患者数计算的中国利福平耐药肺结核患者数为5.8万;根据已发现的病原学阳性肺结核患者数计算的中国利福平耐药肺结核患者数为2.1万。
3.具有多种耐药性表征的结核分枝杆菌(mycobacterium tuberculosis,mtb)所引起的多耐药结核病(multi-drag resistant tuberculosis,mdr-tb)严重妨碍了我国的结核病防治工作,已成为严重的公共卫生和社会问题。而随着多耐药结核病发病率的逐年上升,被用作一线治疗方案的经典抗结核三药体系(利福平-异烟肼-吡嗪酰胺)的疗效也在逐渐下降。其所导致的常规治疗手段无效化,以及后期的抗药性检测进程均不可避免地增加了治疗成本和周期,使耐药结核病人错过了宝贵的救治期,是导致结核病高致死率的重要原因之一。
4.具体来说,多耐药结核病,是由对两种一线抗结核药物:利福平(rif/rifampicin)和异烟肼(inh/isoniazid)具有抗药性的结核分枝杆菌感染所引起的结核病。其中,利福平作为利福平霉素家族的一员,通过与结核分枝杆菌的dna依赖性rna聚合酶(rnap)的活性位点进行结合,抑制基因组的转录复制进程,进而抑制病菌的正常增殖,从而达到抗菌的目的。而编码该rnap与利福平结合区域亚基部分的基因rpob,在特定情况下易产生突变,从而导致该亚基难以与利福平分子产生有效结合,导致利福平对具有该突变基因的病菌失去效果。其中,约95%的结核分枝杆菌利福平耐药菌株在rpob基因利福平耐药决定区(rif resistance determining region/rrdr)内存在突变,突变一般发生在507~533共27个氨基酸密码子(对应基因长度为81bp)区域内,形式包括点突变、插入及缺失,其中以点突变最为常见,突变率较高的位点主要包括531,526,516等。
5.由此,对多耐药结核病中利福平抗性的及时检测,能够帮助医疗工作者快速确诊和防治多耐药结核病,快速为针对性的治疗提供依据。
技术实现要素:
6.本发明的目的在于提供一种检测结核分枝杆菌利福平耐药基因突变情况的试剂盒。
7.本发明的技术方案如下:
8.一种检测结核分枝杆菌利福平耐药基因突变情况的试剂盒,包括在同一qrt-pcr的反应程序下反应的第一反应管、第二反应管和第三反应管,第一至第三反应管中均含有正向检测引物、反向检测引物、内参正向引物、内参反向引物和内参探针,序列依次如seq id no.01至05所示;
9.第一反应管中还含有如seq id no.06所示的第一检测探针和如seq id no.07所示的第二检测探针;
10.第二反应管中还含有如seq id no.08所示的第三检测探针和如seq id no.09所示的第四检测探针;
11.第三反应管中还含有如seq id no.10所示的第五检测探针;
12.第一检测探针和第四检测探针的5’端修饰有第一荧光基团,3’端修饰有对应于该第一荧光基团的第一猝灭基团;第二检测探针和第三检测探针的5’端修饰有第二荧光基团,3’端修饰有对应于该第二荧光基团的第二猝灭基团;第五检测探针的5’端修饰有第三荧光基团,3’端修饰有对应于该第三荧光基团的第三猝灭基团;内参探针的5’端修饰有第四荧光基团,3’端修饰有对应于该第四荧光基团的第四猝灭基团;第一至第四荧光基团互不相同。
13.在本发明的一个优选实施方案中,所述第一荧光基团为fam、rox、hex、cy5、tet或cal-fluor,所述第一猝灭基团为mgb或dabcyl。
14.在本发明的一个优选实施方案中,所述第二荧光基团为fam、rox、hex、cy5、tet或cal-fluor,所述第二猝灭基团为mgb或dabcyl。
15.在本发明的一个优选实施方案中,所述第四荧光基团为fam、rox、hex、cy5、tet或cal-fluor,所述第四猝灭基团为mgb或dabcyl。
16.在本发明的一个优选实施方案中,所述第三荧光基团为tet,所述第三猝灭基团为dabcyl。
17.在本发明的一个优选实施方案中,所述第一荧光基团为rox,所述第二荧光基团为hex,所述第三荧光基团为tet,所述第四荧光基团为fam。
18.进一步优选的,所述第一猝灭基团和第二猝灭基团为mgb,所述第三猝灭基团为dabcyl,所述第三猝灭基团为bhq-1。
19.在本发明的一个优选实施方案中,所述第一至第三反应管的反应体系以50μl的终体积计算,其ph为8.0,具体配方包括:tris-hcl 10-30mm,mgcl23-6mm,每种dntp 0.2mm,taqdna聚合酶4-8u,内参正向引物和内参反向引物各0.1-0.4μm,正向检测引物和反向检测引物各0.1-0.4μm,内参探针0.05-0.2μm,相应的检测探针各0.05-0.2μm,海藻糖3-6%,聚乙二醇20000.5-2%,牛血清蛋白0.1-1%,甘露醇0.5-2%。
20.进一步优选的,所述反应程序如下表所示:
[0021][0022]
进一步优选的,所述反应体系的物料在未进行反应前处于冻干状态。
[0023]
本发明的有益效果是:本发明基于荧光定量聚合酶链式反应(qrt-pcr)类型中衍生的mgb探针法及分子信标法,在相同的反应体系中,使用不同的探针或分子信标,使用共3个反应管对所述耐药基因中的多个点突变位点进行检测,通过各点突变在体系中所表现的ct值和δct值,判定样本中该耐药基因的点突变类型。
附图说明
[0024]
图1为本发明实施例1的实验结果示例图之一。
[0025]
图2为本发明实施例1的实验结果示例图之二。
[0026]
图3为本发明实施例1的实验结果示例图之三。
[0027]
图4为本发明实施例1的实验结果示例图之四。
[0028]
图5为本发明实施例1的实验结果示例图之五。
具体实施方式
[0029]
以下通过具体实施方式结合附图对本发明的技术方案进行进一步的说明和描述。
[0030]
实施例1
[0031]
一种检测结核分枝杆菌利福平耐药基因突变情况的试剂盒,基于荧光定量聚合酶链式反应(qrt-pcr)类型中衍生的mgb探针法及分子信标法。在相同的反应体系中,使用不同的探针或分子信标,使用共3个反应管对结核分枝杆菌利福平耐药基因中的多个点突变位点进行检测。通过各点突变在体系中所表现的ct值和δct值,判定样本中该耐药基因的点突变类型。该δct值为突变位点的突变类型扩增反应结果中的ct值与野生类型扩增反应结果中的ct值之差。
[0032]
该结核分枝杆菌利福平耐药基因为利福平耐药抗性决定区(rifampicinresistancedeterminingregion,rrdr)的81个碱基对(bp)长度的片段,密码子rpob506-rpob533中,突变点为510g>c/t,511t>c,515g>a,516g>t,516a>t,516c>g,521c>a,522c>t,526c>t/g,526a>g/t,531c>t/g,531g>t以及533t>c
[0033]
包括在同一qrt-pcr的反应程序下反应的第一反应管、第二反应管和第三反应管,第一至第三反应管中均含有正向检测引物、反向检测引物、内参正向引物、内参反向引物和内参探针,序列依次如seq id no.01至05所示;
[0034]
第一反应管中还含有如seq id no.06所示的第一检测探针和如seq id no.07所示的第二检测探针,该第一反应管可检测的突变点为510g>c/t,511t>c,521c>a,522c>
t以及对应内参基因;
[0035]
第二反应管中还含有如seq id no.08所示的第三检测探针和如seq id no.09所示的第四检测探针,该第二反应管可检测的突变点为515g>a,516g>t,516a>t,516c>g,526c>t/g,526a>g/t以及对应内参基因;
[0036]
第三反应管中还含有如seq id no.10所示的第五检测探针,该第三反应管可检测的突变点为531c>t/g,531g>t,533t>c以及对应内参基因;
[0037]
上述内参基因为β肌动蛋白(β-actin)编码基因。
[0038]
第一检测探针和第四检测探针的5’端修饰有第一荧光基团,3’端修饰有对应于该第一荧光基团的第一猝灭基团;第二检测探针和第三检测探针的5’端修饰有第二荧光基团,3’端修饰有对应于该第二荧光基团的第二猝灭基团;第五检测探针的5’端修饰有第三荧光基团,3’端修饰有对应于该第三荧光基团的第三猝灭基团;内参探针的5’端修饰有第四荧光基团,3’端修饰有对应于该第四荧光基团的第四猝灭基团。
[0039]
本实施例中,第一荧光基团为rox,第二荧光基团为hex,第三荧光基团为tet,第四荧光基团为fam,第一猝灭基团和第二猝灭基团为mgb,第三猝灭基团为dabcyl,第三猝灭基团为bhq-1。
[0040]
本实施例中的具体引物和探针如下表1和表2所示:
[0041]
表1
[0042][0043]
表2
[0044][0045]
所述第一至第三反应管的反应体系以50μl的终体积计算,其ph为8.0,具体配方包括:tris-hcl 10-30mm,mgcl23-6mm,每种dntp 0.2mm,taqdna聚合酶4-8u,内参正向引物和内参反向引物各0.1-0.4μm,正向检测引物和反向检测引物各0.1-0.4μm,内参探针0.05-0.2μm,相应的检测探针各0.05-0.2μm,海藻糖3-6%(w/v),聚乙二醇20000.5-2%(w/v),牛血清蛋白0.1-1%(w/v),甘露醇0.5-2%(w/v)。
[0046]
所述反应程序如下表3所示:
[0047]
表3
[0048][0049]
所述反应体系的物料在未进行反应前处于冻干状态,在扩增前加入终浓度(以终体积为50μl反应体系)为2%(w/v)的甲酰胺与0.15m的甜菜碱以确保扩增性能。上述冻干的程序如下表4所示,并在冻干的处理过程的前后直至密封时,使室内相对湿度不高于30%:
[0050]
表4
[0051][0052][0053]
本实施例的试剂盒的使用方法如下:
[0054]
(1)样品准备及加样
[0055]
若样品为:i.固体培养基上的菌落,需使用22swg标准接种环收集细菌1环,于200μl生理盐水中悬浮均匀;ii.液体培养基中的菌体,需使用1ml菌液,任一离心机中10000rpm离心15分钟,弃上清并使用200μl生理盐水悬浮均匀;iii.病人体液样本,需使用1m氢氧化钠溶液进行液化后,在任意离心机中10000rpm离心15分钟,弃上清后使用250μl生理盐水洗涤2遍,再重悬于200μl生理盐水中。重悬后的样品用移液枪加入第一至第三反应管中,然后封闭第一至第三反应管。
[0056]
(3)pcr扩增
[0057]
将第一至第三反应管置于荧光pcr仪上,根据表3所示的反应程序进行反应,反应完成后对扩增结果进行判定,具体的判定的规则如下:
[0058]
若内参基因无扩增信号,则需使用新反应体系重新检测。
[0059]
若内参基因有扩增信号时:
[0060]
1)仅针对各探针覆盖位点判定其覆盖突变位点中是否出现突变,而不判读具体突变位点与突变碱基详情。
[0061]
①
以下2种情况判定rpob510或511位点有突变:i.第一反应管中的hex通道、第二反应管中的hex通道与rox通道和第三反应管中的tet通道,以上通道至少有一个出现显著扩增的情况下,且所有第一至第三反应管中的fam通道皆出现显著扩增的前提下,第一反应管中的rox通道无扩增信号;ii.第一反应管中的hex通道、第二反应管中的hex通道与rox通道和第三反应管中的tet通道,以上通道至少有一个出现显著扩增的情况下,且所有第一至
第三反应管中的fam通道皆出现显著扩增的前提下,第一反应管中的rox通道与第一反应管中的hex通道、第二反应管中的hex通道与rox通道和第三反应管中的tet通道中任意一个通道的δct值相差≥3;
[0062]
②
以下2种情况判定rpob515或516位点有突变:i.第二反应管中的rox通道、第一反应管中的hex通道与rox通道和第三反应管中的tet通道,以上通道至少有一个出现显著扩增的情况下,且所有第一至第三反应管中的fam通道皆出现显著扩增的前提下,第二反应管中的hex通道无扩增信号;ii.第二反应管中的rox通道、第一反应管中的hex通道与rox通道和第三反应管中的tet通道,以上通道至少有一个出现显著扩增的情况下,且所有第一至第三反应管中的fam通道皆出现显著扩增的前提下,第二反应管中的hex通道与第二反应管中的rox通道、第一反应管中的hex通道与rox通道和第三反应管中的tet通道中任意一个通道的δct值相差≥3;
[0063]
③
以下2种情况判定rpob526位点有突变:i.第二反应管中的hex通道、第一反应管中的hex通道与rox通道和第三反应管中的tet通道,以上通道至少有一个出现显著扩增的情况下,且所有第一至第三反应管中的fam通道皆出现显著扩增的前提下,第二反应管中的rox通道无扩增信号;ii.第二反应管中的hex通道、第一反应管中的hex通道与rox通道和第三反应管中的tet通道,以上通道至少有一个出现显著扩增的情况下,且所有第一至第三反应管中的fam通道皆出现显著扩增的前提下,第二反应管中的rox通道与第二反应管中的hex通道、第一反应管中的hex通道与rox通道和第三反应管中的tet通道中任意一个通道的δct值相差≥3;
[0064]
④
以下2种情况判定rpob521或522位点有突变:i.第一反应管中的rox通道、第二反应管中的hex通道与rox通道和第三反应管中的tet通道,以上通道至少有一个出现显著扩增的情况下,且所有第一至第三反应管中的fam通道皆出现显著扩增的前提下,第一反应管中的hex通道无扩增信号;ii.第一反应管中的rox通道、第二反应管中的hex通道与rox通道和第三反应管中的tet通道,以上通道至少有一个出现显著扩增的情况下,且所有第一至第三反应管中的fam通道皆出现显著扩增的前提下,第一反应管中的hex通道与第一反应管中的rox通道、第二反应管中的hex通道与rox通道和第三反应管中的tet通道中任意一个通道的δct值相差≥3;
[0065]
⑤
以下2种情况判定rpob531或533位点有突变:i.第一反应管和第二反应管中的hex通道与rox通道,以上通道至少有一个出现显著扩增的情况下,且所有第一至第三反应管中的fam通道皆出现显著扩增的前提下,第三反应管中的tet通道无扩增信号;ii.i.第一反应管和第二反应管中的hex通道与rox通道,以上通道至少有一个出现显著扩增的情况下,且所有第一至第三反应管中的fam通道皆出现显著扩增的前提下,第三反应管中的tet通道与第一反应管和第二反应管中的hex通道与rox通道中任意一个通道的δct值相差≥3;
[0066]
⑥
以下2种情况判定样本中所含结核分枝杆菌为rpob基因野生型,即对应的非耐药菌株:i.所有第一至第三反应管中的fam通道皆出现显著扩增,且第一至第三反应管内的hex、rox和tet通道扩增水平一致;ii.所有第一至第三反应管中的fam通道皆出现显著扩增,且第一至第三反应管内的hex、rox和tet通道任意两个通道的δct值相差≤6。
[0067]
⑦
以下情况判定样本中不含有结核分枝杆菌的核酸片段:所有第一至第三反应管
中的fam通道皆出现显著扩增,同时第一至第三反应管内的hex、rox和tet通道任意通道均无扩增。
[0068]
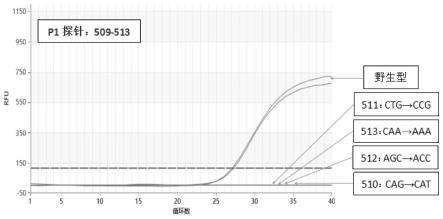
具体的扩增结果的示例如图1至图5所示。图1显示阳性参照品中,rpob510和rpob511野生型以及对应基因510g>c/t,511t>c,511c>a四种突变模式的扩增曲线图。野生型和各突变型的扩增曲线已于图上标出。图2显示阳性参照品中,rpob510和rpob511野生型以及对应基因515g>a,516g>t,516a>t,516c>g四种突变模式的扩增曲线图。野生型和各突变型的扩增曲线已于图上标出。图3显示阳性参照品中,rpob526的野生型以及对应基因526c>t/g,526a>g/t四种突变模式的扩增曲线图。野生型和各突变型的扩增曲线已于图上标出。图4显示阳性参照品中,rpob531和rpob533的野生型以及对应基因531c>t/g,531g>t,533t>c四种突变模式的扩增曲线图。野生型和各突变型的扩增曲线已于图上标出。图5显示阳性参照品中,rpob521和rpob522的野生型以及对应基因521c>a,522c>t两种突变模式的扩增曲线图。野生型和各突变型的扩增曲线已于图上标出。
[0069]
以上所述,仅为本发明的较佳实施例而已,故不能依此限定本发明实施的范围,即依本发明专利范围及说明书内容所作的等效变化与修饰,皆应仍属本发明涵盖的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。