clinic.j clin invest 117,1466-1476.
10.非专利文献2:wu,r.,forget,m.a.,chacon,j.,bernatchez,c.,haymaker,c.,chen,j.q.,hwu,p.,and radvanyi,l.g.(2012).adoptive t-cell therapy using autologous tumor-infiltrating lymphocytes for metastatic melanoma:current status and future outlook.cancer j 18,160-175.
11.非专利文献3:rosenberg,s.a.and dudley,m.e.(2009).adoptive cell therapy for the treatment of patients with metastatic melanoma.curr opin immunol 21,233-240.
12.非专利文献4:fesnak,a.d.,june,c.h.,and levine,b.l.(2016).engineered t cells:the promise and challenges of cancer immunotherapy.nat rev cancer 16,566-581.
13.非专利文献5:klebanoff,c.a.,acquavella,n.,yu,z.,and restifo,n.p.(2011).therapeutic cancer vaccines:are we there yet?immunol rev 239,27-44.
14.非专利文献6:jiang,y.,li,y.,and zhu,b.(2015).t-cell exhaustion in the tumor microenvironment.cell death dis 6,e1792.
15.非专利文献7:gattinoni,l.,klebanoff,c.a.,palmer,d.c.,wrzesinski,c.,kerstann,k.,yu,z.,finkelstein,s.e.,theoret,m.r.,rosenberg,s.a.,and restifo,n.p.(2005).acquisition of full effector function in vitro paradoxically impairs the in vivo antitumor efficacy of adoptively transferred cd8 t cells.j clin invest 115,1616-1626.
16.非专利文献8:lanzavecchia,a.and sallusto,f.(2005).understanding the generation and function of memory t cell subsets.curr opin immunol 17,326-332.
17.非专利文献9:gattinoni,l.(2014).memory t cells officially join the stem cell club.immunity 41,7-9.
18.非专利文献10:gattinoni,l.,speiser,d.e.,lichterfeld,m.,and bonini,c.(2017).t memory stem cells in health and disease.nat med 23,18-27.
19.非专利文献11:gattinoni,l.,lugli,e.,ji,y.,pos,z.,paulos,c.m.,quigley,m.f.,almeida,j.r.,gostick,e.,yu,z.,carpenito,c.,et al.(2011).a human memory t cell subset with stem cell-like properties.nat med 17,1290-1297.
20.非专利文献12:kondo,t.,morita,r.,okuzono,y.,nakatsukasa,h.,sekiya,t.,chikuma,s.,shichita,t.,kanamori,m.,kubo,m.,koga,k.,et al.(2017).notch-mediated conversion of activated t cells into stem cell memory-like t cells for adoptive immunotherapy.nat commun 8,15338.
21.非专利文献13:fraietta,j.a.,lacey,s.f.,orlando,e.j.,pruteanu-malinici,i.,gohil,m.,lundh,s.,boesteanu,a.c.,wang,y.,o'connor,r.s.,hwang,w.t.,et al.(2018a).determinants of response and resistance to cd19 chimeric antigen receptor(car)t cell therapy of chronic lymphocytic leukemia.nat med 24,563-571.
22.非专利文献14:xu,y.,zhang,m.,ramos,c.a.,durett,a.,liu,e.,dakhova,o.,liu,h.,creighton,c.j.,gee,a.p.,heslop,h.e.,et al.(2014).closely related t-memory stem cells correlate with in vivo expansion of car.cd19-t cells and are preserved by il-7and il-15.blood123,3750-3759.
23.非专利文献15:kondo,t.,imura,y.,chikuma,s.,hibino,s.,omata-mise,s.,ando,m.,akanuma,t.,iizuka,m.,sakai,r.,morita,r.,and yoshimura,a.(2018).generation and application of human induced-stem cell memory t cells for adoptive immunotherapy.cancer sci109,2130-2140.
技术实现要素:
24.发明要解决的课题
25.本发明的目的在于消除在t细胞转移疗法中成为问题的t细胞的耗竭,提高t细胞的活性。更具体地,其目的在于制备具有cd45ra
和ccr7
的细胞表面标志物的t细胞。
26.用于解决课题的手段
27.本发明人为了解决上述课题进行了深入研究,发现通过使用基质细胞的细胞培养上清液或cxcl12培养活化的t细胞,得到具有cd45ra
和ccr7
的细胞表面标志物的t细胞,从而完成了本发明。
28.本发明包含以下发明[1]~[13],但不限于此。
[0029]
[1]一种制备细胞表面标志物为cd45ra
和ccr7
的t细胞的方法,其包括使用基质细胞的细胞培养上清液培养t细胞的工序。
[0030]
[2]根据[1]所述的方法,其还包括活化t细胞而得到活化t细胞的工序。
[0031]
[3]根据[1]或[2]所述的方法,其中,基质细胞为选自op9细胞、tst-4细胞和在这些细胞中表达了notch配体的细胞的任意1种以上。
[0032]
[4]根据[1]~[3]中任一项所述的方法,其中,基质细胞为op9-dll1细胞。
[0033]
[5]根据[1]~[4]中任一项所述的方法,其还包括notch信号传导工序。
[0034]
[6]根据[5]所述的方法,其中,notch信号传导工序使用选自dll4、dll1、jag1、jag2和它们的重组体的任意1种以上的notch配体来进行。
[0035]
[7]根据[5]或[6]所述的方法,其中,notch信号传导工序使用重组dll1来进行。
[0036]
[8]根据[5]~[7]中任一项所述的方法,其中,notch信号传导工序利用foxm1或nicd的强制表达来进行。
[0037]
[9]根据[1]~[8]中任一项所述的方法,其中,细胞表面标志物为cd45ra
且ccr7
的t细胞具有cd45ro-和cd62l
的细胞表面标志物。
[0038]
[10]根据[1]~[9]中任一项所述的方法,其中,t细胞为car-t细胞。
[0039]
[11]一种通过根据[1]~[10]中任一项所述的方法制备的t细胞。
[0040]
[12]一种含有根据[11]所述的t细胞的细胞药物。
[0041]
[13]根据[12]所述的细胞药物,其用于治疗选自癌症、感染病、自身免疫性疾病和过敏症的1种以上。
[0042]
作为本发明的另一实施方式,包含以下发明[1a]~[14a]。
[0043]
[1a]一种制备具有cd45ra
和ccr7
的细胞表面标志物的t细胞的方法,其包括在
(a)基质细胞的细胞培养上清液或(b)cxcl12的存在下培养作为原料的t细胞的工序。
[0044]
[2a]根据[1a]所述的方法,其还包括在所述培养工序之前活化作为原料的t细胞的工序。
[0045]
[3a]根据[1a]或[2a]所述的方法,其中,基质细胞为选自op9细胞、tst-4细胞和在这些细胞中表达了notch配体的细胞的任意1种以上。
[0046]
[4a]根据[1a]~[3a]中任一项所述的方法,其中,基质细胞为op9-dll1细胞。
[0047]
[5a]根据[1a]~[4a]中任一项所述的方法,其还包括在所述培养工序之前或所述培养工序中活化notch信号。
[0048]
[6a]根据[5a]所述的方法,其中,notch信号的活化使用选自dll4、dll1、jag1、jag2和它们的重组体的任意1种以上的notch配体来进行。
[0049]
[7a]根据[5a]或[6a]所述的方法,其中,notch信号的活化使用重组dll1来进行。
[0050]
[8a]根据[5a]~[7a]中任一项所述的方法,其中,notch信号的活化利用foxm1或nicd的强制表达来进行。
[0051]
[9a]根据[1a]~[8a]中任一项所述的方法,其中,具有cd45ra
和ccr7
的细胞表面标志物的t细胞具有cd45ro-和cd62l
的细胞表面标志物。
[0052]
[10a]根据[1a]~[9a]中任一项所述的方法,其中,作为原料的t细胞为car-t细胞。
[0053]
[11a]根据[1a]~[10a]中任一项所述的方法,其中,在cxcl12存在下培养的工序中添加igf-i。
[0054]
[12a]一种通过根据[1a]~[11a]中任一项所述的方法制备的t细胞。
[0055]
[13a]一种含有根据[12a]所述的t细胞的细胞药物。
[0056]
[14a]根据[13a]所述的细胞药物,其用于治疗选自癌症、感染病、自身免疫性疾病和过敏症的1种以上。
[0057]
发明效果
[0058]
根据本发明的制备方法,通过在基质细胞的细胞培养上清液(条件培养基(conditioned medium):cm)或cxcl12的存在下培养活化的t细胞,可简便且有效地得到具有cd45ra
和ccr7
的细胞表面标志物的t细胞。
[0059]
根据本方法,不同于通过与饲养细胞共培养而制作的以往的it
scm
细胞,由于不需要除去饲养细胞的工序,例如在car-t疗法和过继性t细胞疗法等的应用中是有利的。
附图说明
[0060]
[图1]图1显示用于在t细胞中过表达nicd的实验设计方案(tcr stimuli:tcr刺激,prime:预刺激,expansion:扩增培养,t
scm-like induction:t
scm
样细胞诱导)。
[0061]
[图2]图2显示为了制作nicd强制表达t细胞而使用的nicd过表达逆转录病毒载体的构建体的示意图。
[0062]
[图3]图3显示诱导至记忆性干细胞样细胞前后的导入空载体的人cd8α
t细胞(empty)或nicd强制表达人cd8α
t细胞(nicd)中的cd45ra和ccr7的表达(左图)和诱导至记忆性干细胞样t细胞前后的cd45ra
ccr7
细胞的细胞数(%)(右图)。
[0063]
[图4]图4显示为了制作foxm1强制表达t细胞而使用的foxm1过表达逆转录病毒载
体的构建体的示意图。
[0064]
[图5]图5显示导入空载体的t细胞(empty)或foxm1基因强制表达t细胞(foxm1δn)中的诱导至记忆性干细胞样t细胞前后的cd45ra、ccr7和cd27表达与诱导至记忆性干细胞样t细胞前后的cd45ra
ccr7
和cd45ra
ccr7
cd27
高
细胞的细胞数(%)。
[0065]
[图6]图6显示导入空载体的t细胞(empty)或foxm1基因强制表达t细胞(foxm1δn)中的诱导至记忆性干细胞样t细胞前后的cd45ra、ccr7和cd27表达与诱导至记忆性干细胞样t细胞前后的cd45ra
ccr7
和cd45ra
ccr7
cd27
高
细胞的细胞数(%)。
[0066]
[图7]图7显示在第0天(左图)或第11天(右图)空载体或foxm1强制表达t细胞中的foxm1表达。foxm1基因表达用18srrna表达水平归一化。
[0067]
[图8]图8显示在添加了foxm1抑制剂硫链丝菌素或dmso的情况下的与op9-hdll1细胞进行共培养的人cd8α
t细胞(on fc,fc上)、与op9-hdll1细胞进行共培养的导入空载体的t细胞(empty on fc,fc上空载体)、在op9-hdll1细胞的培养上清液中进行培养的foxm1强制表达t细胞(foxm1δn in cm,cm中的foxm1δn)中的cd45ra和ccr7的表达(各组n=3)。
[0068]
[图9]图9显示在添加了foxm1抑制剂硫链丝菌素或dmso的情况下的与op9-hdll1细胞进行共培养的人cd8α
t细胞(on fc,fc上)、与op9-hdll1细胞进行共培养的导入空载体的t细胞(empty on fc,fc上空载体)、在op9-hdll1细胞的培养上清液中进行培养的foxm1强制表达t细胞(foxm1δn in cm,cm中的foxm1δn)中的cd45ra和ccr7的表达(各组n=3)。
[0069]
[图10]图10是显示cd45ra和ccr7的表达情况的图(左:阴性对照,右:阳性对照)。
[0070]
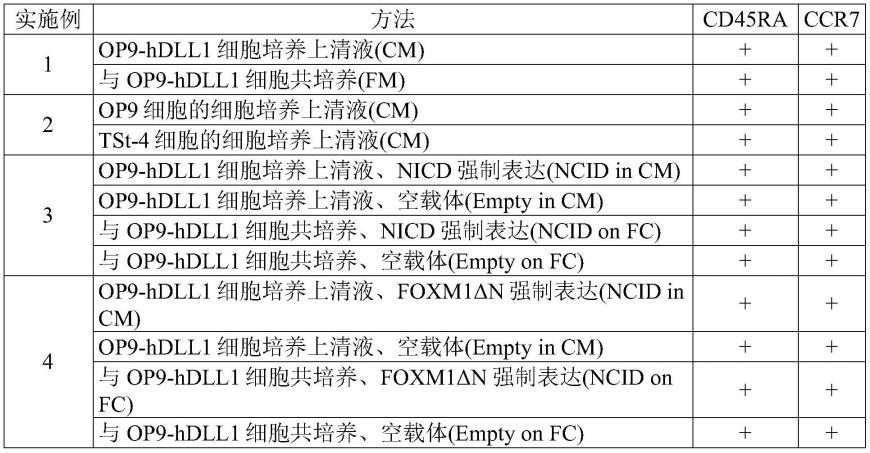
[图11]图11显示与hprt、cxcl12、scf、il-7、flt3l的基因表达(gene expression)相关的电泳结果(实施例6)。
[0071]
[图12]图12是定量cxcl12浓度(concentration)的结果(实施例6)。
[0072]
[图13]图13是显示cd45ra和ccr7均为阳性的细胞的比例的图(实施例7)。
[0073]
[图14]图14是显示从小鼠采集的血液中(blood)的nalm6癌细胞数的图(实施例8)。
具体实施方式
[0074]
本发明的一个实施方式是一种具有cd45ra
和ccr7
的细胞表面标志物的t细胞的制备方法,其包括在基质细胞的细胞培养上清液的存在下培养t细胞的工序。本发明的另一实施方式是一种具有cd45ra
和ccr7
的细胞表面标志物的t细胞的制备方法,其包括在cxcl12的存在下培养t细胞的工序。根据本实施方式的方法,可不与饲养细胞进行共培养而得到具有cd45ra
和ccr7
的细胞表面标志物的t细胞。
[0075]
本发明的方法只要包括在基质细胞的细胞培养上清液或cxcl12的存在下培养t细胞的工序,则没有特殊限定,其它工序可组合公知的工序来进行,本发明例如可包括下述工序:
[0076]
(1)活化t细胞的工序(活化工序),
[0077]
(2)将基因导入t细胞的工序(基因导入工序),
[0078]
(3)notch信号的活化工序(notch信号传导工序),和/或
[0079]
(4)具有cd45ra
和ccr7
的细胞表面标志物的记忆性干细胞样t细胞的细胞回收、分离和/或纯化的工序。
[0080]
这些工序的顺序只要在以下没有特殊限定,则本领域技术人员可适当选择,(3)工序可与(1)或(2)工序同时进行。
[0081]
通常,t细胞是指在细胞表面具有tcr的细胞,但在本说明书中“t细胞”可以是除了t细胞本身还含有其它细胞种类的细胞群,例如可以是含有60%以上、70%以上、80%以上、90%以上或95%以上的t细胞的细胞群。另外,t细胞包含所有分化阶段的t细胞,可以是使细胞表面具有抗原或标志物的t细胞。
[0082]
在本说明书中“记忆性干细胞样t细胞”是指具有cd45ra
和ccr7
的细胞表面标志物的t细胞。在优选的实施方式中,记忆性干细胞样t细胞除了cd45ra
和ccr7
以外还具有cd45ro-和cd62l
的细胞表面标志物。在记忆性干细胞样t细胞中,例如可包含称为t
scm
细胞或it
scm
细胞的公知的细胞。
[0083]
在本说明书中“活化t细胞”是指具有cd4
ccr7-cd45ra-或cd8
ccr7-cd45ra-的细胞表面标志物的t细胞。在优选的实施方式中,活化t细胞具有cd8
ccr7-cd45ra-的细胞表面标志物。在一个实施方式中,在基质细胞的细胞培养上清液或cxcl12的存在下培养t细胞的工序中,作为原料的t细胞可以是活化t细胞,在这种情况下,作为原料的t细胞与活化t细胞同义。
[0084]
活化t细胞的获取、配制可通过本领域技术人员公知的方法进行,例如,作为原料,可使用市售的t细胞群、从人(例如健康的供体、患有特定疾病的供体、患者自身)采集的t细胞群或从这些t细胞群分离、浓缩的期望的t细胞。例如,通过用抗cd3/cd28抗体刺激作为人外周血单核细胞(precision bioservices公司制)市售的细胞,可作为活化t细胞使用。
[0085]
本发明中可使用的活化t细胞除了通过上述方法得到的t细胞以外,可以是对es细胞或诱导多能干细胞(ips细胞)等重编程的未分化细胞进行分化诱导,或对幼稚t细胞等未成熟t细胞进行分化诱导而制作的活化t细胞,也可以是通过基因导入工序修饰为表达特定的t细胞受体(tcr)或嵌合抗原受体(car)的活化t细胞,还可以是通过实施notch信号的活化处理而表达notch相关基因的活化t细胞。
[0086]
基质细胞(stromal cell)也被称为间质细胞,是提供干细胞或幼稚细胞维持存活或分化的环境的细胞,在用作饲养细胞的情况下被认为提供、产生细胞之间的接触刺激或营养因子。在本说明书中“基质细胞”是指基质细胞或对其进行修饰的细胞,例如包含来源于骨髓的op9细胞、tst-4细胞和在这些细胞中表达了notch配体的细胞(例如op9-dll1细胞、tst-4-dll1细胞),优选为op9细胞或表达其notch配体的细胞,更优选为op9-hdll1细胞。
[0087]
作为在基质细胞中表达的notch配体,例如包含dll1、dll4、jag1、jag2或它们的组合,可以是完全的、部分的或修饰的配体,优选为dll1,更优选为hdll1(人dll1)。
[0088]
已知通过使用表达notch配体的op9细胞,可使多能干细胞分化成各种组织的细胞。例如,小鼠来源的op9-dll1细胞常用于在试管内产生免疫细胞或由ips细胞分化诱导t细胞,也报道了通过使用op9-dll1细胞的细胞培养上清液的培养,可由未成熟t细胞分化为成熟t细胞。但是,尚不知晓可使用基质细胞的细胞培养上清液或cxcl12,由成熟t细胞诱导至记忆性干细胞样t细胞。
[0089]
本说明书中的“基质细胞的细胞培养上清液”可通过在培养基中培养基质细胞,得到其细胞培养上清液来配制。例如,可将基质细胞在含有αmem(gibco公司)、胎牛血清(20%,fbs)、青霉素-链霉素溶液(1%,thermofisher公司)等的培养基中,在37℃、5体积%co2的条件下培养1天~2天后,回收培养上清液,通过0.45微米的过滤器过滤而得到。培养中的培养基的更换可适当进行,例如在细胞达到100%汇合时更换。培养液中含有的基质细胞的浓度没有特殊限定,优选为1~2
×
105个/10ml/10cm培养皿。
[0090]“cxcl12”是cxc基序趋化因子的一种,cxcl12及其受体cxcr4与b细胞和骨髓系细胞的产生或造血干细胞向骨髓的归巢有关。由janas等报道了op9-dll1细胞产生cxcl12,cxcl12/cxcr4信号传导有助于前t细胞的增殖和分化(michelle l.janas et al.j exp med.2010jan 18;207(1):247-261)。
[0091]
在本说明书中“在基质细胞的细胞培养上清液的存在下培养t细胞的工序”只要是使用基质细胞的细胞培养上清液的培养工序,则没有特殊限定,可采用本领域技术人员公知的培养方法进行。另外,在本说明书中“在cxcl12的存在下培养t细胞的工序”只要是使用cxcl12的培养工序,则没有特殊限定,可采用本领域技术人员公知的培养方法进行。(以下,对于在基质细胞的细胞培养上清液的存在下培养t细胞的工序和在cxcl12的存在下培养t细胞的工序,有时也简称为培养工序)。
[0092]
在培养工序中使用的培养基和添加剂没有特殊限定,可将通常已知适合于细胞粘附或细胞诱导的培养基和添加剂包被、添加到市售的培养容器中来使用。例如,作为培养基,可使用αmem(gibco公司),作为添加剂,例如可使用人il-7(peprotech公司)等各种细胞因子。
[0093]
本工序的培养方法、条件只要是可由t细胞(特别是活化t细胞)制备记忆性干细胞样t细胞的条件,则没有特殊限定,可采用本领域技术人员公知的培养方法、条件。例如,将活化t细胞接种在添加有上述添加剂的培养基中,加入基质细胞的细胞培养上清液或cxcl12,在约37℃的温度下培养9~11天,更优选培养10~11天。培养上清液的更换可每2~5天、优选每2~4天进行。例如,在t细胞中添加op9-hdll1细胞培养上清液(1~10ml)或cxcl12,在37℃的温度下进行11天的培养,每2~4日进行培养上清液的更换。
[0094]
在一个实施方式中,培养工序不需要饲养细胞。在本说明书中“不需要饲养细胞”是指在实质上不含有饲养细胞的培养条件下进行,特别是指在与饲养细胞共培养以外的条件下进行。
[0095]
本发明可包括notch信号的活化工序(也称为notch信号传导工序)。通过notch信号的活化,引发或介导与notch配体相关的信号传导。notch信号的活化没有特殊限定,优选利用选自重组dll1、foxm1强制表达、nicd强制表达和它们的组合的至少1种来进行。
[0096]
已知“notch信号的活化”在发育过程的各种组织构建过程中对细胞的增殖或分化等细胞的命运决定起到重要的作用。存在被称为notch1、notch2、notch3和notch4的4种不同的notch受体。notch受体是通过与邻近细胞上的delta(在人中被称为delta样)和serrate(在人中被称为jagged)等跨膜配体相互作用而传导短距离信号的细胞表面受体。即,存在于发送信号一侧的细胞中的delta样(dll1、dll3、dll4)和jagged(jag1、jag2)家族成员作为针对notch受体的配体发挥作用。
[0097]
notch信号的活化中的“notch配体”与上述关于基质细胞的notch配体相同,包含
dll4、dll1、jag1、jag2或它们的组合,可以是完全的、部分的或修饰的配体,优选为dll1,更优选为hdll1。
[0098]“notch受体”的种类没有特殊限定,优选为notch1、notch2或它们的组合。
[0099]
notch信号的活化可在固定有notch配体肽的固体材料(基材)上进行,例如,可使用各种notch配体的可溶性肽作为notch配体肽,结合/固定于聚苯乙烯制板或珠等固体材料来进行。在使用“重组dll1”的情况下,例如使用人fc-dll1(adipogen公司制),固定在聚苯乙烯制板上来进行。在这种情况下,可同时进行培养工序和notch信号的活化。通过与培养工序同时进行,在不需要预先制作强制表达与notch信号活化有关的基因的t细胞的方面是有利的。
[0100]
notch信号的活化也可利用强制表达与notch信号有关的基因的t细胞来进行。即,notch信号的活化包括在活化t细胞中强制表达与notch信号有关的基因。基因的种类没有特殊限定,例如列举出foxm1和nicd,它们可具有完全的、部分的或修饰的序列,例如可具有n末端缺失foxm1(foxm1δn)。基因的强制表达可依据本领域技术人员公知的方法进行。
[0101]“nicd”是指notch胞内结构域,已知通过结合notch配体而被切割和释放,然后nicd转移至细胞核,活化notch的靶基因。
[0102]
已知“foxm1”(叉头盒蛋白m1(forkhead box protein m1))调节细胞周期进程g2/m检查点和其它细胞周期相关基因,也已知其不仅调节细胞周期,还调节各种肿瘤中的干性(stemness)、线粒体功能、氧化还原网络。虽然尚不知晓其与notch信号传导有关,但通过下述实验3和4所示的本发明人的研究,首次发现foxm1是notch信号传导中的主要下游基因,并且可正向(positive)控制t
scm
样表型的诱导。
[0103]
本发明也可在cxcl12和igf-i的存在下培养t细胞。“igf-i”是具有与胰岛素类似分子结构的单链多肽。igf-i在肝脏中生长激素依赖性地产生,与各种细胞的增殖或骨形成有关。报道了在前t细胞的分化中也发挥重要的作用(o kecha et al.endocrinology.2000mar;141(3):1209-17)。
[0104]“scf”、“il-7”和“flt3l”都是与包含前t细胞的淋巴细胞的产生和分化有关的细胞因子和增殖因子(p j morrissey et al.cell immunol.1994aug;157(1):118-31.,t a moore and a zlotnik j immunol.1997may 1;158(9):4187-92)。在本说明书中,hprt(次黄嘌呤磷酸核糖转移酶(hypoxanthine phosphoribosyltransferase))用作对照的管家基因。
[0105]
在本说明书中,“活化t细胞的工序”是典型地在培养工序之前进行的工序,可包括为了得到活化t细胞而进行的所有工序。本工序例如包括通过分化诱导得到利用抗cd3/cd28抗体珠eb病毒转化的b细胞、导入car基因或tcr基因的细胞等活化t细胞的工序,向t细胞导入基因的基因导入工序,和它们的组合,这些工序可以适合于得到作为目标的活化t细胞的顺序进行。
[0106]
在本说明书中,“向t细胞导入基因的基因导入工序”是指得到基因修饰t细胞的工序。基因导入可对所有发育阶段的t细胞进行,基因的种类或基因导入方法没有特殊限定,可根据作为目标的记忆性干细胞样t细胞应具备的性质或功能导入1个或多个基因。例如,通过基因导入工序得到的活化t细胞为car-t细胞。由于导入的遗传信息即使经过本实施方式的培养工序也被维持,通过使用具有所需遗传信息的活化t细胞,可得到能够用于作为目
标的细胞疗法的记忆性干细胞样t细胞。t细胞可以是自体细胞,也可以是异体细胞。
[0107]
基因导入例如包括(i)b2m、tap1、tap2、tapasin、nlrc5、lag3、tim3、rfxank、citta、rfx5或rfxap的表达的缺失或减少,(ii)pd?1、socs1/3、hla-e、hla-g、hacd16、41bbl、cd3、cd4、cd8、cd47、cd137、cd80、pdl1、a2ar、活化stat3、car、tcr或针对双特异性或多特异性接合器的表面诱导受体的表达的导入或增加中的1种或多种,特别优选car的表达导入。
[0108]
car(嵌合抗原受体)由t细胞膜内侧的胞内结构域、外侧的胞外结构域、连接它们的间隔区和跨膜结构域构成。胞内结构域的cd3ζ链结合于cd28或4-1bb等共刺激结构域,共刺激结构域增强car-t细胞的细胞增殖,发挥保护原本存在的内源性t细胞的抗凋亡功能的作用。cd3ζ链主导信号的活化和car-t的扩增。作为胞外结构域的单链可变片段scfv与目标元件(targeting element)一起同肿瘤抗原结合。在本发明中,car构建体可使用本技术领域已知的任意的构建体。作为car中的抗原结合结构域,例如可使用cd19或cd20等,优选使用cd19。
[0109]
用于得到car-t细胞的基因操作可通过本领域技术人员公知的方法进行,为了应用于本发明的方法,适当改变操作也是容易的。例如,car构建体被整合到表达载体中。各种表达载体是本技术领域已知的,可利用任意的此类载体。在优选的实施方式中,载体为逆转录病毒或慢病毒载体。也可使用利用电穿孔或脂转染的转染。
[0110]
在本发明的实践中,除非另有说明,否则对于分子生物学或重组dna技术等基因工程方法和一般的细胞生物学方法以及现有技术,操作者可参照本领域的标准书籍。作为这样的书籍,例如列举出下述书籍,它们通过参照被纳入本说明书中。
[0111]“molecular cloning:a laboratory manual”(sambrook&russell,cold spring harbor laboratory press,第3版,2001)
[0112]“current protocols in molecular biology”(ausubel et al.编辑,john wiley&sons,1987)
[0113]“methods in enzymology”系列(academic press)
[0114]“pcr protocols:methods in molecular biology”(bartlett&striling编辑,humana press,2003)
[0115]“animal cell culture:a practical approach”(masters编辑,oxford university press,第3版,2000)
[0116]“antibodies:a laboratory manual”(harlow et al.&lane编辑,cold spring harbor laboratory press,1987)
[0117]“optimization of methods for the genetic modification of human t cells”(mahmood y.bilal,aldo vacaflores,and jon c.d.houtman;immunol cell biol.2015nov;93(10):896-908.)
[0118]
另外,本说明书中参照的用于细胞培养、细胞生物学实验的试剂和试剂盒类可从sigma公司或invitrogen公司、clontech公司、r&d systems公司、bd bioscience公司、lonza公司、ebioscience公司、thermo fisher公司、peprotech公司、biolegend公司、gibco公司、nacalai tesque公司等供应商获取。
[0119]
通过本实施方式的方法得到的记忆性干细胞样t细胞可继续通过公知的方法进行
细胞回收、分离、纯化。记忆性干细胞样t细胞的鉴定可通过确认cd45ra
和ccr7
的细胞表面标志物的表达来进行。对于标志物的表达,其方法没有特殊限制,可通过使用抗体的免疫染色法或逆转录酶介导的聚合酶链反应(rt-pcr)、杂交分析之类的公知的细胞组织生物学方法以及分子生物学方法确认。
[0120]
纯化记忆性干细胞样t细胞的方法只要是公知的细胞分离纯化法,则均可使用,作为其具体的实例,可列举出流式细胞术或磁珠、淘选法等基于抗原-抗体反应的方法,或通过使用蔗糖、聚果糖(percoll)等载体的密度梯度离心的细胞分级法。
[0121]
对于本发明中使用的各种细胞的制作、传代、保存法或细胞生物学实验的一般方法,操作者可参照本领域的标准书籍。作为它们的实例,列举出“细胞培养方案”(中村幸夫主编,羊土社),其通过参照被纳入本说明书中。本说明书中参照的用于细胞培养、发育、细胞生物学实验的试剂和试剂盒类可从invitrogen公司或sigma公司等供应商获取。
[0122]
在另一实施方式中,本发明涉及具有cd45ra
和ccr7
的细胞表面标志物的car-t细胞,car-t细胞优选为记忆性干细胞样car-t细胞。
[0123]
本实施方式的“car-t细胞”只要具有上述表型,则对是自体car-t细胞还是异体car-t细胞没有特殊限定,其获取、制作也可通过本领域技术人员公知的方法进行,关于记忆性干细胞样t细胞的制备方法,可通过得到上述car-t细胞的方法制作。本实施方式的car-t细胞可用于对疾病特异性的过继性t细胞疗法,可充当针对car中的抗原成分结构域的配体的细胞表面标志物的实例包含与癌症、病毒性、细菌性和寄生虫感染、自身免疫性疾病和过敏症相关的细胞表面标志物。
[0124]
例如,car-t细胞可为了治疗选自各种癌症、感染病、自身免疫性疾病和过敏症的1种以上疾病而移植或施用,例如,作为癌症,列举出造血细胞恶性肿瘤和实体癌,作为造血细胞恶性肿瘤,列举出急性成淋巴细胞性白血病(all)、急性髓细胞性白血病(aml)、慢性髓细胞性白血病(cml)、慢性嗜酸性粒细胞白血病(cel)、骨髓增生异常综合征(mds)、非霍奇金淋巴瘤(nhl)和多发性骨髓瘤(mm);作为实体癌,列举出胆管癌、膀胱癌、骨和软组织的癌症、脑肿瘤、乳腺癌、宫颈癌、结肠癌、结直肠腺癌、结直肠癌、硬纤维瘤、胚胎癌、子宫内膜癌、食道癌、胃癌、胃腺癌、多形性神经胶质母细胞瘤、妇科肿瘤、头颈鳞癌、肝癌、肺癌、恶性黑色素瘤、骨肉瘤、卵巢癌、胰腺癌、胰导管腺癌、原发性星形胶质细胞瘤、原发性甲状腺癌、前列腺癌、肾癌、肾细胞癌、横纹肌肉瘤、皮肤癌、软组织肉瘤、睾丸生殖细胞瘤、尿道上皮癌、子宫肉瘤或子宫癌。
[0125]
car-t细胞例如可用磷酸盐缓冲生理盐水扩增培养、清洗和浓缩,使用补充了人白蛋白(例如5%albumex 20,商标)的灭菌生理盐水进行制剂化。car-t细胞可以由本领域技术人员决定的适当的细胞用量施用。在一个实施方式中,car-t细胞施用1.2
×
106个~6
×
108个以上的活细胞。再注入或移植的t细胞的最大数目可在由本领域技术人员进行临床试验时决定。
[0126]
在又一实施方式中,本发明涉及含有通过上述制备方法得到的记忆性干细胞样t细胞或具有cd45ra
和ccr7
的细胞表面标志物的car-t细胞的细胞治疗剂。例如,可作为含有记忆性干细胞样t细胞或car-t细胞作为实质有效成分的药物组合物施用,更具体地,可为了治疗人免疫疾病或癌症而施用。
[0127]
实施例
[0128]
以下,通过实施例来更具体地说明本发明,但本发明不限于下述具体实例。需说明的是,在本说明书中,除非另有说明,数值范围被描述为包含其端点,浓度等为重量基准。
[0129]
[抗体和试剂]
[0130]
抗小鼠notch1抗体(hmn1-12)、抗小鼠notch2抗体(hmn2-35)、抗小鼠notch3抗体(hmn3-133)、抗人cd8a抗体(hit8a)、抗人cd45ra抗体(hi100)、抗人cd45ro抗体(uchl1)、抗人ccr7抗体(g043h7)、抗人cd62l抗体(dreg-56)、抗人cd27抗体(m-t271)使用从ebioscience公司(san diego,ca,usa)或biolegend公司(san diego,ca,usa)购入的抗体。重组人dll1蛋白可从adipogen公司(san diego,ca,usa)购入。
[0131]
[统计分析]
[0132]
在各附图中,分别地,“**”表示p《0.01,“*”表示p《0.05,“n.s.”表示不显著(not significant),误差棒表示平均标准误(s.e.m.),分别地,在图7、图8、图9中采用单因素方差分析(one-way anova)进行统计分析,在图4、图6中采用双因素方差分析(two-way anova)进行统计分析。另外,除非另有说明,各数据表示来自2名不同的健康供体的至少2次独立实验的代表。
[0133]
[流式细胞术分析和细胞分选]
[0134]
为了定量细胞表面标志物的表达收集细胞,并再悬浮于含有0.5%的牛血清白蛋白(bsa)和2mm的乙二胺四乙酸(edta)的磷酸盐缓冲生理盐水(pbs)中,在fc阻断抗体(2.4g2)的存在下进行表面染色。抗体从biolegend公司、ebioscience公司、r&d systems公司、beckman coulter公司、bd biosciences公司和cell signaling technology公司购入。分别进行1:100稀释,对各抗体进行细胞内染色。用facs canto ii细胞计数器(bd biosciences公司制,san jose,ca,usa)进行流式细胞术,使用flowjo软件(tree star公司制,ashland,or,usa)分析数据。使用facs aria ii、facs aria iii细胞分选仪(bd biosciences公司制)和sh800细胞分选仪(sony公司制,东京,日本)筛选小鼠和人t细胞。
[0135]
实施例1:op9-hdll1细胞培养上清液存在下的记忆性干细胞样t细胞的制作
[0136]
1-1.op9-hdll1细胞培养上清液的配制
[0137]
配制op9-hdll1细胞(从理化学研究所获取)的细胞培养上清液(op9-hdll1 cm)。将1.5
×
105个的op9-hdll1细胞接种在细胞培养用10cm培养皿(falcon公司制353003)中,在添加有胎牛血清(20%,fbs,sigma公司制)、青霉素-链霉素溶液(1%,thermo fisher公司)的αmem培养基(gibco公司制,10ml)中使其增殖。细胞的增殖在37℃和5体积%co2的条件下进行。在细胞达到100%汇合时收集培养基,通过无菌膜(孔径:0.45μm)过滤得到培养上清液,在4℃下贮藏。
[0138]
1-2.活化t细胞(活化cd8α
t细胞)的配制
[0139]
[原料t细胞的筛选工序]通过比重离心法从epstein-barr病毒(ebv)血清反应阳性(vca-igg[ ]、ebna[ ])的3名健康供体提供的外周血配制人外周血单核细胞(pbmc)。使用人cd8α
t细胞分离试剂盒(#130-096-495,miltenyi biotec公司制)从pbmc中除去cd8α
t细胞以外的细胞,配制人cd8α
t细胞。
[0140]
[预刺激工序(引发工序)]使用缀合抗cd3抗体和抗cd28抗体的微珠(cd3/cd28dynabeads,veritas公司制),在t细胞/珠比为1:1的条件下使得到的人cd8α
t细胞活化6天。
[0141]
[扩增培养工序(扩增工序)]在引发工序的6天后,对活化的cd8α
t细胞进行tcr刺激,以cd8α
cd45ra-进行荧光活化细胞分选(facs)筛选,得到活化cd8α
t细胞。
[0142]
1-3.op9-hdll1细胞培养上清液存在下的记忆性干细胞样t细胞的配制
[0143]
将得到的活化t细胞接种在平板中,在添加有人il-7(peprotech公司制,10ng/ml)的op9-hdll1 cm(0.4ml)中培养11天,得到记忆性干细胞样t细胞(t
scm
)(cm)。
[0144]
作为对照,将活化t细胞与op9-hdll1细胞(2
×
103个,饲养细胞)和人il-7(peprotech公司制,10ng/ml)共培养11天,得到诱导性记忆性干细胞样t细胞(it
scm
)(fc)。
[0145]
1-4.表面标志物的表达分析
[0146]
通过上述流式细胞术分析,对通过使用op9-hdll1细胞培养上清液培养得到的记忆性干细胞样t细胞研究表面抗原标志物的表达,确认表达cd45ra
和ccr7
(表1)。
[0147]
实施例2:op9、tst-4细胞的细胞培养上清液存在下的记忆性干细胞样t细胞的制作
[0148]
2-1.op9、tst-4细胞培养上清液(op9 cm、tst-4 cm)的配制
[0149]
配制op9细胞(从理化学研究所获取)和tst-4细胞(从理化学研究所获取)的细胞培养上清液(op9 cm、tst-4 cm)。将1.5
×
105个的op9细胞或1.5
×
105个的tst-4细胞接种在细胞培养用10cm培养皿(falcon公司制353003)中,在添加有fbs(20%,sigma公司制)、青霉素-链霉素溶液(1%,thermo fisher公司)的αmem培养基(gibco公司制,10ml)中使其增殖。细胞的增殖在37℃和5体积%co2的条件下进行。在细胞达到100%汇合时收集培养基,通过无菌膜(孔径:0.45μm)过滤得到培养上清液(op9 cm或tst-4cm),在4℃下贮藏。
[0150]
2-2.活化t细胞(活化cd8α
t细胞)的配制
[0151]
[原料t细胞的筛选工序]使用人cd8α
t细胞分离试剂盒(#130-096-495,miltenyi biotec公司制)从pbmc中除去cd8α
t细胞以外的细胞,配制人cd8α
t细胞。
[0152]
[引发工序]使用缀合抗cd3抗体和抗cd28抗体的微珠(cd3/28dynabeads,veritas公司制),在t细胞/珠比为1:1的条件下使得到的人cd8α
t细胞活化6天。
[0153]
[扩增工序]在引发工序的6天后,对活化的cd8α
t细胞进行tcr刺激,以cd8α
cd45ra-进行facs筛选,得到活化cd8α
t细胞。
[0154]
2-3.op9 cm、tst-4 cm存在下的记忆性干细胞样t细胞的配制
[0155]
将得到的活化t细胞接种在平板上,在添加有人il-7(peprotech公司制,10ng/ml)的op9 cm(0.4ml)或tst-4 cm(0.4ml)中培养11天,得到记忆性干细胞样t细胞。
[0156]
2-4.表面标志物的表达分析
[0157]
通过上述流式细胞术分析,对通过使用基质细胞的细胞培养上清液(op9 cm或tst-4cm)培养得到的记忆性干细胞样t细胞研究表面抗原标志物的表达,确认均表达cd45ra
和ccr7
(表1)。
[0158]
实施例3:利用op9-hdll1细胞培养上清液/notch信号活化(nicd强制表达)的记忆性干细胞样t细胞的制作
[0159]
3-1.强制表达nicd的活化t细胞(活化nicd强制表达cd8α
t细胞)的配制
[0160]
根据图1所示的用于在活化t细胞中过表达notch胞内结构域(nicd,序列号1)的实验设计方案,制作图2所示的nicd过表达逆转录病毒载体(pmei-5dna,takara bio公司制)。使用制作的逆转录病毒载体制作活化nicd强制表达t细胞。
[0161]
具体而言,通过与实施例1所记载的引发工序相同的方法,使人cd8α
t细胞活化。接着,在活化24小时后,使用nicd进行逆转录病毒强制表达。在t细胞活化6天后,筛选nicd强制表达t细胞作为venus
细胞,使用cd3/28微珠使其再活化。
[0162]
通过与实施例1所记载的扩增工序相同的方法,以cd8α
cd45ra-进行facs筛选,得到活化nicd强制表达cd8α
t细胞。
[0163]
3-2.op9-hdll1细胞培养上清液存在下的培养
[0164]
由得到的活化nicd强制表达cd8α
t细胞,通过与实施例1相同的方法,在op9-hdll1 cm中培养,得到nicd强制表达记忆性干细胞样t细胞。
[0165]
作为对照,在相同的条件下培养导入空载体而制作的活化cd8α
t细胞,得到记忆性干细胞样t细胞。
[0166]
3-3.表面标志物的表达分析
[0167]
对于得到的nicd强制表达记忆性干细胞样t细胞(nicd)和导入空载体而得到的记忆性干细胞样t细胞(empty),与实施例1相同地研究对标志物特异的抗体的反应性。同时,作为阳性对照,还对通过将导入了nicd或空载体的活化t细胞与op9-hdll1细胞共培养而得到的it
scm
细胞进行表达分析。
[0168]
将结果示出于图3和表1中,通过将利用nicd强制表达的notch信号活化与op9-hdll1细胞培养上清液存在下的培养组合,与同op9-hdll1细胞共培养的情况(fc)相同,确认表达cd45ra
和ccr7
作为表面抗原标志物(cm)。
[0169]
实施例4:利用op9-hdll1细胞培养上清液/notch信号活化(foxm1强制表达)的记忆性干细胞样t细胞的制作
[0170]
4-1.强制表达foxm1的活化t细胞(活化foxm1δn强制表达cd8α
t细胞)的配制
[0171]
代替nicd过表达逆转录病毒载体,使用图4所示的foxm1δn(序列号2)过表达逆转录病毒载体,通过与实施例3的活化nicd强制表达cd8α
t细胞的配制方法相同的方法,配制在t细胞中强制表达n末端缺失foxm1的活化foxm1δn强制表达cd8α
t细胞。
[0172]
4-2.op9-hdll1细胞培养上清液存在下的培养
[0173]
由得到的活化foxm1δn强制表达cd8α
t细胞,通过与实施例1相同的方法,在op9-hdll1 cm中培养,得到记忆性干细胞样foxm1δn强制表达t细胞。与实施例3相同,作为对照,导入空载体而制作记忆性干细胞样t细胞。
[0174]
4-3.表面标志物的表达分析
[0175]
对于得到的foxm1δn强制表达记忆性干细胞样t细胞(foxm1δn)和记忆性干细胞样t细胞(empty),与实施例1相同地研究对标志物和作为初期t细胞标志物的cd27特异的抗体的反应性。同时,作为阳性对照,还对通过将导入了foxm1δn或空载体的活化t细胞与op9-hdll1细胞共培养而得到的it
scm
细胞(foxm1δn,empty)进行表达分析(表1和图5、图6)。另外,对这些细胞进行foxm1的表达分析(图7)。
[0176]
此外,进行了在将导入了foxm1δn或空载体的活化t细胞与op9-hdll1细胞共培养时添加foxm1抑制剂硫链丝菌素(thiostrepton)的情况下的处理,并进行了此情况下的cd45ra和ccr7的表达分析(图8、图9)。
[0177]
由图8、9和表1可知,通过将利用foxm1强制表达的notch信号活化与op9-hdll1细胞培养上清液存在下的培养组合,与共培养的情况(fc)相同,表达cd45ra
和ccr7
,此外,还
确认foxm1强制表达细胞高表达作为初期t细胞标志物的cd27(cm)。
[0178]
由图7也确认,通过将foxm1导入t细胞,与只使用表达notch配体的基质细胞(op9-hdll1细胞)的培养上清液的情况相比,foxm1的表达量显著增加。
[0179]
另外,由图8、9的结果可确认,通过抑制共培养体系中的foxm1的作用,抑制cd45ra
ccr7
的诱导,即使是利用培养上清液的培养体系,通过foxm1的诱导,也抑制cd45ra
ccr7
的诱导,得到提示foxm1是notch信号传导中的下游基因、foxm1诱导cd45ra
ccr7
的结果。
[0180]
记忆性干细胞样t细胞的表面标志物的表达分析结果
[0181]
对于在实施例1~4中制作的将notch信号活化与op9-hdll1细胞培养上清液存在下的培养组合而制作的记忆性干细胞样t细胞,将进行表面标志物的表达分析的结果汇总示出于表1中。
[0182]
[表1]
[0183]
表1.t细胞的各种表面标志物的表达
[0184][0185]
可确认,通过在基质细胞培养上清液存在下的培养工序中组合利用使用强制表达nicd或foxm1δn的活化t细胞的notch信号活化,得到表达cd45ra
和ccr7
的t细胞。
[0186]
另外,由图3和图5、6的结果可知,与在共培养中组合notch信号活化的情况相比,在培养上清液中组合notch信号活化的情况下,得到的cd45ra
ccr7
细胞的细胞数大幅增加。即,提示在本发明的制备方法中,通过采用notch信号的活化,与共培养体系相比,可更有效地制作记忆性干细胞样t细胞。
[0187]
实施例5:利用op9-hdll1细胞培养上清液/notch信号活化(重组dll1)的记忆性干细胞样t细胞的制作方法
[0188]
5-1.活化抗cd19 car-t细胞的配制
[0189]
使用由抗cd19 scfv(来自fmc63)、人cd8α铰链结构域和跨膜结构域、以及人4-1bb-cd3z细胞内信号基序构成的抗cd19 car过表达逆转录病毒载体,通过与实施例3的活化nicd强制表达cd8α
t细胞的配制方法相同的方法,配制抗cd19 car强制表达cd8α
t细胞。具体而言,通过与实施例1所述的预刺激工序(引发工序)相同的方法,使人cd8α
t细胞活化。接着,在活化24小时后,使用逆转录病毒进行抗cd19car强制表达。在t细胞活化6天后,
筛选抗cd19 car强制表达t细胞作为venus
细胞,使用进行了x射线照射的人cd19强制表达白血病细胞(k562-hcd19)使抗cd19car-t细胞再活化。即,将含有抗cd19 car-t细胞和k562-hcd19细胞的细胞悬液(抗cd19 car-t细胞:2.5
×
105个/ml,k562-hcd19细胞:0.625
×
105个/ml)接种在u形底96孔板中(每1孔200μl)。培养4天后,进行相同的活化操作,再培养4天。以cd8α
venus
cd45ra-筛选抗cd19 car强制表达cd8α
t细胞,得到活化抗cd19 car强制表达cd8α
t细胞。
[0190]
5-2.hdll1-fc蛋白质的配制
[0191]
通过pcr扩增由人cdna克隆的人dll1的胞外区,并亚克隆到pcdna3-higg1-fc载体中,由此制作pcdna3-hdll1-higg1-fc载体。在0.1%明胶包被的培养皿中接种expi293f细胞(thermo fisher scientific)(107个/26ml/15cm培养皿(falcon,353025))。24小时后,使用pei max(polysciences,24765-1)将pcdna3-hdll1-higg1-fc载体转染到expi293f细胞中。距转染16小时后,用杜尔贝科改良伊格尔培养基(dulbecco's modified eagle medium)(dmem,nacalai tesque,0845964)清洗1次,更换为配制的无血清培养基(26ml)。作为该无血清培养基,使用含有牛血清白蛋白(bsa,nacalai tesque,01863-48,0.5%)、青霉素-链霉素(nacalai tesque,26253-84,1%)、hepes(nacalai tesque,17557-94,1mm)、丙酮酸钠(nacalai tesque,06977-34,1mm)、mem非必需氨基酸溶液(nacalai tesque,06344-56,稀释100倍)、l-谷氨酰胺(nacalai tesque,16948-04,2mm)、its-x(gibco,51500-056,稀释100倍)、脂质浓缩物(化学上限定的脂质浓缩物(chemically defined lipid concentrate),gibco,11905-031,稀释1000倍)的dmem/f12(nacalai tesque,11581-15)。距更换培养基72小时后,回收培养上清液并用无菌膜(孔径:0.22μm)过滤,在4℃下保存。
[0192]
5-3.重组dll1平板的制作
[0193]
在4℃、o/n下将用磷酸缓冲生理盐水(pbs)稀释的蛋白a(sigma-aldrich,p6031,10μg/ml)和纤连蛋白(富士胶片和光纯药,063-05591,5μg/ml)吸附在未处理的12孔板(falcon,351143,800μl/孔)上。将孔用pbs清洗2次,使用封闭缓冲液(hbss/2%bsa)在25℃下封闭45分钟。通过用pbs清洗2次以除去封闭缓冲液后,将hdll1-fc(4ml)添加到蛋白a/纤连蛋白包被的孔中,在37℃、5体积%co2存在下孵育2小时。在细胞接种前将孔用pbs清洗2次。
[0194]
5-4.活化抗cd19 car-t细胞的培养
[0195]
将配制的活化抗cd19 car强制表达cd8α
t细胞以1
×
105个/孔的密度接种在制作的重组dll1平板上,在添加有人il-7(peprotech,200-07,10ng/ml)的op9-hdll1细胞培养上清液(cm,1ml)的存在下培养11天,得到记忆性干细胞样抗cd19 car-t细胞。
[0196]
5-5.表面标志物的表达分析
[0197]
对于得到的记忆性干细胞样抗cd19 car-t细胞,与实施例1相同地研究对标志物特异的抗体的反应性。同时还分析作为阴性对照的不使用重组dll1和培养上清液培养的细胞、作为阳性对照的与饲养细胞(fc)共培养的细胞。将结果示出于图10中。
[0198]
由图10确认,通过将利用重组dll1的notch信号活化与op9-hdll1细胞培养上清液存在下的培养组合,与同op9-hdll1细胞共培养的情况相同,得到表达cd45ra和ccr7作为表面抗原标志物的t细胞。
[0199]
实施例6:基质细胞产生的活性因子的分析
[0200]
6-1.利用实时pcr的op9-hdll1细胞的基因表达分析
[0201]
使用reliaprep tm rna cell miniprep system(promega,z6012)由105个的op9-hdll1细胞纯化总rna。使用pct试剂盒(high capacity cdna reverse transcription kit,applied biosystems,4368813),由得到的op9-hdll1的总rna进行实时pcr,得到单链cdna。将得到的op9-hdll1的cdna系列稀释(1:1、1:16、1:256),使用ssofast evagreen supermix(biorad、172-5203)作为模板,利用嵌入法对其进行实时pcr(cfx connect(biorad)),将各目标基因(hprt、cxcl12、scf、il-7、flt3l)扩增。为了使得到的目标基因的pcr扩增产物可视化,加入染料(上样染料(loading dye),toyobo,re-dye),应用到1%琼脂糖凝胶上,进行电泳。将结果示出于图11中。
[0202]
(使用的引物)
[0203]
·
小鼠hprt
[0204]
正向引物:ctttgctgacctgctggatt(序列号4)
[0205]
反向引物:tatgtcccccgttgactgat(序列号5)
[0206]
·
小鼠cxcl12
[0207]
正向引物:gccaacgtcaagcatctgaaa(序列号6)
[0208]
反向引物tgtctgttgttgttcttcagcc(序列号7)
[0209]
·
小鼠scf
[0210]
正向引物:gcgggaatcctgtgactgat(序列号8)
[0211]
反向引物:catcccggcgacatagttga(序列号9)
[0212]
·
小鼠il-7
[0213]
正向引物:acatcatctgagtgccacatt(序列号10)
[0214]
反向引物:gggcaattactatcagttcctgt(序列号11)
[0215]
·
小鼠flt3l
[0216]
正向引物:tgttacttcagccacagtccc(序列号12)
[0217]
反向引物:gaagattgacggccacagtga(序列号13)
[0218]
6-2.基质细胞培养上清液中cxcl12的测定
[0219]
配制op9细胞、op9-hdll1细胞和tst-4细胞的培养上清液(op9 cm、op9-hdll1cm、tst-4 cm)。将1.5
×
105个的各细胞接种在细胞培养用培养皿(10cm,falcon,353003)上,在添加有胎牛血清(fbs,20%,sigma-aldrich,172012)、青霉素-链霉素(1%,nacalai tesque,26253-84)的α-mem培养基(gibco,11900-024,1.5ml)中使其增殖。细胞的增殖在37℃和5体积%co2的条件下进行。在细胞达到100%汇合时回收培养基(op9 cm、op9-hdll1 cm、tst-4 cm),用无菌膜(孔径:0.45μm)过滤,在4℃下保存。通过酶联免疫吸附法(elisa)定量分析得到的细胞培养上清液中含有的cxcl12(invitrogen,emcxcl12)。将结果示出于图12中。
[0220]
由图11的结果提示,在研究的候选活性因子中,cxcl12特别高表达。由图12确认,实际上在op9-hdll1细胞培养上清液中存在cxcl12。另外,确认在op9细胞和tst4细胞的培养上清液中也存在cxcl12。
[0221]
实施例7:利用cxcl12/igf-i/notch信号活化的记忆性干细胞样抗cd19 car-t细胞的制作方法
[0222]
7-1.活化t细胞的培养
[0223]
在与实施例5相同地制作的重组dll1平板(hdll1-fc/fn)或未处理的平板上以1
×
105个/孔的密度接种配制的活化抗cd19 car强制表达cd8α
t细胞。以图13所示的组合在含有人il-7(peprotech,200-07,10ng/ml)、胎牛血清(fbs,20%,sigma-aldrich,172012)和青霉素-链霉素(1%,nacalai tesque,26253-84)的α-mem培养基(gibco,11900-24,1ml)中添加人cxcl12(peprotech,300-28a,100ng/ml)和人igf-i(peprotech,100-11,50ng/ml),培养11天,由此得到记忆性干细胞样抗cd19 car-t细胞。
[0224]
7-2.表面标志物的表达分析
[0225]
对于得到的记忆性干细胞样抗cd19 car-t细胞,与实施例1相同地研究对标志物特异的抗体的反应性。将结果示出于图13中。
[0226]
由图13确认,通过使用添加cxcl12的培养基代替基质细胞的培养上清液,也可诱导记忆性干细胞样t细胞。另外,确认该记忆性干细胞样t细胞的诱导因添加igf-i和重组dll1处理而被增强。
[0227]
实施例8:通过cxcl12/igf-i/notch信号活化制作的记忆性干细胞样抗cd19car-t细胞的抗肿瘤效果
[0228]
8-1.利用使用人白血病模型小鼠的抗cd19 car-t细胞的抗肿瘤效果的评价
[0229]
将nalm6细胞以5
×
106个/ml悬浮在pbs中,对nsg小鼠(nod-scid il-2rγ
null
小鼠)尾静脉注射200μl的细胞悬液。距nalm6细胞移植7天后,将与实施例7相同配制的记忆性干细胞样抗cd19 car-t细胞(ff car-it
scm
)或未诱导至记忆性干细胞样的抗cd19 car-t细胞(car-t)以2.5
×
106个/ml混悬在pbs中,对nsg小鼠尾静脉注射200μl的细胞悬液。从距各抗cd19 car-t细胞移植14天后的nsg小鼠采集40μl的血液,得到用缓冲液(ack lysis buffer)进行溶血处理的细胞悬液。
[0230]
通过流式细胞术分析,研究得到的细胞悬液的表面抗原标志物的表达,测量fvd-mcd45-hcd19
的nalm6癌细胞数。还设定car-t细胞非施用组和通过与饲养细胞共培养制作的记忆性干细胞样抗cd19 car-t细胞(fc car-it
scm
)施用组,一并进行评价。将结果示出于图14中。
[0231]
(使用的抗体和试剂)
[0232]
bv421抗小鼠cd45抗体(biolegend,103133)(克隆:30-f11)
[0233]
pe抗人cd19抗体(biolegend,302208)(克隆:4g7)
[0234]
fixable viability dye efluor tm 780(ebiosciences,65-0865-18)
[0235]
由图14确认,通过cxcl12/igf-i/notch信号活化制作的记忆性干细胞样抗cd19car-t细胞显示出强抗肿瘤活性。
[0236]
产业上的可利用性
[0237]
本发明可消除在t细胞转移疗法等中成为问题的t细胞的耗竭,提高t细胞的活性,因此期待应用于过继性t细胞疗法或car-t细胞疗法。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
