1.本发明涉及利用细胞衍生囊泡对唾液腺细胞的增殖能力增强效果、淀粉酶活性促进效果、跨上皮抗性增强效果、水通道蛋白5(aquaporin 5)的表达增强及唾液分泌量增加效果的唾液腺治疗剂。
背景技术:
2.微泡(microvesicles)为通常具有0.03μm~1μm的大小的亚细胞器的一种,其特征在于,在几乎所有种类的细胞中,其从细胞膜中自然释放出来,由此具有作为细胞膜结构的双磷脂(phospholipid)膜形态。上述囊泡作为用于物质代谢、代谢物质的运送、酶的储存、化学反应等的细胞的基本工具,已知其通过在细胞之间传递信使核糖核酸(mrna)、微小核糖核酸(mirna)及蛋白质等来起到细胞间信号传递的媒介作用。
3.另一方面,唾液腺为在爬虫类以上的高等脊椎动物的口腔开口的外分泌腺的总称,大部分分泌粘液,但某些分泌作为消化液的唾液。哺乳动物有下颌下腺、舌下腺、腮腺,哺乳动物还在耳下具有下颌下腺与舌下腺,但腮腺在哺乳动物中较为发达。三种都属于复管泡状腺,都形成大的腺体。腮腺只由浆液性腺细胞组成,而下颌下腺和舌下腺由浆液性腺细胞和黏液性细胞组成。两侧排泄管的上皮由圆柱形状的细胞组成。从腺体分泌淀粉酶、α-d-葡萄糖水解酶,从排泄管分泌nacl来激活淀粉酶。已知在唾液腺中主要在腮腺,某种程度上在下颌下腺中也使腺内分泌的物质通过特定的细胞移行到血液中来诱导激素活性。并且,上述唾液腺称为大唾液腺,将单独位于口腔内的多处、虽然规模小但参与唾液分泌的则称为小唾液腺。
4.唾液腺为分泌如帮助消化作用的淀粉酶的酶的重要的身体组织,但当唾液腺组织受到损伤时,却没有副作用少且有效的治疗剂。因此,有关活体来源的副作用少的唾液腺治疗剂的研究开发的必要性日益增加。
技术实现要素:
5.技术问题
6.由此,本发明人在探索、研究对治疗唾液腺有效的物质的过程中,确认到细胞衍生囊泡(cell derived vesicle)对损伤的唾液腺的治疗有效,从而完成了本发明。
7.因此,本发明的目的在于,提供包含细胞衍生囊泡的用于预防或治疗唾液腺疾病的药物组合物。
8.技术方案
9.为了实现上述目的,本发明提供包含细胞衍生囊泡的用于预防或治疗唾液腺疾病的药物组合物。
10.并且,本发明提供包含细胞衍生囊泡的用于预防或改善唾液腺疾病的保健功能食品组合物。
11.并且,本发明提供唾液腺疾病的预防或治疗方法,包括对个体处理细胞衍生囊泡
的步骤,上述细胞衍生囊泡的制备方法包括通过微孔挤出包含细胞的试样的步骤。
12.并且,本发明提供细胞衍生囊泡在用于预防或治疗唾液腺疾病的药物中的用途,上述细胞衍生囊泡的制备方法包括通过微孔挤出包含细胞的试样的步骤。
13.并且,本发明提供细胞衍生囊泡在生产用于预防或治疗唾液腺疾病的药物制剂中的用途,上述细胞衍生囊泡的制备方法包括通过微孔挤出包含细胞的试样的步骤。
14.发明的效果
15.本发明的包含细胞衍生囊泡的药物组合物具有增强因放射线损伤的唾液腺组织细胞的增殖能力、促进淀粉酶的活性、提高跨上皮抗性(transepithelial resistance)的效果,具有增强水通道蛋白5的表达、增加唾液分泌量的效果。因此,本发明的包含细胞衍生囊泡的药物组合物可以用于预防及治疗唾液腺疾病的用途,可以在医药领域及保健功能食品领域广泛使用。
附图说明
16.图1为检测腮腺细胞的增殖能力随放射线照射而变化的图。
17.图2为使用admsc-cdv处理因放射线照射损伤的腮腺细胞时检测增殖能力变化的图。
18.图3为照射放射线9天后,确认admsc-cdv对因放射线损伤的腮腺细胞的增殖能力的增强效果的图。
19.图4为使用admsc-cdv处理因放射线照射损伤的腮腺细胞时检测淀粉酶活性变化的图。
20.图5为使用admsc-cdv处理因放射线照射损伤的腮腺细胞时检测跨上皮抗性的变化的图。
21.图6为检测下颌下腺细胞的增殖能力随放射线照射而变化的图。
22.图7为使用admsc-cdv处理因放射线照射损伤的下颌下腺细胞时检测增殖能力变化的图。
23.图8为照射放射线9天后,确认admsc-cdv对因放射线损伤的下颌下腺细胞的增殖能力的增强效果的图。
24.图9为使用admsc-cdv处理因放射线照射损伤的下颌下腺细胞时检测淀粉酶活性变化的图。
25.图10为使用admsc-cdv处理因放射线照射损伤的下颌下腺细胞时检测跨上皮抗性的变化的图。
26.图11为检测舌下腺细胞的增殖能力随放射线照射而变化的图。
27.图12为使用admsc-cdv处理因放射线照射损伤的舌下腺细胞时检测增殖能力变化的图。
28.图13为照射放射线9天后,确认admsc-cdv对因放射线损伤的舌下腺细胞的增殖能力的增强效果的图。
29.图14为使用admsc-cdv处理因放射线照射损伤的舌下腺细胞时检测淀粉酶活性变化的图。
30.图15为使用admsc-cdv处理因放射线照射损伤的舌下腺细胞时检测跨上皮抗性的
变化的图。
31.图16为比较自然分泌的外泌体与间充质干细胞衍生囊泡对因放射线损伤的唾液腺细胞的增殖能力的图。
32.图17为比较自然分泌的外泌体与源自脂肪细胞的间充质干细胞衍生囊泡的跨上皮抗性的图。
33.图18为比较自然分泌的外泌体与源自脐带的间充质干细胞衍生囊泡的跨上皮抗性的图。
34.图19为比较自然分泌的外泌体与间充质干细胞衍生囊泡对唾液腺组织受损的小鼠模型的淀粉酶活性促进效果的图。
35.图20为示出在将间充质干细胞衍生囊泡应用于小鼠模型时唾液分泌量的变化的图。
具体实施方式
36.本发明提供包含细胞衍生囊泡的用于预防或治疗唾液腺疾病的药物组合物,上述细胞衍生囊泡的制备方法包括通过微孔挤出包含细胞的试样的步骤。
37.本发明的术语“细胞衍生囊泡”是指从细胞产生的囊泡,是指如下囊泡:通常为亚细胞器的一种,在几乎所有种类的细胞中,其从细胞膜中释放出来,具有作为细胞膜结构的双磷脂膜形态。
38.本发明的细胞衍生囊泡为微米大小,例如,大小可以为0.03μm~1μm。本发明的囊泡通过由来源细胞的细胞膜成分组成的脂质双层膜分为内部和外部,具有细胞的细胞膜脂质和细胞膜蛋白质、核酸及细胞成分等,比原细胞的大小小,但不限定于此。
39.在本发明中,上述细胞可不受限地使用能够分离出细胞衍生囊泡的细胞,可以为从自然界的生物个体分离的细胞。并且,上述细胞可以源自包括人类及非人类哺乳动物在内的任意类型动物、植物,可以为多种免疫细胞、肿瘤细胞、干细胞、腺泡细胞、肌上皮细胞或者血小板,优选地,上述干细胞可以为选自由间充质干细胞、诱导多能干细胞、胚胎干细胞及唾液腺干细胞组成的组中的一种以上,优选地,可以为源自脂肪细胞的间充质干细胞或者源自脐带的间充质干细胞,但不限定于此。
40.本发明的细胞衍生囊泡具有增强唾液腺组织细胞的增殖能力、促进淀粉酶的活性、提高跨上皮抗性的效果,可以增强水通道蛋白5的表达,增加唾液分泌量。
41.本发明的囊泡可以使用选自由挤出包含有核细胞的悬浮液、超声波分解、细胞溶解、匀质化、冷冻-解冻、电穿孔、化学物质处理、机械分解及从外部向细胞施加力的物理刺激的处理组成的组中的方法来制备,但不限定于此。在本技术中,例示了使用挤出机挤出包含有核细胞的悬浮液的方法来制备囊泡。为制备本发明的有核细胞衍生囊泡而施加的挤出机的挤压力可以为5psi至200psi,可以为10psi至150psi,可以为50psi至100psi。
42.本发明的上述囊泡可以通过包括通过微孔挤出包含干细胞的试样的步骤的制备方法制备,优选地,可以通过从微孔尺寸大的微孔到微孔尺寸小的微孔依次挤出的步骤制备。
43.本发明的上述细胞衍生囊泡可以与自然状态下分泌的外泌体和表达的标记物等不同。
44.本发明的上述微孔的直径可以为0.01μm至100μm,优选为0.1μm至20μm,更优选为0.4μm至10μm。
45.在本发明中,“唾液腺疾病”可以为因唾液腺组织受损或发生炎症而难以发挥正常功能的状态,优选为选自由放射线照射及放射性同位素导致的唾液腺损伤、口腔干燥症、感染性急性唾液腺炎(infectious acute sialadenitis)、感染性慢性唾液腺炎(infectious chronic sialadenitis)、唾液腺结核(tuberculosis)、干燥综合征(sjogren's syndrome)、涎石病(sialolithiasis)、涎腺病(sialadenosis)、唾液腺肿瘤及老化导致的唾液腺功能衰退组成的组中的一种,更优选为放射线照射及放射性同位素导致的唾液腺损伤或者口腔干燥症,上述放射性同位素可以为例如放射性碘。尤其,如下颌下腺与腮腺的主唾液腺分别承担平时的唾液分泌及刺激引起的唾液分泌,当因放射线及放射性同位素治疗等原因而使唾液腺暴露于放射线时,给唾液腺分泌上皮细胞带来不可逆的损伤,细胞之间的紧密结合(tight junction)因此而变得松弛,从而增加唾液腺细胞的上皮透过性。若唾液腺细胞上皮透过性增加,则会吸收不应吸收的大分子或者细菌,或者会因作为唾液酶的淀粉酶的分泌、水以及离子的输送等的非正常作用而改变唾液分泌量及唾液成分。本发明的细胞衍生囊泡可以基于增强唾液腺细胞增殖能力、促进淀粉酶活性、增强跨上皮抗性效果及增加唾液分泌量的效果而具有改善、治疗上述唾液腺疾病的症状的效果。
46.在本发明中,上述唾液腺可以为腮腺、下颌下腺或者舌下腺。
47.在本发明中,可以根据能够显出唾液腺疾病的预防或者治疗效果的剂型、配合目的等包含任意量(有效量)的上述细胞衍生囊泡,其中,“有效量”是指当在给药期间通过医疗专家向作为其应用对象的哺乳动物,优选地,向人类给药本发明的组合物时,能够显出增强唾液腺细胞增殖能力的效果等所希望的功能性、药理学效果的本发明组合物所包含的有效成分的量。上述有效量可以由本发明所属技术领域的普通技术人员在通常的能力范围内通过实验来决定,优选地,可以包含1
×
105particles/ml至1
×
10
13
particles/ml的浓度的细胞衍生囊泡,更优先地,可以包含5
×
107particles/ml至1
×
10
13
particles/ml的浓度的细胞衍生囊泡,更加优选地,可以包含5
×
108particles/ml至1
×
10
13
particles/ml的浓度的细胞衍生囊泡,进而优选地,可以包含1
×
109particles/ml至1
×
10
13
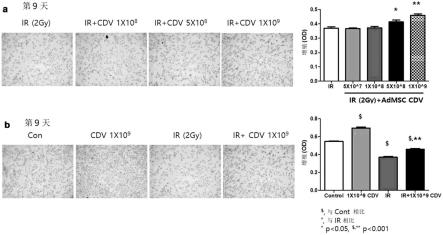
particles/ml的浓度的细胞衍生囊泡。
48.除有效成分外,本发明的用于预防或治疗唾液腺疾病的药物组合物还可以包含用于上升、加强预防或治疗唾液腺疾病的效果的已验证安全性并公认为具有预防或治疗唾液腺疾病的效果的任意化合物或者天然提取物。
49.本发明的药物组合物可以分别根据通常的方法剂型化为散剂、颗粒剂、片剂、胶囊剂、悬浮液、乳液、糖浆、喷剂等口服剂型、外用剂、栓剂及灭菌注射溶液的形态来使用。上述药物组合物所包含的载体、赋形剂及稀释剂可以为乳糖、葡萄糖、蔗糖、山梨糖醇、甘露醇、木糖醇、赤藓糖醇、麦芽糖醇、淀粉、阿拉伯胶、海藻酸盐、明胶、磷酸钙、硅酸钙、纤维素、甲基纤维素、微晶纤维素、聚乙烯吡咯烷酮、水、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石、硬脂酸镁及矿物油等。制剂化时可以使用通常使用的填充剂、增量剂、结合剂、湿润剂、崩解剂、表面活性剂等稀释剂或赋形剂来制备。用于口服给药的固体制剂包括片剂、丸剂、散剂、颗粒剂、胶囊剂等,这些固体制剂通过在本发明的药物组合物中混合一种以上的赋形剂,例如淀粉、碳酸钙、蔗糖或者乳糖、明胶等来制备。并且,除单纯的赋形剂以外,还使用如硬脂酸
镁、滑石的润滑剂。用于口服的液体制剂有悬浮剂、内服液剂、乳剂、糖浆剂等,除广泛使用的作为单纯稀释剂的水、液体石蜡以外,还可以包括多种赋形剂,例如湿润剂、甜味剂、芳香剂、保存剂等。用于胃肠外给药的制剂包括灭菌的水溶液、非水性溶剂、悬浮剂、油剂、冷冻干燥制剂、栓剂。非水性溶剂、悬浮剂可以使用丙二醇、乙二醇、如橄榄油的植物油、如油酸乙酯的可注射酯类等。栓剂的基剂可以使用witepsol、聚乙二醇、吐温(tween)61、可可脂、肉实树酯、甘油明胶等。
50.本发明的药物组合物的剂量根据治疗对象的年龄、性别、体重、所要治疗的特定疾病或者病理状态、疾病或者病理状态的严重程度、给药途径以及处方人员的判断不同。基于上述因素的剂量的确定在本发明所属技术领域的普通技术人员的水平范围内,通常,剂量为0.01mg/kg/天至约2000mg/kg/天的范围。更优选的剂量为1mg/kg/天至500mg/kg/天。给药可以一天给药一次,也可以分为数次给药。无论从任何方面来看,上述剂量并不限定本发明的范围。
51.本发明的药物组合物能够以多种途径向鼠、家畜、人类等哺乳动物给药。可以预测给药的所有方式,例如,可以通过口服、直肠或静脉、肌肉、皮下、含漱(gargling)、向口腔内唾液腺注射、子宫内膜或脑血管内注射来给药。本发明的化合物几乎没有毒性及副作用,因此,是在以预防为目的而长期服用时也可放心使用的药剂。
52.并且,本发明提供包含细胞衍生囊泡的用于预防或改善唾液腺疾病的保健功能食品组合物,上述细胞衍生囊泡的制备方法包括通过微孔挤出包含细胞的试样的步骤。
53.本发明的保健功能食品包含制备食品时通常添加的成分,例如,包含蛋白质、碳水化合物、脂肪、营养素及调味剂。例如,在制备为饮剂的情况下,除作为有效成分的细胞衍生囊泡以外,可以包含香味剂或天然碳水化合物作为追加成分。例如,天然碳水化合物包括单糖(例如葡萄糖、果糖等)、二糖(例如麦芽糖、蔗糖等)、寡糖、多糖(例如糊精、环糊精等)以及糖醇(例如木糖醇、山梨糖醇、赤藓糖醇等)。香味剂可以利用天然香味剂(例如索马甜、甜叶菊提取物等)以及合成香味剂(例如糖精、阿巴斯甜等)。
54.本发明的保健功能食品包括片剂、胶囊剂、丸剂或液剂等形态,作为可以添加本发明的细胞衍生囊泡的食品,有例如各种饮剂、肉类、香肠、面包、糖果类、小食品类、面类、冰淇淋、乳制品、汤、离子饮料、饮品、酒精饮料、口香糖、茶以及维生素复合剂等。
55.本发明的用于预防或改善唾液腺疾病的保健功能食品的有效成分及效果与上述用于预防或治疗唾液腺疾病的药物组合物相同,因此,为了避免本说明书过于复杂,将省略对两者之间相同内容的说明。
56.并且,本发明提供唾液腺疾病的预防或治疗方法,包括向个体处理细胞衍生囊泡的步骤,上述细胞衍生囊泡的制备方法包括通过微孔挤出包含细胞的试样的步骤。
57.并且,本发明提供细胞衍生囊泡在用于预防或治疗唾液腺疾病的药物中的用途,上述细胞衍生囊泡的制备方法包括通过微孔挤出包含细胞的试样的步骤。
58.并且,本发明提供细胞衍生囊泡在生产用于预防或治疗唾液腺疾病的药物制剂中的用途,上述细胞衍生囊泡的制备方法包括通过微孔挤出包含细胞的试样的步骤。
59.通过以下实施例详细说明本发明。这些实施例仅用于说明本发明,而不是限定本发明的范围。
60.实施例1.培养人唾液腺细胞
61.获得接受腮腺切除术的患者的正常唾液腺组织的腮腺(parotid gland)、下颌下腺(submandibular gland)及舌下腺(sublingual gland)并通过显微镜观察时去除周围组织后,立即放入含有1%的抗生素(antibiotics)的hank’s平衡盐溶液(hbss)在进行一次培养试验前在4℃的温度下保管。本研究使用的人源唾液腺组织是在得到仁荷大学医院器官生命伦理委员会的认可后用于实验的(irb认证编号:non2017-002)。使用手术剪将新鲜的组织细细剪开后,加入0.25%的胶原蛋白水解酶b型(collagenase type b)(sigma aldrich公司,美国),并在37℃的温度下处理30分钟。使用70μm的滤器过滤获得的细胞悬浮液后,将以1500rpm的转速离心分离5分钟后获得的细胞悬浮于含有10%的胎牛血清(fbs)(atcc公司,美国)和1%的抗生素(invitrogen公司,美国)的杜氏改良伊戈尔培养基(dmem)/f12培养基(invitrogen公司,美国)后,将细胞移到细胞培养皿中,并在37℃、5%的co2的恒温箱中培养。
62.实施例2.准备因放射线(ir)受损的唾液腺组织
63.使用linear accelerator 4mv x-ray(mevatron md型,siemens medical laboratory公司,美国)向在实施例1中准备的传代培养至第3代至第6代的腮腺上皮细胞(parotid epithelial cells,hpecs,以下称腮腺细胞)、舌下腺上皮细胞(sublingual epithelial cells,hlecs,以下称舌下腺细胞)以及下颌下腺上皮细胞(submandibular epithelial cells,hmecs,以下称下颌下腺细胞)照射放射线。不同细胞对放射线的敏感性不同,因此,向腮腺上皮细胞和舌下腺上皮细胞分别照射0gy、2gy、5gy的放射线,向下颌下腺上皮细胞照射0gy、7gy、15gy的放射线,在37℃、5%co2的恒温箱中培养细胞。
64.实施例3.制备源自脂肪的间充质干细胞衍生囊泡(adipose derived mesenchymal stemcell derived vesicle,admsc cdv)
65.通过挤出法从脂肪来源间充质干细胞制备囊泡。使用磷酸盐缓冲溶液(phosphate buffered saline;pbs)洗涤在干细胞完全生长培养基(complete growth medium)中培养的间充质干细胞,以0.25
×
106cells/ml至1
×
106cells/ml的浓度使洗涤的干细胞在磷酸盐缓冲溶液(pbs)中再悬浮(resuspension)。使用挤出机(extruder)使上述悬浮溶液通过微孔的大小为10μm的膜过滤器(membrane filter)后,再通过微孔的大小为5μm的膜过滤器,接着再通过微孔的大小为1μm或0.4μm的膜过滤器。为了在通过上述方式获得的悬浮液中去除脱氧核糖核酸(dna),加入benzonase核酸酶(benzonase nuclease)后在37℃的温度下反应90分钟。为了纯化去除脱氧核糖核酸的悬浮液,以切向流过滤(tff,tangential flow filtration)使其通过膜柱(membrane column)。若需要浓缩,则对获得的悬浮液进行超高速离心分离(ultracentrifuge),使用磷酸盐缓冲溶液使通过上述方式获得的沉淀层再悬浮,使用0.2μm的膜过滤器过滤后获得间充质干细胞衍生囊泡。
66.实施例4.确认源自脂肪的间充质干细胞衍生囊泡对因放射线受损的腮腺组织的效果
67.4.1.腮腺细胞暴露于放射线时的增殖能力变化
68.实施了确认腮腺细胞暴露于放射线时腮腺细胞的增殖能力发生何种变化的实验。具体地,以与实施例2相同的方法向在实施例1中准备的腮腺细胞照射放射线来使细胞受损。然后,使用cck8 uptake assay(dojindo公司,日本)检测放射线照射后增殖度随时间的变化。cck8uptake assay以如下方式进行。以1
×
103cells/well的浓度将上述因放射线受
损的腮腺细胞分别接种于96孔(well)中。然后,在37℃、5%co2的恒温箱中分别培养1天、3天、6天、9天、12天后,加入10μl的cck8 reagent,在37℃、5%co2的恒温箱中培养3小时后,使用96孔培养板读取器(96well plate reader)(dynex revelation型,dynex ltd公司,英国)在490nm的波长下测量吸光度来检测增殖能力。检测的增殖能力如图1所示。
69.如图1所示,照射0gy、2gy、5gy的放射线后观察腮腺细胞的增值程度1天、3天、6天、9天、12天的结果,确认到未照射放射线的组(0gy)随着时间很好地发生了细胞增殖,相反,相比于未照射放射线的组,照射2gy或5gy的放射线组的细胞增殖从第3天开始显著减少。
70.4.2.确认源自脂肪的间充质干细胞衍生囊泡对因放射线受损的腮腺组织的增殖能力增强效果
71.实施了用于确认源自脂肪的间充质干细胞衍生囊泡对因放射线受损的腮腺组织的增殖能力增强效果的实验。实验组设定如下。分为未照射放射线的组、照射2gy的放射线的组以及照射5gy的放射线的组,再分别设定以0particles/ml、5
×
107particles/ml、1
×
108particles/ml、5
×
108particles/ml或1
×
109particles/ml浓度使在实施例3中制备的admsc-cdv的处理浓度不同的下位组,分别在照射放射线后的第1天、第3天、第6天、第9天及第12天检测各下位组的增殖能力。使用与实施例4.1相同的方法检测细胞增殖能力,检测结果如图2的a部分至图2的c部分所示。
72.并且,将放射线损伤9天后检测的增殖能力分为normal control组(未做任何处理的组)、ir组(只使用2gy的放射线(ir)处理)、admsc-cdv组(未使用放射线处理,使用1
×
109particles/ml的admsc-cdv处理)、ir admsc-cdv组(使用2gy的放射线(ir)、1
×
108particles/ml、5
×
108particles/ml或1
×
109particles/ml的admsc-cdv处理)来比较的结果如图3的a部分及图3的b部分所示。
73.如图2的a部分所示,以5
×
107particles/ml~1
×
109particles/ml浓度的admsc-cdv处理照射0gy的放射线的腮腺细胞后,分别在第1天、第3天、第6天、第9天及第12天确认细胞增殖能力的结果,在以5
×
108particles/ml及1
×
109particles/ml的浓度处理的组中确认到从第6天开始细胞增殖能力增加了,且确认到上述效果持续到第12天。
74.如图2的b部分所示,以5
×
107particles/ml~1
×
109particles/ml浓度的admsc-cdv处理照射2gy的放射线的腮腺细胞后,分别在第1天、第3天、第6天、第9天及第12天确认细胞增殖能力的结果,确认与未使用admsc-cdv处理的组相比,以5
×
108particles/ml及1
×
109particles/ml的浓度处理admsc-cdv的组从第6天开始显出增殖能力增加的状态,一直持续到第12天。
75.如图2的c部分所示,以5
×
107particles/ml~1
×
109particles/ml浓度的admsc-cdv处理照射5gy的放射线的腮腺细胞后,分别在第1天、第3天、第6天、第9天及第12天确认细胞增殖能力的结果,确认与未使用admsc-cdv处理的组相比,以1
×
109particles/ml浓度的admsc-cdv处理的组的细胞增殖能力增加了,这种效果从照射放射线后的第6天开始持续到第12天。
76.如图3的a部分所示,以不同浓度的admsc-cdv处理照射2gy的放射线的腮腺细胞,9天后确认细胞增殖能力的结果,确认到相比于只照射2gy的放射线的组的细胞增殖能力,照射2gy的放射线并使用5
×
108particles/ml或1
×
109particles/ml浓度的admsc-cdv处理的组的细胞增殖能力浓度依赖性地增加了。
77.如图3的b部分所示,确认到与未做任何处理的组相比,未照射放射线但使用1
×
109particles/ml浓度的admsc-cdv处理的组的细胞增殖能力显著高,只照射2gy的放射线的组的细胞增殖能力比未做任何处理的组减少,确认到照射2gy的放射线并使用1
×
109particles/ml浓度的admsc-cdv处理的组的细胞增殖能力比只照射2gy的放射线的组明显高。
78.综合上述数据,确认admsc-cdv增强腮腺细胞的增殖能力,因放射线受损的腮腺细胞的增殖能力也通过admsc-cdv得到增加。
79.4.3.确认源自脂肪的间充质干细胞衍生囊泡对因放射线受损的腮腺组织的淀粉酶活性促进效果
80.实施了用于确认源自脂肪的间充质干细胞衍生囊泡对因放射线受损的腮腺组织的淀粉酶活性促进效果的实验。具体地,以与实施例2相同的方法向在实施例1中准备的腮腺细胞照射放射线,将对腮腺细胞未做任何处理的组及只照射5gy的放射线的组设定为对照组,将向腮腺细胞照射5gy的放射线并以5
×
107particles/ml~1
×
109particles/ml浓度的在实施例3中制备的admsc-cdv处理的组设定为实验组。具体以如下方法实施实验。以1
×
103cells/well的浓度将实验组和对照组的腮腺细胞分别接种于96孔培养板,照射放射线后立即分别按照设定的方式处理admsc-cdv。为了在照射放射线后的第6天及第9天检测分泌在细胞培养液中的淀粉酶的活性,根据说明书实施a-amylase assay kit(abcam公司,美国),使用96孔培养板读取器在405nm的波长下检测吸光度值。检测结果如图4所示。
81.如图4所示,确认到与未做任何处理的组相比,只照射5gy的放射线的组中淀粉酶的活性减少了,将照射5gy的放射线并以不同浓度的admsc-cdv处理的组分别培养6天及9天的结果,在6天及9天均确认到照射5gy的放射线并使用1
×
109/ml的admsc-cdv处理的组的淀粉酶活性恢复到与未做任何处理的组的淀粉酶活性相似的水平。即,确认admsc-cdv促进腮腺细胞的淀粉酶活性,因放射线受损的腮腺细胞的淀粉酶活性也通过admsc-cdv得到促进。
82.4.4.确认源自脂肪的间充质干细胞衍生囊泡对因放射线受损的腮腺组织的跨上皮抗性(transepithelial resistance,teer)增强效果
83.实施了用于确认源自脂肪的间充质干细胞衍生囊泡对因放射线受损的腮腺组织的跨上皮抗性增强效果的实验。具体地,以与实施例2相同的方法向在实施例1中准备的腮腺细胞照射放射线,将对腮腺细胞未做任何处理的组及只照射5gy的放射线的组设定为对照组,将向腮腺细胞照射5gy的放射线并以5
×
107particles/ml~1
×
109particles/ml浓度的在实施例3中制备的admsc-cdv处理的组设定为实验组。具体以如下方法实施实验。以1
×
105cells/well的浓度将实验组和对照组的腮腺细胞接种于侵袭小室(直径(diameter)12mm,孔径(pore size)0.4μm,corning公司,美国),照射放射线后立即分别按照设定的方式处理admsc-cdv。在37℃、5%co2的恒温箱中培养处理的细胞后分别在第6天及第9天使用millicell ers-2(emd millipore corp公司,美国)检测跨上皮抗性(teer),照射放射线6天后的检测结果如图5的a部分所示,照射放射线9天后的检测结果如图5的b部分所示。
84.如图5的a部分所示,向腮腺细胞照射5gy的放射线6天后检测跨上皮抗性的结果,确认到与未做任何处理的组相比,只照射放射线的组中跨上皮抗性显著减小,确认到照射5gy的放射线后处理admsc-cdv的所有组的跨上皮抗性均与只照射放射线的组相比显著高。
cdv处理照射15gy的放射线的下颌下腺细胞后,分别在第1天、第3天、第6天及第9天确认细胞增殖能力的结果,确认到与未使用admsc-cdv处理的组相比,以1
×
109particles/ml浓度的admsc-cdv处理的组的细胞增殖能力增加了。
97.如图8的a部分所示,以不同浓度的admsc-cdv处理照射5gy的放射线的下颌下腺细胞,9天后确认细胞增殖能力的结果,确认到相比于只照射5gy的放射线的组的细胞增殖能力,照射5gy的放射线并使用1
×
109particles/ml浓度的admsc-cdv处理的细胞增殖能力高。
98.如图8的b部分所示,确认到与未做任何处理的组相比,未照射放射线但使用1
×
109particles/ml浓度的admsc-cdv处理的组的细胞增殖能力未显出差异,确认到只照射5gy的放射线的组的细胞增殖能力比未做任何处理的组减少,但照射5gy的放射线并使用1
×
109particles/ml浓度的admsc-cdv处理的组的细胞增殖能力比只照射5gy的放射线的组明显高。
99.综合上述数据,确认admsc-cdv增强下颌下腺细胞的增殖能力,因放射线受损的下颌下腺细胞的增殖能力也通过admsc-cdv得到增加。
100.5.3.确认源自脂肪的间充质干细胞衍生囊泡对因放射线受损的下颌下腺组织的淀粉酶活性促进效果
101.实施了用于确认源自脂肪的间充质干细胞衍生囊泡对因放射线受损的下颌下腺组织的淀粉酶活性促进效果的实验。具体地,以与实施例2相同的方法向在实施例1中准备的下颌下腺细胞照射放射线,将对下颌下腺细胞未做任何处理的组及只照射5gy的放射线的组设定为对照组,将向下颌下腺细胞照射5gy的放射线并以5
×
107particles/ml~1
×
109particles/ml浓度的在实施例3中制备的admsc-cdv处理的组设定为实验组。具体以与实施例4.3相同的方法检测淀粉酶活性,检测结果如图9所示。
102.如图9所示,确认到与未做任何处理的组相比,只照射5gy的放射线的组中淀粉酶的活性减少了,将照射5gy的放射线并以不同浓度的admsc-cdv处理的组分别培养6天及9天的结果,在6天及9天均确认到照射5gy的放射线并使用1
×
109/ml的admsc-cdv处理的组的淀粉酶活性恢复到与未做任何处理的组的淀粉酶活性相似的水平。即,确认admsc-cdv促进下颌下腺细胞的淀粉酶活性,因放射线受损的下颌下腺细胞的淀粉酶活性也通过admsc-cdv得到恢复。
103.5.4.确认源自脂肪的间充质干细胞衍生囊泡对因放射线受损的下颌下腺组织的跨上皮抗性增强效果
104.实施了用于确认源自脂肪的间充质干细胞衍生囊泡对因放射线受损的下颌下腺组织的跨上皮抗性增强效果的实验。具体地,以与实施例2相同的方法向在实施例1中准备的下颌下腺细胞照射放射线,将对下颌下腺细胞未做任何处理的组及只照射15gy的放射线的组设定为对照组,将向下颌下腺细胞照射15gy的放射线并以5
×
107particles/ml~1
×
109particles/ml浓度的在实施例3中制备的admsc-cdv处理的组设定为实验组。以与实施例4.4相同的方法检测跨上皮抗性,检测结果如图10的a部分及图10的b部分所示。
105.如图10的a部分所示,向下颌下腺细胞照射放射线6天后检测跨上皮抗性的结果,确认到与未做任何处理的组相比,所有照射放射线的组的跨上皮抗性显著低,确认到照射15gy的放射线后处理1
×
109particles/ml的admsc-cdv的组的跨上皮抗性比照射15gy的放
射线后处理5
×
107particles/ml~5
×
108particles/ml的admsc-cdv的组高。
106.如图10的b部分所示,照射放射线9天后检测跨上皮抗性的结果,确认到与未做任何处理的组相比,所有照射放射线的组的跨上皮抗性均低,减小的跨上皮抗性在分别处理5
×
108particles/ml及1
×
109particles/ml的admsc-cdv的组中再次增加了。
107.即,确认admsc-cdv增加下颌下腺细胞的跨上皮抗性,因放射线受损的下颌下腺细胞的跨上皮抗性也通过admsc-cdv得到恢复。
108.实施例6.确认源自脂肪的间充质干细胞衍生囊泡对因放射线受损的舌下腺组织的效果
109.6.1.向舌下腺细胞照射放射线时增殖能力的变化
110.实施了确认向舌下腺细胞照射放射线时的舌下腺细胞的增殖能力发生何种变化的实验。具体地,以与实施例2相同的方法向在实施例1中准备的舌下腺细胞照射放射线来使细胞受损。然后,以与实施例4.1相同的方法在照射放射线后的第1天、第3天、第6天、第9天及第13天检测舌下腺细胞的增殖能力。检测的增殖能力如图11所示。
111.如图11所示,照射0gy、2gy、5gy的放射线后观察舌下腺细胞的增值程度1天、3天、6天、9天、13天的结果,确认到未照射放射线的组(0gy)随着时间很好地发生了细胞增殖,相反,照射2gy或5gy的放射线组相比于未照射放射线的组,细胞增殖从第6天开始显著减少。
112.6.2.确认源自脂肪的间充质干细胞衍生囊泡对因放射线受损的舌下腺组织的增殖能力增强效果
113.实施了用于确认源自脂肪的间充质干细胞衍生囊泡对因放射线受损的舌下腺组织的增殖能力增强效果的实验。实验组设定如下。分为未照射放射线的组、照射2gy的放射线的组以及照射5gy的放射线的组,再分别设定以0particles/ml、5
×
107particles/ml、1
×
108particles/ml、5
×
108particles/ml或1
×
109particles/ml的浓度使在实施例3中制备的admsc-cdv的处理浓度不同的下位组,分别在照射放射线后的第1天、第3天、第6天、第9天及第12天检测各下位组的增殖能力。使用与实施例4.1相同的方法检测细胞增殖能力,检测结果如图12的a部分至图12的c部分所示。
114.并且,将放射线损伤9天后检测的增殖能力分为normal control组(未使用放射线及admsc-cdv处理的组)、ir组(未使用admsc-cdv处理,只使用2gy的放射线处理)、admsc-cdv组(未使用放射线处理,使用1
×
109particles/ml的admsc-cdv处理)、ir admsc-cdv组(使用2gy的放射线、1
×
108particles/ml、5
×
108particles/ml或1
×
109particles/ml的admsc-cdv处理)来比较的结果如图13的a部分及图13的b部分所示。
115.如图12的a部分所示,以5
×
107particles/ml~1
×
109particles/ml浓度的admsc-cdv处理照射0gy的放射线的舌下腺细胞后,分别在第1天、第3天、第6天、第9天及第12天确认细胞增殖能力的结果,确认到从第6天开始细胞增殖能力在以1
×
109particles/ml的浓度处理的组中增加了,确认到上述效果持续到第12天。
116.如图12的b部分所示,以5
×
107particles/ml~1
×
109particles/ml浓度的admsc-cdv处理照射2gy的放射线的舌下腺细胞后,分别在第1天、第3天、第6天、第9天及第12天确认细胞增殖能力的结果,确认与未使用admsc-cdv处理的组相比,以1
×
109particles/ml的浓度处理admsc-cdv的组从第9天开始显出增殖能力增加的状态,上述效果一直持续到第12天。
117.如图12的c部分所示,以5
×
107particles/ml~1
×
109particles/ml浓度的admsc-cdv处理照射5gy的放射线的舌下腺细胞后,分别在第1天、第3天、第6天、第9天及第12天确认细胞增殖能力的结果,确认到与未使用admsc-cdv处理的组相比,以1
×
109particles/ml浓度的admsc-cdv处理的组的细胞增殖能力从第9天开始增加了,这种效果一直持续到第12天。
118.如图13的a部分所示,以不同浓度的admsc-cdv处理照射2gy的放射线的舌下腺细胞,9天后确认细胞增殖能力的结果,确认到相比于只照射2gy的放射线的组的细胞增殖能力,照射2gy的放射线并使用1
×
109particles/ml浓度的admsc-cdv处理的组的细胞增殖能力高。
119.如图13的b部分所示,确认到与未做任何处理的组相比,未照射放射线但使用1
×
109particles/ml浓度的admsc-cdv处理的组的细胞增殖能力显著高,只照射2gy的放射线的组的细胞增殖能力比未做任何处理的组减少,确认到照射2gy的放射线并使用1
×
109particles/ml浓度的admsc-cdv处理的组的细胞增殖能力比只照射2gy的放射线的组明显高。
120.综合上述数据,确认admsc-cdv增强舌下腺细胞的增殖能力,因放射线受损的舌下腺细胞的增殖能力也通过admsc-cdv得到增加。
121.6.3.确认源自脂肪的间充质干细胞衍生囊泡对因放射线受损的舌下腺组织的淀粉酶活性促进效果
122.实施了用于确认源自脂肪来的充质干细胞衍生囊泡对因放射线受损的舌下腺组织的淀粉酶活性促进效果的实验。具体地,以与实施例2相同的方法向在实施例1中准备的舌下腺细胞照射放射线,将对舌下腺细胞未做任何处理的组及只照射5gy的放射线的组设定为对照组,将向舌下腺细胞照射5gy的放射线并以5
×
107particles/ml~1
×
109particles/ml浓度的在实施例3中制备的admsc-cdv处理的组设定为实验组。具体以与实施例4.3相同的方法检测淀粉酶活性,照射放射线6天后检测的结果如图14的a部分所示,照射放射线9天后检测的结果如图14的b部分所示。
123.如图14的a部分所示,确认到与未做任何处理的组相比,只照射5gy的放射线的组中淀粉酶的活性减少了,而照射5gy的放射线并处理1
×
109particles/ml的admsc-cdv的组的淀粉酶活性比未做任何处理的组的淀粉酶活性的水平更高。
124.如图14的b部分所示,确认到与未做任何处理的组相比,只照射5gy的放射线的组中淀粉酶的活性减少了,而照射5gy的放射线并处理5
×
108particles/ml的admsc-cdv的组的淀粉酶活性比只照射5gy的放射线的组、照射5gy的放射线并处理5
×
107particles/ml的admsc-cdv的组以及照射5gy放射线并处理1
×
108particles/ml的admsc-cdv的组的淀粉酶活性增加了,确认到照射5gy的放射线并处理1
×
109particles/ml的admsc-cdv的组的淀粉酶的活性比未做任何处理的组的淀粉酶活性水平更高。
125.即,确认admsc-cdv促进舌下腺细胞的淀粉酶活性,因放射线受损的舌下腺细胞的淀粉酶活性也通过admsc-cdv得到恢复。
126.6.4.确认源自脂肪的间充质干细胞衍生囊泡对因放射线受损的舌下腺组织的跨上皮抗性增强效果
127.实施了用于确认源自脂肪的间充质干细胞衍生囊泡对因放射线受损的舌下腺组
织的跨上皮抗性增强效果的实验。具体地,以与实施例2相同的方法向在实施例1中准备的舌下腺细胞照射放射线,将对舌下腺细胞未做任何处理的组及只照射5gy的放射线的组设定为对照组,将向舌下腺细胞照射5gy的放射线并以5
×
107particles/ml~1
×
109particles/ml浓度的在实施例3中制备的admsc-cdv处理的组设定为实验组。以与实施例4.4相同的方法检测跨上皮抗性,检测结果如图15的a部分及图15的b部分所示。
128.如图15的a部分所示,向舌下腺细胞照射放射线6天后检测跨上皮抗性的结果,确认到与未做任何处理的组相比,只照射放射线的组中跨上皮抗性显著减小,照射5gy的放射线并处理5
×
107particles/ml及5
×
108particles/ml的admsc-cdv的组比只照射5gy的放射线的组的跨上皮抗性高。
129.如图15的b部分所示,照射放射线9天后检测跨上皮抗性的结果,确认所有照射5gy的放射线的组中的跨上皮抗性比未做任何处理的组都低,确认到照射5gy的放射线并处理5
×
107particles/ml~1
×
109particles/ml的admsc-cdv的组的跨上皮抗性比只照射5gy的放射线的组高。
130.即,确认admsc-cdv增加舌下腺细胞的跨上皮抗性,因放射线受损的舌下腺细胞的跨上皮抗性也通过admsc-cdv得到恢复。
131.实施例7.确认细胞衍生囊泡与自然分泌的外泌体相比的增殖能力增强效果
132.7.1.制备源自脂肪细胞来源间充质干细胞(admsc)的自然分泌的外泌体
133.通过超高速离心分离或切向流过滤从脂肪细胞来源间充质干细胞培养液获得自然分泌的外泌体。具体地,去除在细胞完全(complete)生长培养基中培养的间充质干细胞的现有培养液后,放入经在120000g的条件下利用超高速离心分离16小时后获得的去除外泌体的(exosome-depleted)培养液后培养24小时。然后,在培养液通过如下顺序的超高速离心分离来分泌自然分泌的外泌体。首先,以在300g的条件下10分钟、在2000g的条件下10分钟、在10000g的条件下30分钟的顺序依次进行离心分离来获得上清液,或者以与实施例3相同的方法通过切向流过滤使其通过膜柱后获得滤液。然后,在120000g的条件下进行超高速离心分离2小时,获得沉淀的层后使其在磷酸盐缓冲溶液中再悬浮后,为了洗涤而再次以120000g的条件进行超高速离心分离2小时或3小时。然后,使沉淀的层在磷酸盐缓冲溶液中再悬浮来获得悬浮液。使上述悬浮液通过0.2μm的无菌瓶顶过滤装置(steritop threaded bottle top filter)(millipore公司,美国)来进行过滤,从而获得源自间充质干细胞的自然分泌的外泌体。
134.7.2.确认间充质干细胞衍生囊泡与自然分泌的外泌体相比的增殖能力增强效果
135.实施了用于比较自然分泌的外泌体与细胞衍生囊泡对因放射线受损的腮腺组织的增殖能力增强效果的实验。具体地,以在实施例2中准备的因5gy的放射线受损的腮腺细胞为对象,设定为未做任何处理的无处理实验组(ir)、处理1
×
109个的在实施例7.1中制备的自然分泌的外泌体(admsc ne)的实验组(ir admsc ne)、处理1
×
109个的在实施例3中制备的admsc cdv的实验组(ir admsc cdv)。以与实施例4.1相同的方法在暴露于放射线的第9天检测各实验组的增殖能力,检测结果如图16及表1所示。
136.表1
[0137] irir admsc neir admsc cdv平均值
±
标准差1.00
±
0.041.01
±
0.041.06
±
0.08
[0138]
如图16及表1所示,在处理自然分泌的外泌体(admsc ne)的实验组(ir admsc ne)的情况下,与无处理实验组(ir)相比,未恢复因放射线受损的腮腺的增殖能力。但是,在处理admsc cdv的实验组(ir admsc cdv)的情况下,确认到与无处理实验组(ir)相比,腮腺增殖能力显著恢复。
[0139]
实施例8.确认细胞衍生囊泡与自然分泌外泌体相比的跨上皮抗性增强效果
[0140]
8.1.确认源自脂肪细胞的间充质干细胞衍生囊泡与自然分泌的外泌体相比的跨上皮抗性增强效果
[0141]
实施了用于比较自然分泌的外泌体与细胞衍生囊泡对因放射线受损的腮腺组织的跨上皮抗性增强效果的实验。具体地,以未照射放射线的腮腺细胞的对照组(con),以实施例2中准备的因5gy的放射线受损的腮腺细胞为对象,设定未做任何处理的无处理实验组(ir)、分别处理1
×
108个、1
×
109个、1
×
10
10
个的在实施例7.1中制备的自然分泌的外泌体(admsc ne)的实验组、分别处理1
×
108个、1
×
109个、1
×
10
10
个的在实施例3中制备的admsc cdv的实验组(admsc cdv)。以与实施例4.4相同的方法在暴露于放射线的第9天检测各实验组的跨上皮抗性,检测结果如图17所示。
[0142]
如图17所示,确认到在处理自然分泌的外泌体(admsc ne)的实验组中,与外泌体的数量无关地,未显出与无处理实验组(ir)之间的显著差异,而在处理admsc cdv的实验组中,跨上皮抗性都比无处理实验组(ir)相比增加了。
[0143]
8.2.确认源自脐带的间充质干细胞衍生囊泡(uc-msc cdv)与自然分泌的外泌体相比的跨上皮抗性增强效果
[0144]
实施了用于确认在细胞衍生囊泡的来源细胞不同的情况下是否也增加跨上皮抗性的实验。具体地,以与实施例3相同的方法从脐带来源间充质干细胞制备细胞衍生囊泡(uc-msc cdv),以与实施例7.1相同的方法制备自然分泌的外泌体(uc-msc ne)。以实施例2中制备的因5gy的放射线受损的腮腺细胞为对象,设定未做任何处理的无处理实验组(ir)、处理5
×
107个、1
×
109个的自然分泌的外泌体(uc-msc ne)的实验组、处理1
×
109个、1
×
10
10
个的uc-msc cdv的实验组(uc-msc cdv)。分别在暴露于放射线的第3天、第6天、第9天以与实施例9.1相同的方法检测uc-msc cdv和从脐带来源间充质干细胞分离的自然分泌的外泌体的跨上皮抗性,结果如图18所示。
[0145]
如图18所示,确认到在处理自然分泌的外泌体(uc-msc ne)的实验组中,与外泌体的数量及暴露于放射线的时间无关地,未显出无处理实验组(ir)之间的显著差异,但在处理uc-msc cdv的实验组的跨上皮抗性均与无处理实验组(ir)相比增加。通过上述结果确认,本发明的细胞衍生囊泡即使来源细胞不同,也与自然分泌的外泌体不同地,在处理细胞时,具有增强跨上皮抗性的效果。
[0146]
实施例9.在动物模型中确认间充质干细胞衍生囊泡与自然生成的外泌体相比的淀粉酶活性促进效果。
[0147]
实施了用于确认在将本发明的间充质干细胞衍生囊泡实际应用于唾液腺受损的动物模型时是否具有唾液腺功能恢复效果的实验。用于实验的小鼠(4周龄雌鼠(female)c3h;18g-22g)是从orient bio公司的实验动物生产中心(orient bio公司,城南,韩国)购买的,根据仁荷大学实验动物指导书进行饲育。20只小鼠分为正常实验组实验组(cont)、处理15gy的放射线的实验组(ir)、照射放射线后处理4
×
109个的uc-msc-cdv的实验组(ir
uc-msc-cdv)、照射放射线后处理4
×
109个的uc-msc-ne的实验组(ir uc-msc-ne),所有动物实验均在获得仁荷大学动物伦理委员会的认可后进行的(inha 1612140464)。在4℃的温度下以1500g的条件将从上述设定4个实验组的小鼠中获得的唾液离心分离10分钟后,仅获取上清液并按照淀粉酶检测协议(abcam公司,美国)检测淀粉酶活性。向装有唾液(50μl)的96孔培养板中加入100μl预先制备好的反应混合物并充分混合后,在常温下反应10分钟、60分钟后,在405nm的吸光度下分别检测吸光度。求得反应60分钟时的吸光度与反应10分钟时的吸光度之间的差值并换算为淀粉酶活性来确认,其结果如图19所示。
[0148]
如图19所示,在向唾液腺组织因放射线损伤而受损的小鼠模型处理uc-msc ne的情况下,虽然没有观察到淀粉酶活性发生显著变化,但在处理uc-msc cdv的情况下,观察到淀粉酶活性显著增加。通过上述结果在生物体(in vivo)内确认本发明的细胞衍生囊泡对受损的唾液腺组织具有治疗效果。
[0149]
实施例10.确认间充质干细胞衍生囊泡的唾液分泌量增加效果
[0150]
实施了用于确认当将本发明的间充质干细胞衍生囊泡应用于小鼠模型时是否具有增加唾液分泌量的效果的实验。具体地,向用于实验的小鼠(4周龄雌鼠c3h;18g-22g)腹腔内注射氯胺酮(100mg/kg)来麻醉后,利用胰岛素注射器向两侧下颌下腺局部注射40μl的109个/μl的uc-msc cdv后缝合。然后,在7周后注射氯胺酮(100mg/kg,i.p.)来麻醉小鼠后,注射作为毒蕈碱性胆碱能激动剂的毛果芸香碱(pilocarpine,0.2mg/kg,i.p.)后立即收集从小鼠口中积聚的唾液7分钟并测量重量来检测唾液分泌量,其结果如图20所示。
[0151]
如图20所示,确认到在处理uc-msc cdv的小鼠的情况下,与未处理的对照组的小鼠相比,唾液分泌量显著增加。通过上述结果确认本发明的细胞衍生囊泡具有增加唾液分泌量的效果。
[0152]
以下,说明包含本发明的细胞衍生囊泡的用于预防或治疗唾液腺疾病的药物组合物的制备例,但不是出于限制本发明的目的,而只是具体说明本发明。
[0153]
制备例1.制备散剂
[0154]
100mg的本发明的细胞衍生囊泡。
[0155]
1g的乳糖。
[0156]
混合上述成分后填充进密封袋中制备散剂。
[0157]
制备例2.制备片剂
[0158]
100mg的本发明的细胞衍生囊泡。
[0159]
100mg的玉米淀粉。
[0160]
100mg的乳糖。
[0161]
2mg的硬脂酸镁。
[0162]
混合上述成分后,根据通常的片剂制备方法压片来制备片剂。
[0163]
制备例3.制备胶囊剂
[0164]
100mg的本发明的细胞衍生囊泡。
[0165]
100mg的玉米淀粉。
[0166]
100mg的乳糖。
[0167]
2mg的硬脂酸镁。
[0168]
混合上述成分后,根据通常的胶囊剂制备方法填充进明胶胶囊来制备胶囊剂。
[0169]
制备例4.制备丸
[0170]
100mg的本发明的细胞衍生囊泡。
[0171]
1.5g的乳糖。
[0172]
1g的甘油。
[0173]
0.5g的木糖醇。
[0174]
混合上述成分后,根据通常的方法以一个丸为4g的方式制备。
[0175]
制备例5.制备颗粒
[0176]
100mg的本发明的细胞衍生囊泡。
[0177]
50mg的大豆提取物。
[0178]
200mg的葡萄糖。
[0179]
600mg的淀粉。
[0180]
混合上述成分后,添加100mg的30%的乙醇后在60℃的摄氏温度下干燥形成颗粒后填充进袋中。
[0181]
制备例6.制备注射剂
[0182]
10mg的本发明的细胞衍生囊泡。
[0183]
180mg的甘露醇。
[0184]
2974mg的注射用灭菌蒸馏水。
[0185]
26mg的na2hpo42h2o。
[0186]
根据通常的注射剂制备方法以1安碚瓶(2ml)包含上述成分含量的方式制备。
[0187]
制备例7.片剂型保健功能食品
[0188]
配合15重量百分比的二十八烷醇粉末、15重量百分比的乳糖水解物粉末、15重量百分比的分离大豆蛋白粉末、15重量百分比的壳寡糖、10重量百分比的酵母提取物粉末、10重量百分比的维生素矿物质混合制剂、4.6重量百分比的硬脂酸镁、0.2重量百分比的二氧化钛、0.2重量百分比的甘油脂肪酸酯以及20重量百分比的本发明的细胞衍生囊泡以通常的方法制备片剂型保健功能食品。
[0189]
制备例8.保健饮料
[0190]
配合5重量百分比的蜂蜜、3重量百分比的果糖、0.0001重量百分比的盐酸核黄素钠、0.0001重量百分比的盐酸吡哆辛、86.9998重量百分比的水以及5重量百分比的本发明的细胞衍生囊泡以通常的方法制备保健饮料。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
