1.本发明涉及纳米药物制备技术领域,尤其涉及一种橙皮苷纳米粒及其制备方法。
背景技术:
2.橙皮苷(hesperidin),又称川陈皮素,为芸香科柑橘类物种的二氢黄铜类化合物,是由橙皮素和芸香糖结合而成的苷,分子式为c
28h34o15
,相对分子质量610.57。橙皮苷微溶于水,是一种天然的抗癌物质,具有较广的抗癌谱,作用机制复杂。目前已知橙皮苷具有多种效用,如抗坏血病、抗癌、抗氧化、预防糖尿病以及抗心血管疾病等,是一种具有良好开发前景的药物。具有抗菌、抗炎、清除自由基、抗氧化、止咳祛痰、降血脂、抗癌抗肿瘤、抑制肺纤维化、预防和治疗肝病、抑制血小板凝结、抗粥样动脉硬化等作用,可被广泛地应用于医药、食品等领域。
3.橙皮苷具有多种生物学效应,能够对不同的信号通路进行干预,在抗肿瘤方面,可能涉及nf-kb通路信号转导抑制,tgf-β/smad信号通路阻滞以及ppar-γ通路的活化。目前研究表明橙皮苷可能是一种潜在的多靶点抗肿瘤药物,它对肿瘤的抑制可能是通过多条信号通路相互作用的结果,并且在不同的肿瘤细胞和肿瘤微环境中的作用效果也不同。在实际应用中,由于橙皮苷的低溶解性导致其生物利用度不高。
4.纳米载药体系(nano drug delivery system,ndds)是指将纳米技术和纳米材料应用到治疗中,主要通过提升病变部位药物的靶向递送等来解决传统药物治疗中存在的问题。纳米药物载体是一种新型载体,通常由天然或合成的高分子材料制成,也有部分纳米药物载体是由无机纳米颗粒、无机-有机纳米材料等构成。因其粒径远远小于毛细血管管径,并能降低药物毒副作用、提高药物稳定性、缓释控释药物靶向释放等优点,所以被广泛应用于医学领域中。近年研究的仿生响应性纳米载药体系,更是能够进一步提高药物靶向治疗效果。不仅能极大程度的降低机体对外来药物载体的免疫性,有效避免作用药物被免疫系统捕获,还有利于药物通过epr效应富集到肿瘤部位发挥作用。除此之外,还能促使各种免疫细胞集中到炎症区域,使得这些仿生纳米载体能够实现对炎症及相关疾病的主动靶向性,从而建立抗肿瘤免疫反应。
5.目前关于橙皮苷纳米药物的研究减少,现有技术中制备的橙皮苷复合物性质有待提高,例如文章(nano-formulations ofhesperidin and essential oil extracted from sweet orange peel:chemical properties and biologicalactivities,ahmed aboul-enein,et al.egyptian journal of chemistry.august 2021.08,ejchem.2021.84783.4139)中采用peg包载的橙皮苷复合物,其平均粒径为337.2nm,属于较大纳米粒子,后续应用过程中可能会影响生物利用度,平均电位 4.89mv,在0~5mv范围内,会出现纳米粒子快速凝结的情况,并且peg具有一定的生物毒性,该纳米粒子的安全性存疑。
技术实现要素:
6.本发明的目的在于提供一种橙皮苷纳米粒及其制备方法,以解决现有技术中橙皮苷纳米粒性质差、生物利用度不高等问题。
7.为了实现上述发明目的,本发明提供以下技术方案:
8.本发明提供了一种橙皮苷纳米粒,所述橙皮苷纳米粒包含橙皮苷-卵磷脂脂质体结构。
9.本发明还提供了一种橙皮苷纳米粒的制备方法,包含如下步骤:
10.将橙皮苷溶液与表面活性剂混合,得到混合溶液a;
11.将混合溶液a与卵磷脂溶液混合,得到混合溶液b;
12.将混合溶液b逐滴加入水中,至水相无分层,得到混合溶液c;
13.将混合溶液c进行纯化,即得橙皮苷纳米粒。
14.优选的,所述橙皮苷溶液的溶剂为二甲基亚砜,所述橙皮苷溶液中橙皮苷的浓度为10~80mg/ml。
15.优选的,所述表面活性剂为聚乙二醇,所述表面活性剂的分子量为200~2000道尔顿。
16.优选的,所述橙皮苷溶液中的橙皮苷的质量与表面活性剂的质量比为1:1~5。
17.优选的,所述卵磷脂溶液的溶剂为无水乙醇或乙醇水溶液,所述乙醇水溶液的体积浓度为70~80%,所述卵磷脂溶液中卵磷脂的浓度为50~300mg/ml。
18.优选的,所述混合溶液b与水的体积比为0.025:1~10。
19.优选的,所述纯化包含如下步骤:
[0020]ⅰ、将混合溶液c进行超滤,得到超滤产物;
[0021]ⅱ、将超滤产物进行离心,得到上清液和沉淀;
[0022]ⅲ、将沉淀进行洗涤、离心;
[0023]
将所述步骤ⅲ重复进行2~4次,即得橙皮苷纳米粒。
[0024]
优选的,所述超滤的截留分子量为80~120kda。
[0025]
优选的,所述步骤ⅱ和步骤ⅲ中离心的转速为1000~3000r/min,所述离心的时间为5~7min。
[0026]
本发明还提供了一种橙皮苷纳米粒在制备治疗肺癌的药物中的应用。
[0027]
本发明的技术效果和优点:
[0028]
本发明通过将橙皮苷包裹在卵磷脂加载的表面活性剂溶液中,形成纳米橙皮苷,其平均粒径仅有120nm,平均电位可达-10.45mv,包封率为72.11%,性质优良。其抑制a549肺癌细胞活力的ic50为118μmol/ml,与橙皮苷抑制a549肺癌细胞活力的ic50相比,降低了306μmol/ml。划痕实验结果显示,橙皮苷纳米粒作用24h后,浓度为100μmol/ml的橙皮苷纳米粒的迁移抑制率为56.16%,浓度为50μmol/ml的迁移抑制率为53.65%,浓度为25μmol/ml的迁移抑制率为36.05%。细胞凋亡染色实验中,浓度为100μmol/ml的橙皮苷纳米粒的实验组的凋亡率为10.20%,浓度为50μmol/ml的橙皮苷纳米粒实验组的凋亡率为6.83%;以上结果与橙皮苷相比均有明显提升,表明构建的橙皮苷纳米粒体系能够有效的提高橙皮苷的生物利用度。
附图说明
[0029]
图1为橙皮苷抑制a549的细胞增殖作用曲线图;
[0030]
图2为橙皮苷纳米粒抑制a549的细胞增殖作用曲线图;
[0031]
图3为橙皮苷对a549细胞凋亡的影响图;
[0032]
图4为橙皮苷纳米粒对a549细胞凋亡的影响图;
[0033]
图5为橙皮苷对a549细胞迁移能力的影响;
[0034]
图6为橙皮苷纳米粒对a549细胞迁移能力的影响。
具体实施方式
[0035]
本发明提供了一种橙皮苷纳米粒,所述橙皮苷纳米粒包含橙皮苷-卵磷脂脂质体结构。
[0036]
本发明还提供了一种橙皮苷纳米粒的制备方法,包含如下步骤:
[0037]
将橙皮苷溶液与表面活性剂混合,得到混合溶液a;
[0038]
将混合溶液a与卵磷脂溶液混合,得到混合溶液b;
[0039]
将混合溶液b逐滴加入水中,至水相无分层,得到混合溶液c;
[0040]
将混合溶液c进行纯化,即得橙皮苷纳米粒。
[0041]
在本发明中,所述橙皮苷溶液的溶剂优选为二甲基亚砜,所述橙皮苷溶液中橙皮苷的浓度优选为10~80mg/ml,进一步优选为20~70mg/ml,还优选为40~60mg/ml;本发明所述表面活性剂优选为聚乙二醇,所述表面活性剂的分子量优选为200~2000道尔顿,进一步优选为500~1500道尔顿,还优选为800~1200道尔顿;所述橙皮苷溶液中的橙皮苷与表面活性剂的质量比优选为1:1~5,进一步优选为1:2~4。
[0042]
在本发明中,所述卵磷脂溶液的溶剂优选为无水乙醇或乙醇水溶液,当卵磷脂溶液的溶剂为乙醇水溶液时,所述乙醇水溶液的体积浓度优选为70~80%,进一步优选为73~78%;本发明所述卵磷脂溶液中卵磷脂的浓度优选为50~300mg/ml,进一步优选为100~200mg/ml;本发明中卵磷脂溶液的制备过程优选包括如下步骤:将卵磷脂溶解于无水乙醇或乙醇水溶液中,溶解过程伴随磁力搅拌和35~40℃水浴,卵磷脂溶液与混合溶液a混合之前优选保持35~40℃水浴状态。
[0043]
在本发明中,所述水优选为纯净水,所述水的温度优选为35~40℃;所述混合溶液b与水的体积比优选为0.025:1~10,进一步优选为0.025:3~7;所述将混合溶液b逐滴加入水中优选伴随磁力搅拌,所述磁力搅拌的转速优选为300~500r/min。
[0044]
在本发明中,所述纯化优选包含如下步骤:
[0045]ⅰ、将混合溶液c进行超滤,得到超滤产物;
[0046]ⅱ、将超滤产物进行离心,得到上清液和沉淀;
[0047]ⅲ、将沉淀进行洗涤、离心;
[0048]
将所述步骤ⅲ重复进行2~4次,即得橙皮苷纳米粒。
[0049]
在本发明中,所述超滤之前还优选包括将混合溶液c进行水浴超声,所述水浴超声的时间优选为5~15min,所述水浴超声的温度优选为35~40℃,所述水浴超声之后优选包括在磁力搅拌条件下进行透析,所述透析采用的透析膜孔径优选为80~120nm,所述透析的时间优选为10~15h,所述透析的目的在于去除未负载的橙皮苷;所述超滤的截留分子量优
选为80~120kda,进一步优选为90~110kda,所述超滤的目的在于去除有机溶剂;所述洗涤采用的试剂优选为水;本发明所述离心的转速优选为1000~3000r/min,进一步优选为1500~2500r/min,所述离心的时间优选为5~7min,所述步骤ⅲ重复的次数优选为2~4次。
[0050]
本发明还提供了一种橙皮苷纳米粒在制备治疗肺癌的药物中的应用,所述药物优选的以本发明橙皮苷纳米粒为唯一活性成分;所述药物优选的还包括辅料,本发明对所述辅料的种类没有特殊限定,采用本领域常规的药物辅料即可;本发明所述的药物剂型优选为散剂、片剂、颗粒剂、胶囊剂、溶液剂、乳剂、混悬剂、注射剂、喷雾剂、气雾剂或粉雾剂等。在本发明中,所述药物包括载体,所述载体优选为口服制剂用的粘合剂、润滑剂、崩解剂、助溶剂、稀释剂、稳定剂、悬浮剂、无色素、矫味剂等;可注射制剂用的防腐剂、加溶剂、稳定剂等;局部制剂用的基质、稀释剂、润滑剂、防腐剂等。
[0051]
试剂、细胞来源如下:
[0052]
本发明所述的卵磷脂购自上海太伟药业有限公司,橙皮苷、聚乙二醇购自chemmedexpress,a549细胞购自atcc。
[0053]
其余所用原料及试剂均为商业购买。
[0054]
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
[0055]
实施例1
[0056]
(1)取300mg卵磷脂溶解于1ml无水乙醇中,水浴37℃进行磁力搅拌,直到完全融化,37℃热浴恒温保存。
[0057]
(2)称取80mg橙皮苷溶解于1ml二甲基亚砜中,磁力搅拌至完全溶解。
[0058]
(3)取100μl卵磷脂溶液、80μl橙皮苷溶液,混合均匀。
[0059]
(4)取20ml提前热浴好37℃的纯净水,在400r/min磁力搅拌的情况下,逐滴注入混合好的卵磷脂橙皮苷混合液。
[0060]
(5)将得到纳米卵磷脂包载橙皮苷初液采用amiconfilter(100kda,2700r/min)进行超滤,得到溶液10ml,此时溶液浓度为80mg/ml。
[0061]
(6)将溶液进行水浴超声8min,进一步通过透析袋,在磁力搅拌的条件下进行透析(透析膜孔径100nm)12h,所得混合液在2000r/min条件下离心7min,并用水洗涤,洗涤-离心步骤重复2次,收集剩余物,即得到卵磷脂包裹橙皮苷的橙皮苷纳米粒。
[0062]
实施例2
[0063]
(1)取70mg卵磷脂溶解于1ml无水乙醇中,水浴35℃进行磁力搅拌,直到完全融化,35℃热浴恒温保存。
[0064]
(2)称取20mg橙皮苷溶解于1ml二甲基亚砜中,磁力搅拌至完全溶解。
[0065]
(3)取100μl卵磷脂溶液、80μl橙皮苷溶液,混合均匀。
[0066]
(4)取20ml提前热浴好37℃的纯净水,在500r/min磁力搅拌的情况下,逐滴注入混合好的卵磷脂橙皮苷混合液。
[0067]
(5)将得到纳米卵磷脂包载橙皮苷初液采用amiconfilter(100kda,2700r/min)进行超滤,得到溶液10ml,此时溶液浓度为90mg/ml。
[0068]
(6)将溶液进行水浴超声10min,进一步通过透析袋,在磁力搅拌的条件下进行透析(透析膜孔径100nm)11h,所得混合液在1500r/min条件下离心5min,并用水洗涤,洗涤-离
心步骤重复3次,收集剩余物,即得到卵磷脂包裹橙皮苷的橙皮苷纳米粒。
[0069]
实施例3
[0070]
(1)取200mg卵磷脂溶解于1ml无水乙醇中,水浴37℃进行磁力搅拌,直到完全融化,37℃热浴恒温保存。
[0071]
(2)称取40mg橙皮苷溶解于1ml二甲基亚砜中,磁力搅拌至完全溶解。
[0072]
(3)取100μl卵磷脂溶液、80μl橙皮苷溶液,混合均匀。
[0073]
(4)取20ml提前热浴好37℃的纯净水,在400r/min磁力搅拌的情况下,逐滴注入混合好的卵磷脂橙皮苷混合液。
[0074]
(5)将得到纳米卵磷脂包载橙皮苷初液采用amiconfilter(100kda,2700r/min)进行超滤,得到溶液10ml,此时溶液浓度为70mg/ml。
[0075]
(6)将溶液进行水浴超声10min,进一步通过透析袋,在磁力搅拌的条件下进行透析(透析膜孔径100nm)14h,所得混合液在2500r/min条件下离心8min,并用水洗涤,洗涤-离心步骤重复4次,收集剩余物,即得到卵磷脂包裹橙皮苷的橙皮苷纳米粒。
[0076]
实验例1纳米粒性能测定
[0077]
取实施例1得到的橙皮苷纳米粒1ml,采用zetaplus型激光粒度分析仪(美国布鲁克海文仪器有限公司)进行粒径和电位的测定;
[0078]
包封率的计算公式如下:
[0079]
包封率=(1-游离橙皮苷质量/橙皮苷总质量)
×
100%
[0080]
检测结果显示,橙皮苷纳米粒的平均粒径为120nm,平均电位-10.45mv,包封率为72.11%,说明本技术制备方法制得的橙皮苷纳米粒较小,有利于在生物体中进行药物递送,且性质稳定,不易出现凝聚现象,包封率较高。
[0081]
实验例2抑制a549细胞增殖实验
[0082]
取实施例1得到的橙皮苷纳米粒,用三蒸纯水稀释得到橙皮苷纳米粒工作液;
[0083]
将橙皮苷用三蒸纯水稀释得到橙皮苷工作液;
[0084]
视阴性对照组活细胞数目为100%,抑制率为0。用浓度为200μmol/ml、100μmol/ml、50μmol/ml、25μmol/ml、12.5μmol/ml的橙皮苷工作液分别作用于a549细胞12h、24h、48h、72h;使用浓度为100μmol/ml、50μmol/ml、25μmol/ml、12.5μmol/ml、6.725μmol/ml的橙皮苷纳米粒工作液作用于a549细胞12h、24h、48h、72h。
[0085]
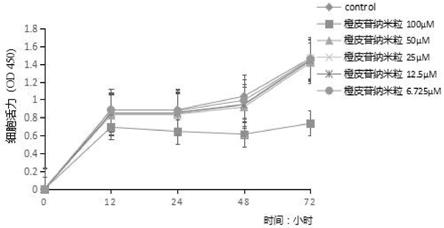
先用细胞计数仪计数所制备的细胞悬液中的细胞数量,然后接种细胞到培养板内置于恒温培养箱中培养24h。将培养板中的培养基吸出,按浓度梯度加入橙皮苷工作液和橙皮苷纳米粒工作液,置于培养箱中培养至相应时间,然后加入cck8溶液培养2小时后在酶标仪下检测得到相应的od值,制作出一个以时间为横坐标(x轴),od值为纵坐标(y轴)的折线图,如图1~2所示。
[0086]
结果显示:橙皮苷抑制a549肺癌细胞活力的ic50为423.57μmol/ml,浓度为200μmol/ml时较对照组出现抑制增殖作用,浓度为100-12.5μmol/ml抑制效果不明显,可见生物利用度较低。橙皮苷纳米粒抑制a549肺癌细胞活力的ic50为117.64μmol/ml,并在浓度为100μmol/ml处有显著增殖抑制作用,呈现剂量性依赖。
[0087]
实验例3促进a549细胞凋亡染色实验
[0088]
(1)在96孔细胞培养板中配置100μl的细胞悬液,细胞数量为3000个/孔,置于培养
箱中培养24h(37℃,5%co2);
[0089]
(2)配制浓度为200μmol/ml、100μmol/ml的橙皮苷纳米粒工作液以及200μmol/ml、100μmol/ml的橙皮苷工作液,配制方法同实验例2;
[0090]
(3)按浓度梯度加入橙皮苷纳米粒工作液和橙皮苷工作液,将细胞培养板置于培养箱中培养24h;
[0091]
(4)用pbs缓冲液清洗细胞两次;
[0092]
(5)(活细胞染色)用ao/eb试剂盒对细胞进行染色,常温避光孵育15min;
[0093]
(6)(死细胞染色)用4%多聚甲醛溶液固定细胞10min;再用荧光淬灭封片溶液(含dapi)对细胞进行染色,常温避光孵育30min,结果如图3~4所示。
[0094]
结果显示:
[0095]
在dapi染色实验中,对照组的细胞核呈现椭圆形,染色较浅;浓度为200μmol/ml的橙皮苷工作液作用24h后,部分细胞发生凋亡:细胞染色较深,细胞体积缩小,细胞与周围的细胞开始脱离,细胞核发生形态变化,细胞核染色加深,且出现核固缩和碎裂现象;浓度为100μmol/ml的橙皮苷实验组细胞仅有少量细胞发生凋亡,凋亡效果不明显。在ao/eb双荧光染色中,对照组的细胞的细胞膜正常,胞浆浓缩、核dna浓缩致密,在荧光显微镜下可以观察到细胞呈绿色荧光圆球状小体,橙红色的细胞凋亡数量少,凋亡率为4.03%;浓度为200μmol/ml的实验组细胞的细胞膜通透性下降,部分绿色荧光细胞发生形变,橙色细胞凋亡数量较对照增多,但不明显,凋亡率为7.65%。浓度为100μmol/ml的橙皮苷实验组大部分细胞呈绿色圆球状小体,橙红色的凋亡细胞数量下降,凋亡率为5.49%。
[0096]
在dapi染色实验中,对照组的细胞核呈现椭圆形,染色较浅;100μmol/ml的橙皮苷纳米粒工作液的细胞发生形态变化:细胞体积缩小,细胞与周围的细胞开始脱离,细胞核也发生形态变化,细胞核染色加深,且出现核固缩和碎裂现象,浓度为50μmol/ml的橙皮苷实验组细胞较浓度为100μmol/ml的实验组低。在ao/eb双荧光染色实验中,对照组细胞的细胞膜正常,胞浆浓缩、核dna浓缩致密,在荧光显微镜下可以观察到细胞呈绿色荧光圆球状小体,凋亡率为3.65%;浓度为100μmol/ml的橙皮苷纳米粒作用24h后,大量细胞的细胞膜通透性下降,eb能够进入细胞将细胞染成橙红色荧光,凋亡率为10.20%;浓度为50μmol/ml的橙皮苷纳米粒作用24h,也有部分凋亡细胞被染成橙红色,但较浓度100μmol/ml实验组少,凋亡率为6.83%。两个实验组的凋亡现象都较对照组明显,说明橙皮苷纳米粒能够显著的促进肺癌细胞发生凋亡。
[0097]
实验例4抑制a549细胞迁移实验
[0098]
(1)在24孔细胞培养板中放置插件,在每个插件小室中配置70μl细胞悬液,细胞数量为45000个/孔,在插件外围加入300μla549细胞培养基,将细胞培养板置于培养箱中培养6-12h(37℃,5%co2);
[0099]
(2)将插件小室内的培养基更换为基础培养基(medm),将细胞培养板置于培养箱中饥饿过夜;
[0100]
(3)配制浓度为200μmol/ml,100μmol/ml,50μmol/ml的橙皮苷纳米粒工作液和浓度为100μmol/ml,50μmol/ml,25μmol/ml的橙皮苷工作液,配制方法同实验例2;
[0101]
(4)将插件取出,按浓度梯度加入橙皮苷工作液和橙皮苷纳米粒工作液,在对照组每孔添加10μltgfβ-1,将细胞培养板置于培养箱中培养12h和24h;
[0102]
(5)在倒置显微镜下观察细胞迁移情况并拍照,结果如图5~6所示。
[0103]
结果显示:
[0104]
橙皮苷实验组:
[0105]
在0h时,划痕边界清晰,宽度一致。经橙皮苷作用12h、24h后,对照组细胞边界随着时间的延长,细胞发生迁移:12h的迁移率25.77%,24h的迁移率30.19%;加入了tgfβ-1的对照组,迁移情况为:12h的迁移率为20.22%,24h的迁移率为41.13%;浓度为100μmol/ml的橙皮苷实验组细胞边界的细胞迁移速度较对照组慢(p《0.05),24h的迁移率为20.85%,与对照组相比降低了20.28%;浓度为50μmol/ml的橙皮苷实验组24h的迁移率为24.70%,与对照组相比降低了16.43%;浓度为25μmol/ml的橙皮苷实验组24h的迁移率为31.59%,与对照组相比降低了9.54%;且该效应呈一定时间剂量依赖性。
[0106]
橙皮苷纳米粒实验组:
[0107]
在0h时,各组划痕边界清晰,宽度一致。经培养12h、24h后,对照组细胞边界随着时间的延长,细胞发生迁移:12h的迁移率为62.66%,24h的迁移率为70.46%;加入了tgfβ-1的对照组,迁移情况更为显著:12h的迁移率为49.01%,24h的迁移率为75.95%:浓度为100μmol/ml的橙皮苷纳米粒实验组细胞边界的细胞迁移速度明显变慢,与对照组相比有较为显著的差异(p《0.05),24h的迁移率为19.79%,与对照组相比降低了56.16%;浓度为50μmol/ml橙皮苷纳米粒实验组24h的迁移率为22.30%,与对照组相比降低了53.65%;浓度为25μmol/ml的橙皮苷纳米粒实验组24h的迁移率为39.90%,与对照组相比降低了36.05%;该效应随着橙皮苷纳米粒浓度的增加而增加,并呈时间剂量依赖性。
[0108]
由以上实施例可知,本发明提供了一种橙皮苷纳米粒,经检测,橙皮苷纳米粒的平均粒径为120nm,平均电位-10.45mv,包封率为72.11%,性质显著优于现有技术中的橙皮苷复合物。对橙皮苷纳米的抗肺癌作用进行了分析,在细胞增殖实验中得到橙皮苷纳米粒抑制a549肺癌细胞活力的ic50为117.65μmol/ml,对a549细胞的抑制浓度最低为50μmol/ml;划痕实验结果显示,橙皮苷纳米粒对a549细胞迁移的抑制效果从药物浓度25-100μmol/ml依次递增,有显著的浓度依赖性。浓度为100μmol/ml时的迁移抑制率为56.16%,浓度为50μmol/ml时的迁移抑制率为53.65%,浓度为25μmol/ml时的迁移抑制率为36.05%;在细胞凋亡染色实验中得到,浓度为100μmol/ml的橙皮苷纳米实验组的凋亡率为10.20%,浓度为50μmol/ml的橙皮苷纳米实验组的凋亡率为6.83%,与橙皮苷相比有效的提高了生物利用度。
[0109]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。