嵌合抑制性受体
1.相关申请的交叉引用
2.本技术要求2019年8月20日提交的美国临时申请号62/889,324的权益,其据此以引用的方式以其整体并入本文。
3.序列表
4.本技术含有序列表,所述序列表已经由efs-web提交并且据此以引用的方式以其整体并入本文。20xx年xx月xx日创建的所述ascii拷贝被命名为xxxxxus_序列表.txt.,并且大小为x,xxx,xxx字节。
背景技术:
5.嵌合抗原受体(car)能够靶向免疫调节细胞如t细胞的体内活化。这些重组膜受体具有抗原结合结构域和一个或多个信号传导结构域(例如,t细胞活化结构域)。这些特殊受体允许t细胞识别肿瘤细胞上的特异性蛋白抗原并诱导t细胞活化和信号传导通路。用表达嵌合受体的t细胞的临床试验的最新结果已经为它们作为癌症免疫疗法的剂的效用提供了有力支持。然而,尽管有这些有希望的结果,仍鉴定出与car t细胞治疗相关的许多副作用,引起显著的安全性问题。一种副作用是来自tcr和car工程化的t细胞的“靶上但组织外”不良事件,其中car t细胞在靶肿瘤组织外与其配体结合并诱导免疫反应。因此,鉴定适当的car靶标的能力对于有效靶向和治疗肿瘤而不损伤表达相同靶抗原的正常细胞是重要的。调控对靶标的适当反应和减少脱靶副作用的能力在诸如tcr、工程化的tcr和嵌合tcr的其他免疫受体系统中也是重要的。
6.抑制性嵌合抗原受体(也称为icar)是在与靶细胞上的其同源配体结合后抑制或降低免疫调节细胞活性的蛋白质构建。目前的icar设计利用pd-1细胞内结构域进行抑制,但已证明难以复制。因此,需要用于icar的替代性抑制性结构域。还需要用于免疫受体系统的适当的抑制性结构域、策略和构建体。
技术实现要素:
7.在一些方面,本文提供了嵌合抑制性受体,其包括:细胞外配体结合结构域;包括跨膜结构域的膜定位结构域;和在靠近免疫受体时抑制免疫受体活化的酶抑制性结构域。
8.在其他方面,本文提供了编码至少一种本公开的嵌合抑制性受体的核酸。在一些实施方案中,编码至少一种嵌合抑制性受体的核酸是载体。
9.在其他方面,提供了基因工程化的细胞,其包含编码至少一种本公开的嵌合受体的核酸如载体或表达本公开的嵌合抑制性受体。在一些方面,提供了表达嵌合抑制性受体的基因工程化的细胞,其中嵌合抑制性受体包括:细胞外配体结合结构域;膜定位结构域,其中膜定位结构域包含跨膜结构域;和酶抑制性结构域,其中抑制性结构域在靠近免疫受体时抑制免疫受体活化。
10.在再其他方面,提供了用于抑制本公开的基因工程化的细胞中的免疫受体活化的方法。
11.在又其他方面,提供了用于利用本公开的基因工程化的细胞或药物组合物来降低免疫反应和/或治疗自身免疫性疾病的方法。
12.在其他方面,药物组合物包含本文提供的组合物中的任一种的工程化的细胞和药学上可接受的载剂、药学上可接受的赋形剂或其组合。
13.在一些实施方案中,细胞外配体结合结构域与选自以下的配体结合:蛋白质复合物、蛋白质、肽、受体结合结构域、核酸、小分子和化学剂。
14.在一些实施方案中,细胞外配体结合结构域包括抗体或其抗原结合片段。在一些实施方案中,细胞外配体结合结构域包括f(ab)片段、f(ab')片段、单链可变片段(scfv)或单结构域抗体(sdab)。
15.在这些实施方案中的一些中,配体是肿瘤相关抗原。在这些实施方案中的一些中,配体不在肿瘤细胞上表达。在这些实施方案中的一些中,配体在非肿瘤细胞上表达。在这些实施方案中的一些中,配体在健康组织的细胞上表达。
16.在一些实施方案中,细胞外配体结合结构域包括二聚化结构域。在一些实施方案中,配体还包括同源二聚化结构域。
17.在一些实施方案中,配体是细胞表面配体。在一些实施方案中,细胞表面配体在进一步表达免疫受体的同源配体的细胞上表达。
18.在一些实施方案中,本公开的嵌合受体的膜定位结构域还包括细胞外结构域的至少一部分。在一些实施方案中,膜定位结构域还包括细胞内结构域的至少一部分。在一些实施方案中,膜定位结构域还包括细胞外结构域的至少一部分和细胞内结构域的至少一部分。
19.在一些实施方案中,膜定位结构域包括选自由以下组成的组的跨膜结构域:lax跨膜结构域、cd25跨膜结构域、cd7跨膜结构域、lat跨膜结构域、来自lat突变体的跨膜结构域、btla跨膜结构域、cd8跨膜结构域、cd28跨膜结构域、cd3ζ跨膜结构域、cd4跨膜结构域、4-ibb跨膜结构域、ox40跨膜结构域、icos跨膜结构域、2b4跨膜结构域、pd-1跨膜结构域、ctla4跨膜结构域、btla跨膜结构域、tim3跨膜结构域、lir1跨膜结构域、nkg2a跨膜结构域、tigit跨膜结构域和lag3跨膜结构域、lair1跨膜结构域、grb-2跨膜结构域、dok-1跨膜结构域、dok-2跨膜结构域、slap1跨膜结构域、slap2跨膜结构域、cd200r跨膜结构域、sirpα跨膜结构域、havr跨膜结构域、gitr跨膜结构域、pd-l1跨膜结构域、kir2dl1跨膜结构域、kir2dl2跨膜结构域、kir2dl3跨膜结构域、kir3dl1跨膜结构域、kir3dl2跨膜结构域、cd94跨膜结构域、klrg-1跨膜结构域、pag跨膜结构域、cd45跨膜结构域和ceacam1跨膜结构域。在一些实施方案中,膜定位结构域还包括对应的细胞外结构域的至少一部分和/或对应的细胞内结构域的至少一部分。在一些实施方案中,lat突变体是lat(ca)突变体。
20.在一些实施方案中,膜定位结构域将嵌合抑制性受体引导和/或分离至细胞膜的结构域。在一些实施方案中,膜定位结构域将嵌合抑制性受体定位至脂筏或重脂筏。在一些实施方案中,膜定位结构域与定位在细胞膜的结构域中的一种或多种细胞膜组分相互作用。在一些实施方案中,膜定位结构域足以在不存在结合同源配体的细胞外配体结合结构域的情况下减轻由酶抑制性结构域对免疫受体活化的组成型抑制。
21.在一些实施方案中,膜定位结构域介导嵌合抑制性受体定位至细胞膜的结构域,所述细胞膜的结构域不同于在不存在结合同源配体的细胞外配体结合结构域的情况下由
免疫受体的一种或多种组分占据的细胞膜的结构域。
22.在一些实施方案中,膜定位结构域还包括近端蛋白片段。在一些实施方案中,膜定位结构域还包括一个或多个细胞内抑制性共信号传导结构域。在一些实施方案中,嵌合蛋白的一个或多个细胞内抑制性共信号传导结构域包括一个或多个含itim的蛋白或其片段。在一些实施方案中,一个或多个含itim的蛋白或其片段选自pd-1、ctla4、tigit、btla和lair1。在一些实施方案中,一个或多个细胞内抑制性共信号传导结构域包括一个或多个非itim支架蛋白或其片段。在一些实施方案中,一个或多个非itim支架蛋白或其片段选自grb-2、dok-1、dok-2、slap1、slap2、lag3、havr、gitr和pd-l1。
23.在一些实施方案中,本公开的嵌合抑制性受体的细胞外配体结合结构域通过细胞外接头区连接至膜定位结构域。
24.在一些实施方案中,细胞外接头区位于细胞外配体结合结构域与膜定位结构域之间,并且可操作地和/或物理上连接至细胞外配体结合结构域和膜定位结构域中的每一个。在一些实施方案中,细胞外接头区源自选自由以下组成的组的蛋白质:cd8α、cd4、cd7、cd28、igg1、igg4、fcγriiiα、lngfr和pdgfr。在一些实施方案中,细胞外接头区包含选自由以下组成的组的氨基酸序列:aaaievmypppyldneksngtiihvkgkhlcpsplfpgpskp(seq id no:46)、eskygppcpscp(seq id no:47)、eskygppapsap(seq id no:48)、eskygppcppcp(seq id no:49)、epkscdkthtcp(seq id no:50)、aaafvpvflpakptttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlycnhrn(seq id no:51)、tttpaprpptpaptialqplslrpeacrpaaggavhtrgldfacd(seq id no:52)、acptglythsgecckacnlgegvaqpcganqtvcepcldsvtfsdvvsatepckpctecvglqsmsapcveaddavcrcaygyyqdettgrceacrvceagsglvfscqdkqntvceecpdgtysdeadaec(seq id no:53)、acptglythsgecckacnlgegvaqpcganqtvc(seq id no:54)和avgqdtqevivvphslpfkv(seq id no:55)。在一些实施方案中,细胞外接头区包含选自由以下组成的组的氨基酸序列:ggs(seq id no:29)、ggsggs(seq id no:30)、ggsggsggs(seq id no:31)、ggsggsggsggs(seq id no:32)、ggsggsggsggsggs(seq id no:33)、gggs(seq id no:34)、gggsgggs(seq id no:35)、gggsgggsgggs(seq id no:36)、gggsgggsgggsgggs(seq id no:37)、gggsgggsgggsgggsgggs(seq id no:38)、ggggs(seq id no:39)、ggggsggggs(seq id no:40)、ggggsggggsggggs(seq id no:41)、ggggsggggsggggsggggs(seq id no:42)、ggggsggggsggggsggggsggggs(seq id no:43)、gstsgsgkpgsgegstkg(seq id no:44)和eaaakeaaakeaaakeaaak(seq id no:45)。
25.在一些实施方案中,嵌合抑制性受体还包含位于膜定位结构域与酶抑制性结构域之间并且可操作地和/或物理上连接至膜定位结构域和酶抑制性结构域中的每一个的细胞内间隔区。在一些实施方案中,细胞内间隔区包含选自由以下组成的组的氨基酸序列:ggs(seq id no:29)、ggsggs(seq id no:30)、ggsggsggs(seq id no:31)、ggsggsggsggs(seq id no:32)、ggsggsggsggsggs(seq id no:33)、gggs(seq id no:34)、gggsgggs(seq id no:35)、gggsgggsgggs(seq id no:36)、gggsgggsgggsgggs(seq id no:37)、gggsgggsgggsgggsgggs(seq id no:38)、ggggs(seq id no:39)、ggggsggggs(seq id no:40)、ggggsggggsggggs(seq id no:41)、ggggsggggsggggsggggs(seq id no:42)、ggggsggggsggggsggggsggggs(seq id no:43)、gstsgsgkpgsgegstkg(seq id no:44)和eaaakeaaakeaaakeaaak(seq id no:45)。在一些实施方案中,细胞内间隔区包含选自由以
下组成的组的氨基酸序列:aaaievmypppyldneksngtiihvkgkhlcpsplfpgpskp(seq id no:46)、eskygppcpscp(seq id no:47)、eskygppapsap(seq id no:48)、eskygppcppcp(seq id no:49)、epkscdkthtcp(seq id no:50)、aaafvpvflpakptttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlycnhrn(seq id no:51)、tttpaprpptpaptialqplslrpeacrpaaggavhtrgldfacd(seq id no:52)、acptglythsgecckacnlgegvaqpcganqtvcepcldsvtfsdvvsatepckpctecvglqsmsapcveaddavcrcaygyyqdettgrceacrvceagsglvfscqdkqntvceecpdgtysdeadaec(seq id no:53)、acptglythsgecckacnlgegvaqpcganqtvc(seq id no:54)和avgqdtqevivvphslpfkv(seq id no:55)。
26.在一些实施方案中,本公开的嵌合抑制性受体的酶抑制性结构域包括细胞外结构域、跨膜结构域和/或细胞内结构域的至少一部分。在一些实施方案中,酶抑制性结构域包括酶催化结构域。
27.在一些实施方案中,酶抑制性结构域包括酶的至少一部分。在一些实施方案中,酶的部分包括酶结构域或酶片段。在一些实施方案中,酶的部分是酶的催化结构域。
28.在一些实施方案中,酶选自由以下组成的组:csk、shp-1、shp-2、pten、cd45、cd148、ptp-meg1、ptp-pest、c-cbl、cbl-b、ptpn22、lar、ptph1、ship-1、zap70和rasgap。
29.在一些实施方案中,酶抑制性结构域源自csk。在一些实施方案中,酶抑制性结构域包含具有src同源物3(sh3)缺失的csk蛋白。
30.在一些实施方案中,酶抑制性结构域源自shp-1。在一些实施方案中,酶抑制性结构域包含蛋白酪氨酸磷酸酶(ptp)结构域。
31.在一些实施方案中,酶抑制性结构域源自shp-2。
32.在一些实施方案中,酶抑制性结构域源自pten。
33.在一些实施方案中,酶抑制性结构域源自cd45。
34.在一些实施方案中,酶抑制性结构域源自cd148。
35.在一些实施方案中,酶抑制性结构域源自ptp-meg1。
36.在一些实施方案中,酶抑制性结构域源自ptp-pest。
37.在一些实施方案中,酶抑制性结构域源自c-cbl。
38.在一些实施方案中,酶抑制性结构域源自cbl-b。
39.在一些实施方案中,酶抑制性结构域源自ptpn22。
40.在一些实施方案中,酶抑制性结构域源自lar。
41.在一些实施方案中,酶抑制性结构域源自ptph1。
42.在一些实施方案中,酶抑制性结构域源自ship-1。在一些实施方案中,酶抑制性结构域包含蛋白酪氨酸磷酸酶(ptp)结构域。
43.在一些实施方案中,酶抑制性结构域源自zap70。在一些实施方案中,酶抑制性结构域包含src同源物1(sh1)结构域、src同源物2(sh2)结构域或sh1结构域和sh2结构域。在一些实施方案中,酶抑制性结构域包含具有激酶结构域缺失的zap70蛋白。在一些实施方案中,其中酶抑制性结构域包含具有tyr492phe氨基酸取代、tyr493phe氨基酸取代或tyr492phe氨基酸取代和tyr493phe氨基酸取代的突变zap70蛋白。
44.在一些实施方案中,酶抑制性结构域源自rasgap。
45.在一些实施方案中,酶抑制性结构域包括调节基底抑制的一个或多个修饰。在一
些实施方案中,一个或多个修饰降低基底抑制。在其他实施方案中,一个或多个修饰增加基底抑制。
46.在一些实施方案中,在嵌合抑制性受体靠近免疫受体募集时,酶抑制性结构域抑制免疫受体活化。
47.在一些实施方案中,免疫受体是嵌合免疫受体。在一些实施方案中,免疫受体是嵌合抗原受体。在一些实施方案中,免疫受体是天然存在的免疫受体。在一些实施方案中,免疫受体是天然存在的抗原受体。
48.在一些实施方案中,免疫受体选自t细胞受体、模式识别受体(prr)、nod样受体(nlr)、toll样受体(tlr)、杀伤活化受体(kar)、杀伤抑制剂受体(kir)、补体受体、fc受体、b细胞受体和细胞因子受体。
49.在一些实施方案中,免疫受体是t细胞受体。
50.在一些实施方案中,本公开的基因工程化的细胞还包括至少一种免疫受体。在一些实施方案中,至少一种免疫受体是嵌合免疫受体。在一些实施方案中,至少一种免疫受体是嵌合抗原受体。在一些实施方案中,至少一种免疫受体是天然存在的免疫受体。在一些实施方案中,至少一种免疫受体是天然存在的抗原受体。在一些实施方案中,至少一种免疫受体选自t细胞受体、模式识别受体(prr)、nod样受体(nlr)、toll样受体(tlr)、杀伤活化受体(kar)、杀伤抑制剂受体(kir)、补体受体、fc受体、b细胞受体和细胞因子受体。
51.在一些实施方案中,本公开的嵌合抑制性受体在靠近免疫受体时在配体结合时抑制免疫受体活化。
52.在一些实施方案中,配体是细胞表面配体。在一些实施方案中,细胞表面配体在进一步表达同源免疫受体配体的细胞上表达。在一些实施方案中,与嵌合抑制性受体结合的配体和与免疫受体结合的同源免疫受体配体将嵌合抑制性受体靠近免疫受体定位。在一些实施方案中,嵌合抑制性受体靠近免疫受体的定位抑制免疫受体活化。
53.在一些实施方案中,细胞是t细胞。在一些实施方案中,免疫受体是t细胞受体。在一些实施方案中,免疫受体活化是t细胞活化。
54.在一些实施方案中,本公开的基因工程化的细胞是免疫调节细胞。在一些实施方案中,免疫调节细胞选自由以下组成的组:t细胞、cd8 t细胞、cd4 t细胞、γ-δt细胞、细胞毒性t淋巴细胞(ctl)、调控性t细胞、病毒特异性t细胞、天然杀伤t(nkt)细胞、天然杀伤(nk)细胞、b细胞、肿瘤浸润性淋巴细胞(til)、先天淋巴细胞、肥大细胞、嗜酸性粒细胞、嗜碱性粒细胞、嗜中性粒细胞、髓样细胞、巨噬细胞、单核细胞、树突细胞、esc源性细胞和ipsc源性细胞。
55.在一些实施方案中,细胞是自体的。在一些实施方案中,细胞是同种异体的。
56.本文还提供了抑制免疫受体活化的方法。方法包括:在适合嵌合抑制性受体结合同源配体的条件下接触本文公开的基因工程化的细胞或药物组合物,其中,当靠近工程化的细胞的细胞膜上表达的免疫受体定位时,嵌合抑制性抑制免疫受体活化。
57.本文还提供了用于降低免疫反应的方法。方法包括:向需要这种治疗的受试者施用本文公开的基因工程化的细胞或药物组合物。
58.本文还提供了用于防止、减弱或抑制由在免疫调节细胞的表面上表达的靶向肿瘤的嵌合受体诱导的细胞介导的免疫反应的方法。方法包括:向需要这种治疗的受试者施用
本文公开的基因工程化的细胞或药物组合物。
59.本文还提供了用于防止、减弱或抑制由在免疫调节细胞的表面上表达的靶向肿瘤的嵌合受体诱导的细胞介导的免疫反应的方法。方法包括:在适合嵌合抑制性受体结合同源配体的条件下,使本文公开的基因工程化的细胞或药物组合物与嵌合抑制性受体的同源配体接触,其中,在配体与嵌合抑制性受体结合时,酶抑制性结构域防止、减弱或抑制靶向肿瘤的嵌合受体的活化。
60.本文还提供了治疗自身免疫性疾病或可通过降低免疫反应治疗的疾病的方法。方法包括:向需要这种治疗的受试者施用本文公开的基因工程化的细胞或药物组合物。
61.这些和其他方面将在下面更详细地描述。
附图说明
62.以下附图形成本说明书的一部分,并且被包括在内以进一步证实本公开的某些方面,通过参考这些附图中的一个或多个并结合本文呈现的具体实施方案的详细描述,可以更好地理解本公开的某些方面。应当理解,附图中示出的数据决不限制本公开的范围。
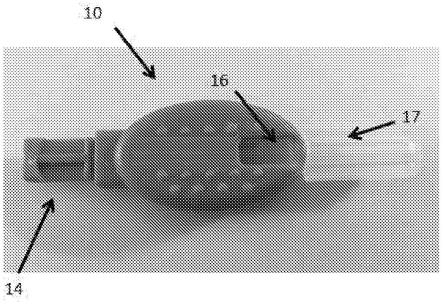
63.图1.描绘本公开的嵌合抑制性受体阻断t细胞活化的机制的示意图。
64.图2.描绘嵌合抑制性受体的某些实施方案的组成的示意图。elbd:细胞外配体结合结构域-实例包括但不限于scfv(例如,抗肿瘤抗原)、天然受体/配体结构域和正交二聚化结构域(例如,可以与可溶性靶向分子接合的亮氨酸拉链);mld:膜定位结构域(任选地包括参与定位至细胞膜的亚结构域(例如,脂筏)的近端细胞内区段和细胞外区段-实例包括但不限于lax、cd25、cd7的跨膜结构域(pavel ot
á
hal等,biochim biophys acta.2011年2月;1813(2):367-76)和lat的突变体(例如,lat(ca),参见例如kosugi a.等,involvement of shp-1tyrosine phosphatase in tcr-mediated signaling pathways in lipid rafts,immunity,2001年6月;14(6):669-80,其整体并入本文);eid:酶抑制性结构域(例如,抑制天然t细胞活化级联的酶,包含酶的结构域、片段或突变体,经选择以使功效最大化和使基底抑制最小化)-实例包括但不限于csk(pavel ot
á
hal等,biochim biophys acta.2011年2月;1813(2):367-76)、shp-1(参见例如kosugi a.等,involvement of shp-1tyrosine phosphatase in tcr-mediated signaling pathways in lipid rafts,immunity,2001年6月;14(6):669-80)、pten、cd45、cd148、ptp-meg1、ptp-pest、c-cbl、cbl-b、lyp/pep/ptpn22、lar、ptph1、ship-1、rasgap(参见例如,stanford等,regulation of tcr signaling by tyrosine phosphatases:from immune homeostasis to autoimmunity,immunology,2012年9月;137(1):1-19,其整体并入本文)。
65.图3.描绘嵌合抑制性受体(例如,“延伸的”嵌合抑制性受体)的某些实施方案的组成的示意图。elbd、mld和eid如对于图2所描述。sid:支架抑制性结构域-实例包括但不限于含itim的蛋白结构域(例如,pd-1、ctla4、tigit、btla和/或lair1的胞质尾区)或其一个或多个片段)和抑制t细胞活化的非itim支架蛋白结构域或其一个或多个片段,包括grb-2、dok-1、dok-2、slap、lag3、havr、gitr和pd-l1。
66.图4.示出非门acar/icar体系的示意图。t细胞经工程改造以表达包括csk结构域作为eid结构域的抗cd19 icar,以抑制包括cd28-cd3ζ细胞内信号传导结构域的共表达的acar的信号传导。k562靶细胞经工程改造以表达acar的同源抗原(cd20)或者经工程改造以
表达acar的同源抗原(cd20)和icar的同源抗原(cd19)两者。
67.图5.证实在转导cd4 t细胞和cd8 t细胞后在没有随后富集的情况下,icar构建体抗cd19_scfv-csk融合物在未修饰细胞上以可检测水平的表达的代表性流式细胞术图。
68.图6.如通过流式细胞术对于acar构建体和icar构建体所评估的表达谱。显示的是:acar =表达acar的细胞(有和没有icar)[第一个柱];icar =表达icar的细胞(有和没有acar)[第二个柱];且双重 =表达acar和icar两者的细胞[第三个柱]。
[0069]
图7.如通过杀伤效率所评估的acar信号传导的icar抑制的功效,表示为杀伤cd19/cd20靶细胞与仅杀伤cd20靶细胞的比率。显示的是:仅用acar构建体转导(左侧柱);用具有csk酶抑制性结构域的icar (icar31)和acar共转导t细胞(中间柱);和用具有包含sh3缺失的csk酶抑制性结构域的icar(icar26)和acar共转导t细胞(右侧柱)。
具体实施方式
[0070]
定义
[0071]
除非另有说明,否则权利要求和说明书中使用的术语如以下定义。
[0072]
如本文所用的术语“嵌合抑制性受体”或“抑制性嵌合抗原受体”或“抑制性嵌合受体”是指当在细胞如免疫效应细胞中表达时,为细胞提供对靶细胞的特异性和负调控细胞内信号转导的能力的多肽或一组多肽。嵌合抑制性受体也可以被称为“icar。”[0073]
术语“靶向肿瘤的嵌合受体”或“活化嵌合受体”是指活化嵌合受体、靶向肿瘤的嵌合抗原受体(car)或工程化的t细胞受体,其具有能够诱导在表达活化嵌合受体的细胞中的信号转导或蛋白质表达变化从而导致免疫反应的起始的结构。靶向肿瘤的嵌合受体也可以被称为“acar。
[0074]
如本文所用的术语“跨膜结构域”是指跨越细胞膜的结构域。在一些实施方案中,跨膜结构域包含疏水性α螺旋。
[0075]
术语“肿瘤”是指肿瘤细胞和相关的肿瘤微环境(tme)。在一些实施方案中,肿瘤是指肿瘤细胞或肿瘤块。在一些实施方案中,肿瘤是指肿瘤微环境。
[0076]
术语“未表达”是指比将导致靶向肿瘤的嵌合抗原受体活化的非肿瘤细胞中的表达水平低至少2倍的表达。在一些实施方案中,表达比将导致靶向肿瘤的嵌合抗原受体活化的非肿瘤细胞中的表达水平低至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、或至少10倍或更多倍。
[0077]
术语“改善”是指治疗疾病状态例如癌症疾病状态的任何治疗有益结果,包括预防、减轻其严重性或进展、缓解或治愈。
[0078]
术语“原位”是指在与活生物体分开生长例如在组织培养物中生长的活细胞中发生的过程。
[0079]
术语“体内”是指在活生物体中发生的过程。
[0080]
如本文所用的术语“哺乳动物”包括人和非人两者,并且包括但不限于人、非人灵长类、犬、猫、鼠、牛、马和猪。
[0081]
在两个或更多个核酸或多肽序列的上下文中,术语百分比“同一性”是指,如使用下文所述的序列比较算法(例如,blastp和blastn或技术人员可用的其他算法)之一或通过视觉检查所测量,在对于最大对应性进行比较和比对时两个或更多个序列或子序列具有特
定百分比的相同的核苷酸或氨基酸残基。取决于应用,百分比“同一性”可以存在于被比较的序列的区域上,例如在功能结构域上,或者替代性地,存在于待比较的两个序列的全长上。
[0082]
对于序列比较,通常一个序列充当与测试序列进行比较的参考序列。当使用序列比较算法时,将测试序列和参考序列输入计算机中,必要时指定子序列坐标,并指定序列算法程序参数。序列比较算法随后基于指定的程序参数计算一个或多个测试序列相对于参考序列的百分比序列同一性。
[0083]
用于比较的序列的最佳比对可以例如通过以下方法进行:smith和waterman,adv.appl.math.2:482(1981)的局部同源性算法,needleman和wunsch,j.mol.biol.48:443(1970)的同源性比对算法,pearson和lipman,proc.nat'l.acad.sci.usa 85:2444(1988)的相似性搜索方法,通过这些算法(在wisconsin genetics软件包,genetics computer group,575science dr.,madison,wis.中的gap、bestfit、fasta和tfasta)的计算机化实施,或视觉检查(通常参见ausubel等,见下文)。
[0084]
适合确定百分比序列同一性和序列相似性的算法的一个实例是blast算法,其在altschul等,j.mol.biol.215:403-410(1990)中描述。用于进行blast分析的软件可通过国家生物技术信息中心研究中心(national center for biotechnology information)(www.ncbi.nlm.nih.gov/)公开获得。
[0085]
术语“足够量”意指足以产生所需效果的量,例如足以调节细胞中蛋白质聚集的量。
[0086]
术语“治疗有效量”是有效改善疾病症状的量。治疗有效量可以是“预防有效量”,因为预防可以被认为是治疗。
[0087]
应当注意,除非上下文另外明确规定,否则如本说明书和所附权利要求中所使用,单数形式“一个/种”和“所述”包括复数个/种指示物。
[0088]
嵌合抑制性受体
[0089]
本文提供了嵌合抑制性受体,其尤其可用作用于控制免疫细胞活性的非逻辑门。嵌合抑制性受体包括细胞外配体结合结构域、包含跨膜结构域的膜定位结构域;和酶抑制性结构域。在一些实施方案中,在本公开的嵌合抑制性受体靠近免疫受体募集时,酶抑制性结构域抑制免疫受体活化。不希望受理论的束缚,嵌合抑制性受体与其同源配体之间的结合通常介导酶抑制性结构域靠近免疫受体和/或下游信号传导复合物的空间募集,使得酶抑制性结构域能够负调控细胞内信号转导级联。近端可以包括物理上相互作用的两个分子(例如,蛋白质或蛋白质结构域)。近端可以包括物理上足够靠近以可操作地彼此相互作用的两个分子。近端可以包括与共享的中间分子例如支架蛋白物理上或可操作地相互作用的两个分子。近端可以包括与共享的复合物例如信号传导级联物理上或可操作地相互作用的两个分子。近端可以包括物理上相互作用一段持续的时间以可操作地彼此相互作用的两个分子。近端可以包括物理上足够靠近一段持续的时间以可操作地彼此相互作用的两个分子。近端可以包括与共享的中间分子例如支架蛋白物理上或可操作地相互作用一段持续的时间的两个分子。近端可以包括与共享的复合物例如信号传导级联物理上或可操作地相互作用一段持续的时间的两个分子。介导可操作的相互作用的持续时间通常是指比随机相互作用更久的相互作用,并且可以包括持续的物理靠近,例如持续的配体介导的定位至细胞
膜的不同结构域(例如,免疫突触)。靠近免疫受体可以包括定位至允许直接抑制免疫受体的信号传导活性的细胞环境。靠近免疫受体可以包括定位至允许抑制由免疫受体介导的细胞内信号转导级联的细胞环境。因此,可以将所公开的嵌合抑制性受体工程改造以含有适当的细胞外配体结合结构域,细胞外配体结合结构域在存在同源配体的情况下将降低细胞内信号传导,如免疫反应。在一些实施方案中,配体定位在细胞表面上。在一些实施方案中,配体是不在细胞表面上的剂,诸如小分子,分泌因子,环境信号或介导酶抑制性结构域靠近免疫受体的空间募集的其他可溶性和/或分泌剂,诸如交联试剂,介导蛋白结构域的异二聚化的小分子,或抗体,它们各自可以介导酶抑制性结构域靠近免疫受体的空间募集。嵌合抑制性受体的用途包括但不限于降低免疫反应、控制t细胞活化、控制car-t反应和治疗自身免疫性疾病或可通过降低免疫反应治疗的任何疾病。
[0090]
在一些方面,本文提供了嵌合抑制性受体,其包含:细胞外配体结合结构域;膜定位结构域,其中膜定位结构域包含跨膜结构域;和酶抑制性结构域,其中酶抑制性结构域在靠近免疫受体时抑制免疫受体活化。
[0091]
酶抑制性结构域
[0092]
如本文所用,术语“酶抑制性结构域”是指具有抑制细胞内信号转导级联例如天然t细胞活化级联的酶功能的蛋白质结构域。例如,酶抑制性结构域可以是酶或酶的催化结构域,其酶活性介导细胞内信号转导的负调控。能够负调控细胞内信号转导的酶和酶功能的非限制性实例包括(1)其酶磷酸化活性介导细胞内信号转导的负调控的激酶或激酶结构域,(2)其酶磷酸酶活性介导细胞内信号转导的负调控的磷酸酶或磷酸酶结构域,和/或(3)其酶泛素化活性介导细胞内信号转导的负调控的泛素连接酶。信号传导的酶调控(例如,抑制细胞内信号转导级联)更详细地描述在pavel ot
á
hal等(biochim biophys acta.2011年2月;1813(2):367-76);kosugi a.等(involvement of shp-1 tyro sine phosphatase in tcr-mediated signaling pathways in lipid rafts,immunity,2001年6月;14(6):669-80);以及stanford等(regulatio n of tcr signaling by tyrosine phosphatases:from immune homeos tasis to autoimmunity,immunology,2012年9月;137(1):1-19)中,其各自出于所有目的以引用的方式并入本文。
[0093]
在一些实施方案中,本公开的嵌合抑制性受体的酶抑制性结构域包含细胞外结构域、跨膜结构域和/或细胞内结构域的至少一部分。在一些实施方案中,酶抑制性结构域包含酶的至少一部分,诸如酶的生物活性部分。在一些实施方案中,酶的部分包含一个或多个酶结构域、一个或多个酶片段或其一个或多个突变体,诸如激酶结构域或磷酸酶结构域及其突变体。在一些实施方案中,酶的部分是酶的催化结构域,诸如酶的具有激酶或磷酸酶催化活性的部分。在一些实施方案中,选择一个或多个酶结构域、一个或多个酶片段或其一个或多个突变体以使功效最大化和使基底抑制最小化。
[0094]
在一些实施方案中,酶抑制性结构域包含调节基底抑制的一个或多个修饰。修饰的实例包括但不限于一个或多个截短突变、一个或多个氨基酸取代、翻译后修饰位置的引入(其实例是本领域技术人员已知的)和新官能团的添加。在一些实施方案中,选择一个或多个酶结构域、一个或多个酶片段或其一个或多个突变体以使功效最大化和使基底抑制最小化。在一些实施方案中,一个或多个修饰降低基底抑制。在其他实施方案中,一个或多个修饰增加基底抑制。在一个非限制性说明性实例中,并且不希望受理论的束缚,sh3结构域
的缺失(例如,在csk酶中)可以使组成型聚集/信号传导最少化(即,在不存在配体结合的情况下),由此降低嵌合抑制性受体的基底水平酶抑制性活性。
[0095]
在一些实施方案中,嵌合抑制性受体与其同源配体之间的配体结合可以介导嵌合抑制性受体定位至细胞环境,其中酶抑制性结构域靠近细胞内信号传导结构域或免疫受体,从而允许直接抑制免疫受体的信号传导活性。在一个非限制性说明性实例中,在t细胞上表达的嵌合抑制性受体与其同源配体之间的结合可以引起酶抑制性结构域靠近tcr或car细胞内信号传导结构域的定位(例如,定位至免疫突触),使得酶抑制性结构域能够负调控t细胞信号传导和/或活化。在一些实施方案中,嵌合抑制性受体与其同源配体之间的配体结合可以介导嵌合抑制性受体定位至细胞环境,其中酶抑制性结构域靠近免疫受体,从而允许抑制由免疫受体介导的细胞内信号转导级联。在一些实施方案中,嵌合抑制性受体与其同源配体之间的配体结合可以介导多个嵌合抑制性受体的空间聚集以靠近免疫受体,使得酶抑制性结构域的聚集促进它们对免疫受体的抑制活性。
[0096]
在一些实施方案中,酶选自csk、shp-1、shp-2、pten、cd45、cd148、ptp-meg1、ptp-pest、c-cbl、cbl-b、ptpn22、lar、ptph1、ship-1、zap70和rasgap。
[0097]
在一些实施方案中,酶抑制性结构域具有src同源物3(sh3)结构域。在一些实施方案中,酶抑制性结构域源自具有src同源物3(sh3)缺失的蛋白质。在一些实施方案中,酶抑制性结构域具有蛋白酪氨酸磷酸酶(ptp)结构域。在一些实施方案中,酶抑制性结构域包括src同源物1(sh1)结构域、src同源物2(sh2)结构域或sh1结构域和sh2结构域。
[0098]
在一些实施方案中,酶抑制性结构域源自具有降低激酶活性的一个或多个激酶结构域缺失或突变的蛋白质。在一些实施方案中,酶抑制性结构域源自具有降低产生显性负性突变体的激酶活性的一个或多个激酶结构域缺失或突变的蛋白质。在一个非限制性说明性实例中,并且不希望受理论的束缚,包含具有激酶结构域的缺失或突变的酶抑制性结构域(例如,在zap70酶中)的嵌合抑制性受体可以作为显性负性激酶活性丧失蛋白,并通过与对应的天然野生型蛋白竞争而降低或消除细胞内信号传导级联,对应的天然野生型蛋白是酶抑制性结构域的来源。
[0099]
在一些实施方案中,酶抑制性结构域源自csk。在一些实施方案中,源自csk的酶抑制性结构域是具有src同源物3(sh3)缺失的csk蛋白。
[0100]
在一些实施方案中,酶抑制性结构域源自shp-1。在一些实施方案中,源自shp-1的酶抑制性结构域具有酪氨酸磷酸酶(ptp)结构域。
[0101]
在一些实施方案中,酶抑制性结构域源自shp-2。在一些实施方案中,酶抑制性结构域源自pten。在一些实施方案中,酶抑制性结构域源自cd45。在一些实施方案中,酶抑制性结构域源自cd148。在一些实施方案中,酶抑制性结构域源自ptp-meg1。在一些实施方案中,酶抑制性结构域源自ptp-pest。在一些实施方案中,酶抑制性结构域源自c-cbl。在一些实施方案中,酶抑制性结构域源自cbl-b。在一些实施方案中,酶抑制性结构域源自ptpn22。在一些实施方案中,酶抑制性结构域源自lar。在一些实施方案中,酶抑制性结构域源自ptph1。
[0102]
在一些实施方案中,酶抑制性结构域源自ship-1。在一些实施方案中,酶抑制性结构域源自具有蛋白酪氨酸磷酸酶(ptp)结构域的ship-1。
[0103]
在一些实施方案中,酶抑制性结构域源自zap70。在一些实施方案中,源自zap70的
酶抑制性结构域具有src同源物1(sh1)结构域、src同源物2(sh2)结构域或sh1结构域和sh2结构域。在一些实施方案中,源自zap70的酶抑制性结构域具有激酶结构域缺失。在一些实施方案中,源自zap70的酶抑制性结构域具有tyr492phe氨基酸取代、tyr493phe氨基酸取代、或tyr492phe氨基酸取代和tyr493phe氨基酸取代。
[0104]
在一些实施方案中,酶抑制性结构域源自rasgap。
[0105]
酶抑制性结构域的示例性序列示于表1a和表1b中。在一些实施方案中,酶抑制性结构域是表1a中列出的任何氨基酸序列。在一些实施方案中,酶抑制性结构域具有与表1a中列出的任何氨基酸序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一的氨基酸序列。在一些实施方案中,酶抑制性结构域由与表1b中列出的任何核酸序列至少60%、至少65%、至少70%、至少75%、至少80%或至少85%同一的核酸序列编码。在一些实施方案中,酶抑制性结构域由与表1b中列出的任何核酸序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一的核酸序列编码。
[0106]
表1a-酶抑制性结构域氨基酸序列
[0107]
[0108]
[0109][0110]
表1b-酶抑制性结构域核酸序列
[0111]
[0112]
[0113]
[0114]
[0115]
[0116]
[0117]
[0118]
[0119][0120]
细胞外配体结合结构域
[0121]
如本文所用,术语“细胞外配体结合结构域”是指本公开的嵌合抑制性蛋白的与特
异性细胞外配体结合的结构域。配体结合结构域的实例是本领域技术人员已知的,并且包括但不限于单链可变片段(scfv)、天然受体/配体结构域和正交二聚化结构域,诸如与可溶性靶向分子接合的亮氨酸拉链。
[0122]
在一些实施方案中,细胞外配体结合结构域包含抗原结合结构域。本公开的抗原结合结构域可以包括与抗原结合的任何结构域,包括而不限于单克隆抗体、多克隆抗体、重组抗体、双特异性抗体、缀合抗体、人抗体、人源化抗体和其功能片段,包括但不限于单结构域抗体(sdab),诸如骆驼源性纳米抗体的重链可变结构域(vh)、轻链可变结构域(vl)和可变结构域(vhh),以及结合本领域已知的替代性支架起抗原结合结构域作用的任何结构域,诸如重组纤连蛋白结构域、t细胞受体(tcr)、具有增强的亲和力的重组tcr或其片段,例如单链tcr等。
[0123]
在一些实施方案中,细胞外配体结合结构域包含抗体或其抗原结合片段。在一些实施方案中,细胞外配体结合结构域包含f(ab)片段、f(ab')片段、单链可变片段(scfv)或单结构域抗体(sdab)。
[0124]
术语“单链”是指包含通过肽键线性连接的氨基酸单体的分子。在某些实施方案中,氨基酸单体通过肽接头线性连接,包括但不限于包含表2中所示的任何氨基酸序列。在一些实施方案中,肽接头包含选自由以下组成的组的氨基酸序列:ggs(seq id no:29)、ggsggs(seq id no:30)、ggsggsggs(seq id no:31)、ggsggsggsggs(seq id no:32)、ggsggsggsggsggs(seq id no:33)、gggs(seq id no:34)、gggsgggs(seq id no:35)、gggsgggsgggs(seq id no:36)、gggsgggsgggsgggs(seq id no:37)、gggsgggsgggsgggsgggs(seq id no:38)、ggggs(seq id no:39)、ggggsggggs(seq id no:40)、ggggsggggsggggs(seq id no:41)、ggggsggggsggggsggggs(seq id no:42)、ggggsggggsggggsggggsggggs(seq id no:43)、gstsgsgkpgsgegstkg(seq id no:44)和eaaakeaaakeaaakeaaak(seq id no:45)。
[0125]
表2-肽接头
[0126]
接头氨基酸序列seq id no:(g2s)1接头ggs29(g2s)2接头ggsggs30(g2s)3接头ggsggsggs31(g2s)4接头ggsggsggsggs32(g2s)5接头ggsggsggsggsggs33(g3s)1接头gggs34(g3s)2接头gggsgggs35(g3s)3接头gggsgggsgggs36(g3s)4接头gggsgggsgggsgggs37(g3s)5接头gggsgggsgggsgggsgggs38(g4s)1接头ggggs39(g4s)2接头ggggsggggs40(g4s)3接头ggggsggggsggggs41(g4s)4接头ggggsggggsggggsggggs42
(g4s)5接头ggggsggggsggggsggggsggggs43whitlow接头gstsgsgkpgsgegstkg44接头2eaaakeaaakeaaakeaaak45
[0127]“单链fv”或“sfv”或“scfv”包括抗体的vh结构域和vl结构域,其中这些结构域存在于单一多肽链中。在一个实施方案中,fv多肽还包含在vh结构域与vl结构域之间的多肽接头,其使得scfv能够形成抗原结合所需的结构。如本文更详细描述的,scfv具有通过多肽链从其c末端连接到重链可变结构域(vh)的n末端的轻链可变结构域(vl)。替代性地,scfv包含多肽链,其中vh的c末端通过多肽链连接至vl的n末端。在某些实施方案中,vh和vl被肽接头隔开。在某些实施方案中,scfv肽接头包含表2中所示的任何氨基酸序列。在某些实施方案中,scfv包含结构vh-l-vl或vl-l-vh,其中vh是重链可变结构域,l是肽接头,并且vl是轻链可变结构域。在一些实施方案中,一个或多个scfv中的每一个包含结构vh-l-vl或vl-l-vh,其中vh是重链可变结构域,l是肽接头,并且vl是轻链可变结构域。当存在连接在一起的两个或更多个scfv时,每个scfv可以用连接的肽连接至下一个scfv。在一些实施方案中,一个或多个scfv中的每一个通过肽接头隔开。
[0128]“fab片段”(也称为片段抗原结合)含有轻链的恒定结构域(cl)和重链的第一恒定结构域(ch1)以及分别在轻链和重链上的可变结构域vl和vh。可变结构域包含参与抗原结合的互补决定环(cdr,也称为高变区)。fab'片段与fab片段的区别在于在包含来自抗体铰链区的一个或多个半胱氨酸的重链ch1结构域的羧基末端添加几个残基。在一个特别的这样的实施方案中,在单链fab分子中,fab轻链的c末端连接至fab重链的n末端。
[0129]“f(ab’)2”片段含有两个在铰链区附近通过二硫键连接的fab’片段。f(ab’)2片段可以例如通过重组方法或通过胃蛋白酶消化完整抗体而产生。f(ab’)片段可以例如通过用β-巯基乙醇处理而解离。
[0130]“fv”片段包含一个重链可变结构域和一个轻链可变结构域的非共价连接的二聚体。
[0131]
术语“单结构域抗体”或“sdab”是指一种分子,其中抗体的一个可变结构域与抗原特异性结合,而不存在另一个可变结构域。单结构域抗体及其片段描述在arabi ghahroudi等,febs letters,1998,414:521-526以及muyldermans等,trends in biochem.sci.,2001,26:230-245中,其各自以引用的方式以其整体并入。单结构域抗体也被称为sdab或纳米抗体。sdab是相当稳定的,并且易于作为与抗体fc链的融合配偶体表达(harmsen mm,de haard hj(2007)."properties,production,and applications of camelid single-domain antibody fragments".appl.microbiol biotechnol.77(1):13-22)。
[0132]“抗体片段”包含完整抗体的一部分,诸如完整抗体的抗原结合区或可变区。抗体片段包括例如fv片段、fab片段、f(ab’)2片段、fab’片段、scfv(sfv)片段和scfv-fc片段。
[0133]
在一些实施方案中,细胞外配体结合结构域包含来自受体的结构域,其中受体选自由以下组成的组:tcr、bcr、细胞因子受体、rtk受体、丝氨酸/苏氨酸激酶受体、激素受体、免疫球蛋白超家族受体和tnfr超家族受体。
[0134]
在一些实施方案中,细胞外配体结合结构域还包含二聚化结构域。在一些实施方案中,配体结合结构域还包含同源二聚化结构域。
[0135]
如本文所用,术语“配体”是指一种分子,其与同源蛋白上的位点(即,同源蛋白的
配体结合结构域)如受体结合,由此产生细胞反应/信号、细胞-细胞识别和/或细胞-细胞相互作用。配体可以是例如一个或多个双原子(例如,no、co等)、小分子(例如,药物、药品、单糖、核苷酸、核苷酸衍生物、氨基酸、氨基酸衍生物、小分子激素、小分子神经递质等)和/或大分子(例如,脂质、多糖、肽、可溶性蛋白、细胞表面蛋白、细胞因子、趋化因子、激素、酶等)。在一些实施方案中,配体是天然存在的生物配体(即,配体天然产生,诸如由细胞天然产生)。在其他实施方案中,配体是非天然存在的或合成的配体(即,配体通过合成产生,诸如通过化学合成产生,或经工程改造以在一些方面不同于天然配体,如经工程改造以在通常不表达配体的细胞中表达)。在一些实施方案中,嵌合抑制性蛋白仅可以通过结合非天然存在的或合成的配体而被活化。合成配体的实例包括但不限于药物、药品和工程化的大分子(例如,合成蛋白质)。
[0136]
在一些实施方案中,嵌合受体的细胞外配体结合结构域与选自以下的配体结合:蛋白质复合物、蛋白质、肽、受体结合结构域、核酸、小分子和化学剂。在一些实施方案中,配体是细胞因子、趋化因子、激素或酶。
[0137]
在一些实施方案中,配体是细胞表面配体。例如,嵌合抑制性受体的配体在非靶细胞表面上存在或表达。细胞表面配体包括但不限于细胞表面标记物,诸如细胞分化(cd)标记物、受体、蛋白质、蛋白质复合物、细胞膜组分(例如,膜内在蛋白、细胞骨架结构、多糖、脂质及其组合)和与膜相关结构结合的分子(例如,与一种或多种细胞表面配体结合的可溶性抗体)。在一些实施方案中,细胞表面配体在进一步表达免疫受体的同源配体的细胞上表达。在一些实施方案中,嵌合抑制性受体的配体是肿瘤相关抗原。在一些实施方案中,嵌合抑制性受体的配体不在肿瘤细胞上表达。在一些实施方案中,嵌合抑制性受体的配体在非肿瘤细胞上表达。在一些实施方案中,嵌合抑制性受体的配体在健康组织或通常被认为是健康的组织的细胞上表达。
[0138]
在一个说明性实例中,嵌合抑制性受体可用作控制细胞活性如免疫细胞活性的非逻辑门。活化嵌合受体与嵌合抑制性受体(如本文所述的那些)的组合可以用于相同的细胞中以降低靶上脱靶毒性。例如,如果非靶细胞表达由活化嵌合受体识别的配体和由嵌合抑制性受体识别的配体两者,则表达活化嵌合受体的工程化的细胞可以与非靶细胞结合并导致脱靶信号传导反应。然而,在这种情况下,相同的工程化的细胞也表达嵌合抑制性受体,嵌合抑制性受体可以结合其在非靶细胞上的同源配体,并且嵌合抑制性受体的抑制功能可以降低、减少、防止或抑制由活化嵌合受体介导的信号传导(“非逻辑门控”)。
[0139]
在一些实施方案中,本公开的嵌合抑制性受体与在正常细胞(例如,通常被认为是健康的细胞)上表达但不在肿瘤细胞上表达的一种或多种配体特异性结合。在一个说明性非限制性实例中,靶向肿瘤的活化嵌合受体和嵌合抑制性受体的组合可以用于相同的免疫反应细胞中以降低靶上肿瘤外毒性。例如,如果健康细胞表达由靶向肿瘤的嵌合受体识别的肿瘤相关抗原和由嵌合抑制性受体识别的与健康细胞相关的抗原两者,则表达一种或多种靶向肿瘤的嵌合受体的工程化的免疫反应细胞可以与健康细胞结合并导致肿瘤外细胞反应。在这种情况下,相同的工程化的免疫反应细胞还表达抑制性嵌合抗原,抑制性嵌合抗原可以结合其在健康细胞上的同源配体,并且嵌合抑制性受体的抑制功能可以降低、减少、防止或抑制由靶向肿瘤的嵌合受体介导的免疫反应细胞的活化。
[0140]
如本文所用,术语“免疫受体”是指与配体结合并引起免疫系统反应的受体。与配
1多肽。可以使用任何合适的pd-1多肽。示例性pd-1多肽包括而不限于ncbi参考号np_005009和np_032824。在一些实施方案中,跨膜结构域源自lag-3多肽。可以使用任何合适的lag-3多肽。示例性lag-3多肽包括而不限于ncbi参考号np_002277.4和np_032505.1。在一些实施方案中,跨膜结构域源自2b4多肽。可以使用任何合适的2b4多肽。示例性2b4多肽包括而不限于ncbi参考号np_057466.1和np_061199.2。在一些实施方案中,跨膜结构域源自btla多肽。可以使用任何合适的btla多肽。示例性btla多肽包括而不限于ncbi参考号np_861445.4和np_001032808.2。可以使用任何合适的lir-1(lilrb1)多肽。示例性lir-1(lilrb1)多肽包括而不限于ncbi参考号np_001075106.2和np_001075107.2。
[0145]
在一些实施方案中,跨膜结构域包含含有与ncbi参考号np_001139345、aaa92533.1、np_006130.1、np_031668.3、np_932170.1、np_001106862.1、np_000607.1、np_038516.1、np_001552.2、np_001070977.1、np_003318.1、np_035789.1、np_036224、np_059508、np_005205.2、np_033973.2、np_005009、np_032824、np_002277.4、np_032505.1、np_057466.1、np_061199.2、np_861445.4或np_001032808.2的序列至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%同源的氨基酸序列的多肽或其片段。在一些实施方案中,同源性可以使用标准软件如blast或fasta来确定。在一些实施方案中,多肽可以包含一个保守氨基酸取代、多达两个保守氨基酸取代或多达三个保守氨基酸取代。在一些实施方案中,多肽可以具有作为ncbi参考号np_001139345、aaa92533.1、np_006130.1、np_031668.3、np_932170.1、np_001106862.1、np_000607.1、np_038516.1、np_001552.2、np_001070977.1、np_003318.1、np_035789.1、np_036224、np_059508、np_005205.2、np_033973.2、np_005009、np_032824、np_002277.4、np_032505.1、np_057466.1、np_061199.2、np_861445.4或np_001032808.2的连续部分的氨基酸序列,其长度为至少20、至少30、至少40、至少50、至少60、至少70、至少80、至少90、至少100、至少110、至少120、至少130、至少140、至少150、至少160、至少170、至少180、至少190、至少200、至少210、至少220、至少230或240个氨基酸。
[0146]
可以衍生出跨膜结构域的合适多肽的另外实例包括而不限于以下:t细胞受体的α、β或ζ链的一个或多个跨膜区、cd27、cd3ε、cd45、cd5、cd9、cd16、cd22、cd33、cd37、cd64、cd80、cd86、cd134、cd137、cd154、kirds2、cd2、cd27、lfa-1(cd11a、cd18)、gitr、cd40、baffr、hvem(lightr)、slamf7、nkp80(klrf1)、nkp44、nkp30、nkp46、cd160、cd19、il2rβ、il2rγ、il7rα、itga1、vla1、cd49a、itga4、ia4、cd49d、itga6、vla-6、cd49f、itgad、cd11d、itgae、cd103、itgal、cd11a、lfa-1、itgam、cd11b、itgax、cd11c、itgb1、cd29、itgb2、cd18、lfa-1、itgb7、tnfr2、dnam1(cd226)、slamf4(cd244、2b4)、cd84、cd96(触觉)、ceacam1、crtam、ly9(cd229)、cd160(by55)、psgl1、cd100(sema4d)、slamf6(ntb-a、ly108)、slam(slamf1、cd150、ipo-3)、blame(slamf8)、selplg(cd162)、ltbr、pag/cbp、nkg2d和ng2c。
[0147]
在一些实施方案中,源自lat突变体的跨膜结构域源自lat(ca)突变体。参见例如,kosugi a.等,involvement of shp-1tyrosine phosphatase in tcr-mediated signaling pathways in lipid rafts,immunity,2001年6月;14(6):669-80。
[0148]
在一些实施方案中,跨膜结构域选自表3中示出的氨基酸序列。在一些实施方案中,跨膜结构域包含多肽,多肽包含与表3中示出的任何序列至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%
或100%同源的氨基酸序列。在一些实施方案中,同源性可以使用标准软件如blast或fasta来确定。在一些实施方案中,多肽可以包含一个保守氨基酸取代、多达两个保守氨基酸取代或多达三个保守氨基酸取代。在一些实施方案中,跨膜结构域是与表3中列出的任何核酸序列至少60%、至少65%、至少70%、至少75%、至少80%或至少85%同一的核酸序列。在一些实施方案中,跨膜结构域是与表3中列出的任何核酸序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一的核酸序列。
[0149]
表3-跨膜结构域
[0150][0151]
在一些实施方案中,膜定位结构域还包含对应的细胞外结构域的至少一部分和/或对应的细胞内结构域的至少一部分(参见例如,源自本文所述的膜定位结构域的本文所述的间隔子或铰链)。
[0152]
在一些实施方案中,膜定位结构域还包含近端蛋白片段。近端蛋白片段是指在其天然环境中紧邻跨膜结构域的蛋白区段。例如,近端蛋白片段可以是落在蛋白质的跨膜结构域之外或落在被认为是蛋白质的跨膜结构域的序列的常规边界之外的蛋白区段。在一些实施方案中,近端蛋白片段可以是间隔子或铰链序列。在一些实施方案中,近端蛋白片段可以不同于间隔子或铰链序列。
[0153]
在一些实施方案中,膜定位结构域将嵌合抑制性受体引导或分离至细胞膜的结构域。如本文所用,术语“细胞膜的结构域”是指细胞膜中脂质组成和物理特性的横向不均匀性。细胞膜结构域形成可以由多种力驱动:氢键结合、疏水熵力、电荷配对和范德华力。细胞膜结构域可以经由膜内的蛋白质-蛋白质相互作用、膜内的蛋白质-脂质相互作用或膜内的脂质-脂质相互作用产生。细胞膜结构域的实例是本领域技术人员已知的,并且包括但不限于脂筏、重脂筏、轻脂筏、小窝、修补、支柱(post)、栅栏(fence)、格子(lattice)、筏和支架。参见例如,nicolson g.l.,the fluid-mosaic model of membrane structure:still relevant to understanding the structure,function and dynamics of biological membranes after more than 40years,biochim.biophys.acta.2014年6月;1838(6):1451-66。
[0154]
在一些实施方案中,膜定位结构域将本公开的嵌合抑制性受体定位至脂筏。在一些实施方案中,膜定位结构域与定位在细胞膜的结构域中的一种或多种细胞膜组分相互作用。细胞膜组分的实例是本领域技术人员已知的,并且包括但不限于各种膜内在蛋白、细胞骨架结构、多糖、脂质及其组合。参见例如,nicolson g.l.,the fluid-mosaic model of membrane structure:still relevant to understanding the str ucture,function and dynamics of biological membranes after more t han 40years,biochim.biophys.acta.2014年6月;1838(6):1451-66。
[0155]
在一些实施方案中,膜定位结构域介导嵌合抑制性受体基底定位(即,在不存在同源配体的情况下定位)至细胞膜的结构域,所述细胞膜的结构域的不同于被免疫受体的一种或多种组分占据的细胞膜的结构域,诸如不同于被免疫受体占据的脂筏的膜部分。在一些实施方案中,基底膜定位结构域足以减轻由酶抑制性结构域对免疫受体活化的组成型抑制。
[0156]
如本文所用,术语“免疫受体活化”是指起始信号传导级联的事件,信号传导级联最终导致免疫反应。t细胞活化是免疫受体活化的一个实例。通常,并且不希望受理论的束缚,尽管膜定位结构域可以减轻免疫受体的组成型抑制,但是嵌合抑制性受体与其同源配体之间的结合通常介导酶抑制性结构域靠近免疫受体和/或下游信号传导复合物的空间募集,使得酶抑制性结构域能够负调控细胞内信号转导级联。在一个非限制性说明性实例中,嵌合抑制性受体与其同源配体之间的结合可以将受体和酶抑制性结构域定位至免疫突触,并且抑制免疫受体信号传导和/或活化,诸如t细胞活化(例如,抑制免疫突触中存在的tcr,诸如与其同源配体结合的tcr),直接作用于免疫受体和/或作用于参与细胞内信号转导级联的另一种信号传导组分。
[0157]
在一些实施方案中,非特异性跨膜结构域将足以防止酶抑制性结构域组成型抑制t细胞活化。在其他实施方案中,可以选择介导定位至细胞膜的区域的跨膜结构域(包含近端蛋白片段),所述区域在物理上不同于被t细胞受体的组分占据的那些区域(例如,分离成“重”脂筏而不是“经典”脂筏;参见例如,stanford等,regulation of tcr signaling by tyrosine phosphatases:from immune homeostasis to autoimmunity,immunology,2012年9月;137(1):1-19),诸如细胞膜的除免疫突触以外的区域。
[0158]
间隔子和铰链结构域
[0159]
嵌合抑制性受体也可以含有间隔子或铰链结构域。在一些实施方案中,间隔子结
构域或铰链结构域位于嵌合抑制性受体的细胞外结构域(例如,包含细胞外配体结合结构域)与跨膜结构域之间,或位于嵌合抑制性受体的细胞内信号传导结构域与跨膜结构域之间。间隔子或铰链结构域是任何寡肽或多肽,其功能是将跨膜结构域连接至多肽链中的细胞外结构域和/或细胞内信号传导结构域。间隔子或铰链结构域可以为嵌合抑制性受体或其结构域提供柔性,或防止嵌合抑制性受体或其结构域的空间位阻。在一些实施方案中,间隔子结构域或铰链结构域可以包含多达300个氨基酸(例如,10至100个氨基酸,或5至20个氨基酸)。在一些实施方案中,一个或多个间隔子结构域可以包括在嵌合抑制性受体的其他区域中。在一些实施方案中,间隔子或铰链结构域包括来自与膜定位结构域相同的来源的细胞外结构域的至少一部分和/或细胞内结构域的至少一部分。
[0160]
示例性间隔子或铰链结构域蛋白序列示于表4中。示例性间隔子或铰链结构域核苷酸序列示于表5中。在一些实施方案中,间隔子或铰链结构域是与表4中列出的任何氨基酸序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一的氨基酸序列。在一些实施方案中,间隔子或铰链结构域是与表5中列出的任何核酸序列至少60%、至少65%、至少70%、至少75%、至少80%或至少85%同一的核酸序列。在一些实施方案中,间隔子或铰链结构域是与表5中列出的任何核酸序列至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%同一的核酸序列。
[0161]
表4-间隔子/铰链结构域氨基酸序列
[0162]
[0163][0164]
表5-间隔子/铰链结构域核酸序列
[0165]
[0166]
[0167][0168]
在一些实施方案中,嵌合抑制性受体还包含在细胞外配体结合结构域与膜定位结构域之间的间隔区,也称为细胞外接头。在一些实施方案中,细胞外接头区位于细胞外配体结合结构域与膜定位结构域之间,并且可操作地和/或物理上连接至细胞外配体结合结构域和膜定位结构域中的每一个。
[0169]
在一些实施方案中,嵌合抑制性受体还包含在膜定位结构域与酶抑制性结构域之间的间隔区,也称为细胞内间隔区。在一些实施方案中,嵌合抑制性受体还包含位于膜定位结构域与酶抑制性结构域之间并且可操作地和/或物理上连接至膜定位结构域和酶抑制性结构域中的每一个的细胞内间隔区。
[0170]
在一些实施方案中,细胞外接头区和/或细胞内间隔区源自选自由以下组成的组的蛋白质:cd8α、cd4、cd7、cd28、igg1、igg4、fcγriiiα、lngfr和pdgfr。在一些实施方案中,细胞外接头区和/或细胞内间隔区包含选自由以下组成的组的氨基酸序列:aaaievmypppyldneksngtiihvkgkhlcpsplfpgpskp(seq id no:46)、eskygppcpscp(seq id no:47)、eskygppapsap(seq id no:48)、eskygppcppcp(seq id no:49)、epkscdkthtcp(seq id no:50)、aaafvpvflpakptttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlycnhrn(seq id no:51)、tttpaprpptpaptialqplslrpeacrpaaggavhtrgldfacd(seq id no:52)、acptglythsgecckacnlgegvaqpcganqtvcepcldsvtfsdvvsatepckpctecvglqsmsapcveaddavcrcaygyyqdettgrceacrvceagsglvfscqdkqntvceecpdgtysdeadaec(seq id no:53)、acptglythsgecckacnlgegvaqpcganqtvc(seq id no:54)和avgqdtqevivvphslpfkv(seq id no:55)。
[0171]
在一些实施方案中,细胞外接头区和/或细胞内间隔区包含与seq id no:46至少约80%、至少约85%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或约100%同一的氨基酸序列。
[0172]
在一些实施方案中,细胞外接头区和/或细胞内间隔区包含与seq id no:47至少约80%、至少约85%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或约100%同一的氨基酸序列。
[0173]
在一些实施方案中,细胞外接头区和/或细胞内间隔区包含与seq id no:48至少约80%、至少约85%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或约100%同一的氨基酸序列。
[0174]
在一些实施方案中,细胞外接头区和/或细胞内间隔区包含与seq id no:49至少约80%、至少约85%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或约100%同一的氨基酸序列。
[0175]
在一些实施方案中,细胞外接头区和/或细胞内间隔区包含与seq id no:50至少约80%、至少约85%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或约100%同一的氨基酸序列。
[0176]
在一些实施方案中,细胞外接头区和/或细胞内间隔区包含与seq id no:51至少约80%、至少约85%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少
约95%、至少约96%、至少约97%、至少约98%、至少约99%或约100%同一的氨基酸序列。
[0177]
在一些实施方案中,细胞外接头区和/或细胞内间隔区包含与seq id no:52至少约80%、至少约85%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或约100%同一的氨基酸序列。
[0178]
在一些实施方案中,细胞外接头区和/或细胞内间隔区包含与seq id no:53至少约80%、至少约85%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或约100%同一的氨基酸序列。
[0179]
在一些实施方案中,细胞外接头区和/或细胞内间隔区包含与seq id no:54至少约80%、至少约85%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或约100%同一的氨基酸序列。
[0180]
在一些实施方案中,细胞外接头区和/或细胞内间隔区包含与seq id no:55至少约80%、至少约85%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或约100%同一的氨基酸序列。
[0181]
在一些实施方案中,细胞外接头区和/或细胞内间隔区包括肽接头,诸如表2中所示的任何氨基酸序列。在一些实施方案中,细胞外接头区和/或细胞内间隔区包括具有选自由以下组成的组的氨基酸序列的肽接头:ggs(seq id no:29)、ggsggs(seq id no:30)、ggsggsggs(seq id no:31)、ggsggsggsggs(seq id no:32)、ggsggsggsggsggs(seq id no:33)、gggs(seq id no:34)、gggsgggs(seq id no:35)、gggsgggsgggs(seq id no:36)、gggsgggsgggsgggs(seq id no:37)、gggsgggsgggsgggsgggs(seq id no:38)、ggggs(seq id no:39)、ggggsggggs(seq id no:40)、ggggsggggsggggs(seq id no:41)、ggggsggggsggggsggggs(seq id no:42)、ggggsggggsggggsggggsggggs(seq id no:43)、gstsgsgkpgsgegstkg(seq id no:44)和eaaakeaaakeaaakeaaak(seq id no:45)。
[0182]
在一些实施方案中,细胞外接头区和/或细胞内间隔区调节嵌合抑制性受体的敏感性。在一些实施方案中,相对于缺乏细胞外接头区和/或细胞内间隔区的其他方面相同的嵌合抑制性受体,细胞外接头区和/或细胞内间隔区增加嵌合抑制性受体的敏感性。在一些实施方案中,相对于缺乏细胞外接头区和/或细胞内间隔区的其他方面相同的嵌合抑制性受体,细胞外接头区和/或细胞内间隔区降低嵌合抑制性受体的敏感性。在一些实施方案中,相对于缺乏细胞外接头区和/或细胞内间隔区的其他方面相同的嵌合抑制性受体,细胞外接头区和/或细胞内间隔区调节嵌合抑制性受体的效力。在一些实施方案中,相对于缺乏细胞外接头区和/或细胞内间隔区的其他方面相同的嵌合抑制性受体,细胞外接头区和/或细胞内间隔区增加嵌合抑制性受体的效力。在一些实施方案中,相对于缺乏细胞外接头区和/或细胞内间隔区的其他方面相同的嵌合抑制性受体,细胞外接头区和/或细胞内间隔区降低嵌合抑制性受体的效力。在一些实施方案中,相对于缺乏细胞外接头区和/或细胞内间隔区的其他方面相同的嵌合抑制性受体,细胞外接头区和/或细胞内间隔区调节对于在工程化的细胞上表达的靶向肿瘤的嵌合受体的活化的基底防止、减弱或抑制。在一些实施方案中,相对于缺乏细胞外接头区和/或细胞内间隔区的其他方面相同的嵌合抑制性受体,细胞外接头区和/或细胞内间隔区降低基底防止、减弱或抑制。在一些实施方案中,相对于缺乏细胞外接头区和/或细胞内间隔区的其他方面相同的嵌合抑制性受体,细胞外接头区和/或细胞内间隔区增加基底防止、减弱或抑制。
[0183]
在一些实施方案中,嵌合抑制性受体还包含位于跨膜结构域与细胞内信号传导结构域之间并且可操作地连接至跨膜结构域和细胞内信号传导结构域中的每一个的细胞内间隔区。在一些实施方案中,嵌合抑制性受体还包含位于跨膜结构域与细胞内信号传导结构域之间并且物理上连接至跨膜结构域和细胞内信号传导结构域中的每一个的细胞内间隔区。
[0184]
在一些实施方案中,相对于缺乏细胞内间隔区的其他方面相同的嵌合抑制性受体,细胞内间隔区调节嵌合抑制性受体的敏感性。在一些实施方案中,相对于缺乏细胞内间隔区的其他方面相同的嵌合抑制性受体,细胞内间隔区增加嵌合抑制性受体的敏感性。在一些实施方案中,相对于缺乏细胞内间隔区的其他方面相同的嵌合抑制性受体,细胞内间隔区降低嵌合抑制性受体的敏感性。在一些实施方案中,相对于缺乏细胞内间隔区的其他方面相同的嵌合抑制性受体,细胞内间隔区调节嵌合抑制性受体的效力。
[0185]
在一些实施方案中,相对于缺乏细胞内间隔区的其他方面相同的嵌合抑制性受体,细胞内间隔区增加嵌合抑制性受体的效力。在一些实施方案中,相对于缺乏细胞内间隔区的其他方面相同的嵌合抑制性受体,细胞内间隔区降低嵌合抑制性受体的效力。在一些实施方案中,相对于缺乏细胞内间隔区的其他方面相同的嵌合抑制性受体,当在工程化的细胞上表达时,细胞内间隔区调节对于在工程化的细胞上表达的靶向肿瘤的嵌合受体的活化的基底防止、减弱或抑制。在一些实施方案中,相对于缺乏细胞内间隔区的其他方面相同的嵌合抑制性受体,细胞内间隔区降低基底防止、减弱或抑制。在一些实施方案中,相对于缺乏细胞内间隔区的其他方面相同的嵌合抑制性受体,细胞内间隔区增加基底防止、减弱或抑制。
[0186]
细胞内抑制性共信号传导结构域
[0187]
在一些实施方案中,嵌合抑制性受体包含一个或多个细胞内抑制性共信号传导结构域。在一些实施方案中,一个或多个细胞内抑制性共信号传导结构域在膜定位结构域与酶抑制性结构域之间。在一些实施方案中,一个或多个细胞内抑制性共信号传导结构域在跨膜结构域与酶抑制性结构域之间。在一些实施方案中,一个或多个细胞内抑制性共信号传导结构域是酶抑制性结构域的c末端。在一些实施方案中,一个或多个细胞内抑制性共信号传导结构域通过肽接头(例如,参见表2)或间隔子或铰链序列(例如,参见表4)连接至其他结构域(例如,膜定位、跨膜结构域或酶抑制性结构域)。在一些实施方案中,当存在两个或更多个细胞内抑制性共信号传导结构域时,两个或更多个细胞内抑制性共信号传导结构域可以通过肽接头(例如,参见表2)或间隔子或铰链序列(例如,参见表4)连接。
[0188]
在一些实施方案中,嵌合蛋白的一个或多个细胞内抑制性共信号传导结构域包含一个或多个含itim的蛋白或其一个或多个片段。itim是在许多抑制性免疫受体的胞质尾区中见到的保守氨基酸序列。在一些实施方案中,一个或多个含itim的蛋白或其片段选自pd-1、ctla4、tigit、btla和lair1。在一些实施方案中,一个或多个细胞内抑制性共信号传导结构域包含一个或多个非itim支架蛋白或其一个或多个片段。在一些实施方案中,一个或多个非itim支架蛋白或其片段选自grb-2、dok-1、dok-2、slap、lag3、havr、gitr和pd-l1。在一些实施方案中,酶抑制性结构域和itim和/或非itim支架的抑制机制重叠,例如,含itim的蛋白募集衍生出酶抑制性结构域的酶的内源型式,诸如shp-1。在一些实施方案中,酶抑制性结构域和itim和/或非itim支架的抑制机制不同,并且可以是互补的/协同的,例如,含
itim的蛋白和csk或cbl-b源性酶抑制性结构域的活性。
[0189]
免疫受体
[0190]
在一些实施方案中,免疫受体是天然存在的免疫受体。在一些实施方案中,免疫受体是天然存在的抗原受体。在一些实施方案中,免疫受体选自t细胞受体(tcr)、模式识别受体(prr)、nod样受体(nlr)、toll样受体(tlr)、杀伤活化受体(kar)、杀伤抑制剂受体(kir)、nk细胞受体、补体受体、fc受体、b细胞受体和细胞因子受体。在一些实施方案中,免疫受体是tcr。
[0191]
在一些实施方案中,免疫受体是嵌合免疫受体。在一些实施方案中,免疫受体是嵌合抗原受体(car)。通常,如本文所用并且除非另有说明,否则car形式的免疫受体是指通常为重组多肽构建体的活化car,重组多肽构建体至少包含细胞外抗原结合结构域、跨膜结构域和细胞质信号传导结构域(本文也称为“细胞内信号传导结构域”),细胞质信号传导结构域包含源自如下定义的刺激分子的功能性信号传导结构域。
[0192]
本公开的car可以是第一代、第二代或第三代car。“第一代”car包含通常源自t细胞受体链的单一细胞内信号传导结构域。“第一代”car通常具有来自cd3-ζ(cd3ζ)链的细胞内信号传导结构域,其是来自内源tcr的信号的主要递质。“第一代”car可以提供从头抗原识别并引起cd4
t细胞和cd8
t细胞两者通过它们在单一融合分子中的cd3ζ链信号传导结构域活化,独立于hla介导的抗原呈递。“第二代”car将来自多种共刺激分子(例如,cd28、4-1bb、icos、ox40)之一的第二细胞内信号传导结构域添加至car的胞质尾区以向t细胞提供额外信号。“第二代”car提供共刺激(例如,cd28或4-1bb)和活化(cd3ζ)两者。临床前研究指明,“第二代”car可以改善免疫反应细胞如t细胞的抗肿瘤活性。“第三代”car具有多个细胞内共刺激信号传导结构域(例如,cd28和4-1bb)和一个细胞内活化信号传导结构域(cd3ζ)。
[0193]
在一些实施方案中,car多肽构建体中的结构域在相同的多肽链中,例如,包含嵌合融合蛋白。在一些实施方案中,car多肽构建体中的结构域彼此不邻近,例如,在不同的多肽链中。在一些实施方案中,刺激分子是与t细胞受体复合物相关的ζ链。在一些实施方案中,细胞质信号传导结构域包含主要信号传导结构域(例如,cd3-ζ的主要信号传导结构域)。在一些实施方案中,细胞质信号传导结构域还包含源自至少一种如下定义的共刺激分子的一个或多个功能性信号传导结构域。在一些实施方案中,共刺激分子选自4-1bb(即,cd 137)、cd27、icos和/或cd28。在一些实施方案中,car包含嵌合融合蛋白,嵌合融合蛋白包含细胞外抗原结合结构域、跨膜结构域和细胞内信号传导结构域,所述细胞内信号传导结构域包含源自刺激分子的功能性信号传导结构域。在一些实施方案中,car包含嵌合融合蛋白,嵌合融合蛋白包含细胞外抗原结合结构域、跨膜结构域和细胞内信号传导结构域,所述细胞内信号传导结构域包含源自共刺激分子的功能性信号传导结构域和源自刺激分子的功能性信号传导结构域。在一些实施方案中,car包含嵌合融合蛋白,所述嵌合融合蛋白包含细胞外抗原结合结构域、跨膜结构域和细胞内信号传导结构域,所述细胞内信号传导结构域包含两个源自一个或多个共刺激分子的功能性信号传导结构域和源自刺激分子的功能性信号传导结构域。在一些实施方案中,car包含嵌合融合蛋白,所述嵌合融合蛋白包含细胞外抗原结合结构域、跨膜结构域和细胞内信号传导结构域,所述细胞内信号传导结构域包含至少两个源自一个或多个共刺激分子的功能性信号传导结构域和源自刺激分子的功能性信号传导结构域。在一些实施方案中,car在car融合蛋白的氨基末端(n-ter)包含任
选的前导序列(也称为信号序列)。在一些实施方案中,car还包含在细胞外抗原结合结构域的n末端的前导序列,其中在细胞加工和将car定位至细胞膜期间,前导序列任选地从抗原识别结构域(例如,scfv)裂解。
[0194]
各种嵌合抗原受体是本领域已知的,包括但不限于scfv-fcεriγcaix、scfv-fcεriγ、scfv-cd3ζ、scfv-cd28-cd3ζ、scfv-cd28-cd3ζ、scfv-cd3ζ、scfv-cd4-cd3ζ、cd3ζ/cd137/cd28、scfv-cd28-41bb-cd3ζ、scfv-cd8-cd3ζ、scfv-fceriγ、cd28/4-1bb-cd3ζ、scfv-cd28mut-cd3ζ、调蛋白-cd3ζ、scfv-cd28、scfv-cd28-ox40-cd3ζ、scfv-cd3ξ、il-13-cd28-4-1bb-cd3ζ、il-13-cd3ζ、il-13-cd3ζ、scfv-fcεriγ、scfv-cd4-fcεriγ、scfv-cd28-fcεriγ、ly49h-cd3ζ、nkg2d-cd3ζ、scfv-b2c-cd3ζ和fceri-cd28-cd3ζ。在一些实施方案中,嵌合抗原受体已经被修饰以包括控制元件。在一些实施方案中,嵌合抗原受体是分裂嵌合抗原受体;参见例如wo2017/091546。
[0195]
在一些实施方案中,免疫受体是嵌合tcr。嵌合tcr通常包括接枝到例如tcrα链或tcrβ链的tcr链的一个或多个恒定结构域上以产生嵌合tcr的细胞外配体结合结构域,所述嵌合tcr与目标抗原如肿瘤相关抗原特异性结合。不希望受理论的束缚,据信嵌合tcr可以在抗原结合时通过tcr复合物进行信号传导。例如,可以将抗体或抗体片段(例如,scfv)接枝到诸如tcrα链或tcrβ链的tcr链的恒定结构域(例如,细胞外恒定结构域、跨膜结构域和细胞质结构域的至少一部分)。作为另一实例,可以抗体或抗体片段的cdr可以接枝到tcrα链和/或β链中以产生与抗原特异性结合的嵌合tcr。这种嵌合tcr可以通过本领域已知的方法产生(例如,willemsen ra等,gene therapy 2000;7:1369-1377;zhang t等,cancer gene ther 2004 11:487-496;以及aggen等,gene ther.2012年4月;19(4):365-74;出于所有目的以引用的方式并入本文)。
[0196]
免疫受体如嵌合抗原受体的抗原可以是肿瘤相关抗原。
[0197]
免疫受体通常能够诱导表达免疫受体的细胞中的信号转导或蛋白质表达变化,其导致在与同源配体结合时对免疫反应的调节(例如,调控、活化、起始、刺激、增加、防止、减弱、抑制、降低、减少、抑制或阻抑免疫反应)。例如,当tcr/car簇中存在cd3链响应配体结合时,产生基于免疫受体酪氨酸的活化基序(itam)介导的信号转导级联。具体地,在某些实施方案中,当内源tcr、外源tcr、嵌合tcr或car(具体地,活化car)结合它们相应的抗原时,发生免疫突触的形成,其包括许多分子在结合受体(例如,cd4或cd8、cd3γ/δ/ε/ζ等)附近的聚集。膜结合信号传导分子的这种聚集使得cd3链内所含的itam基序变得磷酸化,进而可以起始t细胞活化通路并最终活化转录因子,诸如nf-κβ和ap-1。这些转录因子能够诱导t细胞的整体基因表达以增加il-2产生以用于增殖和表达主调控因子t细胞蛋白,从而起始t细胞介导的免疫反应,诸如细胞因子产生和/或t细胞介导的杀伤。
[0198]
编码嵌合抑制性受体的核酸
[0199]
在其他方面,本文提供了编码至少一种如上所述的嵌合抑制性受体的核酸。在一些实施方案中,编码至少一种嵌合抑制性受体的核酸是载体。在一些实施方案中,载体选自质粒载体、病毒载体、慢病毒载体或噬菌体载体。
[0200]
当嵌合抑制性受体是多链受体时,使用一组多核苷酸。在这种情况下,多核苷酸组可以经克隆到单个载体或多个载体中。在一些实施方案中,多核苷酸包含编码嵌合抑制性受体的序列,其中编码细胞外配体结合结构域的序列与编码细胞内信号传导结构域和膜定
位结构域的序列邻近并且在同一阅读框中。
[0201]
多核苷酸可以经密码子优化以在哺乳动物细胞中表达。在一些实施方案中,多核苷酸的整个序列已经密码子优化以在哺乳动物细胞中表达。密码子优化是指编码dna中同义密码子(即,编码相同氨基酸的密码子)的出现频率在不同物种中有偏倚的发现。这种密码子简并性允许由多种核苷酸序列编码相同的多肽。多种密码子优化方法是本领域已知的,并且包括例如在至少美国专利号5,786,464和6,114,148中公开的方法,这些专利出于所有目的以引用的方式并入本文。
[0202]
编码嵌合抑制性受体的多核苷酸可以使用本领域已知的重组方法获得,诸如通过从表达多核苷酸的细胞筛选文库,通过从已知包括其的载体衍生,或通过从含有其的细胞和组织直接分离使用标准技术获得。替代性地,多核苷酸可以合成产生,而不是克隆产生。
[0203]
多核苷酸可以经克隆到载体中。在一些实施方案中,使用本领域已知的表达载体。因此,本公开包括表达可以直接转导到细胞中的嵌合抑制性受体的逆转录病毒和慢病毒载体构建体。
[0204]
本公开还包括一种可以直接转染到细胞中的rna构建体。一种产生用于转染的mrna的方法包括用具体设计的引物体外转录(ivt)模板,然后添加polya,以产生含有3’和5’非翻译序列(“utr”)(例如,本文所述的3’utr和/或5’utr)、5’帽(例如,本文所述的5’帽)和/或内部核糖体进入位点(ires)(例如,本文所述的ires)、待表达的核酸和polya尾的构建体。如此产生的rna可以有效地转染不同种类的细胞。在一些实施方案中,rna嵌合抑制性受体载体通过电穿孔转导到细胞,例如t细胞或nk细胞中。
[0205]
在一些实施方案中,本公开的载体还可以包含促进分泌的信号序列、多腺苷酸化信号和转录终止子、允许附加型复制的元件和/或允许选择的元件。
[0206]
工程化的细胞
[0207]
本文还提供了基因工程化的细胞,其包含编码至少一种本公开的嵌合抑制性受体的核酸或表达本公开的嵌合抑制性受体。引入核酸/载体的各种方式(即,基因工程改造)是本领域技术人员已知的,并且包括但不限于转导(即,病毒感染)、转化和转染。转染的机制包括基于化学的转染(例如,磷酸钙介导的、脂质转染/脂质体介导的等)、基于非化学的转染(例如,电穿孔、细胞挤压、声孔作用、光学转染、原生质体融合、刺穿转染、流体动力递送等)和基于颗粒的转染(例如,基因枪、磁转染、颗粒轰击等)。
[0208]
在一些实施方案中,本公开的基因工程化的细胞是免疫调节细胞。免疫调节细胞包括但不限于t细胞、cd8 t细胞、cd4 t细胞、γ-δt细胞、细胞毒性t淋巴细胞(ctl)、调控性t细胞、病毒特异性t细胞、天然杀伤t(nkt)细胞、天然杀伤(nk)细胞、b细胞、肿瘤浸润性淋巴细胞(til)、先天淋巴细胞、肥大细胞、嗜酸性粒细胞、嗜碱性粒细胞、嗜中性粒细胞、骨髓细胞、巨噬细胞、单核细胞、树突细胞、esc源性细胞和ipsc源性细胞。
[0209]
在一些实施方案中,本公开的基因工程化的细胞是免疫细胞。在一些实施方案中,免疫细胞是t细胞。t细胞的实例包括但不限于cd8 t细胞、cd4 t细胞、效应细胞、辅助细胞(th细胞)、细胞毒性细胞(tc细胞、ctl、t-杀伤细胞、杀伤t细胞)、记忆细胞(中央记忆t细胞、效应记忆t细胞、组织驻留记忆t细胞、虚拟记忆t细胞等)、调控性t细胞(例如,cd4 、foxp3 、cd25 )、天然杀伤t细胞、粘膜相关不变细胞和γδt细胞。在一些实施方案中,免疫细胞是
[0210]
在一些实施方案中,本公开的基因工程化的细胞是干细胞,诸如间充质干细胞
(msc)、多能干细胞、胚胎干细胞、成体干细胞、骨髓干细胞、脐带干细胞或其他干细胞。
[0211]
在一些实施方案中,基因工程化的细胞是自体的。在一些实施方案中,基因工程化的细胞是同种异体的。
[0212]
在一些实施方案中,基因工程化的细胞还包含免疫受体。在一些实施方案中,免疫受体是天然存在的免疫受体(例如,基因工程化的是表达内源免疫受体的免疫细胞)。在一些实施方案中,免疫受体是天然存在的抗原受体。在一些实施方案中,免疫受体选自t细胞受体、模式识别受体(prr)、nod样受体(nlr)、toll样受体(tlr)、杀伤活化受体(kar)、杀伤抑制剂受体(kir)、补体受体、fc受体、b细胞受体和细胞因子受体。
[0213]
在一些实施方案中,细胞的免疫受体是嵌合免疫受体。在一些实施方案中,免疫受体是嵌合抗原受体。在一些实施方案中,嵌合受体在配体结合时抑制免疫受体活化。
[0214]
在一些实施方案中,基因工程化的细胞经进一步工程改造以表达外源免疫受体。例如,基因工程化的细胞可以经工程改造以表达嵌合免疫受体,诸如car。在另一个实例中,基因工程化的细胞可以经工程改造以表达对于工程化的细胞外源的天然存在的免疫受体。
[0215]
在一些实施方案中,基因工程化的细胞经工程改造以表达嵌合抑制性受体和外源免疫受体。基因工程化的细胞可以经工程改造以同时表达嵌合抑制性受体和外源免疫受体两者(例如,同时引入编码每种受体的多核苷酸)。基因工程化的细胞可以经工程改造以依次表达嵌合抑制性受体和外源免疫受体两者(例如,首先经工程改造以表达嵌合抑制性受体和外源免疫受体,然后经工程改造以表达另一受体)。
[0216]
在一些实施方案中,与本公开的嵌合抑制性受体结合的配体和与免疫受体结合的同源免疫受体配体将嵌合抑制性受体靠近免疫受体定位。在一些实施方案中,嵌合抑制性受体靠近免疫受体的定位抑制免疫受体活化。在一些实施方案中,免疫受体活化是t细胞活化。例如,在t细胞信号传导和/或活化的情况下,与嵌合抑制性受体和免疫受体结合的相应配体将嵌合抑制性受体靠近免疫突触中的免疫受体定位。
[0217]
生产和使用方法
[0218]
在另一方面,本公开提供了一种制备用于实验或治疗用途的表达或能够表达嵌合抑制性受体的基因工程化的细胞(例如,基因工程化的免疫调节细胞)的方法。在另一方面,本公开提供了一种制备用于实验或治疗用途的表达或能够表达嵌合抑制性受体和免疫受体的基因工程化的细胞(例如,基因工程化的免疫调节细胞)的方法。
[0219]
制备治疗性嵌合抑制性受体工程化的细胞的离体工序是本领域熟知的。例如,将细胞从哺乳动物(例如,人)分离并用表达本文公开的嵌合抑制性受体的载体基因工程改造(即,体外转导或转染)。可以将嵌合抑制性受体工程化的细胞施用到哺乳动物受者以提供治疗益处。哺乳动物受者可以是人,并且嵌合抑制性受体修饰的细胞相对于受者可以是自体的。替代性地,细胞相对于受者可以是同种异体的、同基因的或异种的。用于造血干细胞和祖细胞的离体扩增的工序描述于美国专利号5,199,942中,可以应用于本公开的细胞,所述美国专利以引用的方式并入本文。其他合适的方法是本领域已知的,因此本公开不限于离体扩增细胞的任何特定方法。简短地讲,免疫效应细胞(例如,t细胞、nk细胞)的离体培养和扩增包括:(1)自哺乳动物从外周血收获物或骨髓外植体收集cd34 造血干细胞和祖细胞;和(2)离体扩增这种细胞。除了美国专利号5,199,942中描述的细胞生长因子外,其他因子如flt3-l、il-1、il-3和c-kit配体也可以用于细胞的培养和扩增。
[0220]
在一些实施方案中,方法包括将细胞群(例如,在细胞培养基中)培养至所需细胞密度(例如,足以用于特定的基于细胞的疗法的细胞密度)。在一些实施方案中,细胞群在不存在阻抑可阻抑蛋白酶的活性的剂的情况下或在存在阻抑可阻抑蛋白酶的活性的剂的情况下培养。
[0221]
在一些实施方案中,将细胞群培养一段时间,这导致产生包含细胞数为起始群的至少2倍的扩增的细胞群。在一些实施方案中,将细胞群培养一段时间,这导致产生包含细胞数为起始群的至少4倍的扩增的细胞群。在一些实施方案中,将细胞群培养一段时间,这导致产生包含细胞数为起始群的至少16倍的扩增的细胞群。
[0222]
本文还提供了抑制免疫受体活化的方法。在一些实施方案中,方法包括:使包含编码至少一种本公开的嵌合受体的核酸的基因工程化的细胞、表达本公开的嵌合抑制性受体的基因工程化的细胞或包含基因工程化的细胞的药物组合物与同源配体在适合嵌合抑制性受体结合同源配体的条件下接触,其中,当靠近工程化的细胞的细胞膜上表达的免疫受体定位时,嵌合抑制性抑制免疫受体活化。
[0223]
本文还提供了用于降低免疫反应的方法。在一些实施方案中,方法包括:向需要这种治疗的受试者施用包含编码至少一种本公开的嵌合受体的核酸的基因工程化的细胞、表达本公开的嵌合抑制性受体的基因工程化的细胞或包含基因工程化的细胞的药物组合物。
[0224]
本文还提供了防止、减弱或抑制由在免疫调节细胞的表面上表达的靶向肿瘤的嵌合受体诱导的细胞介导的免疫反应的方法,所述方法包括:向需要这种治疗的受试者施用包含编码至少一种本公开的嵌合受体的核酸的基因工程化的免疫调节细胞、表达本公开的嵌合抑制性受体的基因工程化的免疫调节细胞或包含基因工程化的免疫调节细胞的药物组合物。
[0225]
本文还提供了防止、减弱或抑制由在免疫调节细胞的表面上表达的靶向肿瘤的嵌合受体诱导的细胞介导的免疫反应的方法,所述方法包括:使包含编码至少一种本公开的嵌合受体的核酸的基因工程化的免疫调节细胞、表达本公开的嵌合抑制性受体的基因工程化的免疫调节细胞或包含基因工程化的免疫调节细胞的药物组合物与同源配体在适合嵌合抑制性受体结合同源配体的条件下接触,其中,当靠近工程化的细胞的细胞膜上表达的免疫受体定位时,嵌合抑制性抑制免疫受体活化。
[0226]
本文还提供了治疗自身免疫性疾病或可通过降低免疫反应治疗的疾病的方法。在一些实施方案中,方法包括:向需要这种治疗的受试者施用包含编码至少一种本公开的嵌合受体的核酸的基因工程化的细胞、表达嵌合抑制性受体的本公开的基因工程化的细胞或包含基因工程化的细胞的药物组合物。
[0227]
在一些实施方案中,方法包括施用或接触进一步表达或能够表达免疫受体的基因工程化的细胞。在一些实施方案中,方法包括施用或接触经进一步工程改造以表达免疫受体的基因工程化的细胞。在一些实施方案中,方法包括施用或接触进一步表达或能够表达嵌合免疫受体的基因工程化的细胞。在一些实施方案中,方法包括施用或接触经进一步工程改造以表达嵌合免疫受体的基因工程化的细胞。在一些实施方案中,方法包括施用或接触进一步表达或能够表达car的基因工程化的细胞。在一些实施方案中,方法包括施用或接触经进一步工程改造以表达car的基因工程化的细胞。
[0228]
减弱由免疫受体(例如,靶向肿瘤的嵌合受体)起始的免疫反应可以是减少或降低
免疫受体的活化、减少或降低免疫受体的信号转导、或减少或降低工程化的细胞的活化。与缺乏抑制性嵌合受体的工程化的细胞相比,与免疫受体的活化、信号转导或工程化细胞的活化相比,抑制性嵌合受体可以使免疫受体的活化、由免疫受体引起的信号转导或由免疫受体引起的工程化的细胞的活化减弱1倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍或更多倍。在一些实施方案中,减弱是指免疫受体在被活化后活性的减小或降低。
[0229]
减弱由免疫受体(例如,靶向肿瘤的嵌合受体)起始的免疫反应可以是抑制或降低免疫受体的活化、抑制或降低免疫受体的信号转导、或抑制或降低工程化的细胞的活化。与缺乏抑制性嵌合受体的工程化的细胞相比,与免疫受体的活化、信号转导或工程化细胞的活化相比,抑制性嵌合受体可以使免疫受体的活化、由免疫受体引起的信号转导或由免疫受体引起的工程化的细胞的活化防止约1倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍或更多倍。在一些实施方案中,防止是指免疫受体在被活化后活性的阻断。
[0230]
抑制由免疫受体(例如,靶向肿瘤的嵌合受体)起始的免疫反应可以是抑制或降低免疫受体的活化、抑制或降低免疫受体的信号转导、或抑制或降低工程化的细胞的活化。与缺乏抑制性嵌合受体的工程化的细胞相比,与免疫受体的活化、信号转导或工程化细胞的活化相比,抑制性嵌合受体可以使免疫受体的活化、由免疫受体引起的信号转导或由免疫受体引起的工程化的细胞的活化抑制约1倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍或更多倍。在一些实施方案中,抑制是指免疫受体在被活化前后活性的减小或降低。
[0231]
阻抑由免疫受体(例如,靶向肿瘤的嵌合受体)起始的免疫反应可以是抑制或降低免疫受体的活化、抑制或降低免疫受体的信号转导、或抑制或降低工程化的细胞的活化。与缺乏抑制性嵌合受体的工程化的细胞相比,与免疫受体的活化、信号转导或工程化细胞的活化相比,抑制性嵌合受体可以使免疫受体的活化、由免疫受体引起的信号转导或由免疫受体引起的工程化的细胞的活化阻抑约1倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍或更多倍。在一些实施方案中,阻抑是指免疫受体在被活化前后活性的减小或降低。
[0232]
免疫反应可以是自活化的免疫调节细胞产生和分泌细胞因子或趋化因子。免疫反应可以是对靶细胞的细胞介导的免疫反应,诸如细胞介导的杀伤。
[0233]
在一些实施方案中,嵌合抑制性受体能够阻抑自活化的工程化的细胞如免疫调节细胞产生细胞因子。在一些实施方案中,嵌合抑制性受体能够阻抑对靶细胞的细胞介导的免疫反应,其中免疫反应通过工程化的细胞的活化诱导。
[0234]
在一个方面,本公开提供了一种类型的细胞疗法,其中细胞如免疫细胞经基因工程改造以表达本文提供的嵌合抑制性受体,并且将基因工程化的细胞施用到有需要的受试者。
[0235]
因此,在一些实施方案中,方法包括将扩增的细胞群的细胞递送至需要基于细胞的疗法的受试者以治疗病患或病症。在一些实施方案中,受试者是人受试者。在一些实施方案中,病患或病症是自身免疫性病症。在一些实施方案中,病患或病症是免疫相关病症。在一些实施方案中,病患或病症是癌症(例如,原发性癌症或转移性癌症)。在一些实施方案
中,癌症是实体癌。在一些实施方案中,癌症是液体癌症。
[0236]
药物组合物
[0237]
嵌合抑制性受体或基因工程化的细胞可以在药物组合物中配制。本公开的药物组合物可以包含如本文所述的嵌合抑制性受体(例如,icar)或基因工程化的细胞(例如,多个表达嵌合抑制性受体的细胞)与一种或多种药学上或生理学上可接受的载剂、稀释剂或赋形剂的组合。这类材料应该是无毒的,并且不应干扰活性成分的功效。载剂或其他材料的精确性质可以取决于施用途径,例如口服、静脉内、皮肤或皮下、鼻、肌肉内、腹膜内途径。在某些实施方案中,将组合物直接注射到目标器官(例如,受病症影响的器官)中。替代性地,组合物可以例如通过施用至循环系统(例如,肿瘤脉管系统)间接提供给目标器官。可以在施用组合物之前、期间或之后提供扩增和分化剂,以增加t细胞、nk细胞或ctl细胞在体外或体内的产生。
[0238]
在某些实施方案中,组合物是包含基因工程化的细胞如免疫调节或免疫细胞或其祖细胞和药学上可接受的载剂的药物组合物。施用可以是自体的或异源的。例如,免疫调节或免疫细胞或祖细胞可以从一个受试者获得,并施用到同一受试者或不同的相容的受试者。在一些实施方案中,基因工程化的细胞如免疫调节或免疫细胞或其后代可以源自外周血细胞(例如,体内、离体或体外来源的)并且可以经由局部注射施用,所述局部注射包括导管施用、全身注射、局部注射、静脉内注射或肠胃外施用。当施用本公开的治疗组合物(例如,含有本公开的基因工程化的细胞的药物组合物)时,其通常将被配制成单位剂量可注射形式(溶液、悬浮液、乳液)。
[0239]
本公开的某些方面涉及组合物的制剂,其包含本公开的嵌合受体或表达这种嵌合受体的基因工程化的细胞(例如,本公开的免疫调节或免疫细胞)。在一些实施方案中,包含基因工程化的细胞的本公开的组合物可以作为无菌液体制剂提供,包括而不限于等渗水溶液、悬浮液、乳液、分散体和粘性组合物,可以将其缓冲至选定的ph。液体制剂通常比凝胶、其他粘性组合物和固体组合物更易于制备。另外,液体组合物可以更方便地施用,尤其是通过注射施用。在一些实施方案中,粘性组合物可以在适当的粘度范围内配制以提供与具体组织的更久接触期。液体或粘性组合物可以包含载剂,载剂可以是含有例如水、盐水、磷酸盐缓冲盐水、多元醇(例如,甘油、丙二醇、液体聚乙二醇等)及其合适的混合物的溶剂或分散介质。
[0240]
用于口服施用的药物组合物可以是片剂、胶囊、粉剂或液体形式。片剂可以包括固体载剂如明胶或佐剂。液体药物组合物通常包括液体载剂,诸如水、石油、动物或植物油、矿物油或合成油。可以包括生理盐水溶液、葡萄糖或其他糖溶液或二醇如乙二醇、丙二醇或聚乙二醇。
[0241]
对于静脉内、皮肤或皮下注射,或在病痛部位注射,活性成分将是肠胃外可接受的水溶液形式,其无热原并且具有合适的ph、等渗性和稳定性。本领域相关技术人员能够使用例如等渗载体制备合适的溶液,所述等渗载体诸如氯化钠注射液、林格氏注射液、乳酸林格氏注射液。根据需要,可以包括防腐剂、稳定剂、缓冲剂、抗氧化剂和/或其他添加剂。在一些实施方案中,本公开的组合物可以是等渗的,即,具有与血液和泪液相同的渗透压。在一些实施方案中,可以使用例如氯化钠、葡萄糖、硼酸、酒石酸钠、丙二醇或其他无机或有机溶质实现所需的等渗性。
[0242]
在一些实施方案中,本公开的组合物还可以包括可以增强组合物的稳定性和无菌性的各种添加剂。这种添加剂的实例包括而不限于抗微生物防腐剂、抗氧化剂、螯合剂和缓冲剂。在一些实施方案中,可以通过包含各种抗菌剂和抗真菌剂中的任一种来防止微生物污染,抗菌剂和抗真菌剂包括而不限于对羟基苯甲酸酯、氯丁醇、苯酚、山梨酸等。本公开的可注射药物制剂的延长吸收可以通过使用延迟吸收的合适剂如单硬脂酸铝和明胶来实现。在一些实施方案中,可以通过将本公开的基因修饰的细胞与根据需要各种量的任何其他成分一起掺入足够量的适当溶剂中来制备无菌可注射溶液。这种组合物可以与合适的载剂、稀释剂或赋形剂如无菌水、生理盐水、葡萄糖、右旋糖等混合。在一些实施方案中,组合物也可以是冻干的。根据施用途径和所需的制剂,组合物可以含有辅助物质,诸如润湿剂、分散剂、ph缓冲剂和抗微生物剂。
[0243]
在一些实施方案中,本公开的制剂的组分经选择为化学惰性的并且不影响本公开的基因修饰的细胞的活力或功效。
[0244]
关于本公开的基因工程化的细胞的治疗用途的一项考虑是实现最佳功效所需的细胞的量。在一些实施方案中,细胞的施用量将随所治疗的受试者而变化。在某些实施方案中,向有需要的受试者施用的基因工程化的细胞的量可以在1x104个细胞至1x10
10
个细胞的范围内。在一些实施方案中,将被认为是有效剂量的细胞的精确量可以基于每个受试者的个体因素,包括他们的体型、年龄、性别、体重和特定受试者的状况。本领域技术人员基于本公开和本领域的知识可以容易地确定剂量。
[0245]
无论是多肽、抗体、核酸、小分子还是将给予个体的其他药学上有用的根据本发明的化合物,优选以“治疗有效量”或“预防有效量”施用(视情况而定,尽管预防可以被认为是治疗),这足以对个体显示出益处。实际施用量以及施用速率和时间进程将取决于所治疗的蛋白质聚集疾病的性质和严重程度。治疗处方,例如剂量决定等,在普通医师和其他医生的责任范围内,并且通常考虑待治疗的病症、个体患者的状况、递送部位、施用方法和医师已知的其他因素。上述技术和方案的实例可以在remington's pharmaceutical sciences,第16版,osol,a.(编),1980中见到。
[0246]
组合物可以根据待治疗的病患单独施用或与其他治疗组合同时或依序施用。
[0247]
药盒
[0248]
本公开的某些方面涉及用于治疗和/或预防癌症或其他疾病(例如,免疫相关或自身免疫病症)的药盒。在某些实施方案中,药盒包括治疗性或预防性组合物,所述治疗性或预防性组合物包含有效量的一种或多种本公开的嵌合受体、本公开的分离的核酸、本公开的载体和/或本公开的细胞(例如,基因工程化的细胞,诸如免疫调节或免疫细胞)。在一些实施方案中,药盒包括无菌容器。在一些实施方案中,这种容器可以是盒、安瓿、瓶、小瓶、管、袋、囊、泡罩包装或本领域已知的其他合适的容器形式。容器可以由塑料、玻璃、层压纸、金属箔或其他适合容纳药物的材料制成。
[0249]
在一些实施方案中,提供了治疗性或预防性组合物以及用于将治疗性或预防性组合物施用到患有癌症或免疫相关病症或处于发展癌症或免疫相关病症的风险中的受试者的说明书。在一些实施方案中,说明书可以包括关于使用组合物治疗和/或预防病症的信息。在一些实施方案中,说明书包括而不限于治疗性或预防性组合物的描述、剂量方案、用于治疗或预防病症或其症状的施用方案、预防措施、警告、适应症、反适应症、剂量过量信
息、不良反应、动物药理学、临床研究和/或参考文献。在一些实施方案中,说明书可以直接印刷在容器上(当存在时),或作为施加到容器上的标签,或作为在容器中或与容器一起提供的单独的单页、小册子、卡片或文件夹印刷。
[0250]
额外实施方案
[0251]
下面提供了描述本发明的具体非限制性实施方案的列举的实施方案:
[0252]
实施方案1.一种嵌合抑制性受体,其包含:
[0253]
细胞外配体结合结构域;
[0254]
膜定位结构域,其中所述膜定位结构域包含跨膜结构域;和
[0255]
酶抑制性结构域,其中所述酶抑制性结构域在靠近免疫受体时抑制免疫受体活化。
[0256]
实施方案2.如实施方案1所述的嵌合抑制性受体,其中所述细胞外配体结合结构域与选自由以下组成的组的配体结合:蛋白质复合物、蛋白质、肽、受体结合结构域、核酸、小分子和化学剂。
[0257]
实施方案3.如实施方案1或实施方案2所述的嵌合抑制性受体,其中所述细胞外配体结合结构域包含抗体或其抗原结合片段。
[0258]
实施方案4.如实施方案1或实施方案2所述的嵌合抑制性受体,其中所述细胞外配体结合结构域包含f(ab)片段、f(ab')片段、单链可变片段(scfv)或单结构域抗体(sdab)。
[0259]
实施方案5.如实施方案1-4中任一项所述的嵌合抑制性受体,其中所述配体是肿瘤相关抗原。
[0260]
实施方案6.如实施方案1-4中任一项所述的嵌合抑制性受体,其中所述配体不在肿瘤细胞上表达。
[0261]
实施方案7.如实施方案1-4中任一项所述的嵌合抑制性受体,其中所述配体在非肿瘤细胞上表达。
[0262]
实施方案8.如实施方案1-4中任一项所述的嵌合抑制性受体,其中所述配体在健康组织的细胞上表达。
[0263]
实施方案9.如实施方案1-8中任一项所述的嵌合抑制性受体,其中所述细胞外配体结合结构域包含二聚化结构域。
[0264]
实施方案10.如实施方案9所述的嵌合抑制性受体,其中所述配体还包含同源二聚化结构域。
[0265]
实施方案11.如实施方案2-10中任一项所述的嵌合抑制性受体,其中所述配体是细胞表面配体。
[0266]
实施方案12.如实施方案11所述的嵌合抑制性受体,其中所述细胞表面配体在还表达所述免疫受体的同源配体的细胞上表达。
[0267]
实施方案13.如实施方案1-12中任一项所述的嵌合抑制性受体,其中所述膜定位结构域还包含细胞外结构域的至少一部分。
[0268]
实施方案14.如实施方案1-12中任一项所述的嵌合抑制性受体,其中所述膜定位结构域还包含细胞内结构域的至少一部分。
[0269]
实施方案15.如实施方案1-12中任一项所述的嵌合抑制性受体,其中所述膜定位结构域还包含细胞外结构域的至少一部分和细胞内结构域的至少一部分。
[0270]
实施方案16.如实施方案1-12中任一项所述的嵌合抑制性受体,其中所述膜定位结构域包含选自由以下组成的组的跨膜结构域:lax跨膜结构域、cd25跨膜结构域、cd7跨膜结构域、lat跨膜结构域、来自lat突变体的跨膜结构域、btla跨膜结构域、cd8跨膜结构域、cd28跨膜结构域、cd3ζ跨膜结构域、cd4跨膜结构域、4-ibb跨膜结构域、ox40跨膜结构域、icos跨膜结构域、2b4跨膜结构域、pd-1跨膜结构域、ctla4跨膜结构域、btla跨膜结构域、tim3跨膜结构域、lir1跨膜结构域、nkg2a跨膜结构域、tigit跨膜结构域和lag3跨膜结构域、lair1跨膜结构域、grb-2跨膜结构域、dok-1跨膜结构域、dok-2跨膜结构域、slap1跨膜结构域、slap2跨膜结构域、cd200r跨膜结构域、sirpα跨膜结构域、havr跨膜结构域、gitr跨膜结构域、pd-l1跨膜结构域、kir2dl1跨膜结构域、kir2dl2跨膜结构域、kir2dl3跨膜结构域、kir3dl1跨膜结构域、kir3dl2跨膜结构域、cd94跨膜结构域、klrg-1跨膜结构域、pag跨膜结构域、cd45跨膜结构域和ceacam1跨膜结构域。
[0271]
实施方案17.如实施方案16所述的嵌合抑制性受体,其中所述膜定位结构域还包含对应细胞外结构域的至少一部分和/或对应细胞内结构域的至少一部分。
[0272]
实施方案18.如实施方案16或实施方案17所述的嵌合抑制性受体,其中所述lat突变体是lat(ca)突变体。
[0273]
实施方案19.如实施方案1-18中任一项所述的嵌合抑制性受体,其中所述膜定位结构域将所述嵌合抑制性受体引导或分离至细胞膜的结构域。
[0274]
实施方案20.如实施方案1-19中任一项所述的嵌合抑制性受体,其中所述膜定位结构域将所述嵌合抑制性受体定位至脂筏或重脂筏。
[0275]
实施方案21.如实施方案1-20中任一项所述的嵌合抑制性受体,其中所述膜定位结构域与定位在细胞膜的结构域中的一种或多种细胞膜组分相互作用。
[0276]
实施方案22.如实施方案1-21中任一项所述的嵌合抑制性受体,其中所述膜定位结构域足以在不存在结合同源配体的所述细胞外配体结合结构域的情况下减轻由所述酶抑制性结构域对免疫受体活化的组成型抑制。
[0277]
实施方案23.如实施方案1-21中任一项所述的嵌合抑制性受体,其中所述膜定位结构域介导所述嵌合抑制性受体定位至细胞膜的结构域,所述细胞膜的结构域不同于不同于在不存在结合同源配体的所述细胞外配体结合结构域的情况下由免疫受体的一种或多种组分占据的所述细胞膜的结构域。
[0278]
实施方案24.如实施方案23所述的嵌合抑制性受体,其中所述膜定位结构域还包含近端蛋白片段。
[0279]
实施方案25.如实施方案1-24中任一项所述的嵌合抑制性受体,其中所述嵌合抑制性受体还包含一个或多个细胞内抑制性共信号传导结构域。
[0280]
实施方案26.如实施方案25所述的嵌合抑制性受体,其中所述一个或多个细胞内抑制性共信号传导结构域包含一个或多个含itim的蛋白或其片段。
[0281]
实施方案27.如实施方案26所述的嵌合抑制性受体,其中所述一个或多个含itim的蛋白或其片段选自由以下组成的组:pd-1、ctla4、tigit、btla和lair1。
[0282]
实施方案28.如实施方案25所述的嵌合抑制性受体,其中所述一个或多个细胞内抑制性共信号传导结构域包含一个或多个非itim支架蛋白或其片段。
[0283]
实施方案29.如实施方案28所述的嵌合抑制性受体,其中所述一个或多个非itim
支架蛋白或其片段选自由以下组成的组:grb-2、dok-1、dok-2、slap1、slap2、lag3、havr、gitr和pd-l1。
[0284]
实施方案30.如实施方案1-29中任一项所述的嵌合抑制性受体,其中所述细胞外配体结合结构域通过细胞外接头区连接至所述膜定位结构域。
[0285]
实施方案31.如实施方案30所述的嵌合抑制性受体,其中所述细胞外接头区位于所述细胞外配体结合结构域与所述膜定位结构域之间,并且可操作地和/或物理上连接至所述细胞外配体结合结构域和所述膜定位结构域中的每一个。
[0286]
实施方案32.如实施方案30或实施方案31所述的嵌合抑制性受体,其中所述细胞外接头区源自选自由以下组成的组的蛋白质:cd8α、cd4、cd7、cd28、igg1、igg4、fcγriiiα、lngfr和pdgfr。
[0287]
实施方案33.如实施方案30或实施方案31所述的嵌合抑制性受体,其中所述细胞外接头区包含选自由以下组成的组的氨基酸序列:aaaievmypppyldneksngtiihvkgkhlcpsplfpgpskp(seq id no:46)、eskygppcpscp(seq id no:47)、eskygppapsap(seq id no:48)、eskygppcppcp(seq id no:49)、epkscdkthtcp(seq id no:50)、aaafvpvflpakptttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlycnhrn(seq id no:51)、tttpaprpptpaptialqplslrpeacrpaaggavhtrgldfacd(seq id no:52)、acptglythsgecckacnlgegvaqpcganqtvcepcldsvtfsdvvsatepckpctecvglqsmsapcveaddavcrcaygyyqdettgrceacrvceagsglvfscqdkqntvceecpdgtysdeadaec(seq id no:53)、acptglythsgecckacnlgegvaqpcganqtvc(seq id no:54)和avgqdtqevivvphslpfkv(seq id no:55)。
[0288]
实施方案34.如实施方案30或实施方案31所述的嵌合抑制性受体,其中所述细胞外接头区包含选自由以下组成的组的氨基酸序列:ggs(seq id no:29)、ggsggs(seq id no:30)、ggsggsggs(seq id no:31)、ggsggsggsggs(seq id no:32)、ggsggsggsggsggs(seq id no:33)、gggs(seq id no:34)、gggsgggs(seq id no:35)、gggsgggsgggs(seq id no:36)、gggsgggsgggsgggs(seq id no:37)、gggsgggsgggsgggsgggs(seq id no:38)、ggggs(seq id no:39)、ggggsggggs(seq id no:40)、ggggsggggsggggs(seq id no:41)、ggggsggggsggggsggggs(seq id no:42)、ggggsggggsggggsggggsggggs(seq id no:43)、gstsgsgkpgsgegstkg(seq id no:44)和eaaakeaaakeaaakeaaak(seq id no:45)。
[0289]
实施方案35.如实施方案1-33中任一项所述的嵌合抑制性受体,其中所述嵌合抑制性受体还包含位于所述膜定位结构域与所述酶抑制性结构域之间并且可操作地和/或物理上连接至所述膜定位结构域和所述酶抑制性结构域中的每一个的细胞内间隔区。
[0290]
实施方案36.如实施方案34所述的嵌合抑制性受体,其中所述细胞内间隔区包含选自由以下组成的组的氨基酸序列:ggs(seq id no:29)、ggsggs(seq id no:30)、ggsggsggs(seq id no:31)、ggsggsggsggs(seq id no:32)、ggsggsggsggsggs(seq id no:33)、gggs(seq id no:34)、gggsgggs(seq id no:35)、gggsgggsgggs(seq id no:36)、gggsgggsgggsgggs(seq id no:37)、gggsgggsgggsgggsgggs(seq id no:38)、ggggs(seq id no:39)、ggggsggggs(seq id no:40)、ggggsggggsggggs(seq id no:41)、ggggsggggsggggsggggs(seq id no:42)、ggggsggggsggggsggggsggggs(seq id no:43)、gstsgsgkpgsgegstkg(seq id no:44)和eaaakeaaakeaaakeaaak(seq id no:45)。
[0291]
实施方案37.如实施方案34所述的嵌合抑制性受体,其中所述细胞内间隔区包含
选自由以下组成的组的氨基酸序列:aaaievmypppyldneksngtiihvkgkhlcpsplfpgpskp(seq id no:46)、eskygppcpscp(seq id no:47)、eskygppapsap(seq id no:48)、eskygppcppcp(seq id no:49)、epkscdkthtcp(seq id no:50)、aaafvpvflpakptttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlycnhrn(seq id no:51)、tttpaprpptpaptialqplslrpeacrpaaggavhtrgldfacd(seq id no:52)、acptglythsgecckacnlgegvaqpcganqtvcepcldsvtfsdvvsatepckpctecvglqsmsapcveaddavcrcaygyyqdettgrceacrvceagsglvfscqdkqntvceecpdgtysdeadaec(seq id no:53)、acptglythsgecckacnlgegvaqpcganqtvc(seq id no:54)和avgqdtqevivvphslpfkv(seq id no:55)。
[0292]
实施方案38.如实施方案1-34中任一项所述的嵌合抑制性受体,其中所述酶抑制性结构域包含细胞外结构域、跨膜结构域和/或细胞内结构域的至少一部分。
[0293]
实施方案39.如实施方案38所述的嵌合抑制性受体,其中所述酶抑制性结构域包含酶催化结构域。
[0294]
实施方案40.如实施方案1-34中任一项所述的嵌合抑制性受体,其中所述酶抑制性结构域包含酶的至少一部分。
[0295]
实施方案41.如实施方案40所述的嵌合抑制性受体,其中所述酶的部分包含酶结构域或酶片段。
[0296]
实施方案42.如实施方案40所述的嵌合抑制性受体,其中所述酶的部分是所述酶的催化结构域。
[0297]
实施方案43.如实施方案39-42中任一项所述的嵌合抑制性受体,其中所述酶选自由以下组成的组:csk、shp-1、shp-2、pten、cd45、cd148、ptp-meg1、ptp-pest、c-cbl、cbl-b、ptpn22、lar、ptph1、ship-1、zap70和rasgap。
[0298]
实施方案44.如实施方案1-43中任一项所述的嵌合抑制性受体,其中所述酶抑制性结构域源自csk。
[0299]
实施方案45.如实施方案44所述的嵌合抑制性受体,其中所述酶抑制性结构域包含具有src同源物3(sh3)缺失的csk蛋白。
[0300]
实施方案46.如实施方案1-43中任一项所述的嵌合抑制性受体,其中所述酶抑制性结构域源自shp-1。
[0301]
实施方案47.如实施方案47所述的嵌合抑制性受体,其中所述酶抑制性结构域包含蛋白酪氨酸磷酸酶(ptp)结构域。
[0302]
实施方案48.如实施方案1-43中任一项所述的嵌合抑制性受体,其中所述酶抑制性结构域源自shp-2。
[0303]
实施方案49.如实施方案1-43中任一项所述的嵌合抑制性受体,其中所述酶抑制性结构域源自pten。
[0304]
实施方案50.如实施方案1-43中任一项所述的嵌合抑制性受体,其中所述酶抑制性结构域源自cd45。
[0305]
实施方案51.如实施方案1-43中任一项所述的嵌合抑制性受体,其中所述酶抑制性结构域源自cd148。
[0306]
实施方案52.如实施方案1-43中任一项所述的嵌合抑制性受体,其中所述酶抑制性结构域源自ptp-meg1。
[0307]
实施方案53.如实施方案1-43中任一项所述的嵌合抑制性受体,其中所述酶抑制性结构域源自ptp-pest。
[0308]
实施方案54.如实施方案1-43中任一项所述的嵌合抑制性受体,其中所述酶抑制性结构域源自c-cbl。
[0309]
实施方案55.如实施方案1-43中任一项所述的嵌合抑制性受体,其中所述酶抑制性结构域源自cbl-b。
[0310]
实施方案56.如实施方案1-43中任一项所述的嵌合抑制性受体,其中所述酶抑制性结构域源自ptpn22。
[0311]
实施方案57.如实施方案1-43中任一项所述的嵌合抑制性受体,其中所述酶抑制性结构域源自lar。
[0312]
实施方案58.如实施方案1-43中任一项所述的嵌合抑制性受体,其中所述酶抑制性结构域源自ptph1。
[0313]
实施方案59.如实施方案1-43中任一项所述的嵌合抑制性受体,其中所述酶抑制性结构域源自ship-1。
[0314]
实施方案60.如实施方案60所述的嵌合抑制性受体,其中所述酶抑制性结构域包含蛋白酪氨酸磷酸酶(ptp)结构域。
[0315]
实施方案61.如实施方案1-43中任一项所述的嵌合抑制性受体,其中所述酶抑制性结构域源自zap70。
[0316]
实施方案62.如实施方案58所述的嵌合抑制性受体,其中所述酶抑制性结构域包含src同源物1(sh1)结构域、src同源物2(sh2)结构域或sh1结构域和sh2结构域。
[0317]
实施方案63.如实施方案58所述的嵌合抑制性受体,其中所述酶抑制性结构域包含具有激酶结构域缺失的zap70蛋白。
[0318]
实施方案64.如实施方案58所述的嵌合抑制性受体,其中所述酶抑制性结构域包含具有tyr492phe氨基酸取代、tyr493phe氨基酸取代或tyr492phe氨基酸取代和tyr493phe氨基酸取代的突变zap70蛋白。
[0319]
实施方案65.如实施方案1-43中任一项所述的嵌合抑制性受体,其中所述酶抑制性结构域源自rasgap。
[0320]
实施方案66.如实施方案1-43中任一项所述的嵌合抑制性受体,其中所述酶抑制性结构域包含调节基底抑制的一个或多个修饰。
[0321]
实施方案67.如实施方案65所述的嵌合抑制性受体,其中所述一个或多个修饰降低基底抑制。
[0322]
实施方案68.如实施方案65所述的嵌合抑制性受体,其中所述一个或多个修饰增加基底抑制。
[0323]
实施方案69.如实施方案1-68中任一项所述的嵌合抑制性受体,其中在所述嵌合抑制性受体靠近免疫受体募集时,所述酶抑制性结构域抑制免疫受体活化。
[0324]
实施方案70.如实施方案1-69中任一项所述的嵌合抑制性受体,其中所述免疫受体是嵌合免疫受体。
[0325]
实施方案71.如实施方案70所述的嵌合抑制性受体,其中所述免疫受体是嵌合抗原受体。
[0326]
实施方案72.如实施方案1-69中任一项所述的嵌合抑制性受体,其中所述免疫受体是天然存在的免疫受体。
[0327]
实施方案73.如实施方案72所述的嵌合抑制性受体,其中所述免疫受体是天然存在的抗原受体。
[0328]
实施方案74.如实施方案1-69中任一项所述的嵌合抑制性受体,其中所述免疫受体选自由以下组成的组:t细胞受体、模式识别受体(prr)、nod样受体(nlr)、toll样受体(tlr)、杀伤活化受体(kar)、杀伤抑制剂受体(kir)、补体受体、fc受体、b细胞受体和细胞因子受体。
[0329]
实施方案75.如实施方案1-73中任一项所述的嵌合抑制性受体,其中所述免疫受体是t细胞受体。
[0330]
实施方案76.一种核酸,其编码如实施方案1-75中任一项所述的嵌合抑制性受体。
[0331]
实施方案77.一种载体,其包含如实施方案76所述的核酸。
[0332]
实施方案78.一种基因工程化的细胞,其包含如实施方案76所述的核酸。
[0333]
实施方案79.一种基因工程化的细胞,其包含如实施方案77所述的载体。
[0334]
实施方案80.一种基因工程化的细胞,其表达根据实施方案1-75中任一项所述的嵌合抑制性受体。
[0335]
实施方案81.一种表达嵌合抑制性受体的基因工程化的细胞,其中所述嵌合抑制性受体包含:
[0336]
细胞外配体结合结构域;
[0337]
膜定位结构域,其中所述膜定位结构域包含跨膜结构域;和
[0338]
酶抑制性结构域,其中所述抑制性结构域在靠近免疫受体时抑制免疫受体活化。
[0339]
实施方案82.如实施方案78-81中任一项所述的工程化的细胞,其中所述细胞还包含免疫受体。
[0340]
实施方案83.如实施方案82所述的工程化的细胞,其中所述免疫受体是嵌合免疫受体。
[0341]
实施方案84.如实施方案83所述的工程化的细胞,其中所述免疫受体是嵌合抗原受体。
[0342]
实施方案85.如实施方案82所述的工程化的细胞,其中所述免疫受体是天然存在的免疫受体。
[0343]
实施方案86.如实施方案85所述的工程化的细胞,其中所述免疫受体是天然存在的抗原受体。
[0344]
实施方案87.如实施方案82所述的工程化的细胞,其中所述免疫受体选自由以下组成的组:t细胞受体、模式识别受体(prr)、nod样受体(nlr)、toll样受体(tlr)、杀伤活化受体(kar)、杀伤抑制剂受体(kir)、补体受体、fc受体、b细胞受体和细胞因子受体。
[0345]
实施方案88.根据实施方案82-87中任一项所述的工程化的细胞,其中所述嵌合抑制性受体在配体结合时抑制免疫受体活化。
[0346]
实施方案89.如实施方案82-88中任一项所述的工程化的细胞,其中所述配体是细胞表面配体。
[0347]
实施方案90.根据实施方案89所述的工程化的细胞,其中所述细胞表面配体在进
一步表达同源免疫受体配体的细胞上表达。
[0348]
实施方案91.如实施方案90所述的工程化的细胞,其中与所述嵌合抑制性受体结合的配体和与所述免疫受体结合的同源免疫受体配体将所述嵌合抑制性受体靠近所述免疫受体定位。
[0349]
实施方案92.如实施方案91所述的工程化的细胞,其中所述嵌合抑制性受体靠近所述免疫受体的定位抑制免疫受体活化。
[0350]
实施方案93.如实施方案88-93中任一项所述的工程化的细胞,其中所述细胞是t细胞。
[0351]
实施方案94.如实施方案93所述的工程化的细胞,其中所述免疫受体是t细胞受体。
[0352]
实施方案95.如实施方案94所述的工程化的细胞,其中所述免疫受体活化是t细胞活化。
[0353]
实施方案96.如实施方案78-92中任一项所述的工程化的细胞,其中所述细胞是免疫调节细胞。
[0354]
实施方案97.如实施方案96所述的工程化的细胞,其中所述免疫调节细胞选自由以下组成的组:t细胞、cd8 t细胞、cd4 t细胞、γ-δt细胞、细胞毒性t淋巴细胞(ctl)、调控性t细胞、病毒特异性t细胞、天然杀伤t(nkt)细胞、天然杀伤(nk)细胞、b细胞、肿瘤浸润性淋巴细胞(til)、先天淋巴细胞、肥大细胞、嗜酸性粒细胞、嗜碱性粒细胞、嗜中性粒细胞、髓样细胞、巨噬细胞、单核细胞、树突细胞、esc源性细胞和ipsc源性细胞。
[0355]
实施方案98.如实施方案78-97中任一项所述的工程化的细胞,其中所述细胞是自体的。
[0356]
实施方案99.如实施方案78-97中任一项所述的工程化的细胞,其中所述细胞是同种异体的。
[0357]
实施方案100.一种药物组合物,其包含如实施方案78-99中任一项所述的工程化的细胞和药学上可接受的载剂、药学上可接受的赋形剂或其组合。
[0358]
实施方案101.一种抑制免疫受体活化的方法,所述方法包括:
[0359]
在适合嵌合抑制性受体结合同源配体的条件下,使如实施方案78-99中任一项所述的工程化的细胞或如实施方案100所述的药物组合物与所述同源配体接触,
[0360]
其中,当靠近所述工程化的细胞的细胞膜上表达的免疫受体定位时,所述嵌合抑制性抑制免疫受体活化。
[0361]
实施方案102.一种用于降低免疫反应的方法,所述方法包括:
[0362]
向需要这种治疗的受试者施用如实施方案78-99中任一项所述的工程化的细胞或如实施方案100所述的药物组合物。
[0363]
实施方案103.一种防止、减弱或抑制由在免疫调节细胞的表面上表达的靶向肿瘤的嵌合受体诱导的细胞介导的免疫反应的方法,所述方法包括:
[0364]
向需要这种治疗的受试者施用如实施方案78-99中任一项所述的工程化的细胞或如实施方案100所述的药物组合物。
[0365]
实施方案104.一种防止、减弱或抑制在免疫调节细胞的表面上表达的靶向肿瘤的嵌合受体的活化的方法,所述方法包括:
0.45um过滤器去除细胞碎片。根据以下方案使用lenti-x concentrator(目录号631231和631232):1)将1体积的lenti-x concentrator与3体积的澄清上清液合并。通过轻轻反转混合;2)将混合物在冰上或在4℃下孵育30分钟过夜;(3)在4℃下以1,500x g离心样品45分钟;(4)小心地去除并丢弃上清液,小心不要扰动沉淀;(5)使用无菌pbs 0.1%bsa将沉淀轻轻地重悬于原始体积的1/10-1/100中。
[0390]
转导和扩增
[0391]
将原代t细胞从人供体pbmc中分离并冷冻。在第1天,将1x106个纯化的cd4 /cd8 t细胞解冻并用3x106个human t-activator cd3/cd28 dynabead刺激,然后在1ml具有0.2μg/ml il-2的optimizer cts t细胞扩增培养基(gibco)中培养。在第2天,用编码活化car(acar)的慢病毒(参见上述生产方法)和/或编码抑制性car(icar)的慢病毒共转导细胞,产生acar 、icar 和acar /icar (双重 )t细胞(每种构建体100k,如通过gostix(tekara)定量)。每种car处于组成型sffv启动子的控制下。各种acar和icar构建体和相关car结构域描述于下表a中并且完整编码序列提供在表c中。在第3天,通过磁体去除dynabead。对t细胞进行计数并传代(0.5x106个细胞/毫升)。在随后的扩增期间,每两天传代细胞(0.5x106个细胞/毫升)。
[0392]
表a-car构建体
[0393][0394]
共培养测定
[0395]
在第7天,用pe缀合的抗myc和bv421缀合的抗flag抗体(分别对应于acar和icar)对每个细胞群的等分试样染色,并使用lx cytoflex流式细胞术机器定量它们的转基因表达。在第8天,对t细胞进行计数并将其分配到96孔板中以进行共培养测定,其中每个孔含有5x105个k562靶细胞,所述靶细胞经工程改造以共表达acar靶cd20和icar靶cd19或经工程改造以仅表达cd20并且用celltrace紫色染料(invitrogen)染色,和5x105个acar 或双重 t细胞。将共培养物孵育(37
°
,5%co2)40小时。在第10天,将共培养物中的细胞用nir生存力染料(biolegen)染色,并使用cytoflex lx流式细胞仪定量活靶细胞的数量。将每个工程化的car-t细胞群的杀伤效率计算为存活野生型k562相对于每个表达cd20的k562靶细胞系的比率。归一化杀伤效率计算为双重(cd20 cd19 )抗原靶细胞对单一(仅cd20 )抗原靶细胞的car-t杀伤效率的比率。
[0396]
含有酶抑制性结构域的car结果
[0397]
评估了通过含有酶抑制性结构域(eid)的car对t细胞信号传导的抑制。一般策略
图示在图1-3中,显示当含eid的嵌合受体与靶细胞上表达的同源配体接合时,由所述受体介导的对信号传导的抑制。
[0398]
建立了用于评估含eid的嵌合受体的抑制的系统。图4图示所述系统,其中k562靶细胞经工程改造以表达acar的同源抗原(cd20)或经工程改造以表达acar的同源抗原(cd20)和icar的同源抗原(cd19)。所检查的系统评估了包含csk结构域作为eid结构域的抗cd19 icar抑制包含cd28-cd3ζ细胞内信号传导结构域的acar的信号传导的能力。图5提供了代表性流式细胞术图,其证实在转导cd4 t细胞和cd8 t细胞后在没有随后富集的情况下,icar构建体抗cd19_scfv-csk融合物在未修饰细胞上以可检测水平的表达。重要的是,t细胞证实在慢病毒共转导后icar构建体和acar构建体两者的共表达(图5,右下)。所检查的各种构建体的表达谱通过流式细胞术评估并且呈现在图6中,证实acar构建体和icar构建体的表达。显示的是:acar =表达acar的细胞(有和没有icar)[第一个柱];icar =表达icar的细胞(有和没有acar)[第二个柱];且双重 =表达acar和icar两者的细胞[第三个柱]。重要的是,acar 群(第一个柱)与双重 群(第三个柱)的比较证实,大多数表达acar的细胞是双重 的(即,还表达icar),指示存在最少的残留仅acar细胞(即,仅表达acar),其将不会被功能性icar抑制。
[0399]
然后评估icar构建体抑制信号传导的能力。如图7中所示,尽管用acar构建体转导仅导致有效的靶细胞杀伤(图7,左柱;表示为杀伤cd19/cd20靶细胞与仅杀伤cd20靶细胞的比率),用具有csk酶抑制性结构域的icar(icar31)共转导t细胞导致杀伤效率降低约50%(图7,中间柱)。用具有csk酶抑制性结构域而在csk sh3结构域中有缺失的icar(icar26)共转导t细胞未证实抑制(图7,右柱)。因此,数据证实含有酶抑制性结构域的car能够以配体特异性方式抑制由活化car介导的细胞信号传导。
[0400]
实施例2:含酶抑制性结构域(eid)的car的评估
[0401]
car-t和k562共培养方法
[0402]
慢病毒产生:
[0403]
慢病毒使用以下产生:lenti-x 293t包装细胞系(clontech,目录号632180);lx293t完全生长培养基,无抗生素;dmem,高葡萄糖;1mm丙酮酸钠;10%fbs,热灭活;opti-mem i减血清培养基(gibco/thermo fisher;目录号31985);fugene hd(promega,目录号e2311);包膜、包装和转移载体质粒;vsv-g假型化包膜载体(pmd2.g);包装载体,其含有gag、pol、rev和tat,可以与第2代和第3代转移载体(psmax2)一起使用。在转染前一天的傍晚,将来自90%汇合的10cm培养皿的293t(ft)细胞提起并以1:3稀释分配,并将细胞在37℃、5%co2下正常孵育过夜(细胞在转染时的第二天应为60-85%汇合的)。
[0404]
根据以下方案为每个10cm培养皿准备转染反应:
[0405]
1.在单独的1.7ml管中为每个10cm培养皿准备转染反应。
[0406]
2.在室温下添加900ul opti-mem i。
[0407]
3.每个反应添加9ug载体骨架(含有目标基因)。
[0408]
4.每个反应添加8ug包装载体。
[0409]
5.每个反应添加1ug包膜载体(pmd2.g)。
[0410]
6.通过快速涡旋3秒彻底混合。
[0411]
7.每个反应添加55ul fugene hd。
[0412]
8.通过快速上下吸取20-30次进行混合。
[0413]
9.在室温下静置10分钟(允许形成dna复合物)。
[0414]
10.以逐滴的方式将混合物缓慢添加到培养皿周围,然后通过轻轻地来回上下摇动5-10秒(不涡旋)来混合。
[0415]
11.将培养皿置于病毒培养箱中。
[0416]
在第2天和第3天使用血清学移液管收获病毒上清液。使用millipore steriflip 0.45um过滤器去除细胞碎片。根据以下方案使用lenti-x concentrator(目录号631231和631232):1)将1体积的lenti-x concentrator与3体积的澄清上清液合并。通过轻轻反转混合;2)将混合物在冰上或在4℃下孵育30分钟过夜;(3)在4℃下以1,500xg离心样品45分钟;(4)小心地去除并丢弃上清液,小心不要扰动沉淀;(5)使用无菌pbs 0.1%bsa将沉淀轻轻地重悬于原始体积的1/10-1/100中。
[0417]
转导和扩增
[0418]
将原代t细胞从人供体pbmc中分离并冷冻。在第1天,将1x106个纯化的cd4 /cd8 t细胞解冻并用3x106个human t-activator cd3/cd28 dynabead刺激,然后在1ml具有0.2μg/ml il-2的optimizer cts t细胞扩增培养基(gibco)中培养。在第2天,用编码活化car(acar)的慢病毒(参见上述生产方法)和/或编码抑制性car(icar)的慢病毒共转导细胞,产生acar 、icar 和acar /icar (双重 )t细胞(每种构建体100k,如通过gostix(tekara)定量)。每种car处于组成型sffv启动子的控制下。各种acar和icar构建体和相关car结构域描述在下表b中。在第3天,通过磁体去除dynabead。对t细胞进行计数并传代(0.5x106个细胞/毫升)。在随后的扩增期间,每两天传代细胞(0.5x106个细胞/毫升)。
[0419]
共培养测定
[0420]
在第7天,用pe缀合的抗myc和bv421缀合的抗flag抗体(分别对应于acar和icar)对每个细胞群的等分试样染色,并使用lx cytoflex流式细胞术机器定量它们的转基因表达。在第8天,对t细胞进行计数并将其分配到96孔板中以进行共培养测定,其中每个孔含有5x105个k562靶细胞,所述靶细胞经工程改造以共表达acar靶cd20和icar靶cd19或经工程改造以仅表达cd20并且用celltrace紫色染料(invitrogen)染色,和5x105个acar 或双重 t细胞。将共培养物孵育(37
°
,5%co2)40小时。在第10天,将共培养物中的细胞用nir生存力染料(biolegen)染色,并使用cytoflex lx流式细胞仪定量活靶细胞的数量。将每个工程化的car-t细胞群的杀伤效率计算为存活野生型k562相对于每个表达cd20的k562靶细胞系的比率。归一化杀伤效率计算为双重(cd20 cd19 )抗原靶细胞对单一(仅cd20 )抗原靶细胞的car-t杀伤效率的比率。
[0421]
含有酶抑制性结构域的car评估结果
[0422]
评估了通过含有酶抑制性结构域(eid)的car对t细胞信号传导的抑制。评估策略遵循实施例1中所述。评估单独表达acar或共表达acar和icar的工程化的t细胞在与表达由icar、acar、两者识别或两者都不识别的同源抗原的工程化的靶细胞共培养时的细胞毒性、细胞因子释放、活化相关标记物的表达。所评估的示例性构建体描述于表b中。还评估了靶向肿瘤相关抗原的acar与靶向通常在健康组织和/或细胞上表达的抗原的icar的组合。
[0423]
工程化的t细胞的流式细胞术分析证实acar构建体和icar构建体的共表达。然后评估各种icar构建体抑制信号传导的能力。结果证实含酶抑制性结构域的car能够以配体
特异性方式抑制活化car的细胞信号传导,包括确定证实最稳健的信号传导抑制和/或配体特异性的那些icar特征(例如,eid、额外结构域、结构域组织等)。
[0424][0425]
其他实施方案
[0426]
本说明书中公开的所有特征都可以以任何组合来组合。本说明书中公开的每个特征可以由用于相同、等效或相似目的的替代性特征替代。因此,除非另有明确说明,否则所公开的每个特征仅是通用系列的等效或相似特征的实例。
[0427]
从以上描述中,本领域技术人员可以容易地确定本公开的必要特征,并且在不偏离本公开的精神和范围的情况下,可以对本公开进行各种改变和修改以使其适应各种用途和条件。因此,其他实施方案也在权利要求内。
[0428]
等同物
[0429]
虽然本文已经描述并说明了若干发明实施方案,但是本领域的普通技术人员将容易想到用于执行功能和/或获得结果的各种其他装置和/或结构和/或一个或多个本文所述的优点,并且这些变化和/或修改中的每一个都被认为是在本文所述的发明实施方案的范围内。更一般地讲,本领域的技术人员将容易地理解,本文所述的所有参数、尺寸、材料和构造旨在是示例性的,并且实际参数、尺寸、材料和/或构造将取决于使用本发明教导的一种或多种具体应用。本领域的技术人员将认识到或者能够使用不超过常规的实验确定本文所述的具体发明实施方案的许多等同物。因此,应该理解,前述实施方案仅作为示例呈现,并且在所附权利要求及其等同物的范围内,发明实施方案可以不同于具体描述并要求保护的方式实施。本公开的发明实施方案涉及本文所述的每个单独的特征、系统、制品、材料、药盒和/或方法。另外,如果这样的特征、系统、制品、材料、药盒和/或方法不相互矛盾,则两种或更多种这样的特征、系统、制品、材料、药盒和/或方法的任何组合包括在本公开的发明范围内。
[0430]
如本文定义和使用的所有定义应理解为优先于字典定义、以引用的方式并入的文献中的定义和/或所定义术语的普通含义。
[0431]
本文公开的所有参考文献、专利和专利申请都关于其各自引用的主题以引用的方式并入,其在一些情况下可以涵盖整个文件。
[0432]
除非明确指出相反情况,否则本说明书和权利要求中使用的不定冠词“一个/种”应理解为意指“至少一个/种”。
[0433]
本说明书和权利要求中使用的短语“和/或”应理解为意指如此结合的要素中的“一个/种或两个/种”,即这些要素在一些情况下结合地存在而在其他情况下单独地存在。用“和/或”列出的多个要素应以相同的方式解释,即,如此结合的“一个/种或多个/种”要素。除了由“和/或”子句具体标识的要素以外,可以任选地存在其他要素,无论是与具体标识的那些要素相关还是无关。因此,作为非限制性实例,当与诸如“包含”的开放式语言结合使用时,提及“a和/或b”可以在一个实施方案中仅指a(任选地包括除b以外的要素);在另一个实施方案中,仅指b(任选地包括除a以外的要素);在又另一个实施方案中,指a和b两者(任选地包括其他要素);等等。
[0434]
如本说明书和权利要求中所用,“或”应理解为具有与如上所定义的“和/或”相同的含义。例如,当分隔列表中的项目时,“或”或“和/或”应被解释为包括性的,即,包括许多或一系列要素中的至少一个/种,但也包括多个一个/种元素,以及任选的额外未列出的项目。只有明确地指示相反的术语,诸如“只有一个/种”或“恰好一个/种”,或者,当在权利要求中使用时,“由
……
组成”将指包括许多或一系列要素中的恰好一个/种要素。一般而言,如本文所用的术语“或”仅应被解释为指示在排他性项目之前指示排他性替代项(即“一个/种或另一个/种,但并非两者”),诸如“一个/种”、“仅一个/种”或“恰好一个/种”。当在权利要求中使用时,“基本上由
……
组成”将具有如其在专利法领域中使用的普通含义。
[0435]
如本说明书和权利要求中所用,关于一个/种或多个/种要素的列表的短语“至少
一个/种”应理解为意指至少一个/种要素选自要素列表中的任何一个/种或多个/种要素,但不一定包括要素列表内具体列出的每一个/种要素中的至少一个/种要素,并且不排除要素列表中的要素的任何组合。此定义还允许除了在短语“至少一个/种”所指的元素列表内具体识别的要素以外,可以任选地存在要素,无论是与具体标识的那些要素相关还是无关。因此,作为非限制性实例,“a和b中的至少一个/种”(或等同地,“a或b中的至少一个/种”,或等同地,“a和/或b中的至少一个/种”)在一个实施方案中可以指至少一个/种a,任选地包括多于一个/种a,而不存在b(并且任选地包括除b以外的要素);在另一个实施方案中,可以指至少一个/种b,任选地包括多于一个/种b,而不存在a(并且任选地包括除a以外的要素);在又另一个实施方案中,可以指至少一个/种a,任选地包括多于一个/种a,和至少一个/种b,任选地包括多于一个/种b(并且任选地包括其他要素);等等。
[0436]
还应理解的是,除非明确地指示相反,否则本文要求保护的包括多于一个步骤或动作的任何方法中,所述方法的步骤或动作的顺序不一定限于所述方法的步骤或动作被叙述的顺序。
[0437]
在权利要求以及以上说明书中,所有过渡短语如“包含”、“包括”、“携带”、“具有”、“含有”、“涉及”、“持有”、“构成”等应理解为开放式的,即,意指包括但不限于。如美国专利局专利审查工序手册第2111.03节中所述,只有过渡短语“由......组成”和“基本上由...组成”应分别是闭合式或半闭合式的过渡短语。应当理解,在替代实施方案中,本文档中使用开放式过渡短语(例如,“包含”)描述的实施方案也被设想为“由开放式过渡短语描述的特征组成”和“基本上由开放式过渡短语描述的特征组成”。例如,如果本公开描述“包含a和b的组合物”,则本公开还考虑替代实施方案“由a和b组成的组合物”和“基本上由a和b组成的组合物。”[0438]
额外序列
[0439]
本文提及的载体、盒和蛋白结构域的某些额外序列在下文描述并由seq id no提及。
[0440]
表c-额外序列
[0441]
[0442]
[0443]
[0444]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。