1.本发明涉及一种肠溶微丸、其制备方法和包含它的制剂,特别是涉及艾普拉唑肠溶微丸、其制备方法和包含它的制剂。
背景技术:
2.质子泵抑制剂(proton pump inhibitors,ppis)是能够选择地抑制人体胃黏膜细胞分泌小管膜上的h
/k
-atp酶(又称质子泵或酸泵)的药物。由于该h
/k
-atp酶是抑制胃酸分泌的最终途径,对其进行抑制可明显降低胃酸的分泌,因此,质子泵抑制剂通常被用于治疗消化道由于胃酸作用而诱发或导致的疾病(即酸相关疾病),其包括胃和十二指肠溃疡、胃食管反流病、手术吻合口溃疡和卓-艾综合症等。根据作用机理,可以将已知的ppis分为非可逆性ppis和可逆性ppis(reversible ppi,rppis)。其中,非可逆性ppis主要为苯并咪唑衍生物,能迅速穿过壁细胞膜并蓄积在强酸性的分泌小管中,然后质子化转化为次磺酰胺类化合物,后者可与h
/k
-atp酶α亚基中的半胱氨酸残基上的巯基形成共价结合的二硫键,由此使h
/k
-atp酶不可逆地失活、抑制其泌酸活性(张璇,“质子泵抑制剂-拉唑类药物专利技术综述”,《专利文献研究2018-医药制药》,知识产权出版社,北京,2019.9:p554-567)。目前全球已经上市的此类药物有:奥美拉唑(omeprazole)、兰索拉唑(lansoprazole)、泮托拉唑(pantoprozole)、雷贝拉唑(rabeprazole)、埃索美拉唑(esomeprazole)、艾普拉唑(ilaprazole)、右兰索拉唑(delansoprazole)等。
3.与其他的拉唑类药物相似,艾普拉唑也属于酸不稳定性化合物。只是,相比于现有的其他拉唑类药物,艾普拉唑具有更低的稳定性。酸不稳定性化合物是在酸性介质中不稳定但是在中性和碱性介质中具有较好稳定性的物质。这些化合物的共同特点是,在酸介质中,经过迅速地降解/转变,可以成为生物学上有效的化合物。酸不稳定的质子泵抑制剂在酸性和中性介质中对降解/转化敏感,用于口服时,应避免其与胃酸接触而影响其稳定性。解决该问题的一般方法是将这类药物的口服制剂以肠溶材料包衣,制备成肠溶微丸制剂(例如参见cn1183047a、cn1146720a、us4786505、ep0519365)。这些肠溶微丸制剂通常包含有药丸芯、缓冲衣层以及外层的肠溶衣层。针对药丸芯,可以在该药丸芯的药物组合物中加入碱化剂(或称缓冲剂)以增加ppis的稳定性,或者在不含碱化剂的药丸芯上附加碱性层,以保护ppis不被酸破坏(参见cn103705483a)。此外,为了避免肠溶材料中游离羧基对该类药物的稳定性的影响,在肠溶衣层内还需要具有一定厚度的缓冲衣层(即隔离层)。
4.关于该隔离层,现有技术中已经公开了许多技术方案,例如:
5.cn87103285a(上述us4786505的中国同族)公开了一种用于口服的酸不稳定物质(例如苯并咪唑类化合物)的药用制剂。该用于治疗胃肠疫病的药用制剂由芯子材料、一层或多层底包衣层(即隔离层)和肠溶衣层组成,该芯子材料含有酸不稳定性化合物与呈碱性反应的化合物,或含有酸不稳定性化合物有选择的碱性盐与碱性化合物;底包衣层含有在水中可溶解的或能迅速崩解的呈惰性反应的化合物,或水中可溶的能形成膜的聚合化合物,可选地,还可以含有缓冲ph的碱性化合物。此外,以适当的方法处理最后的肠包衣剂型,
使水份含量降低到很低的水平,以得到在长期贮存中具有良好的稳定性的剂型。其中,该缓冲ph的碱性化合物可以是氧化镁,氢氧化镁或碳酸镁、氢氧化铝或氢氧化钙,碳酸铝或碳酸钙,硅酸铝或硅酸钙;复合的铝/镁化合物,例如al2o3·
6mgo
·
co2·
12h2o,(mg6al2(oh)
16
co3.4h2o),mgo
·
al2o3·
2sio2·
nh2o,其中n不是整数并小于2,或为类似化合物;或者为其他药用合格的ph-缓冲物质,例如磷酸、柠檬酸或其他合适的弱无机酸或有机酸的钠、钾、钙、镁和铝盐。用做隔离层的材料选自药用合格的水可溶的惰性化合物或用做包衣膜的聚合物,例如糖、聚乙二醇、聚乙烯吡咯烷酮、聚乙烯醇、羟丙基纤维素、羟甲基纤维素、羟丙基甲基纤维素等。在隔离层中,也可包含普通的增塑剂、色素、二氧化钛、滑石粉和其他添加剂。
6.cn101036633a公开了一种奥美拉唑肠溶微丸胶囊及其制备方法。该胶囊内容物为奥美拉唑肠溶微丸,该肠溶微丸包含有空白丸芯、含有碱性成份的活性药物层、隔离层和肠溶衣层。该隔离层将碱性的奥美拉唑活性药物层与呈酸性的肠溶材料隔离开,同时在隔离层增加氧化镁和钛白粉作为保护成份,通过协同作用明显地提高了药物的稳定性。
7.cn102119927a公开了一种质子泵抑制剂肠溶微丸制剂及其制备方法。该质子泵抑制剂肠溶微丸由空白丸芯、载药层、隔离层(i)和(ii)及肠溶层组成,为了提高药物稳定性并改善由于水不溶性碱的加入而降低的载药效率,该载药层和隔离层(i)同时含有水溶性无机碱,且载药层所用碱包含氢氧化钠和能与氢氧化钠在水溶液中形成缓冲且ph为11-12(不包括11)的碱性环境的另外一种水溶性无机碱。
8.cn106176669a公开了一种泮托拉唑钠肠溶微丸、其制备方法和包含该微丸的胶囊和胶囊制备方法,该泮托拉唑钠肠溶微丸由内至外顺次包括药丸芯、第一隔离层、第二隔离层和肠溶层,该药丸层中包括泮托拉唑钠和复合碱性物(磷酸钠盐的混合物);第一隔离层包括羟丙基甲基纤维素、聚维酮k30、聚乙二醇600(peg-600)、硬脂酸镁和滑石粉;第二隔离层包括羟丙基甲基纤维素、聚乙二醇400(peg-400)、碳酸氢钠、二氧化钛和丙三醇三乙酸酯;且在该肠溶微丸中,第一隔离层与第二隔离层的质量比能显著地影响最终的药物效果。
9.cn1785186a公开了一种泮托拉唑或其盐的肠溶微丸,所述微丸从内到外包括丸芯、底衣层、药层、缓冲层、隔离层和肠溶层。为了获得期望的效果,必须对其中的包衣层数、各层厚度、中间层粘合剂和稳定剂的用量等因素进行调整,因而该文献中严格限制了各层的增重量,否则不能达到发明期望达到的效果。
10.用于制备拉唑类肠溶微丸及其制剂的现有技术方法存在如下不利之处,导致现有技术的拉唑类肠溶微丸及其制剂无法同时具有良好的稳定性和耐酸性(尤其是耐酸性不易得到满足):在通过现有技术制备的拉唑类肠溶微丸的隔离层中,紧邻药丸芯(亦即含药丸)的隔离层通常含有能够防止微丸发生粘连的水不溶性惰性物质(如滑石粉,二氧化硅,二氧化钛,硬脂酸镁等)和/或水溶性碱性化合物,以及紧邻肠溶层的隔离层通常含有碱性化合物,这两者均会降低肠溶微丸及其制剂的稳定性和/或耐酸性。
技术实现要素:
11.因此,本发明的目的之一在于提供一种艾普拉唑肠溶微丸,该肠溶微丸克服了现有技术的缺陷,可以具有下述性质之一、两者或两者以上:具有良好的稳定性、良好的耐酸性,提高的溶出度和/或提高的载药量(在本文中有时也称上药率)以及生物利用度。
12.上述目的通过根据本发明的肠溶微丸得以实现,该肠溶微丸从内向外依次包括药丸芯、第一隔离层、第二隔离层和肠溶层,其中,药丸芯含有艾普拉唑和/或艾普拉唑的药学上可接受的盐和第一辅料。
13.根据本发明的第一方面,本发明提供了一种肠溶微丸,该肠溶微丸从内向外依次包括药丸芯、第一隔离层、第二隔离层和肠溶层,其中,药丸芯含有艾普拉唑和/或艾普拉唑的药学上可接受的盐和第一辅料,所述肠溶微丸的特征在于,第一隔离层中含有水不溶性碱性化合物,所述第一辅料与艾普拉唑和/或艾普拉唑的药学上可接受的盐之间的重量比为0.2~5:1。
14.根据本发明的第二方面,本发明提供了一种肠溶微丸,该肠溶微丸从内向外依次包括药丸芯、第一隔离层、第二隔离层和肠溶层,其中,药丸芯含有艾普拉唑和/或艾普拉唑的药学上可接受的盐和第一辅料,所述肠溶微丸的特征在于,第一隔离层含有水不溶性碱性化合物和第一辅料为水不溶性碱性化合物,其中第一隔离层含有水不溶性碱性化合物与第一辅料的水不溶性碱性化合物可以相同或不同。
15.根据本发明的第三方面,本发明提供了一种肠溶微丸,该肠溶微丸从内向外依次包括药丸芯、第一隔离层、第二隔离层和肠溶层,其中,药丸芯含有艾普拉唑和/或艾普拉唑的药学上可接受的盐和第一辅料,所述肠溶微丸的特征在于,艾普拉唑和/或艾普拉唑的药学上可接受的盐的粒径d90≤100μm,和第二隔离层不含碱性物质。
16.根据本发明的一个实施方案,根据本发明的肠溶微丸在肠溶层外侧还设有保护层。
17.根据本发明的一个实施方案,在根据本发明的肠溶微丸中,在药丸芯与第一隔离层之间不存在其他的层。
18.根据本发明的一个实施方案,在根据本发明的肠溶微丸中,在第二隔离层与肠溶层之间不存在其他的层。
19.根据本发明的一个实施方案,在根据本发明的肠溶微丸中,在第一隔离层与第二隔离层之间不存在其他的层。
20.根据本发明的一个实施方案,根据本发明的肠溶微丸中的第一辅料为碱性化合物,优选为水不溶性碱性化合物,更优选选自氢氧化镁、氢氧化铝、氧化镁、碳酸镁、碳酸钙、氢氧化钙。
21.根据本发明的一个实施方案,艾普拉唑的药学上可接受的盐可以例如为艾普拉唑钠、艾普拉唑镁、艾普拉唑锌、艾普拉唑钾、艾普拉唑锂或艾普拉唑钙等。在此,本领域技术人员可以根据需要选择合适的盐。
22.根据本发明的一个实施方案,根据本发明的肠溶微丸的药丸芯还包含表面活性剂。优选地,所述表面活性剂为吐温80或十二烷基硫酸钠。
23.根据本发明的一个实施方案,第一隔离层中的水不溶性碱性化合物与艾普拉唑和/或其药学上可接受的盐的重量比为0.2~5:1,优选0.25~4:1,更优选0.3~3:1,尤其优选0.5~2:1,最优选0.8~1.2:1,例如1:1。
24.根据本发明的一个实施方案,第二隔离层中包含能够防止微丸发生粘连的水不溶性惰性物质,其与粘合剂的用量按重量计的比例在1~8:1.5~10,或者1-10:1~20,或者4~26:7~44范围内。
25.根据本发明的一个实施方案,艾普拉唑和/或艾普拉唑的药学上可接受的盐的粒径d90可以为选自任意两个下述端点之间的范围:0μm(在组成范围时不包括该点值)10μm,20μm,30μm,40μm,50μm,60μm,70μm,80μm,90μm,100μm。
26.本领域技术人员能够理解,本文中各个方面以及各个实施方案中的一个或更多个特征可以自由组合,以形成新的技术方案,同时通过这些组合获得的技术方案也落入本发明的范围之内。在下文进一步对本发明的技术方案、术语和原理进行阐述。
27.关于肠溶微丸的药丸芯:
28.根据本发明的肠溶微丸的药丸芯(或称为含药丸)可以是全活性药丸芯或包覆有载药层的空白微丸芯。在本文中,术语“全活性药丸芯”是指包含艾普拉唑和/或艾普拉唑的药学上可接受的盐和第一辅料,以及其他一种或多种可药用赋形剂的药丸芯,其中作为活性成分的艾普拉唑和/或艾普拉唑的药学上可接受的盐分散在其它成分(所述第一辅料和其他一种或多种可药用赋形剂等)中,而不独立地或者与任意其它成分一起形成另外的层;在包覆有载药层的空白微丸芯中,载药层包含艾普拉唑和/或艾普拉唑的药学上可接受的盐和第一辅料和任选的赋形剂。
29.当药丸芯中的艾普拉唑和/或其药学上可接受的盐仅在第一隔离层包含的水不溶性碱性化合物的作用下,无法实现足够的贮存稳定性时,另外在药丸芯中加入的第一辅料可以实现其贮存稳定性的提高。
30.药丸芯中的第一辅料可以为现有技术中用于提高酸不稳定性化合物的稳定性所使用的常规辅料。优选地,第一辅料为碱性化合物,包括水不溶性碱性化合物和水溶性碱性化合物。根据本发明优选地,使用水不溶性碱性化合物作为药丸芯中的第一辅料;更优选地,使药丸芯中包含的水不溶性碱性化合物与第一隔离层中包含的水不溶性碱性化合物相同,由此可以进一步增强隔离层缓冲ph的作用。在根据本发明的实施方案中,水不溶性碱性化合物可以选自,但不限于,氢氧化镁、氢氧化铝、氧化镁、碳酸镁、碳酸钙、氢氧化钙中的一种或更多种。优选地,碱性化合物与艾普拉唑和/或其药学上可接受的盐的重量比为0.2~5:1,优选0.25~4:1,更优选0.3~3:1,尤其优选0.5~2:1,最优选0.8~1.2:1,例如1:1。
31.根据本发明,在药丸芯中还可以包含表面活性剂。根据本发明的实施例结果证明,表面活性剂可以提高肠溶微丸及其制剂中的艾普拉唑和/或其药学上可接受的盐的溶出度,进而有效地改善它们的生物利用度。在根据本发明的实施例中,药丸芯包含的表面活性剂可以选自非离子表面活性剂、阴离子表面活性剂和两性离子表面活性剂。优选地,非离子表面活性剂可以选自聚乙二醇型、多元醇型(如吐温80)等;阴离子表面活性剂可以选自高级脂肪酸盐、硫酸酯盐、磺酸盐等,如十二烷基硫酸钠;两性离子表面活性剂可以选自磷酯类。
32.根据本发明,艾普拉唑和/或其药学上可接受的盐的粒径可以影响肠溶微丸的溶出度和/或载药量。在根据本发明的优选实施方案中,艾普拉唑和/或其药学上可接受的盐的粒径可以为粒径d90≤100μm;在这种情况下,肠溶微丸具有良好的溶出度,进而可以提高由肠溶微丸制备的肠溶微丸制剂的生物利用度。更优选地,艾普拉唑和/或其药学上可接受的盐的粒径d90可以为选自任意两个下述端点之间的范围:10μm,20μm,30μm,40μm,50μm,60μm,70μm,80μm,90μm,100μm,尤其是d90≤50μm,由此可以达到提高的载药量。
33.根据本发明的一个实施方案,上述空白微丸芯为现有技术中常规使用的空白微丸
芯。在根据本发明的实施方案中,空白微丸芯可以选自,但不限于,微晶纤维素丸芯、蔗糖丸芯或甘露醇丸芯,其粒径可以为50~500μm,优选100~400μm,更优选250~350μm,最优选约300μm。
34.根据本发明的一个实施方案,如上所述的载药层还可以包含粘合剂。粘合剂可以选自,但不限于,羟丙基纤维素、羟丙甲纤维素、羟甲基纤维素、羟乙基纤维素、羧甲基纤维素、甲基纤维素、聚乙烯吡咯烷酮、聚乙烯醇、聚乙二醇、糖浆和淀粉的一种或更多种。在根据本发明的实施方案中,粘合剂可以选自羟丙基纤维素-ssl(例如来自nisso的可商购系列)、羟丙甲纤维素e5、聚乙烯吡咯烷酮k30、聚乙烯醇、甲基纤维素和聚乙二醇的一种或更多种。
35.关于肠溶微丸的隔离层:
36.肠溶微丸的隔离层的基本功能是用于将处于碱性环境的药丸芯与含游离羧基的肠溶层隔离,以防止艾普拉唑和/或其药学上可接受的盐在包衣过程或在贮存过程中的降解或变色。在针对艾普拉唑肠溶微丸及其制剂的研究中,发明人发现,采用现有技术中的常规制备方法(例如在制备与药丸芯紧密相邻的隔离层时)通常使用的能够防止微丸发生粘连的水不溶性惰性物质(如滑石粉,二氧化硅,二氧化钛,硬脂酸镁等)和/或水溶性碱性化合物,以及在制备与肠溶层紧密相邻的隔离层时通常使用的碱性化合物,会降低肠溶微丸及其制剂的稳定性和/或耐酸性,尤其是对于稳定性相对低的酸不稳定性化合物如艾普拉唑而言,这导致其肠溶微丸及其制剂无法同时达到关于稳定性和耐酸性的要求。在本文中,术语“紧密相邻”是指肠溶微丸的药丸芯与其包衣或包覆层之间或者两个层彼此之间不存在另外的层。
37.导致该技术问题的原因之一,发明人经试验证明并认为(但不受此局限),与药丸芯紧密相邻的隔离层(对应于根据本发明的第一隔离层)中包含的能够防止微丸发生粘连的水不溶性惰性物质和药丸芯包含的酸不稳定性化合物两者之间的相容性由于酸不稳定性化合物的不同的稳定性而不同,即:在根据现有技术制备的肠溶微丸及其制剂中,当药丸芯包含的酸不稳定性化合物(如艾普拉唑)的稳定性低时,与药丸芯紧密相邻的隔离层中包含的能够防止微丸发生粘连的水不溶性惰性物质(如滑石粉)与酸不稳定性化合物的相容性也会降低。因此,即使在药丸芯和/或隔离层中包含的作为稳定剂的碱性化合物的保护下,依然会造成加速试验结果中有关物质(即杂质)的明显增加,从而降低肠溶微丸制剂的稳定性。这在一定程度上限制了能够适用于根据现有技术制备的肠溶微丸及其制剂的酸不稳定性化合物的范围,即:根据现有技术制备的肠溶微丸及其制剂的配方或组成无法很好地适用于稳定性相对低的艾普拉唑和/或其药学上可接受的盐。此外,当在与药丸芯紧密相邻的隔离层(对应于根据本发明的第一隔离层)包含水溶性碱性化合物时,在长期的高温高湿条件下,肠溶微丸的隔离层会吸入游离水而导致水溶性碱性化合物溶解,从而使得与肠溶层紧密相邻的隔离层的碱性升高而显碱性,当在酸性介质下肠溶层有水渗入时,造成肠溶层提前溶解,从而导致肠溶微丸及其制剂的耐酸性降低。由于与肠溶层紧密相邻的隔离层显碱性而导致肠溶层提前溶解的原理亦适用于当与肠溶层紧密相邻的隔离层(对应于根据本发明的第二隔离层)中包含碱性化合物的情况。
38.因此,根据本发明,肠溶微丸包括至少两个包含惰性物质的隔离层,即至少包括靠近药丸芯而与药丸芯紧密相邻的第一隔离层和与第一隔离层相比远离药丸芯或与肠溶层
紧密相邻的第二隔离层,其中,第一隔离层包含水不溶性碱性化合物,而不包含水溶性碱性化合物和能够防止微丸发生粘连的水不溶性惰性物质,第二隔离层不包含碱性化合物。当肠溶微丸包括三个或以上的隔离层时,位于第一隔离层与第二隔离层之间的其他隔离层可以是符合根据本发明的第一隔离层或者第二隔离层的定义的隔离层,也可以是现有技术中通常使用的隔离层。
39.根据本发明,水不溶性碱性化合物可以是现有技术中用于提高酸不稳定性化合物的稳定性通常使用的不溶于水的碱性化合物。在根据本发明的实施方案中,水不溶性碱性化合物可以选自,但不限于,氢氧化镁、氢氧化铝、氧化镁、碳酸镁、碳酸钙、氢氧化钙中的一种或更多种。
40.根据本发明,能够防止微丸发生粘连的水不溶性惰性物质可以选自药剂学中常规的一种或更多种润滑剂、助流剂和抗粘剂(亦即抗黏剂,下文同)一种或更多种。在根据本发明的实施方案中,能够防止微丸发生粘连的水不溶性惰性物质可以选自,但不限于,二氧化硅、硅酸钙、胶态二氧化硅、硅酸铝、硅酸铝钙、硅酸镁、硬脂酸钠、硬脂酸锌、硬脂酸镁、滑石粉和二氧化钛等。在根据本发明的艾普拉唑肠溶微丸的一个实施方案中,肠溶微丸的第一隔离层中不包含如下能够防止微丸发生粘连的水不溶性惰性物质:滑石粉、二氧化硅、二氧化钛和硬脂酸镁中的一种或更多种。
41.在根据本发明的优选实施方案中,第一隔离层主要由水不溶性碱性化合物和粘合剂组成,以及第二隔离层主要由能够防止微丸发生粘连的水不溶性惰性物质和粘合剂组成。根据本发明,通过调节第一隔离层中包含的水不溶性碱性化合物与粘合剂的用量或者第二隔离层中包含的能够防止微丸发生粘连的水不溶性惰性物质与粘合剂的用量,能够影响肠溶微丸制剂的溶出度,进而影响其生物利用度。例如,在根据本发明的艾普拉唑肠溶微丸片的优选实施方案中,各成分的配比可以为如下:当艾普拉唑用量为5~15重量份时,第一隔离层中包含粘合剂5~36重量份,水不溶性碱性化合物5~36重量份;第二隔离层中包含粘合剂4~26重量份,能够防止微丸发生粘连的水不溶性惰性物质7~44重量份。
42.上述粘合剂为根据现有技术的隔离层中通常使用粘合剂。根据本发明,粘合剂可以选自药用合格的水可溶性惰性化合物或用做包衣膜的聚合物,如羟丙基纤维素、羟丙甲纤维素、羟甲基纤维素、羟乙基纤维素、羧甲基纤维素、甲基纤维素、聚乙烯吡咯烷酮、聚乙烯醇、聚乙二醇、糖浆和淀粉中的一种或更多种。
43.关于肠溶微丸的肠溶层:
44.在现有技术中的肠溶微丸制剂通常使用的肠溶层也适用于本发明,例如cn87103285a(us4786505的中国同族)中记载了关于肠溶层的详细介绍;发明人将其作为参考,并将所述文献中与肠溶层相关的内容和其中引用的所有文献的相关内容引入本技术中。
45.根据本发明,肠溶层可以包含一种或更多种选自下组的物质:丙烯酸树脂类、羧甲乙纤维素等纤维素类、欧巴代等的肠溶包衣材料,以及任选的一种或更多种选自增塑剂、抗粘剂、润滑剂的添加剂。在根据本发明的实施方案中,肠溶层可以包含丙烯酸树脂类肠溶包衣材料、增塑剂(如聚乙二醇、三乙酸甘油酯、柠檬酸三乙酯、邻苯二甲酸酯等)、抗粘剂(如滑石粉、单硬脂酸甘油酯等)。其中,丙烯酸树脂类肠溶包衣材料选自醋酸邻苯二甲酸纤维素、邻苯二甲酸羟丙甲基纤维素、甲基丙烯酸共聚物的溶液或分散液l30d55、醋酸琥珀酸羟
丙甲基纤维素、聚乙酸邻苯二甲酸乙烯、虫胶中的一种或更多种。在根据本发明的艾普拉唑肠溶微丸的优选实施方案中,肠溶层所含的肠溶包衣材料与艾普拉唑和/或其药学上可接受的盐重量比为2~20:1。在根据本发明的艾普拉唑肠溶微丸的优选实施方案中,增塑剂与艾普拉唑和/或其药学上可接受的盐重量比为0.6~6:1,优选0.8~4:1,更优选1~2:1。
46.关于肠溶微丸的保护层:
47.根据本发明,肠溶微丸还可以在肠溶层外侧设有保护层,优选保护层与肠溶层紧密相邻。所述保护层可以防止在制备成制剂之前的放置过程、或者在其制剂的制备过程中、或者制备成制剂后的放置过程中各种半成品/产品之间可能发生的粘连。此外,设置保护层还可以有效地提高肠溶微丸的溶出度,从而改善由其制备的肠溶微丸制剂的生物利用度。
48.在根据本发明的实施方案中,保护层可以包含粘合剂以及抗粘剂。粘合剂可以选自羟丙甲纤维素、羟丙基纤维素、聚乙烯吡咯烷酮、聚乙烯醇、甲基纤维素和聚乙二醇中的一种或更多种。抗粘剂可以选自滑石粉、硬脂酸镁、二氧化钛和二氧化硅中的一种或更多种。
49.根据本发明,增大保护层中的抗粘剂的用量可以提高肠溶微丸的耐酸性。在根据本发明的艾普拉唑肠溶微丸的优选实施方案中,当艾普拉唑和/或其药学上可接受的盐为5~15重量份时,抗粘剂的用量为0.5~5重量份。
50.根据本发明的第四方面,本发明提供了肠溶微丸的制备方法,所述方法至少包括以下步骤:1)制备包含艾普拉唑和/或艾普拉唑的药学上可接受的盐和第一辅料的药丸芯;2)包覆第一隔离层和之后包覆第二隔离层;以及3)包覆肠溶层。
51.优选地,在步骤2)包括:制备包含水不溶性碱性化合物并且不包含水溶性碱性化合物和能够防止微丸发生粘连的水不溶性惰性物质的第一混悬液,并将第一混悬液包覆在步骤1)中获得的药丸芯上;制备不包含碱性化合物的第二混悬液,并将第二混悬液包覆为第二隔离层,优选作为与肠溶层紧密相邻的第二隔离层进行包覆;
52.优选地,在步骤1)中,所述第一辅料与所述第一隔离层包含的水不溶性碱性化合物共同作用,从而使得艾普拉唑和/或艾普拉唑的药学上可接受的盐实现贮存稳定性。
53.优选地,肠溶微丸的制备方法还包括步骤4):包覆保护层。
54.在根据本发明的实施方案中,肠溶微丸的制备方法可以包括下述步骤的一个或更多个:
55.1)通过例如流化床法在空白微丸芯上包覆载药层,制备药丸芯,载药层包含艾普拉唑和/或艾普拉唑的药学上可接受的盐、作为第一辅料的碱性化合物以及粘合剂;
56.2)通过例如流化床法从内向外地分别将至少第一混悬液和第二混悬液包覆到在步骤1)中所获得的药丸芯上,其中,第一混悬液包含水不溶性碱性化合物,而不包含水溶性碱性化合物和能够防止微丸发生粘连的水不溶性惰性物质,形成第一隔离层;第二混悬液不包含碱性化合物,形成第二隔离层;由此制备隔离丸;
57.3)将肠溶包衣材料和选自增塑剂、抗粘剂、润滑剂和乳化剂的一种或更多种制成肠溶层混悬液;通过例如流化床法,将肠溶层混悬液包覆在步骤2)中获得的隔离丸上,制备肠溶微丸。
58.优选地,上述肠溶微丸的制备方法还可以包括步骤4):将选自羟丙基纤维素、羟丙甲纤维素、甲基纤维素、聚乙烯吡咯烷酮、聚乙烯醇、羧甲基纤维素和聚乙二醇中的一种或
更多种的粘合剂加入纯化水中,制备保护层包衣液,通过例如流化床法,将保护层包衣液包覆到在步骤3)中所获得的肠溶微丸上,制备具有保护层的肠溶微丸。
59.根据本发明,可选地,可以使用上述根据本发明的肠溶微丸制备艾普拉唑肠溶微丸制剂,肠溶微丸制剂的剂型可以是片剂、胶囊剂、干混悬剂或者丸剂。
60.根据本发明的第五方面,本发明提供了一种艾普拉唑肠溶微丸片,该肠溶微丸片包含根据本发明的肠溶微丸和压片辅料(第二辅料,以区别于肠溶微丸的药丸芯中所述的辅料)。
61.可选地,该肠溶微丸片还包括薄膜衣。
62.根据本发明,用于制备肠溶微丸片的肠溶微丸可以为包含保护层的肠溶微丸或者不包含保护层的肠溶微丸。
63.根据本发明,压片辅料可以为本领域现有技术中对肠溶微丸片进行压片时所使用的常规压片辅料。在根据本发明的实施方案中,压片辅料包括填充剂、稀释剂、崩解剂和润滑剂,其中,填充剂和/或稀释剂可以选自,但不限于,淀粉、预胶化淀粉、乳糖、甘露醇以及微晶纤维素中的一种或更多种;崩解剂可以选自,但不限于,交联聚维酮、交联羧甲基纤维素钠和交联羧甲基淀粉钠中的一种或更多种;润滑剂可以选自,但不限于,滑石粉、硬脂酸镁、硬脂富马酸钠和二氧化硅中的一种或更多种。
64.根据本发明,薄膜衣可以为本领域现有技术中对肠溶微丸片进行薄膜包衣时所使用的常规薄膜衣。在根据本发明的实施方案中,薄膜衣包括包衣粉,包衣粉可以选自,但不限于,羟丙基纤维素、聚乙烯吡咯烷酮、聚乙烯醇、甲基纤维素、聚乙二醇、滑石粉、色淀和欧巴代胃溶中的一种或更多种。
65.将根据本发明的肠溶微丸制备成肠溶微丸片的压片方法,以及可选地包覆薄膜衣的方法,均为本领域现有技术中对肠溶微丸片进行压片和包衣的常规方法。
66.根据本发明的第六方面,本发明提供了一种艾普拉唑肠溶微丸胶囊,该肠溶微丸胶囊包括根据本发明的具有保护层的上述肠溶微丸。
67.根据本发明,胶囊可以为本领域现有技术中根据所需用量规格用于填充肠溶微丸时所使用的常规胶囊;例如,胶囊可以为使用胶囊封口材料进行密封的胶囊壳;其中,胶囊的胶囊壳材料可以选自,但不限于,明胶、淀粉、海藻酸钠和羟丙基甲基纤维素中的一种或更多种;该胶囊封口材料可以选自,但不限于,明胶、羟丙甲基纤维素、甲基纤维素、丙烯酸树脂、β-环糊精、乙基纤维素、改性淀粉、醋酸纤维素、聚乙烯吡咯烷酮(pvp)、聚乙烯醇(pva)和羧甲基纤维素钠中的一种或更多种。
68.将根据本发明的肠溶微丸制备成肠溶微丸片胶囊的方法,可以为本领域现有技术中制备肠溶微丸胶囊的常规方法。
69.根据本发明的第七方面,本发明提供了一种艾普拉唑微丸干混悬剂,其包含根据本发明的肠溶微丸和干混悬颗粒。
70.将根据本发明的肠溶微丸制备成肠溶微丸干混悬剂的方法可以为本领域现有技术中制备肠溶微丸干混悬剂的常规方法。
71.在已在进行的动物实验研究中,发明人发现,包含根据本发明的肠溶微丸的制剂在胃肠道疾病的治疗和/或预防方面表现出有益的效果,所述胃肠道疾病主要包括胃灼热、炎性肠病、克罗恩病、过敏性肠综合征、溃疡性结肠炎、消化性溃疡、应激性溃疡、出血性消
化性溃疡、十二指肠溃疡及十二指肠溃疡复发、与nsaid相关的胃溃疡、成人活动性良性胃溃疡、感染性肠炎、结肠炎、胃酸过多症、消化不良、胃轻瘫、佐林格-埃利森综合征、胃食管返流疾病(gerd)、幽门螺旋杆菌相关的疾病或根除幽门螺旋杆菌、所有级别的糜烂性食管炎、短肠综合征,或者任何以上疾病的组合。
72.因此,根据本发明的第八方面,本发明提供了一种治疗和/或预防胃肠道疾病的方法。该方法包括给需要此治疗和/或预防的患者施用治疗和/或预防有效量的根据本发明的肠溶微丸制剂的步骤。在根据本发明的实施方案中,根据本发明的肠溶微丸制剂为根据本发明的艾普拉唑肠溶微丸片、艾普拉唑肠溶微丸胶囊或者艾普拉唑肠溶微丸干混悬剂。其中,可使用该方法治疗和/或预防的胃肠道疾病包括,但不限于,胃灼热、炎性肠病、克罗恩病、过敏性肠综合征、溃疡性结肠炎、消化性溃疡、应激性溃疡、出血性消化性溃疡、十二指肠溃疡及十二指肠溃疡复发、与nsaid相关的胃溃疡、成人活动性良性胃溃疡、感染性肠炎、结肠炎、胃酸过多症、消化不良、胃轻瘫、佐林格-埃利森综合征、胃食管返流疾病(gerd)、幽门螺旋杆菌相关的疾病或根除幽门螺旋杆菌、所有级别的糜烂性食管炎、短肠综合征,或者任何以上疾病的组合。
73.相应地,根据本发明的第九方面,本发明提供了根据本发明的肠溶微丸及其制剂在制备治疗和/或预防胃肠道疾病的药物时的用途,所述胃肠道疾病包括,但不限于,胃灼热、炎性肠病、克罗恩病、过敏性肠综合征、溃疡性结肠炎、消化性溃疡、应激性溃疡、出血性消化性溃疡、十二指肠溃疡及十二指肠溃疡复发、与nsaid相关的胃溃疡、成人活动性良性胃溃疡、感染性肠炎、结肠炎、胃酸过多症、消化不良、胃轻瘫、佐林格-埃利森综合征、胃食管返流疾病(gerd)、幽门螺旋杆菌相关的疾病或根除幽门螺旋杆菌、所有级别的糜烂性食管炎、短肠综合征,或者任何以上疾病的组合。
74.更进一步地,本发明的肠溶微丸及其制剂在用于制备治疗和/或预防胃肠道疾病的药物时,所述胃肠道疾病包括,但不限于,十二指肠溃疡及溃疡复发,胃溃疡,胃食管返流疾病(gerd),幽门螺旋杆菌相关的疾病;或所述药物可用于根除幽门螺旋杆菌,还可以预防非甾体抗炎药造成的消化性溃疡疾病,预防抗血小板聚集药物(包括,但不限于氯吡格雷、普拉格雷、替格瑞洛)等造成的胃肠道出血及相关的溃疡。
75.在本发明中,发明人发现并排除了制约艾普拉唑肠溶微丸及其制剂无法同时具有良好的稳定性和耐酸性(尤其是耐酸性)的影响因素,并且通过本发明的技术方案,达到了如下的有益效果:
76.1)通过在艾普拉唑的肠溶微丸中设置至少两个隔离层(第一隔离层和第二隔离层以及任选的其它隔离层)并限定这些隔离层(尤其是第一隔离层和第二隔离层)的组成,根据本发明的肠溶微丸及其制剂能够同时具有更良好的稳定性和耐酸性。
77.2)通过调节艾普拉唑和/或其药学上可接受的盐的粒径,调节第一隔离层中水不溶性碱性化合物与粘合剂的重量比、或者调节该第二隔离层中能够防止微丸发生粘连的水不溶性惰性物质与粘合剂的重量比,或者额外地包覆保护层,可以使得根据本发明的肠溶微丸及其制剂具有提高的活性成分溶出度,从而可以实现提高的生物利用度。
78.3)本发明所述的艾普拉唑肠溶微丸及其制剂具有良好的人体内抑酸效果,在服用后1h内就可抑制胃酸到ph 4以上,达到临床起效效果。根据本发明的肠溶微丸片能达到快速起效的效果,从而更快速地解除患者的痛苦。
附图说明
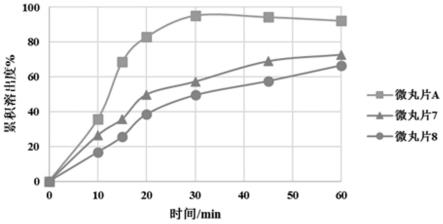
79.图1为根据本发明的微丸片与具有不同隔离层处方的对比微丸片7和8(图中简称微丸片7、微丸片8)在加速稳定性测试中的累积溶出度。
80.图2为根据本发明的微丸片与具有不同药丸层的对比微丸片11和16(图中简称微丸片11、微丸片16)在加速稳定性测试中的累积溶出度。
81.图3为根据本发明的微丸片与具有不同艾普拉唑粒径的药芯丸处方的对比微丸片3和4(图中简称微丸片3、微丸片4)在加速稳定性测试中的累积溶出度。
82.图4为根据本发明的微丸片与不具有保护层的对比微丸片12(图中简称微丸片12)在加速稳定性测试中的累积溶出度。
83.图5为根据本发明的微丸片与根据现有技术方法制备的对比微丸片1和对比微丸片2(图中简称微丸片1、微丸片2)在人体胃内ph实时检测平均值记录。
84.图6为根据本发明的微丸片与根据现有技术方法制备的对比微丸片1和对比微丸片2(图中简称微丸片1、微丸片2)在比格犬体内的血药浓度变化曲线。
具体实施方式
85.在本章节中,将主要以艾普拉唑的根据本发明的肠溶微丸片剂和干混悬剂为优选例,示例性地示出根据本发明的肠溶微丸制剂及其制备方法。
86.其中,该艾普拉唑肠溶微丸片包括微丸(其从内向外依次包括药丸芯、第一隔离层、第二隔离层、肠溶层和保护层)、压片辅料和薄膜衣;其中,药丸芯包括空白微丸芯和载药层,载药层包含艾普拉唑和/或艾普拉唑的药学上可接受的盐(其粒径d90优选为≤50μm)、碱性化合物、表面活性剂以及粘合剂;该第一隔离层包含水不溶性碱性化合物和粘合剂,而不包含水溶性碱性化合物和能够防止微丸发生粘连的水不溶性惰性物质;该第二隔离层主要包含粘合剂和能够防止微丸发生粘连的水不溶性惰性物质(如可以作为抗粘剂的滑石粉、二氧化硅、二氧化钛、硬脂酸镁等),而不包含碱性化合物。
87.优选地,该药丸芯中包含的碱性化合物为水不溶性碱性化合物;更优选地,该药丸芯中包含的水不溶性碱性化合物与该第一隔离层中所包含的水不溶性碱性化合物相同。
88.具体地,该艾普拉唑肠溶微丸片中各组成及配比可以,但不限于,如下所示:(以重量份为单位)
89.艾普拉唑肠溶微丸:
90.1)药丸芯:
91.空白微丸芯
ꢀꢀ
5~15;
92.载药层,包括:
93.艾普拉唑(或其药学上可接受的盐)
ꢀꢀ
5~15;
94.碱性化合物
ꢀꢀ
5~15;
95.表面活性剂
ꢀꢀ
0.2~0.6;
96.粘合剂
ꢀꢀ
8~24;
97.2)第一隔离层:
98.粘合剂
ꢀꢀ
5~36;
99.水不溶性碱性化合物
ꢀꢀ
5~36;
100.3)第二隔离层:
101.粘合剂
ꢀꢀ
4~26;
102.抗粘剂
ꢀꢀ
7~44;
103.4)肠溶层:
104.肠溶包衣材料30~100(指固含量);
105.抗粘剂
ꢀꢀ
1~5;
106.增塑剂
ꢀꢀ
9~30;
107.5)保护层:
108.粘合剂
ꢀꢀ
0.5~4;
109.抗粘剂
ꢀꢀ
0.5~5;
110.压片
111.6)压片辅料:
[0112][0113]
7)薄膜衣:
[0114]
包衣粉
ꢀꢀ
10~40。
[0115]
该肠溶微丸片同时具有很高的稳定性和耐酸性,适用于稳定性很低的艾普拉唑;并且,该艾普拉唑肠溶微丸片还具有良好的载药量和很高的溶出度/生物利用度。
[0116]
下面结合具体实施例和附图对本发明作进一步的说明,但本发明不应受到下面公开的具体实施例的限制。下述实施例中所用方法如无特别说明均为常规方法。对下述实施例中的测试数据结果所能够表明的结论,可以是本领域技术人员能够基于本领域常识而合理推论得出的结论,而不局限于下面公开的文字记载。
[0117]
实施例1:肠溶微丸的制备
[0118]
在本实施例1中,将以艾普拉唑和/或其药学上可接受的盐为例,制备根据本发明的肠溶微丸a-g,以及制备用于比较肠溶微丸各组成层的不同处方对肠溶微丸及其制剂的性能的影响的对比微丸3-18。其中,与根据本发明的肠溶微丸a-g相比,对比微丸3和4在载药层中具有不同的艾普拉唑粒径;对比微丸5-10、14-15具有不同的隔离层;对比微丸11、16、17具有改变处方的载药层;以及对微丸12-13具有不同的保护层;对比微丸18具有改变的艾普拉唑和/或其药学上可接受的盐与第一辅料的比例。
[0119]
(一)肠溶微丸各组成层的制备处方:
[0120]
1.1含药丸(w)的制备处方、方法、以及其含药丸上药率
[0121]
在本实施例中制备的是包括空白微丸芯和载药层的含药丸(即药丸芯)。
[0122]
1)含药丸处方w1(单位:g)
[0123]
艾普拉唑(粒径d90为46.8μm)100蔗糖丸芯(粒径250-350μm)100氢氧化镁100
聚山梨酯804羟丙基纤维素-ssl150纯化水3000
[0124]
制备过程:
[0125]
称取150g羟丙基纤维素-ssl、4g聚山梨酯80溶于3000g纯化水中得羟丙基纤维素粘合剂溶液,然后将100g氢氧化镁加入到粘合剂溶液中,采用高剪切分散10000rpm分散5min,然后将d90粒径为46.8μm的艾普拉唑原料100g分散到含氢氧化镁的粘合剂中,10000rpm高剪切分散均匀,然后通过glatt gpcg-1流化床将艾普拉唑药物混悬液喷涂到蔗糖丸芯上。
[0126]
具体工艺参数如下:
[0127][0128]
w1含药丸上药率=(含药丸实际含量)/(含药丸理论含量)
×
100%=95.6%
[0129]
2)含药丸处方w2(单位:g)
[0130]
艾普拉唑镁(粒径d90≤50μm)50微晶纤维素丸芯50羟丙基纤维素-ssl100十二烷基硫酸钠2碳酸镁150纯化水2000
[0131]
制备过程:
[0132]
称取处方量100g羟丙基纤维素-ssl、2g十二烷基硫酸钠溶于2000g纯化水中,加入150g碳酸镁高剪切10000rpm分散5min;然后将50g艾普拉唑镁分散到含碳酸镁的粘合剂中,10000rpm高剪切分散均匀,通过glatt gpcg-1流化床,将艾普拉唑镁药物混悬液喷到微晶纤维素丸芯上。
[0133]
具体工艺参数如下:
[0134][0135]
w2含药丸上药率=(含药丸实际含量)/(含药丸理论含量)
×
100%=91.4%
[0136]
3)含药丸处方w3(单位:g)
[0137][0138][0139]
制备过程:
[0140]
称取处方量240g聚乙烯吡咯烷酮k30、6g十二烷基硫酸钠溶于4800g纯化水中,加入150g碳酸钙10000rpm高剪切分散均匀,然后将150g艾普拉唑锌分散到含碳酸钙的粘合剂中,10000rpm高剪切分散均匀,通过glatt gpcg-1流化床,将艾普拉唑锌药物混悬液喷到蔗糖丸芯上。
[0141]
具体工艺参数如下:
[0142][0143]
w3含药丸上药率=(含药丸实际含量)/(含药丸理论含量)
×
100%=92.4%
[0144]
4)含药丸处方w4(单位:g)
[0145]
艾普拉唑(粒径d90≤50μm)150甘露醇丸芯100聚乙烯吡咯烷酮k30180聚山梨酯806
氧化镁50纯化水3000
[0146]
制备过程:
[0147]
称取处方量180g聚乙烯吡咯烷酮k30、6g聚山梨酯80溶于3000g纯化水中,加入50g氧化镁,10000rpm高剪切分散均匀,然后将150g艾普拉唑分散到含氧化镁的粘合剂中,10000rpm高剪切分散均匀,通过glatt gpcg-1流化床,将艾普拉唑药物混悬液喷到甘露醇丸芯上。
[0148]
具体工艺参数如下:
[0149][0150][0151]
w4含药丸上药率=(含药丸实际含量)/(含药丸理论含量)
×
100%=93.3%
[0152]
5)含药丸处方w5(单位:g)
[0153]
艾普拉唑(粒径d90≤50μm)150蔗糖丸芯150羟丙甲纤维素e580聚山梨酯806氢氧化镁50纯化水1600
[0154]
制备过程:
[0155]
称取处方量80g羟丙甲纤维素e5、6g聚山梨酯80溶于1600g纯化水中,加入50g氢氧化镁,10000rpm高剪切分散均匀,然后将150g艾普拉唑分散到含氢氧化镁的粘合剂中,10000rpm高剪切分散均匀,通过glatt gpcg-1流化床,将艾普拉唑药物混悬液喷到蔗糖丸芯上。
[0156]
具体工艺参数如下:
[0157]
[0158]
w5含药丸上药率=(含药丸实际含量)/(含药丸理论含量)
×
100%=94.1%
[0159]
6)含药丸处方w6(单位:g)
[0160]
艾普拉唑(粒径d90≤50μm)100蔗糖丸芯(250-350μm)100羟丙基纤维素-ssl100纯化水3000
[0161]
制备过程:
[0162]
称取处方量100g羟丙基纤维素-ssl溶于3000g纯化水中得羟丙基纤维素粘合剂溶液,然后将100g艾普拉唑原料分散到粘合剂溶液中,10000rpm高剪切分散均匀,然后通过glatt gpcg-1流化床将艾普拉唑药物混悬液喷涂到蔗糖丸芯上。
[0163]
具体工艺参数如下:
[0164][0165]
w6含药丸上药率=(含药丸实际含量)/(含药丸理论含量)
×
100%=93.4%
[0166]
7)含药丸处方w7(单位:g)
[0167]
艾普拉唑(粒径d90≤50μm)100蔗糖丸芯(250-350μm)100氢氧化镁100羟丙基纤维素-ssl100纯化水3000
[0168]
制备过程:
[0169]
称取处方量100g羟丙基纤维素-ssl溶于3000g纯化水中得羟丙基纤维素粘合剂溶液,然后将100g艾普拉唑原料和100g氢氧化镁分散到粘合剂溶液中,10000rpm高剪切分散均匀,然后通过glatt gpcg-1流化床将艾普拉唑药物混悬液喷涂到蔗糖丸芯上。
[0170]
具体工艺参数如下:
[0171][0172]
w7含药丸上药率=(含药丸实际含量)/(含药丸理论含量)
×
100%=95.4%
[0173]
8)含药丸处方w8
[0174]
同含药丸处方w1,不同之处仅在于艾普拉唑粒径d90大于等于80μm且小于等于100μm。w8含药丸上药率=(含药丸实际含量)/(含药丸理论含量)
×
100%=87.2%
[0175]
9)含药丸处方w9
[0176]
同含药丸处方w1,不同之处仅在于艾普拉唑粒径d90>100μm。w9含药丸上药率=(含药丸实际含量)/(含药丸理论含量)
×
100%=79.3%
[0177]
10)含药丸处方w10(单位:g)
[0178]
艾普拉唑(粒径d90为46.8μm)100蔗糖丸芯(粒径250-350μm)100聚山梨酯804羟丙基纤维素-ssl150纯化水3000
[0179]
制备过程:
[0180]
称取150g羟丙基纤维素-ssl、4g聚山梨酯80溶于3000g纯化水中得羟丙基纤维素粘合剂溶液,然后将d90粒径为46.8μm的艾普拉唑原料100g分散到含聚山梨酯80的粘合剂中,10000rpm高剪切分散均匀,然后通过glatt gpcg-1流化床将艾普拉唑药物混悬液喷涂到蔗糖丸芯上。
[0181]
具体工艺参数如下:
[0182][0183]w10
含药丸上药率=(含药丸实际含量)/(含药丸理论含量)
×
100%=97.6%w11)含药丸处方w11(单位:g)
[0184]
艾普拉唑镁(粒径d90≤50μm)50
微晶纤维素丸芯50羟丙基纤维素-ssl100十二烷基硫酸钠2碳酸镁200纯化水2000
[0185]
制备过程:
[0186]
称取处方量100g羟丙基纤维素-ssl、2g十二烷基硫酸钠溶于2000g纯化水中,加入200g碳酸镁高剪切10000rpm分散5min;然后将50g艾普拉唑镁分散到含碳酸镁的粘合剂中,10000rpm高剪切分散均匀,通过glatt gpcg-1流化床,将艾普拉唑镁药物混悬液喷到微晶纤维素丸芯上。
[0187]
具体工艺参数如下:
[0188][0189]w11
含药丸上药率=(含药丸实际含量)/(含药丸理论含量)
×
100%=92.5%
[0190]
12)含药丸处方w12(单位:g)
[0191]
艾普拉唑(粒径d90≤50μm)200蔗糖丸芯150羟丙甲纤维素e5100聚山梨酯806氢氧化镁50纯化水2000
[0192]
制备过程:
[0193]
称取处方量100g羟丙甲纤维素e5、6g聚山梨酯80溶于2000g纯化水中,加入50g氢氧化镁,10000rpm高剪切分散均匀,然后将200g艾普拉唑分散到含氢氧化镁的粘合剂中,10000rpm高剪切分散均匀,通过glatt gpcg-1流化床,将艾普拉唑药物混悬液喷到蔗糖丸芯上。
[0194]
具体工艺参数如下:
[0195][0196]w12
含药丸上药率=(含药丸实际含量)/(含药丸理论含量)
×
100%=93.8%
[0197]
13)含药丸处方w13(单位:g)
[0198]
艾普拉唑(粒径d90≤50μm)180微晶纤维素丸芯50羟丙基纤维素-ssl100十二烷基硫酸钠2碳酸镁30纯化水2000
[0199]
制备过程:
[0200]
称取处方量100g羟丙基纤维素-ssl、2g十二烷基硫酸钠溶于2000g纯化水中,加入30g碳酸镁高剪切10000rpm分散5min;然后将180g艾普拉唑分散到含碳酸镁的粘合剂中,10000rpm高剪切分散均匀,通过glatt gpcg-1流化床,将艾普拉唑药物混悬液喷到微晶纤维素丸芯上。
[0201]
具体工艺参数如下:
[0202][0203]w13
含药丸上药率=(含药丸实际含量)/(含药丸理论含量)
×
100%=94.5%
[0204]
1.2隔离层(g)的制备处方
[0205]
1)隔离层处方g1(单位:g)
[0206][0207]
制备过程:
[0208]
称取处方量10g羟丙基纤维素-ssl溶于200g纯化水中,然后加入10g碳酸镁,10000rpm高剪切分散均匀,制备第一层隔离衣处方。称取8g羟丙基纤维素-ssl溶于160g纯化水中,加入14g滑石粉,10000rpm高剪切分散均匀,制备第二层隔离衣处方。通过glatt gpcg-1流化床,先后将两层隔离混悬液,喷到含药丸芯上。
[0209]
具体工艺参数如下:
[0210][0211]
2)隔离层处方g2(单位:g)
[0212]
[0213]
制备过程:
[0214]
称取处方量23g羟丙基纤维素-ssl溶于460g纯化水中,然后加入23g碳酸镁,10000rpm高剪切分散均匀,制备第一层隔离衣处方。称取17.2g羟丙基纤维素-ssl溶于344g纯化水中,加入28.8g滑石粉,10000rpm高剪切分散均匀,制备第二层隔离衣处方。通过glatt gpcg-1流化床,先后将两层隔离混悬液,喷到含药丸芯上。
[0215]
具体工艺参数参见上述隔离层处方g1。
[0216]
3)隔离层处方g3(用于对比微丸7)(单位:g)
[0217][0218]
制备过程:
[0219]
称取处方量88g羟丙基纤维素-ssl溶到1140g纯化水中,然后加入88g碳酸镁,10000rpm高剪切分散均匀,制备第一层隔离衣处方。称取17.2g羟丙基纤维素-ssl溶到520g纯化水中,加入28.8g滑石粉,10000rpm高剪切分散均匀,制备第二层隔离衣处方。通过glatt gpcg-1流化床,先后将两层隔离混悬液,喷到含药丸芯上。
[0220]
具体工艺参数参见上述隔离层处方g1。
[0221]
4)隔离层处方g4(用于对比微丸9)(单位:g)
[0222]
[0223]
制备过程:
[0224]
称取处方量23g羟丙基纤维素-ssl溶于460g纯化水中,然后加入23g碳酸镁、11.5g滑石粉,10000rpm高剪切分散均匀,制备第一层隔离衣处方。称取17.2g羟丙基纤维素-ssl溶于344g纯化水中,加入28.8g滑石粉,10000rpm高剪切分散均匀,制备第二层隔离衣处方。通过glatt gpcg-1流化床,先后将两层隔离混悬液,喷到含药丸芯上。
[0225]
具体工艺参数参见上述隔离层处方g1。
[0226]
5)隔离层处方g5(用于对比微丸10)(单位:g)
[0227][0228]
制备过程:
[0229]
称取处方量23g羟丙基纤维素-ssl溶于460g纯化水中,然后加入23g碳酸钠,10000rpm高剪切分散均匀,制备第一层隔离衣处方。称取17.2g羟丙基纤维素-ssl溶于344g纯化水中,加入28.8g滑石粉,10000rpm高剪切分散均匀,制备第二层隔离衣处方。通过glatt gpcg-1流化床,先后将两层隔离混悬液,喷到含药丸芯上。
[0230]
具体工艺参数参见上述隔离层处方g1。
[0231]
6)隔离层处方g6(用于对比微丸5)(单位:g)
[0232]
艾普拉唑含药丸90羟丙基纤维素ssl33滑石粉57纯化水890
[0233]
制备过程:
[0234]
称取处方量33g羟丙基纤维素-ssl溶于890g纯化水中,然后加入57g滑石粉,10000rpm高剪切分散均匀,制备隔离层包衣液。通过glatt gpcg-1流化床,然后将隔离混悬液,喷到含药丸芯上。
[0235]
具体工艺参数参见上述隔离层处方g1。
[0236]
7)隔离层处方g7(用于对比微丸6)(单位:g)
[0237]
[0238][0239]
制备过程:
[0240]
称取处方量23g聚维酮k30溶于460g纯化水中,然后加入23g二氧化钛,10000rpm高剪切分散均匀,制备第一层隔离层包衣液。称取26g聚维酮k30溶于520g纯化水中,然后加入44g二氧化硅,10000rpm高剪切分散均匀,制备第二层隔离层包衣液;通过glatt gpcg-1流化床,先后将两层隔离混悬液,喷到含药丸芯上。
[0241]
具体工艺参数参见上述隔离层处方g1。
[0242]
8)隔离层处方g8(用于对比微丸8)(单位:g)
[0243][0244]
制备过程:
[0245]
称取处方量23g羟丙基纤维素-ssl溶于720g纯化水中,然后加入23g碳酸镁,10000rpm高剪切分散均匀,制备第一层隔离衣处方。称取52g羟丙基纤维素-ssl溶于1040g纯化水中,加入100g滑石粉,10000rpm高剪切分散均匀,制备第二层隔离衣处方。通过glatt gpcg-1流化床,先后将两层隔离混悬液,喷到含药丸芯上。
[0246]
具体工艺参数参见上述隔离层处方g1。
[0247]
9)隔离层处方g9(用于对比微丸14)(单位:g)
[0248][0249]
制备过程:
[0250]
称取处方量10g羟丙基纤维素-ssl、5g碳酸钠、5g滑石粉溶于200g纯化水中,制备第一层隔离衣处方。称取8g羟丙基纤维素-ssl溶于160g纯化水中,加入14g滑石粉,10000rpm高剪切分散均匀,制备第二层隔离衣处方。通过glatt gpcg-1流化床,先后将两层隔离混悬液,喷到含药丸芯上。
[0251]
具体工艺参数参见上述隔离层处方g1。
[0252]
10)隔离层处方g10(单位:g)
[0253][0254]
制备过程:
[0255]
称取处方量15g羟丙甲纤维素-e5溶于300g纯化水中,然后加入15g氧化镁,10000rpm高剪切分散均匀,制备第一层隔离衣处方。称取12g羟丙甲纤维素-e5溶于240g纯化水中,加入21g二氧化钛,10000rpm高剪切分散均匀,制备第二层隔离衣处方。通过glatt gpcg-1流化床,先后将两层隔离混悬液,喷到含药丸芯上。
[0256]
具体工艺参数参见上述隔离层处方g1。
[0257]
11)隔离层处方g11(单位:g)
[0258][0259]
制备过程:
[0260]
称取处方量20g羟丙基纤维素-ssl溶于400g纯化水中,然后加入20g氢氧化镁,10000rpm高剪切分散均匀,制备第一层隔离衣处方。称取8g羟丙基纤维素-ssl溶于160g纯化水中,加入14g滑石粉,10000rpm高剪切分散均匀,制备第二层隔离衣处方。通过glatt gpcg-1流化床,先后将两层隔离混悬液,喷到含药丸芯上。
[0261]
具体工艺参数参见上述隔离层处方g1。
[0262]
12)隔离层处方g12(单位:g)
[0263][0264]
制备过程:
[0265]
称取处方量23g羟丙基纤维素-ssl溶于460g纯化水中,然后加入23g氢氧化镁,10000rpm高剪切分散均匀,制备第一层隔离衣处方。称取46g羟丙基纤维素-ssl溶于920g纯化水中,制备第二层隔离衣处方。通过glatt gpcg-1流化床,先后将两层隔离混悬液,喷到含药丸芯上。
[0266]
具体工艺参数参见上述隔离层处方g1。
[0267]
1.3肠溶层(c)的制备处方
[0268]
肠溶层处方c1(单位:g)
[0269]
艾普拉唑隔离丸92
尤特奇l30d-55223.8滑石粉3.4柠檬酸三乙酯20.1纯化水447.6
[0270]
制备过程:
[0271]
称取处方量20.1g柠檬酸三乙酯溶于447.6g纯化水中,加入3.4g滑石粉,10000rpm高剪切分散均匀,然后与223.8g尤特奇l30d-55搅拌45min备用,通过glatt gpcg-1流化床,肠溶包衣液,喷到隔离微丸上。
[0272]
具体工艺参数如下:
[0273][0274]
1.4保护层(b)的制备
[0275]
1)保护层处方b1(单位:g)
[0276]
艾普拉唑肠溶微丸100羟丙甲纤维素e52.5硬脂酸镁1.2纯化水50
[0277]
制备过程:
[0278]
称取处方量2.5g羟丙甲纤维素e5溶于50g纯化水中,然后加入1.2g硬脂酸镁,5000rpm高剪切分散均匀,制得保护层包衣液。通过glatt gpcg-1流化床,将保护层包衣液,喷到肠溶微丸上。
[0279]
具体工艺参数如下:
[0280][0281]
2)保护层处方b2(单位:g)
[0282]
艾普拉唑肠溶微丸100
羟丙基纤维素-ssl0.5硬脂酸镁0.5纯化水10
[0283]
制备过程:
[0284]
称取处方量0.5g羟丙基纤维素-ssl溶于10g纯化水中,然后加入0.5g硬脂酸镁,3000rpm高剪切分散均匀,制得保护层包衣液。通过glatt gpcg-1流化床,将保护层包衣液,喷到肠溶微丸上。
[0285]
具体工艺参数参见上述保护层处方b1。
[0286]
3)保护层处方b3(单位:g)
[0287]
艾普拉唑肠溶微丸100羟丙基纤维素-ssl4硬脂酸镁5纯化水80
[0288]
制备过程:
[0289]
称取处方量4g羟丙基纤维素-ssl溶于80g纯化水中,然后加入5g硬脂酸镁,5000rpm高剪切分散均匀,制得保护层包衣液。通过glatt gpcg-1流化床,将保护层包衣液,喷到肠溶微丸上。
[0290]
具体工艺参数参见上述保护层处方b1。
[0291]
4)保护层处方b4(单位:g)
[0292]
艾普拉唑肠溶微丸100羟丙基纤维素-ssl2.5滑石粉1.2纯化水50
[0293]
制备过程:
[0294]
称取处方量2.5g羟丙基纤维素-ssl溶于50g纯化水中,然后加入1.2g滑石粉,5000rpm高剪切分散均匀,制得保护层包衣液。通过glatt gpcg-1流化床,将保护层包衣液,喷到肠溶微丸上。
[0295]
具体工艺参数参见上述保护层处方b1。
[0296]
5)保护层处方b5(单位:g)
[0297]
艾普拉唑肠溶微丸100羟丙基纤维素-ssl2.5二氧化钛1.2纯化水50
[0298]
制备过程:
[0299]
称取处方量2.5g羟丙基纤维素-ssl溶于50g纯化水中,然后加入1.2g二氧化钛,5000rpm高剪切分散均匀,制得保护层包衣液。通过glatt gpcg-1流化床,将保护层包衣液,喷到肠溶微丸上。
[0300]
具体工艺参数参见上述保护层处方b1。
[0301]
6)保护层处方b6(用于对比微丸13)(单位:g)
[0302]
艾普拉唑肠溶微丸100羟丙甲纤维素e52.5硬脂酸镁0.2纯化水50
[0303]
制备过程:
[0304]
称取处方量2.5g羟丙甲纤维素e5溶于50g纯化水中,然后加入0.2g硬脂酸镁,5000rpm高剪切分散均匀,制得保护层包衣液。通过glatt gpcg-1流化床,将保护层包衣液,喷到肠溶微丸上。
[0305]
具体工艺参数参见上述保护层处方b1。
[0306]
(二)制备肠溶微丸:
[0307]
1)制备根据本发明的肠溶微丸:
[0308]
根据上述章节(一)中列举出的肠溶微丸各组成层的处方,制备如下表1所示的根据本发明的肠溶微丸a-g。
[0309]
表1:根据本发明的肠溶微丸(片)a-g的处方组成。
[0310][0311]
其中,w
x
含药丸上药率=(含药丸实际含量)/(含药丸理论含量)
×
100%
[0312]
2)制备对比微丸3-16:
[0313]
根据上述章节(一)中列举出的肠溶微丸各组成层的处方,制备如下表2-1和2-2所示的对比微丸3-15。
[0314]
表2-1:主要用于隔离层研究的对比微丸(片)5-10、14-15的处方组成。
[0315][0316]
*:为了便于针对各数据之间的比较,在此使用了具有统一粒径d90的艾普拉唑。根据本发明,本领域技术人员应该知晓,此粒径d90并不局限于此。
[0317]
表2-2:用于肠溶微丸组成层研究的对比微丸(片)3-4、11-13、16-18的处方组成。
[0318][0319][0320]
*:为了便于针对各数据之间的比较,在此使用了具有统一(或具体)粒径d90的艾普拉唑。根据本发明,本领域技术人员应该知晓,此粒径d90并不局限于此。
[0321]
实施例2:肠溶微丸片的制备
[0322]
在本实施例2中,将在实施例1中所制备的根据本发明的肠溶微丸a-g、以及对比微丸3-18制备成根据本发明的肠溶微丸片a-g、以及对比微丸片3-18。此外,还根据现有技术的肠溶微丸片的制备方法,以艾普拉唑(粒径d90为46.8μm,以便于数据之间的比较)为药物活性物质,制备了对比微丸片1(根据cn1134666a)和对比微丸片2(根据cn102525990a)。
[0323]
2.1制备根据本发明的肠溶微丸片a-g、以及对比微丸片3-18
[0324]
通过如下压片、包衣的步骤,将在上表1和表2-1、2-2中所示出的肠溶微丸分别制
备成肠溶微丸片:
[0325]
1)制备微丸压片(单位:g)
[0326]
艾普拉唑外包衣微丸200微晶纤维素ph102339.2交联聚维酮-xl113.1硬脂富马酸钠12.8
[0327]
片剂制备过程:
[0328]
将艾普拉唑肠溶外包衣微丸与微晶纤维素ph102、交联聚维酮-xl、硬脂富马酸钠根据上述处方量放入3升混料斗中,10rpm混合15min。然后置于压片机进行压片,片剂硬度8-12kg,片重折合每片含艾普拉唑5mg。
[0329]
2)微丸片剂包衣(单位:g)
[0330]
微丸片400欧巴代包衣粉20纯化水166.5
[0331]
包衣制备过程:
[0332]
称取欧巴代包衣液20g,溶于166.5g纯化水中,采用高效包衣锅对艾普拉唑微丸片进行包衣。
[0333]
2.2制备对比微丸片1:
[0334]
根据cn1134666a实施例16中肠溶微丸片的制备方法和工艺,采用实施例15的外包衣,以艾普拉唑为药物活性物质,并在载药层添加了表面活性剂,制备了对比微丸片1。方法具体如下:
[0335]
1)含药丸的制备
[0336]
含药丸处方(单位:g)
[0337]
蔗糖丸芯100艾普拉唑148羟丙甲纤维素e522聚山梨酯803纯化水700
[0338]
制备过程:
[0339]
称取150g羟丙甲纤维素e5、3g吐温80溶于纯化水中得羟丙甲纤维素粘合剂溶液,然后将粒径d90小于50μm的艾普拉唑原料分散到粘合剂中,10000rpm分散5min,然后通过glatt gpcg-1流化床将艾普拉唑药物混悬液喷涂到蔗糖丸芯上。
[0340]
具体工艺参数如下:
[0341][0342]
2)隔离丸的制备
[0343]
隔离丸处方(单位:g)
[0344][0345][0346]
制备过程:
[0347]
称取103g羟丙基纤维素-ssl溶于387.5g纯化水中得羟丙基纤维素粘合剂溶液,然后将42.5g滑石粉、2.75g硬脂酸镁加入到粘合剂溶液中,采用高剪切分散10000rpm分散5min,然后通过glatt gpcg-1流化床将隔离层包衣液喷涂到艾普拉唑含药丸上。具体工艺参数如下:
[0348]
具体工艺参数如下:
[0349][0350]
3)肠溶丸的制备
[0351]
肠溶丸处方(单位:g)
[0352]
艾普拉唑镁隔离丸127.3尤特奇l30d-55127单硬脂酸甘油酯1.9柠檬酸三乙酯3.8聚山梨酯801.8
纯化水50
[0353]
制备过程:
[0354]
称取1.8g聚山梨酯80、3.8g柠檬酸三乙酯、1.9g单硬脂酸甘油酯溶于50g的70℃纯化水中,高剪切5000rpm,5min,放置至室温,然后与127g尤特奇l30d-55搅拌45min备用,通过glatt gpcg-1流化床,肠溶包衣液,喷到隔离微丸上。
[0355]
具体工艺参数如下:
[0356][0357][0358]
4)保护层微丸的制备
[0359]
保护层处方(单位:g)
[0360]
艾普拉唑肠溶丸171.3羟丙甲纤维素e52.5硬脂酸镁0.08纯化水51.3
[0361]
制备过程:
[0362]
称取2.5g羟丙基纤维素e5溶于51.3g纯化水中,然后加入0.08g硬脂酸镁,5000rpm高剪切分散均匀,制得保护层包衣液。通过glatt gpcg-1流化床,将保护层包衣液,喷到肠溶微丸上。
[0363]
具体工艺参数如下:
[0364][0365]
5)微丸压片的制备(单位:g)
[0366]
艾普拉唑肠溶包衣微丸173.9微晶纤维素ph102869.5交联聚维酮17.39硬脂富马酸钠17.39
[0367]
片剂制备过程:
[0368]
将艾普拉唑肠溶包衣微丸与微晶纤维素、交联聚维酮、硬脂富马酸钠根据上述处方量放入3升混料斗中,10rpm混合15min。然后置于压片机进行压片,片剂硬度8-12kg,片重折合每片含艾普拉唑5mg。
[0369]
6)微丸片剂包衣的制备(单位:g)
[0370]
微丸片1000欧巴代包衣粉40纯化水333
[0371]
称取欧巴代包衣液40g,溶于333g纯化水中,采用高效包衣锅对艾普拉唑微丸片进行包衣。制得对比微丸片1。
[0372]
2.3制备对比微丸片2:
[0373]
根据cn102525990a的肠溶微丸片的制备方法,以艾普拉唑为药物活性物质,制备了对比微丸片2。
[0374]
1)含药丸芯的制备
[0375]
含药丸芯的处方(单位:g)
[0376][0377]
制备过程:
[0378]
取空白蔗糖丸芯(0.25~0.3mm),用50目和60目分别筛分,取50目到60目之间微丸进行上药。上药溶液配制方法:将上述处方量的羟丙基甲基纤维素、氧化镁溶于80%(v/v)乙醇水溶液中,用4%(m/v)的氢氧化钠溶液调节溶液ph约为12,加入处方量艾普拉唑,搅拌均匀。上药溶液粘度为13.22cp。
[0379]
具体工艺参数见下:
[0380][0381]
制得浅黄色艾普拉唑微丸310g,收率为90.3%。
[0382]
2)隔离丸的制备
[0383]
隔离丸的处方(单位:g)
[0384]
艾普拉唑含药素丸300hpmc 5cp15滑石粉5080%v/v乙醇水溶液535
[0385]
制备过程:
[0386]
取含药微丸300g,隔离液需调节ph值至10.5以上再进行包衣,隔离层溶液粘度为15.24cp,操作参数见下表:
[0387]
[0388]
制得微丸345g,收率为94.5%。
[0389]
3)肠溶丸的制备
[0390]
肠溶丸的处方(单位:g)
[0391]
艾普拉唑隔离丸150尤特奇l30d-55180聚乙二醇600010吐温800.3水200
[0392]
制备过程:
[0393]
向尤特奇l30d-55中加入4%(m/v)氢氧化钠水溶液6.5ml,在搅拌下加入聚乙二醇6000,过80目筛。取隔离丸进行肠溶衣包覆操作。主要参数为:物料温度25~30℃,进风温度28~35℃,喷液速度10~30rpm,风机频率30-40。制得微丸214.1g,收率为99.9%。
[0394]
4)微丸压片的制备
[0395]
微丸压片处方(单位:g)
[0396]
艾普拉唑肠包衣微丸150预胶化淀粉50淀粉50甘露醇50微晶纤维素ph1012404%淀粉浆10
[0397]
按照表中处方量进行混合,压片,片重314.9mg。制得对比微丸片2。
[0398]
实施例3:肠溶微丸胶囊的制备
[0399]
将600g艾普拉唑保护层包衣微丸a(w1 g2 c1 b1)通过胶囊填充剂装入3号胶囊壳中,每粒胶囊中 包含5mg艾普拉唑。
[0400]
实施例4:肠溶微丸片和胶囊的性能测试
[0401]
在本实施例4中,对上述实施例中制备的肠溶微丸片和胶囊进行了含量、溶出度、有关物质等测试,并以根据本发明的微丸片a为参照物,比较了对比微丸片3-16的各项检测结果。测试方法具体如下:
[0402]
1.含量测定:
[0403]
1)操作方法:(通用方法参见《中国药典》2015年版四部通则0512)
[0404]
具体方法如下:
[0405]
供试品溶液制备:取有关物质项下供试品溶液,精密量取5ml,置50ml量瓶中,用流动相稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液。
[0406]
对照品溶液制备:取艾普拉唑对照品适量,精密称定,加稀释剂溶解并稀释制成每1ml中约含20μg的溶液,作为对照品溶液。
[0407]
系统适用性溶液:取杂质ⅰ(艾普拉唑砜,化学名称:2-[[(4-甲氧基-3-甲基)-2-吡啶基]甲基]-磺酰基-5-(1h-吡咯-1-基)-1h-苯并咪唑)对照品与艾普拉唑对照品适量,加稀释剂溶解并稀释制成每1ml中含杂质ⅰ与艾普拉唑各20μg的溶液。
[0408]
色谱条件:用十八烷基硅烷键合硅胶为填充剂,以乙腈400ml用磷酸盐缓冲溶液
(取磷酸氢二钾2.28g,加水溶解并稀释至1000ml,用磷酸调ph至7.5)稀释至1000ml为流动相,流速为1.0ml/min,检测波长为237nm;柱温25℃。
[0409]
系统适用性要求:系统适用性溶液色谱图中,理论板数按艾普拉唑峰计算不低于2500,杂质ⅰ峰与艾普拉唑峰间的分离度应符合规定。
[0410]
测定法:分别精密量取对照品溶液及供试品溶液20μl,注入液相色谱仪,记录色谱图。
[0411]
2)计算方法:按外标法以峰面积计算10片的平均含量。
[0412]
3)标准规定:含艾普拉唑(c19h18n4o2s)应为标示量的90.0%~110.0%。
[0413]
2.溶出度测定:
[0414]
1)操作方法:按照溶出度与释放度测定法(通用方法参见《中国药典》2015年版四部通则0931第二法方法1)测定。具体方法如下:
[0415]
取本品,以0.1mol/l盐酸溶液(取盐酸9.0ml,加水至1000ml)300ml为溶出介质,转速为每分钟100转,依法操作,经120分钟时,随即在各溶出杯中加入预热至37
±
0.5℃的0.086mol/l磷酸氢二钠溶液(取30.8g磷酸氢二钠和7g吐温80,加水至1000ml)700ml,混匀,转速不变,继续依法操作,经45分钟时取样。
[0416]
供试品溶液:取溶出液适量,滤过,精密量取续滤液5ml,立即精密加入0.15mol/l氢氧化钠溶液1ml,摇匀,滤过,取续滤液作为供试品溶液。
[0417]
对照品溶液:艾普拉唑对照品约10mg,精密称定,置20ml量瓶中,加乙腈适量使溶解,用乙腈稀释至刻度,摇匀,精密量取1ml置100ml量瓶中,用磷酸盐缓冲液(ph6.8)(取0.086mol/l磷酸氢二钠溶液700ml与0.1mol/l盐酸溶液300ml,混匀,即得)稀释至刻度,摇匀,精密量取5ml,立即精密加入0.05mol/l氢氧化钠溶液1ml,摇匀,滤过,取续滤液作为对照品溶液。
[0418]
照含量测定项下的方法测定,计算每片溶出量。
[0419]
3.有关物质测试:
[0420]
1)操作方法:按照高效液相色谱法(通用方法参见《中国药典》2015年版四部通则0512)测定。具体方法如下:
[0421]
稀释剂:0.05mol/l氢氧化钠-甲醇-水=50:20:30
[0422]
供试品溶液:取本品10片,置250ml量瓶中,加0.05mol/l氢氧化钠溶液125ml,置振荡器中振摇(250转/分钟)20分钟,加50ml甲醇超声10分钟,用水稀释至刻度,摇匀,离心,取上清液。
[0423]
对照溶液:精密量取供试品溶液适量,用稀释剂稀释制成每1ml中约含艾普拉唑1μg的溶液。
[0424]
灵敏度溶液:精密量取对照溶液1ml,置10ml量瓶中,用稀释剂稀释至刻度,摇匀。
[0425]
杂质ⅰ对照品贮备液:取杂质ⅰ约6mg,置100ml量瓶中,用稀释剂稀释至刻度。
[0426]
系统适用性溶液:取艾普拉唑对照品约3mg,置10ml量瓶中,加稀释剂适量使溶解,精密加入杂质ⅰ对照品贮备液1ml,用稀释液稀释至刻度,摇匀。
[0427]
色谱条件:用十八烷基硅烷键合硅胶为填充(gemini-nx c18 150
×
4.6mm,5μm或效能相当的色谱柱),以0.01mol/l磷酸氢二钾溶液(用10%磷酸调节ph值至7.5)为流动相a,以乙腈为流动相b,按下表进行线性梯度洗脱;流速为1.0ml/min;检测波长为237nm;柱温
25℃。
[0428]
时间(min)流动相a(%)流动相b(%)077235663415505040505040.57723507723
[0429]
系统适用性溶液要求:系统适用性溶液色谱图中,杂质ⅰ峰与艾普拉唑峰之间的分离度应大于2.0。灵敏度溶液色谱图中,艾普拉唑峰峰高的信噪比应大于10。
[0430]
测定法:精密量取供试品溶液和对照溶液各20μl,分别注入液相色谱仪,记录色谱图。
[0431]
4.1根据本发明的肠溶微丸片和胶囊的稳定性测试及耐酸性测试
[0432]
1)在本实施例中,对根据本发明的肠溶微丸片a-g及实施例3胶囊进行了加速稳定性考察,具体方法如下:
[0433]
试验方案:将肠溶微丸片a-g和实施例3胶囊分别用hdpe瓶包装,每瓶14片(粒),将包装后的微丸片或胶囊放置于40℃/rh75%的加速稳定性试验箱中,1/3/6个月后取样,检测不同处方肠溶微丸片或胶囊的有关物质。检测而得的肠溶微丸片a-g和实施例3胶囊的稳定性数据如下表3-1所示:
[0434]
表3-1:根据本发明的肠溶微丸片a-g和实施例3胶囊的稳定性数据:
[0435]
时间微丸片a微丸片b微丸片c微丸片d微丸片e微丸片f微丸片g胶囊0天0.12%0.16%0.19%0.15%0.13%0.18%0.26%0.20%1个月0.15%0.22%0.26%0.24%0.20%0.36%0.54%0.34%3个月0.36%0.25%0.89%0.77%0.97%0.47%0.87%0.58%6个月0.87%1.07%1.28%0.82%0.99%0.68%1.02%0.98%
[0436]
从表3-1中可以看出,由根据本发明的肠溶微丸制备而成的微丸片a-g和胶囊具有良好的稳定性,其总杂质不超过1.5%。
[0437]
2)在本实施例中,对根据本发明的肠溶微丸片a-g及实施例3胶囊进行了耐酸性考察,具体方法如下:
[0438]
取肠溶微丸片a-g及胶囊样品各6片,以0.1mol/l盐酸溶液(取盐酸9.0ml,加水至1000ml)300ml为溶出介质,转速为每分钟100转,依法操作,经120分钟时,取出溶出杯,采用抽滤装置,过滤掉盐酸,剩余微丸收集到50ml容量瓶中,加入20ml 0.05mol/l氢氧化钠溶液,置振荡器中振摇(250转/分钟)20分钟,加30ml甲醇超声10分钟,用水稀释至刻度,摇匀,离心,取上清液。测定微丸中剩余的药物含量,即样品的耐酸性。
[0439]
表3-2:根据本发明的肠溶微丸片a-g和实施例3胶囊的耐酸性数据:
[0440]
时间微丸片a微丸片b微丸片c微丸片d微丸片e微丸片f微丸片g胶囊0天99.6%99.1%97.9%96.5%97.4%98.4%98.7%96.8%1个月98.8%98.6%98.2%96.8%97.8%98.2%98.5%96.3%
3个月98.3%97.9%98.1%95.9%98.2%98.1%97.8%97.2%6个月98.2%98.0%97.6%95.6%97.5%97.6%97.9%96.6%
[0441]
从表3-2中可以看出,由根据本发明的肠溶微丸制备而成的肠溶微丸片a-g和胶囊具有良好的耐酸性,耐酸力都在90%以上。
[0442]
4.2肠溶微丸片的稳定性和耐酸性测试:
[0443]
在本实施例4.2中,以肠溶微丸片为例,比较了肠溶微丸片的成分及配比对其稳定性和耐酸性的影响。
[0444]
4.2.1肠溶微丸所包含的隔离层的成分的影响:
[0445]
1)根据本发明的肠溶微丸片a与对比微丸片5、6、9、10和14的稳定性测试比较:
[0446]
在本实施例中,对根据本发明的肠溶微丸片a与对比微丸片5、6、9、10和14进行了加速稳定性考察。其中,相比于根据本发明的肠溶微丸片a,对比微丸片5仅具有一层不包含碱性化合物的惰性物质隔离层;对比微丸片6、9、10和14均具有与药丸芯紧密相邻的第一隔离层和与肠溶层紧密相邻的第二隔离层,然而,在对比微丸片6中,第一隔离层包括粘合剂和抗粘剂,不包含碱性化合物;在对比微丸片9中,该第一隔离层为混合层(所谓混合层是指除了包含粘合剂,还同时包含碱性化合物和能够防止微丸发生粘连的水不溶性惰性物质的层),且其所包含的碱性化合物为水不溶性碱性化合物;在对比微丸片10中,该第一隔离层为主要包含粘合剂和水溶性碱性化合物的碱性层;在对比微丸片14中,该第一隔离层为混合层,且其包含作为碱性化合物的水溶性碱性化合物。
[0447]
试验方案:将根据本发明的肠溶微丸片a和对比微丸片5、6、9、10和14分别用hdpe瓶包装,每瓶14片,将包装后的微丸片放置于40℃/rh75%的加速稳定性试验箱中,1/3/6个月后取样,检测不同处方微丸片的有关物质。所测得的微丸片的稳定性数据如下表4-1所示:
[0448]
表4-1:根据本发明的微丸片a与对比微丸片5、6、9、10和14的稳定性数据:
[0449][0450]
从表4-1中可以看出,对于稳定性低的艾普拉唑,当其肠溶微丸片仅包含一层隔离层(即对比微丸片5)时,无法满足稳定性的要求(即总杂质不超过1.5%)。当该肠溶微丸片至少包含第一隔离层和第二隔离层时,这些隔离层的成分也会对其稳定性造成影响,例如:当第一隔离层为包含碱性化合物和能够防止微丸发生粘连的水不溶性惰性物质的混合层(即对比微丸片9和14)时,即使是有碱性化合物保护的情况下,有关物质依然明显增加(总杂质含量分别为1.79%和1.68%),无法满足稳定性的要求;与之相比,当第一隔离层为包含碱性化合物而不包含能够防止微丸发生粘连的水不溶性惰性物质的碱性层(例如微丸片a和对比微丸片10)时,该肠溶微丸片具有良好的稳定性;此外,对于稳定性低的艾普拉唑,
当其肠溶微丸片仅在药丸芯中包含碱性化合物(即对比微丸片6)时,无法满足稳定性的要求(即总杂质不超过1.5%)。
[0451]
2)根据本发明的肠溶微丸片a与对比微丸片10、14、15的耐酸性比较:在本例中,对根据本发明的肠溶微丸片a和对比微丸片10、14、15进行了耐酸性测试。其中,相比于根据本发明的肠溶微丸片a,对比微丸片15与其的不同之处在于:对比微丸片15的第二隔离层中不包含能够防止微丸发生粘连的水不溶性惰性物质。具体方法如下:
[0452]
将根据本发明的肠溶微丸片a和对比微丸片10、14和15分别用hdpe瓶包装,每瓶14片,将包装后的微丸片放置于40℃/rh75%的加速稳定性试验箱中,1/3/6个月后取样,随后,以0.1mol/l盐酸溶液(取盐酸9.0ml,加水至1000ml)300ml为溶出介质,转速为每分钟100转,依法操作,经120分钟时,取出溶出杯,采用抽滤装置,过滤掉盐酸,剩余微丸收集到50ml容量瓶中,加入20ml0.05mol/l氢氧化钠溶液,置振荡器中振摇(250转/分钟)20分钟,加30ml甲醇超声10分钟,用水稀释至刻度,摇匀,离心,取上清液。测定微丸中剩余的药物含量,即样品的耐酸性。所测得的微丸片的耐酸性数据如下表4-2所示:表4-2:根据本发明的肠溶微丸片a与对比微丸片10、14、15的耐酸性数据比较。
[0453]
时间微丸片a对比微丸片10对比微丸片14对比微丸150天96.7%96.2%95.3%97.9%1个月95.9%95.6%92.1%97.6%3个月95.5%92.1%87.5%95.5%6个月95.3%85.6%82.5%96.3%
[0454]
从表4-2中的结果可以看出,在加速条件下,在稳定性测试中原本稳定性就较低的对比微丸片(如对比微丸片14)的耐酸性也较低;相比于根据本发明的肠溶微丸片a,具有包含不同碱性化合物种类(即水溶性碱性化合物)的第一隔离层的对比微丸片10的耐酸性逐渐变差(6个月时,该对比微丸片10中剩余的艾普拉唑含量为85.6%),低于所需达到的标准(即6片耐酸平均值不低于90%)。也就是说,虽然以碱性化合物作为第一隔离层可以使得该肠溶微丸片具有良好的稳定性,然而,碱性化合物的种类会影响该肠溶微丸片的耐酸性。与包含水溶性碱性化合物的第一隔离层相比,根据本发明,将包含水不溶性碱性化合物的隔离层作为肠溶微丸片的第一隔离层,可以改善并提高该肠溶微丸片的耐酸性。此外,还可以从表4-2中看出,第二隔离层中不包含能够防止微丸发生粘连的水不溶性惰性物质的对比微丸片15的耐酸性没有受到影响。
[0455]
综上可知,关于肠溶微丸所包括的各种隔离层成分,设置至少两层隔离层,并且针对与药丸芯紧密相邻的第一隔离层而言,当该第一隔离层包含水不溶性碱性化合物,而不包含水溶性碱性化合物和能够防止微丸发生粘连的水不溶性惰性物质时,可以使得由此肠溶微丸制备而得的艾普拉唑肠溶微丸片同时具备很好的稳定性和耐酸性。
[0456]
4.2.2根据本发明的肠溶微丸所包括的隔离层中各成分的配比的影响:
[0457]
1)根据本发明的肠溶微丸片a与对比微丸片7、8的稳定性测试比较:
[0458]
在本例中,对根据本发明的肠溶微丸片a与对比微丸片7、8进行了加速稳定性考察。其中,与根据本发明的肠溶微丸片a相比,在对比微丸片7中,第一隔离层中所含的水不溶性碱性化合物用量较大,例如,当艾普拉唑用量为10份,第一隔离层中所含的水不溶性碱性化合物用量大于36份;在对比微丸片8中,第二隔离层中所包含的抗粘剂(相当于根据本
发明的能够防止微丸发生粘连的水不溶性惰性物质)用量较大,例如,当艾普拉唑用量为10份,第二隔离层中抗粘剂用量大于44份。
[0459]
其具体方法如下:
[0460]
将根据本发明的肠溶微丸片a和对比微丸片7、8分别用hdpe瓶包装,每瓶14片,将包装后的微丸片放置于40℃/rh75%的加速稳定性试验箱中,1/3/6个月后取样,检测不同处方肠溶微丸片的有关物质。所测得的肠溶微丸片的稳定性数据如下表5-1所示:
[0461]
表5-1:根据本发明的肠溶微丸片a与对比微丸片7、8的稳定性数据:
[0462]
时间微丸片a对比微丸片7对比微丸片80天0.12%0.25%0.23%1个月0.15%0.34%0.50%3个月0.36%0.67%0.87%6个月0.87%0.92%0.95%
[0463]
从表5-1中的结果可以看出,相比于根据本发明的肠溶微丸片a,具有不同隔离层组分配比的对比微丸片7(在第一隔离层的配比不同)和8(在第二隔离层的配比不同)的稳定性依然处于标准范围内(总杂质不超过1.5%)。也就是说,隔离层组分配比的改变,不会影响该肠溶微丸片的稳定性。
[0464]
2)根据本发明的肠溶微丸片a与对比微丸片7、8的耐酸性比较:
[0465]
在本例中,对根据本发明的肠溶微丸片a与对比微丸片7、8进行了耐酸性检测。具体方法参考4.2.1中耐酸性考察。
[0466]
其结果如下表5-2中所示:
[0467]
表5-2:根据本发明的肠溶微丸片a与对比微丸片7、8的耐酸性数据。
[0468]
时间微丸片a对比微丸片7对比微丸片80天96.7%95.6%96.4%1个月95.9%95.8%95.8%3个月95.5%96.1%96.2%6个月95.3%95.4%94.6%
[0469]
从表5-2所示出的结果可以看出,相比与于根据本发明的肠溶微丸片a,具有不同隔离层组分配比的对比微丸片7(在第一隔离层的配比不同)和8(在第二隔离层的配比不同)的耐酸性依然处于标准范围内(即6片耐酸平均值不低于90%)。也就是说,隔离层组分配比的改变,不会影响该肠溶微丸片的耐酸性。
[0470]
综上可知,在肠溶微丸的隔离层中各组分配比的改变,不会影响由该肠溶微丸制备而成的肠溶微丸片的稳定性和耐酸性。
[0471]
4.2.3根据本发明的肠溶微丸片a、f、g与微丸片17、18的耐酸性比较:
[0472]
在本实施例中,对根据本发明的肠溶微丸片a、f、g与微丸片17、18进行了耐酸性检测。具体方法参考4.2.1中耐酸性考察。
[0473]
其结果如下表5-3中所示:
[0474]
表5-3:根据本发明的肠溶微丸片a、f、g与微丸片17、18的耐酸性数据。
[0475]
时间微丸片a微丸片g微丸片h对比微丸片17对比微丸片18
0天96.7%98.4%98.7%96.1%97.1%1个月95.9%98.2%98.5%92.4%96.5%3个月95.5%98.1%97.8%90.5%95.6%6个月95.3%97.6%97.9%88.1%94.8%
[0476]
从表5-3所示出的结果可以看出,对比微丸片17耐酸性降低,因为微丸片17在加速稳定性条件下药物降解,从而导致测定的耐酸数值降低。微丸片18的耐酸数值也有降低,也是由于加速过程中,有部分艾普拉唑降解导致。而采用本发明的药丸芯的配方的微丸片a、g、h均能得到很好的耐酸性值。
[0477]
4.3肠溶微丸所包括的药丸芯组成对其肠溶微丸片的稳定性的影响:
[0478]
在本实施例4.3中,以艾普拉唑肠溶微丸片为例,比较了肠溶微丸所包括的药丸芯的成分及艾普拉唑粒径对其稳定性的影响。
[0479]
肠溶微丸所包含的药丸芯的成分的影响:
[0480]
根据本发明的肠溶微丸片a与对比微丸片11、16、17的稳定性测试比较:
[0481]
在本例中,对根据本发明的肠溶微丸片a与对比微丸片11、16、17进行了加速稳定性考察。其中,对比微丸片11的药丸芯中不包含碱性化合物和表面活性剂,对比微丸片16的药丸芯中不包含表面活性剂但含有碱性化合物,对比微丸片17的药丸芯中不包含碱性化合物但含有表面活性剂。
[0482]
试验方案:将肠溶微丸片a和对比微丸片11、16分别用hdpe瓶包装,每瓶14片,将包装后的肠溶微丸片放置于40℃/rh75%的加速稳定性试验箱中,1/3/6个月后取样,检测不同处方肠溶微丸片的有关物质。所测得的肠溶微丸片的稳定性数据如下表6所示:
[0483]
表6:根据本发明的肠溶微丸片a与对比微丸片11、16、17的稳定性数据:
[0484]
时间微丸片a对比微丸片11对比微丸片16对比微丸片170天0.12%0.23%0.26%1.54%1个月0.15%0.89%0.57%3.25%3个月0.36%1.69%0.86%6.26%6个月0.87%2.76%1.05%8.12%
[0485]
从表6中的结果可以看出,当艾普拉唑肠溶微丸中的药丸芯不包含碱性化合物和表面活性剂时(即对比微丸片11),该肠溶微丸片无法满足稳定性的要求(总杂质不超过1.5%);当艾普拉唑肠溶微丸中的药丸芯不包含碱性化合物时(即对比微丸片17),微丸片制备完成后,有关物质就已经非常高,超过1.5%。与之相比,药丸芯只包含碱性化合物而不包含表面活性剂的对比微丸片16的加速试验的稳定性结果良好。
[0486]
综上可知,对于稳定性低的艾普拉唑,当其肠溶微丸片仅在第一隔离层中包含水不溶性碱性化合物(即对比微丸片11)时,无法满足稳定性的要求(即总杂质不超过1.5%);另外,药丸芯不包含碱性化合物而仅包含表面活性剂的情况下获得的微丸片也未满足稳定性要求。
[0487]
4.3.2肠溶微丸所包括的药丸芯中的艾普拉唑粒径对肠溶微丸片的稳定性的影响
[0488]
根据本发明的肠溶微丸片a与对比微丸片3和4的稳定性测试比较:
[0489]
在本例中,对根据本发明的肠溶微丸片a与对比微丸片3、4进行了加速稳定性考察。其中,相比于根据本发明的肠溶微丸片a,对比微丸片3中肠溶微丸的药丸层的艾普拉唑
粒径d90大于等于80μm且小于等于100μm,对比微丸片4中肠溶微丸的药丸层的艾普拉唑粒径d90大于100μm。其具体方法如下:
[0490]
试验方案:将微丸片a和微丸片3、4分别用hdpe瓶包装,每瓶14片,将包装后的微丸片放置于40℃/rh75%的加速稳定性试验箱中,1/3/6个月后取样,检测不同处方微丸片的有关物质。所测得的微丸片的稳定性数据如下表7所示:
[0491]
表7:根据本发明的肠溶微丸片a与对比微丸片3和4的稳定性数据。
[0492]
时间微丸片a对比微丸片3对比微丸片40天0.12%0.25%0.22%1个月0.15%0.46%0.22%3个月0.36%0.78%0.64%6个月0.87%0.99%0.85%
[0493]
从表7中的结果可以看出,相比与于根据本发明的肠溶微丸片a,包含具有不同艾普拉唑粒径d90的药丸芯的对比微丸片3(艾普拉唑粒径d90大于等于80μm且小于等于100μm)和对比微丸片4(艾普拉唑粒径d90大于100μm)的稳定性依然处于标准范围内(总杂质不超过1.5%),也就是说,肠溶微丸药丸层所包含的艾普拉唑粒径d90的改变,不会影响该肠溶微丸片的稳定性。
[0494]
综上可知,在肠溶微丸的药丸芯中所含有包含的艾普拉唑粒径,不会影响由该肠溶微丸制备而成的肠溶微丸片的稳定性和耐酸性。
[0495]
4.4肠溶微丸中的保护层对肠溶微丸片的稳定性及耐酸性的影响
[0496]
在本实施例4.4中,以艾普拉唑肠溶微丸片为例,比较了肠溶微丸中的保护层的设置及其组分用量对其稳定性或耐酸性的影响。
[0497]
4.4.1肠溶微丸中的保护层的设置的影响:
[0498]
1)根据本发明的微丸片a与对比微丸片12的稳定性测试比较:
[0499]
在本例中,对根据本发明的肠溶微丸片a与对比微丸片12进行了加速稳定性考察。其中,制备成对比微丸片12的肠溶微丸不包含保护层。
[0500]
试验方案:将微丸片a和微丸片12分别用hdpe瓶包装,每瓶14片,将包装后的微丸片放置于40℃/rh75%的加速稳定性试验箱中,1/3/6个月后取样,检测不同处方微丸片的有关物质。所测得的微丸片的稳定性数据如下表8-1所示:
[0501]
表8-1:根据本发明的微丸片a与对比微丸片12的稳定性数据。
[0502]
时间微丸片a对比微丸片120天0.12%0.22%1个月0.15%0.3%3个月0.36%0.46%6个月0.87%0.79%
[0503]
从表8-1中的结果可以看出,相比于根据本发明的肠溶微丸片a,其肠溶微丸不包含保护层的对比微丸片12的稳定性依然处于标准范围内(总杂质不超过1.5%)。也就是说,肠溶微丸是否包含保护层,不会影响该肠溶微丸片的稳定性。
[0504]
2)根据本发明的肠溶微丸片a与对比微丸片12的耐酸性比较:
[0505]
在本例中,对根据本发明的肠溶微丸片a与对比微丸片12进行了耐酸性检测。具体
方法参考4.2.1中耐酸性考察。
[0506]
其结果如下表8-2中所示:
[0507]
表8-2:根据本发明的肠溶微丸片a与对比微丸片12的耐酸性数据。
[0508]
时间微丸片a对比微丸片120天96.7%88.4%1个月95.9%87.5%3个月95.5%87.3%6个月95.3%86.4%
[0509]
从表8-2中可以看出,对比微丸片12在肠溶层外面没有保护层的情况下的耐酸性略低于标准范围(即6片耐酸平均值不低于90%)。然而,发明人在实验过程发现,该测定的耐酸性数据偏低的原因是,没有保护层的肠溶微丸由于容易相互之间发生粘连,在处理过程中部分的药物降解,从而导致该测定的耐酸性数据偏低。因此,在这里,本领域技术人员可以知晓,如果在制备该肠溶微丸制剂时能够通过除了设置保护层以外的手段,如及时与制剂辅料相混合等,以防止肠溶微丸之间发生粘连,那么,是否设置保护层将不会影响该制剂的耐酸性。
[0510]
4.4.2肠溶微丸中的保护层的组分用量的影响:
[0511]
在本实例中,对根据本发明的肠溶微丸片a与对比微丸片13的耐酸性进行测试比较:
[0512]
在本实例中,对根据本发明的肠溶微丸片a与对比微丸片13进行了加速稳定性考察。其中,制备成对比微丸片13的肠溶微丸的保护层中抗粘剂(如硬脂酸镁)的含量偏低,例如,当艾普拉唑用量为5~15份时,抗粘剂用量小于0.5份。
[0513]
试验方案:将微丸片a和微丸片13分别用hdpe瓶包装,每瓶14片,将包装后的微丸片放置于40℃/rh75%的加速稳定性试验箱中,1/3/6个月后取样,检测微丸片的耐酸性,即:将微丸片置于0.1m的盐酸溶液中,2h后将微丸收集,检测微丸中剩余的艾普拉唑含量。所测得的微丸片的耐酸性数据如下表9所示:
[0514]
表9:根据本发明的肠溶微丸片a与对比微丸片13的耐酸性数据比较。
[0515]
时间微丸片a对比微丸片130天96.7%96.9%1个月95.9%96.6%3个月95.5%94.1%6个月95.3%91.6%
[0516]
从表9中的结果可以看出,肠溶微丸片13在长期试验中,加速6个月耐酸性也有下降趋势(即从开始时的96.9%下降至到6个月后的91.6%)。发明人发现,加速6个月,在耐酸试验中,对比微丸片13有部分肠溶微丸在溶出杯底部粘连,从而导致耐酸性降低。这说明保护层中,能够防止微丸发生粘连的水不溶性的惰性材料(如滑石粉、硬脂酸镁、二氧化钛等)的用量太低时会导致保护效果差,无法有效地防止肠溶微丸之间的粘连,从而影响到耐酸性。
[0517]
4.5肠溶微丸片的溶出度测试
[0518]
4.5.1根据本发明的肠溶微丸片a与对比微丸片15的溶出度比较:
[0519]
在本例中,根据上面章节4.1中所述方法,比较了根据本发明的肠溶微丸片a和对比微丸片15的溶出度。所测得的微丸片的溶出度数据如下表10所示:
[0520]
表10:根据本发明的微丸片a与对比微丸片15的溶出度数据。
[0521][0522][0523]
从表10中所示的溶出度结果可以看出,根据本发明的肠溶微丸片a与对比微丸片15均具有良好的溶出度(溶出度不低于80%)。这表明,当第二隔离层仅包含粘合剂而不包含能够防止微丸发生粘连的水不溶性惰性物质(如抗粘剂)时,不会影响该肠溶微丸制剂的溶出度,进而也应不会影响其体内生物利用度。
[0524]
4.5.2根据本发明的肠溶微丸片a与对比微丸片7、8的溶出度比较:
[0525]
在本例中,根据上面章节4.1中所述方法,比较了根据本发明的肠溶微丸片a和对比微丸片7、8的溶出度。所测得的微丸片的溶出度数据如下表11和图1所示:
[0526]
表11:根据本发明的微丸片a与对比微丸片7、8的溶出度数据。
[0527]
t/min微丸a对比微丸片7对比微丸片800%0%0%1035.80%26.40%16.80%1568.50%35.70%25.60%2082.90%49.80%38.50%3095.20%57.20%49.50%4594.30%68.90%57.60%6092.20%72.60%66.60%
[0528]
从图1和表11中所示的溶出度结果可以看出,根据本发明的肠溶微丸片a具有良好的溶出度(溶出度不低于80%)。相比于根据本发明的肠溶微丸片a,对比微丸片7、8的溶出度明显地降低至所需达到的标准范围(溶出度不低于80%)之外,这表明,这些肠溶微丸片的释放明显减慢,这将推迟在体内的起效时间,进而会影响体内生物利用度。
[0529]
如上文所述,在肠溶微丸的隔离层中各组分配比的改变,不会影响由该肠溶微丸制备而成的肠溶微丸片的稳定性和耐酸性。然而,该肠溶微丸的隔离层中各组分配比的改变会影响相应其肠溶微丸片的溶出度,进而影响该制剂的体内生物利用度。因此,为了进一步改善体内生物利用度,根据本发明优选地,肠溶微丸的隔离层中各组分配比可以为:当艾普拉唑用量为5~15份时,第一隔离层中包含粘合剂5~36份,水不溶性碱性化合物5~36
份,第二隔离层中包含粘合剂4~26份,能够防止微丸发生粘连的水不溶性惰性物质7~44份。
[0530]
4.5.3根据本发明的肠溶微丸片a与对比微丸片11、16的溶出度比较:
[0531]
在本例中,根据上面章节4.1中所述方法,比较了根据本发明的肠溶微丸片a和对比微丸片11、16的溶出度。所测得的微丸片的溶出度数据如下表12和图2所示:
[0532]
表12:根据本发明的肠溶微丸片a与对比微丸片11、16的溶出度数据。
[0533]
t/min微丸a对比微丸11对比微丸1600%0%0%1035.8%22.5%29.5%1568.5%27.6%46.3%2082.9%37.2%66.6%3095.2%45.4%78.3%4594.3%51.6%81.8%6092.2%60.5%83.9%
[0534]
从图2和表12所示的结果可以看出,相比于根据本发明的肠溶微丸片a,对比微丸片11的溶出度明显降低至标准范围之外(溶出度不低于80%)。在对比微丸片16中,其药丸芯不含表面活性剂,其制剂的药物溶出度虽然在标准范围内,但是相较于肠溶微丸片a偏低,溶出度低于85%。
[0535]
如上文所述,肠溶微丸片在药丸芯中所包含的表面活性剂不会影响其稳定性,但是会影响该制剂的溶出度,也就是说,在肠溶微丸片的药丸芯中添加表面活性剂,可以有效地提高该制剂的溶出度,进而有效地改善生物利用度。
[0536]
4.5.4根据本发明的肠溶微丸片a与对比微丸片3、4的溶出度比较:
[0537]
在本例中,根据上面章节4.1中所述方法,比较了根据本发明的肠溶微丸片a和对比微丸片3、4的溶出度比较。所测得的微丸片的溶出度数据如下表13和图3所示:
[0538]
表13:根据本发明的微丸片a与对比微丸片3、4的溶出度数据。
[0539]
t/min微丸片a对比微丸片3对比微丸片400%0%0%1035.8%20.5%13.5%1568.5%36.7%26.4%2082.9%56.8%45.6%3095.2%68.4%56.5%4594.3%75.8%60.5%6092.2%82.9%72.5%
[0540]
从图3和表13中所示的溶出度结果可以看出,相比于根据本发明的肠溶微丸片a,对比微丸片3、4的溶出度明显降低,其中,当肠溶微丸的药丸芯的艾普拉唑粒径d90大于100μm时(即对比微丸片4),其溶出度减低至标准范围(即溶出度不低于80%)之外。
[0541]
4.5.5根据本发明的肠溶微丸片a与对比微丸片12的溶出度比较:
[0542]
在本例中,根据上面章节4.1中所述方法,比较了根据本发明的肠溶微丸片a和对比微丸片12的溶出度比较。所测得的微丸片的溶出度数据如下表14和图4所示:
[0543]
表14:根据本发明的肠溶微丸片a与对比微丸片12的溶出度数据。
[0544]
t/min微丸片a对比微丸片1200%0%1035.8%32.5%1568.5%46.8%2082.9%62.5%3095.2%75.6%4594.3%78.2%6092.2%79.2%
[0545]
从图4和表14示出的结果可以看出,相比于根据本发明的肠溶微丸片a,不具有保护层的对比微丸片12的溶出度明显降低至大约的标准值(溶出度不低于80%)。发明人在实验中发现,其溶出度明显降低的原因是,不具有保护层的根据本发明的肠溶微丸之间容易发生粘连,从而影响其在溶出介质中的释放速度。因此,当具有保护层时,肠溶微丸片a在溶出介质中不会发生粘连,释放较高;对比微丸片12没有保护层,微丸片在介质中会粘连,释放偏低。因此,在这里,本领域技术人员可以知晓,如果在制备该肠溶微丸制剂时能够通过除了设置保护层以外的手段,如及时与制剂辅料相混合等,以防止肠溶微丸之间发生粘连,或者,通过在第一隔离层和第二隔离层之间添设其他隔离层而使得肠溶微丸之间不容易发生粘连,那么,是否设置保护层将不会影响该制剂的溶出度。
[0546]
4.6肠溶微丸所包括的药丸芯中的艾普拉唑粒径对肠溶微丸片的载药量的影响
[0547]
比较实施例1中第“1.1含药丸(w)的制备处方、方法、以及其含药丸上药率”章节中所示出的含药丸上药率w(即载药量)可以看出,对比微丸片3和4所包含的药丸芯w8和w9的载药量w8和w9分别为87.2%和79.3%。与之相比,当肠溶微丸片的药丸芯所包含的艾普拉唑粒径d90≤50μm时,其药丸芯(例如w1-w5)的载药量大于90%。
[0548]
如上文所述,在肠溶微丸的药丸芯中所包含的艾普拉唑粒径不会影响由该肠溶微丸制备而成的肠溶微丸片的稳定性和耐酸性;该肠溶微丸的药丸芯中所包含的艾普拉唑粒径会影响其肠溶微丸片的溶出度,进而影响体内生物利用度。此外,该肠溶微丸的药丸芯中所包含的艾普拉唑粒径的大小还会影响该肠溶微丸的药丸芯的载药量。
[0549]
因此,为了进一步改善体内生物利用度,优选地,根据本发明肠溶微丸的药丸层中的艾普拉唑粒径d90可以为≤100μm;更优选地,根据本发明肠溶微丸的药丸层中的艾普拉唑粒径d90可以为≤50μm,此时,不仅其肠溶微丸片的药物释放速度比较快,即30min内释放达到90%以上,而且其药丸芯还具有较高的载药量(大于90%)。
[0550]
实施例5:根据本发明的肠溶微丸片的抑酸效果
[0551]
研究目的:观察比较本发明的肠溶微丸片a和对比微丸片1、2在健康受试者口服用药第一天的抑酸效果。
[0552]
试验方案:本研究为随机、开放、交叉设计的单中心研究,纳入健康受试者18例。试验一个周期,将18例受试者随机分为三组,每组6人,分别服药微丸片a、对比微丸片1和对比微丸片2。每人空腹服药一次,测定24h胃内ph值。
[0553]
胃内ph记录:胃内ph记录将使用丹麦medtronic公司的ph测试系统。将导管经鼻腔放置胃内,导管一段与digitrapper mkiii记录装置相连。次记录装置通过微处理器能联系
记录受试者胃内ph值。导管将置于食管下端括约肌8-10cm处,导管表面的刻度能显示其位置。探针在每次ph记录中在同一位置,在每次ph监测前,都必须使用ph 7.01和ph 1.07的缓冲液作2点标定。每次记录结束后digitrapper mkiii内的数据都讲下载到计算机内做进一步分析。
[0554]
试验结果:将每组受试者的胃ph记录值进行处理,分析得多个患者的每个时间点的ph平均值绘制成曲线,如图5所示。
[0555]
从图5中可以看出,根据本发明的肠溶微丸片a的起效迅速,在服用后1h内就可抑制胃酸到ph 4以上,达到临床起效效果。与之相比,对比微丸片1在服用后3h左右才达到临床起效效果;对比微丸片2在服用后2.5h左右达到临床起效效果。由此可见,根据本发明的肠溶微丸片能达到快速起效的效果,从而更快速地解决患者的痛苦。
[0556]
此外,在本例中,还根据上述实施例中的方法,测试了对比微丸片1和对比微丸片2的稳定性和耐酸性,结果参见下表15和16。
[0557]
表15:对比微丸片1与对比微丸片2的稳定性数据。
[0558]
时间对比微丸片1对比微丸片20天2.12%0.55%1个月4.15%1.82%3个月5.36%2.42%6个月9.87%5.79%
[0559]
表16:对比微丸片1与对比微丸片2的耐酸性数据。
[0560]
时间对比微丸片1对比微丸片20天92.6%90.1%1个月88.3%85.5%3个月83.5%81.3%6个月80.6%78.9%
[0561]
从表15和16中可以看出,根据现有技术制备的艾普拉唑肠溶微丸片(即对比微丸片1和对比微丸片2)在加速稳定测试过程中,具有显著地低于所需达到的标准(稳定性标准:总杂质不超过1.5%;耐酸性标准:耐受力不低于90%)的稳定性和耐酸性。
[0562]
实施例6:根据本发明的艾普拉唑肠溶微丸片比格犬药代动力学试验
[0563]
1)实验设计
[0564]
试验动物:比格犬。
[0565]
数量:共12只,雌雄各半,分3组(微丸片a、对比微丸片1、对比微丸片2)。给药方式及次数:口服灌胃,给药一次(给药前半小时以0.024ml/kg的剂量肌注给予0.25mg/ml的五肽胃泌素pentagastrin)。
[0566]
采血点:给药前0h,给药后1、1.5、1.75、2、2.5、3、3.5、4、5、6、8h,共12个采血点。
[0567]
给药剂量:单片给药。
[0568]
2)实验周期:单片给药、三周期三交叉,清洗期7天,共计15天。
[0569]
比格犬给药方案如下:
[0570][0571]
3)样品分析:测血浆中艾普拉唑浓度(血浆样品处理时加1mol/l naoh溶液碱化血浆)。分析方法:hplc-ms/ms。
[0572]
4)实验结果:见图6。
[0573]
从图6中所示的比格犬体内药动数据图可知,根据本发明的肠溶微丸片a在比格犬体内的生物利用度更高,达到抑制胃酸分泌起效的时间更快。与之相比,对比微丸片1和对比微丸片2的比格犬体内累积血药浓度低,从而表明对比微丸片1和对比微丸片2的生物利用度较低。
[0574]
实施例7:拉唑类药物的稳定性比较:
[0575]
考察不同拉唑类药物原料在ph6.8和8.0介质中的稳定性:
[0576]
配制含0.5%w/w十二烷基硫酸钠的ph6.8的磷酸缓冲盐介质和ph8.0的缓冲盐介质,放到溶出杯中,每杯1000ml,分别称取艾普拉唑、奥美拉唑镁、埃索美拉唑镁、雷贝拉唑钠、泮托拉唑、兰索拉唑各0.5mg,加入到溶出杯中,采用桨法150rpm搅拌,确保拉唑原料沉入到介质中溶解,分别在15min、30min、45min、60min时取样5ml加入到20ml氢氧化钠稳定介质中,然后用流动相定容到50ml。
[0577]
按照《中国药典》2015年版二部中关于奥美拉唑镁、埃索美拉唑镁、雷贝拉唑钠、泮托拉唑钠、兰索拉唑的测定方法对介质中取的样进行含量测定,以确定各拉唑在ph6.8和8.0介质中的稳定性。测定结果如下表17和表18所示:
[0578]
表17:不同拉唑类药物在ph6.8介质中不同时间降解剩余量。
[0579]
时间点艾普拉唑奥美拉唑镁埃索美拉唑镁雷贝拉唑钠泮托拉唑钠兰索拉唑0min100.0%100.0%100.0%100.0%100.0%100.0%15min59.7%81.2%89.6%70.3%83.6%85.7%30min42.7%66.7%70.9%51.5%65.9%70.2%45min29.4%47.4%56.0%38.6%50.2%53.6%60min20.7%29.2%41.4%24.6%35.4%38.6%
[0580]
表18:不同拉唑类药物在ph8.0介质中不同时间降解剩余量。
[0581]
时间点艾普拉唑奥美拉唑镁埃索美拉唑镁雷贝拉唑钠泮托拉唑钠兰索拉唑0min100.0%100.0%100.0%100.0%100.0%100.0%15min94.3%98.2%99.2%97.3%98.6%98.7%30min91.5%95.4%98.6%93.5%95.9%96.2%
45min88.6%96.3%97.6%90.6%92.2%95.3%60min84.6%91.2%96.4%88.5%91.4%93.5%
[0582]
由表17和表18可以看出,不同拉唑类药物在ph6.8介质中的稳定性都比较差,其中,艾普拉唑的稳定性最差,埃索美拉唑镁的稳定性相对最好。
[0583]
实施例8艾普拉唑微丸干混悬剂的制备
[0584]
在本实施例8中,将以根据本发明的艾普拉唑肠溶微丸为例,制备艾普拉唑微丸干混悬剂。
[0585]
1)干混悬颗粒v处方(单位:g)
[0586]
组分重量(g)黄原胶20壳聚糖1400ccna75阿斯巴甜15
[0587]
制备方法:将黄原胶、壳聚糖、ccna和阿斯巴甜混合均匀后,加入干法制粒机进行制粒。工艺参数为:压轮间距0.2mm,喂料速度:30rpm,压轮转速5rpm,整粒转速10rpm。制粒完毕后,过筛进行整粒,控制粒径在0.5-0.7mm之间。得干混悬颗粒
ⅴ
。
[0588]
2)干混悬剂e-v的制备
[0589]
艾普拉唑肠溶微丸e 60.5mg和2.0g上述干混悬颗粒
ⅴ
混合,装瓶,即得规格5mg的艾普拉唑肠溶干混悬剂e-v。
[0590]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。