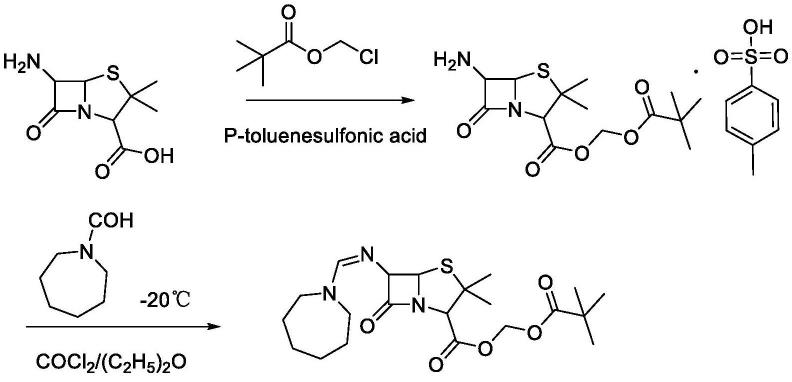
1.本发明涉及基因工程技术领域,特别涉及一种环二肽合成酶基因及其应用和副地衣芽胞杆菌。
背景技术:
2.根结线虫(meloidogyne)是一种高度专化型的杂食性植物病原线虫,通常由植物的根尖侵入,以口针刺伤寄主,分泌有毒物质,这些物质含有多种消化酶,诱发寄主组织发生各种病理变化,破坏寄主细胞的正常代谢功能,最典型的症状是形成大小形状不同的瘤状根结,根结内有多个雌虫。
3.根结线虫寄主范围较广,几乎能够侵染所有农作物。目前主流的治理方法包括使用化学农药的化学治理方法以及使用微生物菌剂的生物治理方法。其中,化学农药治理效果较好,但会给人畜健康和生态环境带来严重威胁;微生物菌剂主要采用杀线虫细菌,但由于根结线虫不能取食细菌菌体,导致微生物菌剂的研发受到严重制约。
技术实现要素:
4.本发明的主要目的是提出一种环二肽合成酶基因及其应用和副地衣芽胞杆菌,旨在提供一种环二肽合成酶,所述环二肽合成酶不仅能够合成一种对根结线虫具有较强毒杀活性的环二肽,而且产量大、纯度高、合成工艺简单。
5.为实现上述目的,本发明利用采集自中国云南省屏边县的锈毛掌叶树新鲜叶片,从其中分离纯化得到一株副地衣芽胞杆菌。本发明分离纯化得到的副地衣芽胞杆菌已经在中国典型培养物保藏中心保藏,地址:中国武汉武汉大学,分类命名为副地衣芽胞杆菌(bacillus paralicheniformis)zzq-12,保藏编号为cctcc no.m 20211646,保藏时间为2021年12月20日。
6.本发明还提出一种环二肽合成酶基因,所述环二肽合成酶基因的核苷酸序列如seq id no:1所示。
7.本发明还提出一种环二肽合成酶,所述环二肽合成酶由如上文所述的环二肽合成酶基因编码得到,所述环二肽合成酶的氨基酸序列如seq id no:2所示。
8.本发明还提出一种环二肽,用于毒杀根结线虫,所述环二肽由如上文所述的环二肽合成酶合成得到。
9.本发明还提出一种根结线虫杀虫剂,所述根结线虫杀虫剂包括如上文所述的环二肽。
10.本发明还提出一种重组质粒,所述重组质粒包含如上文所述的环二肽合成酶基因。
11.本发明还提出一种重组菌株,所述重组菌株包含如上文所述的环二肽合成酶基因。
12.本发明还提出一种环二肽的合成方法,所述环二肽的合成方法包括以下步骤:
13.将如上文所述的环二肽合成酶基因进行异源表达,得到培养物;
14.将所述培养物离心,去上清液,用乙酸乙酯-乙酸混合溶剂萃取,将萃取液旋蒸,然后用甲醇-乙腈混合溶剂溶解残留物,再离心得到沉淀,用乙腈溶解所述沉淀得到粗提液;
15.采用高效液相色谱法对粗提液进行纯化,得到环二肽。
16.可选地,将所述培养物离心,去上清液,用乙酸乙酯-乙酸混合溶剂萃取,将萃取液旋蒸,然后用甲醇-乙腈混合溶剂溶解残留物,再离心得到沉淀,用乙腈溶解所述沉淀得到粗提液的步骤中,所述乙酸乙酯-乙酸混合溶剂中,所述乙酸的浓度为0.08~0.12ml/l;和/或,
17.所述甲醇-乙腈混合溶剂中,甲醇和乙腈的体积比为1:(0.8~1.2)。
18.可选地,采用高效液相色谱法对粗提液进行纯化,得到环二肽的步骤中,所述高效液相色谱法的参数包括:
19.色谱柱为agilent c18反相柱,且所述色谱柱的尺寸为250mm
×
4.6mm;
20.流动相为含有0.1wt%三氟乙酸的ddh2o和乙腈的混合溶液;
21.流动相的条件为0-30min,体积分数为20%-60%的乙腈梯度洗脱;
22.检测波长为210nm;
23.流速为1ml/min。
24.本发明技术方案中,提出的环二肽合成酶基因可以编码出一种环二肽合成酶,所述环二肽合成酶能够直接以细胞内氨酰-trnas(aa-trnas)作为底物合成出大量的环二肽cll、clp和clm,合成工艺简单,且得到的所述环二肽cll、clp和clm纯度高,并对根结线虫具有较强的毒杀活性,能用于制备根结线虫杀虫剂。
附图说明
25.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅为本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
26.图1为实施例2中副地衣芽胞杆菌zzq-12的菌落形态图;
27.图2为实施例2中副地衣芽胞杆菌zzq-12的营养体形态图;
28.图3为实施例2中副地衣芽胞杆菌zzq-12的芽胞形态图;
29.图4为实施例3中pcr扩增片段的电泳图;
30.图5为实施例3中环二肽clp的hplc分析图(a)及质谱分析图(b);
31.图6为实施例3中环二肽clm的hplc分析图(c)及质谱分析图(d);
32.图7为实施例3中环二肽cll的hplc分析图(e)及质谱分析图(f);
33.图8为实施例4毒杀活性试验(1)中试验组和对照组的番茄长势对比图;
34.图9为实施例4毒杀活性试验(2)中三种环二肽的效果对比图。
35.本发明目的的实现、功能特点及优点将结合实施例,参照附图做进一步说明。
具体实施方式
36.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中
的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。
37.需要说明的是,实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。此外,各个实施例之间的技术方案可以相互结合,但是必须是以本领域普通技术人员能够实现为基础,当技术方案的结合出现相互矛盾或无法实现时应当认为这种技术方案的结合不存在,也不在本发明要求的保护范围之内。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
38.根结线虫寄主范围较广,几乎能够侵染所有农作物。目前主流的治理方法包括使用化学农药的化学治理方法以及使用微生物菌剂的生物治理方法。其中,化学农药治理效果较好,但会给人畜健康和生态环境带来严重威胁;微生物菌剂主要采用杀线虫细菌,但由于根结线虫不能取食细菌菌体,导致微生物菌剂的研发受到严重制约。
39.环二肽是由两个氨基酸缩合而成的稳定六元环二酮哌嗪类化合物,是最小环肽。环二肽有很多优点:(1)合成简单,只需要一个酶——环二肽合成酶(cdps),直接以细胞内氨酰-trnas(aa-trnas)作为底物合成环二肽;(2)具有很强的抗病毒、细菌和线虫等多种生物学活性;(3)具有热和酸碱稳定性,且不被蛋白酶降解;(4)对人畜和环境安全。
40.郭静等从恶臭假单胞菌中发现能杀根结线虫的环二肽cyclo(pro-ile)(cpi),但环二肽cyclo(pro-ile)(cpi)在该菌中产量低,使得获得环二肽的效率很低,不能满足实际应用中对环二肽量的需求;华南农业大学肖芹团队通过异源表达植物乳杆菌lbp-k10 cdps基因的方法,高效获得环二肽,但该cdps能同时合成多种环二肽,用薄层层析(tlc)分离所产生的环二肽,比较粗放,纯度低。鉴于此,本发明利用采集自中国云南省屏边县的锈毛掌叶树新鲜叶片,从其中分离纯化得到一株副地衣芽胞杆菌。本发明分离纯化得到的副地衣芽胞杆菌已经在中国典型培养物保藏中心保藏,地址:中国武汉武汉大学,分类命名为副地衣芽胞杆菌(bacillus paralicheniformis)zzq-12,保藏编号为cctcc no.m 20211646,保藏时间为2021年12月20日。
41.该菌株对根结线虫具有毒杀活性。具体来说,副地衣芽胞杆菌zzq-12可产生对南方根结线虫(meloidogyne incognita,mi)有毒杀活性的物质,发明人研究发现,所述副地衣芽胞杆菌zzq-12产生的杀根结线虫的活性物质为环二肽。进一步地,所述环二肽包括环二肽clp、clm以及cll,经单一同位素测定,这三种环二肽的分子量大小依次是211.1246da(clp),245.1287da(clm)和227.1747da(cll)。
42.进一步地,图1至3依次为副地衣芽胞杆菌zzq-12的菌落、营养体及芽胞形态。参阅图1至3,所述副地衣芽胞杆菌zzq-12的微生物学特征如下:菌体大小为(1~1.2)μm
×
(3~5)μm,细胞为杆状,芽胞中生,革兰氏染色为阳性反应。所述副地衣芽胞杆菌zzq-12在lb琼脂平板上可形成质地软且不规则的白色菌落,能形成生物膜。此外,所述副地衣芽胞杆菌zzq-12的最适生长温度为37℃,ph 6-8均生长良好,最适生长ph为7.0-7.2。
43.本副地衣芽胞杆菌zzq-12可以按照常规甘油管保藏方法保藏。
44.本发明还提出一种环二肽合成酶基因,所述环二肽合成酶基因的核苷酸序列如seq id no:1所示,总长750bp。
45.本发明技术方案中,提出的环二肽合成酶基因可以编码出一种环二肽合成酶,所
述环二肽合成酶能够直接以细胞内氨酰-trnas(aa-trnas)作为底物合成出大量的环二肽cll、clp和clm,合成工艺简单,且得到的所述环二肽cll、clp和clm纯度高,并对根结线虫具有较强的毒杀活性,能用于制备根结线虫杀虫剂。
46.具体来说,本发明对上述副地衣芽胞杆菌zzq-12的总dna样品进行全基因组测序后,通过生物信息学分析后,预测到1个环二肽合成酶基因。经过以副地衣芽胞杆菌zzq-12的dna为模板,扩增得到环二肽合成酶(cdps)的基因片段,即环二肽合成酶基因。
47.本发明还提出一种环二肽合成酶,所述环二肽合成酶由如上文所述的环二肽合成酶基因编码得到,所述环二肽合成酶的氨基酸序列如seq id no:2所示,总长249bp。所述环二肽合成酶能够高效合成大量环二肽cll、clp和clm,产量高、速度快,且合成得到的环二肽cll、clp和clm对根结线虫均具有较强的毒杀活性,特别是环二肽cll,在浓度为800μg/ml时,其对根结线虫的致死率接近100%。
48.本发明还提出一种环二肽,用于毒杀根结线虫,所述环二肽由如上文所述的环二肽合成酶合成得到。具体来说,所述环二肽包含环二肽cll、clp和clm,且对根结线虫具有较强的毒杀活性;所述环二肽可以通过任意一种本领域常规的环二肽合成酶合成环二肽的方法得到。
49.进一步地,本发明还提出一种环二肽的合成方法,所述环二肽的合成方法包括以下步骤:
50.步骤s10,将如上文所述的环二肽合成酶基因进行异源表达,得到培养物。
51.具体地,在一些实施例中,先将环二肽合成酶基因插入到pet-28a( )大肠杆菌表达载体,然后转化到dh5a感受态细胞中,提取得到重组质粒;然后将所述重组质粒转化大肠杆菌bl21感受态细胞获得重组菌株,对重组菌株的环二肽合成酶进行诱导表达,即可从发酵产物中分离纯化得到含有环二肽的培养物。本发明方法能够大量制备含有环二肽的培养物,制备效率高,且培养物中环二肽种类单纯。
52.步骤s20,将所述培养物离心,去上清液,用乙酸乙酯-乙酸混合溶剂萃取,将萃取液旋蒸,然后用甲醇-乙腈混合溶剂溶解残留物,再离心得到沉淀,用乙腈溶解所述沉淀得到粗提液。
53.其中,所述乙酸乙酯-乙酸混合溶剂中,所述乙酸的浓度为0.08~0.12ml/l;所述甲醇-乙腈混合溶剂中,甲醇和乙腈的体积比为1:(0.8~1.2)。选用如上所述浓度范围的乙酸乙酯-乙酸混合溶剂能够更高效地萃取出环二肽,萃取效率高,得到的产物纯度高;采用如上所述的混合比例范围的甲醇-乙腈混合溶剂能够更好地溶解残留物。
54.需要说明的是,在对沉淀进行溶解时,优选色谱级的乙腈,有助于提高粗提液纯度,更利于后续的高效液相色谱纯化。
55.步骤s30,采用高效液相色谱法对粗提液进行纯化,得到环二肽。
56.本实施例通过采用高效液相色谱法对粗提液进行纯化和分析,方法简单易控制,且能够获得较高纯度的环二肽cll、clp和clm,进一步提高了环二肽产物的纯度,有利于应用到根结线虫毒杀上,效果明显。
57.具体地,本步骤中,所述高效液相色谱法的参数包括:
58.色谱柱为agilent c18反相柱,且所述色谱柱的尺寸为250mm
×
4.6mm;流动相为含有0.1wt%三氟乙酸(tfa)的ddh2o(a)和乙腈(b)的混合溶液,其中,ddh2o是指双蒸水;流动
相的条件为0-30min,20%-60%乙腈梯度洗脱,也就是说,在开始洗脱后的30min内,使用体积浓度为20%-60%乙腈进行洗脱,本实施例通过反复收集30min内洗脱的差异峰,经旋干、冻干处理,即得高纯度的环二肽产品;检测波长为210nm;流速为1ml/min。
59.本发明还提出一种根结线虫杀虫剂,所述根结线虫杀虫剂包括如上文所述的环二肽,或者包括由如上文所述的环二肽的合成方法制得的环二肽。所述根结线虫杀虫剂可以由单一的上述环二肽制得,也可以由上述环二肽和其他具有毒杀活性的效用成分复配得到,还可以由上述环二肽和其他具有改善土壤性能、有助于植物生长或者提高杀虫剂自身性能(例如稳定性等)的组分复配得到。由于环二肽cll、clp和clm对根结线虫具有较强的毒杀活性,使得本根结线虫杀虫剂在毒杀根结线虫上具有明显效果。
60.此外,本发明还提出一种重组质粒,所述重组质粒包含如上文所述的环二肽合成酶基因。应当理解,插入了上述环二肽合成酶基因的重组载体即属于本发明的保护范围内。
61.进一步地,本发明优选为以pet-28a( )大肠杆菌表达载体作为重组质粒的载体,利用上述合成基因的5’端和3’端带有的限制性酶切位点ecor i和hind iii将上述环二肽合成酶基因克隆至pet-28a( )大肠杆菌表达载体,得到上述重组质粒。
62.此外,本发明还提出一种重组菌株,所述重组菌株包含如上文所述的环二肽合成酶基因。
63.该重组菌株可以由包含上述的环二肽合成酶基因的重组质粒转化大肠杆菌bl21感受态细胞获得。即,该重组菌株还可以包含上述重组质粒。将上述重组质粒导入表达细胞中即可获得重组菌株,目的基因即可随着宿主细胞的繁殖而复制。通常来说,所述表达细胞可以是大肠杆菌,也可以是酵母等细胞,或者是其他类型的细胞例如动物细胞等,在本实施例中,表达细胞优选为大肠杆菌bl21感受态细胞。
64.需要说明的是,上述涉及到基因合成、重组质粒及重组菌株制备、以及重组菌株发酵培养获得重组蛋白等实施方式中,未说明具体实验方式、实验原材料者,均按照基因工程及基于基因工程进行微生物发酵培养制备蛋白质的常规方法进行。
65.以下结合具体实施例和附图对本发明的技术方案作进一步详细说明,应当理解,以下实施例仅仅用以解释本发明,并不用于限定本发明。
66.实施例1菌株的分离
67.(1)叶表面芽胞杆菌的分离与筛选
68.选取中国云南省屏边县的锈毛掌叶树新鲜叶片,用5wt%次氯酸钠水溶液消毒10min,70%(体积分数)酒精消毒1min。按照1ml/g的比例添加无菌去离子水,充分捣烂,得到悬液。
69.在超净台上,取1g悬液倒入装有lb-naac液体培养基(培养基配方:蛋白胨10g,酵母粉5g,氯化钠10g,醋酸钠34.02g,补充蒸馏水至1l,ph为7.0,121℃灭菌30min)的三角瓶中,30℃,220rpm摇床培养4h。将三角瓶置于80℃水浴3min。冷却后,在超净台用移液枪吸取100μl培养液涂布于luria-berta medium(lb)固体平板(配方:蛋白胨10g,酵母粉5g,氯化钠10g,琼脂粉4.5-6g,补充蒸馏水至1l,ph7.0,121℃灭菌30min),30℃培养12-16h。挑取生长形态类似芽胞杆菌的菌落于t3固体平板(配方:蛋白胨5g,酵母粉1.5g,氯化猛0.05g,0.05m磷酸钠缓冲液,琼脂粉4.5-6g,补充蒸馏水至1l,ph7.0,121℃灭菌30min)上划线,30℃培养48h。挑取上述单菌落,用蕃红染色液(配置方法:2.5%蕃红的乙醇溶液10ml,加蒸馏
水稀释至100ml,过滤后使用)简单染色后用光学显微镜观察,产芽胞的杆状细菌可初步判定为芽胞杆菌。
70.(2)杀根结线虫芽胞杆菌的筛选
71.挑取上述不同芽胞杆菌的单菌落,接种于5ml lb液体培养基(配方:蛋白胨10g,酵母粉5g,氯化钠10g,补充蒸馏水至1l,ph7.0,121℃灭菌30min)中,于30℃过夜活化。将1ml的培养物转移至100ml lb液体培养基中,于30℃,220rpm培养30h。取1ml培养液用于测定该时刻的发酵液的od
600
值,然后,将同批次、不同菌株的培养物od
600
值调成一致。
72.将育苗盆中生长20天的同批次番茄苗(长势一致)移栽至单个种植盆中,同时接种同等量的南方根结线虫,3天后,将上述培养物进行灌根。40天后统计根结数量、卵块数量和番茄长势。根据统计结果,筛选出根结数量和卵块数量较少以及番茄长势较好的培养物对应的芽胞杆菌,经鉴定,该菌株为副地衣芽胞杆菌zzq-12。
73.实施例2菌株的鉴别
74.下述试验采用的菌株均为实施例1分离得到的菌株。
75.(1)将菌株在lb平板上37℃培养形成菌落,观察菌落形态、颜色等特征。结果如图1-3所示,菌落呈圆形,表面不光滑,山丘状突起,表面暗,粗糙,有黏液光泽。
76.菌体大小为(1~1.2)μm
×
(3~5)μm,细胞为杆状,芽胞中生,革兰氏染色为阳性反应。所述副地衣芽胞杆菌zzq-12在lb琼脂平板上可形成质地软且不规则的白色菌落,能形成生物膜。
77.(2)对菌株进行基因组测序
78.a.总dna的提取
79.挑取芽胞杆菌zzq-12单菌落接种于5ml lb液体培养基中,30℃过夜活化,取0.5ml培养物转移至装有50ml lb液体培养基的三角瓶中,30℃培养3-4h;12000rpm,离心5min,收集菌体,取5ml ste缓冲液[0.1mol/l nacl,10mmol/l tris-hcl(ph 8.0),1mmol/l edta (ph 8.0)]洗涤一次,加3ml溶液i[1mol/l tris-hcl(ph 8.0),0.5mol/l edta(ph 8),50mmol/l葡萄糖]和50μl溶菌酶(浓度:50mg/ml),在37℃作用2h;加入3ml 10%的十二烷基磺酸钠(sds)于55℃水浴30min:加3.6ml 5mol/l nacl混和,冰上静置10min,在12000rpm,处理15min,取上清于新离心管;加入等体积苯酚/氯仿/异戊醇(体积比依次为25∶24∶1),轻柔颠倒混匀200次,而后离心12000rpm,5min,吸取上清液,并重复抽提1-2次;将上层dna溶液转移至新离心管,加入等体积预冷无水乙醇,-20℃静置2h,12000rpm离心5min,沉淀用1ml 70%(体积分数)乙醇洗涤一次,冷冻抽干后溶于200μl te缓冲液中,得到总dna样品。
[0080]
b.全基因组测序及16s rrna基因提取
[0081]
将上述制备好的总dna样品通过illumina hiseq2500测序平台进行全基因组测序。使用双端测序技术,reads读长为125bp,测序数据量为1g,经拼接软件abyss完成本菌株的基因组组装。以芽胞杆菌kj-16的16s rrna基因(nr_137421.1)为query序列,通过blastn提取本菌株基因组中的16s rrna序列,本菌株基因组中的16s rrna序列如seq id no:3所示,所述16s rrna序列与ncbi nucleotide collection(nr/nt)数据库进行比对,确定本菌株为副地衣芽胞杆菌zzq-12。
[0082]
实施例3环二肽的制备
[0083]
(1)副地衣芽胞杆菌zzq-12环二肽合成酶(cdps)基因的异源表达
[0084]
a.cdps基因扩增:以实施例1获得的副地衣芽胞杆菌zzq-12的总基因组dna为模板,通过pcr扩增环二肽合成酶基因,其中,pcr扩增的反应条件为:98℃预变性5min,95℃变形30s,53℃退火40s,72℃延伸1min,循环次数30次,72℃10min,16℃保温10min。用0.5%的琼脂糖凝胶进行电泳检测,其结果如图4所示,其中,泳道1为pcr扩增片段泳带,泳道m为trans2k plus ii dna marker。从图中可以看出泳道1出现了750bp左右的条带,其大小与预测的环二肽合成酶基因(750bp)大小相吻合。pcr引物为:12cdps-up:ccggaattcatgaatcaatcgctaaaa(含ecor i酶切位点);12cdps-down:cccaagcttttaatgtttgacgtcaaa(含hind iii酶切位点)。可以说明pcr成功扩增出环二肽合成酶基因。对其基因序列进行测序,其核苷酸序列如seq id no:1所示。最后,选用ecor i和hind iii酶切位点,构建ecor i cdps hind iii原核表达载体。
[0085]
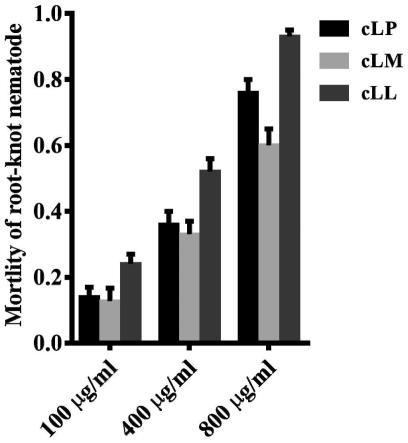
b.cdps基因与pet-28a( )载体连接:用ecori和hindiii将步骤a获得的环二肽合成酶基因从pcr产物上切下来,割胶回收切下的环二肽合成酶基因片段;将含有pet-28a( )载体的大肠杆菌,接种于lb培养基中,37℃,200rpm,培养10h,抽提质粒;采用ecor i和hind iii对pet-28a( )质粒进行双酶切(37℃,1h),用t4连接酶在16℃条件下过夜连接双酶切后的cdps基因和pet-28a( )载体,得到连接产物。
[0086]
从超低温冰箱取出dh5a感受态细胞(100μl/支),置于冰上融化,加入10μl连接产物,轻柔混匀,冰浴30min;42℃热激90s,冰浴5min,向ep管中加入500μl 37℃lb培养基,然后用封口膜封管口,37℃,200rpm恢复培养1h;4000g离心3-5min,弃大部分上清,将剩余的200μl细胞重悬,涂布于含100μg/ml的氨苄青霉素(amp)的lb培养基平板上,37℃倒置培养14h;鉴定长出的菌落,挑取阳性菌落在含amp(100μg/ml)的液体lb培养基中,37℃,200rpm,培养4h,抽提质粒,即得重组质粒。
[0087]
c.重组质粒转化bl21感受态细胞并诱导表达:将上述重组质粒转化大肠杆菌bl21感受态细胞中,得到含有重组质粒的重组大肠杆菌bl21,即重组菌株。将重组菌株接种于10ml新鲜lb培养基(100μg/ml amp)中,37℃,200rpm,培养12h,鉴定转化子并保存;按照1%接菌量接种于装有500ml液体lb培养基(100μg/ml amp)的1l三角瓶(4瓶)中,37℃,200rpm培养,当od
600
=0.6时,加入iptg至终浓度为0.1mm,37℃诱导培养4h,得到包含环二肽的培养物。
[0088]
(2)环二肽的分离鉴定
[0089]
a.环二肽的分离:12000rpm,离心上述诱导的培养物10min,去除菌体。上清用两倍体积的乙酸乙酯(含0.1ml/l的乙酸)萃取,萃取物60℃旋转蒸干,残留物用甲醇:乙腈(体积比为1:1)再溶解,离心,沉淀用色谱级乙腈再溶解,即为环二肽粗提液。
[0090]
b.环二肽纯品的制备:将上述粗提液采用高效液相色谱仪(water 1525)system分析,并设置主要技术参数如下:
[0091]
色谱柱:agilent c18反相柱(250mm
×
4.6mm,5μl)
[0092]
流动相:ddh2o(0.1wt%tfa)和乙腈
[0093]
流动相条件:0-30min,20%-60%乙腈梯度洗脱
[0094]
检测波长:210nm
[0095]
流速:1ml/min
[0096]
将30min内洗脱的差异峰(10min、11min和13min)流液反复收集多次,旋干、并作冻
干处理,将获得的粉末称重,溶于20%乙腈(ph 5.0),并在相同流动相条件下检测其纯度。
[0097]
c.环二肽的一级质谱分析:将上述环二肽纯品经过质谱仪agilent technologies 6540udhaccurate-mass q-tof lc/ms测定其分子量。
[0098]
一级质谱分析条件:
[0099]
毛细管电压:3,500v;
[0100]
喷雾压力:35lb/in2gauge;
[0101]
干燥气流速:9liters/min;
[0102]
温度:350℃;
[0103]
q-tof扫描范围:100-3,000m/z;
[0104]
数据采集速率:1spectrum/s。
[0105]
结果如图5-7所示,纯化得到的三种环二肽在分子量分别为210.14da、244.12da和226.17da(用单一同位素峰定)。该分子量与副地衣芽胞杆菌zzq-12分泌的环二肽在分子量为210.1368da(clp)、244.1246da(clm)和226.1681da(cll)几乎是吻合的,这证明得到的环二肽即为副地衣芽胞杆菌zzq-12分泌的环二肽clp、clm和cll。
[0106]
实施例4毒杀活性检测
[0107]
(1)取实施例1分离得到的副地衣芽胞杆菌zzq-12,接种于5ml lb液体培养基(配方:蛋白胨10g,酵母粉5g,氯化钠10g,补充蒸馏水至1l,ph7.0,121℃灭菌30min)中,于30℃过夜活化。将1ml的培养物转移至100ml lb液体培养基中,于30℃,220rpm培养30h,得到培养物。
[0108]
将育苗盆中生长20天的同批次番茄苗(长势一致)移栽至单个种植盆中,共八盆,从左到右依次摆放,并将左边四盆设定为lb对照组,将右边四盆设为试验组。对八盆番茄苗同时接种同等量的南方根结线虫。3天后,使用等量的上述培养物,对试验组四盆番茄苗分别进行灌根。60天后,统计根结数量、卵块数量和番茄长势,其中,番茄长势如图8所示。
[0109]
结果分析:根结数量自左向右依次为58、58、60、57、20、17、22、21,显然,右边四盆番茄苗的根结数量明显少于对照组;卵块数量自左向右依次为43、44、45、43、9、6、10、8,显然,右边四盆番茄苗的卵块数量明显少于对照组;从番茄长势来看,右边四盆番茄苗的长势明显优于对照组;说明副地衣芽胞杆菌zzq-12的培养物对南方根结线虫具有明显的毒杀活性。
[0110]
(2)将实施例3获得的环二肽纯品制成终浓度为800μg/ml以及稀释的100μg/ml与400μg/ml的试验样品,对根结线虫进行毒杀试验,结果如图9所示。
[0111]
从图中可以看出,环二肽clp、clm以及cll均有杀线虫活性,且环二肽cll的活性最高,其浓度为800μg/ml时,对根结线虫的致死率接近100%。
[0112]
以上仅为本发明的优选实施例,并非因此限制本发明的专利范围,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包括在本发明的专利保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。