1.本发明涉及生物技术领域,具体地,涉及一种基因表达调控系统及其应用。
背景技术:
2.crispr-cas系统是一种广泛存在于原核生物中对抗噬菌体等外源可移动基因元件入侵的适应性免疫系统,crispr-cas系统的发现推动分子生物学发生了前所未有的变革,在基因编辑、分子诊断、高通量筛选、细菌耐药研究等多个技术领域得到了广泛应用。目前crispr-cas系统也被开发应用于基因的转录抑制,利用一个向导rna(grna)引导cas效应复合体或者缺失了核酸酶活性的cas效应蛋白(如dcas9)至特定的靶标位置,通过阻止rna聚合酶与靶标基因启动子的结合或阻止rna聚合酶在dna链上的延伸实现对靶标基因转录的抑制,引起相应的表型变化从而可以明确靶标基因的功能。该方法能够准确、高效地靶向任一基因并抑制基因表达,提高了基因功能研究的效率。
3.目前已经发现的crispr-cas系统主要分为两类六型,其中1类系统由多个cas蛋白所组成的效应复合体对靶标核酸序列执行剪切降解,包括i、iii和iv型;2类系统则由单一cas效应蛋白对靶标核酸序列执行剪切降解,包括ii、v和vi型。由于2类系统效应蛋白比如dcas9结构的单一性,目前绝大多数crispr-cas相关的转录抑制技术开发都集中围绕于dcas9展开,利用第1类系统特别是自然界中含量最丰富的i型系统对基因表达进行抑制的研究却鲜有报道。
4.据研究表明,i型系统在细菌特别是非模式菌株中具有较cas9更为高效的靶向效率,开发基于i型系统的转录抑制技术将有望在更加广泛的细菌宿主中实现更为高效的基因转录抑制。但由于i型系统结构组成复杂,目前在异源细菌宿主中表达i型系统用于基因转录抑制的方法需将整个i型系统编码基因簇整合于细菌的基因组中,这将不可避免地对宿主基因组造成非预期的改变(doi:10.1093/nar/gkab521)。如何在异源细菌宿主中使用质粒系统更为便捷地表达i型cas效应复合体和grna对靶标基因的转录进行抑制尚未有报道。
技术实现要素:
5.为了解决现有技术中制约i型crispr-cas系统在异源细菌宿主中的应用难题,本发明提供了一种基因表达调控系统及其应用。
6.本发明的第一个目的是提供一种用于基因表达调控的组合物。
7.本发明的第二个目的是提供一种用于基因表达调控的质粒组合物。
8.本发明的第三个目的是提供上述组合物和/或上述质粒组合物在基因表达调控中的应用。
9.本发明的第四个目的是提供一种基因表达调控的方法。
10.为了实现上述目的,本发明是通过以下方案予以实现的:
11.本发明基于铜绿假单胞菌ucbpp-pa14中的i-f型crispr-cas系统(也称csy系统),
在大肠杆菌中通过设计建立了能够分别稳定表达4种csy蛋白和1个grna的双质粒系统,并将其应用于对靶标基因的转录表达调控。
12.一种用于基因表达调控的组合物,所述组合物包含csy效应蛋白及mini-crispr,或包含csy效应蛋白及grna;所述csy效应蛋白的核苷酸序列如seq id no.1所示;所述mini-crispr含有靶标序列,在靶标序列的5’端和3’端均有核苷酸序列如seq id no.5所示的序列;所述grna从5’端到3’端依次为核苷酸序列如seq id no.6所示的序列、靶标序列rna、核苷酸序列如seq id no.7所示的序列,所述靶标序列rna为将靶标序列中的“t”换为“u”的rna。
13.优选地,所述靶标序列为:在靶标基因中,正义链或反义链上的“5
’‑
cc-3
’”
序列下游紧跟的长度为32bp的核苷酸序列。
14.更优选地,所述靶标序列为:在靶标基因的启动子区域中,正义链或反义链上的“5
’‑
cc-3
’”
序列下游紧跟的长度为32bp的核苷酸序列。
15.所述csy效应蛋白即为核苷酸序列如seq id no.1所示的csy基因簇编码的4种csy蛋白组成的复合体。
16.待mini-crispr转录出rna后,csy4蛋白识别该rna中核苷酸序列如seq id no.5所示序列对应的部分,将该rna剪切加工成一个成熟的grna;grna继续与其余csy蛋白结合组装成复合体后,通过grna中靶标序列rna与受体细胞基因组上靶标序列的互补配对将csy蛋白复合体结合于靶标序列处,通过阻止rna聚合酶与启动子的结合抑制靶标基因的表达。
17.一种用于基因表达调控的质粒组合物,包含质粒1和质粒2,其中质粒1为表达核苷酸序列如seq id no.1所示的序列的质粒;质粒2为表达mini-crispr的质粒,所述mini-crispr含有靶标序列,在靶标序列的5’端和3’端均有核苷酸序列如seq id no.5所示的序列。
18.优选地,所述质粒1中,核苷酸序列如seq id no.1所示的序列上游有核苷酸序列如seq id no.2所示的ptrc启动子。
19.更优选地,所述质粒1的核苷酸序列如seq id no.3所示。
20.优选地,所述质粒2中,mini-crispr的上游有核苷酸序列如seq id no.2所示的ptrc启动子。
21.核苷酸序列如seq id no.2所示的ptrc启动子既可以启动核苷酸序列如seq id no.1所示的csy基因簇的表达,又可以启动mini-crispr的表达。
22.上述组合物和/或上述质粒组合物在基因表达调控中的应用也应在本发明的保护范围之内。
23.优选地,所述基因表达调控为抑制基因的转录表达。
24.一种基因表达调控的方法,将上述质粒组合物导入靶细胞。
25.优选地,所述方法包括以下步骤:先将质粒1导入靶细胞;再将质粒2导入上一步所得的细胞。
26.优选地,所述靶细胞为大肠杆菌感受态细胞。
27.更优选地,所述大肠杆菌为mg1655菌株。
28.优选地,所述导入靶细胞的方法为电转化法。
29.与现有技术相比,本发明具有以下有益效果:
30.本发明提供的i-f型crispr-cas双质粒系统能够准确识别并结合靶标基因的启动子区域,通过常规质粒转化即可实现对靶标基因转录表达的有效抑制,实验表明具有可行性与高效性。该系统在细菌基因功能研究中具有明显的简便性,同时在细菌生理学研究、代谢通路改造、天然化合物合成、药物靶点发现、新型药物开发、高通量筛选等方面都具有广阔的应用前景。
附图说明
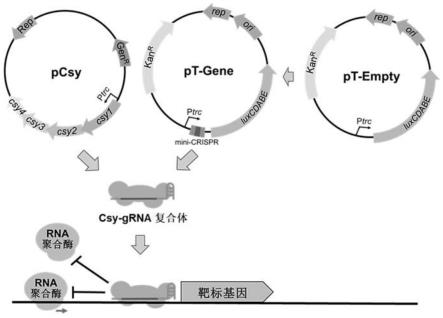
31.图1为i-f型crispr-cas双质粒系统的构成及工作原理的示意图;i-f型crispr-cas双质粒系统包括两个基本质粒:pcsy质粒和pt-empty质粒;i-f型crispr-cas双质粒系统的工作过程为:pt-empty质粒经过加工,连接有靶向靶标基因的mini-crispr,形成pt-gene质粒;pt-gene质粒转录出mini-crispr,经pcsy质粒转录翻译出的csy4蛋白加工形成成熟的grna;grna与其余csy蛋白结合组装成csy-grna复合体,通过grna中靶标序列rna与靶标基因启动子上的靶标序列进行互补配对,将csy蛋白复合体结合于靶标序列处,通过阻止rna聚合酶与启动子的结合抑制靶标基因的表达。
32.图2为mg1655 pcsy菌株中csy基因簇里4个csy基因表达的扩增曲线。
33.图3为mg1655 pcsy-pt-empty菌株、mg1655 pcsy-pt-lacz1菌株、mg1655 pcsy-pt-lacz2菌株的lux发光值测定。
34.图4为mg1655 pcsy-pt-lacz1菌株、mg1655 pcsy-pt-lacz2菌株中的lacz基因相对于mg1655 pcsy-pt-empty菌株中lacz基因的表达量。
35.图5为mg1655 pcsy-pt-empty菌株、mg1655 pcsy-pt-lacz1菌株、mg1655 pcsy-pt-lacz2菌株中的β-半乳糖苷酶活性。
具体实施方式
36.下面结合说明书附图及具体实施例对本发明做出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
37.本发明所用生物材料:感受态大肠杆菌dh5α菌株购自北京全式金生物技术有限公司(货号:cd201-02);pbbr1-mcs5质粒、pms402质粒、pacrispr质粒、铜绿假单胞菌ucbpp-pa14菌株、大肠杆菌mg1655菌株均由华南农业大学群体微生物研究中心保存。
38.本发明所用试剂材料:庆大霉素购自北京鼎国昌盛生物技术有限责任公司(货号:ag139);卡那霉素购自北京鼎国昌盛生物技术有限责任公司(货号:ak177);isopropylβ-d-1-thiogalactopyranoside(iptg)购自北京鼎国昌盛生物技术有限责任公司(货号:ci175);ortho-nitrophenyl-β-galactoside(onpg)购自北京索莱宝科技有限公司(货号:o8040)。
39.实施例1 pcsy质粒的构建
40.以pbbr1-mcs5质粒为骨架,搭载来源于铜绿假单胞菌ucbpp-pa14基因组(ncbi基因组序列号:nc_008463.1)的csy基因簇(seq id no.1),由ptrc启动子(seq id no.2)驱动csy基因簇的表达。
41.pcsy质粒的具体构建方法如下:
42.1、以pacrispr质粒(addgene:plasmid#113348)为模板扩增ptrc启动子片段
43.(1)根据pacrispr质粒的序列,设计上游扩增引物ptrc启动子5’primer-1:5
’‑
gataagcttgatatcgaattccatatggtatacactttgccctttaca-3’及下游扩增引物ptrc启动子3’primer-1:5
’‑
cgaaagctgtgctcctgtttaaactctagaactagtcttgctatttctagctctaaaac-3’,序列中下划线标注的为用于扩增的引物序列,其余为克隆连接所需的同源臂序列及新引入的限制酶识别位点序列。
44.(2)使用vazyme公司的2
×
phanta flash master mix(dye plus)对ptrc片段进行pcr扩增。反应体系为:milliq h2o,20μl;ptrc启动子5’primer-1(10μm),2μl;ptrc启动子3’primer-1(10μm),2μl;2
×
phanta flash master mix(dye plus),25μl;pacrispr质粒,1μl。反应程序为:98℃,30s;98℃,10s,60℃,5s,72℃,5s,共35个循环;72℃,1min。
45.(3)使用天根生化科技(北京)有限公司生产的universal dna纯化回收试剂盒(dp214)对pcr产物进行回收,具体步骤按照试剂盒说明书进行操作,即得到ptrc启动子片段-1。
46.2、以ucbpp-pa14基因组dna为模板扩增csy基因簇
47.(1)使用北京全式金生物(transgen biotech)生产的genomic dna kit(目录号:ee101-01v)提取铜绿假单胞菌ucbpp-pa14的基因组(ncbi基因组序列号:nc_008463.1),具体步骤根据试剂盒使用操作手册进行。
48.(2)以ucbpp-pa14基因组dna(ncbi基因组序列号:nc_008463.1)为模板,通过pcr扩增得到含有csy1、csy2、csy3、csy4基因的csy基因簇。
49.所用上游扩增引物为csy基因簇5’primer:5
’‑
actagttctagagtttaaacaggagcacagctttcgaatgc-3’及csy基因簇3’primer:5
’‑
ctatagggcgaattggagctccggccagcagccctgaag-3’,序列中下划线标注的为用于扩增的引物序列,其余为克隆连接所需的同源臂序列及新引入的限制酶识别位点序列。
50.(3)使用天根生化科技(北京)有限公司生产的universal dna纯化回收试剂盒(dp214)对pcr产物进行回收,具体步骤按照试剂盒说明书进行操作,即得到csy基因簇片段。
51.3、酶切连接
52.(1)用ecori-hf(购自neb公司)和saci(购自neb公司)对pbbr1-mcs5质粒进行双酶切,反应体系为:10
×
rcutsmart buffer,5μl;pbbr1-mcs5质粒,5μg;ecori-hf,2μl;saci,2μl;milliq h2o补足至50μl。37℃酶切2h,即得到酶切后的pbbr1-mcs5质粒。
53.(2)用ultra one step cloning kit(购自南京诺唯赞生物科技股份有限公司)将酶切后的pbbr1-mcs5质粒和本实施例步骤1所得的ptrc启动子片段-1及本实施例步骤2所得的csy基因簇片段进行连接。反应体系为:2
×
mix,5μl;酶切后的pbbr1-mcs5质粒,100ng;ptrc启动子片段-1,50ng;csy基因簇片段,50ng;milliq h2o补足至10μl。
54.50℃反应15min后,置于冰上3~5min,加入感受态大肠杆菌dh5α细胞;经过42℃热激45s后,加入1ml lb液体培养基,37℃复苏1h;将菌液涂布到含有25μg/ml庆大霉素的lb固
体培养基上,置于37℃培养箱倒置培养16h。
55.4、鉴定
56.挑取培养基上长出的菌落,用10μlmilliq h2o重悬菌落后进行pcr鉴定,所用鉴定引物为:pcsy质粒5’primer:5
’‑
ggctcgtatgttgtgtggaa-3’、pcsy质粒3’primer:5
’‑
tcttcgctattacgccagct-3’。反应体系为:milliq h2o,20μl;pcsy质粒5’primer(10μm),2μl;pcsy质粒3’primer(10μm),2μl;2
×
t5super pcr mix(colony)(北京擎科生物科技有限公司),25μl;菌落重悬液,1μl。
57.将pcr产物送至生工生物工程(上海)股份有限公司进行测序确认。
58.用天根生化科技(北京)有限公司生产的质粒小提试剂盒(dp103)提取经测序验证正确的质粒,即得到pcsy质粒(seq id no.3)。
59.本发明提供的pcsy质粒(seq id no.3)的结构如图1中的“pcsy”所示,用于表达csy基因簇,该质粒具有宿主范围广、拷贝数高、表达稳定等特点。
60.实施例2 pt-empty质粒的构建
61.以pms402质粒为骨架,首先在xhoi与bamhi位点之间引入ptrc启动子及其它限制酶识别位点比如kpni,用于后续连接mini-crispr。
62.pt-empty质粒的具体构建方法如下:
63.1、以pacrispr质粒(addgene:plasmid#113348)为模板扩增ptrc启动子片段
64.(1)根据pacrispr质粒的序列,设计上游扩增引物ptrc启动子5’primer-2:5
’‑
ccctttcgtcttcacctcgaggtatacactttgccctttacacatttt-3’及下游扩增引物ptrc启动子3’primer-2:5
’‑
gccgcaactagaggatccgcggaattccgggtacccttgctatttctagctctaaaac-3’,序列中下划线标注的为用于扩增的引物序列,其余为克隆连接所需的同源臂序列及新引入的限制酶识别位点序列。
65.(2)使用vazyme公司的2
×
phanta flash master mix(dye plus)对ptrc片段进行pcr扩增。反应体系为:milliq h2o,20μl;ptrc启动子5’primer-2(10μm),2μl;ptrc启动子3’primer-2(10μm),2μl;2
×
phanta flash master mix(dye plus),25μl;pacrispr质粒,1μl。反应程序为:98℃,30s;98℃,10s,60℃,5s,72℃,5s,共35个循环;72℃,1min。
66.(3)使用天根生化科技(北京)有限公司生产的universal dna纯化回收试剂盒(dp214)对pcr产物进行回收,具体步骤按照试剂盒说明书进行操作,即得到ptrc启动子片段-2。
67.2、酶切连接
68.(1)用xhoi(购自neb公司)和bamhi-hf(购自neb公司)对pms402质粒进行酶切,反应体系为:10
×
rcutsmart buffer,5μl;pms402质粒,5μg;xhoi,2μl;bamhi-hf,2μl;milliq h2o补足至50μl。37℃酶切2h,即得到酶切后的pms402质粒。
69.(2)用ultra one step cloning kit(购自南京诺唯赞生物科技股份有限公司)将酶切后的pms402质粒和本实施例步骤1所得ptrc启动子片段-2,进行连接。反应体系为:2
×
mix,5μl;酶切后的pms402质粒,250ng;ptrc启动子片段-2,50ng;milliq h2o补足至10μl。
70.50℃反应15min后,置于冰上3~5min,加入感受态大肠杆菌dh5α细胞;经过42℃热
激45s后,加入1ml lb液体培养基,37℃复苏1h;将菌液涂布到含有50μg/ml卡那霉素的lb固体培养基上,置于37℃培养箱倒置培养16h。
71.3、鉴定
72.挑取培养基上长出的菌落,用10μlmilliq h2o重悬菌落后进行pcr鉴定,所用鉴定引物为:pt-empty质粒5’primer:5
’‑
ccgacgtctaagaaaccatt-3’、pt-empty质粒3’primer:5
’‑
tagtcatatttgccatccat-3’。反应体系为:milliq h2o,20μl;pt-empty质粒5’primer(10μm),2μl;pt-empty质粒3’primer(10μm),2μl;2
×
t5 super pcr mix(colony)(北京擎科生物科技有限公司),25μl;菌落重悬液,1μl。
73.将pcr产物送至生工生物工程(上海)股份有限公司进行测序确认。
74.用天根生化科技(北京)有限公司生产的质粒小提试剂盒(dp103)提取经测序验证正确的质粒,即得到pt-empty质粒(seq id no.4)。
75.本发明提供的pt-empty质粒(seq id no.4)的结构如图1中的“pt-empty”所示,ptrc启动子除了驱动mini-crispr的表达,还同时驱动编码荧光脂酶的结构基因luxa、luxb、luxc、luxd、luxe的表达,即可通过检测lux发光值来确定mini-crispr是否表达。
76.实施例3 pt-gene质粒的构建(以lacz基因为例)
77.pt-gene质粒的结构如图1中的“pt-gene”所示。
78.以大肠杆菌mg1655(ncbi基因组序列号:nc_000913.3)的lacz基因(基因id:945006)作为靶标基因,构建pt-lacz质粒。
79.(1)grna表达序列——mini-crispr的设计
80.在lacz基因(基因id:945006)的启动子区域中,选取核苷酸序列为“5
’‑
cc-3
’”
下游连接的32bp核苷酸序列作为靶标序列设计grna,本发明中将grna的表达序列命名为mini-crispr。
81.本实施例在lacz基因(基因id:945006)的启动子区域中选取如下两段不同的序列作为grna的靶标序列:
82.lacz1:5
’‑
gctcacaattccacacaacatacgagccggaa-3’;
83.lacz2:5
’‑
tgtgtgaaattgttatccgctcacaattccac-3’。
84.根据lacz1的序列设计mini-crispr-lacz1:lacz1:根据lacz2的序列设计mini-crispr-lacz2:lacz2:上述序列中,方框标注的为mini-crispr的5’端和3’端固定序列(seq id no.5),中间无标注的为grna的靶标序列。
85.待mini-crispr转录出rna后,csy4蛋白识别该rna中核苷酸序列如seq id no.5所示序列对应的部分,将该rna剪切加工成一个成熟的grna。
86.mini-crispr-lacz1对应的grna-lacz1为
mini-crispr-lacz2对应的grna-lacz2为lacz2为上述序列中,5’端方框标注的为核苷酸序列如seq id no.6所示的grna固定序列,3’端方框标注的为核苷酸序列如seq id no.7所示的grna固定序列,中间无标注的为grna的靶标序列rna,该靶标序列rna为将靶标序列中的“t”换为“u”的rna。
87.成熟的grna继续与其余csy蛋白结合组装成复合体后,通过grna的靶标序列rna与受体细胞基因组上靶标序列的互补配对将csy蛋白复合体结合于靶标序列处。
88.(2)将mini-crispr-lacz1和mini-crispr-lacz2的序列送交生工生物生工生物工程(上海)股份有限公司,以pt-empty质粒(seq id no.4)为骨架,在kpni与bamhi位点之间插入mini-crispr-lacz1或mini-crispr-lacz2,合成即得到分别含有mini-crispr-lacz1和mini-crispr-lacz2的pt-gene质粒,分别命名为pt-lacz1质粒和pt-lacz2质粒。
89.实施例4 i-f型crispr-cas双质粒系统的构建
90.1、电转感受态细胞的制备
91.(1)将冻存的大肠杆菌mg1655菌株在lb固体培养基上划线复苏。挑取一个单菌落于2ml lb液体培养基中37℃振摇(200rpm)培养过夜(约16h)。第二天取100μl菌液转接到10ml新鲜的lb培养基中,在37℃摇床中以200rpm转速继续振摇培养。
92.(2)当菌液od600达到0.6左右,将大肠杆菌mg1655菌液置于冰上冷却30min,在4℃离心机中以4500rpm的转速离心10min。小心弃去上清,再将底部细菌沉淀重悬于5ml经灭菌、预冷处理的milliq h2o中。
93.(3)重复离心和重悬步骤3次之后,将细菌沉淀重悬于0.2ml经灭菌、预冷处理的milliq h2o中,即获得大肠杆菌mg1655电转感受态细胞。
94.2、大肠杆菌mg1655电转感受态细胞电转
95.(1)取0.1ml感受态细胞与500ng实施例1所得pcsy质粒(seq id no.3)混匀,转移至间隙为2mm的电转杯中进行电击,反应程序为:脉冲参数25af;200ω;2.5kv。
96.(2)电击结束后,立即加入1ml lb液体培养基混匀,并转移到培养管中,在37℃摇床中以200rpm转速孵育1h。
97.(3)5000rpm室温离心5min后,去除900μl的上清,并以剩余的上清重悬菌体,将重悬液涂布于含有25μg/ml庆大霉素的lb固体培养基上,于37℃培养箱中倒置培养16h,即获得含有pcsy质粒的mg1655菌株,命名为mg1655 pcsy菌株。
98.3、mg1655 pcsy菌株电转感受态细胞的制备
99.按照本实施例步骤1的方法制备得到mg1655 pcsy菌株电转感受态细胞。
100.4、mg1655 pcsy菌株电转感受态细胞电转
101.按照本实施例步骤2的方法,分别将实施例2所得pt-empty质粒(seq id no.4)、实施例3所得pt-lacz1质粒和pt-lacz2质粒通过电击转化至mg1655 pcsy菌株电转感受态细胞,即获得分别含有pt-empty质粒(seq id no.4)、实施例3所得pt-lacz1质粒和pt-lacz2质粒的mg1655 pcsy菌株,分别命名为mg1655 pcsy-pt-empty菌株、mg1655 pcsy-pt-lacz1菌株、mg1655 pcsy-pt-lacz2菌株。
102.mg1655 pcsy-pt-lacz1菌株、mg1655 pcsy-pt-lacz2菌株同时含有一个pcsy质粒
(seq id no.3)和一个pt-lacz质粒(分别为pt-lacz1与pt-lacz2),其中pcsy质粒(seq id no.3)能够表达四种csy蛋白,pt-lacz1与pt-lacz2质粒能够表达靶向lacz基因启动子的grna。如图1所示,由csy蛋白与grna所组成的csy-grna复合体将在grna的引导下特异性地结合于基因组中lacz基因的启动子,通过阻止rna聚合酶与启动子的结合,抑制lacz基因的转录表达。
103.实施例5双质粒电转菌株的功能鉴定
104.一、实验方法
105.1、csy基因的表达鉴定
106.(1)挑取1个mg1655 pcsy-pt-empty菌株单菌落,在含有25μg/ml庆大霉素和50μg/ml卡那霉素的lb液体培养基中37℃振摇(200rpm)培养过夜(约16h)。取100μl菌液转接到10ml含有25μg/ml庆大霉素和50μg/ml卡那霉素以及0.5mm iptg的lb液体培养基中,在37℃摇床中以200rpm转速继续振摇培养使od600达到0.4~0.5。
107.(2)以13000rpm的转速离心1min,收集1ml mg1655 pcsy-pt-empty菌株的菌液,使用rna提取试剂盒(购自上海普洛麦格生物产品有限公司,lot号:0000465711)提取细菌总rna,具体步骤按照试剂盒说明书进行操作。
108.(3)取1μg细菌总rna,使用反转录试剂盒(购自北京全式金生物(transgen biotech),目录号:at311-02)反转录合成cdna,具体步骤按照试剂盒说明书进行操作。
109.(4)将cdna产物稀释20倍,使用翌圣生物科技(上海)股份有限公司的hieff power qpcr sybr green master mix(货号:11196es08)试剂盒进行qpcr实验。所用检测引物如表1所示。
110.表1 qpcr引物信息
[0111][0112]
反应体系为:2
×
power qpcr sybr green master mix,10μl;csy1-f/csy2-f/csy3-f/csy4-f(10μm),1μl;csy1-r/csy2-r/csy3-r/csy4-r(10μm),1μl;cdna,1μl;milliq h2o,7μl。反应程序为:95℃,30s;95℃,10s,60℃,30s,共40个循环。在abi quantstudio 6实时荧光定量pcr仪(life technologies)进行qpcr反应,记录mg1655 pcsy-pt-empty菌株中csy1基因、csy2基因、csy3基因、csy4基因的扩增曲线。
[0113]
2、靶标基因lacz的表达鉴定
[0114]
(1)分别挑取mg1655 pcsy-pt-empty菌株、mg1655 pcsy-pt-lacz1菌株、mg1655 pcsy-pt-lacz2菌株的单菌落各2个,在含有25μg/ml庆大霉素和50μg/ml卡那霉素的lb液体培养基中37℃振摇(200rpm)培养过夜(约16h)。分别取100μlmg1655 pcsy-pt-empty菌株、
mg1655 pcsy-pt-lacz1菌株、mg1655 pcsy-pt-lacz2菌株的菌液转接到10ml含有25μg/ml庆大霉素、50μg/ml卡那霉素以及0.5mm iptg的lb液体培养基中,在37℃摇床中以200rpm转速继续振摇培养使od600达到0.4~0.5。
[0115]
(2)分别吸取0.2mlmg1655 pcsy-pt-empty菌株、mg1655 pcsy-pt-lacz1菌株、mg1655 pcsy-pt-lacz2菌株的菌液于白色96孔板中,用酶标仪(biotek)分别测定三种菌液的lux发光值。
[0116]
(3)按照本实施例步骤1的方法分别提取mg1655 pcsy-pt-empty菌株、mg1655 pcsy-pt-lacz1菌株、mg1655 pcsy-pt-lacz2菌株的总rna、反转录合成cdna、qpcr反应。所用检测引物为lacz-f:5
’‑
tgttccgtcatagcgataa-3’、lacz-r:5
’‑
gttcaggcagttcaatcaa-3’。使用2-δδct
的方法分析mg1655 pcsy-pt-empty菌株、mg1655 pcsy-pt-lacz1菌株、mg1655 pcsy-pt-lacz2菌株中lacz基因的相对表达情况。
[0117]
3、β-半乳糖苷酶活性测定
[0118]
(1)分别挑取mg1655 pcsy-pt-empty菌株、mg1655 pcsy-pt-lacz1菌株、mg1655 pcsy-pt-lacz2菌株的单菌落各2个,在含有25μg/ml庆大霉素和50μg/ml卡那霉素的lb液体培养基中37℃振摇(200rpm)培养过夜(约16h)。将100μlmg1655 pcsy-pt-empty菌株、mg1655 pcsy-pt-lacz1菌株、mg1655 pcsy-pt-lacz2菌株的菌液转接到10ml含有25μg/ml庆大霉素、50μg/ml卡那霉素以及0.5mm iptg的lb液体培养基中,在37℃摇床中以200rpm转速继续振摇培养使od600达到0.4~0.5,记录od600数值。
[0119]
(2)分别取0.2mlmg1655 pcsy-pt-empty菌株、mg1655 pcsy-pt-lacz1菌株、mg1655 pcsy-pt-lacz2菌株的菌液与0.2ml含有0.27%β-巯基乙醇的z buffer(60mm na2hpo4·
7h2o,10mm kcl,40mm nah2po4·
h2o,1mm mgso4·
7h2o)混合,加入20μl 0.1%sds、10μl氯仿,剧烈震荡5min,置于37℃水浴锅中孵育5min。
[0120]
(3)加入200μl 8.8mg/mlonpg,开始计时;继续在37℃水浴锅中反应,直至溶液颜色变黄;加入500μl 1m na2co3,停止计时。
[0121]
(4)记录反应液的od420与od550值并计算β-半乳糖苷酶的活性。
[0122]
二、实验结果
[0123]
如图2所示,qpcr成功检测到4个csy基因(csy1基因、csy2基因、csy3基因、csy4基因)在mg1655 pcsy-pt-empty菌株中的扩增曲线,说明pcsy质粒所搭载的csy基因簇能够在大肠杆菌mg1655中稳定表达。
[0124]
如图3所示,mg1655 pcsy-pt-empty菌株、mg1655 pcsy-pt-lacz1菌株、mg1655 pcsy-pt-lacz2菌株的菌液样品中均能检测到较高的发光值,说明mg1655 pcsy-pt-lacz1菌株、mg1655 pcsy-pt-lacz2菌株中的grna均已表达。
[0125]
如图4所示,相比于mg1655 pcsy-pt-empty菌株,mg1655 pcsy-pt-lacz1菌株和mg1655 pcsy-pt-lacz2菌株中lacz基因的表达量分别降低了94%和97%,说明靶标基因lacz的转录表达被有效抑制。
[0126]
如图5所示,相比于mg1655 pcsy-pt-empty菌株,mg1655 pcsy-pt-lacz1菌株和mg1655 pcsy-pt-lacz2菌株的β-半乳糖苷酶活性分别降低97%和94%,说明靶标基因lacz的蛋白表达被有效抑制。
[0127]
综上述结果表明,本发明成功构建能够抑制靶标基因表达的i-f型crispr-cas双
质粒系统,该双质粒系统具有可行性与高效性,通过常规的质粒转化即可实现对靶标基因的有效抑制,抑制率高达94%以上。
[0128]
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,对于本领域的普通技术人员来说,在上述说明及思路的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。