一种重组sortasea酶及其固定化方法和应用
技术领域
1.本发明属于生物工程领域,尤其涉及一种重组sortasea酶及其固定化方法和应用。
背景技术:
2.从金黄色葡萄球菌中分离得到的转肽酶sortasea可以特异性识别并结合蛋白质c端的lpxtg序列,切断苏氨酸和甘氨酸之间的肽键后,将其与另外一个n末端含有甘氨酸残基的肽链通过肽键相连。基于此功能,sortasea酶可用于蛋白质的合成与修饰;
3.近年来,sortasea已被广泛应用于蛋白质末端的修饰。利用sortasea所催化的转肽反应,研究发现可以将任何感兴趣的水溶性修饰基团添加到蛋白质的末端,包括生物素、荧光素和交联剂等功能基团;
4.尽管sortasea酶因为其转肽酶活性,广泛地应用于蛋白质的合成与修饰反应中,但是由于其还具有水解酶活性,其修饰后的产物又会被sortasea作为底物重新被水解从而使修饰后的分子被掉落,即反应结束后sortasea不易从反应体系中分离。目前解决的方案是通过及时将反应体系中多余的sortasea去除的方式减少其水解反应的发生。常用的去除方法是在sortasea的末端引入一个亲和标签,如6his,利用亲和吸附原理将酶与产物进行分离。该方法需要一步完整的亲和纯化过程,耗时长且成本较高,因此,本发明提供了一种利用半胱氨酸固定sortasea酶的方法及其应用。
技术实现要素:
5.为了解决上述问题,本发明的首要目的在于提供一种重组sortasea酶及其固定化方法和应用。
6.本发明的具体技术方案包括:
7.本发明提供了一种重组sortasea酶,所述重组sortasea酶是通过在sortasea酶的c末端引入一个半胱氨酸进行序列改造得到的,该重组sortasea酶的蛋白序列如seq id no.1所示。
8.作为本发明的进一步优化方案,表达重组sortasea酶的载体为pet-28a,表达重组sortasea酶的菌株为大肠杆菌bl21。
9.本发明还提供了如上述任一所述的重组sortasea酶的编码基因,所述编码重组sortasea酶的基因的核苷酸序列如seq id no.2所示。
10.本发明还提供了一种如权利要求上述所述的重组sortasea酶在蛋白质的合成与修饰中的应用。
11.本发明还提供了一种如上述所述的重组sortasea酶的固定化方法,利用半胱氨酸将sortasea酶通过巯基偶联固定到商品化树脂上,所述商业化树脂中的碘乙酸基团与重组sortasea酶暴露的巯基形成共价且不可逆硫醚键、并发生特异性高效反应,可永久性地将重组sortasea酶连接到树脂上。
12.本发明还提供了一种如上述所述的固定化sortasea酶在蛋白质的合成与修饰中的应用。
13.作为本发明的进一步优化方案,所述固定化sortasea酶发挥蛋白修饰功能后,使用低速离心机,在3000rpm离心5min后即可去除固定化sortasea酶。
14.本发明利用半胱氨酸可以与巯基偶联的原理,在sortasea酶的c端加上半胱氨酸,再将重组sortasea固定在树脂上,该固定化的流程操作简单,反应高效且特异强,此外,该固定化方法不可逆,固定化的重组sortasea酶不易脱落。而且固定化重组sortasea酶仍然能够保持很高的转肽酶活性,该活性可以应用于蛋白质的合成和修饰过程中,其中的蛋白修饰包括生物素标记、荧光标记等,标记后的蛋白可以用于生化分析检测,如荧光共振能量转移(fret)、表面等离子共振(spr)、微量热泳动仪(mst)、活细胞检测等实验;另外,本发明可以直接通过离心将固定化sortasea酶进行反应后的去除,即只需3000rpm下离心5min就可高效快速去除反应中剩余的sortasea酶,且无残留。避免了剩余sortasea所带来的水解可逆反应,大大提高了sortasea酶在蛋白质修饰功能中的高效性。
15.综上所述,本发明的有益效果为:
16.本发明通过在sortasea酶的末端引入一个半胱氨酸,利用巯基共价偶联的原理,将重组sortasea酶固定到商品化的偶联树脂上,反应结束后,只需要通过简单的离心方法,即可将sortasea酶去除,该方法大幅度地减少了操作的时间、实现了基本以零成本的方式去除了反应中多余的sortasea酶,提高了sortasea酶在蛋白质的合成与修饰中的应用价值。
附图说明
17.图1为重组sortasea酶的表达及纯化结果;
18.图2为野生型sortasea酶的表达及纯化结果;
19.图3为重组sortasea酶的蛋白质量检测结果;
20.图4为野生型sortasea酶的蛋白质粒检测结果;
21.图5为固定化sortasea酶的活性检测结果;
22.图6为野生型sortasea酶的活性检测结果;
23.图7为固定化重组sortasea酶进行蛋白质修饰功能的lc-ms检测结果;
24.图8为固定化野生型sortasea酶进行蛋白质修饰功能的lc-ms检测结果。
具体实施方式
25.下面结合附图对本技术作进一步详细描述,有必要在此指出的是,以下具体实施方式只用于对本技术进行进一步的说明,不能理解为对本技术保护范围的限制,该领域的技术人员可以根据上述申请内容对本技术做出一些非本质的改进和调整。
26.一、材料
27.本实施例所用方法如无特别说明均为本领域的技术人员所知晓的常规方法,所用的试剂等材料,如无特别说明,均为市售购买产品。
28.二、方法
29.1、蛋白纯化及蛋白质量检测
30.(1)按照seq id no.2所示核苷酸序列人工合成重组sortasea酶序列,将重组sortasea酶序列插入到pet-28a载体上,并导入大肠杆菌bl21感受态细胞中,获得重组sortasea酶表达菌株;同时,以c端未添加半胱氨酸的野生型sortasea酶序列为对照,将野生型sortasea酶序列插入到pet-28a载体上,并导入大肠杆菌bl21感受态细胞中,获得野生型sortasea酶表达菌株,野生型sortasea酶的蛋白序列见no.3。
31.(2)诱导表达融合蛋白:将明显表达的两种类型的菌株分别接种至50ml lb液体培养基中37℃培养过夜,将过夜培养的细菌按1:100的比例接至5l lb液体培养基中,37℃培养至菌液od600为0.6-0.8时加入0.5mm iptg,15℃培养过夜,5000rpm离心收集菌体。
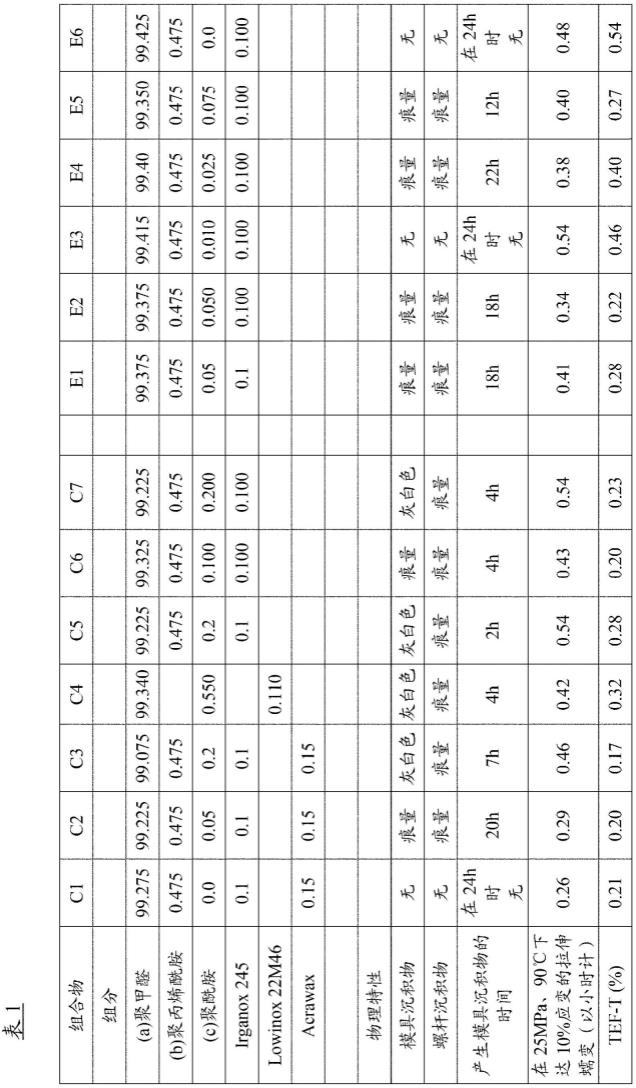
32.(3)蛋白纯化:将收集的两种类型的菌体分别进行称重,按照质量比1:10的比例加入相应体积的裂解缓冲液(50mm tris-hcl(ph8.0),500mm nacl,5%glycerol),使用高压均质机破碎菌体,16000rpm高速离心收集上清。使用亲和层析his ff富集纯化蛋白,纯化前先用裂解buffer平衡his ff柱,将所有细胞上清挂柱后,用含咪唑的溶液洗脱,收集洗脱下的蛋白进行sds-page检测,并用nanodrop测定蛋白浓度,计算蛋白产量,重组sortasea酶和野生型sortasea酶的蛋白纯化结果分别如图1和图2所示,与野生型sortasea酶相比,重组sortasea酶纯度更高。
33.(4)蛋白质量检测:分别将咪唑洗脱下的重组sortasea酶和野生型sortasea酶蛋白取少量分别进行质谱和分子筛检测。质谱检测重组sortasea酶的分子量为17016.37da,与其理论分子量17017.99da非常接近,表明his ff纯化后的重组sortasea蛋白为目标蛋白;野生型sortasea酶的分子量为17780.97da,与其理论分子量17781.81da非常接近。此外,分子筛的结果显示,重组sortasea酶和野生型sortasea酶在溶液中均以单体的形式存在,大大地提高了其实际应用中的有效酶量。实验结果如图3和图4所示。
34.2、固定化的sortasea酶的活性测定
35.sortasea作为一种转肽酶,能够特异性识别leu-pro-x-thr-gly(lpxtg)多肽序列,并在特定位点苏氨酸thr与甘氨酸gly残基间进行切割,所得的苏氨酸羧基末端可以共价连接到目标物上。本发明以abz-lpetgk(dnp)-nh2为底物((购于上海捷妮泰生物科技有限公司),其中abz(ortho-aminobenzoic acid)作为荧光基团,dnp(2,4-dinitrophenyl)作为猝灭基团,当多肽底物序列是完整时,表现出的是内部的荧光猝灭,但当sortasea在底物的thr与gly残基间切割候使得荧光基团abz与猝灭基团dnp分开,释放abz荧光信号并可连续检测,因此利用该原理可对sortasea的酶活定量分析,具体步骤如下:
36.(1)sortasea酶的固定化:重组sortasea酶根据商品化树脂偶联的操作流程,将重组sortasea酶通过巯基偶联到树脂上,得到固定化sortasea酶,通过测得偶联前酶的总量和偶联后剩余的酶量,可以算出每1ml树脂可以偶联15mg重组sortasea酶;
37.野生型sortasea酶的固定方法是利用野生型sortasea酶的n端带有his标签,根据商品化镍磁珠的操作流程,将野生型sortasea酶通过his亲和标签偶联到镍磁珠上,通过测得偶联前酶的总量和偶联后剩余的酶量,可以算出每1ml树脂可以偶联10mg野生型sortasea酶。
38.(2)酶活测定:sortasea酶活测定缓冲液为50mm hepes ph7.5,150mm nacl,5mm cacl2、底物为50μm abz-lpetgk(dnp)-nh2、反应温度为室温,用缓冲液分别将固定化重组sortasea酶和固定化野生型sortasea酶从4μm以2倍梯度稀释6个浓度。将10μl底物转移至
384孔板中并设置复孔,转移10μl待测sortasea至相应的孔板中,立即离心并振荡混匀,使用tecan m1000酶标仪收集底物被切割后产生的荧光信号值。并运用graphpad prism9软件进行数据分析,最终获得待测蛋白酶的酶活参数,结果如图5和图6所示。
39.结果分析:以每纳摩尔sortasea每秒产生的荧光信号强度表示酶活,固定化重组sortasea酶活力为0.001064rfu/s/nm,固定化野生型sortasea酶活力为0.001162rfu/s/nm。根据酶活参数可知,表明固定化后的重组sortasea酶与常规的固定化野生型sortasea酶相比,仍具有较高的酶活,可用于工业化生产中。
40.3、固定化sortasea酶的去除效果试验
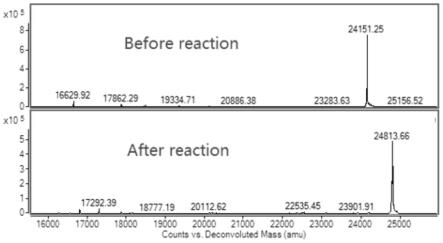
41.(1)准备固定化重组sortasea酶,需要修饰的目标蛋白1以及修饰物。其中,目标蛋白1的分子量为24151da,蛋白序列见no.4,修饰物为biotin-lpet-g(2-hydroxyacetic acid)-gh(购于北京中科亚光生物科技有限公司),其分子量为663da;
42.用于检测固定化野生型sortasea酶去除效果,准备所需要修饰的目标蛋白2及修饰物,目标蛋白1的分子量为18908da,蛋白序列见no.5,修饰物为biotin-lpet-g(2-hydroxyacetic acid)-gh,其分子量为663da;
43.(2)将sortasea酶、目标蛋白和修饰蛋白三种样品按照摩尔比例1:20:200进行混合,室温下反应1小时后,3000rpm离心5min将酶移除,然后,利用lc-ms检测反应前后反应体系中样品的分子量判断sortasea酶是否将修饰物标记在了目标蛋白上,结果如图7和图8所示。
44.结果分析:目标蛋白1反应后的样品分子量增加了662.41da,该分子量对应的为修饰物的分子量,表明修饰成功。此外,根据lc-ms检测的范围可以看到,在17017da的位置没有发现明显的峰,17017da对应是重组sortasea的蛋白分子量,说明重组sortasea酶已经被移除干净。目标蛋白2反应后的样品分子量增加了666.6da,该分子量对应的分子量应为修饰物的分子量,表明修饰成功。但是,根据lc-ms检测的范围可以看到,反应后在17780da和18447da处出现明显的峰,两个峰分别对应的是野生型sortasea酶的分子量以及标记上修饰物的野生型sortasea酶的分子量,说明在该反应体系中,固定化的野生型sortasea酶未被去除干净,发生了水解反应。
45.三、结论
46.本发明利用半胱氨酸可以与巯基偶联的原理,在sortasea酶的c端加上半胱氨酸,再将重组sortasea固定在树脂上,该固定化的流程操作简单,反应高效且特异强,此外该固定化方法不可逆,固定化重组sortasea酶不易脱落。而且固定化后的重组sortasea酶仍然能够保持很高的转肽酶活性,该活性可以应用于蛋白质的合成和修饰过程中,其中的蛋白修饰包括生物素标记、荧光标记等,标记后的蛋白可以用于生化分析检测,如荧光共振能量转移(fret)、表面等离子共振(spr)、微量热泳动仪(mst)、活细胞检测等实验;
47.另外,本发明可以直接通过离心将固定化重组sortasea酶进行反应后的去除,即只需3000rpm下离心5min就可高效快速去除反应中剩余的sortasea酶,且无残留。避免了剩余sortasea所带来的水解可逆反应,大大提高了sortasea酶在蛋白质修饰功能中的高效性。
48.以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员
来说,在不脱离本发明构思的前提下,还可以做出若干改进,这些都属于本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。