一株产生育酚的重组裂殖壶菌、其构建方法及应用
【技术领域】
1.本发明属于基因工程技术领域,具体涉及一株产生育酚的重组裂殖壶菌,还涉及所述重组菌株的构建方法,及其在生产生育酚中应用。
背景技术:
2.生育酚(tocopherol)属于维生素e(vitamin e)的一个类型,其主要来源于植物种子的油脂中,生育酚和生育三烯酚具有抵抗日常膳食中脂类物质被氧化的能力,这种能力通常被定义为为“维生素e活性”。维生素e的应用领域非常广泛,可以添加在化妆品、护肤品中,还可以作为医疗保健品预防各种疾病,在动植生命中有着不可替代的重要地位,故而人类对维生素e的需求量巨大。但是目前的一些化学合成、生物提取的方法存在收率低、纯度不高、浪费较大、易污染环境、设备昂贵、操作复杂及质量差等问题。因此,通过生物技术手段调控一些关键酶基因的表达,成为天然生育酚合成的新途径。
3.裂殖壶菌(schizochytrium)属于破囊壶藻科,是一类海洋异养微生物,以裂殖的方式进行繁殖,其单细胞内能够积累大量对人体有益的活性物质,如油脂、色素(类胡萝卜素、叶黄素和虾青素等)、角鳖烯等,这类物质的合成所用到的共同前体物质乙酰辅酶a在裂殖壶菌中含量比较高,这也是这类活性物质能大量积累的原因。生育酚合成的一个前体物质是植基二磷酸(pdp),而植基二磷酸是由香叶基香叶基二磷酸(ggpp)在4-羟苯丙酮酸二加氧酶(hppd)的作用下合成的,香叶基香叶基二磷酸同时也是类胡萝卜素合成的前体物质,所以我们尝试在类胡萝卜素合成通路的基础上构建生育酚合成通路,寻找天然生育酚合成的新途径。
4.本专利通过对生育酚合成途径中关键酶基因的挖掘,在裂殖壶菌中构建生育酚异源合成途径,得到一株能合成生育酚的裂殖壶菌重组菌株。
技术实现要素:
5.本发明的目的是在裂殖壶菌中构建生育酚异源合成途径,同时进行生育酚合成途径中关键基因的挖掘,提供一种产生育酚的重组工程菌株,以及该重组菌株的构建方法和应用。
6.本发明的思路是通过筛选能够在裂殖壶菌中成功表达的生育酚合成基因,在裂殖壶菌中构建生育酚异源合成途径,得到一株能合成生育酚的裂殖壶菌重组菌株。
7.基于此,本发明提供一株重组裂殖壶菌,所述重组裂殖壶菌含有来来源于拟南芥的香叶基香叶基二磷酸还原酶基因ggh、来源于小球藻的尿黑酸植基转移酶基因hpt、和来源于镰孢菌的γ-生育酚甲基转移酶基因γ-tmt。
8.在本发明中,所述基因ggh的核酸序列如seq id no.1所示,所述基因hpt的核酸序列如seq id no.2所示,所述基因γ-tmt的核酸序列如seq id no.3所示。
9.本发明还提供上述重组裂殖壶菌的构建方法,所述方法包括以下步骤:
10.(1)构建汗ggh基因、hpt基因以及γ-tmt基因的重组质粒
11.获取来源于拟南芥的香叶基香叶基二磷酸还原酶基因ggh、来源于小球藻的尿黑酸植基转移酶基因hpt和来源于镰孢菌的γ-生育酚甲基转移酶基因γ-tmt的序列,合成并添加酶切位点,并在序列末端连接egfp基因;将合成片段与质粒pbluzeo-18s分别经酶切和连接构建重组质粒pbluzeo-18s-atggh、pbluzeo-gahpt-18s和pbluzeo-ftγ-tmt-18s,将所得重组质粒热激转化大肠杆菌感受态细胞,筛选阳性转化子并测序验证正确;
12.(2)重组质粒转化裂殖壶菌
13.将上述重组质粒酶切线性化处理后,取10μl加入100μl裂殖壶菌atcc 20888感受态细胞,混匀后转移至预冷的电转杯,冰上静置30min后进行电击,电击结束后立即加入1ml预冷的含1m山梨醇的种子培养基,轻轻混匀后转移至预冷的含1m山梨醇的4ml种子培养基中,28℃、200rpm培养2h;然后取300μl菌液均匀涂于含50μg/ml博来霉素的固体平板,置于28℃培养箱培养24h,所得单菌落提取基因组进行pcr验证并验证正确;
14.(3)构建重组裂殖壶菌atcc-20889
15.将步骤(2)中验证成功的重组质粒pbluzeo-atggh-18s,pbluzeo-gahpt-18s,pbluzeo-ftγ-tmt-18s中的atggh,gahpt和ftγ_tmt片段通过酶切连接,然后连在质粒pbluzeo-18s上获得重组质粒pbluzeo-atggh-gahpt-ftγ_tmt-18s,酶切线性化处理后,电击法法转入裂殖壶菌中,获得重组菌株atcc-20889(atcc-pbl-atggh-gahpt-ftγ_tmt)。
16.根据一种优选的实施方式,上述步骤(3)的裂殖壶菌、即本发明的出发菌株是裂殖壶菌atcc-20889。
17.本发明还提供上述重组裂殖壶菌在生产生育酚中的应用。
18.优选地,所得重组裂殖壶菌在种子培养基中,180-220rpm、27-29℃恒温摇床里培养48-72h,然后以3-6%的接种量接入发酵培养基中,180-220rpm、27-29℃恒温摇床里培养3-5d。
19.根据一种优选的实施方式,所述种子培养基含有:葡萄糖40g/l、酵母膏2g/l、谷氨酸钠10g/l、kh2po
4 4g/l、nacl 15g/l、mgcl
2 3g/l、cacl2·
2h2o 1g/l、kcl 2g/l、mgso4·
7h2o 5g/l、fecl30.1g/l;
20.所述发酵培养基含有:葡萄糖40g/l、酵母膏2g/l、谷氨酸钠10g/l、kh2po
4 4g/l、nacl 15g/l、mgcl
2 3g/l、(nh4)2so
4 6g/l、kcl 2g/l、mgso4·
7h2o 5g/l、fecl
3 0.1g/l。
21.本发明的香叶基香叶基二磷酸还原酶从来源于油菜、向日葵、花生、拟南芥中选取,经过验证确认只有来源于拟南芥的atggh基因能够实现有效表达。
22.本发明中的尿黑酸植基转移酶从来源于嗜热光全绿丝菌、莱茵衣藻、小球藻和柠檬草中选取,经过验证确认只有来源于小球藻的gahpt基因能够实现有效表达。
23.本发明中的γ-生育酚甲基转移酶从来源于镰孢菌、芬兰石菖蒲、炭疽病菌和油菜中选取,经过验证确认只有来源于镰孢菌的ftγ-tmt基因能够实现有效表达。
24.本发明通过筛选能够在裂殖壶菌中成功表达的生育酚合成基因,在裂殖壶菌中构建生育酚异源合成途径,并通过基因挖掘筛选到高产生育酚的重组裂殖壶菌。
25.尽管关键基因如4-羟苯丙酮酸二加氧酶(hppd)、2-甲基-6-植基苯醌甲基转移酶(mpbqmt)、生育酚环化酶(tc)基因、香叶基香叶基二磷酸还原酶(ggh)、尿黑酸植基转移酶(hpt)和γ-生育酚甲基转移酶(γ-tmt)均与高产生育酚相关,但经过实验发现,香叶基香叶基二磷酸还原酶(ggh)、尿黑酸植基转移酶(hpt)和γ-生育酚甲基转移酶(γ-tmt)这三
个基因在重组裂殖壶菌中的表达量均非常低,无法起到提高重组裂殖壶菌的生育酚产量的作用。
26.采用本发明的裂殖壶菌重组菌株atcc 20889(atcc-pbl-atggh-gahpt-ftγ_tmt)进行发酵培养合成生育酚,生育酚的产量可达到126.5μg/g dcw,其中γ-生育酚含量达到82.3μg/g dcw,α-生育酚含量达到44.2μg/g dcw。
27.本发明通过基因挖掘在裂殖壶菌中成功表达生育酚合成基因,在裂殖壶菌中构建生育酚异源合成途径并实现了较高产量。
【附图说明】
28.图1为生育酚合成途径通路图;
29.图2为原始菌株中6个关键基因实时荧光定量pcr结果。
【具体实施方式】
30.下面结合附图和实施例对本发明进一步详细说明,但本发明的保护范围不仅限于这些实施例。
31.在本发明中,如无特殊说明,用于说明浓度的“%”是质量百分比,“:”是质量比。
32.本发明涉及以下培养基:
33.种子培养基含有:葡萄糖40g/l、酵母膏2g/l、谷氨酸钠10g/l、kh2po
4 4g/l、nacl 15g/l、mgcl
2 3g/l、cacl2·
2h2o 1g/l、kcl 2g/l、mgso4·
7h2o 5g/l、fecl
3 0.1g/l;
34.发酵培养基含有:葡萄糖40g/l、酵母膏2g/l、谷氨酸钠10g/l、kh2po
4 4g/l、nacl 15g/l、mgcl
2 3g/l、(nh4)2so
4 6g/l、kcl 2g/l、mgso4·
7h2o 5g/l、fecl
3 0.1g/l。
35.固体种子培养基:在种子培养基的基础上,添加1.5-2%琼脂,灭菌,在超净台内倒入灭菌的平板中。
36.博莱霉素种子筛选培养基:1.5%固体种子培养基灭菌后,当培养基降温至50℃,加入终浓度为100μg/ml的博莱霉素(z-cin),立即倒平板,4℃冰箱避光保存。
37.本发明涉及以下基因序列:
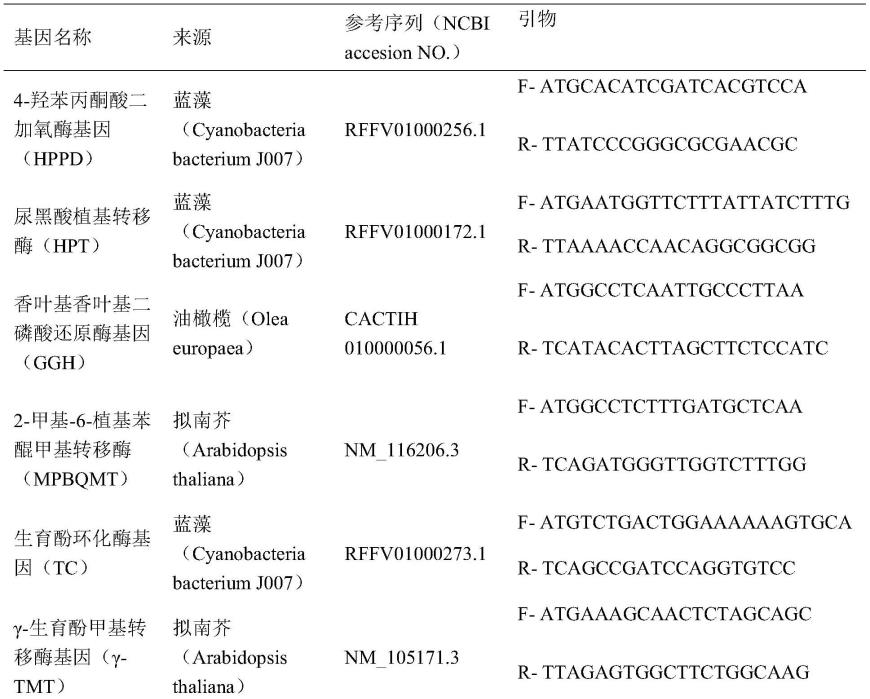
38.表1生育酚合成途径中关键基因和内参基因来源及引物信息
[0039][0040][0041]
表2香叶基香叶基二磷酸还原酶ggh基因来源
[0042][0043]
表3尿黑酸植基转移酶hpt基因来源
[0044][0045]
表4γ-生育酚甲基转移酶γ-tmt基因来源
[0046][0047]
本发明涉及以下引物:
[0048]
表5引物信息
[0049]
[0050]
[0051][0052]
实施例1生育酚合成关键基因qpcr验证
[0053]
首先提取原始菌株裂殖壶菌schizochytrium atcc 20888基因组,同时提取能合成生育酚的花生样品的rna,反转录获得cdna作为对照样品,之后依据qpcrgreen master mix(without rox)试剂盒说明书,使用primer 5.0软件设计引物,选取gapdh作为内参基因进行qrt-pcr分析(基因引物的序列见列表1)。实时荧光定量pcr(qrt-pcr)在linegene 9600plus荧光定量pcr仪(博日,杭州)上进行,定量反转录步骤按照primescripttm rt regent kit with gdna eraser说明书进行;荧光定量pcr操作步骤按照qpcrgreen master mix(without rox)试剂盒的说明进行。每个样品进行三次生物学重复和三次技术重复。采用2-δδct
的方法计算基因相对定量的qrt-pcr表达量。验证原始菌株atcc 20888中6个关键基因的相对表达量,初步确定原始菌株中是否含有产生育酚的关键基因。
[0054]
结果如图2所示,原始菌株中6个基因的表达量高低不一,其中4-羟苯丙酮酸二加氧酶(hppd)、2-甲基-6-植基苯醌甲基转移酶(mpbqmt)和生育酚环化酶(tc)基因均有表达,且表达量相当,而香叶基香叶基二磷酸还原酶(ggh)、尿黑酸植基转移酶(hpt)和γ-生育酚甲基转移酶(γ-tmt)这三个基因表达量均非常低,初步判断原始菌株atcc 20888中可能没有这三个基因,这也是此菌株无法合成生育酚的原因。
[0055]
实施例2香叶基香叶基二磷酸还原酶基因ggh基因、尿黑酸植基转移酶hpt基因和γ-生育酚甲基转移酶γ-tmt基因挖掘
[0056]
1、ggh、hpt、γ-tmt基因重组表达质粒构建
[0057]
从ncbi上获取来源于油菜(bnggh)、向日葵(haggh)、花生(ahggh)、拟南芥(atggh)的ggh基因序列,来源于嗜热光全绿丝菌(cahpt)、莱茵衣藻(crhpt)、小球藻(gahpt)、柠檬草(lihpt)的hpt基因序列,以及来源于镰孢菌(ftγ-tmt)、芬兰石菖蒲(cgγ-tmt)、炭疽病菌(caγ-tmt)、油菜(bnγ-tmt)的γ-tmt基因序列,送生工合成,添加酶切位点,并在序列末端连egfp基因。将合成片段与质粒pbluzeo-18s(质粒来源:购于上海生工生物工程(上海)股份有限公司)分别经酶切和连接获得重组质粒pbluzeo-bnggh-18s,pbluzeo-haggh-18s,pbluzeo-ahggh-18s,pbluzeo-atggh-18s;pbluzeo-cahpt-18s,pbluzeo-crhpt-18s,pbluzeo-gahpt-18s,pbluzeo-lihpt-18s;pbluzeo-ftγ-tmt-18s,pbluzeo-cgγ-tmt-18s,pbluzeo-caγ-tmt-18s,pbluzeo-bnγ-tmt-18s。将获得的重组质粒热激转化大肠杆
菌感受态细胞中,在含有100μg/ml氨苄抗性的lb平板上培养筛选阳性转化子,提取质粒进行测序验证。
[0058]
2、制备裂殖壶菌感受态细胞
[0059]
挑取平板上已活化好的schizochytrium sp.atcc20888裂殖壶菌单菌落至50ml种子培养基中28℃,200r/min培养24h;按4%的接种量再次转接至50ml种子培养基中28℃,200r/min培养24h取20ml菌液,4000rpm离心2min,弃上清收集菌体,用25ml的预处理剂(含25ml dtt的20mm ph6.5磷酸缓冲溶液)重悬菌体,150rpm震荡30min以松散细胞壁。然后分别用20ml已预冷的无菌水和1m的无菌预冷山梨醇溶液分别洗涤菌体两次,离心条件为4000rpm,4℃,2min,最后用200μl的1m的无菌预冷山梨醇溶液重悬菌体,分装于1.5ml无菌离心管中。
[0060]
3、重组表达质粒的转化及荧光比较
[0061]
将上述验证正确的重组质粒酶切线性化处理后,取10μl加入100μl裂殖壶菌atcc 20888感受态细胞,混匀后转移至预冷的电转杯,冰上静置30min,然后将电转杯擦干后置于电转仪,电压设置为2kv,电击时间为一个脉冲。电击结束后立即加入1ml预冷的含1m山梨醇的种子培养基,轻轻混匀后转移至预冷的含1m山梨醇的4ml种子培养基中(装于25ml锥形瓶),28℃,200rpm培养2h。取300μl菌液均匀涂于含50μg/ml博来霉素的固体平板,置于28℃培养箱培养24h。
[0062]
将平板上长出的单菌落接种至种子培养基,28℃,200rpm培养24h后提取基因组做pcr验证。结果显示抗性筛选标记已重组至裂殖壶菌的基因组,实现了外源基因的同源重组,获得重组菌株1(atcc-pbl-bnggh),2(atcc-pbl-haggh),3(atcc-pbl-ahggh),4(atcc-pbl-atggh);5(atcc-pbl-cahpt),6(atcc-pbl-crhpt),7(atcc-pbl-gahpt),8(atcc-pbl-lihpt),9(atcc-pbl-ftγ-tmt),10(atcc-pbl-cgγ-tmt),11(atcc-pbl-caγ-tmt),12(atcc-pbl-bnγ-tmt)。
[0063]
然后通过荧光显微镜定性观察重组菌株荧光有无来初步判断该基因是否能够在宿主中表达,方法如下:
[0064]
(1)制片:在培养3天的平板中挑取单菌落适量,于200ml蒸馏水中,充分混匀,取10μl点到载玻片上,盖上盖玻片。
[0065]
(2)镜检:将制作完成的片置于荧光显微镜上观察,先在亮视野中,找到清晰的裂殖壶菌菌体视野,然后打开蓝光激发光,关闭照明灯,在暗视野下观察荧光有无。
[0066]
结果显示,只有重组菌株4(atcc-pbl-atggh),7(atcc-pbl-gahpt)和9(atcc-pbl-ftγ-tmt)有荧光,其他重组菌株均没有荧光,说明只有来源于拟南芥(arabidopsis thaliana)的香叶基香叶基二磷酸还原酶基因,和来源于小球藻的gahpt基因以及来源于镰孢菌的ftγ-tmt基因能在宿主中表达,而其他来源的ggh基因,hpt基因和γ-tmt基因均不能在宿主中表达。
[0067]
3、重组菌株atcc-20889构建
[0068]
将上述获得的3个重组质粒pbluzeo-atggh-18s,pbluzeo-gahpt-18s,pbluzeo-ftγ-tmt-18s中的atggh,gahpt和ftγ_tmt片段通过酶切连接,然后连在pbluzeo-18s上获得重组质粒pbluzeo-atggh-gahpt-ftγ_tmt-18s,经同样的方式酶切线性化处理后,按上述方法转入裂殖壶菌atcc 20888中,获得重组菌株atcc-20889(atcc-pbl-atggh-gahpt-ft
γ_tmt)按上述方法将得到的重组菌株在发酵培养基中,220rpm、28℃条件下恒温摇床里培养96h,然后取5ml发酵液离心并收集菌体,研磨破胞后,用2m1丙酮分两次萃取,离心取上清,过滤后,进hplc分析。
[0069]
通过检测重组菌株atcc-20889中生育酚含量来验证此菌株是否能够产生育酚。
[0070]
检测样品的制备:取1m1sd发酵液于1.5ml离心管中,12000rpm离心5min,取上清于新的离心管,并加入40ml冰醋酸,再用0.22μm水系针孔式滤头过滤。
[0071]
hplc检测条件:流动相:0.01m kh2po4溶液(a)和甲醇(b);比例:90%a/10%b;流速:0.8ml/min;检测波长:290nm;色谱柱:ymc-pack ods-aq(4.6
×
250mm)。
[0072]
标准曲线制备方法如下:
[0073]
γ-生育酚标准曲线的制作:用万分之一天平称取10mgγ-生育酚,溶于10ml纯甲醇溶液中,浓度定为1g/l的母液,依次用纯甲醇溶液梯度稀释,稀释得到浓度分别为250mg/l,100mg/l,50mg/l,20mg/l,5mg/l的γ-生育酚溶液,并用相同的方法再稀释出两批同浓度的γ-生育酚溶液,对所有样品经0.22μm有机系针孔式滤头过滤,再进行hplc分析。
[0074]
α-生育酚的标准曲线制备方法同γ-生育酚标准曲线的制作。
[0075]
结果如表6显示,检测重组菌株atcc-20889(atcc-pbl-atggh-gahpt-ftγ_tmt)的生育酚含量,发现重组菌株atcc-20889(atcc-pbl-atggh-gahpt-ftγ_tmt)的总生育酚含量达到126.5μg/g dcw,其中γ-生育酚含量达到82.3μg/g dcw,α-生育酚含量达到44.2μg/gdcw。由此裂殖壶菌中生育酚异源合成途径初步构建成功。其分别选用来源于拟南芥的atggh基因,来源于小球藻的gahpt基因和来源于镰孢菌的ftγ-tmt基因基因。
[0076]
表6各重组菌株发酵液中各种生育酚含量
[0077]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。