1.本发明涉及中药制剂技术领域,尤其涉及一种三胶扶正合剂及其制备方法和鉴别方法。
背景技术:
2.目前在治疗肿瘤时通常采用化疗技术进行治疗,虽然化疗会减缓肿瘤细胞增殖,但是会产生骨髓抑制和免疫功能低下的拮抗作用,而目前并没有一种试剂可以减缓肿瘤细胞的增殖,同时还能减缓化疗所带来的骨髓抑制以及免疫功能低下问题。
技术实现要素:
3.本发明的目的在于提供一种三胶扶正合剂及其制备方法和鉴别方法,可以减缓肿瘤细胞的增殖,同时还能减缓化疗所带来的骨髓抑制以及免疫功能低下问题。
4.为实现上述目的,第一方面,本发明提供了一种三胶扶正合剂,所述三胶扶正合剂包括黄芪、白术、当归、丹参、茯苓、补骨脂、鹿胶、枸杞、红参、枳实、阿胶、龟胶和炙甘草。
5.第二方面,本发明提供一种三胶扶正合剂的制备方法,制备得到如第一方面所述的三胶扶正合剂,包括如下步骤:
6.按照配比要求获取四种试剂原料,并基于渗漉法进行渗漉后,排出漉液中的乙醇后,得到渗漉液;
7.获取三种试剂原料进行蒸馏,并将蒸馏后的药渣与三种试剂原料进行多次的煎煮,过滤浓缩后得到水煎液;
8.将获取的阿胶、龟胶和鹿胶加水进行烊化,得到烊化液;
9.将所述水煎液和所述渗漉液合并后,加入苯甲酸搅拌静置48小时,并在过滤沉淀后,依次与蒸馏液和所述烊化液混合,得到三胶扶正合剂。
10.其中,按照配比要求获取四种试剂原料,并基于渗漉法进行渗漉后,排出漉液中的乙醇后,得到渗漉液,包括:
11.按照配比要求获取四种试剂原料,并分别进行粉碎过滤,得到100目粒径的粉末,其中,四种试剂原料分别为红参、补骨脂、丹参和茯苓;
12.基于渗漉法,利用50%的乙醇将四种粉末进行渗漉;
13.利用减压回收法排出收集得到的漉液中的乙醇,得到渗漉液。
14.其中,获取三种试剂原料进行蒸馏,并将蒸馏后的药渣与三种试剂原料进行多次的煎煮,过滤浓缩后得到水煎液,包括:
15.获取三种试剂原料,并进行蒸馏,收集蒸馏液,其中,三种试剂原料分别为白术、当归和枳实;
16.将蒸馏后得到的药渣与获取的三种试剂原料进行三次煎煮,分别收集每一次煎煮得到的煎液,依次进行混合、过滤和浓缩后,得到水煎液,其中,三种试剂原料分别为炙甘草、黄芪和枸杞。
17.其中,所述苯甲酸的含量为3g。
18.其中,三次煎煮的含量分别为第一次4000ml、第二次3500ml、第三次3000ml。
19.第三方面,本发明提供一种三胶扶正合剂的鉴别方法,用于鉴别采用如第二方面所述的制备方法制备得到的三胶扶正合剂,包括红参对照鉴别方法和黄芪对照鉴别方法。
20.其中,所述红参对照鉴别方法包括以下步骤:
21.将制备得到的三胶扶正合剂与乙醇依次进行混合、过滤和浓缩,然后加入三氯甲烷进行振摇提取,并在抽取三氯甲烷试剂后,利用正丁醇对蒸干的残渣进行溶解过滤,得到的滤液为供试品溶液;
22.利用红参对照药材与正丁醇进行加热回流提取1小时,并在经过过滤和浓缩后,得到对照药材溶液;
23.基于照薄层色谱法分别对所述供试品溶液和所述对照药材溶液进行试验,完成鉴别。
24.其中,基于照薄层色谱法分别对所述供试品溶液和所述对照药材溶液进行试验,完成鉴别,包括:
25.基于照薄层色谱法分别吸取所述供试品溶液和所述对照药材溶液,并分别点于同一硅胶g薄层板上后,利用展开剂进行展开、取出和晾干后,喷洒硫酸和甲醇混合溶液,在105℃下加热至斑点显色清晰,并置于紫外光灯下检视,完成鉴别。
26.其中,所述红参对照鉴别方法包括以下步骤:
27.将制备得到的三胶扶正合剂蒸干后,得到的残渣与乙醇依次进行混合、过滤和蒸干,然后利用氢氧化钠溶液进行溶解,并在调节ph值后,加入乙酸乙酯溶液再次进行蒸干,得到的残渣用乙酸乙酯溶解后得到供试品溶液;
28.利用黄芪对照药材与乙醇进行加热回流提取20分钟,并在经过过滤和滤液蒸干后,得到对照药材溶液;
29.基于照薄层色谱法分别对所述供试品溶液和所述对照药材溶液进行试验,完成鉴别。
30.其中,基于照薄层色谱法分别对所述供试品溶液和所述对照药材溶液进行试验,完成鉴别,包括:
31.基于照薄层色谱法分别吸取所述供试品溶液和所述对照药材溶液,并分别点于同一硅胶g薄层板上后,利用展开剂进行展开、取出、晾干以及置于氨蒸气中熏蒸后,置于紫外光灯下检视,完成鉴别。
32.本发明的一种三胶扶正合剂及其制备方法和鉴别方法,所述三胶扶正合剂包括黄芪、白术、当归、丹参、茯苓、补骨脂、鹿胶、枸杞、红参、枳实、阿胶、龟胶和炙甘草,按照配比要求获取四种试剂原料,并基于渗漉法进行渗漉后,排出漉液中的乙醇后,得到渗漉液;获取三种试剂原料进行蒸馏,并将蒸馏后的药渣与三种试剂原料进行多次的煎煮,过滤浓缩后得到水煎液;将获取的阿胶、龟胶和鹿胶加水进行烊化,得到烊化液;将所述水煎液和所述渗漉液合并后,加入苯甲酸搅拌静置48小时,并在过滤沉淀后,依次与蒸馏液和所述烊化液混合,得到三胶扶正合剂,并利用红参对照鉴别方法和黄芪对照鉴别方法对得到的三胶扶正合剂进行鉴别,均满足要求,同时,在进行试验时,能够抑制肿瘤细胞的增殖,同时也能够减缓化疗导致的骨髓抑制以及免疫功能低下的问题。
附图说明
33.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
34.图1是本发明提供的一种三胶扶正合剂的制备方法的步骤示意图。
35.图2是本发明提供的基于红参对照鉴别方法的三胶扶正合剂的鉴别方法的步骤示意图。
36.图3是本发明提供的基于黄芪对照鉴别方法的三胶扶正合剂的鉴别方法的步骤示意图。
37.图4是本发明提供的基于红参对照鉴别方法的三胶扶正合剂tlc图。
38.图5是本发明提供的基于黄芪对照鉴别方法的三胶扶正合剂tlc图。
39.图6是本发明提供的各组小鼠肿瘤体积情况对比图。
40.图7是本发明提供的空白组、合剂低、中、高浓度组和足叶乙甙组肿瘤体积情况对比图。
具体实施方式
41.下面详细描述本发明的实施例,所述实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
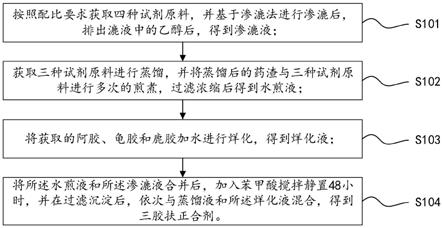
42.在本发明的描述中,需要理解的是,术语“长度”、“宽度”、“上”、“下”、“前”、“后”、“左”、“右”、“竖直”、“水平”、“顶”、“底”“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。此外,在本发明的描述中,“多个”的含义是两个或两个以上,除非另有明确具体的限定。
43.本发明提供一种三胶扶正合剂,包括黄芪、白术、当归、丹参、茯苓、补骨脂、鹿胶、枸杞、红参、枳实、阿胶、龟胶和炙甘草。
44.请参阅图1,本发明提供一种三胶扶正合剂的制备方法,包括如下步骤:
45.s101、按照配比要求获取四种试剂原料,并基于渗漉法进行渗漉后,排出漉液中的乙醇后,得到渗漉液。
46.具体的,按照配比要求,获取红参、补骨脂、丹参和茯苓进行粉碎,并利用100目筛进行过滤,得到4种100目粒径的粉末;然后按照照流浸膏剂与浸膏剂的渗漉法,利用50%的乙醇作为溶剂,进行渗漉,并在渗漉的同时,收集漉液,在渗漉结束后,对收集得到的漉液进行减压,回收漉液中的乙醇,得到渗漉液。
47.s102、获取三种试剂原料进行蒸馏,并将蒸馏后的药渣与三种试剂原料进行多次的煎煮,过滤浓缩后得到水煎液。
48.具体的,基于配比要求获取白术、当归和枳实,并与水混合后进行蒸馏,收集蒸馏液,其中,所述蒸馏液为蒸馏过程中收集到的挥发出来的包含药性成分的液体,而蒸馏后的药渣与另外获取的炙甘草、黄芪和枸杞进行三次煎煮,第一次煎煮的容量为4000ml、第二次
3500ml、第三次3000ml,分别收集每一次煎煮得到的煎液,将收集的三次煎液进行混合、过滤和浓缩后,得到适量的水煎液。
49.s103、将获取的阿胶、龟胶和鹿胶加水进行烊化,得到烊化液。
50.具体的,将按照配比获取的阿胶、龟胶和鹿胶混合后,加入适量的水进行烊化,得到烊化液。
51.s104、将所述水煎液和所述渗漉液合并后,加入苯甲酸搅拌静置48小时,并在过滤沉淀后,依次与蒸馏液和所述烊化液混合,得到三胶扶正合剂。
52.具体的,将水煎液和渗漉液混合,并加入3g的苯甲酸进行充分的搅拌混合,然后静置48小时,在静置结束后,除去沉淀,并加入蒸馏液你、烊化液再次进行搅拌混合,然后加水至1000ml,混匀后得到三胶扶正合剂,制备得到的三胶扶正合剂为棕褐色粘稠状液体,气芳香,味微苦、微甘、微辛。
53.制备得到的三胶扶正合剂的相对密度不低于1.07,ph值为5.0-7.0左右,具有滋肾填精,益气补血,健脾和。用于放、化疗造成的白细胞下降,免疫机能低下及中晚期肿瘤病人。一般是采用口服使用,一日三次,一次30-50ml。
54.请参阅图2,本发明提供一种三胶扶正合剂的鉴别方法,包括如下步骤:
55.s201、将制备得到的三胶扶正合剂与乙醇依次进行混合、过滤和浓缩,然后加入三氯甲烷进行振摇提取,并在抽取三氯甲烷试剂后,利用正丁醇对蒸干的残渣进行溶解过滤,得到的滤液为供试品溶液;
56.s202、利用红参对照药材与正丁醇进行加热回流提取1小时,并在经过过滤和浓缩后,得到对照药材溶液;
57.s203、基于照薄层色谱法分别对所述供试品溶液和所述对照药材溶液进行试验,完成鉴别。
58.在本实施方式中,取制备得到的三胶扶正合剂30ml,加乙醇100ml,充分振摇,过滤,滤液浓缩至10ml,然后,加入三氯甲烷30ml,振摇提収,分取三氯甲烷液,蒸干,在蒸干得到的残渣中加入正丁醇5ml使残渣溶解,过滤,滤液作为供试品溶液。
59.另取红参对照药材5g,加正丁醇50ml,加热回流提取1小时,过滤,滤液浓缩至约5ml,作为对照药材溶液。
60.基于照薄层色谱法进行试验,吸取上述两种溶液各5μl,分别点于同一硅胶g薄层板上,以环己烷-丙酮(2:1)为展开剂,展开,取出,晾干,喷以硫酸-甲醇(1:1),在105℃加热至斑点显色清晰,置紫外光灯(365nm)下检视。供试品色谱中,在与对照药材色谐相应的位置上,显相同颜色的荧光斑点,对比结果如图4所示。
61.请参阅图3,本发明提供一种三胶扶正合剂的鉴别方法,包括如下步骤:
62.s301、将制备得到的三胶扶正合剂蒸干后,得到的残渣与乙醇依次进行混合、过滤和蒸干,然后利用氢氧化钠溶液进行溶解,并在调节ph值后,加入乙酸乙酯溶液再次进行蒸干,得到的残渣用乙酸乙酯溶解后得到供试品溶液;
63.s302、利用黄芪对照药材与乙醇进行加热回流提取20分钟,并在经过过滤和滤液蒸干后,得到对照药材溶液;
64.s303、基于照薄层色谱法分别对所述供试品溶液和所述对照药材溶液进行试验,完成鉴别。
65.在本实施方式中,取制备得到的三胶扶正合剂10ml,蒸干,残渣加乙醇20ml使蒸干的三胶扶正合剂溶解,放置20分钟,过滤,将滤液蒸干,向残渣中加0.3%氢氧化钠溶液15ml使其溶解,过滤,滤液用稀盐酸调节ph值至5~6,然后,加乙酸乙酯15ml,振摇提取,分取乙酸乙酯液,加入适量无水硫酸钠后,过滤,滤液蒸干,残渣加乙酸乙酯1ml使溶解,作为供试品溶液。
66.另取黄芪对照药材2g,加乙醇30m,加热回流20分钟,过滤,将滤液蒸干,同法制成对照药材溶液。
67.基于照薄层色谱法进行试验,吸取上述两种溶液各10μl,分别点于同一硅胶g薄层板上以三氯甲烷-甲醇(10:1)为展开剂,展开,取出,晾干,置氨蒸气中熏蒸后,置紫外光灯(365nm)下检视供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光主斑点,对比结果如图5所示。
68.在将本试剂进行检验后,得到的检验结果如表1所示。
69.表1三胶扶正合剂的检验结果
[0070][0071]
由表1可知,采用本发明所限定的方法制备得到的三胶扶正合剂是符合相关的国家标准的。
[0072]
为了检验采用本发明的制备方法制备得到的三胶扶正合剂的药效,分为两种试验方法,第一种为拮抗放化疗对小鼠毒副作用的实验,第二种为抗肿瘤作用的实验。
[0073]
进行第一种实验时,利用小鼠构建低白细胞模型、免疫抑制模型,观察三胶扶正合剂是否具有拮抗放、化疗毒副作用的效果及二者作用的大小。
[0074]
1、材料与方法
[0075]
1.1仪器与试药
[0076]
1.1.1仪器
[0077]
722型紫外可见分光光度计
[0078]
1.1.2实验药物、动物
[0079]
三胶扶正合剂为棕褐色浸膏,每克含生药5g,临用时以生理盐水配制成所需浓度,复方阿胶浆,注射用环磷酰胺,盐酸左旋咪唑片,nih小鼠,雌雄各半,体重20-24g。
[0080]
1.2方法
[0081]
1.2.1实验分组
[0082]
小鼠随机分成9组,每组10只,其中,低白细胞模型分组:a组正常对照组,b组模型对照组,c组cy 10ml/kg复方阿胶浆组,d、e、f组cy 1.63g/kg、小鼠随机分成9组,每组10只,其中,低白细胞模型分组:a组正常对照组,cy 6.5g/kg、cy 26g/kg 1号三胶扶正合剂组,g、h、i组cy 1.25g/kg、cy 5.0g/kg、cy 20g/kg 2号三胶扶正合剂组,(剂量设置是根据人一天用药量换算成小鼠用量作为中剂量,再以4倍剂量递减作为小剂量,4倍递增作为大剂量);免疫抑制模型分组:a组正常对照组,b组模型对照组,c组cy 0.025g/kg lms组,d、e、f组cy 1.63g/kg、cy 6.5g/kg、cy 26g/kg 1号三胶扶正合剂组,g、h、i组cy 1.25g/kg、cy 5.0g/kg、cy 20g/kg 2号三胶扶正合剂组。
[0083]
1.2.2对cy致低白细胞模型小鼠的外周血白细胞、骨髓及cfu-s的影响
[0084]
各组小鼠(a组除外)腹腔注射cy0.1g/kg,每日一次,连续3天,构造小鼠低白细胞模型。于最末一次给药2小时后,开始给各组药物灌胃,每天一次,持续6天。分别在给药第3、6天采尾静脉血,检查白细胞数。最后颈椎脱臼处死小鼠,剥离右侧股骨用生理盐水冲出全部骨髓,制成单细胞悬液,计数后取一定量尾静脉注入
60
coγ射线7.50gy致死量全身照射的小鼠体内,8天后,杀鼠取脾,用bouin氏液固定,肉眼计每脾集落数。根据每股骨有核细胞数和静脉注入单位有核细胞数所产生的cfu-s数,求出各组股骨cfu-s数,进而求出集落存活比。
[0085]
计算公式为:集落存活比=给药组股骨cfu-s数/对照组股骨cfu-s数
[0086]
1.2.3对cy致免疫抑制模型小鼠网状内皮系统吞噬功能的影响
[0087]
各组小鼠(a组除外)皮下注射cy0.08g/kg,每日一次,连续5天,造成小鼠免疫抑制模型。同时对各组药物进行灌胃,每天一次,持续6天。于最末一次给药1小时后,每鼠经尾静脉注射印度墨汁(用生理盐水稀释5倍)10ml/kg。注射后分别于1、5分钟从眼眶静脉取血20μ1加到2ml0.1%溶液中摇匀,用722型分光光度计在680nm下比色,测光密度值,计算廓清指数k,经体重及肝脾重换算后,求出吞噬指数a。
[0088]
1.2.4小鼠灌胃给药的急性毒性实验研究
[0089]
nih小鼠40只,雌雄各半,在实验室条件(25c)下喂养3天,并在实验前禁食(不禁水)8小时。随机分成两组,用0.9%生理盐水配制浓度为5g/ml(最大溶解度)的三胶扶正合剂溶液1号、2号,按0.1m/10g体重ig,每隔2小时1次,连续3次,总给药量150g/kg体重(相当于临床人用量的23倍)。给药后立即观察两组小鼠的一般情况,如活动度、步态、呼吸、排便情况和毛发等;记录小鼠死亡数,并连续观察14天。
[0090]
1.2.5统计学分析
[0091]
采用sas9.1 for windows软件对所有数据进行统计学分析和成组涉及的t检验。
[0092]
2结果
[0093]
2.1对小鼠外周白细胞、骨髓和cfu-s的影响
[0094]
给药第三天,模型对照组外周血白细胞数较正常对照组明显降低(p《0.01),表明造模成功:cy 三胶扶正合剂组的白细胞数明显高于模型对照组,表明该药有升白细胞作用,见表2。模型对照组骨髓有核细胞数及cfu-s较正常对照组明显降低(p《0.05),表明cy抑制骨髓造血功能:cy 三胶扶正合剂组的骨髓有核细胞数,cfu-s及存活比明显高于模型对
照组,表明该药能恢复骨髓造血功能,见表3。
[0095]
表2各组小鼠用药第3、6天白细胞计数比较
[0096][0097]
与正常对照组比较,δp《0.05,δδp《0.01;与模型对照组比较,*p《0.05,**p《0.01。
[0098]
表3三胶扶正合剂对小鼠骨髓和cfu-s的影响
[0099]
[0100][0101]
与正常对照组比较,δp《0.05;与模型对照组比较,*p《0.05,**p《0.01。
[0102]
2.2对小鼠网状内皮系统吞噬功能的影响
[0103]
模型对照组的碳粒廓清能力较正常对照组明显下降(p《0.01),表明cy抑制机体免疫功能;cy 三胶扶正合剂组明显提高k值和a值,表明该药能改善网状内皮系统对异物的清除能力,即增强了非特异性免疫功能,见表4。
[0104]
表4三胶扶正合剂对小鼠网状内皮系统吞噬功能的影响
[0105][0106][0107]
与正常对照组比较,δp《0.05,δδp《0.01;与模型对照组比较,*p《0.05,**p《0.01。
[0108]
2.3小鼠灌胃给药的急性毒性实验结果
[0109]
给药后两组小鼠一般情况良好,活动度正常,呼吸均匀,步态、肌张力、大小便、毛
发均无明显异常改变;小鼠无惊厥现象发生,给药后立即和以后的摄食均正常;观察期间所有受试小鼠全部存活。所以,本次实验中nih小鼠的最大耐受量为150g/kg体重。
[0110]
综上所述,三胶扶正合剂1号、2号及复方阿胶浆均有一定的提升外周白细胞,促进骨髓有核细胞增值及cfu-s,并增强免疫功能低下小鼠的网状内皮系统的吞噬功能的作用,且1号合剂效果最好;三胶扶正合剂1号、2号及盐酸左旋咪唑片对小鼠网状内皮系统功能的增强作用无明显差异;中剂量已接近最佳剂量;小鼠的最大耐受量为150g/kg体重。可以得出,三胶扶正合剂能够拮抗放化疗所致小鼠的骨髓抑制和免疫功能低下,且安全无毒副作用,为临床推广奠定基础。
[0111]
进行第二种实验时,利用小鼠构建低白细胞模型、免疫抑制模型,观察三胶扶正合剂是否具有拮抗放、化疗毒副作用的效果及二者作用的大小。
[0112]
1材料与方法
[0113]
1.1实验药物.
[0114]
三胶扶正合剂为棕褐色浸膏,1.39g/l,临用时用生理盐水配成所需浓度。阳性对照组:足叶乙甙软胶囊,临用时用聚乙二醇400配成所需浓度。
[0115]
1.2实验动物.
[0116]
km小鼠,雌雄各半,体重20-25g,所有动物在恒温、恒湿、无菌净化屏障系统内饲养。
[0117]
1.3体外药物干预癌细胞试验
[0118]
1.3.1 mtt法检测药物抑癌作用
[0119]
取对数生长期的人肺腺癌a549细胞、乳腺癌mcf-7细胞、肝癌hepg2细胞,并设立各自空白对照组,进行各细胞的药敏试验。调整细胞浓度为2x104ml-1
,每孔4x103个细胞接种于96孔板。37℃、5%c02培养4h后分浓度梯度(分设5个浓度梯度)加入三胶扶正合剂1号、2号。同时设立空白对照组。各加药实验组给药后24小时、48小时、72小时分别用mtt法检测细胞存活状况,并同时作空白对照,以明确对三胶扶正合剂作用于不同肿瘤细胞系(作为敏感细胞)的抑制效果、最佳药物浓度、最佳药效时间。计算细胞增殖抑制率。
[0120]
1.3.2肿瘤细胞凋亡试验
[0121]
将a549细胞以1x106ml浓度接种于培养瓶,培养液体积为1ml。4h后加入a/3浓度1ml 1号、2号合剂。72h后消化细胞,用annexin v-fitc/pi双染法上流式细胞仪进行凋亡检测。试验分组:a空白对照组(simple0),b三胶扶正合剂1号组(simple1),c三胶扶正合剂2号组(simple2)。
[0122]
1.4荷瘤km小鼠模型试验
[0123]
1.4.1三胶扶正合剂抑瘤试验
[0124]
随机分组为:
①
空白对照组
②
三胶扶正合剂1号组
③
三胶扶正合剂2号组
④
足叶乙甙组,每组5只,共计20只。合剂原液a1.39g/ml,在接种敏感肿瘤细胞前3天,
②
、
③
组小鼠分别灌胃给三胶扶正合剂1号、2号(中浓度,0.46g/ml)。其余组正常饲养。三天后收集对数生长期h22肿瘤细胞,调整细胞密度为107ml-1
,接种于各组小鼠肩胛部皮下。小鼠接种完毕后,置恒温(25
±
2℃)、恒湿(45%~50%)、无菌净化屏障系统内饲养。接种后
②
、
③
组继续相同浓度三胶扶正合剂灌胃给药。足叶乙甙组灌胃剂量为4mg/kg/d,1次/天,连续5天。30天后处死小鼠观察。观察指标:组织病理学方法确诊为肿瘤(肿瘤组织作病理切片,he染色检查);
每组小鼠的肿瘤发生率;每组荷瘤小鼠的平均肿瘤个数;每组荷瘤小鼠的平均肿瘤体积;不同治疗组的转移和各脏器情况(肝、肺、胃组织)。
[0125]
1.4.2不同浓度2号三胶扶正合剂抑瘤试验
[0126]
随机分组为
①
空白对照组、
②
三胶扶正合剂2号组低浓度、
③
三胶扶正合剂2号组中浓度、
④
三胶扶正合剂2号组高浓度、
⑤
足叶乙甙组,每组10只,共计50只。收集对数生长期h22肿瘤细胞,调整细胞密度为10'ml",接种于各组小鼠肩胛部皮下。小鼠接种完毕后,置恒温(25
±
2℃)、恒湿(45%~50%)、无菌净化屏障系统内饲养。接种当天开始
②
、
③
组小鼠分别灌胃给低、中、高浓度三组2号三胶扶正合剂,浓度分别为:低浓度a/5,0.28g/ml、中浓度a/3,0.46g/ml、高浓度2a/3,0.92g/ml,其余组正常饲养。足叶乙甙组灌胃剂量为4mg/kg/d,1次/天,连续5天。30天后处死剩余小鼠观察。观察指标及数据分析方法均同上。
[0127]
2结果
[0128]
经过上面的几次实验,其中,mtt结果显示:三胶扶正合剂对肿瘤细胞的生长有明显的抑制作用,2号合剂效果略好于1号合剂;肝癌hepg2细胞效果略好于其他两种细胞。
[0129]
细胞凋亡检测实验表明:应用合剂后肿瘤细胞早期凋亡和坏死均明显高于对照组。
[0130]
对于荷瘤小鼠实验,通过实验证实,加药组小鼠成瘤率与对照组无明显差异,但瘤体体积、重量均明显小于空白对照组,且2号合剂效果优于1号合剂。但合剂组抑瘤效果差于足叶乙甙组,如图6所示。而2号合剂三个浓度分组治疗抑瘤实验的结果表明:高浓度效果优于低浓度,但不及足叶乙甙组效果,如图7所示。
[0131]
对于nf-kb检测结果,合剂组的nf-kb基因水平明显低于对照组,表明药物能够有效抑制细胞内nf-kb的表达。
[0132]
综上所述可以得出:三胶扶正合剂无论是在体内外肿瘤细胞的增殖还是在nf-kb基因水平上均有明显抑制作用,可作为辅助抗肿瘤药物在临床中推广应用。
[0133]
以上所揭露的仅为本发明一种较佳实施例而已,当然不能以此来限定本发明之权利范围,本领域普通技术人员可以理解实现上述实施例的全部或部分流程,并依本发明权利要求所作的等同变化,仍属于发明所涵盖的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。