一种基于谷胱甘肽保护的金铜纳米团簇与ce
3
形成组装体的荧光探针及其应用
技术领域
1.本发明属于荧光探针技术领域,具体涉及一种基于谷胱甘肽保护的金铜纳米团簇与ce
3
形成组装体(aucuncs-ce
3
)的荧光探针及其作为试剂在杨梅素检测中的应用。
背景技术:
2.杨梅素(杨梅黄酮,myricetin,分子式c
15h10
o8,分子量318.24;cas号: 529-44-2)是一种黄酮类化合物,广泛存在于杨梅科、葡萄科、豆科、浆果、水果、蔬菜、蜂蜜、红酒、茶等多种天然植物和日常食品中。现代药理学研究表明,杨梅素具有抗炎、抗肿瘤、抗菌、抗病毒、抗肥胖等多种生物学功能。此外,杨梅素可用于化妆品中,调节紫外线b诱导的h2o2的产生,抑制皮肤中光老化自由基的产生。虽然杨梅素分布广泛,对人体健康有益,但荧光检测方法仍然很少。因此,建立一种简便、快速、可靠、准确、重现性好的杨梅素分析方法具有重要的应用价值。
3.传统检测杨梅素的主要分析方法有电化学法、高效液相色谱法等,虽然该方法精密度好、检出限低,但是操作繁琐、设备成本高、较难用于快速检测。随着纳米材料快速发展,利用纳米材料作为荧光探针用于检测已成为研究热点之一,其中荧光探针技术由于具有高灵敏度、快速、操作简单等特点备受关注,被认为是检测痕量物质的有效手段。目前使用的荧光探针主要是量子点和金属纳米簇,尽管其他荧光材料也可以作为光探针,但由于金属纳米簇具有独特的光学性质,近年来在生物传感、生物成像、新型催化剂等领域得到了广泛的应用。此外,得益于金属纳米簇合成研究的巨大进展,可以很容易地获得尺寸定制、稳定性好、质量好的铜纳米簇。铜纳米簇具有发光效率高、荧光寿命长、光学和化学稳定性好、斯托克斯位移大等特点,近期得到越来越广泛的关注,铜纳米簇已被广泛应用于光学传感和生物成像。
4.铜纳米簇由于容易被氧化,导致稳定性差,进而应用受限,故需对其荧光性能进行改进。根据文献报道,其它金属原子掺杂可以大幅度提高金属纳米簇的光致发光性能和稳定性,因此,本发明采用金原子掺杂到铜纳米簇中形成金铜双金属纳米簇,其稳定性得到大幅度改善。尤其是该纳米簇具有优异的聚集诱导发光 (aie)特性,通过与ce
3
组装形成聚集体(aucunc-ce
3
)能够大幅度提高该双金属纳米簇的光致发光性能和存储时间。本发明进一步采用该组装体作为荧光探针,实现了杨梅素的高灵敏度定量检测。
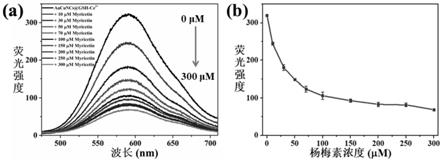
技术实现要素:
5.本发明的目的在于提供一种基于谷胱甘肽保护的金铜纳米团簇与ce
3
形成组装体的荧光探针及其在检测杨梅素中的应用。该荧光探针为金铜纳米簇与ce
3
作用形成的组装体,应用于检测杨梅素。
6.首先基于文献报道的方法制备铜纳米簇(图1a),由于其稳定性差(图1b),不利于后期应用,需要进一步优化和改进。通过掺杂haucl4·
3h2o形成金铜双金属纳米簇,其存储
时间由四天稳定至一周(图2b)。这表明通过掺杂异质金属原子来提高铜纳米簇的稳定性提供了一种新思路。由于金铜纳米簇的荧光强度较弱,而金属纳米簇的聚集诱导发射是一种可以提高金属纳米簇光致发光性能的简单有效的方法;故引入金属离子ce
3
,使金铜纳米簇的荧光强度发生大幅度增强(图4),且荧光量子产率提升至22%,此外,纳米簇可以稳定存在25天(图5)。因此, aucuncs-ce
3
组装体可以作为稳定的荧光探针。
7.本发明将该荧光探针应用于杨梅素检测中,其具有响应快速(图6)、响应范围宽0~300μm(图7)等优点,并在1.0~7.0μm浓度范围内呈现良好线性,检出限为0.14μm(图8)。此外该探针对杨梅素的选择性高于其他具有相似结构的黄酮醇类衍生物以及常见的氨基酸(图9),并且这些氨基酸等物质对杨梅素的检测并无干扰(图10),因此该探针能够有效检测杨梅素。机制研究表明,杨梅素使 aucuncs-ce
3
组装体发生猝灭机制可归因于静态猝灭过程(表1)以及内滤效应 (图11)。
8.本发明所述的一种基于谷胱甘肽保护的金铜纳米团簇与ce
3
形成组装体的荧光探针溶液,是以cuso4·
5h2o和haucl4·
3h2o作为cu和au源,谷胱甘肽(gsh) 作为还原剂和稳定剂;其由如下步骤所述方法制备得到:
9.(1)首先将5.0ml、160~170mm的谷胱甘肽水溶液加入到5.0ml、8~12mm 的cuso4·
5h2o水溶液中,待溶液变为白色悬浮液后,再逐滴加入1.0m的naoh 水溶液,直至浑浊液再次变透明,溶液呈淡黄色,此时溶液的ph为4.0~5.0,再在室温下搅拌1.5~3.0h,得到铜纳米簇溶液;
10.(2)将haucl4·
3h2o添加到步骤(1)得到的铜纳米簇溶液中并搅拌2~4小时,haucl4·
3h2o的终浓度为1.0~1.5mm,得到金铜纳米簇溶液;
11.(3)向步骤(2)得到的金铜纳米簇溶液中加入15~30ml乙醇,然后在 6000~8000rpm下离心10~20分钟收集沉淀;将沉淀溶解在蒸馏水中,加入乙醇并离心3~5次,去除所有残留的小分子,冻干后得到纯的金铜纳米簇粉末;
12.(4)将步骤(3)得到的纯的金铜纳米簇粉末置于10mm、ph=6.5~7.0的 hepes-naoh缓冲液中,配置成金铜纳米簇浓度为0.4~0.6mg
·
l-1
的金铜纳米簇溶液;然后向其中加入硝酸铈水溶液作用10~30min,硝酸铈的终浓度为100~300μm,从而得到本发明所述的一种基于谷胱甘肽保护的金铜纳米团簇与ce
3
形成组装体 (aucuncs-ce
3
)的荧光探针溶液。
附图说明
13.图1:(a)cuncs的荧光发射谱图,(b)cuncs的稳定性曲线。
14.图2:(a)不同含量haucl4·
3h2o aucuncs溶液的荧光发射光谱图,(b)不同含量haucl4·
3h2o aucuncs溶液的稳定性曲线。
15.图3:(a)aucuncs的激发发射光谱图,(b)aucuncs的透射电镜图,(c) aucuncs的粒径分布图,(d)aucuncs的红外吸收光谱图,(e)aucuncs中铜元素的光电子能谱图,(f)aucuncs的金元素的光电子能谱图。
16.图4:(a)不同ce
3
浓度的aucuncs-ce
3
溶液的荧光发射光谱图,(b) aucuncs-ce
3
溶液590nm处荧光强度与ce
3
浓度的关系曲线。
17.图5:aucuncs-ce
3
溶液590nm处荧光强度稳定性曲线。
18.图6:aucuncs-ce
3
溶液590nm处荧光强度对杨梅素加入时间的响应时间光谱图。
19.图7:(a)aucuncs-ce
3
对不同浓度(0~300μm)杨梅素的响应荧光光谱图,(b) 图(a)590nm处荧光强度与杨梅素浓度的关系曲线。
20.图8:(a)aucuncs-ce
3
对小浓度(0~7μm)杨梅素的响应荧光光谱图,(b)图 (a)590nm处荧光强度与杨梅素浓度的关系曲线。
21.图9:aucuncs-ce
3
对杨梅素及干扰物的荧光强度变化图。
22.图10:aucuncs-ce
3
对杨梅素和干扰物混合后的荧光强度变化图。
23.图11:aucuncs-ce
3
的荧光激发光谱和杨梅素的紫外-可见吸收谱图。
24.表1:aucuncs-ce
3
加入杨梅素前后寿命变化数据
[0025][0026]
图1对应实施例1;图2对应实施例2;图3对应实施例3;图4对应实施例 4;图5对应实施例5;图6~图8对应实施例6;图9~图10对应实施例7;图11、表1对应实施例8。
[0027]
金铜纳米簇激发波长为350nm,发射波长为606nm(图3a)。采用透射电子显微镜(tem)表征金铜纳米簇的表面形貌和大小,该纳米簇分散性较高、粒径较为均一(图3b),平均粒径为~2.8nm(图3c)。在红外光谱图中,gsh的s-h典型的拉伸振动在2525cm-1
处,在金铜纳米簇中,该峰消失,表明金属表面形成了cu-s和/ 或au-s键(图3d),说明成功获得了双金属纳米团簇。此外,在xps结果中,在 932.3ev和952.2ev处有两个明显的峰,分别属于cu(0)和cu(i)的cu 2p
3/2
和cu2p
1/2
(图3e),942.0ev处特征峰的缺失排除了cu(ii)的存在。au 4f
7/2
和4f
5/2
的特征结合能分别为84.1和87.7ev,au 4f
7/2
的84.1ev经过分峰处理在83.8和84.8ev 处有两个峰,分别属于au(0)和au(i)(图3f)。根据结果,表明大部分au(iii)被还原为au(0)和au(i),并与铜原子结合形成金铜杂化纳米团簇。因此,成功制备了金铜纳米簇,其中cu(0)和au(0)形成金属核,cu(i)和au(i)覆盖在核表面。
[0028]
如图4-5所示,随着在金铜纳米簇溶液中逐步加入不同浓度ce
3
,金铜纳米簇荧光强度得到增强,并且荧光发射波长蓝移至590nm,且当ce
3
浓度达到200μm 时饱和(图4)。故将金铜纳米簇与200μm ce
3
作用作为组装体,且该组装体存储时间可以保持25天(图5),故把aucuncs-ce
3
当作较稳定的荧光探针。
[0029]
如图6-8所示,向aucuncs-ce
3
组装体中加入50μm杨梅素,采用荧光光谱观察到杨梅素使aucuncs-ce
3
组装体发生淬灭,且响应快速(图6,前8分钟左右是aucuncs-ce3 组装体稳定的时间,在第8分钟时加入50μm杨梅素,立马淬灭,并在2~3分钟淬灭稳定至含50μm杨梅素应淬灭的强度处)。此外,随着杨梅素浓度的增加,荧光探针在590nm处的荧光强度随之下降,最后在杨梅素浓度在300μm时基本达到饱和,故杨梅素的响应范围0~300μm(图7),并在1.0~7.0μm 浓度范围内呈现良好线性,检出限为0.14μm(图8)。
[0030]
此外,还分析了aucuncs-ce
3
组装体对其他物质如芹菜素、槲皮素、桑色素溶液及
20种天然氨基酸溶液的影响,结果表明,芹菜素、槲皮素、桑色素较杨梅素使荧光猝灭效果差,其他物质均未对aucuncs-ce
3
组装体有作用(图9)。说明该荧光探针能够对杨梅素进行有效检测。除此之外,20种天然氨基酸溶液用于检验aucuncs-ce
3
组装体对杨梅素的干扰性。这些氨基酸等对荧光aucuncs-ce
3
探针检测杨梅素没有影响(图10),说明该方法在实际应用中是一种检测杨梅素的有效手段。
[0031]
在机制研究过程中,aucuncs-ce
3
组装体在添加杨梅素前后的平均荧光寿命基本不变(表1),说明杨梅素对aucuncs-ce
3
组装体发生静态猝灭效应。以及杨梅素的最大吸收峰与aucuncs-ce
3
组装体的激发光谱重叠(图11),因此,杨梅素使aucuncs-ce
3
组装体发生猝灭机制可能是内滤效应。总体结果表明,aucuncs-ce
3
组装体荧光猝灭可归因于内滤效应,并且是静态猝灭过程。
具体实施方式
[0032]
本发明中使用的三水合氯金酸(haucl4·
3h2o,》99.9%)和五水合硫酸铜(cuso4·
5h2o,》99.9%)由北京化工厂(中国北京)供应。4-(2-羟乙基)-1-哌嗪乙磺酸(hepes,》99.9%)、谷胱甘肽(gsh)及20种天然氨基酸(val,met,cys,ile,pro,arg,phe,gly,gln,glu,thr,trp,ser,ala,asp,lys,leu,asn,tyr,his)购买于上海阿拉丁生化科技有限公司(中国上海)。杨梅素、桑色素、芹菜素、槲皮素购买于上海麦克林生化科技有限公司,氢氧化钠(naoh)购买于国药集团化学试剂有限公司。所有的化学药品均是分析纯,且没有再纯化。超纯水用于整个实验过程。
[0033]
实施例1:
[0034]
将5.0ml(163mm)谷胱甘肽水溶液加入到5.0mlcuso4·
5h2o(10mm)水溶液中。待溶液变为白色悬浮液后,逐滴加入1.0m的naoh溶液,直至浑浊液再次变透明,呈现淡黄色,此时溶液的ph为4.2,再室温下搅拌2h,得到铜纳米簇溶液。利用荧光光谱测试铜纳米簇(cuncs)的激发发射以及监测其稳定性。
[0035]
结果显示:铜纳米簇的发射为630nm,激发为350nm(图1a),与报道的铜纳米簇基本一致,但为了尽可能获得全谱,故采用370nm的光激发,并且后续荧光测试统一采用激发波长为370nm,此外,铜纳米簇只能稳定四天(图1b)。
[0036]
实施例2:
[0037]
基于实施例1中的铜纳米簇溶液,向其中分别掺杂终浓度为0.25、0.50、0.75、1.0、1.25、1.5mm的haucl4·
3h2o并继续搅拌3小时,得到金铜纳米簇(aucuncs)溶液。利用荧光光谱监测金铜纳米簇的发射波长及荧光强度变化,同时监测金铜纳米簇的稳定性。
[0038]
结果显示:随着haucl4·
3h2o掺杂浓度的增加,发射波长伴随蓝移并且荧光强度稍微降低,同时,在掺杂0.25、0.50、0.75mm的haucl4·
3h2o时,金铜纳米簇溶液的稳定性并没有改善;在掺杂1.0、1.25、1.5mm的haucl4·
3h2o时,金铜纳米簇溶液溶液基本上可以稳定7天(图2),故选择掺杂含量为1.0~1.5mmhaucl4·
3h2o的为较优实施方案,选择掺杂含量为1.0mmhaucl4·
3h2o作为最佳实施方案。
[0039]
实施例3:
[0040]
基于实施例1-2,将5.0ml(50mg/ml)谷胱甘肽水溶液加入到5.0mlcuso4·
5h2o(10mm)水溶液中,待溶液变为白色悬浮液后,逐滴加入1.0m的naoh溶液,直至浑浊液再次
变透明,呈现淡黄色,室温下搅拌2h,此时溶液的 ph为4.2,得到铜纳米簇溶液。然后添加终浓度1.0mm的haucl4·
3h2o到铜纳米簇溶液中并搅拌3小时。最后,向反应体系中加入20ml乙醇,在7000rpm 下离心15分钟后收集沉淀。将沉淀溶解在蒸馏水中,然后加入乙醇并离心3次,去除所有残留的小分子,通过冷冻干燥机冷冻干燥后获得纯的金铜纳米簇粉末,并储存在4℃以供进一步使用。
[0041]
结果显示:基于实施例3得到的金铜纳米簇激发波长为350nm,发射波长为 606nm(图3a)。采用透射电子显微镜(tem)表征金铜纳米簇的表面形貌和大小,从图中可以看出纳米颗粒的分散性较高、且粒径较为均一(图3b)。通过对大约200 个颗粒进行系统分析后发现晶粒平均尺寸为~2.8nm(图3c)。然后利用红外光谱监测了谷胱甘肽(gsh)和金铜纳米簇中配体gsh的振动吸收变化。gsh的s-h典型的拉伸振动出现在2525cm-1
处,在铜纳米簇和金铜纳米簇中消失,表明金属表面形成了cu-s和/或au-s键(图3d)。结果表明,成功获得了双金属纳米团簇。此外,通过xps测量来确定双金属纳米团簇中cu和au原子的价态。在932.3ev和 952.2ev处有两个明显的峰,分别属于cu(0)和cu(i)的cu 2p
3/2
和cu 2p
1/2
(图3e), 942.0ev处特征峰的缺失排除了cu(ii)的存在。au 4f
7/2
和4f
5/2
的特征结合能分别为84.1和87.7ev,au 4f
7/2
的84.1ev经过分峰处理在83.8和84.8ev处有两个峰,分别属于au(0)和au(i)(图3f)。根据结果,表明大部分au(iii)被还原为au(0)和 au(i),并与铜原子结合形成金铜杂化纳米团簇。因此,本实施例成功制备了金铜纳米簇,其中cu(0)和au(0)形成金属核,cu(i)和au(i)覆盖在核表面。
[0042]
实施例4:
[0043]
先用超纯水配置浓度为10mm的hepes水溶液,再用1.0m naoh调节ph 至6.8,则得到10mm的hepes-naoh(ph=6.8)缓冲液。将实施例3得到的金铜纳米簇粉末置于ph=6.8的hepes-naoh缓冲液中,配置成浓度为0.50mg
·
l-1
的金铜纳米簇溶液;然后采用超纯水配置浓度为100mm的硝酸铈水溶液,向金铜纳米簇溶液中逐渐滴入硝酸铈水溶液,使硝酸铈的终浓度分别为50、100、150、200、300、400μm,利用荧光光谱(激发波长370nm)监测荧光变化。
[0044]
结果显示:ce
3
引入后金铜纳米簇荧光强度得到增强,并且伴随ce
3
浓度的增加荧光发射波长蓝移至590nm,且当ce
3
浓度达到200μm时饱和(图4),0.50 mg
·
l-1
金铜纳米簇与200μm ce
3
作用形成组装体(aucuncs-ce
3
),即本发明所述的一种基于谷胱甘肽保护的金铜纳米团簇与ce
3
组装体的荧光探针溶液。
[0045]
实施例5:
[0046]
将实施例4中得到的组装体置于4℃冰箱中,用荧光光谱仪监测其稳定性。
[0047]
结果显示:该组装体在25天内荧光光谱基本上没有变化(图5),其稳定性得到进一步提升,故该组装体可以作为较稳定的荧光探针。
[0048]
实施例6:
[0049]
将实施例4中的aucuncs-ce
3
组装体作为稳定的荧光探针,向该组装体中加入杨梅素的丙酮溶液,使杨梅素的终浓度为50μm,采用荧光光谱(激发370nm,发射590nm,时间为分钟),进行监测该组装体对杨梅素的响应速度。此外,测试该组装体对杨梅素的响应范围,先用丙酮配置10mm的杨梅素溶液,将10mm的杨梅素溶液逐渐滴加到该组装体中。同时为了测试该组装体对杨梅素的检出限,故将该荧光探针用缓冲溶液稀释10倍,再同比例稀释杨梅素溶液(1mm),将1mm 杨梅素溶液逐渐滴加到稀释后的组装体中,利用荧光光谱监测590nm
处荧光强度变化。
[0050]
结果显示:杨梅素使aucuncs-ce
3
组装体发生淬灭,且响应快速(图6)。且随着杨梅素浓度的增加,荧光探针在590nm处的荧光强度随之下降,最后在杨梅素浓度在300μm时基本达到饱和。故对杨梅素的响应范围在0~300μm之间(图 7)。在检出限测试中,杨梅素浓度在1.0~7.0μm时有较好的线性关系,采用590nm 处的荧光强度值与杨梅素浓度的线性关系作图,计算得到对杨梅素的检测限为0.14 μm(图8)。
[0051]
实施例7:
[0052]
为了研究aucuncs-ce
3
组装体对杨梅素的选择性,采用dmso配置10mm 的芹菜素、槲皮素、桑色素溶液以及采用超纯水制备10mm的20种天然氨基酸溶液(val,met,cys,ile,pro,arg,phe,gly,gln,glu,thr,trp,ser,ala,asp,lys,leu, asn,tyr,his),再分别向组装体中滴加芹菜素溶液、槲皮素溶液、桑色素溶液、杨梅素溶液及20种天然氨基酸溶液,使芹菜素、槲皮素、桑色素、杨梅素及20种天然氨基酸的终浓度均为300μm。所有的荧光测试均在室温下,然后进行荧光光谱测试。在检验aucuncs-ce
3
组装体对杨梅素的干扰性,将aucuncs-ce
3
组装体置于hepes-naoh(ph 6.8)缓冲溶液中,加入终浓度为300μm杨梅素后,再分别加入一系列干扰物(val,met,cys,ile,pro,arg,phe,gly,gln,glu,thr,trp,ser, ala,asp,lys,leu,asn,tyr,his),加入的各种干扰物的终浓度均为300μm,然后利用荧光光谱监测590nm处荧光强度变化。
[0053]
结果显示,在选择性实验中,芹菜素(apigenin)、槲皮素(quercetin)、桑色素(morin)较杨梅素(myricetin)使荧光猝灭效果差,其他物质(20种天然氨基酸)均未对aucuncs-ce
3
组装体有作用(图9),表明该荧光探针能够对杨梅素进行有效检测。在干扰性实验检测中,含有杨梅素的溶液中加入其他干扰物后,均不会影响aucuncs-ce
3
组装体对杨梅素的荧光响应(图10)。因此,我们认为这些氨基酸对荧光aucuncs-ce
3
组装体探针检测杨梅素没有影响,说明该方法在实际应用中是一种检测杨梅素的有效手段。
[0054]
实施例8:
[0055]
为了探究杨梅素使aucuncs-ce
3
组装体发生淬灭的机理,首先测量了 aucuncs-ce
3
组装体在添加杨梅素前后的荧光寿命。以及通过荧光光谱仪测试该组装体的激发光谱,以及杨梅素的紫外吸收,比较光谱是否有重叠。
[0056]
结果显示,aucuncs-ce
3
组装体平均荧光寿命为14.5106ns,在添加杨梅素后,平均寿命变化为13.7623ns(表1);在加入杨梅素前后,平均荧光寿命基本不变,说明杨梅素对aucuncs-ce
3
组装体发生静态猝灭效应。杨梅素的最大吸收峰与aucuncs-ce
3
组装体的激发光谱重叠(图11)。当荧光材料的激发光谱与猝灭剂或分析物的吸收光谱有明显的重叠区域时,就会发生内滤效应。因此,内滤效应可能是杨梅素使aucuncs-ce
3
组装体发生猝灭的一种机制。总体结果表明, aucuncs-ce
3
组装体荧光猝灭可归因于内滤效应,并且是静态猝灭过程。
[0057]
还需要说明的是,本发明的具体实施例只是用来示例性说明,并不以任何方式限定本发明的保护范围,本领域的相关技术人员可以根据上述一些说明加以改进或变化,但所有这些改进和变化都应属于本发明权利要求的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。