1.本发明属于废水处理领域,具体涉及一种基于微藻培养净化头孢拉定废水的方法。
背景技术:
2.头孢菌素高效、低毒、临床应用广泛,具有抗菌谱广、抗菌作用强、耐青霉素酶、过敏反应较青霉素类少见等优点,它不但可以破坏细菌的细胞壁,还可以在细菌的繁殖期内杀菌,而对机体几乎没有毒性,因此在临床得到了广泛的应用。
3.头孢类抗生素生产废水除了含有大量有机物质外,往往还残留有头孢类抗生素的成分。由于头孢菌素类抗生素是一种广谱抗菌素,它会破坏细菌的细胞壁,使得细菌失去活性。高浓度头孢类抗生素废水利用传统活性污泥法难以有效处理,因为细菌是抗生素的靶细胞,抗生素的存在会影响细菌的生长,从而影响细菌净化废水的效果。除此之外,微生物在高抗生素浓度条件下增殖会被诱导产生抗生素抗性基因,携带该类基因的微生物如果进入环境将会降低抗生素效果,产生极大危害。
技术实现要素:
4.本发明的目的在于克服现有技术中的缺点,提供一种基于微藻培养净化头孢拉定废水的方法。
5.为实现上述目的,本发明采用的技术方案为:
6.一种基于微藻培养净化头孢拉定废水的方法,包括下述步骤:
7.1)、将功能性微藻进行预先培养,使其达到对数生长期;
8.2)、步骤1)中对数生长期的功能性微藻接种至含头孢拉定抗生素的废水中,进行抗生素废水的净化。
9.所述的功能性微藻为四尾栅藻或者小球藻l166。
10.步骤2)中头孢拉定的浓度为25-100mg/l。
11.预先培养的条件设置为:全天光照,光照强度4800-5200lux,培养温度 24-26℃,通气量30-40ml/min,通入的气体为co2和n2的混合气,co2所占的体积分数为5%。
12.与现有技术相比,本发明的有益效果是:
13.1)本发明利用微藻培养净化人工模拟高浓度抗生素废水,在8天的培养之后,四尾栅藻对于抗生素的降解率在95%以上。同时四尾栅藻8天后的生物量浓度能达到111.85
±
1.26mg/l,叶绿素含量达到20.00
±
1.58mg/g,类胡萝卜素含量达到7.36
±
0.26mg/g。在8天的培养之后,小球藻l166对于抗生素的降解率在85%以上。同时小球藻l166 8天后的生物量浓度能达到138.19
±
0.37 mg/l,叶绿素含量达到18.78
±
0.38mg/g,类胡萝卜素含量达到6.80
±
0.03 mg/g。
14.2)本发明利用微藻净化高浓度抗生素废水,不需要投加营养盐,利用微藻的光合作用,使污染物得到净化,并且得到微藻生物量以及细胞色素。
15.3)微藻产生的类胡萝卜素类可以消除微藻在抗生素胁迫下产生的活性氧,如三重态叶绿素和单线态氧,有利于抗生素的净化。本方法中在抗生素胁迫下微藻产生的类胡萝卜素含量显著高于没有抗生素的胁迫下的微藻。表明这种藻非常适合抗生素的消除,并且能够达到很高的净化效能。
附图说明
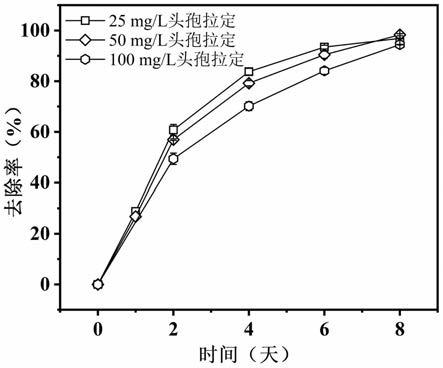
16.图1是实施例1中四尾栅藻对不同浓度头孢拉定的降解率结果图;
17.图2是实施例1中不同浓度头孢拉定下四尾栅藻的生物量浓度变化图;
18.图3是实施例1中不同浓度头孢拉定下四尾栅藻的叶绿素含量变化图;
19.图4是实施例1中不同浓度头孢拉定下四尾栅藻的类胡萝卜素含量变化图。
20.图5是实施例2中小球藻l166对不同浓度头孢拉定的降解率结果图;
21.图6是实施例2中不同浓度头孢拉定下小球藻l166的生物量浓度变化图;
22.图7是实施例2中不同浓度头孢拉定下小球藻l166的叶绿素含量变化图;
23.图8是实施例2中不同浓度头孢拉定下小球藻l166的类胡萝卜素含量变化图。
24.图9为对比例小球藻l166(a)和四尾栅藻(b)对不同浓度磺胺二甲氧基嘧啶 (sdm)的降解率结果图;
25.图10是对比例小球藻l166(a)和四尾栅藻(b)对不同浓度磺胺二甲氧基嘧啶 (sdm)的生物量浓度变化图;
26.图11是对比例小球藻l166(a)和四尾栅藻(b)对不同浓度磺胺二甲氧基嘧啶 (sdm)的叶绿素含量变化图;
27.图12是对比例小球藻l166(a)和四尾栅藻(b)对不同浓度磺胺二甲氧基嘧啶 (sdm)的类胡萝卜素含量变化图。
具体实施方式
28.为了使本技术领域的技术人员更好地理解本发明的技术方案,下面结合附图和最佳实施例对本发明作进一步的详细说明。
29.实施案例1:一种强化微藻净化含高浓度抗生素废水,利用紫外强化的方法,包括如下步骤:
30.1)、将四尾栅藻scenedesmus quadricauda fachb-44接种至含有200ml 灭菌后的bg-11培养基中,将其置于生化培养箱中进行预先培养,使四尾栅藻达到对数生长期,之后将其作为工作藻液;
31.预先培养的条件设置为:全天光照,光照强度4800-5200lux,培养温度 24-26℃,通气量30-40ml/min,通入的气体为co2和n2的混合气,co2所占的体积分数为5%。
32.2)、步骤1)获得的藻液经过3次去离子水洗涤离心后,再接种至含有不同浓度的人工模拟高浓度抗生素废水中,置于微藻培养架上培养。确保初始接种微藻在680nm波长下吸光度为0.1,全天光照,光照强度4800-5200lux,培养温度24-26℃,培养周期8天,定期取样测定微藻对于抗生素的净化率。人工模拟高浓度抗生素废水的配置方式为将一定量4g/l头孢拉定母液加入到200 ml bg-11培养基中,获得含25、50、100mg/l头孢拉定人工模拟高浓度抗生素废水。
33.3)、定期收集步骤2)培养的藻液,测定其在680nm波长下的吸光度,根据四尾栅藻干重与吸光度的标准曲线转化成细胞的干重,四尾栅藻干重与吸光度的标准曲线为:四尾栅藻细胞干重(g/l)=0.446
×
od
680-0.006,r2=0.999。
34.4)、定期收集步骤2)培养的藻液,经过离心后弃去上清液,获得藻泥,将收获的藻泥重新悬浮在同等体积下的甲醇-水溶液中,在4℃下保存16-24h,之后离心测定上清液多波长下的吸光度,测定细胞内光合色素浓度,将其与细胞干重作比,获得归一化后的细胞内光合色素含量。
35.图1所示在经过8天的培养后,微藻对于25、50、100mg/l人工模拟废水中头孢拉定净化率在96.89
±
0.14%、98.32
±
0.40%、94.45
±
0.12%。
36.图2所示在经过8天的培养后,微藻在净化25、50、100mg/l人工模拟废水中头孢拉定过程中生物量分别为122.32
±
0.32mg/l、117.86
±
0.32mg/l、 111.847
±
1.26mg/l。
37.图3所示在经过8天的培养后,微藻在净化25、50、100mg/l人工模拟废水中头孢拉定过程中叶绿素含量分别为20.00
±
1.58mg/g、21.83
±
0.45mg/g、 22.00
±
0.78mg/g,相比于对照组,分别提升了47.09%,60.54%和61.78%。
38.图4所示在经过8天的培养后,微藻在净化25、50、100mg/l人工模拟废水中头孢拉定过程中类胡萝卜素分别为7.36
±
0.26mg/g、7.69
±
0.20mg/g、 7.69
±
0.50mg/g,相比于对照组,分别提升了22.25%,27.68%和27.59%。
39.bg-11为对照组,与实施案例的区别在于培养基不需要添加抗生素。
40.实施案例2:实施案例2与实施案例1的区别仅在于使用小球藻l166代替四尾栅藻。
41.图5所示在经过8天的培养后,小球藻l166对于25、50、100mg/l头孢拉定废水净化率在96.95
±
1.19%、95.74
±
0.52%、86.32
±
0.04%。
42.图6所示在经过8天的培养后,小球藻l166在净化25、50、100mg/l头孢拉定废水中生物量分别为134.32
±
2.55mg/l、138.19
±
0.37mg/l、127.23
ꢀ±
0.91mg/l。
43.图7所示在经过8天的培养后,小球藻l166在净化25、50、100mg/l头孢拉定废水中叶绿素含量分别为18.78
±
0.38mg/g、18.97
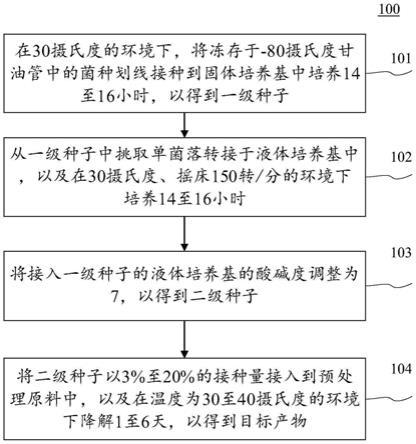
±
0.24mg/g、18.06
ꢀ±
0.03mg/g,相比于对照组,分别提升了15.86%,17.07%和11.44%。
44.图8所示在经过8天的培养后,小球藻l166在净化25、50、100mg/l头孢拉定废水过程中类胡萝卜素分别为6.68
±
0.01mg/g、6.80
±
0.03mg/g、6.52
ꢀ±
0.14mg/g,相比于对照组,分别提升了14.39%,16.50%和11.60%。
45.对比例:对比例与实施例的区别仅在于使用磺胺二甲氧基嘧啶(sdm)替代头孢拉定。
46.小球藻l166(a)和四尾栅藻(b)对不同浓度磺胺二甲氧基嘧啶(sdm)的去除情况如9所示。由图可知,经过12天的培养,小球藻l166对25mg/l磺胺二甲氧基嘧啶的去除率最高为13.96%,对100mg/l磺胺二甲氧基嘧啶的去除率最高为13.44%。在培养第6天,四尾栅藻对于低浓度(25mg/l)和高浓度(100 mg/l)的sdm达到了最大的去除率,分别为11.43%和4.01%。
47.暴露于不同浓度sdm下小球藻细胞生长状况如图10所示。第12天,暴露于25,50,100mg/l sdm中,小球藻l166的干重相比对照组下降了2.02%,7.90%和16.94%。在12天后,暴露于25,50,100mg/l sdm中,四尾栅藻干重相比对照组(136.35mg/l)下降了17.28%,
40.03%,53.42%
48.两株藻随sdm浓度变化时光合色素的含量,如图11所示。第12天,暴露于25,50,100mg/l sdm时,小球藻l166的总叶绿素含量为23.33
±
1.56mg/g, 23.87
±
1.27mg/g,22.15
±
1.03mg/g。仅在100mg/l sdm下降了4.80%。在第12天时,暴露于25,50,100mg/l sdm时,四尾栅藻的叶绿素含量为5.54
ꢀ±
0.15mg/g,4.66
±
0.51mg/g,6.26
±
1.21mg/g,分别降低了49.01%,57.11%, 42.42%
49.图12显示随培养时间的延长,暴露于不同浓度sdm的藻类胡萝卜素含量的变化。在第12天时,与对照组相比(6.53mg/g),暴露于25,50,100mg/l sdm 时,小球藻l166类胡萝卜素含量分别为6.49
±
0.25mg/g,6.58
±
0.15mg/g, 6.23
±
0.32mg/g,仅在100mg/l sdm显著下降4.80%。在第12天时,与对照组相比(6.883mg/g),暴露于25,50,100mg/l sdm时,四尾栅藻类胡萝卜素含量分别为5.51
±
0.61mg/g,5.14
±
0.13mg/g,4.25
±
1.08mg/g,分别下降了19.88%,25.22%,38.22%。
50.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。