approaches.j chromatogr b analyt technol biomed life sci 848(1):28
–
39)。发现使用精氨酸溶液作为洗脱液的蛋白a层析可防止从蛋白a洗脱时的蛋白质聚集(arakawa,t.,philo,js,tsumoto,k.,yumioka,r.,ejima,d.2004.elution of antibodies from a protein-a column by aqueous arginine solutions,protein expr.purif.36,244
–
248)。
7.生物制药行业仍然需要定义改进的方法,以降低下游加工中低ph步骤期间蛋白质聚集的风险。特别是在蛋白a亲和层析中向洗脱缓冲液中添加药学上可接受的稳定化赋形剂的方法引起了人们的高度关注,因为这种缓冲系统在病毒灭活的后续关键加工步骤中也起着至关重要的作用。
技术实现要素:
8.令人惊讶地发现,在诸如mab的生物药物蛋白的纯化加工中,将选自由二糖、多元醇和聚(乙二醇)聚合物的中性赋形剂添加到蛋白a亲和层析中的洗脱缓冲液中,防止靶蛋白的聚集和沉淀,从而导致在洗脱产物汇集物中提高的产物产率。进一步发现,所选的赋形剂在病毒灭活步骤中的低ph处理期间有效地稳定mab,并且在低ph处理期间不干扰病毒灭活。由于所选的赋形剂在包含靶mab的药物制备物中是可接受的和有用的,因此无需在进一步的加工步骤中去除赋形剂。
9.特别是,本发明提供了一种从细胞培养样品中纯化靶蛋白的方法,其中细胞培养样品包含靶蛋白、病毒化合物和其他与产物和过程相关的杂质,所述方法包括亲和层析步骤、病毒灭活步骤和任选的其他纯化步骤,其中亲和层析步骤包括:
10.a)将细胞培养样品上样到亲和层析柱,从而使靶蛋白结合到亲和层析柱;
11.b)通过使亲和层析柱与具有ph《6并包含赋形剂的洗脱缓冲液接触,从亲和层析柱洗脱靶蛋白,其中赋形剂选自由二糖、多元醇和聚(乙二醇)聚合物组成的组;
12.c)收集从步骤(b)获得的一个或多个含有靶蛋白的级分;
13.d)合并从步骤(c)获得的级分以形成洗脱产物汇集物,
14.并且其中病毒灭活步骤包括:
15.e)在ph 2至5温育洗脱产物汇集物。
16.根据本发明优选的实施方案,亲和层析步骤是蛋白a亲和层析步骤。
17.根据本发明另一个优选的实施方案,靶蛋白是单克隆抗体。
18.根据本发明另一个优选的实施方案,聚(乙二醇)聚合物具有1,000g/mol至10,000g/mol的平均分子量。
19.根据本发明有益的方面,赋形剂选自由蔗糖、海藻糖、山梨糖醇、甘露醇和peg4000组成的组。
20.在本发明优选的实施方案中,洗脱缓冲液具有按重量计2%至15%、更优选按重量计5%至10%的赋形剂浓度。
21.在本发明另一个优选的实施方案中,洗脱缓冲液是柠檬酸盐缓冲液。
22.优选地,洗脱缓冲液具有2.5至5.5的ph。
23.根据本发明其他有益方面,洗脱步骤(b)包括使用从ph 5.5到ph 2.75的洗脱缓冲液梯度使亲和层析柱与洗脱缓冲液接触。
24.根据本发明另一个有益方面,在温育步骤(e)之前,将洗脱产物汇集物的ph调节至ph 2至ph 5范围内的ph。
25.根据本发明另一个有益实施方案,温育步骤(e)在ph 2.5至ph 4.5进行。
26.根据本发明另一个优选实施方案,温育步骤(e)在室温进行。
具体实施方式
27.在优化生物药物蛋白质的下游加工过程中,重点是获得高产物产率和高产物纯度。然而,许多生物药物活性蛋白质,特别是单克隆抗体在低ph条件下进行的加工步骤(例如亲和层析步骤和病毒灭活步骤)中倾向于形成二聚体、寡聚体或更高级的聚集体和沉淀。为了提供具有所需纯度的治疗性蛋白质产物,必须在纯化过程期间去除这些聚集蛋白质物质。本发明现在提供一种从细胞培养样品中纯化靶蛋白的方法,其中细胞培养样品包含靶蛋白、病毒化合物和其他与产物和过程相关的杂质,所述方法包括亲和层析步骤、病毒灭活步骤和任选的其它纯化步骤,其中亲和层析步骤包括用具有ph<6且包含选自由二糖、多元醇和聚(乙二醇)聚合物组成的组的赋形剂的洗脱缓冲液对靶蛋白的洗脱。发现向洗脱缓冲液中添加一种选择的赋形剂可以稳定低ph溶液中的靶蛋白,这反映在低蛋白聚集和靶蛋白的高产率上。令人惊讶地发现,所选择的赋形剂不干扰也在低ph条件下进行的随后病毒灭活步骤。相反,发现所选择的赋形剂也在低ph温育期期间稳定靶蛋白。由于所选择的赋形剂是药学上可接受的并且可以安全地施用给人和动物,因此无需将它们从纯化过程中去除。这允许优化生物药物蛋白质的下游加工以降低成本并缩短加工时间。
28.术语“亲和层析”是指基于例如抗原和抗体、酶和底物、受体和配体或蛋白质和核酸之间的高度特异性相互作用来分离生化混合物的层析过程。此类层析树脂的实例包括但不限于蛋白a树脂、蛋白g树脂、蛋白l树脂、固定化金属离子亲和层析等。
29.在本发明的一个具体实施方案中,亲和层析柱是蛋白a亲和层析柱。
30.术语“蛋白a亲和层析”是指使用蛋白a对物质和/或颗粒的分离或纯化,其中蛋白a通常固定化在固相上。蛋白a是一种40-60kd的细胞壁蛋白,最初在金黄色葡萄球菌(staphylococcus aureus)中发现。抗体与蛋白a树脂的结合是高度特异性的。用于本文的蛋白a亲和层析的蛋白a亲和层析柱包括但不限于固定化在聚乙烯醚固相上的蛋白a,例如柱(merck,darmstadt,germany),固定化在有孔玻璃基质上的蛋白a,例如柱(merck,darmstadt,germany),固定化在琼脂糖固相上的蛋白a,例如mabselect
tm sure
tm
柱(ge healthcare,uppsala,sweden)。
31.本发明可以包括进一步的纯化步骤,这些纯化步骤通常用于细胞培养来源的靶蛋白的纯化过程中。非限制性实例是柱层析步骤如亲和层析柱、疏水相互作用柱和离子交换柱以及过滤步骤如超滤和渗滤。
32.术语“细胞培养样品”是指源自细胞培养基的样品,即在细胞,特别是哺乳动物宿主细胞的培养、生长或维持期间使用的溶液,并且包含目的靶蛋白。如本文所用,包含靶蛋白的细胞培养样品可以是收获的细胞培养液样品或可以是来自先前过滤和/或层析步骤的洗脱液。
[0033]“蛋白质”是包含一条或多条多肽链或至少一条多于100个氨基酸残基的多肽链的大分子。多肽还可以包含非肽成分,例如碳水化合物基团。碳水化合物基团和其他非肽取代
基可以由产生多肽的细胞添加到多肽中,并且会随细胞类型而变化。多肽在本文中根据它们的氨基酸骨架结构来定义;诸如碳水化合物基团的取代基通常没有具体说明,但仍然可以存在。
[0034]
如本文所用,术语“抗体”是指任何形式的抗体或其片段,并且是表现出所需生物活性的蛋白质。因此,它以最广泛的意义使用并且具体涵盖单克隆抗体(包括全长单克隆抗体)、多克隆抗体、多特异性抗体(例如双特异性抗体)和抗体片段,只要它们表现出所需的生物活性。“分离的抗体”是指结合化合物的纯化状态,在这种情况下是指分子基本上不含其他生物分子,例如核酸、蛋白质、脂质、碳水化合物或其他材料,例如细胞碎片和生长培养基。通常,术语“分离的”并非意指完全不存在此类物质或不存在水、缓冲液或盐,除非它们以实质上干扰如本文描述的结合化合物的实验或治疗用途的量存在。
[0035]
如本文所用,术语“单克隆抗体”或“mab”是指从基本上同质的抗体群体中获得的抗体,即,除了以少量存在的可能天然发生的突变之外,构成群体的个体抗体是相同的。单克隆抗体具有高度特异性,针对单一抗原表位。相反,常规(多克隆)抗体制备物通常包括大量针对(或特异于)不同表位的抗体。修饰语“单克隆”表示抗体的特征是从基本上同质的抗体群体中获得,并且不应解释为需要通过任何特定方法产生抗体。例如,根据本发明使用的单克隆抗体可以通过kohler等人,(1975)nature 256:495首先描述的杂交瘤方法制备,或者可以通过重组dna方法制备(参见,例如,美国专利号4,816,567)。“单克隆抗体”也可以例如使用在clackson等人,(1991)nature 352:624-628和marks等人,(1991)j.mol.biol.,222:581-597中描述的技术从噬菌体抗体文库分离。
[0036]
本文中的单克隆抗体具体包括“嵌合”抗体(免疫球蛋白),其中重链和/或轻链的一部分与源自特定物种或属于特定抗体类别或亚类的抗体中的相应序列相同或同源,而链的其余部分与源自另一物种或属于另一抗体类别或亚类的抗体中的相应序列相同或同源,以及此类抗体的片段,只要它们表现出所需的生物活性(美国专利号4,816,567;和morrison等人,(1984)proc.natl.acad.sci.usa 81:6851-6855)。
[0037]
为了从亲和层析柱中回收单体形式的靶蛋白或抗体,吸附之后是从亲和层析树脂中洗脱单体形式的吸附的蛋白质。与之前的吸附步骤相比,可以通过应用洗脱缓冲液改变柱中流动相的ph条件来实现对吸附的蛋白质的洗脱。
[0038]
术语“流动相”表示适合从层析柱回收多肽的水和/或水性缓冲液和/或有机溶剂的任何混合物。在本文中,术语“用于洗脱”或“洗脱”分别如本领域技术人员已知的那样使用,并且表示吸附的物质从固体或吸附剂中溶出,任选地置换出来,所述固体或吸附剂(即吸附物质的柱材料)用流体浸渍。
[0039]
如本文所用,术语“缓冲液”是指通过其酸-碱共轭组分的作用抵抗ph变化的缓冲溶液。“洗脱缓冲液”是用于从层析柱中洗脱蛋白质的缓冲液。本发明的亲和层析步骤的洗脱缓冲液通常具有ph<6。本领域技术人员知道ph的选择很大程度上取决于目的靶蛋白的稳定性概况。在一个优选的实施方案中,ph在2.5至5.5的范围内。将ph控制在该范围内的缓冲液的实例包括磷酸盐、乙酸盐、柠檬酸盐或铵缓冲液,或其组合。优选的这种缓冲液是柠檬酸盐。
[0040]
在本发明中,洗脱缓冲液包含选自由二糖、多元醇和聚(乙二醇)组成的组的赋形剂。
[0041]
在本发明的一个实施方案中,赋形剂是药学上可接受的化合物。术语“药学上可接受的化合物”是指在用于患者的剂量和浓度下无毒并且与药物制剂的其他成分相容的化合物。
[0042]
在一个实施方案中,赋形剂是二糖。在另一个实施方案中,二糖是蔗糖或海藻糖。
[0043]
在另一个实施方案中,赋形剂是多元醇。在一个优选的实施方案中,多元醇是指具有至少四个羟基的糖醇。因此,在一个实施方案中,多元醇选自:具有四个游离羟基的四醇,或具有五个游离羟基的戊醇,或具有六个游离羟基的己醇。在一个优选的实施方案中,多元醇是山梨糖醇或甘露醇。
[0044]
在本发明的一个实施方案中,赋形剂是聚(乙二醇)聚合物。尽管聚(乙二醇)聚合物的分子量变化很大,但分子量范围为约400g/mol至约30,000g/mol的聚合物通常是合适的。在本发明的优选实施方案中,合适地选择平均分子量在1,000g/mol至10,000g/mol、更优选3,000g/mol至5,000g/mol的范围内的聚乙二醇。在本发明的实施例中,选择平均分子量为4,000g/mol的聚乙二醇(peg4000)。
[0045]
在一个优选的实施方案中,洗脱缓冲液具有的赋形剂浓度为按重量计2%至15%,更优选按重量计5%至10%。任何赋形剂都可以以高于实现预期稳定效果所需的浓度使用。本领域技术人员可以确定其中存在效果并且可以在本文报道的方法中耐受的赋形剂浓度范围。
[0046]
在一个实施方案中,一种或多种赋形剂可以存在于施加于层析材料的洗脱缓冲液中,所述洗脱缓冲液用于洗脱靶蛋白,尤其是抗体。在一个实施方案中,洗脱缓冲液包含多至五种不同的赋形剂。如果溶液中存在多于一种赋形剂,则存在于溶液中的所有赋形剂的浓度总和优选地在如上定义的范围内。对于任何单一赋形剂或赋形剂的任何组合,本领域技术人员在确定洗脱缓冲液中的合适浓度时将考虑单个溶解度。
[0047]
在根据本发明过程的优选实施方案中,结合和洗脱层析步骤之后是病毒灭活。
[0048]
优选地,来自结合和洗脱层析(亲和层析步骤)的输出物或洗脱物经受病毒灭活。病毒灭活使病毒失去活性或无法感染,这很重要,特别是在靶分子用于治疗用途的情况下。
[0049]
许多病毒含有可以通过化学改变而被灭活的脂质或蛋白质外壳。一些病毒灭活过程能够使病毒完全变性,而不是简单地使病毒灭活。灭活病毒的方法是本领域技术人员众所周知的。一些更广泛使用的病毒灭活过程包括,例如,使用以下一种或多种方法:溶剂/去污剂灭活(例如使用triton x 100);巴氏杀菌(加热);酸性ph灭活;和紫外线(uv)灭活。可以将这些过程中的两个或更多个组合;例如,在高温下进行酸性ph灭活。
[0050]
为了确保完全和有效的病毒灭活,病毒灭活通常在持续搅拌的情况下在延长的时间段内进行,以确保病毒灭活剂与样品的适当混合。例如,在当今工业中使用的许多过程中,来自捕获步骤的输出物或洗脱物被收集在集中罐中,并在延长的时间段内进行病毒灭活(例如,》1到2小时,通常随后过夜贮存)。
[0051]
在本文所述的各种实施方案中,病毒灭活所需的时间可以通过进行管线内病毒灭活(virus inactivation in-line)或通过在该步骤中使用缓冲罐(surge tank)而不是集中罐而得到显著缩短。
[0052]
可以在本文描述的过程中使用的病毒灭活技术的实例可以在例如us2017320909(a1)中找到,其通过引用并入本文。
[0053]
在本发明的一个优选实施方案中,病毒灭活使用酸性ph,其中来自结合和洗脱层析步骤的输出物暴露于酸性ph以进行病毒灭活,使用缓冲罐或管线内进行。用于病毒灭活的ph通常小于5.0,或优选在3.0和4.0之间。在一些实施方案中,ph为约3.6或更低。使用管线内方法的病毒灭活所用的持续时间可以是10分钟或更少、5分钟或更少、3分钟或更少、2分钟或更少、或者约1分钟或更少之间的任何时间。在缓冲罐的情况下,灭活所需的时间通常少于1小时,或优选少于30分钟。
[0054]
在本文所述的本发明的一些实施方案中,合适的病毒灭活剂在层析过程步骤和过程中的下一个单元操作(例如,流过纯化)之间在管线内引入。优选地,管或连接管线包含静态混合器,其确保在输出物进入下一个单元操作之前,来自层析处理步骤的输出物与病毒灭活剂适当混合。通常,结合和洗脱层析的输出物以一定的流速流过管,这确保了与病毒灭活剂的最短接触时间。可以通过使用一定长度和/或直径的管来调节接触时间。
[0055]
在一些实施方案中,在暴露于酸一段时间后,将碱或合适的缓冲液另外地引入管或连接管线中,从而使样品的ph达到下一步骤的合适ph,其中ph对靶分子无害。因此,在一个优选的实施方案中,暴露于低ph以及暴露于碱性缓冲液都是通过静态混合器在管线内混合来实现的。
[0056]
在一些实施方案中,代替管线内静态混合器,或除了管线内静态混合器之外,缓冲罐用于用病毒灭活剂处理来自结合和洗脱层析步骤的输出物,其中缓冲罐的体积不超过结合和洗脱层析步骤的输出物总体积的25%,或不超过结合和洗脱层析步骤的输出物体积的15%或不超过10%。因为当缓冲罐的体积显著小于典型集中罐的体积时,可以实现样品与病毒灭活剂更有效的混合。
[0057]
在一些实施方案中,病毒灭活可以通过在结合和洗脱层析步骤中改变洗脱缓冲液的ph来实现,而不是必须向来自亲和层析步骤的输出物中添加酸。
[0058]
通常,在病毒灭活后,对样品进行流过纯化过程。
[0059]
在一些实施方案中,可以在病毒灭活之后和流过纯化之前包括过滤步骤。这样的步骤可能是需要的,特别是在病毒灭活后(即,在添加酸和碱两者后)观察到样品混浊的情况下。在一些实施方案中,过滤步骤可包括微孔过滤器或深层过滤器。
[0060]
如前所述,已发现通过添加合适的赋形剂可以稳定待纯化的蛋白质并且可以避免混浊和不需要的聚集。因此,在本发明的一个优选实施方案中,病毒灭活步骤和亲和层析步骤都在至少赋形剂的存在下进行,所述赋形剂选自由二糖、多元醇和聚(乙二醇)聚合物组成的组。在一个更优选的实施方案中,添加的赋形剂选自由蔗糖、海藻糖、山梨糖醇、甘露醇和peg4000组成的组。
[0061]
通过这种方式,可以以纯化和稳定的形式获得所需的蛋白质,同时保持病毒灭活。
[0062]
在本发明中,从亲和层析步骤获得的洗脱产物汇集物暴露于ph病毒灭活。暴露于酸性ph减少或完全消除ph敏感的病毒污染物。ph病毒灭活步骤包括将洗脱产物汇集物在2至5、优选2.5至4.5、特别优选2.8至3.6的ph下温育一段时间。通常,通过中和ph值并在必要时通过过滤去除颗粒来完成ph病毒灭活步骤。
[0063]
在本发明的另一个实施方案中,洗脱产物汇集物的ph可以调节至病毒灭活步骤所需的ph。在一个实施方案中,洗脱产物汇集物的ph必须通过添加酸来降低,酸包括但不限于柠檬酸、乙酸、辛酸或其他合适的酸。ph水平的选择取决于靶蛋白组分的稳定性。根据本发
明,存在于洗脱产物汇集物中的应用的赋形剂可以增强靶蛋白在低ph病毒灭活期间的稳定性。
[0064]
低ph病毒灭活期间靶蛋白的稳定性也受低ph温育的持续时间的影响。在一个实施方案中,低ph温育的持续时间为30min至120min,优选30min至60min。
[0065]
在另一个实施方案中,病毒灭活在室温下执行。
附图说明
[0066]
图1显示了在低ph处理期间某些赋形剂对maba的稳定作用。带有三角形标记的上部曲线显示了在低ph处理期间示例性中性赋形剂(0.5m山梨糖醇)对maba的稳定作用,表现为通过动力学sec测量的在ph 2.8的温育时间内稳定或增加的maba单体含量。作为阴性对照,带有圆形标记的下部曲线显示了示例性离子赋形剂(0.5m精氨酸hcl)在低ph条件下的去稳定作用,表现为通过在ph 2.8的温育时间内maba单体含量的显著降低(实施例1)。
[0067]
图2是显示在低ph处理期间通过nanodsf测量的某些赋形剂(山梨糖醇和精氨酸hcl)效果的条形图(实施例1.5)。比“无添加剂对照”(例如0.5m山梨糖醇)更高的tm值表明稳定性质。观察到添加精氨酸hcl的去稳定作用。
[0068]
图3是显示在低ph值处理期间所选的赋形剂(山梨糖醇、甘露醇、蔗糖、海藻糖、peg4000和精氨酸hcl)对maba稳定性的总结作用的条形图。基于动力学se-hplc和nanodsf的结果,所选的中性赋形剂(山梨糖醇、甘露醇、蔗糖、海藻糖和peg4000)在应激条件期间显示出稳定作用,如正
△
(delta)值所示。然而,peg4000在不添加nacl的情况下只能稳定柠檬酸盐缓冲系统中的maba(实施例1)。
[0069]
图4是显示在低ph值处理期间所选的赋形剂(山梨糖醇、甘露醇、蔗糖、海藻糖、peg4000和精氨酸hcl)对mabb稳定性的总结作用的条形图。基于动力学se-hplc和nanodsf的结果,所选的中性赋形剂(山梨糖醇、甘露醇、蔗糖、海藻糖和peg4000)在应激条件期间显示出稳定作用,表现为单体和tm值增加的减少。然而,peg4000在不添加nacl的情况下只能稳定柠檬酸盐缓冲系统中的mabb(实施例1)。
[0070]
图5是显示在ph 2.8的低ph病毒灭活60分钟期间由所选的中性赋形剂(蔗糖、甘露醇、海藻糖和peg4000和山梨糖醇)引起的maba稳定性改善的条形图(实施例4)。
[0071]
图6是显示在ph 2.8的低ph病毒灭活60分钟期间由所选的中性赋形剂(蔗糖、甘露醇、海藻糖和peg4000和山梨糖醇)引起的mabb稳定性改善的条形图(实施例4)。
[0072]
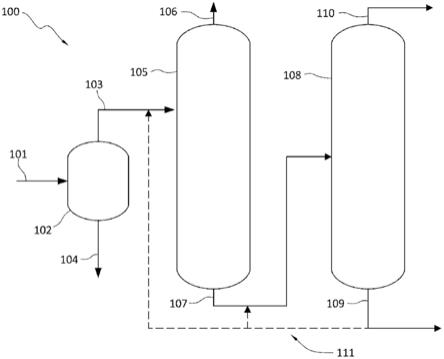
图7是显示使用mlv病毒在ph 3.6进行低ph处理的过程步骤的流程图(实施例5)。
[0073]
图8是显示低ph处理期间,在所选的中性赋形剂(山梨糖醇、甘露醇、蔗糖、海藻糖和peg4000)存在下mlv的病毒减少因数相对温育时间的图(实施例6)。
[0074]
图9是显示在低ph处理60分钟后,在所选的中性赋形剂(山梨糖醇、甘露醇、蔗糖、海藻糖和peg4000)存在下mlv病毒的病毒减少因数的条形图(实施例6)。
[0075]
实施例
[0076]
实施例1:所选的赋形剂对低ph诱导聚集测试(体外)的稳定作用
[0077]
已在体外评估了在模拟单克隆抗体下游加工期间的蛋白a层析和病毒灭活步骤的低ph应激条件期间使用中性赋形剂对mab的作用。已经通过两种模型蛋白(maba和mabb)在低ph值下添加或不添加nacl的温育实验进行体外筛选测试。使用动力学sec和nanodsf来分
析这些实验对样品的构象稳定性、片段化(fragmentation)和聚集行为的作用,并与没有赋形剂的对照条件进行比较。
[0078]
此外,离子赋形剂(精氨酸hcl)也用作阴性对照,以显示不适合在低ph条件下温育的赋形剂的去稳定作用。
[0079]
实施例1.1:0.25m柠檬酸盐缓冲液ph 3.0的制备
[0080]
溶液a:0.25m柠檬酸一水合物(c6h8o7·
h2o fw=210.14)
[0081]
将52.5g柠檬酸一水合物(m=210.14g/mol)称重到合适的烧瓶中。加入500ml的milli-q-水,并搅拌溶液直至物质完全溶解。
[0082]
溶液b:0.25m柠檬酸三钠二水合物(c6h5o7na3·
2h2o fw=294.12)
[0083]
将18.4g柠檬酸三钠二水合物(m=294.12g/mol)称重到合适的烧瓶中。加入500ml的milli-q-水,并搅拌溶液直至物质完全溶解。
[0084]
混合大约415ml的溶液a和大约85ml的溶液b,也得到大约500ml的0.25m柠檬酸盐缓冲液ph 3.0。如有必要,使用1m hcl溶液或1m naoh将ph值调节至3.0
±
0.05。
[0085]
使用0.45μm hawp混合纤维素酯过滤器(merck,darmstadt,germany)过滤缓冲液,并在使用前在超声波浴中脱气20min。
[0086]
实施例1.2:蛋白质样品制备
[0087]
测试的蛋白质是maba和mabb。
[0088]
maba是一种单克隆抗体(约152kda),pi~7.01-8.58。它是tff后纯化的mab,并用10mm柠檬酸盐缓冲液ph 5.5、0.1m nacl、0.1m甘氨酸配制。该溶液的浓度为16mg/ml。
[0089]
mabb是一种单克隆抗体(约145kda),pi~7.6-8.3。它是tff后纯化的mab,并用50mm醋酸钠ph 5.0配制。该溶液的浓度为80mg/ml。
[0090]
表1:体外赋形剂筛选的样品制备
[0091][0092]
实施例1.3:应激条件
[0093]
通过使用所选缓冲条件(0.1m柠檬酸盐缓冲液ph 2.8)以1:20稀释mab样品(maba的最终浓度为0.8mg/ml,mabb的最终浓度为4mg/ml)来启动应激条件。第一个样品在用所选缓冲液稀释后直接在se-hplc中测量。通过每30分钟重复测量来监测聚集动力学2小时。还
通过纳米差示扫描荧光法(nanodsf)测量所有样品以进行解链温度(tm)分析。用这些储备溶液制备不同的赋形剂制剂(缓冲条件的移液方案见表1)。
[0094]
实施例1.4:尺寸排阻层析(sec)条件
[0095]
柱:tskgel supersw3000
[0096]
系统:agilent 1290uhplc
[0097]
流量:0.35ml/min
[0098]
洗脱液:0.025m nah2po4*h2o/0.025m na2hpo4/0.4m naclo4*h2o/ph6.3
[0099]
样品:低ph筛选条件中的maba和mabb
[0100]
赋形剂山梨糖醇和精氨酸hcl的蛋白质稳定作用结果见图1。添加0.5m山梨糖醇观察到蛋白质稳定作用;添加0.5m精氨酸hcl观察到去稳定作用。
[0101]
实施例1.5:nanodsf条件
[0102]
nanodsf是一种修改的差示扫描荧光测定法,用于使用内在色氨酸或酪氨酸荧光来确定蛋白质稳定性。蛋白质稳定性可以通过热解折叠实验来阐释。蛋白质的热稳定性通常由“解链温度”或“tm”来描述,在该温度下,蛋白质群体中的50%解折叠,对应于从折叠到解折叠的过渡的中点。
[0103]
使用prometheus nt 48(nanotemper technologies gmbh,munich,germany)进行分析。样品体积为10μl,并且加热速率为1℃/min。而温度斜度从20℃开始并持续到95℃。
[0104]
关于赋形剂山梨糖醇和精氨酸hcl的蛋白质稳定作用的结果见图2。添加0.5m山梨糖醇观察到蛋白质稳定作用;添加0.5m精氨酸hcl观察到去稳定效应。
[0105]
如图4和图5所示,根据所选的赋形剂(山梨糖醇、甘露醇、蔗糖、海藻糖、peg4000和精氨酸hcl)的筛选结果,发现在低ph处理期间中性赋形剂例如多元醇(如甘露醇、山梨糖醇)和二糖(例如蔗糖、海藻糖)以及peg4000有效地稳定溶液中的mab。
[0106]
实施例2:用于蛋白a层析的缓冲液和赋形剂溶液的制备
[0107]
使用0.45μm hawp混合纤维素酯过滤器(merck,darmstadt,germany)过滤所有缓冲液和赋形剂,并在使用前在超声波浴中脱气20min。对于所有蛋白a层析运行,制备和使用以下缓冲液:
[0108]
表2:用于蛋白a层析的缓冲液a1,ph 5.50
[0109][0110]
表3:用于蛋白a层析的缓冲液a2,ph 7.00
[0111][0112]
表4:用于蛋白a层析的缓冲液b,ph 2.75
[0113][0114]
根据其保护抗体免于聚集的能力选择以下赋形剂:
[0115]
表5:具有应用的浓度、制造商和质量标准的应用赋形剂
[0116][0117]
实施例2.1:在柠檬酸盐缓冲液ph5.5中制备0.5m蔗糖
[0118]
将171.1g蔗糖(m=342.29g/mol)称重到合适的烧瓶中。添加约800ml0.1m柠檬酸钠缓冲液ph 5.5,并搅拌溶液直至物质完全溶解。使用1m hcl将ph值调节至5.5 /-0.05。然后,将溶液转移到1000.0ml容量瓶中,并用0.1m柠檬酸钠缓冲液ph 5.5填充至刻度并充分混合。
[0119]
实施例2.2:在柠檬酸盐缓冲液ph 2.75中制备0.5m蔗糖
[0120]
将171.1g蔗糖(m=342.29g/mol)称重到合适的烧瓶中。添加约800ml0.1m柠檬酸钠缓冲液ph 2.75,并搅拌溶液直至物质完全溶解。使用1m hcl将ph值调节至2.75 /-0.05。然后,将溶液转移到1000.0ml容量瓶中,并用0.1m柠檬酸钠缓冲液ph 2.75填充至刻度并充分混合。
[0121]
实施例2.3:在柠檬酸盐缓冲液ph 5.5中制备0.5m海藻糖
[0122]
将171.1g海藻糖(m=342.29g/mol)称重到合适的烧瓶中。添加约800ml0.1m柠檬酸钠缓冲液ph 5.5,并搅拌溶液直至物质完全溶解。使用1m hcl将ph值调节至5.5 /-0.05。然后,将溶液转移到1000.0ml容量瓶中,并用0.1m柠檬酸钠缓冲液ph 5.5填充至刻度并充分混合。
[0123]
实施例2.4:在柠檬酸盐缓冲液ph 2.75中制备0.5m海藻糖
[0124]
将171.1g海藻糖(m=342.29g/mol)称重到合适的烧瓶中。添加约800ml0.1m柠檬酸钠缓冲液ph 2.75,并搅拌溶液直至物质完全溶解。使用1m hcl将ph值调节至2.75 /-0.05。然后,将溶液转移到1000.0ml容量瓶中,并用0.1m柠檬酸钠缓冲液ph 2.75填充至刻度并充分混合。
[0125]
实施例2.5:在柠檬酸盐缓冲液ph 5.5中制备0.5m甘露醇
[0126]
将91.09g甘露醇(m=182.17g/mol)称重到合适的烧瓶中。添加约800ml0.1m柠檬酸钠缓冲液ph 5.5,并搅拌溶液直至物质完全溶解。使用1m hcl将ph值调节至5.5 /-0.05。然后,将溶液转移到1000.0ml容量瓶中,并用0.1m柠檬酸钠缓冲液ph 5.5填充至刻度并充
分混合。
[0127]
实施例2.6:在柠檬酸盐缓冲液ph 2.75中制备0.5m甘露醇
[0128]
将91.09g甘露醇(m=182.17g/mol)称重到合适的烧瓶中。添加约800ml0.1m柠檬酸钠缓冲液ph 2.75,并搅拌溶液直至物质完全溶解。使用1m hcl将ph值调节至2.75 /-0.05。然后,将溶液转移到1000.0ml容量瓶中,并用0.1m柠檬酸钠缓冲液ph 2.75填充至刻度并充分混合。
[0129]
实施例2.7:在柠檬酸盐缓冲液ph 5.5中制备0.5m甘露醇
[0130]
将91.09g甘露醇(m=182.17g/mol)称重到合适的烧瓶中。添加约800ml0.1m柠檬酸钠缓冲液ph 5.5,并搅拌溶液直至物质完全溶解。使用1m hcl将ph值调节至5.5 /-0.05。然后,将溶液转移到1000.0ml容量瓶中,并用0.1m柠檬酸钠缓冲液ph 5.5填充至刻度并充分混合。
[0131]
实施例2.8:在柠檬酸盐缓冲液ph2.75中制备0.5m甘露醇
[0132]
将91.09g甘露醇(m=182.17g/mol)称重到合适的烧瓶中。添加约800ml0.1m柠檬酸钠缓冲液ph 2.75,并搅拌溶液直至物质完全溶解。使用1m hcl将ph值调节至2.75 /-0.05。然后,将溶液转移到1000.0ml容量瓶中,并用0.1m柠檬酸钠缓冲液ph 2.75填充至刻度并充分混合。
[0133]
实施例2.9:在柠檬酸盐缓冲液ph 5.5中制备5%(w/v)peg4000
[0134]
将50g peg4000(m=3500-4500g/mol)称重到合适的烧瓶中。添加约800ml 0.1m柠檬酸钠缓冲液ph 5.5,并搅拌溶液直至物质完全溶解。使用1mhcl将ph值调节至5.5 /-0.05。然后,将溶液转移到1000.0ml容量瓶中,并用0.1m柠檬酸钠缓冲液ph 5.5填充至刻度并充分混合。
[0135]
实施例2.10:在柠檬酸盐缓冲液ph 2.75中制备5%(w/v)peg4000
[0136]
将50g peg4000(m=3500-4500g/mol)称重到合适的烧瓶中。添加约800ml 0.1m柠檬酸钠缓冲液ph 2.75,并搅拌溶液直至物质完全溶解。使用1m hcl将ph值调节至2.75 /-0.05。然后,将溶液转移到1000.0ml容量瓶中,并用0.1m柠檬酸钠缓冲液ph 2.75填充至刻度并充分混合。
[0137]
实施例3:蛋白a层析法
[0138]
实施例3.1:蛋白a层析树脂
[0139]
基材是一种基于聚乙烯醚的刚性亲水聚合物。固定在其上的是五聚体形式的金黄色葡萄球菌蛋白a的c结构域,它是在大肠杆菌中重组产生的。a来自merck(darmstadt,germany),并且柱由repligen gmbh(ravensburg,germany)填充。
[0140]
表6:应用的a树脂的柱参数
[0141]
柱长度2cm柱内径0.8cm柱体积1ml平均粒径~50μm基材亲水性聚乙烯醚官能团在大肠杆菌中产生的重组蛋白a,源自天然蛋白a的c结构域
lot#k93457960序列#00168
[0142]
ultra plus树脂具有可控孔玻璃基质和与其结合的重组天然蛋白a作为配体。ultra plus来自merck(darmstadt,germany),并且柱由repligen gmbh(ravensburg,germany)填充。
[0143]
表7:应用的ultra plus树脂的柱参数
[0144]
柱长度2cm柱内径0.8cm柱体积1ml平均粒径60μm基材可控孔玻璃官能团重组天然蛋白alot#a4sa045aq序列#00227
[0145]
mabselect
tm sure
tm
树脂具有琼脂糖基质。通过硫醚固定在其上的是具有c末端半胱氨酸的工程化蛋白a结构域的重组产生的(在大肠杆菌中重组产生的)四聚体。该树脂由ge healthcare(uppsala,sweden)生产,并且柱由repligen gmbh(ravensburg,germany)填充。
[0146]
表8:应用的mabselect
tm sure
tm
树脂的柱参数
[0147]
柱长度2cm柱内径0.8cm柱体积1ml平均粒径85μm基材刚性、高度交联的琼脂糖官能团碱稳定的蛋白a衍生结构域序列#00620
[0148]
实施例3.2:蛋白质样品制备
[0149]
第一个模型蛋白是单克隆抗体maba(约152kda),pi~7.01-8.58。它用作澄清的细胞培养收获物,使用具有0.8/0.2μm膜(pall corporation,ny,usa)的90pf过滤单元进行过滤。该溶液的浓度为0.943mg/ml,ph值为7.0并且电导率为12ms/cm。
[0150]
第二种模型蛋白是由merck(darmstadt,germany)生产的单克隆抗体mabb(约145kda),pi~7.6-8.3。它用作澄清的细胞培养收获物,使用具有0.8/0.2μm膜(pall corporation,ny,usa)的90pf过滤单元进行滤。该溶液的浓度为1.45mg/ml,ph值为7.0并且电导率为12.87ms/cm。
[0151]
实施例3.3:蛋白a层析法
[0152]
使用以下方法参数进行蛋白a层析:
[0153]
表9:蛋白层析的方法参数
[0154][0155][0156]
通过应用从ph 5.5到ph 2.75的30cv线性梯度,以规定的梯度斜率进行洗脱。
[0157]
实施例4:尺寸排阻层析
[0158]
洗脱后,通过在室温下将溶液在低ph保持1h,对来自蛋白a层析的含有mab的洗脱产物汇集物进行病毒灭活,然后中和至4.0-8.0范围内的所需ph。通过用1m hcl滴定将洗脱产物汇集物的ph值调节至ph 2.8
±
0.05,开始模拟病毒灭活过程步骤的低ph处理。随后通过高效尺寸排阻层析(hp-sec)分析低ph温育对添加或不添加稳定赋形剂的不同模型蛋白的影响。
[0159]
hp-sec分析的条件:
[0160][0161]
图5和图6显示了hp-sec分析的结果。含有所选的中性赋形剂(山梨糖醇、甘露醇、蔗糖、海藻糖和peg4000)的样品中单体mab的高含量表明,这些赋形剂在蛋白a层析和随后的低ph病毒灭活步骤期间中对蛋白质稳定性具有总体积极影响。
[0162]
实施例5:制备用于病毒灭活实验的缓冲液和赋形剂溶液
[0163]
实施例5.1:制备1m柠檬酸溶液
[0164]
将21.01g柠檬酸一水合物(m=210.14g/mol)称重到合适的烧瓶中。添加100ml milli-q-水,并搅拌溶液直至物质完全溶解。使用0.2μm过滤器过滤该溶液。
[0165]
实施例5.2:制备0.1m柠檬酸盐缓冲液,ph3.5
[0166]
溶液a:0.1m柠檬酸一水合物(c6h8o7·
h2o fw=210.14)
[0167]
将21.01g柠檬酸一水合物(m=210.14g/mol)称重到合适的烧瓶中。添加1000ml milli-q-水,并搅拌溶液直至物质完全溶解。
[0168]
溶液b:0.1m柠檬酸三钠二水合物(c6h5o7na3·
2h2o fw=294.12)
[0169]
将29.41g柠檬酸三钠二水合物(m=294.12g/mol)称重到合适的烧瓶中。添加1000ml milli-q-水,并搅拌溶液直至物质完全溶解。
[0170]
将大约700ml的溶液a和大约300ml的溶液b混合以获得大约1000ml的0.1m柠檬酸盐缓冲液ph 3.5。如有必要,使用1m柠檬酸溶液或1m naoh将溶液的ph调节至3.5
±
0.05。
[0171]
实施例5.3:在0.1m柠檬酸盐缓冲液ph 3.5中制备0.5m山梨糖醇
[0172]
将9.1g山梨糖醇(m=182.17g/mol)称重到合适的烧瓶中。添加约80ml0.1m柠檬酸盐缓冲液ph 3.5,并搅拌溶液直至物质完全溶解。使用1m柠檬酸溶液或1m naoh将ph调节至3.5
±
0.05。然后,将溶液转移到100.0ml容量瓶中,并用0.1m柠檬酸盐缓冲液ph 3.5填充至刻度并充分混合。使用0.2μm过滤器过滤该溶液。
[0173]
实施例5.4:在0.1m柠檬酸盐缓冲液ph 3.5中制备0.5m甘露醇
[0174]
将9.1g甘露醇(m=182.17g/mol)称重到合适的烧瓶中。添加约80ml0.1m柠檬酸盐缓冲液ph 3.5,并搅拌溶液直至物质完全溶解。使用1m柠檬酸溶液或1m naoh将ph调节至3.5
±
0.05。然后,将溶液转移到100.0ml容量瓶中,并用0.1m柠檬酸盐缓冲液ph 3.5填充至刻度并充分混合。使用0.2μm过滤器过滤该溶液。
[0175]
实施例5.5:在0.1m柠檬酸盐缓冲液ph 3.5中制备0.5m蔗糖
[0176]
将17.1g蔗糖(m=342.29g/mol)称重到合适的烧瓶中。添加约80ml 0.1m柠檬酸盐缓冲液ph 3.5,并搅拌溶液直至物质完全溶解。使用1m柠檬酸溶液或1m naoh将ph调节至3.5
±
0.05。然后,将溶液转移到100.0ml容量瓶中,并用0.1m柠檬酸盐缓冲液ph 3.5填充至刻度并充分混合。使用0.2μm过滤器过滤该溶液。
[0177]
实施例5.6:在0.1m柠檬酸盐缓冲液ph 3.5中制备0.5m海藻糖
[0178]
将17.1g海藻糖(m=342.29g/mol)称重到合适的烧瓶中。添加约80ml0.1m柠檬酸盐缓冲液ph 3.5,并搅拌溶液直至物质完全溶解。使用1m柠檬酸溶液或1m naoh将ph调节至3.5
±
0.05。然后,将溶液转移到100.0ml容量瓶中,并用0.1m柠檬酸盐缓冲液ph 3.5填充至刻度并充分混合。使用0.2μm过滤器过滤该溶液。
[0179]
实施例5.7:在0.1m柠檬酸盐缓冲液ph 3.5中制备0.5m peg4000
[0180]
将5g peg4000(m=3500-4500g/mol)称重到合适的烧瓶中。添加约80ml 0.1m柠檬酸盐缓冲液ph 3.5,并搅拌溶液直至物质完全溶解。使用1m柠檬酸溶液或1m naoh将ph调节至3.5
±
0.05。然后,将溶液转移到100.0ml容量瓶中,并用0.1m柠檬酸盐缓冲液ph 3.5填充至刻度并充分混合。使用0.2μm过滤器过滤该溶液。
[0181]
实施例6:在低ph灭活保持期间赋形剂对病毒减少的有效性
[0182]
异嗜性鼠白血病病毒(mlv)被用作病毒减少实验的模型病毒。mlv代表无缺陷的γ逆转录病毒。对于源自cho细胞系的生物制品和单克隆抗体产物,必须包含mlv。
[0183]
表10:应用的模型病毒
[0184]
病毒mlv
毒株pnfs th-1基因组ssrna包膜有科逆转录病毒科尺寸(nm)80-110对物理/化学试剂的抗性低
[0185]
应用的模型蛋白是如实施例1.2中所述的mabb。
[0186]
表11:应用的模型蛋白
[0187][0188][0189]
所有测定均使用tcid
50
感染性方法进行。
[0190]
起始材料准备
[0191]
在掺加(spiking)之前,材料在37℃
±
1℃的水浴中解冻,轻轻倒置,并且一旦冰完全融化,就从水浴中取出容器。
[0192]
对于低ph加载样品,以130mg/ml接收样品并使用单独的缓冲液(根据实施例5.2的0.1m柠檬酸盐缓冲液ph 3.5)或柠檬酸盐缓冲液中的赋形剂(根据实施例4.3至4.7)稀释至10mg/ml的最终浓度。
[0193]
为了调整到所需的蛋白质浓度,需要以1比13的稀释度进行制备,例如将1份的低ph加载量添加到12份的缓冲液或柠檬酸盐缓冲液中的赋形剂中。
[0194]
在整个操作过程中混合样品并保持低ph。一旦样品温度达到20℃
±
0.5℃,使用1m柠檬酸和/或1m tris将ph调节至ph 3.6。
[0195]
对于掺加,掺加50ml经ph调节的样品。剩余部分用1m tris调节至ph6.0至ph 8.0,并分配5ml样品用于掺加。该样品是时间零中和对照,并掺加了5%(v/v)mlv。
[0196]
将病毒掺加物(5%v/v)添加到中和的对照样品中。然后将样品等分以产生中和加载物样品和加载物保持样品。确认中和加载物样品的ph,并在滴定前将样品置于冰上。加载物保持样品保持在与本体样品相同的温度。
[0197]
将大约5%(v/v)的病毒掺加物添加到经过ph调节的50ml样品中。掺加后5分钟(t=5分钟),取出样品并立即用1m tris进行中和。
[0198]
在20℃
±
0.5℃下,在ph 3.6至3.64(目标ph 3.6)下进行低ph处理。在整个温育期间监测ph,并在需要时将其调整到目标ph(ph 3.6)。
[0199]
在t=15分钟和t=30分钟时取出样品。立即用1m tris将样品的ph调节至ph 6.0至ph 8.0。在ph 3.6下60分钟后,用1m tris将剩余物调节至ph6.0至ph 8.0。
[0200]
过程步骤
[0201]
图表记录器用于监测每个实验整个期间的温度。记录间隔为每1分钟。所有过程步骤如图7所示并在下文描述,图7中引用的所有体积均为近似体积。
[0202]
在添加病毒掺加物后,在任何额外的操作和收集任何样品之前彻底混合材料。
[0203]
收集后,将所有样品彻底混合,并在需要时使用1m tris立即将其中和至ph 6.00至8.00的范围内。将所需体积置于冰上进行测定,并在滴定前立即使用0.45μm过滤器进行过滤。接种0.45μm过滤和未过滤的阳性对照。
[0204]
图8和图9显示了与不含赋形剂的样品相比,在存在所选的中性赋形剂(山梨糖醇、甘露醇、蔗糖、海藻糖和peg4000)的情况下,低ph灭活保持期间病毒减少实验的结果。
[0205]
根据病毒减少因数和稳健性评估,单元操作可分为有效、无效或中等有效(fda q5a,1998)。“有效”步骤提供了至少4log10的减少因数,并且不受过程变量中的小扰动的影响。“无效”步骤提供1log10或更少的减少因数,并且“中等有效”步骤介于这两个极端值之间(emd millipore,2013年)。
[0206]
在具有和不具有所选的赋形剂的所有情况下,使用所选的赋形剂仍能实现有效的病毒减少步骤(减少因数》4log10)。这清楚地表明所选择的赋形剂不会对病毒灭活过程步骤产生负面影响。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。