用于细胞培养的微载体
发明领域
1.本发明总体上涉及用于细胞培养的微载体、一种产生此类微载体的方法以及所述微载体的用途。发明背景
2.尺寸为几十微米级的微载体(mc)已被用作三维细胞培养生长表面,以在生物反应器中的受控环境内以更好的营养可用性、增强的表面积、以及自动化和高通量收获的优势实现细胞扩增。
3.由有机和无机材料制成且呈现不同表面化学的mc是可商购的,但该领域的研究已集中在较新mc上,所述较新mc可被改造为提供化学、机械诱因以影响细胞增殖、维持干细胞的干性、促进干细胞分化成所需细胞类型,并使得能够易于释放细胞。发明概述
4.除了上述目标之外,使用mc进行细胞扩增的另外的显著进步是整合可潜在有助于监测细胞培养期间的细胞健康的感测功能,和/或报告感兴趣的生物标记物。
5.根据本发明的第一方面,提出了一种细胞培养微载体珠。微载体珠包含具有以等离激元纳米颗粒为斑点(点,涂覆)的表面的珠体。
6.如本文所用,术语“纳米颗粒”表示具有周围界面层并且具有在亚微米范围内的特征尺寸(例如具有在1至500nm范围内的直径)的颗粒优选地,所述等离激元金属纳米颗粒具有在2至200nm范围内的直径。在本文件中,并且除非与上下文矛盾,否则术语“直径”意指可以在与所考虑的物体的凸包相切的两个相对平行平面之间形成的最小距离。直径的测量可以例如通过扫描电子显微术(sem)、透射电子显微术或扫描探针显微术(spm)进行。
7.优选地,等离激元纳米颗粒包括金属纳米颗粒或由其组成。此类等离激元金属纳米颗粒可包括以下或由以下组成:例如金、银或铝纳米颗粒,但不排除其他等离激元金属或合金。可以使等离激元纳米颗粒官能化,例如使得它们将特异性结合至细胞上的受体。
8.珠体可包含溶胀(水合)或未溶胀(脱水)状态的水凝胶基质。这种水凝胶基质可包含以下或由以下组成:例如多糖(例如,琼脂糖、葡聚糖等)、弹性蛋白样多肽(elp)等。珠体可由这种水凝胶基质组成,或者可替代地,具有由水凝胶基质包围的(固体)芯。
9.珠体优选地携带在其体积内分布的带正电荷的基团。在这种情况下,可以通过静电组装实现等离激元纳米颗粒至珠体的附着。
10.优选地,微载体珠仅在珠体表面上(即不在珠体内部,在珠体内部至少不深)携带等离激元纳米颗粒。在这种情境下,“深”意指从表面0.3
·
r或更多,其中r表示珠体半径。
11.等离激元纳米颗粒可用封端剂稳定,所述封端剂例如柠檬酸盐。
12.等离激元纳米颗粒可以是任何形状的,例如,球形、星形、棒形、立方体形等。在球形纳米颗粒的情况下,它们的直径优选小于或等于100nm。其他形状的纳米颗粒,例如纳米星、纳米棒等的大小会更大。如果纳米颗粒是纳米棒,则横截面直径应优选地在2至200nm的范围内,而纳米棒的长度可能更大。
13.微载体珠的主体优选具有在50μm至1mm范围内的直径。所述珠体的直径与所述等
离激元金属纳米颗粒的直径的比率优选在250至50000的范围内,更优选在250至25000的范围内。在具有水凝胶基质的珠体的情况下,所指示的直径范围可以指脱水状态的直径或水合状态(例如,当在细胞培养基中使用时)的直径或任何中间状态的直径。
14.在第二方面,本发明涉及一种细胞培养反应器,所述细胞培养反应器含有细胞培养基和如本文所述的微载体珠。
15.本发明的另一方面涉及一种观察(体外)在如本文所述的微载体珠上的活细胞的方法。所述方法包括:ο用探测光照射所述微载体珠,以激发等离激元金属纳米颗粒中的表面等离激元,ο以及检测响应于所述照射从所述等离激元金属纳米颗粒发射的光。
16.所述检测优选基于以下技术中的一种或多种:(局域)表面等离激元共振(spr)、表面增强拉曼光谱术(sers)、荧光和二次谐波产生。根据spr技术,测量吸收波长的变化或所检测到的光的任何其他特性的变化,以指示由细胞反应诱导的局部折射率变化,所述细胞反应例如细胞与另一生物实体(例如抗原)的相互作用、细胞分裂等。
17.本发明的又另外的方面涉及一种在载体主体上填装纳米颗粒的方法。该方法对于在细胞培养微载体上填装等离激元纳米颗粒可能特别有用,但也可以用于其他目的。所述方法包括:ο在载体主体处于溶胀状态时将纳米颗粒附着在所述载体主体的表面上,ο减小所述载体主体的体积,从而使所述纳米颗粒一起移动靠近。
18.附着过程本身可以使用载体主体与纳米颗粒之间的静电吸引来实现。应理解,这种静电组装可被视为一种具有理论最大覆盖度的随机顺序吸附(rsa)过程。实验中获得的覆盖度通常显著低于理论最大覆盖度,特别是由于有限的时间。因此,应理解,本发明的方法允许通过在载体主体溶胀时将纳米颗粒附着然后使载体主体收缩来增加纳米颗粒的密度。在收缩状态下纳米颗粒之间的较小平均距离在实际应用例如等离激元感测中可以是有益的。可替代地,所述方法可用于缩短给定目标密度的纳米颗粒的附着过程。
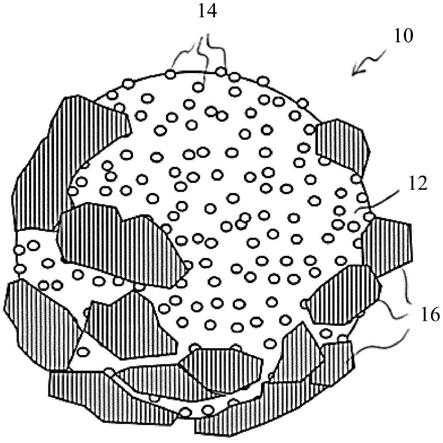
19.如上所指示,纳米颗粒可以是等离激元纳米颗粒,例如等离激元金属纳米颗粒。另外,所述载体主体可包含用于细胞培养的微载体珠。
20.优选地,所述载体主体包含水凝胶基质,并且所述体积减小是通过所述水凝胶的(至少部分)脱水实现的。
21.应理解,可利用微载体珠上的等离激元纳米颗粒的存在来例如收获细胞。例如,可以通过激发等离激元纳米颗粒中的局域表面等离激元共振来刺激细胞从所述微载体珠释放。具体地,可以通过纳米颗粒的等离激元加热来刺激细胞的释放。
附图说明
22.附图展示了本发明的若干方面,并且连同详细描述一起用于解释本发明的原理。在这些附图中:图1:是细胞培养微载体的示意图,所述细胞培养微载体具有涂覆有等离激元纳米颗粒的表面;图2:是将等离激元纳米颗粒附着在用于细胞培养的微载体上的方法的图解。图3:是在本发明的实施中使用的等离激元纳米颗粒(左侧)和微载体(右侧)的大
小分布图;图4:示出用不同浓度的金纳米颗粒覆盖然后干燥的水凝胶微载体的sem图像;图5:示出aunp涂覆的微载体的用切片机切出的切片的sem图像,所述图像聚焦在融合微载体之间的界面上,放大率从(i)到(iv)渐增;图6:示出在干燥状态下的裸mc(a)、在水中的裸mc(c)、在水中的aunp涂覆的mc的光学显微术图像,以及相应的观察到的大小分布(d);图7:示出具有渐增覆盖度的au纳米颗粒涂覆的微载体的悬浮液的照片(a)),相应的吸收光谱图(b)),以及强度峰值和位置图(c));图8:是裸微载体上和等离激元纳米颗粒涂覆的微载体上的细胞培养物中葡萄糖和乳酸浓度的演变图。优选实施方案的描述
23.图1示意性地展示了细胞培养微载体珠10。微载体珠10包括具有以等离激元纳米颗粒14为斑点的表面的珠体12(例如,常规的可商购的mc)。还展示了使用微载体珠10作为生长表面的细胞16。
24.关于将感测功能(例如细胞健康监测和/或生物标记物报告)整合在微载体珠中,关键要求是mc的改性对细胞粘附和增殖没有不受控制的不利影响,并且一种或多种感测功能与其中待使用mc的环境相容。因此,当要使用具有附着的等离激元纳米颗粒的微载体珠时,应进行对比测试,以便评估等离激元纳米颗粒的存在是否(以及如果必要的话,以何种程度)改变所培养细胞的行为。
25.在下文讨论的示例中,示出了将金纳米颗粒的高密度组装体整合在基于葡聚糖的mc(可商购的cytodex-1
tm
微载体,其基于被带正电荷的n,n-二乙基氨基乙基(deae)基团取代的交联葡聚糖基质)的表面上保留了与未涂覆(未改性)mc情况下同等水平的细胞扩增和细胞迁移能力。进一步证明了以金纳米颗粒为斑点的mc适合用于等离激元感测。结果显示,鉴于金颗粒的生物相容性,使用其独特的光学、光谱特性易于感测,同时在复杂环境中保持稳定,金纳米颗粒是用以整合到微载体上的绝佳选择。
26.如图2中所展示,金纳米颗粒114附着在mc 112上可以利用正电荷在mc的聚合物基质内的存在通过静电自组装来实现。图2更具体地展示了在带正电荷的水凝胶mc 112上的柠檬酸盐稳定的金纳米颗粒114(参见增强细节)的静电自组装。静电自组装过程本身是已知的,但据诸位发明人所知,先前未曾在mc上尝试过。带电荷的胶体与带相反电荷的表面的不可逆单层附着可以被视为一种随机顺序吸附(rsa)过程,所述过程导致理论最大表面覆盖度54.7%(挤紧极限(jamming limit)),但实际上达到的表面覆盖度通常显著更低。
27.以等离激元纳米颗粒为斑点的mc可用于例如利用与纳米结构表面紧密接近的增强的电磁场基于表面增强拉曼光谱术(sers)感测。增强的幅值取决于特征和其组件的几何属性,并且是非线性的,伴随邻近纳米颗粒之间的渐减的分离。纳米颗粒之间的连接处的高电磁场称为“间隙热点”。此类热点的发生的可能性随纳米颗粒密度而增加。因此,在条件(例如温度、ph等)下,将等离激元纳米颗粒组装在基于水凝胶的微载体上可能是特别有利的,其中后者是高度溶胀的。通过使mc收缩(通过改变环境条件),减少了附着至表面的纳米颗粒之间的平均距离,这有利于上述热点的发生。实例
28.将deae-葡聚糖mc(cytodex-1
tm
,购自西格玛-奥德里奇)通过静电相互作用用柠檬酸盐稳定的金纳米颗粒官能化,如图2中所呈现。milliq水(18.2mωcm,密理博(millipore))用于制备溶液并用于所有冲洗。根据特克维奇(turkevich)方法通过用柠檬酸钠(na3c6h5o7,西格玛-奥德里奇)还原氯金酸(haucl4,西格玛-奥德里奇)制备柠檬酸盐稳定的金纳米颗粒(aunp)。所获得的aunp基本上呈球形,平均大小为12nm。
29.将制备的胶体悬浮液在4℃下储存,并在使用前12小时从冰箱中取出。艾本德安全锁式管(eppendorf safe-lock tube)2ml、锥形底离心管50ml、硅晶片(siegert wefer)和玻璃晶片(menzel
tm
显微镜盖玻片)分别用作容器并支持表征。
30.通过聚焦离子束扫描电子显微术(fib-sem)测量aunp的大小。使用helios nanolab
tm
650显微镜以20kv的加速电压和4mm的距离进行操作,获得aunp的fib-sem图像。使用二次电子检测器。将aunp吸附在用3-氨基丙基三甲氧基硅烷官能化的带正电荷的硅表面上,然后测量aunp的大小。
31.通过光学显微术测量mc的大小。使用奥林巴斯(olympus)显微镜bx51获得mc的图像。使用两个物镜(奥林巴斯;x10、x50)用于聚焦。使用奥林巴斯流图像分析(olympus stream image analysis)软件获取图像。
32.图3示出了通过fib-sem测量的aunp(左)和在水中的以aunp为斑点的mc(右)的大小分布。
33.使用动态光散射(dls)来确定金纳米颗粒的流体动力学大小和ζ电位。使用的机器是malvern zetasizer nano zs。一次性折叠毛细管ζ池(malvern)用于测量这两个参数。aunp溶液的ph等于5.8。如下制备样品:在两个不同的一次性池内注射100%和33%的金纳米颗粒稀释溶液(用于比较)。通过dls测定金纳米颗粒的ζ电位,得到在ph 6下为-34
±
10mv。由于封端剂(柠檬酸盐)在该ph值下带负电荷,ζ电位是负的。微载体太大,所以它们不能通过dls来表征。然而,已知的是,deae-葡聚糖由于其deae基团而在几乎所有ph下均带正电荷。因此,预期金纳米颗粒覆盖微载体的表面。cytodex-1是遍及整个基质中具有正性基团的交联水凝胶。因此,问题出现了:金纳米颗粒是否渗透在微载体内部并使内部表面(孔)官能化。然而,如下所详述,外部和内部结构的表征揭示了金纳米颗粒仅分布于外表面上。deae-葡聚糖微载体在添加到任何培养基中时溶胀。因此,可用于与金纳米颗粒相互作用的表面积根据所使用的培养基而改变。
34.通过sem研究了每个微载体上金纳米颗粒的分布和数量。图4示出用不同浓度的金纳米颗粒覆盖然后干燥的mc的sem图像。在干燥过程期间,mc的收缩导致褶皱的表面和aunp的更密集填装。aunp覆盖度从左到右增加(以两个放大率显示)。从低到高浓度的转变可容易观察到。在饱和覆盖度下,发现微载体被纳米颗粒完全覆盖,而在较低的颗粒覆盖度下,纳米颗粒显示均匀但斑驳的覆盖。
35.为了研究金纳米颗粒是否渗透到mc的孔中的问题,使以aunp为斑点的mc从悬浮液中沉淀,然后在80℃下在烘箱中干燥,通过超薄切片术切出切片,并通过sem和nano-sims(纳米级二次离子质谱)表征。发现烘箱干燥过程将微载体界面融合,如可在图4中所观察到的。不能实现微载体的完全分离,即使获得了比在烘箱中干燥时更好的结果也如此。可以在sem中看到纳米颗粒限于微载体之间的界面,没有证据表明在mc内的内部分布(参见图5)。在切片机切片上
197
au的元素分布的nano-sims测量证实了这一发现。因此,np覆盖的mc可以
由简单的几何模型表示,其中aunp均匀分布在溶胀mc的外部。
36.图6示出了在干燥状态下的裸mc(a)、在水中的裸mc(c)和aunp涂覆的mc的大小分布(d)。在水中从干燥至完全水合状态的溶胀(直径 260%)高于将干mc置入aunp悬浮液中时实现的溶胀(直径 115%)。在aunp悬浮液中的较低溶胀可以是由高离子强度引起的静电排斥筛选的结果。
37.将rsa作为mc表面上aunp的静电组装过程的模型,可以将达到挤紧极限所需的np的浓度(每个mc上的np)计算为:其中s
mc
=4πr2是mc的表面积,其中r是mc半径,并且s
np
=πr2是金纳米颗粒的占位面积,其中r是np半径。其中r=6nm并且r=86μm,[np]
理想
=4.5
·
108。
[0038]
为了用金纳米颗粒涂覆mc,系统地增加悬浮液中的纳米颗粒浓度([np]
ution
),这与对应于单层覆盖度的纳米颗粒浓度([np]
理想
,公式1)有关。溶液中纳米颗粒的浓度([nps]
ution
)定义为在溶液中在每个微载体上可用的纳米颗粒的数量,并通过将纳米颗粒的总数除以相同体积中存在的微载体总数来计算。悬浮液中纳米颗粒的总数可以根据在溶液中金的质量与一个金纳米颗粒的质量的比率来估算。根据合成期间使用的金盐(所有这些假定均还原为金)的摩尔浓度获知在溶液中金的质量。通过将np近似于球体来获得每个金颗粒的质量,其中直径对应于大小分布的峰值(见图3),并假定金np的密度与大块金的密度相同。每单位体积的mc数量得自制造商关于每克干重的mc数量的规格(cytodex
tm-1为6.8
·
106g-1
)以及所用干粉末的质量。
[0039]
涂覆有aunp的cytodex
tm-1mc容易与无任何涂覆的cytodex-1区分,因为裸mc在水中是透明的,涂覆的mc显现为紫色(强度取决于纳米颗粒覆盖度)(图7a))。随着纳米颗粒覆盖度变化,涂覆有au纳米颗粒的微载体的吸收光谱在金颗粒的局域表面等离激元共振带的强度峰值方面系统地增加(图7b)和c))。强度峰值的增加还与波长峰值的红移相关(图7b)和c))。在金颗粒的饱和覆盖度下,均改变了平台(图7c))。峰值位置的红移符合相邻颗粒之间等离激元耦合的预期,等离激元耦合的机会随颗粒覆盖度增加。当纳米颗粒浓度达到[np]
理想
的三倍或更多倍时,实现饱和覆盖度。使用tecan infinite m1000 pro板读取器获得微载体的uv可见光光谱,并在250至1000nm范围内记录。greiner cellstar
tm 96孔板用作板读取器。如下制备样品:将200μl每种mc悬浮液(c0-c9)添加至微板孔中。下表指示用于采用aunp使微载体官能化的试剂,即cytodex-1的质量、aunp悬浮液(如上所指示产生)的体积和添加以达到每次2ml总体积的水的体积。样品名称mc的质量[mg]aunp溶液的体积[ml]水的体积[ml]c0100.0002.000c1100.0601.940c2100.1201.880c3100.2401.760c4100.4801.520c5100.9601.040c6101.9200.080
c751.9200.080c82.51.92080c911.536464
[0040]
将不同质量的商业mc粉末直接在九个不同的艾本德管中称重。然后添加对应体积的aunp悬浮液和水。将mc孵育3小时。孵育后,mc已沉淀,并去除上清液。然后通过以下方式将mc洗涤三次:ο在艾本德管中添加水并上下吸移,以洗涤溶液中的所有mc;ο在2分钟期间以1300g离心;以及ο去除上清液。
[0041]
然后将aunp涂覆的mc以其光谱表征。
[0042]
通过拉曼光谱术评价非弹性散射特性。使用配备有在785nm工作的高功率近红外激光二级管和在633nm工作的可见激光二级管的renishaw invia
tm
拉曼显微镜在100至4000cm-1
延伸范围内记录拉曼散射光谱。在获取光谱之前,使用光学显微镜(奥林巴斯;物镜,x50l)聚焦激光束。激光输出功率为0.9mw(10%)。对于每个光谱,记录5秒的6次累积。为了确保表面的代表性表征,对同一微载体的不同部分和不同微载体均进行多次测量。使用wire
tm
和originlab
tm
软件分析结果。将获取的光谱平滑化并归一化。如下制备样品:将一些mc置于碳拉片上。
[0043]
用aunp涂覆的mc(cytodex
tm-1)和其未涂覆的形式进行细胞培养测试。如图8所示,通过每天测量葡萄糖和乳酸浓度的时间演变来监测细胞动力学生长。葡萄糖是细胞的主要能量来源,而乳酸是葡萄糖代谢的代谢副产物之一。因此,葡萄糖和乳酸浓度是细胞生长和代谢活性的重要指标。约50%-100%的葡萄糖通常转化为细胞培养发酵中的乳酸。aunp涂覆的cytodex
tm-1 mc上的细胞以与未涂覆的cytodex
tm-1 mc上的细胞相同的方式消耗葡萄糖。当葡萄糖受限时,葡萄糖的消耗速度减慢,因此乳酸的产生速率下降。注意到商业cytodex
tm-1与aunp涂覆的cytodex
tm-1 mc之间没有显著差异。
[0044]
在细胞培养之前,cytodex
tm-1 mc应在pbs(磷酸盐缓冲盐水)中溶胀,并在120℃下高压灭菌以对所述mc进行灭菌。然而,在附着金纳米颗粒之前,不对cytodex-1mc进行高压灭菌。由于aunp附着后潜在地影响金纳米颗粒与微载体的相互作用后,在高压灭菌和未高压灭菌的aunp涂覆的cytodex
tm-1上进行细胞培养。
[0045]
通过荧光显微术实现细胞活力的定量。将细胞(人间充质干细胞)与用以分别对活细胞(绿色)和死细胞(红色)染色的钙黄绿素am和乙锭均二聚物-1(ethd-1)分子混合。发现在未高压灭菌的情况下细胞在更大程度上定殖于aunp涂覆的cytodex
tm-1上。因此,高压灭菌对微载体具有抑制细胞粘附的影响。然而,aunp与cytodex
tm-1mc之间的相互作用似乎没有受到影响:微载体在高压灭菌后仍然是不透明的,确认存在aunp。不希望受理论束缚,诸位发明人表明,较低细胞粘附的一个原因可能是金纳米颗粒与柠檬酸盐(金纳米颗粒的稳定剂)之间的静电相互作用由于高温被破坏。去除带负电荷的柠檬酸盐分子会改变微载体表面上的总电荷,由此影响与细胞的相互作用。
[0046]
另外测试了在商业微载体上培养的细胞是否会迁移到以等离激元纳米颗粒为斑点的微载体上。迁移测定包括将(未高压灭菌的)aunp涂覆的cytodex
tm-1添加至在裸的但其他方面相同的cytodex
tm-1微载体上的细胞培养物中。
[0047]
将2ml cytodex
tm-1悬浮液(20g/l)和25ml细胞培养基添加至125ml锥形瓶中。在37℃和5%co2下在1小时期间将mc保持在该容器中。通过胰蛋白酶消化将细胞从其容器烧瓶脱附并收获。将它们添加至已经含有微载体的锥形瓶中(0.8
·
105个细胞/ml)。将细胞和mc在细胞培养基中孵育,以允许细胞粘附在mc上。1小时后,将在微载体上锚定的细胞置于70rpm(37℃;5%co2)的搅拌下。每天取出细胞培养基的样品,以测量葡萄糖和谷氨酰胺消耗,以及乳酸、铵和乳酸脱氢酶产生。通过荧光显微术评估细胞活力。为此,将细胞与用以分别对细胞、活细胞和死细胞染色的dapi、钙黄绿素am和乙锭均二聚物-1(ethd-1)分子混合。
[0048]
在第4天,50%的细胞培养基发生变化。将涂覆有金纳米颗粒的微载体在第4天添加至cytodex
tm-1培养烧瓶中。孵育1小时后,重新启动搅拌(70rpm)。每天用荧光显微术进行细胞的定量。将细胞与dapi混合以对细胞染色。细胞能够朝向新的载体移动,确认了改性微载体支持细胞扩增功能的能力。
[0049]
总而言之,等离激元纳米颗粒涂覆的微载体的光学特性与金纳米颗粒覆盖度相关,并表明在饱和覆盖度下的强等离激元耦合。等离激元-np涂覆的mc揭示了使用sers或其他等离激元感测技术检测较小的有机分子的可能性。等离激元-np涂覆的mc与其未涂覆的对应物的比较显示出相似的细胞生长动力学和人间充质干细胞的迁移,给出了保留细胞扩增功能的首个证据。此处报告的等离激元微载体,为微载体与生物介质之间的界面处的变化的等离激元感测,以及为监测在不同细胞扩增阶段的生物细胞的变化,以及为潜在地通过等离激元加热效应实现细胞的等离激元释放铺好了前进的道路。
[0050]
虽然本文已经详细描述了具体的实施例,但是本领域技术人员应理解,鉴于本披露的总体传授,可以对这些细节作出各种修改和替代方案。因此,所披露的特定安排意为仅仅是说明性的,而不是限制本发明的范围,该范围将由全方面的所附权利要求及其任何和所有等效物给出。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
