1.本发明涉及放射性金属标记抗体的制造方法。
背景技术:
2.利用抗体所具有的对靶标分子的特异性,而将抗体用作用于检测靶标分子的试剂、诊断药、或用于治疗疾病的医药品。为了进一步提高检测性能及治疗效果,已在进行与结合有放射性核素、药剂的抗体有关的研究。
3.专利文献1中记载了包含由13~17个氨基酸残基形成的氨基酸序列、且能够与人抗体结合的肽。该文献中还记载有上述肽能够利用含有放射性同位素的络合物等标记物质、抗癌剂等药剂进行修饰,以及能够形成该肽与抗体的复合体。
4.专利文献2中记载了经
111
in(其作为放射性金属)的dtpa络合物修饰的肽与抗体的复合体。还记载了该抗体复合体与肿瘤中发现的靶标分子特异性地结合。
5.现有技术文献
6.专利文献
7.专利文献1:国际公开第2016/186206号小册子
8.专利文献2:国际公开第2017/217347号小册子
9.专利文献3:国际公开第2019/125982号小册子
技术实现要素:
10.但是,在制造结合有放射性金属络合物的抗体时,根据所使用的配体及放射性金属的组合,为了提高络合物的形成效率,需要对反应体系进行加热。但是,在该条件下,抗体会被加热改性,因而无法得到目标抗体。专利文献1及2中未对解决这样的问题的反应条件进行任何研究。
11.因此,本发明的课题在于提供即使在温和的反应条件下,放射性金属对抗体的标记效率也优异的放射性金属标记抗体的制造方法。
12.本发明提供放射性金属标记抗体的制造方法,其包括使放射性金属络合物与利用肽位点特异性地修饰而得的抗体进行点击反应,生成放射性金属标记抗体的工序,
13.点击反应在放射性金属络合物所具备的第一原子团与和肽直接地或间接地连接的第二原子团之间执行,
14.第二原子团为包含叠氮基的原子团、或者包含反式环辛烯的原子团。
15.另外,本发明提供放射性金属标记抗体,其为利用肽位点特异性地进行了修饰的放射性金属标记抗体,
16.放射性金属络合物与肽直接地或间接地连接,在该肽与该放射性金属络合物之间具有由下述式(10a)表示的含三唑骨架的结构,或者在该肽与该放射性金属络合物之间具有含哒嗪骨架的结构。
17.[化学式1]
[0018][0019]
(式中,r
1a
表示与修饰部或螯合部的键合位点,r
2a
表示与肽的键合位点。)
[0020]
另外,本发明提供螯合接头,其具有:与放射性金属配位的螯合部;和,具备能够进行点击反应的第一原子团的修饰部,其中,第一原子团为下述式(1a)或(1b)中任一者所表示的原子团。
[0021]
[化学式2]
[0022][0023]
(式(1a)中,r1表示与修饰部或螯合部的键合位点,式(1b)中,r3及r4中的一者表示与修饰部或螯合部的键合位点,另一者表示氢原子、甲基、苯基或吡啶基。)
[0024]
另外,本发明提供肽修饰抗体,其是利用包含下述式(i)表示的、由13~17个氨基酸残基形成的氨基酸序列的肽,位点特异性地修饰而得的肽修饰抗体,
[0025]
在肽的n末端或c末端具有能够进行点击反应的第二原子团,第二原子团为下述式(2a)或(2b)中任一者表示的原子团。
[0026]
(xa)-xaa1-(xb)-xaa2-(xc)-xaa3-(xd)
···(i)[0027]
(式中,xa、xb、xc及xd分别表示连续的a个x、连续的b个x、连续的c个x、及连续的d个x,
[0028]
x是在侧链上不具有硫醇基及卤代乙酰基中的任一者的氨基酸残基,
[0029]
a、b、c及d各自独立地为1以上5以下的整数,并且满足a b c d≤14,
[0030]
xaa1及xaa3各自独立地,
[0031]
表示来自在侧链上具有硫醇基的氨基酸的氨基酸残基,并且介由二硫键而键合或硫醚基介由接头而键合;或者,
[0032]
一者表示来自在侧链上具有硫醇基的氨基酸的氨基酸残基,另一者表示来自在侧链上具有卤代乙酰基的氨基酸的氨基酸残基,且介由硫醚键而键合,
[0033]
xaa2为赖氨酸残基、精氨酸残基、半胱氨酸残基、天冬氨酸残基、谷氨酸残基、2-氨基辛二酸、或二氨基丙酸。)
[0034]
[化学式3]
[0035][0036]
(式(2a)中,r2表示与肽的n末端或c末端的键合位点,式(2b)中,r5表示与肽的n末端或c末端的键合位点。)
[0037]
根据本发明,即使在温和的反应条件下,放射性金属对抗体的标记效率也优异。
具体实施方式
[0038]
以下,基于优选实施方式对本发明的放射性金属标记抗体的制造方法进行说明。
[0039]
本发明的制造方法具备使放射性金属络合物与利用肽位点特异性地修饰而得的抗体(以下,也将其简称为“肽修饰抗体”。)进行点击反应,生成放射性金属标记抗体的工序(标记工序)。放射性金属及其络合物、以及肽的详细内容如后文所述。
[0040]
放射性金属络合物及肽修饰抗体各自具有能够进行点击反应的原子团,这些原子团彼此反应,使得能够将放射性金属络合物与肽修饰抗体彼此键合。即,本工序中的点击反应在放射性金属络合物所具备的第一原子团、与和肽修饰抗体中的肽直接地或间接地连接的第二原子团之间执行。
[0041]
所谓“直接地或间接地”,是指在第二原子团与肽之间是否具有后述的接头结构。所谓“直接地”,是指不具有接头结构,详细而言,是指第二原子团不介由接头结构而与肽的n末端或c末端键合。另外,所谓“间接地”,是指具有接头结构,详细而言,是指第二原子团介由接头结构与肽的n末端或c末端键合。为“直接地”或“间接地”中的任意方式时,第二原子团均优选与肽的n末端侧键合。
[0042]
上述的接头结构由以下的式(s1)表示。
[0043]
**-((l1)
m-z)
k-l
2-ag2···
(s1)
[0044]
(式中,**表示与肽的n末端或c末端的键合位点,
[0045]
l1为聚乙二醇(peg)接头部,
[0046]
m为1以上50以下的整数,
[0047]
z为将(l1)m与l2键合的第二接头部,
[0048]
k为0或1,
[0049]
l2为第二peg接头部,
[0050]
ag2为第二原子团。)
[0051]
上述式(s1)中,z的结构只要为将(l1)m与l2彼此键合的接头结构即可,没有特别限定,例如可以包含由1个以上5个以下的氨基酸残基形成的氨基酸序列。该情况下,z中包含的氨基酸序列优选包含半胱氨酸残基,更优选介由硫醚基(其通过半胱氨酸残基的硫醇基与马来酰亚胺基的键合而形成)与l2键合。
[0052]
本发明中,构成l2的peg接头部优选具有以下的式(p1)所示的结构。式(p1)中,n为
整数,优选为1以上50以下,更优选为1以上20以下,进一步优选为2以上10以下。
[0053]
[化学式4]
[0054][0055]
peg接头部的结构的一端可以利用来自市售的peg化试剂的结构或者来自peg化时通常使用的试剂的结构而修饰,没有特别限定,例如可例示出来自二甘醇酸或其衍生物、马来酰亚胺或其衍生物的结构。
[0056]
本工序中,作为能够进行点击反应的原子团的组合,根据点击反应的种类而选择适当的组合,例如,可举出炔烃与叠氮化物的组合、1,2,4,5-四嗪与烯烃的组合等。就这些原子团而言,只要第一原子团具有上述原子团中的一者、第二原子团具有成为第一原子团的组合的原子团即可。从同时实现放射性金属络合物及肽修饰抗体的稳定性、和提高它们的结合效率的观点考虑,优选第一原子团为炔烃且第二原子团为叠氮化物、或者第一原子团为1,2,4,5-四嗪且第二原子团为烯烃。作为具有这样的原子团的组合的点击反应的具体例,可举出huisgen环加成反应、或反电子需求型狄尔斯-阿尔德(diels-alder)反应等。
[0057]
作为能够进行点击反应的原子团的组合的具体例,如下式所示,可举出:第一原子团为包含作为炔烃的二苄基环辛炔(dbco)的原子团(式(1a))、与第二原子团为包含作为叠氮化物的叠氮基的原子团(式(2a))的组合;或者,第一原子团为包含1,2,4,5-四嗪的原子团(式(1b))、与第二原子团为包含作为烯烃的反式环辛烯(tco)的原子团(式(2b))的组合。
[0058]
[化学式5]
[0059][0060]
(式(1a)中,r1表示与修饰部或螯合部的键合位点,式(2a)中,r2表示与肽修饰抗体中的肽的键合位点。)
[0061]
[化学式6]
[0062][0063]
(式(1b)中,r3及r4中的一者表示与另一结构的键合位点,另一者表示氢原子、甲
基、苯基或吡啶基,式(2b)中,r5表示与另一结构的键合位点。)
[0064]
就本工序而言,只要放射性金属络合物与肽修饰抗体能够进行点击反应即可,它们的添加顺序不限,例如,可以向收容有溶剂的反应容器中添加放射性金属络合物及肽修饰抗体中的一者、接着添加另一者而反应,也可以向在溶剂中分散有放射性金属络合物及肽修饰抗体中的一者的分散液中添加另一者并使其反应。或者,可以向收容有溶剂的反应容器中同时添加两者并使其反应。
[0065]
作为本工序中使用的溶剂,可以使用含有水的溶剂,例如,可以使用水、生理盐水、或乙酸钠缓冲液、乙酸铵缓冲液、磷酸缓冲液、磷酸缓冲生理盐水、三羟基甲基氨基甲烷缓冲液(以下,简称为“tris缓冲液”)、4-(2-羟基乙基)-1-哌嗪乙烷磺酸缓冲液(以下,简称为“hepes缓冲液”)、或四甲基铵乙酸缓冲液等缓冲液等。在使用缓冲液的情况下,从同时实现络合物及抗体的稳定性、和它们的结合效率的观点考虑,作为25℃时的ph,下限优选为3.5以上,更优选为4.0以上,进一步优选为4.5以上,更进一步优选为5.0以上,尤其优选为5.5以上,上限优选为10.0以下,更优选为9.5以下,进一步优选为9.0以下,更进一步优选为8.5以下,尤其优选为8.0以下,作为优选的范围,为4.0以上10.0以下,作为进一步优选的范围,为5.5以上8.5以下。
[0066]
从防止肽修饰抗体的非预期改性、并且提高放射性金属络合物与肽修饰抗体的结合效率的观点考虑,对于本工序中的点击反应而言,反应温度的上限优选为120℃以下,更优选为90℃以下,进一步优选为50℃以下,更进一步优选为40℃以下。另外,反应温度的下限只要为能够进行点击反应的温度即可,没有特别限制,优选为10℃以上,更优选为15℃以上,进一步优选为20℃以上,更进一步优选为30℃以上,尤其优选为35℃以上。就点击反应的反应时间而言,以上述的反应温度为条件,下限优选为5分钟以上,更优选为10分钟以上,进一步优选为20分钟以上,更进一步优选为30分钟以上,尤其优选为60分钟以上,上限优选为36小时以下,更优选为24小时以下,更进一步优选为20小时以下,尤其优选为15小时以下,优选的范围为5分钟以上24小时以下,进一步优选的范围为10分钟以上20小时以下。
[0067]
反应液量没有特别限定,从制造工序的实用性的观点考虑,在本工序开始时,下限优选为0.01ml以上,更优选为0.1ml以上,进一步优选为1ml以上,上限优选为1000ml以下,更优选为100ml以下,进一步优选为10ml以下,例如,优选为0.1ml以上10ml以下。另外,就放射性金属络合物及肽修饰抗体在反应液中的浓度而言,各自独立地,在本工序的开始时,下限优选为0.01μmol/l以上,更优选为0.1μmol/l以上,进一步优选为1μmol/l以上,上限优选为10000μmol/l以下,更优选为1000μmol/l以下,进一步优选为100μmol/l以下,从目标放射性金属标记抗体的收量的观点考虑,例如优选为1μmol/l以上100μmol/l以下。
[0068]
得到的放射性金属标记抗体可以直接使用,或者,也可以使用过滤器、膜滤器、填充有各种填充剂的柱、色谱等进行纯化。
[0069]
根据具有上述工序的本发明的制造方法,在温和的反应条件下使放射性金属络合物与肽修饰抗体结合,能够高收率地得到由放射性金属标记的抗体。另外,得到的标记抗体能够在不阻碍抗体的抗原特异性的位点特异性地进行标记,因此,抗体自身所具有的抗原特异性得以维持。尤其是上述工序即使不进行用于促进放射性金属络合物与肽修饰抗体的结合反应的加热处理,也能够充分且在短时间内进行络合物与抗体的结合反应,因此,即使在使用了正电子释放核素等半衰期短的放射性金属的情况下,也能够在短时间内得到放射
化学性纯度及放射化学性收率高的标记抗体。
[0070]
就本发明的制造方法而言,根据标记抗体的用途及目的,从能够没有特别限制地使用进行标记的放射性金属的观点考虑,优选在标记工序之前具备使配体与放射性金属反应而形成放射性金属络合物的工序(络合物形成工序)。本工序中使用的配体优选具有第一原子团。另外,从提高络合物形成效率的观点考虑,本工序中的放射性金属优选以能够电离的放射性金属化合物的方式使用,进一步优选以放射性金属离子的方式使用(以下,也将这些方式总称为“放射性金属源”。)。
[0071]
另外,从不依赖于配体与放射性金属的组合而提高放射性金属络合物的形成效率的观点考虑,在络合物形成工序中,优选对配体和放射性金属进行加热而使其反应。关于这一方面,根据配体与放射性金属的组合,有时在非加热条件下络合物形成无法良好地进行,但通过在加热条件下进行经放射性金属离子配位而得的络合物的形成,能够不依赖于配体与放射性金属的组合而高效地进行络合物形成。
[0072]
就络合物形成工序而言,只要能够与放射性金属离子形成络合物即可,配体与放射性金属源的添加顺序不限,例如,可以向收容有溶剂的反应容器中添加配体及放射性金属源中的一者、接着添加另一者并使其反应,也可以向在溶剂中分散有配体及放射性金属源中的一者的分散液中添加另一者并使其反应。或者,可以向收容有溶剂的反应容器中同时添加两者并使其反应。
[0073]
作为络合物形成工序中的反应条件,例如可以为以下的条件。作为本工序中使用的溶剂,例如可以使用水、生理盐水、或乙酸钠缓冲液、乙酸铵缓冲液、磷酸缓冲液、磷酸缓冲生理盐水、tris缓冲液、hepes缓冲液、或四甲基铵乙酸缓冲液等缓冲液等、或者碳原子数1以上5以下的醇、乙腈、n,n-二甲基甲酰胺、四氢呋喃、二甲基亚砜及丙酮等水溶性有机溶剂或它们的混合溶剂。作为反应温度,例如可以为室温(25℃),也可以为加热条件下,从同时实现抑制配体的分解和提高络合物的形成效率的观点考虑,上限优选为120℃以下,更优选为90℃以下,进一步优选为50℃以下,更进一步优选于40℃以下进行。下限为能够进行点击反应的温度即可,没有特别限制,优选为0℃以上,更优选为10℃以上,进一步优选为15℃以上,更进一步优选为20℃以上,更进一步优选为30℃以上,尤其优选为35℃以上。优选于30℃以上100℃以下、进一步优选于37℃以上90℃以下进行加热。就反应时间而言,以上述的反应温度为条件,下限优选为5分钟以上,更优选为10分钟以上,进一步优选为20分钟以上,更进一步优选为30分钟以上,尤其优选为60分钟以上,上限优选为300分钟以下,更优选为150分钟以下,进一步优选为120分钟以下,尤其优选为60分钟以下,优选为10分钟以上150分钟以下,进一步优选为30分钟以上60分钟以下。
[0074]
络合物形成工序中的放射性金属源例如可以使用在以水为主体的溶剂中分散或溶解有放射性金属离子的溶液。
[0075]
本工序中的反应液量没有特别限定,从制造工序的实用性的观点考虑,在本工序开始时,下限优选为0.01ml以上,更优选为0.1ml以上,进一步优选为1ml以上,上限优选为1000ml以下,更优选为100ml以下,进一步优选为10ml以下,例如,优选为0.01ml以上100ml以下。另外,就配体及放射性金属离子在反应液中的浓度而言,各自独立地,在本工序开始时,下限优选为0.01μmol/l以上,更优选为0.1μmol/l以上,进一步优选为1μmol/l以上,上限优选为10000μmol/l以下,更优选为1000μmol/l以下,进一步优选为100μmol/l以下,从目
标放射性金属络合物的收率的观点考虑,例如优选为1μmol/l以上100μmol/l以下。配体及放射性金属离子的摩尔比率根据所使用的配体及放射性金属离子的种类的不同而不同,作为配体/放射性金属离子,下限优选为10/1以上,更优选为100/1以上,进一步优选为200/1以上、300/1以上,更进一步优选为500/1以上,上限优选为10000/1以下,更优选为9000/1以下,进一步优选为8000/1以下,更进一步优选为7000/1以下,优选为200/1以上10000/1以下,尤其优选为500/1以上7000/1以下的范围。
[0076]
得到的放射性金属络合物可以直接使用,或者,也可以使用过滤器、膜滤器、填充有各种填充剂的柱、色谱等进行纯化。特别地,即使在使用难以检测的低能量放射线、释放α射线的放射性金属核素的情况下,本工序也良好地进行络合物形成,生成物的收率高,因此能够将包含该放射性金属核素的络合物在未纯化的状态下供于以后的工序,在这一方面是有利的。
[0077]
从同时实现配体与放射性金属离子的反应的反应效率的提高、和得到的络合物与肽修饰抗体的点击反应的反应效率的提高的观点考虑,配体优选具有:作为供放射性金属离子配位的位点的螯合部;和,与第一原子团结合的修饰部。
[0078]
如以下的式(3a)所表示的,修饰部(式(3a)中,由rm表示。)与上述的螯合部(式(3a)中,由ch表示。)结合,并且结合有上述第一原子团(式(3a)中,由ag表示。)。式(3a)中,rm是直链或支链、取代或未取代、并且总碳原子数为10以上50以下的原子团。
[0079]
[化学式7]
[0080][0081]
就修饰部rm而言,只要能够形成配体与放射性金属离子的络合物即可,与螯合部ch的结合方式没有特别限制,从高效地形成配体与放射性金属离子的络合物的观点考虑,优选修饰部rm与螯合部ch形成硫脲键而结合、或者修饰部rm与螯合部ch形成酰胺键而结合。另外,从提高放射性金属络合物与抗体的标记效率的观点考虑,也优选修饰部rm与第一原子团中的上述式(1a)及式(1b)表示的r1以及r3或r4结合。
[0082]
从进一步提高放射性金属络合物与抗体的标记效率的观点考虑,就修饰部而言,优选以下的式(p2)所示的结构结合在式(3a)中由rm表示的结构中。该结构为来自乙二醇的结构,式(p2)中,r优选为2以上50以下的整数,进一步优选为2以上30以下的整数。
[0083]
[化学式8]
[0084][0085]
另外,对于螯合部而言,只要在结构中具有供放射性金属配位的位点即可,没有特别限定,优选cb-te2a(1,4,8,11-四氮杂双环[6.6.2]十六烷-4,11-二乙酸(1,4,8,11-tetraazabicyclo[6.6.2]hexadecane-4,11-diacetic acid))、cdta(反式-1,2-环己二胺
四乙酸(cyclohexane-trans-1,2-diamine tetra-acetic acid))、cdtpa(4-氰基-4-[[(十二烷基硫醚基)硫代甲基]硫醚基]-戊酸(4-cyano-4-[[(dodecylthio)thioxomethyl]thio]-pentanoic acid))、dota(1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid))、dotma((1r,4r,7r,10r)-α,α’,α”,α
”’‑
四甲基-1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸((1r,4r,7r,10r)-α,α’,α”,α
”’‑
tetramethyl-1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraa cetic acid))、dotam(1,4,7,10-四(氨基甲酰基甲基)-1,4,7,10-四氮杂环十二烷(1,4,7,10-tetrakis(carbamoylmethyl)-1,4,7,10-tetraazacyclododecane))、dota-ga(α-(2-羧基乙基)-1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(α-(2-carboxyethyl)-1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid))、dotp(((1,4,7,10-四氮杂环十二烷-1,4,7,10-四基)四(亚甲基))四膦酸(((1,4,7,10-tetraazacyclododecane-1,4,7,10-tetrayl)tetrakis(methylene))tetraphosphonic acid))、dotmp(1,4,7,10-四氮杂环十二烷-1,4,7,10-四(亚甲基膦酸)(1,4,7,10-tetraazacyclododecane-1,4,7,10-tetrakis(methylenephosphonic acid)))、dota-4amp(1,4,7,10-四氮杂环十二烷-1,4,7,10-四(乙酰氨基亚甲基膦酸(1,4,7,10-tetraazacyclododecane-1,4,7,10-tetrakis(acetamidomethylenephosphonic acid))、d02p(四氮杂环十二烷二甲烷膦酸(tetraazacyclododecane dimethanephosphonic acid))、去铁胺(dfo,deferoxamine)、dtpa(n,n-双[2-[双(羧甲基)氨基]乙基]-甘氨酸(glycine,n,n-bis[2-[bis(carboxymethyl)amino]ethyl]-))、dtpa-bma(5,8-双(羧甲基)-11-[2-(甲基氨基)-2-氧代乙基]-3-氧代-2,5,8,11-四氮杂十三烷基-13-甲酸(5,8-bis(carboxymethyl)-11-[2-(methylamino)-2-oxoethyl]-3-oxo-2,5,8,11-tetraazatridecan-13-oic acid))、edta(2,2’,2”,2
”’‑
(乙烷-1,2-二基双(氮三基(azanetriyl)))四乙酸(2,2’,2”,2
”’‑
(ethane-1,2-diylbis(azanetriyl))tetraacetic acid))、nota(1,4,7-三氮杂环壬烷-1,4,7-三乙酸(1,4,7-triazacyclononane-1,4,7-triacetic acid))、notp(1,4,7-三氮杂环壬烷-1,4,7-三基三(亚甲基膦酸)(1,4,7-triazacyclononane-1,4,7-triyltris(methylenephosphonic acid))、tetpa(1,4,8,11-四氮杂环十四烷-1,4,8,11-四丙酸(1,4,8,11-tetraazacyclotetradecane-1,4,8,11-tetrapropionic acid))、teta(1,4,8,11-四氮杂环十四烷-n,n’,n”,n
”’‑
四乙酸(1,4,8,11-tetraazacyclotetradecane-n,n’,n”,n
”’‑
tetraacetic acid))、ttha(3,6,9,12-四(羧甲基)-3,6,9,12-四氮杂十四烷二甲酸(3,6,9,12-tetrakis(carboxymethyl)-3,6,9,12-tetraazatetradecanedioic acid))、heha(1,2,7,10,13-六氮杂环十八烷-1,4,7,10,13,16-六乙酸(1,2,7,10,13-hexaazacyclooctadecane-1,4,7,10,13,16-hexaacetic acid))、1,2-hopo(n,n’,n”,n
”’‑
四(1,2-二氢-1-羟基-2-氧代吡啶-6-羰基)-1,5,10,14-四氮杂十四烷(n,n’,n”,n
”’‑
tetra(1,2-dihydro-1-hydroxy-2-oxopyridine-6-carbonyl)-1,5,10,14-tetraazatetradecane))、pepa(1,4,7,10,13-五氮杂环十五烷-n,n’,n”,n”,n
””‑
五乙酸(1,4,7,10,13-pentaazacyclopentadecane-n,n’,n”,n
”’
,n
””‑
penta-aceti c acid))、h4octapa(n,n
’‑
双(6-羧基-2-吡啶基甲基)-乙二胺-n,n
’‑
二乙酸(n,n
’‑
bis(6-carboxy-2-pyridylmethyl)-ethylenediamine-n,n
’‑
diacetic acid))、h2bispa2(6,6
’‑
({9-羟基-1,5-双(甲氧基羰基)-2,4-二(吡啶-2-基)-3,7-二氮杂双环[3.3.1]壬-3,7-二基}双(亚甲
基))二吡啶甲酸(6,6
’‑
({9-hydroxy-1,5-bis(methoxycarbonyl)-2,4-di(pyridine-2-yl)-3,7-diazabicyclo[3.3.1]nonane-3,7-diyl}bis(-methylene))dipicolinic acid))、h2dedpa(1,2-[{6-(羧基)-吡啶-2-基}-甲基氨基]乙烷(1,2-[{6-(carboxy)-pyridin-2-yl}-methylamino]ethane))、h2macropa(6-(1,4,10,13-四氧杂-7,16-二氮杂环十八烷-n,n
’‑
甲基)吡啶甲酸(6-(1,4,10,13-tetraoxa-7,16-diazacyclooctadecan-n,n
’‑
methyl)picolinic acid))、h5decapa(n,n
”‑
双(6-羧基-2-吡啶基甲基)-二亚甲基三胺-n,n’,n
”‑
三乙酸(n,n
”‑
bis(6-carboxy-2-pyridylmethyl)-diethylenetriamine-n,n’,n
”‑
triacetic acid))、h6phospa(n,n
’‑
(亚甲基膦酸酯基)-n,n
’‑
[6-(甲氧基羰基)吡啶-2-基]-甲基-1,2-二氨基乙烷(n,n
’‑
(methylenephosphonate)-n,n
’‑
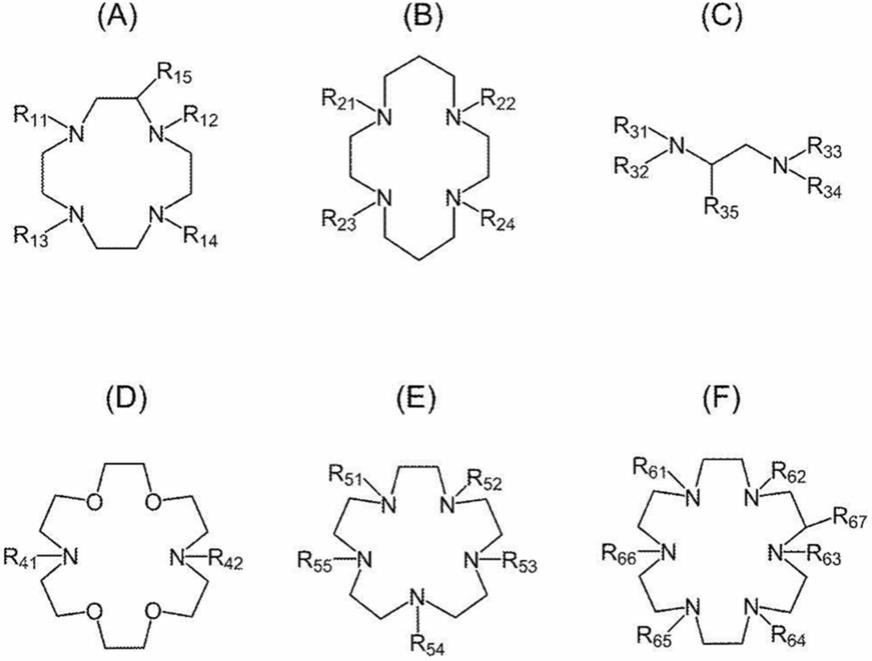
[6-(methoxycarbonyl)pyridin-2-yl]-methyl-1,2-diaminoethane))、hp-d03a(羟基丙基四氮杂环十二烷三乙酸(hydroxypropyltetraazacyclododecanetriacetic acid))或卟琳或者由下述式(a)至(k)中的任一者表示。上述结构可以根据后述的放射性金属的种类而适当选择。任意螯合部均可充分地发挥本发明的效果。
[0086]
[化学式9]
[0087][0088]
[化学式10]
[0089][0090]
式(a)中,r
11
、r
13
及r
14
各自独立地为包含-(ch2)
p
cooh、-(ch2)
p
c5h5n、-(ch2)
p
po3h2、-(ch2)
p
conh2或-(chcooh)(ch2)
p
cooh的基团,r
12
或r
15
中的一者为氢原子、羧基、或者碳原子数2或3的羧基烷基,另一者为与上述修饰部键合的基团,p为0以上3以下的整数。
[0091]
式(b)中,r
21
、r
22
、r
23
及r
24
各自独立地为羧基或者碳原子数2或3的羧基烷基,但r
21
、r
22
、r
23
或r
24
中的任一基团为与上述修饰部键合的基团。
[0092]
式(c)中,r
31
、r
32
、r
33
及r
34
各自独立地为包含下述原子团的基团,所述原子团具有氢原子和2个以上10个以下的碳原子、且可含有氮原子或氧原子,r
35
为与上述修饰部键合的基团。
[0093]
式(d)中,r
41
或r
42
中的一者为包含具有氢原子和5个以上20个以下的碳原子、且包含选自氮原子、氧原子及硫原子中的一种以上的原子团的基团,另一者为与上述修饰部键合的基团。
[0094]
式(e)中,r
51
、r
52
、r
53
、r
54
及r
55
各自独立地为羧基、或者碳原子数2或3的羧基烷基,其中,r
51
、r
52
、r
53
、r
54
或r
55
中的任一基团为与上述修饰部键合的基团。
[0095]
式(f)中,r
61
、r
62
、r
63
、r
64
、r
65
及r
66
各自独立地为羧基、或者碳原子数2或3的羧基烷
基,r
67
为与上述修饰部键合的基团。
[0096]
式(g)中,r
71
及r
72
为-o(ch2ch2o)nch3(其中,n为1以上5以下的整数),r
73
、r
75
、r
76
及r
78
各自独立地为碳原子数1以上5以下的烷基,r
74
或r
77
中的任一者为碳原子数1以上5以下的羟基烷基,另一者为与上述修饰部键合的基团。
[0097]
式(h)中,r
81
及r
82
各自独立地为碳原子数1以上5以下的烷基,该烷基的末端可被经1个以上的羧基取代的吡啶基取代,r
87
为-choh或-c=o,但r
81
、r
82
或r
87
中的任一基团为与上述修饰部键合的基团,r
83
及r
84
为可被取代的吡啶基团,r
85
及r
86
各自独立地为-coora,ra为碳原子数1以上5以下的烷基。
[0098]
式(i)中,r
91
、r
92
、r
93
及r
94
各自独立地为-och2cooh,但r
91
、r
92
、r
93
或r
94
中的任一基团为与上述修饰部键合的基团,r
95
、r
96
、r
97
及r
98
各自独立地为碳原子数1以上6以下的烷基。
[0099]
式(j)中,r
101
、r
102
及r
103
各自独立地为羧基、或者碳原子数2或3的羧基烷基;或者,式(j)中,r
101
、r
102
及r
103
中的至少一者为与上述修饰部键合的基团,其他基团为羧基、或者碳原子数2或3的羧基烷基。
[0100]
上述式(a)~(j)中,“与修饰部键合的基团”表示来自羧基、氨基、n-羟基琥珀酰亚胺酯(nhs)基、2,6-二氧代四氢-2h-吡喃基、异氰酸酯基或异硫氰酸酯基的结构、与修饰部键合的结构。
[0101]
作为式(a)表示的具体结构,可举出来自以下的式(a-1)~(a-12)表示的化合物的结构。
[0102]
[化学式11]
[0103]
[0104]
[化学式12]
[0105][0106]
[化学式13]
[0107][0108]
作为式(b)及(c)表示的具体结构,可举出来自以下的式(b-1)~(b-2)及(c-1)~(c-5)表示的化合物的结构。
[0109]
[化学式14]
[0110][0111]
[化学式15]
[0112][0113]
作为式(d)及(e)表示的具体结构,可举出来自以下的式(d-1)~(d-3)、及(e-1)表示的化合物的结构。
[0114]
[化学式16]
[0115][0116]
作为式(f)及(g)表示的具体结构,可举出来自以下的式(f-1)~(f-2)、及(g-1)表示的化合物的结构。
[0117]
[化学式17]
[0118][0119]
作为式(h)及(i)表示的具体结构,可举出来自以下的式(h-1)~(h-4)、及(i-1)表示的化合物的结构。
[0120]
[化学式18]
[0121][0122]
[化学式19]
[0123][0124]
作为式(j)表示的具体结构,可举出来自以下的式(j-1)~(j-5)表示的化合物的结构。
[0125]
[化学式20]
[0126][0127]
如前文所述,螯合部与修饰部的键合位点优选为酰胺键、硫脲键,从进一步提高收率的观点考虑,更优选为酰胺键。
[0128]
酰胺键例如通过上述式(b-1)~(b-2)、(g-1)、(h-1)~(h-4)、(i-1)、(j-1)~(j-3)表示的化合物的羧基、上述式(a-10)、(a-11)的n-羟基琥珀酰亚胺酯(nhs)基、或上述(a-12)的2,6-二氧代四氢-2h-吡喃基、与伯胺的反应而形成,或者,通过式(k)表示的化合物的图中的右端记载的氨基、与具有羟基、羧基或nhs基的试剂的反应而形成。此处,在与具有羟基的试剂反应的情况下,将羟基转变为羧基而使用。另外,硫脲键通过上述式(a-2)、(a-3)、(d-2)或(f-2)表示的化合物的异硫氰酸酯基、与伯胺或马来酰亚胺基的反应而形成。
[0129]
修饰部可以从所期望的第一原子团所结合、且具备伯胺的市售试剂或能够形成酰胺键、硫脲键的市售试剂中进行各种选择而形成。
[0130]
作为这样的试剂,在使用上述式(1a)表示的dibenzylcyclooctyne(dbco)作为第一原子团的情况下,可以选择dbco-胺、dbco-马来酰亚胺、dbco-peg-nhs酯、dbco-peg-醇、
dbco-peg-胺、dbco-peg-马来酰亚胺等,优选可以选择dbco-胺、dbco-马来酰亚胺、dbco-peg-胺、dbco-peg-马来酰亚胺。
[0131]
放射性金属络合物只要为使具有下述结构的配体与放射性金属反应而形成的物质即可,没有特别限定,所述结构是从上述的第一原子团、螯合部及修饰部中选择适当的种类而得的,其中,放射性金属络合物优选为使具有以下的式(ii)表示的结构的配体与放射性金属反应而形成的。
[0132]
a-b-c
···
(ii)
[0133]
式(ii)中,a由以下的式(iia)表示。
[0134]
[化学式21]
[0135][0136]
式(iia)中,ra、rb及rc独立地为包含-(ch2)
p
cooh、-(ch2)
p
c5h5n、-(ch2)
p
po3h2、-(ch2)
p
conh2或-(chcooh)(ch2)
p
cooh的基团,p为0以上3以下的整数,rd或re中的任一者为与b的键合位点(*),另一者为氢原子、或包含-(ch2)
p
cooh、-(ch2)
p
c5h5n、-(ch2)
p
po3h2、-(ch2)
p
conh2或、-(chcooh)(ch2)
p
cooh的基团,p为0以上3以下的整数。
[0137]
式(ii)中,b由以下的式(iib)表示。
[0138]
[化学式22]
[0139][0140]
式(iib)中,la及lb独立地为至少包含酰胺键或硫脲键的碳原子数1以上50以下的结合接头,t为0以上30以下的整数,s为0或1,*为与a的键合位点,**为与c的键合位点。
[0141]
式(ii)中,c为以下的式(iic)表示的炔烃衍生物或式(iid)表示的四嗪衍生物中的任一者。
[0142]
[化学式23]
[0143][0144]
式(iic)中,x为chrk-**或n-**,y为chrk或c=o,rk独立地为氢原子、或为碳原子数1以上5以下的烷基,在x为chrk-**、且y为chrk的情况下,rk部分可以一起形成环烷基,rf、rg、rh及ri独立地为氢原子、卤素原子、碳原子数1以上5以下的烷基,可以rf与rg一起、或者rh与ri一起形成烃环,**表示与b的键合位点,式(iid)中,**表示与b的键合位点,rj表示氢原子、甲基、苯基或吡啶基。
[0145]
另外,就配体而言,作为a,更优选下述中的任一者:上述式(iia)中,ra至rd为-(ch2)
p
cooh、p为1、re为与b的键合位点即dota衍生物;或者,ra至rc为-(ch2)
p
cooh、p为1、rd为与b的键合位点(*)、re为氢原子的do3a衍生物或dotaga衍生物。
[0146]
式(ii)中,a为上述dota衍生物的情况下,更进一步优选为:dota-pegt-dbco衍生物,其中,b中la为含有硫脲键的碳原子数1以上50以下的结合接头,s为0或1,在s为1的情况下,t为0以上30以下的整数,lb为含有酰胺键或硫脲键的碳原子数1以上50以下的结合接头,c为式(iic)表示的炔烃衍生物,式(iic)中,x为n-**,y为chrk,rk为氢原子,rf与rg一起形成苯环,rh与ri一起形成苯环,**为与b的键合位点;或者,dota-pegt-tz衍生物,其中,b中la为含有硫脲键的碳原子数1以上50以下的结合接头,s为0或1,在s为1时,t为0以上30以下的整数,lb为含有酰胺键或硫脲键的碳原子数1以上50以下的结合接头,c为式(iid)表示的四嗪衍生物。
[0147]
式(ii)中,a为上述do3a衍生物的情况下,更进一步优选为do3a-pegt-dbco衍生物,其中,b中la为含有酰胺键或硫脲键的碳原子数1以上50以下的结合接头,s为0或1,在s为1时,t为0以上30以下的整数,lb为含有酰胺键或硫脲键的碳原子数1以上50以下的结合接头,c为式(iic)表示的炔烃衍生物,式(iic)中,x为n-**,y为chrk,rk为氢原子,rf与rg一起形成苯环,rh与ri一起形成苯环,**为与b的键合位点。
[0148]
式(ii)中,a为上述dotaga衍生物的情况下,更进一步优选为dotaga-pegt-dbco衍生物,其中,b中la为含有酰胺键或硫脲键的碳原子数1以上50以下的结合接头,s为0或1,在s为1时,t为0以上30以下的整数,lb为含有酰胺键或含有硫脲键的碳原子数1以上50以下的结合接头,c为式(iic)表示的炔烃衍生物,式(iic)中,x为n-**,y为chrk,rk为氢原子,rf与rg一起形成苯环,rh与ri一起形成苯环,**为与b的键合位点。
[0149]
以下,对上述的各实施方式中可共通地适用的事项进行说明。就本发明中使用的
肽修饰抗体而言,抗体的特定部位被肽特异性地修饰,优选抗体的fc区(恒定区)被特异性地修饰,尤其优选抗体的fc区中的赖氨酸残基被位点特异性地修饰。即,本发明中,可以在标记工序之前具备使肽与抗体反应而得到肽修饰抗体的工序(抗体修饰工序)。
[0150]
本发明中使用的抗体为含有fc区的多肽即可,可以为单克隆抗体也可以为多克隆抗体,优选为单克隆抗体。单克隆抗体也包括抗体变体(嵌合抗体、人源化抗体等)等经人工修饰的基因重组型抗体。
[0151]
本发明中使用的肽只要是在抗体的fc区位点特异性地进行修饰的物质即可,可以为链状肽,也可以为环状肽,优选为环状肽。另外,优选包含由下述式(i)表示的、由13~17个氨基酸残基形成的氨基酸序列。涉及氨基酸序列的以下说明中,氨基酸序列的纸面左侧表示n末端侧,氨基酸序列的纸面右侧表示c末端侧,以此进行说明。与肽连接的第二原子团的键合位置只要能够在与第一原子团之间进行点击反应即可,没有特别限制,从提高反应性的观点考虑,优选在肽的n末端或c末端具有第二原子团,进一步优选在肽的n末端具有第二原子团。
[0152]
(xa)-xaa1-(xb)-xaa2-(xc)-xaa3-(xd)
···(i)[0153]
上述式(i)中,xa、xb、xc及xd分别表示连续的a个x、连续的b个x、连续的c个x、及连续的d个x,
[0154]
x是在侧链上不具有硫醇基及卤代乙酰基中的任一者的氨基酸残基,
[0155]
a、b、c及d各自独立地为1以上5以下的整数,并且满足a b c d≤14,
[0156]
xaa1及xaa3各自独立地,
[0157]
表示来自在侧链上具有硫醇基的氨基酸的氨基酸残基,并且介由二硫键而键合、或硫醚基介由接头键合;或者,
[0158]
一者表示来自在侧链上具有硫醇基的氨基酸的氨基酸残基,另一者表示来自在侧链上具有卤代乙酰基的氨基酸的氨基酸残基,且介由硫醚键而键合,
[0159]
xaa2为赖氨酸残基、精氨酸残基、半胱氨酸残基、天冬氨酸残基、谷氨酸残基、2-氨基辛二酸、或二氨基丙酸,优选经桥连剂修饰。
[0160]
作为上述式(i)中的x可包含的氨基酸残基,例如,可举出来自甘氨酸、丙氨酸、苯基丙氨酸、脯氨酸、天冬酰胺、天冬氨酸、谷氨酸、精氨酸、组氨酸、丝氨酸、苏氨酸、酪氨酸、蛋氨酸等氨基酸的残基,x可以为由同一种类的氨基酸形成的氨基酸残基,也可以为由各自不同种类的氨基酸形成的氨基酸残基。
[0161]
式(i)中的a、b、c及d只要为上述范围内的数即可,没有特别限制,从肽与抗体的结合稳定性的观点考虑,以a b c d≤14为条件,a优选为1以上3以下的整数,b优选为1以上3以下的整数,c优选为3以上5以下的整数,及d优选为1以上3以下的整数。
[0162]
xaa1及xaa3为来自在侧链上具有硫醇基的氨基酸的氨基酸残基,这些氨基酸可以各自相同,也可以不同。作为在侧链上具有硫醇基的氨基酸,例如可举出半胱氨酸、同型半胱氨酸。这样的氨基酸残基优选通过二硫键键合、或者介由以下的式(4)所示的结构键合有硫醚基。式(4)中,波浪线部分表示与硫醚基的键合部分。
[0163]
[化学式24]
[0164][0165]
就xaa1及xaa3而言,可以代替上述的组合,xaa1及xaa3中的一者为来自在侧链上具有硫醇基的氨基酸的氨基酸残基,另一者为来自在侧链上具有卤代乙酰基的氨基酸的氨基酸残基。它们介由硫醚键而键合。卤代乙酰基的末端被碘等卤素取代,通过与另一侧链中的硫醇基反应,卤素脱离,形成硫醚键。
[0166]
式(i)表示的肽的具体氨基酸序列例如可举出国际公开2016/186206号小册子、国际公开2017/217347号小册子及国际公开2018/230257号小册子中记载的肽,也可以使用它们。
[0167]
这些之中,作为肽的氨基酸序列,优选具有以下的序列(1)~(14)中的任一者,进一步优选具有以下的序列(1)、(2)、(13)或(14)。通过具有这样的氨基酸序列,从而能够提高肽与抗体(例如,人igg)的结合亲和性。以下的氨基酸序列(1)~(14)中,(xaa2)表示赖氨酸残基、半胱氨酸残基、天冬氨酸残基、谷氨酸残基、2-氨基辛二酸、或二氨基丙酸,优选由桥连剂修饰,(xaa1)及(xaa3)均表示同型半胱氨酸残基。另外,以下的氨基酸序列(1)~(14)中,(xaa1)、(xaa2)及(xaa3)以外的氨基酸用一个字母缩写表示。
[0168]
(1)dcayh(xaa2)gelvwct
[0169]
(2)gpdcayh(xaa2)gelvwctfh
[0170]
(3)rcayh(xaa2)gelvwcs
[0171]
(4)gprcayh(xaa2)gelvwcsfh
[0172]
(5)spdcayh(xaa2)gelvwctfh
[0173]
(6)gddcayh(xaa2)gelvwctfh
[0174]
(7)gpscayh(xaa2)gelvwctfh
[0175]
(8)gpdcayh(xaa2)gelvwcsfh
[0176]
(9)gpdcayh(xaa2)gelvwcthh
[0177]
(10)gpdcayh(xaa2)gelvwctfy
[0178]
(11)spdcayh(xaa2)gelvwctfy
[0179]
(12)sddcayh(xaa2)gelvwctfy
[0180]
(13)rgncayh(xaa2)gqlvwctyh
[0181]
(14)g(xaa1)dcayh(xaa2)gelvwct(xaa3)h
[0182]
本发明中使用的肽可通过下述方式制造:组合使用氨基酸(天然氨基酸及非天然氨基酸均可),供于例如液相合成法、固相合成法、自动肽合成法、基因重组法或噬菌体展示法等肽合成法。在合成肽时,可根据需要对所使用的氨基酸的官能团进行保护。这些例如可以按照国际公开2017/217347号小册子及国际公开2018/230257号小册子中记载的方法进行。
[0183]
就第二原子团向本发明中的肽的导入方法而言,可举出下述方法:利用上述的方法得到具有所期望的氨基酸序列的肽之后,将该肽溶解于加入有溶解辅助剂及还原剂、以及根据需要添加有酸的溶液中,向该溶液中添加作为第二原子团的、含有叠氮基或tco的原
子团的有机溶剂溶液,于室温搅拌,由此导入第二原子团。
[0184]
在导入含有叠氮基的原子团作为第二原子团的情况下,可以使用市售的叠氮基导入试剂、按照常规方法在肽的n末端或c末端直接导入叠氮基、或者介由上述的接头结构而导入含有叠氮基的原子团。作为所使用的叠氮基导入试剂,例如,可举出甲硅烷基叠氮化物、磷酸叠氮化物、烷基铵叠氮化物、无机叠氮化物、磺酰基叠氮化物、或peg叠氮化物等。
[0185]
另外,在导入含有tco的原子团作为第二原子团的情况下,可以使用包含tco的市售的点击化学用试剂、按照常规方法在肽的n末端或c末端直接导入tco、或者介由上述的接头结构而导入含有tco的原子团。
[0186]
使肽与抗体结合而得到肽修饰抗体的方法例如可以使用桥连剂而进行。所谓桥连剂,是指用于使肽与抗体借助共价键而连接的化学物质,作为其例子,可举出双琥珀酰亚胺戊二酸酯(dsg)、双琥珀酰亚胺辛二酸酯(dss)等优选含有2个以上琥珀酰亚胺基的桥连剂、由二亚胺代己二酸二甲酯等优选含有2个以上酰亚胺酸部分的化合物或其盐形成的桥连剂、以及由3,3
’‑
二硫代双丙亚氨酸二甲酯、二硫代双琥珀酰亚胺基丙酸等具有二硫键的化合物或其盐形成的桥连剂等。通过使用这样的桥连剂,能够在肽中的xaa2的氨基酸残基与抗体之间发生桥连反应。就抗体中的发生桥连反应的部位而言,在使用人igg(例如,曲妥珠单抗)作为抗体的情况下,xaa2的氨基酸残基、与曲妥珠单抗中的按照eu编号的lys246残基及lys248残基的至少一者之间,位点特异性地介由桥连结构而结合。这些lys残基存在于人igg中的fc区,即使是曲妥珠单抗以外的抗体,本领域技术人员也可以比对抗体的氨基酸序列并且确定相应的lys残基。
[0187]
肽与抗体的结合方法例如可以将上述的肽、抗体、桥连剂、和根据需要添加的催化剂在10℃以上30℃以下的环境下分散在适当的缓冲液中而进行。反应时间可以为10分钟以上2小时左右。肽与抗体反应时的摩尔比率以肽:抗体计可以为1:1~20:1的范围。
[0188]
就经由上述工序得到的肽修饰抗体而言,只要相对于1分子抗体(优选免疫球蛋白类为igg的抗体)而言至少结合有1分子以上的肽即可,从维持抗体本身的活性(抗原识别作用、中和作用、补体活化作用、调理素作用)的观点考虑,优选在抗体的fc区(恒定区)位点特异性地结合有肽,本发明中,肽修饰抗体更优选相对于1分子抗体而言结合有1分子或2分子肽。
[0189]
上述肽修饰抗体是以任意的比例含有相对于1分子抗体而言1分子肽所结合的抗体(以下,称为“一价抗体”)、和相对于1分子抗体而言2分子肽所结合的抗体(以下,称为“二价抗体”)的混合物,可以将其直接用于以后的工序,也可以在利用过滤器、膜滤器、填充有各种填充剂的柱、各种色谱等方法将未修饰抗体、一价抗体、和二价抗体进行分离纯化后仅将任一价数的抗体供于以后的工序。在纯化的结果为无法将未修饰抗体与其他价数的抗体分离的情况下,也可以以含有它们的混合物的形式供于以后的工序。
[0190]
将未修饰抗体、一价抗体、和二价抗体进行分离纯化的情况下,可以利用上述的任意纯化方法进行分离纯化,优选使用填充有各种填充剂的柱,更优选使用填充有适于抗体等蛋白质的分离纯化的填充剂的柱。
[0191]
放射性金属络合物中以离子的状态配位的放射性金属可以使用释放α射线、β射线或γ射线或者它们的组合的放射线的金属核素。作为这样的放射性金属的核素,例如可举出碱金属、碱土金属、镧系元素、锕系元素、过渡金属或这些金属以外的金属的放射性同位
素等。这些之中,从能够商业利用并且实现络合物形成性的提高的观点考虑,作为放射性金属的核素,优选使用
44
sc、
51
cr、
57
co、
58
co、
60
co、
59
fe、
67
ga、
68
ga、
64
cu、
67
cu、
89
sr、
89
zr、
90
y、
99m
tc、
103
ru、
111
in、
153
sm、
165
dy、
166
ho、
177
lu、
186
re、
188
re、
198
au、
201
tl、
197
hg、
203
hg、
212
bi、
213
bi、
212
pb、
227
th或
225
ac。这些放射性金属可以按照常规方法制造,优选作为含有放射性金属电离后的形态的溶液而得到。
[0192]
在以疾病的治疗为目的使用放射性金属标记抗体的情况下,从提高治疗效果的观点考虑,作为放射性金属,优选使用释放α射线的核素或释放β-射线的核素。释放α射线的核素只要是在放射性金属的蜕变过程中释放α射线的核素即可,详细而言,可优选使用
212
bi、
213
bi、
227
th或
225
ac等,更优选为
227
th或
225
ac,进一步优选为
225
ac。释放β-射线的核素只要能够在放射性金属的蜕变过程中释放β-射线的核素即可,详细而言,可优选使用
60
co、
59
fe、
64
cu、
67
cu、
89
sr、
90
y、
99m
tc、
103
ru、
153
sm、
165
dy、
166
ho、
177
lu、
186
re、
188
re、
198
au、
203
hg、
212
bi、
213
bi或
212
pb等,更优选使用
64
cu、
67
cu、
89
sr、
90
y或
177
lu。
[0193]
另外,在以疾病的诊断、病灶的检测为目的使用放射性金属标记抗体的情况下,从提高诊断性能的观点考虑,作为放射性金属,优选使用释放β
射线的核素、电子俘获蜕变核素、或释放γ射线的核素。释放β
射线的核素只要是能够在放射性金属的蜕变过程中释放正电子的核素即可,可优选使用
44
sc、
58
co、
68
ga、
64
cu或
89
zr等,更优选为
64
cu或
89
zr。电子俘获蜕变核素只要是能够在放射性金属的蜕变过程中释放俄歇电子或特性x射线的核素即可,可优选使用
51
cr、
57
co、
58
co、
67
ga、
68
ga、
64
cu、
89
zr、
111
in、
186
re、
201
tl或
197
hg等。释放γ射线的核素只要是能够通过γ衰变而释放γ射线的核素即可,作为通过γ衰变而释放γ射线的核素,可优选使用
99m
tc、
68
ga或
201
tl。
[0194]
例如,在基于离子半径选择放射性金属络合物中以离子的状态配位的放射性金属的情况下,作为离子半径为70~130pm左右的放射性金属,可举出
67
ga、
68
ga、
64
cu、
67
cu、
89
zr、
90
y、
99m
tc、
103
ru、
111
in、
153
sm、
165
dy、
166
ho、
177
lu、
186
re、
188
re、
198
au、
201
tl、
197
hg、
203
hg、
212
bi、
213
bi、
212
pb、
225
ac等,这些优选能够与具有上述式(a)~(k)表示的结构的螯合部的配体形成放射性金属络合物。
[0195]
例如,在以疾病的治疗为目的使用放射性金属标记抗体的情况下,使用
225
ac、
177
lu或
90
y作为放射性金属时,优选使用具有由上述式(a)或(d)~(i)中的任一者表示的结构的螯合部的配体,更优选使用具有由上述式(a)、(d)或(f)中的任一者表示的结构的螯合部的配体,进一步优选使用具有由上述式(a)表示的结构的螯合部的配体。另外,在以疾病的诊断、病灶的检测为目而使用放射性金属标记抗体的情况下,作为放射性金属使用
89
zr或
111
in时,作为配体,优选使用具有由上述式(a)、(c)或(k)中的任一者表示的结构的螯合部的配体,进一步优选使用具有由上述式(a)表示的结构的螯合部的配体。
[0196]
就本发明中使用的抗体的免疫球蛋白的类别而言,可以没有特别限制地使用igg、iga、igm、igd或ige中的任意类别,这些之中,igg是免疫应答的二次应答中的主要类别,在血中存在最多,对抗原的识别特异性高,从这些方面考虑可优选使用igg。此外,优选为哺乳动物的igg,作为哺乳动物,具体而言,可举出:人、黑猩猩等灵长类;大鼠、小鼠及兔等实验动物;猪、牛、马、绵羊和山羊等家畜动物;以及狗及猫等宠物。另外,进一步优选人igg或兔igg,更进一步优选人igg。另外,关于这些抗体的亚类,也没有特别限制,例如使用人igg时,可以为igg1、igg2、igg3及igg4中的至少一种,优选igg1、igg3或igg4。
[0197]
经由上述的制造方法得到的放射性金属标记抗体是抗体的特定部位被肽特异性地修饰而得的。放射性金属络合物与肽直接地或间接地连接,在肽与放射性金属络合物之间,优选具有由点击反应形成的键合位点。键合位点优选为下述化学结构,所述化学结构来自放射性金属络合物所具备的第一原子团、和与肽连接的第二原子团。作为这样的化学结构,例如,键合位点形成包含经取代的三唑骨架的结构、或者形成包含经取代的哒嗪骨架的结构。作为包含经取代的上述骨架的结构,例如,可举出下述结构:在三唑骨架或哒嗪骨架上键合有包含取代基、脂肪族环及芳香族环中的至少一种的结构,并且具有与修饰部或螯合部的键合位点及与肽的键合位点。
[0198]
作为具体的键合位点的结构,例如在第一原子团及第二原子团为包含dbco的原子团、与包含叠氮基的原子团的组合的情况下,虽然也取决于使用的反应试剂,不过由于形成包含以下的式(10a)或式(10b)所示的三唑骨架的结构、且它们为异构体的关系,因此可以以任意的比例含有。另外,在第一原子团及第二原子团为包含1,2,4,5-四嗪的原子团、与包含tco的原子团的组合的情况下,虽然也取决于使用的反应试剂,形成包含以下的式(10c)所示的哒嗪骨架的结构。式(10a)及式(10b)中,r
1a
表示与修饰部或螯合部的键合位点,r
2a
表示与肽的键合位点。式(10c)中,r
3a
及r
4a
中的一者表示氢原子、甲基、苯基或吡啶基,另一者表示与修饰部或螯合部的键合位点,r
5a
表示与肽的键合位点。
[0199]
[化学式25]
[0200][0201]
放射性金属标记抗体也可以直接或纯化后制备包含该放射性金属标记抗体作为有效成分的放射性药物组合物。放射性药物组合物是指包含放射性金属标记抗体或其衍生物、成为适合向生物体内施与的形态的组合物。放射性药物组合物例如可以使由上述的方法制造的放射性金属标记抗体溶解于以水为主体且与生物体大致等渗的溶剂中而进行制造。该情况下,放射性药物组合物优选为水溶液的形态,可以根据需要包含药学上容许的其他成分。放射性药物组合物经口地、或静脉内、皮下、腹腔内或肌肉内等非经口地施与至生物体,用于疾病的治疗、疾病的诊断、或病灶的检测等。
[0202]
作为可对上述式(a)~(j)以及含三唑骨架的结构及含哒嗪骨架的结构进行取代的取代基,例如可举出卤素原子、饱和或不饱和的烷基、羟基、醛基、羧基、酰基、氨基、硝基、酯基、异硫氰酸酯基、硫氧基、氰基、酰胺基、酰亚胺基、磷酸基、苯基、苄基、吡啶基等。这些取代基可以一种单独进行取代,也可以使两种以上的这些取代基组合而进行取代。
[0203]
实施例
[0204]
以下,利用实施例更详细地说明本发明。然而,本发明的范围不限于这些实施例。以下的表中,
“‑”
栏表示未实施。
[0205]
〔实施例1~4〕
[0206]
(1-1.络合物形成工序)
[0207]
将本实施例中使用的配体的结构示于以下的式(l1-1)~(l1-3)。式(l1-1)表示的do3a-dbco按照liang y,jiang x,yuan r,zhou y,ji c,yang l等人,metabolism-based click-mediated platform for specific imaging and quantification of cell surface sialic acids.anal chem.jan 3;89(1):538-543.(2017)中记载的方法而合成。式(l1-2)表示的dota-dbco按照wang h,wang r,cai k,he h,liu y,yen j等人,selective in vivo metabolic cell-labeling-mediated cancer targeting.nat chem biol.apr;13(4):415-424.(2017)中记载的方法而合成。另外,式(l1-3)表示的do3a-peg4-dbco使用的是iris biotech gmbh公司制的市售品。将这些配体分散于作为溶剂的0.1mol/l乙酸钠缓冲液(ph6.0)中,形成含有1.7mmol/l配体的分散液。将该分散液0.0025ml、与作为放射性金属源的含有
225
ac离子的溶液(0.2mol/l盐酸水溶液,放射能浓度160mbq/ml,利用oak ridge national laboratory制备,液量0.0025ml)0.4mbq(在检测日时,根据放射能进行衰减计算而得的计算值)进行混合而得到反应液,将该反应液在加热条件下进行反应,得到
225
ac络合物溶液。配体与放射性金属离子的摩尔比率为配体:
225
ac离子=3000:1,反应液的加热温度为70℃,加热时间为90分钟。
[0208]
[化学式26]
[0209][0210]
利用以下的方法对得到的
225
ac络合物的放射化学性纯度进行测定。即,利用薄层色谱仪(agilent公司制,型号:sgi0001,展开溶剂:乙腈/水混合液(体积比1:1))将
225
ac络合物溶液的一部分展开,然后,用radioγ-tlc分析仪(raytest制,model gita star)进行测定。将在原点附近检测到的峰值的的放射能(计数)相对于检测到的总放射能(计数)的百分率作为
225
ac络合物的放射化学性纯度(%)。结果,
225
ac络合物的放射化学性纯度为89~99%。得到的
225
ac络合物溶液直接用于标记工序。
[0211]
(1-2.抗体修饰工序)
[0212]
另行地,利用国际公开2017/217347号小册子中记载的方法制造肽,得到下述式(p3)表示的含有17个氨基酸残基的肽。该肽的氨基酸序列与序列号(2)的xaa2为赖氨酸残基的序列相同,赖氨酸残基的侧链末端氨基经r1所示的结构修饰。另外,2个半胱氨酸残基彼此以二硫键键合,肽的n末端介由具有二甘醇酸及8个peg的接头结构而键合有乙基叠氮化物作为包含叠氮基的原子团(第二原子团)。
[0213]
[化学式27]
[0214][0215]
(式(p3)中,gly表示甘氨酸,pro表示脯氨酸,asp表示天冬氨酸,cys表示半胱氨酸,ala表示丙氨酸,tyr表示酪氨酸,his表示组氨酸,glu表示谷氨酸,leu表示亮氨酸,val表示缬氨酸,trp表示色氨酸,phe表示苯基丙氨酸。)
[0216]
将该肽与人igg抗体(利妥昔单抗;roche公司制,或曲妥珠单抗;roche公司制)在乙酸钠缓冲液(ph6.0)中混合而得的混合液于室温反应30分钟,得到包含肽修饰抗体的溶液。该肽修饰抗体是利用上述的肽对抗体的fc区位点特异性地进行修饰而得的。
[0217]
(2.肽修饰抗体分离工序)
[0218]
用1mol/l乙酸钠缓冲液(ph6.0)将上述的肽修饰抗体稀释,添加于proteina柱(ge healthcare公司制,hitrap mabselect sure)中,使含有0.15mol/l氯化钠的0.05mol/l乙酸钠缓冲液(ph5.7)流动,将包含二价抗体的溶液回收,以回收的级分中包含的二价抗体的浓度成为15mg/ml的方式来调节浓度。然后,使含有0.15mol/l氯化钠的0.05mol/l乙酸钠缓冲液(ph3.5)流动,将包含一价抗体的溶液回收,以回收的级分中包含的未修饰抗体及一价抗体的浓度成为17~40mg/ml的方式调节浓度。
[0219]
(3.标记工序)
[0220]
将经由上述的各工序得到的
225
ac络合物的溶液和包含肽修饰抗体(一价抗体)的溶液在未纯化的状态下各自添加于含有0.02mol/l抗坏血酸的0.09mol/l乙酸钠缓冲液中,于37℃进行点击反应120分钟,得到实施例1至4的
225
ac络合物标记抗体。
225
ac络合物的量及肽修饰抗体(一价抗体)的量分别为43μmol及46μmol(实施例1)、或者均为100μmol(实施例2至4),第一原子团(dbco)与第二原子团(叠氮化物)的摩尔比各自为约1:1。将未纯化时的实施例的
225
ac络合物标记抗体的反应率(%)示于以下的表1。此处,所谓反应率(%),是指相对于络合物形成工序中的标记率(%)而言的
225
ac络合物标记抗体的放射化学性纯度(%),标记率(%)是指相对于装入放射能而言的
225
ac络合物的放射能(%)。
[0221]
进而,使用超滤过滤器(merck公司制,型号:ufc505096),将于37℃反应2小时得到的
225
ac络合物标记抗体的溶液进行纯化。将纯化后的
225
ac络合物标记抗体的放射化学性纯度(rcp)及放射化学性收率(rcy)示于以下的表1。
[0222]
225
ac络合物标记抗体的放射化学性纯度及放射化学性收率的测定方法如下所述。即,利用薄层色谱仪(agilent公司制,型号:sgi0001,展开溶剂为乙腈:0.1mmol/l edta溶液的混液(体积比1:1))进行展开,用radioγ-tlc分析仪(raytest制,model gita star)进行测定,将在原点附近检测到的峰值的的放射能(计数)相对于检测到的总放射能(计数)的百分率作为放射化学性纯度(%)。另外,将相对于标记工序开始时加入的总放射能(根据由γ射线分光计(ge半导体检测器:gmx10p4-70(ortec公司制)、多通道分析器:m7-000(seiko eg&g公司制)、数据处理:spectrum navigator:ds-p300(seiko eg&g公司制)及gamma studio:ds-p600(seiko eg&g公司制))测得的计数计算的放射能)而言的、超滤纯化后回收的放射能(与上述同样地,根据由γ射线分光计测得的计数计算的放射能)的百分率作为放
射化学性收率(%)。
[0223]
〔实施例5〕
[0224]
(1-1.络合物形成工序)
[0225]
本实施例中,除了使用以下的式(l2)所示的结构的配体以外,与实施例1同样地进行,得到225ac络合物溶液。式(l2)表示的dota-peg7-tz按照poty s,membreno r,glaser jm,ragupathi a,scholz ww,zeglis bm等人.the inverse electron-demand diels-alder reaction as a new methodology for the synthesis of 225ac-labelled radioimmunoconjugates.chem commun(camb).mar 8;54(21):2599-2602.(2018)中记载的方法进行合成。
[0226]
[化学式28]
[0227][0228]
(1-2.抗体修饰工序)
[0229]
本实施例中使用的肽为下述式(p4)表示的由17个氨基酸残基形成的肽。该肽的氨基酸序列与序列号(2)的xaa2为赖氨酸残基的序列相同,赖氨酸残基的侧链末端氨基经r2所示的结构修饰。另外,2个半胱氨酸残基的硫醇基彼此通过上述式(4)表示的接头连接,肽的n末端具有下述接头结构,所述接头结构从n末端侧观察依次具有:5个peg;半胱氨酸残基,其侧链的硫醇基被包含作为第二原子团的tco的由r1表示的结构取代;2个谷氨酸残基;乙酰基。
[0230]
[化学式29]
[0231][0232]
(式(p4)中,gly表示甘氨酸,pro表示脯氨酸,asp表示天冬氨酸,cys表示半胱氨酸,ala表示丙氨酸,tyr表示酪氨酸,his表示组氨酸,glu表示谷氨酸,leu表示亮氨酸,val表示缬氨酸,trp表示色氨酸,phe表示苯基丙氨酸)
[0233]
将该肽与人igg抗体(曲妥珠单抗;roche公司制)在乙酸钠缓冲液(ph6)中混合而得的混合液于室温反应30分钟,得到包含肽修饰抗体的溶液。
[0234]
(2.标记工序)
[0235]
利用与实施例1同样的步骤进行点击反应,得到
225
ac络合物标记抗体。
225
ac络合物的量及肽修饰抗体的量均为100μmol,第一原子团(1,2,4,5-四嗪)与第二原子团(tco)的摩尔比为1:1。将未纯化时的实施例的
225
ac络合物标记抗体的反应率(%)示于以下的表1。此处,所谓反应率(%),是指相对于络合物形成工序中的标记率(%)而言的
225
ac络合物标记抗体的放射化学性纯度(%),所谓标记率(%),是指相对于装入放射能而言的
225
ac络合物的放射能(%)。另外,将与实施例1同样地使用超滤过滤器进行纯化后的
225
ac络合物标记抗体的放射化学性纯度(rcp)及放射化学性收率(rcy)示于以下的表1。
[0236]
[表1]
[0237][0238]
如表1所示,判明了对于进行了络合物形成工序之后进行络合物与抗体的反应的实施例而言,即使未对抗体进行过度的加热,标记反应也以温和的反应条件进行,并且放射性金属对抗体的标记效率优异。
[0239]
〔实施例6~7〕使用了
225
ac标记dotaga-dbco的tmab,rmab制造
[0240]
(1.络合物形成工序)
[0241]
将本实施例中使用的配体的结构示于以下的式(l1-4)。式(l1-4)表示的dotaga-dbco基于bernhard等人,dotaga-anhydride:a valuable building block for the preparation of dota-like chelating agents chem.eur.j.2012,18,7834-7841中记载的方法来制造。将这些配体分散于作为溶剂的0.1mol/l乙酸钠缓冲液(ph6.0)中,形成包含1.7mmol/l配体的分散液。将该分散液0.005ml、与作为放射性金属源的含有
225
ac离子的溶液(0.2mol/l盐酸水溶液,放射能浓度320~340mbq/ml,由oak ridge nationallaboratory制备,液量0.005ml)1.6~1.7mbq(在检测日时,根据放射能进行衰减计算而得的计算值)进行混合而得到反应液,将该反应液在加热条件下反应,得到
225
ac络合物溶液。配体与放射性金属离子的摩尔比率为配体:
225
ac离子=约2500:1,反应液的加热温度为70℃,加热时间为30分钟。
[0242]
[化学式30]
[0243][0244]
与实施例1同样地,对得到的
225
ac络合物的放射化学性纯度进行测定,结果为90%。得到的
225
ac络合物溶液直接用于标记工序。
[0245]
(2.标记工序)
[0246]
将经由上述的工序(1)得到的未纯化状态的
225
ac络合物的溶液和包含与实施例1同样地操作而得到的肽修饰抗体(一价抗体)的溶液各自添加于含有0.1mol/l精氨酸的0.1mol/l组氨酸缓冲液(ph6.0)中,于37℃进行点击反应120分钟,得到
225
ac络合物标记抗体。
225
ac络合物的量及肽修饰抗体(一价抗体)的量分别为85nmol及100nmol(实施例6及7),第一原子团(dbco)与第二原子团(叠氮化物)的摩尔比各自为约1:1.2。将未纯化时的
225
ac络合物标记抗体的反应率(%)示于以下的表2。此处,所谓反应率(%),是指相对于络合物形成工序中的标记率(%)而言的
225
ac络合物标记抗体的放射化学性纯度(%),标记率(%)是指相对于装入放射能而言的
225
ac络合物的放射能(%)。
[0247]
进而,使用超滤过滤器(merck公司制,型号:ufc505096),将于37℃反应2小时得到的
225
ac络合物标记抗体的溶液纯化。将纯化后的
225
ac络合物标记抗体的放射化学性纯度(rcp)及放射化学性收率(rcy)示于以下的表2。
[0248]
225
ac标记一价抗体的放射化学性纯度及放射化学性收率的测定方法与实施例1同样地进行。
[0249]
[表2]
[0250][0251]
〔实施例8〕使用了
89
zr标记dotaga-dbco的tmab制造
[0252]
(1.络合物形成工序)
[0253]
本实施例中使用的配体的结构与上述的式(l1-4)相同。使该配体分散于作为溶剂的dmso中,制成包含0.33mmol/l配体的分散液。将该分散液0.030ml与作为放射性金属源的含有
89
zr离子的溶液(0.1mol/l盐酸水溶液,放射能浓度181mbq/ml,由日本medi-physics株式会社制备,液量0.33ml)60mbq混合而得到反应液,将该反应液在加热条件下反应,得到
89
zr络合物溶液。配体与放射性金属离子的摩尔比率为配体:
89
zr离子=约250:1,反应液的加热温度为70℃,加热时间为60分钟。
[0254]
利用以下的方法对得到的
89
zr络合物的放射化学性纯度进行测定。即,利用薄层色谱仪(agilent公司制,型号:sgi0001,展开溶剂:乙腈/水混合液(体积比1:1))将
89
zr络合物溶液的一部分展开,然后,用radioγ-tlc分析仪(raytest制,model gita star ps)进行测定。将在原点附近检测到的峰值的的放射能(计数)相对于检测到的总放射能(计数)而言的百分率作为
89
zr络合物的放射化学性纯度(%)。结果,
89
zr络合物的放射化学性纯度为90%。得到的
89
zr络合物溶液直接用于标记工序。
[0255]
(2.标记工序)
[0256]
将经由上述的工序(1)得到的未纯化状态的
89
zr络合物的溶液、和包含与实施例1同样地操作而得到的肽修饰抗体(一价抗体)的溶液在未纯化的状态下各自添加于含有0.1mol/l精氨酸的0.1mol/l组氨酸缓冲液(ph6.0)中,于37℃进行点击反应120分钟,得到实施例8的
89
zr络合物标记抗体。
89
zr络合物的量及肽修饰抗体(一价抗体)的量各自为100nmol,第一原子团(dbco)与第二原子团(叠氮化物)的摩尔比各自为约1:1。将未纯化时的实施例的
89
zr络合物标记抗体的反应率(%)示于以下的表3。此处,所谓反应率(%),是指相对于络合物形成工序中的标记率(%)而言的
89
zr络合物标记抗体的放射化学性纯度(%),标记率(%)是指相对于装入放射能而言的
89
zr络合物的放射能(%)。
[0257]
进而,使用超滤过滤器(merck公司制,型号:ufc505096),将于37℃反应2小时得到的
89
zr络合物标记抗体的溶液纯化。将纯化后的
89
zr络合物标记抗体的放射化学性纯度(rcp)及放射化学性收率(rcy)示于以下的表3。
[0258]
89
zr络合物标记抗体的放射化学性纯度及放射化学性收率的测定方法与实施例8同样地进行。
[0259]
[表3]
[0260][0261]
〔实施例9〕使用了
89
zr标记dota-dbco的tmab制造
[0262]
(1-1.络合物形成工序)
[0263]
本实施例中使用的配体的结构与上述的式(l1-2)相同。使该配体分散于作为溶剂的dmso中,制成包含1mmol/l配体的分散液。将该分散液0.1ml与作为放射性金属源的含有
89
zr离子的溶液(0.1mol/l盐酸水溶液,放射能浓度450mbq/ml,由冈山大学制备,液量0.1ml)45mbq进行混合而得到反应液,使该反应液在加热条件下反应,得到
89
zr络合物溶液。
配体与放射性金属离子的摩尔比率为配体:
89
zr离子=约10000:1,反应液的加热温度为70℃,加热时间为60分钟。
[0264]
得到的
89
zr络合物的放射化学性纯度按照实施例1进行。结果,
89
zr络合物的放射化学性纯度为99%。
[0265]
(1-2.未反应物除去工序)
[0266]
使用高效液相色谱(hplc)分取所得的
89
zr络合物溶液,将未反应的dota-dbco除去。hplc的条件如下所述。检测器:紫外吸光光度计(测定波长:254nm)/闪烁检测器,色谱柱:xbridge c18 3.5μm,4.6
×
100nm;waters制,流动相a:10mmol/l组氨酸缓冲液ph6.5、流动相b:液相色谱用乙腈、流动相的送液:将流动相a及流动相b的混合比以下述方式变更来进行浓度梯度控制(a:b=90:10(0分钟)
→
50:50(40分钟)(vol%/vol%))、流量:0.5ml/分钟、分取峰的保持时间约32分钟。将得到的分取液蒸馏除去溶剂,直至约20μl,以用于标记工序。
89
zr络合物标记抗体的未反应物除去工序中的放射化学性收率(hplc回收率)示于以下的表4。就放射化学性收率(hplc回收率)的测定方法而言,将分取液的放射能的量相对于本工序开始时装入放射能的量而言的百分率作为未反应物除去工序中的hplc回收率(%)。
[0267]
(2.标记工序)
[0268]
将经由上述各工序得到的
89
zr络合物的溶液、和包含与实施例1同样地操作而得到的肽修饰抗体(一价抗体)的溶液各自添加于含有0.1mol/l精氨酸的0.1mol/l组氨酸缓冲液(ph6.0中),于37℃进行点击反应120分钟,得到
89
zr络合物标记抗体。将未纯化时的实施例的
89
zr络合物标记抗体的标记工序反应率(%)示于以下的表4。这里,所谓标记工序反应率(%),是指相对于hplc分取液的放射能而言的
89
zr络合物的放射能(%)。
[0269]
进而,使用超滤过滤器(merck公司制,型号:ufc505096),将于37℃反应2小时而得到的
89
zr络合物标记抗体的溶液纯化。将纯化后的
89
zr络合物标记抗体的放射化学性纯度(rcp)及放射化学性收率(rcy)示于以下的表4。
[0270]
89
zr络合物标记抗体的放射化学性纯度及放射化学性收率的测定方法按照实施例1进行。
[0271]
[表4]
[0272][0273]
以上,参照实施方式对本发明进行了说明,但本发明不限于上述实施方式。本发明的构成、详细内容中,可以在本发明的范围内进行本领域技术人员能够理解的各种变更。
[0274]
在此所述的包含专利及专利申请说明书在内的所有刊物中记载的内容通过被引用至此而使其全部内容以与公开的相同程度被并入本说明书中。
[0275]
产业上的可利用性
[0276]
根据本发明,即使是温和的反应条件,也能够实现放射性金属对抗体的高标记效率。
[0277]
本技术以于日本提出申请的日本特愿2019-191561(申请日:2019年10月18日)为基础,其内容均包括在本说明书中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。